Спосіб одержання похідних таксану та проміжні сполуки
Формула / Реферат
1. Способ получения производных таксана общей формулы (I):
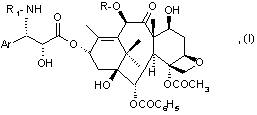
где R - атом водорода или ацетил,
R1 - бензоил или трет-бутоксикарбонил,
Аr - фенил,
отличающийся тем, что производное защищенного баккатина III или 10-дезацетилбаккатина III общей формулы (III):
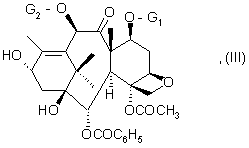
G1 - защитная группа функциональной оксигруппы,
G2 - ацетил или защитная группа функциональной оксигруппы,
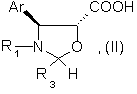
подвергают этерификации действием кислоты общей формулы (II):
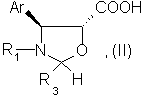
где Аr и R1 имеют указанные значения,
R3 - атом водорода или арил, возможно замещенный,
или производного этой кислоты с получением соединения общей
формулы (IV):
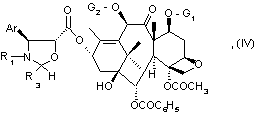
где Аr, R1, R3, G1 и G2 имеют указанные значения,
деблокируют боковое звено и, возможно, функциональные оксигруппы, защищенные заместителями G1 и G2 с получением соединения формулы (V):
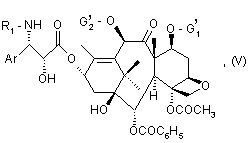
где Аr и R1 имеют указанные выше значения,
G1' - атом водорода или защитная группа функциональной оксигруппы,
G2' - атом водорода или ацетил, или защитную группу функциональной оксигруппы, у которого защитные группы G1' и, возможно G2' заменены, возможно, на атомы водорода для получения соединения формулы (I).
2. Способ по п.1, отличающийся тем, что этерификацию осуществляют с помощью кислоты или одного из ее производных, в формулах которых заместители Аг и R1 имеют значения, аналогичные указанным в п.1,
R3 - атом водорода или радикал С1-С4алкокси или фенил, возможно, замещенный одним или несколькими электродонорными радикалами.
3. Способ по п.2, отличающийся тем, что электродонорные радикалы выбраны среди С1-С4алкоксигрупп.
4. Способ по п.1, отличающийся тем, что защитные группы баккатина III или 10-дезацетилбаккатина III, представленные заместителями G1 и G2, выбирают среди радикалов (2,2,2-трихлорэтокси)карбонил и 2-(2-трихлорметилпропокси)карбонил или радикалов триалкилсилил, диалкиларилсилил, алкилдиарилсилил или триарилсилил, в которых алкильные части содержат от 1 до 4 атомов углерода, а арильные части представляют собой предпочтительно фенилы.
5. Способ по любому из пп.1 - 4, отличающийся тем, что этерификацию осуществляют действием кислоты общей формулы (II):
где Ar и R1 имеют значения, указанные в п.1,
R3 имеет значения, указанные в любом из пп.1 или 3,
осуществляют в присутствии агента конденсации и агента активации в органическом растворителе при температуре от –10 до 90°С.
6. Способ по п. 5, отличающийся тем, что агент конденсации выбирают среди карбодиимидов, реакционноспособных карбонатов, а агент активации выбирают среди аминопиридинов.
7. Способ по п. 6, отличающийся тем, что агент конденсации выбирают среди дициклогексилкарбодиимида и 2-дипиридилкарбоната, а агент активации выбирают среди 4-диметиламинопиридина и 4-пирролидинопиридина.
8. Способ по п.5, отличающийся тем, что растворитель выбирают среди простых эфиров, кетонов, сложных эфиров, нитрилов, алифатических углеводородов, галогенсодержащих алифатических углеводородов и ароматических углеводородов.
9. Способ по п. 8, отличающийся тем, что растворитель выбирают среди ароматических углеводородов.
10. Способ по любому из пп. 1 - 4, отличающийся тем, что этерификацию осуществляют с помощью ангидрида общей формулы (IIa):
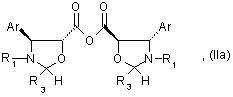
где Аr и R1 имеют значения, указанные в п.1,
R3 имеет значения, указанные в любом из пп.1 или 3, в присутствии агента активации в органическом растворителе при температуре 0 – 900С.
11. Способ по п. 10, отличающийся тем, что агент активации выбирают среди аминопиридинов.
12. Способ по п. 11, отличающийся тем, что агент активации выбирают среди 4-диметиламинопиридина и 4-пирролидинопиридина.
13 Способ по п. 10, отличающийся тем, что растворитель выбирают среди простых эфиров, кетонов, сложных эфиров, нитрилов, алифатических углеводородов, галогенсодержащих алифатических углеводородов и ароматических углеводородов.
14. Способ по любому из пп. 1 - 4, отличающийся тем, что этерификацию осуществляют действием активированной кислоты формулы (IIb):
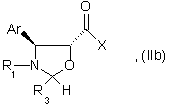
где Аr и R1 имеют значения, указанные в п.1,
R3 имеет значения, указанные в любом из пп.1-3,
Х - атом галогена или ацилокси- или ароилоксирадикал,
возможно приготовленной in situ в присутствии основания, в органическом растворителе при температуре от 10 до 80оС.
15. Способ по п. 14, отличающийся тем, что основание выбирают среди азотсодержащих органических оснований.
16. Способ по п. 15, отличающийся тем, что азотсодержащее основание выбирают среди третичных алифатических аминов, пиридина и аминопиридинов.
17. Способ по п. 15, отличающийся тем, что растворитель выбирают среди простых эфиров, кетонов, сложных эфиров, нитрилов, алифатических углеводородов, галогенсодержащих алифатических углеводородов и ароматических углеводородов.
18. Способ по п. 17, отличающийся тем, что растворитель выбирают среди ароматических углеводородов.
19. Способ по любому из пп.1 - 4, отличающийся тем, что снимают защиту с боковой цепи и, возможно, с функциональных групп, защищенных защитными группами G1 и G2, содержащими силил, в присутствии минеральной или органической кислоты или их смесей, в среде органического растворителя при температуре от 10 до 60°С.
20. Способ по п. 19, отличающийся тем, что минеральную кислоту выбирают среди соляной и серной кислот, а органическую кислоту выбирают среди уксусной кислоты, трифторметансульфокислоты, метансульфокислоты и пара-толуолсульфокислоты.
21. Способ по п. 19, отличающийся тем, что растворитель выбирают среди спиртов, сложных эфиров, нитрилов, алифатических углеводородов, галогенсодержащих алифатических углеводородов и ароматических углеводородов.
22. Способ по п. 1, отличающийся тем, что снимают защиту с боковой цепи в присутствии окислителя, взятого в воде или в водно-органической среде.
23. Способ по п. 22, отличающийся тем, что в качестве окислителя используют нитрат аммония и церия IV, взятый в водно-органической среде.
24. Способ по любому из пп. 22 или 23, отличающийся тем, что в качестве водно-органической среды используют среду: вода-ацетонитрил.
25. Способ по п.22, отличающийся тем, что в качестве окислителя используют 2,3-дихлор-5,6-дициано-1,4-бензохинон в воде.
26. Способ по п. 1, отличающийся тем, что снимают защиту с боковой цепи путем гидрогенолиза.
27. Способ по п. 26, отличающийся тем, что гидрогенолиз осуществляют с помощью водорода в присутствии катализатора.
28. Способ по п. 1, отличающийся тем, что замену защитных групп G1 и, возможно, групп G2, представляющих собой радикал 2,2,2-трихлорэтоксикарбонил или 2-(2-трихлорметилпропокси)карбонил, на атомы водорода осуществляют с помощью цинка, возможно, ассоциированного с медью, в присутствии уксусной кислоты при температуре от 20 до 600С, или с помощью минеральной или органической кислоты, взятой в растворе в алифатическом спирте, содержащем 1-3 атома углерода, или в сложном алифатическом эфире в присутствии цинка, возможно, ассоциированного с медью.
29. Кислоты общей формулы (II):
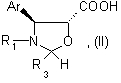
где Аr и R1 имеют значения, указанные в п. 1,
R3 имеет значения, указанные в любом из пп.1 - 3,
возможно имеющие форму соли, сложного эфира, ангидрида, смешанного ангидрида или галогенида.
30. Соединение общей формулы (IV):
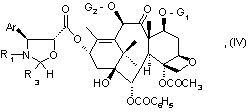
где Аr и R1 имеют значения, указанные в п.1,
R3 имеет значения, указанные в любом из пп. 1 - 3,
G1 и G2 имеют значения, указанные в любом из пп. 1 - 4.
Текст
1 Способ получения производных таксана общей формулы (І) О .(її) R (33) FR R,-NH соон Аг (21)95038242 (22)04 10 1993 (24)15 01 2002 (46) 15 01 2002, Бюл № 1, 2002 р (86) PCT/FR93/00968, 04 10 1993 (31)92/11742 (32)05 10 1992 R-0 ЛІ) где R - атом водорода или ацетил, Ri - бензоил или трет-бутоксикарбонил, Аг - фенил, отличающийся тем, что производное защищенного баккатина III или 10-дезацетилбаккатина III общей формулы (III) O-G, H з где Аг и Ri имеют указанные значения, F 3 - атом водорода или арил, возможно замещен? ный, или производного этой кислоты с получением соединения общей формулы (IV) 0 0- G 0 G2-0 і , Аг, M L v —1 о V/ \ R r R H H OCOCH HO \ / 3 o c o c 6H5 где Ar, Ri,R з, С 1 и G 2 имеют /ка: анн деблокируют боковое звено и, возможно, функциональные оксигруппы, защищенные заместителями Gi и G2 с получением соединения формулы (V) (V I) R.-NH . (НО ОСОС 6 Н 5 ю ГО 00 О ,(V) Gi - защитная группа функциональной оксигруппы, G2 - ацетил или защитная группа функциональной оксигруппы, подвергают этерификации действием кислоты общей формулы (II) О где Аг и Ri имеют указанные выше значения, G-Г - атом водорода или защитная группа функциональной оксигруппы, G2' - атом водорода или ацетил, или защитную группу функциональной оксигруппы, у которого защитные группы G-Г и, возможно G21 заменены, возможно, на атомы водорода для получения соединения формулы (I) 2 Способ по п 1, отличающийся тем, что этерификацию осуществляют с помощью кислоты или одного из ее производных, в формулах которых го 43835 заместители Аг и Ri имеют значения, аналогичные указанным в п 1, F 3 - атом водорода или радикал СгС4алкокси или ? фенил, возможно, замещенный одним или несколькими электродонорными радикалами 3 Способ по п 2, отличающийся тем, что электродонорные радикалы выбраны среди d С4алкоксигрупп 4 Способ по п 1, отличающийся тем, что защитные группы баккатина III или 10дезацетилбаккатина III, представленные заместителями Gi и G2, выбирают среди радикалов (2,2,2трихлорэтокси)карбонил и 2-(2трихлорметилпропокси)карбонил или радикалов триалкилсилил, диалкиларилсилил, алкилдиарилсилил или триарилсилил, в которых алкильные части содержат от 1 до 4 атомов углерода, а арильные части представляют собой предпочтительно фенилы 5 Способ по любому из пп 1 - 4, отличающийся тем, что этерификацию осуществляют действием кислоты общей формулы (II) СООН (II) R з Н где Аг и Ri имеют значения, указанные в п 1, F 3 имеет значения, указанные в любом из пп 1 или ? 3, осуществляют в присутствии агента конденсации и агента активации в органическом растворителе при температуре от-10 до 90°С 6 Способ по п 5, отличающийся тем, что агент конденсации выбирают среди карбодиимидов, реакционноспособных карбонатов, а агент активации выбирают среди аминопиридинов 7 Способ по п 6, отличающийся тем, что агент конденсации выбирают среди дициклогексилкарбодиимида и 2-дипиридилкарбоната, а агент активации выбирают среди 4-диметиламинопиридина и 4-пирролидинопиридина 8 Способ по п 5, отличающийся тем, что растворитель выбирают среди простых эфиров, кетонов, сложных эфиров, нитрилов, алифатических углеводородов, галогенсодержащих алифатических углеводородов и ароматических углеводородов 9 Способ по п 8, отличающийся тем, что растворитель выбирают среди ароматических углеводородов 10 Способ по любому из пп 1 - 4, отличающийся тем, что этерификацию осуществляют с помощью ангидрида общей формулы (Па) О О la) Н где Аг и Ri имеют значения, указанные в п 1, R3 имеет значения, указанные в любом из пп 1 или З, в присутствии агента активации в органическом растворителе при температуре 0 - 90°С 11 Способ по п 10, отличающийся тем, что агент активации выбирают среди аминопиридинов 12 Способ по п 11, отличающийся тем, что агент активации выбирают среди 4диметиламинопиридина и 4пирролидинопиридина 13 Способ по п 10, отличающийся тем, что растворитель выбирают среди простых эфиров, кетонов, сложных эфиров, нитрилов, алифатических углеводородов, галогенсодержащих алифатических углеводородов и ароматических углеводородов 14 Способ по любому из пп 1 - 4, отличающийся тем, что этерификацию осуществляют действием активированной кислоты формулы (lib) О Аг X R H (lib) з где Аг и Ri имеют значения, указанные в п 1, R3 имеет значения, указанные в любом из пп 1-3, X - атом галогена или ацилокси- или ароилоксирадикал, возможно приготовленной in situ в присутствии основания, в органическом растворителе при температуре от 10 до 80°С 15 Способ по п 14, отличающийся тем, что основание выбирают среди азотсодержащих органических оснований 16 Способ по п 15, отличающийся тем, что азотсодержащее основание выбирают среди третичных алифатических аминов, пиридина и аминопиридинов 17 Способ по п15, отличающийся тем, что растворитель выбирают среди простых эфиров, кетонов, сложных эфиров, нитрилов, алифатических углеводородов, галогенсодержащих алифатических углеводородов и ароматических углеводородов 18 Способ по п 17, отличающийся тем, что растворитель выбирают среди ароматических углеводородов 19 Способ по любому из пп 1 - 4, отличающийся тем, что снимают защиту с боковой цепи и, возможно, с функциональных групп, защищенных защитными группами d и G2, содержащими силил, в присутствии минеральной или органической кислоты или их смесей, в среде органического растворителя при температуре от 10 до 60°С 20 Способ по п 19, отличающийся тем, что минеральную кислоту выбирают среди соляной и серной кислот, а органическую кислоту выбирают среди уксусной кислоты, тр и фтор метан сул ьфокислоты, метан сул ьфо кислоты и паратолуолсульфокислоты 21 Способ по п 19, отличающийся тем, что растворитель выбирают среди спиртов, сложных эфиров, нитрилов, алифатических углеводородов, галогенсодержащих алифатических углеводородов и ароматических углеводородов 22 Способ по п 1, отличающийся тем, что снимают защиту с боковой цепи в присутствии окис 43835 лителя, взятого в воде или в водно-органической среде 23 Способ по п 22, отличающийся тем, что в качестве окислителя используют нитрат аммония и церия IV, взятый в водно-органической среде 24 Способ по любому из пп 22 или 23, отличающийся тем, что в качестве водно-органической среды используют среду вода-ацетонитрил 25 Способ по п 22, отличающийся тем, что в качестве окислителя используют 2,3-дихлор-5,6дициано-1,4-бензохинон в воде 26 Способ по п 1, отличающийся тем, что снимают защиту с боковой цепи путем гидрогенолиза 27 Способ по п 26, отличающийся тем, что гидрогенолиз осуществляют с помощью водорода в присутствии катализатора 28 Способ по п 1, отличающийся тем, что замену защитных групп d и, возможно, групп G2, представляющих собой радикал 2,2,2трихлорэтоксикарбонил или 2-(2трихлорметилпропокси)карбонил, на атомы водорода осуществляют с помощью цинка, возможно, ассоциированного с медью, в присутствии уксусной кислоты при температуре от 20 до 60°С, или с помощью минеральной или органической кислоты, взятой в растворе в алифатическом спирте, содержащем 1-3 атома углерода, или в сложном алифатическом эфире в присутствии цинка, воз можно, ассоциированного с медью 29 Кислоты общей формулы (II) А г. СООН Настоящее изобретение касается нового способа получения производных таксана общей формулы I О / Н R-0 R -NH О ждународной заявке РСТ WO 92/09589, производные общей формулы (I) могут быть получены путем конденсации производного оксазолидина обшей формулы II СООН R:—hL 1 R X) X H з где Аг и Ri имеют значения, указанные в п 1, R3 имеет значения, указанные в любом из пп 1 - 3, возможно имеющие форму соли, сложного эфира, ангидрида, смешанного ангидрида или галогени30 Соединение общей формулы (IV) O-G (IV) где Аг и Ri имеют значения, указанные в п 1, R3 имеет значения, указанные в любом из пп 1 - 3, Gi и G2 имеют значения, указанные в любом из пп 1 -4 Boc-N, осос н ососн в 5 где R представляет собой атом водорода или ацетил, a Ri представляет собой бензоил или остаток R2 -О-СО- где R представляет собой линейный или разветвленный алкил, содержащий от 1 до 8 атомов углерода, Аг представляет собой фенил, обладающий противолейкемическими и противоопухолевыми свойствами Особый интерес представляют соединения общей формулы (І), в которой R представляет собой атом водорода или ацетил, Ri представляет собой бензоил или трет, бутоксикарбониламино остаток, а Аг представляет собой фенил Соединения общей формулы (I), где Ri представляет собой бензоил, соответствуют таксолу и 10-дезацетил-таксолу, а соединения общей формулы (I), где Ri представляет собой трет, бутоксикарбонил, соответствуют соединениям, описанным в европейском патенте ЕР N 0253738 В соответствии со способом, описанным в ме ,(ll) (II) 1 2 э где Аг имеет значения, аналогичные указанным выше, Вое представляет собой трет, бутоксикар-бонил, a R2 и R3 имеют одинаковые или различные значения и представляют собой алкил, содержащий от 1 до 4 атомов углерода, возможно замещенный одним или несколькими арилами, или арил, или же R2 и R3 образуют вместе с атомом углерода, с которым они связаны, кольцо, имеющее от 4 до 7 звеньев, с защищенным баккатином III или 10-дезацетил-баккатином III общей формулы III 43835 0-G 8 10-дезацетил-баккатина 111 общей формулы G -О ?"Gi ° (III) till) где Gi представляет собой защитную группу функциональной оксигруппы, G2 представляет собой ацетил или защитную группу функциональной оксигруппы, с получением соединения общей формулы IV О Q-G где Gi представляет собой защитную группу функциональной оксигруппы, a G2 представляет собой ацетил или защитную группу функциональной оксифуппы, подвергают этерификации действием кислоты общей формулы II Аг. СООН R Вое-И где Аг, F?2, R3 , G-і, G2 Вое имеют значения, аналогичные указанным выше, - обработки в кислой среде соединения общей формулы (IV), осуществляемой в условиях, не влияющих на d и G2, с получением соединения общей формулы V О O-G НО (II) где Ri представляет бензоил или остаток R2 О-СО- где R2 представляет собой линейный или разветвленный алкил, содержащий от 1 до 8 атомов углерода, Аг представляет собой фенил, R3 3 представляет собой атом водорода, Сі -С4 алкоксигруппу или фенил, возможно замещенный одним или двумя заместителями, выбранными из Сі -Сб -алкила или Сі -Сє алкоксигруппы, или производного этой кислоты с получением соединения общей формулы IV О 0-G (IV) ОСОС Н в S где Аг, G-і, G2 имеют значения, аналогичные указанным выше, - обработки соединения общей формулы (V) реагентом, обеспечивающим введение бензоила или R -О-СО-, с получением соединения формулы VI О 0-G і: -І І R-N R " з ^Н ОСОС Н e 5 ULUL v ОСОСН з где Аг, R-і, R3, Gi и G2 имеют значения, указанные выше, деблокируют боковое звено и, возможно, функциональные оксигруппы, защищенные заместителями d и G2 с получением соединения формулы V R [VI) Н О где Аг, R-i, G1, G2 имеют значения, аналогичные указанным выше, и -замены защитных групп d и G2 соединения общей формулы (VI) атомами водорода с получением соединения общей формулы (I) Согласно изобретению способ получения соединений общей формулы (I) заключается в том, что производное защищенного баккатина 111 или где Аг и Ri имеют значения, указанные выше, Gi представляет собой атом водорода или защитную группу функциональной оксигруппы, a G2 представляет собой атом водорода или ацетил, или защитную группу функциональной оксигруппы, у которого защитные группы d и, возможно, G2 заменены, возможно, на атомы водорода для по 43835 лучения соединения формулы I Согласно настоящему изобретению, этерификацию соединения общей формулы (III) осуществляют с помощью кислоты общей формулы (II), которая может иметь форму ангидрида, галогенида или смешанного ангидрида Предпочтительно использовать кислоту общей формулы (II) или ее активированные производные, в формуле которых R3 представляет собой атом водорода или алкоксирадикал, содержащий от 1 до 4 атомов углерода, или фенил, возможно замещенный одним или несколькими элекгродонорными радикалами, выбранными, в частности, из группы алкоксирадикалов, содержащих от 1 до 4 атомов углерода Этерификация с помощью кислоты общей формулы (II) может быть осуществлена в присутствии агента конденсации, например карбодиимида, такого как дициклогексилкарбодиимид, или реакционноспособного карбоната, каким является 2-дипиридилкарбонат, и агента активации, такого как аминопиридин, например, 4диметиламинопиридин или 4- пирролидинопиридин Названную этерификацию осуществляют в органическом растворителе, выбранном среди таких простых эфиров, как тетрагидрофуран, диизопро-пиловый эфир, метил-трет бутиловый эфир или диоксан, среди таких кетонов, как метилизобутил-кетон, таких сложных эфиров, как этилацетат, изопропилацетат или п-бутилацетат, таких нитрилов, как ацетонитрил, таких алифатических углеводородов, как пентан, гексан или гептан, таких гал о-ген содержащих алифатических углеводородов, как дихлорметан или 1,2-дихлорэтан, или таких ароматических углеводородов, как бензол, толуол, ксилолы, этилбензол, изопроп ил бензол или хлорбензол, при температуре, составляющей от -10 до 90°С Особо предпочтительно осуществлять этерификацию в ароматическом растворителе при температуре, близкой 20°С Этерификация может быть также осуществлена при использовании кислоты общей формулы (II) в форме ангидрида формулы (На) О О Па) з/ где Ar, Ri и R3 имеют значения, аналогичные указанным выше, в присутствии агента активации, например аминопиридина, а именно 4диметиламинопиридина или 4- пирролидинопиридина, в органическом растворителе, выбранном среди таких простых эфиров, как тетрагидрофуран, диизопропиловый эфир, метил- трет, бутиловый эфир или диоксан, таких кетонов, как метилизобутилкетон, таких сложных эфиров, как этилацетат, изопропилацетат или п-бутилацетат, таких нитрилов, как ацетонитрил, таких алифатических углеводородов, как пентан, гексан или гептан, таких гал о ген содержащих алифатических углеводо 10 родов, как дихлорметан или 1,2-дихлорэтан, или таких ароматических углеводородов, как бензол, толуол, ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре, составляющей от 0 до 90°С Этерификация может быть также осуществлена при использовании кислоты общей формулы (II) в форме галогенида или смешанного ангидрида общей формулы (lib) О (lib) где Ar, Ri и R3 имеют значения, аналогичные указанным выше, а X представляет собой атом галогена или радикал ацилокси или ароилокси, возможно полученный in situ, в присутствии основания, которым преимущественно является азотсодержащее органическое основание, такое как трет, алифатический амин, например триэтиламин, пиридин, аминопиридина такого, как 4диметиламинопиридин или 4пирролидинопиридин, в инертном органическом растворителе, выбранном среди таких простых эфиров, как тетрагидрофуран, диизопропиловый эфир, метил-трет бутиловый эфир или диоксан, среди кетонов, среди таких сложных эфиров, как этилацетат, изопропилацетат или п-бутилацетат, среди таких нитрилов, как ацетонитрил, таких алифатических углеводородов, как пентан, гексан или гептан, таких галогенсо-держащих алифатических углеводородов, как дихлорметан или 1,2дихлорэтан, и таких ароматических углеводородов, как бензол, толуол, ксилолы, этилбензол, изопропилбензол или хлорбензол, при температуре, составляющей от 10 до 80°С, а предпочтительно 20°С Предпочтительно использовать активированное производное общей формулы (XI), в которой X представляет собой атом галогена или радикал ацилокси, содержащий от 1 до 5 атомов углерода, или ароилокси, арильная часть которого представляет собой фенил, возможно замещенный от 1 до 5 атомами или радикалами, имеющими одинаковое или различное значение, выбранными среди атомов галогена (хлор, бром) и радикалов нитро, метил или метокси Деблокирование боковой цепи может быть осуществлено в присутствии минеральной кислоты (соляной кислоты, серной кислоты) или органической кислоты (уксусной кислоты, метансульфокислоты, трифторметансульфокислоты, паратолуолсульфокислоты), используемой в единственном числе или в смеси, и проводится в органическом растворителе, выбранном среди спиртов (метанол, этанол, пропанол, изопропанол), простых эфиров (тетрагидрофуран, диизопропиловый эфир, метил-п-бутиловый эфир), сложных эфиров (этилацетат, изопропилацетат, п-бутилацетат), алифатических углеводородов (пентан, гексан, гептан), галогенсодержащих алифатических угле 43835 12 11 водородов 10 до 40°С, а предпочтительно близкой 20°С (дихлорметан, 1,2-дихлорметан), ароматичеСложный эфир общей формулы (XII) может ских углеводородов (бензол, толуол, ксилолы) и быть получен путем взаимодействия альдегида нитрилов (ацетонитрил), при температуре, сообщей формулы (XIII) ставляющей от -10 до 60°С, а предпочтительно от R3 -CHO, 15 до 30°С Минеральная или органическая кислогде R3 имеет значение, аналогичное указанта может быть использована в каталитическом ному выше, взятого в форме диалкилацеталя или количестве или стехиометрическом количестве ено-лалкильного эфира или ортоформиата общей или в избытке формулы XIV Деблокирование может быть также осуществHC(OR3)3 лено в условиях окисления при использовании, где R3 имеет значение, аналогичное указанному например, нитрата аммония и церия IV, взятых в выше, на производное фенилизосерина общей смеси ацетонитрил-вода или 2,3-дихлор-5,бформулы XV дициано-1,4-бензохинон в воде .COOR Аг. Деблокирование может быть также осуществлено в условиях восстановления, например, путем R -NH ОН гидрогенолиза, в присутствии катализатора і (XV) Защитные группы d и G2 представляют собой где Ar, Ri и R4 имеют значения, аналогичные предпочтительно 2,2,2-трихлорэтоксикарбонил, 2указанным выше, предпочтительно взятого в (2-трихлорметилпропокси)-карбонил или радикалы форме 2S, 3S, осуществляемого в инертном оргатриал килсил ил, диалкил-арилсилил, алкилдианическом растворителе в присутствии сильной рилсилил или триарилсилил, алкильная часть коминеральной кислоты, например серной, или торых содержит от 1 до 4 атомов углерода, а сильной органической кислоты, например паратоарильная часть представляет собой предпочтилуолсульфокислоты, возможно в форме соли пительно фенилы ридиния, при температуре, составляющей от 0°С Замена защитных групп d и, возможно, G2, до температуры кипения реакционной смеси Наипредставляющих собой силилсодержащий радиболее подходящими растворителями являются кал, на атомы водорода может быть осуществлеароматические углеводороды на одновременно с деблокированием боковой Производное фенилизосерина общей формуцепи Замена защитных групп d и, возможно, G2, лы (XV) может быть получено путем ацилировапредставляющих собой 2,2,2ния производного фенилизосерина общей формутрихлорэтоксикарбонил или 2-(2-три хлор-мелы XVI тилпропокси)-карбонил, осуществляется с помоАг\ .COOR щью цинка, возможно, ассоциированного с медью, в присутствии уксусной кислоты при температуре, \ составляющей от 20 до 60°С, или с помощью миNH ОН неральной или органической кислоты (такой как (XVI) соляная кислота или уксусная кислота), взятой в где Аг и R4 имеют значения, аналогичные укарастворе с алифатическим спиртом, содержащим занным выше от 1 до 3 атомов углерода, или в таком сложном Ацилирование осуществляют, воздействуя алифатическом эфире, как этилацетат, изопропибензоилхлоридом или реакционноспособным пролацетат или п-б ути л ацетат, в присутствии цинка, изводным общей формулы XVII возможно, ассоциированного с медью R2-O-CO-Y, Эта замена может быть также осуществлена Где R2 имеет значение, аналогичное указанпутем электролитического восстановления ному выше, a Y представляет собой атом галогена Кислота общей формулы (II) может быть по(фтор хлор) или ocraTOK-O-R2 или -O-CO-O-R2, лучена путем омыления в основной среде сложноиспользуя органический растворитель, например го эфира общей формулы XII такой алифатический сложный эфир, как этилацетат, или такой галогенсодержащий алифатический .COOR углеводород, как дихлорметан, в присутствии минерального или органического основания, например бикарбоната натрия В основном реакцию (XII) проводят при температуре от 0 до 50°С, а предпочтительно близкой к 20°С Соединение общей формулы (XVI) может быть получено в условиях, описанных в междунагде Ar, Ri и R3 имеют значения, аналогичные родной заявке PCTWON92/09589 указанным выше, a R4 представляет собой алкил, Изобретение относится также к кислотам обсодержащий от 1 до 4 атомов углерода, возможно щей формулы II замещенный фенилом В основном, омыление осуществляют с помощью такого минерального основания, как гидроокись щелочного металла (лития, калия, натрия), карбоната или бикарбоната щелочного металла (бикарбоната натрия, карбоната или бикарбоната калия) в среде водно-спиртовой, такой как смесь метанол-вода, при температуре, составляющей от 43835 13 соон СП) где Ri представляет собой бензоил или остаток R2-O-CO- где R2 представляет собой линейный или разветвленный алкил, содержащий от 1 до 8 атомов углерода, Аг представляет собой фенил, R3 представляет собой атом водорода, С1-С4 алкоксигруппу или фенил, возможно замещенный одним или двумя заместителями, выбранными из С-і-Сб алкила или С-і-Сє алкоксигруппы, имеющим форму сложного эфира, ангидрида, смешанного ангидрида или галогенида, в качестве исходного продукта для получения соединений общей формулы I Изобретение относится также к соединениям формулы IV О 0-G Аг. где Кі, Аг и R3 имеют указанные выше значения, a Gi представляет собой защитную группу функциональной оксигруппы, a G2 представляет собой ацетил или защитную группу функциональной оксигруппы в качестве промежуточного продукта при получении соединения общей формулы I Способ, предлагаемый в настоящем изобретении, особо пригоден при получении соединении общей формулы (І), в которой R представляет собой атом водорода или ацетил, a Ri представляет собой бензоил или трет, бутоксикарбонил, Аг представляет собой фенил Нижеследующие примеры иллюстрируют настоящее изобретение Пример 1 Раствор 10,0г метип-3-трет бутоксикарбониnaMHHO-2-OKCH-3^eHHn-nponnoHaTa-(2R, 3S) и 0,25г пара-толуол сул ьфоната пиридиния в 200см3 толуола подвергают дегидратации путем дистилляции 20см растворителя В течение 5мин в реакционную смесь, нагретую до температуры кипения, вводят 8,34см пара-метоксибензальдегида диметилацеталя Во время введения названного соединения дистиллируют 50см растворителя, а затем еще 100см После охлаждения до температуры, приблизительно равной 20°С, в течение Юмин прибавляют 80см циклогексана Полученную смесь охлаждают до температуры 0 - 5°С Полученную пульпу подвергают фильтрованию на фритированном стекле, образованный осадок промывают 40см циклогексана, затем сушат при пониженном давлении и температуре, близкой к 20°С Таким образом получают (выход 74%) 10,39г 14 3-трет, бутоксикар-бонил-2-(4-метоксифенил)-4фенил-5-метоксикарбонил-1,3-оксазолидина-(2Р?, 4S, 5R), имеющего следующие характеристики - инфракрасный спектр (таблетки с КВг) характеристические полосы поглощения 3100 - 3000, 2980, 2960, 2930, 2910, 2840, 1740, 1700, 1614, 1514, 1460, 1435, 1390, 1370, 1245, 1175, 1165, 1 316,760,700см - спектр ядерно-магнитного резонанса протона (400 МГц, CDCU, температура 323К, химический сдвиг ° в ррт, константы сочетания J в Гц) 1,11 (S, 9H), 3,60 (S, ЗН), 3,82 (S, ЗН) 4,58 (d, J = 5, 1Н), 5,42 (d широкий, J = 5,1 Н), 6,38 (S широкий, 1Н), 6,92 (d, J = 7,5, 2Н), 7,30 (mt, 7H) К раствору 3,0г соединения, полученного ра3 3 нее, взятого в 27см метанола, прибавляют 14см отводного раствора, содержащего 0,31 г моногидратированного гидроксида лития В течение 2ч осуществляют перемешивание при температуре, близкой 20°С Метанол удаляют путем дистилляции при пониженном давлении, после чего прибавляют 40см дихлорметана В режиме интенсивного перемешивания реакционную смесь подкисляют путем присоединения 1 N-ной соляной кислоты до рН 1 После отстаивания водную фазу дважды экстрагируют 40см3 дихлорметана Объединенные органические фазы сушат на сульфате натрия После фильтрования и выпаривания растворителя получают (при выходе 94,5%) 2,88г 3-трет бутоксикарбонил-2-(4метоксифенил)-4-фенил-1,3-оксазолидин-5Kap6oHOBO^(2R, 4S, 5R) кислоты, имеющей следующие характеристики - инфракрасный спектр (таблетки с КВг), характеристические полосы поглощения 3325 - 2675 2980, 2955, 2935, 2845, 1755, 1700, 1615, 1590, 1515, 1460, 1250, 1175, 1030, 835, 765 и 705см \ - спектр ядерно-магнитного резонанса протона (250 МГц, CDCI3, химический сдвиг ° в ррт, константы сочетания J в Гц) 1,08 (S, 9H) 3,82 (3, ЗН), 4,61 (d, J = 5,1Н), 5,42 (d широкий, J = 5,1Н), 6,38 (З широкий, 1Н), 6,92 (d, J = 7,5, 2Н), 7,30-7,45 (mt, 7Н) Пример 2 К перемешиваемому раствору 1,0г 3трет, бутоксикарбонил2-(4-метоксифенил)-4фeнил-1,3-oкcaзoлилин-5-кapбoнoвoй-(2R, 4S, 5R) кислоты 1,34г 4-ацетокси- 2*^-бензоилокси-5 " ,20-эпокси1,13^ -диокси-9-оксо-бис-(2,2,2трихлорэтокси)- 7 " , 1 о " -карбонилокси-11 таксена и 0,061 г 4-диметиламинопиридина в 7,6см безводного толуола прибавляют при температуре 0°С 0,52г дициклогексилкарбодиимида В течение 2ч осуществляют перемешивание при температуре 20°С Дициклогексилкарбамид отделяют путем фильтрования и промывают толуолом Собранные органические фазы промывают 0,1 N-ным раствором соляной кислоты, насыщенным раствором гидро-генокарбоната натрия, после чего сушат на сульфате натрия После фильтрования и концентрирования насухо при пониженном давлении получают 2,09г сырого 3-трет бутоксикарбонил-2(4-метоксифенил)-4-фенил-1,3-оксазолидин-5 16 43835 туре, близкой к 20°С, при перемешивании прибавкарбоксилата-(2Р, 4S, 5R) 4-ацетокси-2 ^ ляют 40см3 воды После отстаивания органическую фазу сушат на сульфате магния После бензоилокси-5 " , 20-эпокси-1 -окси-9-оксо-бисфильтрования и концентрирования насухо остаток (2,2,2-трихл орэпокси)-7 " , 10 " -карбонилоксирастворяют в 8см 3 диизопропилового эфира Кристаллизующийся продукт отделяют путем фильт11 -таксен-13 ^ -ила, имеющего следующие харакрования, промывают в диизопропиловом эфире, 3 теристики после чего сушат при пониженном давлении Та- инфракрасный спектр (СНСІз) характеристиким образом получают (при выходе 50%) 1,7г 3ческие полосы поглощения 3575, 1765, 1740, 1725, трет бутоксикарбони-ламино-2-(3,41710, 1615, 1515, 1455, 1250, 1175, 980, 710 и 700 см \ диметоксифенил)-4-фенил-5-метоксикарбонил- спектр ядерно-магнитного резонанса протона 1,3-оксазолидин- (2R, 4S, 5R), имеющего следую(400 МГц, CDCI3), температура 323К, химический щие характеристики - инфракрасный спектр (таблетки из смеси с сдвиг^ в ррт, константы сочетания J в Гц) КВг) характеристические полосы поглощения 1,09 (S, 9H), 1,18 (3, ЗН), 1,27 (S, ЗН) 1,67 (3, 3085, 3065, 3030, 2975, 2935, 2840, 1740, 1700, ЗН), 1,72(S, 1H), 1,82(3, ЗН), 1,90(3, ЗН), 2,02 (т, 1600, 1520, 1495, 1455, 1425, 1265, 1175, 1025, 1Н), 2,13 (dd, J = 15 и 9,1 Н), 2,25 (dd, J = 15 и 800, 755,700см1, 9,1 Н), 2,60 (mt, 1H), 3,83 (d, J = 7,1Н), 3,83 (З, ЗН), - спектр ядерно-магнитного резонанса протона 4,12 (d, J = 8,15), 4,26 (d, J = 8,1 H), 4,60 (d, J = 5,1H), 4,61 (d, J = 12,1 H), 4,78 (аЬогран , J = 11, (300 МГц, DMSO сіє, химический сдвиг 5 5 в ррт, 2H), 4,90 (d шир , J = 10,1 H), 4,90 (d, J = 12,1Н), константы сочетания J в Гц), 5,45 (d шир , J = 5,1 H), 5,50 (dd, J = 11 и 7,1 H), 1,00 (З, 9Н), 3,58 (3, ЗН), 3,80 (3, ЗН), 3,83 (S, 5,66 (d, J = 7,1H), 6,12 (t, J = 9,1 H), 6,18 (З, 1Н), ЗН), 4,68 (d, J = 4,1Н), 5,31 (mf, HI), 6,34 (mf, 1H) 6,39 (S шир), 6,94 (d, J = 7,5, 2H), 7,42 (d, J = 7,5, 6,95 - 7,10 (mt, 3H), 7,35 - 7,50 (mt, 5H) 2H), 7,35 и 7,50 (mt, 5H) 7,49 (t, J = 5 2H), 7,63 (t, J К раствору 1,63г таким образом полученного = 7,5, IH),8,03(d,J = 7,5,2H) сложного эфира, взятого в 25см3 метанола и 7см 3 дистиллированной воды, прибавляют 0,24г 86%К раствору 0,161г соединения, полученного ного гидроксида калия В течение 40мин перемевыше, в 2,1см этилацетата прибавляют 9 ^ л шивают при температуре, близкой к 20°С После 37%-ного водного раствора соляной кислоты (р/р) удаления метанола путем дистилляции при пониВ течение Зч, осуществляют перемешивание при женном давлении и подкисления среды до рН 3-4 температуре, близкой 20°С Количественный анас помощью 1 N-ной соляной кислоты, образованлиз, осуществленный путем жидкостной хроматоный осадок отделяют фильтрованием Осадок графии высокой результативности, показал, что после фильтрования промывают водой, затем выход 3-трет,бутоксикарбонила амино-З-фенил-2сушат Таким образом получают (при выходе 92%) й: окси-пропионата (2R, 3S) 4-ацетокси-2 1,45г 3-трет бутоксикарбонил-2-(3,4-диметоксифенил)-4-фенил-1,3-оксазолидин-5-карбоновой-(2Р, -20-ЭПОКСИ-1 -окси-9 оксо-бисбензоилокси 43S 5R) кислоты, чистота которой составляет 95%, а характеристики которой следующие (2,2,2-трихлорэтокси)- 7 " , 10 " -карбонилокси- инфракрасный спектр (таблетки в смеси с 11 -таксен-13*^ -ила составляет 95% КВг) характеристики полосы поглощения 3225, 3-трет бутоксикарбониламино-З-фенил-23030, 3005, 2975, 2930, 2840, 1740, 1710, 1610, окси-пропионат-(2Р, 3S) -ацетокси-2 й: 1600, 1515, 1465, 1455, 1260, 1175, 1020, 15 бензоилокси-5 20-эпокси-1 -окси-9-оксо-бис (2,2,2-трихлорэтокси)- 7 " , 10 " -карбонилокси11-таксен-13 ^ - ила превращают в 3-трет бутоксикарбониламино-3-фенил-2-окси-пропионат-(2Р 3S) 4- ацетокси-2^ -бензоилокси-5" , 20-эпокси' , 1 о " -триокси-И-таксен- 1 3 ^ - и л а (иди Таксотер) в условиях, описанных в патенте ЕР N 0253738 Пример 3 Раствор 2,43г метил-3-трет бутоксикарбониламино-2-окси-3-фенил-пропионата-(2Р 3S) и 0,059г пара-толуол сул ьфоната пиридиния в 60см3 толуола подвергают дегидратации путем дистиллирования 5см3 растворителя Затем к реакционной смеси, нагретой до температуры кипения, прибавляют в течение 15мин раствор 1,7г 3,4диметоксибензальдегиддиметилацеталя в 14см3 толуола В процессе прибавления названного соединения дистиллируют 15см3 толуола, а затем еще 25см После охлаждения при темпера 760,700см 1 , - спектр ядерно-магнитного резонанса протона (250 МГц, DMSO сіє, химический сдвиг ° в ррт, константы сочетания J в Гц) 1,00 (S, 9H), 3,78 (S, ЗН), 3,81 (3, ЗН), 4,55 ((d, J = 4,1Н), 5,23 (mf, 1H), 6,29 (mf, 1H), 6,90 - 7,10 (mt, ЗН), 7,30 - 7,50 (mt, 5H) Пример 4 К перемешиваемой суспензии 0,155г 3-трет, бутоксикарбонил-2-(3,4диметоксифенил-4-фенил-1,3-оксазолипин-5карбоновой-(2Р 4S, 5R) кислоты и 0,24г 4ацетокси-2 й: -бензоилокси-5 " , 20-эпокси-1, 13адиокси-9-оксо-бис-(2,2,2-трихлорэтокси)-7 " , 10 " -карбонилокси-11-таксен в 2,25см безводного толуола прибавляют в один прием при температуре 0°С 0,076г дициклогексилкарбодиимида и 0,0075г 4-диметиламинопиридина Осуществляют перемешивание в течение 1ч при температуре 0°С Образовавшийся дициклогексилкарбамид отделяют фильтрованием Осадок после фильт 43835 18 17 рования промывают толуолом Объединенные 1,3-оксазолидина-(43, 5R) в виде смеси диастетолуол содержащие фазы последовательно прореоизомеров А и В квазиэквимолекулярной, мывают водным насыщенным раствором бикаримеющей следующие характеристики боната натрия, затем водой После высушивания - инфракрасный спектр (ССЦ) характеристии концентрирования насухо при пониженном давческие полосы поглощения 3095, 3070, 3035, 2980, лении получают (при выходе количественном) 2955, 2935, 2840, 1760, 1645, 1710, 1615, 1590, 0,430г 3-трет бутоксикарбонил-(3,41510, 1465, 1455, 1435, 1210, 1160, 1040, 835 и 700 диметоксифенил)-4-фенил-1,3-оксазолидин-5см , - спектр ядерно-магнитного резонанса протона карбоксилат-(2Р, 4S, 5R) 4-ацетокси-2 ^ бензоилокси-5 " , 20-эпокси-1,13 й: диокси-9-оксобис-(2,2,2-трихлорэтокси)-7 " , 1о" карбонилокси-И-таксен-ІЗ*^ -ила, характеристики которого следующие - инфракрасный спектр (ССІз) характеристические полосы поглощения 3580, 3550 - 3375, 3090, 3070, 3030, 1765, 1740, 1730, 1715, 1605, 1520, 1500, 1465, 1455, 1265, 1250, 1180, 1035, 985, 710 и 695 с м 1 , - спектр ядерно-магнитного резонанса протона (400 МГц, CDCI3, температура 323К, химический сдвиг ° в ррт, константы сочетания J в Гц) 1,10 (S, 9Н), 1,17 (3, ЗН), 1,25 (3, ЗН), 1,66 (3, ЗН), 1,70(S, 1H), 1,82(3, ЗН), 1,90(3, ЗН), 2,02 (mt, 1H), 2,13 (dd, J = 15 и 9,1Н), 2,24 (dd, J = 15 и 9,1Н), 2,60 (mt, 1H), 3,83 (d, J = 7,1 H), 3,89 (З, ЗН), 3,93 (З, ЗН), 4,12 (d, J = 8,1H), 4,26 (d, J = 8,1H), 4,60 (d, J = 4,5, 1H), 4,60 (d, J = 12 1H), 4,78(аЬогран , 2H), 4,89 (d шир , J = 10, 1H), 4,90 (d, J = 12, 1H), 5,46 (d, шир , J = 4,5, 1H), 5,50 (dd, J = 11 и 7,1 H), 5,66 (d, J = 7 1H), 6,13 (t, J = 9,1H), 6,15 (S, 1H), 6,39 (S, 1H), 6,90 (d, J = 7,5, 1H), 7,03 (d, J= 1, 1H), 7,07 (dd, J = 7,5 и 1, 1H), 7,35 и 7,50 (mt, 5H), 7,48 (t, J = 7,5, 2H), 7,62 (t, J = 7,5, 1H), 8,03 (d, J = 7,5, 2H) К раствору 0,223г сложного эфира, полученного выше, в 2,5см3 метанола прибавляют 12 ^ л метансульфокислоты Смесь перемешивают в течение 2ч ЗОмин при температуре, близкой 20°С Количественный анализ, осуществленный путем жидкостной хроматографии высокой результативности, показывает, что выход 3- трет, бутоксикарбони-ламино-3-фенил-2-окси-пропионата-(2Р, 3S) 4-ацетокси-2 й: -бензоилокси-5 " , 20-эпокси-1 окси-9-оксо-бис-(2,2,2-трихлорэтокси)-7 " , " карбонилокси-И-таксен-ІЗ*^ -ила составляет 88% Пример 5 Раствор 0,497г метил-3-трет бутоксикарбониламино-2-окси-3-фенил-пропионата-(2Р,33), 0,021г паратолуолсульфоната пиридиния и 0,29г 2 4-диметоксибензальдегида в 20см3 безводного толуола нагревают при рефлексе в течение 24ч Воду, образовавшуюся в процессе реакции, удаляют с помощью насадки Дина-Старка После охлаждения при температуре, близкой к 20°С, раствор промывают в водном 37%-ном растворе гидрогеносульфита натрия (вес/вес), затем в водном насыщенном растворе бикарбоната натрия После концентрирования органической фазы при пониженном давлении получают (при выходе 80%) 0,700г 3-трет бутоксикарбонил-2-(2,4диметоксифенил-4-фенил-5-метоксикарбо-нил (250 МГц, DMSO сіє, химический сдвиг ° в ррт, константы сочетания J в Гц) 1,00 (S, -С(СН3)з для В), 1,22 (S, -С(СН3)3 для А), 3,55 (mf -СООСН3 или -ОСН 3 для В), 3,87 и 3,85 (mt, -СООСН3 или -ОСНз для А и В), 4,64 (d, J = 4,5, -Н5 для В), 5,01 (d, J = 2,5, -Н5 для А), 5,21 (d, J = 2,5, -Н4 для А), 5,26 (d, J = 4,5 -Н4 для В), 6,46 (dd, J = 7,5 и 1,5, -С6Н5 в 2 -Н5 для А), 6,52 (S, -Н2 для А), 6,50 - 6,65 (mt, -Н5 и С 6 Н 5 в 2 -Н5 и -НЗ В + -С6Н5 в 2 -НЗ для А), 7,00 (d, J = 7,5, -С6Н5 в 2 Н6 для В), 7,30 - 7,53 (mt, 5H, -С6Н5 в4-Н2-Н6 для А и В) К раствору 0,700г сложного эфира, полученного выше, взятого в смеси 9см 3 метанола и 3 см 3 дистиллированной воды, прибавляют 0,073г моногидратного гидроксида лития В течение Зч ЗОмин смесь перемешивают при температуре, равной приблизительно 20°С Метанол удаляют путем дистилляции при пониженном давлении Водную фазу промывают толуолом, затем подкисляют до рН 3-4 путем введения водного 1 N-ного раствора соляной кислоты Полученный осадок отделяют фильтрованием, а остаток после фильтрования обильно промывают водой до нейтральности, после чего сушат при пониженном давлении Таким образом получают (при выходе 74%) 0,450г 3трет бутокси-карбонил-2-(2,4-диметилфенил)-4фенил-1,3-оксазолидин-5-карбоновой (4S, 5R) кислоты в виде смеси диастереоизомерных форм А и В квази эквимолекулярной, имеющей следующие характеристики - инфракрасный спектр (в таблетках с КВг) характеристические полосы поглощения 3300 2700, 2700 - 2250, 3070, 3030, 3005, 2975, 2940, 2840, 1710, 1615, 1590, 1510, 1460, 1210, 1160, 1035, 835 и 700 с м 1 , - спектр ядерно-магнитного резонанса протона (200 МГц, DMSO de, температура 393К, химический сдвиг ° в ррт, константы сочетания J в Гц, смесь 2 диастериоизомеров в соотношении 55/45) 1,00(S, -С(СНз) для В), 1,25(S, -C(CH3)3 для А), 3,75 и 3,85 (mt, 6H, -ОСН3 для А и В), 4,43 (d, J = 5, -Н5 для В), 4,77 (d, J = 2, -Н5 для А), 5,21 (d,J = 2, Н4 для А), 5,21 (d, J = 2, -Н4 для В), 6,42 dd, J = 7,5 и 1,5, С 6 Н 5 в 2 -Н5 для А), 6,49 (S, -Н2 для А, 6,45 6,60 (mt, -Н2 и С 6 Н 5 в 2 -Н5 и -НЗ для В + -С6Н5 в 2 -НЗ для А/, 7,02 (d, J = 7,5, -С6Н5 в -Н6 для А/, 7,15 /d, J = 7,5, -С6Н5 в 2 -Н6 для В/, 7,25-7,50 (mt, 5H, С Н в -Н2 и -Н6 для А и В/ Пример 6 К перемешиваемой суспензии 1,671 г 3трет бутоксикарбонил-2-(2,4-диметоксифенил)-4фенил-1,3-оксазолидин-5-карбоновой-(43, 5R) кислоты 5^ , и 1,003г 4-ацетокси-2 й: -бензоилокси20-эпокси-1,13 а -диокси-9-оксо-бис-(2,2,2 19 43835 н трихлорэтокси)-7•P , 10,-карбонилокси-11 -таксона 3 в 8см безводного толуола прибавляют в один прием при температуре 0°С 0,658г дициклогексилкарбодиимида и 0,0287г 4диметиламинопиридина В течение Юмин осуществляют перемешивание притемпературе 0° С, а затем при температуре, близкой к 20°С, в течение 5ч Образовавшийся дициклогексилкар-бамид отделяют фильтрованием и промывают в толуоле Собранные толуол содержащие фазы промывают водным насыщенным раствором бикарбоната натрия, а затем водой После высушивания, фильтрования и концентрирования насухо при пониженном давлении получают 1,623г 3трет бутоксикарбонил-2-(2,4-диметоксифенил)-4фенил-1,3-оксазолидин-5-карбоксилата-(43, 5R) 4 ацетокси-2 й: -бензоилокси-5 " , 20-эпокси-1-окси9-оксо-бис-(2,2,2-трихлорэ-токси)-7 " , 1о" карбонилокси-И-таксен-ІЗ*^ -ила неочищенного в виде диастереоизо-мерной смеси, которую разделяют на изомеры с помощью жидкостной хроматографии на силика-геле, используя в качество элюента смесь этила-цетат-циклогексан (75-25 по объему) Один из двух диастереоизомеров имеет следующие характеристики - спектр ядерно-магнитного резонанса протона (400 МГц, CDCI3, химический сдвиг ° в ррт, константы сочетания J в Гц), 1,20 (S, ЗН), 1,25 (S, 9H), 1,30 (5, ЗН), 1,76 (5, 1Н), 1,85 (3, ЗН), 2,00 (5, ЗН), 2,05 (mt, 1H), 2,17 (5, ЗН), 2,26 (dd, J = 15 и 9, 1Н), 2,34 (dd, J = 15 и 9, 1Н), 2,60 (mt 1H) 3,82 (5, ЗН), 3,92 (S, ЗН), 3,95 (d j = 7,1Н), 4,14 (d, J = 8, 1H), 4,30 (d, J = 8, 1H), 4,62 (d, J = 12, 1H), 4,80 (ab огран 2H), 4,90 (mt, 1H), 4,92 (mt 1H), 4,92 (d J = 12, 1H), 5,36 (d, J = 2, 1H), 5,63 (dd, J = 11 и 7, 1H), 5,70 (d, J = 7, 1H), 6,28 (S, 1H), 6,34 (t, J = 9, 1H), 6,43 (dd, J = 7,5 и 1,5, 1H), 6,51 (d, J = 1,5, 1H), 6,69 (S, 1H), 7,16 (d, J = 7,5, 1H), 7,35-7,50 (mt, 3H), 7,48 (t, J = 7,5, 2H), 7,67 (d, J = 7,5, 2H), 7,63 (t, J = 7,5, 1H), 8,04 (d, J = 7,5, 2H) Другой диастериоизомер имеет следующие характеристики - инфракрасный спектр (ССЦ) характеристические полосы поглощения 3580, 3550-3300, 3070, 3030, 1760, 1740, 1710, 1610, 1590, 1510, 1455, 1435, 1260, 1250, 1210, 1180, 1035, 985,710 и 700 см - спектр ядерно-магнитного резонанса протона (400МГц, CDCI3, химический сдвиг 5 в ррт, константы сочетания J в Гц) 1,10(5, 9Н -С(СН3)3), 11,18(3, ЗН -СН3 16 или 17), 1,24 (S, ЗН -СН 16 или 17), 1,53 (S, ЗН -СН3 19), 1,66 (S, 1H -ОН 1), 1,82 (В, ЗН -СН 18), 2,00(5, ЗН -СОСН3 ), 2,00 (mt, 1H -(СН)-Н6 , 2,12 (dd, J = 15 и 9, 1Н -(СН)- -Н14 ), 2,24 (dd, J = 15 и 9, 1Н -(СН) -Н14 ), 2,60 (mt, 1H (СН)- -Н6 ), 3,82 (d, J = 7, 1Н -НЗ), 3,82 (5, ЗН -ОСН3), 3,90 (S, ЗН ОСН3), 4,12 (d, J = 8,1Н -(СН) -Н20 ), 4,26 (d, J = 8, 1H (СН) -Н20 , 4,55 (d, J = 4, 1H -H5 ), 4,62 (d, J = 12, 1H -O(CH) -Н/ в СС13СН2ОСОО в -7), 4,78 (ab, J 20 = 11, 2Н О -СН2 в С13СН2ОСОО в -10), 4,89 (d шир , J -Н5 , 4,89 (d, J = 12, 1H -O(CH) -Н в СНзССН2ОСОО в - 7), 5,46 (d шир , J = 4, 1Н -Н41 ), 5,50 (dd, J = 11 и 7, 1H -Н7 , 5,65 (d, J = 7, 1Н Н2 , 6,05 (t, J = 9, 1Н -Н13 ), 6,16 (S, 1H -НЮ ), 6,50 (mt, 2Н -С6Н5 в 2і -НЗ й -Н5 , 6,72 (mf, 1Н -Н2), 7,22 [d, J= 7,5, 1Н С 6 Н 5 в2'-Н6],7,30 - 7,50 [mt, 5H С 6 Н 5 в 41 (-Н2- -Н6)] , 7,48 [t, J = 7,5, 2Н -ОСОС6Н5 -НЗ и -Н5] , 7,63 [t, J = 7,5, 1НОСОС 6 Н 5 -Н4 ] ,8,03[d, J = 7,5, 2Н -ОСОС6Н5 (-Н2 и -Н6))] К раствору 1,623г неочищенного сложного эфира, полученного выше, в 20см метанола прибавляют 8 0 ^ л метан сул ьфоки слоты В течение 4ч при температуре, близкой 20°С, смесь перемешивают Количественный анализ, осуществленный путем жидкостной хроматографии высокой результативности, показал, что выход 3трет бутоксикарбониламино-З-фенил-2-оксипропионата-(2Р, 3S) 4-ацетокси-2й:-бензоилокси5 " 20-эпокси-9-оксо-бис-(2,2,2-трихлорэтокси) Р 7 Р : 1 о " -карбонилокси-И-таксен-ІЗ*^-ила составляет 88% Пример 7 Раствор 10,0г метил-3-трет бутоксикарбониламино-2-окси-3-фенил-пропионата-(2Р, 3S) 1,0г пара-толуол сул ьфоната пиридиния и 5,7см бензальдегиддиметилацеталя в 250см3 безводного толуола нагревают с обратным холодильником Перегоняют 200см3 со растворителя за 2ч Раствор охлаждают до температуры, близкой 20°С, и промывают 50см3 воды После отстаивания, высушивания и концентрирования насухо органической фазы полученный остаток растворяют в 14см3 диизопропилового эфира Полученную пульпу фильтруют, промывают и отжимают Таким образом получают (при выходе 65%) 8,4г 3трет бутокси-карбониламино-2,4-дифенил-5метоксикарбонил-1,3-оксазолидин-(2Р, 4S, 5R)B виде одного диастереоизомера, имеющего следующие характеристики - инфракрасный спектр (таблетировано в смеси с КВг) характеристические полосы поглощения 3250, 3095, 3070, 3030, 2975, 1710, 1500, 1460, 1165, 760 и 700см 1 , - спектр ядерно-магнитного резонанса протона (300МГц, DMSO сіє, химический сдвиг ° в ррт, константы сочетания J в Гц) 0,95(S, 9H), 4,26 (mf, 1H), 5,10 (mf, 1H), 6,20 (5, 1Н), 7,25 - 7,55 (mt, 5H) К раствору 7,07г сложного эфира, полученного выше, в 88см метанола и 22см3 воды прибавляют 1,26г гидроксида калия 86%-ного Осуществляют перемешивание в течение ночи при температуре, близкой к 25°С Метанол удаляют путем перегонки при пониженном давлении Затем подкисляют добавлением 1 N-ной соляной кислоты до рН 2 Образованный осадок отделяют фильтрованием, обильно затем промывают водой до нейтральной реакции, после чего сушат при пониженном давлении Таким образом получают (при выходе количественном) 7,0г 3-трет бутоксикар-бонил-2,4дифенил-1,3-оксазолидин-5-карбоновой-(2Р, 4S, 5R) кислоты в виде единственного диастереоизо 21 43835 мера, имеющего следующие характеристики - инфракрасный спектр (таблетировано в смеси с КВг) основные характеристические полосы поглощения 3080, 3050, 3030, 3005, 2975, 1760, 1695, 1600, 1585, 1490, 1460, 1435, 1175, 760 и 700см 1 - спектр ядерно-магнитного резонанса протона (200 МГц, DMSO d , химический сдвиг 5 6 ррт, константы сочетания J в Гц), 0,98 (S, 9H), 3,38 (5, ЗН), 4,71 (d, J = 4,1), 5,30 (d широкий, J = 4, 1Н), 6,38(S, 1H), 7,25 - 7,55 (mt, 5H) Пример 8 К перемешиваемой суспензии 1,25г 3-трет бутоксикарбонил-2,4-дифенил-1,3-оксазопидин-5карбоновой-(2Р, 4S, 5R) кислоты и 1,08г 4ацетокси-2 й: -бензоилокси-5 " , 20-эпокси1,13^ -диокси-9-оксо-бис-(2,2,2-трихлорэтокси) 7 Р : ю " , - карбонилокси-11-таксена в 12см3 безводного толуола прибавляют 0,70г дициклогексилкарбодиимида и 0,030г 4диметиламинопиридина Смесь перемешивают в течение 24ч при температуре, близкой к 20 С Образовавшийся дициклогексилкарбамид отделяют фильтрованием, после чего промывают толуолом Собранные органические фазы промывают водным насыщенным раствором бикарбоната натрия После высушивания и концентрирования насухо при пониженном давлении получают 2,27г неочищенного соединения, которое очищают путем жидкостной хроматографии на силикагеле, используя в качестве элюента смесь гексанэтилацетат (1/1 по объему) Таким образом получают (при выходе 75%) 1,05г 3-трет бутокси-2,4дифенил-1,3оксазоли-дин-5-карбоксилата-(2Р, 4S, 5R) 4-ацетокси-2 ^ бензоилокси- 5 " , 20эпокси-1-окси-9-оксо-бис-(2,2,2трихлорэтокси)jР
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 305/00, A61K 31/421, C07D 263/06, C07D 413/12, A61K 31/42, C07D 263/04, A61K 31/337, A61P 35/00, A61K 31/335
Мітки: таксану, проміжні, сполуки, похідних, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/13-43835-sposib-oderzhannya-pokhidnikh-taksanu-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних таксану та проміжні сполуки</a>
Попередній патент: 4-аміно-1-піперидилбензоїлгуанідини, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі та спосіб її одержання
Наступний патент: Спосіб каталітичного оксихлорування етану до вінілхлориду
Випадковий патент: Опалювальний котел газовий