Похідне бензотіофену, фармацевтична лікарська форма, фармацевтична композиція, спосіб лікування остеопорозу та спосіб зниження рівнів ліпідів
Номер патенту: 57596
Опубліковано: 16.06.2003
Автори: Арбатнот Гордон Нелсон, ХАРТАУЕР Керрі Джон, Стратфорд Роберт Юджін, мол., ЛЮК Уейн Дуглас, Далдер Брайан Уестон
Формула / Реферат
l. Похідне бензотіофену формули І
(I)
та його фармацевтичнo прийнятні солі та сольвати, яке відрізняється тим, що знаходиться у подрібненій формі, причому середній розмір відповідних частинок є меншим ніж 25 мікрон, і розмір щонайменше 90% відповідних частинок є меншим ніж 50 мікрон.
2. Сполука за п. 1, де середній розмір відповідних частинок становить від 5 до 20 мікрон.
3. Сполука за п. 1, де розмір щонайменше 90 % відповідних частинок є меншим ніж 35 мікрон.
4. Сполука за будь-яким з пп. 1-3, де сполукою формули І є ралоксифену гідрохлорид.
5. Сполука за п. 4, яка являє собою несольватований кристалічний гідрохлорид, який має рентгенівську дифрактограмму, одержану за допомогою мідного джерела випромінювання, практично таку,як наведено нижче:
Міжплощинна відстань d
І/Іо
(Ангстреми)
(х100)
13,3864
71,31
9,3598
33,16
8,4625
2,08
7,3888
7,57
6,9907
5,80
6,6346
51,04
6,1717
29,57
5,9975
5,67
5,9135
9,87
5,6467
38,47
5,4773
10,54
5,2994
4,74
4,8680
4,03
4,7910
5,98
4,6614
57,50
4,5052
5,75
4,3701
9,03
4,2516
69,99
4,2059
57,64
4,1740
65,07
4,0819
12,44
3,9673
22,53
3,9318
100,00
3,8775
9,07
3,7096
33,38
3,6561
21,65
3,5576
3,36
3,5037
7,97
3,4522
18,02
3,4138
4,65
3,2738
10,23
3,1857
8,90
3,1333
6,24
3,0831
9,43
3,0025
12,13
2,9437
4,96
2,8642
7,70
2,7904
11,95
2,7246
3,05
2,6652
3,32
2,5882
7,30.
6. Фармацевтична лікарська форма, яка містить або до складу якої входять сполука за будь-яким з пп. 1-5 та один або декілька фармацевтично прийнятних носіїв, розріджувачів або наповнювачів.
7. Фармацевтична композиція, яка містить або до складу якої входять сполука за п. 1 або її фармацевтично прийнятна сіль або сольват, у поєднанні з одним або декількома фармацевтично прийнятними носіями, розріджувачами або наповнювачами.
8. Спосіб лікування остеопорозу, який включає введення ефективної кількості сполуки формули І за будь-яким з пп. 1-5 або фармацевтичної лікарської форми або композиції за п. 6 або 7 особі, яка цього потребує.
9. Спосіб зниження рівнів ліпідів у сироватці, який включає введення ефективної кількості сполуки формули І за будь-яким з пп. 1-5 або фармацевтичної лікарської форми або композиції за п. 6 або 7 особі, яка цього потребує.
10. Виріб, до складу якого входить пакувальний матеріал, в якому уміщена фармацевтична лікарська форма, причому зазначений пакувальний матеріал додатково споряджений етикеткою, на якій вказано, що зазначена фармацевтична лікарська форма є придатною для пригнічення певного патологічного стану людини, причому згадана фармацевтична лікарська форма містить або до її складу входить сполука за будь-яким з пп. 1-5.
Текст
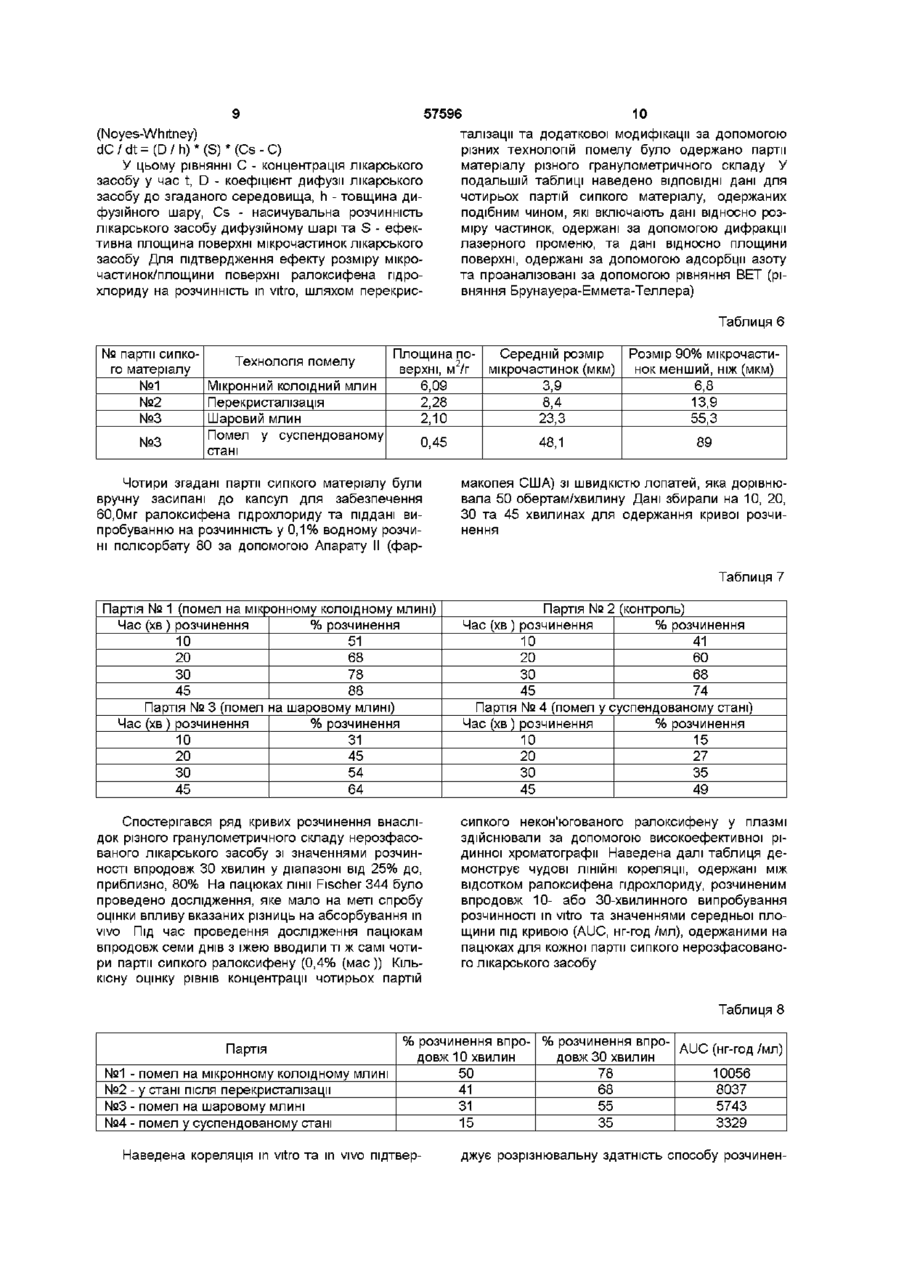
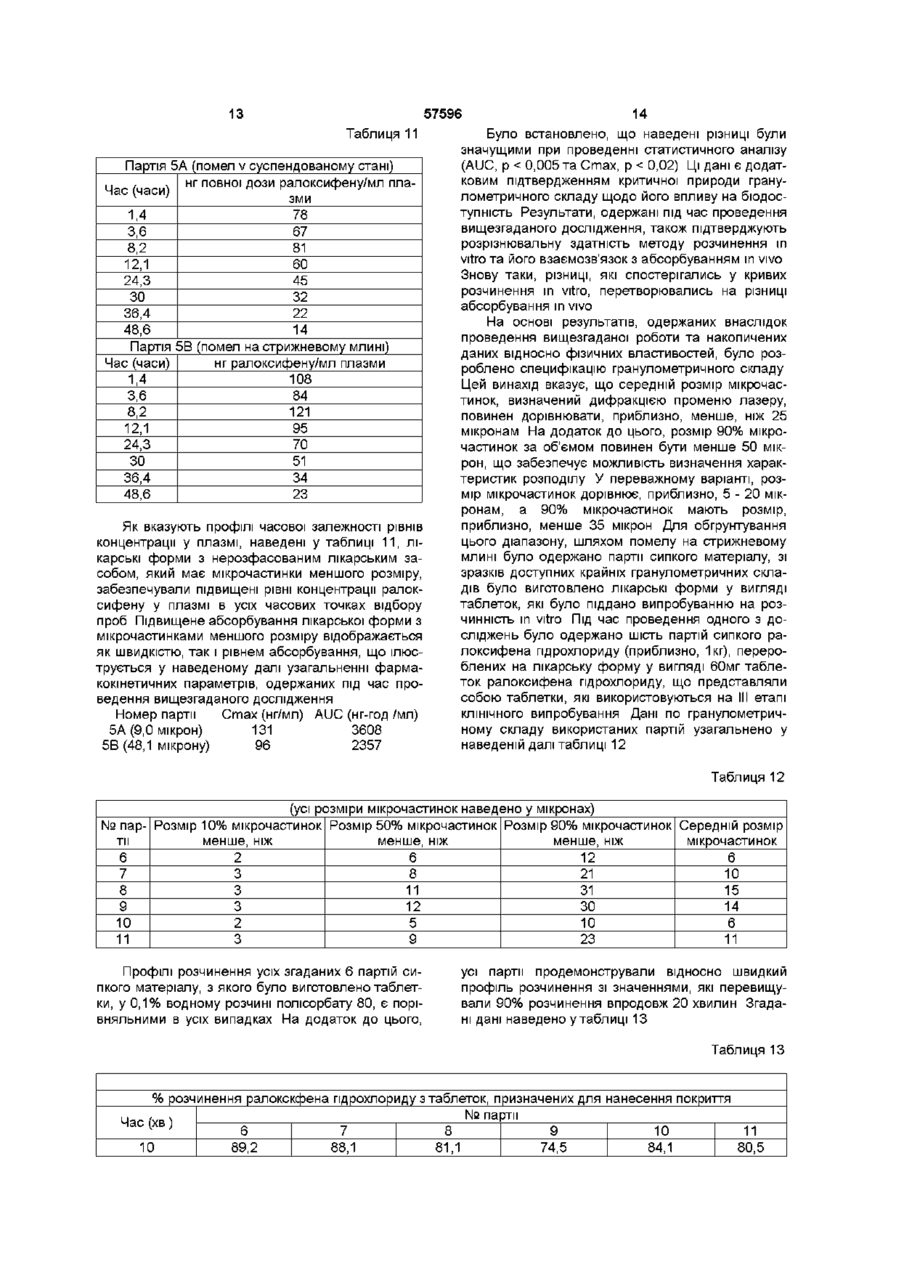
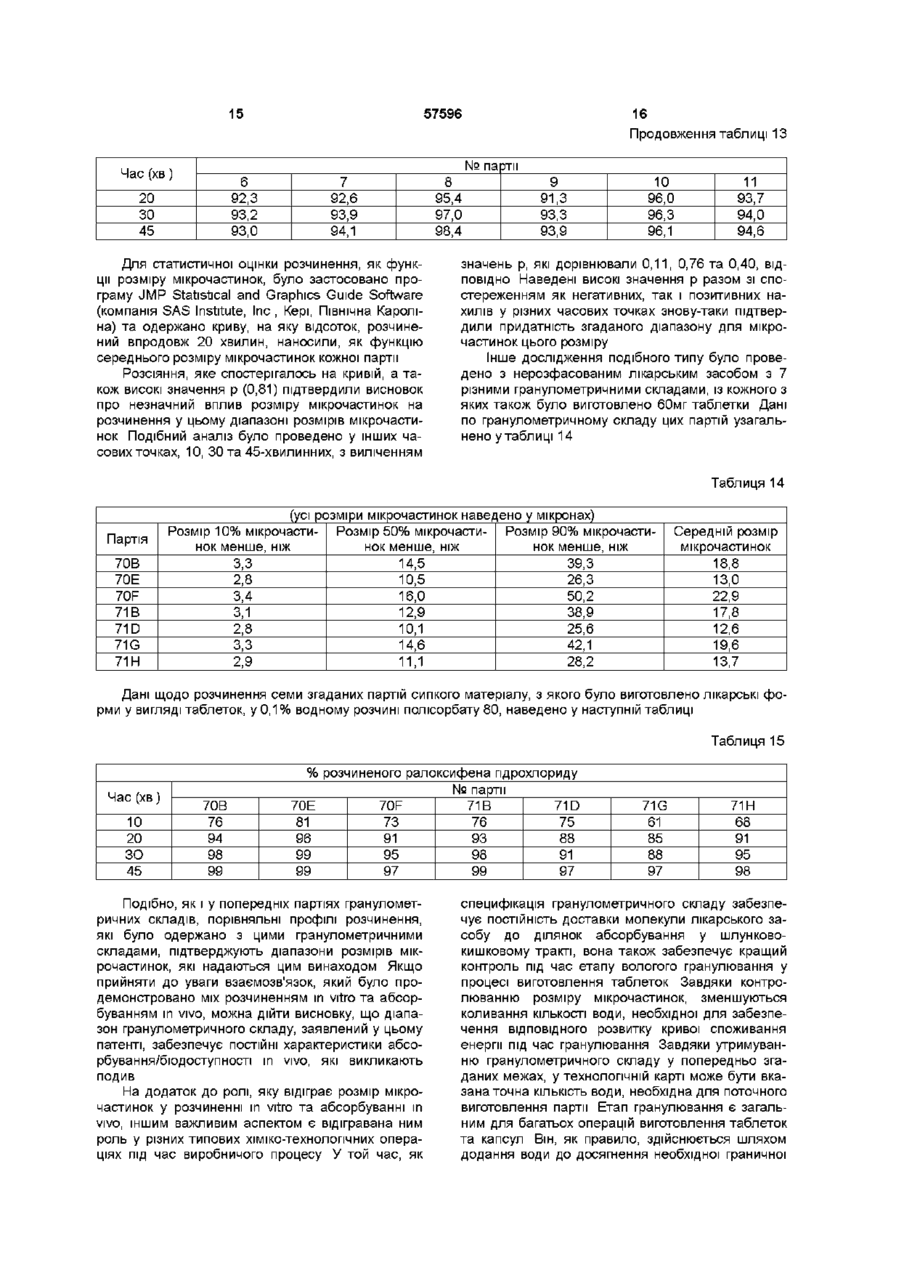
І Похідне бензотюфену формули І та його фармацевтично прийнятні солі та сольвати, яке в і д р і з н я є т ь с я тим, що знаходиться у подрібненій формі, причому середній розмір ВІДПОВІДНИХ частинок є меншим ніж 25 мікрон, і розмір щонайменше 90% ВІДПОВІДНИХ частинок є меншим ніж 50 мікрон 2 Сполука за п 1, де середній розмір ВІДПОВІДНИХ частинок становить від 5 до 20 мікрон 3 Сполука за п 1, де розмір щонайменше 90 % ВІДПОВІДНИХ частинок є меншим ніж 35 мікрон 4 Сполука за будь-яким з пп 1-3, де сполукою формули І є ралоксифену пдрохлорид 5 Сполука за п 4, яка являє собою несольватований кристалічний пдрохлорид, який має рентгенівську дифрактограмму, одержану за допомогою мідного джерела випромінювання, практично таку, як наведено нижче Міжплощинна відстань d І/Іо (Ангстреми) (хЮО) 13,3864 71,31 9,3598 33,16 8,4625 2,08 7,3888 7,57 6,9907 5,80 6,6346 51,04 6,1717 29,57 5,9975 5,67 5,9135 9,87 5,6467 38,47 5,4773 10,54 5,2994 4,74 4,8680 4,03 4,7910 5,98 4,6614 57,50 4,5052 5,75 4,3701 9,03 4,2516 69,99 4,2059 57,64 4,1740 65,07 4,0819 12,44 3,9673 22,53 3,9318 100,00 3,8775 9,07 3,7096 33,38 3,6561 21,65 3,5576 3,36 3,5037 7,97 3,4522 18,02 3,4138 4,65 3,2738 10,23 3,1857 8,90 3,1333 6,24 3,0831 9,43 3,0025 12,13 2,9437 4,96 2,8642 7,70 2,7904 11,95 2,7246 3,05 2,6652 3,32 2,5882 7,30 6 Фармацевтична лікарська форма, яка містить або до складу якої входять сполука за будь-яким з пп 1-5 та один або декілька фармацевтично при О (О ю ю О) 57596 йнятних носіїв, розріджувачів або наповнювачів включає введення ефективної КІЛЬКОСТІ сполуки формули І за будь-яким з пп 1-5 або фармацевти7 Фармацевтична композиція, яка містить або до чної лікарської форми або композиції за п 6 або 7 складу якої входять сполука за п 1 або її фармаособі, яка цього потребує цевтично прийнятна сіль або сольват, у поєднанні з одним або декількома фармацевтично прийнят10 Виріб, до складу якого входить пакувальний ними носіями, розріджувачами або наповнювачаматеріал, в якому уміщена фармацевтична лікарми ська форма, причому зазначений пакувальний матеріал додатково споряджений етикеткою, на 8 Спосіб лікування остеопорозу, який включає якій вказано, що зазначена фармацевтична лікарвведення ефективної КІЛЬКОСТІ сполуки формули І ська форма є придатною для пригнічення певного за будь-яким з пп 1-5 або фармацевтичної лікарпатологічного стану людини, причому згадана фаської форми або композиції за п 6 або 7 особі, яка рмацевтична лікарська форма містить або до її цього потребує складу входить сполука за будь-яким з пп 1-5 9 Спосіб зниження рівнів ЛІПІДІВ у сироватці, який Цей винахід має відношення до галузі фармацевтичної та органічної хімії і надає бензтюфенову сполуку, у подрібненій формі, придатну для лікуваннії різних медичних показань, у тому числі остеопорозу та зниження рівня ЛІПІДІВ Зокрема, бензтюфен має такий гранулометричний склад, який забезпечує підвищену бюдоступність та контроль під час процесу виготовлення Термін "остеопороз" описує групу хвороб, які мають різну етіологію, однак характеризуються чистою втратою маси кісткової тканини на одиницю об'єму Наслідком цієї втрати маси кісткової тканини та руйнування кістки є неспроможність скелету до забезпечення адекватної структурної підтримки тіла Одним з найбільш поширених типів остеопорозу є остеопороз, пов'язаний з менопаузою БІЛЬШІСТЬ ЖІНОК втрачає, приблизно, від 20% до 60% маси кісткової тканини у трабекулярній лакуні кістки впродовж 3 - 6 років після припинення місячних Ця швидка втрата пов'язана, взагалі, з прискоренням розсмоктування та формування кістки Цикл розсмоктування, однак, є домінуючим, наслідком чого є чиста втрата кісткової тканини Остеопороз є поширеною та серйозною хворобою постклімактеричних жінок Зараз ралоксифен знаходиться на III етапі КЛІНІЧНИХ випробувань, як медичний засіб для лікування остеопорозу Результати, які було одержано під час проведення цих випробувань, а також ІНШІ дані, вказують не тільки на потенційну придатність застосування ралоксифену, як засобу для лікування остеопорозу, але також на його потенційну придатність для зменшення рівнів ЛІПІДІВ низької густини (ЛІПІДІВ сироватки) (LDL), пригнічення ендометриту та фіброзу матки, та запобігання раку грудної залози Застосування ралоксифену дещо стримували його фізичні характеристики, які мають відношення як до його бюдоступності, так і до процесу виготовлення Наприклад, ралоксифен, взагалі, є нерозчинним і це може негативно впливати на його бюдоступність Цілком зрозуміло, що шляхом будь-якого поліпшення фізичних характеристик ралоксифену була б забезпечена його більш підвищена придатність до застосування, як лікарського засобу, а також поліпшена можливість одержання Цей винахід надає сполуку формули І (І) а також и фармацевтично прийнятні солі та сольвати, згадана сполука відрізняється тим, що знаходиться у подрібненій формі, причому середній розмір згаданих мікрочастинок дорівнює, приблизно, менше, ніж 25 мікронам, а у переважному варіанті він складає, приблизно, від 5 до 20 мікрон Цей винахід, додатково, охоплює сполуки формули І, розмір, як мінімум, 90% мікрочастинок яких дорівнює, приблизно, менше, ніж 50 мікронам, а у переважному варіанті він складає, приблизно, менше, ніж 35 мікрон Цей винахід, додатково, має відношення до фармацевтичних композицій, які вміщують або до складу яких включено одну або більше сполук формули І, до складу яких, факультативно, входить естроген або прогестин, та до застосування згаданих сполук, незалежно або у поєднанні з естрогеном або прогестином, для полегшення симптомів остеопорозу, зниження рівнів ЛІПІДІВ та пригнічення ендометриту, фіброзу матки та раку грудної залози На цей час встановлено, що завдяки обробці сполук формули І, яка забезпечує утворення мікрочастинок, розмір яких знаходиться у визначеному вузькому діапазоні, можна одержати фармацевтичні композиції, активний інгредієнт яких має постійну криву розчинення in vitro та постійний рівень бюдоступності in vivo На додаток до забезпечення згаданих необхідних характеристик розчинення/бюдоступності, наслідком зведення розміру мікрочастинок до вузького діапазону виявилось суттєве поліпшення виробничих можливостей Середній розмір мікрочастинок сполук формули І за цим винаходом складає, приблизно, менше, ніж 25 мікрон, а у переважному варіанті він дорівнює, приблизно, 5 - 20 мікронам Цей винахід, додатково, охоплює сполуки формули І, розмір, як мінімум, 90% мікрочастинок яких дорівнює, при близно, менше, ніж 50 мікронам, а у переважному варіанті він складає, приблизно, менше, ніж 35 мікрон У більш переважному варіанті, середній розмір мікрочастинок складає, приблизно, від 5 до 20 мікрон, причому, як мінімум, 90% мікрочастинок має розмір, який дорівнює, приблизно, менше, ніж 35 мікрон Фахівцям, знайомим зі способами подрібнення, слід розуміти, звичайно, що гранична межа, встановлена для 90 або більше ВІДСОТКІВ мікрочастинок, призначена для додаткового відрізнення подрібнених сполук за цим винаходом від сполук, які мають більш широкий гранулометричний склад завдяки значним коливанням розміру мікрочастинок, які спостерігаються у усіх речовин, подрібнених шляхом застосування способів подрібнення, наприклад, помелом, з використанням різноманітного доступного на цей час обладнання для молоття, наприклад молоткових, стрижневих або струменевих млинів Цей винахід, крім того, надає фармацевтичні композиції, які вміщують або до складу яких включено згадану подрібнену сполуку за цим винаходом та один або більшу КІЛЬКІСТЬ фармацевтично прийнятних наповнювачів або носив Термін "сольват" означає агрегат, до складу якого входить одна або більше молекул розчиненої речовини, наприклад, сполуки формули І, та молекула розчиннику Репрезентативні сольвати утворюються з метиленхлоридом, 1,2-дихлоретаном, хлороформом та 1,2,3-трихлорпропаном Хімічна назва ралоксифену - 6-пдрокси-2-(4пдроксифеніл)-3-[4-(2-піперидиноетокси)бензоіл]бензо[Ь]-тюфен Термін "ралоксифен" означає також його солі та сольвати, причому перевага надається хлористоводневій солі Сполуки за цим винаходом можуть бути одержані за допомогою встановлених способів, наприклад, таких, які докладно описано у патентах США №№ 4133814, 4418068 та 4380635 Переважною формою ралоксифена пдрохлориду для використання за цим винаходом є несольватована кристалічна форма, опис якої наведено у заявці на патент Великобританії №2293382 або заявці на патент Німеччини №19534744, яка має рентгенівські дифракційні характеристики, наведені у цьому описі Бюдоступність сполук, які мають погану розчинність, часто може поліпшуватись шляхом підвищення площини поверхні мікрочастинок, які входять до складу лікарських форм Площина поверхні мікрочастинок на одиницю об'єму, звичайно, підвищується при зменшенні їх розміру У цій галузі техніки добре ВІДОМІ різні способи помелу або подрібнення лікарської речовини, і кожний з цих способів знаходить широке застосування з метою зменшення розміру мікрочастинок та підвищення площини їх поверхні Зрозуміло, що найкращим способом поводження з будь-якою сполукою, яка має низькі показники розчинності, є її помел з одержанням частинок найменшого розміру, цей шлях, однак, не завжди є практичним або необхідним Економічна вартість процесу молоття складається не тільки з безпосередньої вартості самого процесу, але свій вклад до неї вносять і ІНШІ пов'язані фактори Наприклад, у випадку над 57596 мілкого матеріалу, виникають складнощі та необхідність у додаткових витратах під час заповнення капсул або виготовлення таблеток, оскільки згаданий матеріал не є плинним, а твердне на обладнанні для завершу вальної обробки Наслідком згаданих складнощів під час завершувальної обробки є неоднорідність кінцевого продукту, що є неприйнятним у випадку лікарського засобу На додаток до цього, під час процесу молоття утворюється фізичне тепло та речовина, яка піддається обробці, підпадає під дію тиску Наслідком подібних умов є хімічна деструкція, внаслідок чого застосування згаданих способів помелу, як правило, зводиться до мінімального рівня Таким чином, між властивостями, які забезпечують максимальну бюдоступність (площина поверхні мікрочастинок) та практичними межами виробничого процесу завжди існує динамічна рівновага Точка компромісу, яка позначає "найкраще рішення", є унікальною для кожної ситуації та унікальною відносно її визначення Способи визначення розміру мікрочастинок є відомими у цій галузі Далі наведено опис одного зі способів, який, однак, не має обмежувального значення Наприклад, може бути застосованим загальний спосіб, розкритий у патенті США №4605517 Під час одержання подрібненої сполуки за цим винаходом, тобто сполуки формули І, у и неочищеному стані, спочатку, за допомогою приладу, пристосованого для вимірювання еквівалентного сферичного діаметру, наприклад, лазерного розсіювального аналізатору розподілу частинок за розмірами Horiba LA900 або еквівалентного йому, визначають розміри частинок, з яких вона складається У типовому випадку, до складу репрезентативного зразку сполуки формули І у неочищеному стані входять мікрочастинки, які мають середній еквівалентний сферичний діаметр, який дорівнює, приблизно, 110 - 200 мікронам, та гранулометричний склад широкого діапазону Після визначення розміру мікрочастинок у неочищеному стані, неочищену сполуку піддають помелу, за допомогою, у переважному варіанті, стрижневого млину, за ВІДПОВІДНИМИ умовами швидкості обертання та швидкості подачі, для одержання значення розміру частинок, яке вкладається до вищенаведених меж ВІДПОВІДНО ДО ЦЬОГО винаходу Ефективність помелу визначають шляхом перевірки зразків за допомогою лазерного розсіювального аналізатору розподілу частинок за розмірами Horiba LA900, кінцевий розмір частинок перевіряють подібним же чином У разі, якщо після першого проходу через млин потрібний гранулометричний склад одержати не вдається, здійснюють один або більше додаткових проходів Після ЦЬОГО сполука формули І у подрібненому стані, склад якої відповідає вищенаведеним межам за цим винаходом, може змішуватись з наповнювачем або носієм, ВІДПОВІДНО до необхідності, та, наприклад, пресуватись до таблеток Таким чином, наприклад, подрібнена сполука може змішуватись з безводною лактозою, моногідратом лактози, кросповідоном та гранулюватись у водній дисперсії повідону та полісорбату 80 Після висушування та помелу до гранул, згаданий матеріал 57596 8 зразку диспергувальний розчин було виготовлено шляхом додання 20 крапель диспергатору Coulter 1А до насиченого водного розчину пдрохлориду ралоксифену Диспергувальний розчин фільтрували через мікропористий мембранний фільтр (0,2 мікрона) для одержання необхідного суспендувального диспергатора, вільного від мікрочастинок Через п'ять хвилин після виготовлення дисперсії здійснювали потрійне визначення розміру мікрочастинок Потрійні вимірювання здійснюють, як мінімальну перевірку для а) проведення більш достовірних вимірювань та Ь) перевірки відтворюваності еквівалентного відбору зразків суспендованого матеріалу, тобто, того, чи не випала суспензія до осаду Результати автоматично реєструвались і відтворювались графічно для надання характеристичної кривої залежності між відсотковим значенням частоти та розміром, нижчим за необхідний, та інтегральної характеристичної кривої залежності між відсотковим значенням частоти та розміром, нижчим за необхідний, для згаданого зразку На їх основі було виведено значення еквівалентного сферичного діаметру (значення, на 50% нижче за необхідне) та стандартне квадратичне відхилення розподілу, вираховане, як зазначалось перед тим Під час піддання згаданої сполуки процесу обробки було досліджено декілька фізичних властивостей ралоксифена пдрохлориду До них налеТаким чином, визначений еквівалентний сфежали розмір мікрочастинок, площина поверхні та ричний діаметр є статистичним відображенням об'ємна густина порошку теоретичної частинки, яка має такі ж самі властивості, що і "невідома" частинка Головним визначником потенційного впливу згаданих властивостей на характеристики лікарсьЯк згадувалось перед тим, середній еквівалекого засобу є розчинність лікарської речовини у нтний сферичний діаметр частинок помеленої воді Розчинність ралоксифена пдрохлориду у воді сполуки формули І може визначатись за допомоскладає, приблизно, 0,Змг/мл при 25°С і є значно гою лазерного розсіювального аналізатору розпонижчою у Штучному Шлунковому Соку, фармакоділу частинок за розмірами Horiba LA900 За допея США (0,002мг/мл) та Штучній Кишковій РІДИНІ, помогою такого приладу можна одержати значенфармакопея США (0,002мг/мл) при 37°С Значення ня для суспензії частинок невідомого розміру і згарозчинності у воді підпадають під класифікацію даний прилад може піддаватись ПОСТІЙНІЙ перевірфармакопеї США "дуже слабко розчинні", у той ці за допомогою контрольного зразку, який склачас, як ВІДПОВІДНО до нещодавно опублікованого дають частинки, розміри яких вкладаються у очікудовідника SUPAC ("Industry Guidance Immediate ваний діапазон, визначений на основі статистичноRelease Solid Oral Dosage Forms Pre- and Postго аналізу згаданого зразку Численними перевірApproval Changes Chemistry, Manufacturing and ками контрольного зразку було визначено стандаControls, In Vitro Dissolution Testing, and In Vivo ртне квадратичне відхилення вимірів, яке Bioequivalence Documentation", Prepared by the дорівнює 1,3 мікрону Immediate Release Scale-Up and Post Approval Далі, як приклад, наведено опис одержання Change (SUPAC), Expert Working Group of the композицій у ВІДПОВІДНОСТІ до цього винаходу В Chemistry Manufacturing Controls Coordinating усіх Прикладах сполуку було одержано з неочиCommittee (CMC CC) of the Center for Drug щеної форми за допомогою стрижневого млину, Evaluation and Research at the PDA) для твердих вона складалась з частинок, які мали середній пероральних дозованих лікарських форм негайноеквівалентний сферичний діаметр, приблизно, від го виділення, згадана сполука має низьку розчин5 до 20 мікрон, як мінімум, 90% частинок мали ність при дозорозчинному об'ємі, який перевищує розмір, який дорівнював, приблизно, менше, ніж 35 250мл Приймаючи до уваги низьку розчинність, мікронам швидкість, з якою дозована форма розчиняється у Розмір частинок відновленого пдрохлориду шлунково-кишковому тракті, може, потенційно, ралоксифену вимірювали наступним чином Аналівпливати на швидкість та рівень абсорбування зу гранулометричного складу шляхом розсіювання активної сполуки Двома пов'язаними фізичними лазерного променя піддавали невеликий зразок властивостями нерозфасованого лікарського завідновленого матеріалу, який було суспендовано, собу ("ангро"), які можуть змінювати швидкість приблизно, у 180мл диспергувального розчину розчинення дозованої форми, є розмір мікрочасЗразок додається до диспергатору доти, доки не тинок та площина поверхні Вплив площини повеодержується прийнятний рівень затуманення прорхні, яка є функцією розміру мікрочастинок, ілюстменю лазера, після чого здійснюють визначення рується наведеним далі рівнянням Ноєса-Уітні гранулометричного складу Перед суспендуванням може бути, на завершення, змішаним зі стеаратом магнію та впресованим до таблеток Оскільки мікрочастинки у неочищеному стані, а також після помелу або застосування інших способів зменшення їх розміру, мають неправильну форму, їхні характеристики необхідно визначати не шляхом вимірювання дійсного розміру, наприклад, товщини або довжини, а шляхом визначення властивостей теоретичних сферичних частинок, які обумовлюють властивості зразку Таким чином, згаданим мікрочастинкам надається "еквівалентний сферичний діаметр" Значення, віднайдені під час визначення характеристик великої КІЛЬКОСТІ "невідомих" частинок, можуть бути графічно відображеними у вигляді кривої залежності частоти від діаметру або, у разі застосування інших способів, у вигляді залежності маси від діаметру, як правило, з прийняттям відсоткових значень, нижчих за необхідну частоту або масу Це дозволяє одержати характеристичну криву, яка представляє гранулометричний склад згаданого зразку, тобто інтегральну криву розподілу відсоткових значень, нижчих за необхідні Значення з цієї кривої можуть бути зчитаними безпосередньо або нанесеними на логарифмічний папір для одержання відповідної прямої лінії Середній еквівалентний сферичний діаметр є на 50% нижчим за необхідний 57596 10 талізації та додаткової модифікації за допомогою різних технологій помелу було одержано партії матеріалу різного гранулометричного складу У У цьому рівнянні С - концентрація лікарського подальшій таблиці наведено ВІДПОВІДНІ дані для засобу у час t, D - коефіцієнт дифузії лікарського чотирьох партій сипкого матеріалу, одержаних засобу до згаданого середовища, h - товщина диподібним чином, які включають дані відносно розфузійного шару, Cs - насичувальна розчинність міру частинок, одержані за допомогою дифракції лікарського засобу дифузійному шарі та S - ефеклазерного променю, та дані відносно площини тивна площина поверхні мікрочастинок лікарського поверхні, одержані за допомогою адсорбції азоту засобу Для підтвердження ефекту розміру мікрота проаналізовані за допомогою рівняння BET (річастинок/площини поверхні ралоксифена пдровняння Брунауера-Еммета-Теллера) хлориду на розчинність in vitro, шляхом перекрис (Noyes-Whitney) dC / dt = (D / h) * (S) * (Cs - C) Таблиця 6 № партії сипкого матеріалу Технологія помелу Мікронний колоїдний млин Перекристалізація Шаровий млин Помел у суспендованому стані №1 №2 №3 №3 Площина поСередній розмір 2 верхні, м /г мікрочастинок (мкм) 6,09 3,9 2,28 8,4 2,10 23,3 0,45 Чотири згадані партії сипкого матеріалу були вручну засипані до капсул для забезпечення 60,0мг ралоксифена пдрохлориду та піддані випробуванню на розчинність у 0,1% водному розчині полісорбату 80 за допомогою Апарату II (фар 48,1 Розмір 90% мікрочастинок менший, ніж (мкм) 6,8 13,9 55,3 89 макопея США) зі швидкістю лопатей, яка дорівнювала 50 обертам/хвилину Дані збирали на 10, 20, ЗО та 45 хвилинах для одержання кривої розчинення Таблиця 7 Партія № 1 (помел на мікронному колоїдному млині) Час (хв) розчинення % розчинення 10 20 ЗО 45 51 68 78 88 10 20 ЗО 45 Партія № 3 (помел на шаровому млині) Час (хв) розчинення % розчинення 10 20 ЗО 45 Партія № 2 (контроль) Час (хв) розчинення % розчинення 41 60 68 74 Партія № 4 (помел у суспендованому стані) Час (хв) розчинення % розчинення 31 45 54 64 10 20 ЗО 45 Спостерігався ряд кривих розчинення внаслідок різного гранулометричного складу нерозфасованого лікарського засобу зі значеннями розчинності впродовж ЗО хвилин у діапазоні від 25% до, приблизно, 80% На пацюках лінії Fischer 344 було проведено дослідження, яке мало на меті спробу оцінки впливу вказаних різниць на абсорбування m vivo Під час проведення дослідження пацюкам впродовж семи днів з їжею вводили ті ж самі чотири партії сипкого ралоксифену (0,4% (мас)) Кількісну оцінку рівнів концентрації чотирьох партій 15 27 35 49 сипкого некон'югованого ралоксифену у плазмі здійснювали за допомогою високоефективної рідинної хроматографії Наведена далі таблиця демонструє чудові ЛІНІЙНІ кореляції, одержані між відсотком ралоксифена пдрохлориду, розчиненим впродовж 10- або 30-хвилинного випробування розчинності in vitro та значеннями середньої площини під кривою (AUC, нг-год /мл), одержаними на пацюках для кожної партії сипкого нерозфасованого лікарського засобу Таблиця 8 Партія №1 - помел на мікронному колоїдному млині №2 - у стані після перекристалізації №3 - помел на шаровому млині №4 - помел у суспендованому стані % розчинення впро- % розчинення впроAUC (нг-год /мл) довж 10 хвилин довж ЗО хвилин 50 78 10056 41 68 8037 31 55 5743 15 35 3329 Наведена кореляція in vitro та in vivo підтвер джує розрізнювальну здатність способу розчинен 12 11 57596 ня, а також підкреслює необхідність стратегії конттивна площина поверхні Цим міркуванням може ролювання або гранулометричного складу, або пояснюватись краща кореляція різниць розміру площини поверхні нерозфасованого лікарського мікрочастинок з різницями розчинення in vitro та засобу Додатковий аналіз наведених даних свідабсорбування in vivo, у порівнянні зі схожістю чить про те, що дані щодо розміру мікрочастинок площин поверхні двох партій Виходячи з цих рекраще корелюють з різницями, які було спостерезультатів, було прийняте рішення у подальшому жено у даних відносно розчинності та абсорбції m використовувати гранулометричний склад, як конvivo Пояснення цього може базуватись на рівнянні трольний параметр для забезпечення постійних Ноєса-Уітні, яке пов'язує розчинність з ефективхарактеристик лікарського засобу відносно видіною площиною поверхні Постулюється, що плолення лікарської складової щина поверхні, визначена шляхом адсорбування Для додаткового дослідження впливу розміру азоту ралоксифеном, змеленим різними способамікрочастинок ралоксифена гідрохлориду на харами, не прогнозує ефективної площини поверхні, ктеристики лікарського засобу, які визначались за доступної для розчинювального середовища Це результатами розчинення in vitro та абсорбування демонструється порівнянням парти, яку було одеin vivo, на мавпах роду Cynomolgus було запланоржано шляхом перекристалізації (партія №2) та ване проведення дослідження часової залежності парти, яку було одержано шляхом помелу на шарівнів концентрації одиночної дози у плазмі Під ровому млині (партія №3) У той час, як вони мачас дослідження порівнювали абсорбування двох ють дуже подібні значення площини поверхні, 2,28 партій сипкого ралоксифену, які мали середні розта 2,10м2/г, ВІДПОВІДНО, партія, яку було одержано міри мікрочастинок 48,1 та 9,0 мікрон Згадані паршляхом перекристалізації, має менший середній ти сипкого матеріалу були перетворені на гранурозмір мікрочастинок, який дорівнює 8,4 мікрону, у льовані матриці, які представляли собою гранупорівнянні з 23,3 мікрону у парти, яку було одерльований матеріал, який піддається пресуванню з жано шляхом помелу на шаровому млині Мікроодержанням таблеток, призначених для викорисфотографії, одержані за допомогою сканувального тання людиною На додаток до цього, партію сипелектронного мікроскопу, демонструють дуже некого матеріалу з середнім розміром мікрочастинок, рівні поверхні мікрочастинок, одержаних шляхом який дорівнював 9,0 мікронам, було одержано помелу на шаровому млині, з численними тріщишляхом помелу на стрижневому млині, що преднами та розколинами, які можуть підвищити плоставляє собою необхідний шлях промислового щину поверхні під час вимірювання шляхом адсопомелу У наведеній далі таблиці представлено рбування азоту, однак можуть не забезпечити узагальнені дані по розміру мікрочастинок двох площини поверхні, доступної для розчинювальнозгаданих партій сипкого матеріалу го середовища, наслідком чого є зменшена ефекТаблиця 9 № партії сипкого матеріалу/ № партії гранульованого матеріалу Технологія помелу Розмір 10% мік- Розмір 50% мік- Розмір 90% мік- Середній рочастинок ме- рочастинок ме- рочастинок ме- розмір мікнше, НІЖ МКМ нше, НІЖ МКМ нше, НІЖ МКМ рочастинок Партія 5А Помел у суспендованому стані 11,4 44,1 90 48,1 Партія 5В Помел на стрижневому МЛИНІ 3,2 8,6 15,1 9,0 З метою одержання кривих розчинення, гранульований матеріал вручну засипали до капсул для забезпечення еквіваленту 60мг ралоксифена гідрохлориду Далі наведено дані розчинення у 0,1% водному середовищі Твін за способом перемішування лопатями при частоті 50 обертів/хвилину Таблиця 10 Партія 5А (помел у суспендованому стані) Час (хвилини) % розчинення 10 33 20 55 ЗО 65 45 74 Партія 5В (помел на стрижневому млині) Час (хвилини) % розчинення 10 20 ЗО 45 63 91 95 97 Наведена різниця гранулометричного складу знову викликала суттєву різницю кривих розчинення у 0,1% водному розчинювальному середовищі полісорбату 80 Під час проведення вищезгаданого дослідження мавпам вводили кожну лікарську форму у ВІДПОВІДНОСТІ до перехресного протоколу дослідження з включенням повторного періоду для врахування міжсуб'єктної варіабельності У наведеній далі таблиці 11 представлено середні усереднені рівні концентрації у плазмі після введення мавпам повної 25мг/кг пероральної дози ралоксифену 13 57596 Таблиця 11 Партія 5А (помел v суспендованому стані) нг повної дози ралоксифену/мл плаЧас (часи) зми 1,4 78 3,6 67 8,2 81 12,1 60 24,3 45 ЗО 32 36,4 22 48,6 14 Партія 5В (помел на стрижневому млині) Час (часи) нг ралоксифену/мл плазми 1,4 108 3,6 84 8,2 121 12,1 95 24,3 70 ЗО 51 36,4 34 48,6 23 Як вказують профілі часової залежності рівнів концентрації у плазмі, наведені у таблиці 11, лікарські форми з нерозфасованим лікарським засобом, який має мікрочастинки меншого розміру, забезпечували підвищені рівні концентрації ралоксифену у плазмі в усіх часових точках відбору проб Підвищене абсорбування лікарської форми з мікрочастинками меншого розміру відображається як швидкістю, так і рівнем абсорбування, що ілюструється у наведеному далі узагальненні фармакокшетичних параметрів, одержаних під час проведення вищезгаданого дослідження Номер партії Стах (нг/мл) AUC (нг-год /мл) 5А (9,0 мікрон) 131 3608 5В (48,1 мікрону) 96 2357 14 Було встановлено, що наведені різниці були значущими при проведенні статистичного аналізу (AUC, р < 0,005 та Стах, р < 0,02) Ці дані є додатковим підтвердженням критичної природи гранулометричного складу щодо його впливу на бюдоступність Результати, одержані під час проведення вищезгаданого дослідження, також підтверджують розрізнювальну здатність методу розчинення m vitro та його взаємозв'язок з абсорбуванням in vivo Знову таки, різниці, які спостерігались у кривих розчинення in vitro, перетворювались на різниці абсорбування in vivo На основі результатів, одержаних внаслідок проведення вищезгаданої роботи та накопичених даних відносно фізичних властивостей, було розроблено специфікацію гранулометричного складу Цей винахід вказує, що середній розмір мікрочастинок, визначений дифракцією променю лазеру, повинен дорівнювати, приблизно, менше, ніж 25 мікронам На додаток до цього, розмір 90% мікрочастинок за об'ємом повинен бути менше 50 мікрон, що забезпечує можливість визначення характеристик розподілу У переважному варіанті, розмір мікрочастинок дорівнює, приблизно, 5 - 20 мікронам, а 90% мікрочастинок мають розмір, приблизно, менше 35 мікрон Для обгрунтування цього діапазону, шляхом помелу на стрижневому млині було одержано партії сипкого матеріалу, зі зразків доступних крайніх гранулометричних складів було виготовлено лікарські форми у вигляді таблеток, які було піддано випробуванню на розчинність in vitro Під час проведення одного з досліджень було одержано шість партій сипкого ралоксифена гідрохлориду (приблизно, 1кг), перероблених на лікарську форму у вигляді 60мг таблеток ралоксифена гідрохлориду, що представляли собою таблетки, які використовуються на III етапі КЛІНІЧНОГО випробування Дані по гранулометричному складу використаних партій узагальнено у наведеній далі таблиці 12 Таблиця 12 (усі розміри мікрочастинок наведено у мікронах) № пар- Розмір 10% мікрочастинок Розмір 50% мікрочастинок Розмір 90% мікрочастинок Середній розмір ти менше, ніж менше, ніж менше, ніж мікрочастинок 6 2 6 12 6 7 3 8 21 10 8 3 11 31 15 9 3 12 ЗО 14 10 2 5 10 6 11 3 9 23 11 Профілі розчинення усіх згаданих 6 партій сипкого матеріалу, з якого було виготовлено таблетки, у 0,1% водному розчині полісорбату 80, є порівняльними в усіх випадках На додаток до цього, усі партії продемонстрували відносно швидкий профіль розчинення зі значеннями, які перевищували 90% розчинення впродовж 20 хвилин Згадані дані наведено у таблиці 13 Таблиця 13 % розчинення ралокскфена гідрохлориду з таблеток, призначених для нанесення покриття № партії Час (хв ) 6 7 8 9 10 11 10 89,2 88,1 81,1 74,5 84,1 80 5 15 57596 16 Продовження таблиці 13 № партії Час (хв) 6 92,3 93,2 93,0 20 ЗО 45 7 92,6 93,9 94,1 Для статистичної оцінки розчинення, як функції розміру мікрочастинок, було застосовано програму JMP Statistical and Graphics Guide Software (компанія SAS Institute, Inc , Kepi, Північна Кароліна) та одержано криву, на яку відсоток, розчинений впродовж 20 хвилин, наносили, як функцію середнього розміру мікрочастинок кожної партії Розсіяння, яке спостерігалось на кривій, а також високі значення р (0,81) підтвердили висновок про незначний вплив розміру мікрочастинок на розчинення у цьому діапазоні розмірів мікрочастинок Подібний аналіз було проведено у інших часових точках, 10, ЗО та 45-хвилинних, з виліченням 8 95,4 97,0 98,4 9 91,3 93,3 93,9 10 96,0 96,3 96,1 11 93,7 94,0 94,6 значень р, які дорівнювали 0,11, 0,76 та 0,40, ВІДПОВІДНО Наведені високі значення р разом зі спостереженням як негативних, так і позитивних нахилів у різних часових точках знову-таки підтвердили придатність згаданого діапазону для мікрочастинок цього розміру Інше дослідження подібного типу було проведено з нерозфасованим лікарським засобом з 7 різними гранулометричними складами, із кожного з яких також було виготовлено 60мг таблетки Дані по гранулометричному складу цих партій узагальнено у таблиці 14 Таблиця 14 Партія 70В 70Е 70F 71В 71D 71G 71Н (усі розміри мікрочастинок наведено у мікронах) Розмір 10% мікрочасти- Розмір 50% мікрочасти- Розмір 90% мікрочастинок менше, ніж нок менше, ніж нок менше, ніж 3,3 14,5 39,3 2,8 10,5 26,3 3,4 16,0 50,2 3,1 12,9 38,9 2,8 10,1 25,6 3,3 14,6 42,1 2,9 11,1 28,2 Середній розмір мікрочастинок 18,8 13,0 22,9 17,8 12,6 19,6 13,7 Дані щодо розчинення семи згаданих партій сипкого матеріалу, з якого було виготовлено лікарські форми у вигляді таблеток, у 0,1% водному розчині полісорбату 80, наведено у наступній таблиці Таблиця 15 Час (хв) 10 20 ЗО 45 70В 76 94 98 99 % розчиненого ралоксифена гідрохлориду № партії 70Е 70F 71В 71D 81 73 76 75 96 91 93 88 99 95 98 91 99 97 99 97 Подібно, як і у попередніх партіях гранулометричних складів, порівняльні профілі розчинення, які було одержано з цими гранулометричними складами, підтверджують діапазони розмірів мікрочастинок, які надаються цим винаходом Якщо прийняти до уваги взаємозв'язок, який було продемонстровано міх розчиненням in vitro та абсорбуванням in vivo, можна дійти висновку, що діапазон гранулометричного складу, заявлений у цьому патенті, забезпечує ПОСТІЙНІ характеристики абсорбування/бюдоступності in vivo, які викликають подив На додаток до ролі, яку відіграє розмір мікрочастинок у розчиненні in vitro та абсорбуванні m vivo, іншим важливим аспектом є відігравана ним роль у різних типових хіміко-технолопчних операціях під час виробничого процесу У той час, як 71G 61 85 88 97 71Н 68 91 95 98 специфікація гранулометричного складу забезпечує ПОСТІЙНІСТЬ доставки молекули лікарського засобу до ділянок абсорбування у шлунковокишковому тракті, вона також забезпечує кращий контроль під час етапу вологого гранулювання у процесі виготовлення таблеток Завдяки контролюванню розміру мікрочастинок, зменшуються коливання КІЛЬКОСТІ води, необхідної для забезпечення ВІДПОВІДНОГО розвитку кривої споживання енергії під час гранулювання Завдяки утримуванню гранулометричного складу у попередньо згаданих межах, у технологічній карті може бути вказана точна КІЛЬКІСТЬ води, необхідна для поточного виготовлення партії Етап гранулювання є загальним для багатьох операцій виготовлення таблеток та капсул Він, як правило, здійснюється шляхом додання води до досягнення необхідної граничної 18 17 57596 сибензоат, метилбензоат, о-ацетокс и бензоат, наточки гранулювання Наступною типовою ХІМІКОфталш-2-бензоат, бромід, ізобутират, фенілбутитехнолопчною операцією, яка залежить від гранират, р-пдроксибутират, бутин-1,4-дюат, гексин-1,4чної точки гранулювання, є помел гранульованого дюат, капрат, каприлат, хлорид, цинамат, цитрат, матеріалу та кінцевий гранулометричний склад, форміат, фумарат, гліколят, гептаноат, ппурат, одержаний внаслідок гранулювання Було відкрилактат, малат, малеат, пдроксималеат, малонат, то, що розмір мікрочастинок активного інгредієнту, манделат, мезилат, нікотинат, ізонікотинат, нітрат, який надходить, також впливає на кінцевий грануоксалат, фталат, терефталат, фосфат, монопдролометричний склад сухих розмелених агломерагенфосфат, дипдрогенфосфат, метафосфат, пітів, які утворюються під час гранулювання За певрофосфат, пропюлат, пропюнат, фенілпропюнат, ної КІЛЬКОСТІ води, більш грубий гранулометричний саліцилат, себацат, сукцинат, суберат, сульфат, склад забезпечить більш мілкий гранулометричбісульфат, піросульфат, сульфіт, бісульфіт, сульний склад сухих розмелених агломератів Наслідфонат, бензолсульфонат, р-бромфенілсульфонат, ком надмілкого гранулометричного складу буде хлорбензолсульфонат, етансульфонат, 2поганий потік матеріалу під час гранулювання та пдроксиетансульфонат, метансульфонат, нафтапогіршений рівень контролювання маси окремих лш-1-сульфонат, нафталш-2-сульфонат, ртаблеток на етапі пресування Таким чином, попетолуолсульфонат, ксилол сул ьфонат, тартрат і т ш редньо згадані вузькі межі гранулометричного Переважною сіллю, звичайно, є хлористоводнева складу забезпечують більшу придатність процесу сіль до автоматизування завдяки зменшенню коливань КІЛЬКОСТІ води, необхідної на етапі гранулювання Фармацевтично прийнятні солі, одержані дота забезпеченню сухих розмелених гранул ВІДПОданням кислоти, у типовому випадку утворюються ВІДНОГО гранулометричного складу для запобігання шляхом реагування сполуки формули І з еквімовибраковуванню таблеток під час пресування вналярною або надлишковою КІЛЬКІСТЮ КИСЛОТИ слідок неприйнятної маси останніх Сполуки за цим винаходом можуть вводитись Цей винахід також надає способи використанрізними шляхами, у тому числі, перорально, рекня сполук формули І у процесах пригнічення До тально, черезшкірно, підшкірно, внутрішньовенно, прикладів такого використання належить пригнівнутрішньом'язово та штраназально Ці сполуки, у чення остеопорозу, лікування або попередження переважному варіанті, вводяться до складу лікарраку грудної залози, пригнічення фіброзу матки, ської форми перед и введенням Вибір лікарської пригнічення ендометриту та зниження рівня холеформи буде вирішуватись лікарем Таким чином, стерину у сироватці іншим аспектом цього винаходу є фармацевтична композиція, до складу якої входить ефективна КІТермін "ефективна КІЛЬКІСТЬ", ЯКИЙ використаЛЬКІСТЬ сполуки формули І або и фармацевтично но у цьому описі, означає КІЛЬКІСТЬ сполуки форприйнятної солі, до складу якої факультативно мули І, здатну полегшити симптоми різних патоловходить ефективна КІЛЬКІСТЬ естрогену або прогесгічних станів, які описано у цьому описі Конкретна тину, та фармацевтично прийнятний носій, розрідоза сполуки, введеної за цим винаходом, буде, джувач або наповнювач звичайно, визначатись певними обставинами справи, до яких належать, наприклад, сполука, яка Загальна КІЛЬКІСТЬ активних інгредієнтів у тавводиться, шлях введення, стан здоров'я пацієнту ких лікарських формах складає від 0,1% (мас) до та патологічний стан, який піддається лікуванню 99,9% (мас) Термін "фармацевтично прийнятний" Типова денна доза включає нетоксичну КІЛЬКІСТЬ означає, що носій, розріджувач, наповнювачі та сполуки за цим винаходом, яка складає, приблизсіль повинні бути сумісними з іншими інгредієнтано, від 10,0мг до ЮООмг/день До складу переважми згаданої лікарської форми і не причиняти шконих денних доз, взагалі, буде входити, приблизно, ди їх реципієнту від 50мг до 150мг/день Фармацевтичні лікарські форми за цим винаОкрім хлористоводневої солі, сполуки за цим ходом можуть готуватися за способами, знаними у винаходом утворюють фармацевтично прийнятні цій галузі з використанням добре відомих та легко солі, одержані доданням кислот та основ, з найрідоступних інгредієнтів Наприклад, сполуки форзноманітнішими органічними та неорганічними мули І з/без естрогену або прогестину, можуть кислотами та основами і до їх числа належать фівводитись до складу лікарських форм зі звичайнизіологічно прийнятні солі, які часто використовують ми наповнювачами, розріджувачами та носіями і у фармацевтичній хімії Такі солі також складають виготовлятись у формі таблеток, капсул, суспенчастину цього винаходу До типових неорганічних зій, порошків і т п До прикладів наповнювачів, кислот, які використовують для утворення таких розріджувачів та носив, придатних для подібних солей, належать, бромистоводнева, йодистоводлікарських форм, належать наведені далі заповнева, азотна, сірчана, фосфорна, ппофосфорна і нювачі та наповнювачі, наприклад, крохмаль, цукт ш Можна також використовувати солі, які є пори, манітта ПОХІДНІ кремнію, в'яжучі речовини, нахідними від органічних кислот, наприклад, аліфаприклад, карбоксиметилцелюлоза та ІНШІ ПОХІДНІ тичних моно- та дикарбоксильних кислот, фенілцелюлози, альгінати, желатина та полівшілпіролізаміщених алканових кислот, пдроксиалкановихта дон, зволожуючі речовини, наприклад, гліцерин, пдроксиалкандюнових кислот, ароматичних кисречовини, сприяючі розпаду, наприклад, карбонат лот, аліфатичних та ароматичних сульфонових кальцію, бікарбонат натрію та структурований покислот До таких фармацевтично прийнятних совідон (кросповідон), речовини для уповільнення лей, таким чином, належать ацетат, фенілацетат, розчинення, наприклад, парафін, прискорювачі трифторацетат, акрилат, аскорбат, бензоат, хлорвсмоктування, наприклад, четвертинні сполуки бензоат, динітробензоат, пдроксибензоат, метокамонію, поверхнево-активні речовини, наприклад, 20 10% розчину у воді) Натрійкарбоксиметильована целюлоза 4,5 Магнію стеарат 0,5 Тальк 1 Ралоксифен, крохмаль та целюлозу пропускають через сито №45 (0,353мм) і ретельно змішують Розчин полівшілпіролідону змішують з утвореними порошками, які після цього пропускають через сито №14 (1,41мм) Утворені таким чином гранули висушують при 50 - 60°С і пропускають через сито №18 (1,00мм) Натрійкарбоксиметильований крохмаль, стеарат магнію та тальк, попередньо пропущені через сито №60 (0,248мм), додають до гранул, які після перемішування пресують на таблетковій машині до утворення таблеток Суспензії, кожна з яких включає 0,1 - ЮООмг медикаменту на 5мл дозу, виготовляють таким чином Лікарська форма 4 Суспензії 19 57596 цетиловий спирт, полюорбат 80, гліцерину моностеарат, адсорбтивні носи, наприклад, каолін та бентоніт, та змащувальні речовини, наприклад, тальк, стеарат кальцію та магнію, а також тверді пол іетил ГЛІКОЛІ Лікарські форми з цими сполуками можна виготовляти у вигляді еліксирів або розчинів для традиційного перорального введення або у вигляді розчинів, придатних для парентерального введення, наприклад, внутрішньом'язовим, підшкірним або внутрішньовенним шляхами На додаток до цього, ці сполуки добре придатні для введення до складу лікарських форм уповільненого виділення і т ш Лікарські форми можуть утворюватись таким чином, щоб виділення активного інгредієнту відбувалося виключно або переважно у визначеній частині шлунково-кишкового тракту, можливо, впродовж визначеного періоду часу Покриття, оболонки та захисні матриці можна виготовляти, наприклад, з полімерних речовин або смол Сполуки формули І, самостійно або у поєднанні з іншою фармацевтичною речовиною, взагалі, будуть вводитись у традиційній лікарській формі Наведені далі приклади лікарських форм є тільки ілюстративними і не призначені для обмеження обсягу цього винаходу Лікарські форми У наведених далі лікарських формах розмір мікрочастинок ралоксифена пдрохлориду відповідає встановленому цим винаходом Лікарська форма 1 Желатинові капсули Тверді желатинові капсули виготовляють з використанням такого Інгредієнт КІЛЬКІСТЬ (мг/капсулу) 10,0 -1000 Ралоксифена пдрохлорид Крохмаль, державна фармакопея 0 - 650 Рухлива крохмальна пудра 0 - 650 Силіконова рідина, 350 сантистоксів 0-15 Специфічну наведену вище лікарську форму можна змінювати у ВІДПОВІДНОСТІ ДО розумних передбачених варіантів Лікарську форму у вигляді таблетки готують з використанням наведених нижче інгредієнтів Лікарська форма 2 Таблетки Інгредієнт КІЛЬКІСТЬ (мг^аблетку) 2,5 -1000 200 - 650 Ралоксифена пдрохлорид Целюлоза мікрокристалічна Кремнію дюксид, фумігований 10-650 Стеаринова кислота 5-15 Компоненти змішують і пресують до утворення таблеток У альтернативному варіанті, таблетки, до складу кожної з яких входить 2,5 - ЮООмг ралоксифену, виготовляють таким чином Лікарська форма 3 Таблетки Інгредієнт Ралоксифена пдрохлорид Крохмаль Целюлоза мікрокристалічна Полівшілпіролідон (у вигляді КІЛЬКІСТЬ (мг^аблетку) 25 -1000 45 35 4 Інгредієнт КІЛЬКІСТЬ (мг/5мл) Ралоксифена пдрохлорид 0,1 - ЮООмг Натрійкарбоксиметильована целюлоза 50мг Сироп 1,25мг Розчин бензойної кислоти 0,Юмл Коригент За потребою Барвник За потребою Дистильована вода до 5мл 5мл Медикамент пропускають через сито №45 і змішують з натрійкарбоксиметильованою целюлозою та сиропом до утворення гомогенної пасти Розчин бензойної кислоти, коригент та барвник розводять деякою КІЛЬКІСТЮ води і додають з перемішуванням Після ЦЬОГО додають воду у КІЛЬКОСТІ, достатній для отримання необхідного об'єму Виготовляють аерозольний розчин, до складу якого входять такі інгредієнти Лікарська форма 5 Аерозоль Інгредієнт КІЛЬКІСТЬ, % (мас) Ралоксифена пдрохлорид 0,25 Етанол 25,75 Пропелент 22 (хлордифторметан) 70,00 Ралоксифен змішують з етанолом і суміш додають до порції пропеленту 22, охолодженої до 30°С і перенесеної до пристрою для наповнення Після ЦЬОГО потрібна КІЛЬКІСТЬ переноситься до контейнеру з нержавіючої сталі і розводиться залишковою КІЛЬКІСТЮ пропепенту Після ЦЬОГО контейнер опоряджується клапанним пристроєм Супозиторії виготовляють таким чином Лікарська форма 6 Супозиторії Інгредієнт КІЛЬКІСТЬ (мг/супозиторій) Ралоксифена пдрохлорид 250 Гліцериди насичених жирних кислот 2000 Ралоксифен пропускають через сито №60 (0,248мм) і суспендують у гліцеридах насичених жирних кислот, попередньо розтоплених з застосуванням мінімального потрібного нагріву Після 21 Інгредієнт КІЛЬКІСТЬ Ралоксифена пдрохлорид 50мг Ізотонічний фізрозчин ЮООмл Розчин ралоксифена вводять пацієнту внутрішньовенно зі швидкістю, приблизно, 1мл/хвилину Лікарська форма 8 Комбінована капсула І Інгредієнт КІЛЬКІСТЬ (мг/капсулу) Ралоксифена пдрохлорид 50 Премарин 1 Avicel рН 101 50 Крохмаль 1500 117,50 Силіконове масло 2 Твін 80 0,50 Cab-0-Sil 0,25 Лікарська форма 9 Комбінована капсула II Інгредієнт КІЛЬКІСТЬ (мг/капсулу) Ралоксифена пдрохлорид 50 Норетилнодрел 5 Avicel рН 101 82,50 Крохмаль 1500 90 Силіконове масло 2 Твін 80 0,50 Лікарська форма 10 Комбінована таблетка Інгредієнт Ралоксифена пдрохлорид Премарин Кукурудзяний крохмаль, державна фармакопея Повідон, К29-32 AvicelpH 101 Avicel pH 102 КросповідонХМО Стеарат магнію Cab-0-Sil Лікарська форма 11 Інгредієнт Ралоксифена пдрохлорид Полівшілпіролідон Полісорбат80 Безводна лактоза КІЛЬКІСТЬ (мг/капсулу) 50 1 50 6 41,50 136,50 2,50 0,50 0,50 КІЛЬКІСТЬ (мг/капсулу) 60-150 15,75 5,25 264,62 Структурований ПОЛІВІНІЛПІ ролідон 31,5 Стеаринова кислота 5,25 Стеарат магнію 2,63 Суміш ралоксифена пдрохлориду, лактози та частини структурованою полІВІНІЛпіролідону гранулюють з водним розчином полівшілпіролідону та полісорбату 80 Гранули висушують, зменшують до прийнятного розміру та змішують зі стеариновою кислотою, стеаратом магнію і залишком структурованого полівшілпіролідону Суміш пресують у вигляді окремих таблеток Лікарська форма 12 Інгредієнт Ралоксифена пдрохлорид 22 Полівшілпіролідон 15,75 Полісорбат 80 5,75 Безводна лактоза 132,06 Декстроза 132,06 Структурований полівшілпіролідон 31,5 Стеаринова кислота 5,25 Стеарат магнію 2,63 Суміш ралоксифена пдрохлориду, безводної лактози, декстрози та частини структурованого полівшілпіролідону гранулюють зі спиртовим розчином полівшілпіролідону та полісорбату 80 Гранули висушують, зменшують до прийнятного розміру та змішують зі стеаратом магнію, стеариновою кислотою і залишком структуро ва ного ПОЛІВІнілпіролідону Суміш пресують у вигляді окремих таблеток Лікарська форма 13 57596 цього суміш виливають до супозиторної форми номінальною МІСТКІСТЮ 2Г І витримують до охолодження Внутрішньовенну лікарську форму виготовляють таким чином Лікарська форма 7 Внутрішньовенний розчин КІЛЬКІСТЬ (мг/капсулу) 60,150 Інгредієнт КІЛЬКІСТЬ (мг/капсулу) 60-150 16,00 10,00 154,00 Ралоксифена пдрохлорид Гідроксипропілцелюлоза Натрію лаурилсульфат Декстроза Структурована натрійкарбоксиметильована целюлоза 16,00 Стеарат магнію 4,00 Суміш ралоксифена пдрохлориду, декстрози та структурованої натрійкарбоксиметильованої целюлози гранулюють з водним розчином гідрокси пропіл целюлози та натрію л аури л сульфату Гранули висушують, зменшують до прийнятного розміру та змішують зі стеаратом магнію Суміш пресують у вигляді окремих таблеток Лікарська Форма 14 Інгредієнт КІЛЬКІСТЬ (мг/капсулу) 30,00 144,00 Ралоксифена пдрохлорид Безводна лактоза Водний розчин лактози, висушений розбризкуванням 36,00 Полівшілпіролідон 12,00 Полісорбат 80 2,40 Структурований полівшілпіролідон 14,40 Стеарат магнію 1,20 Суміш ралоксифена пдрохлориду, безводної лактози, водного розчину лактози, висушеного розбризкуванням, та частини структуро ва ного полівшілпіролідону гранулюють з водним розчином полівшілпіролідону та полісорбату 80 Гранули висушують, зменшують до прийнятного розміру та змішують зі стеаратом магнію і залишком структурованого полівшілпіролідону Суміш пресують у вигляді окремих таблеток масою 240мг Лікарська форма 15 Інгредієнт КІЛЬКІСТЬ (мг/капсулу) 30,00 160,00 11,00 7,00 Ралоксифена пдрохлорид Безводна лактоза Гідроксипропілцелюлоза Полоксамер Структурована натрійкарбоксиметильована целюлоза 23,00 Стеаринова кислота 2,00 Стеарат магнію 4,00 Суміш ралоксифена пдрохлориду, безводної 23 Інгредієнт КІЛЬКІСТЬ (мг/капсулу) 30,00 89,00 89,00 10,00 5,00 Ралоксифена пдрохлорид Лактоза Декстроза Гідроксипропілметилцелюлоза Натрію лаурилсульфат Структурований натрійполівінілпіролідон 12,00 Стеаринова кислота 5,00 Суміш ралоксифена пдрохлориду, лактози, декстрози та структурованого полівшілпіролідону гранулюють з водним розчином пдроксипропілметилцелюлози та натрію л аур ил сульфату Гранули висушують, зменшують до прийнятного розміру та змішують зі стеариновою кислотою Після ЦЬОГО суміш пресують у вигляді окремих таблеток масою 240мг Лікарська форма 17 Інгредієнт КІЛЬКІСТЬ (мг/капсулу) 60,00 156,00 7,20 7,20 Ралоксифена пдрохлорид Безводна лактоза Полівшілпіролідон Полісорбат80 Структурований натрійполівінілпіролідон 7,20 Стеарат магнію 2,40 Суміш ралоксифена пдрохлориду, безводної лактози та структуро ва ного полівшілпіролідону гранулюють з водним розчином полівшілпіролідону та полісорбату 80 Гранули висушують, зменшують до прийнятного розміру та змішують зі стеаратом магнію Суміш пресують у вигляді окремих таблеток масою 240мг Лікарська форма 18 Інгредієнт 24 57596 лаісгози та струїсгурованої натрійкарбоксиметильованої целюлози гранулюють з водним розчином полоксамеру та пдроксипропілцелюлози Гранули висушують, зменшують до прийнятного розміру та змішують зі стеариновою кислотою та стеаратом магнію Після цього суміш пресують у вигляді окремих таблеток масою 240мг Лікарська форма 16 КІЛЬКІСТЬ (мг/капсулу) 60,00 120,00 Ралоксифена пдрохлорид Безводна лактоза Водний розчин лактози, висушений розбризкуванням 30,00 Полівшілпіролідон 12,00 Полісорбат80 2,40 Структурований натрійполівінілпіролідон 14,40 Стеарат магнію 1,20 Суміш ралоксифена пдрохлориду, безводної лактози, водного розчину лактози, висушеного розбризкуванням, та частини структуро ва ного полівшілпіролідону гранулюють з водним розчином полівшілпіролідону та полісорбату 80 Гранули висушують, зменшують до прийнятного розміру та змішують зі стеаратом магнію і залишком структурованого полівшілпіролідону Суміш пресують у вигляді окремих таблеток масою 240мг Лікарська форма 19 Інгредієнт КІЛЬКІСТЬ (мг/капсулу) 60,00 77,00 73,00 7,00 4,00 Ралоксифена пдрохлорид Маніт Декстроза Гідроксипропілметилцелюлоза Полісорбат 80 Натрій(крохмаль)гліколят 14,00 Стеаринова кислота 4,00 Стеарат магнію 1,00 Суміш ралоксифена пдрохлориду, маніту, декстрози та натрій(крохмаль)гліколяту гранулюють з водним розчином полісорбату 80 та пдроксипропілметилцелюлози Гранули висушують, зменшують до прийнятного розміру та змішують зі стеариновою кислотою і стеаратом магнію Суміш пресують у вигляді окремих таблеток масою 240мг Лікарська форма 20 . КІЛЬКІСТЬ Інгредієнт (мг/капсулу) Ралоксифена пдрохлорид 150,00 Безводна лактоза 41,00 Водний розчин лактози, висушений розбризкуванням 10,25 Полівшілпіролідон 11,50 Полісорбат 80 2,30 Структурований натрійполівінілпіролідон 13,80 Стеарат магнію 1,15 Суміш ралоксифена пдрохлориду, безводної лактози, водного розчину лактози, висушеного розбризкуванням, та частини структуро ва ного полівшілпіролідону гранулюють з водним розчином полівшілпіролідону та полісорбату 80 Гранули висушують, зменшують до прийнятного розміру та змішують зі стеаратом магнію і залишком структурованого полівшілпіролідону Суміш пресують у вигляді окремих таблеток масою 230мг Лікарська форма 21 . Інгредієнт КІЛЬКІСТЬ . , . (мг/капсулу) 150,00 Ралоксифена пдрохлорид Водний розчин лактози, висушений розбризкуванням 56,00 Полівшілпіролідон 7,00 Полісорбат 80 1,20 Структурований натрійполівінілпіролідон 13,80 Стеарат магнію 2,00 Суміш ралоксифена пдрохлориду, водного розчину лактози, висушеного розбризкуванням, та частини структуро ва ного полівшілпіролідону гранулюють з водним розчином полівшілпіролідону та полісорбату 80 Гранули висушують, зменшують до прийнятного розміру та змішують зі стеаратом магнію і залишком структуро ва ного полівшілпіролідону Суміш пресують у вигляді окремих таблеток масою 230мг Лікарська форма 22 . Інгредієнт Ралоксифена пдрохлорид Безводна лактоза Полівшілпіролідон Полісорбат 80 Поліетиленгліколь 8000 КІЛЬКІСТЬ (мг/капсулу) 150,00 52,40 11,50 4,60 11,50 26 25 57596 Суміш ралоксифена пдрохлориду та безводСтруктурований полівшілпіроної лаісгози гранулюють з водним розчином полілідон 9,20 сорбату 80 та полівшілпіролідону Гранули висуГід роксипропіл метил целюлоза 6,90 шують, зменшують до прийнятного розміру та зміКолоїдний кремнію дюксид 1,00 шують з поліетиленгліколем 8000 Суміш пресують Суміш ралоксифена пдрохлориду, водного у вигляді окремих таблеток масою 230мг розчину лактози, висушеного розбризкуванням, та структуро ва ного полівшілпіролідону гранулюють з Капсули можуть виготовлятись з використанводним розчином натрію лаурилсульфату та пдроням інгредієнтів та процедур, опис яких наведено ксипропіл метил целюлози Гранули висушують, далі зменшують до прийнятного розміру та змішують з Лікарська форма 23 колоїдним дюксидом кремнію Після ЦЬОГО суміш КІЛЬКІСТЬ Інгредієнт засипають до твердих желатинових капсул розміру (мг/капсулу) З за допомогою традиційного обладнання для заРалоксифена пдрохлорид 30; ,00 повнення капсул, кожна капсула вміщує 230мг ціВодний розчин лактози, висульової суміші шений розбризкуванням 178. ,30 Натрію лаурилсульфат Лікарська форма 25 4,,60 Структурований полівшілпіроКІЛЬКІСТЬ Інгредієнт лідон 9.,20 (мг/капсулу) Гід роксипропіл метил целюлоза 6.,90 150,00 Ралоксифена пдрохлорид Колоїдний кремнію дюксид 1..00 Водний розчин лактози, висуСуміш ралоксифена пдрохлориду, водного шений розбризкуванням 58,30 розчину лактози, висушеного розбризкуванням, та Натрію лаурилсульфат 4,60 структурованого полівшілпіролідону гранулюють з Структурований полівінілпіроводним розчином натрію лаурилсульфату та пдролідон 9,20 ксипропіл метил целюлози Гранули висушують, Гід роксипропіл метил целюлоза 6,90 зменшують до прийнятного розміру та змішують з Колоїдний кремнію дюксид 1,00 колоїдним дюксидом кремнію Після ЦЬОГО суміш Суміш ралоксифена пдрохлориду, водного засипають до твердих желатинових капсул розміру розчину лактози, висушеного розбризкуванням, та З за допомогою традиційного обладнання для заструктуро ва ного полівшілпіролідону гранулюють з повнення капсул, кожна капсула вміщує 230мг ціводним розчином натрію лаурилсульфату та пдрольової суміші ксипропіл метил целюлози Гранули висушують, зменшують до прийнятного розміру та змішують з Лікарська форма 24 колоїдним дюксидом кремнію Після ЦЬОГО суміш КІЛЬКІСТЬ Інгредієнт засипають до твердих желатинових капсул розміру (мг/капсулу) З за допомогою традиційного обладнання для заРалоксифена пдрохлорид 60,00 повнення капсул, кожна капсула вміщує 230мг ціВодний розчин лактози, висульової суміші шений розбризкуванням 148,30 Натрію лаурилсульфат 4,60 Комп'ютерна верстка Е Гапоненко Підписано до друку 05 07 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzothiophene derivative, a pharmaceutical medicine, a pharmaceutical composition, a method for treatment of osteoporosis and a method for reducing lipides levels
Автори англійськоюLuke Wayne Douglas
Назва патенту російськоюПроизводное бензотиофена, фармацевтическая лекарственная форма, фармацевтическая композиция, способ лечения остеопороза и способ снижения уровней липидов
Автори російськоюЛЮК Уэйн Дуглас
МПК / Мітки
МПК: A61K 31/4535, C07D 333/56, A61P 15/00, A61P 3/06, A61K 31/4465, A61P 3/00, A61P 19/10, A61K 31/445, A61K 31/4523, A61P 19/00, A61K 31/00, A61P 35/00
Мітки: бензотіофену, форма, композиція, зниження, ліпідів, лікування, рівнів, остеопорозу, лікарська, спосіб, похідне, фармацевтична
Код посилання
<a href="https://ua.patents.su/13-57596-pokhidne-benzotiofenu-farmacevtichna-likarska-forma-farmacevtichna-kompoziciya-sposib-likuvannya-osteoporozu-ta-sposib-znizhennya-rivniv-lipidiv.html" target="_blank" rel="follow" title="База патентів України">Похідне бензотіофену, фармацевтична лікарська форма, фармацевтична композиція, спосіб лікування остеопорозу та спосіб зниження рівнів ліпідів</a>
Попередній патент: Спосіб опріснення води і установка для його здійснення
Наступний патент: Гідравлічний клапан
Випадковий патент: Спосіб вакуумної перегонки нафтового продукту