Композиція солей амфетаміну уповільненого вивільнення
Формула / Реферат
1. Фармацевтична композиція, яка містить суміш декстра- та левоамфетаміну та/або його солей, та оболонку або матрикс відстроченого вивільнення, що містить полівінілацетат, ацетат целюлози, ацетат бутират целюлози, ацетат пропіонат целюлози, етилцелюлозу, жирну кислоту, естер жирної кислоти, алкіл алкоголь, віск, зеїн (проалмін з пшениці), полі(мет)акрилат, мікрокристалічну целюлозу або полі(етиленоксид), у кількості, що є ефективною для того, щоб досягти відстроченого вивільнення вказаного амфетаміну та/або його солей, що забезпечує середнє значення профілю концентрації у плазмі пацієнтів, що страждають на ADHD, який має по суті таку саму початкову крутизну, як і декстраамфетаміновий профіль та/або левоамфетаміновий профіль, забезпечений 20 мг ADDERAL® XR від 2 до 4 годин після введення, для загальної дози 20 мг, або відповідну початкову крутизну (-ни) від 2 год до 4 год, після введення прямо пропорційного до вказаного профілю (-лів), для загальної дози, відмінної від 20 мг.
2. Фармацевтична композиція за п. 1, яка містить суміш сульфату декстраамфетаміну, сахарату декстраамфетаміну, аспартату амфетаміну та сульфату амфетаміну.
3. Фармацевтична композиція за п. 2, яка містить еквівалентні кількості за вагою сульфату декстраамфетаміну, сахарату декстраамфетаміну, аспартату амфетаміну та сульфату амфетаміну.
4. Фармацевтична композиція за п. 1, де вказані амфетаміни та/або сіль(-лі) забезпечуються у ядрі, яке покрите оболонкою, що містить фармацевтично прийнятний нерозчинний у воді плівкоутворювач, що забезпечує відстрочене вивільнення або інший полімер, який забезпечує відстрочене вивільнення.
5. Фармацевтична композиція за п. 4, в якій покриття додатково містить агент, який регулює розчинення.
6. Фармацевтична композиція за п. 1, в якій середнє значення профілю концентрації у плазмі пацієнтів, що страждають на ADHD, має по суті такий самий декстраамфетаміновий профіль та/або левоамфетаміновий профіль, забезпечений 20 мг ADDERAL® XR, після того, як мине приблизно 12 годин після введення, для загальної дози 20 мг, або для того, щоб забезпечити прямо пропорційний до вказаного профілю (-лів), для загальної дози, відмінної від 20 мг.
7. Фармацевтична композиція за п. 1, в якій середнє значення профілю концентрації у плазмі у пацієнтів, що страждають на ADHD, що має початкову крутизну від 2 до 4 годин після введення від приблизно 3,7 до приблизно 11,4 нг/(мл год) для декстраамфетамінів та/або від приблизно 1,4 до приблизно 3 нг/(мл год) для левоамфетамінів, усі при загальній дозі амфетаміну 20 мг, або початкову крутизну від 2 годин до 4 годин після введення, яка є прямо пропорційною до вказаної для загальної дози, відмінної від 20 мг.
8. Фармацевтична композиція за п. 1, в якій середнє значення профілю концентрації у плазмі у пацієнтів, що страждають на ADHD, що має початкову крутизну від 2 до 4 годин після введення від приблизно 4 до приблизно 8 нг/(мл год) для декстраамфетамінів та від приблизно 1,5 до приблизно 2,2 нг/(мл год) для левоамфетамінів, усі при загальній дозі амфетаміну 20 мг, або початкову крутизну від 2 годин до 4 годин після введення, яка є прямо пропорційною вказаній для загальної дози, відмінної від 20 мг.
9. Фармацевтична композиція за п. 1, де середнє значення профілю концентрації у плазмі у пацієнтів, що страждають на ADHD, яке має значення AUC 556,6 нг год./мл ± 20 % та Сmах 28,0 нг/мл ± 20 % для d-амфетаміну та AUC 205,1 нг год./мл ± 20 % та Сmах 8,7 нг/мл ± 20 % для l-амфетаміну при загальній дозі амфетаміну 20 мг, або відповідно, значення AUC та Сmах прямо пропорційні вказаним для загальної дози амфетаміну, відмінної від 20 мг.
10. Фармацевтична композиція за п. 1, де вивільнення розкладання є приблизно першочерговим відстроченим вивільненням розкладання вказаних амфетамінів і/або солі(-ей), яке має значення AUC 556,6 нг год./мл ± 20% та Сmах 28,0 нг/мл ± 20 % для d-амфетаміну та AUC 205,1 нг год./мл ± 20% та Сmах 8,7 нг/мл ± 20 % для l-амфетаміну при загальній дозі амфетаміну, відмінної від 20 мг, або відповідно, значення AUС та Сmах прямо пропорційні для загальної дози амфетаміну, відмінної від 20 мг.
11. Фармацевтична композиція за будь-яким з попередніх пунктів, що містить матрикс відстроченого вивільнення.
12. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій зазначена форма містить вказані амфетаміни та/або їх сіль(-лі), ядро та оболонку, що є покритим покриттям відстроченого вивільнення.
13. Фармацевтична композиція за будь-яким з попередніх пунктів, де профіль вивільнення розкладання вказаних амфетамінів та/або його солі(-ей) є першочерговим.
14. Фармацевтична композиція за будь-яким з попередніх пунктів, де вказане покриття відстроченого вивільнення або матрикс містить полівінілацетат, ацетат целюлози, ацетат бутират целюлози, ацетат пропіонат целюлози, етилцелюлозу, мікрокристалічну целюлозу або поліетиленоксид.
15. Фармацевтична композиція за п. 14, де вказаний матрикс відстроченого вивільнення або покриття включає етилцелюлозу.
16. Застосування фармацевтичної композиції за п. 15, для виробництва медикаменту для лікування синдрому дефіциту уваги та гіперактивності.
Текст
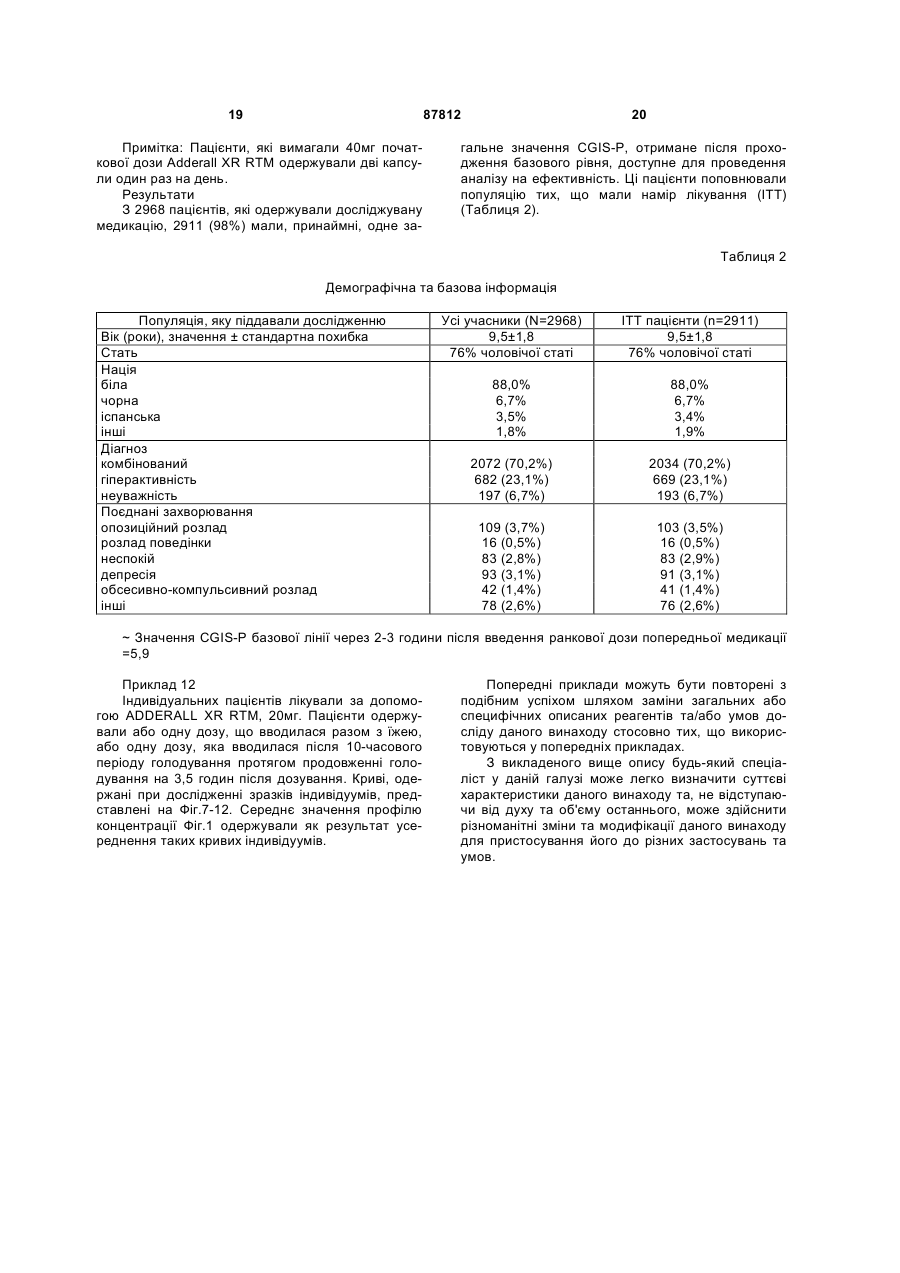
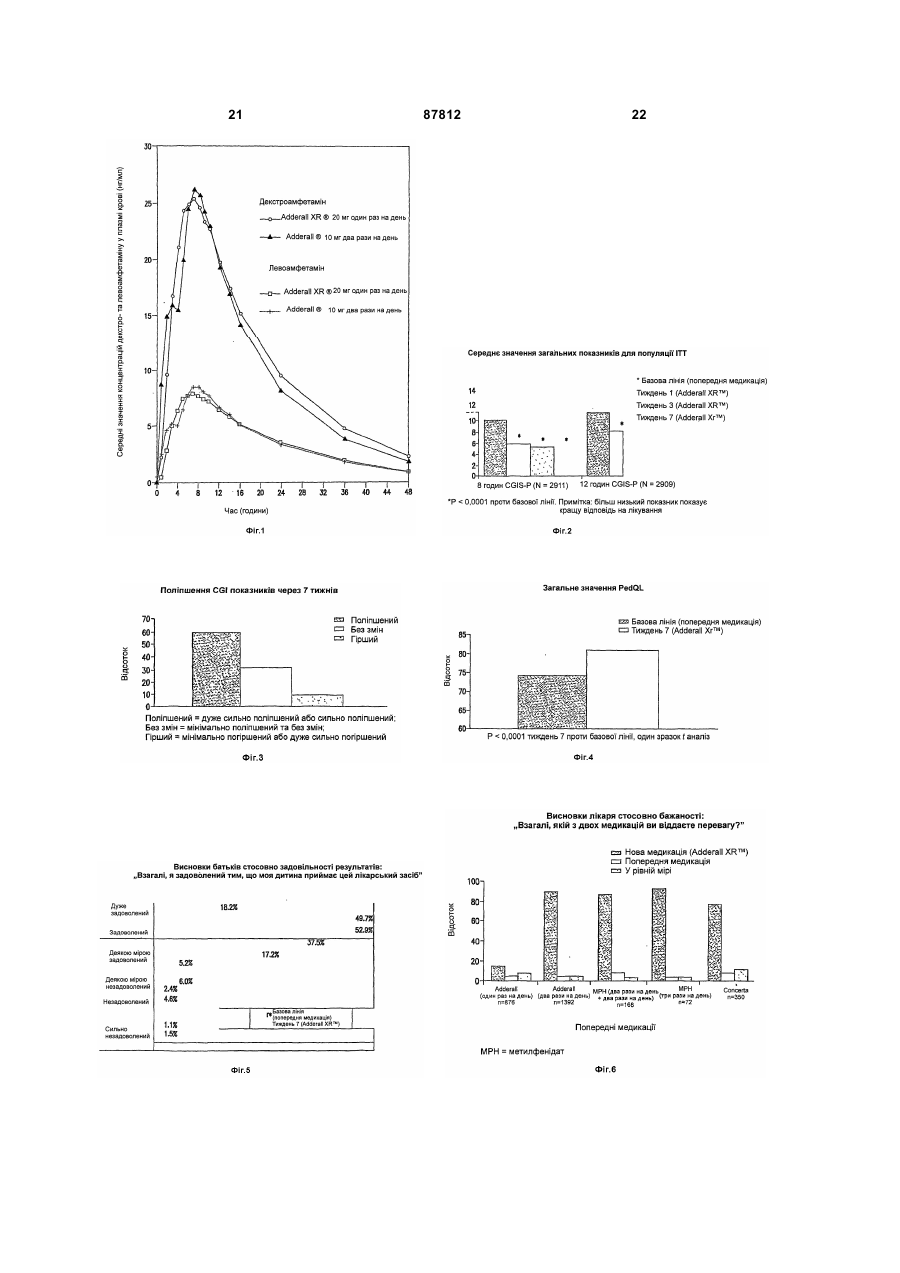
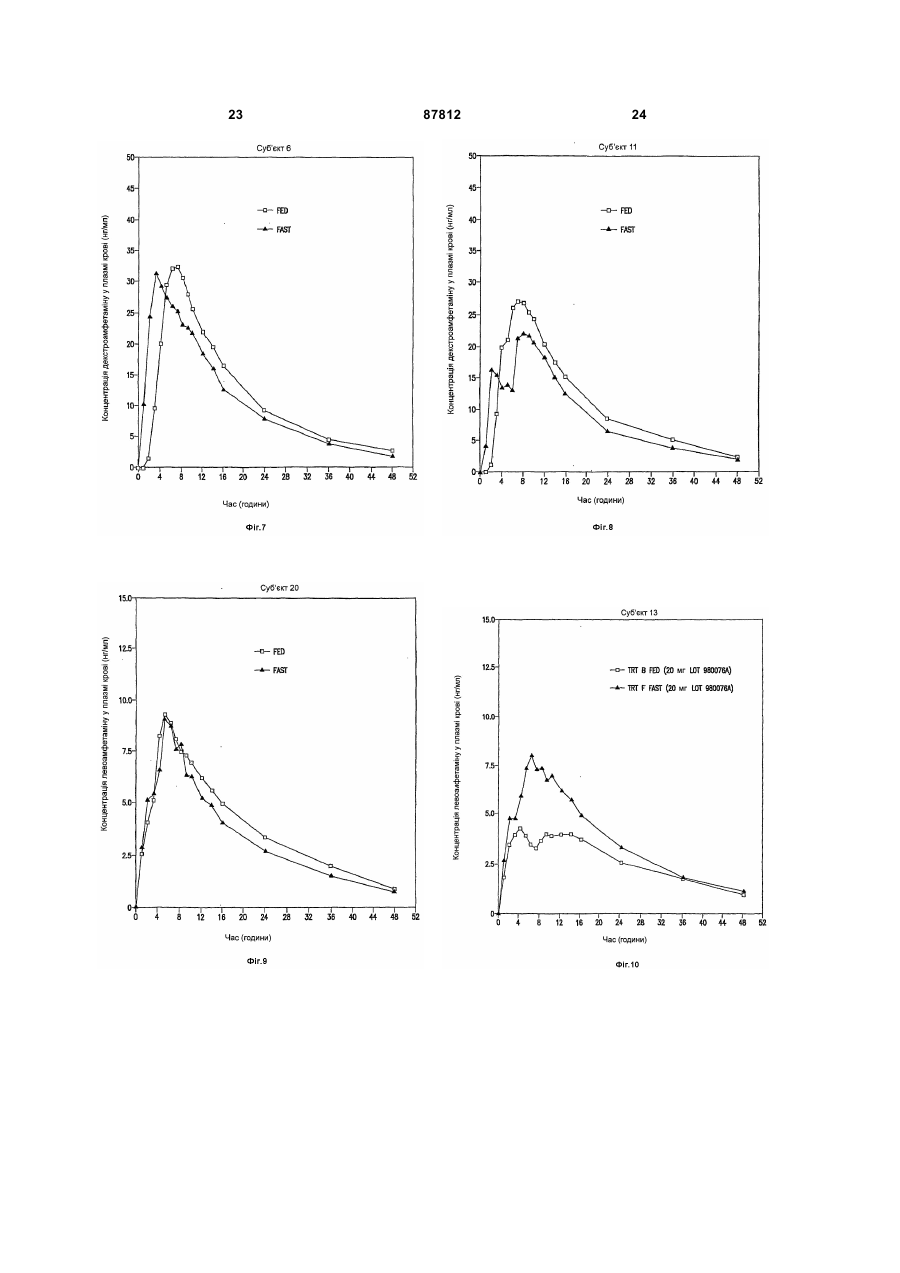
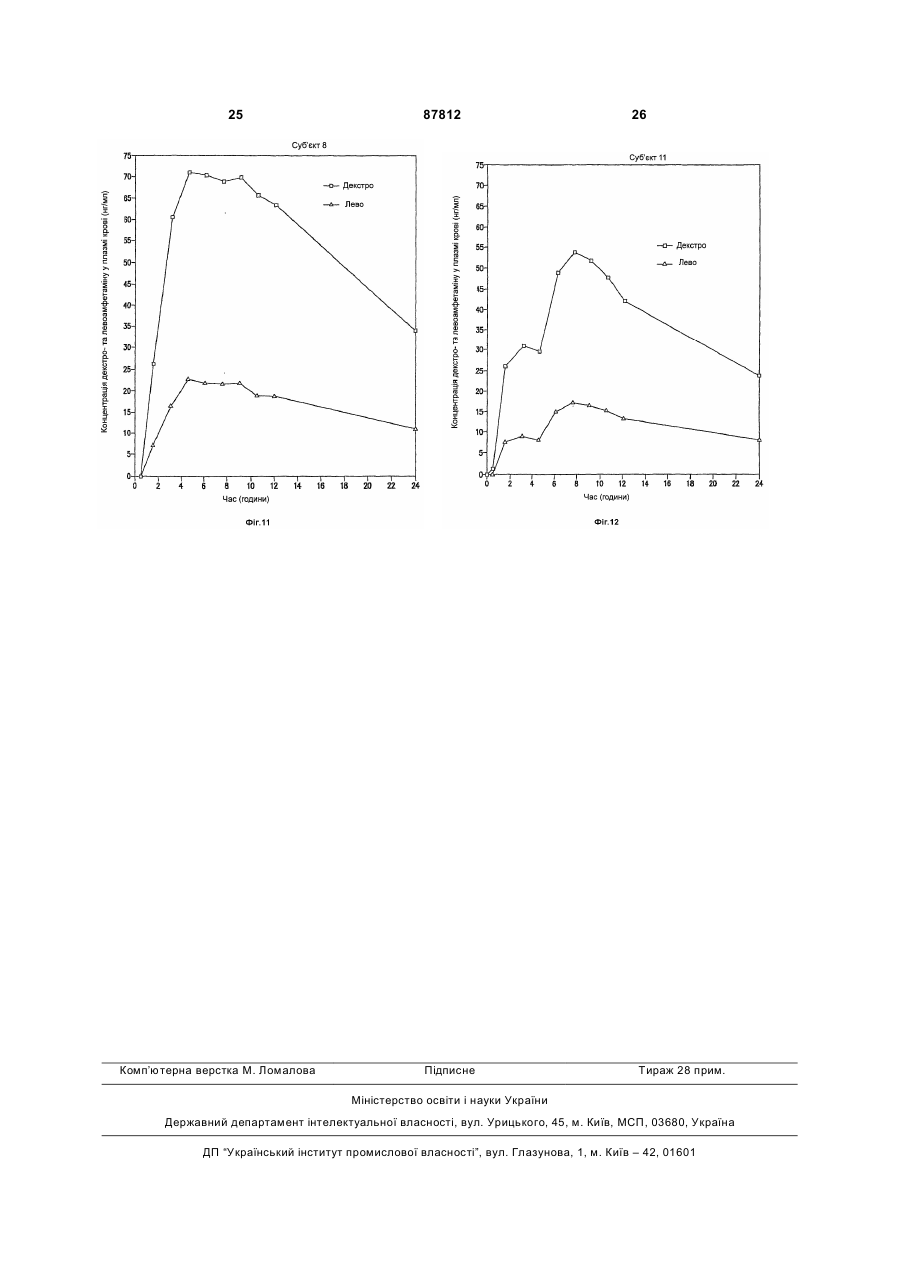
1. Фармацевтична композиція, яка містить суміш декстра- та левоамфетаміну та/або його солей, та оболонку або матрикс відстроченого вивільнення, що містить полівінілацетат, ацетат целюлози, ацетат бутират целюлози, ацетат пропіонат целюлози, етилцелюлозу, жирну кислоту, естер жирної кислоти, алкіл алкоголь, віск, зеїн (проалмін з пшениці), полі(мет)акрилат, мікрокристалічну целюлозу або полі(етиленоксид), у кількості, що є ефективною для того, щоб досягти відстроченого вивільнення вказаного амфетаміну та/або його солей, що забезпечує середнє значення профілю концентрації у плазмі пацієнтів, що страждають на ADHD, який має по суті таку саму початкову крутизну, як і декстраамфетаміновий профіль та/або левоамфетаміновий профіль, забезпечений 20 мг ADDERAL® XR від 2 до 4 годин після введення, для загальної дози 20 мг, або відповідну початкову крутизну (-ни) від 2 год до 4 год, після введення прямо пропорційного до вказаного профілю (-лів), для загальної дози, відмінної від 20 мг. 2. Фармацевтична композиція за п. 1, яка містить суміш сульфату декстраамфетаміну, сахарату декстраамфетаміну, аспартату амфетаміну та сульфату амфетаміну. 2 (19) 1 3 87812 4 пропорційною вказаній для загальної дози, відмінної від 20 мг. 9. Фармацевтична композиція за п. 1, де середнє значення профілю концентрації у плазмі у пацієнтів, що страждають на ADHD, яке має значення AUC 556,6 нг год./мл ± 20 % та Сmах 28,0 нг/мл ± 20 % для d-амфетаміну та AUC 205,1 нг год./мл ± 20 % та Сmах 8,7 нг/мл ± 20 % для l-амфетаміну при загальній дозі амфетаміну 20 мг, або відповідно, значення AUC та Сmах прямо пропорційні вказаним для загальної дози амфетаміну, відмінної від 20 мг. 10. Фармацевтична композиція за п. 1, де вивільнення розкладання є приблизно першочерговим відстроченим вивільненням розкладання вказаних амфетамінів і/або солі(-ей), яке має значення AUC 556,6 нг год./мл ± 20% та Сmах 28,0 нг/мл ± 20 % для d-амфетаміну та AUC 205,1 нг год./мл ± 20% та Сmах 8,7 нг/мл ± 20 % для l-амфетаміну при загальній дозі амфетаміну, відмінної від 20 мг, або відповідно, значення AUС та Сmах прямо пропорційні для загальної дози амфетаміну, відмінної від 20 мг. 11. Фармацевтична композиція за будь-яким з попередніх пунктів, що містить матрикс відстроченого вивільнення. 12. Фармацевтична композиція за будь-яким з попередніх пунктів, в якій зазначена форма містить вказані амфетаміни та/або їх сіль(-лі), ядро та оболонку, що є покритим покриттям відстроченого вивільнення. 13. Фармацевтична композиція за будь-яким з попередніх пунктів, де профіль вивільнення розкладання вказаних амфетамінів та/або його солі(-ей) є першочерговим. 14. Фармацевтична композиція за будь-яким з попередніх пунктів, де вказане покриття відстроченого вивільнення або матрикс містить полівінілацетат, ацетат целюлози, ацетат бутират целюлози, ацетат пропіонат целюлози, етилцелюлозу, мікрокристалічну целюлозу або поліетиленоксид. 15. Фармацевтична композиція за п. 14, де вказаний матрикс відстроченого вивільнення або покриття включає етилцелюлозу. 16. Застосування фармацевтичної композиції за п. 15, для виробництва медикаменту для лікування синдрому дефіциту уваги та гіперактивності. В даній заявці описані композиції для забезпечення форми уповільненого вивільнення (SR), що вводиться орально, одного або більше амфетамінів та/або солей амфетаміну. Також описані способи введення форми уповільненого вивільнення однієї або більше солей амфетаміну пацієнтові, який цього потребує. Переважно ці способи здійснюють для лікування пацієнтів, що страждають на ADHD (синдром дефіцита уваги та гіперактивності), але інші хворобливі стани також можуть піддаватися лікуванню. Форми уповільненого вивільнення одного або більше амфетамінів та/або солей амфетаміну згідно з винаходом переважно рецептують для забезпечення in vivo профілю концентрації у плазмі (тобто, вимірюється загальною концентрацією амфетамінів та/або солей амфетаміну (часто з окремим розрізненням d-та 1ізомерів) у плазмі крові пацієнтів), який є по суті еквівалентним in vivo профілю концентрації у плазмі, що досягається за допомогою композицій "пульсуючого" вивільнення таких самих амфетамінів та/або солей амфетаміну при введенні пацієнтові, наприклад, таких, що досягаються за допомогою ADDERALL XR RTM Shire US Inc., FDA вкладиш в упаковку якого та його маркірування введені у своїй цілісності у дану заявку. Також бажаним є, щоб цей профіль уповільненого вивільнення (профіль концентрації у плазмі відрізняється від профілю вивільнення) типово демонстрував характеристики першого порядку, біфазні або сигмоїдальні характеристики. Особливо бажано, коли композиції SR згідно з винаходом демонструють in vivo профіль концентрації у плазмі для однієї дози суттєво такий самий, як той, що представлений на Фіг.1. Останній демонструє гладкі (приблизно понад 20 пацієнтів) криві концентрації у плазмі, досягнуті для обох солей декстроамфетаміну та левоамфетаміну в ADDERALL XR RTM. (Загальна крива середнього значення концентрації у плазмі для загального рівня амфетаміну представляє собою просту суму двох кривих, представлених на Фіг.1). Оскільки композиції за даним винаходом досягають по суті таких самих кривих середнього значення концентрації у плазмі, вони можуть називатися композиціями швидкого уповільненого вивільнення стосовно початкової крутизни підйому, що спостерігається. Під терміном "по суті такий самий профіль" у даній заявці розуміють, що дві криві мають по суті однакове значення AUC (площа під кривою) та Сmах, тобто ці параметри для кожної кривої на ±20% відрізняються один від одного, або навіть менше, наприклад, ±10%, ±5%, ±2%, тощо, при цьому ці параметри традиційно визначені та розраховані. Див., наприклад, Fundamentals of Clinical Pharmacokinetics, J.G.Wagner, Drug Intelligence Publications, Inc., Hamilton, Illinois, 1975; Guidance for Industry, Bioavailability and Bioequivalence Studies for Orally Administered Drug ProductsGeneral Considerations, FDA, CDER, October 2000. Для Фіг.1 AUC (початок відліку часу до безкінечності) складає 556,6нг год./мл та Сmax складає 28,0нг/мл для d-амфетаміну та 205,1нг год./мл та 8,7мг/мл, відповідно, для 1-амфетаміну. Звичайно плазмові криві, які досягаються за допомогою цього винаходу, можуть навіть ще в більшій мірі співпадати з цільовими кривими, так, як це показано на Фіг.1, наприклад, по суті (наприклад, ±20%) відповідати початковій крутизні підйому, формі кривої після досягнення точки максимуму, Тmах значенням, (7,1год. для d-амфетаміну та 7,4 год. для 1амфетаміну для Фіг.1), тощо. Незважаючи на те, 5 що Фіг.1 показує значення для таблеток 20мг (тобто, дві пульсуючі дози по 10мг), плазмові криві (та, наприклад, AUC та Сmах), які відповідають іншим добовим дозам, таким, як 10, 30, 40, 50, 60, 70, 80, 90мг, будуть по суті лінійно пропорційними таким, що показані на Фіг.1 та які відповідають використовуваній дозі. В іншому незалежному втіленні композиції швидкого уповільненого вивільнення (SR) за даним винаходом для 20мг дози ADDERALL XR RTM Фіг.1 демонструють криві концентрації у плазмі, що мають початкову (наприклад, через 2 години після введення до 4 годин після введення) крутизну від приблизно 3,7 до приблизно 11,4нг/(мл год.) для декстроамфетамінів та приблизно від приблизно 1,4 до приблизно 3нг/(мл год.) для левоамфетамінів, переважно від приблизно 4 до приблизно 8нг/(мл год.) та від приблизно 1,5 до приблизно 2,2нг/(мл год.), відповідно. Точна крутизна для даного пацієнта буде варіювати в залежності від звичайних факторів, включаючи той, чи вживав пацієнт їжу, чи ні. Для інших доз, наприклад, тих, що згадані вище, крутизна варіює безпосередньо (лінійно) пропорційно в залежності від дози. Композиції згідно з WO 00/23055 (розкриття яких введено в дану заявку як посилання), наприклад, для ADDERALL XR RTM, дають можливість досягти подвійного вивільнення активних солей амфетаміну, одного для дозованої форми негайного вивільнення, а іншого - для дозованої форми затриманого вивільнення. Типово, коли час запізнення між формами негайного вивільнення (вивільнення після введення) та формами затриманого вивільнення складає 2-6 годин, бажано від приблизно 3 до приблизно 5 годин, більш бажано від приблизно 3 до приблизно 4 годин, та типово приблизно 4 години. В одному втіленні композиції швидкого уповільненого вивільнення за даним винаходом використовуються для забезпечення профілю середнього значення концентрації у плазмі по суті такого самого, як у Прикладі 5 (комбінація Прикладів 1 та 2) WO 00/23055, незважаючи на те, що останній показує, що традиційна технологія композицій уповільненого вивільнення не була прийнятною для амфетамінів. (Зазначимо, що профіль у плазмі згідно з Прикладом 5, представлений на Фіг.7 WO 00/23055, не є профілем середнього значення, як такий, що представлений на Фіг.1 за даним винаходом, але є скоріше таким, що одержаний від одного індивідуума). SR композиції за даним винаходом виявилися несподівано особливо ефективними для лікування, наприклад, ADHD, як і ADDERALL XR RTM. Наприклад, вони несподівано виявилися ефективними для лікування ADHD гарним чином згідно з даними, представленими у Прикладі 10. Вони також будуть ефективними для лікування ADHD з низькою частотою виникнення побічних ефектів, включаючи зловживання речовиною, звикання, стійкість, тахіфілаксію, тощо. Бажаними солями є ті, що використовуються у комерційному продукті ADDERALL XR RTM, тобто сульфат декстроамфетаміну, сахарат декстроамфетаміну, моногідрат аспартату амфетаміну та сульфат амфетаміну. Проте винахід не обмежений 87812 6 цими специфічними солями амфетаміну. Інші амфетаміни та солі амфетамінів та їх суміші можуть використовуватися у системі доставки на основі уповільненого вивільнення для досягнення профілів концентрації у плазмі згідно з винаходом. Наприклад, може використовуватися амфетамінова основа, його хімічні та хіральні похідні та інші солі. Бажані, коли in vivo профілі концентрації у плазмі солей амфітаміну можуть бути досягнуті шляхом забезпечення твердої дозованої форми солей амфетаміну, яка є здатною до забезпечення уповільненого вивільнення однієї або більше солей аміфетаміну протягом періоду часу, наприклад, від 8 до 12 годин, або більше, бажано від 10 до 12 годин. Наприклад, солі амфетаміну можуть забезпечуватися у ядрі, яке вкрите оболонкою, що дозволяє здійснювати вивільнення солей амфетаміну протягом певного періоду часу, наприклад, такою, як фармацевтично прийнятний нерозчинний у воді плівкоутворювач, взятий самостійно або разом з агентом, який регулює розчинення. Крім того, шляхом поєднання частинок негайного вивільнення з частинками уповільненого вивільнення можна досягти біфазного профілю вивільнення. Є відомими інші способи для забезпечення уповільненого вивільнення лікарського засобу, включаючи такі, що будуть обговорюватися нижче, вони можуть використовуватися для забезпечення доставки на основі уповільненого вивільнення, що приводить до одержання in vivo профілю концентрації у плазмі, що обговорювався вище. Прийнятні системи уповільненого вивільнення включають SR покриття, наприклад, на частинках, на SR матриксах (тобто, немає необхідності у покритті), SR осмотичних системах, тощо, за допомогою яких солі амфетаміну демонструють профіль вивільнення першого порядку, біфазний, сигмоїдальний, тощо, для досягнення профілю у плазмі, еквівалентного "пульсуючим" системам вивільнення таких самих лікарських засобів, як обговорювалося раніше. Прийнятним є приведення у відповідність з бажаним цільовим профілем концентрації при використанні SR. Частинки уповільненого вивільнення можуть бути одержані шляхом покриття традиційних ядер, які містять лікарський засіб, нерозчинним у воді полімером або комбінацією нерозчинних у воді полімерів, або комбінацією нерозчинних у воді та розчинних у воді полімерів. Це звичайно не є комбінацією шарів, але комбінацією полімерів у єдиному покритті. Одержані частинки (або дуже дрібні таблетки) можуть потім поміщатися у капсулу. Для одержання бажаного профілю у плазмі можуть також використовуватися форми, відмінні від частинок у капсульній оболонці, таблеток у капсульній оболонці (наприклад, одна таблетка негайного вивільнення та одна відстроченого, таблетка уповільненого вивільнення у капсульній оболонці для забезпечення загального уповільненого вивільнення). Різноманітні полімерні матеріали можуть використовуватися для досягнення моделі вивільнення, яка необхідна для досягнення бажаного профілю концентрації у плазмі, наприклад, для того, щоб підвищити швидкість швидкої доставки 7 протягом перших 4-8 годин доставки. Наприклад, множинні дозовані форми (наприклад, ті, що обговорювалися вище) згідно з даним винаходом можуть доставляти дози фармацевтично активної солі амфетаміну швидко та повністю для досягнення бажаного профілю лікарського засобу у плазмі реципієнтів протягом періоду часу приблизно 8-12 годин при одноразовому оральному введенні. При такому підході рівні фармацевтично активної солі амфетаміну лікарського засобу у плазмі крові будуть досягати піку достатньо швидко, наприклад, протягом періоду часу приблизно 8 годин або менше, якщо це є бажаним, які потім поступово знижуються протягом періоду часу, наприклад, наступних 12 або більше годин. Бажаний профіль концентрації у плазмі може, таким чином, бути досягнутий при використанні дозованої форми солей амфетаміну швидкого уповільненого вивільнення, що вводиться один раз на добу. Приклади корисної будови частинок для уповільненого вивільнення включають наступні: - цукрове ядро, вкрите амфетаміном, вкритим полімером, - цукрове ядро, вкрите амфетаміном, вкритим сумішшю амфетаміну та полімеру, вкритою полімером, - цукрове ядро, вкрите амфетаміном, вкритим сумішшю відносно високої концентрації амфетаміну та полімеру, вкритою сумішшю відносно слабшої концентрації амфетаміну та полімеру, вкритою полімером, - частинка, що містить амфетамін, вкрита полімером, - частинка, що містить амфетамін, вкрита сумішшю амфетаміну та полімеру, вкритою полімером, - частинка, що містить амфетамін, вкрита сумішшю відносно високої концентрації амфетаміну та полімеру, вкритою сумішшю відносно слабшої концентрації амфетаміну та полімеру, вкритою полімером, та - таблетка або капсула, що містить множину типів частинок, як описано вище, що мають різний час вивільнення амфетаміну та/або різні швидкості вивільнення амфетаміну. Як було згадано вище, також можуть використовуватися частинки SR матриксу, тобто такі, що не мають будь-яких необхідних шарів для досягнення уповільненого вивільнення. Компоненти, що використовуються у таких матриксах, є вибраними з традиційних полімерів SR. В іншій конструкції у композицію поряд з шаруватими частинками або матриксними частинками композиції негайного вивільнення можуть включатися композиції негайного вивільнення, які забезпечують один шлях для досягнення бажаного початкового швидкого вивільнення. Такі композиції негайного вивільнення є традиційними. Див, наприклад, WO 00/23055. Деталі стосовно використання наведених вище конструкцій та інших для досягнення бажаного профілю у плазмі, як вже обговорювалося вище, є повністю традиційними та можуть бути визначені спеціалістом у даній галузі при використанні не більше, ніж декількох, звичайних параметричних експериментів та традиційного доведення, напри 87812 8 клад, при використанні ідентичності полімерів та їх сумішей, відносної кількості компонентів, товщини покриття, діаметру частинок, кількості шарів та їх складу, тощо. Таким чином, наприклад, для даної конструкції (наприклад, однієї з тих, що представлені у прикладах нижче) можуть бути визначені профілі розчинення та виміряні in vivo профілі у плазмі. Останні можуть традиційно потім порівнюватися з цільовими профілями у плазмі (наприклад, з такими для ADDERALL XR RTM), та відмінності компенсуються повністю традиційними композиціями та доведенням профілю розчинення так, як було згадано, але не обмежуючись ними. Прийнятні матеріали, які можуть використовуватися для SR композицій за даним винаходом, є загальновідомими та включають без обмеження полівінілацетат, ацетат целюлози, ацетатбутират целюлози, ацетатпропіонат целюлози, етилцелюлозу, жирні кислоти та їх естери, алкілові спирти, воски, зеїн (проламін з кукурудзи) та водні "полімерні дисперсії, такі, як Eudragit RS та RL30D, Eudragit NE30D, Aquacoat, Surelease, Kollicoat SR30D та ацетат-целюлозний латекс. Способи одержання ядер включають: a. Екструзію-сферонізацію - лікарський(і) засіб(засоби) та інші додаткові речовини гранулюють з доданням розчину зв'язувального агенту. Вологу масу пропускають через екструдер, оснащений ситом з певним розміром. Екструдат піддають сферонізації у пристрої для сферонізації. Одержані гранули висушують та просіюють для подальшого застосування. b. Грануляцію з високим зсувом - лікарський(і) засіб(засоби) та інші додаткові речовини перемішують у сухому стані, а потім суміш зволожують шляхом додання зв'язувального розчину у гранулятор з високим ступенем зсуву/змішувач. Гранули перемішують після зволожування шляхом поєднаного перемішування та подрібнення. Одержані кульки та гранули висушують та просіюють для подальшого застосування. с. Нашаровування розчину або суспензії - розчин або дисперсію лікарського(их) засобу(ів) з доданням або без додання зв'язувального агенту розпилюють на вихідний матеріал з певним розміром частинок у псевдозрідженому шарі у відповідному технологічному пристрої або на іншому прийнятному обладнанні. Лікарський засіб, таким чином, наносять на поверхню вихідного матеріалу. Гранули з лікарським засобом висушують для подальшого застосування. Для цілей даного винаходу ядро частинок бажано має діаметр у межах приблизно від 500 до 1500 мікрон (мікрометрів); більш бажано від 100 до 800 мікрон. На ці частинки може потім наносять покриття у псевдозрідженому шарі відповідного пристрою з альтернативною послідовністю вибраних для покриття шарів. Композиція, переважно у формі гранул, описана вище, може бути внесена у тверді желатинові капсули або з додатковими наповнювачами, або окремо. Типові наповнювачі, що вносяться у композицію капсули, включають без обмеження: наповнювачі, такі, як мікрокристалічна целюлоза, соєві полісахариди, дигідрат фосфату кальцію, 9 сульфат кальцію, лактозу, сахарозу, сорбіт або будь-який інший інертний наповнювач. Крім того, можуть вноситися добавки, що покращують текучість, такі, як спінений діоксид кремнію, силікагель, стеарат магнію, стеарат кальцію або будь-який інший матеріал, що надає текучості порошкам. Також можна додавати у разі необхідності лубрикант, використовуючи при цьому, наприклад, поліетиленгліколь, лейцин, гліцерилбегенат, стерат магнію або стеарат кальцію. Композиція може також бути введена у таблетку, зокрема, шляхом введення у матрикс таблетки, що швидко диспергує частинки після її прийому. Для того, щоб ввести ці частинки у таку таблетку, наповнювач/зв'язувальний агент повинен додаватися до таблетки, яка може вміщувати частинки, але буде запобігати її руйнуванню під час процесу таблетування. Матеріали, які є прийнятними для цієї мети, включають, але не обмежені, мікрокристалічну целюлозу (AVICEL.RTM.), соєвий полісахарид (EMCOSOY.RTM.), попередньо желатиновані крохмалі (STARCH.RTM. 1500, NATIONAL.RTM. 1551) та поліетиленгліколі (CARBOWAX.RTM.). Ці матеріали переважно присутні у кількості в межах 5-75ваг.%, з більш бажаним інтервалом 25-50ваг.%. Крім того, необов'язково додають дезінтегранти для того, щоб диспергувати частинки після прийому таблетки. Прийнятні дезінтегранти включають, але не обмежені: поперечнозв'язану карбоксиметилцелюлозу (AC-DI-SOL.RTM.), крохмальгліколят натрію (EXPLOTAB.RTM., PRIMOJEL.RTM.) та поперечноз'язаний полівінілпіролідон (Plasone-XL). Ці матеріали переважно присутні у кількості в межах 3-15% ваг.%, з більш бажаним інтервалом 5-10ваг.%. Лубриканти також можуть необов'язково додаватися для забезпечення власне таблетування, такі агенти можуть включати, але без обмеження: стеарат магнію, стерат кальцію, стеаринову кислоту, поліетиленгліколь, лейцин, гліцерилбеганат та гідрогенізовану рослинну олію. Такі лубриканти переважно присутні у кількості в межах 0,110ваг.%, з більш бажаним інтервалом 0,33,0ваг.%. Таблетки одержують так, як наприклад, описано нижче. Частинки вводять у змішувач разом з AVICEL.RTM., дезінтегрантом та лубрикантом, змішують протягом кількох хвилин для забезпечення гомогенної суміші, яку потім переносять у завантажувальний бункер таблетувального пресу, за допомогою якого будуть ущільнювати таблетки. Компресійна сила, що використовується, відповідає формі таблеток; проте є недостатньою для розламування. Як гастрорезистентні, розчинні у кишечнику покриття для вивільнення лікарського засобу у кишечнику, якщо це є бажаним, можуть використовуватися різноманітні кишкові матеріали, наприклад, ацетатфталат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетатфталат та EUDRAGIT.RTM. акрилові полімери. Кишкові матеріали, які є розчинними при вищих значеннях рН, часто використовуються у специфічних для кишечника системах доставки та є повністю таки 87812 10 ми, що звичайно використовуються в SR системах згідно з даним винаходом. Кишкові полімери, що використовуються у даному винаході, можуть також традиційно бути модифіковані шляхом змішування з іншими відомими продуктами для покриття, які не є чутливими до рН. Приклади таких продуктів для покриття включають нейтралі естери метакрилової кислоти з доданням невеликої кількості хлориду триметилмонійетилметакрилату, що продаються під торговими назвами EUDRAGIT.RTM. та EUDRAGIT.RTM.RL; дисперсію нейтрального естера без додання будь-яких функціональних груп, що продається під торговою назвою EUDRAGIT.RTM. NE30D та EUDRAGIT.RTM. NE30; та інші продукти покриття, що не залежать від значення рН. Традиційний шар захисного покриття може також наноситися безпосередньо на ядро або на матрикс ядра, що містить лікарський засіб, або на ядро, яке містить шари лікарського засобу, за допомогою традиційних методик покриття, таких, як змащування форми або покриття у псевдозрідженому шарі при використанні розчинів полімерів у воді або прийнятних органічних розчинниках або шляхом використання водних дисперсій полімеру. Прийнятні матеріали для захисного шару включають похідні целюлози, такі, як гідроксіетилцелюлоза, гідроксипропілцелюлоза, гідроксипропілметилцелюлоза, полівінілпіролідон, співполімер полівінілпіролідону та вінілацетату, водні дисперсії етилцелюлози (AQUACOAT.RTM., SURELEASE.RTM.), EUDRAGIT.RTM.RL 30D, OPADRY.RTM. та інші. Запропоновані рівні покриття складають від 1 до 6ваг.%, переважно від 2 до 4ваг.%. Шар, який наноситься на покриття, може також необов'язково використовуватися для композицій згідно з даним винаходом. OPADRY.RTM., OPADRY II.RTM. (Colorcon) відповідні забарвлені та безбарвні марки від Colorcon можуть використовуватися для захисту гранул від злипання та забезпечують забарвлення продукту. Запропоновані рівні захисного покриття або покриття для надання кольору складають від 1 до 6ваг.%, переважно від 2 до 3ваг.%. У склад шару, що наноситься на покриття, може вводитися багато інгредієнтів, наприклад, для забезпечення більш швидкого (негайного) вивільнення, таких, як пластифікатори: ацетилтриетилцитрат, триетилцитрат, ацетилтрибутилцитрат, дибутилсебекат, триацетин, поліетиленгліколі, пропіленгліколь та інші; лубриканти: тальк, колоїдний діоксид кремнію, стеарат магнію, діоксид титану, силікат магнію, тощо. Необов'язкові модифікуючі компоненти захисного шару, які можуть використовуватися для нанесення на кишкове та інше покриття, включають бар'єрний шар для проникнення води (напівпроникний полімер), який може успішно бути нанесений на кишкове або інше покриття для зменшення швидкості проникнення води через шар кишкового покриття, і таким чином, буде збільшувати час затримання вивільнення лікарського засобу. Покриття уповільненого вивільнення, що є загальновідомими для спеціалістів у даній галузі, можуть 11 використовуватися з цією метою шляхом застосування традиційних методик нанесення покриття, таких, як змащування форми або нанесення покриття у псевдозрідженому шарі при використанні розчинів полімерів у воді або прийнятних органічних розчинниках або при використанні водних дисперсій полімерів. Наприклад, можуть використовуватися наступні матеріали, що без обмеження включають: ацетат целюлози, ацетатбутират целюлози, ацетатпропіонат целюлози, етилцелбюлозу, жирні кислоти та їх естери, воски, зеїн та водні дисперсії полімерів, таких, як EUDRAGIT.RTM. RS та RL 30D, EUDRAGIT.RTM. NE 30D, AQUACOAT.RTM., SURELEASE.RTM., ацетат-целюлозний латекс. Може також використовуватися комбінація вказаних вище полімерів та гідрофільних полімерів, таких, як гідроксіетилцелюлоза, гідроксипропілцелюлоза (KLUCEL.RTM., Hercules Corp.), гідроксипропілметилцелюлоза (METHOCEL.RTM., Dow Chemical Corp). Принципи технології композицій уповільненого вивільнення, що застосовуються до цього винаходу, включаючи стандартні способи, згадані у даній заявці, розкриті, наприклад, в R.K. Chang та J.R. Robinson, розділ 4: "Sustained Drug Release from Tablets and Particles Through Coating," в Pharmaceutical Dosage Forms: Tablets, том 3, під редакцією H.A. Lieberman, L. Lachman та J.B. Schwartz, Marcel Dekker, Inc., 1991; R.J. Campbell та G.L. Sackett, розділ 3: "Film coating," в Pharmaceutical Unit Operations: Coating, під редакцією K.E. Avis, A.J. Shukla та R.K. Chang, Interpharm Press, Inc., 1999, розкриття яких введене в дану заявку як посилання. Цей винахід також відноситься до використання композицій SR для лікування захворювань, відмінних від ADHD при використанні доз та у режимах, аналогічних тим, які описані у даній заявці. Такі включають без обмеження хворобу Альцгеймера та інші розлади пам'яті, фіброміалгію, хронічну втому, депресію, обсесивно-компульсивні розлади, окремо або у комбінації з SSRI; опозиційний розлад (ODD), разом або без ADHD та у комбінації або без гуанфацину або велбутрину; неспокою, разом або без ADHD та окремо або у комбінації з анксіолітиком або SSRI; стійкої депресії; реабілітації після удару; хвороби Паркінсона; розладу настрою; шизофренії; хвороби Хантінгтона; деменції, наприклад, AIDS деменції та деменції фронтальної долі; дисфункції руху; апатії, втоми, захворювання Піка; розладів сну, наприклад, нарколепсії, катаплексії, ранкового паралічу та гіпнотичних галюцінацій тощо. Винахід також відноситься до комбінацій SR композицій за даним винаходом з іншими терапевтичними агентами, включаючи усі ті, що є корисними для даного призначення. Такі лікарські засоби можуть бути рецептовані у тій самій дозованій формі як доза SR за даним винаходом або можуть бути рецептовані окремо, наприклад, як вони традиційно використовуються, у цьому випадку лікарські засоби можуть вводитися послідовно у будьякому порядку або одночасно. Типово, коли дози форми будуть знаходитися у тих самих межах, що й для кожного лікарського засобу, який використо 87812 12 вується окремо, або, якщо існує синергетичний ефект, один або більше поєднаних лікарських засобів можуть використовуватися у нижчих дозах. Комбінації охоплюють будь-які, в яких лікарські засоби є біодоступними для пацієнта у той самий час, включаючи комбінації, що вводяться пацієнтові. Такі терапевтичні агенти включають, наприклад, для лікування хвороби Альцгеймера: Ремініл, Когнекс, Арицепт, Екселон, Акатінол, Неотропін, Елдеприл, Естроген, Кліохінол, Ібупрофен та Гінкго білоба; для ADHD: метилфенідат (наприклад, Риталін), Декседрин, Аддералл, Цилерт, клонідин, гуанфацин, тощо; для лікування депресії: Прозак, Золофт, Паксил, Ребоксетин, Велбутрин, Оланзапін, Флуоксетин, Елавіл, Тотраніл, Памелор, Нарділ, Парнат, Дезирил та Ефексор; для лікування розладів настрою: Торазин, Галдол, Наван, Меларил, Клозарил, Ріспердал, Зипрекса, Клозапін, Рисперидон та Оланзапін; для лікування втоми: бензодіазепіни, Анапрокс, Напрозен, Прозак, Золофт, Паксил, Ефексор та Дезирил; для лікування фіброміалгії: Дилантин, Карбатрол, Епітол, Тегретол, Депакон, Депакот, Норпрамін, Авентил, Памелор, Елавіл, Еновіл, Адапін, Синекван, Зоналон та нестероїдні протизапальні лікарські засоби; для лікування опозиційного розладу (ODD): клонідин, Ризперидон та Зипрекса; для лікування апатії: Амісулприд, Оланзапін, Візперидон, Кветіапін, Клозапін та Зотепін; для лікування хвороби Паркінсона: Леведопа, Парлодел, Пермакс та Мірапекс; для лікування шизофренії: Клозапін, Зипрекса, Сероквел та Ріспердал; для лікування хвороби Хантінгтона: галоперидал та клонзепам; для лікування деменції: тіоридазин, галоперидал, Рісперидон, Когнекс, Арицепт та Екселон; для лікування нарколепсії: Провігіл, Декседрин, Модафініл та Риталін; для лікування катаплексії: Ксирем; для лікування галюцінацій: Клозапін, Ризперидон, Зипрекса та Сероквел; для лікування ранкового паралічу: Пероцет, Вікодин та Лорцет; для лікування обсесивно-компульсивного розладу: Анафраніл, Прозак, Зофолт, Паксил, Лувокс; для лікування неспокою: Елавіл, Азендин, Велбутрин, Тегретол, Анафраніл, Норпрамін, Адапін, Синекван, Тофраніл, Епітол, Джамірин, Памелор, Вентил, Авентил, Сурмонтил, тощо; селективні інгібітори зворотного поглинання серотоніну (SSRI), включаючи, Прозак, Лувокс, Серзон, Паксил, Золофт, Ефексор, тощо; бензодіазепіни, включаючи, Ксанакс, Лібріум, Клонопін, Валіум, Зетран, Валреліз, Далман, Атіван, Алзапам, Серакс, Халціон, тощо; інгібітори моноаміноксидази, включаючи Аврорікс, Манерікс, Нардил, Парнат, тощо. Повне розкриття усіх заявок, патентів та публікацій, які цитуються у даній заявці вище та нижче, введені у дану заявку як посилання. Приклади В усіх представлених нижче прикладах усі температури приведені у градусах Цельсія; якщо не вказане інше, то усі частини та проценти приведені за вагою. SR гранули з покриттям 13 Приклад 1 Гранули, що складаються із суміші солей амфетаміну (MASL) 500 грамів Етилцелюлоза (Ethocel N-10, Dow Chemical) 15,46 грама Етилацетат 515 грамів Етилцелюлозу (15,46г) розчиняли у 515 грамах етилацетату. У колонку Wuster завантажують 500 грамів гранул MASL, на які потім наносять покриття, що представляв собою суміш, при наступних умовах: температура 40°С, тиск розпилення 1 бар, швидкість розпилювання 10 грамів/хв. Лінію промивають етилацетатом та гранули висушують протягом приблизно 20 хвилин та відновлюють для одержання продукту, що містить 97ваг.% MASL гранул та 3ваг.% етилцелюлозого покриття. Приклад 2 Гранули, що складаються із суміші солей амфетаміну (MASL) 500 грамів Етилцелюлоза (Ethocel N-10, Dow Chemical) 37,78 грама Гідроксипропілцелюлоза (Klucel LF, Aqualon) 8,70 грама Метиленхлорид 744 грами Метанол 186 грамів Етилцелюлозу (37,78г) та гідропропілцелюлозу (8,70 грамів) розчиняють у суміші метиленхлориду та метанолу (4:1). У колонку Wuster завантажують 500 грамів гранул MASL, на які потім наносять покриття, що представляє собою суміш, при наступних умовах: температура 40°С, тиск розпилення 1 бар, швидкість розпилювання 10 грамів/хв. Лінію промивали етилацетатом та гранули висушують протягом приблизно 20 хвилин та відновлюють для одержання продукту, що містить 92ваг.% MASL гранул та 8ваг.% покриття на основі етилцелюлози/гідроксипропілцелюлози. Приклад 3 Гранули, що складаються із суміші солей амфетаміну (MASL) 500 грамів Surlease (дисперсія на основі 173,92 граетилцелюлози, Colorcon) ма Вода 48,48 грама Surlease (173,92г) розводять за допомогою 43,48 грамів води. У колонку Wuster завантажують 500 грамів гранул MASL, на які потім наносять покриття, що представляє собою суміш, при наступних умовах: температура 60°С на вході, тиск розпилення 1 бар, швидкість розпилювання 6 грамів/хв. Лінію промивають етилацетатом та гранули висушували протягом приблизно 20 хвилин та відновлюють для одержання продукту, що містить 92ваг.% MASL гранул та 8ваг.% етилцелюлозного покриття. Приклад 4 Гранули, що складаються із суміші солей амфетаміну (MASL) 500 грамів Eudragit RS30D 173,92 грама Триетилцитрат 10,3 грама Вода 115,94 грама Триетилцитрат змішують в Eudragit RS30D протягом 30 хвилин. Пластифікований Eudragit RS30D розводять водою та фільтрують через сито 60 меш. У колонку Wuster завантажують 500 гра 87812 14 мів гранул MASL, на які потім наносять покриття, що представляє собою суміш, при наступних умовах: температура 40°С на вході, тиск розпилення 1 бар, швидкість розпилювання 6 грамів/хв. Лінію промивають етилацетатом та гранули висушують протягом приблизно 20 хвилин та відновлюють для одержання продукту, що містить 92ваг.% MASL гранул та 8ваг.% Eudragit RS30D покриття. Приклад 5 Гранули, щоскладаються із суміші солей амфетаміну (MASL) 500 грамів Змішані солі амфетаміну 173,92 грама Гліцерилбегенат (Compritol 888, Gattefosse) 436,5 грама Змішані солі амфетаміну диспергують у розплавленому гліцерилбегенаті. Гарячий розплав, що містить лікарський засіб, розпилюють на гранули, що містять змішані солі амфетаміну у колонці Wuster при наступних умовах: температура 30°С на вході, тиск розпилення 2 бари, швидкість розпилювання 10 грамів/хв. Приклад 6 Гранули, що складаються із суміші солей амфетаміну (MASL) 500 грамів Eudragit L100 25,25 грама Етилцелюлоза (Ethocel N-10, Dow Chemical) 25,25 грама Триетилцитрат 5,05 грама Ацетон 833,4 грама Метанол 277,8 грама Eudragit L100 та етилцелюлозу розчиняють у суміші ацетону та метанолу. Потім додають триетилцитрат до полімерного розчину. У колонку Wuster завантажують 500 грамів гранул MASL, на які потім наносять покриття, що представляє собою суміш, при наступних умовах: температура 40°С, тиск розпилення 1 бар, швидкість розпилювання 10 грамів/хв. Лінію промивають метанолом та гранули висушують протягом приблизно 20 хвилин та відновлюють для одержання продукту, що містить 90ваг.% MASL гранул та 10ваг.% покриття на основі целюлози / Eudragit L100. Гранули на основі SR матриксу/таблетки Приклад 7 Аспартат амфетаміну 50 грамів Сульфат амфетаміну 50 грамів Сахарат декстроамфетаміну 50 грамів Сульфат декстроамфетаміну 50 грамів Мікрокристалічна целюлоза 400 грамів Полі(етиленоксид), Polyox WSR 303 1380 грамів Стеарат магнію 20 грамів Усі солі амфетаміну, мікрокристалічну целюлозу та полі(етиленоксид) просіюють через сито 60 меш та завантажують у клиновидний змішувач з лопаттю. Порошкову суміш розмішують протягом 15 хвилин при використанні лопаті протягом 3 хвилин у середині процесу змішування. Порошкову суміш вивантажують та просіювали через сито 60 меш. Просіяну порошкову суміш змащують стеаратом магнію у клиновидному змішувачі протягом 3 хвилин. Змащену порошкову суміш ущільнюють на роликовому ущільнювальному пристрої для утворення гранул. 15 87812 Приклад 8 Аспартат амфетаміну 50 грамів Сульфат амфетаміну 50 грамів Сахарат декстроамфетаміну 50 грамів Сульфат декстроамфетаміну 50 грамів Мікрокристалічна целюлоза 1780 грамів Стеарат магнію 20 грамів Усі солі амфетаміну та мікрокристалічну целюлозу просіюють через сито 60 меш та завантажують у клиновидний змішувач з лопаттю. Порошкову суміш розмішують протягом 15 хвилин при використанні лопаті протягом 3 хвилин у середині процесу змішування. Порошкову суміш вивантажують та просіюють через сито 60 меш. Просіяну порошкову суміш змащують стеаратом магнію у клиновидному змішувачі протягом 3 хвилин. Змащену порошкову суміш ущільнюють у таблетки при використанні 3/32" пристрою. 8% покриття 12% покриття 1 година 45% 25% 2 години 74% 47% Приклад 11 Передумови Двокомпонентна композиція відстроченого вивільнення Adderall® (змішані солі d- та 1амфетаміну), призначена для здійснення "пульсуючого" вивільнення лікарського засобу, забезпечувала терапевтичний ефект для лікування синдрома дефіцита уваги та гіперактивності (ADHD) протягом усієї доби при одному прийомі ранкової дози. Така капсульна композиція Adderall XR ЯТМ складалася з двох типів гранул Microtrol RТМ змішаних солей амфетаміну у співвідношенні а 50:50 в одній капсулі. Гранули негайного вивільнення були призначені для вивільнення вмісту лікарського засобу протягом періоду часу, близького до такого для Adderall®. Гранули негайного вивільнення були призначені для вивільнення вмісту лікарського засобу через приблизно 4 години після орального введення капсули. Вивчення вихідної композиції з Adderall XR RTM20мг один раз на день продемонструвало порівняну біодоступність та фармакокінетичні профілі, подібні до таких для Adderall RTM 10мг двічі на день з 4-годинними інтервалами, з цього було зроблено висновок, що Adderall RTM 20мг один раз на день є біоеквівалентним Adderall RTM 10мг двічі на день (Michaels та ін. Presented, NCDEU 2001). Реальні дані Ефективність та відстрочена тривалість дії Adderall XR RTM при лікуванні дітей з ADHD було продемонстровано у двох попередніх центральних подвійних сліпих дослідженнях: одне з них здійснювали у лабораторних умовах (McCracken та ін. Submitted), а інше проводили в домашніх умовах та в умовах шкільного оточення (Biederman та ін. Pediatrics 2002, у друці). Це масштабне дослідження з відкритим міченням здійснювали спочатку для оцінки переносимості та ефективності Adderall XR RTM при лікування педіатричного ADHD у суспільних умовах. 16 Приклад 9 Міні-таблетки 500 грамів Surelase 127,7 грама Вода 85,1 грама Surelase (127,7 грама) розводять 85,1 грамами води. У колонку Wuster (Versa-Glatt, Glatt Air Techniques) завантажують 500 грамів гранул MASL, на які потім наносять покриття, що представляє собою суміш, при наступних умовах: температура 60°С температура на вході, тиск розпилення 1 бар, швидкість розпилювання 6 грамів/хв. Лінію промивали метанолом та гранули висушують протягом приблизно 20 хвилин та відновлюють для одержання продукту, що містить 88ваг.% MASL гранул та 12ваг.% покриття на основі етилцелюлози. Дані стосовно розчинення для 8% та 12% рівнів покриття підсумовані у наступній таблиці. 4 години 93% 70% 6 годин 98% 81% 8 годин 100% 87% Способи У даній заявці представлені неперевірені дані стосовно цього передбачуваного 7-тижневого дослідження з відкритим міченням, яке здійснювали у 378 точках усього світу. Продовження дослідження до 8 тижнів було необов'язковим після завершення початкової фази (Діаграма А). Суб'єкти дослідження: Були зареєстровані діти у віці від 6 до 12 років, які мали діагноз DSM-IV ADHD та одержували стабільні дози Adderall® негайного вивільнення або будь-яку композицію метилфенідату. Критерії включення: Гарний загальний стан здоров'я з нормальним тиском крові, пульсом та електрокардіограмою (ЕКГ), значення за шкалою загальних індексів Коннерса - вихідне (CGIS-P) £12 для хлопчиків та £ для дівчаток; відомий тип відповіді на вживання психостимуляторних лікарських засобів. Критерії виключення: неконтрольований, симптоматичний, поєднаний психіатричний розлад; IQ
ДивитисяДодаткова інформація
Назва патенту англійськоюSustained release formulation of amphetamine salts
Автори англійськоюCouch Richard A, Burnside Beth, Chang Rong-Kun
Назва патенту російськоюКомпозиция солей амфетамина замедленного высвобождения
Автори російськоюКуч Ричард А., Бернсайд Бет, Чанг Ронг-Кун
МПК / Мітки
МПК: A61P 25/00, A61K 47/38, A61K 31/137, A61K 9/36
Мітки: композиція, амфетаміну, вивільнення, уповільненого, солей
Код посилання
<a href="https://ua.patents.su/13-87812-kompoziciya-solejj-amfetaminu-upovilnenogo-vivilnennya.html" target="_blank" rel="follow" title="База патентів України">Композиція солей амфетаміну уповільненого вивільнення</a>
Попередній патент: Спосіб виготовлення перукарських ножиць, а також перукарські ножиці
Наступний патент: Система контрольованого вивільнення темозоломіду
Випадковий патент: Гідравлічний кувальний прес