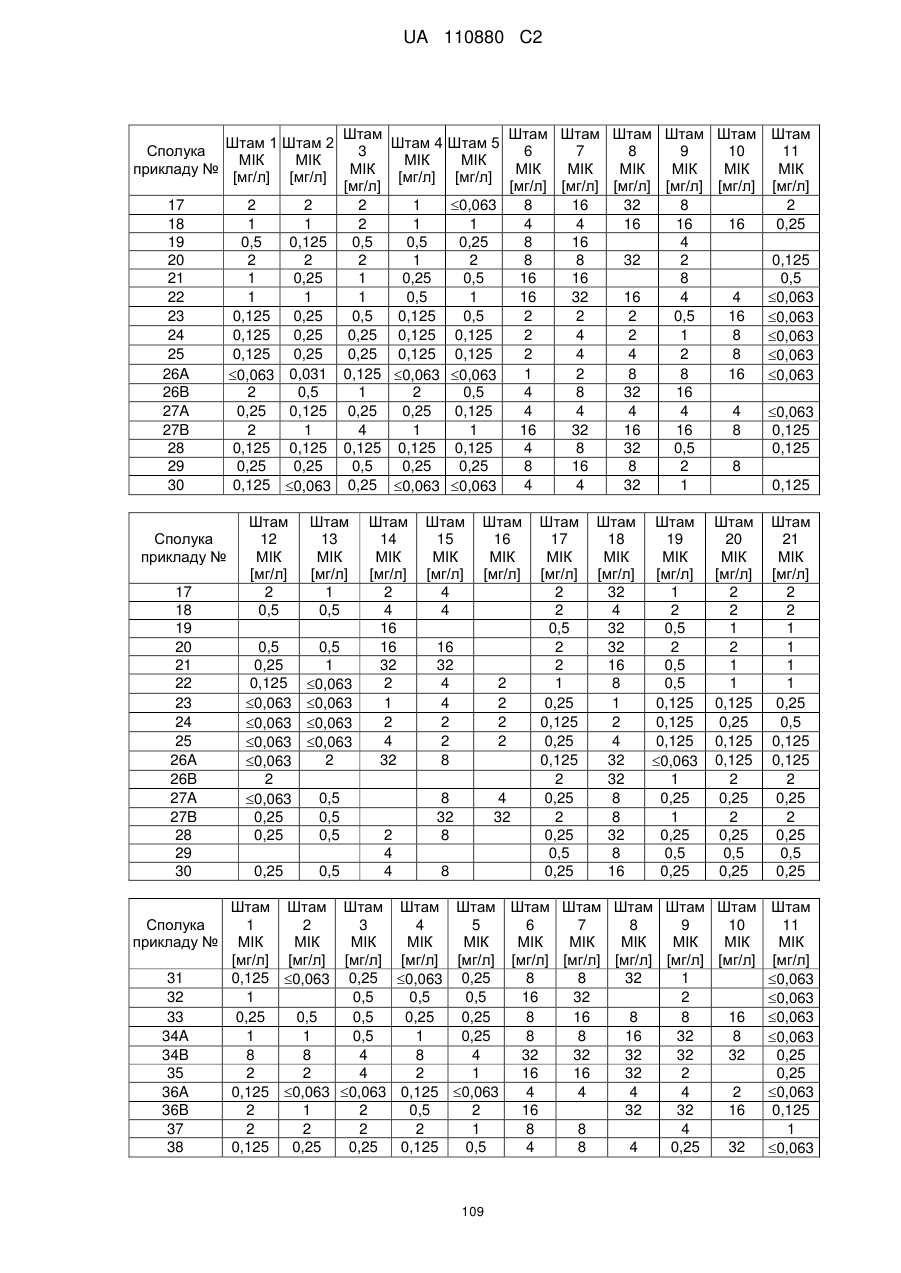
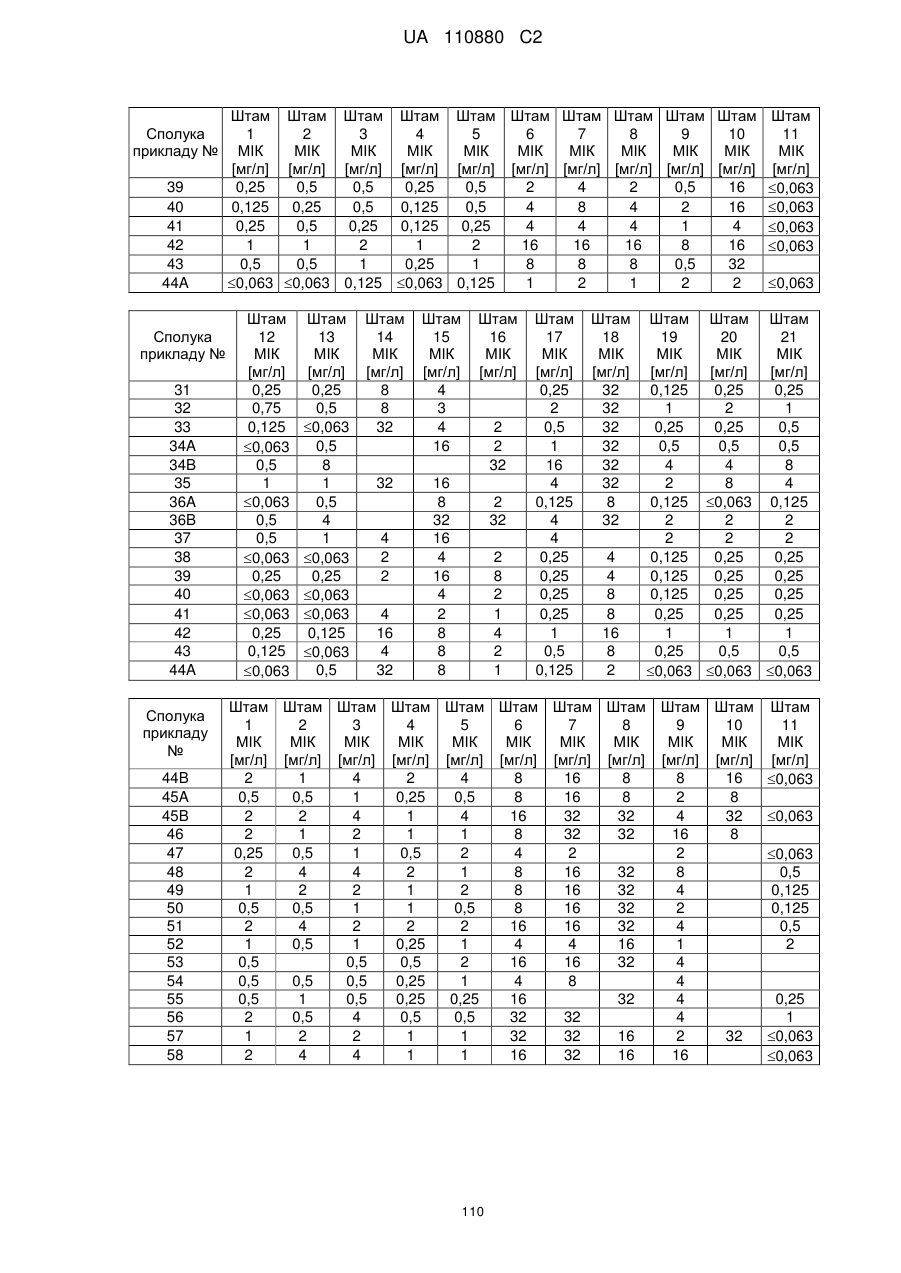
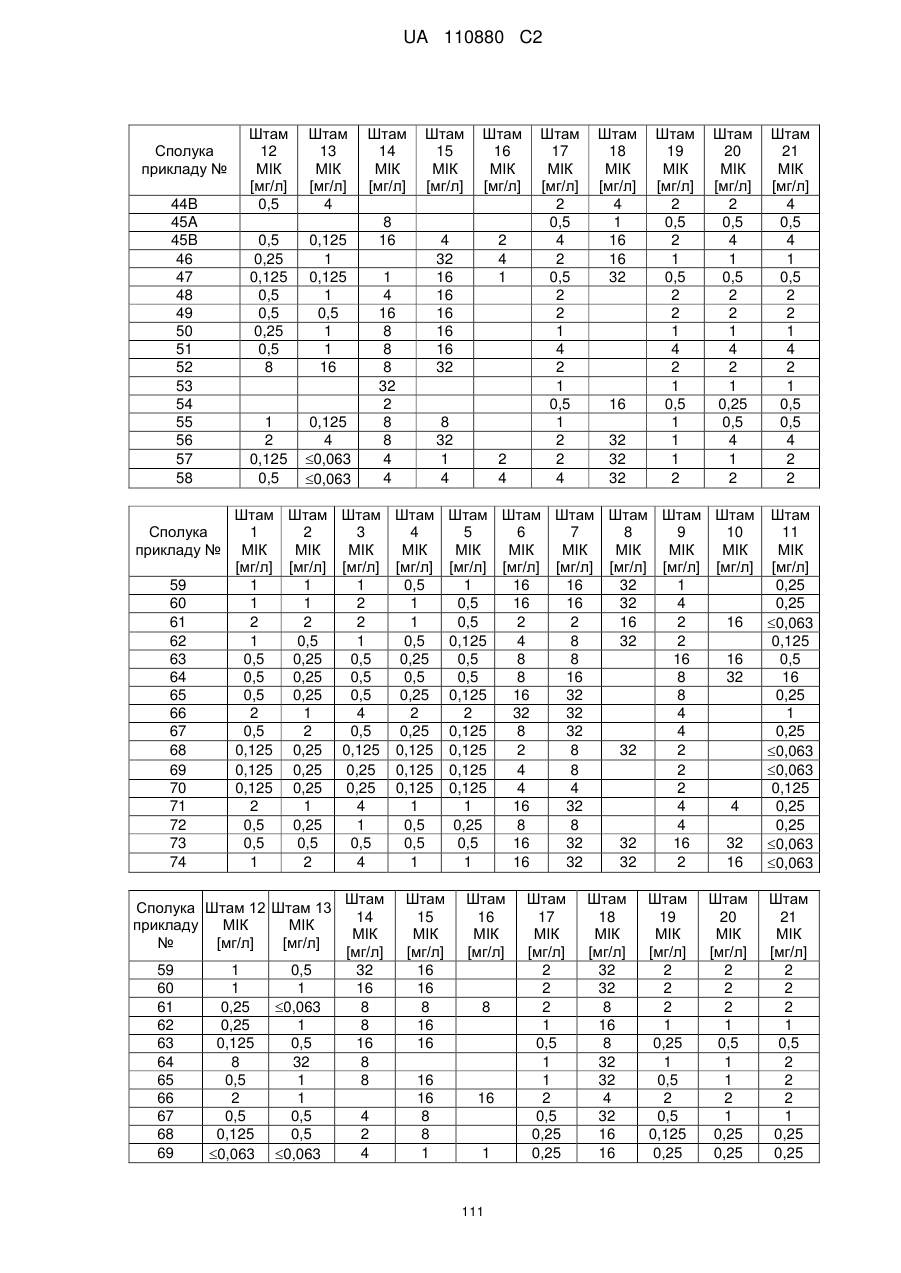
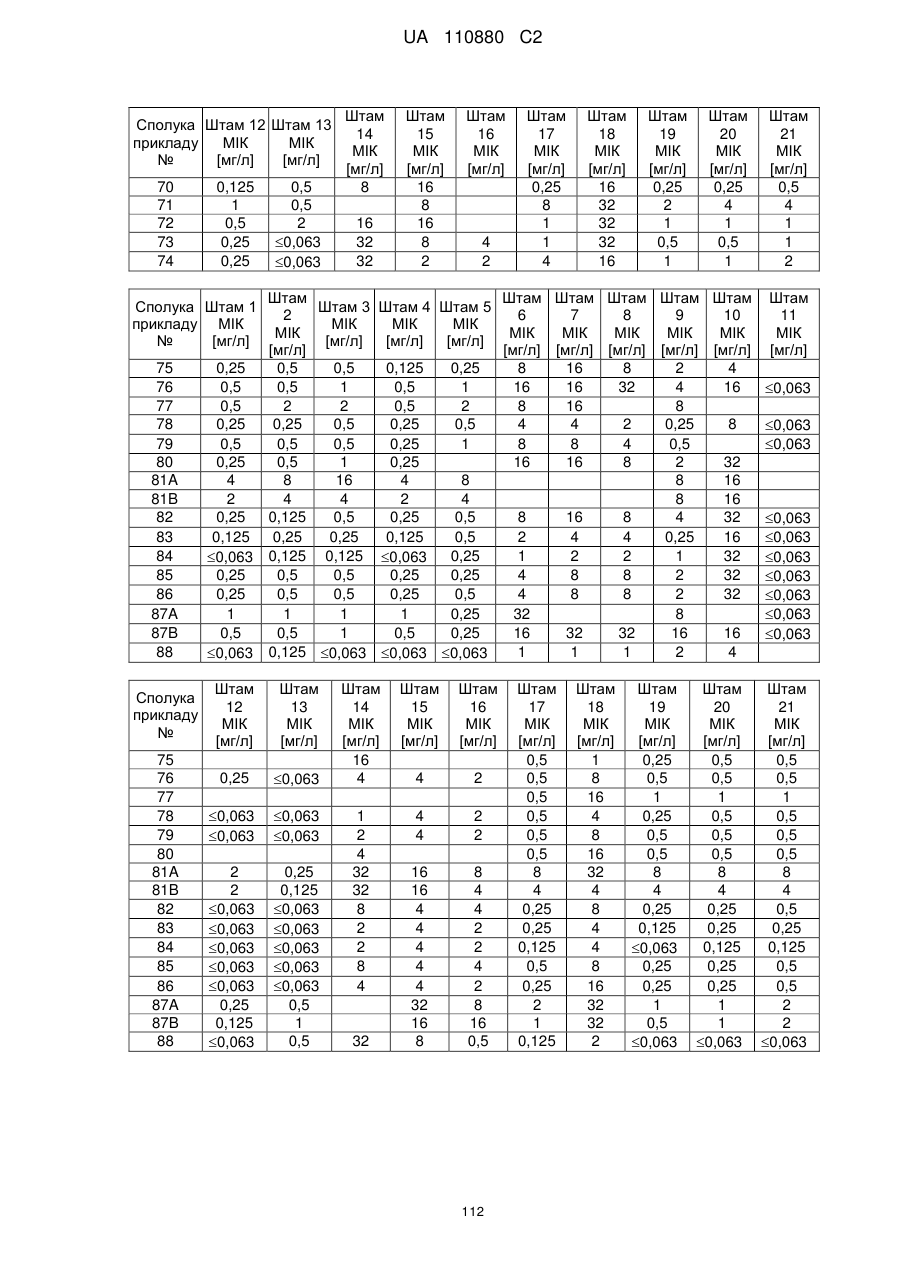
Заміщені амідином бета-лактами, їх одержання та застосування як антибактеріальних засобів
Номер патенту: 110880
Опубліковано: 25.02.2016
Автори: Кленке Буркхард, Віганд Іріт, Хан Ехангір, Цзя Гофен, Брьоц-Естерхельт Хайке, Лян Хун, Бісваджит Гангулі, Лігун Оу, Хена Мустафа, Маіті Самарендра Н., Мухаммад Рахім, Таджаммул Сабіха, Іп Джуді, Редді Андхе, Гао Чуанжун, Шіффер Гуідо, Ян Чжісян
Формула / Реферат
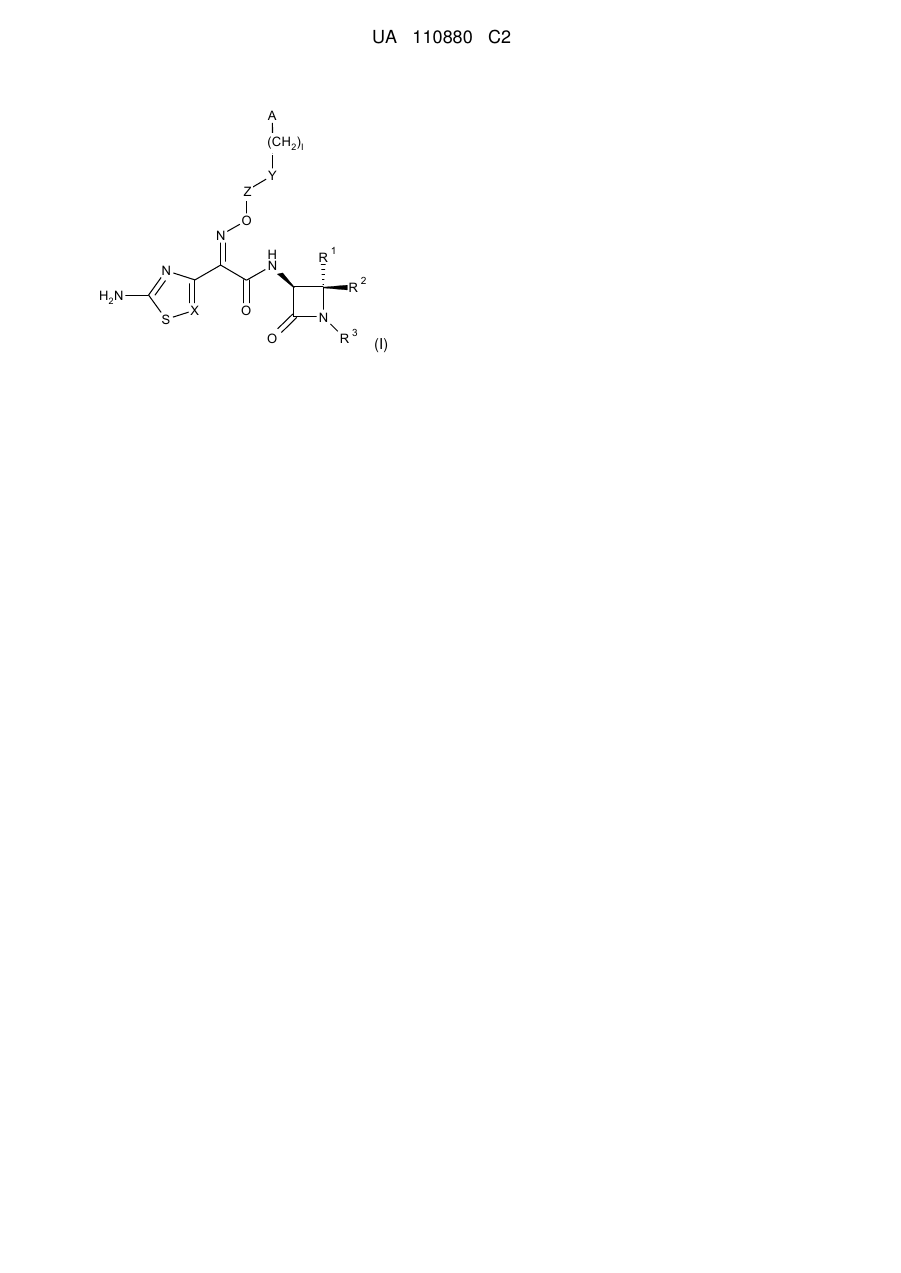
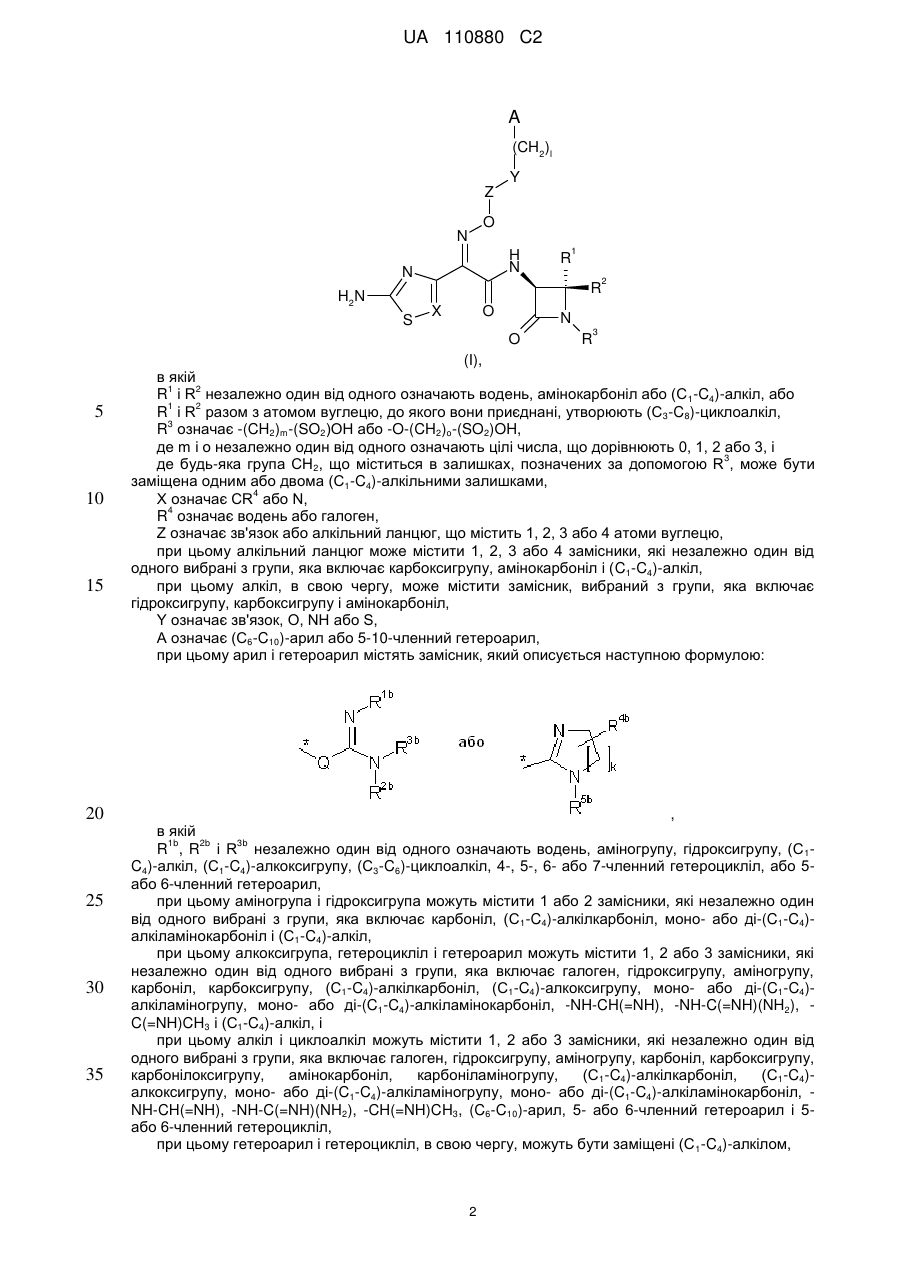
1. Сполука формули
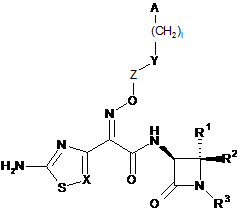 , (I)
, (I)
в якій
R1 і R2 незалежно один від одного означають водень, амінокарбоніл або (С1-С4)-алкіл, або
R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють (С3-C8)-циклоалкіл,
R3 означає -(CH2)m-(SO2)OH абo -O-(CH2)o-(SO2)OH,
де m і о незалежно один від одного означають цілі числа, що дорівнюють 0, 1, 2 або 3, і
де будь-яка група СН2, що міститься в залишках, позначених за допомогою R3, може бути заміщена одним або двома (С1-С4)-алкільними залишками,
X означає CR4 або N,
R4 означає водень або галоген,
Z означає зв'язок або алкільний ланцюг, що містить 1, 2, 3 або 4 атоми вуглецю, при цьому алкільний ланцюг може містити 1, 2, 3 або 4 замісники, які незалежно один від одного вибрані з групи, яка включає карбоксигрупу, амінокарбоніл і (С1-С4)-алкіл,
при цьому алкіл, в свою чергу, може містити замісник, вибраний з групи, яка включає гідроксигрупу, карбоксигрупу і амінокарбоніл,
Y означає зв'язок, О, NH або S,
А означає (С6-С10)-арил або 5-10-членний гетероарил,
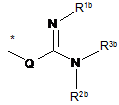
при цьому арил і гетероарил містять замісник, який описується наступною формулою:
 або
або 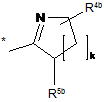 ,
,
в якій
R1b, R2b і R3b незалежно один від одного означають водень, аміногрупу, гідроксигрупу, (С1-С4)-алкіл, (С1-С4)-алкоксигрупу, (С3-С6)-циклоалкіл, 4-, 5-, 6- або 7-членний гетероцикліл або 5- або 6-членний гетероарил, при цьому аміногрупа і гідроксигрупа можуть містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає карбоніл, (С1-С4)-алкілкарбоніл, моно- або ді-(С1-С4)-алкіламінокарбоніл і (С1-С4)-алкіл, при цьому алкоксигрупа, гетероцикліл і гетероарил можуть містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, (С1-С4)-алкілкарбоніл, (С1-С4)-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, моно- або ді-(С1-С4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -C(=NH)CH3 і (С1-С4)- алкіл, і
при цьому алкіл і циклоалкіл можуть містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, карбонілоксигрупу, амінокарбоніл, карбоніламіногрупу, (С1-С4)-алкілкарбоніл, (С1-С4)-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, моно- або ді-(С1-С4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -СН(=NН)СН3, (С6-С10)-арил, 5- або 6-членний гетероарил і 5- або 6-членний гетероцикліл,
при цьому гетероарил і гетероцикліл, в свою чергу, можуть бути заміщені (С1-С4)-алкілом, і
при цьому аміногрупа, в свою чергу, може бути заміщена 5- або 6-членним гетероарилом, або
R2b і R3b разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членний гетероцикл, що містить 1, 2 або 3 додаткових гетероатоми, що вибрані з групи, яка включає N, О і S, і R1b є таким, як визначено вище,
R4b означає водень, аміногрупу, гідроксигрупу, (С1-С4)-алкіл або (С1-С4)-алкоксигрупу, при цьому аміногрупа і гідроксигрупа можуть містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає (С1-С4)-алкілкарбоніл, моно- або ді-(С1-С4)-алкіламінокарбоніл і (С1-С4)-алкіл, при цьому алкоксигрупа може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, (С1-С4)-алкілкарбоніл, (С1-С4)-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, моно- або ді-(С1-С4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -CH(=NH)CH3 і (С1-С4)-алкіл, і при цьому алкіл може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, амінокарбоніл, (С1-С4)-алкілкарбоніл, (С1-С4)-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, моно- або ді-(С1-С4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -CH(=NH)CH3, (С1-С4)-алкіл, (С6-С10)-арил і 5- або 6-членний гетероарил,
R5b означає водень або (С1-С4)-алкіл,
Q означає зв'язок, СН2 або NH,
k означає ціле число, що дорівнює 1 або 2, і
* означає положення приєднання до залишку, позначеного за допомогою А, і при цьому арил і гетероарил можуть додатково містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, ціаногрупу, аміногрупу, гідроксигрупу, (С1-С4)-алкіл, (С1-С4)-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, аміно-(С1-С4)-алкіл, гідроксі-(С1-С4)-алкіл або карбоксигрупу,
при цьому алкіл, алкоксигрупа, алкіламіногрупа, аміноалкіл, гідроксіалкіл і карбоксигрупа, в свою чергу, можуть містити замісник, вибраний з групи, яка включає галоген, (С1-С4)-алкіл і карбоніл, і
I означає ціле число, що дорівнює 0, 1, 2 або 3,
і її солі, її сольвати і сольвати її солей.
2. Сполука за п. 1, яка відрізняється тим, що R1 і R2 незалежно один від одного означають водень або (С1-С4)-алкіл, або
R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють (С3-С8)-циклоалкіл,
R3 означає -(CH2)m-(SO2)OH або O-(CH2)o-(SO2)OH,
де m і о незалежно один від одного означають цілі числа, що дорівнюють 0 або 1, і де будь-яка група СН2, що міститься в залишках, позначених за допомогою R3, може бути заміщена одним або двома (С1-С4)-алкільними залишками,
X означає CR4 або N,
R4 означає водень або галоген,
Z означає зв'язок або алкільний ланцюг, що містить 1, 2 або 3 атоми вуглецю, при цьому алкільний ланцюг може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає карбоксигрупу, амінокарбоніл і (С1-С4)-алкіл,
при цьому алкіл, в свою чергу, може містити замісник, вибраний з групи, яка включає гідроксигрупу і карбоксигрупу,
Y означає зв'язок, О, NH або S,
А означає (С6-С10)-арил або 5-10-членний гетероарил, при цьому арил і гетероарил містять замісник, який описується наступною формулою:
 або
або 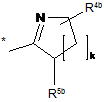 ,
,
в якій
R1b, R2b і R3b незалежно один від одного означають водень, аміногрупу, гідроксигрупу, (С1-С4)-алкіл, 4-, 5-, 6- або 7-членний гетероцикліл або 5- або 6-членний гетероарил, при цьому гетероцикліл і гетероарил можуть містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, (С1-С4)-алкілкарбоніл, (С1-С4)-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, моно- або дi-(С1-С4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -C(=NH)CH3 і (С1-С4)-алкіл, і
при цьому алкіл може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, карбонілоксигрупу, амінокарбоніл, карбоніламіногрупу, (С1-С4)-алкілкарбоніл, (С1-С4-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, моно- або ді-(С1-С4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -СН(=NН)СН3, (С6-С10)-арил, 5- або 6-членний гетероарил і 5- або 6-членний гетероцикліл,
при цьому гетероарил і гетероцикліл, в свою чергу, можуть бути заміщені (С1-С4)-алкілом, або
R2b і R3b разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членний гетероцикл, що містить 1, 2 або 3 додаткових гетероатоми, що вибрані з групи, яка включає N, О і S, і R1b є таким, як визначено вище,
R4b означає водень, аміногрупу, гідроксигрупу, (С1-С4)-алкіл або (С1-С4)-алкоксигрупу, при цьому аміногрупа і гідроксигрупа можуть містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає (С1-С4)-алкілкарбоніл, моно- або ді-(С1-С4)-алкіламінокарбоніл і (С1-С4)-алкіл, і
при цьому алкіл може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, амінокарбоніл, (С1-С4)-алкілкарбоніл, (С1-С4)-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, моно- або ді-(С1-С4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -CH(=NH)CH3, (С1-С4)-алкіл, (С6-С10)-арил і 5- або 6-членний гетероарил,
R5b означає водень або (С1-С4)-алкіл,
Q означає зв'язок, СН2 або NH,
k означає ціле число, що дорівнює 1 або 2, і
* означає положення приєднання до залишку, позначеного за допомогою А, і при цьому арил і гетероарил можуть додатково містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, ціаногрупу, аміногрупу, гідроксигрупу, (С1-С4)-алкіл, (С1-С4)-алкоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, аміно-(С1-С4)-алкіл, гідроксі-(С1-С4)-алкіл або карбоксигрупу,
при цьому алкіл, алкоксигрупа, алкіламіногрупа, аміноалкіл, гідроксіалкіл і карбоксигрупа, в свою чергу, можуть містити замісник, вибраний з групи, яка включає галоген, (С1-С4)-алкіл і карбоніл, і I означає ціле число, що дорівнює 0 або 1, і її солі, її сольвати і сольвати її солей.
3. Сполука за п. 1 або 2, яка відрізняється тим, що
R1 і R2 незалежно один від одного означають водень або (С1-С4)-алкіл, або
R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють (С3-C8)-циклоалкіл,
R3 означає -(SO2)OH або -O-(CH2)o-(SO2)OH,
де о означає ціле число, що дорівнює 0 або 1, і
де будь-яка група СН2, що міститься в залишках, позначених за допомогою R3, може бути заміщена одним або двома (С1-С4)-алкільними залишками,
X означає СН,
Z означає алкільний ланцюг, що містить 2 або 3 атоми вуглецю, при цьому алкільний ланцюг може містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає карбоксигрупу, амінокарбоніл, метил, гідроксиметил, гідроксіетил,
Y означає О,
А означає феніл або 5- або 6-членний гетероарил,
при цьому феніл і гетероарил містять замісник, який описується наступною формулою:
 або
або 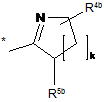 ,
,
в якій
R1b, R2b і R3b незалежно один від одного означають водень, аміногрупу, гідроксигрупу, (С1-С4)-алкіл або 4-, 5-, 6- або 7-членний гетероцикліл, при цьому гетероцикліл може містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає аміногрупу, карбоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу і (С1-С4)-алкіл, і
при цьому алкіл може містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає гідроксигрупу, аміногрупу, карбоксигрупу, карбонілоксигрупу, амінокарбоніл, карбоніламіногрупу, моно- або ді-(С1-С4)-алкіламіногрупу, моно- або ді-(С1-С4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), феніл, 6-членний гетероарил і 5- або 6-членний гетероцикліл, або
R2b і R3b разом з атомом азоту, до якого вони приєднані, утворюють 6-членний гетероцикл, що містить 1 або 2 атоми азоту, і R1b означає водень,
R4b означає водень або аміногрупу, при цьому аміногрупа може бути заміщена одним або двома (С1-С4)-алкілами,
R5b означає водень,
Q означає зв'язок,
k означає ціле число, що дорівнює 1 або 2, і
* означає положення приєднання до залишку, позначеного за допомогою А, і при цьому феніл і гетероарил можуть додатково містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, ціаногрупу, аміногрупу, гідроксигрупу, (С1-С4)-алкіл або гідроксі-(С1-С4)-алкіл, при цьому гідроксіалкіл, в свою чергу, може бути заміщений карбонілом, і I дорівнює 0,
і її солі, її сольвати і сольвати її солей.
4. Сполука за будь-яким із пп. 1-3, яка відрізняється тим, що
R1 і R2 незалежно один від одного означають водень або метил,
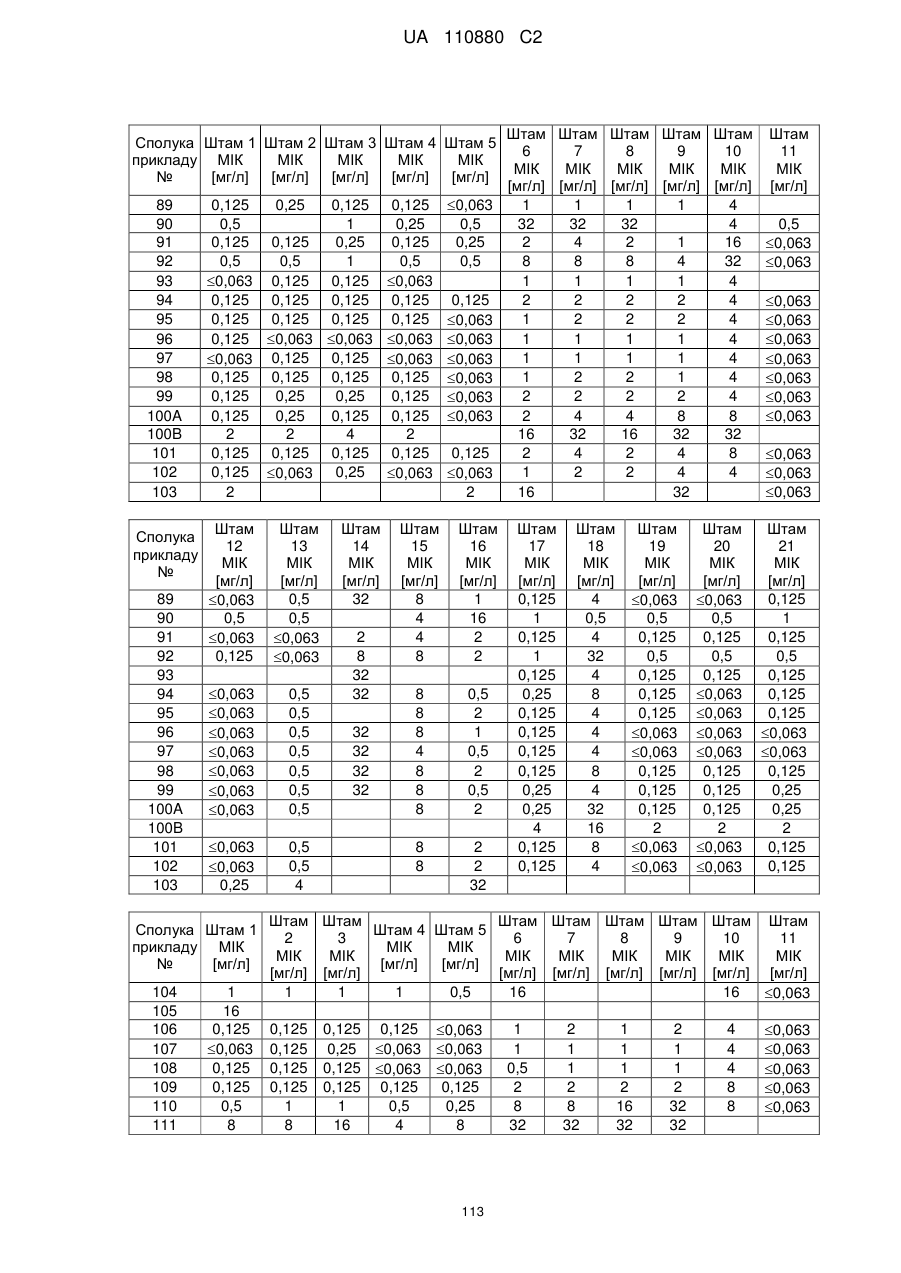
R3 означає -(SO2)OH або -O-(SO2)OH, X означає СН,
Z означає алкільний ланцюг, що містить 2 або 3 атоми вуглецю, при цьому алкільний ланцюг може містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає карбоксигрупу і метил,
Y означає О,
А означає феніл або 6-членний гетероарил, при цьому феніл і гетероарил містять замісник, який описується наступною формулою:
 ,
,
в якій
R1b і R2b означають водень,
R3b означає водень, аміногрупу, гідроксигрупу, (С1-С4)-алкіл або 4-, 5- або 6-членний гетероцикліл, що містить атом азоту,
при цьому алкіл може містити замісник, вибраний з групи, яка включає гідроксигрупу, аміногрупу, карбоксигрупу, карбонілоксигрупу, моно- або ді-(С1-С4)-алкіламіногрупу, -NH-CH(=NH), -NH-C(=NH)(NH2), 5- або 6-членний гетероарил, що містить атом азоту, і 5- або 6-членний гетероцикліл, що містить атом азоту,
Q означає зв'язок,
* означає положення приєднання до залишку, позначеного за допомогою А, і при цьому арил і гетероарил можуть додатково містити 1 замісник, вибраний з групи, яка включає галоген, ціаногрупу, аміногрупу, гідроксигрупу, (С1-С4)-алкіл або гідроксі-(С1-С4)-алкіл, і
I дорівнює 0,
і її солі, її сольвати і сольвати її солей.
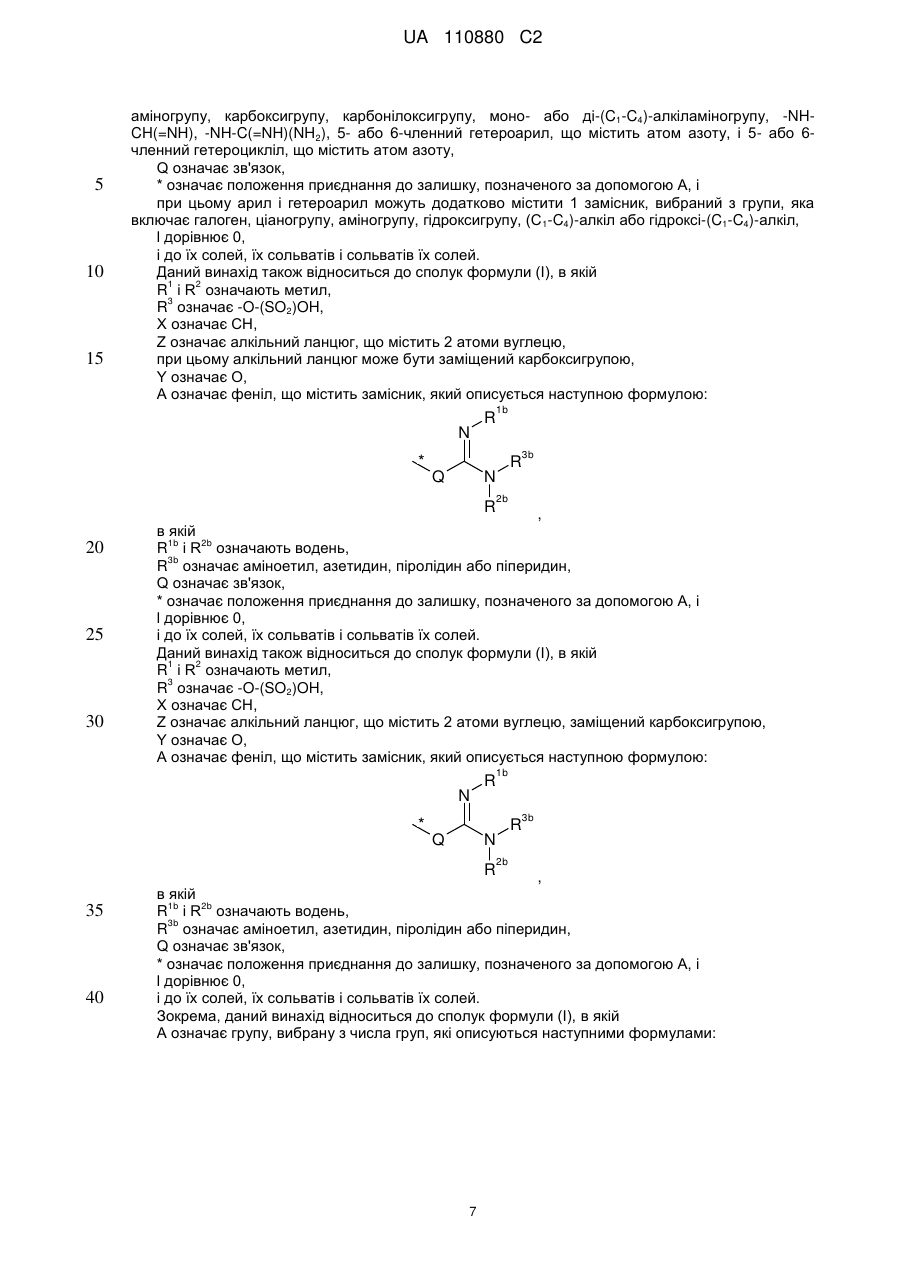
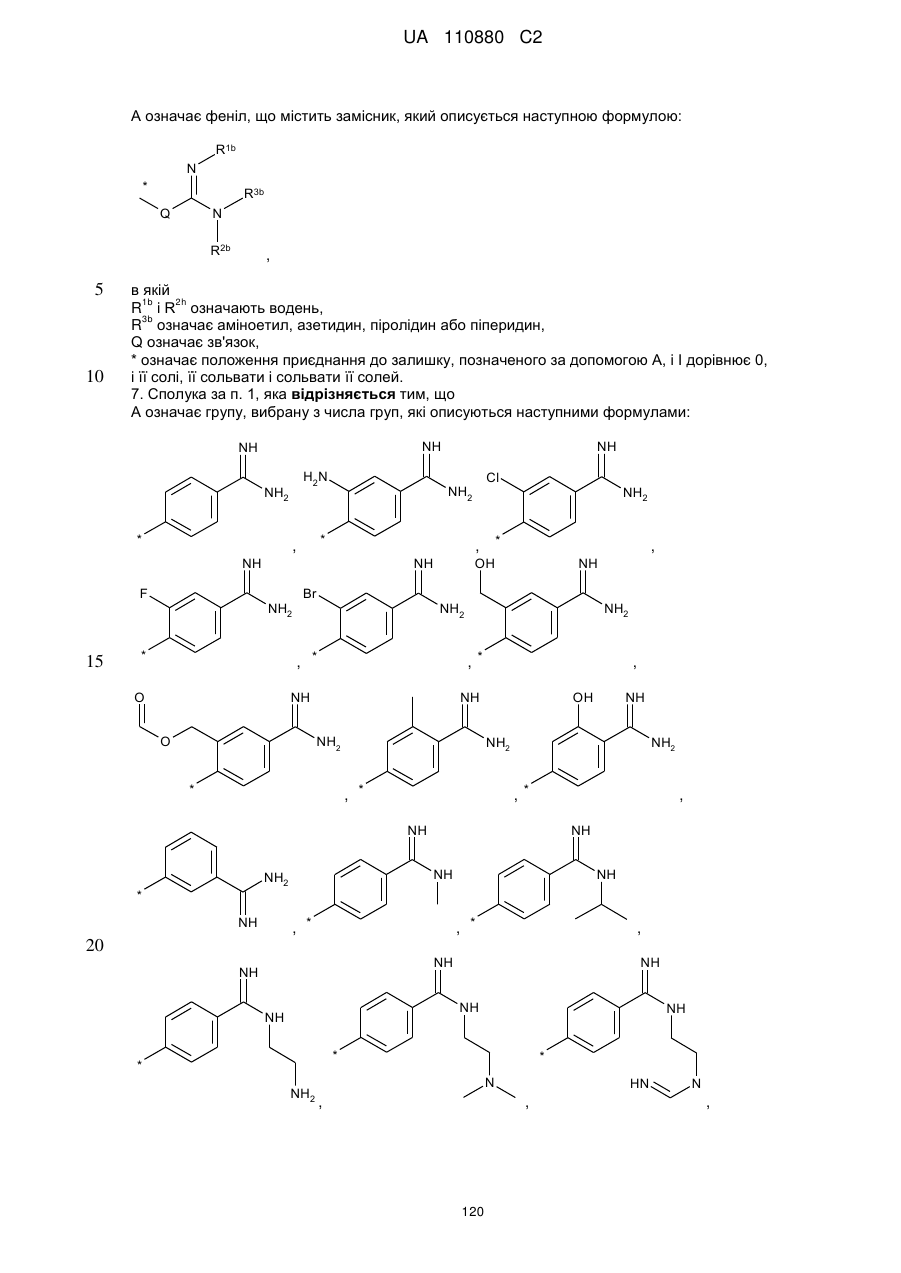
5. Сполука за будь-яким із пп. 1-4, яка відрізняється тим, що
R1 і R2 означають метил,
R3 означає -O-(SO2)OH,
X означає СН,
Z означає алкільний ланцюг, що містить 2 атоми вуглецю, при цьому алкільний ланцюг може бути заміщений карбоксигрупою,
Y означає О,
А означає феніл, що містить замісник, який описується наступною формулою:
 ,
,
в якій
R1b i R2b означають водень,
R3b означає аміноетил, азетидин, піролідин або піперидин,
Q означає зв'язок,
* означає положення приєднання до залишку, позначеного за допомогою А, і I дорівнює 0,
і її солі, її сольвати і сольвати її солей.
6. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що
R1 і R2 означають метил,
R3 означає -O-(SO2)OH,
X означає СН,
Z означає алкільний ланцюг, що містить 2 атоми вуглецю, заміщений карбоксигрупою,
Y означає О,
А означає феніл, що містить замісник, який описується наступною формулою:
 ,
,
в якій
R1b і R2h означають водень,
R3b означає аміноетил, азетидин, піролідин або піперидин,
Q означає зв'язок,
* означає положення приєднання до залишку, позначеного за допомогою А, і I дорівнює 0,
і її солі, її сольвати і сольвати її солей.
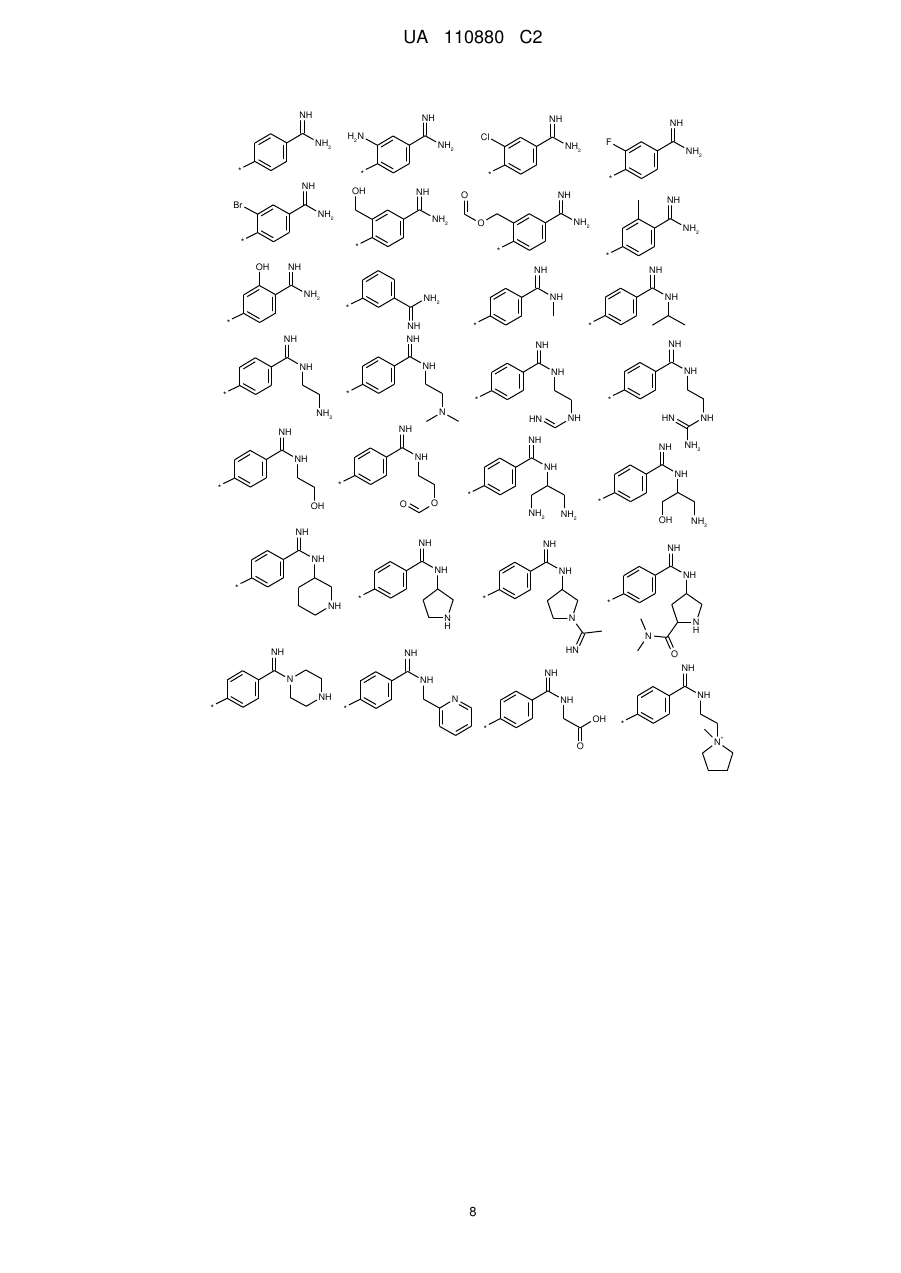
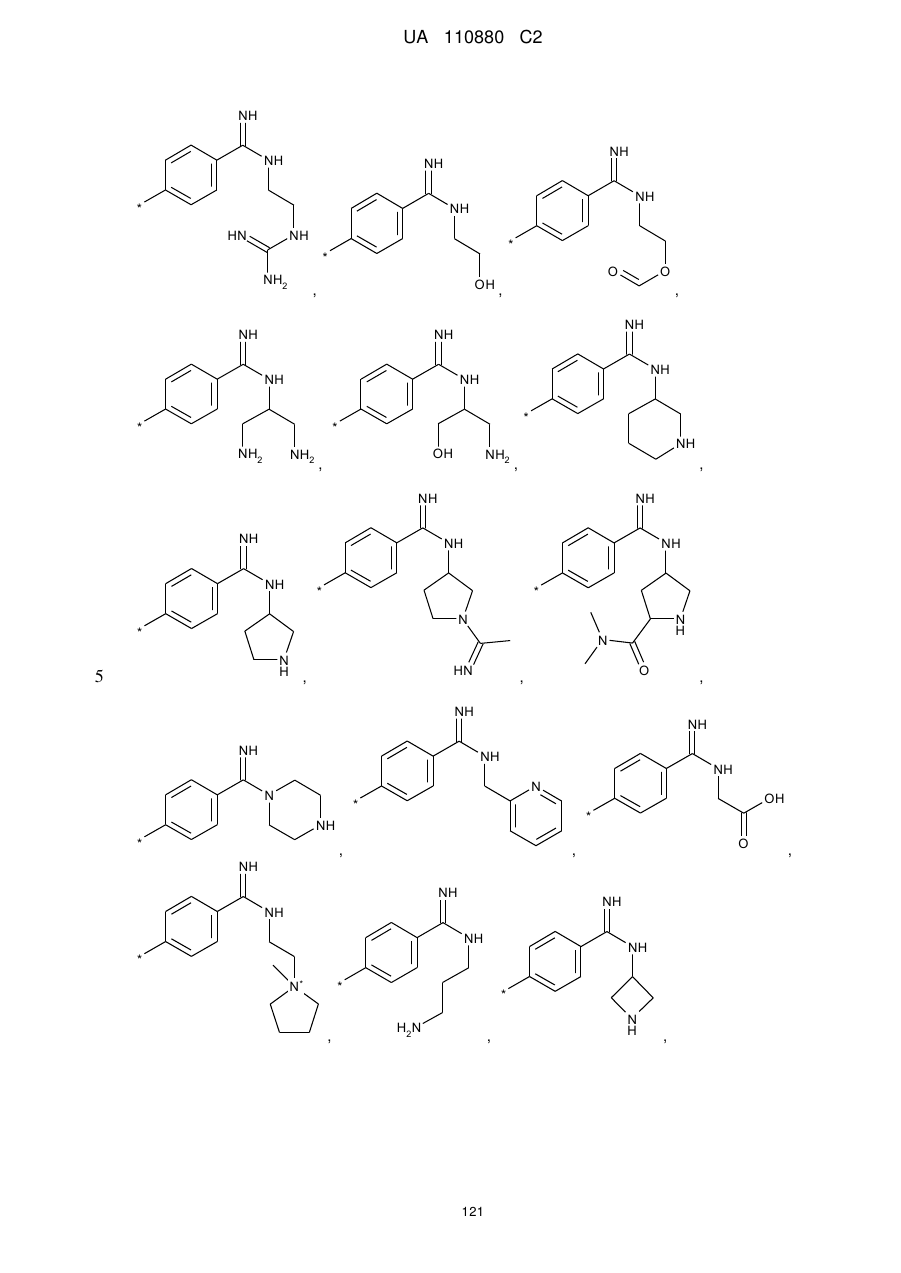
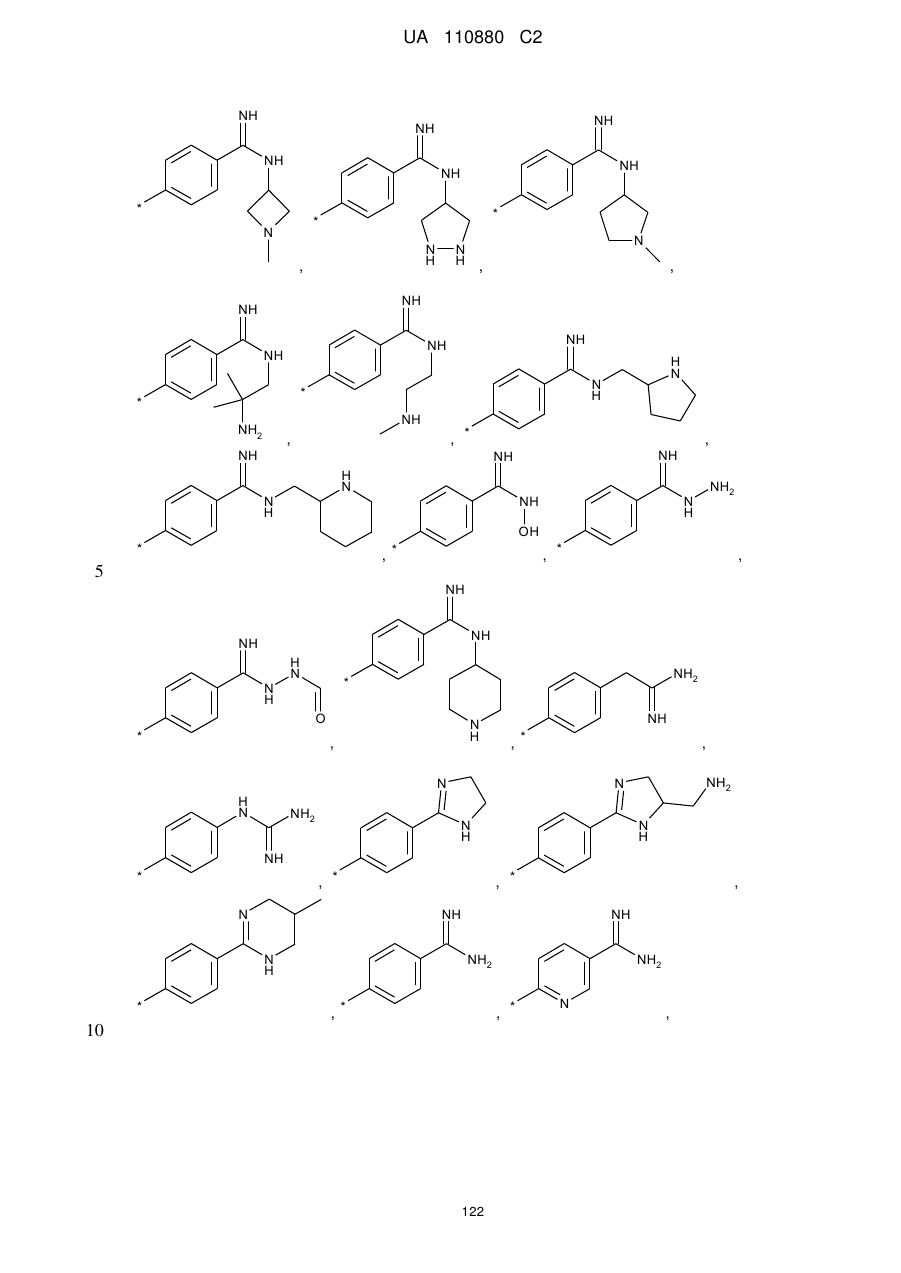
7. Сполука за п. 1, яка відрізняється тим, що
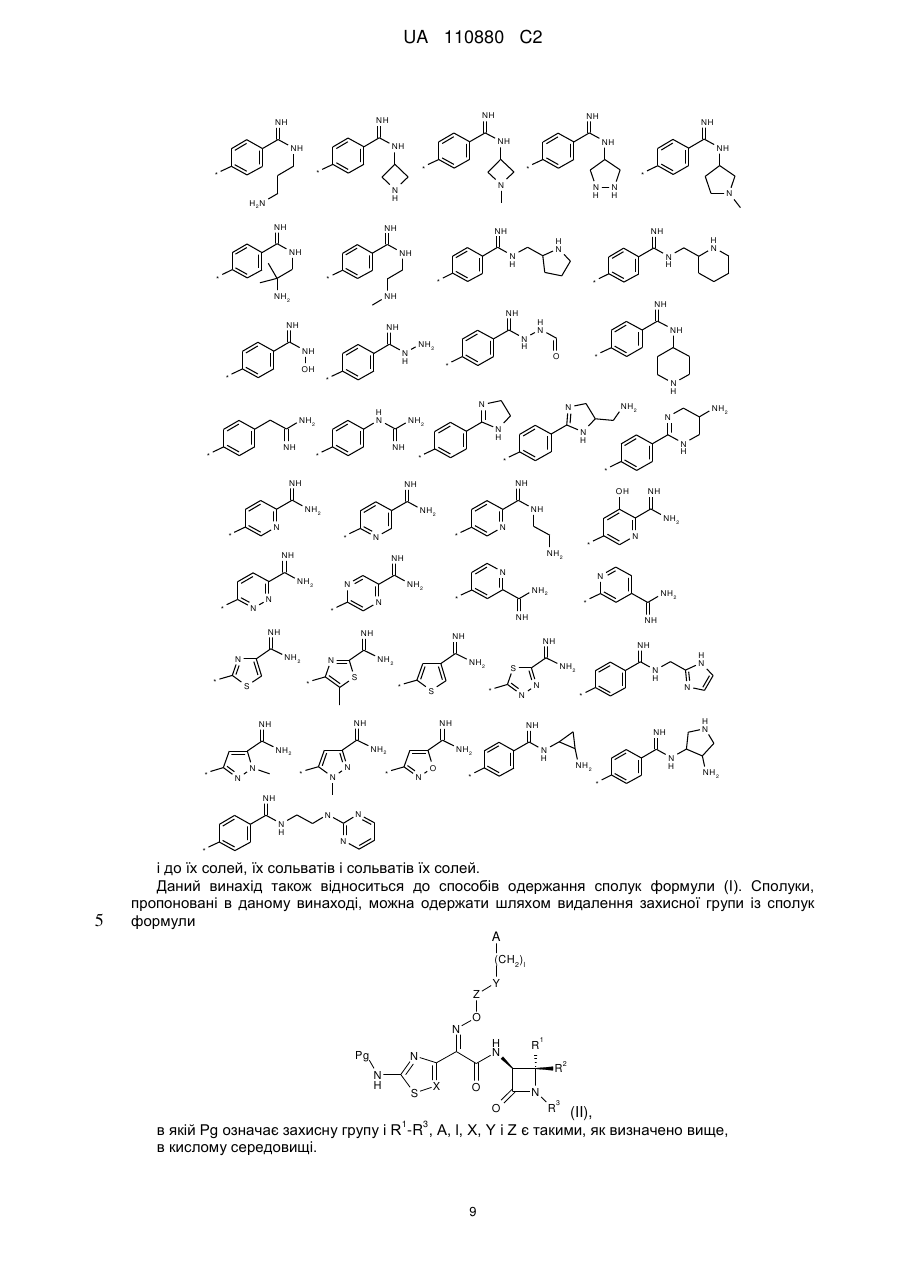
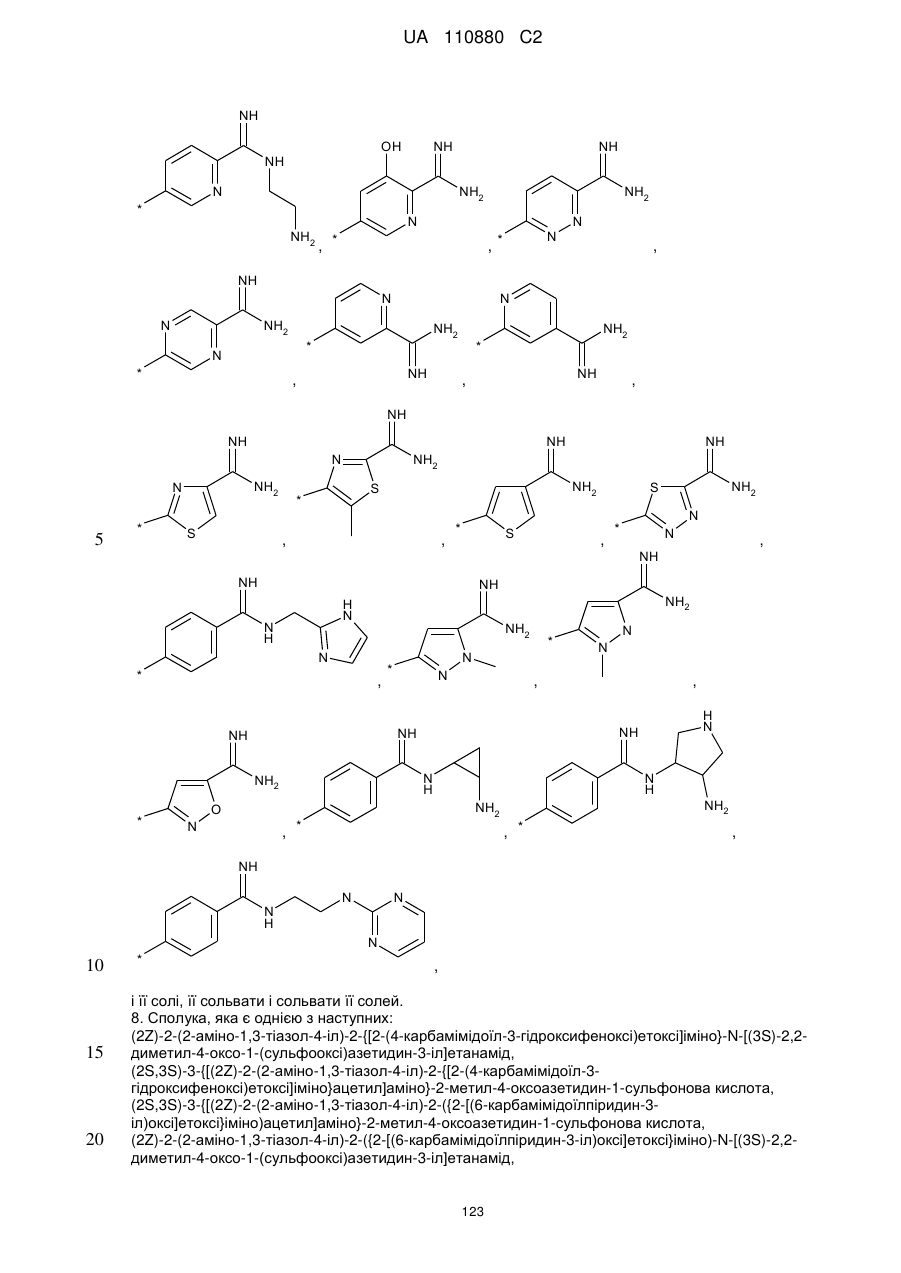
А означає групу, вибрану з числа груп, які описуються наступними формулами:
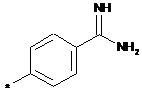 ,
,  ,
, 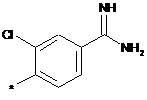 ,
, 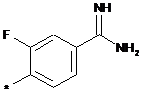 ,
,
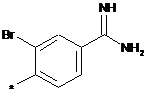 ,
, 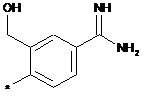 ,
,  ,
, 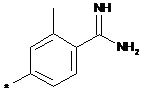 ,
,
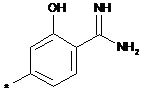 ,
, 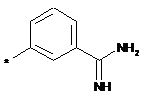 ,
, 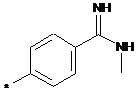 ,
, 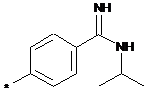 ,
,
 ,
,  ,
,  ,
,  ,
,
 ,
, 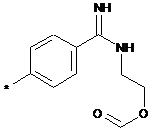 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,
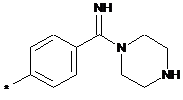 ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
, 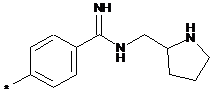 ,
, 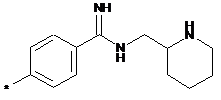 ,
,
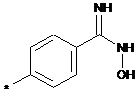 ,
,  ,
, 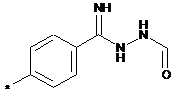 ,
,  ,
,
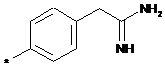 ,
, 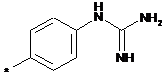 ,
, 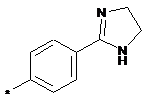 ,
,  ,
,  ,
,
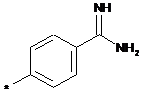 ,
, 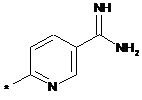 ,
,  ,
, 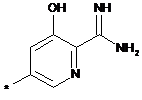 ,
,
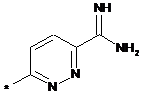 ,
,  ,
, 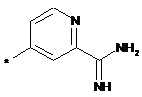 ,
, 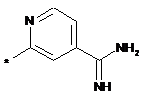 ,
,
 ,
, 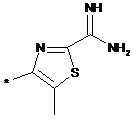 ,
, 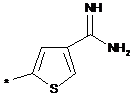 ,
, 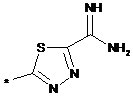 ,
, 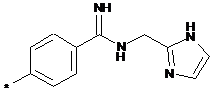 ,
,
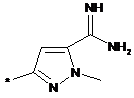 ,
, 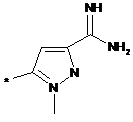 ,
, 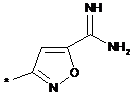 ,
,  ,
,  ,
,
 ,
,
і її солі, її сольвати і сольвати її солей.
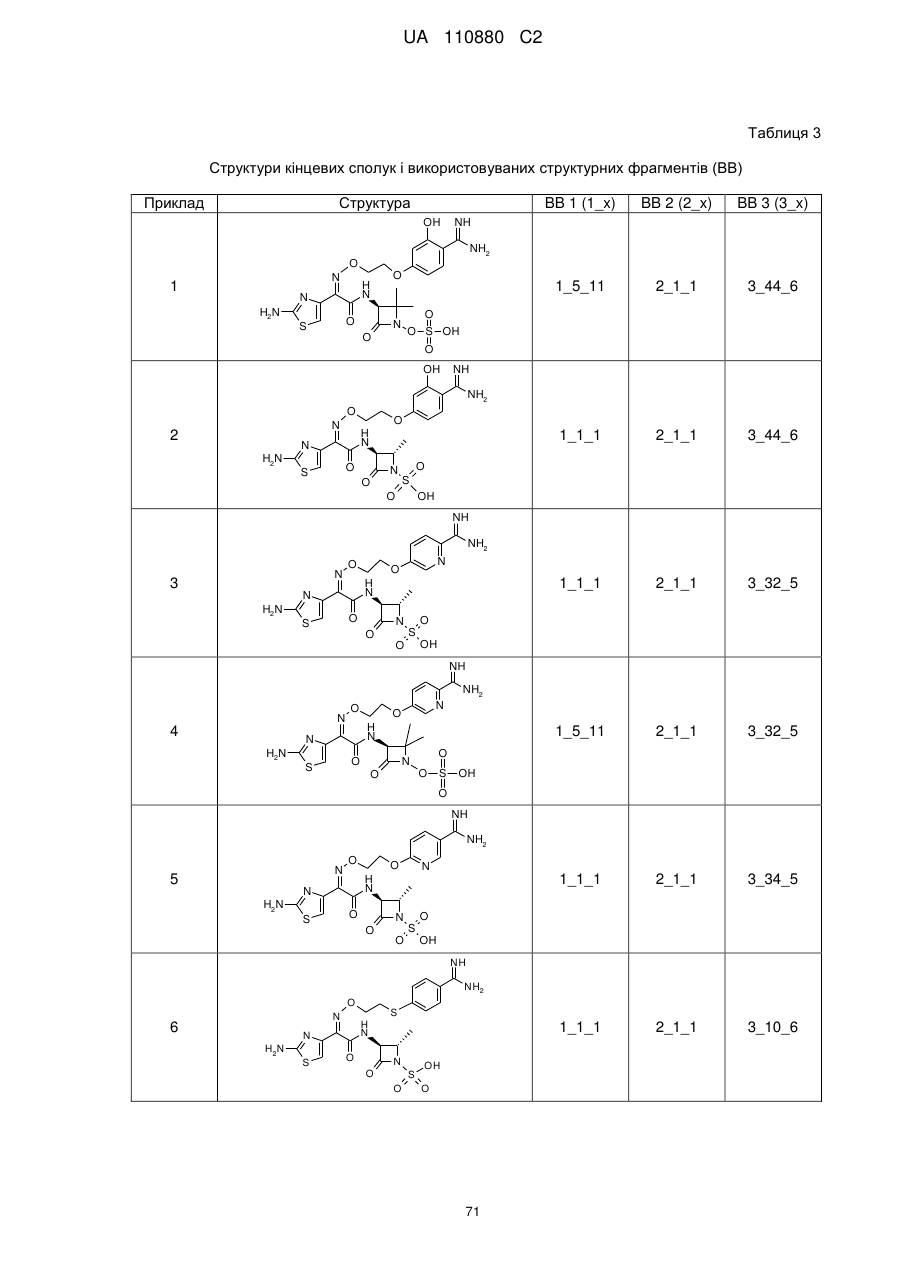
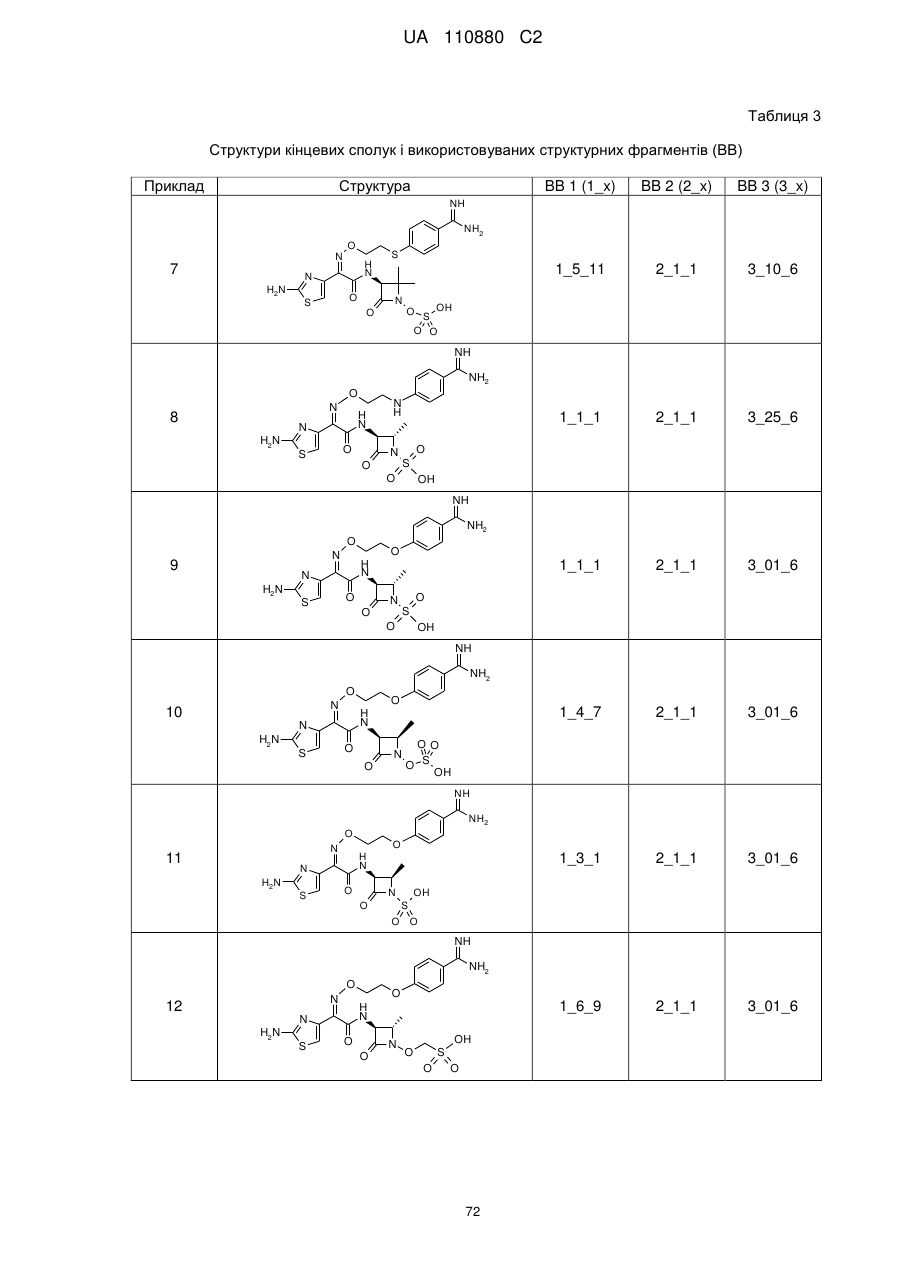
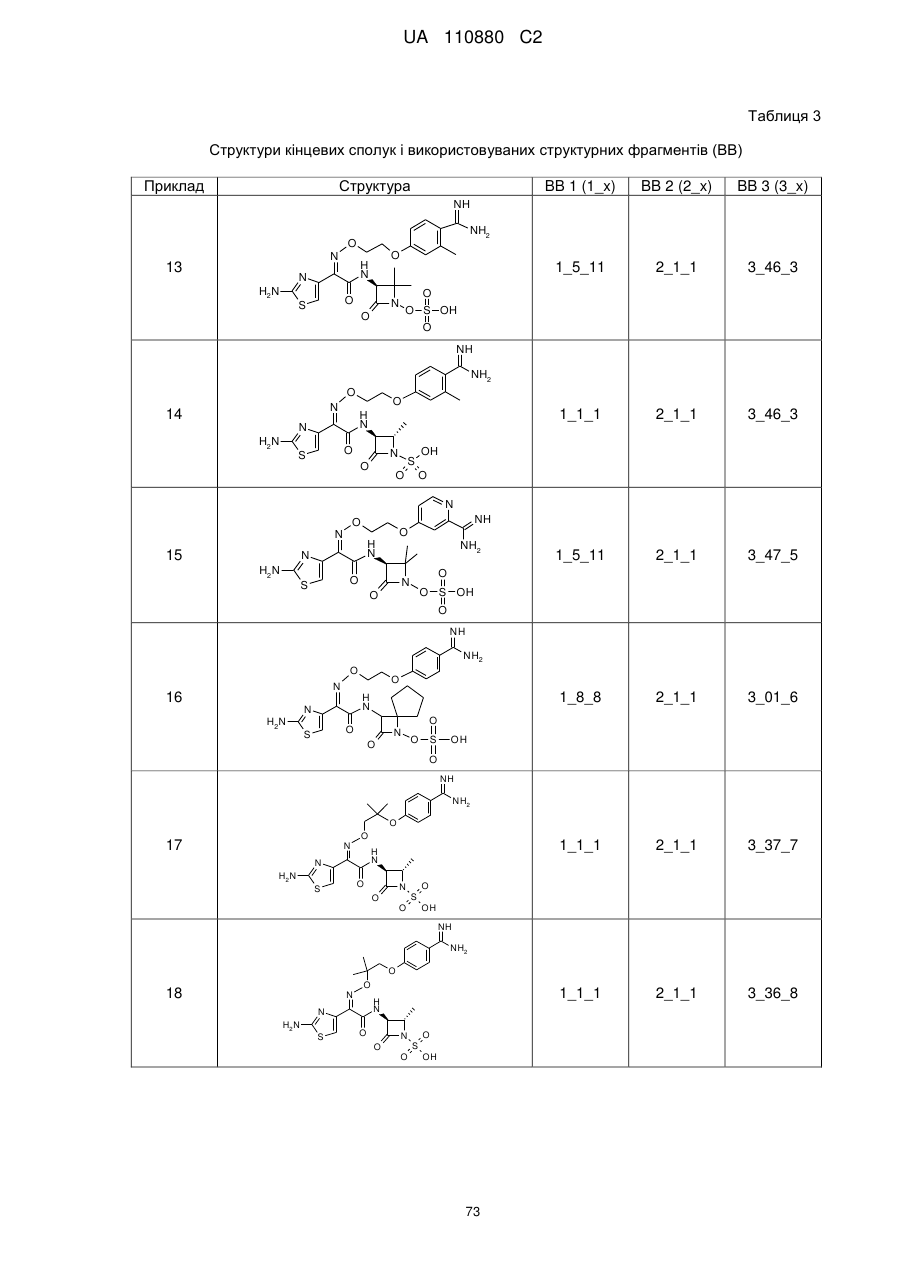
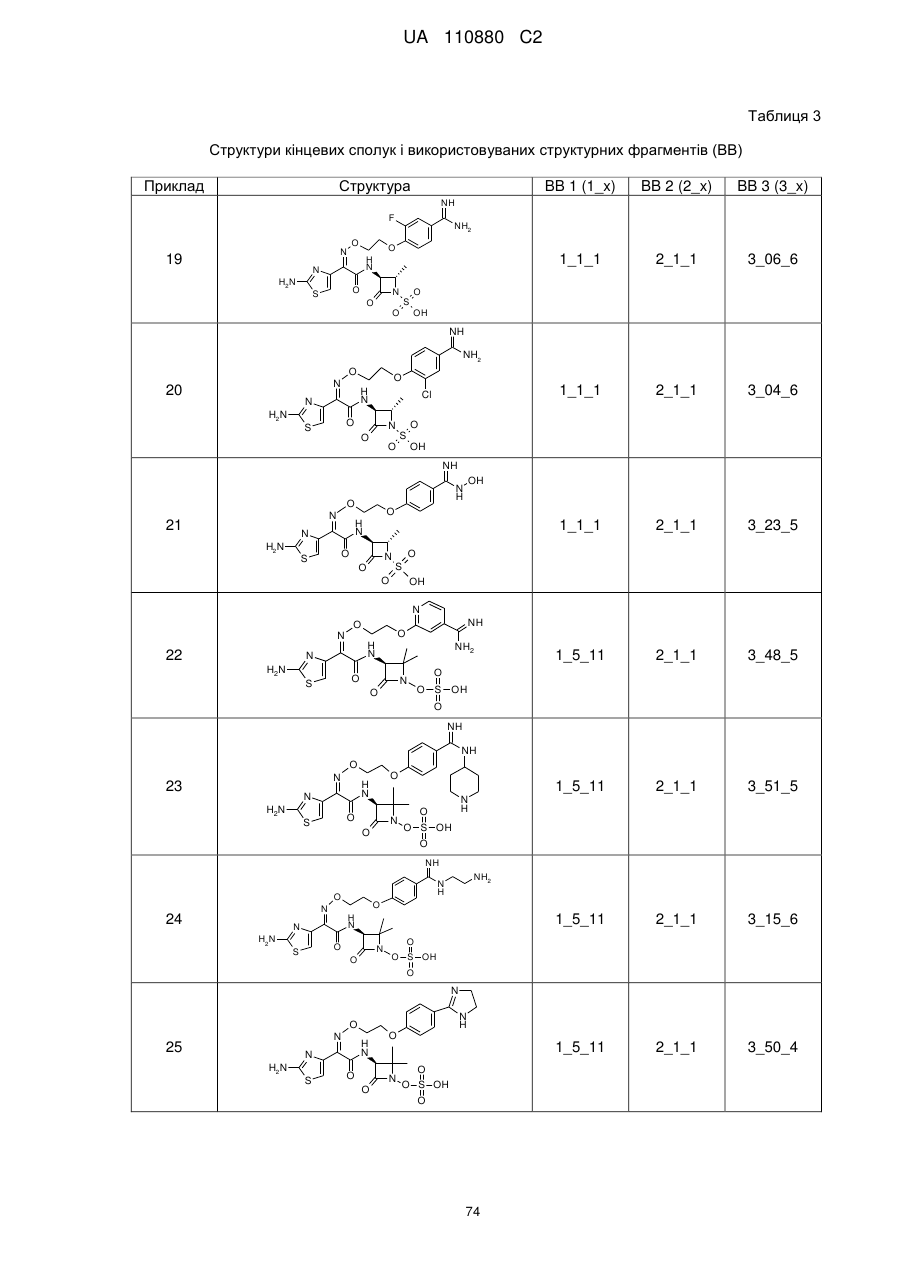
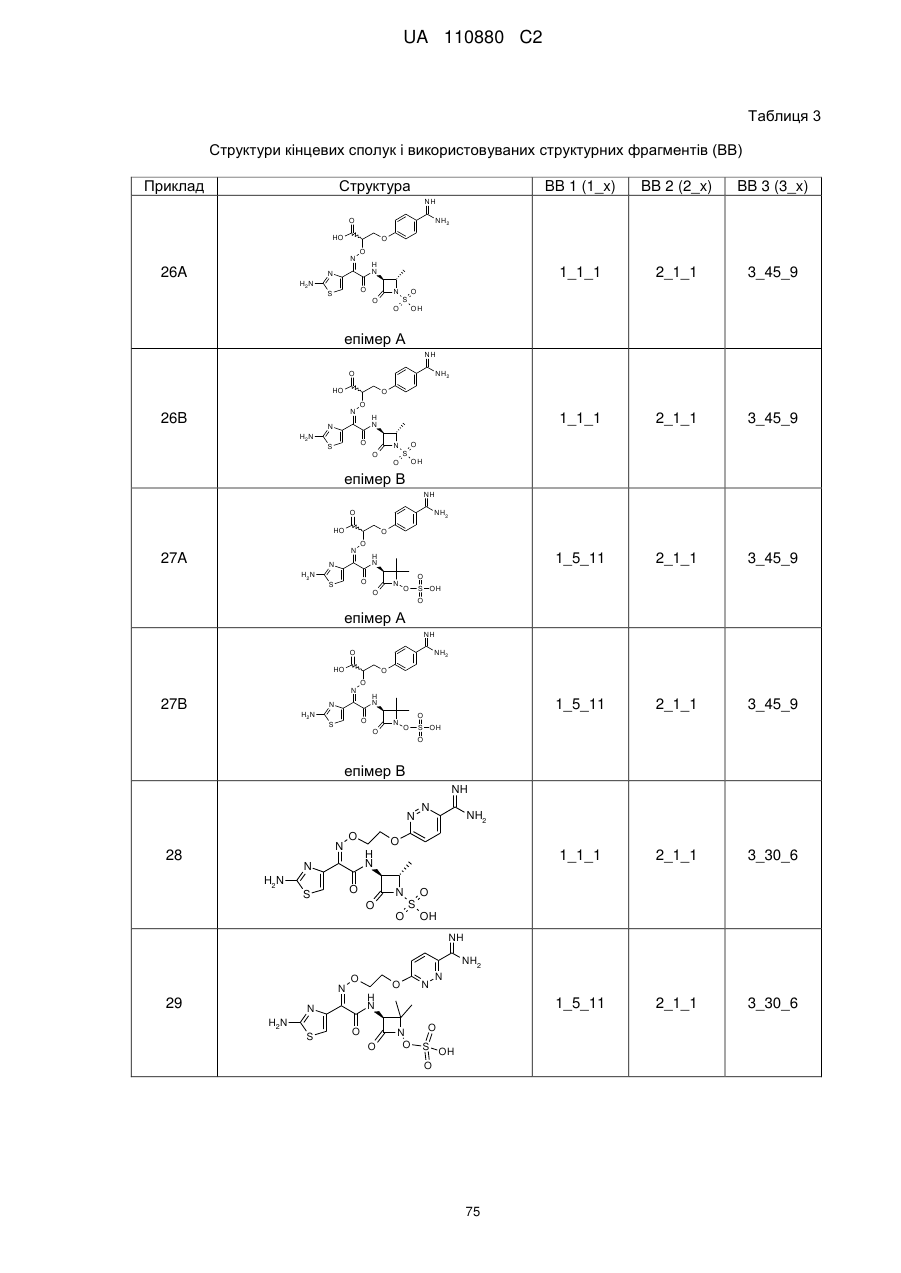
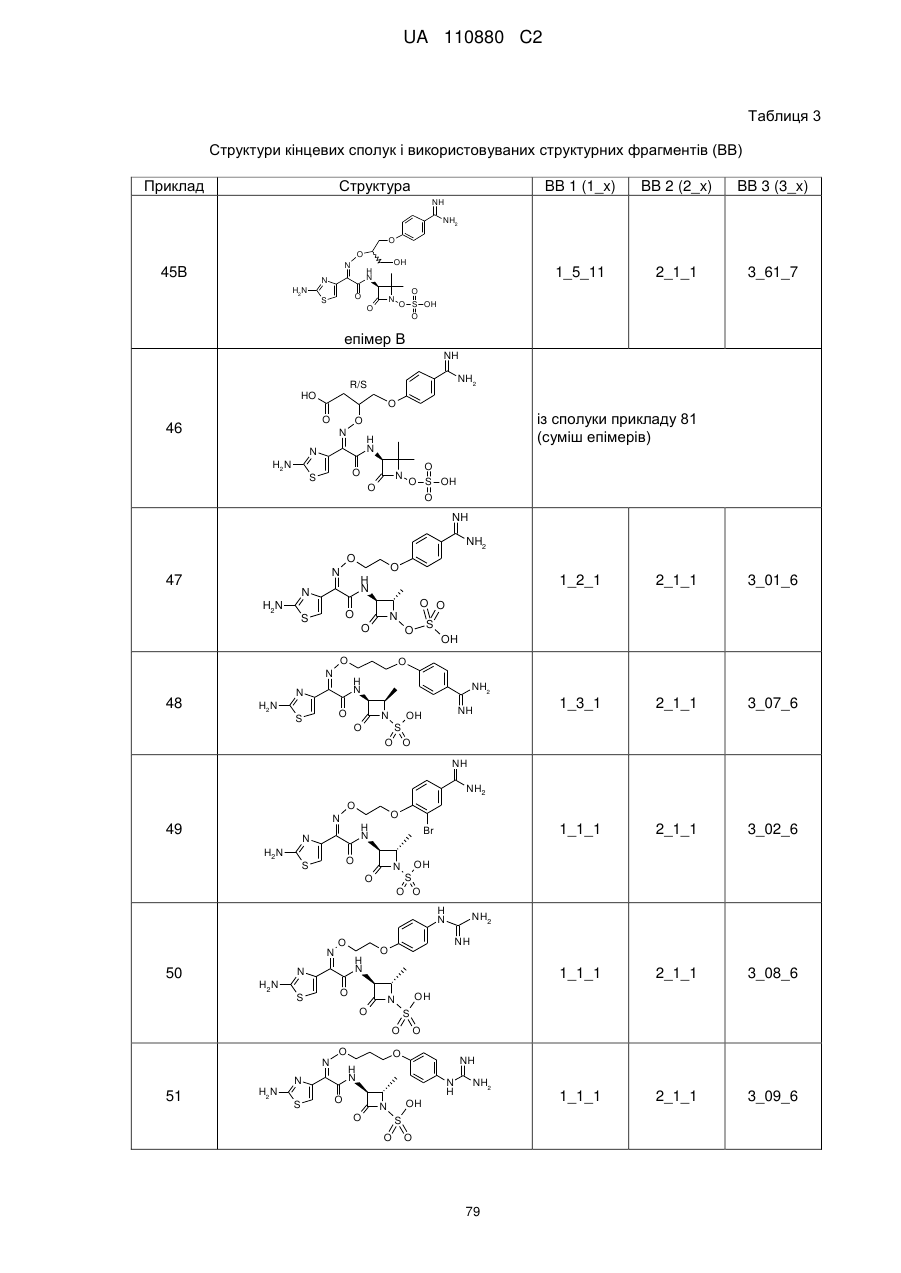
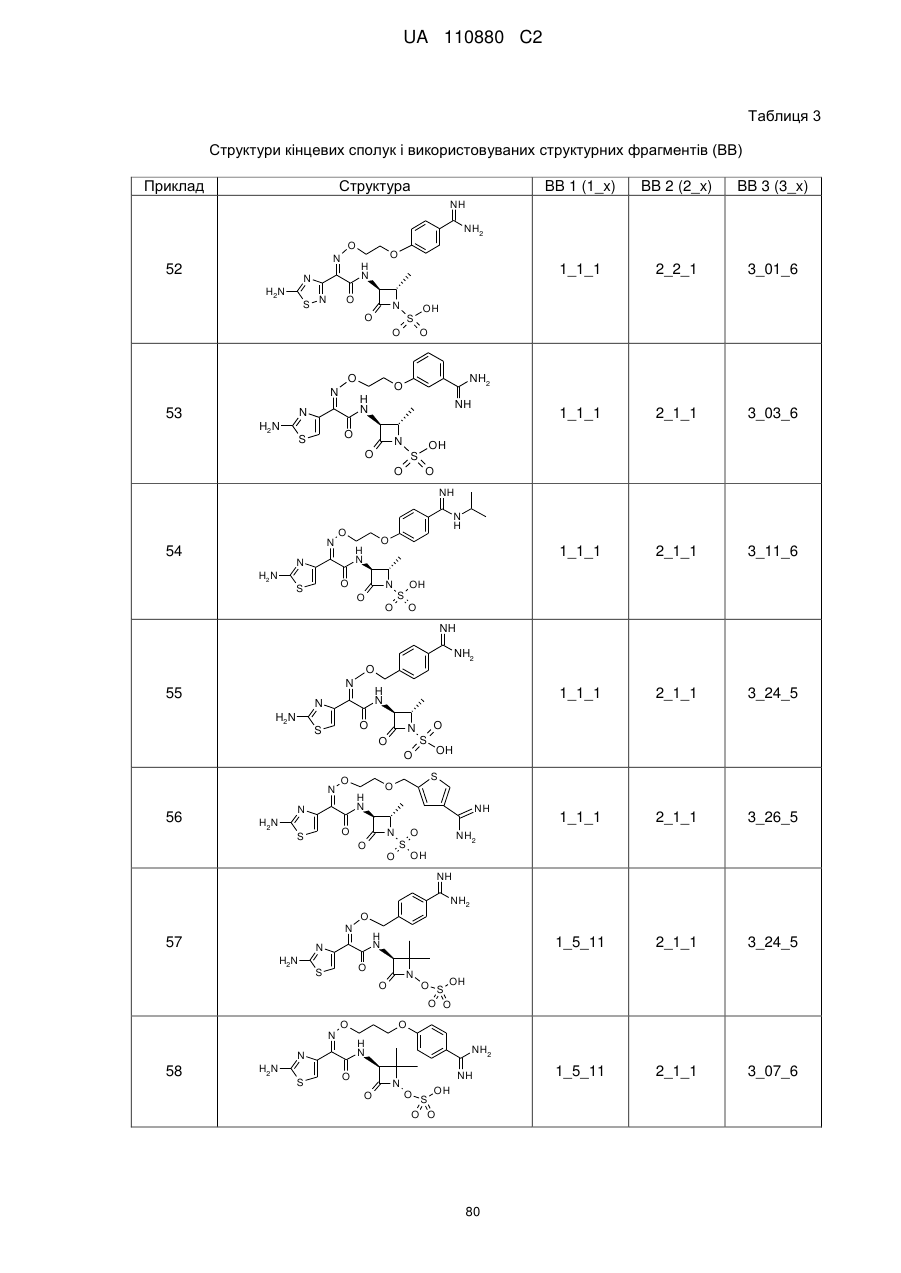
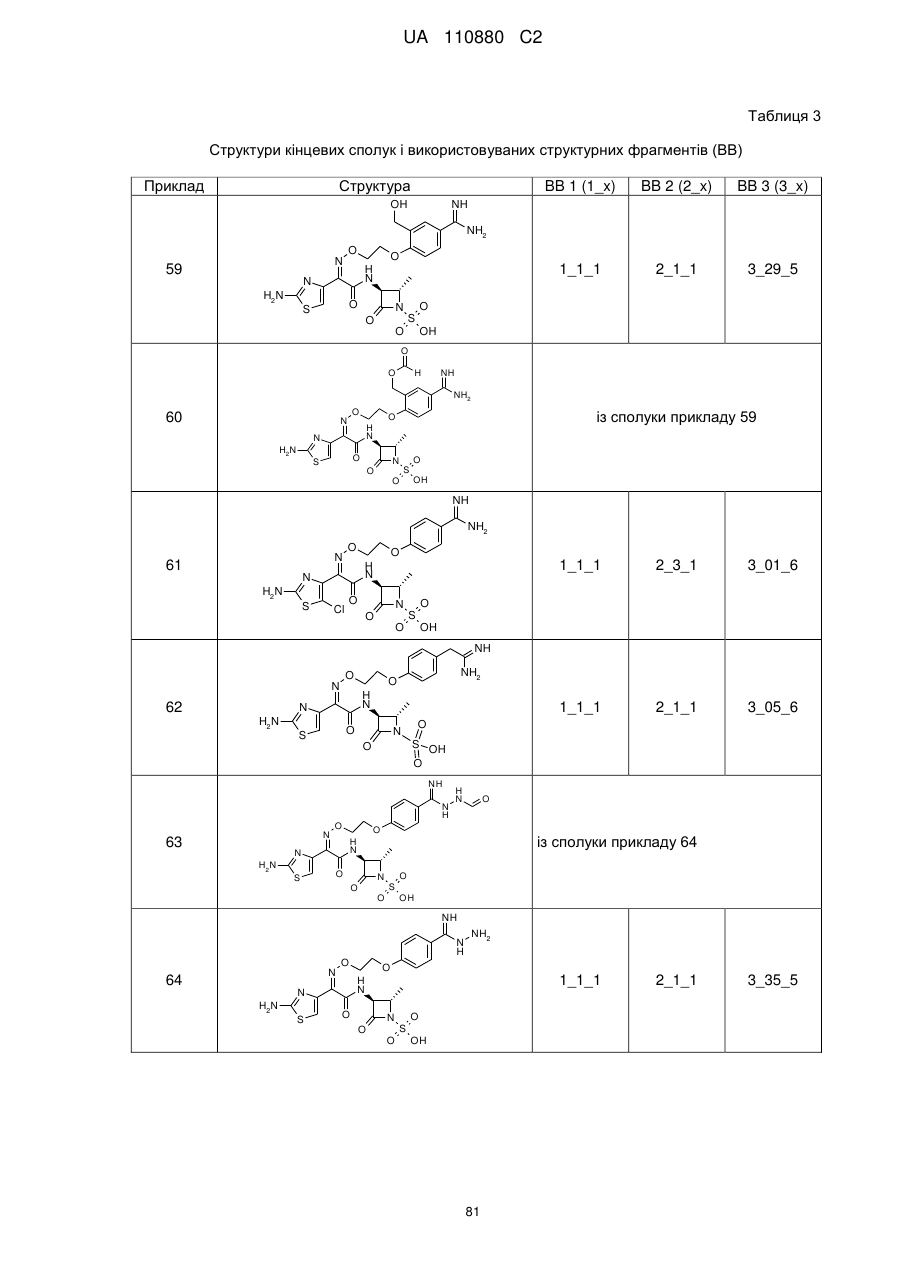
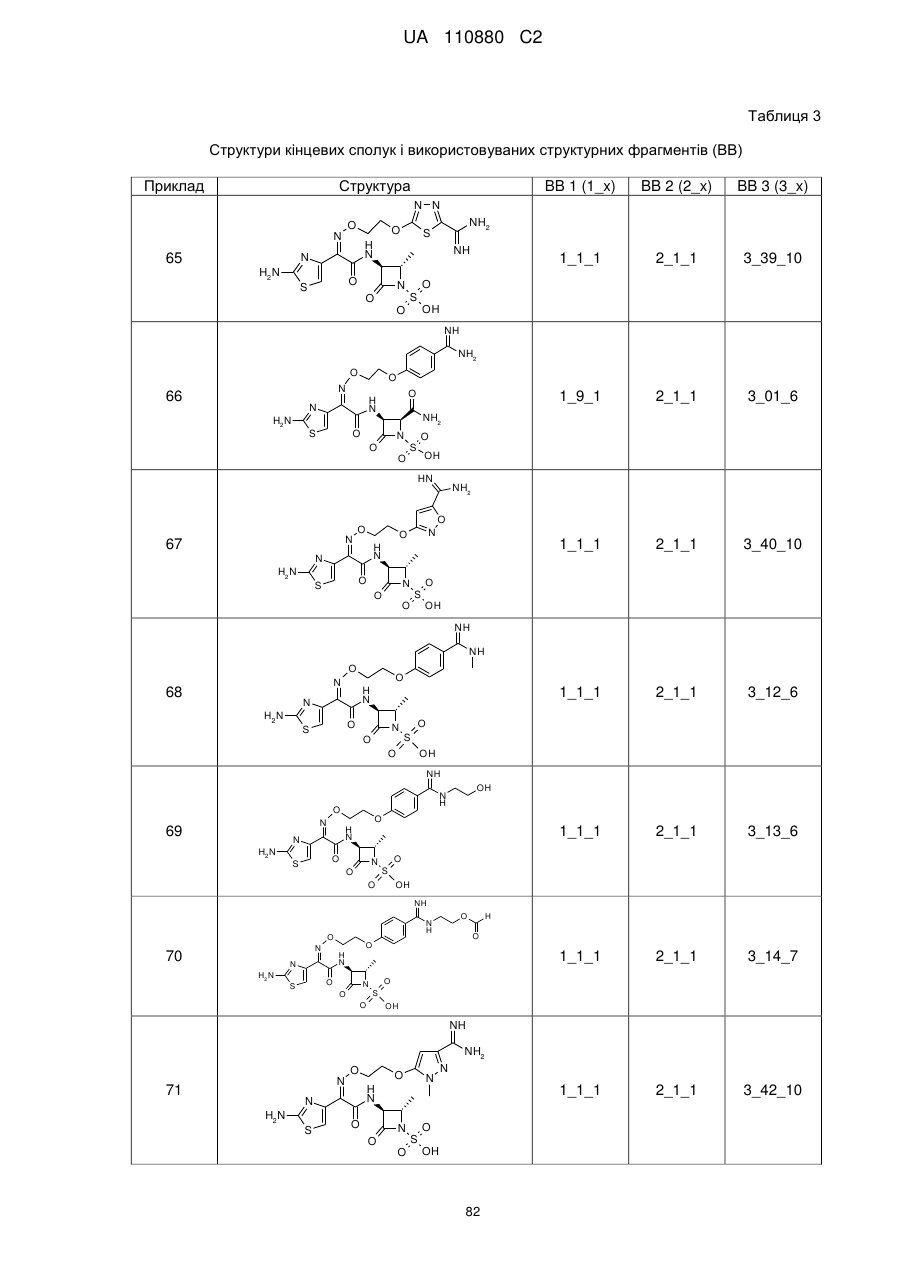
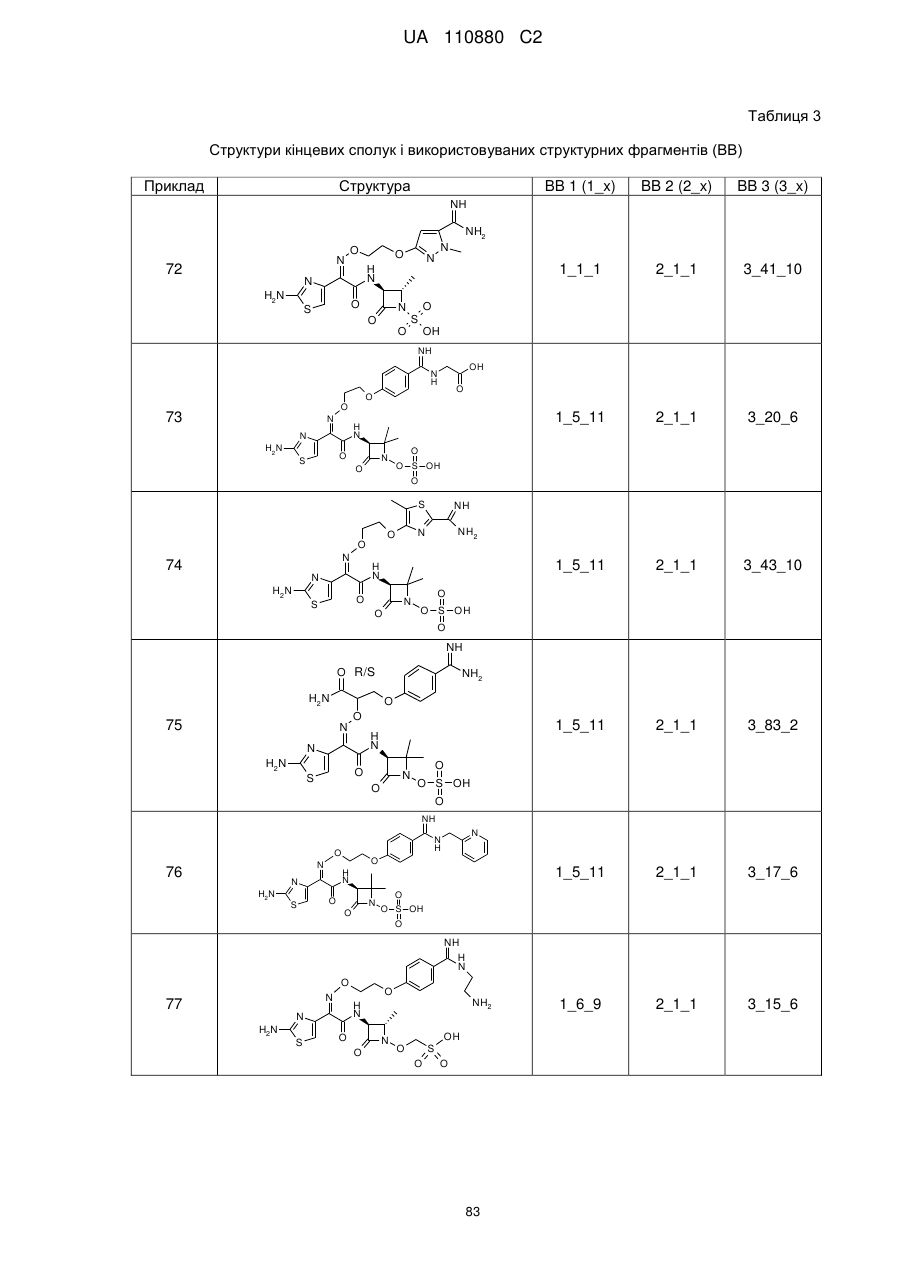
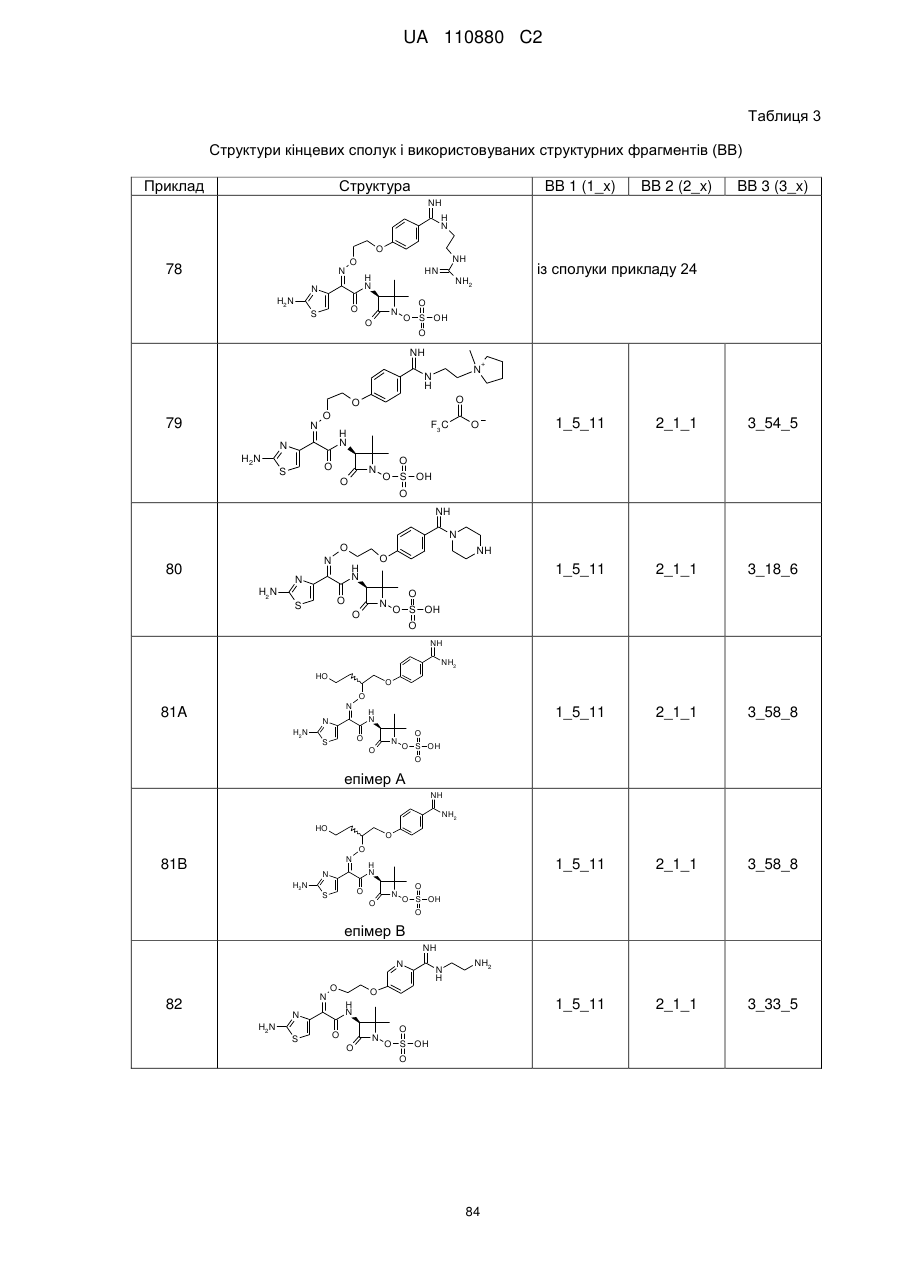
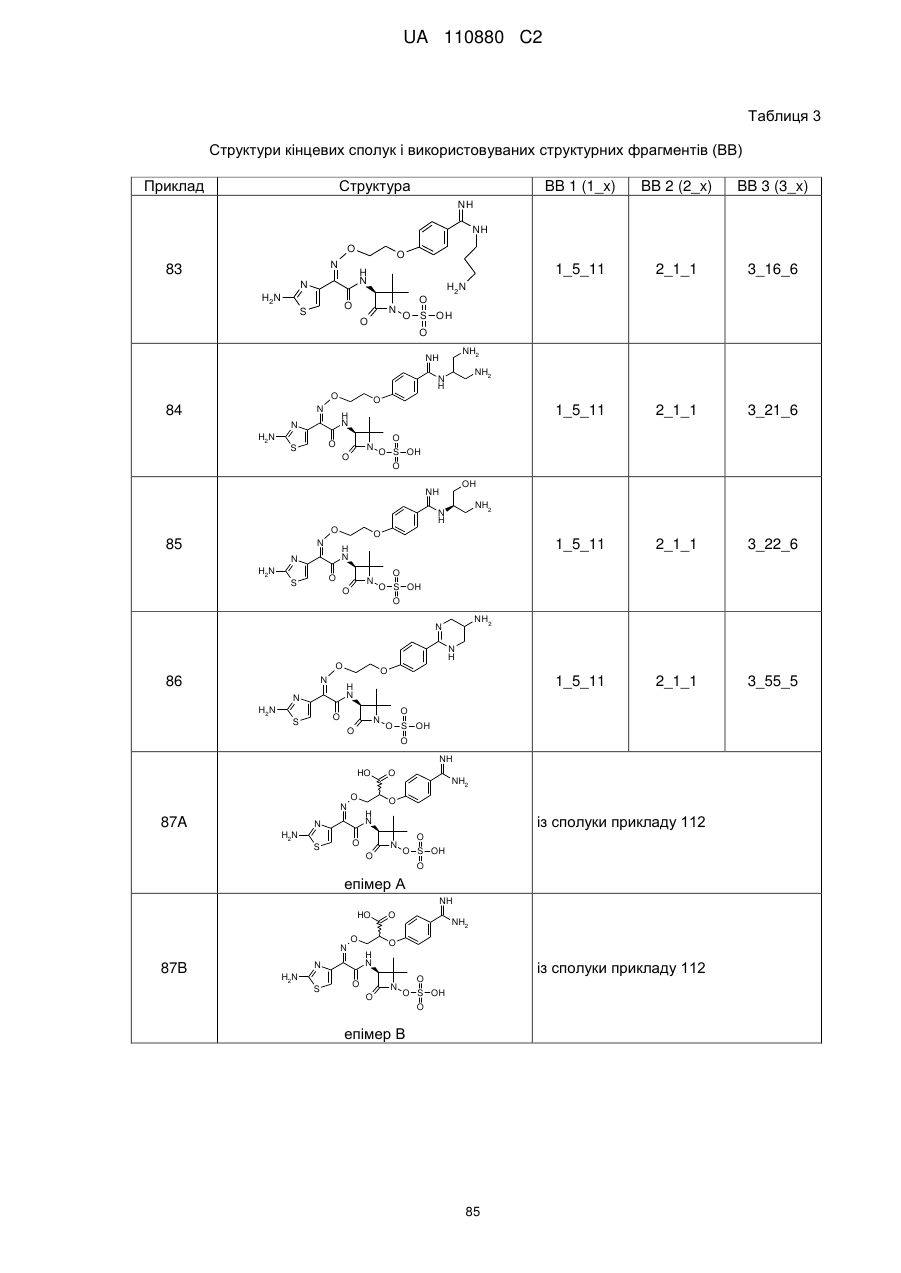
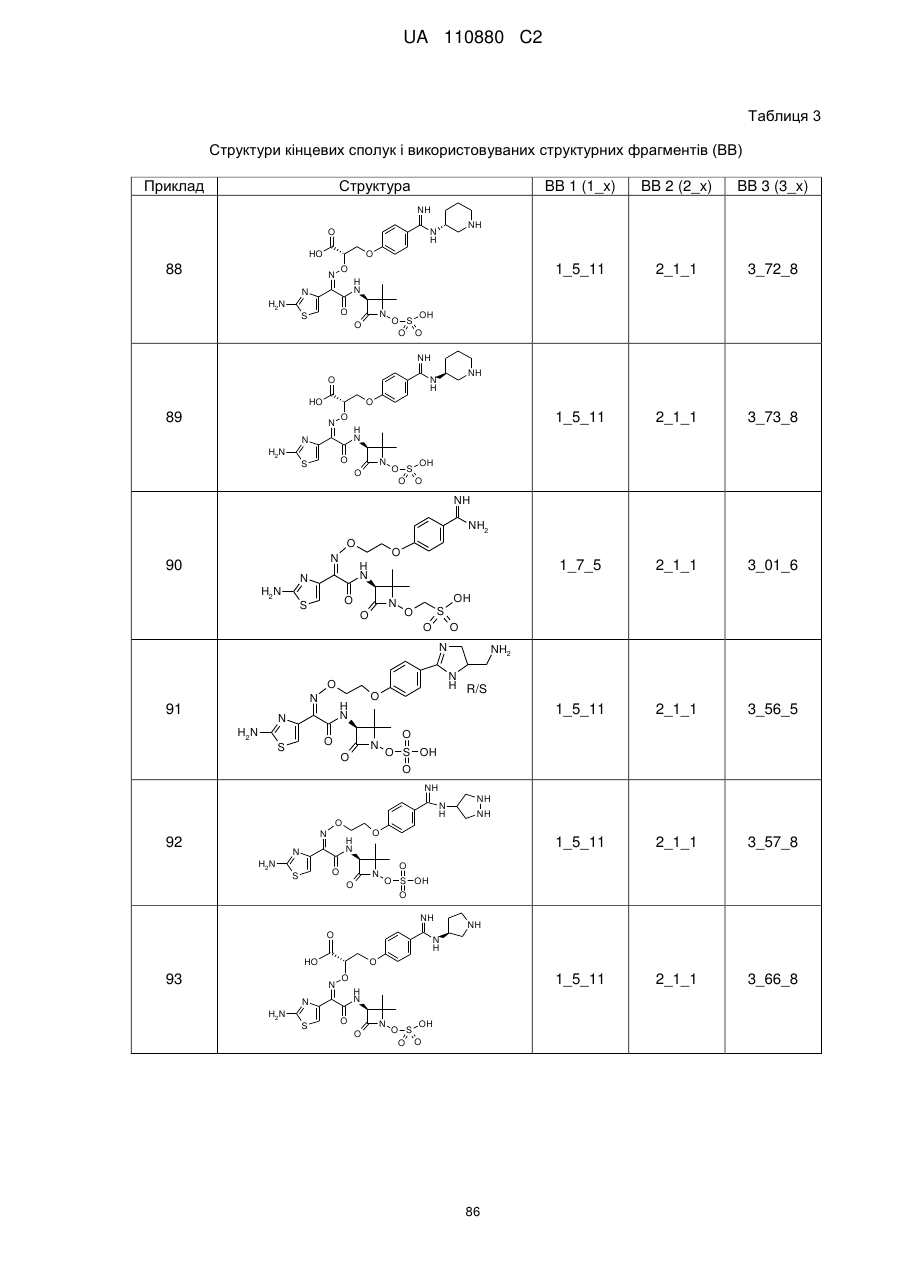
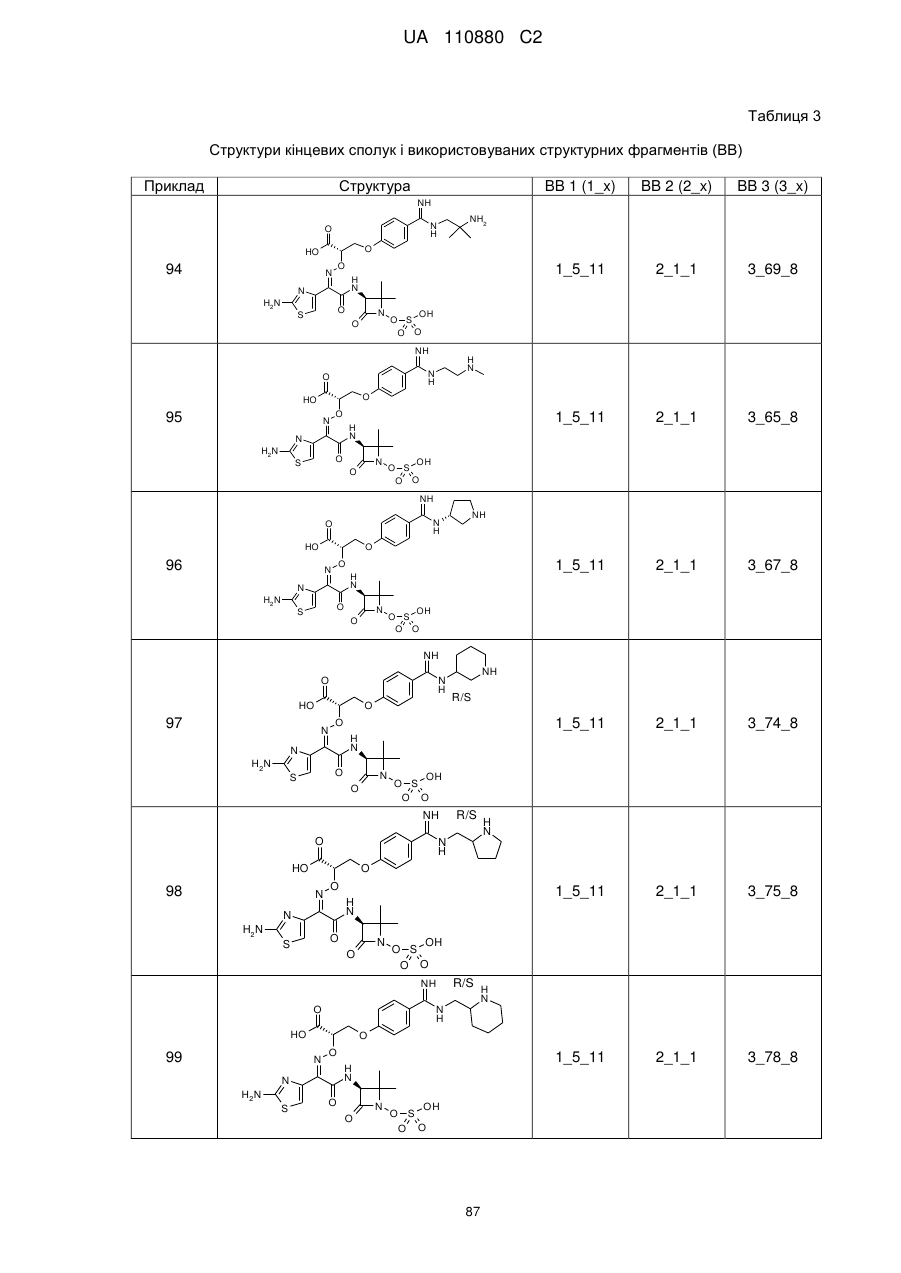
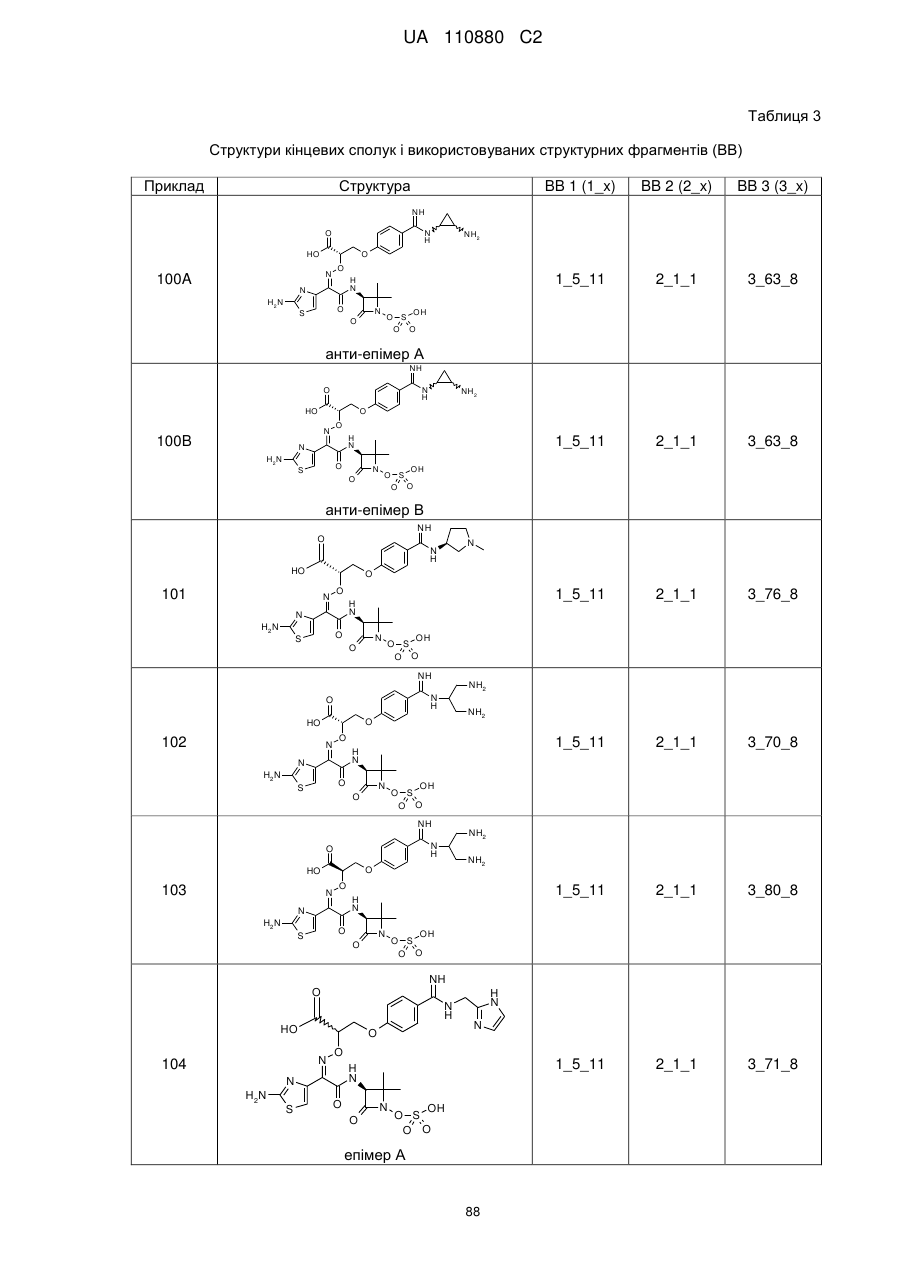
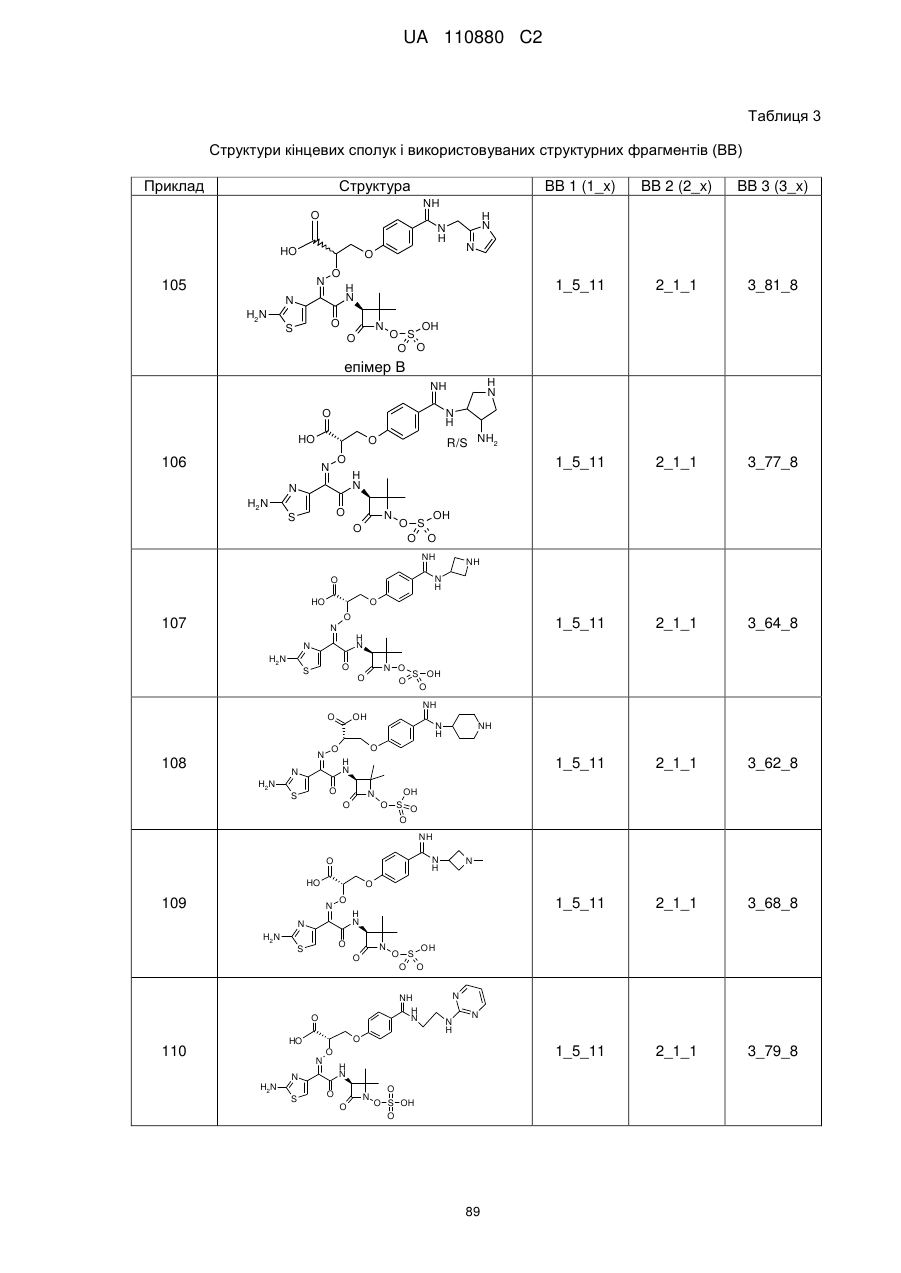
8. Сполука, яка є однією з наступних:
(2Z)-2-(2-амiнo-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїл-3-гідроксифеноксі)етоксі]іміно}-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїл-3-гідроксифеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(6-карбамімідоїлпіридин-3-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(6-карбамімідоїлпіридин-3-іл)оксі]етоксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(5-карбамімідоїлпіридин-2-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тiaзол-4-іл)-2-({2-[(4-карбамімідоїлфеніл)сульфаніл]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(4-карбамімідоїлфеніл)сульфаніл]етоксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(4-карбамімідоїлфеніл)аміно]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}-N-[(2R,3S)-2-метил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2R,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
{[(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-iл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-іл]окси}метансульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїл-3-метилфеноксі)етоксі]іміно}-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїл-3-метилфеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(2-карбамімідоїлпіридин-4-іл)оксі]етоксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}-N-[2-оксо-1-(сульфооксі)-1-азаспіро[3.4]окт-3-ил]етанамід,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфенокси)-2-метилпропоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
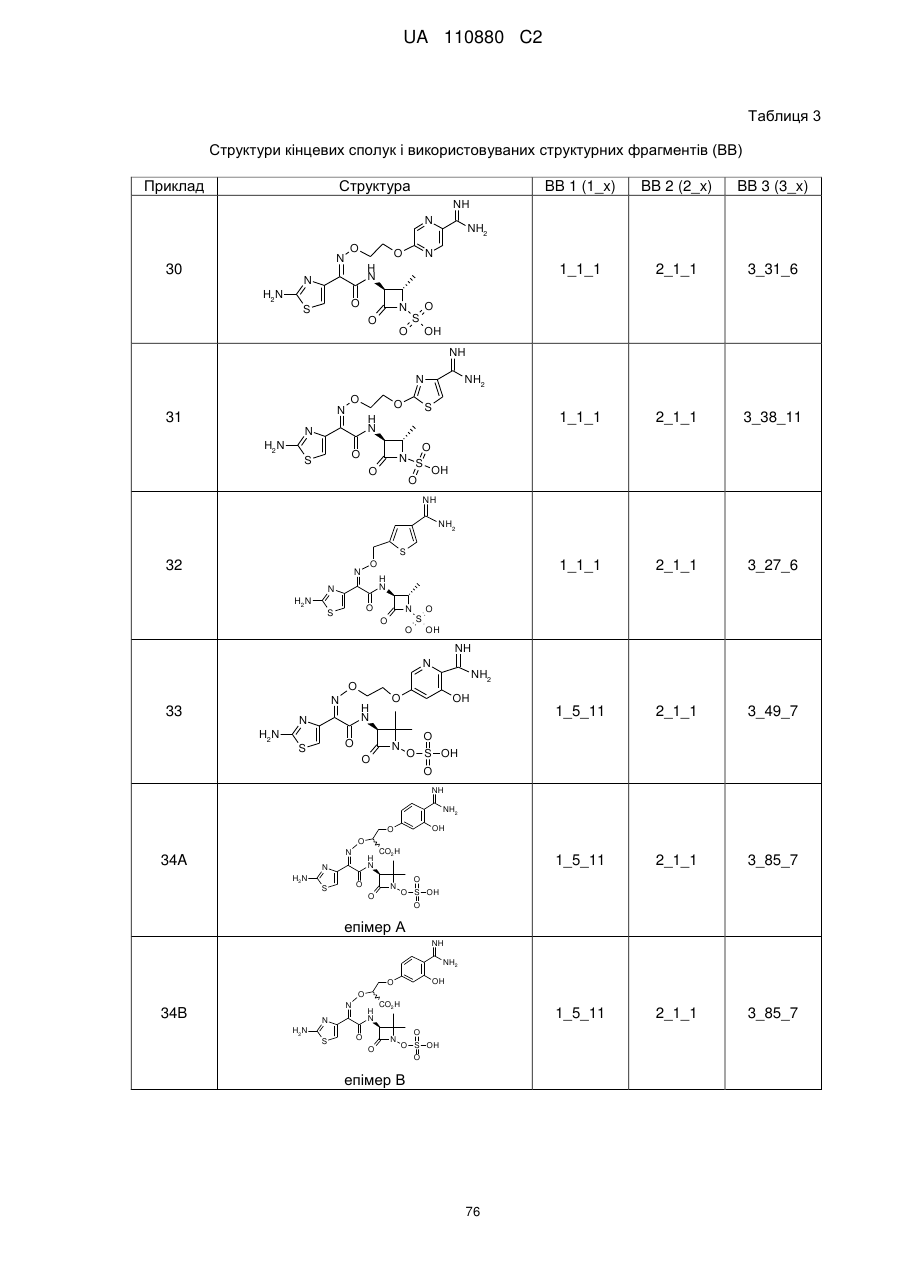
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({[1-(4-карбамімідоїлфенокси)-2-метилпропан-2-іл]оксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїл-2-фторфеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїл-2-хлорфеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[4-(N-гідроксикарбамімідоїл)феноксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(4-карбамімідоїлпіридин-2-іл)оксі]етоксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]-2-[(2-{4-[N-(піперидин-4-іл)карбамімідоїл]феноксі}етоксі)іміно]етанамід,
(2Z)-2-[(2-{4-[N-(2-аміноетил)карбамімідоїл]феноксі}етоксі)іміно]-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[4-(4,5-дигідро-1Н-імідазол-2-іл)феноксі]етоксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2S і 2R)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(2S,3S)-2-метил-4-оксо-1-сульфоазетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-карбамімідоїлфенокси)пропанова кислота,
(2S і 2R)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)-азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-карбамімідоїлфенокси)пропанова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(6-карбамімідоїлпіридазин-3-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(6-карбамімідоїлпіридазин-3-іл)оксі]етоксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(5-карбамімідоїлпіразин-2-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(4-карбамімідоїл-1,3-тіазол-2-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-(2-[(4-карбамімідоїлтіофен-2-іл)метоксі]іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(6-карбамімідоїл-5-гідроксипіридин-3-iл)oкci]eтoкci}iмiнo)-N-[(3S)-2,2-димeтил-4-oкco-1-(cyльфooкci)aзeтидин-3-іл]етанамід,
(2S і 2R)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)-азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-карбамімідоїл-3-гідроксифенокси)пропанова кислота,
(2S,3S)-3-{[(2Z)-2-{[2-(2-аміно-4-карбамімідоїлфеноксі)етоксі]іміно}-2-(2-аміно-1,3-тіазол-4-іл)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S і 2R)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)-азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-[(6-карбамімідоїлпіридин-3-іл)окси]пропанова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[{3-(4-карбамімідоїлфенокси)пропоксі}іміно]ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
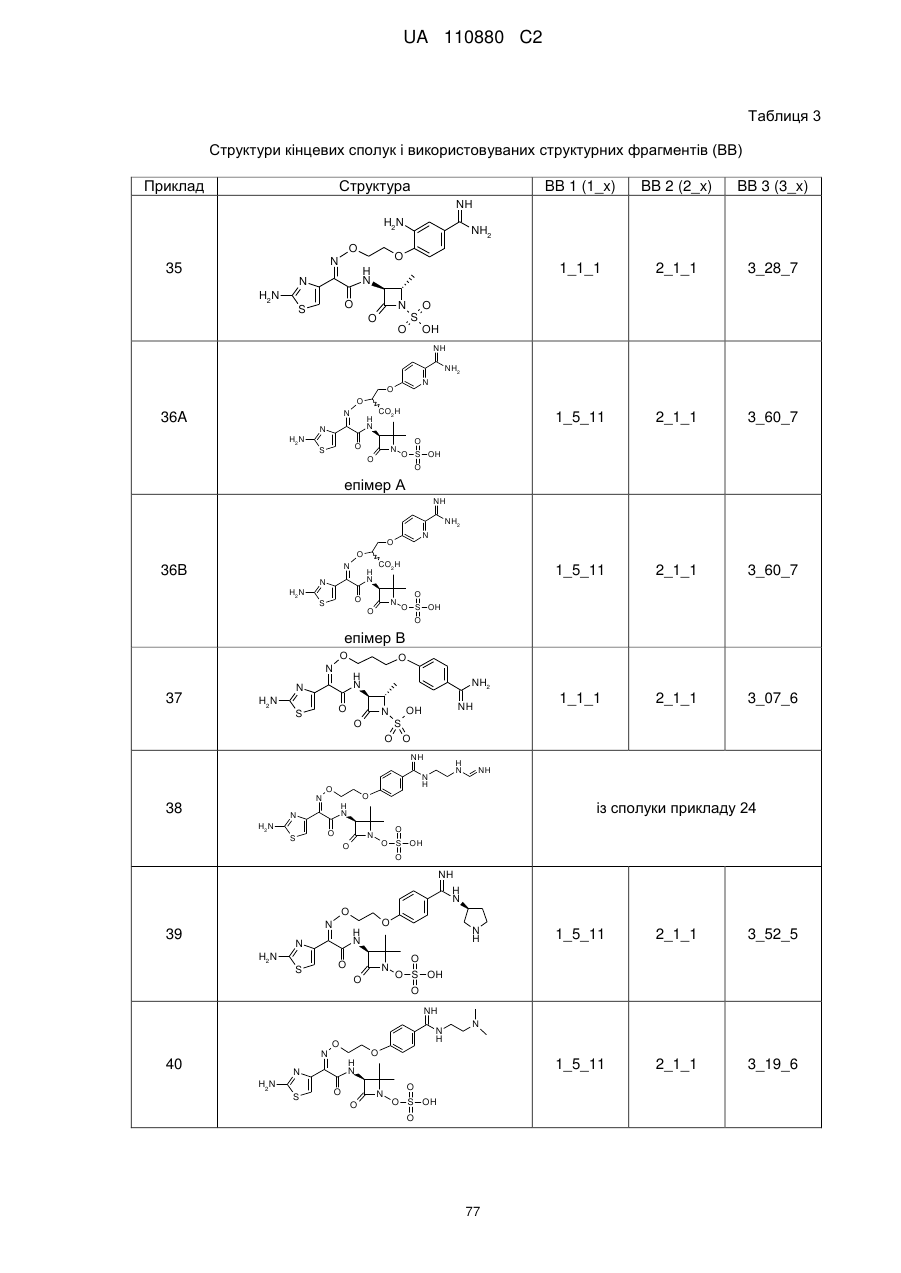
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-1-гідрокси-2,2-диметил-4-оксоазетидин-3-іл]-2-({2-[4-(N-{2-[(імінометил)аміно]етил}карбамімідоїл)феноксі]етоксі}іміно)етанамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]-2-{[2-(4-{N-[(3S)-піролідин-3-іл]карбамімідоїл}феноксі)етоксі]іміно}етанамід,
(2Z)-2-(2-аміно-1,3-тiaзол-4-іл)-2-{[2-(4-{N-[2-(диметиламіно)етил]карбамімідоїл}феноксі)етоксі]іміно}-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(4S)-4-{[{4-[2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}оксі)етокси]феніл}(іміно)метил]аміно}-N,N-диметил-L-пролінамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-iл]-2-{[2-(4-{N-[(3S)-1-етанiмiдоїлпіролідин-3-іл]карбамімідоїл}феноксі)етоксі]іміно}етанамід,
(2R і 2S)-3-{4-[ N -(2-аміноетил)карбамімідоїл]феноксі}-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)пропанова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({[(2R і 2S)-1-(4-карбамімідоїлфенокси)-3-гідроксипропан-2-іл]оксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
3-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-4-(4-карбамімідоїлфенокси)бутанова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}-N-[(2S,3S)-2-метил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2R,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-iл)-2-{[3-(4-карбамімідоїлфенокси)пропоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-амінo-1,3-тіазол-4-іл)-2-{[2-(2-бpoм-4-карбамімідоїлфеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідамідофеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[3-(4-карбамімідамідофенокси)пропоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(5-аміно-1,2,4-тіадіазол-3-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}-N-[(2S,3S)-1-гідрокси-2-метил-4-оксоазетидин-3-іл]етанамід,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(3-карбамімідоїлфеноксі)етоксі]іміно}-ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-({(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[(2-{4-[N-(пpoпaн-2-іл)карбамімідоїл]феноксі}етоксі)іміно]ацетил}аміно)-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[(4-карбамімідоїлбензил)оксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(4-карбамімідоїлтіофен-2-іл)метоксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2Z)-2-(2-амiнo-1,3-тiaзoл-4-iл)-2-{[(4-кapбaмiмiдoїлбeнзил)oкci]iмiнo}-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
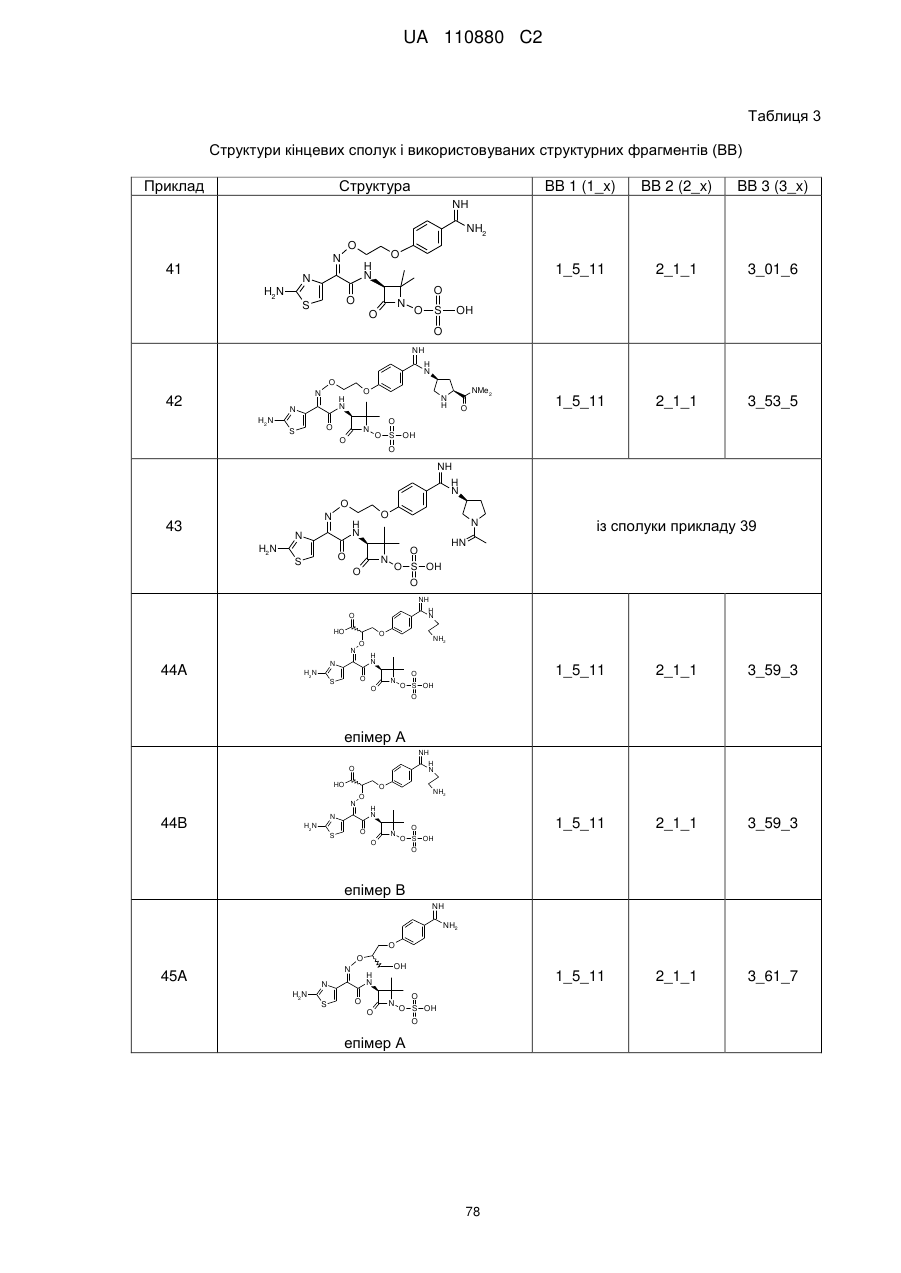
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[3-(4-карбамімідоїлфенокси)пропоксі]іміно}-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[4-карбамімідоїл-2-(гідроксиметил)феноксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-({(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[(2-{4-карбамімідоїл-2-[(формілокси)метил]феноксі}етоксі)іміно]ацетил}аміно)-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-5-хлор-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-({2-[4-(2-аміно-2-іміноетил)феноксі]етоксі}іміно)-2-(2-аміно-1,3-тіазол-4-іл)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-({(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[(2-{4-[(2-формілгідразиніл)(іміно)метил]феноксі}етоксі)іміно]ацетил}аміно)-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-({(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[(2-{4-[гідразиніл(іміно)метил]феноксі}етоксі)іміно]ацетил}аміно)-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(5-карбамімідоїл-1,3,4-тіадіазол-2-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-карбамімідоїлфеноксі)етоксі]іміно}ацетил]аміно}-2-карбамоїл-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(3-карбамімідоїл-1,2-оксазол-5-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[4-(N-метилкарбамімідоїл)феноксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-({(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[(2-{4-[N-(2-гідроксіетил)карбамімідоїл]феноксі}етоксі)іміно]ацетил}аміно)-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[2-(4-{N-[2-(формілоксі)етил]карбамімідоїл}феноксі)етоксі]іміно}ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(3-карбамімідоїл-1-метил-1Н-піразол-5-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
(2S,3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(5-карбамімідоїл-1-метил-1Н-піразол-3-іл)оксі]етоксі}іміно)ацетил]аміно}-2-метил-4-оксоазетидин-1-сульфонова кислота,
N-[{4-[2-({[(1Z)-1-(2-амiнo-1,3-тiaзoл-4-iл)-2-{[(3S)-2,2-димeтил-4-oкco-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}оксі)етокси]феніл}(іміно)метил]гліцин,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({2-[(2-карбамімідоїл-5-метил-1,3-тіазол-4-іл)оксі]етоксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-карбамімідоїлфенокси)пропанамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]-2-[(2-{4-[N-(піридин-2-ілметил)карбамімідоїл]феноксі}етоксі)іміно]етанамід,
{[(2S,3S)-3-{[(2Z)-2-[(2-{4-[N-(2-амiнoeтил)кapбaмiмiдoїл]фeнoкci}eтoкci)iмiнo]-2-(2-аміно-1,3-тіазол-4-іл)ацетил]аміно}-2-метил-4-оксоазетидин-1-іл]окси}метансульфонова кислота,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[(2-{4-[Z-(2-карбамімідамодіетил)карбамімідоїл]феноксі}етоксі)іміно]-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
1-(2-{[{4-[2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}оксі)етокси]феніл}(іміно)метил]аміно}етил)-1-метилпіролідинійхлорид,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]-2-[(2-{4-[іміно(піперазин-1-іл)метил]феноксі}етоксі)іміно]етанамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-({[1-(4-карбамімідоїлфенокси)-(2R і 2S)-4-гідроксибутан-2-іл]оксі}іміно)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-{[2-({6-[N-(2-аміноетил)карбамімідоїл]піридин-3-іл}оксі)етоксі]іміно}-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-[(2-{4-[N-(3-амінопропіл)карбамімідоїл]феноксі}етоксі)іміно]-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[(2-{4-[N-(1,3-діамінопропан-2-іл)карбамімідоїл]феноксі}етоксі)іміно]-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-{[2-(4-{N-[(2R)-1-аміно-3-гідроксипропан-2-іл]карбамімідоїл}феноксі)етоксі]іміно}-2-(2-аміно-1,3-тіазол-4-іл)-N-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2Z)-2-({2-[4-(5-аміно-1,4,5,6-тетрагідропіримідин-2-іл)феноксі]етоксі}іміно)-2-(2-аміно-1,3-тіазол-4-іл)-4-[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(2R і 2S)3-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)-азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-2-(4-карбамімідоїлфенокси)пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-{N-[(3R)-піперидин-3-іл]карбамімідоїл}фенокси)пропанова кислота,
(2R)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-{N-[(3R)-піперидин-3-іл]карбамімідоїл}фенокси)пропанова кислота,
{[(3S)-3-{[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-{[(4-карбамімідоїлбензил)оксі]іміно}ацетил]аміно}-2,2-диметил-4-оксоазетидин-1-іл]окси}метансульфонова кислота,
(2Z)-2-[(2-{4-[5-(амінометил)-4,5-дигідро-1Н-імідазол-2-іл]феноксі}етоксі)іміно]-2-(2-аміно-1,3-тіазол-4-іл)- N -[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]етанамід,
(3S)-3-({(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-[(2-{4-[N-(піразолідин-4-іл)карбамімідоїл]феноксі}етоксі)іміно]ацетил}аміно)-2,2-диметил-4-оксоазетидин-1-сульфонова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-сульфоазетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-{N-[(3S)-піролідин-3-іл]карбамімідоїл}фенокси)пропанова кислота,
(2S)-3-{4-[N-(2-аміно-2-метилпропіл)карбамімідоїл]феноксі}-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-{N-[2-(метиламіно)етил]карбамімідоїл}фенокси)пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-сульфоазетидин-3-iл]амiно}-2-оксоетилiден]амiно}окси)-3-(4-{N-[(3R)-пiролiдин-3-іл]карбамімідоїл}фенокси)пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-{4-[N-(піперидин-3-іл)карбамімідоїл]фенокси}пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-{4-[N-(піролідин-2-ілметил)карбамімідоїл]фенокси}пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-{4-[N-(піперидин-2-ілметил)карбамімідоїл]фенокси}пропанова кислота,
(2S)-3-{4-[N-(транс-(R,R і S,S)-2-аміноциклопропіл)карбамімідоїл]феноксі}-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-cyльфoaзeтидин-3-iл]aмiнo}-2-oкcoeтилiдeн]aмiнo}oкcи)-3-(4-{N-[(3S)-1-метилпіролідин-3-іл]карбамімідоїл}-фенокси)пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-{4-[N-(1,3-діамінопропан-2-іл)карбамімідоїл]фенокси}пропанова кислота,
(2R)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-{4-[N-(1,3-діамінопропан-2-іл)карбамімідоїл]фенокси}пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}оксі)-3-{4-[N-(1Н-імідазол-2-ілметил)карбамімідоїл]фенокси}пропанова кислота,
(2R)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}оксі)-3-{4-[N-(1Н-імідазол-2-ілметил)карбамімідоїл]фенокси}пропанова кислота,
(2S)-3-{4-[N-(4-амінопіролідин-3-іл)карбамімідоїл]феноксі}-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}оксі)-3-{4-[N-(азетидин-3-іл)карбамімідоїл]фенокси}пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-{4-[N-(піперидин-4-іл)карбамімідоїл]фенокси}пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}оксі)-3-{4-[N-(азетидин-3-іл)карбамімідоїл]фенокси}пропанова кислота,
(2S)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-{N-[2-(піримідин-2-іламіно)етил]карбамімідоїл}фенокси)пропанова кислота,
(2R)-2-({[(1Z)-1-(2-аміно-1,3-тіазол-4-іл)-2-{[(3S)-2,2-диметил-4-оксо-1-(сульфооксі)азетидин-3-іл]аміно}-2-оксоетиліден]аміно}окси)-3-(4-{N-[2-(піримідин-2-іламіно)етил]карбамімідоїл}фенокси)пропанова кислота; і її солі, її сольвати і сольвати її солей.
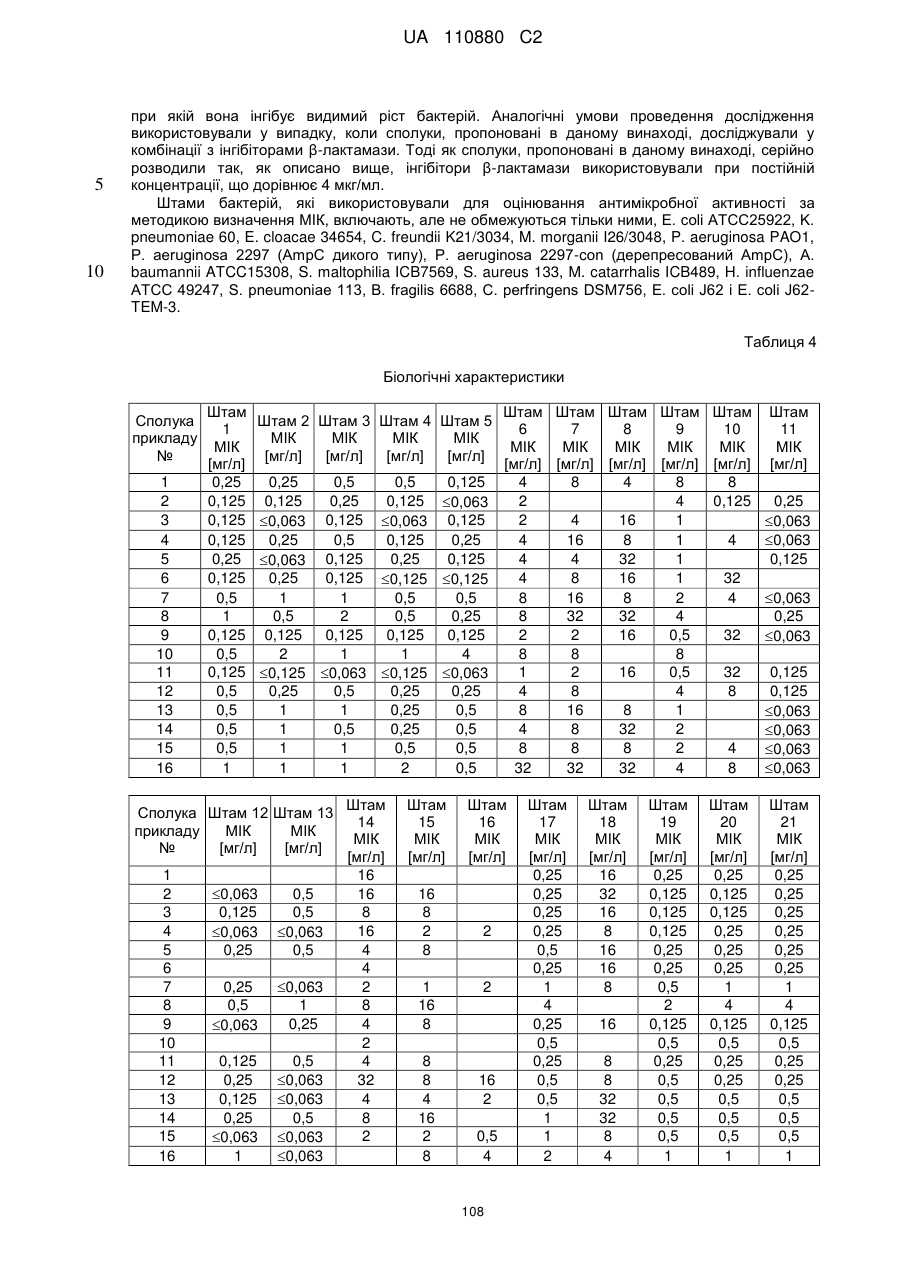
9. Сполука за будь-яким із пп. 1-8, призначена для застосування в способі лікування і/або попередження захворювань, краще бактеріальних інфекцій, особливо краще викликаних грамнегативними бактеріями.
10. Спосіб одержання сполуки формули (І) за п. 1, при якому видаляють захисну групу із сполуки формули
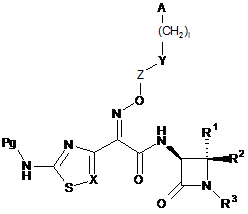 , (II)
, (II)
в якій Pg означає захисну групу і R1-R3, A, I, X, Y і Z є такими, як визначено в п. 1.
11. Спосіб за п. 10, який відрізняється тим, що сполуку (II) одержують за реакцією сполуки формули
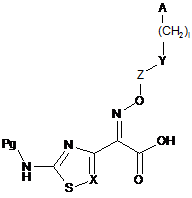 , (III)
, (III)
в якій Pg означає захисну групу і А, І, X, Y і Z є такими, як визначено в п. 1, зі сполукою формули
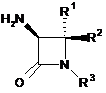 , (IV)
, (IV)
в якій R1, R2 і R3 є такими, як визначено в п. 1.
12. Застосування сполуки за будь-яким із пп. 1-9 для лікування і/або профілактики захворювань.
13. Застосування сполуки за будь-яким із пп. 1-9 для приготування лікарського засобу, призначеного для лікування і/або профілактики захворювань.
14. Застосування сполуки за будь-яким із пп. 1-9 для приготування лікарського засобу, призначеного для лікування і/або профілактики бактеріальних інфекцій.
15. Лікарський засіб, який містить принаймні одну сполуку за будь-яким із пп. 1-9 в комбінації принаймні з однією додатковою активною сполукою.
16. Лікарський засіб за п. 15, який відрізняється тим, що додатковою активною сполукою є інгібітор b-лактамази.
17. Лікарський засіб, який містить принаймні одну сполуку за будь-яким із пп. 1-9 в комбінації принаймні з одним інертним, нетоксичним, фармацевтично прийнятним наповнювачем.
18. Лікарський засіб за будь-яким із пп. 15-17, призначений для застосування в способі лікування і/або попередження бактеріальних інфекцій.
19. Спосіб боротьби з бактеріальними інфекціями у людей і тварин, при якому вводять принаймні одну сполуку за будь-яким із пп. 1-9 або лікарський засіб за будь-яким із пп. 15-18 в антибактеріально ефективній кількості.
Текст
Реферат: У заявці описано нові -лактами формули (І), їх одержання і застосування. Зокрема, у заявці описано нові -лактами, що є заміщеними амідином похідними монобактаму, які застосовуються як протимікробні засоби, та їх одержання. UA 110880 C2 (12) UA 110880 C2 A (CH2)I Y Z N O H N N R 1 R H2N S X O 2 N O R 3 (I) UA 110880 C2 5 10 15 20 25 30 35 40 45 Даний винахід відноситься до нових β-лактамів, їх одержання та застосування. Зокрема, даний винахід відноситься до нових β-лактамів, що є заміщеними амідином похідними монобактаму, які застосовуються як протимікробні засоби, та до їх одержання. Експерти в галузі суспільної охорони здоров'я і посадові особи вважають виникнення і поширення резистентних щодо антибіотиків бактерій однією з важливих проблем суспільної охорони здоров'я в 21 столітті. Хоча це явище саме по собі не є новим, поширення резистентних щодо антибіотиків бактерій досягло безпрецедентного масштабу. У той час як більшість резистентних ізолятів виникає в стаціонарних лікувальних установах, лікарі і епідеміологи виявили зростаючу кількість резистентних бактерій в суспільстві у людей, що не отримували раніше медичне обслуговування. Продовжує зростати кількість пацієнтів, які вмирають від внутрішньолікарняних інфекцій, що не піддаються лікуванню. Терапевтичні засоби є особливо обмеженими для лікування інфекцій, викликаних мультирезистентними грамнегативними патогенами, включаючи кишкові бактерії і неферментуючі бактерії; ситуація ускладнюється тим, що в фармацевтичній промисловості виробляється незначна кількість сполук, які мають перспективний профіль усунення резистентності (H.W. Boucher et al.; Bad bugs, no drugs: No ESKAPE! An update from the Infectious Diseases Society of America; Clin Inf Dis 2009, 48, 1-12). Історично склалося так, що досить результативні і добре переносимі антибіотики класу βлактамів були основними засобами для лікування інфекцій, викликаних грамнегативними патогенами. З числа таких антибіотиків для лікування інфекцій, викликаних грамнегативними бактеріями, широко використовують головним чином цефалоспорини 3-го покоління, карбапенеми і монобактами. Однак велика кількість, більш ніж 1000 β-лактамаз (постійно оновлюваний перелік β-лактамаз приведений в інтернеті: http://www.lahey.org/Studies/), і додаткові механізми резистентності в середньостроковій перспективі являють серйозну загрозу для придатності застосування наявних в даний час сполук, що відносяться до цих підкласів. βЛактамази широкого спектра дії (БЛШС) і карбапенемази досить помітно сприяють виникненню резистентності. Для подолання цього утруднення наполегливо необхідні нові β-лактами, здатні усувати резистентність. Монобактами, включаючи азтреонам, єдиний затверджений FDA (Управління з санітарного нагляду за якістю харчових продуктів і медикаментів США) монобактам, що використовується в усьому світі, і другий аналог, наявний у продажу тільки в Японії (тигемонам), безсумнівно є недостатньо вивченим підкласом β-лактамів. Огляди з азтреонаму наведені в публікаціях: W.C. Hellinger, N.S. Brewer; Carbapenems and Monobactams-Imipenem, Meropenem and Aztreonam; Mayo Clin. Proc. 1999, 74, 420-434. R.B. Sykes, D.P. Bonner; Discovery and Development of the monobactams; Rev. Infect. Dis. 1985, 7 (Suppl. 4), 579-593. Спроба збільшити доставку β-лактамів в клітини шляхом використання в мікроорганізмах систем сидерофорів, що доставляють залізо, є одним підходом, який розглядали в сфері монобактамів: Basilea (WO 2007065288), Naeja Pharmaceuticals (WO 2002022613) і Squibb & Sons (US 5290929, EP 531976, EP 484881). В публікаціях Squibb & Sons (US 5318963, US 5112968) показано, що гетероарильні ланки, що імітують сидерофори, також можна приєднати до бічного ланцюга гідразидів. Недавно фірма Pfizer провела повторне дослідження монокарбамів, моноциклічних β-лактамів, що містять сульфоніламінокарбонільну активуючу групу в положенні N1 (WO 2010070523). Крім того, Basilea в WO 2008116813 описав методики комбінованої терапії з використанням комбінації монобактамів з карбапенемами. Внаслідок все більшого розвитку резистентності патогенних бактерій щодо відомих антибактеріальних засобів, включаючи множинну резистентність, постійно необхідний пошук нових антибактеріальних сполук, краще сполук, що містять різні структурні фрагменти. Даний винахід відноситься до сполук формули (I) 1 UA 110880 C2 A (CH2)l Y Z O N H N N S X O 15 20 25 30 35 2 N O 10 1 R H2N 5 R R 3 (I), в якій 1 2 R і R незалежно один від одного означають водень, амінокарбоніл або (C 1-C4)-алкіл, або 1 2 R і R разом з атомом вуглецю, до якого вони приєднані, утворюють (C 3-C8)-циклоалкіл, 3 R означає -(CH2)m-(SO2)OH або -O-(CH2)o-(SO2)OH, де m і o незалежно один від одного означають цілі числа, що дорівнюють 0, 1, 2 або 3, і 3 де будь-яка група CH2, що міститься в залишках, позначених за допомогою R , може бути заміщена одним або двома (C1-C4)-алкільними залишками, 4 X означає CR або N, 4 R означає водень або галоген, Z означає зв'язок або алкільний ланцюг, що містить 1, 2, 3 або 4 атоми вуглецю, при цьому алкільний ланцюг може містити 1, 2, 3 або 4 замісники, які незалежно один від одного вибрані з групи, яка включає карбоксигрупу, амінокарбоніл і (C1-C4)-алкіл, при цьому алкіл, в свою чергу, може містити замісник, вибраний з групи, яка включає гідроксигрупу, карбоксигрупу і амінокарбоніл, Y означає зв'язок, O, NH або S, A означає (C6-C10)-арил або 5-10-членний гетероарил, при цьому арил і гетероарил містять замісник, який описується наступною формулою: , в якій 1b 2b 3b R , R і R незалежно один від одного означають водень, аміногрупу, гідроксигрупу, (C 1C4)-алкіл, (C1-C4)-алкоксигрупу, (C3-C6)-циклоалкіл, 4-, 5-, 6- або 7-членний гетероцикліл, або 5або 6-членний гетероарил, при цьому аміногрупа і гідроксигрупа можуть містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає карбоніл, (C 1-C4)-алкілкарбоніл, моно- або ді-(C1-C4)алкіламінокарбоніл і (C1-C4)-алкіл, при цьому алкоксигрупа, гетероцикліл і гетероарил можуть містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, (C1-C4)-алкілкарбоніл, (C1-C4)-алкоксигрупу, моно- або ді-(C1-C4)алкіламіногрупу, моно- або ді-(C1-C4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), C(=NH)CH3 і (C1-C4)-алкіл, і при цьому алкіл і циклоалкіл можуть містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, карбонілоксигрупу, амінокарбоніл, карбоніламіногрупу, (C 1-C4)-алкілкарбоніл, (C1-C4)алкоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, моно- або ді-(C1-C4)-алкіламінокарбоніл, NH-CH(=NH), -NH-C(=NH)(NH2), -CH(=NH)CH3, (C6-C10)-арил, 5- або 6-членний гетероарил і 5або 6-членний гетероцикліл, при цьому гетероарил і гетероцикліл, в свою чергу, можуть бути заміщені (C 1-C4)-алкілом, 2 UA 110880 C2 при цьому аміногрупа, в свою чергу, може бути заміщена 5- або 6-членним гетероарилом, або 5 10 15 20 25 30 35 40 45 50 55 60 2b 3b R і R разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членний гетероцикл, 1b що містить 1, 2 або 3 додаткових гетероатоми, що вибрані з групи, яка включає N, O і S, і R є таким, як визначено вище, 4b R означає водень, аміногрупу, гідроксигрупу, (C1-C4)-алкіл або (C1-C4)-алкоксигрупу, при цьому аміногрупа і гідроксигрупа можуть містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає (C 1-C4)-алкілкарбоніл, моно- або ді-(C1-C4)алкіламінокарбоніл і (C1-C4)-алкіл, при цьому алкоксигрупа може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, (C 1C4)-алкілкарбоніл, (C1-C4)-алкоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, моно- або ді-(C1C4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -CH(=NH)CH3 і (C1-C4)-алкіл, і при цьому алкіл може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, амінокарбоніл, (C1-C4)-алкілкарбоніл, (C1-C4)-алкоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, моно- або ді(C1-C4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -CH(=NH)CH3, (C1-C4)-алкіл, (C6C10)-арил і 5- або 6-членний гетероарил, 5b R означає водень або (C1-C4)-алкіл, Q означає зв'язок, CH2 або NH, k означає ціле число, що дорівнює 1 або 2, і * означає положення приєднання до залишку, позначеного за допомогою A, і при цьому арил і гетероарил можуть додатково містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, ціаногрупу, аміногрупу, гідроксигрупу, (C 1C4)-алкіл, (C1-C4)-алкоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, аміно-(C1-C4)-алкіл, гідроксі-(C1-C4)-алкіл або карбоксигрупу, при цьому алкіл, алкоксигрупа, алкіламіногрупа, аміноалкіл, гідроксіалкіл і карбоксигрупа, в свою чергу, можуть містити замісник, вибраний з групи, яка включає галоген, (C 1-C4)-алкіл і карбоніл, і l означає ціле число, що дорівнює 0, 1, 2 або 3, і до їх солей, їх сольватів і сольватів їх солей. Сполуки, пропоновані в даному винаході, являють собою сполуки формули (I) і їх солі, сольвати і сольвати їх солей, а також сполуки, які описуються формулою (I) і вказані нижче в даному винаході, як типові варіанти здійснення, і їх солі, сольвати і сольвати їх солей, якщо тільки сполуки, які описуються формулою (I) і зазначені нижче, вже не є солями, сольватами і сольватами солей. Сполуки, пропоновані в даному винаході, залежно від своєї структури можуть існувати в стереоізомерних формах (енантіомери, діастереоізомери). Тому даний винахід також відноситься до енантіомерів або діастереоізомерів та відповідних їх сумішей. Стереоізомерно однорідні компоненти можна виділити з таких сумішей енантіомерів і/або діастереоізомерів за допомогою відомих методик. Якщо сполуки, пропоновані в даному винаході, можуть існувати в таутомерних формах, то до обсягу даного винаходу входять всі таутомерні форми. Солями, кращими для задач даного винаходу, є фізіологічно прийнятні солі сполук, пропонованих в даному винаході. Однак до обсягу даного винаходу також включені солі, які самі по собі непридатні для використання у фармацевтиці, але які можна використовувати, наприклад, для виділення або очищення сполук, пропонованих в даному винаході. Приклади фармацевтично прийнятних солей сполук формули (I) включають солі неорганічних основ, такі як солі амонію, солі лужних металів, краще солі натрію або калію, солі лужноземельних металів, краще солі магнію і кальцію; солі органічних основ, краще солі, одержані з циклогексиламіну, бензиламіну, октиламіну, етаноламіну, діетаноламіну, діетиламіну, триетиламіну, етилендіаміну, прокаїну, морфоліну, піроліну, піперидину, Nетилпіперидину, N-метилморфоліну, піперазину, використовуваних як органічні основи; або солі, утворені з основними амінокислотами, краще лізином, аргініном, орнітином і гістидином. Приклади фармацевтично прийнятних солей сполук формули (I) також включають солі неорганічних кислот, такі як гідрохлориди, гідроброміди, сульфати, фосфати або фосфонати; солі органічних кислот, краще ацетати, форміати, пропіонати, лактати, цитрати, фумарати, малеати, бензоати, тартрати, малати, метансульфонати, етансульфонати, толуолсульфонати або бензолсульфонати; або солі, утворені з кислими амінокислотами, краще аспартат або глутамат. 3 UA 110880 C2 5 10 15 20 25 30 35 40 45 50 55 Для задач даного винаходу сольвати означають такі форми сполук, пропонованих в даному винаході, які у твердому або рідкому стані утворюють комплекс шляхом координації з молекулами розчинника. Гідрати є особливою формою сольватів, у яких координація відбувається з водою. В контексті даного винаходу замісники, якщо не зазначено інше, мають наступні значення. Термін алкіл означає (C1-C6)-алкіл, краще (C1-C4)-алкіл, що має розгалужений або лінійний ланцюг, краще такий як метил, етил, пропіл, бутил, ізопропіл, ізобутил і трет-бутил. Термін алкіламіногрупа означає алкільний замісник, приєднаний через аміногрупу. Термін алкілкарбоніл означає алкільний замісник, приєднаний через карбонільну групу. Термін алкіламінокарбоніл означає алкіламінний замісник, приєднаний через карбонільну групу. Термін циклоалкіл означає аліфатичні кільця C3-C8, краще C3-C6, краще такі як циклопропіл, циклобутил, циклопентил і циклогексил. Термін алкоксигрупа означає (C1-C6)-алкоксигрупу, що має розгалужений або лінійний ланцюг, краще (C1-C4)-алкоксигрупу, краще таку як метоксигрупа, етоксигрупа, пропоксигрупа, бутоксигрупа, ізопропоксигрупа, ізобутоксигрупа і трет-бутоксигрупа. Термін алкоксикарбоніл означає алкоксильний замісник, приєднаний через карбонільну групу. Термін гетероарил означає циклічні гетероароматичні групи, які містять 5-10 кільцевих атомів, краще 5-6 кільцевих атомів, і які містять до 4, краще до 2 гетероатомів, вибраних з групи, яка включає N, O, S, де N також може утворити N-оксид. Кращими є моноциклічні гетероарильні групи, які містять 5-6 кільцевих атомів, що включають до 2 гетероатомів, вибраних з групи, яка включає N, O і S, краще такі як тіофен, бензотіофен, фуран, бензофуран, пірол, піразол, імідазол, тіазол, тіадіазол, оксазол, ізоксазол, піридин, піразин, піримідин, піридазин, індол, ізоіндол, пурин, хінолін або ізохінолін. Багато які інші гетероарильні групи, підходящі для задач даного винаходу, відомі спеціалісту в даній галузі техніки або їх можна легко знайти в літературі. Термін гетероцикліл означає насичені або частково ненасичені гетероциклічні групи, які містять 4-10 кільцевих атомів, краще 5-6 кільцевих атомів, і які містять до 3, краще до 2 гетероатомів, вибраних з групи, яка включає N, O, S, SO і SO 2, де N також може утворити Nоксид. Кращими є насичені моноциклічні гетероциклільні групи, які містять 5-6 кільцевих атомів, що включають до 2 гетероатомів, вибраних з групи, яка включає N, O і S, краще такі як піролідин, піролін, тетрагідрофуран, тетрагідротіофен, тіазолідин, імідазолідин, імідазолін, піперидин, піран, тетрагідропіран, тіопіран, тетрагідротіопіран, морфолін, тіоморфолін, піперазин, піперидазин. Багато які інші гетероциклільні групи, підходящі для задач даного винаходу, відомі спеціалісту в даній галузі техніки або їх можна легко знайти в літературі. Термін галоген означає фтор, хлор, бром або йод; краще фтор або хлор. Термін амінокарбоніл означає аміногрупу, приєднану через карбонільну групу. Термін карбоніламіногрупа означає карбонільну групу, приєднану через аміногрупу. Термін карбоксигрупа означає групу карбонової кислоти, тобто групу -COOH. Термін карбонілоксигрупа означає карбонільну групу, приєднану через атом кисню. Даний винахід також відноситься до сполук формули (I), в якій 1 2 R і R незалежно один від одного означають водень або (C1-C4)-алкіл, або 1 2 R і R разом з атомом вуглецю, до якого вони приєднані, утворюють (C 3-C8)-циклоалкіл, 3 R означає -(CH2)m-(SO2)OH або -O-(CH2)o-(SO2)OH, де m і o незалежно один від одного означають цілі числа, що дорівнюють 0 або 1, і 3 де будь-яка група CH2, що міститься в залишках, позначених за допомогою R , може бути заміщена одним або двома (C1-C4)-алкільними залишками, 4 X означає CR або N, 4 R означає водень або галоген, Z означає зв'язок або алкільний ланцюг, що містить 1, 2 або 3 атоми вуглецю, при цьому алкільний ланцюг може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає карбоксигрупу, амінокарбоніл і (C 1-C4)-алкіл, при цьому алкіл, в свою чергу, може містити замісник, вибраний з групи, яка включає гідроксигрупу і карбоксигрупу, Y означає зв'язок, O, NH або S, A означає (C6-C10)-арил або 5-10-членний гетероарил, при цьому арил і гетероарил містять замісник, який описується наступною формулою: 4 UA 110880 C2 5 10 15 20 25 30 35 40 45 50 , в якій 1b 2b 3b R , R і R незалежно один від одного означають водень, аміногрупу, гідроксигрупу, (C 1C4)-алкіл, 4-, 5-, 6- або 7-членний гетероцикліл, або 5- або 6-членний гетероарил, при цьому гетероцикліл і гетероарил можуть містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, (C1-C4)-алкілкарбоніл, (C1-C4)-алкоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, моно- або ді-(C1-C4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -C(=NH)CH3 і (C1-C4)алкіл, і при цьому алкіл може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, карбонілоксигрупу, амінокарбоніл, карбоніламіногрупу, (C 1-C4)-алкілкарбоніл, (C1-C4)алкоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, моно- або ді-(C1-C4)-алкіламінокарбоніл, NH-CH(=NH), -NH-C(=NH)(NH2), -CH(=NH)CH3, (C6-C10)-арил, 5- або 6-членний гетероарил і 5або 6-членний гетероцикліл, при цьому гетероарил і гетероцикліл, в свою чергу, можуть бути заміщені (C1-C4)-алкілом, або 2b 3b R і R разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членний гетероцикл, 1b що містить 1, 2 або 3 додаткових гетероатоми, що вибрані з групи, яка включає N, O і S, і R є таким, як визначено вище, 4b R означає водень, аміногрупу, гідроксигрупу, (C1-C4)-алкіл або (C1-C4)-алкоксигрупу, при цьому аміногрупа і гідроксигрупа можуть містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає (C 1-C4)-алкілкарбоніл, моно- або ді-(C1-C4)алкіламінокарбоніл і (C1-C4)-алкіл, і при цьому алкіл може містити 1, 2 або 3 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, гідроксигрупу, аміногрупу, карбоніл, карбоксигрупу, амінокарбоніл, (C1-C4)-алкілкарбоніл, (C1-C4)-алкоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, моно- або ді(C1-C4)-алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), -CH(=NH)CH3, (C1-C4)-алкіл, (C6C10)-арил і 5- або 6-членний гетероарил, 5b R означає водень або (C1-C4)-алкіл, Q означає зв'язок, CH2 або NH, k означає ціле число, що дорівнює 1 або 2, і * означає положення приєднання до залишку, позначеного за допомогою A, і при цьому арил і гетероарил можуть додатково містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, ціаногрупу, аміногрупу, гідроксигрупу, (C 1C4)-алкіл, (C1-C4)-алкоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, аміно-(C1-C4)-алкіл, гідроксі-(C1-C4)-алкіл або карбоксигрупу, при цьому алкіл, алкоксигрупа, алкіламіногрупа, аміноалкіл, гідроксіалкіл і карбоксигрупа, в свою чергу, можуть містити замісник, вибраний з групи, яка включає галоген, (C 1-C4)-алкіл і карбоніл, і l означає ціле число, що дорівнює 0 або 1, і до їх солей, їх сольватів і сольватів їх солей. Даний винахід також відноситься до сполук формули (I), в якій 1 2 R і R незалежно один від одного означають водень або (C1-C4)-алкіл, або 1 2 R і R разом з атомом вуглецю, до якого вони приєднані, утворюють (C 3-C8)-циклоалкіл, 3 R означає -(SO2)OH або -O-(CH2)0-(SO2)OH, де o означає ціле число, що дорівнює 0 або 1, і 3 де будь-яка група CH2, що міститься в залишках, позначених за допомогою R , може бути заміщена одним або двома (C1-C4)-алкільними залишками, X означає CH, Z означає алкільний ланцюг, що містить 2 або 3 атоми вуглецю, при цьому алкільний ланцюг може містити 1 або 2 замісники, які незалежно один від одного 5 UA 110880 C2 вибрані з групи, яка включає карбоксигрупу, амінокарбоніл, метил, гідроксиметил, гідроксіетил, Y означає O, A означає феніл або 5- або 6-членний гетероарил, при цьому феніл і гетероарил містять замісник, який описується наступною формулою: 5 10 15 20 25 30 35 40 , в якій 1b 2b 3b R , R і R незалежно один від одного означають водень, аміногрупу, гідроксигрупу, (C 1C4)-алкіл або 4-, 5-, 6- або 7-членний гетероцикліл, при цьому гетероцикліл може містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає аміногрупу, карбоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, і (C1-C4)-алкіл, і при цьому алкіл може містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає гідроксигрупу, аміногрупу, карбоксигрупу, карбонілоксигрупу, амінокарбоніл, карбоніламіногрупу, моноабо ді-(C1-C4)-алкіламіногрупу, моноабо ді-(C1-C4)алкіламінокарбоніл, -NH-CH(=NH), -NH-C(=NH)(NH2), феніл, 6-членний гетероарил і 5- або 6членний гетероцикліл, або 2b 3b R і R разом з атомом азоту, до якого вони приєднані, утворюють 6-членний гетероцикл, 1b що містить 1 або 2 атоми азоту, і R означає водень, 4b R означає водень або аміногрупу, при цьому аміногрупа може бути заміщена одним або двома (C1-C4)-алкілами, 5b R означає водень, Q означає зв'язок, k означає ціле число, що дорівнює 1 або 2, і * означає положення приєднання до залишку, позначеного за допомогою A, і при цьому феніл і гетероарил можуть додатково містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає галоген, ціаногрупу, аміногрупу, гідроксигрупу, (C 1C4)-алкіл або гідроксі-(C1-C4)-алкіл, при цьому гідроксіалкіл, в свою чергу, може бути заміщений карбонілом, і l дорівнює 0, і до їх солей, їх сольватів і сольватів їх солей. Даний винахід також відноситься до сполук формули (I), в якій 1 2 R і R незалежно один від одного означають водень або метил, 3 R означає -(SO2)OH або -O-(SO2)OH, X означає CH, Z означає зв'язок або алкільний ланцюг, що містить 2 або 3 атоми вуглецю, при цьому алкільний ланцюг може містити 1 або 2 замісники, які незалежно один від одного вибрані з групи, яка включає карбоксигрупу і метил, Y означає O, A означає феніл або 6-членний гетероарил, при цьому феніл і гетероарил містять замісник, який описується наступною формулою: 1b N * R 3b Q N R 2b R 45 , в якій 1b 2b R і R означають водень, 3b R означає водень, аміногрупу, гідроксигрупу, (C 1-C4)-алкіл або 4-, 5- або 6-членний гетероцикліл, що містить атом азоту, при цьому алкіл може містити замісник, вибраний з групи, яка включає гідроксигрупу, 6 UA 110880 C2 5 10 15 аміногрупу, карбоксигрупу, карбонілоксигрупу, моно- або ді-(C1-C4)-алкіламіногрупу, -NHCH(=NH), -NH-C(=NH)(NH2), 5- або 6-членний гетероарил, що містить атом азоту, і 5- або 6членний гетероцикліл, що містить атом азоту, Q означає зв'язок, * означає положення приєднання до залишку, позначеного за допомогою A, і при цьому арил і гетероарил можуть додатково містити 1 замісник, вибраний з групи, яка включає галоген, ціаногрупу, аміногрупу, гідроксигрупу, (C 1-C4)-алкіл або гідроксі-(C1-C4)-алкіл, l дорівнює 0, і до їх солей, їх сольватів і сольватів їх солей. Даний винахід також відноситься до сполук формули (I), в якій 1 2 R і R означають метил, 3 R означає -O-(SO2)OH, X означає CH, Z означає алкільний ланцюг, що містить 2 атоми вуглецю, при цьому алкільний ланцюг може бути заміщений карбоксигрупою, Y означає O, A означає феніл, що містить замісник, який описується наступною формулою: 1b N * R 3b Q N R 2b R 20 25 30 , в якій 1b 2b R і R означають водень, 3b R означає аміноетил, азетидин, піролідин або піперидин, Q означає зв'язок, * означає положення приєднання до залишку, позначеного за допомогою A, і l дорівнює 0, і до їх солей, їх сольватів і сольватів їх солей. Даний винахід також відноситься до сполук формули (I), в якій 1 2 R і R означають метил, 3 R означає -O-(SO2)OH, X означає CH, Z означає алкільний ланцюг, що містить 2 атоми вуглецю, заміщений карбоксигрупою, Y означає O, A означає феніл, що містить замісник, який описується наступною формулою: 1b N * R 3b Q N R 2b R 35 40 , в якій 1b 2b R і R означають водень, 3b R означає аміноетил, азетидин, піролідин або піперидин, Q означає зв'язок, * означає положення приєднання до залишку, позначеного за допомогою A, і l дорівнює 0, і до їх солей, їх сольватів і сольватів їх солей. Зокрема, даний винахід відноситься до сполук формули (I), в якій A означає групу, вибрану з числа груп, які описуються наступними формулами: 7 UA 110880 C2 NH NH H2N NH2 * NH NH2 F NH2 * NH NH Cl NH2 * OH NH * NH O NH Br NH2 NH2 * * OH NH2 O NH2 * NH * NH NH NH2 * * * NH NH NH NH NH * * NH NH NH NH NH NH NH2 * * * N NH2 NH HN NH HN NH NH NH NH2 NH NH NH NH NH * * O OH * O * NH2 NH2 OH NH2 NH NH NH NH NH NH NH NH * * NH * * N H N N H N NH N O NH NH NH NH * HN NH N NH NH * OH * * + O 8 N UA 110880 C2 NH NH NH NH NH NH NH * N NH N H NH N NH H N H N N H * N H * NH2 N H NH NH * NH * N H H2N NH NH * * * NH * NH NH NH NH H N NH NH OH * NH N H NH2 N H O * * * N H N H N NH2 NH NH2 N N H N H NH * * NH2 N NH2 * N H * * NH NH NH NH2 OH N NH2 N * N * N * NH * NH2 NH N NH2 NH2 * S N S NH2 * N N N * NH H N NH NH2 N H N H NH2 O * N H N N H N * NH N NH NH2 S NH2 * NH NH2 NH N NH NH NH2 N * S NH2 * NH NH NH * * N NH * NH2 * N N NH2 N N N * NH NH NH2 NH2 * NH N N N H N * 5 і до їх солей, їх сольватів і сольватів їх солей. Даний винахід також відноситься до способів одержання сполук формули (I). Сполуки, пропоновані в даному винаході, можна одержати шляхом видалення захисної групи із сполук формули A (CH2)l Y Z O N Pg H N N N H 1 R 2 R S X O N O 3 R (II), 1 3 в якій Pg означає захисну групу і R -R , A, l, X, Y і Z є такими, як визначено вище, в кислому середовищі. 9 UA 110880 C2 5 Умови проведення реакції в кислому середовищі можуть включати обробку сполук формули (II) мурашиною кислотою, оцтовою кислотою, трифтороцтовою кислотою або хлористоводневою кислотою при температурах, що знаходяться в діапазоні від 0 до 100 °C, впродовж часу, що знаходиться в діапазоні від 10 хв до 16 год., краще обробку 90 % мурашиною кислотою при температурі, що дорівнює 30-60 °C, впродовж 30-60 хв. Сполуки формули (II) можна синтезувати за реакцію сполук формули A (CH2)l Y Z O N Pg OH N N H X S O (III), в якій Pg означає захисну групу і A, l, X, Y і Z є такими, як визначено вище, зі сполуками формули 1 R H2 N 2 R N 10 15 20 25 30 35 3 R O (IV), 1 2 3 в якій R , R і R є такими, як визначено вище. Реакцію звичайно проводять в інертних розчинниках за присутності реагенту сполучення і, якщо це є підходящим, з додаванням основи, при температурі, яка знаходиться у діапазоні від 20 до 80 °C, впродовж 1-24 год., краще при температурі, що дорівнює 20-30 °C, впродовж ночі. Інертними розчинниками є, наприклад, дихлорметан (ДХМ), трихлорметан, бензол, толуол, тетрагідрофуран (ТГФ), 1,4-діоксан, N, N-диметилформамід (ДМФ), N, N-диметилацетамід (ДМА), N-метилпіролідин-2-он (NMP) і ацетонітрил, а також суміші зазначених вище розчинників. Кращим розчинником є N, N-диметилформамід. Придатними реагентами сполучення є, наприклад, карбодііміди, такі як N, N'-діетил-, N, N,'дипропіл-, N, N'-діізопропіл-, N, N'-дициклогексилкарбодіімід, N-(3-диметиламіноізопропіл)-N'етилкарбодіімідгідрохлорид (ЕДХ), N-циклогексилкарбодіімід-N‘-пропілоксиметилполістирол (ПС-карбодіімід), або карбонільні сполуки, такі як карбонілдіімідазол (КДІ), або 1,2-оксазолієві сполуки, такі як 2-етил-5-феніл-1,2-оксазолій-3-сульфат або 2-трет-бутил-5метилізоксазолійперхлорат, або ациламінові, такі як 2-етоксі-1-етоксикарбоніл-1,2дигідрохінолін, або пропанфосфоновий ангідрид, або ізобутилхлорформіат, або біс-(2-оксо-3оксазолідиніл)фосфорилхлорид, або O-(бензотриазол-1-іл)-N, N,N',N'тетраметилуронійгексафторфосфат (HBTU), 2-(2-оксо-1-(2H)-піридил)-1,1,3,3тетраметилуронійтетрафторборат (TPTU) або O-(7-азабензотриазол-1-іл)-N, N,N',N'тетраметилуронійгексафторфосфат (ГАТУ), або 1-гідроксибензотриазол (HOBt), або бензотриазол-1-ілокситрис(диметиламіно)фосфонійгексафторфосфат (BOP), або бензотриазол-1-ілокситрис(піролідино)фосфонійгексафторфосфат (PyBOP), або Nгідроксисукцинімід, а також суміші зазначених вище реагентів сполучення з додаванням або без додавання основи. В останньому випадку можна використовувати і неорганічні, і органічні основи. Придатними основами, є, наприклад, карбонати і бікарбонати, триетиламін, діізопропілетиламін, N-метилморфолін, N-метилпіперидин або 4-диметиламінопіридин. Краще, якщо реакції проводять з використанням суміші карбодііміду і 1-гідроксибензотриазолу з додаванням або без додавання бікарбонату натрію як основи. Сполуки формули (III) з бажаною Z-орієнтацією оксиму можна селективно одержати за реакцією сполук формули O Pg 40 OH N N H S X в якій Pg означає захисну групу, і X є таким, як визначено вище, зі сполуками формули 10 O (V), UA 110880 C2 A (CH2)l Y Z O H2 N 5 10 15 (VI), в якій A, l, Y і Z є такими, як визначено вище. Реакцію звичайно проводять в протонних розчинниках або в сумішах розчинників, що містять принаймні один протонний розчинник, при температурі, яка знаходиться у діапазоні від 0 до 100 °C, впродовж 1-24 год. Придатними протонними розчинниками є, наприклад, метанол, етанол, ізопропанол, трет-бутанол, вода або оцтова кислота. Розчинниками, придатними для одержання сумішей, є, наприклад, дихлорметан, трихлорметан, тетрагідрофуран, 1,4-діоксан, ацетонітрил і N, N-диметилформамід. Краще, якщо реакції проводять в суміші безводного етанолу і хлороформу при 20-30 °C впродовж ночі. Сполуки формули (IV) можна синтезувати відповідно до наступної літератури: J. Org. Chem. 1982, 47 (26), 5160–5167; WO 2007/65288; J. Antibiotics 1985, 38 (11), 1536-1549; WO 2008/116813; Org. Proc. Res. Dev. 2002, 6 (6), 863-868; EP 336667; DE 3336262; BE 904699, або за методиками, зміненим порівняно з описаними в зазначених публікаціях, шляхом, відомим спеціалісту в даній галузі техніки. Сполуки формули (V) можна синтезувати відповідно до наступної літератури: Chem. & Pharm. Bull., 1990, 38(12), 3476 – 3479; Bioorg. Med. Chem., 2007, 38 (21), 6716-6732; Chem. & Pharm. Bull., 1990, 38(12), 3476 – 3479 або Bioorg. Med. Chem., 2007, 38(21), 6716-6732. Сполуки формули (VI) можна одержати шляхом видалення захисної групи із сполук формули A (CH2)l Y Z O O N (VII) 20 25 30 O , в якій A, l, Y і Z є такими, як визначено вище. Реакцію видалення захисної групи звичайно проводять з використанням гідразину, аміаку або метиламіну, або їх солі або сольвату в протонних розчинниках або в сумішах розчинників, що містять принаймні один протонний розчинник, при температурі, яка знаходиться у діапазоні від 0 до 100 °C, впродовж 1-24 год. Протонними розчинниками є, наприклад, метанол, етанол, ізопропанол, трет-бутанол, вода або оцтова кислота. Розчинниками, придатними для одержання сумішей, є, наприклад, дихлорметан, трихлорметан, тетрагідрофуран, 1,4-діоксан, ацетонітрил і N, N-диметилформамід. Краще, якщо реакції проводять з використанням гідразинмоногідрату в безводному етанолі при 20-30 °C впродовж 2-6 год. Сполуки формули (VII) можна одержати за реакцію сполук формули A (CH2)l Y Z Lg 35 40 (VIII) , в якій Lg означає групу, що відщеплюється, і A, l, Y та Z є такими, як визначено вище, з N-гідроксифталімідом. Реакцію можна провести як реакцію типу реакції алкілування (Lg = галогенід, мезилат, тозилат, трифлат або подібна група) або типу реакції Міцунобу (Lg=OH). Реакції типу реакції алкілування звичайно проводять за присутності неорганічної або органічної основи в апротонних розчинниках при температурі, яка знаходиться у діапазоні від 0 до 100 °C, впродовж 1-24 год. Реакції типу реакції Міцунобу звичайно проводять за присутності трифенілфосфіну і алкілазодикарбоксилату в апротонних розчинниках при температурі, яка знаходиться у діапазоні від 0 до 100 °C, впродовж 1-24 год. Придатними апротонними розчинниками є, 11 UA 110880 C2 5 наприклад, ацетонітрил, тетрагідрофуран, дихлорметан, трихлорметан, 1,4-діоксан, N, Nдиметилформамід, N, N-диметилацетамід і N-метилпіролідин-2-он. Краще, якщо реакцію проводять за умов проведення реакції Міцунобу (Lg=OH) за присутності трифенілфосфіну і діізопропілазодикарбоксилату в безводному тетрагідрофурані при 0-30 °C впродовж 2-6 год. При використанні альтернативної кращої методики реакцію проводять за умов проведення реакції алкілування за присутності карбонату калію або 1,8-діазабіцикло[5.4.0]ундец-7-ену (ДБУ) в ацетонітрилі або N, N-диметилформаміді при 20-80 °C впродовж 2-16 год. Прикладами кращих сполук формули (VIII) є сполуки формул O A O Br 10 A Pg O O (VIIIa) OH (VIIIb), в яких Pg означає алкіл- або арилалкільну складноефірну захисну групу і A є таким, як визначено вище. Сполуки формули (VIIIa) і (VIIIb) можна синтезувати шляхом перетворення ціаногрупи, що міститься в сполуках формул O (Hetero)Aryl (гетеро)арил O CN (Hetero)Aryl (гетеро)арил Pg O O Br 15 20 25 30 35 40 45 , (IXa) CN OH (IXb) в яких Pg означає алкіл- або арилалкільну складноефірну захисну групу, на необхідну заміщену або незаміщену амідинову функціональну групу. Перетворення ціано(гетеро)арилу на відповідний амідин можна здійснити за ряду різних умов проведення реакцій в кислому і лужному середовищі. Однією можливістю є обробка ціано(гетеро)арилу газоподібною хлористоводневою кислотою в протонному розчиннику, такому як метанол або етанол, при 0-30 °C впродовж 2-24 год. Потім проміжний O-алкіламідат, що утворився, обробляють розчином аміаку або аміном в тому ж самому розчиннику при 20-50 °C впродовж 1-16 год. Газоподібна хлористоводнева кислота також може утворитися in situ із ацетилхлориду або тіонілхлориду; замість розчину аміаку також можна використовувати хлорид амонію за присутності основи, такої як триетиламін або діізопропілетиламін. Іншою можливістю є введення ціано(гетеро)арилу в реакцію з аміном, хлоридом амонію або сіллю аміну за присутності триметилалюмінію в непротонному розчиннику, такому як толуол або дихлорбензол, при 20-120 °C впродовж 1-16 год. Іншою можливістю є обробка ціано(гетеро)арилу гідроксиламіном в полярних розчинниках, таких як етанол, вода або диметилсульфоксид, або в суміші зазначених вище розчинників при 20-80 °C впродовж 1-16 год. Потім проміжний амідоксим, що утворився, деоксигенують з використанням водню над паладієм на вугіллі в оцтовій кислоті при 20-50 °C впродовж 4-24 год. Замість гідроксиламіну можна використовувати гідроксиламінгідрохлорид за присутності триетиламіну або діізопропілетиламіну; деоксигенування також можна провести з використанням співрозчинника, такого як метанол, етанол або 1,4-діоксан, або з використанням додатково ангідриду оцтової кислоти. Іншою можливістю є обробка ціано(гетеро)арилу алкоксидом натрію у відповідному спирті, краще метоксидом натрію в метанолі, при 20-50 °C впродовж 2-20 год. Потім проміжний Oалкіламідат, що утворився, обробляють розчином аміаку або аміном так, як описано вище. Іншою можливістю є обробка ціано(гетеро)арилу гексаметилдисилазидом літію в інертному розчиннику, такому як тетрагідрофуран при 0-20 °C впродовж 2-20 год. Потім із утвореного проміжного амідину, який містить захисну силільну групу, видаляють захисну групу шляхом обробки кислотою в полярному розчиннику, краще хлористоводневою кислотою в етанолі, при 0-20 °C впродовж 1-16 год. При цьому гексаметилдисилазид літію може утворитися in situ, наприклад, із н-бутиллітію і гексаметилдисилазану. Сполуки формули (IXa) і (IXb) можна синтезувати із сполук формули (Hetero)Aryl (гетеро)арил HO (X) 12 CN UA 110880 C2 5 10 15 20 25 30 35 40 45 50 55 60 за методиками алкілування, зміненими порівняно з описаними в літературі, наприклад, в публікації J. Am. Chem. Soc. 2009, 131 (10), 3762-3771 і в WO 2008096189, або за методиками розкриття циклу епоксидної групи, зміненими порівняно з описаними в літературі, наприклад, в публікаціях ChemMedChem. 2007, 2 (5), 641-654; Heterocycles 2005, 65 (11), 2667-2674 і Tetrahedron Lett. 2001, 42 (50), 8743-8745. Перед проведенням алкілування або розкриття циклу епоксидної групи, сполуки формули (X) також можна спочатку перетворити на відповідний амідин за методиками, що докладно описані вище. Сполуки, пропоновані в даному винаході, характеризуються цінним діапазоном фармакологічних характеристик, які неможливо було прогнозувати. Тому вони придатні для застосування як лікарські засоби для лікування і/або профілактики захворювань у людей і тварин. Сполуки, пропоновані в даному винаході, зокрема, характеризуються сприятливим діапазоном антибактеріальних характеристик. Тому даний винахід також відноситься до застосування сполук, пропонованих в даному винаході, для лікування і/або профілактики захворювань, викликаних бактеріями, зокрема грамнегативними бактеріями. Даний винахід також відноситься до застосування сполук, пропонованих в даному винаході, для лікування і/або профілактики захворювань, краще захворювань, зазначених нижче. Даний винахід також відноситься до застосування сполук, пропонованих в даному винаході, для приготування лікарського засобу, призначеного для лікування і/або профілактики захворювань, зокрема бактеріальних інфекцій і краще захворювань, зазначених нижче. Даний винахід також відноситься до способу лікування і/або профілактики захворювань, зокрема бактеріальних інфекцій і краще захворювань, зазначених нижче, з використанням сполук, пропонованих в даному винаході, в терапевтично ефективній кількості. Сполуки, пропоновані в даному винаході, мають спектр антибактеріального впливу по відношенню до грамнегативних бактерій і деяких грампозитивних бактерій в поєднанні з низькою токсичністю. Сполуки, пропоновані в даному винаході, є особливо придатними для застосування у ветеринарії і медицині для профілактики і лікування місцевих і системних інфекцій, які викликані, наприклад, наступними патогенами або сумішами наступних патогенів: Аеробні грампозитивні бактерії: включаючи, але не обмежуючись тільки ними, Staphylococcus spp. (S. aureus), Streptococcus spp. (S. pneumoniae, S. pyogenes, S. agalactiae, Streptococcus груп C і G), а також Bacillus spp. і Listeria monocytogenes. Аеробні грамнегативні бактерії: Enterobacteriaceae, включаючи, але не обмежуючись тільки ними, Escherichia spp. (E. coli), Citrobacter spp. (C. freundii, C. diversus), Klebsiella spp. (K. pneumoniae, K. oxytoca), Enterobacter spp. (E. cloacae, E. aerogenes), Morganella morganii, Hafnia alvei, Serratia spp. (S. marcescens), Proteus spp. (P. mirabilis, P. vulgaris, P. penneri), Providencia spp. (P. stuartii, P. rettgeri), Yersinia spp. (Y. enterocolitica, Y. pseudotuberculosis), Salmonella spp., Shigella spp., а також неферментуючі бактерії, включаючи, але не обмежуючись тільки ними, Pseudomonas spp. (P. aeruginosa), Burkholderia spp. (B. cepacia), Stenotrophomonas maltophilia і Acinetobacter spp. (A. baumannii, Acinetobacter gen. sp. 13TU, Acinetobacter gen. sp. 3), а також Bordetella spp. (B. bronchiseptica), Moraxella catarrhalis і Legionella pneumophila; крім того, Aeromonas spp., Haemophilus spp. (H. influenzae), Neisseria spp. (N. gonorrhoeae, N. meningitidis), а також Alcaligenes spp. (включаючи A. xylosoxidans), Pasteurella spp. (P. multocida), Vibro spp. (V. cholerae), Campylobacter jejuni і Helicobacter pylori. Крім того, до спектру антибактеріального впливу також входять строго анаеробні бактерії, включаючи, але не обмежуючись тільки ними, Bacteroides spp. (B. fragilis), Peptostreptococcus spp. (P. anaerobius), Prevotella spp., Brucella spp. (B. abortus), Porphyromonas spp. і Clostridium spp. (Clostridium perfringens). Представлений вище перелік патогенів наведений в основному для прикладу і його жодним чином не слід вважати обмежуючим. Прикладами захворювань, які можуть бути викликані зазначеними патогенами і які можна попередити, перебіг яких можна покращити або які можна вилікувати сполуками, пропонованими в даному винаході, є, наприклад: Інфекції дихальних шляхів, такі як інфекції нижніх дихальних шляхів, інфекція легень у страждаючих на муковісцидоз пацієнтів, гострий напад хронічного бронхіту, позалікарняна пневмонія (ПЛП), внутрішньолікарняна пневмонія (включаючи пневмонію, пов'язану з штучною вентиляцією легень (ШВЛ)), захворювання верхніх дихальних шляхів, дифузний панбронхіоліт, тонзиліт, фарингіт, гострий синусит і отит, включаючи мастоїдит; інфекції сечових шляхів і геніталій, наприклад, цистит, уретрит, пієлонефрит, ендометрит, простатит, сальпінгіт і епідидиміт; інфекції очей, такі як кон'юнктивіт, язва роговиці, іридоцикліт і післяопераційні 13 UA 110880 C2 5 10 15 20 25 30 35 40 45 50 55 60 інфекції у пацієнтів після проведення радіальної кератотомії; кров'яні інфекції, наприклад, сепсис; інфекції шкіри і м'яких тканин, наприклад, інфекційний дерматит, інфіковані рани, інфіковані опіки, флегмона, фолікуліт і імпетиго; інфекції кісток і суглобів, такі як остеомієліт і септичний артрит; інфекції шлунково-кишкового тракту, наприклад, дизентерія, ентерит, коліт, некротичний ентероколіт і аноректальні інфекції; внутрішньочеревні інфекції, такі як черевний тиф, інфекційна діарея, перитоніт при апендициті, пельвіоперитоніт і внутрішньочеревні абсцеси; інфекції порожнини рота, наприклад, інфекції після стоматологічних операцій; інші інфекції, наприклад, меліодоз, інфекційний ендокардит, абсцеси печінки, холецистит, холангіт, мастит, а також менінгіт і інфекції нервової системи. Крім лікування людей, можна лікувати бактеріальні інфекції у тварин, таких як примати, свині, жуйні тварини (корови, вівці, кози), коні, кішки, собаки, домашня птиця (така як кури, індики, перепели, голуби, декоративні птахи), а також продуктивна і декоративна риба, плазуни і амфібії. Сполуки, пропоновані в даному винаході, можуть діяти системно і/або місцево. Для забезпечення такого впливу їх можна вводити відповідним шляхом, таким як, наприклад, парентеральний, легеневий, назальний, сублінгвальний, лінгвальний, трансбукальний, ректальний, шкірний, черезшкірний, кон'юнктивальний, вушний, або у вигляді імплантату або стенту. При використанні цих шляхів введення сполуки, пропоновані в даному винаході, можна вводити в відповідних препаративних формах. Парентеральне ведення можна проводити з виключенням стадії всмоктування (наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньокардіально, внутрішньохребцево або внутрішньопопереково) або із включенням стадії всмоктування (наприклад, внутрішньом'язово, підшкірно, внутрішньошкірно, нашкірно або внутрішньочеревно). Препаративними формами, придатними для парентерального введення, зокрема, є, препарати для ін'єкції і вливання в формі розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Придатними для інших шляхів введення є, наприклад, фармацевтичні форми для інгаляції (зокрема, для порошкових інгаляторів, розпилювачів), краплі, розчини, спреї для носу; таблетки, плівки/облатки або капсули для лінгвального, сублінгвального або трансбукального введення, супозиторії, препарати для очей і вух, вагінальні капсули, водні суспензії (лосьйони, збовтувані суміші), ліпофільні суспензії, мазі, креми, черезшкірні терапевтичні системи (такі як, наприклад, пластири), молочко, пасти, плівки, присипки, імплантати або стенти. Сполуки, пропоновані в даному винаході, можна перетворити на зазначені препаративні форми. Це можна виконати звичайним чином шляхом змішування з інертними, нетоксичними фармацевтично прийнятними інертними наповнювачами. Ці інертні наповнювачі, зокрема, включають носії (наприклад, мікрокристалічну целюлозу, лактозу, маніт), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори і диспергуючі засоби або змочувальні агенти (наприклад, додецилсульфат натрію, поліоксисорбітанолеат), зв'язуючі (наприклад, полівінілпіролідон), синтетичні і натуральні полімери (наприклад, альбумін), стабілізатори (наприклад, антіоксиданти, такі як, наприклад, аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як, наприклад, оксиди заліза) і речовини, що виправляють смак і/або запах. Даний винахід також відноситься до лікарських засобів, які містять принаймні одну сполуку, пропоновану в даному винаході, звичайно разом з одним або більшою кількістю інертних, нетоксичних фармацевтично прийнятних інертних наповнювачів, а також до їх застосування для зазначених вище цілей. Даний винахід також відноситься до лікарських засобів, які містять принаймні одну сполуку, пропоновану в даному винаході, в комбінації принаймні з однією додатковою активною сполукою, а також до їх застосування для зазначених вище цілей. Приклади додаткової активної сполуки включають інгібітори β-лактамази. Приклади придатних інгібіторів β-лактамази, що використовуються в комбінації зі сполуками, пропонованими в даному винаході, включають клавуланову кислоту, тазобактам, сулбактам, авібактам (NXL-104) і MK-7655. Мінімальна кількість сполук, пропонованих в даному винаході, яку необхідно ввести, є терапевтично ефективною кількістю. Термін "терапевтично ефективна кількість" означає кількість сполуки, яка попереджує початок, полегшує симптоми, зупиняє прогресування бактеріальної інфекції і/або усуває її у людей або тварин. Звичайно ефективний режим дозування сполук, пропонованих в даному винаході, для дорослих включає введення від приблизно 50 до приблизно 3000 мг сполуки формули (I) в разовій дозі; в другому варіанті здійснення ефективна разова доза становить від приблизно 100 14 UA 110880 C2 5 10 15 20 25 30 35 40 45 50 55 60 до приблизно 2000 мг. В іншому варіанті здійснення ефективна разова доза становить від приблизно 500 до приблизно 1200 мг. Звичайно дози вводять від 1 до 4 разів на добу. В одному варіанті здійснення дози вводять 3 рази на добу. В деяких випадках може виявитися необхідним використання доз, що знаходяться за межами цих значень. Тим не менше за відповідних показань може виявитися необхідним відхилення від зазначених кількостей, зокрема, залежно від маси тіла, шляху введення, індивідуальної реакції на активний інгредієнт, типу препарату і часу або інтервалу між введеннями. Таким чином, в деяких випадках буде достатньо використання кількості, меншої зазначеної мінімальної, а в інших випадках необхідно перевищити зазначену верхню межу. У випадку введення більш значних кількостей може виявитися доцільним їх розділення на декілька окремих доз, що вводяться впродовж доби. В наведених нижче дослідженнях і прикладах, якщо не зазначено інше, виражені в процентах значення є масовими; виражені в частинах значення також є масовими. Співвідношення кількостей розчинників, співвідношення розбавлення і значення концентрації в розчинах рідина/рідина у всіх випадках є об'ємними. Вираз "мас./об." означає "маса/об'єм". Так, наприклад, "10 % мас./об." означає: 100 мл розчину або суспензії містить 10 г речовини. Приклади Абревіатури : хімічний зсув в част./млн br s: широкий синглет в ЯМР CDCl3: дейтерований хлороформ d: дублет в ЯМР dd: дублет дублетів в ЯМР ДХМ: дихлорметан ДМФ: N, N-диметилформамід ДМСО: диметилсульфоксид EtOAc: етилацетат ЕР : режим негативних іонів в мас-спектрометрії з іонізацією електророзпиленням + ЕР : режим позитивних іонів в мас-спектрометрії з іонізацією електророзпиленням г: грам(-и) ч: година(-и) ВЕРХ: високоефективна рідинна хроматографія Гц: герц J: константа спін-спінової взаємодії в ЯМР л: літр(-и) M: молярна концентрація m: мультиплет в ЯМР мг: міліграм(-и) МГц: мегагерц хв: хвилина (хвилини) мл: мілілітр(-и) ммоль: мілімоль(-і) моль: моль(-і) МС: мас-спектрометрія н.: нормальна концентрація ЯМР: ядерний магнітний резонанс q: квартет в ЯМР s: синглет в ЯМР t: триплет в ЯМР t-BuOH: трет-бутиловий спирт ТФК: трифтороцтова кислота ТГФ: тетрагідрофуран ТШХ: тонкошарова хроматографія ТМС: тетраметилсилан Аналітичні методики 1 19 Всі спектри H і F ЯМР знімали за допомогою спектрометра ЯМР Varian Oxford AS 400, 1 19 працюючого при 400 МГц у випадку H і при 376 МГц у випадку F відповідно. Дані ЯМР реєстрували у вигляді хімічних зсувів відносно тетраметилсилану (ТМС), що використовувався як внутрішній стандарт. Спектри ЯМР знімали з використанням CDCl 3 з додаванням 0,05 % ТМС, CD3OD з додаванням 0,05 % ТМС або ДМСО-d6 з додаванням 0,03 % ТМС. 15 UA 110880 C2 5 10 15 20 Аналіз за допомогою ВЕРХ проводили з використанням модуля розділення Waters 2695 і детектуючої системи з фотодіодною матрицею Waters 2996 або з використанням блоку керування Waters 600, включаючи автоматичний пробовідбірник Waters 717plus, і детектуючу систему з фотодіодною матрицею Waters 2996, на колонці Atlantis T3-C18-3 мкм-4,6150 мм з використанням суміші ацетонітрил/0,1 % водний розчин H3PO4 в градієнтному режимі при 22 °C і швидкості потоку, що дорівнює 1 мл/хв. Препаративну ВЕРХ проводили за допомогою системи Waters Prep LC 2767 з використанням блоку керування Waters Prep HPLC і детектора поглинання при двох довжинах хвиль Waters 2487 на колонці Gem-C-18-10 мкм-50100 мм (швидкість потоку: 70 мл/хв), XBridge-C-18-5 мкм 30100 мм (швидкість потоку: 42 мл/хв), Ace-C-18-5 мкм 30250 мм (швидкість потоку: 40 мл/хв) або GemNX-C-18-10 мкм-50250 мм (швидкість потоку: 80 мл/хв) з використанням суміші ацетонітрил/0,1 % водний розчин трифтороцтової кислоти в градієнтному режимі або суміші ацетонітрил/0,1 % водний розчин мурашиної кислоти в градієнтному режимі при 22 °C. Мас-спектри знімали за допомогою модуля розділення Waters 2795 з використанням режиму + іонізації ЕР або ЕР . Колонкову хроматографію проводили з використанням силікагелю, що випускається фірмою Desican Inc.: марка CC (230 – 400 меш). Наявні у продажу розчинники і реагенти звичайно використовували без додаткового очищення. Всі продукти сушили до дослідження характеристик і використання на наступних стадіях синтезу. Загальні методики синтезу 1. Синтез β-лактамних структурних фрагментів 1.1. (3S, 4S)-3-Аміно-4-метил-2-оксоазетидин-1-сульфонова кислота H2 N O N S O O 25 OH 1_1_1 Сполуку 1_1_1 синтезували відповідно до публікації David M. Floyd, Alan W. Fritz, Josip Pluscec, Eugene R. Weaver, Christopher M. Cimarusti J. Org. Chem., 1982, 47 (26), 5160–5167. 1.2. (3S, 4S)-3-Аміно-4-метил-1-(сульфооксі)азетидин-2-он H2 N N O 30 O O O S OH 1_2_1 Сполуку 1_2_1 синтезували відповідно до WO 2007/65288 1.3. (3S, 4R)-3-Аміно-4-метил-2-оксоазетидин-1-сульфонова кислота H2 N O N S O O 35 OH 1_3_1 Сполуку 1_3_1 синтезували відповідно до публікації David M. Floyd, Alan W. Fritz, Josip Pluscec, Eugene R. Weaver, Christopher M. Cimarusti J. Org. Chem., 1982, 47 (26), 5160–5167. 1.4. (3S, 4R)-3-Аміно-4-метил-1-(сульфооксі)азетидин-2-он 16 UA 110880 C2 5 10 15 20 25 30 35 40 45 До розчину гідроксиду калію (2,53 г, 45,1 ммоль в 28 мл води) при кімнатній температурі додавали L-алотреонін (3,0 мг, 25,1 ммоль) і суміш охолоджували до 24 °C з використанням бані з льодом. Потім до безбарвної реакційної суміші без охолодження впродовж 20 хв порціями додавали розчин ди-трет-бутилдикарбонату (Boc2O, 6,02 г в 15 мл t-BuOH) і одержували білий каламутний розчин. Потім реакційну суміш перемішували при кімнатній температурі впродовж 5 год. до тих пір, поки ТШХ (ацетонітрил/ацетон/оцтова кислота, 15:15:1) не вказувала на повну відсутність вихідної речовини. Потім впродовж 7 хв порціями додавали Oбензилоксигідроксиламінгідрохлорид (6,0 г, 37,6 ммоль), потім порціями додавали 6,0 н. розчин HCl (4 мл), підтримуючи значення pH на рівні 4 (утворюється білий дим), потім до реакційної суміші при охолодженні порціями додавали 1-етил-3-(3диметиламінопропіл)карбодіімідгідрохлорид (4,81 г, 25,1 ммоль). Реакційну суміш перемішували при кімнатній температурі впродовж ночі, насичували хлоридом натрію і екстрагували етилацетатом (2200 мл). Органічні екстракти об'єднували, сушили над MgSO 4, фільтрували, випарювали насухо і сушили в вакуумі і одержували сполуку 1_4_2 (6,5 г, 79,5 %) у вигляді в'язкого масла. 1 H ЯМР (400 МГц, ДМСО-d6): =1,02 (d, J=5,8 Гц, 3 H), 1,36 (s, 9 H), 3,49-3,83 (m, 1 H), 3,563,70 (m, 1 H), 4,70-4,81 (m, 2 H), 4,86 (d, J=4,6 Гц, 1 H), 6,73 (d, J=8,5 Гц, 1 H), 7,29-7,42 (m, 5 H), 11,09 (s, 1 H). Діетилазодикарбоксилат (ДЕАД, 0,51 мл. 3,08 ммоль) при кімнатній температурі впродовж 5 хв по краплях додавали до розчину сполуки 1_4_2 (1,0 г, 3,08 ммоль) і трифенілфосфіну (0,81 г, 3,08 ммоль) в ТГФ (40 мл). Реакційну суміш нагрівали при 50 °C впродовж 6 год. і концентрували і одержували в'язке масло, яке очищали за допомогою колонкової хроматографії при елюювані сумішшю етилацетат/гексан (40:60), і одержували сполуку 1_4_3 (0,30 г, 31,7 %). 1 H ЯМР (400 МГц, ДМСО-d6): =1,01 (d, J=5,8 Гц, 3 H), 1,38 (s, 9 H), 3,87-4,11 (m, 1 H), 4,62 (dd, J=9,3 і 5,1 Гц, 1 H), 4,78-5,02 (m, 2 H), 7,21-7,51 (m, 5 H), 7,64 (d, J=9,3 Гц, 1 H). До розчину сполуки 1_4_3 (1,0 г, 3,26 ммоль) в етанолі (100 мл) додавали 10 % Pd/C (100 мг, 2 вологий) і суміш гідрували при тиску, що дорівнює 30 фунт-сила/дюйм , впродовж 3 год. ТШХ (1:1, етилацетат в гексанах) вказувала на завершення реакції. Каталізатор видаляли фільтруванням через шар целіту і промивали метанолом (250 мл). Фільтрат концентрували в вакуумі і одержували сполуку 1_4_4 у вигляді твердої речовини (0,7 г, 99 %), яку використовували на наступній стадії без додаткового очищення. 1 H ЯМР (400 МГц, ДМСО-d6): =1,05 (d, J=6,2 Гц, 3 H), 1,37 (s, 9 H), 3,69-4,09 (m, 1 H), 4,60 (dd, J=8,9 і 5,1 Гц, 1 H), 7,62 (d, J=9,3 Гц, 1 H), 9,92-10,40 (m, 1 H). До розчину сполуки 1_4_4 (2,0 г, 9,24 ммоль) в безводному піридині (20 мл) додавали комплекс триоксид сірки-піридин (1,76 г, 11,09 ммоль) і суміш перемішували при кімнатній температурі впродовж 2 год. Суміш концентрували в вакуумі і одержували спінену речовину, яку розтирали з дихлорметаном (10 мл) і гексаном (30 мл) і одержували сполуку 1_4_5 у вигляді білої твердої речовини (3,46 г), яку безпосередньо використовували на наступній стадії. Сполуку 1_4_5 (3,46 г, 9,21 ммоль) розчиняли в 0,5 M розчині дигідрофосфату калію (100 мл), екстрагували етилацетатом (2100 мл) і екстракт, що містить етилацетат, відкидали. До водного шару однією порцією додавали тетра-н-бутилсульфат амонію (3,13 г, 9,21 ммоль). Суміш перемішували при кімнатній температурі впродовж 1 год. і екстрагували дихлорметаном (250 мл). Об'єднані органічні шари промивали розсолом, сушили над сульфатом натрію, фільтрували і концентрували в вакуумі і одержували сполуку 1_4_6 у вигляді спіненої речовини 17 UA 110880 C2 5 10 15 20 25 30 35 40 (4,0 г), яку безпосередньо використовували на наступній стадії. Сполуку 1_4_6 (4,00 г, 7,41 ммоль) розчиняли в 98 % мурашиній кислоті (16 мл) і суміш перемішували при кімнатній температурі впродовж 3 год. Через декілька хвилин починалося утворення білого осаду. До реакційної суміші додавали дихлорметан (30 мл) і суміш охолоджували до 0-5 °C і витримували в холодильнику впродовж ночі. Білий осад, що утворився, виділяли фільтруванням і сушили в вакуумі і одержували сполуку 1_4_7 (1,00 г, 75,8 %). 1 H ЯМР (400 МГц, ДМСО-d6): =1,32 (d, J=6,2 Гц, 3 H), 4,30-4,42 (m, 1 H), 4,50 (d, J=5,0 Гц, 1 H), 8,31-9,20 (m, 3 H). 1.5. (3S)-3-Аміно-4,4-диметил-1-(сульфооксі)азетидин-2-он До попередньо охолодженого метанолу (650 мл) при 0 °C впродовж 15 хв по краплях додавали ацетилхлорид (AcCl, 96,0 мл, 1,35 моль). Розчин перемішували впродовж ще 5 хв і потім порціями додавали твердий D-серин (51,0 г, 0,49 моль). Одержану суміш кип'ятили зі зворотним холодильником впродовж 2 год., потім охолоджували до кімнатної температури і розчинник видаляли при зниженому тиску. Одержану тверду речовину розтирали з сумішшю гексан/ефір складу 3:1 (300 мл) і одержували сполуку 1_5_2 у вигляді майже білої твердої речовини, яку ретельно сушили в сушильній шафі в вакуумі впродовж ночі, і одержували сполуку 1_5_2 (87,0 г, 99 %) у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, метанол-d4): =3,72 (s, 3H), 3,81 (br. s, 2H), 4,07 (s, 1H), 5,6 (br. s, 1H), 8,78 (br. s, 2H). Триетиламін (ТЕА, 183 мл, 1,3 моль) при 0 °C по краплях додавали до розчину сполуки 1_5_2 (94,0 г, 0,605 моль) в ТГФ (3 л). До одержаної густої білої суспензії при такій же температурі впродовж 1,5 год. по краплях додавали розчин ди-трет-бутилдикарбонату (135,0 г, 0,65 моль) в ТГФ (500 мл). Реакційну суміш перемішували при кімнатній температурі впродовж 16 год. Розчинник видаляли при зниженому тиску і залишок піддавали розподіленню між діетиловим ефіром (3 л) і насиченим водним розчином бікарбонату натрію (3 л). Водний шар екстрагували діетиловим ефіром (32 л), органічні екстракти об'єднували і сушили над сульфатом натрію, фільтрували і фільтрат концентрували при зниженому тиску і одержували сполуку 1_5_3 (134,0 г, 75 %) у вигляді в'язкого масла. 1 H ЯМР (400 МГц, CDCl3): =1,42 (s, 9H), 3,80 (s, 3H), 3,90 (m, 2H), 4,38 (br. s, 1H), 5,44 (br. s, 1H). 3,0 M Розчин MeMgBr в діетиловому ефірі (450 мл, 1,35 моль) при -78 °C по краплях додавали до охолодженого розчину сполуки 1_5_3 (50,0 г, 0,23 моль) в діетиловому ефірі (2 л). Реакційній суміші давали нагрітися до кімнатної температури, її перемішували при кімнатній температурі впродовж 1 год. і потім виливали в насичений водний розчин хлориду амонію (2,5 л). Органічний шар відокремлювали і водний шар екстрагували етилацетатом (32 л). Об'єднані органічні шари промивали розсолом, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску. Залишок розтирали з сумішшю діетиловий ефір/гексан (1:2, 500 мл) і охолоджували в бані з льодом. Тверду речовину, що залишилася, виділяли 18 UA 110880 C2 5 10 15 20 25 30 35 40 45 50 55 60 фільтруванням і одержували сполуку 1_5_4 (33,0 г, 66 %) у вигляді безбарвної твердої речовини. 1 H ЯМР (400 МГц, CDCl3): =1,25 (s, 3 H), 1,35 (s, 3 H), 1,43-1,48 (m, 9 H), 2,49 (br. s, 1 H), 2,62 (br. s, 1 H), 3,47 (d, J=8,9 Гц, 1 H), 3,76-3,86 (m, 1 H), 3,98-4,09 (m, 1 H), 5,37 (br. s, 1 H). 2,2,6,6-Тетраметилпіперидин 1-оксил (TEMPO, 2,3 г, 15 ммоль) додавали до суміші сполуки 1_5_4 (33,0 г, 150 ммоль) в ацетонітрилі (750 мл) і буферу на основі фосфату натрію (600 мл, 0,7 M розчин, pH 6-7) і одержану суміш нагрівали при 35 °C. Потім суміш обробляли шляхом одночасного додавання розчину хлориту натрію (34,2 г в 150 мл води) і 60 крапель сильно розведеного розчину гіпохлориту натрію (3 мл наявного в продажу розчину в 100 мл води). Суміш перемішували при 35 °C впродовж ночі, охолоджували до кімнатної температури, обробляли лимонною кислотою (~15 г, pH 3), насичували хлоридом натрію і екстрагували етилацетатом (32 л). Органічні екстракти об'єднували і концентрували при зниженому тиску. Залишок розчиняли в 1,5 л 2 M розчину карбонату натрію і промивали етилацетатом (22 л). Водний шар охолоджували до 0 °C, 2 M розчином H3PO4 значення pH доводили до рівня 3,0 і розчин насичували хлоридом натрію. Одержану суміш екстрагували етилацетатом (32 л), органічні фази об'єднували, сушили, фільтрували і концентрували при зниженому тиску і одержували сполуку 1_5_5 (28,4 г, 81 %) у вигляді безбарвної твердої речовини. 1 H ЯМР (400 МГц, ДМСО-d6): =1,15 (s, 3 H), 1,17 (s, 3 H), 1,39 (s, 9 H), 3,86 (d, J=8,6 Гц, 1 H) 6,52 (d, J=8,9 Гц, 1 H). Дициклогексилкарбодіімід (ДЦК, 19,5 г, 94,3 ммоль) при кімнатній температурі додавали до розчину сполуки 1_5_5 (20,0 г, 85,7 ммоль) в N, N-диметилформаміді, потім додавали 1гідроксибензотриазол (HOBt, 12,7 г, 94,3 ммоль). Одержану суміш перемішували при кімнатній температурі впродовж 30 хв і додавали O-бензилоксигідроксиламінгідрохлорид (15,1 г, 94,3 ммоль), потім бікарбонат натрію (18,0 г, 214,3 ммоль). Реакційну суміш перемішували при кімнатній температурі впродовж 24 год. і фільтрували через шар целіту, промивали етилацетатом (250 мл) і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії при елюювані за допомогою 30-40 % етилацетату в гексані і одержували сполуку 1_5_6 (24,5 г, 84,5 %) у вигляді безбарвної твердої речовини. 1 H ЯМР (400 МГц, ДМСО-d6): =1,05 (s, 3 H), 1,08 (s, 3 H), 1,26 (s, 9 H), 3,74 (d, J=9,3 Гц, 1 H), 4,62 (br. s, 1 H), 4,72 (s, 2 H), 6,42 (d, J=8,9 Гц, 1 H), 7,26-7,47 (m, 5 H), 11,03 (br. s, 1 H). До розчину сполуки 1_5_6 (96,0 г, 0,283 моль) в піридині (1 л) при 0 °C порціями додавали комплекс триоксид сірки-піридин (58,7 г, 0,368 моль) і суміш перемішували впродовж 2 год. Піридин видаляли в вакуумі і залишок розтирали з сумішшю діетиловий ефір/гексани (1:10, 1 л) для видалення більшої частини піридину. До твердого проміжного продукту додавали розчин карбонату калію (240 г в 1,2 л води) і 500 мл етилацетату. Одержану суміш кип'ятили зі зворотним холодильником впродовж 2 год., охолоджували до кімнатної температури і шар, що містить етилацетат, відокремлювали. Водний шар екстрагували етилацетатом (2200 мл) і об'єднані шари, що містять етилацетат, промивали розсолом, сушили над сульфатом натрію, фільтрували і концентрували. Залишок очищали за допомогою колонкової хроматографії при елюювані за допомогою 30-40 % етилацетату в гексанах. Цільові фракції об'єднували і концентрували. Залишок розтирали з 10 % ефіром в гексані (~400 мл) і одержували сполуку 1_5_7 (58,1 г, 64 %) у вигляді безбарвної твердої речовини. 1 H ЯМР (400 МГц, CDCl3): =1,08 (s, 3H), 1,32 (s, 3H), 1,43 (s, 9H), 4,30 (d, J=6,8 Гц, 1H), 4,96 (s, 2H), 7,40 (m, 5H). До розчину сполуки 1_5_7 (30,0 г, 93,6 ммоль) в метанолі (600 мл) додавали 5 % Pd/C (6,0 г, 2 вологий, ~50 % води) і суміш гідрували при тиску, що дорівнює 50 фунт-сила/дюйм , впродовж 1 год. ТШХ (1:1, етилацетат в гексанах) вказувала на завершення реакції. Каталізатор видаляли фільтруванням через шар целіту і промивали метанолом (2100 мл). Фільтрат концентрували в вакуумі і одержану тверду речовину розтирали з 10 % ефіром в гексанах (100 мл), фільтрували і сушили в вакуумі і одержували сполуку 1_5_8 (21,9 г, кількісний вихід) у вигляді безбарвної твердої речовини. 1 H ЯМР (400 МГц, ДМСО-d6): =1,17 (s, 3H), 1,31 (s, 3H), 1,41 (s, 9H), 4,21 (d, J=6,8 Гц, 1H), 7,71 (d, J=6,8 Гц, 1H), 10,01 (br. s, 1H). До розчину сполуки 1_5_8 (50,0 г, 0,217 моль) в піридині (500 мл) при 0 °C додавали комплекс триоксид сірки-піридин (39,7 г, 0,249 моль). Одержану суміш перемішували при кімнатній температурі впродовж 1,5 год. і концентрували в вакуумі і одержували сполуку 1_5_9 (106,0 г) у вигляді спіненої речовини, яку розчиняли в 4 л 0,5 M розчину KH 2PO4 і екстрагували дихлорметаном (2400 мл). Водний шар охолоджували до 0 °C і додавали тетра-нбутилсульфат амонію (84,8 г, 0,249 моль). Одержану суміш перемішували при 0-5 °C впродовж 1 год. і екстрагували дихлорметаном (5500 мл). Об'єднані шари, що містять дихлорметан, 19 UA 110880 C2 5 10 15 20 25 30 35 40 45 промивали розсолом, сушили над сульфатом натрію, фільтрували і концентрували в вакуумі і одержували проміжний продукт 1_5_10 (115,0 г) у вигляді спіненої речовини, яку розчиняли в 96 % мурашиній кислоті (500 мл) і одержану суміш перемішували при кімнатній температурі впродовж 4 год. Через декілька хвилин починалося утворення білого осаду. До реакційної суміші додавали дихлорметан (500 мл) і суміш охолоджували до 0-5 °C і витримували в холодильнику впродовж вихідних днів. Білий осад виділяли фільтруванням і сушили в вакуумі і одержували сполуку 1_5_11 (24,5 г, 53 % за 3 стадії) у вигляді безбарвної твердої речовини. 1 H ЯМР (400 МГц, ДМСО-d6): =1,42 (s, 3H), 1,43 (s, 3H), 4,15 (s, 1H), 8,80 (br. s, 2H). 1.6. {[(3S, 4S)-3-Аміно-4-метил-2-оксоазетидин-1-іл]окси}метансульфонова кислота Ди-трет-бутилдикарбонат (56,7 г, 59,7 мл, 0,23 моль, Aldrich) при 0 °C по краплях додавали до розчину L-треоніну 1_6_1 (23,8 г, 0,2 моль) в ТГФ (200 мл) і 2 н. водному розчині гідроксиду натрію (120 мл). Одержану суміш перемішували при температурі, що дорівнює від 0 °C до кімнатної температури, впродовж ночі і концентрували при зниженому тиску для видалення розчинника. Залишок насичували хлоридом амонію, охолоджували до 0 °C, підкислювали 1 н. хлористоводневою кислотою до pH 3 і екстрагували етилацетатом (3100 мл). Об'єднані органічні шари промивали водою (200 мл) і розсолом (200 мл), сушили над сульфатом натрію і концентрували при зниженому тиску. Залишок обробляли гексаном (300 мл) і фільтрували і одержували сполуку 1_6_2 (39,7 г, 91 %) у вигляді безбарвної твердої речовини. 1 H ЯМР (400 МГц, ДМСО-d6): =1,06 (d, J=6,2 Гц, 3 H), 1,37 (s, 9 H), 3,86 (dd, J=9,1 і 3,3 Гц, 1 H), 3,98-4,08 (m, 1 H), 6,29 (d, J=9,3 Гц, 1 H). (Аміноокси)метансульфонову кислоту 1_6_3 (5,9 г, 46,4 ммоль) при 0 °C додавали до розчину сполуки 1_6_2 (9,4 г, 42,9 ммоль) в ТГФ (50 мл) і воді (100 мл), 1 н. водним розчином гідроксиду калію значення pH суміші доводили до рівня 4,5 і впродовж 20 хв повільно додавали розчин N-(3-диметиламінопропіл)-N-етилкарбодіімідгідрохлориду (EDCI, 9,3 г, 47,1 ммоль) у воді (30 мл). Одержану суміш перемішували при кімнатній температурі впродовж 3 год., підтримуючи значення pH на рівні 4,0-4,5 за допомогою 1 н. сірчаної кислоти. Додавали гідросульфат тетрабутиламонію (14,5 г, 42,9 ммоль, Aldrich), 1 н. сірчаною кислотою значення pH доводили до рівня 3 і суміш екстрагували хлороформом (5100 мл). Об'єднані шари, що містять хлороформ, сушили над сульфатом натрію і концентрували при зниженому тиску і одержували неочищену сполуку 1_6_4 (17,5 г), яку розчиняли у воді (20 мл) і очищали на колонці, що містить Na-форму іонообмінної смоли Dowex 50WX4 (200 мл), при елюювані водою. Перші 400 мл водних фракцій збирали і ліофілізували і одержували сполуку 1_6_5 (6,93 г, 46 %) у вигляді жовтої твердої речовини. 1 H ЯМР (400 МГц, ДМСО-d6): =1,01 (d, J=6,2 Гц, 3 H), 1,38 (s, 9 H), 3,72-3,91 (m, 2 H), 4,24 (s, 2 H), 4,85 (br. s, 1 H), 6,37 (d, J=8,6 Гц, 1 H), 7,40 (s, 1 H), 11,25 (br. s, 1 H). Метансульфонілхлорид (MsCl, 0,72 г, 6,3 ммоль) при 0 °C шприцом по краплях додавали до розчину сполуки 1_6_5 (2,0 г, 5,71 ммоль) в піридині (60 мл). Одержану суміш перемішували при кімнатній температурі впродовж ночі і концентрували при зниженому тиску. Залишок розчиняли у воді (10 мл), додавали гідросульфат тетрабутиламонію (1,87 г, 5,5 ммоль), 1 н. сірчаною кислотою значення pH доводили до рівня 3 і суміш екстрагували хлороформом (530 мл). Об'єднані шари, що містять хлороформ, сушили над сульфатом натрію і концентрували при зниженому тиску і одержували світло-коричневу тверду речовину. МС показувала, що одержаний продукт являв собою суміш сполуки 1_6_6, N, N,N-трибутилбутан-1-амонієвої солі сполуки 1_6_5 і побічного ди-Ms-продукту. Суміш використовували на наступній стадії без 20 UA 110880 C2 5 10 15 20 25 30 35 40 45 додаткового очищення. Розчин сполуки 1_6_6 (3,1 г, 4,8 ммоль) в ацетоні (10 мл) при кип'ятінні зі зворотним холодильником по краплях додавали до суспензії карбонату калію (3,0 г, 21,7 ммоль) в ацетоні (90 мл). Одержану суміш витримували при кип'ятінні зі зворотним холодильником впродовж 4 год. Після охолодження до кімнатної температури реакційну суміш фільтрували. Фільтрат концентрували при зниженому тиску і одержували неочищений проміжний продукт 1_6_7, який розчиняли в 0,5 M водному розчині KH2PO4 (15 мл), 1 н. сірчаною кислотою значення pH доводили до рівня 3 і суміш екстрагували дихлорметаном (650 мл). Об'єднані шари, що містять дихлорметан, сушили над сульфатом натрію і концентрували при зниженому тиску. Залишок розчиняли у воді (10 мл) і очищали на колонці, що містить Na-форму іонообмінної смоли Dowex 50WX4 (200 мл), при елюювані водою. Перші 500 мл водних фракцій збирали і ліофілізували і одержували 1,3 г неочищеного продукту у вигляді жовтої твердої речовини. МС показувала, що одержаний продукт являв собою суміш сполуки 1_6_8 і сполуки 1_6_5. Цю суміш використовували на наступній стадії без додаткового очищення. Трифтороцтову кислоту (ТФК, 10 мл) при 0 °C додавали до суспензії сполуки 1_6_8, одержаної на попередній стадії у вигляді суміші (1,2 г, 3,6 ммоль), в дихлорметані (5 мл) і анізолі (5 мл). Одержану суміш перемішували при 0 °C впродовж 1 год. і концентрували при зниженому тиску. Залишок перемішували з бензолом (10 мл) і двічі випарювали, промивали дихлорметаном і сушили в вакуумі і одержували неочищену сполуку 1_6_9 (1,6 г, кількісний вихід, містила невелику кількість залишкової трифтороцтової кислоти). Цю речовину, що має чистоту 47 %, використовували на наступній стадії без додаткового очищення. 1 Спектр H ЯМР був складним, оскільки одержаний продукт являв собою суміш сполуки 1_6_9 і сполуки 1_6_5. МС (ЕР ) m/z: [M-Na] розраховано для C5H9N2O5S: 209,02; знайдено: 209,11. 1.7. {[(3S)-3-Аміно-4,4-диметил-2-оксоазетидин-1-іл]окси}метансульфонова кислота Хлорметилметилсульфід (1,15 мл, 13,8 ммоль) при кімнатній температурі по краплях додавали до розчину йодиду калію (2,29 г, 13,8 ммоль) в N, N-диметилформаміді (40 мл). Одержану суміш перемішували при кімнатній температурі впродовж 0,5 год. і додавали третбутил-{(3S)-4,4-диметил-1-гідроксі-2-оксоазетидин-3-іл}карбамат 1_7_1 (1,60 г, 6,94 ммоль), потім карбонат калію (1,90 г, 13,8 ммоль). Одержану суміш перемішували при кімнатній температурі впродовж ночі. Суміш виливали у воду з льодом (200 мл) і екстрагували етилацетатом (330 мл). Об'єднані шари, що містять етилацетат, промивали водою, сушили (сульфат натрію) і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі при елюювані сумішшю гексан-етилацетат складу 6:1 ~ 3:1 і одержували сполуку 1_7_2 (1,73 г, 86 %) у вигляді жовтого масла. 1 H ЯМР (400 МГц, CDCl3): =1,33 (s, 3 H), 1,45 (s, 9 H), 1,54 (s, 3 H), 2,28 (s, 3 H), 4,39 (d, J=6,6 Гц, 1 H, 4,96 (s, 2 H), 5,10 (d, J=6,6 Гц, 1 H). Сульфурилдихлорид (0,71 мл, 8,78 ммоль) при -78 °C по краплях додавали до розчину сполуки 1_7_2 (1,70 г, 5,85 ммоль) в дихлорметані (50 мл). Одержану суміш перемішували при 78 °C впродовж 15 хв і потім при кімнатній температурі впродовж 15 хв. Реакційну суміш охолоджували до -78 °C і по краплях додавали N-етилдіізопропіламін (ДІПЕА, 10,1 мл, 58,5 ммоль), потім тіооцтову кислоту (AcSH, 2,1 мл, 29,3 ммоль). Одержану суміш перемішували при -78 °C впродовж 15 хв і потім при температурі, що дорівнює від -78 °C до кімнатної температури, впродовж 1 год. Реакційну суміш виливали в насичений водний розчин бікарбонату натрію (200 мл) і екстрагували дихлорметаном (350 мл). Об'єднані шари, що містять дихлорметан, сушили над сульфатом натрію і концентрували при зниженому тиску. Залишок очищали за допомогою колонкової хроматографії на силікагелі при елюювані сумішшю гексан-етилацетат складу 6:1 ~ 21 UA 110880 C2 5 10 15 20 25 30 35 40 45 3:1 і одержували сполуку 1_7_4 (1,25 г, 67 %) у вигляді жовтої твердої речовини. 1 H ЯМР (400 МГц, CDCl3): =1,32 (s, 3 H), 1,45 (s, 9 H), 1,52 (s, 3 H), 2,42 (s, 3 H), 4,36 (d, J=6,6 Гц, 2 H), 5,03 (d, J=6,6 Гц, 1 H), 5,36 (s, 2H). Сполуку 1_7_4 (1,10 г, 3,45 ммоль) додавали до розчину 3-хлорпероксибензойної кислоти (мХПБК, 4,0 г, 13,8 ммоль) в дихлорметані (50 мл). Одержану суміш перемішували при кімнатній температурі впродовж ночі і концентрували при зниженому тиску. Залишок обробляли мурашиною кислотою (96 %, 20 мл) і перемішували при кімнатній температурі впродовж 4 год. Тверду речовину відфільтровували і фільтрат концентрували при зниженому тиску. Залишок обробляли дихлорметаном (50 мл), перемішували при кімнатній температурі впродовж 0,5 год. і фільтрували. Фільтрат концентрували при зниженому тиску і одержували неочищену сполуку 1_7_5 (0,9 г, 100 %, розраховано: 0,77 г) у вигляді блідо-жовтої твердої речовини, яку використовували на наступній стадії без обробки. 1 H ЯМР (400 МГц, ДМСО-d6): =1,46 (s, 3 H), 1,48 (s, 3 H), 4,14 (s, 1 H), 4,42 (AB, J=8,0 і 32,0 Гц, 2 H), 8,72 (br s, 1 H). 1.8. 3-Аміно-1-(сульфооксі)-1-азаспіро[3.4]октан-2-он Суміш N-(трет-бутоксикарбоніл)гліцину 1_8_1 (10 г, 57,14 ммоль), бензилхлориду (BnCl, 7,30 мл, 62,85 ммоль), тетра-н-бутиламонійброміду (ТБАБ, 0,19 г, 0,57 ммоль) і бікарбонату калію (6,87 г, 68,57 ммоль) в N, N-диметилформаміді (100 мл) перемішували при кімнатній температурі впродовж 72 год. і фільтрували. Фільтрат концентрували в вакуумі. Залишок обробляли водою і тверду речовину збирали і сушили, і одержували сполуку 1_8_2 (10 г, 67 %). 1 H ЯМР (400 МГц, ДМСО-d6): =1,40 (s, 9H), 3,75 (d, J=6,8 Гц, 2H), 5,10 (s, 2H), 7,20 (t, J=6,8 Гц, 1H), 7,33 (m, 5H). н-Бутиллітій (35,85 мл, 1,6 M розчин в гексані) додавали до охолодженого (-40 °C) розчину діізопропіламіну (7,23 мл, 51,23 ммоль) в ТГФ (40 мл). Суміш перемішували при -40 °C впродовж 30 хв і одержували діізопропіламід літію (ДАЛ). При -78 °C додавали розчин сполуки 1_8_2 (5,43 г, 20,49 ммоль) в ТГФ (20 мл). Суміш перемішували при -78 °C впродовж 30 хв і додавали циклопентанон (висушений над молекулярними ситами, 2,07 мл, 24,59 ммоль). Одержану суміш перемішували при -78 °C впродовж 20 хв, впродовж 30 хв поступово нагрівали до -20 °C і потім впродовж 20 хв до 0 °C, реакцію зупиняли розчином оцтової кислоти (2,70 мл, 47,13 ммоль) в ТГФ (10 мл), суміш виливали у воду (50 мл), екстрагували етилацетатом (200 мл), сушили і концентрували. Залишок очищали за допомогою колонкової хроматографії і одержували сполуку 1_8_3 (5,65 г, 79 %). 1 H ЯМР (400 МГц, ДМСО-d6): =1,40 (s, 9H), 1,50 – 1,90 (m, 8H), 2,20 (s, 1H), 4,25 (d, J=7,7 Гц, 1H), 5,20 (m, 2H), 5,50 (d, J=7,7 Гц, 1H), 7,40 (m, 5H). 10 % Pd/C (0,52 г) додавали до дегазованого розчину сполуки 1_8_3 (5,65 г, 16,19 ммоль) в метанолі (100 мл). Суміш перемішували в атмосфері водню, що подається з балона, впродовж 3 год., і фільтрували через шар целіту. Фільтрат концентрували і одержували сполуку 1_8_4 (4,1 г), яку використовували на наступній стадії без додаткового очищення. 1 H ЯМР (400 МГц, ДМСО-d6): =1,40 (s, 9H), 1,50 – 2,00 (m, 8H), 4,20 (br. s, 1H), 5,95 (br. s, 1H). 1-Гідроксибензотриазол (HOBT, 2,19 г, 16,19 ммоль) і дициклогексилкарбодіімід (ДЦК, 3,34 г, 16,19 ммоль) додавали до охолодженого (0 °C) розчину сполуки 1_8_4 (4,1 г) в ТГФ (20 мл). Суміш перемішували при 0 °C впродовж 2 год. Додавали розчин O-бензилгідроксиламіну (одержували із 7,76 г його відповідної солі з хлороводнем і водного розчину гідроксиду натрію, 22 UA 110880 C2 5 10 15 20 25 30 47,89 ммоль) в ТГФ (10 мл) і суміш перемішували при кімнатній температурі впродовж 5 год. і фільтрували. Фільтрат концентрували і залишок очищали за допомогою колонкової хроматографії і одержували сполуку 1_8_5 (4,7 г, 80 %). 1 H ЯМР (400 МГц, CDCl3): =1,40 (s, 9H), 1,50-2,00 (m, 8H), 3,60 (d, J=7,8 Гц, 1H), 3,90 (s, 1H), 4,90 (s, 2H), 5,62 (d, J=7,8 Гц, 1H), 7,40 (m, 5H), 9,02 (s, 1H). Суміш сполуки 1_8_5 (4,66 г, 12,80 ммоль) і комплексу триоксид сірки-піридин (3,71 г, 23,25 ммоль) в піридині (50 мл) нагрівали при 50-55 °C впродовж 2 год. і концентрували. Залишок розбавляли ацетонітрилом (20 мл) і концентрували. Залишок сушили в високому вакуумі впродовж 2 год., розбавляли етилацетатом (150 мл) і обробляли розчином карбонату калію (19,67 г, 143 ммоль) у воді (54 мл). Одержану суміш кип'ятили зі зворотним холодильником впродовж 2 год., охолоджували до кімнатної температури і фази розділяли. Органічну фазу промивали 5 % водним розчином гідросульфату натрію (20 мл), сушили і концентрували. Залишок очищали за допомогою колонкової хроматографії і одержували сполуку 1_8_6 (2,5 г, 56 %) у вигляді безбарвної твердої речовини. 1 H ЯМР (400 МГц, CDCl3): =1,42 (s, 9H), 1,43 – 2,00 (m, 8H), 4,43 (d, J=8,0 Гц, 1H), 4,90 – 5,00 (m, 3H), 7,40 (m, 5H). 10 % Pd-C (100 мг) додавали до дегазованого розчину сполуки 1_8_6 (1,0 г, 2,89 ммоль) в метанолі (20 мл). Суміш перемішували в атмосфері водню, що подається з балона, впродовж 1 год., і фільтрували через шар целіту. Фільтрат концентрували і одержували сполуку 1_8_7 (0,70 г, 100 %), яку використовували на наступній стадії без додаткового очищення. 1 H ЯМР (400 МГц, ДМСО-d6): =1,39 (s, 9H), 1,50 – 2,00 (m, 8H), 4,28 (d, J=7,9 Гц, 1H), 7,72 (d, J=7,9 Гц, 1H). Суміш сполуки 1_8_7 (0,74 г, 2,89 ммоль) і комплексу триоксид сірки-піридин (1,43 г, 8,96 ммоль) в піридині (20 мл) перемішували при кімнатній температурі впродовж 2 год. і концентрували. Залишок обробляли 10 % водним розчином дигідрофосфату калію (10 мл) і суміш перемішували з тетра-н-бутиламонійгідросульфатом (1,08 г, 3,18 ммоль) при 0 °C впродовж 30 хв. Реакційну суміш екстрагували дихлорметаном (350 мл) і об'єднані органічні фази концентрували. Залишок розчиняли в 98 % мурашиній кислоті (10 мл) і перемішували при кімнатній температурі впродовж 4 год., розбавляли дихлорметаном (30 мл) і витримували в холодильнику впродовж 16 год. Тверду речовину збирали і сушили, і одержували сполуку 1_8_8 (380 мг, 56 %). 1 H ЯМР (400 МГц, ДМСО-d6): =1,40 – 2,00 (m, 6H), 2,20 (m, 2H), 4,37 (s, 1H). 1.9. (3S, 4S)-3-Аміно-4-(амінокарбоніл)-2-оксо-1-азетидинсульфонова кислота O H2N NH2 N O 35 SO3H 1_9_1 Сполуку 1_9_1 синтезували відповідно до публікацій M. Sendai, S. Hashiguchi, M. Tomimoto, S. Kishimoto, T. Matsuo, M. Ochiai; Chemical & Pharmaceutical Bulletin 1985, 33 (9), 3798-3810 і EP 73061. 2. Синтез амінотіазольних і амінотіадіазольних структурних фрагментів 2.1. Оксо[2-(тритиламіно)-1,3-тіазол-4-іл]оцтова кислота O Ph3C N H 40 OH N O S 2_1_1 Сполуку 2_1_1 синтезували відповідно до публікації Sakagami, Kenji; Iwamatsu, Katsuyoshi; Atsumi, Kunio; Hatanaka, Minoru; Chemical & Pharmaceutical Bulletin, 1990, 38(12), 3476 – 3479. 2.2. {5-[(трет-Бутоксикарбоніл)аміно]-1,2,4-тіадіазол-3-іл}(оксо)оцтова кислота O Boc OH N N H S N 2_2_1 23 O UA 110880 C2 Сполуку 2_2_1 синтезували відповідно до публікації Yamawaki, Kenji; Nomura, Takashi; Yasukata, Tatsuro; Uotani, Koichi; Miwa, Hideaki; Takeda, Kei; Nishitani, Yasuhiro; Bioorganic & Medicinal Chemistry, 2007, 38 (21), 6716-6732. 2.3. [5-Хлор-2-(тритиламіно)-1,3-тіазол-4-іл](оксо)оцтова кислота O Ph3C 5 10 15 20 25 30 35 40 OH N N H O S Cl 2_3_1 Сполуку 2_3_1 синтезували відповідно до публікацій: a) Sakagami, Kenji; Iwamatsu, Katsuyoshi; Atsumi, Kunio; Hatanaka, Minoru; Chemical & Pharmaceutical Bulletin, 1990, 38(12), 3476 – 3479. b) Yamawaki, Kenji; Nomura, Takashi; Yasukata, Tatsuro; Uotani, Koichi; Miwa, Hideaki; Takeda, Kei; Nishitani, Yasuhiro; Bioorganic & Medicinal Chemistry, 2007, 38(21), 6716-6732. 3. Синтез арил- і гетероариламідинових бічних ланцюгів 3.1. 4-[2-(Амінооксі)етокси]бензолкарбоксимідамід Стадія 1: 4-(2-Брометокси)бензонітрил (3_1_2) 1,2-Диброметан (471 г, 2,52 моль) і карбонат калію (232 г, 1,68 моль) додавали до розчину 4гідроксибензонітрилу 3_1_1 (100 г, 0,84 моль) в ацетонітрилі (4 л). Суміш кип'ятили зі зворотним холодильником впродовж 18 год., тверду речовину видаляли фільтруванням і фільтрат концентрували і одержували залишок, який очищали за допомогою хроматографії (3:1 гексани/етилацетат), і одержували сполуку 3_1_2 (74,4 г, вихід 40 %) у вигляді твердої речовини. 1 H ЯМР (400 МГц, CDCl3): =3,66 (t, J=6,0 Гц, 2H), 4,34 (t, J=6,2 Гц, 2H), 6,97 (d, J=8,9 Гц, 2H), 7,61 (d, J=8,9 Гц, 2H). Стадія 2: 4-{2-[(1,3-Діоксо-1,3-дигідро-2H-ізоіндол-2-іл)оксі]етокси}бензонітрил (3_1_3) 1,8-Діазабіцикло[5.4.0]ундец-7-ен (49,4 мл, 0,33 ммоль) впродовж 20 хв повільно додавали до розчину сполуки 3_1_2 (74,3 г, 0,33 моль) і N-гідроксифталіміду (Phth-OH, 53,6 г, 0,33 моль) в N, N-диметилформаміді (470 мл) і суміш нагрівали при 46 °C впродовж 6 год. Після видалення розчинника залишок обробляли 1 н. розчином HCl (1 л), що приводило до утворення осаду. Осад збирали фільтруванням, промивали водою і сушили, і одержували сполуку 3_1_3 (98,0 г, вихід 96 %) у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, CDCl3): =4,31-4,43 (m, 2H), 4,51-4,63 (m, 2H), 6,91 (m, J=8,5 Гц, 2H), 7,57 (m, J=8,5 Гц, 2H), 7,75-7,87 (m, 4H). Стадія 3: 4-[2-(Амінооксі)етокси]бензонітрил (3_1_4) Гідразингідрат (11,5 мл, 0,236 моль) додавали до суспензії сполуки 3_1_3 (72,7 г, 0,236 моль) в етанолі (800 мл) і суміш перемішували при 45 °C впродовж 14 год. Тверду речовину видаляли фільтруванням і фільтрат концентрували. Залишок розбавляли етилацетатом (300 мл), тверду речовину видаляли фільтруванням і фільтрат концентрували і одержували сполуку 3_1_4 (40,0 г, вихід 96 %) у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, CDCl3): =4,03 (t, J=4,8 Гц, 2H), 4,21 (t, J=4,8 Гц, 2H), 5,58 (s, 2H), 6,98 (d, J=6,0 Гц, 2H), 7,59 (d, J=6,0 Гц, 2H). Стадія 4: Метил-4-[2-(амінооксі)етокси]бензолкарбоксімідоат (3_1_5) Через розчин сполуки 3_1_4 (15,0 г, 84,7 ммоль) в сухому метанолі (330 мл) при 0 °C впродовж 1 год. пропускали газоподібний хлороводень і суміш перемішували при кімнатній температурі впродовж 14 год. (ЯМР вказував на те, що ступінь перетворення становив 50 %). 24 UA 110880 C2 5 10 15 Через розчин при 0 °C пропускали газоподібний хлороводень впродовж ще 40 хв і реакційну суміш перемішували впродовж 24 год. і одержували суспензію. Сполуку 3_1_5 (23,0 г, вихід 96 %, гідрохлорид) збирали фільтруванням у вигляді білої твердої речовини. 1 H ЯМР (400 МГц, CDCl3): =3,95-4,08 (m, 2H), 4,13-4,25 (m, 2H), 5,55 (br s, 2H), 6,99 (m, J=8,5 Гц, 2H), 7,26 (s, 1H), 7,59 (m, J=8,5 Гц, 2H). Стадія 5: 4-[2-(Амінооксі)етокси]бензолкарбоксимідамід (3_1_6) Аміак (7 н. розчин в метанолі, 53,3 мл) додавали до розчину сполуки 3_1_5 (11,5 г, 37,3 ммоль) в сухому метанолі (150 мл). Суміш перемішували при 50 °C впродовж 2 год. і при кімнатній температурі впродовж 14 год. Після видалення розчинника залишок очищали за допомогою хроматографії і одержували сполуку 3_1_6 (6,2 г, вихід 85 %) у вигляді твердої речовини. 1 H ЯМР (400 МГц, метанол-d4): =3,97-4,05 (m, 2H), 4,24-4,37 (m, 2H), 7,16 (d, J=8,9 Гц, 2H), 7,79 (d, J=8,9 Гц, 2H). З використанням умов, описаних вище в розділі 3.1, одержували наступні амідинові бічні ланцюги: Вихідна речовина Алкілуючий реагент Продукт NH CN 3.2 NH2 O Br HO NH2 Br O Br Br 3.3 Br Br NH2O HO O CN 3.4 NH2 HN CN 3_3_6 NH NH2O Br HO 3_2_6 NH2 Br O Cl Cl 3_4_6 NH NH2O CN 3.5 Br Br HO 3_5_6 NH CN 3.6 NH2 O NH2O Br HO NH2 Br O F F 3_6_6 NH CN 3.7 NH2 Br Br HO NH2O O 3_7_6 3.8. трет-Бутил-{({4-[2-(амінооксі)етокси]феніл}аміно)[(третбутоксикарбоніл)аміно]метиліден}карбамат 25 UA 110880 C2 5 10 15 20 25 30 35 40 45 Стадія 1: трет-Бутил-[4-(2-брометокси)феніл]карбамат (3_8_2) Суміш трет-бутил-(4-гідроксифеніл)карбамату 3_8_1 (25 г, 119,6 ммоль), 1,2-диброметану (41 мл, 478,5 ммоль) і карбонату калію (33 г, 239,2 ммоль) в ацетонітрилі (500 мл) кип'ятили зі зворотним холодильником впродовж 24 год. (ТШХ показувала, що ступінь перетворення становив 50 %). Додатково додавали 1,2-диброметан (20 мл, 239 ммоль) і карбонат калію (16 г, 120 ммоль) і суміш кип'ятили зі зворотним холодильником впродовж ще 23 год. Додатково додавали карбонат калію (16 г, 120 ммоль) і суміш кип'ятили зі зворотним холодильником впродовж ще 5 год. Тверду речовину видаляли фільтруванням і фільтрат концентрували і одержували залишок. Залишок очищали за допомогою хроматографії і одержували сполуку 3_8_2 (15,6 г, вихід 41 %) у вигляді твердої речовини. 1 H ЯМР (CDCl3): =1,51 (s, 9H), 3,61 (t, J=6,0 Гц, 2H), 4,26 (t, J=6,0 Гц, 2H), 4,26 (t, J=6,0 Гц, 2H), 6,34 (s, 1H), 6,85 (d, J=8,8 Гц, 2H), 7,27 (d, J=8,8 Гц, 2H). Стадія 2: трет-Бутил-(4-{2-[(1,3-діоксо-1,3-дигідро-2H-ізоіндол-2іл)оксі]етокси}феніл)карбамат (3_8_3) 1,8-Діазабіцикло[5.4.0]-ундец-7-ен (9 мл, 59,3 ммоль) при кімнатній температурі додавали до розчину сполуки 3_8_2 (15,6 г, 49,4 ммоль) і N-гідроксифталіміду (Phth-OH, 12,1 г, 74 ммоль) в N, N-диметилформаміді (80 мл). Суміш перемішували при 45 °C впродовж 15 год., концентрували, екстрагували етилацетатом, промивали насиченим розчином бікарбонату натрію, 1 н. розчином хлористоводневої кислоти і розсолом, сушили над сульфатом натрію, фільтрували і концентрували. Залишок розтирали з гексанами і тверду речовину збирали і одержували сполуку 3_8_3 (17,1 г, вихід 86 %) у вигляді білої твердої речовини. 1 H ЯМР (CDCl3): =1,50 (s, 9H), 4,32 (t, J=6,4 Гц, 2H), 4,56 (t, J=6,4 Гц, 2H), 6,33 (s, 1H), 6,75 (d, J=8,8 Гц, 2H), 7,22 (d, J=8,8 H, 2H), 7,83 (m, 2H), 7,52 (m, 2H). Стадія 3: 2-[2-(4-Амінофеноксі)етоксі]-1H-ізоіндол-1,3(2H)-діон (3_8_4) Трифтороцтову кислоту (ТФК, 14,3 мл) додавали до розчину сполуки 3_8_3 (7,4 г, 18,6 ммоль) в дихлорметані (150 мл). Суміш перемішували при кімнатній температурі впродовж 2,5 год. і концентрували. Потім залишок розтирали з діетиловим ефіром і тверду речовину збирали і одержували цільову сполуку 3_8_4 (7,5 г, вихід 97 %, сіль з трифтороцтовою кислотою) у вигляді рожевої твердої речовини. 1 H ЯМР (MeOH-d4): =4,36 (m, 2H), 4,55 (m, 2H), 6,98 (d, J=8,8 Гц, 2H), 7,26 (d, J=8,8 Гц, 2H), 7,83 (s, 4H). Стадія 4: трет-Бутил-{(E)-[(трет-бутоксикарбоніл)аміно][(4-{2-[(1,3-діоксо-1,3-дигідро-2Hізоіндол-2-іл)оксі]етокси}феніл)аміно]метиліден}карбамат (3_8_5) Трифтороцтову кислоту (6 мл, 43,2 ммоль) додавали до суспензії сполуки 3_8_4 (7,4 г, 14,1 ммоль) в ацетонітрилі (200 мл) і суміш перемішували при кімнатній температурі впродовж 30 хв. Додавали ди-трет-бутил-[(Z)-1H-піразол-1-ілметиліден]біскарбамат (3,2 г, 10,8 ммоль) і суміш перемішували при кімнатній температурі впродовж 15 год., концентрували і залишок екстрагували етилацетатом, промивали розсолом, фільтрували і концентрували і одержували залишок. Залишок очищали за допомогою хроматографії і одержували сполуку 3_8_5 (3,82 г, вихід 50 %) у вигляді твердої речовини. 1 H ЯМР (CDCl3): =1,49 (s, 9H), 1,53 (s, 9H), 4,32 (t, J=4,4 Гц, 2H), 4,57 (t, J=4,4 Гц, 2H), 6,78 (d, J=8,8 Гц, 2H), 7,45 (d, J=8,8 Гц, 2H), 7,84 (m, 2H), 7,75 (m, 2H), 10,18 (s, 1H), 11,63 (s, 1H). Стадія 5: трет-Бутил-{({4-[2-(амінооксі)етокси]феніл}аміно)[(третбутоксикарбоніл)аміно]метиліден}карбамат (3_8_6) Гідразингідрат (0,35 мл, 7,1 ммоль) додавали до суспензії сполуки 3_8_5 (3,82 г, 7,1 ммоль) в етанолі (200 мл) і суміш перемішували при 35 °C впродовж 18 год. Тверду речовину видаляли фільтруванням і фільтрат концентрували і одержували залишок. Залишок очищали за 26 UA 110880 C2 5 допомогою хроматографії (етилацетат/гексани 1:1) і одержували неочищений продукт (3,1 г), який промивали дихлорметаном і фільтрували. Фільтрат концентрували і одержували чистий продукт 3_8_6 (2,7 г, вихід 97 %) у вигляді білої твердої речовини. 1 H ЯМР (CDCl3): =1,49 (s, 9H), 1,53 (s, 9H), 4,01 (t, J=4,4 Гц, 2H), 4,14 (t, J=4,4 Гц, 2H), 5,54 (s, 2H), 6,89 (d, J=9,2 Гц, 2H), 7,49 (d, J=9,2 Гц, 2H), 10,19 (s, 1H), 11,64 (s, 1H). 3.9. трет-Бутил-{({4-[2-(аміноокси)пропокси]феніл}аміно)[(третбутоксикарбоніл)аміно]метиліден}карбамат H N H2N NHBoc NBoc O O 3_9_6 10 15 20 25 30 35 40 Сполуку 3_9_6 одержували за методикою, що описана вище для одержання сполуки 3_8_6, з використанням 1,3-дибромпропану замість 1,2-диброметану на стадії 1. 3.10. 4-{[2-(Амінооксі)етил]сульфаніл}бензолкарбоксимідамід Стадія 1: 4-[(2-Гідроксіетил)сульфаніл]бензонітрил (3_10_2) 2-Меркаптоетанол (4,10 г, 0,0525 ммоль) і карбонат калію (7,25 г, 0,0525 моль) додавали до розчину 4-фторбензонітрилу 3_10_1 (4,22 г, 0,035 моль) в ацетонітрилі (50 мл) і суміш перемішували при кімнатній температурі впродовж 18 год. Тверду речовину видаляли фільтруванням і фільтрат концентрували і одержували залишок, який очищали за допомогою колонкової хроматографії, і одержували сполуку 3_10_2 (4,0 г, вихід 64 %) у вигляді масла. 1 H ЯМР (400 МГц, CDCl3): =1,92 (t, J=6,1 Гц, 1H), 3,22 (t, J=5,9 Гц, 2H), 3,86 (q, J=6,0 Гц, 2H), 7,38 (m, J=8,6 Гц, 2H), 7,55 (m, J=8,2 Гц, 2H). Стадія 2: 4-{[2-(1,3-Діоксо-1,3-дигідро-2H-ізоіндол-2-іл)етил]сульфаніл}бензонітрил (3_10_3) Трифенілфосфін (5,85 г, 0,0223 моль) додавали до розчину сполуки 3_10_2 (4,00 г, 0,0223 моль) і N-гідроксифталіміду (Phth-OH, 3,64 г, 0,223 моль) в тетрагідрофурані (100 мл), потім впродовж 20 хв повільно додавали діетилазодикарбоксилат (3,66 мл, 0,0223 моль). Суміш перемішували при кімнатній температурі впродовж 24 год., потім концентрували і одержували залишок. Залишок очищали за допомогою колонкової хроматографії і одержували сполуку 3_10_3 (4,6 г, вихід 62 %). 1 H ЯМР (400 МГц, CDCl3): =3,42 (s, 2H), 4,38 (s, 2H, ), 7,41 (m, J=8,2 Гц, 2H), 7,56 (m, J=8,2 Гц, 2H), 7,79 (d, J=3,1 Гц, 2H), 7,85 (br s, 2H). Стадія 3: 4-{[2-(Амінооксі)етил]сульфаніл}бензонітрил (3_10_4) Гідразин (0,804 мл, 0,0256 моль) додавали до суспензії сполуки 3_10_3 (4,6 г, 0,0256 моль) в етанолі (100 мл) і суміш перемішували при 45 °C впродовж 14 год. Тверду речовину видаляли фільтруванням і фільтрат концентрували. Залишок розбавляли дихлорметаном (20 мл) і тверду речовину видаляли фільтруванням. Фільтрат концентрували і одержували сполуку 3_10_4 (3,5 г, вихід 70 %) у вигляді масла. 1 H ЯМР (400 МГц, CDCl3): =3,25 (t, J=6,6 Гц, 2H), 3,88 (t, J=6,6 Гц, 2H), 5,49 (br s., 2H), 7,37 (m, J=8,2 Гц, 2H), 7,54 (m, J=8,6 Гц, 2H). Стадія 4: 4-{[2-(Амінооксі)етил]сульфаніл}бензолкарбоксімідоат (3_10_5) Через розчин сполуки 3_10_4 (3,5 г, 0,0180 моль) в сухому метанолі (100 мл) при 0 °C впродовж 10 хв пропускали газоподібний хлороводень. Суміш перемішували при кімнатній температурі впродовж 14 год. і одержували суспензію. Білу тверду речовину (3,0 г, вихід 74 %, гідрохлорид) збирали фільтруванням. 27 UA 110880 C2 H ЯМР (400 МГц, MeOH-d4): =3,47 (s, 2H), 4,27-4,40 (m, 5H), 7,57 (d, J=9,0 Гц, 2H), 7,98 (d, J=8,6 Гц, 2H). Стадія 5: 4-{[2-(Амінооксі)етил]сульфаніл}бензолкарбоксимідамід (3_10_6) Аміак (7 н. розчин в метанолі, 10 мл) додавали до розчину сполуки 3_10_5 (3,0 г, 73,7 моль) в сухому метанолі (20 мл) і суміш нагрівали при 50 °C впродовж 2 год. Після видалення розчинника залишок очищали за допомогою хроматографії і одержували сполуку 3_10_6 (1,5 г, вихід 54 %) у вигляді твердої речовини. 1 H ЯМР (400 МГц, MeOH-d4): =3,32 (br s, 2H), 3,86 (s, 2H), 7,53 (m, J=8,6 Гц, 2H) 7,71 (m, J=8,60 Гц, 2H). 3.11. 4-[2-(Амінооксі)етокси]-N-(пропан-2-іл)бензолкарбоксимідамід 1 5 10 NH NH NH2 OMe NH HCl O O O H2N 15 O 3_1_5 H2N 3_11_6 В герметизованій пробірці ізопропіламін (2 мл) при 0 °C по краплях додавали до суспензії сполуки 3_1_5 (1 г, 3,57 ммоль) в метанолі (10 мл) і суміш нагрівали при 50 °C впродовж 16 год. Розчинник видаляли при зниженому тиску і залишок піддавали розподіленню між водою (50 мл) і етилацетатом (50 мл). Водний шар ліофілізували і одержували сполуку 3_11_6 (1,0 г, вихід 75 %) у вигляді жовтої спіненої речовини. 3.12. 4-[2-(Амінооксі)етокси]-N-метилбензолкарбоксимідамід NH NH O O H2N 20 3_12_6 Сполуку 3_12_6 одержували за методикою, що описана вище для одержання сполуки 3_11_6, з використанням метиламіну замість ізопропіламіну. 3.13. 4-[2-(Амінооксі)етокси]-N-(2-гідроксіетил)бензолкарбоксимідамід NH OH N H O O H2N 25 3_13_6 Сполуку 3_13_6 одержували за методикою, що описана вище для одержання сполуки 3_11_6, з використанням 2-аміноетанолу замість ізопропіламіну. 3.14. 2-{[{4-[2-(Амінооксі)етокси]феніл}(іміно)метил]аміно}етилформіат NH NH OH N H O HCO2H O O O H2N 30 O N H O 3_13_6 H2N 3_14_7 Сполуку 3_14_7 одержували із сполуки 3_13_6 за стандартною методикою формілування, описаною в літературі, з використанням мурашиної кислоти, див., наприклад, Chem. Commun. 2007, (28), 2977-2979. 3.15. N-(2-(трет-Бутоксикарбоніламіно)етил)-4-[2-(амінооксі)етокси]бензолкарбоксимідамід 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAmidine substituted beta - lactam compounds, their preparation and use as antibacterial agents
Автори англійськоюKlenke, Burkhard, Wiegand, Irith, Schiffer, Guido, Broetz-Oesterhelt, Heike, Maiti, Samarendra N., Khan, Jehangir, Reddy, Andhe, Yang, Zhixiang, Hena, Mostafa, Jia, Guofeng, Ligong, Ou, Liang, Hong, Yip, Judy, Gao, Chuanjun, Tajammul, Sabiha, Mohammad, Rahim, Biswajeet, Ganguli
Автори російськоюКленке Буркхард, Виганд Ирит, Шиффер Гуидо, Брёц-Эстерхельт Хайке, Маити Самарендра Н., Хан Эхангир, Рэдди Андхэ, Ян Чжисян, Хэна Мустафа, Цзя Гофэн, Лигун Оу, Лян Хун, Ип Джуди, Гао Чуанжун, Таджаммул Сабиха, Мухаммад Рахим, Бисваджит Гангули
МПК / Мітки
МПК: A61P 31/04, C07D 417/14, C07D 417/12, A61K 31/427
Мітки: антибактеріальних, засобів, одержання, амідином, бета-лактами, застосування, заміщені
Код посилання
<a href="https://ua.patents.su/131-110880-zamishheni-amidinom-beta-laktami-kh-oderzhannya-ta-zastosuvannya-yak-antibakterialnikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Заміщені амідином бета-лактами, їх одержання та застосування як антибактеріальних засобів</a>
Попередній патент: Поверхневий модуль інфільтраційного блока
Наступний патент: Ароматизуюча композиція для поліпшення тютюнового запаху повітря, яке видихається
Випадковий патент: Послідовності стрибкоподібної перебудови частоти для багатосмугових систем зв'язку