Похідні хіноліну й ізохіноліну, заміщені в 5-положенні, спосіб їх одержання і їх застосування як протизапальних засобів
Номер патенту: 91348
Опубліковано: 26.07.2010
Автори: Хюбнер Ян, Скубалла Вернер, Шмеес Норберт, Ревінкель Хартмут, Шнайдер Маттіас, Шеке Хайке, Дінтер Крістіан, Петров Орлін, Ярох Штефан
Формула / Реферат
1. Сполуки загальної формули (ІІа) або (ІІb)
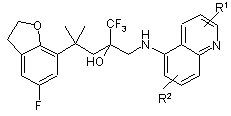 , (IIa)
, (IIa) 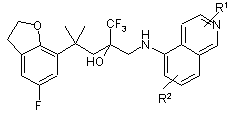 , (IIb)
, (IIb)
у яких
R1 і R2, незалежно один від одного, являють собою атом водню, С1-3-алкільну групу, атом галогену, ціаногрупу, С1-3-алкоксигрупу або гідроксигрупу,
а також їх рацемати або окремо представлені стереоізомери і їх фізіологічно сумісні солі.
2. Сполуки загальної формули (ІІа) або (IIb) за п. 1
 , (IIa)
, (IIa)  , (IIb)
, (IIb)
у яких
R1 і R2, незалежно один від одного, являють собою атом водню, С1-3-алкільну групу, атом галогену, ціаногрупу, С1-3-алкоксигрупу або гідроксигрупу,
а також їх рацемати або окремо представлені стереоізомери і їх фізіологічно сумісної солі.
3. Сполука за п. 1, а саме
5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2-метилхінолін,
5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-1-метилізохінолін,
5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-ізохінол-1(2Н)-он,
5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2,6-диметилхінолін,
5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-6-хлор-2-метилхінолін,
5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-ізохінолін,
5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]хінолін,
5-[4-(2,3-дигідро-5-фтор-7-бензофураніл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]хінолін-2(1Н)-он,
6-фтор-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2-метилхінолін,
8-фтор-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2-метилхінолін або
5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2-метилізохінол-1(2Н)-он.
4. Сполука за п. 3, яка відрізняється тим, що являє собою (+)-енантіомер.
5. Сполука за п. 3, яка відрізняється тим, що являє собою (-)-енантіомер.
6. Спосіб одержання сполук загальних формул IIа або IIb, який відрізняється тим, що ізобутен піддають реакції з використанням каталітичної системи на основі кислоти Льюїса із трифторалкілпіруватом, одержуючи сполуку загальної формули XII
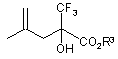 , (XII)
, (XII)
де R3 означає С1-С5-алкіл,
яку потім піддають реакції з 5-фтор-2,3-дигідробензофураном
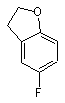
у реакції алкілування Фріделя-Крафта, одержуючи сполуки загальної формули X
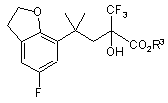 , (X)
, (X)
і потім сполуку загальної формули X відновлюють з утворенням спирту XI
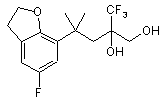 , (XI)
, (XI)
і потім окислюють з утворенням альдегіду (III)
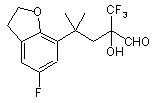 (III)
(III)
або
сполуку X відновлюють безпосередньо до альдегіду III, при цьому в такий спосіб отриманий альдегід (III) потім піддають реакції з одержанням сполук загальної формули IIа або IIb, шляхом взаємодії в умовах відновного амінування з похідним 5-амінохіноліну або з похідним 5-аміноізохіноліну
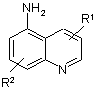 ,
, 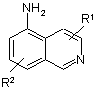 ,
,
де R1 і R2 мають значення, вказані в пункті 1.
7. Спосіб за п. 6, який відрізняється тим, що, додатково, на довільній придатній стадії, за допомогою колонкової хроматографії на хіральній фазі, здійснюють розділення енантіомерів.
8. Спосіб за п. 6, який відрізняється тим, що, додатково, придатну рацемічну проміжну сполуку синтезу переводять за допомогою хіральної допоміжної речовини або в діастереомерні солі або в діастереомери, потім здійснюють розділення діастереомерів, і хіральний допоміжний реагент знову відщеплюють.
9. Спосіб за п. 7, у якому розділення енантіомерів здійснюють на стадії сполуки загальних формул III, IV, V, VI, VII, VIII, IX, X або XI.
10. Спосіб за п. 7, у якому хіральна допоміжна речовина являє собою хіральну основу, хіральний діол, хіральний спирт або хіральну кислоту.
11. Спосіб одержання сполук загальних формул IIа і IIb, який відрізняється тим, що альдегід (III)
 (III)
(III)
піддають реакції в умовах відновного амінування з похідним 5-амінохіноліну або з похідним 5-аміноізохіноліну
 ,
,  ,
,
де R1 і R2 мають значення, вказані в пункті 1.
12. Спосіб одержання сполук загальних формул IIа або IIb за п. 11, який відрізняється тим, що сполуку загальної формули III одержують
або
шляхом відновлення сполуки загальної формули X - використовуваної у вигляді хіральної сполуки або у вигляді рацемату -
 , (X)
, (X)
де R3 означає С1-С5-алкіл, з одержанням спирту XI
 (XI)
(XI)
і наступного окислення з одержанням альдегіду (III),
або
шляхом відновлення сполуки X - використовуваної у вигляді хіральної сполуки або у вигляді рацемату - безпосередньо до альдегіду III
 (III).
(III).
13. Спосіб одержання сполук загальних формул IIа і IIb за п. 12, який відрізняється тим, що сполуку загальної формули X одержують за допомогою реагування сполуки загальної формули XII
 , (XII)
, (XII)
у якій R3 означає С1-С5-алкіл,
яку піддають, якщо це є бажаним, розділенню енантіомерів, потім у вигляді хіральної сполуки або у вигляді рацемату з 5-фтор-2,3-дигідробензофураном

у реакції алкілування Фріделя-Крафта, одержуючи сполуки загальної формули X
 , (X)
, (X)
які, якщо це є бажаним, піддають розділенню енантіомерів.
14. Спосіб одержання сполук загальних формул IIа або IIb за п. 13, який відрізняється тим, що сполуку загальної формули XII одержують шляхом реакції ізобутену з використанням каталітичної системи на основі кислоти Льюїса із трифторалкілпіруватом, одержуючи сполуку загальної формули XII
 , (XII)
, (XII)
у якій R3 означає С1-С5-алкіл,
яку, якщо це є бажаним, піддають розділенню енантіомерів.
15. Спосіб за п. 6 або п. 14, який відрізняється тим, що каталітична система на основі кислоти Льюїса є хіральною.
16. Спосіб за будь-яким з пп. 6-14, який відрізняється тим, що вихідні речовини використовують хіральним чином.
17. Спосіб за будь-яким з пп. 12-14, який відрізняється тим, що відповідні одержувані проміжні продукти піддають розділенню енантіомерів або, після реакції з хіральними допоміжними речовинами, розділенню діастереомерів.
18. Застосування сполук за будь-яким з пп. 1-5 для одержання ліків.
19. Застосування сполук за п. 18 для одержання ліків для лікування запальних захворювань.
Текст
1. Сполуки загальної формули (ІІа) або (ІІb) 3 91348 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2трифторметилпентиламіно]хінолін, 5-[4-(2,3-дигідро-5-фтор-7-бензофураніл)-2гідрокси-4-метил-2трифторметилпентиламіно]хінолін-2(1Н)-он, 6-фтор-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметилпентиламіно]2-метилхінолін, 8-фтор-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметилпентиламіно]2-метилхінолін або 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметилпентиламіно]-2метилізохінол-1(2Н)-он. 4. Сполука за п. 3, яка відрізняється тим, що являє собою (+)-енантіомер. 5. Сполука за п. 3, яка відрізняється тим, що являє собою (-)-енантіомер. 6. Спосіб одержання сполук загальних формул IIа або IIb, який відрізняється тим, що ізобутен піддають реакції з використанням каталітичної системи на основі кислоти Льюїса із трифторалкілпіруватом, одержуючи сполуку загальної формули XII CF3 OH CO2R3 , (XII) де R3 означає С1-С5-алкіл, яку потім піддають реакції дигідробензофураном 4 умовах відновного амінування з похідним 5амінохіноліну або з похідним 5-аміноізохіноліну NH2 , , де R1 і R2 мають значення, вказані в пункті 1. 7. Спосіб за п. 6, який відрізняється тим, що, додатково, на довільній придатній стадії, за допомогою колонкової хроматографії на хіральній фазі, здійснюють розділення енантіомерів. 8. Спосіб за п. 6, який відрізняється тим, що, додатково, придатну рацемічну проміжну сполуку синтезу переводять за допомогою хіральної допоміжної речовини або в діастереомерні солі або в діастереомери, потім здійснюють розділення діастереомерів, і хіральний допоміжний реагент знову відщеплюють. 9. Спосіб за п. 7, у якому розділення енантіомерів здійснюють на стадії сполуки загальних формул III, IV, V, VI, VII, VIII, IX, X або XI. 10. Спосіб за п. 7, у якому хіральна допоміжна речовина являє собою хіральну основу, хіральний діол, хіральний спирт або хіральну кислоту. 11. Спосіб одержання сполук загальних формул IIа і IIb, який відрізняється тим, що альдегід (III) CF3 CHO OH 5-фтор-2,3 O F (III) піддають реакції в умовах відновного амінування з похідним 5-амінохіноліну або з похідним 5аміноізохіноліну NH2 F CF3 N R2 OH CO2R3 F , (X) і потім сполуку загальної формули X відновлюють з утворенням спирту XI O CF3 OH OH O N R2 CF3 OH , (XI) і потім окислюють з утворенням альдегіду (III) CF3 R1 , , де R1 і R2 мають значення, вказані в пункті 1. 12. Спосіб одержання сполук загальних формул IIа або IIb за п. 11, який відрізняється тим, що сполуку загальної формули III одержують або шляхом відновлення сполуки загальної формули X - використовуваної у вигляді хіральної сполуки або у вигляді рацемату F O NH2 R1 у реакції алкілування Фріделя-Крафта, одержуючи сполуки загальної формули X O R2 O з R1 N N R2 NH2 R1 CO2R3 F , (X) де R3 означає С1-С5-алкіл, з одержанням спирту XI CHO OH O CF3 OH F OH (III) або сполуку X відновлюють безпосередньо до альдегіду III, при цьому в такий спосіб отриманий альдегід (III) потім піддають реакції з одержанням сполук загальної формули IIа або IIb, шляхом взаємодії в F (XI) і наступного окислення з одержанням альдегіду (III), або 5 шляхом відновлення сполуки X - використовуваної у вигляді хіральної сполуки або у вигляді рацемату - безпосередньо до альдегіду III CF3 O CHO OH F (III). 13. Спосіб одержання сполук загальних формул IIа і IIb за п. 12, який відрізняється тим, що сполуку загальної формули X одержують за допомогою реагування сполуки загальної формули XII CF3 OH CO2R3 , (XII) у якій R означає С1-С5-алкіл, яку піддають, якщо це є бажаним, розділенню енантіомерів, потім у вигляді хіральної сполуки або у вигляді рацемату з 5-фтор-2,3дигідробензофураном 3 O F у реакції алкілування Фріделя-Крафта, одержуючи сполуки загальної формули X O CF3 OH F 91348 6 які, якщо це є бажаним, піддають розділенню енантіомерів. 14. Спосіб одержання сполук загальних формул IIа або IIb за п. 13, який відрізняється тим, що сполуку загальної формули XII одержують шляхом реакції ізобутену з використанням каталітичної системи на основі кислоти Льюїса із трифторалкілпіруватом, одержуючи сполуку загальної формули XII CF3 OH CO2R3 , (XII) у якій R3 означає С1-С5-алкіл, яку, якщо це є бажаним, піддають розділенню енантіомерів. 15. Спосіб за п. 6 або п. 14, який відрізняється тим, що каталітична система на основі кислоти Льюїса є хіральною. 16. Спосіб за будь-яким з пп. 6-14, який відрізняється тим, що вихідні речовини використовують хіральним чином. 17. Спосіб за будь-яким з пп. 12-14, який відрізняється тим, що відповідні одержувані проміжні продукти піддають розділенню енантіомерів або, після реакції з хіральними допоміжними речовинами, розділенню діастереомерів. 18. Застосування сполук за будь-яким з пп. 1-5 для одержання ліків. 19. Застосування сполук за п. 18 для одержання ліків для лікування запальних захворювань. CO2R3 , (X) Винахід стосується похідних хіноліну й ізохіноліну, заміщених в 5-ому положенні, способу їх одержання і їх застосування як протизапальних засобів. З попереднього рівня техніки WO03/082827 відомі протизапальні засоби загальної формули де Q-радикал містить похідні хіноліну й ізохіноліну. Ці сполуки при їх застосуванні в експериментальних дослідженнях проявляють різну активність у відношенні протизапальних і небажаних метаболічних ефектів і тим самим вони перевершують описані дотепер нестероїдні глюкокортикоїди або мають принаймні таку ж хорошу дію. Крім того, ці сполуки мають поліпшену селективність в порівнянні з іншими стероїдними рецепторами. Зараз зовсім несподівано було виявлено, що сполуки формул (IIа) і (IIb) мають високу активність і зменшені побічні дії й переважно придатні для місцевого введення. Отже, даний винахід стосується сполук загальних формул (IIа) і (IIb) у яких R1 і R2, незалежно один від одного, можуть являти собою атом водню, С1-3-алкільну групу, атом галогену, ціаногрупу, С1-3-алкокси групу або гідрокси групу, а також їх рацемати або окремо представлені стереоізомери й необов'язково їх фізіологічно сумісні солі або їх проліки. Термін «атом галогену» або «галоген» означає атом фтору, хлору, брому або йоду. Переважними є атом фтору, хлору або брому. С1-С3-алкільні групи й С1-С5-алкільні групи можуть мати прямий або розгалужений ланцюг і являють собою метальну, етильну, н-пропільну, ізопропільну, н-бутильну, ізобутильну, mpemбутильну або н-пентильну, 2,2-диметилпропільну, 2-метилбутильну або 3-метилбутильну групу. Переважною є метильна або етильна група. 7 Радикали R1 і R2 переважно являють собою водень, С1-3-алкіл, галоген або гідрокси. Особливо переважними є водень, метил, хлор і гідрокси. Таким чином, у переважному варіанті здійснення винахід стосується сполук загальних формул IIа і IIb, у яких R1 і R2, незалежно один від одного, переважно являють собою водень, С1-3-алкіл, галоген або гідрокси. Особливо переважними є сполуки формул I і IIb, у яких R1 і R2 , незалежно один від одного, являють собою водень, метил, хлор або гідрокси. В одному переважному варіанті здійснення даного винаходу забезпечуються сполуки загальної формули ІІа. Термін "місцеве" охоплює будь-яке можливе введення сполук відповідно до винаходу, що забезпечує можливість прямого проникнення активної речовини в ділянку дії. Сполуки загальних формул (IIа) і (IIb) відповідно до винаходу можуть знаходитися у вигляді різних стереоізомерів внаслідок наявності асиметричних центрів. Об'єктом даного винаходу є рацемати, а також окремо представлені стереоізомери. Переважним об'єктом даного винаходу є окремо представлені стереоізомери, тобто (+)енантіомери й (-)-енантіомери, особливо із прикладів 1, 2, 3, 4, 5, 11 і 12. Сполуки відповідно до винаходу, якщо вони містять гідрокси групу в -положенні по відношенню до атома азоту хінолінілу або ізохінолінілу, також відрізняються наявністю кето-єнольної таутомерії. Відповідно до винаходу, обидві форми охоплюються винаходом, навіть якщо, наприклад, в експериментальній частині згадується тільки одна із двох таутомерних форм. Зокрема, об'єктами даного винаходу є: 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]-2метилхінолін, 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]-1метилізохінолін), 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметилпентиламіно]ізохінол-1 (2Н)-он, 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]2,6-диметилхінолін, 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]-6хлор-2-метилхінолін, 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметилпентиламіно]ізохінолін, 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметилпентиламіно]хінолін, 5-[4-(2,3-дигідро-5-фтор-7-бензофураніл)-2гідрокси-4-метил-2-трифторметилпентиламіно]хінолін-2 [1Н] -он, 6-фтор-5-[4-(5-фтор-2,3-дигідробензофуран-7іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2-метилхінолін, 91348 8 8-фтор-5-[4-(5-фтор-2,3-дигідробензофуран-7іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2-метилхінолін, 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]-2метилізохінол-1(2Н)-он, а також їх окремі енантіомери: 2(R)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]2-метилхінолін), 2(R)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]1-метилізохінолін, 2(R)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно] ізохінол-1 (2Н)-он, 2(R)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]2,6-диметилхінолін, 2(R)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]6-хлор-2-метилхінолін, 2(R)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметилпентиламіно]ізохінолін, 2(R)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифгорметилпентиламіно]хінолін, 2(R)-5-[4-(2,3-дигідро-5-фтор-7-бензофураніл)2-гідрокси-4-метил-2-трифторметилпентиламіно]хінолін-2 [1Н] -он, 2(R)-6-фтор-5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиламіно]-2-метилхінолін, 2(R)-8-фтор-5-[4-(5-фтор-2,3Дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиламіно]-2-метилхінолін, 2(R)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]2-метилхинол-1 (2Н)-он, 2(S)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]2-метилхінолін), 2(S)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]1-метилізохінолін), 2(S)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно] ізохінол-1 (2Н)-он, 2(S)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]2,6-диметилхінолін, 2(S)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]6-хлор-2-метилхінолін, 2(S)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметилпентиламіно]ізохінолін, 2(S)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметилпентиламіно]хінолін, 2(S)-5-[4-(2,3-дигідро-5-фтор-7-бензофураніл)2-гідрокси-4-метил-2-трифторметилпентиламіно]хінолін-2 [1Н]-он, 9 91348 10 2(S)-6-фтор-5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиламіно]-2-метилхінолін, 2(S)-8-фтор-5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиламіно]-2-метилхінолін, 2(S)-5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)2-гідрокси-4-метил-2-трифторметил-пентиламіно]2-метилізохінол-1(2Н)-он. Більш переважними є 5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиламіно]-2-метилхінолін і його окремо представлені енантіомери 2-(R)-5-[4-(5фтор-2,3-дигідробензофуран-7-іл)-2-гідрокси-4метил-2-трифторметил-пентиламіно]-2метилхінолін і 2-(S)-5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиламіно]-2-метилхінолін. Спосіб одержання сполук з WO98/54159, WO00/32584 і WO02/10143 також може використовуватися для одержання сполук відповідно до винаходу. Для зв'язування хінолінової або ізохінолінової групи, що є відмітною ознакою сполук відповідно до винаходу, можна здійснювати наступні етапи способу: Вказані в заголовку сполуки (IIа) і (IIb) можуть бути синтезовані, наприклад, шляхом відновного амінування сполуки формули (III) з 5амінохінолінами або 5-аміноізохінолінами, при цьому як відновники використовують, наприклад, борогідрид натрію або ціаноборогідрид натрію в присутності кислоти. Вищеописані складні ефіру переважно являють собою етилові складні ефіри, але також можуть являти собою складні ефіри типу –COOR3, де R3 означає С1-С5-алкіл. Особливим об'єктом винаходу є одержання сполук загальних формул (IIa) і (IIb), шляхом взаємодії альдегіду (III) в умовах відновного амінування, необов'язково у дві стадії, з похідним 5амінохіноліну або похідним 5-аміноізохіноліну де R1 і R2 мають значення, вказані для сполук формул IIа і IIb у пункті 1 формули винаходу. Іншим об'єктом винаходу є одержання альдегіду (III), який може бути отриманий шляхом відновлення сполуки загальної формули X - використовуваної у вигляді хіральної сполуки або у вигляді рацемату - де R3 означає С1-С5-алкіл, відповідно до методів, відомих фахівцеві в даній галузі, з утворенням спирту (XI) і наступного окислення також відповідно до методів, відомими фахівцеві в даній галузі, з утворенням альдегіду, або шляхом скороченого відновлення, відповідно до методів, відомих фахівцеві в даній галузі, складного ефіру X безпосередньо до альдегіду. Другим об'єктом винаходу є спосіб одержання сполуки загальної формули X, що може бути оде Синтез альдегіду здійснюють, наприклад, використовуючи як вихідну речовину сполуку (IV) (WO0032584) шляхом розщеплення простого метилового ефіру, алілування отриманого фенолу (V), перегрупування алілового простого ефіру (VI) до (VII), дигідроксилування й глікольного розщеплення подвійного зв'язку з утворенням лактолу (VIII), відновлення лактолу до діолу (IX), замикання циклу до дигідробензофурану (X), відновлення складного ефірудо спирту (XI), що завершується окисленням до альдегіду (III). 11 ржання шляхом алкілування Фріделя-Крафта 5фтор-2,3-дигідробензофурану й наступного розділення енантіомерів. Альтернативний спосіб одержання сполук формул IIa і IIb здійснюють у такий спосіб: Ізобутен піддають реакції із застосуванням каталізаторів на основі кислот Л'юіса, наприклад ТіСI4, Ti(OR3)4, TiCl2(OR3)2, TiBr2(OR3)2, PdCl4, Pd(OR3)4, PdCl2(OR3)2, PdBr2(OR3)2, ZnCl2, ZnBr2, AICI3, AlBr3. AlEtCl2, Al Ме2СI, солей Сu, наприклад, Cu(OTf)2, CuCl2, CuBr2, Yb (OTf)3, хіральних каталізаторів, таких як, наприклад, (BINOL)2TiCl2, (BINAP)2TiCl2, (BINOL3)2PdCl2, (BINAP)2PdCl2, (BINOL)2TiBr2, (BINAP)2TiBr2, (BINOL)2PdBr2, (BINAP)2PdBr2, переважно FeCl3, де R3 означає С1С5-алкіл, з трифторетилпіруватом з утворенням етилового ефіру 2-гідрокси-4-метил-2трифторметилпент-4-енової кислоти XII. Потім продукт цієї реакції піддають взаємодії на додатковій стадії реакції з 5-фтор-2,3дигідробензофураном, одержуючи сполуку формули (X). Відновлення складного ефіру до спирту (XI) і наступне окислення до альдегіду (III) або відновлення складного ефіру (X) до альдегіду (III) відповідно до способів, добре відомих фахівцеві в даній галузі, розробляється з альдегідами прямих попередників для сполук загальних формул IIa і IIb, які потім можуть бути отримані шляхом взаємодії альдегіду (III) з відповідної хінолінаміном або ізохінолінаміном в умовах відновного амінування, як було описано раніше в рівні техніки. На стадії складного ефіру (XII) або складного ефіру (X) можна здійснювати розділення енантіомерів. Також придатним для розділення енантіомерів є спирт (XI). Наступне роздільне введення хіральних складних ефірів приводить до енантіомерно чистих сполук загальних формул IIa і IIb. Іншим об'єктом винаходу є спосіб одержання сполук загальної формули XII, у якій R3 означає C1-C5-алкіл, шляхом реакції ізобутену з використанням каталізатора на основі кислоти Л'юіса із трифторалкілпіруватом і розділенням продукту реакції на енантіомери. Підходящими розчинниками для реакції ізобутену із трифторетилпіруватом є, наприклад, СН2СI2, тетрагідрофуран, діоксан і діетиловий ефір. Окремим об'єктом винаходу є застосування хіральних каталізаторів на основі кислот Л'юіса для способу відповідно до винаходу. Один з варіантів здійснення винаходу передбачає розділення енантіомерів на будь-якій стадії синтезу за допомогою колонкової хроматографії на хіральній фазі. Розділення на стадії сполуки формули IIа або IIb становить конкретний варіант здійснення винаходу. Розділення енантіомерів на стадії складного ефіру XII або X становить інший важливий варіант здійснення винаходу. Інший варіант здійснення винаходу передбачає розділення підходящих рацемічних проміжних стадій синтезу за допомогою хіральних ад'ювантів. Рацемічні проміжні стадії можна перетворювати або з хіральними ад'ювантами, наприклад, основами, у діастереомерні солі, або з хіральними ад'ювантами в діастереомери, які потім піддають 91348 12 розділенню діастереомерів. Після цього хіральний допоміжний реагент знову розщеплюють і він може бути відновлений. Підходящі хіральні допоміжні реагенти відомі фахівцеві в даній галузі техніки й наведені, наприклад, у книзі J. Seyden-Penne "Chiral Auxiliaries and Ligands in Asymmetric Synthesis", Wiley Verlag, New York (1995). Підходящими проміжними стадіями для розділення рацемічних проміжних стадій є, наприклад, наступні: а) Всі попередники, які мають принаймні одну спиртову функціональну групу; у зв'язку із цим, хіральні кислоти придатні як допоміжні реагенти. б) Попередники альдегіду, такі як, наприклад, альдегід (II), які одержують після відновлення складного ефіру до спирту (XI) і наступного окислення до альдегіду (III) або відновлення складного ефіру (X) до альдегіду (III); інші попередники складних ефірів додатково необов'язково також можуть бути перетворені в альдегіди для розділення енантіомерів. У зв'язку із цим, допоміжними реагентами є хіральні діоли, які потім утворюють діастереомерні кеталі, які можуть бути розділені й знову відщеплені. в) Всі кислоти, які необов'язково можуть бути отримані з попередників складних ефірів шляхом розщеплення існуючої складноефірної функціональної групи або шляхом окислення сполук нижчих стадій окислення відповідно до способів, які добре відомі фахівцеві в даній галузі техніки; При цьому як допоміжні реагенти можна застосовувати хіральні спирти або хіральні аміни. г) Всі попередники, які містять складноефірну функціональну групу, можуть бути перетворені шляхом переетерифікації в діастереомерні складні ефіри й потім можуть бути піддані обробці, як описано у в). Якщо сполуки відповідно до винаходу представлені у вигляді рацемічних сумішей,то вони можуть бути розділені на чисті, оптично активні форми відповідно до способів розділення рацематів, які відомі фахівцеві в даній галузі техніки. Наприклад, рацемічні суміші можуть бути розділені на чисті ізомери за допомогою хроматографії на врівноваженій оптично активній речовині-носії (CHIRALPAK AD®). Підходящими попередниками є сполуки загальних формул III, IV, V, VI, VII, VIII, IX, X і XI. Також представляється можливим естерифікувати вільну гідрокси групу в рацемічній сполуці загальних формул (IIа) і (lIb) або підходящому попереднику з оптично активною кислотою й розділяти одержувані діастереоізомерні складні ефіри шляхом фракціонованої кристалізації або шляхом хроматографії й омиляти розділені складні ефіри в кожному випадку на оптично чисті ізомери. Як оптично активну кислоту можна використовувати, наприклад, мигдалеву кислоту, камфорсульфонову кислоту або винну кислоту. Допоміжний реагент необов'язково може бути відновлений, як відомо фахівцеві в даній галузі. Таким чином, особливим об'єктом винаходу є спосіб, як описано вище в одній із двох альтерна 13 тив, який характеризується тим, що розділення діастереомерів здійснюють на будь-якій підходящій стадії шляхом естерифікації спиртової функціональної групи з хіральною кислотою, розділення діастереомерів і омилення з або без відновлення хірального допоміжного реагенту. Якщо сполуки загальних формул (IIа) і (IIb) представлені у вигляді солей, то вони можуть бути, наприклад, у вигляді гідрохлориду, сульфату, нітрату, фосфату, півалату, малеату, фумарату, тартрату, бензоату, мезилату, цитрату або сукцинату. Проліки визначаються як сполуки, які необов'язково тільки незначно змінені в порівнянні із заявленими сполуками, які підпадають або не підпадають під обсяг еквівалентів пунктів формули винаходу, і розщеплюються до заявлених сполук при метаболізмі в організмі або при контакті з організмом. Проліки піддаються принаймні одній стадії біоперетворення для вивільнення заявлених сполук, які потім проявляють їх фармакологічну дію. Зв'язування запропонованих у винаході сполук із глюкокортикоїдним рецептором (GR) і іншими рецепторами стероїдних гормонів (мінералокортикоїдним рецептором (MR), прогестероновим рецептором (PR) і андрогенним рецептором (AR)) перевіряють за допомогою отриманих рекомбінантним шляхом рецепторів. Дослідження зв'язування проводять із екстрактами із клітин Sf9, які інфікували бакуловірусами, що містять кодувальні послідовності, для відповідного рецептора стероїдного гормону. У порівнянні з порівняльною речовиною [3Н]-дексаметазоном, речовини проявляють від високої до дуже високої спорідненості GR. Крім того, хіноліни й ізохіноліни формул (IIа) і (IIb), які описані в даному винаході, проявляють високу селективність до глюкокортикоїдного рецептора. Важливим молекулярним механізмом, що лежить в основі протизапальної дії глюкокортикоїдів, прийнято вважати опосередковуване GRрецептором пригнічення транскрипції цитокінів, молекул адгезії, ферментів і інших прозапальних факторів. Подібне пригнічення транскрипції обумовлене взаємодією GR-рецептора з іншими факторами транскрипції, наприклад, АР-1 і NF-каппа-В (оглядову інформацію із цього можна знайти в Cato А.С.В. і Wade E., BioAssays, 18, 1996, стор. 371-378). Сполуки загальних формул (IIа) і (IIb) відповідно до винаходу інгібують ініційовану ліпополісахаридом (ЛПС) секрецію цитокіну IL-8 у людських моноцитах лінії ТНР-1. Концентрацію цитокінів визначали в супернатанті з використанням наявних у продажі наборів для ELISA-аналізу. (Ефективність дексаметазону = 100%); Приклад 1, ІС50 = 5,9 нмоль (74% ефективності); Приклад 10, ІС50 = 21 нмоль (86% ефективності); Приклад 11, ІС50 = 8,5 нмоль (61% ефективності); преднізолон, ІС50 = 13 нмоль (96% ефективності). Протизапальну дію сполук загальних формул (IIа) і (IIb) досліджували в експерименті на тварин проведенням досліду з викликаним кротоновою 91348 14 олією запаленням у щурів і/або мишей (J. Exp. Med., 182, 1995, стор. 99-108). Для цього кротонову олію в етанольному розчині локально наносили на вуха тварин. Одночасно з обробкою кротоновою олією локально вводили тестовані речовини. Через 16-24 год вимірювали масу вух, яка служила мірою запального набряку, а також визначали пероксидазну активність, яка служила мірою припливу гранулоцитів, і еластазну активність, яка служила мірою припливу нейтрофільних гранулоцитів. У цьому досліді сполуки загальних формул (IIа) і (IIb) інгібують після їх локального введення в організм три вищевказані параметри запалення. Однією з небажаних дій, яка найбільш часто зустрічається при глюкокортикоїдній терапії, є так званий "стероїдний діабет" (див. Hatz H J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, (Глюкокортикоїди: імунологічні основи, фармакологія й терапевтичні вказівки), вид-во Wissenschafliche Verlagsgesellschaft mbH, Штутгарт, 1998). Причиною стероїдного діабету є стимуляція глюконеогенезу в печінці, обумовлена індукцією відповідальних за це ферментів і дією вільних амінокислот, що утворюються в результаті розкладання білків (катаболічна дія глюкокортикоїдів). Ключовим ферментом катаболічного обміну речовин у печінці є тирозинамінотрансфераза (ТАТ). Активність цього ферменту можна визначати фотометрично в культурі клітин оброблених клітин гепатоми щурів. Клітки обробляли тестованими речовинами протягом 24 годин і після цього вимірювали активність ТАТ. У цьому тесті сполуки загальних формул (IIа) і (IIb) індукують тризоїнамінотрансферазу в незначному ступені (ефективність дексаметазону = 100%); Приклад 1, ЕС50 = 3,7 нмоль (93% ефективності); Приклад 10. ЕС50 = 10 нмоль (92% ефективності); Приклад 11, ЕС50 = 4,0 нмоль (86% ефективності); преднізолон, ЕС50 = 2,6 нмоль (103% ефективності). Іншою небажаною дією, яка часто виникає при місцевому лікуванні, є індукція атрофії шкіри, що приводить до втрати товщини, еластичності шкіри й в остаточному підсумку механічного опору шкіри. Потенційні можливості речовини викликати атрофію шкіри можуть бути визначені на щурах. Тварин піддавали щоденному місцевому введенню протягом 18 днів ефективними дозами тестованих речовин. Шляхом зміни товщини складок шкіри можна спостерігати за зменшенням товщини шкіри протягом часу лікування. У порівнянні із пропіонатом клобетазолу, який, при концентрації 0,01% (досягається максимальна протизапальна дія), приводить до зменшення товщини шкіри на 65%, зменшення тільки на 41% можна визначити в Прикладі 1 при концентрації 0,1% (досягається максимальна протизапальна дія). Цю перевагу також можна спостерігати відносно речовин із заявки WO 03/082827; наприклад, еутомер із Прикладу 36, уже в концентрації 0,06% (максимальна протизапальна дія), індукує зменшення товщини шкіри на 60%. Запропоновані у винаході сполуки загальних формул (IIа) і (IIb) завдяки їх протизапальній дії, а 15 також додатковій протиалергічній, імунодепресивній й антипроліферативній дії можуть використовуватися як лікарські засоби для лікування або профілактики наступних патологічних станів у ссавців і людини, особливо для місцевого введення: У цьому випадку, термін "захворювання" стосується наступних показань: (i) захворювання легень, які супроводжуються запальними, алергічними й/або проліферативними процесами: - хронічні обструктивні захворювання легень будь-якого походження, насамперед бронхіальна астма, - бронхіт різного походження, - респіраторний дистрес-синдром дорослих (ARDS). гострий респіраторний дистрес-синдром, - бронхоектаз, - всі форми рестриктивних захворювань легень, насамперед алергічний альвеоліт, - всі форми набряку легень, насамперед токсичний набряк легень, наприклад, променевий пневмоніт, - саркоїдози й гранулематози, насамперед хвороба Бека; (ii) ревматичні захворювання/аутоімунні захворювання/захворювання суглобів, які супроводжуються запальними, алергічними й/або проліферативними процесами: - всі форми ревматичних захворювань, насамперед ревматичний артрит, гостра ревматична лихоманка, ревматична поліміалгія, хвороба Бехчета, - реактивний артрит, - запальні захворювання м'яких тканин інших походжень, - симптоми артриту при дегенеративних захворюваннях суглобів (артрозах), - травматичні артрити, - вітіліго, - колагенози будь-якого походження, наприклад, системний червоний вовчок, склеродермія, поліміозит, дерматоміозит, синдром ГужероШегрена, хвороба Стила, синдром Фелті, - саркоїдоз і гранулематоз, - ревматизм м'яких тканин; (iii) алергії або псевдоалергічні захворювання, які супроводжуються запальними й/або проліферативними процесами: - всі форми алергічних реакцій, наприклад, набряк Квінке, сінний нежить, алергія до укусів комах, алергічні реакції на лікарські засоби, препарати крові, контрастні речовини й інші аналогічні алергени, анафілактичний шок, кропивниця, алергічний і подразливий контактний дерматит, алергічне захворювання судин, - алергічний васкуліт; (iv) запалення стінок судин (васкуліти): - нодозний панартеріїт, темпоральний артеріїт, нодозна еритема; - вузликовий поліартеріїт, - гранулематоз Вегнера, - гігантоклітинний артеріїт; (v) нашкірні хвороби, які супроводжуються запальними, алергічними й/або проліферативними процесами: - атопічний дерматит (насамперед у дітей), 91348 16 - всі форми екземи, такі як, наприклад, атопічний дерматит (насамперед у дітей), - висип будь-якого походження або дерматози; - псоріаз або парапсоріатична група, - червоний волосяний лишай, - еритематозні захворювання, викликані різними патогенними факторами, наприклад, опроміненням, хімікатами, опіками й т.д., - пухирчасті дерматози, такі як аутоімунна звичайна пухирчатка, пухирчастий пемфігоїд, - захворювання ліхеноїдного характеру, - шкірна сверблячка (наприклад, алергічного походження), - себорейна екзема, - група розацеа, - багатоформна ексудативна еритема, - баланіт, - вульвіт, - прояви захворювань судин, - випадіння волосся, наприклад, колоподібне облисіння, - шкірна лімфома; (vi) захворювання нирок, які супроводжуються запальними, алергічними й/або проліферативними процесами: - нефротичний синдром, - всі форми нефриту, наприклад, гломерулонефрит; (vii) захворювання печінки, які супроводжуються запальними, алергічними й/або проліферативними процесами: - гострий розпад печінкових клітин, - гострий гепатит різного походження, наприклад, вірусний, токсичний, лікарський, - хронічний агресивний і/або хронічний персистуючий гепатит; (viii) шлунково-кишкові захворювання, які супроводжуються запальними, алергічними й/або проліферативними процесами: - регіональний ентерит (хвороба Крона), - виразковий коліт, - гастрит, - рефлюкс-езофагіт, - неспецифічні виразкові коліти іншого походження, наприклад, глютенова хвороба; (ix) проктологічні захворювання, які супроводжуються запальними, алергічними й/або проліферативними процесами: - екзема заднього проходу, - тріщини, - гемороїдальні вузли, - ідіопатичний проктит; (x) очні хвороби, які супроводжуються запальними, алергічними й/або проліферативними процесами: - алергічні кератит, увеїт, ірит, - кон'юнктивіт, - блефарит, - неврит зорового нерва, - хоріоїдит, - симпатична офтальмія; (xi) оториноларингологічні захворювання, які супроводжуються запальними, алергічними й/або проліферативними процесами: - алергічний риніт, сінний нежить, 17 - зовнішній отит, обумовлений наприклад, контактним дерматитом, інфекцією й т.д., - середній отит; (xii) неврологічні захворювання, які супроводжуються запальними, алергічними й/або проліферативними процесами: - набряк головного мозку, насамперед обумовлений пухлиною набряк головного мозку, - розсіяний склероз, - гострий енцефаломієліт, - менінгіт, - різні форми судорожних припадків, наприклад, блискавичні кивальні судоми, - гостра травма спинного мозку, - удар; (xiii) гематологічні захворювання, які супроводжуються запальними, алергічними й/або проліферативними процесами, такі як, наприклад: ходжкінські й не-ходжкінські лімфоми, тромбоцитемії, еритроцитози, - набута гемолітична анемія, - ідіопатична тромбоцитопенія; (xiv) онкологічні захворювання, які супроводжуються запальними, алергічними й/або проліферативними процесами, такі як, наприклад: карциноми або саркоми. - гострий лімфолейкоз, - злоякісна лімфома, - лімфогранулематози, - лімфосаркоми, - велике метастазування, насамперед при раку молочної залози, бронха й передміхурової залози; (xv) ендокринні захворювання, які супроводжуються запальними, алергічними й/або проліферативними процесами, такі як, наприклад: - ендокринна орбітопатія, - тиреотоксичний криз, - тиреоїдит Де Кервена, - тиреоїдит Хашимото, - базедова хвороба, - гранулематозний тиреоїдит, - хронічний лімфоматозний тиреоїдит; (xvi) трансплантація органів і тканин, реакція "трансплантат проти хазяїна"; (xvii) стани важкого шоку, наприклад, анафілактичний шок, синдром системної запальної реакції (SIRS); (xviii) замісна терапія при: - вродженій первинній недостатності кори надниркових залоз, наприклад, вродженому адреногенітальному синдромі, - придбаної первинної недостатності кори надниркових залоз, наприклад, хвороби Адісона, аутоімунному запаленні надниркових залоз, постінфекційній недостатності кори надниркових залоз, пухлинах, метастазах і т.д., - уродженої вторинної недостатності кори надниркових залоз, наприклад, уродженому гіпопітуїтаризмі, - придбаної вторинної недостатності кори надниркових залоз, наприклад, постінфекційній недостатності кори надниркових залоз, пухлинах і т.д.; (xix) блювота, обумовлена запальними, алергічними й/або проліферативними процесами, 91348 18 - наприклад, блювота, обумовлена застосуванням цитостатиків у сполученні з 5-НТ3антагоністом; (xx) болю запального походження, наприклад, люмбаго; (xxi) інші різні стадії захворювання, включаючи діабет І типу (інсулін-залежний діабет), остеоартрит, синдром Пйєна-Барре, рестеноз після черезшкірної транслюмінальної ангіопластики, хвороба Альцгеймера, гострий і хронічний біль, артеріосклероз, реперфузійне пошкодження, застійна серцева недостатність, інфаркт міокарда, термічне пошкодження, поліорганна недостатність, вторинна по відношенню до травми, гострий гнійний менінгіт, некротизуючий ентероколіт і синдроми, зв'язані з гемодіалізом, лейкоферезом і переливанням гранулоцитів. Переважним є місцеве введення сполук або їх сумішей відповідно до винаходу для лікування захворювань, вказаних в абзацах (i), (ii), (iii), (v), (viii), (ix), (x), (xi), (xv), (xx) і (xxi). Винахід також стосується комбінованих терапій або комбінованих композицій, у яких агоніст глюкокортикоїдного рецептора (GR) формули (І) або його фармацевтично прийнятна сіль, або фармацевтична композиція, що містить агоніст GR формули (І) або його фармацевтично прийнятну сіль, вводять одночасно (необов'язково в одній і тій же композиції) або підряд разом з одним або декількома лікарськими засобами для лікування перерахованих вище патологічних станів. Наприклад, для лікування ревматоїдного артриту, остеоартриту, ХОЗЛ (хронічного обструктивного захворювання легень), астми або алергічного риніту, агоніст GR згідно із даним винаходом можна комбінувати з одним або декількома лікарськими засобами для лікування такого стану. Якщо таку комбінацію агоніста GR формули (І) або його фармацевтично прийнятної солі вводять шляхом інгаляції, то лікарський засіб для комбінованого введення може бути вибраний з наступних засобів: - інгібітор PDE4, включаючи інгібітор ізоформи PDE4D, - селективний агоніст 2 адренорецептора, такий як, наприклад, метапротеренол, изопротеренол, ізопреналін, альбутерол, сальбутамол, формотерол, сальметерол, тербуталін, орципреналін, бітолтеролмезилат, пірбутерол або індакатерол; - антагоніст мускаринового рецептора (наприклад, M1, M2 або М3 антагоніст, такий як, наприклад, більше селективний М3 антагоніст), такий як, наприклад, іпратропій бромід, тіотропій бромід, окситропій бромід, пірензепін або телензепін; - модулятор дії хемокінового рецептора (такий як, наприклад, антагоніст рецептора CCR1); або - інгібітор дії р38 кінази. Крім цього запропоновані у винаході загальних формул (IIа) і (IIb) можна також застосовувати для лікування й профілактики інших, не перерахованих вище патологічних станів, при яких на сьогоднішній день використовують штучні глюкокортикоїди (інформацію із цього питанню див. в Hatz H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, вид-во 19 Wissenschafliche Verlagsgesellschaft mbH, Штутгарт, 1998). Всі розглянуті вище показання (i)-(xx) докладно описані в Hatz H.J., Glucocorticoide: Immunologische Grundlagen, Pharmakologie und Therapierichtlinien, вид-во Wissenschafliche Verlagsgesellschaft mbH, Штутгарт, 1998. Дозування, у якому запропоновані у винаході сполуки необхідно застосовувати для досягнення терапевтичного ефекту при вказаних вище патологічних станах, є змінною величиною й залежать, наприклад, від ефективності конкретної сполуки загальних формул (IIа) і (IIb), хазяїна, методу введення лікарського засобу в організм, типу й тяжкості станів, які підлягають лікуванню, а також від того, чи застосовується запропонована у винаході сполука як профілактичний або лікувальний засіб. Винахід стосується застосування сполук відповідно до винаходу для готування лікарського засобу. Об'єктами даного винаходу є також наступні: (i) застосування однієї із запропонованих у винаході сполук загальних формул (IIа) і (IIb) або їх суміші для одержання лікарського засобу для лікування "захворювання"; (ii) спосіб і метод лікування "захворювання", який полягає в тому, що пацієнтові, який потребує подібного лікарського засобу, вводять запропоновану у винаході сполуку в кількості, ефективній для пригнічення хвороби; (iii) фармацевтична композиція для лікування "захворювання", яка містить одну із запропонованих у винаході сполук або їх суміш і принаймні одну фармацевтичну допоміжну речовину й/або носій. Зокрема, об'єктом даного винаходу є застосування сполук відповідно до винаходу для лікування запальних захворювань. При лікуванні тваринних задовільних результатів у цілому можна очікувати при застосуванні запропонованої у винаході сполуки в добовій дозі від 1 мкг до 100 мг на кг ваги тіла. В організм більших ссавців, наприклад, людини, запропоновану у винаході сполуку рекомендується вводити в добовій дозі від 1 мкг до 100 мг на кг ваги тіла. У переважному варіанті доза запропонованої у винаході сполуки повинна становити від 10 мкг до 30 мг на кг ваги тіла, більш переважно від 10 мкг до 10 мг на кг ваги тіла. Таку дозу доцільно вводити в організм протягом доби декількома меншими дозами. Фармацевтичні препарати на основі запропонованих у винаході нових сполук готують за відомою технологією шляхом переробки діючої речовини разом із широко використовуваними в галеніці носіями, наповнювачами, речовинами, які впливають на розпад лікарської форми, сполучними, вологоутримуючими засобами, ковзними речовинами, абсорбентами, розріджувачами, речовинами, які поліпшують смак, барвниками й т.д. і переведення в необхідну лікарську форму. Щодо цього можна послатися на книгу Remington's Pharmaceutical Science, 15-е вид., вид-во Mack Publishing Company, Східна Пенсільванія, 1980. Особливо переважними є добавки, які придатні для місцевого введення. 91348 20 Для перорального застосування придатні насамперед таблетки, таблетки з покриттям, капсули, пігулки, порошки, грануляти, пастилки, суспензії, емульсії або розчини. Для парентерального застосування можна використовувати сполуки для ін'єкцій. Для внутрішньосуглобової ін'єкції можна використовувати приготовлені відповідним чином кристалічні суспензії. Для внутрішньом'язової ін'єкції можна використовувати водні й масляні розчину для ін'єкцій або суспензії або відповідні депо-препарати. Для ректального застосування пропоновані у винаході нові сполуки можна використовувати в терапевтичних цілях як системно, так і локально в складі супозиторіїв, капсул, розчинів (які вводять, наприклад, за допомогою клізм) і мазей. Для введення запропонованих у винаході нових сполук у легені можна використовувати аерозолі й засоби для інгаляції. Для локального застосування на очах, зовнішньому слуховому проході, середньому вусі, порожнинах носа й навколоносових пазухах запропоновані у винаході нові сполуки можна використовувати в складі відповідних фармацевтичних препаратів у вигляді крапель, мазей і настойок. Для місцевого застосування можна використовувати препарати у вигляді гелів, мазей, жирних мазей, кремів, паст, порошків, емульсій, розчинів і суспензій. Для досягнення достатньої фармакологічної дії вміст сполук загальних формул (IIа) і (IIb) у таких лікарських формах повинен становити від 0,01 до 20%. До обсягу винаходу включені також запропоновані в ньому сполуки загальних формул (IIа) і (IIb) як терапевтично діючі речовини. Крім цього до обсягу винаходу включені запропоновані в ньому сполуки загальних формул (IIа) і (IIb) як терапевтично діючі речовини у сполученні з фармацевтично сумісними й прийнятними допоміжними речовинами й носіями. Об'єктом винаходу є також фармацевтична композиція, яка містить одну з фармацевтично активних запропонованих у винаході сполук або їх суміш або її фармацевтично прийнятну сіль і фармацевтично прийнятну сіль або фармацевтично прийнятні допоміжні речовини й носії. Нижчеподані приклади використовуються для більш докладного пояснення винаходу, але ніяким чином його не обмежують. Синтез важливих попередників, який не описаний в обсязі цих експериментів, уже описаний у попередньому рівні техніки й може бути знайдений, наприклад, в WO 98/54159 і WO 02/10143, WO 03/082280 або WO 03/082827. Експериментальна частина Приклад 1 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]-2етилхінолін Етиловий ефір 4-(5-фтор-2-гідроксифеніл)-2гідрокси-4-метил-2-трифторметил-валеріанової кислоти Розчин етилового ефіру 4-(5-фтор-2метоксифеніл)-2-гідрокси-4-метил-2 21 трифторметил-валеріанової кислоти (WO 00/32584) (10,83г, 30,74 ммоль) у дихлорметані (200 мл) змішували з 1М розчином трибромід бору-хлороформ (60 мл), який при цьому охолоджували на льодяній бані, і його перемішували протягом 3 годин при 2-4°С. Партію виливали в лід і насичений розчин NaHCo3, і його перемішували протягом 30 хвилин, при цьому охолоджували на льоді. Органічну фазу відокремлювали, і водну фазу ще два рази екстрагували дихлорметаном. Об'єднані, органічні екстракти промивали насиченим розчином NaCl, висушували (Na2SO4) і концентрували шляхом упарювання у вакуумі. При колонковій хроматографії залишку (силікагель) з гексаном-етилацетатом одержували 5,36 г продукту. При екстрагуванні водної фази з етилацетатом одержували знову 4,0 г продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,22 (t, 3Н), 1,41 (s, 3Н), 1,47 (s, 3Н), 2,52 (d, 1Н), 2,87 (d, 1H), 3,55 (br., 1H), 3,76 (dq, 1H), 4,11 (dq, 1H), 5,01 (s, 1H), 6,59 (dd, 1H), 6,77 (ddd, 1H), 6,90 (dd, 1H). Етиловий ефір 4-(2-алілокси-5-фторфеніл)-2гідрокси-4-метил-2-трифторметил-валеріанової кислоти Карбонат калію (4,15 г, 30 ммоль) і алілбромід (2,16 мл, 25 ммоль) додавали до розчину етилового ефіру 4-(5-фтор-2-гідроксифеніл)-2-гідрокси-4метил-2-трифторметил-валеріанової кислоти (5,36 г, 15,84 ммоль) у ДМФА (50 мл), який при цьому охолоджували на льоді. Через 2 години при 2°С і через 2 години при кімнатній температурі, партію вливали в суміш води з льодом і екстрагували гексаном-простим ефіром 2:1. Об'єднані органічні екстракти висушували (Na2SO4) і концентрували шляхом упарювання у вакуумі. При здійсненні колонкової хроматографії на силікагелі з гексанометилацетатом одержували 5,7 г продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,18 (t, 3Н), 1,39 (s, 3Н), 1,45 (s, 3Н), 2,54 (d, 1Н), 2,91 (d, 1H), 3,48 (br., 1H), 3,65 (dq, 1H), 4,09 (dq, 1H), 4,55 (dt, 2H), 5,31 (dq, 1H), 5,45 (dq, 1H), 6,09 (ddt, 1H), 6,76 (dd, 1H), 6,84 (ddd, 1H), 6,91 (dd, 1H). Етиловий ефір 4-(3-аліл-5-фтор-2гідроксифеніл)-2-гідрокси-4-метил-2трифторметил-валеріанової кислоти Етиловий ефір 4-(2-алілокси-5-фторфеніл)-2гідрокси-4-метил-2-трифторметил-валеріанової кислоти (5,65 г, 14,93 ммоль) нагрівали під впливом мікрохвиль протягом 10 хвилин до 230°С. Реакційну суміш очищали за допомогою колонкової хроматографії на силікагелі з гексанометилацетатом. Одержували 3,31 г продукту. 1 Н-ЯМР (300 МГц, CDC13); = 1,23 (t, 3Н), 1,40 (s, 3Н), 1,45 (s, 3Н), 2,60 (d, 1Н), 2,78 (d, 1H), 3,37 (d, 2H), 3,49 (br., 1H), 3,83 (dq, 1H), 4,14 (dq, 1H), 5,09 (br., 1H), 5,23 (dq, 1H), 5,26 (dq, 1H), 5,99 (ddt, 1H), 6,72 (dd, 1H), 6,83 (dd, 1H). Етиловий ефір 4-(5-фтор-2-гідрокси-3-(2гідроксіетил)феніл)-2-гідрокси-4-метил-2трифторметил-валеріанової кислоти Етиловий ефір 4-(3-аліл-5-фтор-2гідроксифеніл)-2-гідрокси-4-метил-2трифторметил-валеріанової кислоти (4,9 г, 12,95 ммоль) в ацетоні (214 мл) і воді (32 мл) змішували з оксидом-гідратом N-метилморфоліну (1,75 г, 91348 22 12,95 ммоль) і 0,4 мл розчину тетроксиду осмію (2,5 % по вазі в mpem-бутанолі), який при цьому охолоджували на льоді. Через 30 хвилин при 2°С і 16 годин при кімнатній температурі, партію змішували з іншими 0,3 мл розчину тетроксиду осмію й перемішували протягом 3 днів при кімнатній температурі. Для здійснення звичайної обробки, ацетон відганяли на роторному випарнику, залишок ресуспендували в етилацетаті (200 мл) і воді (150 мл), і фази розділяли. Водну фазу ще два рази екстрагували етилацетатом, об'єднані етилацетатні екстракти промивали насиченим розчином NaCl, висушували (Na2SO4) і концентрували шляхом упарювання. При здійсненні колонкової хроматографії на силікагелі з гексаном-етилацетатом одержували 5,27 г етилового ефіру 4-(3-(2,3дигідроксипропіл)-5-фтор-2-гідроксифеніл)-2гідрокси-4-метил-2-трифторметил-валеріанової кислоти. Його (5,2 г, 12,6 ммоль) перемішували з перйодатом натрію (5,39, 25,2 ммоль) у ТГФ (75 мл) і воді (12,5 мл) протягом 24 годин в атмосфері азоту. Партію концентрували шляхом упарювання, і водний залишок три рази екстрагували етилацетатом. Об'єднані органічні фази промивали насиченим розчином NaCl, висушували (Na2SO4) і концентрували шляхом упарювання у вакуумі. При здійсненні колонкової хроматографії на силікагелі з гексаном-етилацетатом одержували 4,3 г етилового ефіру 4-(5-фтор-2-гідрокси-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-валеріанової кислоти. 4,1 г (10,78 ммоль) ці речовини розчиняли в метанолі (150 мл), розчин змішували порціями з борогідридом натрію (586 мг, 15 ммоль), і його перемішували протягом 30 хвилин при кімнатній температурі. Значення рН встановлювали рівним 7,5 за допомогою оцтової кислоти, і реакційну суміш концентрували шляхом упарювання. Залишок ресуспендували в етилацетаті (200 мл) і насиченому розчині NaHCO3 (75 мл), фази розділяли, органічну фазу промивали насиченим розчином NaCl, висушували (Na2SO4) і концентрували шляхом упарювання у вакуумі, у такий спосіб накопичували 4,01 г продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,23 (t, 3Н), 1,40 (s, 3Н), 1,47 (s, 3Н), 2,59 (d, 1Н), 2,76-2,92 (m, 2H), 2,91 (d, 1H), 3,85 (dq, 1H), 3,98 (m, 2H), 4,05 (dq, 1H), 6,67 (dd, lH),6,81(dd, 1H). Етиловий ефір 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-валеріанової кислоти Етиловий ефір 4-(5-фтор-2-гідрокси-3-(2гідроксіетил)феніл)-2-гідрокси-4-метил-2трифторметил-валеріанової кислоти (3,90 г, 10,2 ммоль) розчиняли із трифенілфосфіном (3,14 г, 12 ммоль) і триетиламіном (2,1 мл, 15 ммоль) в ацетонітрилі (150 мл), змішували із чотирихлористим вуглецем (2 мл) і перемішували протягом 3 днів в атмосфері азоту при кімнатній температурі. Розчинник відганяли на роторному випарнику, і залишок ресуспендували в етилацетаті (150 мл) і воді (75 мл). Етилацетатну фазу відокремлювали, промивали насиченим розчином NaCl, висушували (Na2SO4) і концентрували шляхом упарювання у вакуумі. При здійсненні колонкової хроматографії 23 на силікагелі з гексаном-етилацетатом одержували 3,31 г продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,21 (t, 3H), 1,35 (s, 3H), 1,40 (s, 3H), 2,43 (d, 1H), 2,74 (d, 1H), 3,15 (m, 2H), 3,56 (br., 1H), 3,73 (dq, 1H), 4,13 (dq, 1H), 4,58 (t, 2Н), 6,68 (dd, 1H), 6,77 (dm, 1H). 4-(5-фтор-2,3-дигідробензофуран-7-іл)-4метил-2-трифторметил-1,2-пентадіол Розчин етилового ефіру 4-(5-фтор-2,3-дигідробензофуран-7іл)-2-гідрокси-4-метил-2-трифторметилвалеріанової кислоти (3,2 г, 8,78 ммоль) у простому ефірі (150 мл) змішували з літійалюмінійгідридом (683 мг, 18 ммоль), який при цьому охолоджували на льоді, і його перемішували протягом 1 години при 2°С і протягом 6 годин при кімнатній температурі. Партію охолоджували до 3°С, до неї по краплях додавали насичений розчин НаНСО3 (1,5 мл), і суміш перемішували протягом 30 хвилин при 3°С і протягом 16 годин при кімнатній температурі. Безбарвний осад відсмоктували й промивали простим ефіром. Об'єднані фільтрати концентрували шляхом упарювання й очищали за допомогою колонкової хроматографії на силікагелі з гексаном-етилацетатом. Накопичували 2,65 г продукту у вигляді безбарвної, кристалічної твердої речовини. 1 Н-ЯМР (300 МГц, CDCl3); = 1,39 (s, 3Н), 1,47 (s, 3Н), 2,21 (d, 1Н), 2,46 (d, 1H), 2,89 (br., 1H), 3,17 (t, 2H), 3,41 (dm, 1H), 3,49 (d, 1H), 4,57 (t, 2H), 6,80 (d, 2H). 4-(5-фтор-2,3-дигідробетофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентаналь Комплекс піридин-триоксид сірки (3,82 г, 24 ммоль) додавали в атмосфері азоту до розчину 4(5-фтор-2,3-дигідробензофуран-7-іл)-4-метил-2трифторметил-1,2-пентадіолу (2,61 г, 8,1 ммоль), диметилсульфоксиду (28,6 мл) і триетиламіну (5,6 мл, 40 ммоль) у дихлорметані (85 мл). Партію перемішували протягом 3 годин при кімнатній температурі, змішували з насиченим розчином NH4CI (50 мл), перемішували протягом 30 хвилин при кімнатній температурі й розводили простим ефіром (250 мл). Фази розділяли, і водну фазу екстрагували простим ефіром. Об'єднані органічні фази промивали насиченим розчином NaCl, висушували (Na2SО4) і концентрували шляхом упарювання у вакуумі. При колонковій хроматографії залишку на силікагелі з гексаном-етилацетатом одержували 2,19 г продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,35 (s, 3Н), 1,42 (s, 3Н), 2,20 (d, 1H), 3,17 (t, 2Н). 3,28 (d, 1Н), 3,62 (s, 1H), 4,59 (m, 2H), 6,63 (dd, 1H), 6,81 (dm, 1H), 9,08 (s, 1H) 2-Метил-5-нітрохінолін 2-Метилхінолін (108,3 мл, 0,80 моль) по краплях додавали до 65% азотної кислоти (61 мл, 0,88 моль) при внутрішній температурі 0 - 10°С (охолодження сухим льодом) протягом 45 хвилин. Через 1 годину осаджений нітрат відсмоктували й порціями вводили при внутрішній температурі 0-6°С у концентрованій сірчаній кислоті (240 мл). Через 30 хвилин до суміші додавали нітрат калію (6г, 60 ммоль), і неї перемішували протягом 16 годин при кімнатній температурі. Партію повільно вливали на лід/воду, і значення рН встановлювали рівним 1,5 91348 24 за допомогою 40% NaOH (~ 500 мл). Осад відсмоктували, фільтрат підлуговували за допомогою 25% водного розчину аміаку (рН 10) і фільтрували. Залишок на фільтрі розчиняли в гарячому метанолі (500 мл). При охолодженні викристалізовувався 8-нітро-ізомер. Маточний розчин концентрували шляхом упарювання й очищали за допомогою колонкової хроматографії на силікагелі з гексанометилацетатом, у такий спосіб накопичували 53 г 2метил-5-нітрохіноліну. 1 Н-ЯМР (300 МГц, CDCl3); = 2,79 (s, 3Н), 7,52 (d, 1Н), 7,76 (d, 1H), 8,31 (d, 1H), 8,32 (d,1H), 8,88 (d,1H). 5-Аміно-2-метилхінолін 2-Метил-5-нітрохінолін (25 г, 132,85 ммоль) і паладій на вугіллі (2,5 г) в 8 мл льодяної оцтової кислоти перемішували протягом 51/2 годин в атмосфері водню при атмосферному тиску. Каталізатор відсмоктували й промивали етилацетатом. Об'єднані фільтрати концентрували шляхом упарювання. При колонковій хроматографії залишку на силікагелі з дихлорметаном-ацетоном одержували 10,6 г продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 2,72 (s, 3Н), 4,15 (br., 2Н), 6,76 (dd, 1Н), 7,23 (d, 1H), 7,43-7,50 (m, 2H), 8,06 (d, 1H). 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметилпентиліденаміно]-2-метилхінолін Суміш, яка складалася з 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентаналю (320 мг, 1 ммоль) і 5аміно-2-метилхіноліну (190 мг, 1,2 ммоль) в оцтовій кислоті (2 мл), перемішували протягом 16 годин при кімнатній температурі, розводили 10 мл толуолу й нагрівали протягом 4 годин у водовіддільнику. Партію концентрували шляхом упарювання, у такий спосіб оцтову кислоту азеотропно видаляли з толуолом. Залишок очищали за допомогою колонкової хроматографії на силікагелі з гексаном-етилацетатом: 274 мг продукту накопичували у вигляді безбарвних кристалів. 1 Н-ЯМР (300 МГц, CDCl3); = 1,34 (s, 3H), 1,54 (s, 3H), 2,27 (d, 1H), 2,66 (m, 1H), 2,76 (s, 3H), 2,94 (m, 1H), 3,29 (d, 1H), 4,47 (m, 2H), 4,85 (s, 1H), 6,28 (dm, 1H), 6,51 (d, 1H), 6,61 (dd, 1H), 7,33 (d, 1H), 7,51 (t, 1H), 7,63 (s, 1H), 7,90 (d, 1H), 8,18 (d, 1H). 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно] -2метилхінолін 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметилпентиліденаміно]-2-метилхінолін (266 мг, 0,58 ммоль) і бікарбонат натрію (250 мг) у метанолі (15 мл) перемішували протягом 15 хвилин при кімнатній температурі. До суміші чотирма порціями додавали борогідрид натрію (152 мг, 4 ммоль) протягом 24 годин. Після завершення реакції (спостереження за допомогою TLC), партію змішували з насиченим розчином NaHCO3 (10 мл) і концентрували шляхом упарювання. Залишок ресуспендували в етилацетаті (30 мл) і воді (20 мл), і фази розділяли. Водну фазу екстрагували етилацетатом. Об'єднані органічні фази висушували (Na2SO4) і концентрували шляхом упарювання. 25 При здійсненні колонкової хроматографії на силікагелі з гексаном-етилацетатом одержували 200 мг продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,43 (s, 3Н), 1,54 (s, 3Н), 2,29 (d, 1Н), 2,68 (d, 1H, 2,71 (s, 3Н), 2,923,19 (m, 3Н), 3,34 (dd, 1H), 4,26 (br., 1H), 4,52 (m, 2H), 6,09 (dm, 1H), 6,81 (dm, 1H), 6,87 (dm, 1H), 7,20 (d, 1H), 7,39-7,47 (m, 2H), 7,89 (d, 1H). Енантіомери розділяли за допомогою хіральної ВЕРХ, використовуючи колонку типу Chiralpak AD 20 і елюант гексан (0,1% діетиламін) - етанол в (+)- і (-)-ізомери. (-)-Енантіомер ([ ]D(ТГФ) –43,2°, с=1,45) елюювався перед (+)-енантіомером (([ ]D(ТГФ) +42,8°, с = 1,53). Приклад 2 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]-1метилізохінолін Аналогічно до прикладу 1, 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентаналь перетворювали з 5аміно-1-метилізохіноліном в 5-[4-(5-фтор-2,3Дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиліденаміно]-1-метилізохінолін, який відновлювали з борогідридом натрію до продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,43 (s, 3Н), 1,55 (s, 3Н), 2,29 (d, 1H), 2,69 (d, 1H), 2,90 (s, 3H), 2,903,20 (m, 4H), 3,33 (br., 1H), 4,35 (br., 1H), 4,53 (m, 2H), 6,26 (d, 1H), 6,80 (dm, 1H), 6,88 (dm, 1H), 7,29 (t, 1H), 7,35 (d, 1H), 7,48 (d, 2H), 8,32 (d, 1H). При розділенні енантіомерів за допомогою хіральної ВЕРХ (колонка: Chiralpak AD 20 , елюант: гексан-етанол) спочатку одержували (+)енантіомер ([ ]D(МеОН) +29,8°, с = 0,54) і потім (-)енантіомер ([ ]D(MeOH) -29,4°, с = 0,55). Приклад 3 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно] ізохінол-1 (2Н)-он Аналогічно до прикладу 1, 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентаналь перетворювали з 5аміноізохінол-2(1Н)-оном в 5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиліденаміно]ізохінол-1(2Н)-он, який відновлювали з борогідридом натрію до продукту. 1 Н-ЯМР (300 МГц, [D]6-ДМСО); = 1,33 (s, 3Н), 1,52 (s, 3Н), 1,98 (d, 1Н), 2,78 (d, 1H), 2,84-3,10 (m, 4H), 4,49 (t, 1H), 4,80 (t, 1H), 6,03 (s, 1H), 6,21 (d, 1H), 6,41 (d, 1H), 6,80-6,87 (m, 2H), 7,12-7,17 (m, 2H), 7,47 (d, 1H), 11,21 (br. d, 1H). При розділенні енантіомерів за допомогою хіральної ВЕРХ (колонка: Chiralpak AS 20 , елюант: гексан-етанол) спочатку одержували (+)енантіомер ([ ]D(MeOH) +29,9°, с = 0,92) і потім (-)енантіомер ([ ]D(MeOH) -28,4°, с = 0,94). Приклад 4 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]2,6-диметилхінолін 91348 26 Аналогічно до прикладу 1, 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентаналь перетворювали з 5аміно-2,6-диметилхіноліном в 5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиліденаміно]-2,6диметилхінолін, який відновлювали із ціаноборогідридом натрію до продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,34 (s, 3Н), 1,57 (s, 3Н), 2,22 (d, 1Н), 2,31 (s, 3Н), 2,45 (d, 1H), 2,662,76 (m, 1H), 2,74 (s, 3H), 2,83-3,00 (m, 2H), 3,10 (d, 1H), 3,52 (br. 1H), 4,20 (q, 1H), 4,29 (s, 1H), 4,38 (q, 1H), 6,55 (d, 1H), 6,77 (dm, 1H), 7,22 (d, 1H), 7,42 (d, 1H), 7,68 (d, 1H), 7,94 (d, 1H). При розділенні енантіомерів за допомогою хіральної ВЕРХ (колонка: Chiralcel OJ 5 , елюант: гексан-етанол) спочатку одержували (+)енантіомер ([ ]D(МеОН) +55,8°, с = 0,94) і потім (-)енантіомер ([ ]D(MeOH) -52,1°, с = 0,99). Приклад 5 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]-6хлор-2-метилхінолін Аналогічно до прикладу 1, 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентаналь перетворювали з 5аміно-6-хлор-2-метилхіноліном в 5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентилідєнаміно]-6-хлор-2метилхінолін, який відновлювали із ціаноборогідридом натрію до продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,34 (s, 3Н), 1,57 (s, 3Н), 2,22 (d, 1Н), 2,53 (d, 1Н), 2,75 (s, 3Н), 2,722,83 (m, 1H). 2,89-3,02 (m, 2H), 3,16 (dd, 1H), 4,04 (s, 1H), 4,30 (q, 1H), 4,42 (q, 1H), 6,51 (dm, 1H), 6,73 (dd, 1H), 7,26 (d, 1H), 7,55 (d, 1H), 7,66 (d, 1H),7,96(d, 1H). При розділенні енантіомерів за допомогою хіральної ВЕРХ (колонка: Chiralcel OJ 20 , елюант: гексан-етанол) спочатку одержували (+)енантіомер ([ ]D(МеОН) +41,7°, с = 0,88) і потім (-)енантіомер ([ ]D(MeOH) -39,8°, с = 0,99). Приклад 6 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно] ізохінолін Аналогічно до прикладу 1, 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентаналь перетворювали з 5аміноізохіноліном в 5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиліденаміно] ізохінолін, який відновлювали з борогідридом натрію до продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,43 (s, 3Н), 1,55 (s, 3Н), 2,30 (d, 1Н), 2,71 (d, 1H), 2,92 (m, 1H), 3,07 (m, 1H), 3,17 (dd, 1H), 3,35 (dd, 1H), 4,35 (br.t, 1H), 4,49 (q,1Н), 4,55 (q, 1H), 6,27 (m, 1H), 6,78 (dm, 1H), 6,88 (dm, 1H), 7,36 (m, 2H), 7,40 (d, 1H), 8,45 (d, 1H), 9,13 (s, 1H). Приклад 7 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно] хінолін Аналогічно до прикладу 1, 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2 27 трифторметил-пентаналь перетворювали з 5амінохіноліном в 5-[4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-пентиліденаміно]хінолін, який відновлювали з борогідридом натрію до продукту. 1 Н-ЯМР (300 МГц, CDCl3); = 1,43 (s, 3Н), 1,54 (s, 3Н), 2,31 (d, 1Н), 2,68 (d, 1H), 2,96 (m, 1H), 3,08 (m, 1H), 3,17 (dd, 1H), 3,35 (dd, 1H), 4,32 (br.t, 1H), 4,52 (m, 2H), 6,15 (d, 1H), 6,80 (dm, 1H), 6,88 (dd, 1H), 7,31 (dd, 1H), 7,45 (t, 1H), 7,53 (d, 1H),7,98(d, 1H), 8,86 (dd, 1H). Приклад 8 5-[4-(2,3-Дигідро-5-фтор-7-бензофураніл)-2гідрокси-4-метил-2-трифторметилпентиламіно]хінолін-2[1Н]-он Аналогічно до прикладу 1, відповідний імін одержували, використовуючи як вихідну речовину 250 мг 4-(2,3-дигідро-5-фтор-7-бензофураніл)-2гідрокси-4-метил-2-трифторметил-пентаналю й 124 мг 5-амінохінолін-2[1Н]-ону. Після взаємодії із ціаноборогідридом натрію одержували вказану в заголовку сполуку. 1 Н-ЯМР (CD3OD): = 1,38 (s, 3Н), 1,60 (s, 3Н), 2,74-2,88 (m, 1Н), 2,94-3,05 (m, 4H), 3,05-3,17 (m, 1H), 4,50 (t, 2H), 5,83 (d, 1H), 6,52 (d, 1H), 6,62-6,72 (m, 2H), 6,83 (dd, 1H), 7,22 (t, 1H), 7,94 (d, 1H) Приклад 9 6-фтор-5-[4-(5-фтор-2,3-дигідробензофуран-7іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2-метилхінолін Аналогічно до прикладу 1, відповідний імін одержували, використовуючи як вихідну речовину 250 мг 4-(2,3-дигідро-5-фтор-7-бензофураніл)-2гідрокси-4-метил-2-трифторметил-пентаналю й 138 мг 5-аміно-6-фтор-2-метилхіноліну. Після взаємодії із ціаноборогідридом натрію одержували вказану в заголовку сполуку. 1 Н-ЯМР (CD3OD): = 1,36 (s, 3Н), 1,57 (s, 3Н), 2,01 (d, 1Н), 2,72 (s, 3H), 2,74-2,84 (m, 1H), 2,92 (d, 1H), 2,94-3,08 (m, 1H), 3,23 (d, 1H), 3,31 (d, 1H), 4,34-4,53 (m, 2H), 6,62 (d, 1H), 6,75 (dd, 1H), 7,347,49 (m, 3H), 8,19 (d, 1H) Приклад 10 8-фтор-5-[4-(5-фтор-2,3-дигідробензофуран-7іл)-2-гідрокси-4-метил-2-трифторметилпентиламіно]-2-метилхінолін Аналогічно до прикладу 1, відповідний імін одержували, використовуючи як вихідну речовину 45 мг 4-(2,3-дигідро-5-фтор-7-бензофураніл)-2гідрокси-4-метил-2-трифторметил-пентаналю й 25 мг 5-аміно-8-фтор-2-метилхіноліну. Після взаємодії із ціаноборогідридом натрію одержували вказану в заголовку сполуку. 1 Н-ЯМР (CD3OD): = 1,38 (s, 3Н), 1,62 (s, 3Н), 2,01 (d, 1Н), 2,53 (dt, 1H), 2,73 (s, 3H), 2,84-3,22 (m, 4H), 4,44 (dt, 2H), 5,90 (dd, 1H), 6,66 (dd, 1H), 6,82 (dd, 1H), 7,14 (dd, 1H), 7,40 (d, 1H), 8,21 (dd, 1Н). Приклад 11 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл)-2гідрокси-4-метил-2-трифторметил-пентиламіно]-2метилізохінол-1(2Н)-он Аналогічно до прикладу 1, 4-(2,3-дигідро-5фтор-7-бензофураніл)-2-гідрокси-4-метил-2трифторметил-пентаналь перетворювали з 5аміно-2-метилізохінол-1(2Н)-оном у відповідний 91348 28 імін. Після взаємодії з борогідридом натрію одержували вказану в заголовку сполуку. 1 Н-ЯМР (CDCl3): = 1,40 (s, 3Н), 1,55 (s, 3Н), 2,25 (d, 1Н), 2,65 (d, 1H), 2,95-3,30 (m, 4H), 3,60 (s, 3H), 4,00 (br., 1H), 4,50 (q, 1H), 4,55 (q, 1H), 6,25 (d, 1H), 6,30 (d, 1H), 6,80 (dm, 1H), 6,90 (dm, 1H), 7,05 (d, 1H), 7,25 (t, 1H), 7,85 (d, 1H). Розділення на енантіомери здійснювали на хіральній колонці (Chiralpak AD-H 5 , елюанти гексан/етанол). Кути обертання для енантіомерів становили: [ ]D = +31,5 ± 0,2 (с = 1 метанол) і [ ]D = -32,4 ±0,1 (с = 0,99 метанол) Приклад 12 5-[4-(5-фтор-2,3-дигідробензофуран-7-іл]-2гідрокси-4-метил-2-трифторметил-пентиламіно]-2метилхінолін а) Етиловий ефір 2-гідрокси-4-метил-2трифторметил-пент-4-енової кислоти 3,2 г хлориду заліза (III) суспендували в 1000 мл дихлорметану й охолоджували до -10°С. Додавали 100 г трифторетилпірувату, і суміш перемішували протягом однієї години. Близько 140 г ізобутену конденсували приблизно до -50°С, у той час як піддавали охолодженню, і суміш перемішували протягом п'яти годин при температурі від 40°С до -50°С, і продовжували перемішувати протягом ночі. Після здійснення звичайної водної обробки, водні фази об'єднували й промивали дихлорметаном, органічні фази об'єднували, змішували з активованим вугіллям, перемішували протягом 30 хвилин, фільтрували й концентрували шляхом упарювання. Для додаткового очищення, продукт ресуспендували в суміші циклогексану (100 мл)/метанолу (120 мл), і фази розділяли. Метанольну фазу, яка містить продукт, концентрували шляхом упарювання. Вихід: 118,0 г = 89% теорії 1 Н-ЯМР (600 МГц, CDCl3): = 1,35 (t, 3Н), 1,79 (s, 3Н), 2,59 (d, 1Н), 2,76 (d, 1H), 3,87 (s, 1H), 4,325 (dq, 1H), 4,365 (dq, 1H), 4,82 (s, 1H), 4,92 (s, 1H). Розділення енантіомерів: 200 мг складного ефіру, який одержували в 12а), розчиняли в 2 мл гексану й розділяли на 5 см установці Prochrom (Chiralpak AD) при протитиску 2 бар; елюант: гексан/0,1% трифтороцтова кислота. Одержували дві фракції. Енантіомер І (елюювався першим при використанні вказаних методів ВЕРХ; Chiralpak AS2500,46 мм: 7,58 хвилини/Chiralpak AD-H-5 : 6,8 хвилини): [ ]D = -6,1° ± 0,2° (с = 0,944; CHCl3) Енантіомер II (елюювався при використанні вказаних методів ВЕРХ у вигляді другої сполуки; Chiralpak AS250-4,6 : 9,17 хвилини/Chiralpak ADH-5 : 8,2 хвилини): [ ]D = + 5,9° ± 0,5° (с = 1,072; СНСl3) б) Етиловий ефір 4-(5-фтор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2трифторметил-валеріанової кислоти Вносили 18,32 г 5-фтор-2,3дигідробензофурану й охолоджували до 0°С. При інтенсивному перемішуванні однією порцією додавали 11,77 г хлориду алюмінію (III). Температуру підтримували й тепер повільно по краплях додавали 10,00 г сполуки, отриманої в прикладі 12а). 29 91348 Партії дозволяли повернутися до кімнатної температури, і продовжували перемішувати приблизно протягом 7 годин. Додавали по 50 мл етилацетату й води й перемішували протягом 15 хвилин. Після додавання 5 мл концентрованої соляної кислоти, фази розділяли, і органічну фазу абсорбційно осаджували з розчином бікарбонату натрію. Органічну фазу промивали водою й насиченим розчином хлориду натрію й концентрували шляхом упарювання. Після перегонки опуклої трубки при 85°С/1 мбар і наступної кристалізації неочищеного продукту (дно) з етанолу (100 моль)/води (80 мл), одержували 13,1 г = 81% від теорії продукту реакції. Додатково, відновлювали 8,51 г 5-фтор-2,3 Комп’ютерна верстка В. Мацело 30 дигідробензофурану (дистилят) у вигляді безбарвної рідини. Точка плавлення: 72,4°С 1 Н-ЯМР (600 МГц, CDCl3): = 1,21 (t, 3Н), 1,35 (s, 3Н), 1,40 (s, 3Н), 2,43 (d, 1Н), 2,745 (d, 1Н), 3,15 (m, 2H), 3,56 (sbr, 1H), 3,73 (dq, 1H), 4,125 (dq, 1H), 4,58 (t, 2H), 6,68 (dd, 1H), 6,77 (dm, 1H). Складний ефір, який одержували таким чином, потім додатково можна піддавати реакції як рацемат або ж у вигляді чистого енантіомеру, як описано, наприклад, в WO 03/082827, для одержання сполук загальних формул IIа і IIb. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською5-substituted quinoline and isoquinoline derivatives, a method for the production thereof and their use as antiphlogistics
Автори англійськоюJaroch Stefan, Schmees Norbert, Schaecke Heike, Rehwinkel Hartnut, Skuballa Werner, Schneider Matthias, Huebner Jan, Petrov Orlin, Dinter Christian
Назва патенту російськоюПроизводные хинолина и изохинолина, замещенные в 5-положении, способ их получения и их применение как противовоспалительных средств
Автори російськоюЯрох Штефан, Ревинкель Хартмут, Шеке Хайке, Шмеес Норберт, Скубалла Вернер, Шнайдер Маттиас, Хюбнер Ян, Петров Орлин, Динтер Кристиан
МПК / Мітки
МПК: A61P 29/00, A61K 31/47, C07C 69/68, C07D 307/83, C07D 307/79, C07D 405/12
Мітки: ізохіноліну, застосування, спосіб, 5-положенні, протизапальних, похідні, засобів, одержання, хіноліну, заміщені
Код посилання
<a href="https://ua.patents.su/15-91348-pokhidni-khinolinu-jj-izokhinolinu-zamishheni-v-5-polozhenni-sposib-kh-oderzhannya-i-kh-zastosuvannya-yak-protizapalnikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Похідні хіноліну й ізохіноліну, заміщені в 5-положенні, спосіб їх одержання і їх застосування як протизапальних засобів</a>
Попередній патент: Система стільникового зв’язку та її вузли
Наступний патент: Похідні 13-бензолсульфонілгідразонантрацикліну і спосіб одержання 13-деоксіантрациклінів (варіанти)
Випадковий патент: Полива для керамічних виробів












