Відтворений сурфактант, що містить аналоги білків природних сурфактантів sp-b та sp-c
Номер патенту: 103526
Опубліковано: 25.10.2013
Автори: Бокі Моніка, Піветті Фаусто, Соліані Раскіні Аннамарія
Формула / Реферат
1. Відтворений сурфактант, що містить:
а) 1,2-1,8 % ваги аналога поліпептиду білка природного сурфактанта SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ. ID NO:1);
б) 0,1-0,5 % ваги аналога поліпептиду білка природного сурфактанта SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ. ID NO:2);
в) мононенасичений та насичений фосфоліпід з вагою у діапазоні 45:55-55:45, де вказаний мононенасичений фосфоліпід вибраний з групи, що складеться з пальмітоїлолеїлфосфатидилхоліну (РОРС) та пальмітоїлолеїлфосфатидилгліцерину (POPG), та де вказаний насичений фосфоліпід вибраний з групи, що складається з дипальмітоїлфосфатидилхоліну (DPPC) та дипальмітоїлфосфатидилгліцерину (DPPG);
усі кількості обчислені відносно загальної ваги відтвореного сурфактанту.
2. Відтворений сурфактант за п. 1, що містить:
а) приблизно 1,5 % ваги аналога поліпептиду білка природного сурфактанта SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ. ID NO:1);
б) приблизно 0,2 % ваги аналога поліпептиду білка природного сурфактанта SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ. ID NO:2);
в) 1,2-дипальмітоїл-sn-гліцеро-3-фосфохолін (DРРС) та 1-пальмітоїл-2-олеїл-sn-гліцеро-3-фосфогліцерин (РОРG) у ваговому співвідношенні приблизно 50:50;
усі кількості обчислені відносно загальної ваги відтвореного сурфактанту.
3. Відтворений сурфактант за п. 2, що містить:
а) приблизно 1,5 % ваги аналога поліпептиду білка природного сурфактанта SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ ID:NO.1);
б) приблизно 0,2 % ваги аналога поліпептиду білка природного сурфактанта SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ ID:NO.2);
в) приблизно 49,15 % ваги 1,2-дипальмітоїл-sn-гліцеро-3-фосфохоліну (DРРС); та
г) приблизно 49,15 % ваги 1-пальмітоїл-2-олеїл-sn-гліцеро-3-фосфогліцерину (POPG);
усі кількості обчислені відносно загальної ваги відтвореного сурфактанту.
4. Відтворений сурфактант за будь-яким з пп. 1-3, де поліпептид SEQ ID:NO.2 знаходиться у формі дисульфідзв'язаної молекули з внутрішньомолекулярним дисульфідним зв'язком між двома цистеїновими залишками у 1 та 33 позиціях та/або між двома цистеїновими залишками у 4 та 27 позиціях.
5. Відтворений сурфактант за будь-яким з попередніх пунктів, де POPG знаходиться у вигляді фармацевтично прийнятної солі.
6. Відтворений сурфактант за п. 5, де сіль є сіллю натрію.
7. Відтворений сурфактант за будь-яким з попередніх пунктів, де кожен з вказаних поліпептидів наведений у вигляді фармацевтично прийнятної солі.
8. Відтворений сурфактант за п. 7, де сіль є ацетатною сіллю.
9. Фармацевтичний препарат, що містить відтворений сурфактант за будь-яким з пп. 1-8, де вказаний препарат знаходиться у вигляді розчину, дисперсії, суспензії, або сухого порошку, вибірково у комбінації з одним, або декількома фармацевтично прийнятними носіями.
10. Фармацевтичний препарат за п. 9, де вказаний препарат знаходиться у вигляді водної суспензії.
11. Фармацевтичний препарат за п. 10, де відтворений сурфактант знаходиться у концентрації, що дорівнює 0,1-160 мг/мл водної суспензії.
12. Набір, що містить:
a) відтворений сурфактант за будь-яким з пп. 1-8 у вигляді порошку у першій лікарській формі з одноразовим дозуванням;
b) фармацевтично прийнятний носій у другій лікарській формі з одноразовим дозуванням; та
c) контейнер, призначений для розміщення вказаної першої та другої форм дозування.
13. Відтворений сурфактант за будь-яким з пп. 1-8, для застосування як ліки.
14. Відтворений сурфактант за будь-яким з пп. 1-8 для застосування для лікування або профілактики респіраторного дистрес-синдрому (RDS) у недоношених немовлят або для лікування або профілактики інших захворювань, пов'язаних з нестачею або дисфункцією сурфактанту.
15. Відтворений сурфактант за п. 14, де захворювання включають RDS у дорослих (ARDS), синдром аспірації меконію (MAS), та бронхолегеневу дисплазію (BPD).
Текст
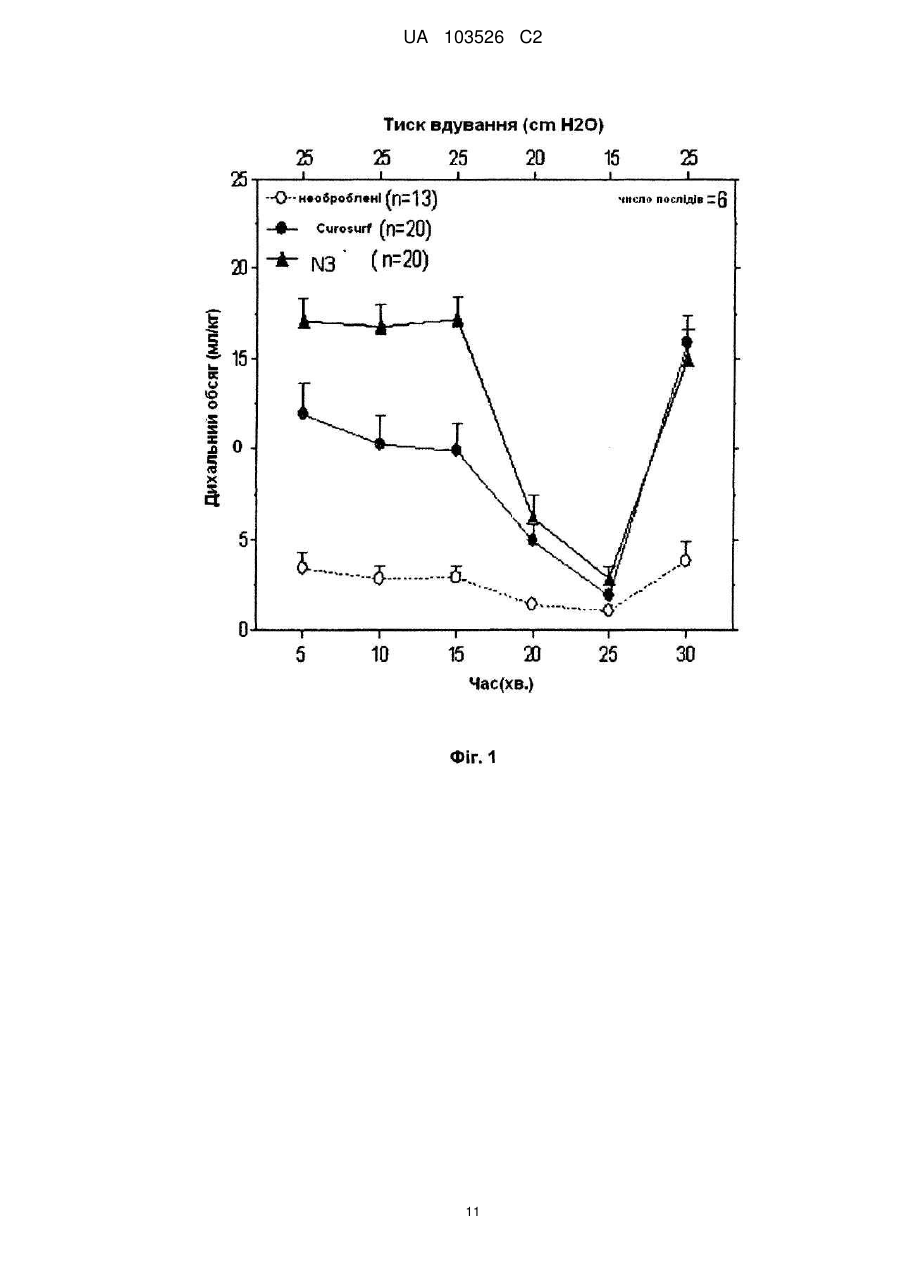
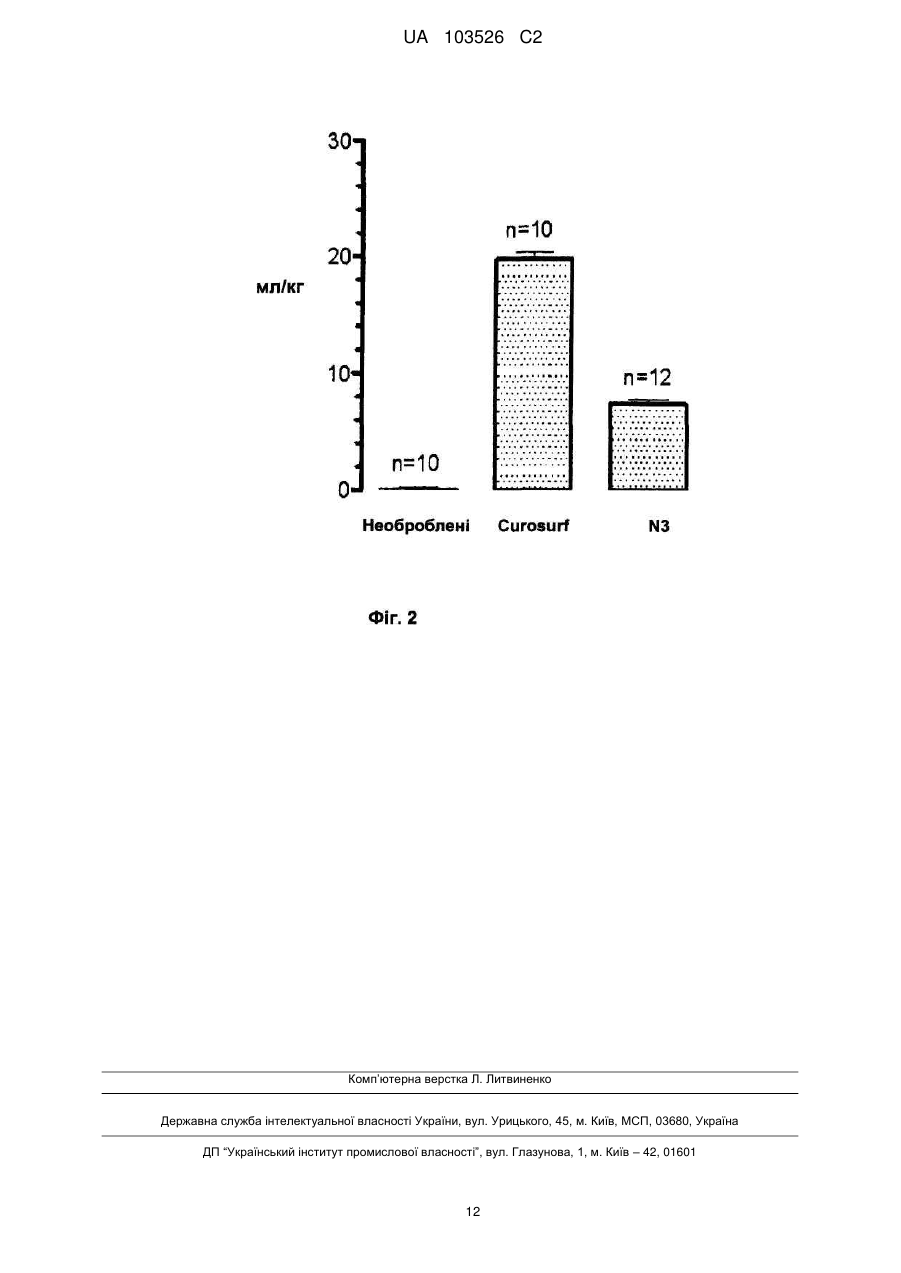
Реферат: Винахід стосується відтвореного сурфактанту, що містить аналоги поліпептидів білків природних сурфактантів SP-C та SP-B, мононенасичений та насичений фосфоліпід. UA 103526 C2 (12) UA 103526 C2 UA 103526 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується відтворених легеневих поверхнево-активних речовин (сурфактантів), прийнятних для профілактики та/або лікування респіраторного дистрессиндрому (RDS) та інших дихальних розладів. Легені людини складаються з великої кількості маленьких повітряних мішечків, званих альвеолами, у яких проходить газовий обмін між кров'ю та повітряними проміжками легенів. У здорових осіб, цей обмін опосередкований присутністю поверхнево-активного комплексу, що містить білки, які оберігають легені від колапсу у кінці видихання. Легеневий поверхнево-активний комплекс складається в першу чергу з ліпіду та містить незначні кількості різних білків. Відсутність адекватних рівнів цього комплексу веде до несправної роботи легенів. Цей синдром має назву респіраторного дистрес-синдрому (RDS) та звичайно уражає недоношених дітей. Вказаний синдром ефективно лікують за допомогою наявних у продажу модифікованих природних поверхнево-активних речовин, екстрагованих з тваринних легенів, як-то "препарат золотого стандарту", відомий як Curosurf®. Головними складовими цих препаратів поверхнево-активних речовин є фосфоліпіди та поверхнево-активні гідрофобні білки B та C (SP-B та SP-C). Через недоліки поверхнево-активних препаратів, отриманих з тваринних тканин, як-то ускладнення процесу виробництва, можливе вірусне забруднення та/або спричинення імунних реакцій, були отримані синтетичні поверхнево-активні речовини. Вказані синтетичні поверхнево-активні речовини можуть бути простими сумішами синтетичних складових, в першу чергу фосфоліпідів та інших ліпідів, що відомі, як “штучні” поверхнево-активні речовини; та, хоча їх вже багато років застосовують у клінічній практиці, їх ефективність не в змозі зрівнятися з ефективністю модифікованих природних поверхневоактивних речовин. Штучні поверхнево-активні речовини, що також містять поверхнево-активні білки/пептиди зараз знаходяться на стадії розробки. Вони називаються або “відтвореними” поверхневоактивними речовинами або “біо-міметичними“ поверхнево-активними речовинами. Проте, відповідно з наявною літературою, жодна з відтворених поверхнево-активних речовин, розроблених до цього часу, не була ефективною відносно податливості легенів, порівняно з подібною, вибраною з поверхнево-активних речовин, екстрагованих від тварин. Більш того, вони породжують слабкі обсяги легеневого газу та ступінь альвеолярної прохідності наприкінці видихання, та потребують вентиляції з позитивним тиском в кінці видиху (PEEP) для досягнення активності in vivo, порівняної з подібною активністю, досягненою від модифікованих природних поверхнево-активних речовин (Johansson J et al. J Appl Physiol 2003, 95, 2055-2063; Davis AJ et al. Am J Respir Crit Care Med 1998; 157, 553-559). Можливим поясненням є те, що відтворені поверхнево-активні речовини на стадії розвитку не породжують повний білковій профіль модифікованих природних поверхнево-активних речовин, оскільки вони містять тільки один білковий (пептидний) компонент. З іншого боку, крім доброї ефективності, поверхнево-активні композиції повинні також проявляти низьку в'язкість для отримання концентрованій суспензії у водному середовищі. Можливість отримання концентрованої суспензії у малому обсязі є, безумовно, рисою особливого значення для її введення новонародженим з дуже малою вагою. Система пептид/фосфоліпід є досить складною сумішшю, властивості якої значно залежать від складу фосфоліпідної суміші, а також від специфічної фосфоліпід-пептидної комбінації. Присутність додаткового пептиду буде впливати на реологічні властивості композиції, що робить систему навіть більш ускладненою. В попередніх дослідженнях, відтворені поверхнево-активні речовини, що містять аналоги обидвох SP-B та SP-C, подібні до поверхнево-активних білків людини, наведені, наприклад, у WO0076535, WO2008011559 та WO2008044109. Проте, жодна з наведених тут композицій не має оптимальних властивостей відносно податливості легенів, а також реологічних властивостей, зокрема в'язкості. Таким чином, існує необхідність у відтворених поверхнево-активних речовинах, що мають ефективність, порівняну з ефективністю поверхнево-активних речовин, екстрагованих з легенів тварин, а також оптимальні реологічні властивості, що дозволяють їх легку доставку та розподілення у бронхо-альвеолярній частині легенів після введення. Заявлений винахід вирішує цю проблему отриманням відтвореної поверхнево-активної композиції з поліпшеними властивостями відносно податливості легенів та в'язкості. Заявлений винахід стосується відтвореної поверхнево-активної речовини, що містить: a) 1.2-1.8 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-C, що складається з послідовності, яка представлена формулою 1 UA 103526 C2 5 10 15 20 25 30 35 40 45 50 55 60 IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ ID NO:1); б) 0.1-0.5 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-B що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ ID NO:2); мононенасичений та насичений фосфоліпід з вагою у діапазоні 45: 55-55:45; Всі значення обчислені відносно загальної ваги відтвореної поверхнево-активної речовини. Заявлений винахід також стосується фармацевтичних композицій, що містять заявлену відтворену поверхнево-активну речовину окремо, або у комбінації з одним, або декількома фармацевтично прийнятними носіями. Заявлений винахід також стосується застосування заявленої відтвореної поверхневоактивної речовини у якості ліків. У подальшому аспекті, винахід стосується застосування заявленої відтвореної поверхневоактивної речовини для профілактики та/або лікування респіраторного дистрес-синдрому (RDS) та інших дихальних розладів. Крім того, винахід стосується застосування заявленої відтвореної поверхнево-активної речовини для виробництва ліків для профілактики та/або лікування респіраторного дистрессиндрому (RDS) та інших дихальних розладів. Винахід також надає спосіб профілактики та/або лікування респіраторного дистрессиндрому (RDS) та інших дихальних розладів, де вказаний спосіб полягає у введенні пацієнту у разі потреби такого лікування терапевтично ефективної кількості відтвореної вищевказаної поверхнево-активної речовини. У подальшому втіленні, винахід надає спосіб, що полягає у введенні розбавленої відтвореної поверхнево-активної речовини винаходу у легені способом промивання (лаважу) для видалення шкідливого матеріалу та/або запального ексудату, для розширення легенів та поліпшення їх функції. Нарешті, винахід також стосується набору, що містить: a) вищезгадану відтворену поверхнево-активну речовину у вигляді порошку у першій лікарській формі з одноразовим дозуванням; b) фармацевтично прийнятний носій у другій лікарській формі з одноразовим дозуванням; та c) контейнерний засіб для розміщення вказаної першої та другої форм дозування. “Активність сурфактанту” для препарату поверхнево-активної речовини визначається, як здатність знижувати поверхневий натяг. Ефективність in vitro екзогенних поверхнево-активних препаратів звичайно перевіряють шляхом вимірювання їх здатності понижувати поверхневий натяг з застосуванням прийнятних пристроїв, як-то спосіб урівноваження Вільгельмі та сурфактометр з системою захоплення бульбашок. Ефективність in vitro екзогенних поверхнево-активних препаратів звичайно перевіряють шляхом вимірювання двох параметрів: i) дихального обсягу, який є індексом податливості легенів, та ii) обсягу легеневого газу, який є індексом поширення альвеолярного повітря, або прохідності в кінці видихання, отже, здатності утворювати стійку фосфоліпідну плівку у альвеолах в кінці видихання. Термін “терапевтично ефективна” кількість, як тут застосовано, має відношення до кількості відтвореної поверхнево-активної речовини, здатної до запобігання, уникнення, зниження або усунення дихального захворювання або розладів, пов'язаних з втратою або дисфункцією ендогенних поверхнево-активних речовин. Термін “фармацевтично прийнятний”, або “фізіологічно задовільний” має відношення до композицій, середовищ, розчинників, солей, які можуть бути введені людині без утворення небажаних фізіологічних дій. Термін “поліпептидний аналог нативного поверхнево-активного білка SP-C” означає поліпептид, що має амінокислотну послідовність, у якої, порівняно з нативним SP-C білком, є втрачені амінокислоти та/або є амінокислотні заміщення, доки поліпептид, у суміші з фосфоліпідами, проявляє легеневу поверхнево-активну активність (як показано за допомогою аналізів дослідження ефективності in vitro та in vivo). Термін “поліпептидний аналог нативного поверхнево-активного білка SP-B”, означає поліпептид, що має амінокислотну послідовність, у якої, порівняно з нативним SP-B білком, є втрачені амінокислоти та/або є амінокислотні заміщення, доки поліпептид, у суміші з фосфоліпідами, проявляє легеневу поверхнево-активну активність (як показано за допомогою аналізів дослідження ефективності in vitro та in vivo). “Рекомбінант” при застосуванні з посиланням, наприклад, на клітину, або на нуклеїнову кислоту, білок, або вектор, вказує на те, що клітина, нуклеїнова кислота, білок або вектор, були 2 UA 103526 C2 5 10 15 20 25 30 35 40 45 50 55 60 змінені введенням гетерологічної нуклеїнової кислоти, або білка, або зміненням нативної нуклеїнової кислоти або білка. Як тут застосовано, термін “близько”, застосований до значення, вказує на похибку у ± 1 %. Фосфоліпіди є ліпідами, у яких одна жирна кислота заміщена фосфатною групою та простою органічною молекулою. Найбільш поширеним класом фосфоліпідів, якій може бути знайдено у поверхнево-активних препаратах є фосфатидилхоліни (PC), фосфатидилетаноламін (PE) фосфатидилгліцерин (PG), фосфатидилінозитол (PI), та фосфатидилсерин (PS). Гліцеринові групи фосфоліпідів звичайно етерифіковані з довголанцюговими жирними кислотами, які, в свою чергу, можуть бути насиченими (наприклад, міристинова, пальмітинова та стеаринова кислота), мононенасиченими (наприклад, олеїнова кислота), або поліненасиченими (наприклад, лінолева та арахідонова кислота). Зокрема, у заяві розглядаються види фосфоліпідів, як-то: -1,2-дипальмітойл-sn-гліцеро-3-фосфохолін, також відомий, як дипальмітойлфосфатидилхолін (DPPC), який є насиченою похідною, та 1-пальмітойл-2-олеїл-sn-гліцеро-3фосфогліцерин, також відомий, як пальмітойл-олеїл-фосфатидилгліцерин (POPG), який є мононенасиченою похідною. Поняття “поліпептид”, “пептид” та “білок” застосовано тут взаємозамінно та мають відношення до полімерів амінокислотних залишків. Амінокислотні послідовності наведені у відповідності з однолітерним кодом стосовно амінокислот, які мають вільну аміногрупу на лівому кінці (N-кінець), та амінокислот, які мають вільну карбоксильну групу на правому кінці (С-кінець). Всі ідентифіковані тут амінокислотні залишки знаходяться у природній L-конфігурації та ідентифіковані тут послідовності викладені згідно зі стандартними абревіатурами для амінокислотних залишків. Для уникнення сумнівів, амінокислотні похідні L-норлейцину тут мають назву nLeu, та L-орнітин скорочено до Orn. Стислий опис фігур. Фіг. 1 показує результати відносно дихальних обсягів (мл/кг) як функцію часу до тиску ® відтвореної поверхнево-активної речовини винаходу (N3) порівняно з Curosurf та необробленими тваринами (n = число тварин). Фіг. 2 показує результати відносно обсягів легеневого газу (мл/кг) відтвореної поверхнево® активної речовини (N3) порівняно з Curosurf та необробленими тваринами (n = число тварин). Багатофакторний план експерименту побудований для того, щоб дослідити, як в'язкість залежить від відносної кількості фосфоліпідів та аналогів SP-B та SP-C у композиціях поверхнево-активних речовин, в загальних рисах наведених у WO 2008044109, а також, як вказані компоненти впливають один на одного у відтвореній поверхнево-активній речовині. Було встановлено, що кількість аналога SP-B істотно впливає на в'язкість композиції поверхнево-активної речовини, отже кількість аналога SP-B слід бути підтримувати як можна нижчою, сумісно з терапевтичною ефективністю, з метою зменшення в'язкості відновленої поверхнево-активної речовини до прийнятних низьких рівнів. WO 2008044109 спрямована на застосування співвідношень DPPC:POPG, що, переважним чином, дорівнюють, або вище, ніж 7:3, у присутності аналога SP-B. WO 2008044109 нічого не повідомляє про в'язкість таких композицій поверхнево-активних речовин. В даний час було винайдено, що, коли кількість аналога SP-B у поверхнево-активній речовині є мінімізованою, то високі співвідношення між динасиченими фосфоліпідами, як-то DPPC та ненасиченими фосфоліпідами, як-то POPG веде до неприйнятно високої в'язкості відповідної композиції. Проте, ми подолали цю проблему шляхом приготування низькорівневих поверхнево-активних речовин SP-B, у яких співвідношення ненасиченого фосфоліпіду до насиченого фосфоліпіду знижується нижче попередньо наведених співвідношень, переважним чином до рівня близько 1:1, та показано, що ці композиції поверхнево-активної речовини мають неочікувану низьку в'язкість, що робить їх корисними для всіх клінічних застосувань. У одному втіленні, заявлений винахід стосується відтвореної поверхнево-активної речовини, що містить: a) 1.2-1.8 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ ID NO:1); б) 0.1-0.5 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ ID NO:2); мононенасичений та насичений фосфоліпід з вагою у діапазоні 45: 55-55:45; Всі значення обчислені відносно загальної ваги відтвореної поверхнево-активної речовини. 3 UA 103526 C2 5 10 15 20 25 30 35 40 45 50 55 60 У відтворенні поверхнево-активної речовини винаходу компонент аналога білка SP-C переважним чином становить біля 1.4-1.6 %, та більш переважним чином близько 1.5 % ваги від загальної ваги відтвореної поверхнево-активної речовини. У відтвореній поверхнево-активній речовині винаходу компонент аналога білка SP-B переважним чином становить біля 0.2-0.4 %, більш переважним чином близько 0.2 % ваги від загальної ваги відтвореної поверхнево-активної речовини. Відтворена поверхнево-активна речовина винаходу може переважним чином містити насичені фосфоліпіди, як-то дипальмітойлфосфатидилхолін (DPPC) та дипальмітойлфосфатидилгліцерин (DPPG) та мононенасичені фосфоліпіди, як-то пальмітойлолеофосфатидилхолін (POPC), пальмітойлолеойлфосфатидилгліцерин (POPG). Бажаним насиченим фосфоліпідом для застосування відповідно до винаходу є DPPC, у той час, як бажаним мононенасиченим фосфоліпідом є POPG. Переважним чином, загальна вага фосфоліпідів становить щонайменш 90 %, переважним чином щонайменш 95 %, переважним чином щонайменш 97.7 %, більш переважним чином 98.3 % загальної ваги відтвореної поверхнево-активної речовини. У одному втіленні, заявлений винахід стосується відтвореної поверхнево-активної речовини, що містить: a) близько 1.5 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ ID NO:1); б) близько 0.2 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ ID NO:2); в) 1,2-дипальмітойл-sn-гліцеро-3-фосфохолін (DPPC) та 1-пальмітойл-2-олеіл-sn-гліцеро-3фосфогліцерин (POPG) у ваговому співвідношенні близько 50:50; Всі значення обчислені відносно загальної ваги відтвореної поверхнево-активної речовини. У одному специфічному втіленні заявлений винахід стосується композиції відтвореної поверхнево-активної речовини, що містить: a) близько 1.5 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ ID:NO.1); б) близько 0.2 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ.ID:NO. 2); в) близько 49.15 % ваги 1,2-дипальмітойл-sn-гліцеро-3-фосфохоліну (DPPC); та г) близько 49.15 % ваги 1-пальмітойл-2-олеіл-sn-гліцеро-3-фосфогліцерину (POPG); Всі значення обчислені відносно загальної ваги відтвореної поверхнево-активної речовини. У бажаному втіленні, поліпептид SEQ ID:NO.2 може бути у вигляді дисульфідно-пов'язаної молекули, де внутрішньомолекулярні дисульфідні зв'язки знаходяться між двома цистеїновими залишками у 1 та 33 позиціях та/або між двома цистеїновими залишками у 4 та 27 позиціях. Поліпептид SEQ ID:NO.1 був позначений у WO 2008044109 (включено тут у своєї повноті у якості посилання) як SP-C33(Leu), у той час, як поліпептид SEQ ID:2 був позначений у WO 2008044109 як Mini-B(Leu), та його дисульфідно-пов'язана форма, як oxMini-B(Leu). У більш бажаному втіленні, відтворена поверхнево-активна речовина винаходу складається в основному з компонентів a), b), c) та вибірково d) у заявленій кількості. Переважним чином, обидва поліпептиди можуть бути присутніми у вигляді фармацевтичноприйнятних солей. Вказані солі охоплюють, наприклад, солі соляної, оцтової, та трифлуорооцтової кислоти. Переважним чином, обидва поліпептиди присутні у композиції у вигляді ацетатів. Також, POPG може, переважним чином, бути присутнім у вигляді фармацевтичноприйнятної солі, наприклад, у вигляді натрієвої солі (POPG Na). Поліпептиди SEQ ID:NO.1 та SEQ ID:NO.2 можуть бути отримані синтетичними способами, або за допомогою відомих фахівцям рекомбінантних способів. Відмінний огляд багатьох прийнятних способів наведений у J.M. Steward and J.D. Young, "Solid Phase Peptide Synthesis", W.H. Freeman Co., San Francisco, 1969, and J. Meienhofer, "Hormonal Proteins and Peptides", Vol.2, p. 46, Academic Press (New York), 1983; для твердофазного білкового синтезу, та E. Schroder and K. Kubke, "The Peptides", Vol. 1, Academic Press (New York), 1965; для класичного рідкофазного синтезу. Поліпептиди можуть, переважним чином, бути отримані з застосуванням способу твердофазного синтезу, що був спочатку описаний Merrifield, у J. Am. Chem. Soc. 85: 2149-2154 4 UA 103526 C2 5 10 15 20 25 30 35 40 45 50 55 (1963). Інші способи синтезу поліпептидів можна знайти, наприклад, у M. Bodanszky et al., Peptide Synthesis, John Wiley & Sons, 2d Ed.,(1976), а також у інших довідкових виданнях, відомих фахівцям. Відповідні захисні групи для застосування у такому синтезі можна знайти у вищезгаданих текстах, а також у J.F.W. McOmie, Protective Groups in Органічн Chemistry, Plenum Press, New York, NY (1973). Наприклад, обидва поліпептиди можуть бути отримані, як описано у WO2008044109. Ефективні дози відтвореної поверхнево-активної речовини винаходу для лікування захворювання, як-то RDS, як тут описано, змінюються у залежності від багатьох різних факторів, включаючи тип захворювання, шлях введення, вагу, фізіологічний стан пацієнта, та спрямованість лікування (профілактичне або терапевтичне). Загальним чином, доза містить 0.01 мг - 10 г/кг маси тіла, переважним чином 0.1-1 г/кг маси тіла, та частота введення може змінюватися у залежності від спрямованості лікування (профілактичне або терапевтичне). Звичайно, дозу близько 50 мг/кг, 100 мг/кг, або 200 мг/кг вводять одноразово. Для застосування у новонароджених, звичайно достатньо одного, або двох введень. Хоча потреби можуть змінюватися, у залежності від тяжкості дихального захворювання та/або інших змінних, визначення оптимальних діапазонів ефективних дозувань знаходиться в межах досвіду фахівців. Заявлений винахід також охоплює фармацевтичні препарати, що містять відтворену поверхнево-активну речовину винаходу. Вказані препарати переважним чином вводять у вигляді розчину, дисперсії, суспензії, або сухого порошку. Переважним чином, вказані композиції містять відтворені поверхнево-активні речовини, розчинені або суспендовані у прийнятному фізіологічно задовільному розчиннику або ресуспензійному носії, як-то у воді або у фізіологічному сольовому водному розчині (0.9 % мас./обс.NaCl). Препарати заявленого винаходу можуть містити водні розчини, переважним чином стерильні, що також можуть містити pH буферизуючі агенти, розріджувачі та інші прийнятні добавки. Препарати можуть бути представлені у однодозових, або у мультидозових контейнерах, наприклад, у запаяних ампулах та флаконах, або можуть зберігатися у замороженому, або ліофілізованому стані, що вимагає тільки додавання стерильного рідкого носія безпосередньо перед застосуванням. Переважним чином, відтворена поверхнево-активна речовина винаходу поставляється у вигляді стерильної суспензії у буферизованому фізіологічному сольовому водному розчині у одноразових скляних флаконах. Фармацевтичні препарати можуть бути отримані згідно з загальноприйнятними способами, добре відомими у фармацевтичній промисловості. Такі способи містять стадію змішування поліпептидів та фосфоліпідів у присутності органічного розчинника. Потім розчинник видаляють за допомогою діалізу, або випаровуванням в атмосфері азоту та/або дією вакууму, або іншими відповідними способами, добре відомими фахівцям, як-то ліофілізацією. Переважним чином, кількість залишкових розчинників може бути менше, ніж 0.1 %, переважним чином менше, ніж 0.05 %, більш переважним чином менше, ніж 0.003 %, ще більш переважно, менше, ніж 0.001 % ваги. Отриманий порошок потім рівномірно та безпосередньо асоціюють з рідкими носіями, або тонкоподрібненими твердими носіями, або з обома типами носіїв. Суміш поліпептидів та фосфоліпідів може бути стерилізованою перед видаленням розчинника, наприклад, стерильною фільтрацією. У деяких інших втіленнях, композиції відтвореної поверхнево-активної речовини стерилізують на кінцевій стадії згідно з відомими у цій галузі способами. Застосування відтвореної поверхнево-активної речовини винаходу здійснюється відомим для фахівців шляхом, наприклад, внутрішньо-трахеальної інстиляцією (вливанням, або болюсом, або через катетер), застосуванням спрею, або небулайзеру. Як описано тут, винахід передбачає застосування концентрованого та розбавленого поверхнево-активного препаратів, в залежності від конкретного застосування, як зазначено в цьому документі. Концентровані поверхнево-активні композиції звичайно застосовують для “болюсного” типу застосувань, тоді, як розбавлені поверхнево-активні композиції звичайно застосовують для “лаважного” типу застосувань. 5 UA 103526 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважним чином, в'язкість вказаних препаратів дорівнює менше, ніж 20 мПа·с, переважним чином, менше, ніж 15 мПа·с після визначення за допомогою звичайного віскозиметра, наявного у продажу, з застосуванням добре відомих способів. Переважним чином, для “болюсного” типу введення, концентрація відтвореної поверхневоактивної речовини відносно співвідношення ваги на мл розчину або суспензії (після додавання рідкого носія) знаходиться у діапазоні близько 0.1-100 мг/мл, переважним чином, 5-80 мг/мл. У бажаному втіленні винаходу, коли відтворену поверхнево-активну речовину вводять шляхом інстиляції у трахею у вигляді суспензії у фізіологічному сольовому розчині (0.9 % мас./обс. хлориду натрію у воді), концентрація дорівнює близько 80 мг/мл. Отже, бажане втілення винаходу стосується фармацевтичного препарату у вигляді водної суспензії у фізіологічному сольовому розчині, що містить близько 80 мг/мл відтвореної поверхнево-активної речовини, що містить a) близько 1.5 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ ID:NO.1); б) близько 0.2 % ваги поліпептидного аналога нативного поверхнево-активного білка SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ ID:NO.2); в) близько 49.15 % ваги 1,2-дипальмітойл-sn-гліцеро-3-фосфохоліну (DPPC); та г) близько 49.15 % ваги 1-пальмітойл-2-олеіл-sn-гліцеро-3-фосфогліцерину (POPG); Всі значення обчислені відносно загальної ваги відтвореної поверхнево-активної речовини. Звичайно, в'язкість вказаного препарату дорівнює близько 9±3 мПа·с при 25 °C та 8±3 мПа·с при 37 °C, як визначено за допомогою звичайного ротаційного віскозиметра, наявного у продажу. При застосуванні для введення шляхом промивання (лаваж), типова концентрація поверхнево-активної речовини дорівнювала близько 0.1-20 мг/мл, більш переважним чином близько 0.5-10 мг/мл (по відношенню до мг поверхнево-активної речовини на мл розчину, або суспензії). Оскільки вона залежить від концентрації, в'язкість розбавлених препаратів може бути навіть нижчою. При застосуванні для фармацевтичного лікування, препарати, що містять відтворену поверхнево-активну речовину заявленого винаходу можуть бути введені або окремо, або, вибірково, у поєднанні з іншими сполуками або композиціями, що застосовують у лікуванні дихальних захворювань або розладів. Наприклад, якщо суб'єкт проходить лікування від дихального розладу, спричиненого бактеріальною інфекцією, то відтворену поверхнево-активну речовину заявленого винаходу можна вводити у поєднанні з іншим з'єднанням, застосованим для лікування бактеріальної інфекції, як-то антибіотиком. Іншим чином, у деяких випадках, наприклад, для запобігання ускладнень, як-то бронхолегеневої дисплазії, відтворену поверхнево-активну речовину заявленого винаходу можна вводити у поєднанні з кортикостероїдами, як-то будесонідом та дипропіонатом беклометазону. У певному втіленні, відтворену поверхнево-активну речовину винаходу та ресуспензійний носій можна запакувати окремо та одночасно у прийнятний контейнерний засіб. Таке окреме пакування компонентів у прийнятний контейнерний засіб також описано у вигляді набору. Отже, цей винахід також стосується набору, що містить: a) відтворену поверхнево-активну речовину винаходу у вигляді порошку у першій лікарській формі з одноразовим дозуванням; б) фармацевтично прийнятний носій у другій лікарській формі з одноразовим дозуванням; та в) контейнер, призначений для розміщення вказаної першої та другої форм дозування. Переважним чином, фармацевтично прийнятний носій є фізіологічним сольовим водним розчином, більш переважним чином він є стерильним. Як описано тут, численні способи введення відтвореної поверхнево-активної речовини та препаратів заявленого винаходу доступні та добре відомі фахівцям. У залежності від типу захворювання, наприклад, дітей, або дорослих з респіраторним дистрес-синдромом, можуть бути доречними різни способи лікування. Звичайно, поверхнево-активну речовину вводять пацієнту (наприклад, недоношеним дітям), що знаходитися під постійною, або періодичною вентиляцією з позитивним тиском (IPPV), шляхом ендотрахеальної інстиляції. Альтернативно, поверхнево-активну речовину можна ввести через тонкий катетер, розміщений у трахеї, з підтримкою дихання пацієнта за допомогою спеціально розроблених 6 UA 103526 C2 5 10 15 20 25 30 назальних пристроїв, як-то масок, канюль або трубок, відповідно до методології, що відома, як постійний позитивний тиск в дихальних шляхах (nCPAP). Останній спосіб може бути здійсненим тільки з поверхнево-активною речовиною, що має низьку в'язкість, тому що висока в'язкість зробить складною проходження поверхнево-активної речовини через тонкий катетер. У випадках, коли пацієнт страждає від дихальної недостатності, пов'язаної з запаленням легенів, легеневою інфекцією або легеневою контузією, можуть бути рекомендовані окремі умови лікування. У одному такому терапевтичному способі, виконується одноразове або багаторазове промивання легенів пацієнта з поверхнево-активною речовиною композиції заявленого винаходу. Відтворена поверхнево-активна речовина винаходу є прийнятною для запобігання, затримки, полегшення, зупинення або інгібування розвитку симптомів або станів, пов'язаних з дихальним захворюванням. Зокрема, вона корисна для профілактики та/або лікування респіраторного дистрес-синдрому (RDS) у недоношених немовлят або інших захворювань, пов'язаних з нестачею поверхневоактивної речовини або дисфункцією, включаючи гостре пошкодження легенів (ALI), RDS у дорослих (ARDS), синдром аспірації меконію (MAS), та бронхолегеневу дисплазію (BPD). Вона також може бути корисною для профілактики та/або лікування інших дихальних розладів, як-то хронічна обструктивна хвороба легень (ХОЗЛ), астма, дихальні інфекції (наприклад, пневмонія, пневмоцистична пневмонія, кістозний фіброз та респіраторний синцитіальний вірус людини), а також для лікування ексудативного отиту. Наступні приклади більш детально ілюструють винахід. ПРИКЛАДИ Приклад 1 - Вплив компонентів на в'язкість. Багатофакторний план експерименту був побудований для оцінки впливу компонентів препарату на в'язкість. Були перевірені різні відсоткові концентрації поліпептидів SP-C33(leu) та ox-Mini-B(leu) а також різні співвідношення DPPC та POPG Nare. Всі отримані суміші ресуспендували у фізіологічному сольовому водному розчині (0.9 % мас./обс.) з концентрацією 80 мг/мл. В'язкість визначали при 25 °C та 37 °C з застосуванням віскозиметру VISCO STAR Plus (Fungilab) з швидкістю обертання 100 об/хв. ® У якості порівняння, Curosurf показав в'язкість у 6-10 мПа·с. (1 мПа·с = 1 сП (сантипуаз)). Результати наведені у Таблиці 1 Таблиця 1 Композиція % PC33(leu) %oxMiniB(leu) DPPC/POPG Na в'язкість 25 °C (мПа·с) в'язкість 37 °C (мПа·с) N1 0,5 % 0,2 % 3 N2 N3 N4 N5 N6 N8 N9 0,5 % 1% 1 1,5 % 0,2 % 1 1,5 % 1% 3 1% 0,5 % 2 1,5 % 0,2 % 3 1,5 % 1% 1 0,5 % 1% 3 54,3 288 9,7 56,8 83,4 554,9 671,2 73,8 29,8 700 7,2 37,1 33,7 119,8 338,1 37,0 35 40 45 Результати вказують на те, що при низьких концентраціях ox-Mini-B(leu) та у присутності низького співвідношення між DPPC та POPG (колонка N3 у Таблиці 1), в'язкість суміші є також дуже низькою. Ці результати показують, що за рахунок мінімізації кількості аналога SP-B у поверхнево-активній речовині та одночасного зниження концентрації насиченого фосфоліпіду по відношенню до ненасиченого фосфоліпіду, можна одержати композицію з достатньо низькою в'язкістю, що робить її прийнятною для всіх застосувань поверхнево-активних речовин, включаючи застосування у концентрованій формі. Приклад 2 - Характеристика відтвореної поверхнево-активної речовини N3. Суміш DPPC:POPG Nа у співвідношенні 1:1, SPC-33(leu) та ox Mini-B(leu) у відсоткових кількостях, наведених для композиції N3 у Таблиці 1 Прикладу 1 розчинили у суміші 98:2 (об./об.) хлороформу та етанолу. Розчинник випарили та отриманий порошок потім гідратували у 0.9 % мас./обс. водному розчині NaCl з перемішуванням, з отриманням поверхнево-активної речовини з концентрацією у 80 мг/мл. 7 UA 103526 C2 Унітарна композиція наведена у Таблиці 2. Таблиця 2 Інгредієнт % 1.5 0.2 49.15 49.15 SP-C33(leu) Ox-Mini-B(leu) DPPC POPG Na 5 10 15 20 25 30 35 Концентрація 1.2 мг/мл 0.16 мг/мл 39.32 мг/мл 39.32 мг/мл В'язкість вказаного препарату, як підтверджено, була дуже низькою, наприклад, близько 9 мПа·с при 25 °C та близько 7 мПа·с при 37 °C. Крім того, вона не змінювалася після 6 місяців зберігання при 5 °C. Препарат був хімічно стабільним після 6 місяців зберігання та загальна кількість фосфоліпідних лізоформ, що була визначена за допомогою ВЕРХ-аналізу (HPLC) дорівнювала менш, ніж 1 % ваги. Приклад 3-in vivo активність відтвореної поверхнево-активної речовини N3. Відтворену поверхнево-активну речовину Прикладу 2 аналізували у недоношених новонароджених кролів, отриманих шляхом гістеректомії при терміні вагітності від 27 днів. Експерименти проводили без застосування позитивного тиску в кінці видиху (PEEP). ® Тварини, що отримали Curosurf були у якості позитивних контролів, та необроблених тварин з того ж посліду застосували у якості негативних контролів. Всі препарати поверхнево-активних речовин вводили з концентрацією у 80 мг/мл та стандартною дозою у 2.5 мл/кг. Недозрілі новонароджені кролі знаходилися під вентиляцією паралельно зі стандартизованою послідовністю пікових вдувань. Для відкриття легенів, спочатку встановили тиск у 35 см H2O протягом 1 хв. Після цього заходу по відкриттю обсягу легенів, тиск знизився до 25 см H2O протягом 15 хв., та далі до 20 та 15 см H2O. Нарешті, тиск знову піднявся до 25 см H2O протягом 5 хв., після чого легені вентилювали додатково 5 хв. з азотом, та потім видалили для вимірювань обсягу газу. Дихальні обсяги та обсяги легеневого газу, відображені у мл/кг, було виміряно, та результати, надані у вигляді середніх значень, наведені у Фіг. 1 та Фіг. 2, відповідно. У Фіг. 1 можна відзначити, що тварини, оброблені відтвореною поверхнево-активною речовиною винаходу показали поліпшення дихальних обсягів, яке було трохи кращим, ніж ® досягнуте після введення Curosurf . Цей результат свідчить про те, що відтворена штучна поверхнево-активна речовина винаходу може забезпечити краще клінічну ефективність, ніж поточний золотий стандарт у цій галузі. Щодо розглянутих обсягів легеневого газу, Фіг. 2 демонструє, що відтворена поверхневоактивна речовина винаходу здатна зростати до значення, порівняного з подібним у відтвореній поверхнево-активній речовині, перевіреній у Прикладі 3 у WO 2008044109, що містить більш високе співвідношення DPPC та POPG (68:31). Крім того, обсяги легеневого газу відтвореної поверхнево-активної речовини винаходу виявляються надійними та відтвореними. 8 UA 103526 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 1. Відтворений сурфактант, що містить: а) 1,2-1,8 % ваги аналога поліпептиду білка природного сурфактанта SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ. ID NO:1); б) 0,1-0,5 % ваги аналога поліпептиду білка природного сурфактанта SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ. ID NO:2); в) мононенасичений та насичений фосфоліпід з вагою у діапазоні 45:55-55:45, де вказаний мононенасичений фосфоліпід вибраний з групи, що складеться з пальмітоїлолеїлфосфатидилхоліну (РОРС) та пальмітоїлолеїлфосфатидилгліцерину (POPG), та де вказаний насичений фосфоліпід вибраний з групи, що складається з дипальмітоїлфосфатидилхоліну (DPPC) та дипальмітоїлфосфатидилгліцерину (DPPG); усі кількості обчислені відносно загальної ваги відтвореного сурфактанту. 2. Відтворений сурфактант за п. 1, що містить: а) приблизно 1,5 % ваги аналога поліпептиду білка природного сурфактанта SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ. ID NO:1); б) приблизно 0,2 % ваги аналога поліпептиду білка природного сурфактанта SP-B, що складається з послідовності, яка представлена формулою 9 UA 103526 C2 5 10 15 20 25 30 35 40 CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ. ID NO:2); в) 1,2-дипальмітоїл-sn-гліцеро-3-фосфохолін (DРРС) та 1-пальмітоїл-2-олеїл-sn-гліцеро-3фосфогліцерин (РОРG) у ваговому співвідношенні приблизно 50:50; усі кількості обчислені відносно загальної ваги відтвореного сурфактанту. 3. Відтворений сурфактант за п. 2, що містить: а) приблизно 1,5 % ваги аналога поліпептиду білка природного сурфактанта SP-C, що складається з послідовності, яка представлена формулою IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (SEQ ID:NO.1); б) приблизно 0,2 % ваги аналога поліпептиду білка природного сурфактанта SP-B, що складається з послідовності, яка представлена формулою CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (SEQ ID:NO.2); в) приблизно 49,15 % ваги 1,2-дипальмітоїл-sn-гліцеро-3-фосфохоліну (DРРС); та г) приблизно 49,15 % ваги 1-пальмітоїл-2-олеїл-sn-гліцеро-3-фосфогліцерину (POPG); усі кількості обчислені відносно загальної ваги відтвореного сурфактанту. 4. Відтворений сурфактант за будь-яким з пп. 1-3, де поліпептид SEQ ID:NO.2 знаходиться у формі дисульфідзв'язаної молекули з внутрішньомолекулярним дисульфідним зв'язком між двома цистеїновими залишками у 1 та 33 позиціях та/або між двома цистеїновими залишками у 4 та 27 позиціях. 5. Відтворений сурфактант за будь-яким з попередніх пунктів, де POPG знаходиться у вигляді фармацевтично прийнятної солі. 6. Відтворений сурфактант за п. 5, де сіль є сіллю натрію. 7. Відтворений сурфактант за будь-яким з попередніх пунктів, де кожен з вказаних поліпептидів наведений у вигляді фармацевтично прийнятної солі. 8. Відтворений сурфактант за п. 7, де сіль є ацетатною сіллю. 9. Фармацевтичний препарат, що містить відтворений сурфактант за будь-яким з пп. 1-8, де вказаний препарат знаходиться у вигляді розчину, дисперсії, суспензії, або сухого порошку, вибірково у комбінації з одним, або декількома фармацевтично прийнятними носіями. 10. Фармацевтичний препарат за п. 9, де вказаний препарат знаходиться у вигляді водної суспензії. 11. Фармацевтичний препарат за п. 10, де відтворений сурфактант знаходиться у концентрації, що дорівнює 0,1-160 мг/мл водної суспензії. 12. Набір, що містить: a) відтворений сурфактант за будь-яким з пп. 1-8 у вигляді порошку у першій лікарській формі з одноразовим дозуванням; b) фармацевтично прийнятний носій у другій лікарській формі з одноразовим дозуванням; та c) контейнер, призначений для розміщення вказаної першої та другої форм дозування. 13. Відтворений сурфактант за будь-яким з пп. 1-8, для застосування як ліки. 14. Відтворений сурфактант за будь-яким з пп. 1-8 для застосування для лікування або профілактики респіраторного дистрес-синдрому (RDS) у недоношених немовлят або для лікування або профілактики інших захворювань, пов'язаних з нестачею або дисфункцією сурфактанту. 15. Відтворений сурфактант за п. 14, де захворювання включають RDS у дорослих (ARDS), синдром аспірації меконію (MAS), та бронхолегеневу дисплазію (BPD). 10 UA 103526 C2 11 UA 103526 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюImproved reconstituted surfactant composition containing analogs of surfactant protein b (sp-b) and surfactant protien c (sp-c)
Автори англійськоюPivetti, Fausto, Bocchi, Monica, Soliani Raschini, Annamaria
Автори російськоюПиветти Фаусто, Боки Моника, Солиани раскини Аннамария
МПК / Мітки
МПК: C07K 14/785, A61K 38/16, A61P 11/00
Мітки: білків, аналоги, містить, природних, сурфактант, відтворений, сурфактантів
Код посилання
<a href="https://ua.patents.su/14-103526-vidtvorenijj-surfaktant-shho-mistit-analogi-bilkiv-prirodnikh-surfaktantiv-sp-b-ta-sp-c.html" target="_blank" rel="follow" title="База патентів України">Відтворений сурфактант, що містить аналоги білків природних сурфактантів sp-b та sp-c</a>
Попередній патент: Датчик і спосіб вимірювання рівня поверхні металу в рідкій фазі
Наступний патент: Пристрій для орієнтування і закріплення заготовок типу дисків
Випадковий патент: Пересувна майстерня відновлення озброєння і військової техніки