Аналоги тироїдного гормону, фармацевтична композиція, що їх містить, спосіб лікування з їх використанням, їх застосування та спосіб одержання
Номер патенту: 98962
Опубліковано: 10.07.2012
Автори: Касундра Ашок, Бхаттамісра Субрат Кумар, Чаутайвалє Віджай, Чхіпа Лаксмікант, Мунші Сіралі, Дутт С., Гупта Рамеш, Замбад Шіталкумар Пукхарай, Сіддіквуй М. Амір, Тулі Давіндер
Формула / Реферат
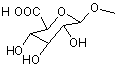
1.Сполука формули (І)
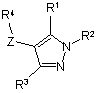 ,
,
(I)
де R1 та R3 є однаковими або різними та незалежно вибрані з Н, (С1-С6)алкілу, (С3-С7)циклоалкілу, гало, CN, CF3, -О-(С1-С6)алкілу, -СО2-(С1-С6)алкілу, СООН, -CONH-(С1-С6)алкілу, -CONH-арилу, -NH2, -CONH-R6, -CONR5, -С1-С3алкіларилу, -(С1-С3) алкіл-R6, -NН-(С1-С6)алкілу, -NH-арилу, -NH-SO2-(С1-С6)алкілу, -CH2-NH-(C1-С6)алкілу, -CH2-O-(С1-С6)алкілу, -С1-С3алкіл-NR5, R6, R7, де С1-С6алкіл та С3-С7-циклоалкіл є необов'язково заміщеними одним або кількома замісниками, вибраними з (С1-С6)алкілу, гало, ціано, -ОН, оксо, -СООН, -О-(С1-С6)алкілу, -О-бензолу, -СОО-(С1-С6)алкілу, -СОNН-(С1-С6)алкілу, -CONR5, -CONH-арилу, -CONH-гетероарилу або -CH2NR5;
R2 вибирають з (С1-С6)алкілу, (С3-С6)циклоалкілу, (С3-С6)алкенілу, (С3-С6)-алкінілу, -С(О)-(С1-С3)алкіл-СООН, -(С1-С3)алкіл-СООН, -С(О)-(С1-С3)алкіл-СОО-алкіл, -С(О)-С(О)О-(С1-С6)алкілу, -С(О)-(С1-С3)алкіл-NН-(С1-С6)алкілу, -С(О)-О-(С1-С6)алкілу, -C(O)NR5, -C(O)NH-(С1-С6)алкілу, -С(О)-(С1-С3)алкіларилу, -С(О)-(С1-С3)алкіл-R6, R6, R7, де вказані (С1-С6)алкіл, (С3-С6)циклоалкіл, (С3-С6)алкеніл, (С3-С6)алкініл є необов'язково заміщеними одним або кількома замісниками, вибраними з пергалоалкілу, оксо, -С(О)ОН, -С(О)-О-(С1-С3)алкілу, -С(О)-O(С1-C3)алкіларилу, -C(O)-O-(C1-C3)aлкiл-R6, -CONH2, -CONH(С1-С3)алкілу, -С(О)NН-арилу, -C(O)NH-R6, -CONR5, -CONHNH2, -C(=NH)NH-(C1-C6)aлкілy, -C(=NH)NH2, C(=NH)NHOH, -C(O)-R8, -C(O)NHSO2(C1-C6)-aлкілy, -C(O)NHSO2-apилy, -C(O)NHOH, -C(O)NHSO2-R6, -C(O)NHNH-(C1-C6)алкілу, -C(O)NHNH- apилy, -CONH-(C1-С2)алкіларилу, -C(O)NH-(C1-C2)aлкiл-R6, -CH2NR5, -NH2, -NН-(С1-С6)алкілу, -NH-C(O)-O-(С1-С3)алкілу, -NH-C(O)-(C1-C3)алкілу, -NHC(O)-apилy, -NHC(O)-(C1-C3)aлкiлapилy, -NHC(O)-R6, -NH-C(O)NR5, -NН-С(О)NН-арилу, -NHC(O)NH-(C1-C6)алкілу, -NHSO2(С1-С6)алкілу, -NН-SО2-арилу, -NH-SO2-R6, гало, ціано, -ОН, -О-(С1-С6)алкілу, -О-арилу, -О-гетероарилу, -О-(С1-С2)алкіларилу, -SO3H, -SO2NH-apилy, -SO2NH-R6 або -SO2NH-(C1-С6)алкілу, R6 або R7;
R5 разом з атомом азоту, до якого він приєднаний, утворюють насичене або ненасичене (С3-С6)-членне кільце, яке може додатково містить 1-2 гетероатоми, вибрані з О, N або S, та які можуть бути необов'язково заміщеними одним або кількома замісниками, вибраними з оксо, -СООН, гало, -ОН, -О-(С1-С6)алкілу або -(С1-С6)алкілу;
R6 вибирають з фенілу або 5-8-членного гетероарилу, який містить 1-4 гетероатоми, вибрані з О, N або S, де вказані гетероарильне або фенольне кільце є необов'язково заміщеним одним або кількома замісниками, вибраними з галогену, -ОН, -(О)-(С1-С6)алкілу, -пергалоалкілу, -(С1-С6)алкілу, -(С3-С6)циклоалкілу, -SО2(С1-С6)алкілу, ціано, -СООН, -С(О)О-(С1-С6)алкілу, -С(О)О-СН2-арилу, -С(О)О-арилу, -СОNН(С1-С3)алкілу, нітро, -NH2, -NH-(С1-С6)алкілу, -NHС(О)-(С1-С6)алкілу, -NНС(О)-арилу, -NHSO2(C1-C6)алкілу, -CONH2, -SО2-(С1-С6)алкілу, -NНSО2(С1-С6)алкілу або -COR8;
R7 означає 3-6-членне гетероциклічне кільце, яке містить 1-4 гетероатоми, вибрані з О, N або S, та вказане гетероциклічне кільце є необов'язково заміщеним одним або кількома замісниками, вибраними з оксо, галогену, -О-(С1-С6)алкілу, -ОН, -CF3, (С1-С6)алкілу, (С3-С6)циклоалкілу, ціано, -СООН, -С(О)О-(С1-С6)алкілу, -С(О)О-СН2-арилу, -С(О)О-арилу, -NH2, -NН-(С1-С6)алкілу, -NНС(О)-(С1-С6)алкілу, -NНС(О)-арилу, -CONH2, -SО2арил(С1-С6)алкілу, -SО2-(С1-С6)алкілу, -NНSО2(С1-С6)алкілу або -COR8;
R8 означає амінокислоту, зв'язану через її атом азоту; Z = O, CH2 aбo NH;
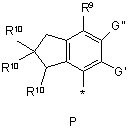
R4 вибирають з Р, Q або Т:
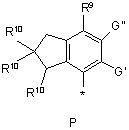 ,
, 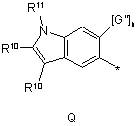 ,
, 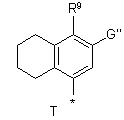 ,
,
R9 вибирають з -ОН, -О-алкілу, -OSO3H, галогену, -С(О)О-(С1-С6)алкілу, -C(O)NHR8, -ОС(О)-(С1-С6)алкілу, -О-пергалоалкілу, -ОС(О)О-(С1-С6)алкілу, -CONR5, -NHСО-(С1-С6)алкілу, -NНС(О)-О-(С1-С6)алкілу, -NНС(О)-О-арилу, -NHSО2-(С1-С6)алкілу-, -NHSО2-арилу, -NHCONR5 або
 ,
,
R10 вибирають з Н, галогену, (С1-С6)алкілу, алкокси, арилокси, -NНСО-(С1-С6)алкілу, -NНSО2-(С1-С6)алкілу або -NH-SO2-арилy;
R11 означає -СО-(С1-С6)алкіл, -SО2-(С1-С6)алкіл або -SO2-арил;
G' вибирають з Н, галогену або (С1-С6)алкілу;
G" вибирають з водню, (С1-С6)алкілу, (С3-С6)циклоалкілу, арилу, галогену, пергалоалкілу, CN, СНО, -(С1-С3)алкіларилу, -(С1-С6)aлкіл-O-(C1-C6)алкілу, -CH2R9, -СН2арилу, -CH2NR5, -СООН, -С(O)O(С1-С6)алкілу, -CONH-(C1-C6)алкілу, -CONR5, -SO2NR5, -SO2NH-(C1-C6)алкілу, -SO2NH-apилy;
n може дорівнювати 1 або 2;
включаючи їх фармацевтично прийнятні солі та їх гідрати, сольвати, атропоізомери,
регіоізомери, енантіомери, діастереоізомери, таутомери, поліморфи та проліки, за умови,
що
коли R4 означає Q тоді,
R2 є іншим, ніж R6 та R7;
включаючи її фармацевтично прийнятні солі та її гідрати, сольвати, атропоізомери, регіоізомери, енантіомери, діастереоізомери, таутомери, поліморфи та проліки.
2. Сполука за п. 1, де R4 вибирають з Р або Т.
3. Сполука за п. 1, яку вибирають з групи, яка складається з наступних сполук:
3-[4-(7-гідроксііндан-4-ілокси)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
7-[3,5-диметил-1-(1Н-тетразол-5-ілметил)-1Н-піразол-4-ілоксі]-індан-4-ол,
7-{3,5-диметил-1-[2-(1Н-тетразол-5-іл)-етил]-1Н-піразол-4-ілоксі}-індан-4-ол,
{2-[4-(7-гідроксііндан-4-ілокси)-3,5-диметилпіразол-1-іл]-ацетиламіно}-оцтова кислота,
2-[4-(7-гідроксііндан-4-ілокси)-3,5-диметилпіразол-1-іл]-N-(1Н-тетразол-5-іл)-ацетамід,
3-[4-(7-гідроксііндан-4-ілокси)-3-тіофен-2-ілпіразол-1-іл]-пропіонова кислота,
3-[4-(7-гiдроксііндан-4-ілокси)-5-тіофен-2-ілпіразол-1-іл]-пропіонова кислота,
7-[1-(1Н-тетразол-5-ілметил)-3-тіофен-2-іл-1Н-піразол-4-ілоксі]-індан-4-ол,
7-[1-(1Н-тетразол-5-ілметил)-5-тіофен-2-іл-1Н-піразол-4-ілоксі]-індан-4-ол,
3-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
5-[4-(7-гідроксііндан-4-ілокси)-3,5-диметилпіразол-1-ілметил]-1Н-піразол-3-ол,
2-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-оцтова кислота,
7-[1-(2-гідроксіетил)-3,5-диметил-1Н-піразол-4-ілметил]-5-метиліндан-4-ол,
3-[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
7-[3,5-диметил-1-(1Н-тетразол-5-ілметил)-1Н-піразол-4-ілметил]-5-метиліндан-4-ол,
7-[3,5-діізопропіл-1-(1Н-тетразол-5-ілметил)-1Н-піразол-4-ілметил]-5-метиліндан-4-ол,
3-[3,5-дициклопропіл-4-(7-гідроксііндан-4-ілокси)-піразол-1-іл]-пропіонова кислота,
3-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-діізопропілпіразол-1-іл]-пропіонова кислота,
[3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-іл]-оцтова кислота,
3-[3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-іл]-пропіонова кислота,
7-[3,5-діетил-1-(1Н-тетразол-5-ілметил)-1Н-піразол-4-ілметил]-5-метиліндан-4-ол,
[3,5-дициклопропіл-4-(7-гідроксііндан-4-ілокси)-піразол-1-іл]-оцтова кислота,
[4-(7-гідроксііндан-4-ілокси)-3,5-диметилпіразол-1-іл]-оцтова кислота,
3-[4-(6-хлор-7-гідроксііндан-4-ілметил)-3,5-діетилпіразол-1-іл]-пропіонова кислота,
[4-(6-хлор-7-гідроксііндан-4-ілметил)-3,5-діетилпіразол-1-іл]-оцтова кислота,
3-{4-[7-гідрокси-6-(піролідин-1-карбоніл)-індан-4-ілметил]-3,5-диметилпіразол-1-іл}-пропіонова кислота,
3-[4-(6-хлор-7-гідроксііндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
1-{2-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-ацетил}-піролідин-2-карбонова кислота,
7-[3,5-диметил-1-(1Н-тетразол-5-ілметил)-1Н-піразол-4-ілокси]-5-метиліндан-4-ол,
[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-діізопропілпіразол-1-іл]-оцтова кислота,
3-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-N-ізопропілпропіонамід,
[4-(7-гідрокси-6-метиліндан-4-ілокси)-3,5-диметилпіразол-1-іл]-оцтова кислота,
3-[4-(7-гідрокси-6-метиліндан-4-ілокси)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
4-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-масляна кислота,
3-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-N-(1Н-тетразол-5-іл)-пропіонамід,
5-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-ілметил]-3Н-[1,3,4]оксадіазол-2-он,
7-{3,5-диметил-1-[2-(1Н-тетразол-5-іл)-етил]-1Н-піразол-4-ілметил}-5-метиліндан-4-ол,
{2-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-ацетиламіно}-оцтова кислота,
5-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-ілметил]-1Н-піразол-3-ол,
5-[3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-ілметил]-3Н-[1,3,4]оксадіазол-2-он,
5-{2-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-етил}-3Н-[1,3,4]оксадіазол-2-он,
{2-[3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-іл]-ацетиламіно}-оцтова кислота,
6-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-ілметил]-2-метил-3Н-піримідин-4-он,
3-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-ілметил]-[1,2,4]оксадіазол-5-ол,
7-(1-бензол-3,5-диметил-1Н-піразол-4-ілметил)-5-метиліндан-4-ол,
3-{4-[7-гідрокси-6-(4-метилбензол)-індан-4-ілметил]-3,5-диметилпіразол-1-іл}-пропіонова кислота,
2-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
3-[4-(7-гідрокси-6-ізопропіліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
{4-[7-гідрокси-6-(4-метилбензол)-індан-4-ілметил]-3,5-диметилпіразол-1-іл}-оцтова кислота,
3-{4-[6-(4-фторбензол)-7-гідроксііндан-4-ілметил]-3,5-диметилпіразол-1-іл}-пропіонова кислота,
{4-[6-(4-фторбензол)-7-гідроксііндан-4-ілметил]-3,5-диметилпіразол-1-іл}-оцтова кислота,
натрієва сіль 4-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-масляної кислоти,
магнієва сіль 3-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонової кислоти,
натрієва сіль 3-[4-(7-гідрокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонової кислоти,
3-{3,5-діетил-4-[6-(4-фторбензол)-7-гідроксііндан-4-ілметил]-піразол-1-іл}-пропіонова кислота,
етиловий естер 3-[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-3-оксо-пропіонової кислоти,
гідразид [3,5-діетил-4-(7-метокси-6-метиліндан-4-ілметил)-піразол-1-іл]-оцтової кислоти,
N-гідрокси-2-[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-ацетамідин,
етиловий естер [4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-оксооцтової кислоти,
[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-морфолін-4-ілметанон,
1-(4-хлорфеніл)-4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметил-1Н-піразол,
2-(4-метансульфонілфеніл)-1-[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-етанон,
етиловий естер 4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-карбонової кислоти,
пропан-2-сульфонова кислота {3-[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіоніл}-амід,
3-[5-етокси-4-(7-метокси-6-метиліндан-4-ілметил)-3-метилпіразол-1-іл]-пропіонова кислота,
3-[3-етокси-4-(7-метокси-6-метиліндан-4-ілметил)-5-метилпіразол-1-іл]-пропіонова кислота,
[4-(7-гідрокси-3,6-диметиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-оцтова кислота,
2-[4-(7-гідрокси-б-метиліндан-4-ілметил)-3,5-диметилпіразол-1-ілметил]-пентандіоєва кислота,
[4-(7-метокси-2,2,6-триметиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-оцтова кислота,
N-{2-[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-етил}-ацетамід,
N-{2-[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-етил}-метансульфонамід,
4-[4-(7-метокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-1-(толуол-4-сульфоніл)-піперидин,
{3,5-діетил-4-[6-(4-фторбензол)-7-гідроксііндан-4-ілметил]-піразол-1-іл}-оцтова кислота,
3-{4-[7-метокси-6-(4-метоксифеніл)-індан-4-ілметил]-3,5-диметилпіразол-1-іл}-пропіонова кислота,
2-[3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-іл]-N-ізопропілацетамід,
метиловий естер 3-[4-(7-етоксикарбонілокси-6-метиліндан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонової кислоти,
натрієва сіль [3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-іл]-оцтової кислоти,
3-[4-(7-метокси-6-метиліндан-4-ілметил)-3-метил-5-трифторметилпіразол-1-іл]-пропіонова кислота,
3-[4-(7-метокси-6-метиліндан-4-ілметил)-5-метил-3-трифторметилпіразол-1-іл]-пропіонова кислота,
[4-(4-гідрокси-3-метил-5,6,7,8-тетрагідронафтален-1-ілметил)-3,5-диметилпіразол-1-іл]-оцтова кислота,
[4-(7-хлоріндан-4-ілокси)-3-тіофен-2-ілпіразол-1-іл]-оцтова кислота,
[4-(7-хлоріндан-4-ілокси)-5-тіофен-2-ілпіразол-1-іл]-оцтова кислота,
{4-[7-метокси-6-метил-2-(4-нітрофеноксі)-індан-4-ілметил]-3,5-диметилпіразол-1-іл}-оцтова кислота,
[5-аміно-4-(7-метокси-6-метиліндан-4-ілметил)-3-(4-метоксифеніл)-піразол-1-іл]-оцтова кислота,
[3-аміно-4-(7-метокси-6-метиліндан-4-ілметил)-5-(4-метоксифеніл)-піразол-1-іл]-оцтова кислота,
2-[3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-іл]-N-(1Н-тетразол-5-іл)-ацетамід,
1-карбоксиметил-5-(5-хлортіофен-2-іл)-4-(7-метокси-6-метиліндан-4-ілметил)-1Н-піразол-3-карбонова кислота,
2-карбоксиметил-5-(5-хлортіофен-2-іл)-4-(7-метокси-6-метиліндан-4-ілметил)-2Н-піразол-3-карбонова кислота,
2-[4-(7-гідроксііндан-4-ілокси)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
1-{2-[3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-іл]-ацетил}-піролідин-2-карбонова кислота,
[3,5-діетил-4-(7-гідрокси-6-піролідин-1-ілметиліндан-4-ілметил)-піразол-1-іл]-оцтова кислота,
3-[3,5-діетил-4-(7-гідрокси-6-піролідин-1-ілметиліндан-4-ілметил)-піразол-1-іл]-пропіонова кислота,
3-[3,5-діетил-4-(7-метокси-6-метоксиметиліндан-4-ілметил)-піразол-1-іл]-пропіонова кислота,
{3,5-діетил-4-[7-гідрокси-6-(піролідин-1-карбоніл)-індан-4-ілметил]-піразол-1-іл}-оцтова кислота,
[3,5-діетил-4-(7-метокси-6-метоксиметиліндан-4-ілметил)-піразол-1-іл]-оцтова кислота,
3-{3,5-діетил-4-[7-гідрокси-6-(піролідин-1-карбоніл)-індан-4-ілметил]-піразол-1-іл}-пропіонова кислота та
N-(4-хлорфеніл)-2-[3,5-діетил-4-(7-гідрокси-6-метиліндан-4-ілметил)-піразол-1-іл]-ацетамід.
4. Фармацевтична композиція, яка містить терапевтично ефективну кількість однієї або кількох сполук за п. 1, необов'язково, у комплексі з фармацевтично прийнятними солями, розчинниками або носіями.
5. Спосіб лікування ожиріння у організмі ссавця, включаючи людину, який включає введення у організм вказаного ссавця терапевтично ефективної кількості сполуки за п. 1.
6. Спосіб покращення резистентності до інсуліну та/або попередження або затримки розвитку вираженого діабету у організмі ссавця, включаючи людину, який включає введення у організм вказаного ссавця терапевтично ефективної кількості сполуки за п. 1.
7. Спосіб попередження або лікування дисліпідемії у організмі ссавця, включаючи людину, який включає введення у організм вказаного ссавця терапевтично ефективної кількості сполуки за п. 1.
8. Спосіб попередження або лікування метаболічного синдрому у організмі ссавця, включаючи людину, який включає введення у організм вказаного ссавця терапевтично ефективної кількості сполуки за п. 1.
9. Спосіб попередження або лікування хвороби або розладу, асоційованого з невідповідною активністю тиреоїдного гормону у організмі ссавця, включаючи людину, який включає введення у організм вказаного ссавця терапевтично ефективної кількості сполуки за п. 1.
10. Спосіб за п. 9, де вказана хвороба або розлад вибрані з 1) станів, асоційованих з хворобою або розладом, асоційованим з надлишковим накопиченням жиру, зміненою мітохондріальною функцією, 2) ліпідних розладів, викликаних порушенням рівноваги рівнів ліпідів в крові та тканині, 3) зменшеної толерантності до глюкози, 4) діабету типу II, 5) заміненої терапії у пацієнтів похилого віку з гіпотироїдизмом, 6) депресії, 7) серцево-судинних хвороб та 8) розладів шкіри.
11. Застосування сполуки формули (ІА) для лікування станів, асоційованих з невідповідною активністю тиреоїдного гормону, вибраних з ожиріння, резистентності до інсуліну, дисліпідемії, метаболічним синдромом, діабетом типу II, заміненою терапією у пацієнтів похилого віку з гіпотироїдизмом, депресією, серцево-судинними хворобами та розладами шкіри, шляхом введення терапевтично ефективної кількості сполуки у організм ссавця, включаючи людину:
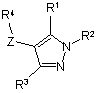 ,
,
IA
де R1 та R3 є однаковими або різними та незалежно вибрані з Н, (С1-С6)алкілу, (С3-С7)циклоалкілу, гало, CN, CF3, -О-(С1-С6)алкілу, -СО2-(С1-С6)алкілу, СООН, -CONH-(С1-С6)алкілу, -CONH-арилу, -NH2, -CONH-R6, -CONR5, -С1-С3алкіларилу, -(С1-С3)алкіл-R6, -NН-(С1-С6)алкілу, -NH-арилу, -NН-SО2-(С1-С6)алкілу, -CH2NH-(С1-С6)алкілу, -СН2-О-(С1-С6)алкілу, -С1-С3алкіл-NR5, R6, R7, де С1-С6-алкіл та С3-С7-циклоалкіл є необов'язково заміщеними одним або кількома замісниками, вибраними з (С1-С6)алкілу, гало, ціано, -ОН, оксо, -СООН, -О-(С1-С6)алкілу, -О-бензолу, -СОО-(С1-С6)алкілу, -СОNН-(С1-С6)алкілу, -CONR5, -CONH-арилу, -CONH-гетероарилу або -CH2NR5;
R2 вибирають з (С1-С6)алкілу, (С3-С6)циклоалкілу, (С3-С6)алкенілу, (С3-С6)алкінілу, -С(О)-(С1-С3)алкіл-СООН, -(С1-С3)алкіл-СООН, -С(О)-(С1-С3)алкіл-СОО-алкілу, -С(О)-С(О)О-(С1-С6)алкілу, -С(О)-(С1-С3)алкіл-NН-(С1-С6)алкілу, -С(О)-О-(С1-С6)алкілу, -C(O)NR5, -C(O)NH-(С1-С6)алкілу, -С(О)-(С1-С3)алкіларилу, -C(O)-(C1-C3)алкіл-R6, R6, R7, де вказані (С1-С6)алкіл, (С3-С6)циклоалкіл, (С3-С6)алкеніл, (С3-С6)алкініл є необов'язково заміщеними одним або кількома замісниками, вибраними з пергалоалкілу, оксо, -С(О)ОН, -С(О)-О-(С1-С3)алкілу, -С(О)-(С1-С3)алкіларилу, -С(О)-(С1-С3)алкіл-R6, -CONH2, -CONH(C1-С3)алкілу, -С(О)NН-арилу, -C(O)NH-R6, -CONR5, -CONHNH2, -C(=NH)NH-(C1-C6)алкілу, -C(=NH)NH2, C(=NH)NHOH, -C(O)-R8, -С(О)NНSО2(С1-С6)алкілу, -C(O)NHSO2-apилy, -C(O)NHOH, -C(O)NHSO2-R6, -C(O)NHNH-(С1-C6)алкілу, -C(O)NHNH-apилy, -CONH-(C1-С2)алкіларилу, -C(O)NH-(C1-C2)aлкiл-R6, -CH2NR5, -NH2, -NH-(C1-C6)алкілy, -NH-C(O)-O-(С1-С3)алкілу, -NН-С(О)-(С1-С3)алкілу, -NHC(O)-арилу, -NНС(О)-(С1-С3)алкіларилу, -NHC(O)-R6, -NH-C(O)NR5, -NH-C(O)NH-apил, -NНС(O)NН-(C1-C6)алкілу, -NHSO2(C1-С6)алкілу, -NH-SO2-арилу, -NH-SO2-R6, гало, ціано, -ОН, -О-(С1-С6)алкілу, -О-арилу, -O-гетероарилу, -О-(С1-С2)алкіларилу, -SO3H, -SO2NH-арилу, -SO2NH-R6 або -SO2NH-(C1-С6)алкілу, R6 або R7;
R5 разом з атомом азоту, до якого він приєднаний, утворюють насичене або ненасичене (С3-С6)-членне кільце, яке може додатково містити 1-2 гетероатоми, вибрані з О, N або S, та які можуть бути необов'язково заміщеними одним або кількома замісниками, вибраними з оксо, -СООН, гало, -ОН, -О-(С1-С6)алкілу або -(С1-С6)алкілу;
R6 вибирають з фенілу або 5-8-членного гетероарилу, який містить 1-4 гетероатоми, вибрані з О, N або S, де вказане гетероарильне або фенільне кільце може бути необов'язково заміщеним одним або кількома замісниками, вибраними з галогену, -ОН, -О-(С1-С6)алкілу, -пергалоалкілу, -(С1-С6)алкілу, -(С3-С6)циклоалкілу, -SО2(С1-С6)алкілу, ціано, -СООН, -С(О)О-(С1-С6)алкілу, -С(О)О-СН2-арилу, -С(О)О-арилу, -CONH(С1-С3)алкілу, нітро, -NH2, -NН-(С1-С6)алкілу, -NНС(О)-(С1-С6)алкілу, -NНС(О)-арилу, -NHSO2(C1-C6)алкілу, -CONH2, -SО2-(С1-С6)алкілу, -NНSО2(С1-С6)алкілу або-COR8;
R7 означає 3-6-членне гетероциклічне кільце, яке містить 1-4 гетероатом, вибрані з О, N або S, та вказане гетероциклічне кільце необов'язково заміщене одним або кількома замісниками, вибраними з оксо, галогену, -О-(С1-С6)алкілу, -ОН, -CF3, (С1-С6aлкілу, (С3-С6)циклоалкілу, ціано, -СООН, -С(О)О-(С1-С6)алкілу, -С(О)О-СН2-арилу, -С(О)О-арилу, -NH2, -NН-(С1-С6)алкілу, -NHС(О)-(С1-С6)алкілу, -NHC(O)-apилy, -CONH2, -SO2aрил(C1-С6)алкілу, -SО2-(С1-С6)алкілу, -NHSO2(C1-C6)aлкілy або -COR8; R8 є амінокислотою, приєднаною через її атом азоту; Z = O, CH2 aбo NH;
R4 вибирають з Р, Q або Т
 ,
,  ,
, 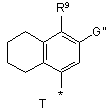 ,
,
R9 вибирають з -ОН, -О-алкілу, -OSO3H, галогену, -С(О)О-(С1-С6)алкілу, -C(O)NHR8, -ОС(О)-(С1-С6)алкілу, -О-пергалоалкілу, -ОС(О)О-(С1-С6)алкілу, -CONR5, -NHCO-(С1-С6)алкілу, -NНС(О)-О-(С1-С6)алкілу, -NНС(О)-О-арилу, -NНSО2-(С1-С6)алкілу, -NHSO2-арилу, -NHCONR5 або
 ,
,
R10 вибирають з Н, галогену, (С1-С6)aлкілу, алкокси, агілокси, -NНСО-(С1-С6)алкілу, -NHSO2-(С1-С6) алкілу або -NH-SO2-aлкілy;
R11 означає Н, (С1-С6)алкіл, -СО-(С1-С6)алкіл, -SО2-(С1-С6)алкіл або -SO2-арил;
G' вибирають з Н, галогену або (С1-С6)алкілу;
G" вибирають з водню, (С1-С6)алкілу, (С3-С6)циклоалкілу, арилу, галогену, пергалоалкілу, CN, СНО, -(С1-С3)алкіларилу, -(С1-С6)алкіл-О-(С1-С6)алкілу, -CH2R9, -СН2-арилу, -CH2NR5, -СООН, -С(О)О(С1-С6)алкілу, -СОNН-(С1-С6)алкілу, -CONR5, -SO2NR5, -SО2NН-(С1-С6)алкілу, -SO2NH-apилy;
n може мати значення 1 або 2;
включаючи її фармацевтично прийнятні солі та їх гідрати, сольвати, атропізомери, регіоізомери, енантіомери, діастереомери, туатомери, поліморфи та проліки.
12. Спосіб одержання сполуки за п. 1, в якому здійснюють:
(і) взаємодію сполуки формули (III) або (IX):
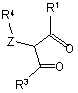 , III
, III 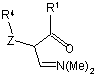 , IX
, IX
з гідратом гідразину або придатно заміщеним гідразином формули
R2NHNH2
з утворенням сполуки формули (ІІ)
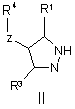 ,
,
і
(іі) взаємодію сполуки формули ІІ із сполукою формули
R2-Y,
де Y є відхідною групою, бажано галогеном, у присутності придатної основи у придатному розчиннику.
13. Сполука, яку вибирають з групи, яка складається з наступних сполук:
3-[4-(1Н-iндол-5-ілметил)-3, 5-диметилпіразол-1-іл]-пропіонова кислота,
[4-(1Н-індол-5-ілметил)-3,5-диметилпіразол-1-іл]-оцтова кислота,
3-[3,5-діетил-4-(1Н-індол-5-ілметил)-піразол-1-іл]-пропіонова кислота,
2-[4-(1Н-iндол-5-ілметил)-3,5-диметилпіразол-1-іл]-етанол,
3-[4-(1Н-iндол-5-ілокси)-3,5-диметилпіразол-1-іл]-пропіонова кислота,
[4-(1Н-iндол-5-ілокси)-3,5-диметилпіразол-1-іл]-оцтова кислота.
Текст
Реферат: 1 2 3’ 4 Даний винахід описує нові тиреоїдподібні сполуки формули (І), де R , R , R R та Z є такими, як визначено в описі, спосіб їх одержання, композицію, яка містить такі сполуки, та застосування таких сполук та композиції як лікарського засобу. Також, сполуки формули (І) мають дуже низьку афінність зв'язування з тиреоїдними рецепторами та, таким чином, уникають тиреотоксичного впливу. Винахід також стосується застосування сполуки формули (І) для виготовлення лікарського засобу для лікування різноманітних хвороб, таких як ожиріння, дисліпідемія, метаболічний синдром та супутні хвороби, асоційовані з метаболічним синдромом. R1 R1 Z N N R3 R2 UA 98962 C2 (12) UA 98962 C2 UA 98962 C2 1 5 10 15 20 25 30 35 40 2 3 4 Даний винахід стосується нових тиреоїдподібних сполук формули (І), де R , R , R , R та Z є такими як вказано у даному документі, способу їх одержання, композиції, яка містить такі сполуки, та застосування таких сполук та композицій у терапії. Більш того, сполуки формули (I) мають дуже низьку афінність зв'язування з тиреоїдними рецепторами, та таким чином, уникають тиреотоксичного впливу. Винахід також стосується застосування сполук формули (I) для виготовлення лікарського засобу для лікування різноманітних хвороб, таких як ожиріння, диcліпідемія, метаболічний синдром та супутні хвороби, асоційовані з метаболічним синдромом. Ожиріння є станом надлишкового накопичення енергії в тілі, при якому природний запас енергії, який зберігається у жировій тканині людей та інших ссавців, підвищений до рівня, коли його асоціюють з певними станами здоров'я або підвищеною смертністю. Ожиріння розвивається з дисбалансу між використанням енергії та споживанням енергії, та фізіологічним підходом лікування ожиріння є отримання негативного енергетичного та жирового балансу. Насправді втрата ваги за допомогою дієти є ефективною для більшості пацієнтів, проте тільки деякі можуть підтримувати таку вагу досить довго. Ожиріння досягло епідемічних розмірів у всьому світі, з більше ніж 1,6 більйонів дорослих з надлишковою вагою, щонайменше 400 мільйонів з них мають клінічне ожиріння, ожиріння є головним чинником хронічних хвороб та безпорадності (WHO fact sheet, 2006). ВОЗ прогнозує, що до 2015 року приблизно 2,3 більйони дорослих матимуть надлишкову вагу та більше ніж 700 мільйонів страждатимуть ожирінням. У 2005 р. щонайменше 20 мільйонів дітей віком до 5 років по всьому світу мали надлишкову вагу. Ожиріння та надлишкова вага є головним ризиком для серйозних хронічних хвороб, включаючи діабет типу ІІ, серцево-судинні хвороби, гіпертензію, дисліпідемію, метаболічний синдром, серцевий напад та певні форми раку. Наслідки для здоров'я можуть складатись з підвищеного ризику передчасної загибелі та серйозних хронічних станів, які знижують загальну якість життя. Хоча ожиріння довго асоціювали з серйозними проблемами здоров'я, тільки нещодавно її почали розглядати як специфічну ціль для медичної терапії. Тому, розвиток нових шляхів лікування ожиріння є ціллю як для біофармацевтичної, так і для медичної галузі (Melnikova I. & Wages D Nature Reviews Drug Discovery (2006); 5: 369-370). Доступна терапія для лікування ожиріння має певні обмеження або внаслідок недостатньої ефективності, або внаслідок більш високого рівня побічних ефектів, та тому існує потреба у кращому лікуванні з бажаною ефективністю та незначними побічними ефектами. Багато сполук, які використовують різноманітні нові терапевтичні досягнення, такі як антагоніст рецептору NPY, бета 3 агоніст тощо, знаходяться на ранніх стадіях розробки. Нещодавно для лікування ожиріння почали застосовувати ліганди, селективні до тиреоїдного рецептору. Епідеміологічні данні чітко показують взаємозв'язок між зміненою вуглеводів та метаболізмом жирів, накопиченням жиру тіла та холестерину та подальшим ризиком розвитку серцево-судинні хвороб, таких як атеросклероз, гіпертензія тощо. Атеросклероз є хворобою артерій, його розглядають як головну причину смерті по всьому світу. Епідеміологічні дані чітко вказують на те, що гіперліпідемія як первинний фактор ризику, що призводить до серцевосудинних хвороб внаслідок атеросклерозу. У останні роки, медична асоціація знов посилила 1 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 увагу щодо зниження рівню холестерину у плазмі, та зокрема, холестерину ліпопротеїнів низької густини, як суттєвої стадії для запобігання розвитку серцево-судинні хвороб. Верхня межа "нормальна" є значно нижчою, ніж вважали раніше. В результаті, значна частина населення опинилась у зоні ризику. Такі незалежні фактори ризику включають непереносимість глюкози, гіпертрофію лівого шлуночку, гіпертензію та чоловічу стать. Серцево-судинні хвороби є найбільш розповсюдженими серед діабетичних ускладнень, щонайменше частково внаслідок наявності великої кількості незалежних факторів ризику у населення. Успішне лікування дисліпідемії у загальній популяції та діабетичних ускладнень зокрема, є найважливішим для медицини. Гіпертензія є станом, який з'являється у популяції людей як вторинний симптом багатьох інших хвороб. Однак, гіпертензія наявна також у багатьох пацієнтів з невідомими причинними факторами. У той час як "природна" гіпертензія зазвичай асоціюється з розладами, такими як ожиріння, діабет та гіпертригліцеридимія, взаємозв'язок між цими розладами є недостатньо вивченим. У багатьох пацієнтів також проявляються симптоми підвищеного кров'яного тиску при повній відсутності будь-яких інших ознак хвороби або розладу. Відомо, що гіпертензія може напряму призвести до багатьох ускладнень, таких як серцева недостатність, ниркова недостатність та серцевий напад (крововилив в мозок). Гіпертензія також приймає участь у розвитку атеросклерозу та коронарних хвороб. Гіпертензія рідко з'являється одна, проте зазвичай з факторами ризику серцево-судинних хвороб, такими як резистентність до інсуліну, вісцеральне ожиріння та дисліпідемія. Ці стани поступово послаблюють пацієнта та можуть призвести до загибелі. Не зважаючи на те, що ефективний контроль за кров'яним тиском зазвичай розглядають як найбільш важливе втручання щодо зниження довготривалих ускладнень гіпертензії, довідники по лікуванню зараз почали включати концепцію загального управління ризиком серцево-судинних хвороб для покращення стану пацієнта. Метаболічний синдром, сукупність метаболічних аномалій є комбінацією резистентності до інсуліну, дисліпідемії, ожиріння та гіпертензії, що призводить до підвищеного рівня захворюваності та загибелі внаслідок серцево-судинних хвороб (ССХ). У загальній популяції, метаболічний синдром підвищує ризик ССХ за фактором 1,65. Наявність метаболічного синдрому прогнозує підвищений ризик загальної та серцево-судинної загибелі (Eberhard Ritz, Am. J Cardiol (2007); 100[Suppl]:53-60). При здійсненні дослідження виявили, що метаболічний синдром наявний у більше ніж 20 % дорослого населення США (Young-Woo Park et al. Arch intern Med (2003); 163: 427-436). При діабеті типу ІІ, ожиріння та дисліпідемія є також переважними та біля 70 % людей з діабетом типу ІІ додатково хворіють на гіпертензію, що також призводить до збільшення загибелі від серцево-судинних хвороб. Метаболічні розлади, що впливають на метаболізм глюкози та жирів, такі як гіперліпідемія, ожиріння, діабет, резистентність до інсуліну, гіперглікемія, непереносність глюкози та гіпертензія, мають довготривалі наслідки для здоров'я, які призводять до хронічних станів, включаючи серцево-судинні хвороби та передчасну загибель. Такі метаболічні та серцевосудинні розлади можуть бути взаємозалежними, погіршувальними або активізуючими один одного та викликають зворотні механізми, які все ще є невідомими. Тому, поліфакторіальне втручання є вирішальним для попередження діабету типу ІІ та зменшення загального ризику серцево-судинних хвороб, асоційованих з метаболічним синдромом (Richard Ceska, Diabetes and Vascular Disease Research (2007); 4(suppl): S2-S4). Більш того, поліфакторіальне втручання є більш корисним, ніж зниження індивідуального фактору ризику для загального зменшення серцево-судинних хвороб. У теперішній час, не існує єдиного шляху лікування, яке б одночасно впливало на різноманітні компоненти метаболічного синдрому. Щитоподібна залоза у відповідь на стимулювання TSH, продукує T4, T3 та rT3. Хоча T4, T3 та rT3 продукуються всередині щитоподібної залози, T4 по кількості є другим головним продуктом. Вироблення T3 & rT3 всередині щитоподібної залози регулююється дуже малою кількістю та не розглядається як достатнє у порівнянні з периферійним виробленням. T4 або перетворюється на T3 або rT3, або видаляється шляхом кон'югації, дезамінування або декарбоксилування. Розрахували, що більше ніж 70 % T4 виробленого у щитоподібній залозі з часом дейодується у периферійних тканинах для утворення T3 або rT3. Хоча частина T3 виробляється у щитоподібній залозі, приблизно 80-85 % виробляється поза щитоподібною залозою, першочергово за допомогою перетворення з T4 у печінці та нирках. Наступне розкладання T3 & rT3 приводить до утворення декількох окремих дийодтиронинів: 3,5-T2, 3,3’T2 та 3,5’-T2 (Kelly GS. Altern Med Rev (2000); 5(4): 306-333). Структурно всі гормони щитоподібної залози ділять на два кільця, тобто первинне кільце та не первинне кільце та їх 2 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 SAR показує неочікувану поведінку впливу замісників в (3’-,5’-, 3-та 5-) первинного або th непервинного кільця відповідно (Burger" 6 edition, vol 3, pp.564-565). T3 вважається найбільш метаболічно активним гормоном щитоподібної залози. Різноманітні експериментальні дослідження свідчать, що головний вплив гормону щитоподібної залози опосередковується T3. Тиреоїдні гормони впливають на метаболізм практично кожної клітини тіла. На нормальному рівні ці гормони підтримують вагу тіла, швидкість метаболічних процесів, температуру тіла та настрій, та впливають на рівень ліпопротеїнів низької густини у сироватці (ЛНГ). Таким чином, гіпотеріоз супроводжується збільшенням ваги, високим рівнем холестерину ЛНГ та депресією. При значному гіпертиреозі ці гормони приводять до втрати ваги, гіперметаболізму, зниження рівня ЛНГ у сироватці, серцевої аритмії, серцевого нападу, м'язової слабкості, остеопорозу у постклімактичних жінок та страху (WO200703419). Мозок є також важливою мішенню гормону щитоподібної залози, головним чином під час розвитку організму, проте також у дорослих тваринах. Важкий гіпотеріоз новонароджених асоціюється зі змінами у мозочку, особливо у гранулярних клітинах та клітинах Пурн'є, які проявляються у зниженні диференціації та міграції; клітини Пурн'є є гіпопластичними, та гранулярні клітини не можуть мігрувати з зовнішнього зародкового шару у внутрішній гранулярний шар у достатній кількості. Відомо, що гормон щитоподібної залози, який називають тироксином ("T4"), перетворюється на тиронін ("T3") у шкірі людини за допомогою дейодинази I, селенопротеїну. Недостатність селену викликає зниження рівня T3 внаслідок зниження активності дейодинази I; таке зниження рівня T3 асоціюється з втратою волосся. У зв'язку з таким спостереженням, ріст волосся є описаним побічним ефектом введення T4. Більш того, T3 та T4 є об'єктом декількох патентних публікацій, які стосуються лікування втрати волосся, включаючи, наприклад, публікації міжнародних заявок на патенти № WO 00/72810 та WO00/72811, Застосування гормонів щитоподібної залози на даний час є обмеженим у заміщувальній терапії для пацієнтів з гіпотиреозом. Однак, заміщувальна терапія, особливо у старших пацієнтів обмежується певним шкідливим впливом гормонів щитоподібної залози. Вплив гормонів щитоподібної залози може бути терапевтично ефективним при розладах, які не стосуються щитоподібної залози, якщо можна уникнути шкідливого впливу або мінімізувати його. Ці потенційно корисні властивості включають зменшення ваги при лікуванні ожиріння, зменшення рівня холестерину при лікуванні гіперліпіемії, зменшення інтенсивності депресії та стимулювання утворення кісток при остеопорозі (Liu Ye et al., JMC (2003); 46: 1580-88). Виявили, що гіпертиреоз асоціюється з загальним низьким рівнем холестерину у сироватці, що є відмінною характеристикою збільшення експресії печіночних ЛНГ рецепторів гормону щитоподібної залози та стимулювання метаболізму холестерину до жовчних кислот (Abrams JJ et. al. J. Lipid Res.(1981); 22: 323-38). Гіпотиреоз, в свою чергу асоціювали з гіперхолестиренімією та відомо, що заміщу вальна терапія гормоном щитоподібної залози знижує загальний рівень холестерину (Aviram M. et. al. CUn. Biochem.(1982); 15: 62-66; Abrams JJ et. al. J. Lipid Res (1981); 22: 323-38). Показали, що тиреоїдний гормон на тваринних моделях має корисний вплив на збільшення холестерину ЛВГ та покращує співвідношення ЛНГ до ЛВГ шляхом збільшення експресії apo A-I, одного з головних аполіпопротеїнів ЛВГ (Ness GC. et. al. Biochemical Pharmacology, (1998); 56: 121-129; Grover GJ. et. al. Endocrinology, (2004); 145: 16561661; Grover GJ. et. al. Proc. Natl. Acad. Sci. USA, (2003); 100:10067-10072). Завдяки його впливу на холестерин ЛНГ та ЛВГ, можливо, що гормони щитоподібної залози також можуть зменшувати ризик атеросклерозу та інших серцево-судинних хвороб. Окрім цього, відомо, що гормони щитоподібної залози знижують ліпопротеїн (a), важливий фактор ризику, який є підвищеним у пацієнтів з атеросклерозом (Paul Webb. Expert Opin. Investig. Drugs, (2004); 13(5): 489-500; de Bruin et. al. J. CUn. Endo. Metab.,(1993); 76: 121-126). Первинні спроби фармакологічного використання гормони щитоподібної залози для лікування таких розладів обмежувалось проявами гіпертиреозу та зокрема серцево-судинною токсичністю (тиреотоксикоз) (Liu Ye et al., JMC (2003); 46: 1580-88). Тиреоїдний гормон діє через рецептори щитоподібної залози. Існує два головні підтипи рецепторів щитоподібної залози розташованих всередині ядра (геномний ефект) TR та TR. TRα1, TRβ1 та TRβ2 ізоформи зв'язують гормон щитоподібної залози та діють як ліганд регульовані фактори транскрипції. TRα2 ізоформа є переважною у пітуетарній та інших частинах НС, проте вона не зв'язує гормон щитоподібної залози та діє у багатьох контекстах як інгібітор транскрипції. TRα1 також є широко розповсюдженим. У літературних джерелах описано багато або більшість впливів гормонів щитоподібної залози на серце та, зокрема, на частоту серцевих скорочень та ритм, які опосередковані ізоформою TRα1. З іншої сторони, більшість впливів гормонів на печінку та інші тканини опосередковується більше β ізоформами рецепторів (Liu Ye et al., JMC (2003); 46: 1580-88). 3 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 Виявили, що тиреоїдний гормон моделює поведінку багатьох метаболічних шляхів потенційно важливих для основного метаболічного рівню. Загалом, головні механізми кандидати включають роз'єднання клітинного метаболізму з синтезом аднозинтрифосфату (ATФ), або зміни ефективності метаболічних процесів на виході з мітохондрій. Тому зробили спроби синтезувати бета-селективний гормон щитоподібної залози та/або тканинно специфічні сполуки для лікування метаболічних розладів, які не викликають тиреотоксичних побічних ефектів, опосередкованих TRα рецепторами. Таким чином, у спробі створити тиреоїдні ліганди специфічні до TRβ багато дослідників намагались синтезувати тиреоїдні міметики, де вивчали вплив різних первинних та не первинних кілець та замісників на них, як описано у US20050085541, US20040039028, WO2007003419, WO2006128056, WO200709913, US20010051645, US20020049226 та US20030040535, які усі включені у даному документі як посилання. До теперішнього часу, вважали, що T3 є більш біологічно активним, ніж T4 та зараз його th вважають домінантним активатором рецепторів гормону щитоподібної залози (Burger" 6 edition, vol 3, pp.564-565). В останнє десятиріччя виявили, що природні йодотироніни, відмінні від T3, проявляють біологічний вплив. Серед них, 3,5-дийодтиронін відповідає за швидкий коротко часовий вплив на окислювальний об'єм клітин та респіраторний рівень шляхом прямої взаємодії з зв'язувальними ділянками мітохондрій. Очевидні данні вказують на те, що вплив T2 не повністю співпадає з T3, але замість цього є специфічний вплив завдяки механізму незалежному від того впливу, що активізується T3 через рецептори гормонів щитоподібної залози (A. Lombardi. Immun Endoc and Metab Агентів in Med Chem (2006); 6: 255-65; WO200509433). Збільшувана кількість доказів вказує на те, що 3,5-дийодтиронін може викликати метаболічну нездатність, можливо шляхом стимулювання втрат енергії через механізм, який включає мітохондрії швидше ніж ядерні рецептори. Така дія T2 може потенційно привести до зменшення ожиріння та зменшення ваги тіла без викликання клінічного синдрому пов'язаного з тиреотоксичним станом, шляхом збільшення притоку жирних кислот у мітохондрії та окислення жирних кислот (A. Lombardi. Immun Endoc and Metab Агентів in Med Chem (2006); 6: 255-65; Horst C., Biochem J. (1989); 261: 945-950). З клінічної точки зору сценарій, який викликає високий рівень окислення жирних кислот, зменшує накопичення жиру, зниження рівнів холестерину та тригліцеридів у сироватці, зниження рівня себореї, зменшення ваги тіла без зниження споживання калорій/жиру є чудовою перспективою для важковиліковуємого ожиріння (A. Lombardi. Immun Endoc and Metab Агентів in Med Chem (2006); 6: 255-65). WO2005/009433 описує композицію 3,5 T2 у терапевтично ефективному дозуванні головним чином для лікування ожиріння, інфільтрація печінки та дисліпідемії. У резюме, тиреоїдні гормони та інші йодотироніни разом або окремо впливають на метаболізм фактично кожної клітини тіла. Ці гормони відіграють важливу фізіологічну роль, таку як підтримання ваги тіла, метаболічного рівня, температури тіла та настрою, та впливають на рівень ліпопротеїдів низької густини (ЛНГ) у сироватці тощо. Таким чином, гормони щитоподібної залози (T4, T3) можуть викликати зменшення ваги за допомогою підвищеного метаболічного рівня та зменшення холестерину ЛНГ завдяки як апрегуляції рецепторів ЛНГ, так і підвищеного метаболізму холестерину. Однак, гормон щитоподібної залози не має достатньо широкого терапевтичного вікна, особливо по відношенню до прискорення серцевої діяльності, щоб бути придатними для лікування розладів, таких як ожиріння та жирові розлади. Нещодавно з'ясували, що TRβ селективні агоністи можна використовувати як терапевтично ефективні засоби для зниження ваги та холестерину в плазмі без викликання шкідливого впливу на серце. Однак, нещодавно також з'ясували, що TR селективний агоніст викликає відповідь проліферації, таку як проліферація гепатоцитів та також викликає проліферацію панкреатичних ацинарних клітин (Amedeo columbano Endocrinology (2006);147(7): 3211-8). Також відомо, що T3 збільшує споживання їжі при малих дозуваннях у тварин незалежно від його впливу на ядро (Wing May Kong et al. Endocrinology (2004); 145: 5252-5258) та збільшення споживання енергії також показав T2 (Horst et al., J Endocrinology (1995); 145: 291-297) що може бути компенсуючим при лікуванні ожиріння. Таким чином, існує потреба у нових тиреоїдподібних сполуках, які є придатними для лікування метаболічних розладів, таких як ожиріння, резистентність до інсуліну, діабет, дисліпідемія, жирова інфільтрація печінки, метаболічний синдром, та розлади зміненої функції щитоподібної залози без небажаних наслідків, таких як тиреотоксикоз та збільшення споживання їжі. Відповідно, винахідники даного винаходу винайшли нові тиреоїдподібні сполуки, які демонструють корисність для лікування або запобігання хвороб або розладів, асоційованих з 4 UA 98962 C2 5 10 15 небажаною гормональною активністю щитоподібної залози, наприклад: 1) стан, асоційований з хворобою або розладом, асоційованим з надлишковим накопиченням жиру, зміненою мітохондріальною функцією 2) ожиріння 3) жирові розлади, викликані дисбалансом рівня жирів у крові або тканинах, такі як дисліпідемія, атеросклероз 4) знижена толерантність до глюкози 5) діабет типу ІІ 6) заміщувальна терапія 7) депресія 8) серцево-судинні хвороби та 9) розлади шкіри та значне уникання небажаного впливу тиреотоксикозу та збільшення споживання їжі. WO2007027842 стосується анілінопіразольних сполук, придатних для лікування діабету та пов'язаних розладів. US2004110816 описує певні інгібітори зворотної транскриптази похідних піразолу, придатних для лікування ВІЛ, та WO9716422 описує певні хромани та тіохромани, які проявляють ретиноїдподібну активність. Короткий опис фігур Фіг. 1 надає графічне зображення впливу досліджуваної сполуки В у OTТГ (оральний тест на толерантність до глюкози) Короткий опис суті винаходу Одним з варіантів втілення даного винаходу є сполука формули (I) R1 R4 z N R2 N R3 I 1 20 25 30 35 40 45 50 3 де, R та R є однаковими або різними, та незалежно вибрані з H, (C1-C6)-алкілу, (C3-C7)циклоалкілу, гало, CN, CF3, -O-(C1-C6)алкілу, -CO2-(C1-C6)алкілу, COOH, -CONH-(C1-C6)алкілу, 6 5 6 CONH-арилу, -NH2, -CONH-R , -CONR , -C1-C3алкіл-арилу, -(C1-C3)алкіл-R , -NH-(C1-C6)алкілу, 5 NH-арилу, -NH-SO2-(C1-C6)алкілу, -CH2-NH-(C1-C6)алкілу, -CH2-O-(C1-C6)алкілу, -C1-C3алкіл-NR , 6 7 R , R , де C1-C6алкіл та C3-C7-циклоалкіл є необов'язково заміщеними одним або кількома замісниками, вибраними з (C1-C6)алкілу, гало, ціано, -OH, оксо, -COOH, -O-(C1-C6)алкілу, -O5 бензолу, -COO-(C1-C6)алкілу, -CONH-(C1-C6)алкілу, -CONR , -CONH-арилу, -CONH-гетероарилу 5 або -CH2NR ; 2 R вибирають з (C1-C6)алкілу, (C3-C6)циклоалкілу, (C3-C6)алкенілу, (C3-C6)-алкінілу, -C(O)-(C1C3)алкіл-COOH, -(C1-C3)алкіл-COOH, -C(O)-(C1-C3)алкіл-COO-алкілу, -C(O)-C(O)O-(C1-C6)алкілу, 5 -C(O)-(C1-C3)алкіл-NH-(C1-C6)алкілу, -C(O)-O-(C1-C6)алкілу, -C(O)NR , -C(O)NH-(C1-C6)алкілу, 6 6 7 C(O)-(C1-C3)алкіларилу, -C(O)-(C1-C3)алкіл-R , R , R , де вказані (C1-C6)алкіл, (C3-C6)циклоалкіл, (C3-C6)алкеніл, (C3-C6)алкініл є необов'язково заміщеними одним або кількома замісниками, вибраними з пергалоалкілу, оксо, –C(O)OH, -C(O)-O-(C1-C3)алкілу, -C(O)-O-(C1-C3)алкіл-арилу, 6 6 5 C(O)-O-(C1-C3)алкіл-R , -CONH2, -CONH(C1-C3)алкілу, -C(O)NH-арилу, -C(O)NH-R , -CONR 8 CONHNH2, -C(=NH)NH-(C1-C6)алкілу, -C(=NH)NH2, C(=NH)NHOH, -C(O)-R , -C(O)NHSO2(C16 C6)алкілу, -C(O)NHSO2-арилу, -C(O)NHOH, -C(O)NHSO2-R , -C(O)NHNH-(C1-C6)алкілу, 6 5 C(O)NHNH-арилу, -CONH-(C1-C2)алкіл-арилу, -C(O)NH-(C1-C2)алкіл-R , -CH2NR , -NH2, -NH-(C1C6)алкілу, -NH-C(O)-O-(C1-C3)алкілу, -NH-C(O)-(C1-C3)алкілу, -NHC(O)-арилу, -NHC(O)-(C16 5 C3)алкіл-арилу, -NHC(O)-R , -NH-C(O)NR , -NH-C(O)NH-арилу, -NHC(O)NH-(C1-C6)алкілу, 6 NHSO2(C1-C6)алкілу, -NH-SO2-арилу, -NH-SO2-R , гало, ціано, -OH, -O-(C1-C6)алкіл, -O-арилу, -O6 гетероарилу, -O-(C1-C2)алкіл-арилу, -SO3H, -SO2NH-арилу, -SO2NH-R або -SO2NH-(C1-C6)алкілу, 6 7 R або R ; 5 R разом з атомом азоту, до якого він приєднаний утворює насичене або ненасичене (C 3-C6)членне кільце, яке може додатково містити 1-2 гетероатоми, вибрані з O, N або S та, які можуть бути необов'язково заміщеними одним або кількома замісниками, вибраними з оксо, -COOH, гало-OH, -O-(C1-C6)алкілу або -(C1-C6)алкілу; 6 R вибирають з фенілу або 5-8-членного гетероарилу, який містить 1-4 гетероатоми, вибрані з O, N або S, де вказане гетероарильне або фенольне кільце є необов'язково заміщеним одним або кількома замісниками, вибраними з галогену, -OH, -O-(C1-C6)алкілу, -пергалоалкілу, -(C1C6)алкілу, -(C3-C6)циклоалкілу, -SO2(C1-C6)алкілу, ціано, -COOH, -C(O)O-(C1-C6)алкілу, -C(O)OCH2-арилу, -C(O)O-арилу, -CONH(C1-C3)алкілу, нітро, -NH2, -NH-(C1-C6)алкілу, -NHC(O)-(C1C6)алкілу, -NHC(O)-арилу, -NHSO2(C1-C6)алкілу, -CONH2, -SO2-(C1-C6)алкілу, -NHSO2(C18 C6)алкілу або -COR ; 5 UA 98962 C2 7 5 R означає 3-6-членне гетероциклічне кільце, яке містить 1-4 гетероатоми, вибрані з O, N або S, та вказане гетероциклічне кільце є необов'язково заміщеним одним або кількома замісниками, вибраними з оксо, галогену, -O-(C1-C6)алкілу, -OH, -CF3, (C1-C6)алкілу, (C3C6)циклоалкілу, ціано, -COOH, -C(O)O-(C1-C6)алкілу, -C(O)O-CH2-арилу, -C(O)O-арилу, -NH2, NH-(C1-C6)алкілу, -NHC(O)-(C1-C6)алкілу, -NHC(O)-арилу, -CONH2, -SO2арил(C1-C6)алкілу, -SO28 (C1-C6)алкілу, -NHSO2(C1-C6)алкілу або -COR ; 8 R є амінокислотою, яка приєднується через її атом азоту; Z=O, CH2 або NH; 4 R вибирають з P, Q або T R9 R9 R11 G" R10 R10 G' R * R10 10 G" N [G"]n 10 * R10 Q P T 9 * 8 R вибирають з -OH, -O-алкілу, -OSO3H, галогену, -C(O)O-(C1-C6)алкілу, -C(O)NHR , -OC(O)5 (C1-C6)алкілу, -O-пергалоалкілу, -OC(O)O-(C1-C6)алкілу, -CONR ,-NHCO-(C1-C6)алкілу, -NHC(O)5 O--(C1-C6)алкілу, -NHC(O)-O-арилу, -NHSO2-(C1-C6)алкілу, -NHSO2-арилу, -NHCONR або; HOOC O O HO OH HO 15 20 25 30 10 R вибирають з H, галогену, (C1-C6)алкілу, алкокси, arілокси, -NHCO-(C1-C6)алкілу, -NHSO2(C1-C6)алкілу або -NH-SO2-арилу; 11 R означає -CO-(C1-C6)алкіл, -SO2-(C1-C6)алкіл або -SO2-арил; G' вибирають з H, галогену або (C1-C6)алкілу; G" вибирають з водню, (C1-C6)алкілу, (C3-C6)циклоалкілу, арилу, галогену, пергалоалкілу, 9 5 CN, CHO, -(C1-C3)алкіларилу, -(C1-C6)алкіл-O-(C1-C6)алкілу, -CH2R , -CH2арилу, -CH2NR , -COOH, 5 5 -C(O)O(C1-C6)алкілу, -CONH-(C1-C6)алкілу, -CONR , -SO2NR , -SO2NH-(C1-C6)алкілу, -SO2NHарилу; n може дорівнювати 1 або 2; включаючи їх фармацевтично прийнятні солі і їх гідрати, сольвати, атропоізомери, регіоізомери, енантіомери, діастереоізомери, таутомери, поліморфи та проліки, за умови що; 4 коли R означає Q, тоді 2 6 7 R відрізняється від R та R ; У іншому варіанті здійснення, даний винахід стосується наведеної вище сполуки, однак включає тільки її фармацевтично прийнятні солі. У іншому варіанті здійснення, даний винахід включає застосування сполуки формули (IA) для лікування хвороб, асоційованих з небажаною гормональною активністю щитоподібної залози, вибраних з ожиріння, резистентності до інсуліну, дисліпідемії, метаболічного синдрому, діабету типу ІІ, заміщувальної терапії у пацієнтів похилого віку з гіпотиреозом, депресії, серцево-судинних хвороб та розладів шкіри, шляхом введення терапевтично ефективної кількості сполуки у ссавців, включаючи людину: R4 R1 z N R2 N R3 35 IA 6 UA 98962 C2 1 5 10 15 20 25 30 35 40 3 де, R та R є однаковими або різними, та незалежно вибрані з H, (C 1-C6)алкілу, (C3C7)циклоалкілу, гало, CN, CF3, -O-(C1-C6)алкілу, -CO2-(C1-C6)алкілу, COOH, -CONH-(C1-C6)алкілу, 6 5 6 -CONH-арил, -NH2, -CONH-R , -CONR , -C1-C3алкіл-арилу, -(C1-C3)алкіл-R , -NH-(C1-C6)алкілу, 5 NH-арилу, -NH-SO2-(C1-C6)алкілу, -CH2-NH-(C1-C6)алкілу, -CH2-O-(C1-C6)алкілу, -C1-C3алкіл-NR , 6 7 R , R , де C1-C6алкіл та C3-C7-циклоалкіл є необов'язково заміщеними одним або кількома замісниками, вибраними з (C1-C6)алкілу, гало, ціано, -OH, оксо, -COOH, -O-(C1-C6)алкілу, -O5 бензолу, -COO-(C1-C6)алкілу, -CONH-(C1-C6)алкілу, -CONR , -CONH-арилу, -CONH-гетероарилу 5 або -CH2NR ; 2 R вибирають з (C1-C6)алкілу, (C3-C6)циклоалкілу, (C3-C6)алкенілу, (C3-C6)-алкінілу, -C(O)-(C1C3)алкіл-COOH, -(C1-C3)алкіл-COOH, -C(O)-(C1-C3)алкіл-COO-алкілу, -C(O)-C(O)O-(C1-C6)алкілу, 5 -C(O)-(C1-C3)алкіл-NH-(C1-C6)алкілу, -C(O)-O-(C1-C6)алкілу, -C(O)NR , -C(O)NH-(C1-C6)алкілу, 6 6 7 C(O)-(C1-C3)алкіларилу, -C(O)-(C1-C3)алкіл-R , R , R , де вказані (C1-C6)алкіл, (C3-C6)циклоалкіл, (C3-C6)алкеніл, (C3-C6)алкініл є необов'язково заміщеними одним або кількома замісниками, вибраними з пергалоалкілу, оксо, –C(O)OH, -C(O)-O-(C1-C3)алкілу, -C(O)-O-(C1-C3)алкіл-арилу, 6 6 5 C(O)-O-(C1-C3)алкіл-R , -CONH2, -CONH(C1-C3)алкілу, -C(O)NH-арилу, -C(O)NH-R , -CONR 8 CONHNH2, -C(=NH)NH-(C1-C6)алкілу, -C(=NH)NH2, C(=NH)NHOH, -C(O)-R , -C(O)NHSO2(C16 C6)алкілу, -C(O)NHSO2-арилу, -C(O)NHOH, -C(O)NHSO2-R , -C(O)NHNH-(C1-C6)алкілу, 6 5 C(O)NHNH-арилу, -CONH-(C1-C2)алкіл-арилу, -C(O)NH-(C1-C2)алкіл-R , -CH2NR , -NH2, -NH-(C1C6)алкілу, -NH-C(O)-O-(C1-C3)алкілу, -NH-C(O)-(C1-C3)алкілу, -NHC(O)-арилу, -NHC(O)-(C16 5 C3)алкіларилу, -NHC(O)-R , -NH-C(O)NR , -NH-C(O)NH-арилу, -NHC(O)NH-(C1-C6)алкілу, 6 NHSO2(C1-C6)алкілу, -NH-SO2-арилу, -NH-SO2-R , гало, ціано, -OH, -O-(C1-C6)алкілу, -O-арилу, 6 O-гетероарилу, -O-(C1-C2)алкіл-арилу, -SO3H, -SO2NH-арилу, -SO2NH-R або -SO2NH-(C16 7 C6)алкілу, R або R ; 5 R разом з атомом азоту до якого він приєднаний утворюють насичене або ненасичене (C 3C6)-членне кільце, яке може додатково містити 1-2 гетероатоми, вибрані з O, N або S та які можуть бути необов'язково заміщеними одним або кількома замісниками, вибраними з оксо, COOH, гало, -OH, -O-(C1-C6)алкілу або -(C1-C6)алкілу; 6 R вибирають з фенілу або 5-8 членного гетероарилу, який містить 1-4 гетероатоми, вибрані з O, N або S, де вказане гетероарильне або фенольне кільце є необов'язково заміщеним одним або кількома замісниками, вибраними з галогену, -OH, -O-(C1-C6)алкілу, -пергалоалкілу, -(C1C6)алкілу, -(C3-C6)циклоалкілу, -SO2(C1-C6)алкілу, ціано, -COOH, -C(O)O-(C1-C6)алкілу, -C(O)OCH2-арилу, -C(O)O-арилу, -CONH(C1-C3)алкілу, нітро, -NH2, -NH-(C1-C6)алкілу, -NHC(O)-(C1C6)алкілу, -NHC(O)-арилу, -NHSO2(C1-C6)алкілу, -CONH2, -SO2-(C1-C6)алкілу, -NHSO2(C18 C6)алкілу або -COR ; 7 R означає 3-6 членне гетероциклічне кільце, яке містить 1-4 гетероатоми, вибрані з O, N або S, та вказане гетероциклічне кільце є необов'язково заміщеним одним або кількома замісниками, вибраними з оксо, галогену, -O-(C1-C6)алкілу, -OH, -CF3, (C1-C6)алкілу, (C3C6)циклоалкілу, ціано, -COOH, -C(O)O-(C1-C6)алкілу, -C(O)O-CH2-арилу, -C(O)O-арилу, -NH2, NH-(C1-C6)алкілу, -NHC(O)-(C1-C6)алкілу, -NHC(O)-арилу, -CONH2, -SO2арил(C1-C6)алкілу, -SO28 (C1-C6)алкілу, -NHSO2(C1-C6)алкілу або -COR ; 8 R означає амінокислоту, яка приєднана через її атом азоту; Z=O, CH2 або NH; 4 R вибирають з P, Q або T R9 R9 R11 G" R10 R10 G' R * R10 P 45 G" N [G"]n 10 * R10 Q T 9 * 8 R вибирають з -OH, -O-алкілу, -OSO3H, галогену,-C(O)O-(C1-C6)алкілу, -C(O)NHR , -OC(O)5 (C1-C6)алкілу, -O-пергалоалкілу, -OC(O)O-(C1-C6)алкілу, -CONR ,-NHCO-(C1-C6)алкілу, -NHC(O)5 O--(C1-C6)алкілу, -NHC(O)-O-арилу, -NHSO2-(C1-C6)алкілу, -NHSO2-арилу, -NHCONR або; 7 UA 98962 C2 HOOC HO O O OH HO 10 5 10 15 20 25 30 35 40 45 50 55 R вибирають з H, галогену, (C1-C6)алкілу, алкокси, арилокси, -NHCO-(C1-C6)алкілу, -NHSO2(C1-C6)алкілу або -NH-SO2-арилу; 11 R означає H, (C1-C6)алкіл, -CO-(C1-C6)алкіл, -SO2-(C1-C6)алкіл або -SO2-арил; G' вибирають з H, галогену або (C1-C6)алкілу; G" вибирають з водню, (C1-C6)алкілу, (C3-C6)циклоалкілу, арилу, галогену, пергалоалкілу, 9 5 CN, CHO, -(C1-C3)алкіларилу, -(C1-C6)алкіл-O-(C1-C6)алкілу, -CH2R , -CH2арилу, -CH2NR , -COOH, 5 5 -C(O)O(C1-C6)алкілу, -CONH-(C1-C6)алкілу, -CONR , -SO2NR , -SO2NH-(C1-C6)алкілу, -SO2NHарилу; n може дорівнювати 1 або 2; включаючи їх фармацевтично прийнятні солі та їх гідрати, сольвати, атропоізомери, регіоізомери, енентіомери, діастереомери, таутомери, поліморфи та проліки. У іншому варіанті здійснення, даний винахід включає синтетичні проміжні сполуки, придатні отримуючи сполук формули (I), та спосіб отримання таких проміжних сполук. У іншому варіанті здійснення даний винахід стосується способу одержання сполуки формули (I) як описано на Схемі 1, 2 та 3. У іншому варіанті здійснення даний винахід стосується фармацевтичної композиції, яка містить сполуку формули (I), необов'язково домішок з фармацевтично активною добавкою, розчинником або носієм. У іншому варіанті здійснення даний винахід стосується способу лікування ожиріння шляхом ведення сполуки формули (I) ссавцю, який цього потребує. У іншому варіанті здійснення даний винахід стосується способу зменшення резистентності до інсуліну та/або попередження або затримки розвитку вираженого діабету шляхом введення сполуки формули (I) ссавцю, який цього потребує. У іншому варіанті здійснення даний винахід стосується способу попередження та лікування дисліпідемії шляхом введення сполуки формули (I) ссавцю, який цього потребує. У іншому варіанті здійснення даний винахід стосується способу попередження та лікування метаболічного синдрому шляхом введення сполуки формули (I) ссавцю, який цього потребує. У іншому варіанті здійснення даний винахід стосується застосування сполуки формули (I) для одержання лікарської речовини для лікування ожиріння. У іншому варіанті здійснення даний винахід стосується застосування сполуки формули (I) для одержання лікарської речовини для зменшення резистентності до інсуліну та/або запобігання або затримання розвитку вираженого інсуліну. У іншому варіанті здійснення даний винахід стосується застосування сполуки формули (I) для одержання лікарського засобу для попередження та лікування дисліпідемії. У іншому варіанті здійснення даний винахід стосується застосування сполуки формули (I) для одержання лікарського засобу для попередження та лікування метаболічного синдрому. У ще одному варіанті здійснення, даний винахід стосується способу лікування захворювання, асоційованого з небажаною активністю гормону щитоподібної залози без значного пригнічення апетиту шляхом введення терапевтично ефективної кількості тиреоїдподібної сполуки. У ще одному варіанті здійснення, даний винахід стосується способу лікування захворювання, асоційованого з небажаною активністю гормону щитоподібної залози без значного пригнічення апетиту шляхом введення терапевтично ефективної кількості сполуки формули (IA). Детальний опис винаходу Визначення Наступні визначення стосуються термінів, використаних по всьому опису, доки не вказано інше. Термін "тиреоїднподібні сполуки", як застосовують у даному документі, означає сполуки подібні до дийодтироніну, які діють подібно до гормону щитоподібної залози, проте не викликають токсичного впливу тиреоїдного гормону. Термін "ліганд рецептору щитоподібної залози" або "ліганд щитоподібної залози" як застосовують у даному документі включає будь-яку хімічну сполуку, яка може приєднуватись до рецептору щитоподібної залози. Ліганд може діяти як антагоніст, агоніст, частковий антагоніст або частковий агоніст. 8 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "рецептор щитоподібної залози" як застосовують у даному документі означає молекулу, яка отримує гормон щитоподібної залози та дозволяє йому увійти в ядро клітини та, який функціонує як гормон-активований фактор транскрипції та діє шляхом регулювання експресії генів. THRs зв'язує ДНК при відсутності гормону, що зазвичай пригнічує транскрипцію генів. Зв'язування гормону викликає конформаційні зміни у рецепторі, що дозволяє активувати транскрипцію. Термін "сполука", який застосовують у даному документі, стосується будь-якої сполуки, яка входить у загальну формулу, описану у даному документі. Сполуки, описані у даному документі, можуть містити один або кілька подвійних зв'язків та тому можуть існувати як стереоізомери, такі як ізомери по подвійному зв'язку (наприклад, геометричні ізомери). Відповідно, хімічні структури, зображені у даному документі, включають всі можливі стереоізомери проілюстрованих сполук, включаючи стереохімічно чисті форми (наприклад, геометрично чисті) та стереохімічні суміші. Сполуки також можуть існувати у декількох таутомерних формах, включаючи енольну форму, кето форму та їх суміші. Відповідно, хімічні структури, зображені у даному документі, включають всі можливі таутомерні форми проілюстрованих сполук. Описані сполуки також включають ізотопно мічені сполуки, де один або кілька атомів мають атомну масу, яка відрізняється від атомної маси наявної у природі. Приклади ізотопів, які можуть бути 2 3 13 14 15 18 17 включеними в сполуки винаходу включають, проте не обмежуються H, H, C, C, N, O, O. Сполуки можуть існувати як у несольватованих формах, так і в сольватованих формах, включаючи гідратовані форми. Загалом, сполуки можуть бути гідратованими або сольватованими. Певні сполуки можуть існувати у численних кристалічних або аморфних формах. Загалом, всі фізичні форми є еквівалентними для використання у даному документі та входять у рамки даного винаходу. Термін "регіоізомери" є відомим для фахівців у галузі терміном, та розглядається у таких підручниках як Organic Synthesis, Smith, M., (McGraw Hill), який визначає регіостереоізомер як "дві або кілька молекул з однаковою емпіричною формулою, проте з різним приєднанням атомів (різний зв'язок)”. Термін "атропоізомер" як застосовують у даному документі стосується стереоізомеру, де хіральний атом розташовано у площині молекули або осі. Також слід розуміти, що коли ілюструють часткову структури сполуки, то рисочка (“ - ”) або зірочка “*” означає місце приєднання часткової структури до іншої частини молекули. Номенклатура сполук даного ® винаходу як зазначено у даному документі відповідає MDL ISIS Draw Version 2.2. "Фармацевтично прийнятні солі" включають похідні описаних сполук, де материнську сполуку модифікують шляхом утворення нетоксичної кислоти та її кислотно-адитивних солей та також стосується фармацевтично прийнятних сольватів, включаючи гідрати таких сполук та таких солей. Приклади фармацевтично прийнятних солей включають, проте не обмежуються, неорганічними та органічними кислотно-адитивними солями основних залишків, таких як аміни; лужними або органічними адитивними солями кислотних залишків, таких як карбонові кислоти; тощо, та комбінаціями, які включають одну або кілька з вищенаведених солей. Фармацевтично прийнятні солі включають нетоксичні солі та четвертинні солі амонію материнської сполуки, наприклад, з нетоксичних неорганічних або органічних кислот. Наприклад, нетоксичні кислотні солі включають ті, що походять від неорганічних кислот, таких як хлорводнева, бром-воднева, сірчана, сульфамінова, фосфорна, азотна тощо; інші прийнятні неорганічні солі включають солі металів, такі як сіль натрію, калію, цезію тощо; та солі лужно-земельних металів, таких як сіль кальцію, магнію, тощо, та комбінації, які містять одну або кілька вищенаведених солей. Фармацевтично прийнятні органічні солі включають солі, отримані з органічних кислот, таких як оцтова, трифтороцтова, пропіонова, бурштинова, гліколева, стеаринова, молочна, оксибурштинова, тартарова, лимонна, аскорбінова, памоїнова, малеїнова, гідроксималеїнова, фенілоцтова, глутамінова, бензойна, саліцилова, метансульфонова, етансульфонова, бензолсульфонова, сульфанілова, 2-ацетоксибензойна, фумарова, толуолсульфонова, метансульфонова, етандисульфонова, щавлева, ізотіонова, HOOC-(CH2)n-COOH, де n дорівнює 0-4, тощо; органічні аміно солі, такі як сіль триетиламіну, триетаноламіну, дициклогексиламіну, N, N'-дибензолетилeндіаміну тощо; та солі амінокислот таких як аргінат, аспаргінат, глутамат тощо; та комбінації, які містять одну або кілька вищевказаних солей. Термін "алкіл" використовують як самого по собі, так і разом з іншою групою, яка відноситься до насиченого аліфатичного вуглеводневого радикалу, який має визначену кількість атомів вуглецю та, який є незаміщеним або необов'язково заміщеним. Коли нижній індекс використовують по відношенню до алкілу іншої групи, то нижній індекс стосується кількості атомів вуглецю, яких може містити група. Наприклад, "C 1-C6-алкіл" стосується будь-якої 9 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 алкільної групи, яка містить від 1 до 6 атомів вуглецю у структурі. Алкіл може мати або прямий ланцюг, або бути розгалуженим. 1Термін "алкеніл", використаний як сам по собі, так і разом з іншою групою, відноситься до ненасиченого (═) аліфатичного вуглеводневого радикалу, який містить вказане число атомів та, який є незаміщеним або необов'язково заміщеним. Коли нижній індекс використовують по відношенню до алкілу іншої групи, то нижній індекс стосується кількості атомів вуглецю, яких може містити група. Наприклад, "C1-C6-алкеніл" стосується будь-якої алкільної групи, яка містить від 1 до 6 атомів вуглецю у структурі. Алкеніл може мати або прямий ланцюг, або бути розгалуженим. Термін "алкініл", використаний як сам по собі, так і разом з іншою групою, відноситься до ненасиченого (≡) аліфатичного вуглеводневого радикалу, який містить вказане число атомів та який є незаміщеним або необов'язково заміщеним. Коли нижній індекс використовують по відношенню до алкілу іншої групи, то нижній індекс стосується кількості атомів вуглецю, яких може містити група. Наприклад, "C 3-C6-алкініл" стосується будь-якої алкінільної групи, яка містить від 3 до 6 атомів вуглецю у структурі. Алкініл може мати або прямий ланцюг, або бути розгалуженим. "Циклоалкіл" відноситься до насиченого аліфатичного вуглеводневого радикалу, який має визначену кількість атомів вуглецю та, який є незаміщеним або необов'язково заміщеним. Коли нижній індекс використовують по відношенню до алкілу іншої групи, то нижній індекс стосується кількості атомів вуглецю, яких може містити група. Наприклад, "C3-C6-циклоалкіл" стосується будь-якої циклоалкільної групи, яка містить від 3 до 6 атомів вуглецю у структурі. Термін "арил" стосується ароматичної групи, наприклад, яка є 6-10 членною моноциклічною або біциклічною системою, яка може бути заміщеною або незаміщеною. Арильні групи можуть бути фенілом, нафтилом тощо. Коли вказане кільце є заміщеним, замісники вибирають з галогену (наприклад, F, Cl, Br, I), гідрокси, алкокси, нітро, карбонової кислоти, CF3, NHSO 2алкілу, NHCO-алкілу, алкілу, алкенілу, алкінілу, циклоалкілу та ацилу. Термін "гетероарил" як застосовують у даному документі, стосується ароматичної групи, наприклад, яка є 5-10 членною моноциклічною або біциклічною системою, яка містить щонайменше один гетероатом та щонайменше одне кільце, що містить атом вуглецю. Гетероарильна група може приєднувати до будь-якого вільного атому азоту або вуглецю будьякого кільця. Моноциклічні гетероарильні групи включають піроліл, піразоліл, піразолiнил, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, ізотіазоліл, фураніл, тіеніл, оксадіазоліл, тетразоліл, тріазоліл, піридил, піразиніл, піримідиніл, піридазиніл, триазиніл тощо. Біциклічні гетероарильні групи включають індоліл, бензотіазоліл, бензодіоксоліл, бензоксазоліл, бензотіеніл, хінолінил, ізохінолінил, бензімідазоліл, цинолінил, хіноксалінил, індазоліл, піролопіридил, фуропіридиніл тощо. “Алкокси" стосується алкільної групи як вказано вище, приєднаної до материнського молекулярного залишку за допомогою кисню. Типові алкокси радикали включають метокси, етокси, н-пропокси, н-бутокси, н-пентилокси, н-гексилокси, втор-бутокси, трет-бутокси, третпентилокси тощо. Як вказано у даному документі, термін "гало" або "галоген" означає фтор, хлор, бром або йод групу. 1 2 Всі замісники (R , R ….) та їх подальші замісники можуть бути приєднані до головної структури до будь-якого гетероатому або атому вуглецю, що приводить до утворення стабільної сполуки. Як вказано у даному документі, термін "ссавці" означає людину або тварину, таку як мавпи, примати, собаки, коти, коні, корови тощо. Як вказано у даному документі, термін "поліморфи" стосується сполук які мають однакову хімічну формулу, однаковий тип солі та, які мають однакову форму гідрату/сольвату, проте які мають різні кристалографічні властивості. Як вказано у даному документі, термін "гідрати" стосується сполуки, де до молекули приєднані декілька молекул води. Як вказано у даному документі, термін "сольвати" стосується сполуки, де до молекули приєднані декілька молекул розчинника. Даний винахід також включає проліки сполук винаходу, тобто вторинних сполук перетворених на первинні in vivo. Естери, які розкладаються іn vivo є тільки одним типом пролікарської речовини вихідної молекули. Естер, сполуки даного винаходу, який гідролізується in vivo (або розкладається) та містить карбоксильну групу є, наприклад, фармацевтично прийнятний естер, який гідролізується у тілі людини або тварини з утворенням вихідної кислоти. Придатні фармацевтично прийнятні 10 UA 98962 C2 5 10 15 естери для карбокси включають C1-C8-алкоксиметил естери, наприклад, метоксиметил, C1-C8алканоїлоксиметиловий естер, наприклад, півалоїлоксиметил; фталідилові естери; C 3-C8циклоалкоксикарбонілокси-C1-C8 -алкілові естери, наприклад, 1-циклогексилкарбонілоксиетил; 1,3-діоксолен-2-онілметилові естери, наприклад, 5-метил-1,3-діоксолен-2-oнілметил; та C1-C8алкоксикарбонілоксиетилові естери, наприклад, 1-метоксикарбонілоксиметил; та можуть бути утворені у будь-якій карбоксильній групі у сполуках даного винаходу. У контексті даного опису, термін "лікувати" або "лікування" також включає "профілактику" доки не вказано протилежне. Термін "лікувати" або "лікування" у контексті даного винаходу також включає введення терапевтично ефективної кількості сполуки даного винаходу, для полегшення або стану до захворювання, хронічного або гострого, або періодичного стану. Це визначення також включає профілактичну терапію для запобігання періодичного стану та пролонгованої терапії для хронічних розладів. Вираз "терапевтично ефективна кількість" означає кількість сполуки, яка при введенні пацієнту для лікування хвороби, має достатній валив на хворобу. "Терапевтично ефективна кількість" сполуки дуже сильно залежить від сполуки, шляху введення, хвороби та важкості стану та віку, ваги пацієнта, що лікують тощо. Термін "включає" означає "містить", проте не обмежується цим значенням. Таким чином, інші інгредієнти, носії та добавки можуть бути присутніми. У одному варіанті здійснення, даний винахід стосується сполуки формули (I) R1 R4 z N R2 N R3 20 25 30 35 40 45 50 I 1 2 3 4 де, R , R , R , Z та R є такими як визначено вище. Винахід також стосується фармацевтично прийнятних солей та їх гідратів, сольватів, атропоізомерів, регіоізомерів, енантіомерів, діастереоізомерів, таутомерів, поліморф та їх проліків. У одному з переважних варіантів здійснення даного винаходу він стосується сполуки 1 2 3 4 формули (I) вказаної вище, де R , R , R та Z є такими як визначено вище, та R вибирають з P або T. Фармацевтична композиція У іншому варіанті здійснення винахід стосується фармацевтичної композиції, яка містить терапевтично ефективну кількість однієї або кількох сполук формули (I). Можливо вводити терапевтично ефективну кількість сполук формули (I) або індивідуально, або у комбінації, безпосередньо без будь-якої композиції, звичайною практикою є введення сполуки у формі фармацевтичних лікарських форм, які містять фармацевтично прийнятні наповнювач(і) та щонайменше один активний інгредієнт. Ці лікарські форми можна вводити різними шляхами включаючи оральний, місцевий, трансдермальний, підшкірний, внутрішньом'язовий, внутрішньовенний, інтраназальний, легеневий тощо. Оральні композиції можуть існувати у формі твердої речовини або рідкої лікарської форми. Тверда лікарська форма включає пігулки, упакування, саше або окремі одиниці такі як таблетки, багаточастинкові форми, капсули (м'який та твердий желатин) тощо. Рідкі лікарські форми включають еліксири, суспензії, емульсії, розчини, сиропи тощо. Композиція для орального застосування одержують за будь-яким відомим способом у галузі для виготовлення композиції, та такі фармацевтичні композиції можуть містити на додаток до активних інгредієнтів наповнювачі, такі як розчинники, розріджувачі, зв'язувальні речовини, солюбілізатори, лубріканти, гліданти, поверхнево-активні речовини, суспендувальні агенти, емульгатори, хелатні агенти, консерванти, агенти що надають присмаку, підсолоджувачі, барвники тощо. Деякі приклади придатних наповнювачів включають лактозу, целюлозу та їх похідні, такі як мікрокристалічна целюлоза, метилцелюлоза, гідроксипропілметилцелюлоза, етилцелюлоза, фосфат кальцію, манітол, крохмаль, желатин, полівініл піролідон, різноманітні смоли такі як гуміарабік, адрагант, ксантан, альгінати та їх похідні, сорбіт, декстроза, ксиліт, стеарат магнію, тальк, колоїдний діоксид кремнію, неорганічна олія, гліцерил моностеарат, гліцерину бегенат, 11 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 натрію крохмаль гліколат, кросповідон, поперечнозшита карбоксиметилцелюлоза, різноманітні емульгатори, такі як поліетилeнгліколь, естери сорбіту і жирної кислоти, алкілові етери поліетиленгліколю, цукрові естери, поліоксиетилен поліоксипропіл блок-співполімери, поліетоксильовані жирнокислотні моноестери, диестери та їх суміші. Стерильні композиції для введення одержують згідно з звичайною фармацевтичною практикою шляхом розчинення або суспендування активної сполуки у наповнювачі, такому як вода для ін'єкцій, N–метил-2-піролідон, пропіленгліколь та інші гліколі, спирти, рослинні олії наявні у природі, такі як кунжутна олія, кокосова олія, арахісова олія, бавовнева олія або синтетичний жирний наповнювач, такий як етилолеат тощо. Буфери, антиоксиданти, консерванти, комплексоутворюючі агенти, такі як похідні целюлози, пептиди, поліпептиди та циклодекстрини тощо можуть бути включеними у разі потреби. Лікарська форма може бути з повільним, уповільненим або контрольованим вивільненням активних інгредієнтів на додаток до лікарських форм з миттєвим вивільненням. Кількість активного інгредієнту, потрібна для досягнення терапевтичного ефекту, звісно змінюється в залежності від певної сполуки, шляху введення, пацієнта та певної хвороби або розладу, що потребує лікування. Сполуки винаходу можна вводити орально або парентерально у дозі від 0,001 дo 1500 мг/кг на день, бажано від 0,01 дo 1500 мг/кг на день, більш бажано від 0,1 дo 1500 мг/кг на день, найбільш бажано від 0,1 дo 500 мг/кг на день. Для дорослих людей доза знаходиться в діапазоні від 5 мг до 35 г на день та бажано від 5 мг до 2 г на день. Таблетки або інші лікарські форми, які вводять як окрему одиницю, можуть містити таку кількість сполуки винаходу, яка є ефективною у такій лікарській формі або декількох таких формах, наприклад, одиниці, які містять 5 мг дo 500 мг. У той час як сполуку винаходу можна використовувати як окремий активний інгредієнт, також можливо її застосування у комбінації з одним або кількома іншими активними інгредієнтами. Такими іншими активними інгредієнтами можуть бути інші сполуки винаходу або інші терапевтичні агенти, наприклад, агенти проти ожиріння або проти дисліпідемії, або інші терапевтично активні агенти. Сполуки даного винаходу можна застосовувати у комбінації з одним або кількома придатними терапевтичними агентами, вибраними з групи, яка складається з гіполіпідемічних агентів, проти-атеросклеротичних агентів, проти-діабетичних агентів, агентів проти остеопорозу, агентів проти ожиріння, агентів проти страху, антидепресантів, анти-гіпертензивних агентів, серцевих глікозидів, пригнічувачів апетиту, агентів що сприяють росту, агентів для лікування розладів шкіри, інгібіторів резорбції кісток та міметиків щитоподібної залози. Приклади придатних гіполіпідемічних агентів для застосування у комбінації зі сполуками даного винаходу включають проте не обмежуються наступними: інгібітор MTP, інгібітор HMG CoA редуктази, інгібітор скваленсинтетази, похідні фіброєвої кислоти, інгібітор ACAT, інгібітори ліпоксигенази, інгібітор абсорбції холестерину, інгібітор клубового співтарнспортеру Na+/жовчна кислота, апрегулятори ЛНГ рецептору, інгібітор білку, що переносить холестериновий естер (CETP), речовина, що підсилює екскрецію жовчних кислот, агоніст рецептору, який активується проліфератором пероксисом (PPAR)-альфа, агоніст рецептору, який активується проліфератором пероксисом (PPAR)-дельта, подвійний агоніст рецептору, який активується проліфератором пероксисом (PPAR)-гама/дельта, подвійний агоніст рецептору, який активується проліфератором пероксисом (PPAR)-альфа/дельта та/або нікотинова кислота та її похідні, або їх фармацевтично прийнятні солі. Приклади придатних проти-діабетичних агентів для застосування у комбінації з сполуками даного винаходу включають проте не обмежуються наступними: бігуанід, такий як метформін, фенформін, сульфонілсечовина, така як гліклазид, інгібітор альфа-глюкозидази, PPARγ агоніст, такий як тіазолідинедіони, PPARα агоніст, такий як фіброєвої кислоти похідні, інгібітор альфаамілази, інгібітор окислення жирних кислот, A2 антагоніст, PPARδ агоніст або антагоніст, PPARα/γ подвійний агоніст, інгібітор aP2, інгібітор дипептидил пептидази IV (DP4), інгібітор SGLT2, інгібітор глікоген фосфори лази, глюкагон подібний пептид-1 (GLP-1) та його аналоги, активатор глюкокінази, агоніст VPAC2 рецептору, інгібітор PTP-1B (протеїн тирозин фосфатаза1B), інгібітор 11β-HSD 1 (11β-гідрокси-стероїд дегідрогеназа 1), меглітинід, антагоніст глюкокортикоїду (GR) також як інсулін або його фармацевтично прийнятна сіль. Приклади придатних агентів проти остеопорозу для застосування у комбінації з сполуками даного винаходу включають проте не обмежуються алендронатом, різедронатом, PTH, фрагментом PTH, ралоксифеном, кальцитоніном, антагоністами RANK ліганду, антагоністами рецепторів чутливих до кальцію, TRAP інгібітори, селективними модуляторами рецептору естрогену (SERM) та AP-1 інгібіторами або їх фармацевтично прийнятними солями. 12 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади придатних агентів проти ожиріння для застосування у комбінації з сполуками даного винаходу включають проте не обмежуються інгібітором 5HT (серотонін) транспортеру, інгібітор NE (норпінефрин) траспортеру, CB-1 (рецептор канабіноїду-1) антагоніст/зворотній агоніст, антагоніст грелину, H3 (гістамін H3) антагоніст/зворотній агоніст, антагоніст NPY1 (нейропептид Y Y1), агоніст NPY2 (нейропептид Y Y2), антагоніст NPY5 (нейропептид Y Y5), лептин або його похідні, опіоїдний антагоніст, антагоніст орексину, агоніст BRS3 (рецептор бомбезину підтип 3), агоніст CCK-A (холецистокінин-A), CNTF (війчастий нейротрофічний фактор), CNTF похідна, агоніст GHS (рецептор стимулятору секреції гормону росту), агоніст 5HT2c (рецептор серотоніну 2c), агоніст Mc3r (рецептор меланокортину 3), агоніст Mc4r (рецептору меланокортину 4), інгібітор повторного захвату моноаміну, агоніст β3 (бета адренергічний рецептор 3), інгібітор DGAT1 (діацилгліцерол ацилтрасферази 1), інгібітор DGAT2 (діацилгліцерол ацилтрасферази 2), інгібітор FAS (синтази жирних кислот), інгібітор PDE (фосфодіестерази), β агоніст гормону щитоподібної залози, UCP-1 (роз'єднувальний білок 1), 2 або 3 активатор, антагоніст глюкокортикоїду, інгібітор SCD-1 (стеароїл-CoA дезатурази-1), інгібітор ліпази, інгібітор транспортеру жирних кислот, інгібітор траспортеру дикарбоксилату, аноректичний агент, такий як дексамфетамін, фентермін, фенілпропаноламін або мазиндол або їх фармацевтично прийнятні солі. Сполуки даного винаходу можна комбінувати з стимуляторами росту, такими як TRH, діетилстилбестерoл, теофілін, енкефаліни, простагландини E серій або їх фармацевтично прийнятні солі, проте не обмежуються ними. Сполуки даного винаходу також можна застосовувати у комбінації з стимуляторами секреції гормону росту, такими як GHRP-6, GHRP-1, GHRP-2 або з фактором вивільнення гормону росту та його аналогами або гормоном росту або соматомединами, включаючи IGF-1 та IGF-2, або з альфа-адренергічними агоністами, такими як 5-HTD агоністи клонідину або серотоніну, такі як суматриптан, або агентами, які інгібують соматостатин або його вивільнення, такими як фізостигмін та піридостигмін. Також описані сполуки винаходу використовують у комбінації з гормоном паращитоподібної залози, PTH(1-34) або бісфосфонатами, такими як MK-217 (алендронат). Приклади придатних агентів проти страху для застосування у комбінації зі сполуками даного винаходу включають діазепам, лоразепам, буспірон, оксазепам та гідроксизин памоат тощо. Приклади придатних антидепресантів для застосування у комбінації зі сполуками даного винаходу включають циталопрам, флуоксетин, нефазодон, сертралін, пароксетин тощо. Приклади придатних проти-гіпертензивних агентів для застосування у комбінації зі сполуками даного винаходу включають проте не обмежуються інгібітором ангіотензин перетворюючого ферменту (ACE), інгібітором реніну, блокатором бета адренергічного рецептору, блокатором альфа адренергічного рецептору, блокатором кальцієвого каналу, активатором калієвого каналу, інгібітором альдостеронсинтази, інгібітором нейтральної ендопептидази (NEP), інгібітором подвійної фермент перетворюючої/нейтральної ендопептидази (ACE/NEP), антагоністом рецептору ендотеліну, антагоністом подвійного ангіотензину та рецептору ендотеліну (DARA), диуретиком або його фармацевтично прийнятною сіллю. Приклади придатних серцевих глікозидів для застосування у комбінації зі сполуками даного винаходу включають дигіталіс та уабаін. Приклади придатних міметиків щитоподібної залози для застосування у комбінації зі сполуками даного винаходу включають, проте не обмежуються KB-2115, MB07811 або їх фармацевтично прийнятними солями. Для лікування розладів шкіри або вищеописаних хвороб застосовують сполуки даного винаходу самих по собі або необов'язково у комбінації з ретиноїдом, таким як третиноїн або аналог вітаміну D. Вищенаведені терапевтичні агенти, при застосуванні у комбінації із сполуками даного винаходу, можна застосовувати, наприклад, у кількостях вказаних у Physicians' Desk Reference (PDR) або як визначено спеціалістом галузі. Коли сполуки винаходу вводять у комбінації з одним або кількома іншими терапевтичними агентами, їх вводять або одночасно, послідовно або у встановленій лікарській формі. Скорочення TSH – тиреоїди-стимулюючий гормон, також відомий як тиреотропін, T4 – тироксин, T3 - трийодтиронін, T2 - дийодтиронін, rT3 – зворотна T3, 13 UA 98962 C2 5 SAR – залежність активності від структури, NPY - нейропептид Y. Реакційні схеми для синтезу сполук винаходу На наступній схемі, реакційні схеми наведені для синтезу сполук згідно з іншим варіантом здійснення даного винаходу. Схема 1 1 10 15 20 25 30 2 3 4 де R , R , R , R та Z є такими як визначено вище та Y означає гало або будь-яку іншу групу, що відходить. У певному варіанті здійснення, сполуки формули (I) отримують з похідних піразолу формули (II) або дике то похідних формули (III) як показано на схемі-1. Похідні формули (II) взаємодіють з заміщеним алкілгалідом або будь-якою іншою алкіл похідною, яка містить придатну групу, що відходить, у присутності основи, вибрані з метал гідриду або метал карбонату, у полярному розчиннику, такому як тетрагідрофуран, отримуючи сполук формули (I). Також, дикетопохідна формули (III) за допомогою взаємодії з заміщеними похідними гідразину у спиртовому розчиннику дають сполуку формули (I). Сполуки формули (II) отримують шляхом обробки сполук формули (III) як показано на Схемі 1, з гідразин гідратом в умовах відомих з літературних джерел. Сполуку формули (III) одержуються зі сполуки формули (IV) шляхом її взаємодії з заміщеними гідроксиінданами формули (XII), (XIV), (XVI) або (XVII) або з гідроксиліндолами у присутності основи, такої як метал карбонат у полярному апротонному розчиннику, такому як тетрагідрофуран. Сполуки формули (IV) можна отримувати з дикето похідної формули (V) шляхом розчинення у придатному розчиннику, такому як ацетонітрил у присутності придатного реагенту, такого як триметилсиліл хлорид та диметилсульфоксид. Альтернативно, сполуки формули (III) напряму отримують шляхом взаємодії сполук формули (V) або з альдегідо похідними формули (XIII) у присутності піперидин-оцтової кислоти, після чого гідратують у присутності каталізатору, такого як Pd/BaSO4 в атмосфері водню, або з хлор похідною формули (XV) у присутності метал гідриду або метал карбонату. У альтернативному способі сполуку формули (III) також отримують зі сполуки формули (VI) шляхом її взаємодії з відповідним кислотним хлоридом або етиловим естером у присутності основи, такої як метал гідрид або метал алкоксид. Сполуку формули (VI) отримують зі сполуки формули (VII) шляхом її взаємодії з придатними похідними гідрокси або аміно індану формули (XII), (XIV), (XVI) або (XVII) або індолу у присутності основи, бажано вибраної з метал гідриду 14 UA 98962 C2 5 10 15 або метал карбонату. Сполука формули (VII), як показано на Схемі 1 отримують шляхом бромування метил кетону формули (VIII) у відповідному розчиннику, такому як метанол. Сполуки формули (II) та формули (I) отримують або з кето похідної формули (IX) або з ціано похідної формули (X). Шляхом взаємодії сполук формули (IX) з відповідно заміщеним або незаміщеним гідразином у присутності спиртового розчинника отримуючи сполук формули (I) та формули (II) відповідно. Сполуку формули (IX) отримують шляхом взаємодії сполуки формули (VI) з диметилформамід діетил ацеталем. Альтернативно, сполука формули (X) взаємодіє зі сполукою формули (XV) у присутності основи, такої як метал гідриду, після чого обробляють відповідно заміщеним або незаміщеним гідразином у присутності спиртового розчинника отримуючи сполук формули (I) та формули (II) відповідно. Як показано на Схемі 1, ціано похідну формули (X) отримують зі сполуки формули (VII) шляхом її розчинення у органічному розчиннику, такому як диметил формамід, у присутності ціаніду натрію. Сполука формули (I), отримана як показано на схемі 1, є або кінцевою сполукою або може бути перетворена на формулу (І) за допомогою перетворення відповідної функціональної групи або використання звичайних способів, відомих у галузі. Проміжні сполуки формули (XII), (XIII), (XIV) та (XV) можуть бути отримані як показано на схемі 2, яка наведена нижче. Схема 2 G" O O XI G" = арил/ нижчий алкіл/,арил / арилалкіл/CF3 / галоген OH OH i C ii D G" G" E CHO XIII XII A, для G " = метил / кислота,/ альдегід/ ціано/ амід B, для G " =галоген 1.G 2.H або I F OH G" O E F NO2 OH G" для G" = H для G" = H XIV XV Y де G " = водень/нижчий алкіл / галоген/ CF3 /ціано/ альдегід/ естер/ арил/ арил алкілl; Y= Br / Cl A. 1. параформальдегід, MgCl2 , TEA, THF 2. Pd-C,H2 , метанол B. N-гало сукцинімід, діізопропіламін ,THF 30 35 H. PPh3, CBr4, THF D. триетилсилан, TFA 25 G.1. MeI, K2CO3, DMF 2. NaBH4, метанол C. AlCl3, 170-1800C 20 E. гексамін, TFA I. тіонил хлорид, THF F. азотна кислота, AcOH- вода Як показано на схемі-2, проміжні сполуки (XII) отримують з заміщеного дигідрокумарину XI або з 4-гідроксиіндану. У певному варіанті здійснення, заміщені дигідрокумарини формули (XI), нагрівають з трихлоридом алюмінію, після чого відновлюють кетогрупу інданoну триетилсиланом у трифтороцтовій кислоті отримуючи сполуки формули (XII). Відновлення інданoну також здійснюють за способом, описаним у US2005/0037925, WO9943647 та US2002/0040016. Альтернативно, 4-гідроксиіндан взаємодіє з параформальдегідом отримуючи сполуки заміщеної альдегідом, яку або відновлюють до метальної групи, у присутності придатного агенту, такого як NH2NH2-KOH-етиленгліколь або Pd/C в атмосфері водню, або до кислоти шляхом окислення альдегіду, використовуючи м'який окислювальний агент, такий як сульфамінова кислота та хлорит натрію. Кислотна група, отримана таким чином, далі взаємодії з відповідним спиртом у присутності неорганічної кислоти отримуючи естеру або використовуючи придатний амін та конденсувальний агент, вибраний з карбодііміду отримуючи аміду. Надалі альдегідну групу формули (XII) також використовували отримуючи ціанопохідної шляхом використання звичайного способу. У іншому альтернативному способі, галоген заміщені гідроксиіндан похідні формули (XII) також одержують шляхом взаємодії 4гідроксиіндану з N-галосукцинімідом у присутності каталітичної кількості діізопропіламіну у 15 UA 98962 C2 розчинниках, бажано тетрагідрофурані або дигалоалкані (G”= галоген), або шляхом обробки сульфурилхлоридом (G”= хлор). 5 10 Сполуку формули (XII) або 4-гідроксиіндан (G’’=H) обробляють гексаміном у трифтороцтовій кислоті отримуючи сполуки формули (XIII). У ще одному варіанті здійснення, сполуку формули (XV) отримують з сполуки формули (XIII) шляхом її взаємодії з метилйодидом у присутності основи, після чого здійснюють відновлення у присутності відновлювального агенту, такого як боргідриднатрію, та подальшої взаємодії отриманої проміжної сполуки з тетрабромідом вуглецю та трифенілфосфіном або тіоніл хлоридом відповідно. У альтернативному способі, сполуку формули (XIV) також одержують з сполуки формули (XII) або 4-гідроксиіндану шляхом її обробки азотною кислотою у присутності оцтової кислоти. Проміжні сполуки формули (XVI) та (XVII) отримують як показано на наведеній нижче схемі 15 3. Схема 3 OH O A O O B для G" =альдегід/ CN/ естер B та Cдля G"=метил D для G'' =галоген O OH G" O XVI XVII де G " = галоген /ціано/ альдегід /естер /амід A. 1 .триетилсилан, TFA або Pd-C, H2 2 . BBr3, MDC B. параформальдегід, MgCl2, TEA, THF C. Pd-C,H2 , метанол D. N-гало сукцинімід, діізопропіламін ,THF 20 Проміжну сполуку формули (XVI) отримують з диметоксиінданoну шляхом відновлення кето групи інданoну, використовуючи триетилсилан або Pd-C, після чого здійснювали взаємодію з трибромідом бору. 25 30 35 40 Сполуку формули (XVII), коли G’’= метил, отримують шляхом обробки 7-метокси-індан-4-олу (XVI) параформальдегідом та після цього відновленням проміжної сполуки за допомогою каталізатору, такого як Pd/C в атмосфері водню, у присутності придатного спиртового розчинника, вибраного з метанолу. Альтернативно, сполуку формули (XVII), коли G’’= естер або амід, отримують шляхом взаємодії сполуки формули (XVI) з параформальдегідом, який при подальшому окисленні у м'яких умовах, як описано у даному документі вище, може бути перетворений на G’’= кислота. Надалі кислотна група може взаємодіяти з відповідним спиртом у присутності неорганічної олії отримуючи естеру або з використанням придатного аміну та конденсувального агенту, вибраного з карбодііміду отримуючи аміду. Сполуку формули (XVII), де G’’= ціано, отримують шляхом відповідного відбору ціано заміщеного інданону або шляхом перетворення похідної аміду на ціано використовуючи звичайний спосіб. Альтернативно, гало заміщену сполуку формули (XVII) отримують шляхом взаємодії 7метокси-індан-4-олу (XVI) з N-галосукцинімідом у присутності каталітичної кількості діізопропіламіну у розчинниках, вибраних з тетрагідрофурану, або шляхом обробки сульфурилхлоридом (G" = Cl). Приклади Даний винахід у подальшому ілюструють наступними необмежувальними прикладами. Приклади ілюструють одержання сполук формули (І) та, таким чином, не розглядаються як такі, що обмежують об'єм винаходу, заявлений у формулі винаходу. 16 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад-1: (Сполука №1) 3-[4-(7-Гідрокси-індан-4-ілокси)-3,5-диметил-піразол-1-іл]-пропіонова кислота СТАДІЯ-I: одержання 4,7-диметоксиіндану. До охолодженої та перемішаної суспензії 4,7-диметоксиіндан-1-ону (35г, 0,182 моль) у триетилсилані (105,7 г, 0,909 моль) додавали трифтороцтову кислоту (350 мл) при 10-15 °C. Перемішування продовжували при кімнатній температурі протягом 2 годин та гасили у воді. Екстракцію здійснювали етилацетатом. Шар етилацетату промивали розчином бікарбонату натрію, сушили над сульфатом натрію, та випаровували отримуючи неочищену масу, яку очищали колонковою хроматографією, використовуючи 5 % етилацетат у гексані (22,5 г). Вихід: 69,3 % 1 H-ЯМР (400 MГц, CDCl3):δ 6,67(2H, с), 3,70 (6H, с), 2,74-2,78 (4H, м), 1,95-2,02 (2H, м) СТАДІЯ-II: Одержання 7-метоксиіндан-4-олу. До прозорого розчину 4,7-диметоксиіндану (22,5 г, 0,126 моль)у метилен хлориді (400 мл), додавали трибромід бору (12,27 мл, 0,13 моль) при 0C. Після 2 годин перемішування при 010C, додавали воду (100 мл) та після цього реакційну суміш екстрагували метиленхлоридом. Шар метиленхлориду сушили над сульфатом натрію та дистилювали отримуючи неочищену масу, яку очищали колонковою хроматографією, використовуючи 7 % етилацетат у гексані (9,0 г). Вихід: 43,4 % 1 H-ЯМР (400MГц, ДМСО-d6): δ 8,66 (1H, с), 6,493-6,558 (2H, м), 3,66 (3H, с), 2,71-2,75 (4H, м), 1,92-2,00 (2H, м) СТАДІЯ-III: Одержання 4-(7-Метокси-індан-4-ілокси)-3,5-диметил-1H-піразолу. До суспензії 60 % гідриду натрію (2,0 г, 0,051 моль) у тетрагідрофурані (20 мл) додавали розчин 7-метоксиіндан-4-олу (7,0 г, 0,042 моль) у тетрагідрофурані (30 мл) при кімнатній температурі. Після однієї години перемішування додавали розчин 3-хлор 2, 4-пентандіону (9,0 мл, 0,075 моль) у тетрагідрофурані (20 мл) та після цього додавали бромід калію (3,0 г, 0,025 моль). Реакційну суміш перемішували при 70C протягом 6 годин. Додавали воду та екстрагували діетиловим етером. Етерний шар відділяли та відганяли отримуючи олійної маси, яку частково очищали крізь колонку, використовуючи 2 % етилацетат у гексані отримуючи неочищену масу (2,7 г). Отриману неочищену масу перемішували з гідразин гідратом (1 мл) у 20 мл етанолу при 10C. Етанол випаровували досуха. Отриманий залишок розділяли між водою та етилацетатом. Відділений шар етилацетату сушили над сульфатом натрію та відганяли отримуючи бажаний продукт (2,0 г). Вихід: 18,1 % (за дві СТАДІЇ) 1 H-ЯМР (400MГц, ДМСО-d6): δ 2,12 (1H, с), 6,61 (1H, д), 6,29 (1H, д), 3,69 (3H, с), 2,88 (2H, т), 2,80 (2H, т), 2,00-2,07 (5H, м), 1,91 (3H, с). СТАДІЯ-IV: Одержання етилового естеру 3-[4-(7-Метокси-індан-4-ілокси)-3,5-диметилпіразол-1-іл]-пропіонової кислоти. До суспензії 60 % гідриду натрію (0,372 г 0,0093 моль) у 10 мл тетрагідрофурану додавали розчин похідної піразолу, отриманої на СТАДІЇ-III (2,0 г, 0,00775 моль) у 10 мл тетрагідрофурану в атмосфері азоту при кімнатній температурі. Після однієї години перемішування при кімнатній температурі, розчин 3-хлор етил пропіонату (1,15 г, 0,0084 моль) у 10 мл тетрагідрофурану додавали до реакційної суміші. Її перемішували при кімнатній температурі протягом 4 годин. Реакційну суміш виливали у воду, екстрагували етилацетатом. Шар етилацетату сушили над сульфатом натрію та відганяли. Отриману неочищену масу очищали за допомогою колонкової хроматографії, використовуючи 20 % етилацетат у гексані отримуючи бажаний продукт (0,850 г). Вихід: 30,6 % 1 H-ЯМР (400MГц, ДМСО-d6): δ 6,60 (1H, д), 6,26 (1H, д), 4,15 (2H, т), 4,05 (2H, к), 3,69 (3H, с), 2,88 (2H, т), 2,78-2,83 (4H, м), 1,99-2,08 (5H, м), 1,89 (3H, с), 1,16 (3H, т). СТАДІЯ-V: Одержання 3-[4-(7-гідрокси-індан-4-ілокси)-3,5-диметил-піразол-1-іл]-пропіонової кислоти. До прозорого розчину похідної етилового естеру, отриманої на СТАДІЇ-IV (0,85 г, 0,0023 моль) у 15 мл метилен хлориду, додавали розчин триброміду бору (1,0 мл, 0,0105 моль) у 15 мл метилен хлориду при 0C. Реакційну суміш перемішували протягом 2 годин при кімнатній температурі; додавали 10 мл води та екстрагували етилацетатом. Шар етилацетату сушили над сульфатом натрію та відганяли отримуючи твердий продукт (230 мг). Вихід: 30,6 % 1 H-ЯМР (400 MГц, ДМСО-d6): δ 12,27 (1H, шс), 8,77 (1H, шс), 6,42 (1H, д), 6,15 (1H, д), 4,10 (2H, т), 2,84 (2H, т), 2,71-2,78 (4H, м), 1,98-2,04 (5H, м), 1,88 (3H, с) + Мас: 315(M -1) 17 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад-2: (Сполука №7) 3-[4-(7-Гідрокси-індан-4-ілокси)-3-тіофен-2-іл-піразол-1-іл]-пропіонова кислота та 3-[4-(7Гідрокси-індан-4-ілокси)-5-тіофен-2-іл-піразол-1-іл]-пропіонова кислота СТАДІЯ-I: Одержання 2-(7-метокси-індан-4-ілокси)-1-тіофен-2-іл-етанону. До прозорого розчину 4-гідрокси-7-метоксиіндану (2,0 г, 0,0121 моль) у ацетоні (20 мл), додавали карбонат калію (2,52 г, 0,0182 моль) при кімнатній температурі та перемішували протягом 1,5 годин. Розчин 2-бром-1-тіофен-2-іл-етанону (3,75 г, 0,0181 моль) у ацетоні (10 мл) додавали при 0C та перемішували протягом 8 годин при кімнатній температурі. Реакційну суміш виливали у воду (50 мл) та екстрагували етилацетатом (2100 мл). Шар етилацетату сушили над сульфатом натрію та випаровували отримуючи неочищений продукт, який очищали за допомогою колонкової хроматографії, використовуючи 2 % етилацетат у гексані як рухому фазу. Зібраний елюент випаровували одержуючи бажаний продукт (2,1 г) як в'язку олію. Вихід: 59,8 % 1 H-ЯМР (400MГц, ДМСО-d6): δ 8,12 (1H, дд), 8,09 (1H, дд), 7,29-7,31 (1H, м), 6,63 (2H, с), 5,33 (2H, с), 3,70 (3H, с), 2,87 (2H, т), 2,78 (2H, т), 1,98-2,06 (2H, м). СТАДІЯ-II: Одержання 3-Диметиламіно-2-(7-метокси-індан-4-ілокси)-1-тіофен-2-ілпропенону. Сполуку, отриману на СТАДІЇ-I Приклад-2 (2,0 г, 0,0069 моль) додавали у 5 мл N, Nдиметилформаміду діетилацеталь при кімнатній температурі та перемішували при 90C протягом 2 годин. Реакційну суміш виливали у охолоджену воду (100 мл) та екстрагували етилацетатом. Шар етилацетату промивали водою, сушили над сульфатом натрію та випаровували одержуючи маслянистий продукт (1,9 г). Його використовували на наступній СТАДІЇ. Вихід: 79,5 % СТАДІЯ-III: Одержання 4-(7-Метокси-індан-4-ілокси)-3-тіофен-2-іл-1H-піразолу та 4-(7Метокси-індан-4-ілокси)-5-тіофен-2-іл-1H-піразолу. До прозорого розчину сполуки, отриманої на СТАДІЇ-II Приклад 2 (1,9 г, 0,0055 моль) у етанолі (30 мл), додавали гідразин гідрат (0,5 мл, 0,0102 моль) та перемішували при 60C протягом 4 годин. Етанол випаровували у вакуумі та додавали воду у реакційну суміш. Її екстрагували етилацетатом (2 × 50 мл). Шар етилацетату сушили над сульфатом натрію та дистилювали в вакуумі отримуючи неочищений продукт, який очищали за допомогою колонкової хроматографії, використовуючи етилацетат у гексані (20:80) як рухому фазу. Зібраний елюент випаровували у вакуумі одержуючи бажаний продукт 1,0 г. Вихід: 58,13 % 1 H-ЯМР (400MГц, ДМСО-d6): для основного ізомеру δ 12,82 (1H, с), 7,67 (1H, д), 7,43 (1H, д), 7,24 (1H, д), 7,02-7,08 (1H, м), 6,65 (1H, д), 6,56 (1H, д), 3,70 (3H, с), 2,92 (2H, т), 2,82 (2H, т), 2,03-2,10 (2H, м). СТАДІЯ-IV: Синтез етилового естеру 3-[4-(7-Метокси-індан-4-ілокси)-3-тіофен-2-іл-піразол-1іл]-пропіонової кислоти та етилового естеру 3-[4-(7-Метокси-індан-4-ілокси)-5-тіофен-2-ілпіразол-1-іл]-пропіонової кислоти. Їх отримували за допомогою способу, описаного для СТАДІЇ-IV наприклад-1. Вихід: 45,4 % 1 H-ЯМР (400MГц, ДМСО-d6): для основного ізомеру δ 7,64 (1H, с), 7,45 (1H, дд), 7,26 (1H, дд), 7,03-7,07 (1H, м), 6,67 (1H, д), 6,62 (1H, д), 4,30 (2H, т), 4,01-4,09 (2H, м), 3,72 (3H, с), 2,782,90 (6H, м), 2,04-2,07 (2H, м), 1,13 (3H, т). СТАДІЯ-V: Одержання 3-[4-(7-метокси-індан-4-ілокси)-3-тіофен-2-іл-піразол-1-іл]-пропіонової кислоти та 3-[4-(7-метокси-індан-4-ілокси)-5-тіофен-2-іл-піразол-1-іл]-пропіонової кислоти. До прозорого розчину сполуки, отриманої на СТАДІЇ-IV (0,6 г, 0,0014 моль) у метанолі (5,0 мл), додавали розчин гідроксиду натрію (0,12 г, 0,0029 моль) у воді (25 мл) та перемішували протягом 2 годин при кімнатній температурі. Mетанол відганяли в вакуумі повністю, залишковий водний шар промивали етером (20 мл), підкислювали розведеною хлорводневою кислотою та екстрагували етилацетатом (250 мл). Відділений шар етилацетату сушили над сульфатом натрію та відганяли в вакуумі отримуючи кислотну похідну (440 мг) як тверду речовину. Вихід: 78,7 % 1 H-ЯМР (400 MГц, ДМСО-d6): для основного ізомеру δ 12,42 (1H, шс), 7,64 (1H, с), 7,44 (1H, д), 7,26 (1H, д), 7,05 (1H, дд), 6,66 (1H, д), 6,62 (1H, д), 4,26 (2H, т), 3,72 (3H, с), 2,78-2,90 (6H, м), 2,01-2,06 (2H, м). СТАДІЯ-VI: Одержання 3-[4-(7-Гідрокси-індан-4-ілокси)-3-тіофен-2-іл-піразол-1-іл]пропіонової кислоти та 3-[4-(7-Гідрокси-індан-4-ілокси)-5-тіофен-2-іл-піразол-1-іл]-пропіонової кислоти 18 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 До прозорого розчину сполуки, отриманої на СТАДІЇ-V Приклад-2 (0,44 г, 0,00118 моль) у метилен хлориді (20 мл), краплями додавали розчин триброміду бору (0,35 мл, 0,0037 моль) у метилен хлориді (5 мл) при 0-10C та перемішували протягом 2 годин при кімнатній температурі (25-28 C). Воду (10 мл) потрохи додавали до реакційної суміші та екстрагували метиленхлоридом (230 мл). Відділений шар метиленхлориду сушили над сульфатом натрію та відганяли у вакуумі отримуючи бажаний продукт (200 мг) як тверду речовину. Вихід: 47,1 % 1 H-ЯМР (400 MГц, ДМСО-d6): для основного ізомеру δ 12,41 (1H, с), 9,00 (1H, с), 7,55 (1H, с), 7,44 (1H, д), 7,29 (1H, д), 7,04-7,06 (1H, м), 6,46-6,54 (2H, м), 4,24 (2H, т), 2,73-2,84 (6H, м), 1,962,06 (2H, м). + Мас.: 369(M -1) Приклад-3: (Сполука №3) 7-[3,5-Диметил-1-(1H-тетразол-5-ілметил)-1H-піразол-4-ілокси]-індан-4-ол СТАДІЯ-I: Одержання [4-(7-метокси-індан-4-ілокси)-3,5-диметил-піразол-1-іл]-ацетонітрилу. Його одержували використовуючи методику подібну до описаної для СТАДІЇ-IV Прикладу-1 використовуючи бромацетонітрил замість етил 3-хлорпропіонату. Вихід: 96,7 % 1 H-ЯМР (400MГц, ДМСО-d6): δ 6,63 (1H, д), 6,31 (1H, д), 5,35 (2H, с), 3,70 (3H, с), 2,89 (2H, т), 2,80 (2H, т), 2,10 (3H, с), 1,98-2,07 (2H, м), 1,93 (3H, с). СТАДІЯ -II: Одержання 5-[4-(7-Метокси-індан-4-ілокси)-3,5-диметил-піразол-1-ілметил]-1Hтетразолу. До перемішаного розчину [4-(7-Метокси-індан-4-ілокси)-3,5-диметил-піразол-1-іл]ацетонітрилу (3,0г, 0,0101 моль) у диметилформаміді (30мл), додавали азид натрію (1,2г, 0,0185 моль) та гідрохлорид триетиламіну (4,0 г, 0,0303моль) при кімнатній температурі (27-30 C). Реакційну суміш перемішували при 90-100 C протягом 4 годин. Реакційну суміш охолоджували та виливали у розведену хлорводневу кислоту (100 мл) та перемішували протягом 30 хв. Відділену тверду речовину відфільтровували та розчиняли у етилацетаті (100 мл). Шар етилацетату сушили над сульфатом натрію та відганяли у вакуумі отримуючи 1,5 г бажаного продукту як тверду речовину. Вихід: 43,7 % 1 H-ЯМР (400MГц, ДМСО-d6): δ 6,62 (1H, д), 6,32 (1H, д), 5,57 (2H, с), 3,70 (3H, с), 2,89 (2H, т), 2,80 (2H, т), 2,11 (3H, с), 2,03-2,09 (2H, м), 1,89 (3H, с). СТАДІЯ-III: 7-[3,5-Диметил-1-(1H-тетразол-5-ілметил)-1H-піразол-4-ілокси]-індан-4-ол. Його одержували використовуючи методику подібну до описаної для СТАДІЇ-VI Прикладу-2. Вихід: 31,3 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 8,85(1H, с), 6,44(1H, д), 6,21(1H, д), 5,55 (2H, с), 2,84(2H, т), 2,76(2H, т), 2,11(3H, с), 2,00-2,06(2H, м), 1,88(3H, с). + Мас: 325 (M -1) Приклад-4: (Сполука №10) 5-[4-(7-Гідрокси-індан-4-ілокси)-3,5-диметил-піразол-1-ілметил]-1H-піразол-3-ол СТАДІЯ-I: Одержання етилового естеру 4-[4-(7-Метокси-індан-4-ілокси)-3,5-диметил-піразол1-іл]-3-оксо-масляної кислоти. Його одержували використовуючи методику подібну до описаної для СТАДІЇ-IV Прикладу-1, використовуючи етиловий естер 4-хлор-3-оксо-масляної кислоти як алкілувальний агент замість етил 3-хлорпропіонату. Вихід: 35,7 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 6,64 (1H, д), 6,33 (1H, д), 5,11 (2H, с), 4,11(2H, к), 3,69-3,70 (5H, м), 2,87-2,92 (2H, м), 2,80 (2H, т), 2,02-2,07 (2H, м), 1,92 (3H, с), 1,90 (3H, с), 1,19(3H, т). СТАДІЯ -II: Одержання 5-[4-(7-метокси-індан-4-ілокси)-3,5-диметил-піразол-1-ілметил]-1Hпіразол-3-олу. До перемішаного розчин кето естеру СТАДІЯ -I Прикладу-4 (0,8 г, 0,00207моль) у метанолі (20 мл), додавали розчин гідразингідрату (0,11 мл, 0,00227 моль) у метанолі (5 мл) при 0-10 C. Реакційну суміш нагрівали до 75-80 C та перемішували протягом 12 годин. Метанол дистилювали у вакуумі та отриману тверду речовину перемішували у етилацетаті (5 мл). Надалі її відфільтровували, сушили відсмоктуванням отримуючи 380 мг бажаного продукту як тверду речовину. Вихід: 51,8 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 11,81(1H, шс), 9,57 (1H, шс), 6,61(1H, д), 6,28 (1H, д), 5,27 (1H, шс), 5,03 (2H, шс), 3,69 (3H, с), 2,88 (2H, т), 2,80 (2H, т), 2,01-2,08 (5H, м), 1,90 (3H, с). 19 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 СТАДІЯ -III: Одержання 5-[4-(7-гідрокси-індан-4-ілокси)-3,5-диметил-піразол-1-ілметил]-1Hпіразол-3-олу Його одержували використовуючи методику подібну до описаної для СТАДІЇ-VI Прикладу-2. Вихід: 60,4 % 1 H-ЯМР (400MГц, ДМСО-d6): δ 8,82 (1H, шс), 6,41 (1H, д), 6,15 (1H, д), 5,22 (1H, с), 5,01 (2H, с), 2,82 (2H, т), 2,74 (2H, т), 1,93-2,06 (5H, м), 1,84 (3H, с). + Мас: 339(M -1) Приклад-5: (Сполука №19) [3,5-Діетил-4-(7-гідрокси-6-метил-індан-4-ілметил)-піразол-1-іл]-оцтова кислота СТАДІЯ -I: Одержання 7-Хлорметил-4-метокси-5-метил-індану. До перемішаного розчину 7-метокси-6-метил-індан-4-карбоксальдегіду (39 г, 0,205 моль) у метанолі (200 мл), боргідрид натрію (9,5 г, 0,225 моль) додавали частинами при 10-20C та перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш виливали у воду (200 мл) та підкислювали розведеною хлорводневою кислотою дo pH 6. Реакційну суміш відганяли у вакуумі та після цього екстрагували етилацетатом (2200 мл). Шар етилацетату сушили над сульфатом натрію та відганяли у вакуумі отримуючи 38 г в'язкої олії. До прозорого розчину в'язкої олії (38,0 г) у метиленхлориді (160 мл), додавали тионілхлорид (29,07 мл, 0,396 моль) при 10-15C та перемішували при 20-25C протягом 2 г. Реакційну суміш виливали у воду (200 мл). Відділений органічний шар промивали насиченим бікарбонатом натрію, сушили над сульфатом натрію, відганяли у вакуумі отримуючи неочищений продукт як твердої речовини. Неочищену тверду речовину розчиняли у гексані, відфільтровували та після цього фільтрат відганяли отримуючи бажану сполуку (36,0 г) як тверду речовину. Вихід: 83,5 % 1 H-ЯМР (400 MГц, ДМСО-d6): δ 6,95 (1H, с), 4,66 (2H, с), 3,70 (3H, с), 2,85-2,98 (4H, м), 2,15 (3H, с), 1,99-2,05 (2H, м). СТАДІЯ -II: Одержання 3,5-діетил-4-(7-метокси-6-метил-індан-4-ілметил)-1H-піразолу. До перемішаної суспензії 3,5-гептандіону (8,7 мл, 0,0642 моль) та карбонату калію (15,0 г, 0,1086 моль) у диметилформаміді (50 мл), повільно додавали розчин 7-хлорметил-4-метокси-5метил-індану (15,0 г, 0,0714 моль) у диметилформаміді (25 мл) та перемішували протягом 2,5-3 годин при 40-45C. До реакційної суміші додавали воду (500 мл), після цього підкислювали розведеною хлорводневою кислотою та екстрагували етилацетатом (2500 мл). Шар етилацетату сушили над сульфатом натрію та відганяли у вакуумі отримуючи 20 г дикето похідне як в'язкк олію. До прозорого розчину отриманої в'язкої олії у ізопропіловому спирті (80 мл), повільно додавали розчин 99 % гідразингідрату (3,3 мл, 0,066 моль) у ізопропіловому спирті (20 мл) при 15-20C. Реакційну суміш нагрівали до 80-85C та перемішували протягом 1 години. Додавали оцтову кислоту (7,5 мл) та продовжували нагрівати протягом ще 11-12 годин. Ізопропіловий спирт відганяли та залишок розділяли між водним бікарбонатом натрію (200 мл) та етилацетатом (2200 мл). Шар етилацетату сушили над сульфатом натрію та відганяли у вакуумі отримуючи тверду речовину. Отриману тверду речовину перемішували у гексані (50 мл), відфільтровували та сушили у вакуумі отримуючи 9,3 г бажаного піразолу. Вихід: 43,7 % 1 H-ЯМР (400 MГц, ДМСО-d6): 12,02 (1H, с), 6,46(1H, с), 3,64(3H, с), 3,51 (2H, с), 2,84-2,88 (2H, м), 2,75 (2H, т), 2,36-2,40 (4H, м), 2,06 (3H, с), 1,96-2,04 (2H, м), 1,00-1,04 (6H, м). СТАДІЯ-III: Одержання етилового естеру [3,5-діетил-4-(7-метокси-6-метил-індан-4-ілметил)піразол-1-іл]-оцтової кислоти. До перемішаного розчину похідної піразолу, отриманої на СТАДІЇ-II Прикладу-5 (9,0 г, 0,0302 моль) та етил бром ацетату (6,7 мл, 0,0604 моль) у диметилформаміді (50 мл), додавали карбонат цезію (14,7 г, 0,0453 моль) та перемішували протягом 16 годин при кімнатній температурі (25-30C). Реакційну суміш виливали у воду (400 мл). Відділену тверду речовину відфільтровували та промивали водою (50 мл) та відсмоктували досуха. Твердий залишок розчиняли у етилацетаті (200 мл) та промивали водою. Шар етилацетату сушили над сульфатом натрію та відганяли у вакуумі отримуючи неочищену тверду речовину. Неочищену тверду речовину перемішували у гексані (50 мл) протягом 2 годин, фільтрували, промивали гексаном (10 мл) та сушили у вакуумі отримуючи бажаний продукт як жовтувату тверду речовину (9,0 г) Вихід: 77,6 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 6,47 (1H, с), 4,90 (2H, с), 4,12 (2H, к), 3,64 (3H, с), 3,54 (2H, с), 2,85-2,89 (2H, м), 2,73-2,77 (2H, м), 2,44 (2H, к), 2,30 (2H, к), 2,06 (3H, с), 1,96-2,04 (2H, м), 1,19 (3H, т), 1,00 (3H, т), 0,89 (3H, т). 20 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 СТАДІЯ-IV: Одержання [3,5-діетил-4-(7-метокси-6-метил-індан-4-ілметил)-піразол-1-іл]оцтової кислоти. До перемішаного розчину етилового естеру [3,5-Діетил-4-(7-метокси-6-метил-індан-4ілметил)-піразол-1-іл]-оцтової кислоти СТАДІЯ-III (9,0 г, 0,0234 моль) у тетрагідрофурані (40 мл) та метанолі (20 мл), додавали розчин гідроксиду натрію (1,87 г, 0,0468 моль) у воді (75 мл) при 20-30C та перемішували протягом 1,5-2 годин. Реакційну суміш виливали у воду (50 мл) та екстрагували етилацетатом (2200 мл). Залишковий водний шар підкислювали розведеною хлорводневою кислотою. Відділену тверду речовину відфільтровували, промивали водою (50 мл) та сушили у вакуумі при 60-65C до отримання бажаного продукту як жовтуватої твердої речовини (6,3 г). Вихід: 75,5 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 12,80-13,00 (1H, шс), 6,48 (1H, с), 4,79 (2H, с), 3,64 (3H, с), 3,54 (2H, с), 2,85-2,89 (2H, м), 2,74-2,78 (2H, м), 2,44 (2H, к), 2,30 (2H, к), 2,06 (3H, с), 1,96-2,04 (2H, м), 1,00 (3H, т), 0,90 (3H, т). СТАДІЯ-V: Одержання [3,5-діетил-4-(7-гідрокси-6-метил-індан-4-ілметил)-піразол-1-іл]оцтової кислотої. До перемішаної суспензії [3,5-Діетил-4-(7-метокси-6-метил-індан-4-ілметил)-піразол-1-іл]оцтової кислоти (6,0г, 0,0168 моль) у метиленхлориді (100 мл), додавали розчин триброміду бору (4,2 мл, 0,0442 моль) у метиленхлориді (20 мл) при 0-5 °C та перемішували протягом 2-3 годин при 20-30 °C. Воду (250 мл) додавали у реакційну суміш та перемішували протягом 1 години. Відділену тверду речовину відфільтровували у вакуумі, промивали водою. Отриману тверду речовину розчиняли у етилацетаті (2,0 л) та промивали водою (1 л). Етилацетат дистилювали в вакуумі та потім отриману тверду речовину перемішували у діетиловому етері (50 мл), фільтрували та сушили при 55-60 °C у вакуумі одержуючи бажаний продукт 4,5 г. Вихід: 78,3 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 8,14 (1H, с), 6,39 (1H, с), 4,77 (2H, с), 3,48 (2H, перекривається з піком води, присутній у ДМСО-d6), 2,68-2,77 (4H, м), 2,43 (2H, к), 2,30 (2H, к), 1,94-2,01(5H, м), 1,00 (3H, т), 0,90 (3H, т). 1H-ЯМР (400MГц, CD3OD):δ 6,66 1H, с), 4,83 (2H, с), 3,59 (2H, с), 2,75-2,83 (4H, м), 2,51(2H, к), 2,42 (2H, к), 1,91-2,07 (5H, м), 1,05 (3H, т), 0,97(3H, т). + Мас: 341(M -1) Приклад-6: (Сполука №,33) 3-[4-(7-Гідрокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]-N-ізопропіл-пропіонамід СТАДІЯ-I Одержання 3-[4-(7-Метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]пропіонової кислоти. Його одержували, використовуючи методику, подібну до описаної для СТАДІЇ-IV Прикладу-5 Вихід: 54,0 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 12,29(1H, шс), 6,49 (1H, с), 4,10 (2H, т), 3,64 (3H, с), 3,48 (2H, с), 2,86 (2H, т), 2,68-2,75 (4H, м), 2,10 (3H, с), 2,08 (3H, с), 1,96-2,03 (2H, м), 1,92 (3H, с). СТАДІЯ-II: Одержання N-Ізопропіл-3-[4-(7-метокси-6-метил-індан-4-ілметил)-3,5-диметилпіразол-1-іл]-пропіонаміду. До розчину 3-[4-(7-Метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]-пропіонової кислоти (1,0 г, 0,00292 моль) у тетрагідрофурані (20 мл), додавали карбоніл-диімідазол (0,62 г, 0,0038 моль) при 20-30 °C. Реакційну суміш нагрівали та перемішували протягом години при 7075 °C. Розчин ізопропіламіну (0,3 мл, 0,00367 моль) у тетрагідрофурані (5 мл) додавали при 2030 °C. Реакційну суміш після цього перемішували при 70 °C протягом 4 годин. Реакційну суміш охолоджували та виливали у воду (50 мл) та екстрагували етилацетатом (2100 мл). Шар етилацетату сушили над сульфатом натрію, відганяли у вакуумі отримуючи неочищений продукт, який перемішували у гексані (20 мл) та фільтрували отримуючи 810 мг бажаного продукту як тверду речовину. Вихід: 72,8 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 7,77 (1H, д), 6,49 (1H, с), 4,10 (2H, т), 3,77 (1H, м), 3,64 (3H, с), 3,47 (2H, с), 2,86 (2H, т), 2,73 (2H, т), 2,49 (2H, перекривається з ДМСО-d6 піком), 2,08 (6H, с), 1,95-2,03 (2H, м), 1,92 (3H, с), 0,98 (6H, д). СТАДІЯ-III: Одержання 3-[4-(7-Гідрокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]N-ізопропіл пропіонаміду. Його одержували, використовуючи методику, подібну до описаної для СТАДІЇ-VI Прикладу-2 Вихід: 51,9 % 21 UA 98962 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (400MГц, ДМСО-d6):δ 8,11 (1H, с), 7,76 (1H, д), 6,40 (1H, с), 4,08 (2H, т), 3,76-3,81 (1H, м), 3,42 (2H, с), 2,75 (2H, т), 2,69 (2H, т), 2,51 (2H, перекривається з ДМСО-d6 піком), 2,07 (3H, с), 2,02 (3H, с), 1,90-1,99 (5H, м), 0,98 (6H, д). + Мас: 370 (M +1) Приклад-7: (Сполука №42) 5-[3,5-Діетил-4-(7-гідрокси-6-метил-індан-4-ілметил)-піразол-1-ілметил]-3H-[1,3,4]оксадіазол2-он СТАДІЯ-I: Одержання гідразиду [3,5-Діетил-4-(7-метокси-6-метил-індан-4-ілметил)-піразол-1іл]-оцтової кислоти. Перемішану суспензію етилового естеру [3,5-Діетил-4-(7-метокси-6-метил-індан-4-ілметил)піразол-1-іл]-оцтової кислоти (3,3 г, 0,0085 моль) та 99 % гідразингідрату (33 мл) нагрівали при 60-65 °C протягом 3 годин. Реакційну суміш виливали у воду (200 мл), перемішували протягом години та після цього фільтрували. Отриману тверду речовину перемішували у метанолі (10 мл), фільтрували та сушили отримуючи 2,9 г бажаного продукту як тверду речовину. Вихід: 91,4 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 9,23 (1H, с), 6,51 (1H, с), 4,58 (2H, с), 4,29-4,30 (2H, д), 3,64 (3H, с), 3,52 (2H, с), 2,87 (2H, т), 2,76 (2H, т), 2,47 (2H, перекривається з ДМСО-d6 піком), 2,30 (2H, к), 2,07 (3H, с), 1,97-2,04 (2H, м), 1,00 (3H, т), 0,90 (3H, т). СТАДІЯ-II: Одержання 5-[3,5-Діетил-4-(7-метокси-6-метил-індан-4-ілметил)-піразол-1ілметил]-3H-[1,3,4]оксадіазол-2-ону. До перемішаного розчину гідразиду [3,5-Діетил-4-(7-метокси-6-метил-індан-4-ілметил)піразол-1-іл]-оцтової кислоти (1,5 г, 0,0041 моль) у 1,4-діоксані (70 мл), додавали карбонілдіімідазол (2,0 г, 0,0121 моль) при 20-30 °C. Реакційну суміш перемішували протягом 8 годин при 90-95 °C. Реакційну суміш охолоджували та виливали у воду (200 мл), перемішували протягом 2 годин та потім відділену тверду речовину відфільтровували. Після цього тверду речовину перемішували у діетиловому етері (25 мл) та фільтрували, сушили отримуючи 900 мг бажаного продукту як тверду речовину. Вихід: 56,2 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 12,28 (1H, шс), 6,45 (1H, с), 5,20 (2H, с), 3,64 (3H, с), 3,54 (2H, с), 2,87 (2H, т), 2,74 (2H, т), 2,54 (2H, к), 2,31 (2H, к), 2,06 (3H, с), 1,98-2,01 (2H, м), 1,00 (3H, т), 0,92 (3H, т). СТАДІЯ-III: Одержання 5-[3,5-Діетил-4-(7-гідрокси-6-метил-індан-4-ілметил)-піразол-1ілметил]-3H-[1,3,4]оксадіазол-2-ону. Його одержували, використовуючи методику, подібну до описаної для СТАДІЇ-VI Прикладу-2. Вихід: 70,7 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 12,41 (1H, с), 8,14 (1H, с), 6,37 (1H, с), 5,20 (2H, с), 3,49 (2H, с), 2,69-2,77 (4H, м), 2,53 (2H, перекривається з ДМСО-d6 піком), 2,31 (2H, к), 1,91-2,01 (5H, м), 0,99 (3H, т), 0,92 (3H, т). + Мас: 383(M +1) Приклад-8: (Сполука №45) 6-[4-(7-Гідрокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-ілметил]-2-метил-3Hпіримідин-4-он СТАДІЯ-I: Одержання етилового естеру 4-[4-(7-метокси-6-метил-індан-4-ілметил)-3,5диметил-піразол-1-іл]-3-оксо-масляної кислоти. Його одержували використовуючи методику подібну до описаної для СТАДІЇ-IV Прикладу-1, використовуючи етиловий естер 4-хлор-3-оксо-масляної кислоти як алкілувальний агент замість етил 3-хлорпропіонату. Вихід: 47,1 % 1 H-ЯМР (400MГц, ДМСО-d6): 6,53(1H, с), 5,07 (2H, с), 4,4,08 (2H, к), 3,64 (3H, с), 3,63 (2H, с), 3,51 (2H, с), 2,86 (2H, т), 2,74 (2H, т), 2,09 (3H, с), 1,97-2,05 (5H, м), 1,92 (3H, с), 1,18 (3H, т) СТАДІЯ-II: Одержання 6-[4-(7-Метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1ілметил]-2-метил-3H-піримідин-4-ону. До розчину етилового естеру 4-[4-(7-Метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол1-іл]-3-оксо-масляної кислоти (1,0 г, 0,0025 моль) у етанолі (60 мл) додавали ацетамідгідрохлорид (0,71 г, 0,0075 моль). Після цього, додавали етоксид натрію (0,51 г, 0,0075 моль) при 5-10 °C та потім перемішували при 70-75 °C протягом 2 годин. Етанол відганяли в вакуумі та залишок розділяли між етилацетатом (100 мл) та водою (100 мл). Потім водний шар екстрагували етилацетатом (2100 мл). Об'єднаний шар етилацетату зменшували до 20 мл та потім фільтрували отримуючи 800 мг бажаного продукту. Вихід: 81,3 % 22 UA 98962 C2 1 5 10 15 20 25 30 35 40 45 50 55 H-ЯМР (400MГц, ДМСО-d6):δ 12,42 (1H, шс), 6,50 (1H, с), 5,16 (1H, с), 4,97 (2H, с), 3,64 (3H, с), 3,55 (2H, с), 2,87 (2H, т), 2,74 (2H, т), 2,27 (3H, с), 2,09 (3H, с), 2,05 (3H, с), 1,98-2,02 (2H, м), 1,95(3H, с). СТАДІЯ-III: Одержання 6-[4-(7-гідрокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1ілметил]-2-метил-3H-піримідин-4-ону. Його одержували, використовуючи методику, подібну до описаної для СТАДІЇ-VI Прикладу-2 Вихід: 58,4 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 12,41 (1H, с), 8,12 (1H, с), 6,42 (1H, с), 5,13 (1H, с), 4,95 (2H, с), 3,49 (2H, с), 2,67-2,77 (4H, м), 2,26 (3H, с), 2,03 (6H, с), 1,94-1,99 (5H, м). + Мас: 379(M +1) Приклад-9: (Сполука №46) 3-[4-(7-Гідрокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-ілметил]-[1,2,4]оксадіазол5-ол СТАДІЯ-I: Одержання [4-(7-метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]ацетонітрилу. Його одержували, використовуючи методику подібну до описаної для СТАДІЇ-IV Прикладу-1, використовуючи бромацетонітрил як N-алкілувальний агент замість етил 3-хлорпропіонату. Вихід: 52,8 % 1 H-ЯМР (400MГц, ДМСО-d6): δ 6,51 (1H, с), 5,31 (2H, с), 3,64 (3H, с),3,52 (2H, с), 2,87 (2H, т), 2,73 (2H, т), 2,15 (3H, с), 2,09 (3H, с), 1,92-2,03 (5H, м). СТАДІЯ-II: Одержання N-гідрокси-2-[4-(7-метокси-6-метил-індан-4-ілметил)-3,5-диметилпіразол-1-іл]-ацетамідину. До перемішаного розчину [4-(7-Метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]ацетонітрилу (2,0 г 0,00647 моль) у метанолі (50 мл), додавали суспензію гідроксиламіну гідрохлориду (2,29 г, 0,033 моль) та карбонат калію (4,37 г, 0,0317 моль) у воді (20 мл). Реакційну суміш перемішували протягом 30-36 годин при 70 °C, охолоджували та потім відфільтровували. Отриману тверду речовину промивали водою (10 мл) та гексаном та сушили у вакуумі отримуючи 1,8 г бажаного продукту. Вихід: 81,4 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 9,20 (1H, шс), 6,52 (1H, с), 5,24 (2H, с), 4,51 (2H, с), 3,64 (3H, с), 3,49 (2H, с), 2,86 (2H, т), 2,74 (2H, т), 2,09 (6H, с), 1,98-2,05 (2H, м), 1,94 (3H, с). СТАДІЯ-III: Одержання 3-[4-(7-метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1ілметил]-[1,2,4]оксадіазол-5-олу. До розчину N-гідрокси-2-[4-(7-метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]ацетаміду (2,4 г, 0,00701 моль) у піридині (50 мл), додавали етилхлорформіат (1,5 мл, 0,0157 моль) при 0-5 °C. Реакційну суміш перемішували протягом 15 хв. та піридин відганяли у вакуумі. До отриманого залишку, додавали суміш води та тетрагідрофурану (1:1) 40 мл та 1M розчину гідроксиду натрію (10 мл) та перемішували при 75 °C протягом години та продовжували протягом 24 годин при 25-28 °C. До реакційної суміші додавали 2M хлорводневу кислоту (200 мл) та екстрагували етилацетатом (2100 мл). Шар етилацетату сушили над сульфатом натрію та відганяли у вакуумі отримуючи 2,0 г твердої речовини. Отриману тверду речовину перемішували з сумішшю тетрагідрофурану (5 мл) та 1M гідроксиду натрію (50 мл) та кип'ятили зі зворотнім холодильником протягом 24 годин. Реакційну суміш охолоджували та додавали 2N хлорводневу кислоту (100 мл). Відділену тверду речовину відфільтровували, промивали водою (20 мл) та розчиняли у етилацетаті (100 мл). Шар етилацетату сушили над сульфатом натрію та відганяли у вакуумі отримуючи 880 мг бажаного продукту, як тверду речовину. Вихід: 34,10 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 6,52 (1H, с), 5,14 (2H, с), 3,64 (3H, с), 3,51 (2H, с), 2,86 (2H, т), 2,74 (2H, т), 2,13 (3H, с), 2,08 (3H, с), 1,95-2,03 (2H, м), 1,94 (3H, с). СТАДІЯ-IV: Одержання 3-[4-(7-Гідрокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1ілметил]-[1,2,4]оксадіазол-5-олу. Його одержували використовуючи методику подібну до описаної для СТАДІЇ-VI Прикладу-2 Вихід: 79,5 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 8,15 (1H, с), 6,44 (1H, с), 5,14 (2H, с), 3,46 (2H, с), 2,68-2,77 (4H, м), 2,13 (3H, с), 2,03 (3H, с), 1,87-1,99 (5H, м). + Мас: 353(M -1) Приклад-10: (Сполука №66) {3-[4-(7-Метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]-пропіоніл}-амід пропан2-сульфонової кислоти. 23 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 До суспензії 60 % гідриду натрію (76 мг, 0,0019 моль) у тетрагідрофурані (2 мл), додавали розчин 3-[4-(7-Метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]-пропіонаміду (500 мг, 0,00146 моль) у тетрагідрофурані (5 мл) при кімнатній температурі та перемішували протягом 20 хв. Розчин ізопропілсульфонілхлориду (0,18 мл, 0,0016 моль) у тетрагідрофурані (3 мл) додавали при 0-5 °C та перемішували при 15-25 °C протягом 3 годин. Тетрагідрофуран відганяли у вакуумі, додавали розведену хлорводневу кислоту (20 мл) до реакційної суміші та екстрагували етилацетатом (50 мл). Шар етилацетату сушили над сульфатом натрію та відганяли у вакуумі отримуючи неочищений продукт, який очищали за допомогою колонкової хроматографії, використовуючи етилацетат як рухому фазу. Фракції відганяли отримуючи 80 мг бажаної сполуки як твердої речовини. Вихід: 12,2 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 11,50 (1H, шс), 6,49 (1H, с), 4,12 (2H, т), 3,64 (3H, с), 3,51-3,55 (1H, м), 3,47 (2H, с), 2,80-2,88 (4H, м), 2,73 (2H, т), 2,09 (3H, с), 2,08(3H, с), 1,96-2,03 (2H, м), 1,91 (3H, с), 1,20 (6H, д). + Мас: 446(M -1) Приклад-11: (Сполука №12) 7-[1-(2-Гідрокси-етил)-3,5-диметил-1H-піразол-4-ілметил]-5-метил-індан-4-ол СТАДІЯ-I: Одержання 3-(7-метокси-6-метил-індан-4-ілметил)-пентан-2,4-діону До розчину 7-метокси-6-метил-індан-4-карбальдегіду (8,0 г 0,042 моль) та ацетил ацетону (4,63 г, 0,046 моль) у толуолі (80 мл) додавали піперидин (0,5 мл) та оцтову кислоту (0,5 мл). Реакційну суміш кип'ятили зі зворотнім холодильником над 3Å молекулярними ситами, використовуючи насадку Діна-Старка протягом 24 годин. Толуол дистилювали в вакуумі отримуючи неочищений продукт, який очищали за допомогою колонкової хроматографії, використовуючи 5 % етилацетат у гексані. Фракції відганяли отримуючи 3,0 г конденсованого продукту. Його розчиняли у метанолі (60 мл) та гідрували на 5 % о/о паладію на сульфаті барію (350 мг) при 40-50 psi, використовуючи водень при 25-30 °C. Реакційну суміш відфільтровували крізь фільтр hyflow та відганяли у вакуумі отримуючи 2,9 г бажаної сполуки як в'язкої олії. Вихід: 25,1 % + Мас: 274(M -1) СТАДІЯ-II: Одержання 2-[4-(7-Метокси-6-метил-індан-4-ілметил)-3,5-диметил-піразол-1-іл]етанол. До перемішаного розчину 3-(7-Метокси-6-метил-індан-4-ілметил)-пентан-2,4-діону (1,0 г, 0,0036 моль) у етанолі (15 мл), додавали розчин 2-гідразин-етанолу (0,33 г, 0,0043 моль) у етанолі (5 мл) при 25-30 °C та реакційну суміш нагрівали до 70 °C протягом години. Додавали оцтову кислоту (2 мл). Далі реакційну суміш перемішували при 70 °C протягом 3 годин. Етанол відганяли в вакуумі отримуючи залишку, який розділяли між етилацетатом (50 мл) та водою (25 мл). Етилацетат відганяли в вакуумі отримуючи неочищений продукт. Неочищений продукт випадав у осад після перемішування у діетиловому етері (10 мл). Тверду речовину відфільтровували у вакуумі та сушили отримуючи 700 мг бажаної сполуки як твердої речовини. Вихід: 61,4 % + Мас: 315(M +1) СТАДІЯ-III: Одержання 7-[1-(2-гідрокси-етил)-3,5-диметил-1H-піразол-4-ілметил]-5-метиліндан-4-олу. Його одержували використовуючи методику подібну до описаної для СТАДІЇ-VI Прикладу-2 Вихід: 45,4 % 1 H-ЯМР (400MГц, ДМСО-d6):δ 8,11 (1H, с), 6,43 (1H, с), 4,80 (1H, т), 3,95 (2H, т), 3,63 (2H, к), 3,43 (2H, с), 2,69-2,77 (4H, м), 2,08 (3H, с), 2,03 (3H, с), 1,92-1,99 (5H, м). + Мас: 301(M +1) Далі описані способи одержання проміжних сполук, які використовували для одержання сполук, вказаних у Таблиці-1: Одержання проміжних сполук 1: Одержання 7-метокси-6-метил-індан-4-карбальдегіду Спосіб-1 СТАДІЯ-I: Одержання 8-метил кумарину Суспензію 2-гідрокси-3-метил бензальдегіду (30 г, 0,220 моль) та безводного ацетату натрію (45 г, 0,55 моль) у оцтовому ангідриді (45 г, 0,44 моль) нагрівали при 175-180 °C протягом 6 годин. Реакційну суміш охолоджували, додавали воду (150 мл) та гексан (60 мл). Все перемішували протягом години та фільтрували. Отриману тверду речовину перемішували з діетиловим етером (30 мл). Потім суспензію відфільтровували та сушили отримуючи 19 г бажаного продукту. 24 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вихід: 85 % ЯМР (400MГц, CDCl3): δ 7,69 (1H, д), 7,35-7,37 (1H, м), 7,30-7,32 (1H, м), 7,16 (1H, т), 6,39 (1H, д), 2,44 (3H, с). СТАДІЯ-II: Одержання 8-метил дигідрокумарину. До розчину 8-метилкумарину (16,2 г) у етилацетаті (160 мл) додавали 10 % о./о. паладій на вугіллі (1,62 г). Гідрування здійснювали протягом 5 годин при 55-60 °C у автоклаві при 240-250 psi., використовуючи водень. Реакційну суміш відфільтровували крізь фільтр hyflow та відганяли у вакуумі отримуючи 14,5 г сполуки, вказаної у заголовку, як білої твердої речовини. Вихід:90 % ЯМР (400MГц, ДМСО-d6): δ 7,10-7,14(2H, м), 7,01(1H, т), 2,93-2,97(2H, м), 2,73-2,76(2H, м), 2,21(3H, с). СТАДІЯ-III: Одержання 4-гідрокси-5-метил-індан-1-ону. Суміш 8-метилдигідрокумарину (20 г, 0,123 моль) та трихлориду алюмінію (49,3 г, 0,370 моль) перемішували протягом 2 годин при 175-180 °C. До реакційної суміші повільно додавали воду (250 мл) та перемішували протягом години. Надалі її відфільтровували та отриману тверду речовину перемішували у метанолі (60 мл). Потім суспензію відфільтровували та отриману тверду речовину сушили у вакуумі отримуючи 13,5 г бажаного продукту як тверду речовину. Вихід:67,5 % ЯМР (400MГц, ДМСО-d6):δ 9,22 (1H, с), 7,15 (1H, д), 7,04 (1H, д), 2,96 (2H, т), 2,59 (2H, т), 2,24 (3H, с) СТАДІЯ-IV: Одержання 5-метил-індан-4-олу. До суспензії 4-гідрокси-5-метил-індан-1-ону (8 г) у метанолі (80 мл), додавали 10 % о./о. PdC. Гідрування здійснювали протягом 5 годин при 55-60 °C у автоклаві при 200-250 psi, використовуючи водень. Реакційну суміш відфільтровували крізь фільтр hyflow та фільтрат дистилювали в вакуумі отримуючи 6,0 г бажаного продукту як білу тверду речовину. Вихід: 82,2 % ЯМР (400MГц, ДМСО-d6): δ 8,36 (1H, с), 6,82 (1H, д), 6,58 (1H, д), 2,73-2,79 (4H, м), 2,10(3H, с), 1,92-1,99 (2H, м) СТАДІЯ-V: Одержання 7-гідрокси-6-метил-індан-4-карбальдегіду. До прозорого розчину 5-метил-індан-4-олу (6 г, 0,0405 моль) у 30 мл трифтороцтової кислоти, додавали гексамін (5,7 г, 0,0405 моль) при 25-28C. Реакційну суміш нагрівали та перемішували при 85-90C протягом 6 годин. Охолоджену реакційну суміш виливали у насичений розчин бікарбонату натрію та екстрагували етилацетатом (2200 мл). Органічний шар сушили над сульфатом натрію та відганяли у вакуумі отримуючи неочищений продукт, який очищали за допомогою колонкової хроматографії, використовуючи етилацетат:гексан (10:90) як рухому фазу. Зібрані фракції відганяли отримуючи 5,4 г бажаного продукту як тверду речовину. Вихід: 76 % ЯМР (400MГц, ДМСО-d6):δ 9,87 (1H, с), 9,63 (1H, шс), 7,44(1H, с), 3,14 (2H, т), 2,79 (2H, т), 2,18 (3H, с), 1,99-2,08 (2H, м). СТАДІЯ-VI: Одержання 7-метокси-6-метил-індан-4-карбальдегіду. До перемішаної суспензії 6-метил-7-гідрокси-індан-4-карбальдегіду (5 г, 0,0284 моль) та карбонату калію (4,7 г, 0,0340 моль) у диметилформаміді, додавали метилйодид (2,2 мл, 0,0312 моль) при 0 °C. Реакційну суміш перемішували при 25-30 °C протягом 4 годин, потім воду (200 мл) додавали та екстрагували етилацетатом (2100 мл). Шар етилацетату сушили над сульфатом натрію та випаровували отримуючи неочищену масу, яку очищали за допомогою колонкової хроматографії, використовуючи етилацетат:гексан (10:90) як рухому фазу. Фракції відганяли у вакуумі отримуючи 4,8 г бажаного продукту як в'язку олію. Вихід: 88,9 % ЯМР (400MГц, ДМСО-d6): δ 9,97 (1H, с), 7,50 (1H, с), 3,84 (3H, с), 3,14 (2H, т), 2,96 (2H, т), 2,22 (3H, с), 2,01-2,08 (2H, м) + Мас: 191(M +1) Спосіб- 2 СТАДІЯ -I: Одержання 4-гідрокси-індан-5-карбальдегіду. До перемішаної суспензії хлориду магнію (71,0 г, 0,745 моль) та параформальдегіду (33,6 г, 1,12 моль) у тетрагідрофурані (200 мл), додавали триетиламін (104 мл, 0,745 моль) при кімнатній температурі та перемішували протягом 30 хв. До реакційної суміші; додавали розчин індан-4-олу (50 г, 0,373) у тетрагідрофурані (100 мл) при кімнатній температурі та нагрівали до 70-75C протягом 6 годин. До реакційної суміші додавали 2N хлорводневу кислоту (600 мл) та екстрагували етилацетатом (2500 мл). Шар етилацетату промивали водою (300 мл), сушили 25 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 60 над сульфатом натрію та потім його відганяли в вакуумі отримуючи в'язку олію (52,0 г), яка перетворювалась на тверду речовину під час зберігання. Вихід: 86,0 % ЯМР (400MГц, ДМСО-d6):δ 10,76 (1H, с), 10,04 (1H, с), 7,55 (1H, д), 6,95 (1H, д), 2,91 (2H, т), 2,83 (2H, т), 2,02-2,09 (2H, м) СТАДІЯ-II: Одержання 5-метил-індан-4-олу До розчину 4-гідрокси-індан-5-карбальдегіду (5 г) у метанолі (80 мл) додавали 10 % о./о. паладій на вугіллі (500 мг). Гідрування здійснювали протягом 8 годин при 55-60 °C у автоклаві при 240-250 psi, використовуючи водень. Реакційну суміш відфільтровували крізь фільтр hyflow та відганяли у вакуумі отримуючи 4,0 г сполуки, вказаної у заголовку, як тверду речовину. Вихід: 88,0 % СТАДІЯ-III: Одержання 7-гідрокси-6-метил-індан-4-карбальдегіду Його одержували за способом, описаним для СТАДІЇ-V способу-1 для одержання проміжної сполуки 1. СТАДІЯ-IV: Одержання 7-метокси-6-метил-індан-4-карбальдегіду Його одержували за способом, описаним для СТАДІЇ-V способу-1 для одержання проміжної сполуки 1. 2: Одержання 7-метокси-6-(4-метил-бензол)-індан-4-карбальдегіду СТАДІЯ-I: Одержання 4-метокси-індан-5-карбальдегіду. До перемішаної суспензії 4-гідрокси-індан-5-карбальдегіду (52,0 г, 0,320 моль) та карбонату калію (57,2 г, 0,414 моль) у диметилформаміді (200 мл) додавали розчин метилйодиду (22 мл, 0,351 моль) у 60 мл диметилформаміду при 0-5 °C. Реакційну суміш перемішували при 25-28C протягом 4 годин та потім виливали у воду (200 мл), після цього її екстрагували етилацетатом (2500 мл). Органічний шар сушили над сульфатом натрію, відганяли у вакуумі отримуючи неочищений продукт, який очищали за допомогою колонкової хроматографії, використовуючи етилацетат:гексан (3:97) як рухому фазу. Зібрані фракції відганяли у вакуумі отримуючи 30 г бажаного продукту як в'язку олію. Вихід: 53,0 % ЯМР (400MГц, ДМСО-d6):δ 10,26 (1H, с), 7,54 (1H, д), 7,12 (1H, д), 3,92 (3H, с), 3,01 (2H, т), 2,91 (2H, т), 2,03-2,10 (2H, м). СТАДІЯ-II: Одержання 4-метокси-5-(4-метил-бензол)-індану. До перемішаної суспензії магнієвих ошурок (1,36 г, 0,056 моль) у 60 мл діетилового етеру, додавали 4-бромтолуол (8,7 мл, 0,071 моль) у 20 мл діетилового етеру при 30-40 °C в атмосфері азоту. Після цього її перемішували при 30-40 °C протягом 45 хв. Розчин 4-метоксиіндан-5-карбальдегіду (5,0 г, 0,0284 моль) у 20 мл діетилового етеру додавали до реакційної суміші при кімнатній температурі. Через годину перемішування при кімнатній температурі, додавали розведену хлорводневу кислоту та екстрагували етилацетатом (2100 мл). Органічний шар сушили над сульфатом натрію, відганяли у вакуумі отримуючи 8,0 г неочищеного спирту, взятого з триетилсиланом (40,0 мл, 0,250 моль) та додавали трифтороцтову кислоту (80 мл) при 0-5 °C. Після перемішування при 70 °C протягом 5 годин, реакційну суміш виливали у насичений розчин бікарбонату натрію та екстрагували етилацетатом (2100 мл). Шар етилацетату сушили над сульфатом натрію та відганяли отримуючи неочищену масу, яку очищали за допомогою колонкової хроматографії, використовуючи етилацетат:гексан (3:97) як рухому фазу. Фракції відганяли отримуючи 5,6 г чистого продукту як в'язку олію. Вихід: 78,2 % ЯМР (400MГц, ДМСО-d6):δ 7,05-7,07 (4H, с), 6,90 (1H, д), 6,87 (1H, д), 3,82 (2H, с), 3,62 (3H, с), 2,88 (2H, т), 2,79 (2H, т), 2,23 (3H, с), 1,95-2,01 (2H, м). СТАДІЯ-III: Одержання 7-метокси-6-(4-метил-бензол)-індан-4-карбальдегіду. Його одержували за способом, описаним для СТАДІЇ-V способу-1 для одержання проміжної сполуки 1. Вихід: 21 % ЯМР (400MГц, ДМСО-d6):δ 9,97(1H, с), 7,49(1H, с), 7,07(4H, с), 3,89 (2H, с), 3,78 (3H, с), 3,16(2H, т), 2,97(2H, т), 2,24(3H, с), 2,02-2,09(2H, м). + Мас: 281(M +1) 3. Одержання 7-метокси-3,6-диметил-індан-4-карбальдегіду СТАДІЯ-I: синтез 4-метокси-5-метил-індан-1-ону До суспензії 4-гідрокси-5-метил-індан-1-ону (50,0 г, 0,308 моль) та карбонату калію (127,0 г, 0,928 моль) у диметилформаміді (250 мл), додавали диметилсульфат (90 мл, 0,928 моль) при 0C. Реакційну суміш нагрівали при 60-65C та перемішували протягом 16 годин. Реакційну 26 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 суміш виливали у воду (1л) та екстрагували етилацетатом (3250 мл). Органічний шар сушили над сульфатом натрію та відганяли у вакуумі отримуючи 10,0 г неочищеного продукту, який очищали за допомогою колонкової хроматографії, використовуючи гексан як рухому фазу. Зібрані фракції відганяли у вакуумі отримуючи 45,0 г бажаного продукту як в'язку олію. Вихід: 82,5 % ЯМР (400MГц, ДМСО-d6):δ 7,30(1H, д), 7,27 (1H, д), 3,84 (3H, с), 3,12 (2H, т), 2,60-2,63 (2H, м), 2,31 (3H, с). СТАДІЯ-II: Синтез 4-метокси-1,5-диметил-індану. До суспензії магнієвих ошурок (2,72 г, 0,113 моль) у діетиловому етері (40 мл), повільно додавали розчин метилйодиду (13,7 мл, 0,219 моль) у діетиловому етері (10 мл) при 30-35C в атмосфері азоту. Реакційну суміш перемішували протягом години при кімнатній температурі та після цього додавали розчин 4-метокси-5-метил-індан-1-ону (10,0 г, 0,0568 моль) у діетиловому етері (30 мл) при 0C. Реакційну суміш перемішували протягом години при кімнатній температурі та потім розводили хлорводневою кислотою (50 мл). Її екстрагували етилацетатом (350 мл). Органічний шар сушили над сульфатом натрію, відганяли у вакуумі отримуючи 10,0 г неочищеного спирту. Отриманий спирт брали з триетилсиланом (41,3 мл, 0,258 моль) та додавали трифтороцтову кислоту (100 мл) при 0C. Реакційну суміш перемішували при 65-70C протягом 4 годин та виливали у насичений розчин бікарбонату натрію. Його екстрагували етилацетатом (2100 мл), сушили над сульфатом натрію, відганяли у вакуумі отримуючи неочищену масу, яку очищали за допомогою колонкової хроматографії, використовуючи гексан як рухому фазу. Зібрані фракції відганяли у вакуумі отримуючи 5,0 г бажаного продукту як в'язку олію. Вихід: 50 % ЯМР (400MГц, ДМСО-d6):δ 6,96 (1H, д), 6,81 (1H, д), 3,69 3H, с), 3,04-3,10 (1H, м), 2,87-2,94 (1H, м), 2,73-2,81 (1H, м), 2,21-2,28 (1H, м), 2,15 (3H, с), 1,46-1,55 (1H, м), 1,20 (3H, д). СТАДІЯ-III: синтез 7-метокси-3,6-диметил-індан-4-карбальдегіду. Його одержували за способом, описаним для СТАДІЇ-V способу-1 для одержання проміжної сполуки 1. Вихід: 43,1 % ЯМР (400MГц, ДМСО-d6):δ 9,98 (1H, с), 7,52 (1H, с), 3,86 (3H, с), 3,76-3,79 (1H, м), 2,89-3,08 (2H, м), 2,12-2,21 (4H, м), 1,79-1,84 (1H, м), 1,12 (3H, д). 4: Одержання 7-метокси-6-метил-2-(4-нітро-фенокси)-індан-4-карбальдегіду СТАДІЯ -I: синтез 2-бром-4-метокси-5-метил-індан-1-ону. До перемішаного розчину 4-метокси-5-метил-індан-1-ону (5,0 г, 0,0284 моль) у оцтовій кислоті (65 мл) та бромводневої кислоти (1 мл), додавали розчин брому (1,47 мл, 0,0284 моль) у 5 мл оцтової кислоти при 10-20C. Реакційну суміш перемішували при 20-25C протягом години. Після цього її виливали у насичений розчин бікарбонату натрію та екстрагували діетиловим етером (3100 мл). Органічний шар сушили над сульфатом натрію, відганяли у вакуумі отримуючи неочищений продукт, який очищали колонковою хроматографією, використовуючи етилацетат:гексан (5:95) як рухому фазу. Зібрані фракції відганяли отримуючи 3,2 г бажаного продукту як в'язку олію. Вихід: 44,2 % ЯМР (400MГц, ДМСО-d6): δ 7,44 (1H, д), 7,38 (1H, д), 5,00-5,03 (1H, м), 3,89-3,97(1H, м), 3,84 (3H, с), 3,31-3,36 (1H, перекривається з піком води присутньої у ДМСО-d6), 2,33 (3H, с). СТАДІЯ-II: синтез 4-метокси-5-метил-2-(4-нітро-фенокси)-індан-1-ону. До перемішаного розчину 2-бром-4-метокси-5-метил-індан-1-ону (2,0 г, 0,0078 моль) у диметилформаміді (15 мл) додавали натрієву сіль 4-нітрофенолу (1,27 г, 0,0078 моль) при 1015C. Після 2 годин перемішування при 25-28C, реакційну суміш виливали у воду (50 мл). Відділену тверду речовину відфільтровували, промивали гексаном та сушили у вакуумі отримуючи 1,8 г бажаного продукту як тверду речовину. Вихід:73,4 % ЯМР (400MГц, ДМСО-d6):δ 8,26 (2H, д), 7,30-7,43 (4H, м), 5,58 (1H, дд), 3,89-3,95 (1H, м), 3,85 (3H, с), 3,10-3,15 (1H, м), 2,34 (3H, с). СТАДІЯ-III: Синтез 4-метокси-5-метил-2-(4-нітро-фенокси)-індану. До суміші 4-метокси-5-метил-2-(4-нітро-фенокси)-індан-1-ону (1,8 г, 0,0057 моль) та тиретилсилану (9,0 мл, 0,0564 моль), додавали трифтороцтову кислоту (18 мл) при 2025C.Реакційну суміш нагрівали до 60-65C протягом 3 годин та потім виливали у насичений розчин бікарбонату натрію. Її екстрагували етилацетатом (2100 мл), сушили над сульфатом натрію, відганяли у вакуумі отримуючи неочищений продукт, який очищали за допомогою 27 UA 98962 C2 5 10 15 20 25 30 35 40 45 50 55 колонкової хроматографії, використовуючи етилацетат:гексан (2:98) як рухому фазу. Зібрані фракції відганяли у вакуумі отримуючи 1,2 г бажаного продукту як тверду речовину. Вихід: 69,7 % ЯМР (400MГц, ДМСО-d6):δ 8,22 (2H, д), 7,18 (2H, д), 7,02 (1H, д), 6,91 (1H, д), 5,40-5,43 (1H, м), 3,71 (3H, с), 3,38-3,51 (2H, м), 2,99-3,10 (2H, м), 2,18 (3H, с). СТАДІЯ-IV: Синтез 7-метокси-6-метил-2-(4-нітро-фенокси)-індан-4-карбальдегіду. Його одержували за способом, описаним для СТАДІЇ-V способу-1 для одержання проміжної сполуки 1. Вихід: 93,1 % ЯМР (400MГц, ДМСО-d6):δ 9,95 (1H, с), 8,19 (2H, д), 7,61 (1H, с), 7,19 (2H, д), 5,47-5,50 (1H, м), 3,88 (3H, с), 3,55-3,70 (2H, м), 3,42-3,46 (1H, м), 3,17-3,21 (1H, м), 2,25 (3H, с). + Мас: 328 (M +1) 5: Одержання 7-метокси-2,2,6-триметил-індан-4-карбальдегіду СТАДІЯ-I: Одержання 4-метокси-2,2,5-триметил-індан-1-ону. До суспензії 60 % гідриду натрію (2,72 г, 0,068моль) у 30 мл тетрагідрофурані додавали розчин 4-метокси-5-метил-індан-1-ону (10,0 г, 0,0568 моль) у тетрагідрофурані (30 мл) при 05 °C; після цього, додавали метилйодид (9,09 мл, 0,146 моль) при 0 °C. Реакційну суміш перемішували протягом 2 годин, потім додавали воду (100 мл) та екстрагували етилацетатом (2100 мл). Шар етилацетату сушили над сульфатом натрію та випаровували отримуючи неочищену масу, яку очищали колонковою хроматографією, використовуючи етилацетат:гексан (3:97) як рухому фазу. Фракції відганяли у вакуумі отримуючи 3,0 г бажаного продукту як в'язку олію. Вихід: 25,88 % ЯМР (400MГц, ДМСО-d6):δ 7,31(1H, д), 7,29 (1H, д), 3,83 (3H, с), 3,03 (2H, с), 2,30 (3H, с), 1,14 (6H, с). СТАДІЯ-II: Одержання 4-метокси-2,2,5-триметил-індану. Його одержували за способом, описаним для СТАДІЇ-ІІІ для одержання проміжної сполуки 4. Вихід: 92,3 % ЯМР (400MГц, ДМСО-d6): δ 6,99 (1H, д), 6,79 (1H, д), 3,68 (3H, с), 2,70 (2H, с), 2,62 (2H, с), 2,14 (3H, с), 1,10 (6H, с). СТАДІЯ-III: Одержання 7-метокси-2,2,6-триметил-індан-4-карбальдегіду. Його одержували за способом, описаним для СТАДІЇ-V способу-1 для одержання проміжної сполуки 1. Вихід: 50,8 % ЯМР (400MГц, ДМСО-d6): δ 9,95 (1H, с), 7,51 (1H, с), 3,83 (3H, с), 2,98 (2H, с), 2,80 (2H, с), 2,21 (3H, с), 1,12 (6H, с). 6: Одержання 7-метокси-6-(піролідин-1-карбоніл)-індан-4-карбальдегіду СТАДІЯ-I: Одержання 4-метокси-індан-5-карбонової кислоти. До прозорого розчину 4-метокси-індан-5-карбальдегіду (11,5 г, 0,065 моль) у дихлорметані (100 мл), додавали сульфамову кислоту (19,0 г, 0,196 моль) при 25-28°. Розчин хлориту натрію (15,28 г, 0,169 моль) у воді (50 мл) додавали при 5-10C. Реакційну суміш перемішували протягом 5 годин при 25-28 °C. Потім реакційну суміш виливали у воду (200 мл) та екстрагували дихлорметаном (2200 мл). Органічний шар сушили над сульфатом натрію, відганяли у вакуумі отримуючи 12,0 г бажаного продукту як в'язку олію. Вихід: 96,0 % +-1 Мас: 191 (M ) СТАДІЯ-II: Одержання (4-метокси-індан-5-іл)-піролідин-1-іл-метанону. До прозорого розчину 4-метокси-індан-5-карбонової кислоти (12,0 г, 0,0625 моль) у тетрагідрофурані (60 мл), додавали карбоніл-діімідазол (13,24 г, 0,0812 моль) при 25-28 °C. Реакційну суміш нагрівали до 65-70 °C та перемішували протягом 2 годин, до реакційної суміші додавали розчин піролідину (5,74 мл, 0,0687 моль) у тетрагідрофурані (20 мл) при 10-15 °C. Реакційну суміш виливали у воду (200 мл) та екстрагували етилацетатом (2100 мл). Органічний шар сушили над сульфатом натрію, відганяли у вакуумі та очищали колонковою хроматографією, використовуючи етилацетат:гексан (20:80) як рухому фазу. Фракції відганяли у вакуумі отримуючи 6,0 г бажаного продукту як в'язку олію. Вихід: 39,2 % ЯМР (400MГц, ДМСО-d6):δ 6,98 (2H, с), 3,74 (3H, с), 3,44 (2H, т), 3,13 (2H, т), 2,85-2,94 (4H, м), 2,01-2,06 (2H, м), 1,75-1,88 (4H, м). СТАДІЯ-III: Одержання 7-метокси-6-(піролідин-1-карбоніл)-індан-4-карбальдегіду 28
ДивитисяДодаткова інформація
Назва патенту англійськоюThyroid hormone analogues, pharmaceutical composition comprising thereof, method for the treatment using thereof, use thereof and preparation method
Автори англійськоюChhipa, Laxmikant, Zambad, Shitalkumar Pukharaj, Gupta, Ramesh, Tuli, Davinder, Kasundra, Ashok, Munshi, Siralee, Siddiqui, M. Amir, Bhattamisra, Subrat Kumar, Dutt, C., Chauthaiwali, Vijay
Назва патенту російськоюАналоги тиреоидного гормона, фармацевтическая композиция, которая их содержит, способ лечения с их использованием, их применение и способ получения
Автори російськоюЧхипа Лаксмикант, Замбад Шиталкумар Пукхарай, Гупта Рамеш, Тули Давиндер, Касундра Ашок, Мунши Сирали, Сиддиквуй М. Амир, Бхаттамисра Субрат Кумар, Дутт С., Чаутайвале Виджай
МПК / Мітки
МПК: A61K 31/4155, C07D 231/14, C07D 403/06, A61P 3/04
Мітки: одержання, застосування, композиція, тироїдного, фармацевтична, лікування, гормону, спосіб, використанням, аналоги, містить
Код посилання
<a href="https://ua.patents.su/54-98962-analogi-tirodnogo-gormonu-farmacevtichna-kompoziciya-shho-kh-mistit-sposib-likuvannya-z-kh-vikoristannyam-kh-zastosuvannya-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Аналоги тироїдного гормону, фармацевтична композиція, що їх містить, спосіб лікування з їх використанням, їх застосування та спосіб одержання</a>
Попередній патент: Похідні піразинону та їх застосування у лікуванні легеневих захворювань
Наступний патент: Карбонат кальцію з модифікованою поверхнею в комбінації з гідрофобним адсорбентом для очистки води
Випадковий патент: Пристрій для обрізки копитець












