Спосіб одержання z-2-(аціламіно)-3-монозаміщених пропеонатів
Номер патенту: 2630
Опубліковано: 26.12.1994
Автори: Фредерік М.Кахан, Едвард Ф.Роджерс, Дональд В. Грехем
Формула / Реферат
Формула изобретения
Способ получения Z-2-(Aцил-амино)-3-монозамещенных препаратов общей формулы І
где R1 - водород, -алкил, натрий;
при этом один или два атома водорода в R2 и R3 могут быть замещены на хлор или бром, когда R3 - прямолинейный - алкил, а R2 не является С3-С4 – алкилом, отличающийся тем, что соединение общей формулы II
где R1 и R3 имеют указанные значения подвергают взаимодействию с амидом общей формулы III
где R2 имеет указанное значение, в среде растворителя при температуре его кипения и процесс ведут при массовом соотношении соединений формулы II и III (1-4):1 с одновременной азеотропной отгонкой образующейся воды.
Текст
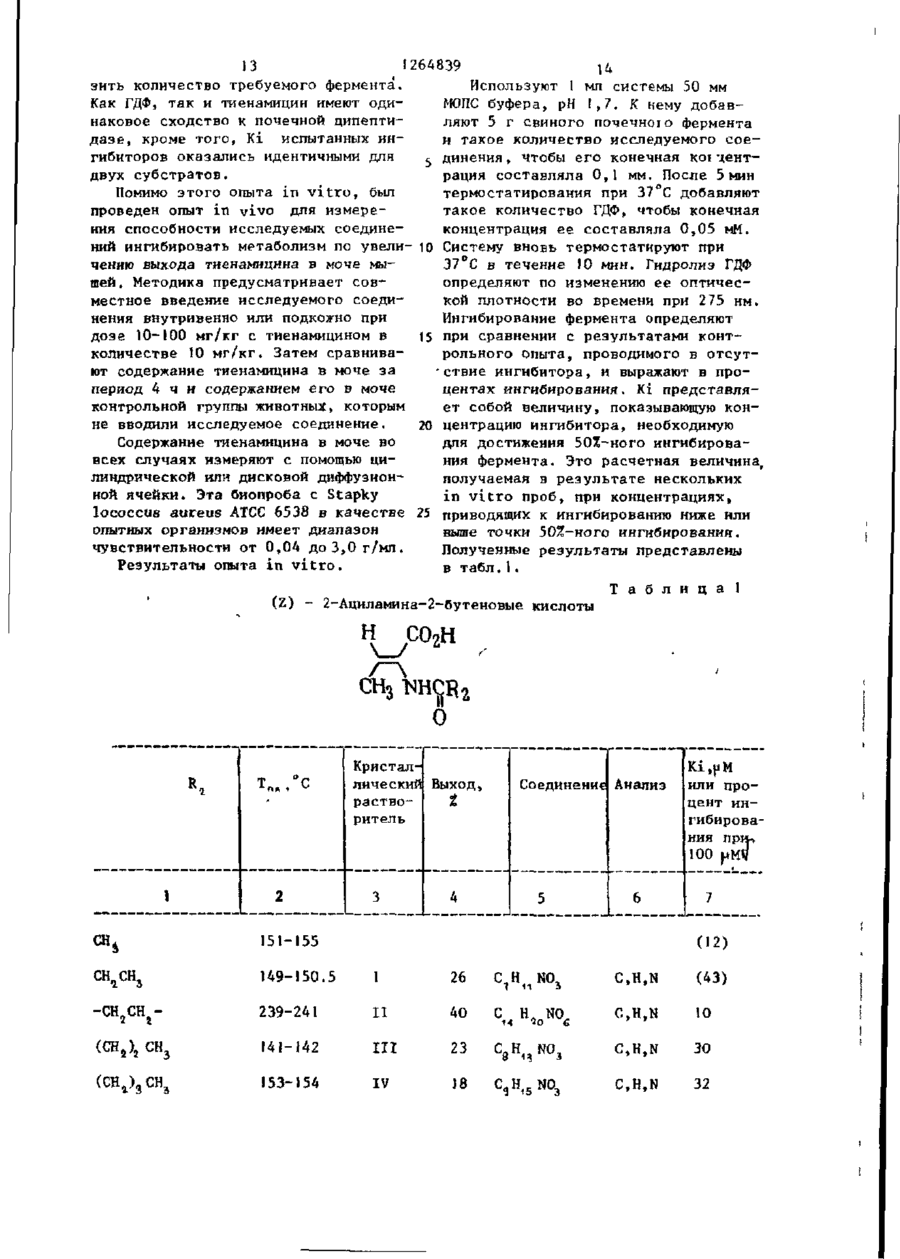
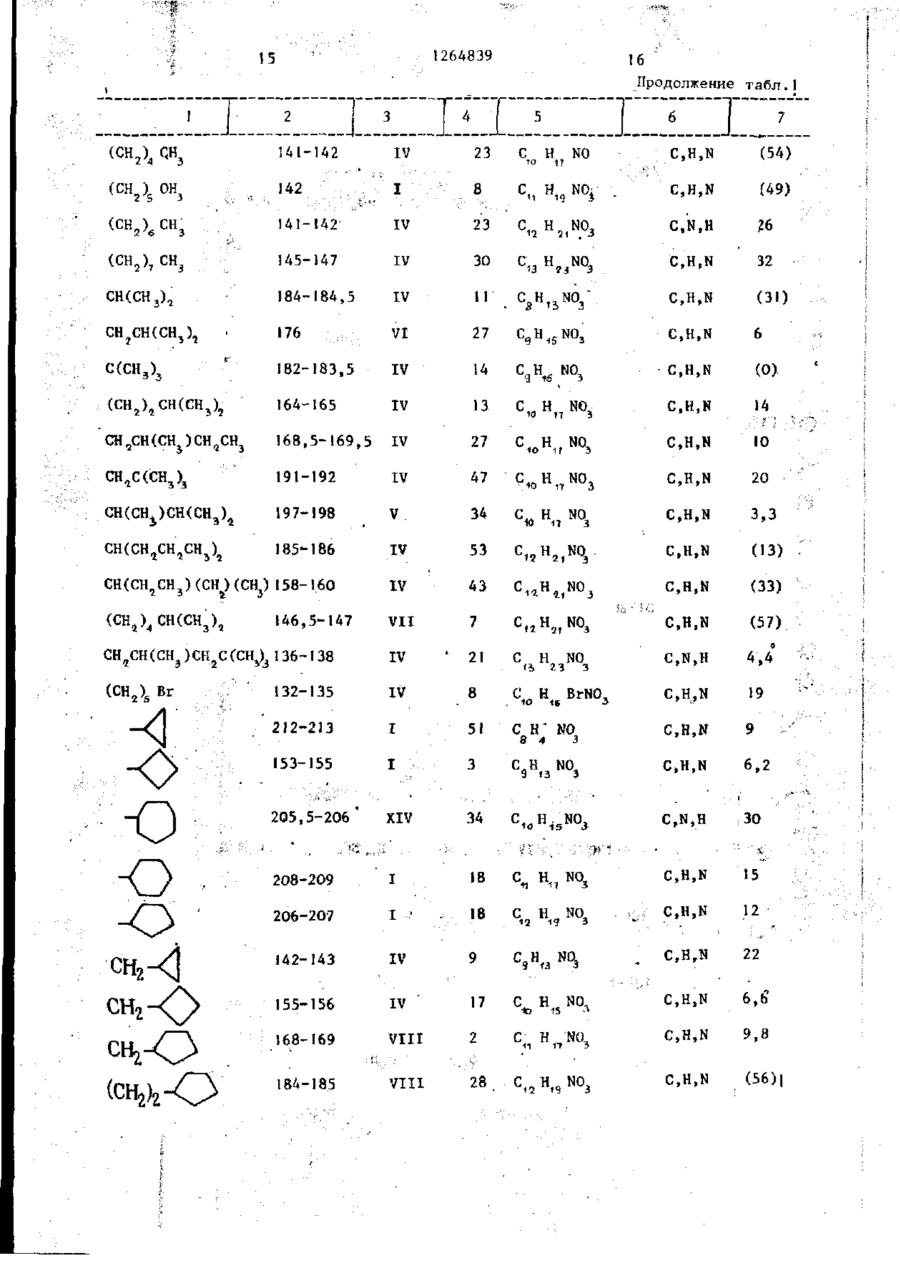
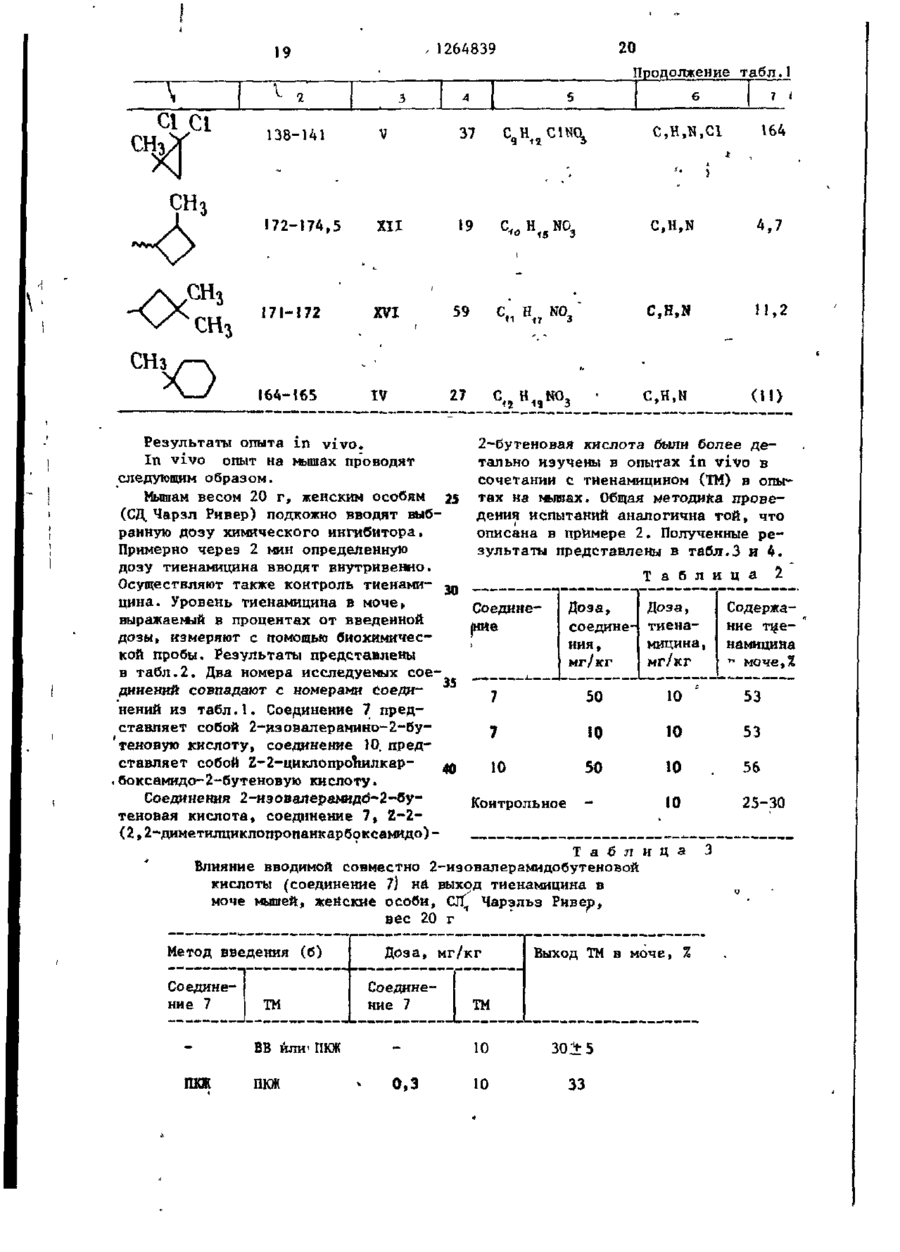
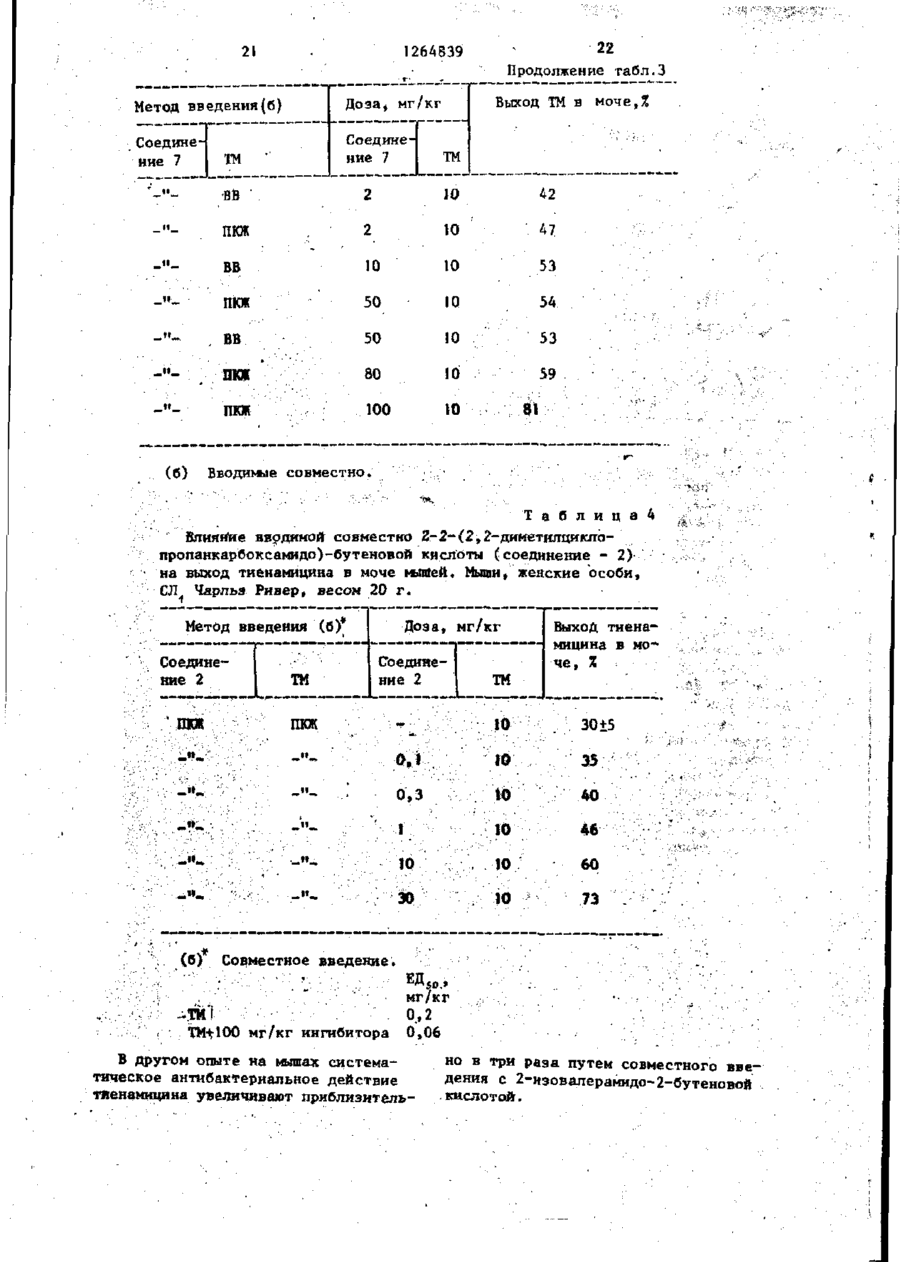
СПОСОБ ПОЛУЧЕНИЯ г-2-(АЦШ1АМИН0)-3-МОНОЗАМЕЩЕННЫХ ПРОПЕОНАТОВ общей формулы I R CONH С=С Н R ООС где R - водород, С1 - С6~алкил, натрий; Ro - С - С о - а л к и л ; R 3 - Ct - С 1О - а л к и л , при э т о м один или д в а а т о м а в о д о р о д а в R j и R j могут быть з а м е т е н ы н а хлор или б р о м , к о г д а R 3 - прямолинейный С 1 ~ С - а л к и л , a R, н е я в л я е т с я С 3 ~ С4-алкилом, о т л и ч а ю щ и й с я т е м , ч т о с о е д и н е н и е общей формулы I I COOR j 1 где R1 и R имеют указанные значения подвергают взаимодействию с амидом общей формулы III 0 М где R имеет указанное значение, в среде растворителя при температуре его кипения и процесс ведут4 при массовом соотношении соединений формулы II и III (1-4):1 с одновременной аэеотропной отгонкой образующейся воды. СО С 00 СО со № £ 4 ' і» Ь 1264839 1 . 1 в 20 мл толуола кипятят при переме^ Изобретение относится к органишивании, собирая воду в маленькой ческой химии, а именно к способу половушке Дин-Старка. Через 20 ч растлучения 2-2-(ациламино)-3~монозамевор охлаждают и обрабатывают слабым щенных пропеонатов формулы 5 током а з о т а . Перед испарением основR CONH 2 ной части растворителя кристаллизаС=С. (О цию индуцируют трением. После вызре00C н вания остаток собирают на фильтре и где R, - водород, С - С -алкил, натпромывают толуолом й некоторым колирий; '0 чеством ( С 9 Н 6 ) а О . Выход белого крис-' R. - С,- С о -алкил; . •... таллического продукта составляет 3 0,63 г (30%). T nft 154,5-155,0°(незпри этом один или два атома водорода начительное предварительное размягв R 2 и R могут быть замещены на чение) . ТСХ (4:1 толуол - АсОН) покахлор или бром, когда R 3 - прямолиней'5 зывает только чрезвычайно, незначиный С1 - СА-алкил, a R 2 не является тельные следы другого изомера. ЯМРСг~. "С. -алкилом, которые могут быть спектр соответствует 2-конфигурации. ;использованы в Ka4ectBe ингибиторов Найдено: С 6 2 , 8 6 ; Н 8,27; N 6 , 7 5 . метаболизма 'дипептидазы. Целью изобретения является разра20 Рассчитано: С 6 2 , 5 3 ; Н 8 , 1 1 ; ботка доступного способа получения N 6,63. Z-2-(ациламино)-З-монозамещенных проП р и м е р З . 2-2-(3-Циклопенпеонатов, обладающих свойством ингитилпропионамидо)-2-бутеновая кислота.! бнровать метаболизм дипептидазы в Раствор 1,41 г (10 ммоль) 3-циклоорганизме. П р и м е р I . Z-2-Изовалерамидо- 25 пентилпропионамида и 1,53 г (15 ммоль) 2-кетомасляной кислоты 2-бутеновая кислота. -перемешивают при кипячении над маРаствор 1,07 г (10,5 ммоль) 2-келенькой ловушкой Дин-Старка. Через томасляной кислоты и 0,71 г (7,0 ммоль) 8 ч раствор охлаждают, в результате изовалерамида в 15 мл толуола перемешивают при температуре кипения и чего идет обильная кристаллизация. собирают воду в маленькой ловушке Остаток собирают на фильтре и промыДин-Старка. Через 5 ч раствор охлажвают толуолом и С СІ. . Выход крисН дают, в результате чего идет сильная таллического продукта составляет кристаллизация. После вызревания оса1,44 г T nft 180,5-182°C (предварительдок собирают и промывают толуолом, а 35 ное размягчение). Продукт перекрисзатем СН 2 С1 2 . Выход белого кристалталлизовывают из металэтилкетона. Вылического вещества составляет 0,47 г, ход белых игольчатых кристаллов 0,63 г Т„, 172-174 (незначительное предва(28%) Т п л 184-185° (незначительное рительное размягчение). Продукт пепредварительное размягчение). ТСХ рекристаллизовывают из диизопропил40 (4:f толуол - АсОН) показывает одно кетона. ТСХ (4:1 толуол-АсОН) покапятно, а ЯМР-спектр соответствует зывает только незначительные следы полностью Z-иэомеру. другого изомера. Найдено: С 63,99; Н 8,67; N 6,27. Выход белых кристаллов составляет0,32 г (25%) Т.ПА. 175 (незначительное 45 Рассчитано: С 63,97; Н 8,50; предварительное размягчение). По данN 6,22. ным ЯМР полученный продукт представП р и м е р 4 . 2-2-(2-Этилгексанляет собой исключительно Z-изомер. амидо)-2-бутеновая кислота. 10 г 2Найдено: С 58,89; Н 8,55; N 7 , 4 3 . этилгексаноил хлорида по каплям при С 50 перемешивании добавляют к 25 мл ох5 лажденного концентрированного растРассчитано: С 58,36; Н 8,16; вора N О в результате чего сразу» H Н N 7,56. же выпадает осадок. Смесь перемешиваП р и м е р 2. г-2-(2,2-Диметилют в течение 2 ч, затем отфильтровыциклопропанкарбоксамидо)-2-пентено55 вают и высушивают на воздухе, в р е вая кислота. зультате чего получают 6,5 г амида. Раствор 1,74 г (15 ммоль) 2-кето1,4 г (10 ммоль) полученного соединевалериановой кислоты и 1 ,13 г (10 ммоль) ния н 1,5 г кетомасляной кислоты 2,2-диметилциклопропанкарбоксамида Л Ч 264839 (15 ммоль) кипятят в 25 мл толуола в течение 15 ч с отгонкой воды. Реакционную смесь охлаждают и частично упаривают в токе азота. Кристаллизация продукта происходит после вызре- 5 вания в течение 3 ч. Кристаллы собирают, трижды промывают толуолом и высушивают на воздухе. Выделяют 1,13 г (50%) продукта, Тпл 160-162°, ЯМРспектры соответствуют заданной струк- Ю туре и показывают присутствие 5%-ного Е-иэомера, ТСХ показывают (4:1 Толуол-АсОН) одно пятно. Найдено: С 56,20; Н 6 , 8 3 ; N 5,32. Рассчитано; С 56,46; Н 6 , 7 1 ; N 5,49. П р и м е р 7. г-2-(2,2-Диэтилдициклопропанкарбоксамидо)-2~бутеновая кислота. Смесь 2,3 г 2-кетомасляной кислоты, 2,0 г 2,2-диэтилциклопропанкарбоксамида и 25 мл толуола кипятят в течение 16 ч с удалением воды с помощью модифицированной ловушки ДинСтарка, содержащей молекулярные сита ( 4 а ) . При охлаждении продукт не выпадает в осадок. Затем добавляют серный эфир (25 мл) и смесь экстрагируют насыщенным раствором Na0HC03 (трижды). Объединенные фракции подкисляют концентрированной НС1. Смолоподобный осадок закристаллизовывает— ся при смешении с водой. После перекристаллизации из этилацетата получают 0,31 г продукта. ТП(1 129-130°С. ЯМР-спектр соответствует продукту с требуемой структурой. Найдено: С 6 3 ^ 6 3 ; Н 9 , 4 3 ; N 5 , 8 8 . (C12H2,NO3) .5 Рассчитано: С 63,40; Н 9,30; N 6,16. П р и м е р 5. г-2-(2,2-Диметилциклопропанкарбоксамидо)-2-бутеновая кислота. 20 1.53 г ( Ї 5 ммоль) 2-кетомасляной кислоты 1,13 г (10 ммоль) 2 , 2 - д и м е тилциклопропанкарбоксамида и 20 мл толуола перемешивают при температуре кипения в течение 10 ч . После охлаж- 25 Найдено: С 6 4 , 0 1 ; Н 8,62; N 6 , 2 1 . дения кристаллический продукт отфильтровывают, промывают толуолом (3 х Рассчитано: С 63,98; Н 8,50; х 10 мл) и высушивают, в р е з у л ь т а т е N 6,22. чего получают 1,06 г продукта, Т п л П р и м е р е . 2-(2,2-Диметилди140-141 о С. ТСХ ( 4 : 1 толуол - АсОН) 30 циклопропанкарбоксамидо)-2-гексенопоказывает практически одно п я т н о , вая кислота, ЯМР-спектр с о о т в е т с т в у е т требуемой Третбутиловый сложный эфир D1структуре. норлейцина. После перекристаллизации из Et OAc К суспензии 9,82 г (75 ммоль) DLи высушивания получают 0 , 5 3 3 г про- 3 5 норлейцина в 80 мл диоксана, помещенд у к т а , T r t A 1 4 2 - 1 4 3 , 5 ° , гомогенного ной в 500 мл автоклав, охлажденной по данным ТСХ. на ледяной бане, медленно (с перемешиванием) добавляют концентрированНайдено: С 60,92; Н 7,71; N 7,38. ной Н S o . Охлаждая полученную смесь на ледяной бане, добавляют 80 мл жид40 Рассчитано: С 60,90; Н 7,67; кого иэобутилена. Смесь нагревают до N 7,10. комнатной температуры и перемешивают П р и м е р 6. 2-2-(2,2-Диметнлпод аутогенным давлением примерно в циклопропанкарбоксамидо)-2-гександнтечение 23 ч. После того, как основкислота. 5 ную часть изобутилена выпускают из Смесь 1,0 г 2,2-диметилцикпопро~ * автоклава, слегка мутный раствор охпанкарбоксамида, 2,4 г 2-кетоаддипнлаждают на ледяной бане, а затем доновой кислоты и 25 мл метилизовалег бавляют к охлажденной смеси 400 мл р а т а кипятят в течение 4 ч , удаляют iH.NaOH и 500 мл Et^O. После встряхи-* воду с помощью модифицированной л о вушки Дин-Старка, содержащей молеку- 50 вания в отдельной воронке происходит разделение слоев, водную фракцию пролярные сита ( 4 а ) . После вызревания мывают дополнительными 10 мл Ес^О. при комнатной температуре в течение EtjO раствор встряхивают с 150 мл ночи кристаллический о с т а т о к отфильт0,5 н.НСК Кислую водную фракцию обровывают, промывают серным эфиром н перекристаллнзовывают из э т и л а ц е т а т а , 5 5 рабатывают 2,5 н. NaOH до достижения сильно щелочной реакции, а затем в р е з у л ь т а т е чего получают 0 , 2 3 г встряхивают с 250 мл Et £ 0. Et 2 0 растпродукта ТГ1л 163-165°, ЯМР-спектр с о вор сушат (MgSO^), отфильтровывают и о т в е т с т в у е т требуемой с т р у к т у р е . $ 1 264839 6 ной температуре под атмосферой азота концентрируют на ротационном испари*в отсутствии света. Через 16,5 ч вытеле. После продолжительного вакуумипавший в осадок хлористый натрий отрования под высоким вакуумом над пафильтровывают. Фильтрат разбавляют ровой баней получают прозрачный бес(С 3 Н ) 2 и последовательно промывают цветный маслянистый продукт в коли3x50 мл 0,5 н.НСІ, 50 мл насыщенного честве 9,04 г (65%). ЯМР~спектр пока^ С 0 3 и 2x50 мл воды (С^Н,.)^ фазу зывает наличие следов диоксана, ТСХ осушают над MgSO^ и"отфильтровывают. (9:! СНС! - МеОН) показала одно Фильтрат выпаривают на ротационном пятно. Третбутиловый сложный эфир -N-(2, Ю испарителе. Бледное, золотисто-желтое масло (6,45 г) подвергают препа2-диметилциклопропанкарбонил)-ВЬ-норративной жидкостной хроматографии вылейцина. сокого давления, в результате чего К раствору 8,98 г (48 ммоль) третотделяют и выделяют 273 и 496 мг бутилового сложного эфира DL-норлей15 двух диастереомеров - третбутил 2цина и 5,05 г (50 ммоль) триэтилами(2,2-диметилциклопропанкарбоксамидо)на в 100 мл СН^СЦ» перемешиваемому 2-метоксигексаноата)(соответствуюна ледяной бане под осушающей трубщие Т п л П 4 - П 8 ° и 124-125,5°), а кой, по каплям (в течение 75 мин) дотакже 1,97 г самостоятельного изомебавляют раствор 6,39 г (48 ммоль 2,2-диметилциклопропанкарбонилхлори- 20 ра (очевидно Z) третбутил-2-(2,2-дида) в 50 мл СН 2 С1 7 . Осаждение Et3N. метилциклопропанкарбоксамидо)-2-гекНС1 происходит в процессе добавления саноата (бесцветное масло). реактанта, особенно ближе к концу. « , 2-(2,2-ДиметилциклопропанкарбоксПо мере плавления льда смесь нагреамидо)-2-гексеновая кислота. вается до комнатной температуры. Че- 25 Раствор 0,84 г (3,0 ммоль) третрез 16 ч смесь встряхивают с 200 мл бутил- 2- (2,2-диметилциклопропанкар0,5 н.НСІ. СН 2 С1 г фракцию промывают боксамидо)-2 гексеноата в 10 мл дополнительно 200 мл 0,5 н.НСІ, за( С 2 Н 5 ) 2 , насыщенный безводным НСІ, *тем 2x200 мл 0,5 н. NaOH и оконча• выдерживают при комнатной температутельно - 200 мл Н а 0 СН..С1, фракцию Зо Р е под осушительной трубкой. Через сушат MgSO», обрабатывают активиро17 ч раствор выпаривают и оставшуюванным углем и отфильтровывают через ся массу растворяют в 10 мл насыщенпелит, фильтрат концентрируют на роного NaHCO . Этот раствор промывают тационном испарителе (под высоким надополнительными 15 мл 0,5 н.НСІ, закуумом). Выход конечного продукта, тем высушивают (MgSO 4 ), отфильтровыпредставляющего собой светло-оранжевают и выпаривают, в результате чего вое вещество, составляет 11,93 г получают вязкое масло. Масло перек(88%) ДСХ (2:1 гексан - Et ОА с) пористаллизовывают из толуола. Выход казывает одно пятно. ЯМР- и ИК-спекбелых1 кристаллов составляет 0,32 г тры соответствуют соединению задан( 4 % . Т п л 119-122°. ТСХ (4:1 толу.7) 40 ной структуры. После вызревания в ол АсОН) показывает одно пятно. ЯМРтечение нескольких дней неиспользоспектр подтверждает образование пракванная часть этого продукта закристически чистого Z-изомера. Примечаталлизовыва^тся. T n ( V 52 - >65°С. ние: при обработке аддукта метанола, Третбутил 2-(2,2-диметилциклопро- 45 третбутил 2-(2,2-диметилциклопропанпанкарбоксамидо)-2-метоксигексаноат. карбоксамидо)-2-метоксигексеноата, безводным НС1 в среде (С а Н 5 ) 7 0 в анаК раствору 6,37 г (22,5 ммоль) логичных условиях образуется тог же третбутнлового сложного эфира N-(2,2продукт. диметилциклопропанкарбонил)-ОЬ-норлейцина в 35 мл Et a 0, перемешиваемо- 50 П р и м е р 9. (+)-2-2-(2,2-Димему при комнатной температуре под аттилциклопропанкарбониламино)-2-октемосферой азота в отсутствие света, новая кислота, натриевая соль. добавляют 2,69 мл (2,45 г, 22,5 ммоль Реагенты -(+)-2,2-Диметилциклопротретбутил гипохлорита. Через 15 мин панкарбоксамид, 7,0 г сложный этилодобавляют раствор метоксида натрия, 55 вый эфир 2-кетооктановой кислоты, полученный растворением 0,52 г 14,7 г; 50 мг пара - толуолсульфоно(22,6 ммоль) натрия в 35 мл СН„ОН. вой кислоты; и 100 мл толуола загруПеремешивание продолжают при комнатжают в 250 мл трехгорлую колбу под 8 1264839 50%-ного метанола и высушивают под ловушкой Дин-Старка, содержащей табвакуумом. Выход сырой соли хинина летки молекулярного сита. Б течение составляет 44,8 г (48,7%)выход мо27 ч смесь интенсивно кипятят. Обраногидрата, Т п л *ПЗ-116°С, Ы ] м зовавшийся светло-желтый раствор охлаждают и выпаривают под вакуумом на 5 = 94,4°, С ь 1,0; CHCl^ . Э т о Л а т е риал перекристаллизовывают из ацетоводяной бане при 45°С в присутствии на и получают .24,35 г'продукта, воды для облегчения удаления толуола. Т 127-І30°С. Очищенную хиноновую Оставшуюся массу суспендируют в соль превращают в кислоту обработкой 230 мл 2н.ЫаОН и перемешивают при 30°С в течение 3 ч, затем Температу- 10 водным основанием и хлороформом, и последующей обработкой кислотой, в ру повышают до 35°С и греют при ней результате'чего попучают (96%) 3,9 г еще в течение 2-1/2 ч до образовапродукта, имеющего [ос] 146,0° . ния прозрачного раствора. Затем раствор охлаждают, добавляют 85 мл хлоКислоту превращают в амид следуристого метилена и доводят рН 8,5 (5 ющим образом. 30,5 г (+) кислоты э среды до с помощью 4н.НС1 при перетечение 5-Ю мин добавляют через камешивании. Органический слой отделяпельную воронку к охлажденному 10°С ют и отбрасывают. Водный слоЙ(Зббмл) хлористому оксалилу 54 мл, содержащеанализируют методом жидкостной хромаму I каплю диметилформамида. Смесь тографии и определяют, что он содер- 20 перемешивают в течение ночи при комжит 37,2 мг/мл, 87% Z-изомера. Затем натной температуре. Образовывается добавляют другую порцию 85 мл СН С1 2 прозрачный раствор, который добавлян доводят рН до 4,5 при перемешивают к 100 мл хлористого метилена для нии. Органический слой отделяют, а разбавления. Избыток хлористого оксаводный слой вновь экстрагируют 50 мл 25 лила удаляют концентрированием и СН а С1 й и доводят рН до 4,5. Объедисмесь дважды промывают хлористым мененные органические экстракты сушат тиленом. Na^SO., отфильтровывают и выпаривают, Образовавшийся раствор разбавляют полученный остаток растворяют в 150мл равным объемом хлористого метилена и изопропанола и 15 мл воды н доводят 30 непрерывно добавляют через капельную рН до 8,2 с помощью 2 H.NaOH. Обравороику примерно к 100 мл безводного зовавшийся раствор концентрируют до жидкого аммиака, который разбавляют маслянистого остатка, который промы100 мл хлористого метилена. вают изопропанолом до тех пор, пока П р и м е р 10.. г-2-(2,2-Дихлорон не превратится в кристаллическое 35 циклопроп
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing z-2-(acylamino)-3-monosubstituted propionates
Автори англійськоюDonald B. Graham
Назва патенту російськоюСпособ получения z-2-(aцил-амино)-3-монозамещенных пропионатов
Автори російськоюДональд В. Грехем
МПК / Мітки
МПК: A61K 31/16, C07C 321/00, C07C 233/36, C07C 233/59, C07C 233/63, C07C 233/47, C07C 233/18, C07C 233/62, C07C 235/10, C07C 235/08, C07D 333/24, C07C 233/60, C07C 235/12, C07C 235/40, C07C 233/48
Мітки: z-2-(аціламіно)-3-монозаміщених, одержання, спосіб, пропеонатів
Код посилання
<a href="https://ua.patents.su/14-2630-sposib-oderzhannya-z-2-acilamino-3-monozamishhenikh-propeonativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання z-2-(аціламіно)-3-монозаміщених пропеонатів</a>
Попередній патент: Фільтр періодичної дії, який працює під тиском
Наступний патент: Пристрій для одноразового відбору проб газу з циліндру двигуна внутрішнього згорання
Випадковий патент: Гідророзподільник гірничого комбайну