Сполуки семікарбазонів та композиція, що виявляє протисудомну активність
Номер патенту: 62915
Опубліковано: 15.01.2004
Формула / Реферат
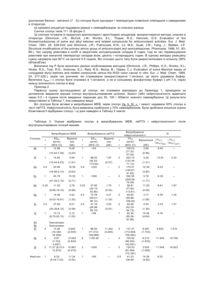
1. Сполука семікарбазону загальної формули (I)
, (І)
де R1, R2, R3 та R4 можуть бути ідентичними або різними, і є воднем, галогеном, C1-9 алкілом, ціано, С1-9 алкокси або фенокси;
R5 є воднем або С1-9 алкілом;
X є киснем або сіркою,
за умови, що а) якщо X є сіркою, то хоча б один з радикалів R1 та R2 не є воднем, а є іншим замісником або хоча б один з радикалів R3 та R4 є фтором, C1-9 алкілом, ціано, C1-9 алкокси, і b) якщо X являє собою кисень, R5 є воднем, метилом чи етилом і один з радикалів R1 та R2 є хлором, то інший радикал з R1 та R2 не є воднем чи хлором або хоча б один радикал з R3 і R4 не є воднем, а є іншим замісником, і с) якщо X являє собою кисень, R5 є воднем, метилом чи етилом, і один з радикалів R1 та R2 не є метокси, то інший радикал з R1 чи R2 не є воднем чи метокси або хоча б один радикал з R3 чи R4 не є воднем, а є іншим замісником, і d) якщо X являє собою кисень, R5 є воднем, метилом чи етилом і один з радикалів R1 та R2 є метилом, то інший радикал з R1 та R2 не є воднем або хоча б один радикал з R3 та R4 не є воднем, а є іншим замісником, і е) якщо X являє собою кисень, R5 є воднем, метилом або етилом, і якщо обидва радикали R1 та R2 є воднем, то хоча б один з радикалів R3 та R4 не є воднем та метилом, а є іншим замісником, або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка відрізняється тим, що хоча б один з радикалів R1 та R2 є воднем або галогеном, кожен з радикалів R3 і R4 є воднем, R5 є воднем або C1-3 алкілом та X є киснем.
3. Сполука за п. 1, яка відрізняється тим, що хоча б один з радикалів R1 та R2 є фтором, R5 є воднем та X є киснем.
4. Сполука за п. 1, яка відрізняється тим, що є одною з таких сполук:
4-(4-бромфенокси)бензальдегід семікарбазон,
4-(4-йодфенокси)бензальдегід семікарбазон,
4-(4-ціанофенокси)бензальдегід семікарбазон,
4-(2-фторфенокси)бензальдегід семікарбазон,
4-(3-фторфенокси)бензальдегід семікарбазон,
4-(2,3-дифторфенокси)бензальдегід семікарбазон,
4-(2,4-дифторфенокси)бензальдегід семікарбазон,
4-(2,5-дифторфенокси)бензальдегід семікарбазон,
4-(2,6-дифторфенокси)бензальдегід семікарбазон,
4-(3,4-дифторфенокси)бензальдегід семікарбазон,
4-(4-хлор-2-фторфенокси)бензальдегід семікарбазон,
4-(2-хлор-4-фторфенокси)бензальдегід семікарбазон,
4-(2-бром-4-фторфенокси)бензальдегід семікарбазон,
4-(4-етилфенокси)бензальдегід семікарбазон,
4-(4-н-пропілфенокси)бензальдегід семікарбазон,
4-(4-втор-бутилфенокси)бензальдегід семікарбазон,
4-(4-трет-бутилфенокси)бензальдегід семікарбазон,
4-(4-фторфенокси)ацетофенон семікарбазон,
4-(4-бромфенокси)ацетофенон семікарбазон,
4-(4-фторфенокси)пропіофенон семікарбазон,
4-(4-бромфенокси)пропіофенон семікарбазон,
4-(4-фторфенілмеркапто)бензальдегід семікарбазон,
4-(4-хлорфенілмеркапто)бензальдегід семікарбазон,
4-(4-бромфенілмеркапто)бензальдегід семікарбазон,
4-(4-метилфенілмеркапто)бензальдегід семікарбазон, та
4-(4-фторфенілмеркапто)ацетофенон семікарбазон.
5. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вона призначена для виготовлення лікарського засобу для лікування судом та судомних нападів у людини чи тварини.
6. Сполука за п. 1 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вона призначена для виготовлення лікарського засобу для лікування епілептичних нападів у людини чи тварини.
7. 4-(4'-Фторфенокси)бензальдегід семікарбазон або його фармацевтично прийнятна сіль.
8. 4-(3,4-Дихлорфенокси)бензальдегід семікарбазон або його фармацевтично прийнятна сіль.
9. Сполука, вибрана з групи, що складається з 4-(2-метилфенокси)бензальдегід семікарбазону, 4-(3-метилфенокси)бензальдегід семікарбазону та 4-(4-метилфенокси)бензальдегід семікарбазону, або її фармацевтично прийнятна сіль.
10. Композиція, що виявляє протисудомну активність, яка відрізняється тим, що вона містить сполуку загальної формули (I)
, (І)
де R1, R2, R3 та R4 можуть бути ідентичними або відрізнятися, і кожен з них являє собою водень, галоген, C1-9 алкіл, ціано, С1-9 алкокси, або феноксигрупу;
R5 являє собою водень або C1-9 алкіл;
X є киснем або сіркою,
за умови, що а) хоча б один з радикалів R1, R2, R3 або R4 не є воднем, а є іншим замісником або b) R5 не є воднем, метилом або етилом, а є іншим замісником, або її фармацевтично прийнятну сіль та фармацевтично прийнятний наповнювач.
11. Композиція за п. 10, яка відрізняється тим, що хоча б один з радикалів R1 та R2 є воднем або галогеном, кожен з радикалів R3 та R4 є воднем, R5 - воднем або C1-3 алкілом та X є киснем.
12. Композиція за п. 10, яка відрізняється тим, що хоча б один з R1 та R2 є фтором, R5 є воднем та X є киснем.
13. Композиція за п. 10, яка відрізняється тим, що вказана сполука являє собою 4-(4'-фторфенокси)бензальдегід семікарбазон або його фармацевтично прийнятну сіль.
14. Композиція за п. 10, яка відрізняється тим, що вказана сполука є одною з таких сполук:
4-(4-бромфенокси)бензальдегід семікарбазон,
4-(4-йодфенокси)бензальдегід семікарбазон,
4-(4-метилфенокси)бензальдегід семікарбазон,
4-(4-ціанофенокси)бензальдегід семікарбазон,
4-(2-фторфенокси)бензальдегід семікарбазон,
4-(3-фторфенокси)бензальдегід семікарбазон,
4-(2,3-дифторфенокси)бензальдегід семікарбазон,
4-(2,4-дифторфенокси)бензальдегід семікарбазон,
4-(2,5-дифторфенокси)бензальдегід семікарбазон,
4-(2,6-дифторфенокси)бензальдегід семікарбазон,
4-(3,4-дифторфенокси)бензальдегід семікарбазон,
4-(3,4-дихлорфенокси)бензальдегід семікарбазон,
4-(4-хлор-2-фторфенокси)бензальдегід семікарбазон,
4-(2-хлор-4-фторфенокси)бензальдегід семікарбазон,
4-(2-бром-4-фторфенокси)бензальдегід семікарбазон,
4-(2-метилфенокси)бензальдегід семікарбазон,
4-(3-метилфенокси)бензальдегід семікарбазон,
4-(4-н-пропілфенокси)бензальдегід семікарбазон,
4-(4-втор-бутилфенокси)бензальдегід семікарбазон,
4-(4-трет-бутилфенокси)бензальдегід семікарбазон,
4-(4-фторфенокси)ацетофенон семікарбазон,
4-(4-бромфенокси)ацетофенон семікарбазон,
4-(4-фторфенокси)пропіофенон семікарбазон,
4-(4-бромфенокси)пропіофенон семікарбазон,
4-(4-фторфенілмеркапто)бензальдегід семікарбазон,
4-(4-хлорфенілмеркапто)бензальдегід семікарбазон,
4-(4-бромфенілмеркапто)бензальдегід семікарбазон,
4-(4-метилфенілмеркапто)бензальдегід семікарбазон та
4-(4-фторфенілмеркапто)ацетофенон семікарбазон.
Текст
Цей винахід стосується семікарбазонових сполук, які мають вплив на активність центральної нервової системи (ЦНС), і фармацевтичних препаратів, які містять такі сполуки. Більш детально, винахід має відношення до семікарбазонів, які мають протисудомні властивості, і до використання таких семікарбазонів для лікування або запобігання судом і нападів у людей і тварин. На протязі багатьох років існує зацікавленість в отриманні ліків, які впливають на активність центральної нервової системи людини і тварин, і, зокрема, протисудомних препаратів, які використовуються для лікування і запобігання епілептичних припадків і інших розладів центральної нервової системи. Попередні роботи, проведені одним з авторів цього винаходу (Dimmock et al., J. Med. Chem., 1993, 36, pp. 2243-2252), показали, що зразки арил семікарбазонів загальної формули А [А] мають протисудомну активність при внутрішньочеревному введенні мишам у випробуваннях максимальним електрошоком (ВМЕ) і у випробуваннях підшкірним введенням пентилентетразола (впПТЗ). Ці випробування є тестовими системами, розробленими для визначення сполук, які могли б запобігти генералізованим тонічно-клонічним приступам і, відповідно, забезпечити повну відсутність судом. Випробування ВМЕ і впПТЗ дискутувались Краллом (КгаІІ) та іншими в статті "Krall et al. «Antiepileptic drug development: II. Anticonvulsant drug screening», Epilepsia, 1978, 19, pp. 409-428"; в цій праці розкриття згаданих методів наводиться як посилання. Однак сполуки формули А виявились нейротоксичними при введенні описаним шляхом, і індекси захисту (ІЗ, а саме: відношення ΊD50/ΕD50) десяти наведених сполук були низькими. Таким чином, необхідні сполуки з виявленням поліпшених протисудомних ефектів та зменшеною токсичністю. Об'єктом винаходу є отримання сполук, які мають вплив на активність центральної нервової системи. Іншим об'єктом винаходу є отримання фармацевтичних препаратів, які мають добру протисудомну активність і прийнятну нейротоксичність. Ще одним об'єктом винаходу є розробка таких методів лікування судом у людей і тварин, які не дають небажаних побічних ефектів. Відповідно до першого аспекту винаходу пропонується сполука загальної формули І [І] де: R1, R2, R3 і R4 можуть бути однаковими або різними і кожен являє собою атом водню або галогену, або С1-9 алкільну, С5-9 циклоаліфатичну, ціанову, С1-9 алкокси або С6-10 арилокси групу; R5 являє собою атом водню або С1-9 алкільну, С3-9 циклоалкільну або С6-10 арильну групу; і X - це кисень або сірка. В сполуках винаходу алкільні замісники, якщо вони присутні, можуть бути прямоланцюговими або розгалуженими. Однак слід зазначити, що вищенаведена сполука Формули І, де R1, R2, R3, R4 і R5 є атомами водню, вже відома з "Tomita et al., «Synthesis of Aldehyde Derivatives Containing a Diphenyl Ether Nucleus», J. Pharm. Soc. Japan, 1955, 75, 1021-1023", але ця стаття не розкриває протисудомної властивості сполуки. Відповідно до іншого аспекту винаходу отримується препарат, який містить в собі сполуку загальної формули І і прийнятні з фармацевтичної точки зору розріджувач, наповнювач або носій. Відповідно до ще одного аспекту винаходу забезпечується метод лікування захворювань центральної нервової системи людей і тварин, який передбачає введення пацієнтам ефективної дози сполуки загальної формули І. Сполуки винаходу можуть бути введені орально і при цьому виявляти дуже високу дію проти судом при захворюваннях ЦНС, тобто можуть мати значення ED50 (для випробувань максимальним електрошоком у щурів) в діапазоні 1-5мг/кг (звичайно в діапазоні 2-3мг/кг) і при цьому не виявляти нейротоксичності при максимальній використаній дозі (тобто 500мг/кг), тобто вони мають надзвичайно придатні значення індексу захисту (ІЗ). Сполуки винаходу мають один або кілька механізмів дії, які відрізняються від механізмів дії звичайних протисудомних препаратів. Більш того, можна вважати, що сполуки винаходу вільні від деяких недоліків звичайних протисудомних препаратів через відсутність принаймні у деяких сполук винаходу просудомних властивостей і негативного впливу на активність певних ферментів печінки. На Фіг.1 спрощено представлена гіпотетична частина рецептора, яка показує різні області зв'язування для сполук, які відповідають цьому винаходу. На Фіг.2 наведені структурні формули для позначення сполук, перелічених в Таблицях з 1 по 3; і На Фіг.3 наведені структурні формули для позначення сполук, перелічених в Таблицях з 4 по 6. Сполуки цього винаходу і сполуки, що мають споріднені структури, можуть бути синтезовані різними хімічними методами, наприклад модифікацією метода, описаного Yeager та ін. («A Convenient Method for the Preparation of 4-Aryloxyphenols», Synthesis, 1991, pp. 63-68; в цій праці опис метода наведений посиланням). Yeager та ін. описують процес для отримання арилоксибензальдегідів або арилоксіарилкетонів. Ці проміжні продукти можуть потому реагувати з семікарбазидами. Цей процес проілюстрований схемою реакції, що наведена нижче: Наведена вище схема реакції потребує утворення проміжних арилокси- або арилтіобензальдегідів, або кетонів через реагування відповідних фенолів або тіофенолів з фторбензальдегідом або фторарил кетонами в придатному розчиннику (наприклад, диметилацетамід) в присутності безводного карбонату калію при температурі в межах від 100 до 200°С при атмосферному тиску газу, який не окислює (наприклад, азот), при нагріванні зі зворотним охолодженням на протязі 5-10 годин. Після охолоджування і додавання води проміжний продукт може бути екстрагований органічним розчинником (наприклад, хлороформом) і висушений. Після цього проміжні арилокси(тіо)бензальдегіди і арилокси(тіо)арил кетони перетворюють на бажані семікарбазони в водному розчині етанолу на протязі від однієї до декількох годин при температурі оточуючого середовища, і потім одержаний осад кінцевого продукту збирають і рекристалізують. Вихідні матеріали, які звичайно реагують в приблизно стехіометричних кількостях, є комерційними продуктами і можуть, зокрема, бути отриманими від Aldrich Chemical Company, Мілуокі, США. Без наміру обмеження винаходу рамками окремої теорії припускається, що сполуки цього винаходу виявляють протисудомну активність, розташовуючи свої молекули біля гіпотетичної частини рецептора мозку людини або тварини; теоретично така взаємодія має місце в трьох зонах рецептора, а саме: в ділянці, що зв'язує арил, ділянці, що зв'язує водень, і в дистальній ділянці, як проілюстровано на Фіг.1. Припускається, що ці ділянки реагують з проксимальним арильним кільцем (кільце, найближче до семікарбазонової групи), з самою семікарбазоновою (H2NCONHN=) групою та з дистальним арильним кільцем сполук, відповідно. Присутність дистального арильного кільця, певних груп замісників на периферії і, в меншій мірі, проксимального арильного кільця в сполуках винаходу виявляється в посиленні приєднання молекули до рецептора і, таким чином, в збільшенні ефективності сполук. Систематизований синтез і оцінка сполук Формули І та сполук з близько спорідненими структурами дозволили вивести наступні загальні принципи. (і) Заміщення метин водню, приєднаного до атому вуглецю карбімінової групи, на більш великі групи не впливає суттєво на протисудомну активність сполук; (іі) розміщення арилокси або арилтіо груп в орто-або мета/положеннях проксимального кільця веде до зниження або відсутності протисудомної активності; (ііі) заміщення кисню ефірної групи на сірку або сульфонілокси групи веде до сполук із схожою протисудомною дією, тоді як інші замісники знижують протисудомну ефективність; (iv) зменшення величини замісників на дистальному арильному кільці збільшує протисудомну активність; і (ν) висока протисудомна активність досягається в випадку, коли хоча б один замісник на дистальній алкіл групі знаходиться в пара положенні. Отже, найкращими сполуками цього винаходу є сполуки, в яких R1 і R2 - це водень або галоген (найкраще фтор); R3, R4 - кожен є воднем; і R5 - це водень або С1-3 алкіл; і X - це О або S (найкраще О). Найкращими сполуками, відповідно до цього винаходу, є 4-(4’-фторфенокси)бензальдегід семікарбазон і 4-(тіофенокси)бензальдегід семікарбазон. Ці сполуки виявили високу активність в ВМЕ випробуванні, низьку токсичність і надали захист в випробуванні збудження роговиці щура без негативних особливостей, таких як просудомні властивості. До речі, тест збудження щура описаний R. J. Racine в «Modification of Seizure Activity by Electrical Stimulation. II. Motor Seizure», Electroencephalogr. Clin. Neurophysiol., 1972, 32, 281-294, і G. Skeen та ін. в «Development of Kindled Seizures Following Electrical Stimulation via the Cornea», 1990, 16(1), 307; розкриття якого включається в цей документ посиланням. Сполуки цього винаходу можуть в деяких випадках мати достатньо високу нейротоксичність при внутрішньочеревному введенні миші. Наприклад, було встановлено, що нейротоксичність має місце приблизно у 65% сполук, які випробовували, а кількісне визначення біоактивностей сполук винаходу дало значення ІЗ в межах 2-14 в випробуванні МЕВ і 1-3 в випробуванні впПТЗ. Однак було знайдено, що така нейротоксичність зникає або зменшується до прийнятного рівня при введенні сполук щурам оральним шляхом. Більш того, в той час як сполука виявляє високу активність в обох випробуваннях МЕВ і впПТЗ при внутрішньочеревному введенні, при оральному введенні активність сполук в випробуванні МЕВ залишається високою, але активність в випробуванні впПТЗ може погіршуватись. Наприклад, для сполуки 4-(4'фторфенокси)бензальдегід семікарбазон доза для орального введення щурам, яка давала значення ED50 в оральному випробуванні, 1.59мг/кг, а ІЗ більше ніж 315. Однак сполука не надавала захисту в випробуванні впПТЗ при дозі 125мг/кг, і тільки 10% щурів були захищені при дозі 250мг/кг. Відсутність нейротоксичності при максимальній дозі, яку використовували (500мг/кг), вела до виключно високого індексу захисту. Сполуки винаходу можуть бути введені людям оральним шляхом, найкраще в дозах 50-75мг/кг, звичайно в формі сумішей з інертними фармацевтично прийнятними сполуками, такими як розріджувачі (наприклад, дигідрофосфат кальцію, дигідросульфат кальцію, целюлоза, декстроза, лактоза, манітол, крохмаль, сорбіт, сахароза і матеріали на основі сахарози), в'яжучі речовини і адгезиви (наприклад, гуміарабік, похідні целюлози, желатин, глюкоза, полівінілпиролідон (ПВП), альгінати, сорбіт, попередньо клейстеризований крохмаль або крохмальна паста і трагакант), дезінтегратори (наприклад, альгінати, целюлоза і похідні целюлози, глиноземи, зшиті ПВП, крохмаль і похідні крохмалю), замаслювачі (наприклад, поліетиленгліколі, стеаринові кислоти, солі і похідні, поверхнево-активні речовини, тальк і віск), речовини, що забезпечують ковзання (кукурудзяний крохмаль, похідні кремнезему і тальк), барвники, смакові додатки і замінники цукру (наприклад, FD&C і D&C фарби і лаки, ароматичні масла і смакові домішки, висушені розбризкуванням, штучні і натуральні замінники цукру). Препарати можуть бути виготовлені в одній з будь-яких звичайних форм для орального введення, наприклад у вигляді порошків, капсул, таблеток, драже, пастилок, розчинів, сиропів та ін. Винахід докладно описано в Прикладах, що подаються далі; ці приклади не мають наміру обмежувати рамки винаходу. Сполуки від 2а до 5ν, наведені нижче в Таблиці 1, були синтезовані згаданим раніше методом. Структури перелічених сполук відповідають показаним на Фіг.2, які позначені тією ж самою першою цифрою (2, 3, 4 або 5), що й замісники з Таблиці 1. Tаблиця 1 Замісники арилу, фізичні дані і оцінка протисудомної дії після внутрішньочеревної ін'єкції мишам і орального введення ,щурам сполук в серіях 2-5 Сполу ка 2а 2h 3 4а 4b 4с 4d 4e 4f 4g 4h 4I 4j 5а 5b 5с 5d 5e 5f 5g 5h 5і Заміс ники арилу Η 4-F Η Η 4-F 4-CI 4-Br 4-І 4-CH3 4-C6H5 4-ОСН3 4-С6Н5 4-CN 2-F 3-F 2,3-F2 2,4-F2 2,5-F2 2,6-F2 3,4-F2 2-CI 3-CI т.п. (°С) 198-199 210-212 224-225 224-225 233-234 225-226 225-226 221-222 219-221 280 218-220 209-210 218-220 228-230 209 225 229-230 230 232 212-213 207-208 185-186 Вихід % 40 48 70 60 65 40 60 71 50 72 60 55 40 42 42 50 42 65 30 86 42 35 внутрішньочеревна ін'єкція мишама МЕВ ПвПТЗ токсичність випробу випробу вання вання 0,5г 4г 0,5г. 4г 0,5г 4г ---100 30 30 30 30 30 -100 -30 100 30 100 зо 100 зо 100 30 30 --300 300 100 30 30 30 100 300 100 300 30 300 300 100 30 300 30 30 30 100 -----30 -100 ----30 300 100 300 100 100 300 30 100 30 -------300 -----300 300 300 ----300 -300 --300 300 -300 300 -----30 30 100 -300 300 -100 -300 --300 300 --100 300 --зо -----300 300 300 300 оральне введення щурамб МЕВ випробування доза 0,25г мг/кг 50 -30 0 50 -50 -50 2 50 4 50 1 50 3 50 3 12.5 -50 -50 -12.5 2 50 2 50 4 12.5 -50 3 12.5 -12.5 0 50 2 50 3 50 - 0,5г 1г 2г 4г -0 -3 4 4 4 4 4 -4 -4 4 4 3 4 1 2 4 4 4 2 1 -4 4 4 4 4 4 -4 -4 4 4 4 4 1 4 4 4 4 1 2 -4 4 4 4 4 4 3 4 1 4 4 4 4 4 4 4 4 4 4 1 4 -4 4 4 4 4 4 1 4 1 4 4 4 4 4 1 4 4 4 3 5j 5k 51 5m 5n 5o 5p 5q 5r 5s 5t 5u 3,4-CI2 216-217 2-F.4-CI 225-226 2-CI.4-F 209-210 2-Br,4-F 203-205 2-CH3 205 3-CH3 205-206 4-C2H5 210 4-n-C3H7 215 4-s-C4H9 192-193 4-t-C4H9 200-202 4-t-C8H17 190 4-О-п203 С4Н9 5v 4-О-n-7Н15 204-206 Фенітоін Карбамазепін Валпроїва кислота а 45 60 59 40 25 35 40 53 38 48 30 35 300 30 30 100 30 30 30 100 100 100 -300 30 30 30 100 100 100 зо 100 30 30 -100 ---300 100 -300 300 ---300 ----100 ---100 100 -300 -100 100 300 300 100 300 -300 100 -300 300 30 300 300 300 300 100 300 100 100 300 300 50 12.5 50 50 12.5 12.5 12.5 12.5 12.5 12.5 12.5 -2 4 4 ------ 2 4 4 4 4 4 2 1 2 -- 4 4 4 4 3 4 4 2 2 4 - 4 4 4 4 4 3 4 4 3 4 4 4 4 4 4 2 4 2 4 4 2 20 -30 30 - -30 100 - --100 300 --300 300 100 100 - 100 300 - Були введені дози 30, 100 і 300мг/кг. Цифри в таблиці показують мінімальну дозу, при введенні якої спостерігалась біоактивність препарату у половини або більшої кількості мишей. Тварин перевіряли через 0.5 і 4 годин після зробленої ін'єкції. Лінії -- показують відсутність протисудомної активності і нейротоксичність. б Цифри в випробуванні показують кількість щурів із 4, що були взяті для випробувань, які були захищені. Лінії -- показують, що активність не спостерігалася, і позначка - вказує, що сполука не випробувалась. Подробиці синтезу різних сполук наведені нижче. Cинтез проміжних сполук 3-феноксибензальдегід, який використовується як вихідний матеріал для синтезу сполуки 3, отримували від Aldrich Chemical Company, Мілуокі, WI. Проміжні арилоксиарил і арилтіоарил альдегід, потрібні в синтезі інших, сполук готували як наведено нижче. Безводний карбонат калію (0.12М) додавали до розчину придатного фенолу або тіофенолу (0.15М) і 4фторбензальдегіду, 4-фторацетофенону або 4-фторпропіофенону (0.14М) в диметилацетамиді (100мл). Суміш нагрівали в колбі із зворотним холодильником при 155°С в атмосфері азоту і контролювали процес за допомогою хроматографії в тонкому шарі (ХТШ), використовуючи бензол:метанол (9:1 по об'єму) як систему розчинників. Приблизно після 5-10 годин суміш охолоджували і додавали воду (100мл). Реакційну суміш екстрагували хлороформом (2x100мл) і зібрані органічні екстракти відмивали водним розчином гідроксиду натрію (4% вага/об'єм) і водою. Після висушування над безводним сульфатом магнію розчинник видаляли під вакуумом і отримане масло дистилювали при зниженому тиску для отримання придатного арилоксіарилу, арилтіоарилового альдегіду або кетону. Чистоту дистиляту перевіряли за допомогою хроматографії в тонкому шарі (ХТШ), використовуючи бензол:метанол (9 : 1 по об'єму) як розчинник. Нижче наведений 1Н ЯМР спектр проміжного продукту, а саме 4-феноксибензальдегіду: δ (CDCI3): 9.94 (s,1H, СНО), 7.82-7.88 (2t, 2Н, орто Η проксимального арильного кільця), 7.38-7.46 (3t, 2Н, мета Η проксимального арильного кільця), 7.20-7.27 (3t, 1Н, пара Η дистального арильного кільця), 7.03-7.12 (3t, 4Н, орто Η дистального арильного кільця). Синтез кінцевих сполук Суміш семікарбазид гідрохлориду (0.01М), ацетату натрію (0.01М) і води (10мл) повільно додавали при перемішуванні до розчину арилоксіарилу або арилтіоарил альдегіду (0.01Μ) в етанолі (95%, 30мл). Реакційну суміш перемішували при кімнатній температурі 1-2 години, осад збирали, відмивали ефіром, висушували і рекристалізували із 95% етанолу (сполуки 3, 4b, 4е, 4h, 5b-е, 5k-t, 5v), абсолютного етанолу (сполуки 4а, 4с, 4d, 4g, 4j, 5a, 5t-j, 5u) або метанолу (сполука 4f). Наведена в літературі температура плавління (°С) сполуки 4а - 219-220°С. Температури плавління, наведені для різних сполук, не є точними. Помилка результатів елементного аналізу (С, Η, Ν) складала 0.4% від обчислених величин, окрім сполуки 5л (обчислене для C15H15N3O2: Ν, 15.60. Знайдено: Ν, 14.80). 1Н ЯМР спектроскопію виконували використовуючи BRUKER AM 300 FT (торгова марка) ЯМР спектрометр. Хроматографію в тонкому шарі проводили використовуючи пластини силікагелю з флуоресцентним індикатором. Синтез сполук типу фігури 3 3-бензилоксибензальдегід, потрібний в синтезі незаміщеної сполуки, отримували від Aldrich Chemical Company, Мілуокі, WI. Інші проміжні альдегіди готували, як наведено нижче. Хлорид бензоїлу або 4-хлорбензоїл хлорид (0.05М) додавали до розчину 4-гідроксибензальдегіду (0.04М) в піридині (100 мл). Після витримки на протязі ночі при кімнатній температурі реакційну суміш виливали в оцтову кислоту (2N, 100мл). Осад збирали, відмивали водою і рекристалізували із суміші вода-метанол для отримання 4-бензоїлоксибензальдегіду і 4-(4-хлорбензоїлокси)бензальдегіду, потрібного в синтезі сполук 68 і 69, відповідно. 4-фенілсульфонілбензальдегід, який використовували в синтезі сполуки 70, готували, як наведено нижче. Суміш бензолсульфінату натрію (0.11М) і 4-фторбензальдегїду (0.1М) в сухому диметилсульфоксиді (75мл) перемішували при 100°С 18 годин в атмосфері азоту і потому виливали суміш на лід (приблизно 200г). Осад збирали, відмивали водою і рекристалізували із етанолу (95% об'єм/об'єм). Накінець, бензолсульфонил хлорид або 4-метилбензсульфонил хлорид (0.20М) додавали по краплині до розчину 4-гідроксибензальдегіду (0.16М) в дихлорметані (90мл) і триетиламіні (3-5мл) при перемішуванні при температурі від 0 до 10°С на протязі 10 хвилин. Після подальших 15 хвилин реакційну суміш розбавляли дихлорметаном і послідовно екстрагували водою, соляною кислотою (10% вага/об'єм), насиченим розчином бікарбонату натрію і насиченим розчином хлориду натрію. Після висушування органічного екстракту видаляли розчинник і отримували проміжний продукт, потрібний для подальшого синтезу. За результатами ХТШ (розчинник бензол : метанол (7 : 3)) сполуки були однорідні і температури плавління співпадали з наведеними в літературі. Ці проміжні альдегіди піддавали реакції з семікарбазидом, як описано раніше. Синтез сполук типів 17 і 18 фігури 3 Ці сполуки готували із придатних арилоксіарил і арилтіоарил альдегідів, використовуючи методи, описані в літературі (Dimmock, J.R.; McColl, J.M.; Wonko, S.L.; Thayer, R.S.; Hancock, D.S. Evaluation of the thiosemicarbazones of some aryl alkyl ketones and related compounds for anticonvulsant activities. Eur. J. Med. Chem. 1991, 26. 529-534; and Dimmock, J.R.; Puthucode, R.N.; Lo, M.S.; Quail, J.W.; Yang, J.; Stables, J.P. Structural modifications of the primary amino group of anticonvulsant aryl semicarbazones. Pharmazie, 1996, 51, 8388.). Час нагріву реактивів в колбі зі зворотним холодильником складав 6 годин, тоді як час перемішування реактивів при кімнатній температурі складав вісім, десять і чотирнадцять годин. В одному випадку реакційну суміш нагрівали при 60°С на протязі 0.5 години. Всі сполуки цього типу були рекристалізовані із етанолу (95% об'єм/об'єм). Величини log P були визначені раніше опублікованим методом (Dimmock, J.R.; Phillips, О.Α.; Wonko, S.L; Hickie, R.A.; Tuer, R.G.; Ambrose, S.J.; Reid, R.S.; Mutus, В.; Talpas, C.J. Evaluation of some Mannich bases of conjugated styryl ketones and related compounds versus the WiDr colon cancer in vitro. Eur. J. Med. Chem. 1989, 24, 217-226.), окрім тих розчинів, які отримували використовуючи 1-октанол, до якого додавали буфер. Величини λмакс і ε сполук були отримані в 1-октанолі, а не в сольовому фосфатному буфері з рН 7.4, через низьку розчинність сполук в воді. Приклад 2 Первісну оцінку протисудомної дії сполук, які отримали відповідно до Прикладу 1, проводили за допомогою введення мишам сполук внутрішньочеревним шляхом. Захист і/або нейротоксичність відмічали через 0.5 і 4 години після введення тваринам доз 30, 100 і 300мг/кг кожного семікарбазона. Ці результати представлені в Таблиці 1, яка наведена вище. Всі сполуки були активні в випробуванні МЕВ, окрім сполук 2а, b, 5t, v, і захист надавали 60% сполук в тесті пвПТЗ. Нейротоксичність була виявлена приблизно у 70% семікарбазонів. Була зроблена кількісна оцінка біоактивності відібраних сполук, і ці дані наведені в Таблиці 2 нижче: Таблиця 2. Оцінка відібраних сполук в випробуваннях МЕВ, пвПТЗ і нейротоксичності після внутрішньочеревних ін'єкцій мишам. Випробування МЕВ Сполука Випробування пвПТЗ 1 5d 0.25 5g 1 5і 0.5 5I 1 5n 5р 5r 4 5s 4 5t 2 Фенітоін 1 18.59 (5.63) 45.78 15.53 (5.71) 11.25 2.78 (0.86) 14.48 4.62 (1.35) 27.69 6.01 (20.39-6.12) 5с (1.91) (9.53-18.91) 0.5 20.69 (6.68-19.16) 5а 5.59 (41.39-2.15) 1 14.65 (18.68-2.14) 4f (3.00) (10.44-9.23) г 1 Відхиле ння (SE) 8.28 (10.54-7.09) 4b t ED50 (мг/кг) (95% СІ) 12.86 (2.08) 13.12 (8.70-20.12) 3.12 (1.03) 1 6.945 (2.045) 1 13.063 (3.833) Запланован Запланован 13.36 (10.39316.258) 8.87 (7.7044.957) 11.27 (8.31312.872) 6.32 (5.44-7.23) ED50 (мг/кг) (95% СІ) >54 Відхиле ння (SE) - г 1 1.87 2 (0.57) 0.5 88.55 (45.52173.94) >220 - 2 1 >350 - 2 0.25 57.85 (30.1393.95) 72.78 (49.0199.12) 41.16 (26.9856.74) >68 1.70 1 t г 1 1 0.5 0.5 t (0.54) 4.27 2 (1.34) 3.53 2 (0.91) 1 11.442 (4.493) 4 4 86.93 (71.514108.966) >150.00 - 4 10.881 (4.272) 2 >200 - 2 11.24 (3.52) 1 >50 - 0.5 Випробування нейротоксичності TD50 Відхилення (мг/кг) (95% СІ) (SE) 108.03 3.69 (71.52(0.96) 57.52) 203.73 4.29 (132.44(1.31) 71.13) 170.01 12.36 (146.81(3.80) 91.65) 292.55 5.78 (209.59(1.77) 79.29) 96.81 11.50 (77.60(4.08) 113.81) 94.80 3.17 (59.86(1.09) 156.29) 64.48 4.54 (42.03(1.36) 84.72) 15.48 62.46 (4.84) (55.5667.86) 131.27 (110.848158.464) 105.92 (85.053142.591) 124.53 (81.064175.187) 41.23 (36.90 ІЗ æ TD 50 ö ç ÷ ç ED ÷ è 50 øMEB æ TD50 ö ç ÷ ç ED ÷ è 50 øпвПТЗ 8.40 - 13.91 2.30 8.22 - 6.39 - 8.61 1.67 6.55 1.30 2.33 1.57 4.76 - 6.467 (1.703) 9.825 1.510 6.313 (1.976) 11.934 500 ->315 2 - - - - -1 >500 >145.57 - - - /4-24b >500 - >210 >90 1 /4-24b >500 >79.179 - >500 - - >88 >162.47 - - >500 >3.22 >100.16 >500 1 >190.02 >297.24 /4-24b >500 >21.6 1 361 (319-402) 859 (719-1148) 0.5 11.4 (2.96) 6.57 (2.17) 101 2.17 ІЗ - індекс захисту, а саме TD50/ED50. Сполука перевірялась через 0.25, 0.5, 1, 3, 4, 6, 8 і 24 години після введення. Сполуку 4b піддали подальшим біотестам. Для сполуки 4b, після внутрішньочеревної ін'єкції щурам, величини ED50 і TD50 в випробуваннях МЕВ і нейротоксичності були відповідно 2.37 і 80.09мг/кг, і ІЗ дорівнював 33.8. При випробуванні збудження щура величина ED50 для цієї сполуки дорівнювала 3.39. Денну дозу 100мг/кг сполуки 4b вводили щурам орально на протязі трьох діб. Після цього видаляли печінку і порівнювали печінкові тканини тварин, які отримували препарат, і контрольних тварин, а саме: вагу печінки і вихід мікросомальних протеїнів на додаток до активності ферментів цитохрому Р450, р-нітроанізол Оb деметилази, UDP-глюкуронозіл трансферази, сульфотрансферази, етоксирезорфін О-деетилази, пентоксирезорфін О-деалкілази, глютатіон S-трансферази і хінон редуктази. Ніяких відмінностей в властивостях між печінками тварин, які отримували препарат, і печінками контрольних тварин не було знайдено (р > 0.05). Обидві сполуки 4b і 5q_перевірялись на протисудомні властивості в тесті на внутрішньовенне введення пентилентетразолу на мишах; введені дози дорівнювали величинам ED50 і TD50 МЕВ сполук 4b і 5q наведених в Таблиці 2. Жодна з сполук не подолала цієї небажаної характеристики, і при використанні дози 108мг/кг сполука 4b збільшувала час до клонусу. Сполуки 4b і 5q також оцінювали на їх можливість запобігати судомам, які спричинені підшкірним введенням мишам бікукуліну і пікротоксину. Семікарбазон 4b надавав частковий захист в цих двох випробуваннях, в той час як 5q був неактивний. На додаток, 4b не надавав захисту при підшкірному введенні мишам стрихніну. Опис цих тестів в подробицях надається нижче. Внутрішньочеревна ін'єкція мишам На додаток до інформації, яка наведена в Таблиці 1, внутрішньочеревні ін'єкції мишам ряду сполук викликають наступні бічні ефекти при різних дозах (мг/кг) і інтервалах часу. По-перше, в випробуванні пвПТЗ відмічали міоклонічне судомне сіпання при введенні сполук 4с: 30, 100; 0.5 години і 5f: 100, 300; 0.5 години. По-друге, спостерігали безперервну судомну активність в випробуванні пвПТЗ для сполук: 4с: 300; 0.5г; 100, 300; 4 г; 4d: 100, 300; 0.5 і 4 г; 4j: 100, 300; 0.5 і 4 г; 5i: 300; 0.5 г; 5l: 300; 0.5 і 4 г; 5o: 100, 300; 0.5 г і 5s: 300; 4 г. Наприкінці 4 годин безперервної судомної активності слідувала смерть в результаті випробування пвПТЗ, коли миші отримували 300мг/кг сполуки 5o. Оральний шлях введення щурам При використанні доз, наведених в Таблиці 1, декілька сполук виявили маргінальну активність в випробуванні пвПТЗ. Ці сполуки, а також кількість захищених в різні періоди часу щурів, наведені нижче: 4е: 1/4 після 0.5, 1, 4 г: 5h: 1/4 після 4 г; 5n: 1/4 після 0.5, 1, 2 г і 5r: 1/4 після 1, 4 г і 2/4 після 2 годин. Внутрішньочеревна ін'єкція сполуки 4b щурам При внутрішньочеревній ін'єкції сполуки 4b щурам після 4 годин в випробуванні МЕВ були отримані наступні характеристики: ED50, величини 95% СІ і відхилення (SE): 2.37, 1.39 - 3.57 і 2.65 (0.76), в цей же час відповідні дані TD50 складали 80.09, 66.14 - 87.27 і 17.02 (6.41). Наданий захист після внутрішньочеревного введення 125 і 250мг/кг сполуки 4b в випробуванні пвПТЗ виявили в 0/2 і 1/10 щурів. Тест збудження щура при використанні сполуки 4b Тест збудження щура проводили відповідно до наведеної вище процедури. Сполуку 4b вводили оральним шляхом і провокували тварину електричною стимуляцією 2 годинами пізніше. ED50 - це доза, потрібна для зменшення приступу судом зі стадії 5 до стадії 3 або менше, і ці стадії описуються таким чином: стадія 1 - це клонус лицевих та ротових м'язів, стадія 2 - це стадія 1 плюс посіпування голови, стадія 3 - це стадія 2 плюс клонус м'язів передніх кінцівок, стадія 4 - це стадія 3 плюс клонус м'язів задніх кінцівок і стадія 5 - це стадія 4 плюс клонус м'язів задніх кінцівок, який повторюється, і падіння. Величини ED50 (мг/кг), 95% СІ і відхилення (SE) для 4b були 3.93, 2.04-6.09 і 3.62 (1.10). Дані ED50 (мг/кг, 95% СІ в дужках) і час випробування для трьох порівнюваних ліків наведені нижче: фенітоїн: > 100, 0.25 г; карбамазепін: 28.90 (7.72 - 75.59), 1 г; і валпроат: 117.41 (67.98-189.02), 0.25 г. Bплив постійного орального введення сполуки 4b на печінку щурів Щури отримували 100мг/кг сполуки 4b на протязі 3 діб. Печінки видаляли, зважували і вплив 4b на мікросомальну систему печінки порівнювали з контрольними тваринами, які отримували тільки сполуку-носій (подрібнену ультразвуком 0.5% метил целюлозу).21-23 (VI) Оцінка сполук 4b і 5q в тесті періодичного внутрішньовенного введення пентилентетразолу Сполуки 4b і 5q в розчині метил целюлози (0.5%) були введені внутрішньочеревним шляхом мишам. Були використані дві дози - величини ED50 в випробуванні МЕВ і TD50. Через 1 годину в хвостову вену миші вливали розчин пентилентетразолу (0.5%), хлориду натрію і гепарину натрію (10 USP одиниць/мл) в воді зі швидкістю 0.37мл/хв (4b) і 0.34мл/хв (5q). Час з початку вливання до появи перших судом і також до початку клонусу записували для тварин, яких випробовували, і для контрольних тварин. З цих даних отримували кількість введеного пентилентетразолу. Як контрольні та для кожної введеної дози використовували 10 тварин, окрім дози 13мг/кг 4b, для якої було взято 9 тварин. Значення часу до першої судоми в секундах, кількість введеного пентилентетразолу в мг/кг (SE) і величина ρ були такі: 4b (доза 13мг/кг): 32.2, 32.3 (1.4), >0.05; 4b (доза 108 мг/кг): 32.2, 32.6 (0.8), >0.05; 5q (доза 15 мг/кг): 32.8, 32.9 (1.4), >0.05; 5q (доза 95 мг/кг): 34.6, 34.6 (1.5), >0.05. Значення часу до появи клонусу в секундах, кількості введеного пентилентетразолу в мг/кг (SE) і величина ρ були такі: 4b (доза 13мг/кг): 37.6, 37.6 (1.5), >0.05; 4b (доза 108мг/кг): 41.5, 42.1 (1.4), >0.05; 5q (доза 15мг/кг): 41.2, 41.2 (2.6), >0.05; 5q (доза 95мг/кг): 44.4, 44.4 (2.5), >0.05. (VII) Oцінка сполук 4b і 5q при використовуванні інших моделей хімічно спричинених судом Різні дози сполук 4Ь і 5q були введені мишам за 1 годину (4b) або 0.5 години (5q) до підшкірного введення мишам доз хемоконвульсантів бікукуліну і пікротоксину. Сполуку (4b) також перевіряли на ефект захисту після підшкірного введення стрихніну. В випадку введення сполуки (4b) кількість тварин, захищених в випробуванні підшкірним введенням бікукуліну при різних дозах (мг/кг), була така: 0/8 (54), 3/8 (108) і 3/8 (216). В випробуванні підшкірним введенням пікротоксину захист при різних дозах був таким: 1/8 (27), 5/16 (108), 2/8 (216). Сполука 5q не показала ніякого ефекту в діапазоні доз 12-96мг/кг в цих двох випробуваннях. Семікарбазон 4b не надавав захисту в випробуванні підшкірним введенням стрихніну при використовуванні доз в діапазоні 13.5-108мг/кг. Використовували по дві тварини на кожну дозу, окрім випробувань бікукуліну і пікротоксину для сполуки 4b, в яких брали 8 або 16 тварин на кожну дозу. Приклад 3 Були отримані сполуки, які мають структури, показані в Таблиці 4. Структури перелічених сполук відповідають таким, що показані на Фіг.3 і помічені однаковим першим числом (12, 13, 14, 15, 16, 17 або 18) із замісниками, які наведені в Таблиці 4. Таблиця 4 Замісники арилу, фізичні дані і оцінка протисудомної дії після внутрішньочеревної ін'єкції мишам і орального введення щурам сполук в серіях 12-18а Спо лука R1 R2 т.п. (°С) 12а 12b Η Η F Η 12с Η СІ 12d Η Br 12е Η СН3 13а CH3 Η 13b СН3 F 13с СН3 СІ 13d СН3 Br 13s C2H5 Η 13f C2H5 F 13g C2H5 СІ 13h C2H5 Br 14a CH3 Η 14b CH3 F 14c CH3 СІ 14d CH3 Br 14 C2H5 F 14f C2H5 СІ 14g C2H5 Br 15a S Η 15h OCO Η 15c OCO СІ 15d OCH2 Η 15a 15f 15g SO2 OSO2 OSO2 Η Η CH3 16а Η F 16b 16c Η Η СІ Вг 16d Η СН3 16e СН3 Η 240 224225 225226 225226 219221 169171 182184 192194 195197 154156 170172 186188 184186 136138 154157 167169 183186 156158 136138 155157 226227 237238 245246 212213 254 146 205207 230231 216 212213 225227 208 внутрішньочеревна ін'єкція мишамb оральне введення щурамс МЕВ пвПТЗ токсичність МЕВ випробування Випробува випробування ння Вихід % доза 0,5г 4г 0,5г 4г 0,5г 4г 0,25г 0,5г 1г 2г 4г мг/кг 65 30 100 ----50 2 4 4 4 4 60 100 300 ----50 -3 4 4 4 40 30 30 30 - 300 30 50 4 4 4 4 4 60 30 30 - - 300 30 50 1 4 4 4 4 50 30 100 - - - - 50 3 4 4 4 4 60 30 100 - - 100 100 30 4 4 4 4 4 74 30 30 100 - 300 100 12.5 - 4 4 4 4 60 30 30 - 30 30 100 30 3 4 4 4 4 30 30 30 300 - 300 100 12.5 1 3 4 4 4 58 30 100 - - 100 100 30 1 4 3 3 - 72 30 30 100 - 300 100 12.5 - 2 4 4 4 38 30 - 300 - 300 100 30 - 1 4 4 4 38 30 30 100 - 300 100 12.5 - 2 4 4 4 14 300 - 300 - 300 - 27 - - - - - - 30 1 1 3 3 2 300 300 300 300 300 - 300 12.5 - - - - - 32 300 300 28 - - - - 55 - - - - - - - - - 15 300 300 5 - - - - - 300 40 30 30 - - - 300 50 - 4 4 4 4 70 - 300 - - - - 12.5 - - - - - 80 - 300 - - - - 12.5 1 - 1 - 2 52 300 300 100 - - - 12.5 - - 1 1 - 40 40 70 -- 300 30 30 -- -30 - --- -300 - -300 - 12.5 1 2 2 4 3 52 30 зо - 300 100 12.5 1 3 4 4 4 40 30 100 30 100 30 300 - -300 -- 100 300 50 12.5 1 0 4 1 4 3 4 4 4 4 32 30 30 100 100 300 100 12.5 0 0 4 4 4 60 100 100 300 - - - 30 0 4 4 4 4 30 16f СН3 F 16g С2Н5 Η 16h С2Н5 F 17а 17b S ΝΗ O O 17c S S 17d ΝΗ S 18а Η О 18b 18c 18d 18e CH3 NHNH2 CONH2 Η О О О S Фенітоін Карбамазепін Валпроат 210 204207 131133 150157 167 181183 171172 172173 176178 160 220 253 146148 91 100 30 - 300 300 300 30 3 4 4 4 4 16 30 100 100 100 100 30 - 3 4 3 4 18 30 100 - - 100 100 30 0 0 2 3 3 56 50 30 30 300 30 30 30 30 - 100 100 зо 100 12.5 12.5 -- 2 - 2 - 3 1 1 2 62 100 100 100 100 - 100 12.5 - 1 2 1 1 40 300 30 30 100 100 12.5 - - - 1 - 60 300 300 - 300 - 300 83 80 75 80 30 30 300 100 --100 100 100 --- 100 300 -300 100 -300 - 100 300 300 300 12,5 30 30 1 -1 4 -- 2 -- 2 -- 1 -- 30 30 30 100 -- -100 300 -300 - 100 100 - 100 300 - 30 - а Були введені дози 30, 100 і 300мг/кг. Цифри в таблиці показують мінімальну дозу, при введенні якої спостерігалась біоактивність у половини або більшої кількості мишей. Тварин перевіряли через 0.5 і 4 годин після зробленої ін'єкції. Лінії -- показують відсутність протисудомної активності і нейротоксичність. б Цифри в випробуванні показують кількість щурів із 4, які були захищені. Лінії -- показують, що активність не спостерігалася, і позначення - вказує, що сполука не випробовувалась. Хоча спроби виділити 2-феноксипропіофенон, потрібний для синтезу сполуки 4 (R1=C2H5; R2=H), були невдалі, реакції незмінно вели до утворення ряду сполук, і ці сполуки синтезували, як наведено нижче. Проміжні альдегіди і кетони піддавали реакції з семікарбазидом (13-16), тіосемікарбазидом (17а,c), аміногаунідином (17b,d), гідразидом мурашиної кислоти (18a,e), оцтовим гідразидом (18b), карбогідразидом (18c) або оксаміновим гідразидом (18d). Первісна оцінка протисудомних властивостей сполук 13-18 проводилась таким чином. Дози 30, 100 і 300г/кг вводили шляхом внутрішньочеревних ін'єкції мишам і оцінювали в випробуваннях МЕВ, пвПТЗ і нейротоксичності через півгодини та через чотири години після введення. Результати наведені в Таблиці 4 на додаток до даних для сполуки 12а-e, які наведені для порівняння. Вибрані сполуки піддали кількісній оцінці, і ці результати показані в Таблиці 5. Таблиця 5 Кількісна оцінка активності відібраних сполук в випробуваннях МЕВ, пвПТЗ і нейротоксичності після внутрішньочеревних ін'єкцій мишам Випробування Випробування МЕВ пвПТЗ Сполука ED50 (м Відхи ED50 t t Відхилення (мг/кг) г/кг) (95% лення (SE) (95% СІ) СІ) (SE) г г 12а 1 12.86 8.28 1 >54 (10.54(3.00) 17.09) 13а 0.25 9.08 6.21 0.25 43.31 1.54 (6.45(1.91) (18.36(0.57) 11.31) 12.07) 13b 1 11.63 22.69 0.25 >80 (10.96(9.34) 12.48) 13f 1 5.46 11.64 2 12.84 3.34 (4.57-6.46) (3.74) (8.25(1.16) 18.55) 13g 4 11.09 20.278 (10.367- (6.827) .583) 15а 1 15.62 4.50 1 >46 (10.45(1.36) 20.56) Випробування нейротоксичності Відхи t TD50 (мг/кг) лення (95% СІ) (SE) г 1 108.03 3.69 (71.52(0.96) 157.52) 1 73.48 10.51 (64.3-86.40) (3.08) IЗа МЕВ пв ПТЗ 8.40 8.09 1.70 2 60.74 45.21 (58.92-63.84) (14.45) 5.22 2 35.26 6.78 (25.02-43.44) (2.05) 6.45 2.75 120 23.21 (8.59) 1 >120 5.92 (1.72) 2 >200 3.676 (0.986) 1 >300 1 113.00 (103.02122.68) 88.00 (83.31194.847) 53.18 (41.42-72.54) 2 2 2 122.57 (101.63149.51) 196.52 (174.42926.477) 42.8 (36.4-47.5) 47.8 (39.2-59.2) 483 (412-571) 4 12.4 2 >50 (3.60) 20.8 0.25 >50 (7.15) 7.31 0.25 209 (2.48) (176-249) 8.51 (2.69) 0.5 0.25 0.25 17.38 (5.73) 4.47 24.001 7.112 315 2 4.82 (1.82) 32.2 4 108.77 (80.26-177.74) 500 0 >72 (500 /4-24 >496 4 4 1 328.28 >16.9 (172.81 >115.6 183.05 (100.59-338.35) 2.49 (0.86) 2 1 /4-24c >125 >500 >6.70 36.8 >21.6 Карбамазепін Валпроат а 1 0.5 (21.4-25.4) 3.57 (2.41-4.72) 395 (332-441) (4.28) 3.84 (1.15) 8.13 (2.76) 1 0.5 361 (319-402) 859 (719-1148) 11.4 (2.96) 6.57 (2.17) 101 2.17 ІЗ позначає індекс захисту, а саме TD50/ED50. Дані для цієї сполуки взяли із посилання 1 с Сполука перевірялась через 0.25, 0.5, 1, 3, 4, 6, 8 і 24 години після введення. Остаточну фармакологічну оцінку представлених сполук проводили, використовуючи модель спричиненої епілепсії.6 В цьому випадку було показано, що судомам, спричиненим переривистою світовою стимуляцією, запобігає на рівні крові ряд антиконвульсантів таким же чином, як це відбувається у людей. З метою визначення, що саме - кисень або сірка - є кращим атомом-спейсером між двома арильними кільцями, а також для порівняння величин ED50 з величинами, отриманими в оральних випробуваннях у щурів і внутрішньочеревних випробуваннях у мишей, було перевірено дві серії сполук. Величини ED50 ефірів 12a-d були 1.5, 2.5, 1.0 і 2.0мг/кг, відповідно, і для тіоефірів, які мають такі самі структури арильних замісників, а саме 12a, 15а, 16b,с, дорівнювали 1.5, 2.5, 1.0 і 1.5мг/кг, відповідно. Таким чином, на ефективність не впливає, кисень чи сірка використовуються як група-спейсер. Величини ED50 сполук 12а, 15а, 16a в оральному випробуванні у щурів знаходяться в діапазоні 1-5мг/кг, в той же час величини для сполук 12а, 15а, 16b, с при внутрішньочеревному випробуванні у мишей дорівнюють приблизно 15-25 мг/кг. Таким чином, результати, отримані у моделі спричиненої епілепсії є порівнюються з даними, що отримані при оральному випробуванні у щурів. b
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds of semicarbazones and a composition revealing an anticonvulsant activity
Назва патенту російськоюСоединения семикарбазонов и композиция, проявляющая протисудорожную активность
МПК / Мітки
МПК: A61K 31/175, C07C 281/00, A61P 25/00, A61P 25/08
Мітки: виявляє, композиція, протисудомну, активність, сполуки, семікарбазонів
Код посилання
<a href="https://ua.patents.su/14-62915-spoluki-semikarbazoniv-ta-kompoziciya-shho-viyavlyaeh-protisudomnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Сполуки семікарбазонів та композиція, що виявляє протисудомну активність</a>
Попередній патент: 4-арил-1-фенілалкіл-1,2,3,6-тетрагідропіридини, способи їх одержання та фармацевтична композиція на їх основі
Наступний патент: Регульований трансформатор
Випадковий патент: Спосіб визначення патогенетичного механізму формування холелітіазу у дітей