Сполуки цефему, що мають антимікробну активність, та фармацевтична композиція, що їх містить
Номер патенту: 41865
Опубліковано: 15.10.2001
Автори: Казуо Сакане, Есхіко Інамото, Кохдзі Кавабата, Кензі Міяй
Формула / Реферат
1. Соединения цефема, обладающие антимикробной активностью общей формулы (I):
в которой:
R1 представляет собой аминогруппу, трифенил(низший)алкиламино- или (низший)алканоиламиногруппу,
R2 представляет собой низший алкил, который может быть замещен 1-3 атомами галогена,
R3 представляет собой карбоксилатогруппу, карбоксигруппу или моно-, ди- или три(фенил)- или моно-, ди- или три(замещенный фенил) (низший)алкоксикарбонильную группу,
R4 представляет собой гидрокси(низший)алкил, (низший)алканоилокси(низший)алкил или карбамоилокси(низший)алкил,
и R5 представляет собой аминогруппу или (низший)алканоиламиногруппу,
R6 представляет собой атом водорода или низший алкил,
X- представляет собой трифторацетат,
n равно 0 при условии, что R3 представляет собой карбоксилатогруппу, и n равно 1 при условии, что R3 представляет собой карбокси- или моно-, ди- или три(фенил)- или моно-, ди- или три(замещенный фенил)(низший) алкоксикарбонильную группу;
и их фармацевтически приемлемые соли.
2. Соединения по п. 1, в которых R1 представляет собой аминогруппу, R3 представляет собой карбоксилатогруппу или карбоксигруппу.
3. Соединения по п. 2, в которых R2 представляет собой низший алкил или дигалоген(низший)алкил.
4. Соединения по п. 3, в которых R2 представляет собой метил или дифторметил, R4 представляет собой 2-гидроксиэтил, 2-формилоксиэтил, 2-ацетоксиэтил или 2-карбамоилоксиэтил,
R5 представляет собой аминогруппу, формамидо- или ацетамидогруппу,
R6 представляет собой атом водорода или метил.
5. Соединение по п. 4, представляющее собой 7b-[2-(2-аминотиазол-4-ил)-2-метоксииминоацетамидо]-3-[3-амино-2-(2-гидроксиэтил)-1-пиразолио]метил-3-цефем-4-карбоксилат (син-изомер) или его соль серной кислоты.
6. Фармацевтическая композиция, имеющая антимикробную активность, включающая активный агент и фармацевтически приемлемый носитель, отличающаяся тем, что включает в качестве активного агента соединение общей формулы (I):
в которой R1 представляет собой аминогруппу, трифенил(низший)алкиламино- или (низший)алканоиламиногруппу,
R2 представляет собой низший алкил, который может быть замещен 1-3 атомами галогена,
R3 представляет собой карбоксилатогруппу, карбоксигруппу или моно-, ди- или три(фенил)- или моно-, ди- или три(замещенный фенил)(низший)алкоксикарбонильную группу,
R4 представляет собой гидрокси(низший)алкил, (низший)алканоилокси(низший)алкил или карбамоилокси(низший)алкил,
и R5 представляет собой аминогруппу или (низший)алканоиламиногруппу,
R6 представляет собой атом водорода или низший алкил,
Х- представляет собой трифторацетат,
n равно 0 при условии, что R3 представляет собой карбоксилатогруппу, и n равно 1, при условии, что R3 представляет собой карбокси- или моно-, ди- или три(фенил)- или моно-, ди- или три(замещенный фенил)(низший) алкоксикарбонильную группу,
или их фармацевтически приемлемые соли в эффективном количестве.
7. Соединения по п. 1 или их фармацевтически приемлемые соли в качестве антимикробного агента.
Текст
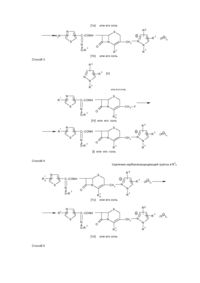
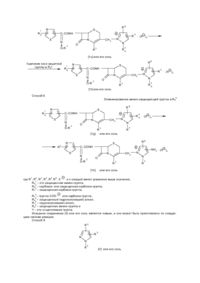
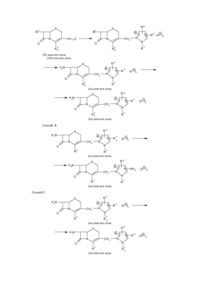
Настоящее изобретение относится к новому соединению цефема и его фармацевтически приемлемой соли. Более конкретно, изобретение относится к новому соединению цефе ма и его фармацевтически приемлемой соли, которые обладают проти вомикробной активностью, к способу и х получения, к фармацевтической композиции, включающей данное соединение и к способу ле чения инфекционных заболеваний у людей или животных. Соединения цефе ма, в общем, известны в данной области. Так, например, в заявке на патент Великобритании GB–A–2 037 821 раскрыты 7-тиазолилзамещенные цефа лоспорины, имеющие монозамещенную пиразолиогруппу в 3 положении, проявляющие высокую активность в отношении грамотрицательных организмов. 7-Тиазолилзамещенные соединения цефема раскрыты также в Европейском патенте ЕР-А-0 062321. Кроме того, в Европейских патентах ЕР-А-0 214600 и ЕР-А-0 222322 раскрыты соединения цефема, которые замещены в 3 положении имидазолильной группой. Целью настояще го изобрете ния является получение соединений цефе ма и их фар мацевтически приемлемых солей, кото рые являются высокоактивными против ряда пато генных микроорганизмов. Еще одной целью настоящего изобретения является способ получения данных соединений цефе ма или их солей. Кроме того, целью настоящего изобрете ния является фармацевтическая композиция, включающая в качестве активного компонента указанное соединение цефема или его фармацевти чески приемлемую соль. Далее, целью настоя ще го изобрете ния является способ лече ния инфек ционных забо леваний, вызван ных пато генными микроорга низмами, кото рый включает вве дение указанного соединения цефе ма зараженным людям или жи вотным . Целевые соединения цефе ма являются новыми и могут быть представлены следующей общей формулой (I): R 1 N R S C–CONH S O-R + N N CH 2 O 2 6 R N 5 · (X –)n N 4 3 R R в которой R представляет собой амино- или защищенную аминогруппу, R2 – низший алкил, который может иметь один или несколько подходящих заместителей, 1 – R3 – это СОО , карбокси- или защищенная карбоксигруппа, R4 – это гидрокси (низший) алкил или защи щенный гидрокси (низший) алкил, R5 – амино- или защищенная амино-группа, R6 – атом водорода или низший алкил, – Х – представляет собой анион, и n – это 0 или 1, при условии, что: – 1) когда R3 – это СОО , тогда n равно 0, и 2) когда R3 является карбокси- или защищенной карбокси-группой, тогда n равно 1. Что касается целевого ве щества (1), необходимо отметить следующие моменты. То есть целевое вещество (1) включает син-изомер, анти-изомер и их смеси. Син-изомер означает геометрический изомер, имеющий частичную структуру, представленную сле дующей формулой: R 1 N C—CO— S N—O—R 2 (в которой R1 и R2 каждый является таким, как указано выше), и анти-изомер означает другой геометрический изомер, имеющий частичную структуру, представленную следующей формулой: R 1 N C—CO— S R2 –O–N (в которой R1 и R2 каждый является таким, как указано выше), причем все такие геометрические изомеры и их смеси включены в объем этого изобретения. В настоящем описании и притязаниях частичная структура эти х гео метрических изомеров и их смесей в целях удобства представлена следующей фор мулой: R N 1 C—CO— S N O—R2 (в которой R1 и R2 каждый является таким, как указано выше). Следующий мо мент, который сле дуе т о тмети ть, состои т в том, что пи разолио-гр уп па вещества (I) так же может существова ть в та утомерных фор мах, при чем та кое та утомерное равнове сие может быть представле но сле дующей схе мой : R6 R6 5 4 + —N 1 5 R 3 5 4 —N 1 2N R5 3 + 2N R4 (B) R4 (A) (в которой R4, R5 и R6 каждый является таким, как указано выше). Оба указанных вы ше тауто мерных изомера включены в объем настояще го изобретения, однако в настоящем описании и притязаниях целевое вещество (I) представлено в целях удобства одним выражением пиразолио-группы формулы (А). Цефемное вещество (I) настоящего изобретения может быть получено с помощью способов, которые иллюстрируются следующи ми ниже схемами реакции. Способ I R S H 2N 6 + N N CH 2 5 C–COOH S 3 R O-R (III) R6 S C–CONH S + N N O-R 2 или его реакционноспособная производная при карбокси-группе, или его соль N R N 4 (II) или его реакционноспособная производная при амино-группе, или его соль 1 N 1 · (X –)n + R N O R R 2 R N CH 2 · (X – )n N O R 5 3 R 4 (I ) соль Способ 2 1 или его Удаление амино защитной группы в R1a N R6 S C–CONH Ra S N N O-R + 2 CH 2 O R 3 R N N R 4 5 · (X – )n [1a] или его соль N R6 S C–CONH H 2N S + N N O-R N CH 2 3 R или его соль [1b] 5 · (X – )n 5 · (X – )n N O 2 R R 4 Способ 3 R6 R N 5 [V] N R R 1 или его соль N S C–CONH S N N O-R 1 4 2 3 Ra [IV] или его соль N C–CONH S + N N O-R CH 2 2 R N N O 3 R [I] или его соль Способ 4 R 4 Удалениекарбоксизащищающей группы в R3 b N R6 S Ra C–CONH S N R1 + N O-R 2 CH 2 O 3 Rb [1с] или его соль N R N 5 R 4 R6 C–CONH O-R + N N 2 · (X – )n N S S CH 2 O 3 Rc [1d] Способ 5 R6 S R 1 CH 2—Y O или его соль R N N R 4 5 · (X – )n N 1 R6 S Ra C–CONH S + N N O-R R N CH 2 N O 2 R · (X – )n 5 4 3 Ra [1e ] или его соль Удаление окси защитной группы в R4a N 1 R S Ra C–CONH S + N N O-R 6 N CH2 R 5 – · (X )n N O 2 R 4 3 Rb [1f] или его соль Способ 6 1 Элиминирование амино-защищающей груп пы в Ra5 N R6 S C–CONH Ra S + N N O-R 2 CH 2 [1g] 1 N O R 5 R a · (X – )n 3 N R 4 или его соль N R6 S C–CONH R S + N N O-R 2 CH 2 O R [1h] 3 NH 2 · (X – )n N N R 4 или его соль – где R1, R2 , R3, R4, R5, R6 , X и n каждый имеет указанное выше значение, 1 Ra – это защищен ная амино-группа, Ra3 – карбокси- или защи щенная карбокси-группа, R13 – защи щенная карбокси-груп па, – Rc3 – груп па СОО или карбокси-груп па, 4 Ra – защи щенный гидрокси(низший) алкил, R14 – гидрокси(низший) алкил, Ra5 – защи щенная амино-группа и Y – это отщепляемая группа. Исходное соединение (II) или его соль является новым, и оно может быть приготовлено по следующим схе мам реакции. Способ А R6 R N 5 N R 4 [V] или его соль R S 7 R N R6 S 7 + CH 2– Z N O N CH2 N O 3 3 Rb – R 5 · (X )n R Rb 4 (VI) или его соль (VII) или его соль R6 S H 2N + N CH 2 5 R N – · (X )n N O 3 Rb R 4 (IIa ) или его соль R6 S H 2N + N R N CH 2 5 · (X –)n N O 3 Rc R 4 (IIb ) или его соль Способ В R S H 2N 6 + N N CH2 3 5 a – · (X )n N O R R 4 R (IIc) или его соль R6 S H 2N + N CH 2 NH 2 · (X – )n N N O 3 R (IId ) или его соль R 4 Способ С R S H 2N 6 + N CH 2 3 5 – · (X )n N O R R N 4 Ra (IIe ) или его соль R S H 2N 6 + N CH 2 O 3 R (IIf) или его соль R N N 4 Rb 6 – · (X )n – где R3, Rb 3, Rc 3, R4 , Ra 4, Rb 4, R5, Ra 5, R6, X и n каждый такой как обозначено выше, 7 R является защи щенной амино-группой и Z – отщепляемой группой. Некоторые из исходных веществ (V) или их со лей являются новыми, и они могут быть приготовлены в соответствии с методами, раскрыты ми в описанных ниже препаративных примерах, или аналогичными им способами. Подхо дящие фармацевтически приемлемые соли целевого ве щества (I) являются традиционными нетоксичными моно- или двойными солями и включают соль металла, та кую как соль щелочного металла (например, соль натрия, соль калия и др.) и соль щелочно-земельного металла (например, соль кальция, соль магния и др.) соль аммония, соль органического основания (например, соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина, соль N,N-дибензилэтилендиамина и др.), аддитивую соль органической кислоты (например, формиат, ацетат, три фторацетат, малеат, тартрат, метансуль фонат, бензолсульфонат, то луолсульфонат и др.) и аддитивную соль неорганической кислоты (например, гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат и др.), соль с аминокислотой (например, соль аргинина, соль аспартиковой кислоты, соль глутаминовой кислоты и др.) и т.п. В приведенном и последующем описании этой заявки, соответствующие примеры различных определений подробно объясняются следующим образом: Термин "низший" означает от 1 до 6 ато мов углерода, если не указано иное количество. Подхо дящая защищающая группа в "защи щенной аминогруппе" может включать ар(низший) алкил, такой как моно- или ди-, или трифенил(низший)алкил, (например, бензил, фенетил, 1-фенилэтил, бензгидрил, тритил и др.), ацил, как объяснено ниже, и тому подобные. Подхо дящий ацил может быть алифа тическим ацилом, аромати ческим ацилом, арилалифати ческим ацилом и гетероциклическималифа тическим ацилом, являющимся производным карбоновой кислоты, угольной кислоты, карбаминовой кислоты, сульфо новой кислоты и т.п. Подхо дящим примером поясненной таким образом ацильной группы может быть низший алканоил (например, формил, ацетил, пропионил, гексаноил, пивалоил и др.) моно- (или ди-, или три-)-галоид(низший)алканоил (например, хлорацетил, трифторацетил и др.), низший алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, трет-пентилоксикарбонил, гексил-оксикарбонил и др.), моно- (или ди-, или три-) галоид (низший) алкоксикарбонил (например, хлорметоксикарбонил, дихлорэтоксикарбонил, трихлорэтоксикарбонил и др.), ароил (например, бензоил, толуоил, ксилоил, нафтоил и др.), ар(низший)алканоил, такой как фенил(низший) алканоил (например, фенилацетил, фе нилпропионил и др.), арилоксикарбонил (например, феноксикарбонил, нафтилоксикарбонил и др.), арилокси-(низший)-алканоил, такой как фенокси(низший)алканоил (например, феноксиацетил, фе ноксипропионил и др.), арилглиоксилоил), например, фенилглиоксилоил, нафтилглиоксилоил и др.), ар(низший)алиоксикарбонил, который может иметь подхо дящие замести тели(ь), такой как фенил(низший)алкоксикарбонил, кото рый может иметь нитро- или низшую алкоксигруппу (например, бензилоксикарбонил, фе нетилоксикарбонил, пара-нитробензилоксикарбонил, пара-метоксибензилоксикарбонил и др.), тиенилацетил, имидазолилацетил, фурилацетил, тетразолилацетил, триазолилацетил, тиа диазолилацетил, тиенилпропионил, тиадиазолпропионил, низший алкилсульфо нил (например, метилсульфо нил, этилсуль фонил, пропилсульфонил), изопропилсульфо нил, пентилсульфо нил, бутилсульфо нил и др.), арилсульфонил (например, фенетилсульфо нил, толилсульфо нил, ксилилсульфонил, нафтилсульфо нил и др.), ар(низший) алкилсуль фонил, та кой как фенил(низший) алкилсульфо нил (например, бензилсуль фонил, фе нилсульфо нил, бензгидрилсульфо нил и др.), и т.п. Предпочти тельным примером определенной таким образом "защи щенной амино-группы" может быть ар(низший) алкиламино- и низшая алканоиламино-группа, более предпочти тельной может быть трифенил (CL-C4) алкиламино- и CL-C4-алканоиламино-группа, и наиболее предпочтительной может быть триалиламино-, формамидо- и ацета мидо-груп па. Подхо дящей "защищен ной карбокси" может быть этерифицированная карбокси-группа или ей подобная, и конкретными примерами эфирной функции в указанной этерифицированной карбокси-группе могут быть такие, как сложный низший алкиловый эфир, (например, сложный метиловый эфир, сложный этиловый эфир, сложный пропиловый эфир, сложный изопропиловый эфир, сложный бути ловый эфир, сложный изобутиловый эфир, сложный трет-бутиловый эфир, сложный пентиловый эфир, сложный гексиловый эфир, сложный 1-циклопропил-этиловый эфир и др.), кото рые могут иметь подходящие заместите ли(ль), например, низший алканоилокси(низший)алкиловый сложный эфир, (например, сложный ацетоксиметиловый эфир, сложный пропионилоксиметиловый эфир, сложный бути рилоксиметиловый эфир, сложный валерилоксиметиловый эфир, сложный пивалоилоксиметиловый эфир, сложный 1-ацетоксиметиловый эфир, 1-пропионилоксиэтиловый сложный эфир, сложный пивалоилоксиметиловый эфир, 2-пропионилоксиэтиловый сложный эфир, сложный гесаноилоксиметиловый эфир, и др.), низший алкансульфо нил (низший)-алкиловый сложный эфир (например, сложный 2-мезилэтиловый эфир и др.) или моно- (или ди-, или три-) галоид (низший)алкиловый сложный эфир, (например, 2-иодэтиловый сложный эфир, сложный 2,2,2трихлорэти ловый эфир и др.); низший алкениловый сложный эфир (например, сложный виниловый эфир, сложный аллиловый эфир и др.); низший алкиниловый сложный эфир (например, сложный этиловый эфир, сложный пропиниловый эфир и др.); ар(низший)-алкиловый сложный эфир, который может иметь подходящий заместитель(ли) (например, сложный бензиловый эфир, сложный 4-метоксибензиловый эфир, сложный 4-нитробензиловый эфир, сложный фенетиловый эфир, сложный тритиловый эфир, сложный бензгидриловый эфир, сложный бис(метоксифе нил)метиловый эфир, сложный 3,4-диметоксибензиловый эфир, сложный 4-гидрокси-3,5-ди-третбутилбензиловый эфир и др.); сложный ариловый эфир, который может иметь подхо дящий заместитель(ли) (например, сложный фениловый эфир, сложный 4-хлорфениловый эфир, сложный толиловый эфир, сложный 4-третбутилфе ниловый эфир, сложный ксилиловый эфир, сложный мезитиловый эфир, сложный кумениловый эфир и др.); или подобные им, в которых предпочтительным может быть моно- или ди-, или три-фенил (CL-C4)алкиловый сложный эфир и наиболее предпочтительным может быть сложный бензгидриловый эфир. Подхо дящим "низшим алкилом" может быть алкил с неразветвленной или разветвленной цепочкой, такой как метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, 2-этилпропил, гексил или т.п., в которых предпочтительным "низшим алкилом" может быть (СL-C4)алкил и наиболее предпочтительным может быть метил. Соответствующие примеры "подхо дящего заместите ля(лей)" в "низшем алкиле, который может иметь один или несколько подхо дящи х заместите лей(ль)" могут включать галоген (например, фтор, хлор, бром, иод) и т.п. Подхо дящие примеры указанного низше го алкила, имеющего один или несколько подхо дящих заместителей(ль), могут включать низший алкил, имеющий один или несколько атомов галоге на, такой как фторметил, дифторметил, трифторметил, 2-фторэтил, 2-хлор-2-фторэтил, 3-бром-2-фторпропил, 1-хлорметил2-иод-1-бромэтил, 2-дифторпропил, 1-дихлорметил-1-метилэтил, 2-фтор-4-хлор-5-бромпентил, 1-дифтор2-этилпропил, 2-фтор-3-иодгексил или т.п., в которых предпочтительным может быть (CL–C4)алкил, имеющий 1-3 атомов галогена, более предпочтительным может быть дигалоид (CL-C4) алкил и наиболее предпочти тельным может быть дифторметил. Подхо дящий "гикрокси(низший)алкил" может включать гидроксиметил, 1-гидроксиэтил, 2гидроксиэтил, 3-гидроксипропил, 1-(гидроксиметил)этил, 1-гидроксибутил, 1-гидроксиметил-1-метилэтил, 3гидроксипентил, 3-гидрокси-2-этилпропил, 6-гидроксигексил и тому подобные, в которых предпочтительным может быть гидрокси(CL-C4)алкил и наиболее предпочтительным может быть 2-гидроксиэтил. Подхо дящий "защи щенный гидрокси(низший)алкил" может включать ацилокси(низший)алкил и тому подобные, в которых подхо дящая "ацильная" функция может называться так, как указано в качестве примера для "защи щенной амино-группы" выше, причем подхо дящие примеры указано "ацилокси(низшего)алкила" могут представлять собой низший алканоилокси(низший)алкил (например, формилоксиметил, 1-формилоксиэтил, 2-формилоксиэтил, 2-ацетоксиэтил, 3-ацетоксипропил, 1-(пропионилоксиметил)этил, 1-бутирилоксибутил, 1-гексаноилоксибутил, 1-пивалоилоксиметил-1-метилэтил, 8-формилоксипентил, 3-формилокси-2-этилпропил, 6-ацетоксигексил и др.), карбамоилокси(низший)алкил (например, карбамоилоксиметил, 1-карбамоилоксиэтил, 2-карбамоилоксиэтил, 3-карбамоилоксипропил, 1-(карбамоилоксиметил)этил, 1карбамоилоксибутил, 1- карбамоилоксиметил-1-метилэтил, 3- карбамоилоксипентил, 3-карбамоилокси-2этилпропил, 6-карбамоилоксигексил и др.) или тому подобные, в которых предпочтительным может быть (СL-C4)алканоилокси(CL-C4)алкил или карбамоилокси(СL-C4)алкил и наиболее предпочтительным может быть 2-формилоксиэтил, 2-ацетоксиэтил или 2–карбамоилоксиэтил. Подходящим "анионом" может быть формиат, ацетат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат, толуолсульфонат, хлорид, бромид, иодид, сульфат, фосфат и т.п. Подхо дящей "о тщепляемой группой" может быть атом галогена (например, хлор, бром, иод и др.) ацилокси-группа, такая, как сульфо нилокси- (например, бензолсульфо нилокси-, то зилокси-, мезилокси- и др.), низшая алканоилокси-груп па (например, ацетилокси-, пропионилокси- и др.) и т.п. Способы получения целевого вещества настоящего изобретения подробно объясняются ниже. Способ I Целевое вещество (I) или его соль могут быть получены путем взаимодействия соединения (II) или его реакционноспособной производной при амино-группе, или его соли с соединением (III) или его реакционноспособной производной при карбокси-груп пе, или его солью. Подхо дящая реакционноспособная производная при аминогруп пе соединения (II) может включать основание Шиффа аминного ти па или его таутомерный изомер анаминного ти па, образующий ся посредством взаимодействия соединения (II) с карбонильным соединением, таким как альдегид, кетон и т.п.; силильную производную, образующуюся при взаимодействии соединения (II) с силильным соединением, таким как бис(триметилсилил)ацетамид, моно(триметилсилил)ацетамид, бис(триметилсилил)мочевина или т.п.; производную, образующуюся при взаимодействии соединения (II) с тре ххлористым фосфо ром или фосгеном и т.п. Подхо дящие соли соединения (II) и его реакционноспособной производной, могут именоваться так, как указано для примера для вещества (I). Подхо дящая реакционноспособная производная при карбокси-группе соединения (III) может включать галогенид кислоты, ангидрид кислоты, активированный амид, акти вированный сложный эфир и т.п. Подхо дящи ми примерами реакционноспособных производных могут быть хлорангидрид кислоты; азид кислоты, смешанный ангидрид кислоты с такой кислотой, как замещенная фосфорная кислота (например, диалкилфосфорная кислота, фе нилфосфорная кислота, дифе нилфосфор ная кислота, дибензилфосфорная кислота, галоидированная фосфор ная кислота, и др.), диалкилфосфорная кислота, сернистая кислота, тиосерная кислота, серная кислота, сульфоновая кислота, (например, метансуль фоновая кислота и др.), алифа тическая карбоновая кислота (например, уксусная кислота, пропионовая кислота, масляная изомасляная кислота, триметилуксусная кислота, пентановая кислота, изопентановая кислота, 2-этилмасляная кислота, трихлоруксусная кислота, и др.) или аромати ческая карбоновая кислота (например, бензойная кислот и др.), симметричный ангидрид кислоты; активированный амид с имидазолом, 4-замещенным имидозалом, диметилпиразолом, триазолом, тетразолом или 1-гидрокси-1Н-бензотриазолом; или активированный сложный эфир (например, цианометиловый сложный эфир, метоксиметиловый сложный эфир, сложный димети лиминометиловый [(CH3)2N=CH-] эфир, сложный виниловый эфир, сложный пропаргиловый эфир, сложный пара-нитрофе ниловый эфир, сложный 2,4-динитрофениловый эфир, сложный трихлорфе ниловый эфир, сложный пентахлорфе ниловый эфир, сложный мезилфе ниловый эфир, сложный фенилазофениловый эфир, сложный фенилтиоэфир, сложный пара-нитрофе нил-тиоэфир, сложный пара-крезил-тиоэфир, сложный карбоксиметил-тиоэфир, сложный пираниловый эфир, сложный пиридиловый эфир, сложный пиперидиловый эфир, сложный 8-хинолил-тиоэфир и др.), или сложный эфир с N-гидроксисоединением (например, N,N-диметилгидроксиламином, 1-гидрокси-2-(1Н)-пиридоном, N-гидроксисук цинимидом, N-гидроксифтальимидом, 1-гидрокси-1Н-бензотриазолом и др. и т.п. Эти реакционноспособные производные необязательно могут быть выбраны из таковых, соответствующи х типу используемого соединения (III). Подхо дящие соли соединения (III) и его реакционноспособная производная могут называться так, как приведено, например, для вещества (I). Обычно взаимодействие осуществляют в традиционном растворителе, таком как вода, спирт (например, метанол, эта нол и др.), ацетон, диоксан, ацетонитрил, хло роформ, хло ристый метилен, хло ристый этилен, тетрагидрофуран, этилацетат, N,N-диметилформамид, пиридин или любой другой органический растворитель, который не оказывает вредного воздействия на реакцию. Эти традиционные растворители также могут использоваться в смеси с во дой. В этой реакции, когда соединение (III) применяется в ви де свободной кислоты или в ви де ее соли, предпочтительно взаимодействие осуществляют в присутствии традиционного конденсирующего агента, такого как N,N'-дициклогексилкарбодиимид; N-циклогексил-N'-морфолиноэтилкарбодиимид; N-циклогексилN'-(4-ди-этиламиноциклогексил)карбодиимид, N,N'-диэтилкарбодиимид, N,N'-диизопропилкарбодиими; Nэтил-N'-(3-диметиламинопропил)карбодиимид; N,N'-карбонилбис-(2-метилимидазол); пента метиленкетенN-циклогексилимин; дифе нилкетен-N-циклогексилимин; этоксиацети лен; 1-алкокси-1-хлорэтилен; триалкилфосфит; этилполифосфат; изопропилполифосфат; оксихлорид фосфо ра (хлористый фосфо рил) треххлористый фосфор; хло ристый тионил; оксалилхлорид; низший алкилгалоидфор миат (например, этилхлорформиат, изопропилхлорфор миат и др.); три фенилфосфин; 2-этил-7-гидроксибензизоксазолиниевая соль; внутримолекулярная соль 2-этил-5-(метасульфо фенил)изоксазолиний гидроксида; 1-(пара-хлорбензолсульфо нилокси)-6-хлор-1Н-бензотриазол; так называемый реактив Вильсмайера, приготовленный взаимодействием N,N-диметилформамида с хлористым тионилом, фосгеном, трихлорметиловым эфиром хлормуравьиной кислоты, оксихлоридом фосфо ра, хлористым метансульфо нилом и др. или т.п. Эта реакция также может быть проведена в присутствии неорганического или органического основания, такого как карбонат щелочного металла, бикарбонат ще лочного металла, три(низший)алкиламин, пиридил, N-(низший)алкилморфолин, N,N-ди(низший)алкилбензиламин или т.п. Температура реакции не является критической, и обычно реакцию проводят или при охлаждении, или при нагревании. Способ 2. Целевое вещество (Ib) или его соль могут быть получены, вовлечением вещества (Ia) или его соли в реакцию элиминирования амино-защи щающей гр уппы в Ra1. Эту реакцию проводят в соответствии с тра диционным методом, таким как гидролиз, восстановление или т.п. Предпочти тельно гидролиз проводится в присутствии основания или кислоты, включая кислоту Льюиса. Подхо дящее основание может включать неорганическое основание и органическое основание, такое как щелочной металл (например, натрий, калий и др.), щелочно-земельный металл (например, магний, кальций и др.), гидроксид, или карбонат, или бикарбонат этих металлов, триалкиламин (например, триметиламин, триэтиламин и др.), пиколин, 1,5-диазабицикло/4,3,0/-нон-5-ен, 1,4-диазабицикло/2,2,2/октан, 1,8диазабицикло/5, 4,0/-унден-7-ен или т.п. Подхо дящая кислота может включать органическую кислоту (например, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, три хлоруксусную кислоту, три фторуксусную кислоту и др.) и неорганическую кислоту, (например, хлористово дородную кислоту, бромистоводородную кислоту, серную кислоту, хло ристый водород, бромистый водород и др.). Реакция элиминирования с использованием кислоты Льюиса, такой как тригалоидуксусная кислота (например, трихлоруксусная кислота, трифторуксусная кислота и др.) или подобной ей, предпочтительно проводится в присутствии агентов, улавливающих катион, (например, анизола, фенола и др.). Обычно реакцию проводят в растворителе, та ком как вода, спирт (например, метанол, этанол и др.), хло ристый метилен, тетрагидрофуран, их смеси, или в любом другом раство рителе, который не оказывает вредного воздействия на реакцию. В качестве растворителя также может применяться жидкое основание или кислота. Температура реакции не является крити ческой, и обычно реакция проводится в условиях от охлаждения до нагревания. Ме тод взаимодействия, применяемый для реакции элимирования может включать химическое восстановление и каталитическое восстановление. Подхо дящие восстанавливающие агенты, которые могут применяться при химическом восстановлении, представляют собой сочетание металла (например, олова, цинка, железа и др.) или соединения металла (например, хло рида хрома, ацета та хро ма и др.) и органической или неорганической кислоты (например, муравьиной кислоты, ук сусной кислоты, пропионовой кислоты, трифторуксусной кислоты, пара-толуолсульфо кислоты, хло ристоводородной кислоты, бромистово дородной кислоты и др.). Подхо дящие катализато ры, которые могут применяться в ката лити ческом восстановлении, – это традиционные катализаторы, такие как платиновые катализаторы (например, платиновая пластина, губчатая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и др.), палладиевые ката лизато ры (например, губчатый палладий, палладиевая чернь, оксид палладия на угле, коллиодный палладий, палладий на сульфа те бария, палладий на карбонате бария и др.), никелевые катализаторы (например, восстановленный никель, оксид никеля, никель Ренея и др.), кобальтовые катализато ры (например, восстановленный кобальт, кобальт Ренея и др.), железные ката лизаторы (например, восстановленное железо, железо Ренея и др.), медные катализаторы (например, восстановленная медь, медь Ренея, медь Ульмана и др.) и т.п. Обычно восстановление прово дится в традиционном раство рителе, который не оказывает вредного воздействия на реакцию, таком как вода, метанол, этанол, пропанол, N,N-диметилформамид или их смеси. Кроме того, в случае, когда упомянутая выше кислота, используемая в реакции, представляет собой жидкость, она также может использоваться в качестве растворителя. Далее, подхо дящий растворитель, который используется в каталитическом восстановлении, может представлять собой упомянутый выше растворитель, другой традиционный растворитель, та кой как диэтиловый эфир, диоксан, тетрагидрофуран и др., или их смеси. Температура реакционной смеси при восста новлении не является критической, и обычно реакцию проводят в условиях от о хлаждения до нагревания. Настоящее изобретение включает в объем защиты случай, когда защищен ная амино-группа в R5 превращается в амино-группу, случай, когда защи щенная карбокси-группа в R3 превращается в карбоксигруп пу, и случай, когда защищенный гидрокси(низший)алкил в R4 превращается в гидрокси(низший)алкил. Способ 3. Целевое вещество (I) или его соль может быть получено путем взаимодействия соединения (IV) или его соли с соединением (V) или его солью. Подхо дящие соли соединений (IV) могут быть солями органических кислот (например, формиат, ацетата, трифторацетат, малеат, тартрат, метансуль фонат, бензолсульфо нат, толуолсульфонат и др.) солями неорганических кислот (например, гидрохлорид, гидробромид, сульфат фосфат и др.) и т.п. Настоящее взаимодействие может быть проведено в растворителе, та ком как вода, фосфатный буфер, ацетон, хло роформ, ацето нитрил, нитробензил, хлористый метилен, хло ристый эти лен, формамид, N,N-диметилформамид, метанол, этанол, диэтиловый эфир, тетрагидрофуран, диметилсуль фоксид или любой другой органический растворитель, который не оказывает вредного воздействия на реакцию, предпочти тельно в растворителях, обладающих сильной полярностью. Среди растворителей, гидрофильные растворители могут использоваться в смеси с водой. Когда соединение (V) является жидкостью, оно также может применяться в качестве растворителя. Предпочтительно реакцию проводят в присутствии основания, например, неорганического основания, такого как гидроксид ще лочного металла, карбонат ще лочного металла, бикарбонат щелочного металла, органического основания, такого как триалкил амин и т.п. Температура реакции не является крити ческой, причем обычно взаимодействие осуществляют при комнатной температуре, при нагревании, или при охлаждении. Предпочтительно настоящее взаимодействие проводят в присутствии галогенида ще лочного металла (например, иодида натрия, иодида калия и др.), тиоцианата ще лочного металла (например, тиоцианата натрия, тиоцианата калия и др.) или т.п. – Анионом Х может быть один из производных отщепляемой группы V, и может быть другим, превращен ным анионом по традиционной методике. Способ 4. Целевое соединение (Id) или его соль могут быть получены посредством вовлечения вещества (Ic) или его соли в реакцию элиминирования карбокси-защи щающей груп пы в R b3. Эта реакция может быть проведена аналогичным образом, как упомянуто в способе 2, выше, и поэтому на тип реакции и условия реакции (например, основание, кислота, катализатор, растворитель, температура реакции и др.), этого взаимодействия мы сошлемся на таковые, которые пояснены в способе 2. Настоящее изобретение включает в объем защиты случаи, когда защищен ная амино-группа в R1 и/или R5 и/или защищен ный гидрокси(низший)алкил в R4 превращаются в аминогруппу и/или гидрокси(низший)алкил, соответственно в хо де этой реакции. Способ 5 Целевое вещество (If) или его соль могут быть получены посредством вовлечения соединения (Iе) или его соли в реакцию элиминирования гидрокси-защищен ной группы в Rа4 . Эта реакция может быть проведена способом, аналогичным упомянутому вы ше в способе 2, и поэтому на тип реакции и условия реакции (например, основание, кислота, катализатор, растворитель, температура реакции и др.) этого взаимодействия мы сошлемся на таковые, которые пояснены в способе 2. Настоящее изобретение включает в объеме защи ты случаи, когда защищенная амино-группа в R1 и/или R5 и/или защищен ная карбокси-груп па в R3 в ходе этой реакции превращаются в амино- и/или карбокси-группу, соответственно. Способ 6 Целевое вещество (Ih) или его соль могут быть получены посредством вовлечения соединения (Ig) или его соли в реакцию элиминирования амино-защи щающей гр уп пы в Rа5. Эта реакция может быть проведена аналогичным образом, как упомянуто выше в способе 2, и поэтому на тип реакции и условия реакции (например, основание, кислота, катализатор, растворитель, температура реакции и др.) это го взаимодействия мы сошлемся на таковые, которые пояснены в способе 2. Настоящее изобретение включает в объем защиты случай, когда защищен ная амино-группа в R1 и/или защищен ная карбокси-группа в R3 и/или защи щенный гидрокси(низший)алкил в R4 превращаются в амино- и/или карбокси-груп пу и/или гидрокси(низший)алкил, соответственно в хо де этой реакции. Реакция в способах от А до С для приготовления исходных соединений (II) или их солей могут быть проведены в соответствии со способами, аналогичными описанным в способах 2–6 для получения вещества (I) или его со ли. Теперь для того, что бы продемонстрировать полезность целевого вещества (I), ниже приведены данные испытаний на МИК (минимальную ин гибирующую концентрацию) ха рактерного ве щества (I) это го изобрете ния. Ме тод испытания Противомикробную активность вне организма определяют методом двухкратного разбавления агаровой пластинки, как описано ниже. Одну петлю ночной культуры каждого испытуе мого штамма в триптиказо-соевом бульоне (108 жизнеспособных клеток на 1 мл) наносят полосами на агар сердечного экстракта (Н1-агар), содержащий постепенно изменяющиеся концентрации представи тельного испытуе мого вещества, причем минимальную ин гибирующую концентрацию (МИК) выражают в единицах мкг/мл после выдерживания при 37оС в течение 20 часов. Испытуе мое вещество (I) 7бета-[2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо]-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)-метил-3-цефем-4-карбоксилат (син-изомер) вещество примера 4. Результат испытания Испытуе мая бактерия Мик (мкг/мл) Испытуе мое вещество (I) P. aeruginosa 26 0,39 Результа ты сравнительного испытания (I) Метод испытания Ан тибактериальная активность ин витро была определена с помощью мето да двукратного разбавления чашки с агаровой средой как это описано ниже. Одна полная петля (Loofull ?) культуры, выращенной в течение ночи, каждой испытуе мой линии в трипти казасоевом бульоне (108 жизнеспособных клеток в мл объема) была нанесена на агар с экстрактом сердца (Н1-агар), содержащий отградуи рованные концентрации характерного испытуемого соединения, и минимальная ингибиторная концентрация (МИК) была выражена в единицах мкг/мл после инкубации при 37оС в те чение 20 часов. (2) Испытуе мое соединение Испытуе мое соединение (I): 7b-[2-(2-Аминотиазол-4-ил)-2-(дифторметоксиимино)-ацетамидо]- 3-[3амино-2-(2-оксиэтил)-1-пиразолий]-метил-3-цефем-4-карбоксилат (син-изомер) (Соединение примера 3). Испытуе мое соединение (2): 7b-[2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо]-3-[4-метил-3-амино-2-(2-оксиэтил)-1-пи разолий]-метил-3-це фем-4-карбоксилат (син-изомер) (соединение Примера 17). Испытуе мое соединение (А): 7b-[2-(2-Аминотиазол-4-ил)-2-(дифторметоксиимино)-ацетамидо]-3-(3амино-2-метил-1-пиразолий)-метил-3-цефем- 4-карбоксилат (син-изомер) (соединение Примера 67 из патента Европы № 0 223 246). Испытуе мое соединение (Б): 7b-[2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо]-3-(4-метил-3-амино-2-метил-1-пиразолий)-метил-3-цефем- 4-карбоксилат (син-изомер) (соединение Примера 89 из патента Европы № 0 223 246). (3) Результа ты испытаний Ми нимальная ингибиторная концентрация (мкг/мл) Испытуе мое соединение (1) (2) (A) (Б) Испытуе мые бактерии E. aerogenes 84 1,56 3,13 50,0 6,25 Для терапевтического назначения целевое вещество (1) и его фармацевти чески приемлемая соль настояще го изобретения используются в виде традиционного фармацевти ческого препарата, кото рый содержит указанное вещество в качестве активного компонента, в смеси с фармацевтически приемлемыми носителями, такими как органическая или неорганическая твердая или жидкая среда для лекарства, которая пригодна для перорального, па рентерального и экстернального назначения. Эти фармацевтические препараты могут быть в твер дой форме, такой как таблетки, гранулы, порошок, капсулы, или в жидкой форме, такой как раствор, суспензия, сироп, эмульсия, лиминад и т.п. Если необхо димо, в указанные выше препараты могут быть включены вспомогательные соединения, стабилизирующие алюенты, увлажняющие агенты и другие обычно применяемые добавки, такие как лактоза, лимонная кислота, вин ная кислота, стеариновая кислота, стеарат магния, белая земля, саха роза, кукуруз ный крахмал, тальк, желатин, агар, пектин, масло земляного ореха, оливковое масло, масло какао, этиленгликоль и т.п. Хо тя дозировка вещества (I) может изменяться и кроме того зави сеть от возраста, состояния пациента, ха рактера заболевания, типа вещества (I), кото рое применяется, и др. Вообще пациенту в сутки можно назначать дозы между 1 мг и приблизительно 4000 мг или даже больше. Для лечения заболеваний, вызванных патогенными микроорганизмами, могут применяться средние единичные дозы приблизительно 50 мг, 100 мг, 250 мг, 500 мг, 1000 мг, 2000 мг целевого вещества (I) настоящего изобретения. Следующие препаративные примеры и примеры даны в целях более подробного иллюстрирования настояще го изобретения. Препаративный пример 1 Смесь уксусного ангидрида (11,13 мл) и муравьиной кислоты (5,93 мл) перемешивают при комнатной температуре в течение 30 минут. К этому раствору до бавляют 5 г 5-амино-1-(2-гидроксиэтил) пиразола при охлаждении льдом, и смесь перемешивают при 30–40 оС в течение 1 часа. Реакционную смесь выливают в смесь воды, тетрагидрофурана и этилацетата и уста навливают ее значение рН=6 водным раствором бикарбоната натрия. Органический слой отделяют, а водный слой экстрагируют смесью тетрагидрофурана и этилацетата три раза. Органические слои объединяют, сушат над сульфатом магния и выпаривают в ва кууме, получая 5,18 г 5-формамидо-1-(2-формилоксиэтил)пиразол. ИК-спектр (в нуйоле): 3180, 1705, 1660 см-1 ЯМР-спектр (в пердейте родиметилсульфоксиде), d: 4,21–4,61 (4Н, мультиплет), 6, 11 и 6,34 (1Н, каждый дублет, J = 3 Гц), 7,47 (1Н, дублет, J = =3 Гц), 8,00 (1Н, синглет), 8,33 (1Н, синглет). Препаративный пример 2 К смеси бензгидрилового эфи ра 7-бета-трет-бутоксикарбониламино-3-хлорметил-3-цефем-4-карбоновой кислоты (20 г) и иодистого натрия (5,82 г) в 20 мл N,N-диметилфор мамида добавляют 21,34 г 5-формамидо-1-(2-формилоксиэтил)пиразола при комнатной температуре. После перемеши вания в течение 24 часов при той же самой температуре смесь выливают в смесь воды и этилацетата. Ор ганический слой отделяют и промывают его водой, водным раствором хлористого натрия, и сушат над сульфа том магния. Растворы выпаривают в вакууме, получая бензгидриловый эфир 7-бета-трет-бутоксикарбониламино-3-(3-формамидо-2-(2-формилоксиэтил)-1-пиразолио)ме-тил-3цефем-4-карбоновой кислоты, иодид (29,6 г). ИК-спектр (в нуйоле): 1780, 1720 см -1. ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 1,49 (9Н, синглет), 3,43 (2Н, широкий синглет), 4,14– 4,38 (2Н, мультиплет), 4,52–4,73 (2Н, мультиплет), 5,15 (1Н, дублет, J = 5 Гц), 5,40 (2Н, широкий синглет), 5,67 (1Н, дублеты, J = 5 Гц и 8 Гц), 6,88 (1Н, синглет), 7,02 (1Н, дублет, J = 3 Гц), 7,18–7,52 (10Н, мультиплет), 7,94 (1Н, дублет, J = 8 Гц), 7,99 (1Н, синглет), 8,27 (1Н, дублет, J = 3 Гц), 8,51 (1Н, ши рокий синглет). Препаративный пример 3 К раствору бензгидрилового эфира 7-бета-трет-бутоксикарбониламино-3-(3-формамидо-2-(2формилоксиэтил) -1-пиразолио)метил-3-цефем-4-карбоновой кислоты, иодиду (29,5 г) и 30 мл анизола в 90 мл хлористого метилена по каплям добавляют 60 мл трифторуксусной кислоты при охлаждении льдом. После перемешивания в течение 1 часа при комнатной температуре, смесь выливают в смесь диизопропилового эфи ра (600 мл) и этилацетата (600 мл). Образовавшийся осадок собирают путем фильтрации, получая соли бис(трифторуксусной кислоты) 7-бета-амино-3-(3-формамидо-2-(2-формилоксиэтил)-1-пиразолио)ме-тил-3-цефем-4-карбоксилата (22,7 г). ИК спектр (нуйол): 1780, 1715, 1660 см-1 ЯМР-спектр (пердейте родиметилсульфоксид): d: 3,53 (2Н, широкий синглет), 4,28–4,56 (2Н, мультиплет), 4,78–4,99 (2Н, мультиплет), 5,29 (2Н, широкий синглет), 5,53 (2Н, широкий синглет), 7,14 (1Н, дублет, J = 3 Гц), 8,22 (1Н, синглет), 8,46 (1Н, дублет, J = 3 Гц), 8,63 (1Н, синглет). Препаративный пример 4 Концентрированную хло ристоводородную кислоту (5,67 мл) добавляют к смеси солей бис (трифторуксусной кислоты) 7-бета-амино-3-(3-формамидо-2-(2-формилоксиэтил)-1-пиразолио)ме-тил-3-цефем-4карбоксилата (10 г) в 50 мл метанола при комнатной температуре. После перемешива ния при этой температуре в течение 3 часов, эту смесь по каплям добавляют в 500 мл этилацетата. Образовавшийся осадок собирают путем фильтрации, получая тригидрохлорид 7-бета-амино-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио) метил-3-цефем-4-карбоксилата (6,1 г). ИК спектр (нуйол): 3250, 1770, 1700, 1625 см -1 ЯМР-спектр (пердейте родиметилсульфоксид), d: 3,43 (2Н, широкий синглет), 3,52–3,88 (2Н, мультиплет), 4,18–4,48 (2Н, мультиплет), 5,28 (2Н, широкий синглет), 5,37 (2Н, широкий синглет), 5,97 (1Н, дублет, J = 3Гц), 8,18 (1Н, дублет, J = 3 Гц). Пример 1 Смесь N,N-диметилформамида (0,41 мл) и 0,49 мл хлористо го фосфо рила в 2 мл этилацетата перемешивают при охлаждении льдом в течение 30 минут, чтобы приготовить реактив Вильсмайера. К указанному вы ше раствору при 0–5оС добавляют 1,02 г 2-(2-формамидотиазол-4-ил)-2-метоксииминоуксусной кислоты, и смесь перемешивают при указанной температуре в течение 30 минут, что бы получить активированный кислотный раствор. Этот активированный кислотный раствор добавляют в раствор 7-бета-амино3-(3-амино-2-(2-гидроксиэтил) -1-пиразолио)метил-3-цефем-4-карбоксилат, тригидрохлорида (2 г) и 5,85 г N—(триметилсилил) ацетамида в 40 мл тетрагидрофурана при охлаждении льдом, и затем смесь переме шивают при 10–15оС в течение 1 часа. Образовавшуюся смесь выливают в 500 мл диэтилового эфи ра, и образовавшийся осадок собирают путем фильтрации, чтобы получить 7-бета-(2-(2-формамидотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио) метил-3-цефем-4-карбоксилат, дигидрохлорид (син-изомер, 2,55 г). ИК-спектр (нуйол): 1770, 1660 см -1 ЯМР-спектр (пердейтеродиметилсульфоксид), d: 3 ,30 (2Н, мультиплет), 3,68 (2Н, мультиплет), 3,92 (3Н, синглет), 4,31 (2Н, мультиплет), 5,29 (1Н, дублет, J = 5 Гц), 5,32 (2Н, м ультиплет), 5,88 (1Н, дублеты, J = 5 Гц и 8 Гц), 5,99 (1Н, дублет, J = 3 Гц), 7,48 (1Н, синглет), 8,12 (1Н, дублет, J = 3 Гц), 8,59 (1Н, синглет), 9,81 (1Н, дублет, J = 8 Гц). Следующие ве щества (примеры 2 и 3) были получены по методике, аналогичной таковой в примере 1. Пример 2 7бета-(2-(2-Аминотиазол-4-ил)-2- метоксииминоацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)-метил-3-цефем-4-карбоксилат, (син-изомер). ИК-спектр (нуйол): 3300, 1770, 1640 см -1 Пример 3 7-бета-(2-(2-Аминотиазол-4-ил)-2-(дифторметоксиимино)-ацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио) метил-3-цефем-4-карбоксилат, (син-изомер). ИК-спектр (нуйол): 3300, 1760, 1660 см -1. Пример 4 К раствору дигидрохлорида 7-бета-(2-(2-формамидотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-амино-2-(2 гидроксиэтил)-1-пиразо лио)-ме тил-3-цефем-4-карбоксилата (син-изомер, 2,5 г) в метаноле (12,5 мл) добавляют 0,88 мл концентрированной хлористоводородной кислоты (0,88 мл) при комнатной температуре. После перемеши вания при той же самой температуре в течение 2 часов смесь выливают в этилацетат (500 мл), и образовавшийся осадок собирают путем фильтрации. Осадок растворяют в воде (100 мл) и подщелачивают до рН = 2 водным раствором (5%) бикарбоната натрия. Этот раствор подвергают хроматографированию на колонке с макропористой неионной адсорбционной смолой "Дайион Эйч-Пи-20" (Торговый знак, производство фирмы Мицубиши Ке микал индастриз). Це левое вещество элюируется 10%-ным диизопропиловым спиртом и лиофилизируется, давая 0,43 г (7-бета-(2-(2-аминотиазол)-4-ил)-2- метоксииминоацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1пиразолио) метил-3-цефем-4-карбоксилата (син-изомер 0,43 г). ИК-спектр (нуйол): 3300, 1770, 1640 см -1. ЯМР-спектр (пердейтеродиметилсульфоксид), d: 3,00 и 3,30 (2Н, АВ-квартет, J = 18 Гц), 3,60 (2Н, мультиплет), 3,83 (3Н, синглет), 4,37 (2Н, мультиплет), 5,06 (1Н, дублет, J = 5 Гц), 5,18 (2Н, широкий синглет), 5,65 (1Н, дублет, J = 5 Гц и 8 Гц), 5,84 (1Н, дублет, J = 3 Гц), 6,71 (1Н, синглет), 7,18 (2Н, широкий синглет), 7,38 (2Н, широкий синглет), 8,03 (1Н, дублет, J = 3 Гц), 9,52 (1Н, дублет, J = 8 Гц). Следующее ве щество (пример 5) было получено по методике, аналогичной таковой при примере 4. Пример 5 7бета-(2-(2-Аминотиазол-4-ил)-2-(дифторметоксиимино)-ацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1 -пиразолио) метил-3-цефем-4-карбоксилат (син-изомер). ИК спектр (нуйол): 3300, 1760, 1660 см-1. Пример 6 В суспензию бензгидрилового эфи ра 7-бета-(2-(дифторметоксиимино)-2-(2-тритиламинотиазол)-4ил)ацетамидо)-3-хлорметил-3-цефем-4-карбоновой кислоты (син-изомер, 5 г) и 0,856 г иодистого натрия в 5 мл N,N-диметилформамида добавляют 4,18 г 5-формамидо-1-(2-формилоксиэтил)пиразола при комнатной температуре. После перемешива ния в течение 24 часов смесь выливают в смесь этилацетата и воды. Выделенный органический слой промывают во дой и водным раствором хлористого натрия, сушат над сульфа том магния и выпаривают в вакууме. Остаток растворяют в тетрагидрофуране и подвергают хроматографи рованию на колонке с ионообменной смолой Амберлит Ай-Ар-Эй 400 (Типа трифторацетата) (Торговый знак, производство фирмы Роом и Хаас Ко.). Целевое вещество элюируют тетрагидрофураном и выпаривают в вакууме, получая соль трифторуксусной кислоты бензгидрилово го эфи ра 7-бета-(2-(дифторметоксиимино)-2(2-тритиламинотиазол)-4-ил)ацетамидо)-3-(3-формамидо)-2-(2-формилоксиэтил)-1-пиразолио)-метил-3-цефем-4-карбоновой кислоты (синизомер, 4,80 кг). ИК-спектр (нуйол): 1780, 1720, 1675 см -1 ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 3,50 (2Н, мультиплет), 3,65 (2Н, мультиплет), 4,35 (2Н, мультиплет), 5,25 (1Н, дублет, J = 5 Гц), 5,50 (2Н, широкий синглет), 5,88 (1Н, дублеты, J = 5 Гц и 8 Гц), 6,91 (1Н, синглет), 7,03 (1Н, синглет), 7,04–7,70 (27Н, мультиплет), 8,08 (1Н, синглет), 8,33 (1Н, дублет, J = 3 Гц), 8,67 (1Н, синглет), 9,05 (1Н, синглет), 10,05 (1Н, дублет, J = 5 Гц). Следующее ве щество (примера 7) было получено по методике, аналогичной таковой в примере 6. Пример 7. 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксиими-ноацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилат (син-изомер). ИК спектр (нуйол): 3300, 1770, 1640 см-1. Пример 8 К раствору соли трифто руксусной кислоты бензгидрилового эфи ра 7бета-(2-дифторметоксиимино)-2(2-тритиламинотиазол-4-ил)ацета мидо)-3-(3-формамидо-2-(2-формилоксиэтил)-1-пиразолио)-метил-3-цефем-4-карбоновой кислоты (син-изомер, 4,7 г) в 15 мл хлористо го метилена и 5 мл анизола добавляют 10 мл трифторуксусной кислоты при охлаждении льдом. После перемеши вания в течение 1,5 часа смесь выливают в диизопропиловый эфир, и образовавшийся осадок собирают посредством фильтрации. Этот осадок растворяют в воде, подще лачивают раствор до рН=12 водным раствором гидроксида натрия при ох лаждении льдом. Смесь перемешивают при той же самой температуре в течение 10 минут и подкисляют до рН = 2 раствором хлористо водородной кислоты (1 нормальным). Этот раствор подвергают хроматографи рованию на колонке с макропористым неионной адсорбционной смолой "Дайион Эйч-Пи-20". Целевое вещество элюируют 10%-ным диизопропиловым спиртом и лиофи лизуют, получая 0,80 г 7-бета-(2-(2-аминотиазол-4-ил)-2-(дифторметоксиимино)ацетамидо-3-(3-формамидо-2-(2-гидроксиэтил)-1-пи разолио)метил-3-це фем-4- карбоксилата (син-изомер). ИК спектр (нуйол): 3250, 1770, 1665 см-1. ЯМР-спектр (оксид дейтерия и пердейтеродиметилсуль фоксид), d: 3,11 и 3,50 (2Н, АВ квартет, J = 18 Гц), 3,85 (2Н, мультиплет), 4,60 (2Н, мультиплет), 5,22 (1Н, дублет, J = 5 Гц), 5,36 (2Н, широкий синглет), 5,81 (1Н, дублет, J = 5 Гц), 6,91 (1Н, триплет, J = 71 Гц), 7,05 (1Н, дублет, J = 3 Гц), 7,18 (1Н, синглет), 8,24 (1Н, дублет, J = 3 Гц), 8 ,44 (1Н, синглет). Пример 9 В суспензию 7-бета-(2-(2-аминотиазол-4-ил)-2-(дифторметоксиимино)ацетамидо-3-(3-формамидо-2-(2гидроксиэтил)-1-пиразолио)метил-3-цефем-4- карбоксилата (син-изомер, 0,7 г) в метаноле (3,5 мл) добавляют 0,42 мл концентрированной хлористоводородной кислоты при комнатной температуре. После перемешивания при той же самой температуре в течение 2 часов смесь выливают в эти лацетат. Образовавшийся осадок растворяют в воде и подщелачивают его до рН = 2 с помощью 5%-ного водного раствора бикарбоната натрия. Этот раствор подвергают хроматографи рованию на колонке с макропористой неионной адсорбционной смолой "Дайион Эйч-Пи-20". Целевое вещество элюируют 10%-ным диизопропиловым спиртом и лиофи лизируют, получая 0,41 г 7-бета-(2-(2-аминотиа зол-4-ил)-2-(дифторметоксиимино) ацетамидо-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилата (син-изомер). ИК-спектр (нуйол): 3300, 1760, 1660 см -1. ЯМР-спектр (в тяжелой воде), d: 3,02 и 3,35 (2Н, АВ квартет, J = 18 Гц), 3,78 (2Н, мультиплет), 4,28 (2Н, мультиплет), 4,95 и 5,16 (2Н, АВ квартет, J = 16 Гц), 5,16 (1Н, дублет, J = 3 Гц), 6,86 (1Н, триплет, J = 69 Гц), 7,16 (1Н, синглет), 7,83 (1Н, дублет, J = 3 Гц). Следующее ве щество (пример 10) было получено по методике, аналогичной таковой в примере 9. Пример 10 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксиимино ацетамидо )-3 -(3 -ам ино -2 -(2 -гидроксиэтил )-1 -пиразо лио)метил-3-цефем-4-карбоксилат (син-изомер). ИК-спектр (нуйол): 3300, 1770, 1640 см -1. Пример 11 В раствор 6,5 г 7бе та-(2-(2-аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилата (син-изомер) в 6,5 мл воды добавляют 6,5 мл двухнормальной серной кислоты при комнатной температуре. Смесь перемешивают при этой температуре, чтобы выпал кристаллический осадок. Эти кристаллы собирают путем фильтрации и промывают их ледяной водой и затем ацето ном, получая соль серной кислоты 7бета-(2-(2-аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио) метил-3-цефем-4- карбоксилата (син-изомер, 5,92). ЯМР-спектр (пердейте родиметилсульфоксид), d: 3,13–3,83 (2Н, мультиплет), 3,40–3,83 (4Н, мультиплет), 5,15 (1Н, дублет, J = 5 Гц), 5,05 и 5,30 (2Н, АВ квартет, J = 13 Гц), 5,79 (1Н, дублеты, J = 5 Гц и 8 Гц), 5,88 (1Н, дублет, J = 3 Гц), 6,71 (1Н, синглет), 7,28 (2Н, широкий синглет), 7,95 (1Н, дублет, J = 3 Гц), 9,57 (1Н, дублет, J = 8 Гц). Препаративный пример 5 7бета-Амино-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил-3- цефем-4-карбоксилат, тригидрохлорид (66 г) растворяют в 264 мл воды. Водный раствор подвергают хро матографирова нию на колонке с "Дайионом Эйч-Пи-20", используя в качестве элюента воду. Фракции, содержащие це левое вещество, объединяют, и к этому объединенному раствору по каплям добавляют 1,15 л изопропилового спирта при охлаждении льдом. Эту смесь перемеши вают в течение 1,5 часа при охлаждении льдом, чтобы выпали в осадок кристаллы. Эти кристаллы собирают путем фильтрации и промывают смесью изопропилового спирта и воды (10:1) при охлаждении льдом и сушат их над пентоксидом фосфо ра, получая 29,95 г 7бета-амино-3(3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилат. гидрохлорид.ди-гидрата. ИК-спектр (нуйол): 3270, 1790, 1560–1635 см-1. ЯМР-спектр (пердейте родиметилсульфоксид), d: 3,43 – 3,77 (2Н, мультиплет), 4,47–5,07 (1Н, дублет, J = 5 Гц), 5,12 и 5,38 (2Н, АВ квартет, J = 16 Гц), 5,92 (1Н, дублет, J = 3 Гц), 7,56 (2Н, широкий синглет), 8,11 (1Н, дублет, J = 3 Гц). Анализ (%): вычислено для С 13Н17N5O 4S х х HCl · 2H2O С 37,90, Н 5,38, N 17,00, Cl 8,60 Найдено: С 37,82, Н 5,56, N 16,73, Cl 8,60. Препаративный пример 6 Смесь уксусного ангидрида (44,5 мл) и муравьиной кислоты (22,3 мл) перемешивают при комнатной температуре в течение 1 часа. К этой смеси добавляют 30 г 5-амино-1-(2-гидроксиэтил)-пиразола при 0– 10оС, и смесь перемешивают при охлаждении льдом в течение 30 минут. Эту смесь выливают в во ду, о хлажденную льдом, подщелачивают ее до рН 10,5 раствором карбоната калия (40%-ным) и перемешивают при охлаждении льдом 30 минут. Смесь экстраги руют смесью тетрагидрофурана и этилацета та 6 раз. Органический слой сушат над сульфа том магния и выпаривают в ва кууме, получая 30,8 г 5-формамидо-1-(2гидроксиэтил)-пиразола. Т. плавления 109–112оС. ИК-спектр (нуйол): 3230, 1695, 1570, 1540 см-1. ЯМР-спектр (пердейте родиметилсульфоксид), d: 3,62–3,95 (2Н, мультиплет), 3,98–4,32 (2Н, мультиплет), 6,22 и 6,36 (1Н, каждый дублет, J = 3 Гц), 7,42 (1Н, дублет, J = 3 Гц), 8,32 и 3,36 (1Н, каждый синглет). Препаративный пример 7 К суспензии 5-формамидо-1-(2-гидроксиэтил)пиразоло (1г) в 50 мл ацетонитрила по каплям добавляют 0,77 мл хлорсульфо нилизоцианата при температуре от -15оС до -20оС. Эту смесь перемешивают в те чение 3 часов при охлаждении льдом. К реакционной смеси добавляют 1 мл воды и оставляют ее выдерживаться в течение ночи. Раствор подще лачивают до рН = 7,5 с помощью 5-нормального раствора гидроксида натрия и затем доводят до рН 8,5 однонормальным раствором гидроокиси натрия. Органический слой отделяют, и водный слой экстрагируют тетрагидрофураном. Экстракт и указанный органический слой объединяют и сушат над сульфатом магния. Растворитель отгоняют, и остаток кристаллизуется из этилацетата, давая 0,60 г 5-амино-1-(2карбамоилоксиэтил)пиразола. ЯМР-спектр (пердейтеродиметилсульфоксид), d: 3,83–4,35 (4Н, мультиплет), 4,80–5,18 (2Н, широкий синглет), 5,32 (1Н, дублет, J = 3 Гц), 6,33–6,87 (2Н, широкий синглет), 7,08 (1Н, дублет, J = 3 Гц). Препаративный пример 8 5-Формамидо-1-(2-карбамоилоксиэтил)пиразол (3,69 г) был получен из 5-амино-1-(2карбамоилоксиэтил)пиразола (3,3 г) по методике, аналогичной таковой в препаративном примере 6. ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 4,22 (4Н, синглет), 6 ,17–6,40 (1Н, мультиплет), 6,40– 6,63 (2Н, мультиплет), 7,30–7,53 (1Н, мультиплет), 8,13–8,47 (1Н, мультиплет). Пример 12 К раствору бензгидрилового эфи ра 7бета-(2-(2-формамидотиазол-4-ил)-2-метоксииминоацетомидо)3-хлорметил-3-цефем-4-карбоксилата (син-изомер, 1,5 г) в N,N-диметилформамиде (3 мл) добавляют иодистый натрий (0,36 г) в атмосфе ре азота. Э ту смесь перемеши вают при комнатной температуре в те чение 30 минут. Затем в нее добавляют 1,42 г 5-формамидо-1-(2-карбамоилоксиэтил)пиразола, и смесь перемешивают при той же самой температуре в течение 24 часов. В эту реакционную смесь добавляют смесь этилацетата (50 мл) и воды со льдом (30 мл). Выделенный органический слой промывают во дой и раствором хло ристого натрия, и сушат над сульфатом магния. Растворитель выпаривают в ва кууме, получая трифторацетат бензгидрилово го эфира 7бета-(2-(2-формамидотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-формамидо-2-(2-кар-бамоилоксиэтил)-1-пиразоло)метил-3-цефем-4-кар-боновой кислоты (син-изомер, 1,60 г). Пример 13 7бета-(2-(2-формамидотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-формамидо-2-(2-карбамо-илоксиэтил)-1-пиразоло)метил-3-цефем-4-карбоксилат (син-изомер, 1,10 г) был получен из трифторацетата бензгидрилового эфи ра 7бета-(2-(2-фор мамидотиазол-4-ил)-2-метоксииминоацета мидо)-3-(3-формамидо-2-(2-карбамоилоксиэтил)-1-пиразолио)метил-3-цефем-4-карбоновой кислоты (син-изомер, 1,6 г) по методике, аналогичной изложенной в примере 8. Пример 14 7бета-(2-(2-Ами нотиа зол-4-ил)-2-метоксииминоацетамидо)-3-(3-амино-2-(2-карбамоилокси этил)-1-пиразо лио)метил-3-цефем-4-карбоксилат (син-изомер, 0,10 г) был получен из 7бета-(2-(2-формамидотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-формамидо-2-(2-карбамоилоксиэтил)-1-пи-разолио)метил-3-цефем-4-карбоксилата (син-изомер) по методике, аналогичной описанной в примере 9. ИК-спектр (нуйол): 3200–3300, 1760, 1710, 1650 см -1 ЯМР-спектр (в пердейтеродиметилсульфоксиде), d: 3,0–3,90 (2Н, мультиплет), 3,90–4,27 (4Н, мультиплет), 3,82 (3Н, синглет), 4,40–5,47 (5Н, мультиплет), 5,47–5,77 (1Н, мультиплет), 5,81 (1Н, дублет, J = 3 Гц), 6,71 (1Н, синглет), 6,90–7,57 (4Н, мультиплет), 7,97 (1Н, дублет, J = 3 Гц), 9,51 (1Н, дублет, J = 8 Гц). Препаративный пример 9 5-Формамидо-4-метил-1-(2-формилоксиэтил) пиразол был получен по методике, аналогичной описанной в препа ративном примере 1. ИК-спектр (нуйол): 3180, 1715, 1660 см -1. ЯМР-спектр (в пердейтеродиметилсульфоксиде), d: 1,81 и 1,86 (3Н, каждый синглет), 4,01–4,48 (4Н, мультиплет), 7,25 и 7,40 (1Н, каждый синглет), 8,06 (1Н, синглет), 8,22 и 9,13 (1Н, каждый синглет). Препаративный пример 10 5-Амино-1-(2-гидроксиэтил)пиразол (5 г) добавляют к 14,7 мл уксусного ангидрида при перемеши вании и охлаждении льдом. Туда же добавляют 6,3 мл пиридина. Эту смесь перемеши вают в те чение 2 часов при 25оС. Реакционную смесь добавляют к смеси эти лацетата (50 мл) и водного раство ра хлористого натрия (50 мл). Затем туда же добавляют водный раствор бикарбоната натрия, чтобы довести рН раствора до 7,0. Водный слой экстрагируют смесью этилацетата и тетрагидрофурана. Экстракт сушат над сульфа том магния. Сульфат магния отфильтровывают, и фильтрат выпаривают при пониженном давлении, получая 5,98 г 5-ацетамидо-1-(2-ацетоксиэтил)пиразола. Т. плавления 83–84оС. ИК-спектр (нуйол): 3270, 1750, 1670, 1565 см-1 ЯМР-спектр (в пердейтеродиметилсуль фоксиде), d: 1,93 (3Н, синглет), 2,03 (3Н, синглет), 4,22 (4Н, широкий синглет), 6,13 (1Н, дублет, J = 2 Гц), 7,82 (1Н, дублет, J = 2 Гц), 9,76 (1Н, синглет). Следующие вещества (препаративные примеры 11–13) были приготовлены по методике, аналогичной описанной в препаративном примере 2. Препаративный пример 11 Бензгидриловый эфир 7бета-трет-бутоксикарбониламино-3-(4-метил-3-формамидо-2-(2-формилоксиэтил)-1-пиразолио)-метил-3-цефем-4- карбоновой кислоты, иодид. ИК спектр (нуйол): 3250, 1780, 1710, 1680 см -1 ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 1,53 (9Н, синглет), 1,97 (3Н, синглет), 3,51 (2Н, широкий синглет), 4,04–4,42 (2Н, мультиплет), 4,52–4,78 (2Н, мультиплет), 5,08 (1Н, дублет, J = 5 Гц), 5,39 (2Н, широкий синглет), 5,61 (1Н, дублеты, J = 5 Гц 8 Гц), 6,86 (1Н, синглет), 7,08–7,52 (10Н, мультиплет), 7,93 (1Н, синглет), 8,18 (1Н, синглет), 8,34 (1Н, синглет), 9,12 (1Н, синглет). Препаративный пример 12 Бензгидриловый эфир 7бета-трет-бутоксикарбониламино-3-(3-ацетамидо-2-(2-ацетоксиэтил) -1-пиразолио)метил-3-цефем-4-карбоновой кислоты, иодид. ИК-спектр (нуйол): 1780, 1720, 1230 см -1 ЯМР-спектр (пердейтеродиметилсульфоксид), d: 1,41 (9Н, синглет), 1,86 (3Н, синглет), 2,25 (3Н, синглет), 3,40 (2Н, широкий синглет), 4,0–4,4 (4Н, мультиплет), 5,12 (1Н, дублет, J = 5 Гц), 5,37 (2Н, синглет), 5,60 (1Н, дублет, J = 8 Гц и 5 Гц), 6,85 (1Н, синглет), 7,24 (1Н, дублет, J = 3 Гц), 7,1–7,6 (10Н, мультиплет), 7,90 (1Н, дублет, J = 8 Гц), 8,21 (1Н, дублет, J = 3 Гц), 11,17 (1Н, синглет). Препаративный пример 13 Бензгидриловый эфир 7бета-трет-бутоксикарбониламино-3-(3-формамидо-2-(2-гидроксиэтил) -1-пиразолио)метил-3-цефем-4-карбоновой кислоты, иодид. ИК-спектр (нуйол): 3300, 1780, 1720, 1560, 1150 см -1 ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 1,43 (9Н, синглет), 3,53 (2Н, широкий синглет), 4,02– 4,5 (4Н, мультиплет), 5,15 (1Н, дублет, J = 5 Гц), 5,40 (2Н, синглет), 5,55 (1Н, дублеты, J = 8 Гц и 5 Гц), 6,90 (1Н, синглет), 7,01 (1Н, дублет, J = 3 Гц), 7,1–7,5 (10Н, мультиплет), 7,97 (1Н, дублет, J = 8 Гц), 8,28 (1Н, дублет, J = 3 Гц), 8,50 (1Н, синглет). Следующие вещества (препаративные примеры 14–16) были получены по методике, аналогичной описанной в препаративном примере 3. Препаративный пример 14 Бис(соли трифторуксусной кислоты) 7бета-амино-3-(4-метил-3-формамидо-2-(2-формилоксиэтил)-1-пиразолио)-метил-3-цефем-4-карбоксилата. ИК-спектр (нуйол): 1780, 1710, 1670 см -1 ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 1,98 (3Н, синглет), 3,49 (2Н, широкий синглет), 4,22– 4,48 (2Н, мультиплет), 4,61–4,87 (2Н, мультиплет), 5,18 (2Н, широкий синглет), 5,46 (2Н, широкий синглет), 8,05 (1Н, синглет), 8,23 (1Н, синглет), 8,35 (1Н, синглет). Препаративный пример 15 Бис(соли трифторуксусной кислоты) 7бета-амино-3-(3-ацетамидо-2-(2-ацетоксиэтил)-1-пиразолио)-метил-3-цефем-4-карбоксилат. ИК-спектр (нуйол): 1780, 1660, 1190 см -1 ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 1,95 (3Н, синглет), 2,23 (3Н, синглет), 3,46 (2Н, широкий синглет), 4,1–4,4 (4Н, мультиплет), 5,20 (2Н, мультиплет), 5,46 (2Н, синглет), 7,01 (1Н, дублет, J = 3 Гц), 8,27 (1Н, дублет, J = 3 Гц), 11,17 (1Н, синглет). Препаративный пример 16 Бис(соли трифто руксусной кислоты) 7бета-амино-3-(3-формамидо-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилата. ИК-спектр (нуйол): 3400, 1780, 1680, 1580, 1200, 1140 см -1 ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 3,70 (2Н, ши рокий синглет), 4,2–4,7 (4Н, мультиплет), 5,23 (2Н, мультиплет), 5,50 (2Н, синглет), 7,07 (1Н, дублет, J = 3 Гц), 8,35 (1Н, дублет, J = 3 Гц), 8,53 (1Н, синглет). Следующие вещества (препаративные примеры 17 и 18) были получены по методике, аналогичной описанной в препаративном примере 4. Препаративный пример 17 7бета-Амино-3-(4-метил-3-амино-2-(2-гидрок -сиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилат, тригидрохлорид. ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 1,94 (3Н, синглет), 3,39 (2Н, широкий синглет), 3,47– 3,78 (2Н, мультиплет), 4,06–4,42 (2Н, мультиплет), 5,21 (4Н, ши рокий синглет), 7,87 (1Н, синглет). Препаративный пример 18 7бета-Амино-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилат, тригидрохлорид. ИК-спектр (нуйол): 3300, 3150, 1780, 1710, 1640, 1580 см -1. ЯМР-спектр (пердейте родиметилсульфоксид), d: 3,60 (2Н, широкий синглет), 4,1–4,5 (4Н, мультиплет), 5,23 (2Н, мультиплет), 5,30 (2Н, синглет), 5,92 (1Н, дублет, J = 3 Гц), 8,07 (1Н, дублет, J = 3 Гц). Следующие ве щества (примеры 15–18) были получены по методике, аналогичной описанной в примере 1. Пример 15. 7бета-(2-(2-Формамидотиазол-4-ил)-2-метоксииминоацетамидо)-3-(4-ме тил-3-ами но-2-(2-гидроксиэтил)-1-пиразолио)-метил-3-цефем-4-карбоксилат (син-изомер) ЯМР-спектр (пердейтеродиметилсуль фоксид), d: 1,94 (3Н, синглет), 3,32 (2Н, широкий синглет), 3,52– 3,68 (2Н, мультиплет), 3,88 (3Н, синглет), 4,12–4,39 (2Н, мультиплет), 5,14 (2Н, широкий синглет), 5,19 (1Н, дублет, J = 5 Гц), 5,82 (1Н, дублеты, J = 5 Гц и 8 Гц), 7,36 (1Н, синглет), 7,83 (1Н, синглет), 8,47 (1Н, синглет), 9,63 (1Н, дублет, J = 8 Гц) Пример 16 7бета-(2-(2-Формамидотиазол-4-ил)-2-метоксиимидоацетамидо )-3 -(3-аце тами до-2-(ацетоксиэтил)-1-пиразолио)-метил-3-цефем-4-карбоксилат (син-изомер) ИК-спектр (нуйол): 1780, 1660, 1550 см -1 ЯМР-спектр (пердейтеродиметилсульфоксид), d:1,96 (3Н, синглет), 2,27 (3Н, синглет), 3,2–3,6 (2Н, мультиплет), 3,87 (3Н, синглет), 4,1–4,5 (4Н, мультиплет), 5,22 (1Н, дублет, J = 5 Гц) 5,43 (2Н, синглет), 5,90 (1Н, дублеты, J = 8 Гц и 5 Гц), 7,00 (1Н, дублет, J = 3 Гц), 7,33 (1Н, синглет), 8,29 (1Н, дублет, J = 3 Гц), 8,43 (1Н, синглет), 9,62 (1Н, дублет, J = 8 Гц). Пример 17 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(4-ме тил-3-ами но-2-(2-гидроксиэтил)-1-пиразо лио)-метил-3-цефем-4-карбоксилат (син-изомер) ИК-спектр (нуйол): 3300, 1765, 1660, 1605 см-1. Пример 18 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-ацетамидо-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем- 4-карбоксилат (син-изомер). ИК-спектр (нуйол): 3200, 1770, 1600 см -1. Пример 19 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо )-3-(4-метил-3-амино-2-(2-гидроксиэтил)- 1-пиразолио)метил-3-цефем-4-карбоксилат (син-изомер) был получен по методике, аналогичной описанной в примере 4. ИК-спектр (нуйол); 3300, 1765, 1660, 1605 см-1. ЯМР-спектр (в тяжелой воде), d: 1,97 (3Н, синглет), 3,06 и 3,37 (2Н, АВ квартет, J = 18 Гц) 3,73–3,93 (2Н, мультиплет), 3,98 (3Н, синглет), 4,19–4,43 (2Н, синглет), 5,09 (2Н, ши рокий синглет), 5,19 (1Н, дублет, J = 5 Гц), 5,89 (1Н, дублe т, J = 5 Гц), 6,96 (1Н, синглет), 7,71 (1Н, синглет). Пример 20 В суспензию 7бета-(2-(2-формамидотиазол-4-ил)-2- метоксииминоацетамидо)-3-(3-ацета мидо- 2-(2ацетоксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилата (син-изомер) (1,46 г) в 7,3 мл метанола добавляют 0,51 мл концентрированной хлористоводородной кислоты при комнатной температуре. Эту смесь перемеши вают 5 часов при комнатной температуре. Реакционную смесь добавляют к этилацетату при перемеши вании и охлаждении льдом. Образовавшееся аморфное твердое вещество сушат в ва кууме, и его растворяют в 40 мл воды. Водный раствор доводят до значения рН = 13 с помощью 1-нормального водного раство ра гидроксида натрия при перемешивании и температуре от -3о до 0оС и перемеши вают в течение 2 часов при той же самой температуре. Значение рН водного раствора доводят до 2 с помощью 1-нормальной хлористоводородной кислоты и подвергают раствор хроматографи рованию на колонке с "Дайионом Эйч-Пи-20", и элюируют 10%-ным изопропиловым спиртом. Фракции, содержащие целевое соединение, объединяют и концентрируют, что бы удалить изопропиловый спирт. При лиофилизации получают 159 мг 7бета-(2-(2-аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-ацетамидо-2-(2-гидрок-сиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилата (син-изомер). Т. плавления 160оС (с разложением). ИК спектр (нуол): 3200, 1770, 1600 см -1. ЯМР спектр (в тяжелой воде), d: 2,26 (3Н, синглет), 3,10 (1Н, дублет, J = 18 Гц), 3,47 (1Н, дублет, J = 18 Гц), 3,8–4,1 (4Н, мультиплет), 3,95 (3Н, синглет), 5,20 (1Н, дублет, J = 5 Гц), 5,32 (2Н, синглет), 5,77 (1Н, дублет, J = 5 Гц), 6,93 (1Н, дублет, J = 3 Гц), 6,94 (1Н, синглет), 8,16 (1Н, дублет, J = 3 Гц). Следующие вещества (пример 21 и 22 были получены по методике, аналогичной описанной в примере 6). Пример 21 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(4-метил-3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил3-цефем-4-карбоксилата (син-изомер). ИК-спектр (нуйол): 3300, 1765, 1660, 1605 см-1. Пример 22 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-ацетамидо-2-(2-гидроксиэтил)-1-пиразо лио)метил-3-цефем-4-карбоксилата (син-изомер). ИК-спектр (нуйол): 3200, 1770, 1600 см -1. Следующие ве щества (примеры 23–27) были получены по методике, аналогичной описанной в примере 8. Пример 23 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксиимино ацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилата (син-изомер). ИК-спектр (нуйол): 3300, 1770, 1640 см -1. Пример 24 7бета-(2-(2-Аминотиазол-4-ил)-2-(дифторметоксииминоацетамидо)-3-(3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил 3-цефем-4-карбоксилата (син-изомер). ИК-спектр (нуйол): 3300, 1760, 1660 см -1. Пример 25 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-амино-2-(2-карбамоилоксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилат (син-изомер). ИК-спектр (нуйол): 3200–3300, 1760, 1710, 1650 см -1. Пример 26 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(4-метил-3-амино-2-(2-гидроксиэтил)-1-пиразолио)метил-3цефем-4-карбоксилата (син-изомер). ИК-спектр (нуйол): 3300, 1765, 1660, 1605 см-1. Пример 27 7бета-(2-(2-Аминотиазол-4-ил)-2-метоксииминоацетамидо)-3-(3-ацетамидо-2-(2-гидроксиэтил)-1-пиразолио)метил-3-цефем-4-карбоксилата (син-изомер). ИК-спектр (нуйол): 3200, 1770, 1600 см -1. Ниже приведены примеры препаративных форм фармацевтической композиции: а) Препарат для инъекции Ингредиенты Ко личество, г Соединение цефа ма по Примеру 1 0,5 a-аргинин 0,325 b) Таблетки Ингредиенты Ко личество, мг Соединение по Примеру 10 40 Крахмал 30 Микрокристаллическая целлюлоза 20 Поливинилпирролидон (10% р-р в воде) 4 Натрий карбоксиметилкрахмал) 4,5 Стеарат магния 0,5 Тальк 4 Всего 100 Активный ингредиент, крахмал и целлюлозу пропускают через сито № 45 меш шкалы США и тщательно перемешивают. Раствор поливинилпирролидон смешивают с полученным порошком и смесь пропускают через сито № 45 меш шкалы США. Полученные таким образом гранулы сушат при 50–60оС и пропускают через сито № 18 меш шкалы США. Натрийкарбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито № 60 меш шкалы США затем добавляют к гранулам, которые после смешивания прессуют на таблеточной маши не, получая таблетки весом 100 мг каждая. с) Суп позитории с') Ингредиенты Ко личество, мг Соединение примера 20 200 Глицериды насыщенных жирных кислот до 2000 мг Активный ингредиент пропускают через сито № 60 меш шкалы США и суспендируют в гли церидах насыщенных жирных кислот, предварительно расплавленных с применением минимально необхо димого тепла. Смесь затем выливают в фор му для суппозитория номинальной вмести мости 2 г и оставляют для охлаждения. с'') Ингредиенты Ко личество Соединение примера 9 50 мг Натрийкарбоксиметилцеллюлоза 50 мг Сироп 1,25 мл Раствор бензойной кислоты 0,10 мл Отдушка по необходимости Краситель по необходимости Очищенная вода до 5 мл Активный ингредиент пропускают через сито № 45 меш шкалы США и смеши вают с натрийкарбоксиметилцеллюлозой и сиропом до образования однородной пасты. Раствор бензойной кислоты, отдушку и краситель разбавляют некоторым количеством воды и добавляют при перемешивании. Затем добавляют воду в количестве, достаточном для достижения требуемого объема. Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds of cephem having an antimicrobial activity and pharmaceutical composition containing them
Автори англійськоюKazuo Sakane, Kohdzi Kavabata, Kendzi Miai, Eskhiko Inamoto
Назва патенту російськоюСоединения цефема, обладающие антимикробной активностью, и фармацевтическая композиция, которая их содержит
Автори російськоюКазуо Сакане, Кохдзи Кавабата, Кензи Мияй, Эсхико Инамото
МПК / Мітки
МПК: C07D 501/00, A61K 31/54, A61K 31/545, A61P 31/04, A61K 31/546, C07F 7/10
Мітки: цефему, композиція, антимікробну, активність, сполуки, містить, мають, фармацевтична
Код посилання
<a href="https://ua.patents.su/18-41865-spoluki-cefemu-shho-mayut-antimikrobnu-aktivnist-ta-farmacevtichna-kompoziciya-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Сполуки цефему, що мають антимікробну активність, та фармацевтична композиція, що їх містить</a>
Попередній патент: Фунгіцидний засіб для рослин, спосіб боротьби або запобігання хворобам рослин, матеріал розмноження рослин
Наступний патент: Гербіцидна композиція та спосіб зменшення фітотоксичності по відношенню до культурних рослин
Випадковий патент: Мобільна персональна система