Пестицидний макролід, спосіб його одержання, штам saccharopolyspora, що продукує макролід, суміш на основі макроліда і спосіб боротьби з інсектицидами або акарицидами
Номер патенту: 71997
Опубліковано: 17.01.2005
Автори: Л'юер Пол, Уорден Томас В., Хан Дональд Р., Йао Раймонд К., Джилберт Джеффрі Р., Нортон Денніс В., Карр Лаура Л., Гропнер Пол Р.
Формула / Реферат
1. Сполука формули (1):
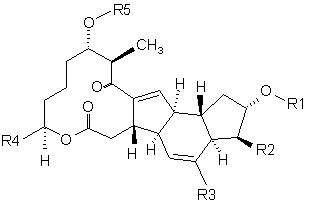 (1)
(1)
або її сіль,
де R1 є групою формули 2а, 2b або 2с
 , (2a)
, (2a)
 , (2b)
, (2b)
 , (2c)
, (2c)
R2 є Н або ОН,
R3 є Н або СН3,
R4 є 1-бутенілом, 1,3-бутадієнілом, н-бутилом, 3-гідрокси-1-бутенілом або 1-пропенілом і
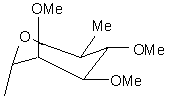
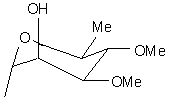
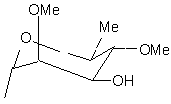
R5 є Н або групою, що має одну з наступних формул 4а-4і:
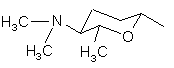 , (4a)
, (4a)
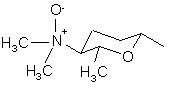 , (4b)
, (4b)
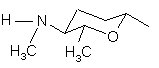 , (4c)
, (4c)
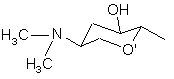 , (4d)
, (4d)
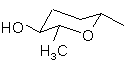 , (4e)
, (4e)
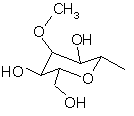 , (4f)
, (4f)
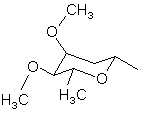 , (4g)
, (4g)
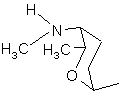 , (4h)
, (4h)
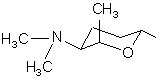 (4i).
(4i).
2. Сполука за п. 1, або її сіль, де R5 є групою, що має одну з наступних формул 4а-4і:
 , (4a)
, (4a)
 , (4b)
, (4b)
 , (4c)
, (4c)
 , (4d)
, (4d)
 , (4e)
, (4e)
 , (4f)
, (4f)
 , (4g)
, (4g)
 , (4h)
, (4h)
 (4i).
(4i).
3. Інсектицидна або акарицидна суміш, яка містить кількість сполуки за п. 2, що інактивує комах, кліщів, або іксодових кліщів у поєднанні з фітологічно або фізіологічно прийнятним носієм.
4. Спосіб боротьби з інсектицидами або акарицидами, який включає нанесення в локус комах, кліщів або іксодових кліщів кількості, що інактивує, сполуки за п. 2.
5. Спосіб захисту локусу від зараження комахами, кліщами або іксодовими кліщами, який включає нанесення в локус кількості сполуки за п. 2, що інактивує комах, кліщів або іксодових кліщів.
6. Спосіб контролю популяції паразитів, що заражають тварину-хазяїна, який включає введення або нанесення тварині-хазяїну паразитицидної кількості сполуки за п. 2.
7. Суміш для контролю зараження вошами у людини, яка містить як діючу речовину сполуку за п. 2 або її фізіологічнo прийнятне похідне, або її сіль і фізіологічнo прийнятний носій.
8. Застосування сполуки формули 1 або її фізіологічнo прийнятних похідних, або її солі, або композиції, що їх містить, як лікарського засобу для боротьби з вошами у людини.
9. Спосіб одержання сполуки за п. 1, який включає культивування NRRL 30141 виду Saccharopolyspora або похідного з неї штаму, що продукує сполуку за п. 1, у підходящому культуральному середовищі при зануренні в умовах аеробної ферментації, доти, поки не буде вироблена така кількість сполуки за п. 1, яку можна виділити, і виділення сполуки за п. 1 з культурального середовища.
10. Біологічно чиста культура NRRL 30141 виду Saccharopolyspora або похідний з неї штам, що продукує сполуку за п. 1.
Текст
Даний винахід відноситься до нової групи природних пестицидних продуктів, і до нового виду Saccharopolyspora, який продукує ці сполуки. Передумови створення винаходу Продукт ферментації А83543 представляє сімейство сполук, іменованих спінозинами, які продукуються певними штамами Saccharopolyspora spinosa. Раніше відкриті спінозини, які виробляються природним шляхом, мають 5,6,5-трициклічну кільцеву систему, конденсовану з 12-членним макроциклічним лактоном, нейтральним цукром (рамнозою) і аміноцукром (форозаміном) (див. Kirst et al. (1991)). Відомі спінозини згадувалися як фактори або компоненти, і кожному давали ідентифікуюче буквене позначення, тобто спінозин А, В, і так далі. Ці сполуки є корисними для контролю павукоподібних, нематод і комах, зокрема, видів Lepidoptera і Diptera, і вони є цілком екологічно прийнятними і мають привабливий токсикологічний профіль. Патент США №5362634 і відповідна заявка на європейський патент №375316 А1 розкриває спінозини А, В, С, D, Е, F, G, Η і J. WO 93/09126 розкриває спінозини L, Μ, Ν, Q, R, S і Т. WO 94/20518 і US 56704486 розкриває спінозини К, О, Р, U, V, W і Υ та їхні похідні. Була створена велика кількість синтетичних модифікацій сполук спінозину, як розкрито у WO 97/00265, але модифікація спінозинів у положенні С-21 була нездійсненною. Положення С-21 у відомих сполуках заміщене метилом або етилом. Якби можна було б знайти засоби, щоб ввести реактивну функціональну групу замість метальної або етильної групи, не спричиняючи небажаних змін в інших частинах молекули, був би відкритий шлях для синтезу багатьох додаткових сполук спінозину. Це було метою, до якої довго прямували і яка раніше була нездійсненною для фахівців, що працюють у галузі синтезу спінозину. Короткий опис винаходу Даний винахід представляє ізольований штам нового виду Saccharopolyspora species, (позначений LW107129 (NRRL 30141). Винахід представляє також сполуки, які можуть бути продуковані шляхом культивування LW107129 у придатному культуральному середовищі і які мають таку загальну формулу 1 або 2: де R1 є групою формули 2а, 2b або 2с R2 є Η або ОН; R3 є Η або СН3; R4 у формулі 1 є 1-бутенілом, 1,3-бутадієнілом, н-бутилом, 3-гідрокси-1-бугенілом або 1-пропенілом; і R4 є етилом у формулі 2; і R5 є Η або групою, що має одну з наступних формул 4а-4і: Конкретні сполуки формули 1 або 2, які були приготовані і виділені при культивуванні штаму LW107129 Saccharopolyspora, ідентифіковані у таблиці І. Таблиця І Сполука № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Формула 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 2 R1 2а 2а 2а 2а 2b 2с 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2а 2Ь 2с 2а R2 Η Η Η Η Η Η Η ОН Η Η Η Η Η ОН ОН Η Η Η ОН Η OH Η Η Η Η OH OH OH Η Η Η R3 Η Η Η Η Η Η Me Η Η Η Η Η Η Η Η Η Η Me Η Η Η Η Η Η Η Η Me Η Η Η Η R4 1-бутеніл 1-бутеніл 1-бутеніл 1-бутеніл 1-бутеніл 1-бутеніл 1-бутеніл 1-бутеніл 3-гідрокси-1-бутеніл 3-гідрокси-1-бутеніл 1,3-бутадієніл 1-бутеніл 1-бутеніл 1-бутеніл 1-бутеніл 1-пропеніл 1-бутеніл 1-бутеніл 1-бутеніл 3-гідрокси-1-бутеніл 3-гідрокси-1-бутеніл 1,3-бутадієніл н-бутил 1-бутеніл 1-бутеніл 1,3-бутадієніл 1-бутеніл 1-пропеніл 1-бутеніл 1-бутеніл етил R5 4а 4b 4с 4d 4а 4а 4а 4а 4а 4с 4а 4е 4f 4е 4g 4а Η Η Η Η Η Η Η 4h 4i 4a 4a 4a Η Η 4a Всі компоненти, перераховані у таблиці І, структурно відрізняються від раніше відомих спінозинів, тому що, стосовно групи R4, жодні раніше відомі сполуки спінозину не мали 1-бутенільну, 3-гідрокси-1-бутенільну, 1,3-бутадієнільну, 1-пропенільну або н-бутильну групу у положенні С-21 макроліду. Крім того, декілька сполук в таблиці І відрізняються від усіх раніше відомих спінозинів, тому що, стосовно групи R5, ці сполуки мають нові групи, зв'язані з киснем в положенні С-17 макроліду. У відомих спінозинах R2 завжди представляє Н, отже, зміна в цьому положенні є новою. Крім того, сполука 31 має нову 14-вуглецеву макролідну кільцеву систему, раніше невідому у сполук, описаних у S. spinosa. Сполуки за даним винаходом можуть реагувати з утворенням солей. Солі, які є фізіологічно прийнятними, є також придатними у сумішах і способах даного винаходу. Солі готують, використовуючи стандартні методики для приготування солей. Наприклад, сполуки за даним винаходом можуть бути нейтралізовані підходящою кислотою з утворенням кислої додаткової солі. Кислі додаткові солі є особливо корисними. Типові придатні кислі додаткові солі включають солі, утворені реакцією з органічною або неорганічною кислотою, такою як, наприклад, сірчана, хлористоводнева, фосфорна, оцтова, бурштинова, лимонна, молочна, малеїнова, фумарова, холева, памоєва, слизова, глутамінова, камфорна, глутарова, гліколева, фталева, винна, мурашина, лауринова, стеаринова, саліцилова, метансульфонова, бензолсульфонова, сорбінова, пікринова, бензойна, корична та подібні кислоти. Ще одним аспектом даного винаходу є процес виробництва сполук формули 1 і 2, який включає культивування Saccharopolyspora штаму LW107129 (NREL 30141) у підходящому середовищі. Сполуки формули 1 і 2 екстрагують з ферментаційного живильного середовища і з міцелію полярними органічними розчинниками. Ці сполуки далі можуть бути очищені методами, добре відомими у даній галузі техніки, такими як колонкова хроматографія. Сполуки формули 1 і 2, де R5 є групою, яка має одну з формул 4а-4і, є корисними для контролю кліщів, іксодових кліщів і комах. Тому інсектицидні та акарицидні суміші і способи для зменшення популяцій комах, кліщів та іксодових кліщів з використанням цих сполук також є частиною даного винаходу. Сполуки формули 1 і 2, де R5 є воднем (С17-псевдоаглікони) є корисними як проміжні сполуки у виготовленні інсектицидних і акарицидних препаратів. Наприклад, ці сполуки можуть бути глікозильовані біля С-17 гідроксильної групи. Глікозилювання може бути здійснене шляхом хімічного синтезу або мікробної біоконверсії, з використанням методик, описаних, наприклад, у US 5539089. Докладний опис винаходу Опис культури Новий штам, що продукує сполуки за даним винаходом, одержав позначення LW107129. Культура LW107129 була виділена із зразка ґрунту, скомпонованого з грунтів, відібраних з численних ділянок. Культуру передали на зберігання, відповідно до умов Будапештської угоди, у Регіональний дослідницький центр Середнього Заходу, Служба досліджень у сільському господарстві, Департамент сільського господарства США, 815 North University Street, Peoria, IL 61604. Цей штам був депонований 3 червня 1999p., і одержав депозитний номер NRRL 30141. Характеристики культури Saccharopolyspora штам LW107129 виробляє надземний міцелій і спори чисто білого кольору на таких середовищах: середовище Беннетта, ISP2 і ISP5. Колонії мають колір від вершкового до світлого жовтуватокоричневого, а субстратний міцелій може набувати світло-коричневого кольору, особливо на середовищах ISP4 і ISP5. Штам LW107129 не спорулює на середовищах ISP3 і ISP4. На жодному з випробуваних середовищ не вироблялися пігменти. Міцелій штаму LW107129 у рідкій культурі піддається фрагментації. Морфологічні характеристики Штам LW107129 продукує яйцевидні спори в ланцюгах до 50 спор. Спори містяться у споровій оболонці, і поверхня спори є ворсистою з рідко розташованими шипами. Фізіологічні характеристики Saccharopolyspora штам LW107129 здатний виробляти кислоту з таких субстратів: D-арабінози, теритритолу, D-фруктози, D-глюкози, гліцерину, D-манітолу, D-манози, L-рамнози, D-рибози і трегалози. Штам LW107129 не може виробляти кислоту з адонітолу, L-арабінози, декстрину, дульцитолу, етанолу, D-галактози, глікогену, інозитолу, лактози, мальтози, мелецитози, мелібіози, рафінози, саліцину, D-сорбітолу, L-сорбози, сахарози, ксилітолу і D-ксилози. Штам LW107129 здатний засвоювати декілька органічних кислот, включаючи цитрат і сукцинат, але не ацетат, бензоат, бутират, форміат, оксалат або тартрат. Штам LW107129 здатний гідролізувати тирозин і сечовину, але не аденін, казеїн, ескулін, гіпурат, гіпоксантин, крохмаль або ксантин. LW107129 нечутливий до таких антибіотиків: карбеніциліну, цефалотину, циклогексіміду, генетицину, лінкоміцину, налідіксової кислоти, новобіоцину, окситетрацикліну, поліміксину В, рифампіну і спектиноміцину, і чутливий до бацитрацину, хлорамфеніколу, еритроміцину, гідромщину В, стрептоміцину, тіострептону, триметоприму і ванкоміцину. Спосіб одержання метаболітів Метаболіти формули 1 і 2 одержують шляхом культивування штаму LW107129 у ферментаційному середовищі, як описано нижче. Культуру LW107129 засівають у вегетативне середовище і вирощують протягом 48 годин при 30°С, струшуючи при 250об/хв. Шістдесят мілілітрів цієї зрілої на першій стадії вегетативної культури використовують для засівання вторинної вегетативної культури у 1 літрі вегетативного середовища у флаконі для культивування місткістю 2л. Цю культуру інкубують при 30°С протягом 48 годин, струшуючи при 195об/хв. Зрілу на другій стадії маточну культуру використовують для засівання 70 літрів середовища у ферментаційній цистерні з мішалкою, як описано у прикладі 1. За виробництвом сполук формули 1 і 2 можна слідкувати у процесі ферментації шляхом дослідження екстрактів рідкого середовища. Кращим методом для слідкування за виробництвом є аналіз екстрактів рідкого середовища за допомогою високоефективної рідинної хроматографії (ВЕРХ). Придатна для аналізу система описана у прикладі 2. Приклад 1 Приготування метаболітів у процесі ферментації Метаболіти формули 1 і 2 одержують шляхом культивування штаму LW107129 у ферментаційному середовищі, як описано нижче. 1мл замороженої вегетативної культури LW107129 відтавали, засівали у 100мл вегетативного середовища у колбі Ерленмейєра місткістю 500мл і вирощували при 30°С, струшуючи при 250об/хв. протягом 48 годин. Вегетативне середовище Інгредієнт Кількість (г) Декстроза 9,0 Триптиказне соєве рідке середовище 30,0 Екстракт дріжджів 3,0 Магнію сульфат 7Н2О 2,0 Деіонізована вода 1000,0 Шістдесят мілілітрів цієї зрілої на першій стадії вегетативної культури використовували для засівання вторинної вегетативної культури у 1 літрі вегетативного середовища у флаконі для культивування місткістю 2л. Цю культуру інкубували при 30°С протягом 48 годин, струшуючи при 195об/хв. Зрілу на другій стадії маточну культуру використовували для засівання 70 літрів ферментаційного середовища у ферментаційній цистерні з мішалкою. Ферментаційне середовище (на літр води) Інгредієнт Кількість (г) Соєве борошно 5,0 Декстроза 10,0 Гліцерин 10,0 Розчинний крохмаль 5,0 Картопляний декстрин 20,0 Меляса 10,0 Порошок кукурудзяного екстракту 5,0 Кальцію карбонат 3,0 Фітинова кислота 1,0 Магнію сульфат 0,5 Заліза (III) хлорид 4Н2О 0,1 Цинку хлорид 0,1 Марганцю хлорид 4Н2О 0,1 Бродіння підтримували при 30°С, 400об/хв. протягом 7-12 днів. Зрілу ферментаційну брагу можна екстрагувати підходящим розчинником і виділити метаболіти шляхом утворення солі і/або хроматографічного розподілу. Приклад 2 Метод аналізу ВЕРХ Наступний метод ВЕРХ є корисним для контролю ферментації при одержанні сполук формули 1 і 2: Додати об'єм денатурованого етанолу, який дорівнює об'єму аліквоти ферментаційного середовища. Струснути суміш і дати постояти протягом, щонайменше, однієї години. Центрифугувати пробу для видалення основної маси клітинних уламків, потім мікроцентрифугувати аліквоту об'ємом 1мл. Освітлений екстракт потім аналізують за допомогою такої системи ВЕРХ: Система ВЕРХ: Нерухома фаза в колонці: колонка розміром 250x4,6мм, носій - дезактивований силікагель С8 з діаметром частинок 5мкм (Hypersil-C8-BDS). Рухома фаза: 10мМ амонію ацетат-метанол-ацетонітрил, лінійний градієнт наведений нижче: Час (хвилини) 0 20 25 30 35 Процент розчинника А 100 0 0 100 100 Процент розчинника В 0 100 100 0 0 де розчинник А є 10мМ амонію ацетатом, а розчинник В є сумішшю метанол-ацетонітрил (1:1). Швидкість потоку рухомої фази: 1мл/хв. Детектування: УФ при 250нм. Часи утримання основних сполук наведені нижче: Сполука 7 Час утримання (хвилини) 24,6 1 3 12 15 18 8 17 13 14 19 20 21(обидва С24-епімери) 24,2 23,7 22,9 22,8 22,6 22,5 22,2 21,6 21,4 20,2 19,3 16,2 Приклад 3 Виділення інсектицидно активних метаболітів із культурального середовища Наступний приклад показує, як з типової порції культивованого LW107129 був виділений найвищий вміст сполук формули І. Цей приклад надає конкретні методики, використані для виділення сполук 1, 3, 7, 8, 12, 13, 14,15, 17, 18, 19,20 і 21. Сполуки 2, 4, 5, 6, 9, 10, 11, 16, 22 і 23-31, які вироблялися мікроорганізмами з меншим відносним вмістом, ніж сполуки, перераховані вище, були виділені з використанням дуже схожих методів, застосованих до більших порцій екстракту рідкого середовища. Оскільки ці способи є дуже схожими і добре відомими фахівцям у даній галузі техніки, детально вони тут не описані. Сукупна культура, тобто клітини плюс рідке живильне середовище, починаючи з ферментації п'яти літрів засіяного середовища, мала загальний об'єм приблизно 3,5 літрів після завершення ферментації. Цю пробу екстрагували рівним об'ємом денатурованого етанолу, енергійно струшуючи і потім даючи постояти при кімнатній температурі протягом 2 годин. Клітинні уламки видаляли центрифугуванням, і 7 літрів 50% водного етанольного екстракту розподіляли, використовуючи дихлорметан (ДХМ: 2x7 літрів). Дихлорметановий екстракт концентрували з одержанням масла блідо-жовтого кольору (3,3г). Масло розчиняли в метанолі і ділили на дві рівні аліквоти, кожну з яких хроматографували на колонці (4x15см, 32-63мкм; Biotage, Inc., США) з силікагелем. З кожної колонки проводили елюювання зі швидкістю 20мл/хв., використовуючи наступні лінійні градієнти розчинників і потім промиваючи кінцевою аліквотою розчинника G (100мл): Час (хвилини) 0 10 15 20 20,01 30 40 50 70 гексан толуол етилацетат метанол вода діетиламін Тип і процент розчинника А В С D Ε 100 0 0 0 0 0 100 0 0 0 0 50 50 0 0 0 50 50 0 0 0 0 0 100 0 0 0 0 0 100 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 де суміші розчинників (% за об'ємом) були такими: А В с D Ε 100% 99,5% 100% 50% 99,5% 50% 0,5% 0,5% F 0 0 0 0 0 0 100 0 0 G 0 0 0 0 0 0 0 100 100 F G 99,5% 70% 20% 9,5% 0,5% 0,5% Фракції (30 секунд; 10мл кожна) збирали протягом всього елюювання. Вони були досліджені методом ВЕРХ відповідно до методики, описаної у прикладі 2, і потім фракції з вертикального перерізу кожної колонки з силікагелем, які містили компоненти, близькі за полярністю, об'єднували, як показано нижче: Номери фракцій 92-97 104-112 114-120 121-140 змиви Ідентифікатор SI-1 SI-2 SI-3 SI-4 SI-5 Ці об'єднані фракції висушували під вакуумом і знову розчиняли в метанолі перед подальшим фракціонуванням, як описано нижче. Аліквоти фракції SI-1 вносили у колонку (250x10мм; розмір частинок 8мкм) з обернено-фазовим силікагелем С-8 (Hypersil-BDS-C8). Нанесену пробу хроматографували в суміші ацетат амонію (10мМ)метанол-ацетонітрил (30:35:35), елююючи зі швидкістю 3мл/хв., і збираючи фракції об'ємом 0,75мл. Фракції, які містили сполуку 17, об'єднували і концентрували до сухого залишку, одержуючи 14,9мг чистої сполуки 17. Фракції, які містили сполуку 18, об'єднували і концентрували до сухого залишку, одержуючи 1,4мг чистої сполуки 18. Фракції, які містили сполуку 12, об'єднували і концентрували до сухого залишку, одержуючи 4,2мг чистої сполуки 12. Аліквоти фракції SI-2 вносили у колонку (250x10мм; розмір частинок 8мкм) з обернено-фазовим силікагелем С-8 (Hypersil-BDS-C8). Нанесену пробу хроматографували, використовуючи лінійний градієнт ацетату амонію (10мМ)-метанолу-ацетонітрилу, вказаний нижче, елююючи зі швидкістю 3мл/хв., і збираючи фракції об'ємом 0,75мл. Час (хвилини) 0 5 25 30 32 40 Процент розчинника А 60 60 0 0 60 60 Процент розчинника В 40 40 100 100 40 40 А = ацетат амонію (10мМ) В = суміш метанол-ацетонітрил (1:1) Фракції, які містили сполуку 20, об'єднували і концентрували до сухого залишку, одержуючи 11,5мг чистої сполуки 20. Фракції, які містиш сполуку 19, об'єднували і концентрували до сухого залишку, одержуючи 3,9мг чистої сполуки 19. Фракції, які містили сполуку 14, об'єднували і концентрували до сухого залишку, одержуючи 2,0мг чистої сполуки 14. Фракції, які містили сполуку 13, об'єднували і концентрували до сухого залишку, одержуючи 4,9мг чистої сполуки 13. Фракції, які містили сполуку 15, об'єднували і концентрували до сухого залишку, одержуючи 2,3мг чистої сполуки 15. Фракції, які містили два 24-епімерних ізомери сполуки 21, об'єднували і концентрували до сухого залишку, одержуючи 15мг суміші двох ізомерів. Цю суміш розчиняли в метанолі і вносили у колонку (250x10мм; розмір частинок 8мкм) з обернено-фазовим силікагелем С-8 (Hypersil-BDS-C8). Нанесену пробу хроматографували в суміші ацетат амонію (10мМ)-метанол-ацетонітрил (85:7,5:7,5), елююючи зі швидкістю 3мл/хв., і збираючи фракції об'ємом 3мл. Фракції, які містили сполуку 21 №1, об'єднували і концентрували до сухого залишку, одержуючи 9,8мг чистої сполуки 21 №1. Фракції, які містили сполуку 21 №2, об'єднували і концентрували до сухого залишку, одержуючи 4,7мг чистої сполуки 21 №2. Об'єднану фракцію SI-3 розчиняли у метанолі і хроматографували на колонці (4x7см; 32-63мкм; Biotage, Inc., США) з силікагелем. З колонки проводили елюювання зі швидкістю 20мл/хв., використовуючи такі умови для градієнту: Час (хвилини) 0 5 15 25 40 Процент розчинника А 100 100 60 0 0 Процент розчинника В 0 0 40 100 100 А = суміш гексан-діетиламін (99,5:0,5) В = суміш гексан-ізопропанол-діетиламін (75:25:2) Фракції збирали (80x0,5хв.; 10мл), фракції 46-50 об'єднували і концентрували до сухого залишку. Суху пробу розчиняли у метанолі і вносили у колонку (250x10мм; розмір частинок 8мкм) з обернено-фазовим силікагелем С-8 (Hypersil-BDS-C8). Нанесену пробу хроматографували в суміші ацетат амонію (10мМ)метанол-ацетонітрил (20:40:40), елююючи зі швидкістю 3мл/хв., і збираючи фракції об'ємом 0,75мл. Фракції, які містили сполуку 1, об'єднували і концентрували до сухого залишку, одержуючи 24,3мг чистої сполуки 1. Фракції, які містили сполуку 7, об'єднували і концентрували до сухого залишку, одержуючи 1,5мг чистої сполуки 7. Об'єднану фракцію SI-4 розчиняли у метанолі і вносили у колонку (250x10мм; розмір частинок 8мкм) з обернено-фазовим силікагелем С-8 (Hypersil-BDS-C8). Нанесену пробу хроматографували у наступній системі з лінійним градієнтом елюювання, при швидкості потоку 5мл/хв., збираючи 88 фракцій об'ємом 1,25мл: Час (хвилини) 0 20 25 30 35 Процент розчинника А 100 0 0 100 100 Процент розчинника В 0 100 100 0 0 А = ацетат амонію (10мМ) В = суміш метанол-ацетонітрил (1:1) Фракції, які містили неочищену сполуку 1, об'єднували і концентрували до сухого залишку, так само, як фракції, які містили неочищену сполуку 8. Кожну з об'єднаних висушених фракцій, зазначених вище, розчиняли у метанолі і знову хроматографували на колонці (250x10мм; розмір частинок 8мкм) з обернено фазовим силікагелем С-8 (Hypersil-BDS-C8). Проби елюювали, використовуючи суміш ацетат амонію (10мМ)метанол-ацетонітрил (20:40:40), зі швидкістю 3мл/хв., і збираючи фракції об'ємом 0,75мл. Фракції, які містили сполуку 8, об'єднували і концентрували до сухого залишку, одержуючи 5,8мг чистої сполуки 8. Фракції, які містили сполуку 1, об'єднували і концентрували до сухого залишку, одержуючи надалі 7,3мг чистої сполуки 1. Висушену промивну колонкову фракцію SI-5 розчиняли у метанолі і вносили у колонку (250x10мм; розмір частинок 8мкм) з обернено-фазовим силікагелем С-8 (Hypersil-BDS-C8). Нанесену пробу хроматографували у суміші ацетат амонію (10мМ)-метанол-ацетонітрил (20:40:40), елююючи зі швидкістю 3мл/хв., і збираючи фракції об'ємом 0,75мл. Фракції, які містили сполуку 7, об'єднували і концентрували до сухого залишку, одержуючи 3,5мг чистої сполуки 7. Спектроскопічні характеристики Хімічні структури нових компонентів були визначені за допомогою спектроскопічних методів, включаючи спектроскопію ядерного магнітного резонансу (ЯМР), мас-спектрометрію (МС), ультрафіолетову спектроскопію (УФ) і шляхом порівняння зі спінозином А і D та спорідненими аналогами. Наступні абзаци описують спектроскопічні властивості компонентів, описаних вище. У цьому обговоренні наводиться детальний аналіз спектроскопічних властивостей сполуки 1. Далі це супроводжується обговоренням спектроскопічних особливостей для інших споріднених компонентів, даючи можливість фахівцеві в даній галузі техніки зробити висновок про хімічну структуру шляхом порівняння з даними для сполуки 1. З метою зручності для читача, наступна схема сполуки 1 надає позначення положень для всіх спектральних даних ЯМР для природних факторів, представлених нижче: Сполука 1 має такі характеристики: Молекулярна маса: 757 Емпірична формула: C43H67NO10 УФ (детектування за допомогою діодної матриці під час аналізу методом ВЕРХ, розчинник = суміш метанол-ацетонітрил (1:1)): 244нм. МС з електророзпиленням: m/z для [М+Н]+ = 758,5; фрагмент-іон форозамінового цукру при m/z 142,1. Точна МС з іонізацією електророзпиленням: m/z для [М+Н]+ = 758,4845+0,0007 (теоретично: 758,4843). Таблиця II підсумовує спектральні дані 1 Н і 13С ЯМР для сполуки 1 у CDCI 3. Таблиця II Дані хімічного зсуву для сполуки 1 (CDCІ 3) Положення 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 1Н 3,14 2,39 3,02 3,42 5,79 5,87 2,16 1,92 1,35 4,30 2,26 1,34 0,90 2,86 6,77 3,31 3,66 1,60 1,80 1,23 1,60 5,04 13С 172,1 34,5 47,6 41,3 128,7 129,3 41,1 36,2 76,0 37,3 46,0 49,4 147,5 144,1 202,8 47,4 80,8 34,2 21,4 31,6 76,3 Положення 22 23 24 25 26 1Н 5,30 5,66 1,99 0,95 1,20 13С 128,0 134,9 25,0 13,1 16,3 1' 2' 2'-ОМе 3' 3'-ОМе 4' 4'-ОМе 5' 6' 4,86 3,50 3,48 3,46 3,48 3,11 3,56 3,55 1,28 95,4 77,7 59,0 81,0 57,6 82,2 60,9 67,9 7,8 1" 2" 4,42 1,98 1,46 1,86 1,50 2,22 2,23 3,50 1,26 103,6 30,9 3" 4" 4"-NMe2 5" 6" 18,3 64,8 40,7 73,7 18,9 Хімічні зсуви посилаються на пристрій вимірювання передачі при 0 ррm. Відмітні ЯМР спектроскопічні особливості інших метаболітів були такими: ЯМР спектри структур, які мають основну макролідну структуру сполуки 7, ілюструвалися відсутністю протонних сигналів при 5,8 і 5,7 ррm, і присутністю нового алкенового резонансу при 5,5 ррm. Крім того, метальний резонанс при 1,7 ррm вказував на присутність алкенової метальної групи. ЯМР спектри структур, які мають основну макролідну структуру сполуки 8, ілюструвалися рядом особливостей. Н-8 виявлявся як дублет при 4,15 ррm, а Н-9 виявлявся при 4,1 ррm (дд). Між Н-8 і Н-9 не було ніякої вимірної константи взаємодії. Сигнал для Н-11 зсунувся у нижню ділянку до 1,5 ррm. Гідроксилювання біля С-24 в будь-якій з цих 21-бутенільних структур було показане зсувом у нижню ділянку як Н-24, так і Н-25, які виявлялися як мультиплет і триплет, відповідно. Одночасно Н-23 змінився на подвійний дублет. ЯМР спектри структур, які мають основну макролідну структуру сполуки 11, ілюструвалися додаванням алкенових резонансів при 5,1, 5,25 і 5,6 ррm, з конфігураціями зв'язку, які узгоджуються з кінцевою алкеновою групою. Крім того, сигнал, що вказує на кінцеву аліфатичну метильну групу при 0,9-1,0 ррm, був відсутній. ЯМР спектри сполук, які мають основну макролідну структуру сполуки 16, ілюструвалися зсувом у нижню ділянку Н-24 і руйнуванням триплетної структури до дублету при приблизно 1,4 ррm. У цих випадках Н-23 змінювався до дублету квартетів, і аналіз двовимірного кореляційно-спектроскопічного спектра показав зв'язування цього дублету з іншим алкеновим протоном, що вказує на присутність пропенілової групи. ЯМР спектри сполук, які мають основну макролідну структуру сполуки 23, ілюструвалися відсутністю бутенілових алкенових протонів і були відрізнені від раніше відомих спінозинів шляхом аналізу двовимірного кореляційно-спектроскопічного і повного спектроскопічного кореляційного експериментів. Аналіз напрямку зв'язування, що витікає з Н-25, виявив 4вуглецеву бутильну групу, зв'язану з С-21. Глікозидні підструктури, приєднані до кисню біля С-17, були ідентифіковані з використанням великої кількості двовимірних ЯМР експериментів. Метальний триплет Н-25 і Н-24 розширеного кільця макроліду 31 нагадує етильну групу у спінозині А. Крім того, Н-21 перемістився у верхню ділянку до 4,8 ррm, відносно його положення у сполуці 1. Однак алкенові протони все ще були присутніми. Двовимірний кореляційно-спектроскопічний спектр показав, що як етильна група, так і алкен були з'єднані з Н-21, що вказує на те, що подвійний зв'язок у цій сполуці знаходився у межах кільця. Це узгоджувалося з даною сполукою, яка була ізомером сполуки 1, ґрунтуючись на її молекулярній масі, яка складала 758 (з даних мас-спектра). Перелік усіх метаболітів з молекулярними аддукт-іонами, що спостерігалися при МС з іонізацією електророзпиленням, з яких була виведена молекулярна маса, наведений у таблиці III: Таблиця III Сполука № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 212 22 23 24 25 26 27 28 29 30 31 1 Ключові дані мас-спектра1 (m/z) 758,5 [М+Н]+ 774,5 [М+Н]+ 744,5 [М+Н]+ 774,4 [М+Н]+ 744,8 [М+Н]+ 744,8 [М+Н]+ 772,5 [М+Н]+ 774,5 [М+Н]+ 774,7 [М+Н]+ 760,5 [М+Н]+ 756,5 [М+Н]+ 748,5 [М+NH4]+ 810,5 [M+NH4]+ 764,5 [M+NH4]+ 808,5 [M+NH4]+ 744,5 [М+Н]+ 617,4 [М+Н]+ 631,4 [М+Н]+ 633,4 [М+Н]+ 650,4 [M+NH4]+ 666,4 [M+NH4]+ 615,4 [М+Н]+ 636,5 [M+NH4]+ 744,4 [М+Н]+ 758,4 [М+Н]+ 772,4 [М+Н]+ 788,7 [М+Н]+ 760,4 [М+Н]+ 620,3 [M+NH4]+ 620,3 [М+МH4]+ 758,4 [М+Н]+ Молекулярні адцукт-іони спостерігали, використовуючи РХ/МС з іонізацією електророзпиленням. Два ізомери, обидва мали однакові МС характеристики. Інсектицидна та акарицидна активність Сполуки за даним винаходом (інші, ніж ті, де R5 представляє Н) є корисними для контролю чисельності комах, кліщів та іксодових кліщів. Тому наступний аспект даного винаходу спрямований на способи пригнічення комах, кліщів або іксодових кліщів, які включають застосування до місцеположення комах, кліщів або іксодових кліщів такої кількості, яка пригнічує комах, кліщів або іксодових кліщів, сполуки формули 1 або 2, 2 де R5 є групою, що має одну з формул 4а-4і. "Місцеположення" комах, кліщів або іксодових кліщів відноситься до навколишнього середовища, в якому комаха, кліщ або іксодовий кліщ живе, або де присутні його яйця, включаючи повітря, що його оточує, їжу, яку він споживає, або об'єкти, з якими він контактує. Наприклад, комах або кліщів, які харчуються рослинами, можна контролювати, наносячи активну сполуку на ті частини рослини, які комахи або кліщі їдять або де вони живуть, особливо листя. Під терміном "пригнічення комах, кліщів або іксодових кліщів" розуміють зменшення кількості живих комах, кліщів або іксодових кліщів, або зменшення кількості яєць. Ступінь зменшення, досягнутий сполукою, залежить, звичайно, від норми витрати сполуки, конкретної застосовуваної сполуки, і цільових видів комах, кліщів або іксодових кліщів. Щонайменше, має бути використана кількість сполуки, що інактивує комах, кліщів або іксодових кліщів. Під терміном "кількість, що інактивує" розуміють, що використовується така кількість сполуки, яка спричиняє вимірне зменшення в обробленій популяції комах, кліщів або іксодових кліщів. Звичайно використовують від приблизно 1 до приблизно 1000 ррm (або від 0,01 до 1кг/акр) сполуки. Сполуки демонструють активність проти великої кількості комах, кліщів та іксодових кліщів. Більш конкретно, сполуки показують активність проти членів ряду Lepidoptera (комахи), таких як бурякові похідні черв'яки, тютюнова совка, яблунева плодожерка і капустяна совка. До інших типових членів цього ряду належать південні похідні черв'яки, озима совка, платтяна міль, вогнівка комірна південна, листокрутки, совка бавовникова американська, совка бавовникова, метелик кукурудзяний, завезена капустяна гусінь, рожевий коробковий черв'як бавовнику, мішечниці, коконопряд кільчастий американський, лугові метелики і осінні похідні черв'яки. Сполуки також показують активність проти членів ряду Coleoptera (жуків і довгоносиків, таких як колорадський жук, жук-блішка одинадцятицятковий, жук-блішка смугастий, хрущик японський і довгоносик бавовниковий) і Diptera (мух справжніх, таких як муха домашня, комарі, дрозофіли, жигалки осіння і коров'яча мала, і молі-мінери вузькокрилі). Дані сполуки також показують активність проти членів ряду Hemiptera (клопів справжніх, таких як клописліпняки, клопи-щитники і клопи-наземники), Homoptera (таких як тлі, цикадки, дельфациди, білокрилки, щитівки і червці), Mallophaga (пухоїдів), Anoplura (вошей), Thysanoptera (трипсів), Orthoptera (таких як таргани, сарана, коники і цвіркуни), Siphonaptera (бліх), Isoptera (термітів), і членів ряду Hymenoptera Formicidae (мурах). Дані сполуки також показують активність проти кліщів та іксодових кліщів ряду Асаrі, наприклад, кліщика павутинного двоплямистого. Інші типові члени цього ряду включають паразитів рослин, таких як кліщик червоний цитрусовий, кліщик павутинний і кліщик плоский цитрусовий, і паразитів тварин, таких як коростяний кліщ, кліщ кінський, кліщ овечий, кліщ кровосисний пташиний, кліщ мінливий, кліщ пташиний і залозниця собача. Конкретні типові членистоногі шкідники, які можуть бути контрольовані за допомогою даних сполук, включають: Amblyomma americanum (Lone-star tick), Amblyomma maculatum (кліщ плямистий), Argas persicus (кліщ персидський), Boophims microplus (кліщ кільчастий), Chorioptes spp. (кліщ коростяний), Demodex bovis (залозниця бичача), Demodex canis (залозниця собача), Dermacentor andersoni (кліщ Андерсена), Dermacentor variabilis (іксодовий кліщ мінливий), Dermanyssus gallinae (кліщ кровосисний пташиний), Ixodes ricinus (кліщ овечий звичайний), Knemidokoptes gallinae (кліщ пташиний), Knemidokoptes mutans (кліщ мінливий), Otobius megnini (кліщ аргасовий), Psoroptes equi (кліщ кінський), Psoroptes ovis (кліщ кінський), Rhipicephalus sanguineus (кліщ собачий коричневий), Sarcoptes scabiei (кліщ коростяний), Aedes (комарі), Anopheles (комарі малярійні), Culex (комарі), Culiseta, Bovicola bovis (воша бичача), Callitroga homnivorax (падальна муха), Chrysops spp. (оленяча муха), Cimex lectularius (клоп постільний), Cochliomyia spp. (личинка м'ясної мухи), Ctenocephalides canis (блоха собача), Ctenocephalides felis (блоха котяча), Culicoides spp. (галиці, мошки або мокреці), Damalinia ovis (воша овеча), Dermatobia spp. (ґедзь підшкірний), Gasterophilus haemorrhoidalis (ґедзь червонохвостий), Gasterophilus intestinalis (ґедзь шлунковий великий), Gasterophilus nasalis (ґедзь носовий оленячий), Glossina spp. (муха цеце), Haematobia irritans (жигалка коров'яча мала), Haematopinus asini (воша ослина), Haematopinus eurysternus (воша великої рогатої худоби коротконоса кровосисна), Haematopinus ovillus (воша головна), Haematopinus suis (воша свиняча), Hydrotaea irritans (головна муха), Hypoderma bovis (ґедзь бичачий підшкірний), Hypoderma lineatum (ґедзь бичачий смугастий), Linognathus ovillus (воша головна), Linognathus pedalis (воша ступнева), Linognathus vituli (воша великої рогатої худоби довгоноса кровосисна), Lucilia spp. (личинка м'ясної мухи), Melophagus ovinus (рунець овечий), Musca spp. (домашня муха), Oestrus ovis (ґедзь червонохвостий), Pediculus spp. (воші), Phlebotomus spp. (мошка), Phormia regina (м'ясна муха), Psorophora spp. (комар), Pthiras spp. (воші), Reduvius spp. (клопи-хижаки), Simulium spp. (мошка), Solenopotes capillatus (воша великої рогатої худоби мала блакитна), Stomoxys calcitrans (жигалка осіння), Tabanus spp. (ґедзь), Tenebrio spp. (личинки хрущаків), Triatoma spp. (kissing bugs). Сполуки є корисними для зменшення популяцій комах, кліщів та іксодових кліщів, і використовуються у способі пригнічення комах, кліщів або іксодових кліщів, який включає застосування до місцеположення комахи, кліща або іксодового кліща ефективної кількості активної сполуки за винаходом, що інактивує комах, кліщів або іксодових кліщів. У одному переважному втіленні даний винахід спрямований на спосіб пригнічення сприйнятливих комах з ряду Lepidoptera, який включає нанесення на рослину ефективної кількості що інактивує комах, активної сполуки за даним винаходом. Інше переважне втілення даного винаходу спрямоване на спосіб пригнічення кусючих мух із ряду Diptera у тварин, який включає пероральне, парентеральне введення або локальне нанесення тварині ефективної кількості, що пригнічує шкідників, даної сполуки. Ще одне переважне втілення даного винаходу спрямоване на спосіб пригнічення кліщів або іксодових кліщів ряду Асаrіnа, який включає застосування до місцеположення кліща або іксодового кліща такої кількості активної сполуки за винаходом, що інактивує кліщів або іксодових кліщів. Не лише сполуки, розкриті тут, є корисними у виробництві сільськогосподарських продуктів, але і кислі додаткові солі цих сполук, де це можливо, також є корисними продуктами. Ці солі є корисними, наприклад, в розділенні і очищенні сполук формули 1 і 2. Крім того, деякі з цих солей можуть мати підвищену розчинність у воді. Кислі додаткові солі можуть бути приготовані із сполук, розкритих у формулі 1, де R5 є основною азотовмісною молекулою цукру, такого як форозамін. Солі цих сполук готують, використовуючи стандартну методику для приготування солей, яка є добре відомою фахівцям у даній галузі техніки. Кислі додаткові солі, які є особливо корисними, включають, але не обмежуються ними, солі, утворені при стандартних реакціях як з органічними, так і з неорганічними кислотами, такими як сірчана, хлористоводнева, фосфорна, оцтова, бурштинова, лимонна, молочна, малеїнова, фумарова, холева, памоєва, слизова, глутамінова, камфорна, глутарова, гліколева, фталева, винна, мурашина, лауринова, стеаринова, саліцилова, метансульфонова, бензолсульфонова, сорбінова, пікринова, бензойна, корична та подібні кислоти. Приклад 4 Відбір комах A. Дослідження змочування новонароджених личинок тютюнової совки (Heliothis viresсеns). Для порівняння інсектицидної активності сполук формули 1 у новонароджених (
ДивитисяДодаткова інформація
Назва патенту англійськоюPesticide macrolide, a method for the preparation thereof, strain saccharopolyspora producing macrolide and a mixture based thereon and a method for controlling insecticides and acaricides
Назва патенту російськоюПестицидный макролид, способ его получения, штамм saccharopolyspora, который продуцирует макролид, смесь на основе макролида и способ борьбы с инсектицидами или акарицидами
МПК / Мітки
МПК: A01N 63/02, A01P 7/04, C12N 1/20, A01N 43/22, A61P 33/14, C12P 19/62, A01P 7/02, C07H 17/08, A61K 31/7048
Мітки: штам, пестицидний, макролід, спосіб, saccharopolyspora, боротьби, основі, одержання, інсектицидами, продукує, макроліда, суміш, акарицидами
Код посилання
<a href="https://ua.patents.su/14-71997-pesticidnijj-makrolid-sposib-jjogo-oderzhannya-shtam-saccharopolyspora-shho-produkueh-makrolid-sumish-na-osnovi-makrolida-i-sposib-borotbi-z-insekticidami-abo-akaricidami.html" target="_blank" rel="follow" title="База патентів України">Пестицидний макролід, спосіб його одержання, штам saccharopolyspora, що продукує макролід, суміш на основі макроліда і спосіб боротьби з інсектицидами або акарицидами</a>
Попередній патент: Спосіб лікування злукової хвороби очеревини
Наступний патент: Роторно-поршневий двигун внутрішнього згорання
Випадковий патент: K-метод визначення вмісту етилового спирту і сухих розчинних речовин у виноматеріалах та винах












