Спосіб отримання амінопіримідинових сполук, проміжна сполука (варіанти), спосіб її отримання (варіанти)
Номер патенту: 77678
Опубліковано: 15.01.2007
Автори: Мацусіта Акьо, Тіка Дзиніті, Ода Мізуго, Каваті Йасугіро
Формула / Реферат
1. Спосіб отримання 2-(N-метил-N-метансульфоніламіно)піримідинової сполуки формули (3):
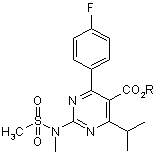 , (3)
, (3)
де R - гідрокарбільна група,
в якому проводять такі операції:
- реакцію гідроксипіримідинової сполуки формули (1):
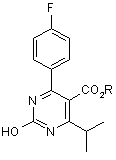 , (1)
, (1)
де R визначено вище,
з органічним сульфонілгалогенідом формули (2)
R'SO2X, (2)
де R' -гідрокарбільна група, а Х - атом галогену, або з органічним сульфоновим ангідридом формули (2а):
(R'SO2)2O, (2а)
де R' визначено вище, і
- реакцію одержаного продукту реакції з N-метил-N-метансульфонамідом.
2. Спосіб за п. 1, який відрізняється тим, що реакцію гідроксипіримідинової сполуки з органічним сульфонілгалогенідом або з органічним сульфоновим ангідридом і реакцію одержаного в результаті продукту з N-метил-N-метансульфонамідом проводять у присутності основи.
3. Спосіб за п. 1, який відрізняється тим, що гідроксипіримідинову сполуку одержують окисненням дигідропіримідинонової сполуки формули (4):
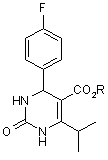 , (4)
, (4)
де R визначено вище у п. 1.
4. Спосіб за п. 3, який відрізняється тим, що дигідропіримідинонову сполуку окиснюють азотною кислотою.
5. Спосіб за п. 3, який відрізняється тим, що дигідропіримідинонову сполуку одержують реакцією ізобутирилацетатного естеру формули (5):
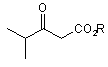 , (5)
, (5)
де R визначено вище у п. 1, з 4-флуорбензальдегідом і сечовиною у присутності протонної сполуки і солі металу.
6. Спосіб за п. 5, який відрізняється тим, що протонною сполукою є протонна кислота.
7. Спосіб за п. 6, який відрізняється тим, що протонною кислотою є сульфурова кислота.
8. Спосіб за п. 5, який відрізняється тим, що сіллю металу є хлорид міді (І).
9. Гідроксипіримідинова сполука формули (1):
 , (1)
, (1)
де R' - гідрокарбільна група.
10. Гідроксипіримідинова сполука за п. 9, яка відрізняється тим, що R є алкільною групою з 1-10 атомами карбону, циклоалкільною групою з 3-6 атомами карбону, арилалкільною групою, що має алкільний компонент з 1-3 атомами карбону, або арильною групою.
11. Спосіб отримання гідроксипіримідинової сполуки за п. 9, в якому проводять окиснення дигідропіримідинонової сполуки формули (4):
 , (4)
, (4)
де R - гідрокарбільна група.
12. Спосіб за п. 11, який відрізняється тим, що дигідропіримідинонову сполуку окиснюють азотною кислотою.
13. Спосіб за п. 11, який відрізняється тим, що дигідропіримідинонову сполуку одержують реакцією ізобутирилацетатного естеру формули (5):
 , (5)
, (5)
де R визначено вище у п. 11, з 4-флуорбензальдегідом і сечовиною у присутності протонної сполуки і солі металу.
14. Спосіб за п. 13, який відрізняється тим, що протонною сполукою є протонна кислота.
15. Спосіб за п. 14, який відрізняється тим, що протонною кислотою є сульфурова кислота.
16. Спосіб за п. 13, який відрізняється тим, що сіллю металу є хлорид міді (І).
17. Дигідропіримідинонова сполука формули (4):
 , (4)
, (4)
де R - гідрокарбільна група.
18. Дигідропіримідинонова сполука за п. 17, яка відрізняється тим, що R є алкільною групою з 1-10 атомами карбону, циклоалкільною групою з 3-6 атомами карбону, арилалкіль-ною групою, що має алкільний компонент з 1-3 атомами карбону, або арильною групою.
19. Спосіб отримання дигідропіримідинонової сполуки за п. 17, в якому проводять реакцію ізобутирилацетатного естеру формули (5):
 , (5)
, (5)
де R визначено вище у п. 17, з 4-флуорбензальдегідом і сечовиною у присутності протонної сполуки і солі металу.
20. Спосіб за п. 19, який відрізняється тим, що протонною сполукою є протонна кислота.
21. Спосіб за п. 19, який відрізняється тим, що протонною кислотою є сульфурова кислота.
22. Спосіб за п. 19, який відрізняється тим, що сіллю металу є хлорид міді (І).
23. Спосіб отримання амінопіримідинової сполуки формули (8):
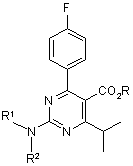 , (8)
, (8)
де R - гідрокарбільна група, а кожний з R1 і R2 незалежно є атомом гідрогену, алкільною групою, алкілсульфонільною групою або арилсульфонільною групою,
в якому проводять реакцію 2-заміщеної піримідинової сполуки формули (6):
 , (6)
, (6)
де R визначено вище, а Х є атомом галогену або органічною сульфонілоксигрупою, з аміновою сполукою формули (7):
![]() , (7)
, (7)
де кожний з R1 і R2 визначено вище.
24. Спосіб за п. 23, який відрізняється тим, що R1 є метилом, а R2 є метансульфонілом.
25. Спосіб за п. 23, який відрізняється тим, що реакцію 2-заміщеної піримідинової сполуки з аміновою сполукою проводять у присутності основи.
26. Галогенопіримідинова сполука формули (9):
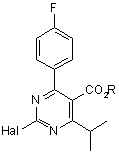 , (9)
, (9)
де R - гідрокарбільна група, a Hal - атом галогену.
27. Галогенопіримідинова сполука за п. 26, яка відрізняється тим, що R є алкільною групою з 1-10 атомами карбону, циклоалкільною групою з 3-6 атомами карбону, арилалкільною групою, що має алкільний компонент з 1-3 атомами карбону, або арильною групою.
28. Галогенопіримідинова сполука за п. 26, яка відрізняється тим, що Hal є атомом хлору.
29. Спосіб отримання галогенопіримідинової сполуки за п. 26, в якому проводять реакцію гідроксипіримідинової сполуки формули (1):
 , (1)
, (1)
де R-гідрокарбільна група, з галогенувальним агентом.
30. Спосіб за п. 29, який відрізняється тим, що галогенувальним агентом є фосфорний оксихлорид або тіонілхлорид.
31. Органічна сульфонілоксипіримідинова сполука формули (10):
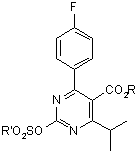 , (10)
, (10)
де кожний з R і R' незалежно є гідрокарбільною групою.
32. Органічна сульфонілоксипіримідинова сполука за п. 31, яка відрізняється тим, що R і R' незалежно є алкільною групою з 1-10 атомами карбону, циклоалкільною групою з 3-6 атомами карбону, арилалкільною групою, що має алкільний компонент з 1-3 атомами карбону, або арильною групою.
33. Спосіб отримання органічної сульфонілоксипіримідинової сполуки за п. 31, в якому проводять реакцію гідроксипіримідинової сполуки формули (1):
 , (1)
, (1)
де R - гідрокарбільна група,
з органічним сульфонілгалогенідом формули (2):
R'SO2X, (2)
де R' - гідрокарбільна група, а Х - атом галогену,
або з органічним сульфоновим ангідридом формули (2а):
(R'O2)2O, (2а)
де R' визначено вище.
34. Спосіб отримання 2-(N-метил-N-метансульфоніламіно)піримідинової сполуки формули (3):
 , (3)
, (3)
де R - гідрокарбільна група, в якому проводять такі операції:
(I) реакцію ізобутирилацетатного естеру формули (5):
 , (5)
, (5)
де R - гідрокарбільна група,
з 4-флуорбензальдегідом і сечовиною у присутності протонної сполуки і солі металу;
(II) окиснення продукту операції (І);
(III) реакцію продукту окиснення операції (II) з органічним сульфонілгалогенідом формули (2):
R'SO2X, (2)
де R' - гідрокарбільна група, а Х - атом галогену, або з органічним сульфоновим ангідридом формули (2а):
(R'O2)2O, (2а)
де R' визначено вище;
(IV) реакцію продукту операції (III) з N-метил-N-метансульфонамідом.
35. Спосіб за п. 1, який відрізняється тим, що R' є заміщеною або не заміщеною арильною групою.
36. Спосіб за п. 1, в якому проводять подальше перетворення сполуки формули (3) у розувастатин або його фармацевтично прийнятну сіль.
37. Спосіб за п. 34, в якому проводять подальше перетворення сполуки формули (3) у розувастатин або його фармацевтично прийнятну сіль.
38. Спосіб за п. 23, в якому проводять подальше перетворення сполуки формули (8) в інгібітор редуктази HMG СоА.
Текст
1. Спосіб отримання 2-(N-метил-Nметансульфоніламіно)піримідинової сполуки формули (3): 2 3 77678 4 18. Дигідропіримідинонова сполука за п. 17, яка CO2R відрізняє ться тим, що R є алкільною групою з 110 атомами карбону, циклоалкільною групою з 3-6 , (5) атомами карбону, арилалкіль-ною групою, що має де R визначено вище у п. 1, з 4алкільний компонент з 1-3 атомами карбону, або флуорбензальдегідом і сечовиною у присутності арильною групою. протонної сполуки і солі металу. 19. Спосіб отримання дигідропіримідинонової спо6. Спосіб за п. 5, який відрізняється тим, що пролуки за п. 17, в якому проводять реакцію ізобутитонною сполукою є протонна кислота. рилацетатного естеру формули (5): 7. Спосіб за п. 6, який відрізняється тим, що проO тонною кислотою є сульфурова кислота. 8. Спосіб за п. 5, який відрізняється тим, що сіллю металу є хлорид міді (І). 9. Гідроксипіримідинова сполука формули (1): F CO2 R N HO N , (1) де R' - гідрокарбільна група. 10. Гідроксипіримідинова сполука за п. 9, яка відрізняється тим, що R є алкільною групою з 1-10 атомами карбону, циклоалкільною групою з 3-6 атомами карбону, арилалкільною групою, що має алкільний компонент з 1-3 атомами карбону, або арильною групою. 11. Спосіб отримання гідроксипіримідинової сполуки за п. 9, в якому проводять окиснення дигідропіримідинонової сполуки формули (4): F CO 2R HN O N H , (4) де R - гідрокарбільна група. 12. Спосіб за п. 11, який відрізняється тим, що дигідропіримідинонову сполуку окиснюють азотною кислотою. 13. Спосіб за п. 11, який відрізняється тим, що дигідропіримідинонову сполуку одержують реакцією ізобутирилацетатного естеру формули (5): O CO2R , (5) де R визначено вище у п. 11, з 4флуорбензальдегідом і сечовиною у присутності протонної сполуки і солі металу. 14. Спосіб за п. 13, який відрізняється тим, що протонною сполукою є протонна кислота. 15. Спосіб за п. 14, який відрізняється тим, що протонною кислотою є сульфурова кислота. 16. Спосіб за п. 13, який відрізняється тим, що сіллю металу є хлорид міді (І). 17. Дигідропіримідинонова сполука формули (4): O CO2R , (5) де R визначено вище у п. 17, з 4флуорбензальдегідом і сечовиною у присутності протонної сполуки і солі металу. 20. Спосіб за п. 19, який відрізняється тим, що протонною сполукою є протонна кислота. 21. Спосіб за п. 19, який відрізняється тим, що протонною кислотою є сульфурова кислота. 22. Спосіб за п. 19, який відрізняється тим, що сіллю металу є хлорид міді (І). 23. Спосіб отримання амінопіримідинової сполуки формули (8): F CO 2R N R1 N N , (8) де R - гідрокарбільна група, а кожний з R1 і R2 незалежно є атомом гідрогену, алкільною групою, алкілсульфонільною групою або арилсульфонільною групою, в якому проводять реакцію 2-заміщеної піримідинової сполуки формули (6): R2 CO2 R N X N , (6) де R визначено вище, а Х є атомом галогену або органічною сульфонілоксигрупою, з аміновою сполукою формули (7): R1 NH R2 , (7) де кожний з R1 і R2 визначено вище. 24. Спосіб за п. 23, який відрізняється тим, що R1 є метилом, а R2 є метансульфонілом. 25. Спосіб за п. 23, який відрізняється тим, що реакцію 2-заміщеної піримідинової сполуки з аміновою сполукою проводять у присутності основи. 26. Галогенопіримідинова сполука формули (9): F F CO 2 R N CO2 R HN O Hal N H , (4) де R - гідрокарбільна група. N , (9) де R - гідрокарбільна група, a Hal - атом галогену. 27. Галогенопіримідинова сполука за п. 26, яка відрізняє ться тим, що R є алкільною групою з 1 5 77678 6 10 атомами карбону, циклоалкільною групою з 3-6 з органічним сульфонілгалогенідом формули (2): атомами карбону, арилалкільною групою, що має R'SO2 X, (2) алкільний компонент з 1-3 атомами карбону, або де R' - гідрокарбільна група, а Х - атом галогену, арильною групою. або з органічним сульфоновим ангідридом фор28. Галогенопіримідинова сполука за п. 26, яка мули (2а): відрізняє ться тим, що Hal є атомом хлору. (R'O2)2 O, (2а) 29. Спосіб отримання галогенопіримідинової споде R' визначено вище. луки за п. 26, в якому проводять реакцію гідрокси34. Спосіб отримання 2-(N-метил-Nпіримідинової сполуки формули (1): метансульфоніламіно)піримідинової сполуки форF мули (3): F CO2 R N O HO N , (1) де R-гідрокарбільна група, з галогенувальним агентом. 30. Спосіб за п. 29, який відрізняється тим, що галогенувальним агентом є фосфорний оксихлорид або тіонілхлорид. 31. Органічна сульфонілоксипіримідинова сполука формули (10): F C O2 R N R'O2 SO N , (10) де кожний з R і R' незалежно є гідрокарбільною групою. 32. Органічна сульфонілоксипіримідинова сполука за п. 31, яка відрізняється тим, що R і R' незалежно є алкільною групою з 1-10 атомами карбону, циклоалкільною групою з 3-6 атомами карбону, арилалкільною групою, що має алкільний компонент з 1-3 атомами карбону, або арильною групою. 33. Спосіб отриманняорганічної сульфонілоксипіримідинової сполуки за п. 31, в якому проводять реакцію гідроксипіримідинової сполуки формули (1): F CO2 R N HO N , (1) де R - гідрокарбільна група, Винахід стосується отримання амінопіримідинових сполук формули (8) H 3C S O CO 2R N N N , (3) де R - гідрокарбільна група, в якому проводять такі операції: (I) реакцію ізобутирилацетатного естеру формули (5): O CO2R , (5) де R - гідрокарбільна група, з 4-флуорбензальдегідом і сечовиною у присутності протонної сполуки і солі металу; (II) окиснення продукту операції (І); (III) реакцію продукту окиснення операції (II) з органічним сульфонілгалогенідом формули (2): R'SO2 X, (2) де R' - гідрокарбільна група, а Х - атом галогену, або з органічним сульфоновим ангідридом формули (2а): (R'O2)2 O, (2а) де R' визначено вище; (IV) реакцію продукту операції (III) з N-метил-Nметансульфонамідом. 35. Спосіб за п. 1, який відрізняється тим, що R' є заміщеною або не заміщеною арильною групою. 36. Спосіб за п. 1, в якому проводять подальше перетворення сполуки формули (3) у розувастатин або його фармацевтично прийнятну сіль. 37. Спосіб за п. 34, в якому проводять подальше перетворення сполуки формули (3) у розувастатин або його фармацевтично прийнятну сіль. 38. Спосіб за п. 23, в якому проводять подальше перетворення сполуки формули (8) в інгібітор редуктази HMG Со А. фонільною групою, і, зокрема стосується отримання 2-(N-метил-Nметансульфоніламіно)піримідиновоі сполуки формули (3) (8) (3) у якій R - гідрокарбільна група, і кожний з R1 і R незалежно є атомом гідрогену алкільною групою, алкілсульфонільною групою або арилсуль2 де R - гідрокарбільна група [У Bioorg Med Chem, 5, 437 (1997)] відзначено, 7 77678 що 2-(N-метил-N-метансульфоніламіно)піримідинова сполука може бути інтермедіатом при одержанні холестеролознижуючого агента (інгібітору редуктази HMG-CoA S-4522) формули: 8 (1) де R визначено вище, з органічним сульфонілгалогенідом формули відомої як кальцієва сіль розувастатину або розувастатин кальцію. [У WO 01/04100] описано процес отримання 2(N-метил-N-метансульфоніламіно)-піримідинової сполуки, який включає такі операції: - реакція метилізобутирилацетату з 4флуорбензонітрил для одержання метил 2-[1аміно-1-(4-флуорфеніл)метилен]-4-метил-3оксопентанату, i реакція 2-[1-аміно-1-{4флуорфеніл)метилен]-4-метил-3-оксопентанату з N-ціано-N-метилметансульфонамідом, який одержують реакцією між N-метилметансульфонамідом i ціаногенхлоридом, для одержання 4-(4флуорфеніл)-6-ізопропіл-5-метоксикарбоніл-2-(Nметансульфоніл-N-метиламіно)піримідину. Відзначено, що повний вихід (відносно кількості метилізобутирилацетату) становить 45,5%. Було виявлено, що процес, [описаний у WO 01/04100], є незручним для промислового застосування, оскільки вихід є низьким і при цьому використовується токсичний ціаногенхлорид як одна з вихідних сполук. Отже, об'єктом винаходу є новий спосіб отримання 2-(N-метил-N-метансульфоніламіно)піримідину або аналогічної амінопіримідинової сполуки, зокрема новий більш зручний спосіб одержання цієї сполуки без використання токсичних сполук і/або з забезпеченням високого виходу і/або високої чистоти. Іншим об'єктом винаходу є новий спосіб отримання 2-(N-метил-N-метансульфоніламіно)піримідину або аналогічної амінопіримідинової сполуки, придатний для промислового застосування. Об'єктом винаходу є спосіб отримання 2-(Nметил-N-метансульфоніламіно)-піримідину формули (3): (3) де R - гідрокарбільна група, який включає такі операції: - реакція гідроксипіримідинової сполуки (1): (2): R'SO2 X (2) де R1 - гідрокарбільна група, а X - атом галогену, або з органічним сульфоновим ангідридом формули (2а): (R'SO2)2 O (2a) де R' визначено вище, i - реакція одержаного продукту реакції з Nметил-N-метансульфонамідом. Об'єктом винаходу також є гідроксипіримідинова сполука формули (1). Ще одним об'єктом винаходу є спосіб отримання гідроксипіримідинової сполуки формули (1), який включає окиснення дигідропіримідинонової сполуки формули (4): (4) де R - гідрокарбільна група. Іншим об'єктом винаходу є дигідропіромідинонова сполука формули (4). Крім того об'єктом винаходу є спосіб отримання дигідропіримідинонової сполуки формули (4), який включає реакцію ізобутирилацетатного естеру формули (5): (5) де R - гідрокарбільна група, з 4-флуорбензальдепдом і сечовиною у присутності протонної сполуки і солі металу Іншим об'єктом винаходу є спосіб отримання амінопіримідинової сполуки формули (8): (8) де R - гідрокарбільна група, а кожний з R 11 R2 незалежно є атомом гідрогену, алкільною групою, алкілсульфонільною групою або арилсульфонільною групою, який включає реакцію 2-заміщеноі піримідинової сполуки формули (6): 9 77678 10 нувати безперервно в однійреакційній суміші. Типовий процес отримання 2-(N-метил-Nметансульфоніламіно)піримідину формули (3) згідно з винаходом ілюструється схемою: (6) де R визначено вище, а X є атомом галогену або органічною сульфонілоксигрупою, з аміновою сполукою формули (7): (7) де кожний з R1 і R2 визначено вище. Об'єктом винаходу є також галогенпіримідинова сполука формули (9): (9) де R - гідрокарбільна група, a Hal - атом галогену. Ще одним об'єктом винаходу є спосіб отримання галогенопіримідинової сполуки формули (9), який включає реакцію гідроксипіримідинової сполуки формули (1) з галогенувальним агентом. Об'єктом винаходу, є також органічна сульфонілоксипіримідинова сполука формули (10): (10) де кожний з R1 і R2 незалежно є гідрокарбільною групою. Іншим об'єктом винаходу є спосіб отримання органічної сульфонілоксипіримідинової сполуки формули (10), який включає реакцію гідроксипіримідинової сполуки формули (1) з органічним сульфонілгалогенідом формули (2): R'SO2 X (2) де R' - гідрокарбільна група, а X - атом галогену, або з органічним сульфоновим ангідридом формули (2а): (R'SO2)2 O (2a) де R1 визначено вище. Крім того, об'єктом винаходу є спосіб отримання 2-(N-метил-N-метансульфоніламіно)піримідину формули (3), який включає такі операції: (I) реакція ізобутирилацетатного естеру формули (5) з 4-флуорбензальдегідом і сечовиною у присутності протонної сполуки і солі металу; (II) окиснення продукту операції (І); (III) реакція продукту окиснення операції (II) з органічним сульфонілгалогенідом формули (2) або з органічним сульфоновим ангідридом формули (2а); і (IV) реакція продукту операції (III) з N-метил-Nметансульфонамідом. У цьому процесі операції (III) і (IV) можна вико Далі детально розглядаються окремі операції цієї схеми. Операція (І) В операції (І), ізобутирилацетатний естер формули (5): (5) де R - гідрокарбільна група, вводять у реакцію з 4 - флуорбензальдепдом і сечовиною у присутності протонної сполуки і солі металу. Гідрокарбільними групами (тобто гідрокарбоновими групами), позначеними R у формулах сполук, що беруть участь реакціях згідно з винаходом, можуть бути алкільні групи, наприклад, метил, етил, пропіл, бутил, пентил, гексил, гептил, октил, доній або децил, зокрема, алкільні групи, що мають 1-6 атомів карбону, і алкільні групи, що мають 1-4 атомів карбону цикло-алкільні групи наприклад, циклопропіл, циклобутил, циклопентил або циклогексил, аралкільні групи, наприклад, бензил, фенілетил або фенілпропіл, або арильні групи, наприклад, феніл або метилфеніл. Гідрокарбільні групи можуть мати будь-які ізомерні конфігурації, наприклад, нормальну, ізо- або третинну. Гідрокарбільні групи можуть мати один або більше замісників, за умови що вони не заважають проходженню реакції. Протонною сполукою може бути неорганічна кислота або її сіль наприклад гідрохлоридна кислота сульфурова кислота, гідросульфат калію, гідросульфат натрію азотна кислота або фосфорна кислота, органічні сульфонові кислоти, наприклад, метансульфонова кислота етансульфонова кислота, бензолсульфонова кислота, ртолуолсульфонова кислота або рбромбензолсульфонова кислота, органічні карбонові кислоти, наприклад, оцтова кислота пропіонова кислота, бутирова кислота або бензойна кислота, спирт, наприклад, метанол, етанол або пропанол Бажаними є протонні кислоти, наприклад, гідроглоридна кислота сульфурова кислота, 11 77678 12 р-толуолсульфонова кислота і оцтова кислота Одержаний продукт реакції, тобто дигідропіНайбільш бажаною є сульфурова кислота Протонримідинонова сполука формули (4), може бути ні сполуки можна використовувати одиночно або ізольована і очищена згідно з звичайними процекомбіновано. дурами, наприклад, дистиляцією, кристалізацією, Протонну сполуку можна використовувати у рекристалізацією і колонною хроматографією. кількості, бажано, від 0,01 до 3моль, більш бажано Операція (II) від 0 1 до 1моль, на один моль ізобутирилацетатОперацією (II) дигідропіримідинонова сполука ного естеру. формули (4), тобто продукт реакції операції (І), Сіллю металу що використовується у реакції, окиснюється з утворенням гідроксипіримідинової може бути хлорид міді (і), хлорид міді (II) ацетат сполуки формули (1) міді (II), хлорид заліза (II), хлорид заліза (III), хлоОкиснення (або дегідрогенувальне окиснення) рид алюмінію, бромід нікелю (II) хлорид олова (IV), може бути проведене в один з звичайних способів тетрахлорид титан у або бромід магнію. Бажаними Бажаним є окиснення з використанням азотної є хлорид міді (І) хлорид міді (II), хлорид заліза (II) і кислоти, оскільки таке окиснення легко виконати і бромід нікелю (II). Найбільш бажаним є хлорид простою є подальша обробка продукту реакції. міді (І) Ці солі можуть містити кристалізаційну воду Азотну кислоту можна використовувати у кільі їх можна використовувати одиночно або комбінокості, бажано, від 1 до 20моль більш бажано, від 3 вано. до 15моль, на один моль дигідропіримідинонової Сіль металу можна використовувати у кількоссполуки формули (4). Бажана концентрація азотної ті, бажано, від 0,001 до 5моль, більш бажано, від кислоти становить від 40 до 80%, більш бажано, 0,01 до 0,1моль, на один моль ізобутирилацетатвід 50 до 70%. ного естеру. Окиснення можна проводити у присутності 4-флуорбензальдепд можна використовувати (або без) розчинника, який може бути будь-яким за у кількості, бажано, від 0,5 до 10моль більш бажаумови, що він не заважає проходженню бажаної но, від 0,9 до 1,1моль, на один моль ізобутирилареакції Прикладами бажаних розчинників можуть цетатного естеру. бути карбонові кислоти, наприклад, оцтова кислоСечовину можна використовува ти у кількості, та, пропіонова кислота і бутирова кислота. Розбажано від 0,5 до 10моль, більш бажано, від 1 5 до чинники можуть використовуватись одиночно або 2моль, на один моль ізобутирилацетатного естеру. у комбінації, у кількості, бажано, від 0,1 до 7мл, Реакцію можна проводити у присутності (або більш бажано, від 0,5 до 3мл на 1г дигідропіримібез) розчинника. Може бути використаний будьдинонової сполуки. Ця кількість можна варіювати який розчинник, який не заважає проходженню залежно від гомогенності і дисперсійної здатності бажаної реакції. Прикладами придатних розчинниреакційної суміші. ків можуть бути спирти наприклад, метанол етанол Окиснення можна виконати введенням у реакn-пропіловий спирт ізопропіло-вий спирт, nцію дигідропіримідинонової сполуки і азотної кисбутиловий спирт, ізобутиловий спирт вторлоти у розчиннику в атмосфері інертного газу, при бутиловий спирт і t-бутиловий спирт, етери, напритемпературі, бажано, від -10 до 100°С, більш баклад, діетиловий етер, діізопропіловий етер, ТГФ і жано, від 0 до 50°С, і при будь-якому зовнішньому диметоксиетан, нітрили наприклад, ацетонітрил, тиску. У реакційну систему можна ввести ініціатор пропіонітрил, бутиронітрил і ізобутиронітрил, галореакції, наприклад, нітрит натрію, для прискорення геновані аліфатичні гідрокарбони, наприклад, окиснення. ДХМ, дихлоретан, хлороформ і карбонтетрахлоОдержаний продукт реакції, тобто гідроксипірид, ароматичні гідрокарбони, наприклад, бензол, римідинова сполука формули (1), може бути очитолуол і ксилол галогеновані ароматичні гідрокарщена з використанням звичайних процедур, набони наприклад, хлорбензол, і нітровані ароматиприклад, дистиляцією, кристалізацією, чні гідрокарбони, наприклад, нітробензол. Бажарекристалізацією і колонною хроматографією. ними є метанол, етанол, n-пропіловий спирт, Операції (III) і (IV) ізопропіловий спирт, n-бутиловий спирт діізопропіОпераціями (III) і (IV) гідроксипіримідинова ловий етер, ТГФ, диметоксиетан, ацетонітрил, сполука формули (1) тобто продукт реакції операбутиронітрил, ізобутилнітрил, ДХМ, дихлоретан, ції (II) вводиться у реакцію з органічним сульфоніхлороформ, толуол, ксилол і хлорбензол Особлилгалогенідом формули (2): во бажаними є метанол, етанол і ізопропіловий R'SO2 X (2) спирт. Розчинники можна використовувати одиноабо з органічним сульфоновим ангідридом чно або у комбінації. формули (2а): Кількість розчинника може становити, бажано, (R'SO2)2 O (2a) від 0,1 до 10л, більш бажано, від 0,3 до 2л, на а одержаний продукт вводиться у реакцію з Nодин моль ізобутирилацетатного естеру. Ця кільметил-N-метансульфонамідом. кість може варіюватись залежно від гомогенності і У формулах (2) і (2а) R' є гідрокарбільною грудисперсійної здатності реакційної суміші. пою, що може мати один або більше замісників. Реакцію можна проводити, вводячи в реакцію Прикладами гідрокарбільних груп можуть бути ізобутирилацетатний естер, 4-флуор-бензальдепд алкільні групи, наприклад, метил, етил пропіл, буі сечовину у розчиннику у присутності протонної тил пентил, гептил, октил, ноніл і децил, зокрема сполуки і солі металу, в атмосфері інертного газу алкільні групи, що мають 1-6 атомів карбону, осопри температурі, бажано, від -10 до 200°С, більш бливо алкільні групи, що мають 1-4 атомів карбобажано, від 30 до 100°С без обмежень на зовнішну, флуоровані алкільні групи, наприклад, трифлуній тиск. орметил, нонафлуорбутил, тридекафлуоргексил, 13 77678 14 гептадекафлуороктил і ункосафлуордецил, циклометилметансульфонамщ може бути використаний алкільні групи, наприклад, циклопропіл, циклобуу кількості бажано, від 0,1 до 30моль, більш бажатил, циклопентил і циклогексил, аралкільні групи, но, від 1 до 5моль, на один моль гідроксипіримідинаприклад, бензил фенілетил і фенілпропіл і аринової сполуки. льні групи включаючи незаміщені і заміщені феніРеакції операцій (III) і (IV) бажано проводити у льні або нафтильні групи наприклад феніл нафтил присутності основи. Прикладами основ можуть толіл ксиліл мезитил, триїзопропілфеніл, метокбути карбонати лужних металів, наприклад, карсифеніл хлорфеніл і нітрофенол. Отже гідрокарбібонат натрію і карбонат калію, гідрокарбонати лульні групи можуть мати один або більше замісників жних металів, наприклад, гідрокарбонат натрію, які не заважають проходженню реакції. Гідрокаргідроксиди лужних металів, наприклад, гідроксид більні групи можуть мати будь-яку ізомерну конфілітію, гідроксид натрію і гідроксид калію, алкоксиди гурацію, наприклад нормальну, ізо- або третинну. лужних металів, наприклад, метоксид натрію, tКоли R' є арилом, бажано, щоб вона була, наприбутоксид натрію, t-бутоксид калію і t-пентоксид клад, фенільною або нафтильною групою (зокренатрію і третинні аміни, наприклад триетиламін, ма, фенілом), незаміщеною або заміщеною 1, 2 триїзопропіламін, діізопропілетиламін і піридин. або 3-ма замісниками. Замісник може бути незаБажаними є карбонат натрію карбонат калію, tлежно вибраний серед, наприклад, алкілу, що має бутоксид калію, t-пентоксид натрію триетиламін і 1-4 атоми карбону, алкоксилу, що має 1-4 атомів піридин. Більш бажаними є карбонат калію, tкарбону, галогено- i нітрогрупи. пентоксид натрію і триетиламін. Найбільш бажаУ формулі (2) X є атомом галогену, наприклад, ними є карбонат калію і t-пентоксид натрію. Оснофлуором, хлором, бромом і іодом. ву можна використовува ти одиночно або у комбіПриклади сульфонілгалогенідів включають націях, у кількості, бажано, від 0,1 до 30моль, метансульфонілфлуорид, метансульфонілхлорид, більш бажано, від 1 до 5моль, на один моль гідроетансульфонілхлорид, 1-пропансульфонілхлорид, ксипіримідинової сполуки. Повні кількості основ 2-пропансульфонілхлорид трифлуорметансульможуть бути введені у реакційну систему перед фонілфлуорид, трифлуорметансульфонілхлорид початком реакції або після її початку. нонафлуорбутансульфонілфлуорид, тридекафлуРеакцію можна проводити у присутності (або оргексансульфонілфлуорид, гептадекафлуороктабез) розчинника. Розчинник може бути будь-яким нсульфонілфлуорид ункосафлуордекансульфоніза умови, що він не заважає проходженню реакції. лфлуорид бензолсульфонілхлорид, 1Прикладами розчинників є вода, кетони, напринафталінсульфонілхлорид, 2клад, ацетон, метилетилкетон і діетилкетон, етери, нафталінсульфонілхлорид, рнаприклад, діетилетер і ΤΓΦ, естери, наприклад, толуолсульфонілфлуорид, ретилацетат, пропілацетат і бутилацетат, нітрили, толуолсульфонілхлорид 2,4,6наприклад, ацетонітрил і пропюнітрил, аміди, натриметилбензолсульфонілхлорид, 2,4,6приклад, Ν,Ν-ДМФ і N-метилпіролідон, сульфокситриізопропілбензолсульфонілхлорид, рди, наприклад диме-тилсульфоксид, сечовини, метоксибензолсульфонілхлорид, рнаприклад, Ν,Ν'-диметилімідазолінон. Бажаними є хлорбензолсульфонілхлорид і 2ацетон ТГФ етилацетат, бутилацетат, ацетонітрил, нітробензолсульфонілхлорид. Бажаними є трифΝ,Ν-ДМФ і диметилсульфоксид. Більш бажаними є луорметансульфонілфлуорид, бензолсульфонілхетилацетат, бутилацетат і ацетонітрил. Найбільш лорид, 1-нафталінсульфонілхлорид, 2бажаними є бутилацетат і ацетонітрил. Розчиннинафталінсульфонілхлорид, рки можуть бути одиночними або у комбінаціях. толуолсульфонілхлорид, 2,4,6-триметилбензолРозчинник використовують у кількості, бажано, сульфонілхлорид, 2,4,6від 0,01 до 100л, більш бажано, від 0,5 до 5л, на триізопропілбензолсульфонілхлорид, родин моль гідроксипіримідинової сполуки. Ця кільметоксибензолсульфонілхлорид і ркість може варіюватись залежно від гомогенності і хлорбензолсульфонілхлорид. Особливо бажаними дисперсійної здатності реакційної суміші. є р-толуолсуль фонілхлорид, 2,4,6Реакцію можна проводити, вводячи у реакцію триметилбензолсульфонілхлорид, 2,4,6гідроксипіримідинову сполуку і органічний сульфотриізопропілбензолсульфонілхлорид і рнілгалоген або сульфоновий ангідрид у розчинниметоксибензолсульфоніл хлорид. ку у присутності основи з перемішуванням у атмоПрикладами сульфонових ангідридів можуть сфері інертного газу. Основу можна додавати бути метансульфоновий ангідрид, трифлуорметапорціями. Реакцію можна проводити при темперансульфоновий ангідрид, бензолсульфоновий ангітурі, бажано, від -30 до 250°С, більш бажано, від0 дрид і р-толуолсульфоновий ангідрид. Бажаними є до 150°С, і при будь-якому зовнішньому тиску. трифлуорметансульфоновий ангідрид, бензолсуОдержаний продукт реакції, тобто 2-(N-метилльфоновий ангідрид і р-толуолсульфоновий ангідN-метанкарбонсульфоніламіно)-піримідинову спорид. Найбільш бажаними є трифлуорметансульлуку формули (3) можна ізолювати і очистити згідфоновий ангідрид і р-толуолсульфоновий но з звичайними процедурами, наприклад, дистиангідрид. ляцією, кристалізацією, рекристалізацією і Сульфонілгалогенід або сульфоновий ангідколонною хроматографією. рид використовуються у кількості бажано від 0,1 до 2-(N-метил-N20моль, більш бажано, від 0,5 до 5моль, найкраще метансульфоніламіно)піримідинову сполуку форвід 1 до 2моль на один моль гідроксипіримідинової мули (3) і інші піримідинові сполуки формули (8) сполуки. можна приготувати з гідроксипіримідинової сполуУ наступній операції Nки формули (1) і 2-заміщеної піримідинової сполу 15 ки формули (6) операціями (V) і (VI): 77678 16 на варіювати залежно від гомогенності і дисперсійної здатності реакційної суміші. У реакції з використанням сульфонілхлориду або сульфонового ангідриду розчинник можна використовувати у кількості, бажано, від 0,1 до 50л, більш бажано, від 0 5 до 2л на один моль гідроксипіримідинової сполуки. Кількості можна варіювати залежно від гомогенності і дисперсійної здатності реакційної суміші. Реакцію можна реалізувати через реакцію гідроксипіримідинової сполуки і галогенувального агента у розчиннику, з перемішуванням в атмосфері інертного газу при температурі бажано, від 0 до 200°С, більш бажано, від 50 до 120°С, при будь-якому зовнішньому тиску. Реакцію можна реалізувати також через реакУ формулі (8), R має значення, визначене вицію гідроксипіримідинової сполуки і сульфонілгаще, а кожна з R1 і R2 незалежно є атомом гідрогелогеніду або сульфонілового ангідриду у розчинну, алкільною групою, алкілсульфонільною групою нику, перемішуванням в атмосфері інертного газу, або арилсульфонільною групою. при температурі, бажано, від -30 до 200°С, більш Операція (V) бажано від 0 до 50°С, при будь-якому зовнішньому У операції (V) гідроксипіримідинова сполука тиску. формули (1) реагує з галогенувальним агентом, Одержаний продукт реакції, тобто 2-заміщену наприклад, хлоруючим агентом або органічним піримідинову сполуку, наприклад, хлорпіримідиносульфонілгалогенідом формули (2): ву або сульфонілоксипіримідинову сполуку, можна R'SO2 X (2) ізолювати і очистити, використовуючи звичайні де R' має значення, визначене вище, а X є процедури, наприклад, дистиляцію кристалізацію, атомом галогену або органічним сульфоновим рекристалізацію і колонну хроматографію. ангідридом формули (2а): Операція (VI) (R'SO2)2 O (2a) Операцією (VI) 2-заміщену піримідинову споде R' має значення, визначене вище. луку, наприклад, хлорпіримідинову сполуку або Прикладами галогенувальних агентів можуть сульфонілоксипіримідинову сполуку отримують бути фосфорний оксихлорид і тіонілхлорид. Галооперацією (V) через реакцію з аміновою сполукою генувальний агент можна застосовувати одиночно формули (7): або у комбінації, у кількості, бажано від 0 1 до 50моль більш бажано, від 1 до 20моль найкраще (7) від 1 5 до 10моль на один моль гідроксипіримідинової сполуки. де кожна з R1 і R2 має значення, визначене Приклади органічних сульфонілгалогенідів і вище. сульфонових ангідридів були наведені раніше. Прикладами групи R1 і R2 можуть бути атом гіОрганічний сульфонілгалогенід або сульфонодрогену, алкільні групи, наприклад, метил, етил, вий ангідрид можна використовувати у кількості, пропіл, бутил, пентил і гексил; алкілсульфонільні бажано, від 0,1 до 20моль, більш бажано, від 0,5 групи, наприклад, метансульфоніл; і арилсульфодо 5моль, найкраще від 1 до 2моль, на один моль нільні групи, наприклад, бензолсульфоніл і ргідроксипіримідинової сполуки. толуолсульфоніл. Реакцію можна проводити у присутності (або Амінову сполуку можна використовувати у кібез) розчинника, який може бути будь-яким, за лькості, бажано, від 0,1 до 30моль, більш бажано, умови, що він не заважає реакції. Прикладами від 1 до 5моль, на один моль 2-заміщеної піримірозчинників можуть бути ароматичні гідрокарбони, динової сполуки. наприклад, толуол, галогеновані ароматичні гідроРеакцію бажано проводити у присутності оскарбони, наприклад, хлорбензол, нітровані гідронови, приклади якої були наведені вище. карбони, наприклад, нітробензол, галогеновані Основу бажано використовувати у кількості, аліфатичні гідрокарбони, наприклад, метиленхлобажано, від 0,1 до 30моль, більш бажано, від 1 до рид 11,2-дихлоретан, аміди, наприклад, Ν,Ν-ДМФ 5 моль, на один моль 2-заміщеної піримідинової вода (не для галогенувального агента), нітрили, сполуки. Реакцію можна проводити у присутності наприклад ацетонітрил і пропіонітрил, естери кар(або без) розчинника, який може бути будь-яким за бонової кислоти наприклад, етилацетат, пропілаумови, що він не заважає реакції. Прикладами цетат, бутилацетат, кетони наприклад ацетон мерозчинників можуть бути вода; кетони, наприклад, тилетилкетон діетилкетон, і етери наприклад ацетон, метилетилкетон і діетилкетон; етери, надіетилетер і ΤΓΦ. Бажаними є бутилацетат толуол приклад, діетилетер і ТГФ; естери, наприклад, метиленхлорид, ацетонітрил, хлорбензол, нітроетилацетат, пропілацетат і бутилацетат; нітрили, бензол і Ν,Ν-ДМФ. Розчинники можна використонаприклад, ацетонітрил і пропіонітрил; аміди, навувати одиночно або у комбінаціях. приклад, Ν,Ν-ДМФ і N-метилпіролідон; сульфоксиРозчинник у реакціях з галогенувальним агенди, наприклад, диметилсульфоксид; сечовини, том можна використовува ти у кількості бажано, від наприклад, Ν,Ν'-диметилімідазолідинон. Бажани0,01 до 10л, більш бажано, від 0,1 до 2л, на один ми є ацетон, ТГФ, етилацетат, бутилацетат, ацемоль гідроксипіримідинової сполуки Кількості мож 17 77678 18 тонітрил, Ν,Ν-ДМФ і диметилсульфоксид. Особликами Вихід - 85% (від кількості метилізобутирилаво бажаними є етилацетат, бутилацетат і ацетоніцетату) трил. Розчинники можуть використовуватись одитемп. плавл. 223-225°С ночно або у комбінаціях. УФ lmax(CH3CN, нм): 194,3, 278,6 Розчинник можна використовува ти, бажано, ІЧ (KВr, см -1): 3296, 3229, 3137, 2963, 1685, від 0,01 до 100л, більш бажано, від 0,5 до 5л, на 1629, 1504, 1225, 1097 1 один моль 2-заміщеної піримідинової сполуки. КіΉ ЯМР (D MSO-d6, δ (1/млн)) 1,14 (6Н, dd, лькості можна варіювати залежно від гомогенності J=6,8, 6,9Гц), 3,52 (ЗН s), 4,0-4,2 (1Н, m), 5,15 (1Н, і дисперсійної здатності реакційної суміші. d, J=3,4Гц), 7,1-7,2 (2H, m), 7,2-7,3 (2Н, m), 7,76 Реакцію можна реалізувати через реакцію 2(1Н, d, J=3,2Гц) 8,91 (1H s). заміщеної піримідинової сполуки і амінової сполуHRMS 292,1247 (теоретичне значення ки у розчиннику, у присутності основи з перемішу(C15H17FN 2O3(M+)) 292,1223) ванням в атмосфері інертного газу, при темпера[Приклад 2] Отримання 4-(4-флуорфеніл)-6турі, бажано, від -20 до 250°С, більш бажано, від ізопропіл-5-метоксикарбоніл-3,4,2(1Н)25 до 150°С, при будь-якому зовнішньому тиску. дигідропіримідинону Реакцію можна проводити у двох окремих рідПовторюють процедуру Прикладу 1 з заміною ких фазах у присутності каталізатора фазового 200мг (2ммоль) хлориду міді 5,41г (20ммоль) хлопереходу. Прикладами таких каталізаторів є тетридгексагідратом заліза (III), (5,41г, 20ммоль), що раметиламонійхлорид, тетраметиламонійбромід, дає 35,6г 4-(4-флуорфеніл)-6-ізопропіл-5тетраетиламонійфлуорид, тетраетиламонійхлометоксикарбоніл-3,4,2(1Н)-дигідропіримідинону. рид, тетраетиламонійбромід, тетрапропіламонійбВихід - 61% (від кількості метилізобутирилромід, тетрапропіламонійіодид, тетрабутиламоацетату). нійфлуорид, тетрабутиламонійхлорид, [Приклад 3] Отримання 4-(4-флуорфеніл)-2тетрабутиламонійбромід, тетрабутиламонійіодид, гідрокси-6-ізопропіл-5-метоксикарбонілпіримідину тетрапентиламонійбромід, тетрагексиламонійброУ 50-мілілітрову скляну колбу, обладнану пемід, тетрагептиламонійбромід, тетраоктиламонійремішувачем і термометром вносять 11мл бромід, бензилдиметилтетрадециламонійхлорид, (144ммоль) азотної кислоти (60-61%, густина 1 38) бензилтриетиламонійхлорид, фенілтриметиламоі при кімнатній температурі повільно додають 4,00г нійхлорид, фенілтриметиламонійіодид і гексаде(13,7ммоль) 4-(4-флуорфеніл)-6-ізопропіл-5цилтриметиламонійхлорид. Бажаними є тетрабуметоксикарбоніл-3,4,2(1Н)-дигідропіримідинону, тиламонійхлорид, тетрабутиламонійбромід, приготовленого, як у Прикладі 1, і суміш витримутетрабутиламонійіодид, бензилтриетиламонійхлоють протягом 30хв. при кімнатній температурі. Пісрид і гексадецилтриметиламонійхлорид Найбільш ля завершення реакції реакційну суміш нейтралібажаними є тетрабутиламонійбромід бензилтзують доданням 140мл насиченого водного риетиламонійхлорид і гексадецилтриметиламонійрозчину гідрокарбонату натрі. Реакційну суміш хлорид. екстрагують етилацетатом. Органічну рідку частиКаталізатор фазового переходу можна викону відділяють і концентрують під зниженим тиском. ристовувати у кількості від 0,01 до 0,5моль бажаЗалишок кристалізують з толуолу, кристали збино, від 0,05 до 0,2моль, на один моль 2-заміщеноі рають на фільтрі, промивають толуолом і одержупіримідинової сполуки. ють 3 64г 4-(4-флуорфеніл)-2-гідрокси-6-ізопропілОдержаний продукт реакції, тобто 2-(N-метил5-метоксикарбонілпіримідину у вигляді безбарвних N-метансульфоніламіно)піримідинову сполуку фокристалів з наведеними нижче характеристиками. рмули (3) або іншу амінопіримідинову сполуку фоВихід - 92% (від кількості 4-(4-флуорфеніл)-6рмули (8) можна ізолювати і очистити, використоізопропіл-5-метоксикарбоніл-3,4,2(1Н) дигідропівуючи звичайні процедури, наприклад, римідинону). дистиляцію, кристалізацію, рекристалізацію або темп. плавл. 193°С (розкладання) колонну хроматографію. УФ lmax(ΟΗ3 ΟΝ, нм): 196,6, 243,2, 317,9 Винахід ілюструється наведеними далі не обІЧ (KВr, см -1): 2991, 2887, 1717, 1653, 1589, межуючими прикладами. 1433, 1280, 1223. 1 [Приклад 1] Отримання 4-(4-флуорфеніл)-6Н ЯМР (D MSO-d6, δ (1/млн)) 1,23 (6Н, d, ізопропіл-5-метоксикарбоніл-3,4,2(1Н)J=6,8Гц), 3,0-3,2 (1Н, m), 3,56 (3Н, s), 7,3-7,4 (2Н, дигідропіримідинону. m), 7,5-7,6 (2Н, m), 12,25 (1Н, brs). HRMS 290,1054 У 500-мілілітрову скляну колбу, обладнану пе(теоретичне значення (C15H15FN2O 3 (М+)) ремішувачем термометром і конденсатором фле290,1067) гми, вносять 28,8г (0,2моль) метилізобутирилаце[Приклад 4] Отримання 4-(4-флуорфеніл)-2тату 24,8г (0,2моль) 4-флуорбензальдепду, 21,0г гідрокси-6-ізопропіл-5-метоксикарбоніл-піримідину (0,35моль) сечовини, 200мг (2ммоль) хлориду міді У 50-мілілітрову скляну колбу, обладнану пе(і), 2мл сульфурової кислоти і 200мл метанолу. ремішувачем і термометром, вносять 2,92г Вміст колби гріють при 64-65°С 24год. під зворот(10ммоль) 4-(4-флуорфеніл)-6-ізопропіл-5ним холодильником з перемішуванням для провеметоксикарбоніл-3,4,2(1Н)-дигідропіримідинону, дення реакції Утворюється кристалічний осад, приготовленого, як у Прикладі 1, і 5мл оцтової киякий збирають на фільтрувальному папері, промислоти. До суміші повільно додають 3,74мл вають метанолом і одержують 49,7г 4-(4(50ммоль) азотної кислоти (60-61%, густина 1,38). флуорфеніл)-6-ізопропіл-5-метоксикарбонілДо суміші додають 0,07г (1ммоль) нітриту натрію, і 3,4,2(1Н)-дигідропіримідинону у вигляді безбарвреакцію витримують одну год. при кімнатній темних кристалів з наведеними нижче характеристипературі. Після завершення реакції реакційну су 19 77678 20 міш нейтралізують внесенням м у 50мл насиченованням, і реакцію проводять при 40°С протягом го водного розчину гідрокарбонату натрію. Реак4год. Далі реакційну суміш охолоджують до кімнаційну суміш екстрагують етилацетатом. Органічну тної температури і додають 2,84г (26ммоль) Nрідку частину відділяють і концентрують під зниметилметансульфонаміду і 4,15г (30ммоль) карбоженим тиском. Залишок кристалізують з толуолу. нату калію (як раніше). Суміш гріють при 110Кристалічний продукт збирають на фільтрі і про125°С 2год. під зворотним холодильником. Після мивають толуолом, одержуючи 2,61г 4-(4завершення реакції суміш охолоджують до кімнатфлуорфеніл)-2-гідрокси-6-ізопропіл-5ної температурі і додають 25мл води і 20мл ацеметоксикарбонілпіримідин у вигляді безбарвних тону. Органічну рідку частину відділяють, промикристалів. Вихід - 90% (від кількості 4-(4вають насиченим водним розчином хлориду флуорфеніл)-6-ізопропіл-5-метоксикарбонілнатрію і сушать над безводним сульфатом магнію. 3,4,2(1Н)-дигідропіримідинону). Суху органічну рідку частину фільтрують і концен[Приклад 5] Отримання 4-(4-флуорфеніл)-2трують під зниженим тиском Залишок кристалізугідрокси-6-ізопропіл-5-метоксикарбоніл-піримідину ють з гептану і одержують 6,58г 4-(4-флуорфеніл)У 200-мілілітрову скляну колбу, обладнану пе6-ізопропіл-5-метоксикарбоніл-2-(N-метил-Nремішувачем і термометром, вносять 54,0г метансульфоніл-аміно)піримідину у вигляді блідо(735ммоль) азотної кислоти (60-61%, густина 1,38). жовтих кристалів. Вихід - 86% (від кількості 4-(4До азотної кислоти при кімнатній температурі пофлуорфеніл)-2-гідрокси-6-ізопропіл-5вільно додають 30,6г (105ммоль) 4-(4метоксикарбонілпіримідину). флуорфеніл)-6-ізопропіл-5-метоксикарбоніл[Приклад 8] Отримання 4-(4-флуорфеніл)-63,4,2(1Н)-дигідропіримідинону, приготовленого, як ізопропіл-5-метоксикарбоніл-2-([\|-метил-Му Прикладі 1, і суміш залишають на 30хв. при кімметансульфоніламіно)піримідину натній температурі. Після завершення реакції реаУ 1000-мілілітрову скляну колбу, обладнану кційну суміш вливають у 162мл води. Водну суміш перемішувачем, термометром і конденсатором нейтралізують доданням 61г водного розчину гідфлегми, вносять 50,0г (172ммоль) 4-(4роксиду натрію (48%, мас) для осадження кристафлуорфеніл)-2-гідрокси-6-ізопропіл-5-метоксилічного продукту, який збирають фільтруванням, карбонілпіримідину, 20,8г (189ммоль) t-пентоксиду сушать і одержують 27,6г 4-(4-флуор феніл)-2натрію і 344мл ацетонітрилу, і одержану суміш гідрокси-6-ізопропіл-5-метоксикарбонілпіримідину перемішують при 0-10°С 30хв. До суміші повільно у вигляді безбарвних кристалів. Вихід - 91% (від додають 36,1г (189ммоль) ркількості 4-(4-флуорфеніл)-6-ізопропіл-5толуолсульфонілхлориду, і реакцію витримують метоксикарбоніл-3,4,2(1 Н)-дигідропіримідинону). 5год. при кімнатній температурі. Далі реакційну [Приклад 6] Отримання 4-(4-флуорфеніл)-2суміш о холоджують до 0-10°С і додають 28,2г гідрокси-6-ізопропіл-5-метоксикарбоніл-піримідину (258ммоль) N-метилметансульфонаміду і 26,5г У 2-літрову скляну колбу, обладнану перемі(241ммоль) t-пентоксиду натрію. Суміш витримушувачем і термометром, вносять 323,3г (3,09моль) ють при 0-10°С одну год. і потім гріють при 75-82°С азотної кислоти (60-61%, густина 1,38) Концентропротягом 2год. під зворотним холодильником. Пісвану азотну кислоту охолоджують до 10°С і додаля завершення реакції суміш о холоджують до кімють 2,36г (34,2ммоль) нітриту натрію, і потім донатної температури і додають 344мл води. Водну дають повільно 100г (342ммоль) 4-(4суміш о холоджують до 0-10°С і перемішують одну флуорфеніл)-6-ізопропіл-5-метоксикарбонілгод. Кристалічний осад збирають фільтруванням, 3,4,2(1Н)-дигідропіримідинону приготовленого як у сушать і отримують 45,3г 4-(4-флуорфеніл)-6Прикладі 1. Суміш залишають для реакції на 2год. ізопропіл-5-метоксикарбоніл-2-(N-метил-Nпри температурі 10-12°С. Після завершення реакметансульфоніл-аміно)піримідину у вигляді блідоції у реакційну суміш вливають 970мл води. Водну жовтих кристалів. Вихід - 68% (від кількості 4-(4суміш нейтралізують доданням 257г водного розфлуорфеніл)-2-гідрокси-6-ізопропіл-5чину гідроксиду натрію (48% мас) для осадження метоксикарбонілпіримідину). кристалічного продукту, який збирають фільтру[Приклад 9] Отримання 4-(4-флуорфеніл)-6ванням, суша ть і отримують 93,3г 4-(4ізопропіл-5-метоксикарбоніл-2-(N-метил-Nфлуорфеніл)-2-гідрокси-6-ізопропіл-5метансульфоніламіно)піримідину з метилізобутиметоксикарбонілпіримідину у вигляді безбарвних рилацетату, 4-флуорбензальдегіду і сечовини кристалів. Вихід - 94% (від кількості 4-(41) У 200-літрову скляну реакційну посудину, флуорфеніл)-6-ізопропіл-5-метоксикарбонілобладнану перемішувачем термометром і конден3,4,2(1Н)-дигідропіримідинону). сатором флегми вносять 24,4кг (169моль) метил[Приклад 7] Отримання 4-(4-флуорфеніл)-6ізобутирилацетату 20,0кг (161моль) 4ізопропіл-5-метоксикарбоніл-2-(N-метил-[Nфлуорбензальдепду, 16,9кг (282моль) сечовини, метансульфоніламіно)піримідину 0,2кг (2моль) хлориду міді (І) 3,0кг сульфурової У 200-мілілітрову скляну колбу, обладнану пекислоти і 80,4кг метанолу. Суміш гріють при 64ремішувачем, термометром і конденсатором фле66°С протягом 20год. під зворотним холодильнигми вносять 5,81г (20ммоль) 4-(4-флуорфеніл)-2ком. Після завершення реакції реакційну суміш гідрокси-6-ізопропіл-5-метоксикарбонілпіримідину, охолоджують до кімнатної температури Кристаліч3,59г (26ммоль) карбонату калію (від Asahi Glass ний осад збирають на фільтрувальному папері, Works, Co , Ltd , Lot No 1111632, розподілення промивають метанолом і одержують 43,4кг 4-(4розмірів часток 75-250мкм 14% 75мкм 86%) і 40мл флуорфеніл)-6-ізопропіл-5-метоксикарбонілбутилацетату. До суміші повільно додають 4,19г 3,4,2(1Н)-дигідропіримідинону у вигляді безбарв(22ммоль) р-толуолсульфонілхлориду з перемішуних кристалів. 21 77678 22 2) У 200-літрову скляну реакційну посудину, тягом 1,5год. під зворотним холодильником. Після обладнану перемішувачем і термометром вносять завершення реакції реакційну суміш охолоджують 62,5кг (615,6моль) розбавленої азотної кислоти і до кімнатної температури і вливають у суміш 0,5кг (6,8моль) нітриту натрію. До суміші повільно льод/вода. Одержану водну суміш нейтралізують додають з охолодженням 20,0кг (68,4ммоль) 4-(4насиченим водним розчином гідрокарбонату нафлуорфеніл)-6-ізопропіл-5-метоксикарбонілтрію Нейтралізовану водну суміш екстрагують 3,4,2(1Н)-дигідропіримідинону, приготовленого, як етилацетатом. Етилацетатну частину відділяють, описано вище. Одержану суміш ви тримують при промивають насиченим водним розчином хлориду низькій температурі (10°С). Після завершення реанатрію і сушать над безводним сульфатом магнію. кції реакційну суміш нейтралізують доданням водВисушен у етилацетатну частину фільтрують, коннометанольного розчину гідроксиду натрію. Далі центрують під зниженим тиском і одержують 1,03г до суміші додають водний розчин гідроксиду на2-хлор-4-(4-флуор феніл)-6-ізопропіл-5трію. Одержану суміш піддають зниженому тиску метоксикарбонілпіримідину у вигляді безбарвних для видалення метанолу. До залишку додають кристалів з наведеними нижче характеристиками. 96,5кг ацетону і 96,5кг води. Водний залишок нейВихід - 97% (від кількості 4-(4-флуорфеніл)-2тралізують доданням оцтової кислоти. Кристалічгідрокси-6-ізопропіл-5-метоксикарбонілпіримідину). ний осад збирають на фільтрувальному папері, темп. плавл.: 99-101 °С промивають сумішшю ацетон/вода і отримують УФ lmax(CH2CN, нм): 194,7, 276,5 17,9кг 4-(4-флуорфеніл)-2-гідрокси-6-ізопропіл-5ІЧ (KВr, см -1): 2980, 1728, 1542, 1508, 1227, метоксикарбонілпіримідину. 1086 1 3) У 200-літрову скляну реакційну посудину, Н ЯМР (DMSO-d6, δ (1/млн)): 1,33 (6Н, d, обладнану перемішувачем, термометром і конJ=6,8Гц), 3,1-3,2 (1Н, m), 3,76 (3Н, s), 7,15 (2Н, t, денсатором флегми, вносять 17,9кг (62,0моль) 4J=8,5Гц), 7,6-7,7 (2H, m). (4-флуорфеніл)-2-гідрокси-6-ізопропіл-5HRMS: 308,0695 (теоретичне значення метоксикарбонілпіримідину, приготовленого, як (C15H14C1FN2O 2 (M+)) 308,0728) описано вище, 107,7кг бутилацетату, 11,1кг [Приклад 11] Отримання 2-хлор-4-(4(80,3моль) карбонату калію (від Asahi Glass Works, флуорфеніл)-6-ізопропіл-5-метоксикарбонілCo , Ltd , Lot No 1111632, розподілення розмірів піримідину часток 75-250мкм - 14%, 75мкм - 86%) і 12,9кг У 25-мілілітрову скляну колбу, обладнану пе(67,7моль) р-толуолсульфонілхлориду. Суміш гріремішувачем, термометром і конденсатором флеють при 60°С протягом 2год. потім реакційну суміш гми, вносять 1,00г (3,43ммоль) 4-(4-флуорфеніл)охолоджують до кімнатної температури. До охоло2-гідрокси-6-ізопропіл-5-метоксидженої суміші додають 8,8кг (80,6моль) Νкарбонілпіримідину, 0,5мл (3,9ммоль) тіонілхлориметилметансульфонаміду і 12,9кг (93,3моль) карду, 3,44мл толуолу і 0,11мл Ν,Ν-ДМФ Суміш гріють бонат калію, і одержану суміш гріють при 122при 80°С протягом 3год. і після завершення реакції 125°С 3год. Після завершення реакції реакційну реакційну суміш охолоджують до кімнатної темпесуміш охолоджують до кімнатної температури, ратурі і вливають у суміш льод/вода. Одержану додають ацетон і воду, органічну рідку частину водну суміш нейтралізують насиченим водним відділяють і промивають водним розчином гідророзчином гідрокарбонату натрію. Нейтралізовану ксиду натрію (3% мас) і потім насиченим водним водну суміш екстрагують етилацетатом, етилацерозчином хлориду натрію. Промиту органічну рідку татну частину відділяють, промивають насиченим частину концентрують під зниженим тиском і до водним розчином хлориду натрію і сушать над кристалічного залишку додають ізопропіловий безводним сульфатом магнію. Висушену етилацеспирт і воду. Кристали фільтрують на фільтрувататну частин у фільтрують, концентрують під знильному папері і промивають ізопропіловим спирженим тиском і одержують 0,80г 2-хлор-4-(4том. Промитий кристалічний продукт і 85,7кг ацефлуорфеніл)-6-ізопропіл-5тону вносять у 200-літрову скляну реакційну метоксикарбонілпіримідину у вигляді безбарвних посудину, обладнану перемішувачем, термометкристалів. Вихід - 76% (від кількості 4-(4ром і конденсатором флегми. Суміш перемішують флуорфеніл)-2-гідрокси-6-ізопропіл-5при 50-55°С до розчинення кристалів в ацетоні. метоксикарбонілпіримідину). Нерозчинений матеріал видаляють фільтруван[Приклад 12] Отримання 4-(4-флуорфеніл)-6ням. Далі до розчину додають 58,3кг води для ізопропіл-5-метоксикарбоніл-2-(N-метил-Nосадження кристалічного продукту, який збирають метансульфоніламіно)піримідину на фільтрувальному папері, промивають сумішшю У 25-мілілітрову скляну колбу, обладнану пеацетон/вода і отримують 19,5кг 4-(4-флуорфеніл)ремішувачем, термометром і конденсатором фле6-ізопропіл-5-метоксикарбоніл-2-(N-метил-Nгми, вносять 546мг (5ммоль) Nметансульфоніламіно)піримідину. метилметансульфонаміду, 551мг (5ммоль) t[Приклад 10] Отримання 2-хлор-4-(4пентоксиду натрію, 10мл ацетонітрилу і 309мг флуорфеніл)-6-ізопропіл-5-метоксикарбоніл(1ммоль) 2-хлор-4-(4-флуорфеніл)-6-ізопропіл-5піримідину метоксикарбонілпіримідину, і суміш гріють при 81У 200-мілілітрову скляну колбу, обладнану пе82°С протягом 3год. під зворотним холодильниремішувачем, термометром і конденсатором флеком. Після завершення реакції реакційну суміш гми, вносять 1,00г (3,43ммоль) 4-(4-флуорфеніл)охолоджують до кімнатної температури і додають 2-гідрокси-6-ізопропіл-5-метокси10мл води. Водну суміш екстрагують етилацетакарбонілпіримідину і 3,4мл (3,7ммоль) фосфорнотом, етилацетатну частин у відділяють і сушать над го оксихлориду і суміш гріють при 100-106°С пробезводним сульфатом магнію. Висушений матері 23 77678 24 ал фільтрують і концентрують під зниженим тисфлуорфеніл)-2-гідрокси-6-ізопропіл-5ком Залишок очищують силікагелевою колонною метоксикарбонілпіримідину). хроматографією (колонка Wako Gel С-200, елюент темп. плавл.: 94-96°С гексан/етилацетат (2:1 (об'єм/об'єм)) і одержують УФ lmax(CH3CN, нм): 194,9, 275,2 339мг 4-(4-флуорфеніл)-6-ізопропіл-5ІЧ (KВr, см -1)): 2961, 1734, 1539, 1389, 1352, метоксикарбоніл-2-(N-метил-N1247, 1090, 980 1 метансульфоніламіно)піримідину. Вихід - 89% (від Н ЯМР (CDCI3, δ (1/млн)): 1,23 (6Н, d, кількості 2-хлор-4-(4-флуорфеніл)-6-ізопропіл-5J=6,8Гц), 2,45 (ЗН, s), 3,0-3,2 (1Н, m), 3,74 метоксикарбонілпіримідину). (J=8,5Гц). [Приклад 13] Отримання 4-(4-флуорфеніл)-6HRMS: 444,1155 (теоретичне значення ізопропіл-5-метоксикарбоніл-2-метан(C32H21FN 2O5S (M+)) 444,1194). сульфонілоксипіримідину [Приклад 15] Отримання 4-(4-флуорфеніл)-6У 100-мілілітрову скляну колбу вносять 10,0г ізопропіл-5-метоксикарбоніл-2-бензол(34,4ммоль) 4-(4-флуорфеніл)-2-гідрокси-6сульфонілоксипіримідину ізопропіл-5-метоксикарбонілпіримідину, 5,22г Повторюють процедуру Прикладу 13 з заміною (58,5ммоль) триетиламіну і 34мл ацетонітрилу. р-толуолсульфонілхлориду бензолсульфонілхлоСуміш охолоджують до 0-5°С у льодяній ванні. До ридом (18,5г, 105ммоль) і одержують 39,3г 4-(4охолодженої суміші повільно додають 5,12г флуорфеніл)-6-ізопропіл-5-метоксикарбоніл-2(44,7ммоль) метансульфонілхлориду і одержану бензолсульфонілоксипіримідин у вигляді блідосуміш витримують при 20-25°С протягом 2год. Пісжовтих кристалів з наведеними нижче характерисля завершення реакції до реакційної суміші додатиками. Вихід - 96% (від кількості 4-(4ють 60мл води. Водну реакційну суміш екстрагуфлуорфеніл)-2-гідрокси-6-ізопропіл-5ють толуолом і толуольну частину відділяють, метоксикарбонілпіримідину). 1 промивають насиченим водним розчином хлориду Н ЯМР (CDCI3, δ (1/млн)): 1,21 (6Н, d, натрію і сушать над безводним сульфатом магнію. J=6,4Гц), 3,0-3,1 (1Н, m), 3,73 (ЗН, s), 7,1-7,2 (2Н, Висушен у суміш фільтрують і концентрують під m), 7,5-7,7 (5Н, m), 8,1-8,2 (2Н, m). зниженим тиском. Залишок кристалізують з мета[Приклад 16] Отримання 4-(4-флуорфеніл)-6нолу і отримують 11,3г 4-(4-флуор феніл)-6ізопропіл-5-метоксикарбоніл-2-(2,4,6ізопропіл-5-метоксикарбоніл-2триметилбензолсульфонілокси)піримідин метансульфонілоксипіримідину у вигляді безбарвПовторюють процедуру Прикладу 13 з заміною них кристалів з наведеними нижче характеристир-толуолсульфонілхлориду 2,4,6ками. Вихід - 89% (від кількості 4-(4-флуорфеніл)триметилбензолсульфонілхлоридом (23,0г, 2-гідрокси-6-ізопропіл-5105ммоль) і одержують 37,7г 4-(4-флуор феніл)-6метоксикарбонілпіримідину). ізопропіл-5-метоксикарбоніл-2-(2,4,6темп. плавл.: 110-111°С триметилбензолсульфонілокси)піримідину у виУФ lmax(CH3CN, нм): 193,7, 276,8 гляді блідо-жовтих кристалів з наведеними нижче ІЧ (KВr, см -1): 2980, 1724, 1562, 1391, 1250, характеристиками. Вихід - 84% (від кількості 4-(41175, 1079, 971 флуорфеніл)-2-гідрокси-6-ізопропіл-51 H ЯМР (CDCI3, δ (1/млн)): 1,33 (6Н, d, метоксикарбонілпіримідину). 1 J=6,6Гц), 3,20 (1Н, m), 3,60 (ЗН, s), 7 1-7,2 (2Н, s), Н ЯМР (СРСІ3, δ (1/млн)): 1,17 (6Н, d, 7,6-7,8 '(2Н, m) J=6,8Гц), 2,34 (3Н, s), 2,67 (6Н, s) 3,0-3,1 (1Н, m), HRMS: 368,0842 (теоретичне значення 3,73 (3Н, s), 7,00 (2Н, s), 7,0-7,2 (2Н, m), 7,4-7,5 (C13H17FN 2O5S (M+)) 368,0892) (2Н, m) [Приклад 14] Отримання 4-(4-флуорфеніл)-6[Приклад 17] Отримання 4-(4-флуорфеніл)-6ізопропіл-5-метоксикарбоніл-2-(різопропіл-5-метоксикарбоніл-2-(2,4,6толуолсульфонілокси)піримідину триізопропілбензолсульфонілокси)піримідину У 200-мілілітрову скляну колбу вносять 27,6г Повторюють процедуру Прикладу 13 з заміною (95,1ммоль) 4-(4-флуорфеніл)-2-гідрокси-6р-толуолсульфонілхлориду 2,4,6ізопропіл-5-метоксикарбонілпіримідину, 12,5г триізопропілбензолсульфонілхлоридом (31,8г, (123ммоль)триетиламіну і 95мл ацетонітрилу. Су105ммоль) і одержують 47,1г 4-(4-флуор феніл)-6міш охолоджують до 0-5°С у льодяній ванні і повіізопропіл-5-метоксикарбоніл-2-(2,4,6льно додають 20,0г (105ммоль) ртриізопропілбензолсульфонілокси)-піримідину у толуолсульфонілхлориду. Одержану суміш витривигляді блідо-жовтих кристалів з наведеними нижмують при 20-25°С протягом 1год. і після заверче характеристиками. Вихід - 89% (від кількості 4шення реакції до реакційної суміші додають 95мл (4-флуорфеніл)-2-гідрокси-6-ізопропіл-5води. Водну реакційну суміш екстрагують толуометоксикарбонілпіримідину). 1 лом, толуольну частину відділяють, промивають з Н ЯМР (CDCI3, δ (1/млн)): 1,12 (6Н, d, насиченим водним розчином хлориду натрію і суJ=6,6Гц), 1,19 (12Н, d, J=6,8Гц), 1,27 (6H, d, шать над безводним сульфатом магнію. Висушену J=7,1Гц), 2,8-2,95 (1H, m), 2,95-3,1 (1Н, m), 3,73 суміш фільтрують і концентрують під зниженим (3Н, s), 4,1-4,3 (2Н, m), 7,0-7,1 (2Н, m), 7,20 (2Н, s), тиском Залишок кристалізують з метанолу і отри7,4-7,5 (2Н, m). мують 35,9г 4-(4-флуорфеніл)-6-ізопропіл-5[Приклад 18] Отримання 4-(4-флуорфеніл)-6метоксикарбоніл-2-(різопропіл-5-метоксикарбоніл-2-(ртолуолсульфонілокси)піримідину у вигляді безбаметоксибензолсульфонілокси)піримідину рвних кристалів з наведеними нижче характерисПовторюють процедуру Прикладу 13 з заміною тиками. Вихід - 85% (від кількості 4-(4р-толуолсульфонілхлориду р 25 77678 26 метоксибензолсульфонілхлоридом (21,7г, сан/етилацетат (2:1, за об'ємом) і одержують 105ммоль) і одержують 39,9г 4-(4-флуор феніл)-6428мг 4-(4-флуорфеніл)-6-ізопропіл-5ізопропіл-5-метоксикарбоніл-2-(рметоксикарбоніл-2-(N-метил-Nметоксибензолсульфонілокси)піримідину у вигляді метансульфоніламіно)піримідину.Вихід - 75% (від безбарвних кристалів з наведеними нижче хараккількості 4-(4-флуорфеніл)-6-ізопропіл-5теристиками. Вихід - 91% (від кількості 4-(4метоксикарбоніл-2-(рфлуорфеніл)-2-гідрокси-6-ізопропіл-5толуолсульфонілокси)піримідину) метоксикарбонілпіримідину). [Приклад 22] Отримання (2-аміно-4-(41 Н ЯМР (CDCI3l δ (1/млн)): 1,25 (6Н, d, флуорфеніл)-6-ізопропіл-5-метоксикарбонілJ=6,8Гц), 3,0-3,2 (1Н, m), 3-,74 (3Н, s), 3,88 (ЗН, s), піримідину 6,99 (2Н, dd, J=2,0, 9,0Гц), 7,0-7,2 (2Н, m), 7,5-7,7 У 25-мілілітрову скляну колбу, обладнану пе(2Н, m), 8,07 (2Н, dd, J=2,2, 9,0Гц). ремішувачем, термометром і вхідним отвором для [Приклад 19] Отримання 4-(4-флуорфеніл)-6газу, вносять, охолоджуючи льодом, 1,00г ізопропіл-5-метоксикарбоніл-2-(р-хлор(2,71ммоль) 4-(4-флуорфеніл)-6-ізопропіл-5бензолсульфонілокси)піримідину метоксикарбоніл-2-метансульфонілоксипіримідину Повторюють процедуру Прикладу 13 з заміною і 8,1мл ТГФ. Суміш перемішують при кімнатній р-толуолсульфонілхлориду ртемпературі протягом 12год. у газоподібному амохлорбензолсульфонілхлоридом (22,2г, 105ммоль) і нії. Після завершення реакції до реакційної суміші одержують 39,9г 4-(4-флуорфеніл)-6-ізопропіл-5додають 10мл води і водну суміш екстрагують тометоксикарбоніл-2-(рлуолом. Толуольну частину відділяють, промивахлорбензолсульфонілокси)піримідину у вигляді ють з насиченим водним розчином хлориду натрію безбарвних кристалів з наведеними нижче харакі сушать над безводним сульфатом магнію. Висутеристиками. Вихід - 89% (від кількості 4-(4шений матеріал фільтрують і концентрують під флуорфеніл)-2-гідрокси-6-ізопропіл-5зниженим тиском Залишок очищують силікагелеметоксикарбонілпіримідину). вою колонною хроматографією (колонка Wako Gel 1 Н ЯМР (CDCI3, δ (1/млн)): 1,23 (6Н, d, C-200 елюент гексан/етилацетат (2:1, за об'ємом)) J=6,6Гц), 3,0-3,2 (1Н, m), 3,74 (3Н, s), 7,1-7,2 (2Н, і одержують 0,63г 2-аміно-4-(4-флуорфеніл)-6m), 7,5-7,7 (4Н, m), 8,0-8,1 (2Н, m). ізопропіл-5-метоксикарбонілпіримідину. Вихід [Приклад 20] Отримання 4-(4-флуорфеніл)-680% (від кількості 4-(4-флуорфеніл)-6-ізопропіл-5ізопропіл-5-метоксикарбоніл-2-(2-нітрометоксикарбоніл-2-метансульфонілоксипіримідин)бензолсульфонілокси)піримідину 6-ізопропіл-5-метоксикарбонілпіримідину. Повторюють процедуру Прикладу 13 з заміною [Приклад 23] Отримання (4-(4-флуорфеніл)-6р-толуолсульфонілхлориду 2ізопропіл-5-метоксикарбоніл-2-Nнітробензолсульфонілхлоридом (23,3г, 105ммоль) метиламінопіримідину і одержують 28,0г 4-(4-флуорфеніл)-6-ізопропіл-5У 50-мілілітрову скляну колбу, обладнану пеметоксикарбоніл-2-(2ремішувачем термометром і крапельною трубкою, нітробензолсульфонілокси)піримідину у вигляді вносять 6,00г (16,3ммоль) 4-(4-флуорфеніл)-6непрозорих кристалів з наведеними нижче харакізопропіл-5-метоксикарбоніл-2теристиками. Вихід - 62% (від кількості 4-(4метансульфонілоксипіримідину. У колбу повільно флуорфеніл)-2-гідрокси-6-ізопропіл-5краплями, охолоджуючи льодом додають 5,06г метоксикарбонілпіримідину). (65,2ммоль) водного 40%-го (мас) метиламінового 1 Н ЯМР (CDCI3, δ (1/млн)): 1,17 (6Н, d, розчину. Одержану суміш перемішують 1год. при J=6,8Гц), 3,0-3,2 (1Н, m), 3,75 (3Н, s), 7,1-7,2 (2Н, тій же температурі і після завершення реакції доm), 7,5-7,6 (2Н, m), 7,7-8,0 (3Н, m), 8,33 (1Н, dd, дають 16мл води. Водну суміш екстрагують з тоJ=1,7, 8,1Гц). луолом, толуольну частину відділяють, промива[Приклад 21] Отримання 4-(4-флуорфеніл)-6ють насиченим водним розчином хлориду натрію і ізопропіл-5-метоксикарбоніл-2-(N-метил-Nсушать над безводним сульфатом магнію. Висуметансульфоніламіно)піримідину шений матеріал фільтрують і концентрують під У 25-мілілітрову скляну колбу, обладнану пезниженим тиском і отримують 4,81г 4-(4ремішувачем, термометром і конденсатором флефлуорфеніл)-6-ізопропіл-5-метоксикарбоніл-2-Nгми, вносять 196мг (1,8ммоль) Nметиламінопіримідину. Вихід - 97% (від кількості 4метилметансульфонаміду, 198мг (1,8ммоль) t(4-флуорфеніл)-6-ізопропіл-5-метоксикарбоніл-2пентоксиду натрію, 7,5мл ацетонітрилу і 667мг метансульфонілоксипіримідину). (1,5ммоль) 4-(4-флуорфеніл)-6-ізопропіл-5[Приклад 24] Отримання 4-(4-флуорфеніл)-6метоксикарбоніл-2-(різопропіл-5-метоксикарбоніл-2толуолсульфонілокси)піримідину. С уміш гріють трифлуорметансульфонілоксипіримідину при 81-82Х протягом 1,5год. під зворотним холоУ 300-мілілітрову скляну колбу, обладнану педильником і після завершення реакції реакційну ремішувачем, термометром і конденсатором флесуміш охолоджують до кімнатної температури. До гми, вносять 8,7г (30,0ммоль) 4-(4-флуорфеніл)-2охолодженої суміші додають 10мл води, і водну гідрокси-6-ізопропіл-5-метокси-карбонілпіримідину, суміш екстрагують етилацетатом. Етилацетатну 3,0г (30,0ммоль) триетиламіну і 150мл толуолу. частину відділяють і суша ть над безводним сульСуміш у колбі охолоджують до 0°С у льодяній ванфатом магнію Висушений матеріал фільтрують і ні і до охолодженої суміші повільно додають 8,46г концентрують під зниженим тиском. Залишок очи(30,0ммоль) трифлуорметансульфонового ангідщують силікагелевою колонною хроматографією риду. Одержану суміш витримують для реакції (колонка Wako Gel C-200, елюент гек3год. при тій же температурі і після завершення 27 77678 28 реакції до реакційної суміші додають 90мл води. З Суміш гріють при 122-125°С протягом 3год. під водної реакційної суміші відділяють рідку органічну зворотним холодильником і після завершення реачастину, яку потім концентрують під зниженим кції реакційну суміш о холоджують до кімнатної тиском. Залишок очищують силікагелевою колонтемператури. До реакційної суміші додають 10мл ною хроматографією (колонка Wako Gel C-200, води і 7мл ацетону і органічну рідку частину віддіелюент: гексан/ етилацетат (8:2, за об'ємом)) і ляють, промивають насиченим водним розчином одержують 8,46г 4-(4-флуорфеніл)-6-ізопропіл-5хлориду натрію і концентрують під зниженим тисметоксикарбоніл-2ком. Залишок очищують силікагелевою колонною трифлуорметансульфонілоксипіримідину з навехроматографією (колонка Wako Gel C-200, елюент: деними нижче характеристиками, у вигляді безбагексан/етилацетат (5:1, за об'ємом)) і одержують рвного масла. Вихід - 74% (від кількості 4-(42,1г 4-(4-флуорфеніл)-6-ізопропіл-5флуорфеніл)-2-гідрокси-6-ізопропіл-5метоксикарбоніл-2-(N-метил-Nметоксикарбонілпіримідину). метансульфоніламіно)піримідину у вигляді білих ІЧ (KВr, см -1): 3421, 2978, 1737, 1570, кристалів. Вихід - 78% (від кількості 4-(41429,1222, 1136, 973, 851 флуорфеніл)-6-ізопропіл-5-метоксикарбоніл-21 Н ЯМР (CDCI3, δ (1/млн)): 1,33 (6Н, d, трифлуорметансульфонілоксипіримідину). J=6,6Гц), 3,1-3,2(1 Η, m), 3,80 (3Η, s), 7,1-7,2 (2Н, [Приклад 27] Отримання 4-(4-флуорфеніл)-6m), 7,7-7,8 (2Н, m). ізопропіл-5-метоксикарбоніл-2-(N-метил-NHRMS: 422,0585 (теоретичне значення метансульфоніламіно)піримідину (C16H14F 4N2O 5S (M+)) 422,0560) У 50-мілілітрову скляну колбу, обладнану пе[Приклад 25] Отримання 4-(4-флуорофеніл)-6ремішувачем, термометром і конденсатором флеізопропіл-5-метоксикарбоніл-2гми, вносять 1,1г (2,5ммоль) 4-(4-флуорфеніл)-6трифлуорметансульфонілоксипіримідин ізопропіл-5-метоксикарбоніл-2-(рУ 300-мілілітрову скляну колбу, обладнану петолуолсульфонілокси)піримідину, 0,55г (5,0ммоль) ремішувачем, термометром і конденсатором флеN-метилметансульфонаміду, 0,69г (5,0ммоль) каргми, вносять 2,9г (10,0ммоль) 4-(4-флуорфеніл)-2бонату калію (від Wako Junyaku Co., Ltd., спеціагідрокси-6-ізопропіл-5-метоксикарбонілпіримідину, льний сорт), 0,32г (1,0ммоль) тетрабутиламонійб1,7г (16,8ммоль) триетиламіну і 50мл толуолу. роміду, 20мл толуолу і 5мл води. Суміш гріють при Суміш у колбі охолоджують до 0°С у льодяній ван85°С протягом 28год. під зворотним холодильнині і до охолодженої суміші повільно додають 2,4г ком і після завершення реакції реакційну суміш (14,1ммоль) трифлуорметансульфонілхлориду, і охолоджують до кімнатної температури. До реакодержану суміш витримують для реакції 3год. при ційної суміші додають 10мл води і 7мл ацетону, і тій же температурі. Після завершення реакції до органічну рідку частину відділяють і аналізують реакційної суміші додають 30мл води і водної реарідинною хроматографією високого розрізнення, кційної суміші відбирають органічну рідку частину, яка підтверджує одержання 0,6г 4-(4-флуорфеніл)яку потім концентрують під зниженим тиском. За6-ізопропіл-5-метокси-карбоніл-2-(N-метил-Nлишок очищують силікагелевою колонною хромаметан-сульфоніламіно)піримідину. Вихід - 63% (від тографією (колонка Wako Gel C-200, елюент: геккількості 4-(4-флуорфеніл)-6-ізопропіл-5-метоксисан/етилацетат (8:2, за об'ємом)) і одержують 2,8г карбоніл-2-(р-толуолсульфонілокси)піримідину). 4-(4-флуорфеніл)-6-ізопропіл-5-метоксикарбоніл-2Промислове застосування трифлуорметансульфонілоксипіримідину з навеПіримідинова сполука, зокрема 2-(N-метил-Nденими нижче характеристиками, у вигляді безбаметансульфоніламіно)піримідинова сполука, прирвного масла. Вихід - 66% (від кількості 4-(4готовлена згідно з винаходом, має цінність як інфлуорфеніл )-2-гідрокси-6-ізопропіл-5термедіат для одержання агента, знижуючого хометоксикарбонілпіримідину). лестерин (агент редуктаза HMG-CoA). Сполука [Приклад 26] Отримання 4-(4-флуорфеніл)-6формули (3) може бути перетворена в інгібітор ізопропіл-5-метоксикарбоніл-2-(N-метил-Nредуктази HMG-CoA використанням процесу, опиметансульфоніламіно)піримідину саного [у П ублікації заявки на Європейський паУ 50-мілілітрову скляну колбу, обладнану петент No.0521471, Bioorg. Med. Chem., 5, 437 (1997) ремішувачем, термометром і конденсатором флеі у Заявці No.WO 00/49014]. Ці документи включені гми, вносять 3,0г (7ммоль) 4-(4-флуорфеніл)-6у цей опис посиланням для пояснення, як сполука ізопропіл-5-метоксикарбоніл-2формули (3) або формули (8) може бути перетвотрифлуорметансульфонілоксипіримідину, 1,45г рена в інгібітор редуктази HMG-CoA, зокрема, у (10,5ммоль) карбонату калію (від Wako Junyaku розувастатин або його фармацевтично прийнятну Co., Ltd., спеціального сорту) і 14мл бутилацетату. сіль, наприклад, розувастинин кальцію. Комп’ютерна в ерстка Т. Чепелев а Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparation of aminopyrimidine compounds, intermediary compound (variants), a process for preparation thereof (variants)
Назва патенту російськоюСпособ получения аминопиримидиновых соединений, промежуточное соединение (варианты), способ его получения (варианты)
МПК / Мітки
МПК: C07D 239/30, C07D 239/69, C07D 239/22, C07D 239/36, C07D 239/34, C07D 239/42
Мітки: варіанти, сполук, проміжна, отримання, амінопіримідинових, сполука, спосіб
Код посилання
<a href="https://ua.patents.su/14-77678-sposib-otrimannya-aminopirimidinovikh-spoluk-promizhna-spoluka-varianti-sposib-otrimannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання амінопіримідинових сполук, проміжна сполука (варіанти), спосіб її отримання (варіанти)</a>
Попередній патент: Спосіб вирощування картоплі
Наступний патент: Екологічно чистий спосіб одержання енергії з вугілля
Випадковий патент: Стріляючий пристрій












