Похідні 1-(d-глюкопіранозил)-3-(4-циклопропілфенілметил)-4-галогеноіндолу та їх застосування як інгібіторів sglt
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятна сіль:
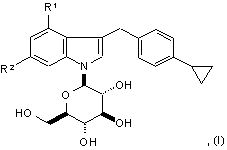
де R1 є фтором або хлором та R2 є воднем або фтором.
2. Сполука за п. 1, де R1 є фтором та R2 є воднем, або R1 є хлором та R2 є воднем, або R1 та R2 обидва є фтором.
3. Сполука за п. 1,де R2 є воднем.
4. Сполука за п. 1, де сполуку вибирають з групи, яка складається з:
4-хлор-3-(4-циклопропілфенілметил)-1-(β-D-глюкопіранозил)індолу,
3-(4-циклопропілфенілметил)-4-фтор-1-(β-D-глюкопіранозил)індолу,
4-хлор-3-(4-циклопропілфенілметил)-6-фтор-1-(β-D-глюкопіранозил)індолу та
3-(4-циклопропілфенілметил)-4,6-дифтор-1-(β-D-глюкопіранозил)індолу
або їх фармацевтично прийнятних солей.
5. Фармавцевтична композиція, яка містить сполуку за п. 1 та фармацевтично прийнятний носій або розчинник.
6. Фармацевтична композиція за п. 5, яка додатково містить інший антидіабетичний агент.
7. Сполука за п. 1 для застосування як активної терапевтичної речовини.
8. Застосування сполуки за п. 1 для виробництва медикаменту для лікування розладів, вибраних з цукрового діабету, діабетичної ретинопатії, діабетичної невропатії, діабетичної нефропатії, уповільнення заживления ран, інсулінорезистентності, гіперглікемії, гіперінсулінемії, підвищеного рівня жирних кислот у крові, підвищеного рівня гліцерину у крові, гіперліпідемії, ожиріння, гіпертригліцеридемії, Синдрому X, діабетичних ускладнень, атеросклерозу та гіпертензії.
9. Спосіб лікування або затримки розвитку, або появи цукрового діабету, діабетичної ретинопатії, діабетичної невропатії, діабетичної нефропатії, уповільнення заживления ран, інсулінорезистентності, гіперглікемії, гіперінсулінемії, підвищеного рівня жирних кислот у крові, підвищеного рівня гліцерину у крові, гіперліпідемії, ожиріння, гіпертригліцеридемії, Синдрому X, діабетичних ускладнень, атеросклерозу та гіпертензії, при якому вводять ссавцю, що потребує лікування, терапевтично ефективну кількість сполуки за п. 1.
10. Спосіб лікування цукрового діабету типу І та II, при якому вводять ссавцю, що потребує лікування, терапевтично ефективну кількість сполуки за п. 1 окремо або у комбінації з іншим антидіабетичним агентом, агентом для лікування діабетичних ускладнень, агентом проти ожиріння, антигіпертензивним агентом, антитромбоцитарним агентом, антиатеросклеротичним агентом та/або гіполіпідемічним агентом.
11. Спосіб одержання сполуки наступної формули:
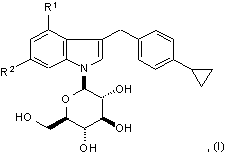
де R1 є фтором або хлором та R2 є воднем або фтором, або її фармацевтично прийнятної солі,
при якому знімають захисні групи сполуки формули (II):
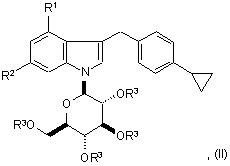
де R3 є захисною групою для гідроксильної групи та інші символи мають значення, як визначено вище,
після чого, у разі необхідності, отриману сполуку перетворюють на її фармацевтично прийнятну сіль.
12. Сполука формули (II):

де R1 є фтором або хлором, R2 є воднем або фтором та R3 є захисною групою для гідроксильної групи,
або її фармацевтично прийнятна сіль.
Текст
1. Сполука формули (І) або її фармацевтично прийнятна сіль: C2 2 (19) 1 3 92100 де R3 є захисною групою для гідроксильної групи та інші символи мають значення, як визначено вище, після чого, у разі необхідності, отриману сполуку перетворюють на її фармацевтично прийнятну сіль. 12. Сполука формули (II): R1 R1 N R2 OH O HO 4 OH , (I) OH де R1 є фтором або хлором та R2 є воднем або фтором, або її фармацевтично прийнятної солі, при якому знімають захисні групи сполуки формули (II): R1 N R2 O R3O OR3 OR3 , (II) OR3 2 де R є фтором або хлором, R є воднем або фтором та R3 є захисною групою для гідроксильної групи, або її фармацевтично прийнятна сіль. 1 N R2 OR3 O R3O OR3 OR3 , (II) Даний винахід стосується нових похідних індолу, які проявляють активність як інгібітори натрій-залежного транспортеру глюкози (SGLT) у кишечнику та нирках. При лікуванні цукрового діабету зазвичай призначають дієтотерапію та лікувальну фізкультуру. У разі коли це лікування недостатньо контролює стан пацієнта, застосовують інсулін або антидіабетичні агенти. Приклади анти-діабетичних агентів включають бігуаніди, сульфонілсечовини, сенсибілізатори інсуліну та інгібітори -глюкозидази. Однак ці анти-діабетичні агенти мають багато побічних ефектів. Наприклад, бігуаніди викликають лактоацидоз, сульфонілсечовини викликають значну гіпоклікемію, сенсибілізатори інсуліну викликають набряк та серцеву недостатність, та інгібітори -глюкозидази викликають здуття живота та діарею. При таких обставинах потрібні нові антидіабетичні агенти, які не будуть викликати таких побічних ефектів. Нещодавно виявили, що гіперглікемія приймає участь у виникненні та розвитку цукрового діабету. Цю теорію називають теорією глюкозотоксичності. Тобто хронічна гіперглікемія призводить до зменшення секреції інсуліну та чуттєвості до інсуліну, рівень глюкози у плазмі є підвищеним та у результаті цукровий діабет погіршується [cf., Diabetologia, vol. 28, p. 119 (1985); Diabetes Care, vol. 13, p. 610 (1990), etc.]. З огляду на цю теорію очікується, що нормалізація рівня глюкози в плазмі зупинить цикл погіршення та як результат, це буде запобігати або лікувати цукровий діабет. Виведення надлишку глюкози безпосередньо у сечу, внаслідок чого нормалізується рівень глю кози у крові, розглядають як один з способів лікування гіперглікемії. Наприклад, реабсорбцію глюкози у нирках зменшують, шляхом інгібування натрій-залежного транспортеру глюкози проксимального звитого ниркового канальцю, в наслідок чого збільшується виділення глюкози у сечу та знижується рівень глюкози у крові. Фактично доведено, що при безперервному підшкірному введенні інгібітора SGLT флоризину тваринам, хворим на діабет, нормалізується рівень глюкози у крові та завдяки тому, що він підтримується на нормальному рівні протягом довгого періоду часу, покращується виділення інсуліну та інсулінорезистентність [cf., Journal of Clinical Investigation, vol. 79, p. 1510 (1987); ibid., vol. 80, p. 1037 (1987); ibid., vol. 87, p. 561 (1991), etc.]. Окрім цього, лікування тварин, хворих на діабет, шляхом введення інгібітора SGLT протягом довгого періоду часу, покращує виділення інсуліну та чутливість до інсуліну, не викликаючи побічних ефектів на нирки або дисбаланс електролітів у крові та, як результат попереджує виникнення та розвиток діабетичної нефропатії та діабетичної невропатії, [посилання, Journal of Medicinal Chemistry, vol. 42, p. 5311 (1999); British Journal of Pharmacology, vol. 132, p. 578 (2001), etc.]. З огляду на вищевказане очікують, що інгібітори SGLT покращують секрецію інсуліну та інсулінорезистентність шляхом зниження рівня глюкози у крові пацієнтів, хворих на діабет, та попереджують виникнення та розвиток цукрового діабету та його ускладнень. У міжнародній публікації WO 2006/035796 описано N-B-D-глюкопіранозил азотовмісні гетеробі 5 циклічні сполуки наступної формули: Вищевказані сполуки описані як інгібітори SGLT1 та/або SGLT2 та вони є придатними для попередження або лікування діабету та пов'язаних з ним хвороб. Даний винахід стосується нових похідних індолу формули (І) або їх фармацевтично прийнятних солей: де R1 є фтором або хлором, та R2 є воднем або фтором. Сполуки формули (І) проявляють активність як інгібітори SGLT у кишечнику та нирках ссавців та є придатними для лікування або попередження цукрового діабету та його ускладнень, таких як діабетична ретинопатія, діабетична невропатія та уповільнення заживлення ран та пов'язаних з цим хвороб. Фармацевтично прийнятні солі сполук формули (І) включають, наприклад, сіль неорганічної кислоти, такої як хлорводнева кислота, бромводнева кислота, йодводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота тощо; або сіль органічної кислоти, такої як мурашинова кислота, оцтова кислота, пропіонова кислота, щавелева кислота, малонова кислота, бурштинова кислота, фумарола кислота, малеїнова кислота, молочна кислота, оксибурштинова кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензенсульфонова кислота тощо; сіль кислої амінокислоти такої як аспарагінова кислота, глутамінова кислота тощо. Також фармацевтично прийнятні солі сполук формули (І) включають їх внутрішьомолекулярні солі, гідрати, сольвати або поліморфи. У переважному варіанті здійснення винаходу R2 є воднем. Як залишок індолу бажаним є 4-фторіндол (наприклад, R1 є фтором та R2 є воднем), 4хлоріндол (наприклад, R1 є хлором та R2 є воднем) 92100 6 або 4,6-дифторінол (наприклад, обидва R1 та R2 є фтором). Бажану сполуку даного винаходу вибирають з наступної групи сполук: 4-хлор-3-(4циклопропілфенілметил)-1-( -Dглюкопіранозил)індол, 3-(4циклопропілфенілметил)-4фтор-1-( -Dглюкопіранозил)індол, 4-хлор-3-(4циклопропілфенілметил)-6-фтор-1-( -Dглюкопіранозил)індол, та 3-(4циклопропілфенілметил)-4,6-дифтор-1-( -Dглюкопіранозил)індол; або їх фармацевтично прийнятні солі. Характеристикою даних сполук є комбінація пциклопропілфенілметильної групи у 3-положенні індольного кільця та атому галогену (зокрема фтору або хлору) у 4-положенні. Сполуки даного винаходу проявляють активність як інгібітори натрій-залежних транспортерів глюкози та значно знижують рівень глюкози у крові. Сполуки винаходу також мають гарні характеристики стосовно побічних ефектів та рентабельності. Вважають, що сполуки даного винаходу корисні при лікуванні, запобіганні або затримці розвитку або появи цукрового діабету (І та Il типу тощо), ускладнень діабету (таких як діабетична ретинопатія, діабетична невропатія, діабетична нефропатія), післяобідньої гіперглікемії, уповільнення заживлення ран, інсулінорезистентності, гіперглікемії, гепрінсулінемії, підвищення рівню жирних кислот у крові, підвищення рівню гліцерину у крові, гіперліпідемії, ожиріння, гіпертригліцеридемії, синдрому X, атеросклерозу або гіпертензії. Сполуки даного винаходу або їх фармацевтично прийнятні солі можна вводити або орально, або парентерально, та їх можна застосовувати у формі придатної композиції лікарської форми. Придатні лікарські форми для орального введення включають, наприклад, тверді лікарські форми, такі як таблетки, гранули, капсули та порошки або рідкі лікарські форми, суспензії, емульсії тощо. Придатні лікарські форми для парентерального введення включають, наприклад, супозиторії; ін'єкції або лікарські форми для внутрішньовенного вливання, які використовують дистильовану воду, фізіологічний розчин або водний розчин глюкози; та лікарські форми для інгаляції. Лікарські форми будуть включати на одну одиницю, наприклад, таблетку, капсулу, порошок, ін'єкцію, супозиторій, чайну ложку тощо, від приблизно 0,01мг/кг до приблизно 100мг/кг маси тіла (бажано від приблизно 0,01мг/кг до приблизно 50мг/кг; та більш бажано від приблизно 0,01мг/кг до приблизно 30мг/кг) активної сполуки та їх можна застосовувати у дозі від приблизно 0,01мг/кг/добу до приблизно 100мг/кг/добу (бажано від приблизно 0,01мг/кг/добу до приблизно 50мг/кг/добу та більш бажано від приблизно 0,01мг/кг/добу до приблизно 30мг/кг/добу). Лікування розладу, описаного у даному винаході, також здійснюють завдяки застосуванню фармацевтичної композиції, яка включає будь-яку з сполук, зазначених у даному документі, та фармацевтично 7 прийнятного носію. Лікарська форма буде містити від приблизно 0,01мг/кг до приблизно 100мг/кг маси тіла (бажано від приблизно 0,01мг/кг до приблизно 50мг/кг; та більш бажано від приблизно 0,01мг/кг до 30мг/кг) активної сполуки та може застосовуватись у будь-якій формі в залежності від способу введення. Лікарські форми застосовують в залежності від шляху введення, вимог суб'єкту, складності стану пацієнту та сполуки, яку вводять. Можна використовувати або щоденне введення, або пост-періодичне лікування. Сполуки формули (І) в разі необхідності можна використовувати у комбінації з одним або кількома іншими анти-діабетичними агентами, антигіперглікемічними агентами та/або агентами для лікування інших хвороб. Сполуки даного винаходу та ці інші агенти можна вводити в одній лікарській формі або у окремій лікарській формі для орального застосування або у ін'єкції. Приклади інших анти-діабетичних агентів та анти-гіперглікемічних агентів включають інсулін, стимулятор секреції інсуліну, сенсибілізатори інсуліну, або інші анти-діабетичні агенти, механізми дії яких відрізняються від інгібування SGLT. Зокрема, прикладами цих агентів є бігуаніди, сульфонілсечовини, інгібітори -глюкозидази, агоністи PPAR ( - рецептор фактору проліферації пероксисом) (наприклад, тіазолідиндіон сполуки), подвійні агоністи PPAR / , агоністи PPARpan, інгібітори дипептидилпептидази IV (ДПП4), мітіглінид, натеглінид, репаглінид, інсулін, глюкагон-подібний пептид-1 (GLP-1) та агоністи його рецептору, інгібітори РТР1В (тирозин-фосфатази1В), інгібітори глікогенфосфорилази, модулятори RXR, інгібітори глюкозо-6-фосфатази, агоністи/антагоністи GPR40, агоністи GPR119, агоністи GPR120, активатори глюкокінази (GK) та інгібітори фруктозо-1,6біфосфатази (FBP-аза). Приклади агентів для лікування інших хвороб включають агенти проти ожиріння, антигіпертензивні агенти, анти-тромбоцитарні агенти, анти-атеросклеротичні агенти та гіполіпідемічні агенти. Агенти проти ожиріння, які необов'язково можна застосовувати у комбінації зі сполукою даного винаходу, включають 3 адренергічні агоністи, інгібітори ліпази, інгібітори зворотнього захоплення серотоніну (та допаміну), ліки на основі бетарецепторів тиреоідних гормонів, анаректичні агенти, антагоністи NPY (нейропептиду Y), аналоги Лептину, агоністи МС4 та антагоністи СВ1. Анти-тромбоцитарні агенти, які необов'язково можна застосовувати у комбінації зі сполукою даного винаходу, включають абциксимаб, діклопидин, ептіфібатид, дипаридамол, аспірин, анагрелид, тірофібан та клопідогрел. Анти-гіпертензивні агенти, які можна необов'язково застосовувати у комбінації зі сполукою даного винаходу, включають інгібітори АСЕ, антагоністи кальцію, альфа-блокатори, діуретики, агенти центральної дії, антагоністи ангіотензину-ІІ, бетаблокатори, інгібітори реніну та інгібітори вазопептидази. Гіполіпідемічні агенти, які можна необов'язково застосовувати у комбінації зі сполукою даного ви 92100 8 находу, включають інгібітори MTP, інгібітори HMG СоА-редуктази, інгібітори скваленсинтази, інгібітори скваленепоксидази, похідні фіброєвої кислоти, інгібітори АСАТ, інгібітори ліпоксигенази, інгібітори абсорбції холестерину, інгібітори здухвинного співтранспортеру Nа+/жовчна кислота, апрегулятори активності рецептору LDL, підсилювачі екскреції жовчної кислоти, нікотинова кислота та її похідні, інгібітори CETP та апрегулятори ABC А1. У разі необхідності сполуки формули (І) можна застосовувати у комбінації з агентами для лікування ускладнень діабету. Ці агенти включають, наприклад, інгібітори PKC, інгібітори альдозоредуктази та/або інгібітори АСЕ. Різноманітні агенти, описані вище, можна застосовувати у одній лікарській формі з сполуками формули (І) або у різних лікарських формах, зі звичайним дозуванням та режимом прийому. Дозування цих агентів змінюється в залежності від, наприклад, віку, маси тіла, стану пацієнту, шляхів введення та лікарської форми. Ці фармацевтичні композиції можна вводити орально ссавцям, зокрема людині, мавпам та собакам, у лікарській формі, наприклад, у таблетці, капсулі, гранулі або порошку, або вводити парентерально у формі ін'єкцій або інтраназально, або у формі трансдермального пластиру. Сполуки формули (І) даного винаходу або їх фармацевтично прийнятні солі можна отримати шляхом зняття захисних груп сполук формули (II): де R3 є захисною групою для гідроксильної групи та інші символи мають значення як визначено вище, після чого, у разі потреби, отриману сполуку перетворюють на фармацевтично прийнятну сіль. Сполуки формули (II) є новими та є наступним аспектом даного винаходу. У сполуках формули (II) захисна група гідроксильної групи вибрана з звичайних захисних груп для гідроксильних груп, та приклади таких захисних сполук включають бензол, алканоїл, такий як ацетил, та алкілсиліл, такий як триметилсиліл, триетилсиліл та трет-бутилдиметилсиліл. Окрім цього, захисна група для гідроксильної групи може утворювати ацетал або силілацетал із сусідньою гідроксильною групою. Приклади такої захисної групи включають алкіліденову групу, таку як ізопропіліден та втор-бутиліден, бензиліденову групу та діалкілсиліленову групу, таку як ди-третбутилсиліленова група. Бажано R3 є алканоїлом, таким як ацетил. Зняття захисних груп здійснюють відповідно до виду захисної групи, яку видаляють, та для цього використовують традиційні способи, такі як від 9 92100 10 новлення, гідроліз, кислотна обробка та фторування. Наприклад, коли видаляють бензольну групу, зняття захисних груп здійснюють шляхом (1) каталітичного відновлення з використанням паладію як каталізатора (наприклад, паладій-вуглець та гідроксид паладію) в атмосфері водню у придатному інертному розчиннику (наприклад, метанолі, етиловому спирті та етилацетаті); (2) обробки деалкілувальним агентом, таким як трибромід бору, трихлорид бору, комплекс трихлорид бору диметилсульфід або йодтриметилсилан у інертному розчиннику (наприклад, дихлорметані); або (3) обробки алкілтіолом, таким як етантіол у присутності кислоти Льюіса (наприклад, комплекс трифторид бору-діетиловий етер) у придатному інертному розчиннику (наприклад, дихлорметані). Коли захисну групу видаляють за допомогою гідролізу, то гідроліз здійснюють обробкою сполук формули (II) основою (наприклад, гідроксидом натрію, гідроксидом калію, гідроксидом літію, метоксидом літію та етоксидом літію) у придатному інертному розчиннику (наприклад, тетрагідрофурані, діоксані, метанолі, етиловому спирті та воді). Кислотну обробку здійснюють шляхом обробки сполук формули (II) кислотою (наприклад, хлорводневою кислотою, п-толуєнсульфоновою кислотою, метансульфоновою кислотою та трифтороцтовою кислотою) у придатному інертному розчиннику (наприклад, метанолі та етиловому спирті). Фторидну обробку здійснюють шляхом обробки сполук формули (II) фторидом (наприклад, фторидом водню, фторидводень-піридин, тетрабутил-амоніюфторид тощо) у придатному інертному розчиннику (наприклад, оцтовій кислоті, спиртах (метанолі, етиловому спирті тощо) ацетонітрилі та тетрагідрофурані). Зняття захисних груп зазвичай здійснюють при зниженій, кімнатній або при підвищеній температурі, наприклад, від 0°C до 50°С, більш бажано від 0°С до кімнатної температури. Таким чином отримані сполуки даного винаходу, ізолюють та очищають звичайними способами, добре відомими у хімії органічного синтезу, такими як перекристалізація, колоночна хроматографія, тонкошарова хроматографія тощо. Сполуки формули (II) можна одержати у відповідності до стадій, описаних на Схемі 1 та Схемі 2. Протягом здійснення будь-якого процесу одержання сполук даного винаходу може бути необхідним та/або бажаним захистити чуттєву або реактивну групу на кожній з молекул. Цього досягають шляхом застосування звичайних захисних груп. Загальний опис захисних груп та їх застосування можна подивитись у T.W. Greene et al., "Protecting Groups in Organic Synthesis", John Wiley & Sons, New York, 1999. Захисні групи видаляють послідовним шляхом, використовуючи відомі фахівцям методи. (У вищенаведеній схемі символи мають значення як визначено вище). Стадія 1: Сполуки формули (IV) отримують шляхом фо рмілування сполук формули (V) з реагентом Вілсмеєра або метилового етеру , -дихлорметилу / тетрахлориду титану. Реагент Вілсмеєра виготовляють звичайним 11 способом, добре відомим фахівцям у галузі, наприклад, з диметилформаміду або Nметилформаніліду/оксихлориду фосфору, тіонілхлориду або оксалілхлориду. Реакцію зазвичай здійснюють у придатному розчиннику, такому як диметилформамід або дихлоретан, при кімнатній або підвищеній температурі, наприклад, при температурі від 25°С до 8°C. Стадія 2: Сполуки формули (III) можна отримати шляхом конденсування сполук формули (IV) з ArLi, ArMgBr, ArZnBr, Ar(Me)2LiZn або ArB(OH)2, де Ar представлена наступною формулою: Конденсування сполук формули (IV) з ArLi, ArMgBr, ArZnBr або Ar(Me)2LiZn зазвичай здійснюють у придатному інертному органічному розчиннику, такому як діетиловий етер, тетрагідрофуран або 1,4-діоксан, при кімнатній або зниженій температурі, наприклад, від -78°С до 25°С. Конденсування сполук формули (IV) з ArB(OH)2 зазвичай здійснюють у присутності каталізатора, такого як (ацетилацетонато)дикарбоніл родію (І) або гідроксил(1,5-циклооктодієн) родію (І) димер, та ліганду, такого як 1,1'-біс (дифенілфосфіно)феросен або три-трет-бутил-фосфін у придатному розчиннику, такому як тетрагідрофуран, 92100 12 диметоксиетан та 1,4-діоксан при кімнатній або підвищеній температурі, наприклад, від 25°С до 100°C. Стадія 3: Сполуки формули (II) отримують шляхом відновлення сполук формули (III). Відновлення сполук формули (III) здійснюють обробкою силановим реагентом або борогідридом у присутності кислоти у придатному розчиннику або у відсутності розчинника. Приклади кислоти включають кислоту Льюіса, таку як комплекс трифторид бору-діетиловий етер та тетрахлорид титану, та сильну органічну кислоту, таку як трифтороцтова кислота та метансульфонова кислота. Приклади сипанових реагентів включають триалкілсилани, такі як триетилсилан, триізопропілсилан. Приклади борогідридів включають борогідрид натрію та триацетоксиборогідрид натрію. Розчинник вибирають з будь-якого, який не перериває реакцію, та приклади розчинників включають ацетонітрил, галогеналкани (наприклад, дихлорметан, хлороформ та дихлоретан) та суміші цих розчинників. Відновлення можна здійснювати при зниженій або кімнатній температурі, наприклад, від -30°C до 25°C. 13 (У вищенаведеній схемі R4 є бромом або йодом та інші символи мають значення як визначено вище). Стадія 1: Сполуки формули (VIII) одержують шляхом конденсації сполук формули (V) з R4-C6H4-COCI, де R4 має таке ж значення, як зазначено вище. Конденсацію здійснюють відповідно до ацилування по Фріделю-Крафтсу, добре відомого у галузі, в придатному розчиннику в присутності кислоти Льюіса. Приклади кислоти Льюіса включають хлорид алюмінію, комплекс трифторид бору - діетиловий етер, хлорид олова (IV) та тетрахлорид титану. Розчинник вибирають з будь-якого, який не перериває реакцію Фріделя-Крафтса, та приклади розчинників включають галогеноалкани такі як, дихлорметан, хлороформ, тетрахлорметан та дихлоретан. Відновлення можна здійснювати при зниженій, кімнатній або підвищеній температурі, наприклад, від -30°C до 60°С. Стадія 2: Сполуки формули (VII) одержують шляхом відновлення сполук формули (VIII). Відновлення здійснюють шляхом взаємодії сполуки (VIII) з відновлювальним агентом у придатному розчиннику. Приклади відновлювальних агентів включають борогідриди (наприклад, борогідрид натрію з або без гептагідрату хлориду церію (III), триацетоксиборогідриднатрію) та гідриди алюмінію (наприклад, гідрид алюмінію та гідрид діізобутилалюмінію). Розчинник вибирають з будь-якого, що не перериває реакцію та приклади розчинників включають етери (наприклад, тетрагідрофуран, діетиловий етер, диметоксиетан та діоксан), спирти (наприклад, метанол, етиловий спирт та 2пропанол) та суміші цих розчинників. Реакцію відновлення здійснюють при зниженій або кімнатній температурі, наприклад, при температурі від -30°C до 25°C. Стадія 3: Сполуки формули (VI) одержують шляхом відновлення сполук формули (VII). Відновлення сполук формули (VII) здійснюють відповідно до Стадії 3 Схеми 1. Стадія 4: 92100 14 Сполуки формули (II) отримують шляхом конденсування сполук формули (VI) з циклопропілВ(ОН)2. Реакцію конденсування здійснюють шляхом звичайного арильного конденсування, наприклад, реакція конденсування Сузукі (посилання на: Suzuki et al., Synth. Commun. 11:513 (1981); Suzuki, Pure and Appl. Chem. 57:1749-1758 (1985); Suzuki et al., Chem. Rev. 95:2457-2483 (1995); Shieh et al., J. Org. Chem. 57:379-381 (1992); Martin et al., Acta Chemica Scandinavica 47:221-230 (1993); Wallace et al., Tetrahedron Lett. 43:6987-6990 (2002) and Molander et al., J. Org. Chem. 68:4302-4314 (2003)). Реакцію конденсування здійснюють у присутності каталізатора Pd та основи, з або без ліганду, та добавки у придатному розчиннику. Прикладами Pd каталізаторів є тетракіс (трифеніл-фосфін)паладію (0), ацетат паладію (II), біс(ацетонітрил)дихлорпаладій (II), дихлорбіс (трифенілфосфін) паладію(ІІ), комплекс [1,1'-біс (дифенілфосфіно)фероцен]дихлорпаладію (II) з дихлорметаном, трис(дибензиліденацетон)дипаладій (0) - хлороформ адукт та хлорид паладію (II). Приклади основ включають карбонати лужних металів (наприклад, карбонат калію, карбонат натрію та бікарбонат натрію), фосфати лужних металів (наприклад, триосновний фосфат калію, фосфат натрію та гідрофосфат натрію), органічні основи (наприклад, N,Nдіізопропілетиламін) та фториди лужних металів (наприклад, фторид цезію та фторид калію). Приклади лігандів включають трициклогексилфосфін та три(о-толіл)фосфін. Приклади добавок включають йодид міді (І). Розчинник вибирають з будь-якого, що не перериває реакцію конденсування, та прикладами розчинників є ароматичні вуглеводні (наприклад, бензол та толуол), етери (наприклад, тетрагідрофуран, 1,2-диметоксиетан та 1,4-діоксан), аміди (наприклад, диметилформамід, диметилацетамід, 1,3-диметил-2-імідазолідинон та Nметилпіролідон), спирти (метанол, етиловий спирт та 2-пропанол), вода та суміші цих розчинників. Реакцію конденсування здійснюють при кімнатній або підвищеній температурі, наприклад, від 25°С до 150°С, бажано від 80°С до 150°С. Початкові сполуки формули (V) одержують відповідно до наступної схеми: 15 (У вищенаведеній схемі символи мають значення як визначено вище). Стадія 1: Сполуки формули (XI) одержують конденсуванням сполук формули (XII) з D-глюкозою. Реакцію конденсування зазвичай здійснюють у придатному розчиннику, такому як ацетонітрил, вода та спирти (наприклад, метанол, етиловий спирт та 1пропанол), в присутності або без каталізаторів, таких як хлорид амонію та оцтова кислота, при кімнатній або підвищеній температурі. Стадія 2: Сполуки формули (IX) одержують шляхом окислення сполук формули (XI). Реакцію окислення зазвичай здійснюють у присутності окисника, такого як паладій на деревному вугіллі, тетрахлор-1,4бензохінон (хлораніл), 2,3-дихлор-5,6-диціано-1,4бензохінон (ДДХ) або сіль етиленбіс(саліцилімін)кобальту (II) у придатному розчиннику, такому як етери (наприклад, діетиловий етер, тетрагідрофуран та 1,4-діоксан), галогеналкани (наприклад, дихлорметан, хлороформ та 1,2дихлоретан), вода та суміші цих розчинників, при кімнатній або підвищеній температурі. Стадія 3: 92100 16 Сполуки формули (V) одержують шляхом захисту гідроксильних груп сполук формули (IX). Захисну групу для гідроксильних груп вибирають з груп, які зазвичай використовують як захисні групи для гідроксильних груп. Приклади захисних груп для гідроксильних груп включають алканоїльну групу (наприклад, ацетил), арилалкільну групу (наприклад, бензол, толуол та анізил), алкілсилільну групу (наприклад, триметилсиліл, третбутилдиметилсиліл та триетилсиліл). Захист здійснюють звичайними методами, добре відомими фахівцям у галузі. Загальний опис захисних груп та їх застосування описано у T.W. Greene et al., "Protecting Groups in Organic Synthesis", John Wiley & Sons, New York, 1999. Стадія 4: Сполуки формули (X) одержують шляхом захисту гідроксильних груп сполук формули (XI) відповідно до Стадії 3. Стадія 5: Сполуки формули (V) також одержують шляхом окислення сполук формули (X) відповідно до стадії 2. Сполуки формули (XII) одержують згідно з наступною схемою: 17 (У вищенаведеній схемі R5 є алкілом, та інші символи мають значення як визначено вище). Стадія 1: Сполуки формули (XV) одержують шляхом циклізації сполук формули (XVI). Реакцію циклізації здійснюють відповідно до індольного синтезу Фішера, який є добре відомим у галузі (посилання на: Chem. Rev., 63, 373, 1963). Цю реакцію зазвичай здійснюють у придатному розчиннику, такому як спирти (наприклад, метанол та етиловий спирт) та гідрокарбонати (наприклад, толуол, нітробензен) або без розчинника з кислотою, такою як кислота Льюіса (наприклад, хлорид цинку), неорганічною кислотою (наприклад, хлорводневою кислотою та поліфосфорною кислотою) та органічною кислотою (наприклад, оцтовою кислотою та трифтороцтовою кислотою) при підвищеній температурі. Стадія 2: Сполуки формули (XIV) одержують шляхом гідролізу сполук формули (XV). Реакцію гідролізу зазвичай здійснюють у придатному розчиннику, такому як вода, спирти (наприклад, метанол та етиловий спирт) та етери (наприклад, діоксан та тетрагідрофуран) з основою, такою як гідроксиди лужних металів (наприклад, гідроксид літію, гідроксид калію та гідроксид натрію) при зниженій, кімнатній або підвищеній температурах. Стадія 3: Сполуки формули (XIII) одержують шляхом декарбоксилування сполук формули (XIV). Декарбоксилування зазвичай здійснюють у придатному розчиннику, такому як хінолін, з каталізатором, таким як мідь, при підвищеній температурі. Стадія 4: Сполуки формули (XII) одержують шляхом відновлення сполук формули (XIII). Реакцію відновлення зазвичай здійснюють у придатному розчиннику, такому як ацетонітрил, галогеналкани (наприклад, дихлорметан та дихлоретан) та етери (наприклад, діетиловий етер, тетрагідрофуран та діоксан) з відновлювальним агентом, таким як триетилсилан, борогідрид цинку, комплекс борантриметиламін, комплекс боран-морфолін та ціаноборогідрид натрію, у присутності кислоти Льюіса, такої як трифтороцтова кислота, комплекс боронтрифторид - діетиловий етер, хлорводнева кислота та оцтова кислота, при кімнатній або підвищеній 92100 18 температурі. Сполуки формули (XVI) отримують шляхом конденсування сполук формули (XVII): де позначення мають значення як визначено вище, з CH3COCO2R5, де R5 має таке значення як зазначено вище. Реакцію конденсування зазвичай здійснюють у придатному розчиннику, такому як ацетонітрил, галогеноалкани (наприклад, дихлорметан та хлороформ) та етери (наприклад, діоксан), вода та спирти (наприклад, метанол, етиловий спирт та 1-пропанол), в присутності або без основи (наприклад, ацетату натрію та ацетату калію) або кислоти (наприклад, хлорводневої кислоти та оцтової кислоти), при кімнатній або підвищеній температурі. Окрім цього, сполуки формули (XVI) одержують шляхом (1) взаємодії сполук формули (XVIII): де позначення мають значення як визначено вище, з нітритом натрію у присутності кислоти, такої як хлорводнева кислота, у придатному розчиннику, такому як вода та спирти (наприклад, метанол та етиловий спирт) при кімнатній або підвищеній температурі з метою отримання відповідної арилдіазонової солі та (2) конденсації арилдіазонової солі з CH3COCH(CH3)CO2R5, де R5 має таке значення, як зазначено вище, у присутності основи, такої як ацетат натрію, гідроксид калію, у придатному розчиннику, такому як вода та спирти (наприклад, метанол та етиловий спирт) при зниженій або кімнатній температурі. Інші початкові сполуки є комерційно доступними або їх можна легко виготовити способами, добре відомими фахівцям у галузі. 19 У подальшому даний винахід ілюструється Прикладами та Порівняльними Прикладами, проте даний винахід не обмежується ними. Приклади Приклад 1: 3-(4-циклопропілфенілметил)-4- фтор-1-( -Dглюкопіранозил)індол: (1) Суміш 4-фторіндоліну (185мг) та D-глюкози (267мг) у H2O (0,74мл) - етиловому спирті (9мл) нагрівали із зворотнім холодильником в атмосфері аргону протягом 24 годин. Розчинник випаровували при пониженому тиску з метою отримання неочищеного 4-фтор-1-( -D-глюкопіранозил)індоліну, який використовували на наступній стадії без подальшої очистки. (2) Вищевказану сполуку суспендували у хлороформі (8мл) та туди послідовно додавали піридин (0,873мл), оцтовий ангідрид (1,02мл) та 4(диметиламіно)піридин (у каталітичній кількості). Після струшування при кімнатній температурі протягом 21 години, реакційну суміш випаровували при пониженому тиску. Залишок розчиняли у етилацетаті, та розчин двічі промивали 10% водним розчином сульфату міді та насиченим водним розчином гідрокарбонату натрію, та висушували над сульфатом магнію. Нерозчинні матеріали відфільтровували, та фільтрат випаровували при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі (гексан : етилацетат=90:10-60:40) з метою отримання 4фтор-1-(2,3,4,6-тетра-O-ацетил- -Dглюкопіранозил)індоліну (365мг) у вигляді безкольорової аморфної рідини. APCI-Mass m/Z 468 (М+Н). 1Н-ЯМР (ДМСО-d6) 1,93 (с, 3Н), 1,96 (с, 3Н), 1,97 (с, 3Н), 2,00 (с, 3Н), 2,83 (ддд, J = 15,5, 10,5 та 10,3Гц, 1Н), 2,99-3,05 (м, 1Н), 3,49-3,57 (м, 2Н), 3,95-3,99 (м, 1Н), 4,07-4,11 (м, 2Н), 4,95 (т, J = 9,5Гц, 1Н), 5,15 (т, J = 9,4Гц, 1H), 5,42 (т, J = 9,6Гц, 1H), 5,49 (д, J = 9,3Гц, 1Н), 6,48 (т, J = 8,6Гц, 1H), 6,60 (д, J = 8,0Гц, 1H), 7,05-7,10 (м, 1Н). (3) Вищевказану сполуку (348мг) розчиняли у 1,4-діоксані (14мл), та до розчину додавали 2,3дихлор-5,6-диціано-1,4-бензохінон (306мг). Після струшування при кімнатній температурі протягом 33 годин, до розчину додавали насичений водний розчин гідрокарбонату натрію (20мл), та органічний розчинник випаровували при пониженому тиску. Залишок двічі екстрагували етилацетатом, та комбінований органічний шар промивали розсолом, висушували над сульфатом магнію та піддавали взаємодії з активованим вугіллям. Нерозчинні матеріали відфільтровували, та 92100 20 фільтрат випаровували при пониженому тиску. Залишок очищали за допомогою колоночної хроматографії на силікагелі (гексан:етилацетат=90:1060:40) та перекристалізували з етилового спирту з метою отримання 4-фтор-1-(2,3,4,6-тетра-Оацетил- -D-глюкопіранозил)індолу (313мг) у вигляді безбарвних кристалів з точкою плавлення 132-135°С. APCI-Mass m/Z 483 (M+NH4). 1Н-ЯМР (ДМСО-d6) 1,64 (с, 3Н), 1,97 (с, 3Н), 1,99 (с, 3Н), 2,04 (с, 3Н), 4,10 (ABX, J = 12,4, 2,7Гц, 1H), 4,14 (АВХ, J = 12,4, 5,2Гц, 1Н), 4,31 (ддд, J = 10,0, 5,2 та 2,7Гц, 1Н), 5,25 ( т , J = 9,7Гц, 1Н), 5,53 ( т , J = 9,5Гц, 1Н), 5,61 (т, J = 9,3Гц, 1Н), 6,22 (д, J = 9,0Гц, 1Н), 6,58 (д, J = 3,4Гц, 1Н), 6,88 (дд, J = 10,8, 7,9Гц, 1Н), 7,19 (тд, J = 8,1, 5,3Гц, 1H), 7,51 (д, J = 8,5Гц, 1H), 7,53 (д, J = 3,4Гц, 1Н). (4) Вищезгадану сполуку (3,50г) та N,Nдиметилформамід (3,49мл) розчиняли у 1,2дихлоретані (70мл) та до розчину краплями додавали оксихлорид фосфору (III) (2,10мл). Суміш струшували при 70°C протягом 1 години та до суміші додавали воду (100мл) при 0°С. Отриману суміш двічі екстрагували етилацетатом (200мл) та висушували над сульфатом магнію. Нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску. Залишок очищали колоночною хроматографією на силікагелі (гексан:етилацетат=90:10-50:50) та перекристалізували з етилового спирту (20мл) з метою отримання 4-фтор-1-(2,3,4,6-тетра-O-ацетил- -Dглюкопіранозил)-індол-3-карбоксальдегіду (2,93г) у вигляді безбарвних кристалів з точкою плавлення 190-192°С. APCI-Mass m/Z 511 (M+NH4). 1Н-ЯМР (ДМСО-d6) 1,64 (с, 3Н), 1,98 (с, 3Н), 2,00 (с, 3Н), 2,05 (с, 3Н), 4,12 (А частина АВХ, J = 12,4, 2,5Гц, 1H), 4,17 (В частина АВХ, J = 12,4, 5,5Гц, 1H), 4,33 (ддд, J = 10,0, 5,5 та 2,5Гц, 1Н), 5,32 (т, J = 9,8Гц, 1H), 5,56 (т, J = 9,6Гц, 1H), 5,66 (т, J = 9,3Гц, 1H), 6,36 (д, J = 9,0Гц, 1Н), 7,11 (дд, J = 10,6, 8,0Гц, 1Н), 7,38 (тд, J = 8,1, 5,1Гц, 1Н), 7,65 (д, J = 8,3Гц, 1Н), 8,53 (с, 1Н), 10,0 (д, J = 2,9Гц, 1Н). (5) До суміші магнієвих ошурків (664мг) та 1,2диброметану (1 крапля) у тетрагідрофурані (40мл) краплями додавали розчин 1-бром-4циклопропілбензену (дивитись WO 96/07657) (5,21г) у тетрагідрофурані (12мл) приблизно 25 хвилин при сильному струшуванні, та сильне струшування здійснювали протягом 30 хвилин при кімнатній температурі. Потім отриману суміш краплями додавали до розчину вищевказаного 4фтор-1-(2,3,4,6-тетра-O-ацетил- -Dглюкопіранозил) індол-3-карбоксальдегіду (4,35г) у тетрагідрофурані (130мл) приблизно 15 хвилин при температурі -78°С в атмосфері аргону. Суміш струшували при цій температурі протягом 30 хвилин та до суміші додавали насичений воднийрозчин хлориду амонію (200мл). Отриману суміш двічі екстрагували етилацетатом (150мл), та комбінований органічний шар висушували над сульфатом магнію. Нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску з метою отримання неочищеного 4циклопропілфеніл-4-фтор-1-(2,3,4,6-тетра-Оацетил- -D-глюкопіранозил) індол-3-іл метанолу, який використовували на наступних стадіях без 21 подальшої очистки. (6) До струшеної суміші вищевказаної сполуки та триетилсилану (2,11мл) у дихлорметан (44мл) ацетонітрилі (87мл) додавали комплекс трифторид бору - діетиловий етер (1,34мл) при 0°C в атмосфері аргону. Суміш струшували при цій температурі протягом 20 хвилин та туди додавали насичений водний розчин гідрату натрію (200мл). Органічний розчинник випаровували при пониженому тиску, та залишок двічі екстрагували етилацетатом (150мл). Після висушування над сульфатом магнію, нерозчинний матеріал відфільтровували та фільтрат випаровували при пониженому тиску. Залишок очищали колоночною хроматографією на силікагелі (гексан:етилацетат=90:10-50:50) та розтирали з етиловим спиртом (40мл) з метою отримання 3-(4циклопропілфенілметил)-4-фтор-1-(2,3,4,6-тетраО-ацетил- -D-глюкопіранозил)індолу (4,71г) у вигляді безбарвних кристалів з точкою плавлення 190-192°С. APCI-Mass m/Z 613 (M+NH4). 1Н-ЯМР (ДМСО-d6) 0,60 (ддд, J = 6,6, 4,7 та 4,3Гц, 2Н), 0,88 (ддд, J = 8,3, 6,3 та 4,0Гц, 2Н), 1,63 (с, 3Н), 1,81-1,87 (м, 1Н), 1,96 (с, 3Н), 1,99 (с, 3Н), 2,04 (с, 3Н), 4,00 (с, 2Н), 4,09 (А частина АВХ, J = 12,2, 2,4Гц, 1Н), 4,13 (В частина АВХ, J = 12,3, 5,5Гц, 1Н), 4,28 (ддд, J = 10,0, 5,3 та 2,7Гц, 1H), 5,23 (т, J = 9,6Гц, 1Н), 5,49-5,56 (м, 2Н), 6,15 (д, J = 8,7Гц, 1Н), 6,77 (дд, J = 11,0, 7,9Гц, 1Н), 6,95 (д, J = 8,2Гц, 2Н), 7,05 (д, J = 8,0Гц, 2Н), 7,14 (тд, J= 8,0, 5,1Гц, 1Н), 7,23 (с, 1Н), 7,46 (д, J= 8,3Гц, 1Н). (7) Вищезгадану сполуку (4,67г) розчиняли у метанол (47мл) - тетрагідрофурані (93мл), та до розчину додавали метоксид натрію (28% розчин метанолу, 1 крапля). Після струшування при кімнатній температурі протягом 1 години, розчинник випаровували при пониженому тиску. Залишок очищали колоночною хроматографією на силікагелі (хлороформ:метанол=99:1-90:10) з метою отримання сполуки вказаної у заголовку, а саме 3(4-циклопропілфенілметил)-4-фтор-1-( -Dглюкопіранозил)індолу (3,23г) у вигляді безбарвної піни. Цю піну кристалізували з етилового спирту H2O з метою отримання гемігідрату вказаної у заголовку сполуки, у вигляді безбарвних кристалів з точкою плавлення 110-112°С. APCI-Mass m/Z 445 (M+NH4), 428 (М+Н). 1Н-ЯМР (ДМСО-d6) 0,60 (м, 2Н), 0,88 (ддд, J = 8,3, 6,3 та 4,1Гц, 2Н), 1,82-1,87 (м, 1Н), 3,23 (тд, J = 9,0, 5,4Гц, 1Н), 3,39 (тд, J = 8,9, 5,1Гц, 1H), 3,42-3,46 (м, 2Н), 3,63-3,68 (м, 2Н), 4,02 (с, 2Н), 4,53 (т, J = 5,6Гц, 1Н), 5,10 (д, J = 5,3Гц, 1Н), 5,17 (д, J = 5,0Гц, 1Н), 5,21 (д, J = 5,9Гц, 1Н), 5,37 (д, J = 9,2Гц, 1Н), 6,74 (дд, J= 11,1, 7,9Гц, 1Н), 6,96 (д, J = 8,2Гц, 2Н), 7,07 (тд, J = 8,1, 5,2Гц, 1Н), 7,13 (д, J = 8,2Гц, 2Н), 7,21 (с, 1Н), 7,35 (д, J = 8,3Гц, 1Н). Розрахована для C24H26FNO5 0.5H2O: С, 66,04; Н, 6,23; F, 4,35; N, 3,21. Виміряна: С, 65,62; Н, 6,27; F, 4,32; N, 3,11. Приклад 2: 4хлор-3-(4циклопропілфенілметил)-1-( -Dглюкопіранозил)індол 92100 22 (1) Суміш 4-хлоріндоліну (2,88г) та D-глюкози (3,38г) у етиловому спирті (150мл) - H2O (10мл) нагрівали із зворотнім холодильником в атмосфері аргону протягом ночі. Розчинник випаровували при пониженому тиску, та залишок очищали колоночною хроматографією на силікагелі (хлороформ:метанол=100:0-88:12) з метою отримання 4хлор-1-( -D-глюкопіранозил)індоліну (3,35г) у вигляді безбарвної піни. APCI-Mass m/Z 316/318 (М+Н). 1Н-ЯМР (ДМСО-d6) 2,87-3,02 (м, 2H), 3,073,12 (м, 1Н), 3,20-3,32 (м, 2H), 3,38-3,47 (м, 2Н), 3,51-3,60 (м, 2Н), 3,68-3,73 (м, 1Н), 4,34-4,37 (м, 1Н), 4,63 (д, J = 8,3Гц, 1Н), 4,93 (д, J =5,1Гц, 1Н), 5,03 (д, J = 4,0Гц, 1Н), 5,06 (д, J = 4,5Гц, 1Н), 6,53 (д, J = 8,0Гц, 1H), 6,60 (д, J = 8,0Гц, 1Н), 6,99 (т, J = 7,9Гц, 1Н). (2) Вищезгадану сполуку (3,3г) розчиняли у 1,4-діоксані (150мл), та до розчину додавали 2,3дихлор-5,6-диціано-1,4-бензохінон (2,85г). Суміш струшували при кімнатній температурі протягом 12 годин. До реакційної суміші додавали насичений водний розчин гідрокарбонату (300мл), та суміш тричі екстрагували етилацетатом. Комбінований органічний шар промивали насиченим водним розчином гідрокарбонату натрію та висушували над сульфатом магнію. Нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску. Залишок очищали колоночною хроматографією на силікагелі (хлороформ метанол=100:0-86:14) з метою отримання 4-хлор-1-( D-глюкопіранозил)індолу (2,01г) у вигляді блідокоричневих кристалів. APCI-Mass m/Z 314/316 (М+Н). 1Н-ЯМР (ДМСО-d6) 3,24-3,50 (м, 4Н), 3,683,74 (м, 2Н), 4,54 (т, J = 5,5Гц, 1Н), 5,11 (д, J= 5,3Гц, 1Н), 5,20 (д, J = 4,8Гц, 1Н), 5,28 (д, J =5,8Гц, 1Н), 5,44 (д, J = 9,2Гц, 1Н), 6,51 (д, J= 3,4Гц, 1Н), 7,11-7,16 (м, 2Н), 7,57-7,58 (м, 2Н). (3) Вищезгадану сполуку (2,01г) суспендували у дихлорметані (100мл), та до суспензії послідовно додавали оцтовий ангідрид (4,24мл), N,Nдіізопропілетиламін (7,8мл) та 4(диметиламіно)піридин (78мг). Після струшування при кімнатній температурі протягом 30 хвилин, суміш послідовно промивали водним розчином лимонної кислоти, водою та насиченим водним розчином гідрокарбонату натрію. Органічний шар висушували над сульфатом магнію. Нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску. Залишок очищали шляхом кристалізації з діетиловий етер-гексану з метою отримання 4-хлор-1-(2,3,4,6-тетра-Oацетил- -D-глюкопіранозил)-індолу (2,94г) у вигляді безбарвних кристалів APCI-Mass m/Z 499/501 23 (M+NH4). 1Н-ЯМР (ДМСО-d6) 1,65 (с, 3Н), 1,97 (с, 3Н), 1,99 (с, 3H), 2,04 (с, 3Н), 4,08-4,16 (м, 2Н), 4,28-4,32 (м, 1Н), 5,26 (т, J = 9,8Гц, 1H), 5,53 (т, J = 9,5Гц, 1H), 5,62 (т, J = 9,3Гц, 1H), 6,23 (д, J = 9,2Гц, 1H), 6,56 (д, J = 3,4Гц, 1H), 7,16 (д, J = 8,2Гц, 1Н), 7,21 ( т , J = 7,9Гц, 1H), 7,61 (д, J = 3,5Гц, 1H), 7,67 (д, J = 8,2Гц, 1Н). (4) Вищевказану сполуку обробляли подібно до того, як це вказано у Прикладах 1-(4), з метою отримання 4-хлор-1-(2,3,4,6-тетра-О-ацетил- -Dглюкопіранозил) індол-3-карбоксальдегіду у вигляді безбарвного порошку. APCI-Mass m/Z 527/529 (M+NH4). 1Н-ЯМР (AMCO- d 6 ) 1,64 (с, 3Н), 1,98 (с, 3Н), 1,99 (с, 3Н), 2,05 (с, 3Н), 4,09-4,19 (м, 2Н), 4,30 (м, 1Н), 5,34 (т, J = 9,8Гц, 1H), 5,54 (т, J = 9,5Гц, 1H), 5,70 (т, J = 9,3Гц, 1H), 6,37 (д, J = 9,0Гц, 1Н), 7,35-7,42 (м, 2Н), 7,82 (д, J = 7,5Гц, 1H), 8,54 (с, 1H), 10,51 (с, 1Н). (5) Вищезгадану сполуку та 1-бром-4циклопропілбензен (дивитись WO 96/07657) обробляли подібно до того, як це вказано у Прикладах 1-(5), з метою отримання неочищеного 4-хлор-1(2,3,4,6- тетра-О-ацетил- -D-глюкопіранозил) індол-3-іл 4-циклопропілфенілметанолу, який використовували на наступних стадіях без подальшої очистки. (6) Вищевказану сполуку обробляли подібно до того, як це вказано у Прикладах 1-(6), з метою отримання 4-хлор-1-(2,3,4,6-тетра-О-ацетил- -Dглюкопіранозил)індолу у вигляді безбарвної твердої речовини. APCI-Mass m/Z 629/631 (M+NH4). 1НЯМР (ДМСО-d6) 0,58-0,62 (м, 2H), 0,88-0,92 (м, 2Н), 1,65 (с, 3Н), 1,82-1,88 (м, 1H), 1,96 (с, 3Н), 1,99 (с, 3Н), 2,03 (с, 3Н), 4,07-4,13 (м, 2H), 4,15 (ABq, J = 16,2Гц, 1H), 4,19 (ABq, J = 16,2Гц, 1H), 4,28 (м, 1Н), 5,24 (т, J = 9,6Гц, 1H), 5,50 (т, J = 9,3Гц, 5,55 (т, J = 9,2Гц, 1H), 6,17 (д, J = 8,7Гц, 1Н), 6,95 (д, J = 8,0Гц, 2Н), 7,02 (д, J = 8,0Гц, 2Н), 7,05 (д, J = 7,7Гц, 1H), 7,16 (т, J = 7,9Гц, 1H), 7.25 (с, 1H), 7,64 (д, J =8,3Гц, 1Н). (7) Вищевказану сполуку обробляли подібно до того, як це вказано у Прикладах 1-(6), з метою отримання 4-хлор-3-(4-циклопропілфенілметил)-1( -D-глюкопіранозил) індолу у вигляді безбарвного порошку. APCI-Mass m/Z 444/446 (М+Н), 461/463 (M+NH4). 1Н-ЯМР (ДМСО-d6) 0,59-0,62 (м, 2H), 0,87-0,92 (м, 2H), 1,82-1,89 (м, 1Н), 3,20-3,48 (м, 4Н), 3,60-3,70 (м, 2H), 4,21 (с, 2Н), 4,54 (т, J = 5,5Гц, 1H), 5,10 (д, J = 5,3Гц, 1Н), 5,17 (д, J = 5,1Гц, 1H), 5,21 (д, J = 5,9Гц, 1H), 5,39 (д, J = 9,0Гц, 1H), 6,96 (д, J = 8,2Гц, 2H), 7,02 (д, J = 7,2Гц, 1H), 7,09 (д, J = 8,0Гц, 2Н), 7,09 (т, J = 7,8Гц, 1H), 7,22 (с, 1H), 7,53 (д, J = 8,2Гц, 1Н). Приклад 3: 3-(4-циклопропілфенілметил)-4,6- дифтор-1-( D-глюкопіранозил)індол 92100 24 Сполуку, вказану у заголовку, одержували у вигляді безбарвну піну, подібно до того, як одержували сполуку Прикладу 1 з 4,6-дифторіндоліну. APCI-Mass m/Z 463 (M+NH4). 1Н-ЯМР (ДМСО-d6) 0,58-0,62 (м, 2Н), 0,88-0,91 (м, 2Н), 1,82-1,88 (м, 1Н), 3,20-3,50 (м, 4Н), 3,59-3,70 (м, 2Н), 3,99 (с, 2Н), 4,54 (т, J = 5,7Гц, 1Н), 5,10 (д, J = 5,3Гц, 1Н), 5,19 (д, J = 5,0Гц, 1Н), 5,22 (д, J = 5,8Гц, 1Н), 5,35 (д, J = 9,0Гц, 1Н), 6,78 (т, J = 9,6Гц, 1Н), 6,96 (д, J = 8,0Гц, 2Н), 7,11 (д, J = 8,0Гц, 2Н), 7,22 (с, 1H), 7,30 (дд, J = 10,0, 1,7Гц, 1Н). Приклад 4: 4- хлор-3-(4-циклопропілфеніл метил)-6- фтор1 -( -D-глюкопіранозил)індол Сполуку, вказану у заголовку, одержували у вигляді безбарвної піни, подібно до того, як одержували сполуку Прикладу 1 з 4-хлор-6фторіндоліну. APCI-Mass m/Z 479/481 (M+NH4). 1НЯМР (ДМСО- d 6 ) 0,59-0,62 (м, 2Н), 0,88-0,91 (м, 2Н), 1,83-1,87 (м, 1H), 3,21-3,50 (м, 4Н), 3,57-3,63 (м, 1Н), 3,65-3,71 (м, 1Н), 4,18 (с, 2Н), 4,54 ( т , J = 5,5Гц, 1H), 5,10 (д, J = 5,3Гц, 1H), 5,16 (д, J = 5,0Гц, 1H), 5,23 (д, J = 5,8Гц, 1H), 5,38 (д, J = 9,0Гц, 1H), 6,97 (д, J = 8,2Гц, 2Н), 7,01 (дд, J = 9,4, 2,0Гц, 1Н), 7,08 (д, J = 8,0Гц, 2Н), 7,22 (с, 1Н), 7,47 (дд, J = 10,1, 2,1Гц, 1Н). Порівняльний Приклад 1: 4-фторіндолін До струшеної суспензії борогідріду натрію (560мг) у діетиловому етері (6мл) краплями додавали хлорид цинку (1,0M розчин у діетиловому етері, 7,4мл). Суміш струшували при кімнатній температурі у атмосфері аргону протягом 1 дня. До отриманої суміші краплями додавали розчин 4фторіндолу (500мг) у діетиловому етері (5мл). Після струшування при кімнатній температурі у атмосфері аргону протягом 12 днів, до суміші додавали охолоджений водний розчин хлорводневої кислоти (30мл) при 0°С. Після цього у суміш додавали охолоджений 2N водний розчин гідроксиду натрію 25 при 0°С, та тричі екстрагували етилацетатом. Комбінований органічний шар висушували над сульфатом магнію, та нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску. Залишок очищали колоночною хроматографією на силікагелі (гексан:етилацетат = 100:0-80:20) з метою отримання вказаної у заголовку сполуки (351мг) у вигляді блідо-жовтої олії. APCI-Mass m/Z 138 (М+Н). 1Н-ЯМР (ДМСО-d6) 2,93 (т, J = 8,6Гц, 2Н), 3,46 (т, J = 8,6Гц, 2Н), 5,78 (ш-с, 1Н), 6,24-6,31 (м, 2Н), 6,87-6,94 (м, 1Н). Порівнювальний Приклад 2: 4-хлоріндолін Розчин 4-хлоріндоліну (3,15г) та триетилсилану (8,30г) у трифтороцтовій кислоті (32мл) струшували при 50°C протягом 30 хвилин. Розчинник випаровували при пониженому тиску, та до залишку додавали насичений водний розчин гідрокарбонату натрію. Суміш двічі екстрагували етилацетатом, та комбіновані органічні шари висушували над сульфатом магнію. Нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску. Залишок очищали колоночною хроматографією на силікагелі (гексан:етилацетат=100:0-80:20) з метою отримання вказаної у заголовку сполуки (2,89г) у вигляді безбарвної олії. APCI-Mass m/Z 154/156 (М+Н). 1НЯМР (ДMCO-d6) 2,94 (т, J = 8,7Гц, 2Н), 3,46 (т, J = 8,7Гц, 2Н), 5,83 (с, 1Н), 6,40 (д, J = 7,7Гц, 1H), 6,50 (д, J = 8,0Гц, 1H), 6,90 (т, J = 7,9Гц, 1Н). Порівняльний Приклад 3: 4,6-дифторіндолін (1) Суміш гідрохлориду 3,5дифторфенілгідрозину (5,0г) та етилпирувату (4,6мл) у етиловому спирті (25мл) нагрівали із зворотнім холодильником протягом 1 години, та розчинник випаровували при пониженому тиску. Тверді речовини залишку розтирали у порошок з гексаном з метою отримання етил 2-(3,5дифторфенілгідразино)пропіонату (4,65г) у вигляді безбарвних кристалів з температурою плавлення 139-141°С. APCI-Mass m/Z 243 (М+Н). (2) Суспензію вищевказаної сполуки (4,65г) у толуолі (47мл) додавали до поліфосфорної кислоти (23г), та суміш нагрівали із зворотнім холодильником у атмосфері аргону протягом 3 годин. Після охолодження до кімнатної температури до суміші додавали воду та етилацетат, та отриману суміш струшували при кімнатній температурі. Нерозчинний матеріал відфільтровували, та фільтрат відділяли. Водний шар екстрагували етилацетатом, та комбінований органічний шар послідовно промивали водою, насиченим водним розчином гідрокарбонату натрію та розсолом. Після висушування над сульфатом магнію та обробки активованим вугіллям, нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску. Твердий залишок розтирали у порошок з діізопропіловим етером-гексаном (1:1) з метою отримання етил 4,6-дифторіндол-2-карбоксилату (3,48г) у вигляді блідо-жовтих кристалів з температурою плавлення 153-154°С. ESI-Mass m/Z 224 (M-H). (3) Суміш вищезгаданої сполуки (3,48г) у 4N водному розчині гідроксиду натрію (7,73мл) та етиловому спирті (35мл) нагрівали із зворотнім холодильником протягом 15 хвилин, та органічний розчинник випаровували при пониженому тиску. 92100 26 До суміші додавали воду та промивали етиловим етером, після чого розчин підкислювали 6N водним розчином хлорводневої кислоти. Отриману суміш екстрагували етилацетатом, та органічний шар промивали розсолом, висушували над сульфатом магнію та обробляли активованим вугіллям. Нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску з метою отримання неочищеного 4,6-дифтор-індол2-карбонової кислоти (3,01г) у вигляді блідокоричневої твердої речовини з температурою плавлення 253-254(dec). ESI-Mass m/Z 196 (M-H). (4) Суміш вищезгаданої сполуки (3,0г) та порошок міді (2,9г) у хіноліні (30мл) струшували при 200°C протягом 5 годин в атмосфері аргону. Після охолодження до кімнатної температури нерозчинні матеріали відфільтровували та промивали етилацетатом (100мл). Фільтрат двічі промивали 6N водним розчином хлорводневої кислоти та розсолом. Кожен водний шар екстрагували етилацетатом, та комбінований органічний шар висушували над сульфатом магнію та обробляли активованим вугіллям. Нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску. Залишок олії очищали колоночною хроматографією на силікагелі (гексан:етилацетат=10:1-6:1) з метою отримання 4,6-дифторіндолу (2,60г) у вигляді блідо-жовтої олії. ESI-Mass m/Z 152 (M-H). (5) Вищезгадану сполуку (2,33г) розчиняли у 1,4-діоксані (30,4мл), та до розчину додавали морфолін-боран (6,15г) та 36% водний розчин хлорводневої кислоти (2,64мл) при кімнатній температурі. Суміш нагрівали із зворотнім холодильником протягом 2 годин, та потім охолоджували до кімнатної температури. До суміші додавали 6N водний розчин хлорводневої кислоти (12,2мл), та отриману суміш нагрівали із зворотнім холодильником протягом 15 хвилин. До суміші додавали 10% водний розчин гідроксиду натрію при 0°С, та туди додавали воду та двічі екстрагували етилацетатом. Комбінований органічний шар промивали розсолом та висушували над сульфатом магнію. Нерозчинний матеріал відфільтровували та фільтрат випаровували при пониженому тиску. Олію залишку очищали колоночною хроматографією на силікагелі (гексан:етилацетат=10:1-6:1) з метою отримання вказаної у заголовку сполуки, 4,6дифторіндоліну (2,05г) у вигляді безбарвної олії. APCI-Mass m/Z 156 (М+Н). 1Н-ЯМР (ДМСО-d6) 2,90 (т, J = 8,6Гц, 2Н), 3,52 (тд, J = 7,5, 1,3Гц, 2Н), 6,08-6,14 (м, 2Н), 6,17 (тд, J = 10,0, 2,1Гц, 1Н). Порівняльний Приклад 4: 4-хлор-6фторіндолін (1) До суспензії 3-хлор-5-фтораніліну (8,0г) у 6N водному розчині хлорводневої кислоти (28мл) додавали розчин нітриту натрію (4,17г) у H2O (5,2мл) при 0°C, та суміш струшували при 0°C протягом 30 хвилин. Отриману суміш додавали до розчину піроксиду калію (17,0г), ацетату натрію (17,0г) та етил 2-метилацетоацетату (8,72г) у H2O (80мл) та етиловому спирті (64мл) при 0°С, та суміш струшували при такій температурі протягом 2 годин. Реагуючу суміш двічі екстрагували етилацетатом, та комбінований органічний шар випаровували при пониженому тиску. Залишок розчиняли 27 92100 у воді та етилацетаті, та нерозчинний матеріал відфільтровували. Фільтрат відділяли, та органічний шар промивали випаровували при пониженому тиску. Залишок розчиняли у воді та етилацетаті, та нерозчинний матеріал відфільтровували. Фільтрат відділяли, та органічний шар промивали розсолом та висушували над сульфатом магнію. Нерозчинний матеріал відфільтровували, та фільтрат випаровували при пониженому тиску. Твердий залишок розтирали у порошок з гексаном з метою отримання етил 2-(3-хлор-5фторфенілгідразино)пропіонату (4,0г) у вигляді блідо-коричневої твердої речовини. APCI-Mass m/Z 259/261 (М+Н). (2) Вищезгадану сполуку обробляли подібно до того, як обробляли сполуку порівняльного прикладу 3 - (2), (3), (4) та (5), з метою отримання вказаної у заголовку сполуки, 4-хлор-6-фторіндоліну у вигляді безбарвної олії. APCI-Mass m/Z 172/174 (М+Н). 1Н-ЯМР (ДМСО-d6) 2,90 (т, J = 9,3Гц, 2Н), 3,52 (т, J = 8,7Гц, 2Н), 6,16 (с, 1Н), 6,19 (дд, J = 10,1, 1,9Гц, 1H), 6,35 (дд, J = 9,5, 1,9Гц, 1Н). Фармакологічні дослідження 1. Аналіз на інгібування SGLT2 Тестові сполуки: Сполуки, описані у вищенаведених прикладах використовували у аналізі інгібування SGLT2. Спосіб: Клітини СНОК1, які експресують людський SGLT2, посіяли у 24-лункові планшети густиною 400,000 клітин/лунку у харчове середовище F-12 (Ham's F-12), яке містить 10% сироватку бичого зародку, 400мкг/мл Geneticin, 50од./мл пініциліну G-натрію (Gibco-BRL) та 50мкг/мл стрептоміцинсульфату. Після культивування протягом 2 днів при 37°С у вологій атмосфері, яка містила 5% CO2, клітини один раз промивали буфером для аналізу (137мМ NaCI, 5мМ KCI, 1мМ CaCI2, 1мМ MgCI2, 50мМ Hepes, та 20мМ Tris, рН 7,4) та інкубували з 250мкл буферу, який містить тестові сполуки, протягом 10 хвилин при 37°С. Тестові сполуки розчиняли у ДМСО. Кінцева концентрація ДМСО становила 0,5%. Реакцію транспортування ініціювали шляхом додавання 50мкл розчину [14С]-метил- -Dглюкопіранозиду (14C-AMG) (кінцева концентрація становила 0,5мМ). Після інкубації протягом 2 годин при 37°С, реакцію зупиняли шляхом відсмоктування інкубаційної суміші, клітини промивали тричі льодовим PBS (забуферений фосфатом фізіологічний розчин). Потім клітини солюбілізували 0,3N NaOH та взяли аліквоти для визначення радіоактивності за допомогою рідинного сцинтиляційного лічильника. Неспецифічне поглинання Комп’ютерна верстка А. Крулевський 28 AMG було визначено як те, що з'явилось у присутності 100мкМ флоризину - специфічного інгібітора натрій-залежного спів-транспотеру глюкози. Специфічне поглинання стандартизували відповідно до концентрацій білка, виміряних за способом Бредфорду. Концентрація, яка інгібує на 50% (IC50), виміряна за кривими залежності відповіді від дози методом найменших квадратів. Результати: Результати показані на наступній таблиці: Таблиця 1 Тестова сполука (Приклад №) 1 2 3 4 IC50 (нМ) 1,9 2,3 2,8 3,6 2. Тест на рівень глюкози у сечі пацюків Тестові сполуки: Сполуки, описані у вищенаведених прикладах, використовували для визначення рівня глюкози у сечі пацюків. Способи: Самці пацюків лінії Sprague-Dawley (SD) віком 6-тижнів помістили у окремі клітки з вільним доступом до їжі та води за 2 дні до експерименту. На початку експерименту вранці пацюкам ввели ліки (0,2% розчин карбоксиметилцелюлози, який містив 0,2% Tween 80) або тестові сполуки (30мг/кг) орально крізь зонд у кількості 10мл/кг. Потім сечу збирали протягом 24 годин, та вимірювали об'єм сечі. Потім обчислювали концентрацію глюкози у сечі, використовуючи набір ферментів, та обчислювали денну кількість глюкози, екскреговану у сечу кожним пацюком. Результати: Рівні кількості глюкози у сечі позначені А, В та C. Ці рівні є наступними: А 2400мг; 2400мг > В 2000мг; 2000мг > C. Таблиця 2 Тестові сполуки (Приклад №) 1 2 3 4 Підписне Рівень глюкози у сечі В А В C Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1-(-d-glycopyranosyl)-3-(4-cyclopropylphenylmethyl)-4-halogeno indole derivatives and use thereof as sglt inhibitors
Автори англійськоюNomura Sumihiro, Sakamaki Shigeki
Назва патенту російськоюПроизводные 1-(d-глюкопиранозил)-3-(4-циклопропилфенилметил)-4-галогеноиндола и их применение в качестве ингибиторов sglt
Автори російськоюНомура Сумихиро, Сакамаки Шигеки
МПК / Мітки
МПК: A61K 31/706, C07H 19/04
Мітки: 1-(d-глюкопіранозил)-3-(4-циклопропілфенілметил)-4-галогеноіндолу, похідні, інгібіторів, застосування
Код посилання
<a href="https://ua.patents.su/14-92100-pokhidni-1-d-glyukopiranozil-3-4-ciklopropilfenilmetil-4-galogenoindolu-ta-kh-zastosuvannya-yak-ingibitoriv-sglt.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-(d-глюкопіранозил)-3-(4-циклопропілфенілметил)-4-галогеноіндолу та їх застосування як інгібіторів sglt</a>
Попередній патент: Універсальна берегозахисна споруда
Наступний патент: Котел-утилізатор для переробки зношених шин
Випадковий патент: Спосіб девулканізації гуми












