Спосіб одержання оптично активних амінопохідних
Номер патенту: 95598
Опубліковано: 25.08.2011
Автори: Мутоу Ейго, Інагакі Ацуші, Ураяма Шінічі, Окада Такаші, Сугісакі Шігехару
Формула / Реферат
1. Спосіб одержання (S)-2-(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8-іл)етиламіну або його солі, в якому
(і) (Е)-2-(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8-іліден)етиламін або його сіль піддають асиметричному відновленню каталізатором, і
(іі) продукт реакції, одержаний на стадії (і), піддають каталітичному відновленню при температурі реакції від 40 °С до 100 °С і рН 3-9 в присутності каталізатора.
2. Спосіб згідно з пунктом 1, де температура реакції на стадії (іі) становить 50-70 °С.
3. Спосіб згідно з пунктом 1, де рН на стадії (іі) становить 5-7.
4. Спосіб згідно з пунктом 1, де як каталізатор на стадії (і) використовують Ru-BINAP каталізатор.
5. Спосіб згідно з пунктом 1, де як каталізатор на стадії (іі) використовують Pd-C каталізатор.
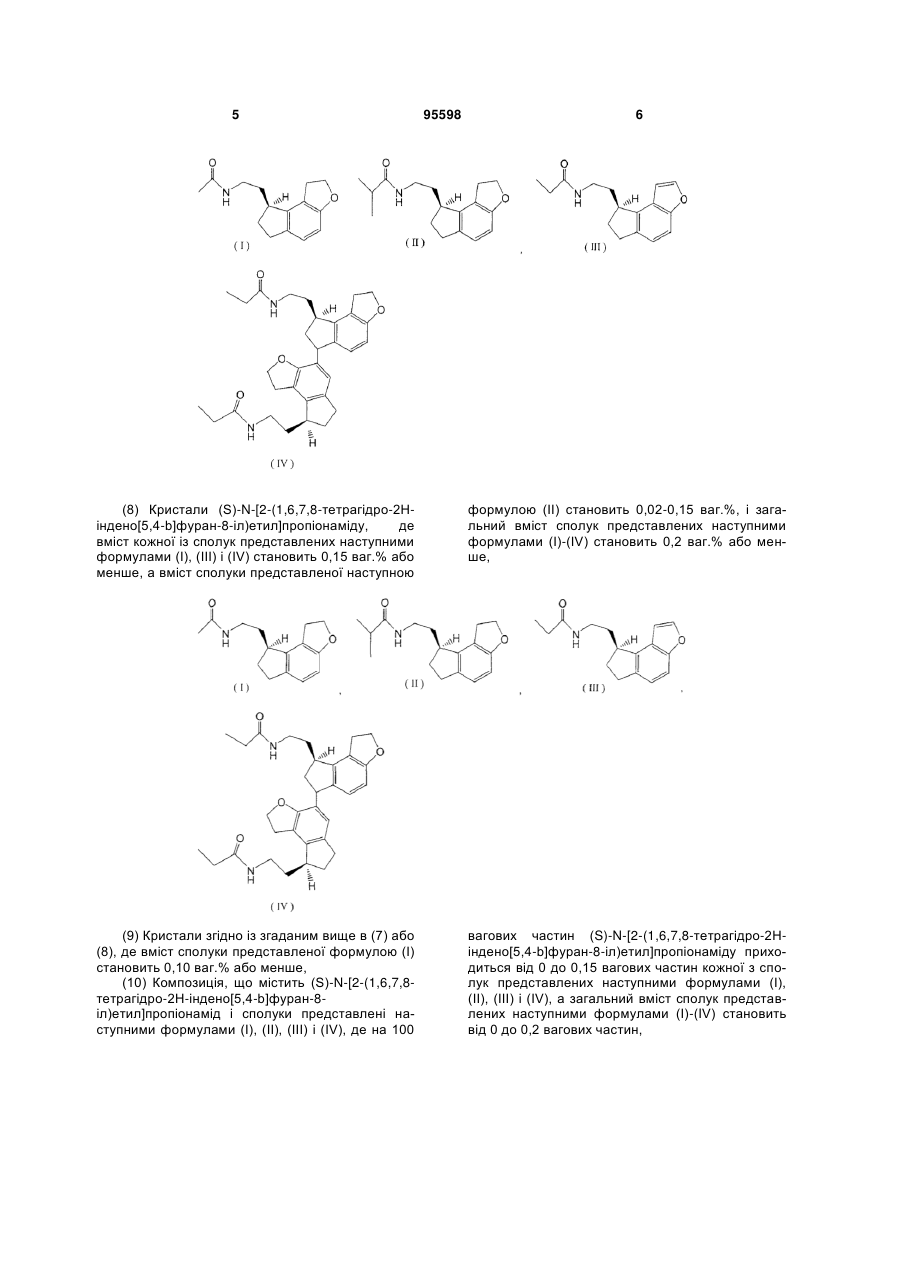
6. Спосіб одержання кристалів (S)-N-[2-(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8-іл)етил]пропіонаміду, в якому
(а) (S)-2-(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8-іл)етиламін, або його сіль, одержаний в способі згідно з пунктом 1, піддають пропіонілуванню аміногрупи, і
(б) кристалізують шляхом додавання водного розчинника до реакційного розчину, одержаного на стадії (а).
Текст
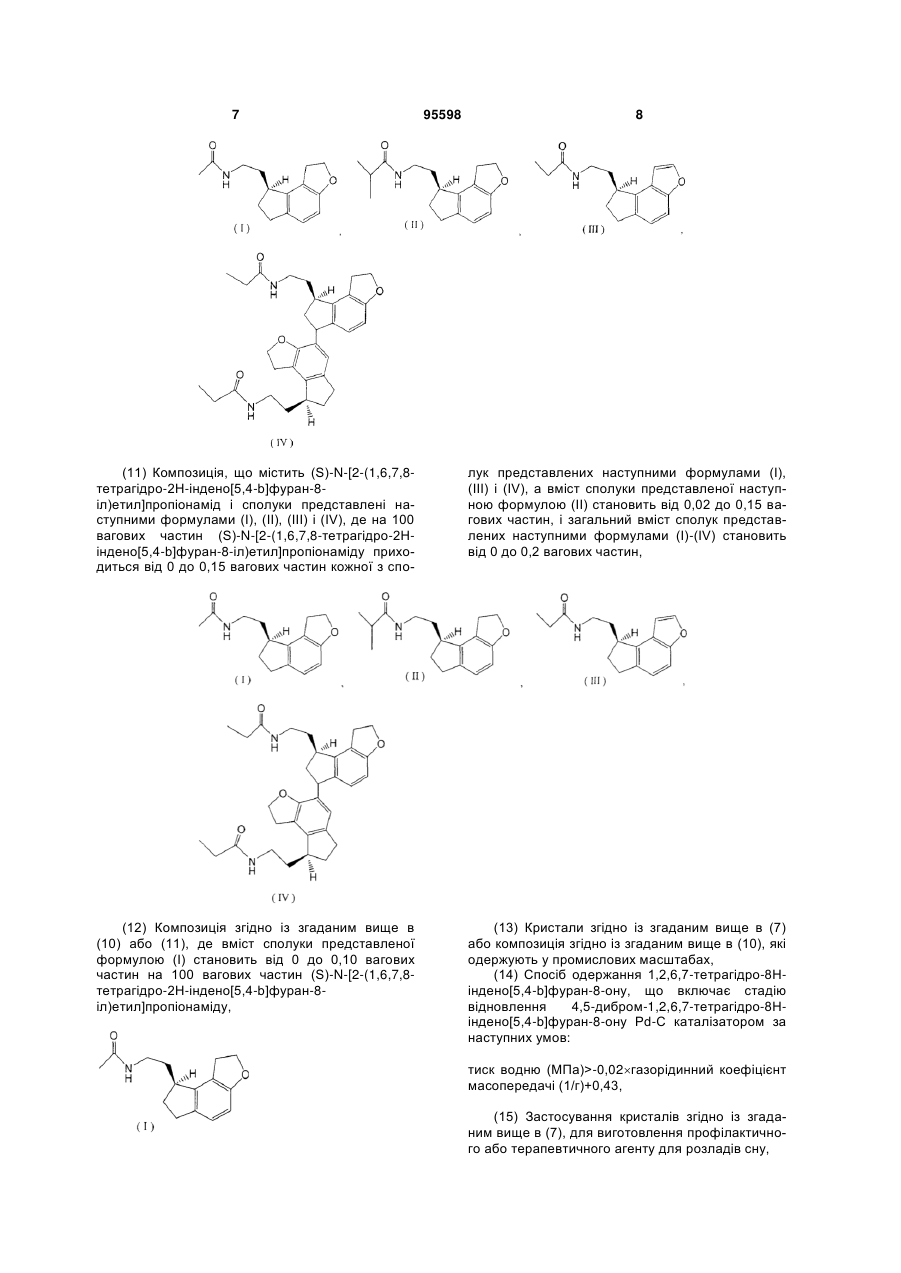
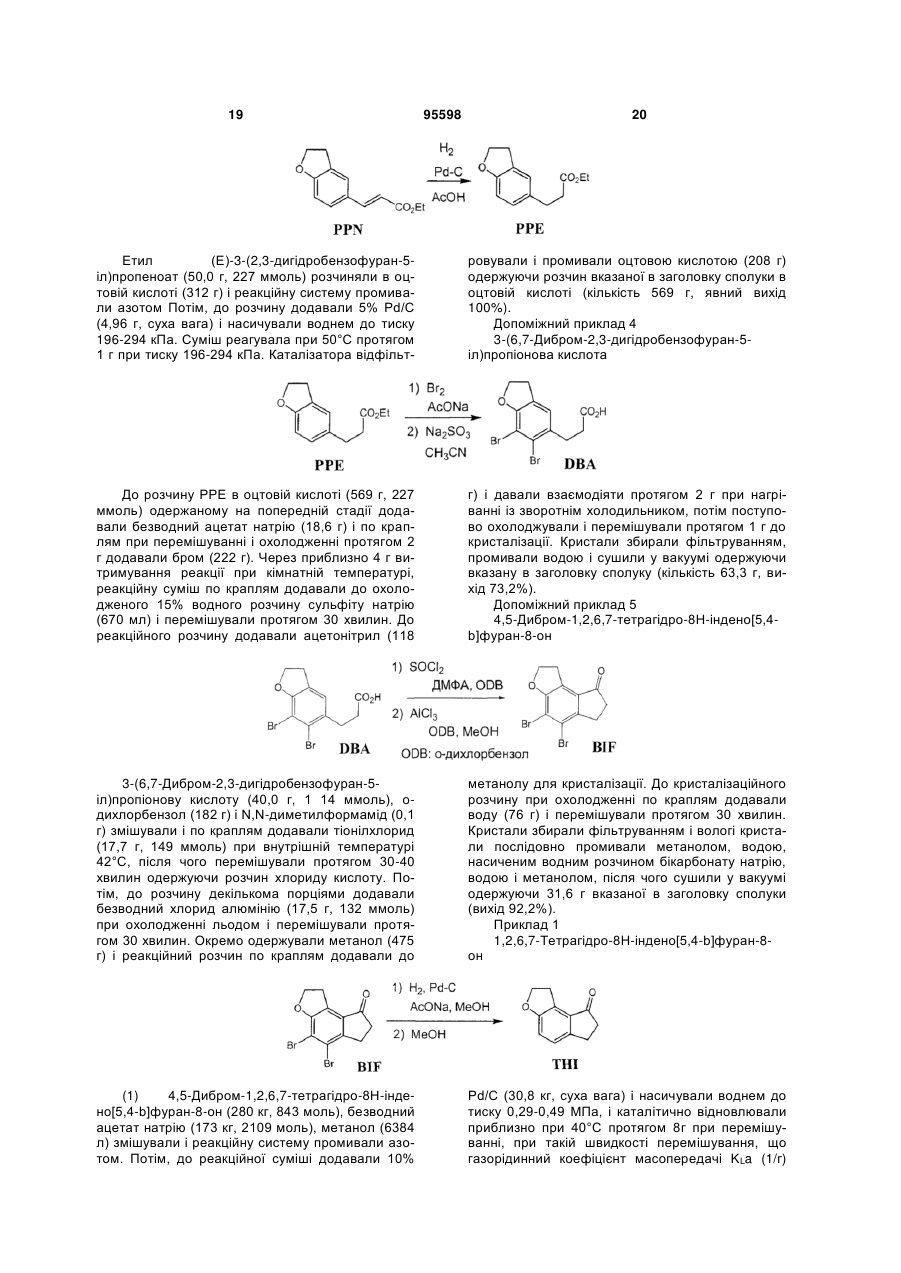
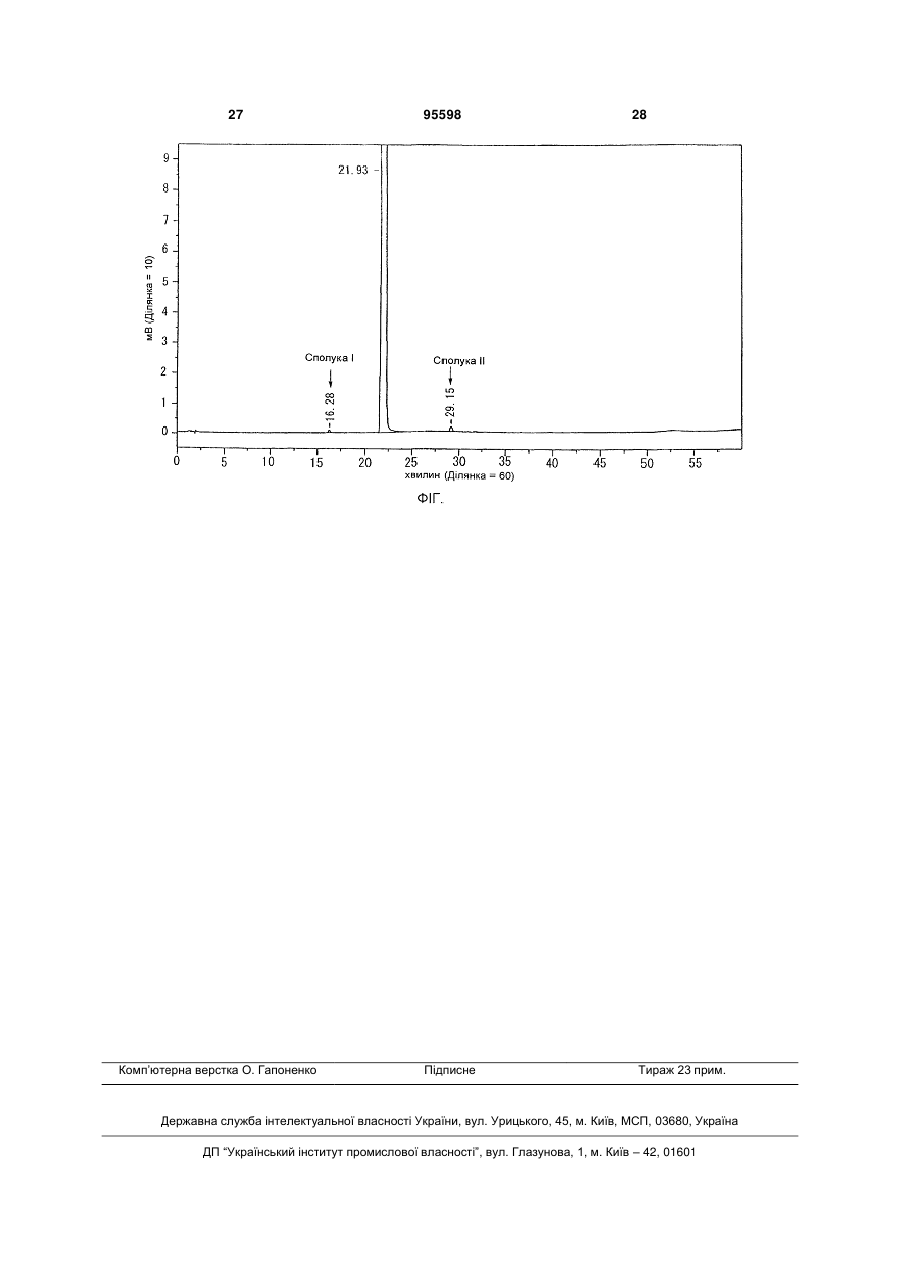
1. Спосіб одержання (S)-2-(1,6,7,8-тетрагідро2Н-індено[5,4-b]фуран-8-іл)етиламіну або його солі, в якому C2 2 (19) 1 3 З іншого боку, в Liebigs. Ann. Chem., 10,945 (1989) і J. Chem. Soc. (A), 1324 (1968) описується димеризація бензофуранової сполуки в присутності Pd-каталізатора. Однак, в цих випадках має місце димеризація через зв'язування двох ароматичних кілець, і структури їх димерів відрізняються від тих димерів, що утворюються при реакції між ароматичним кільцем і бензольним положенням, і подібні сполуці представленій приведеною вище формулою (IV'). Крім того, J Chem. Soc. D, 736 (1970) описує, що окислення бензильного положення бензофуранової сполуки має місце в присутності Pd-каталізатора, але утворення димеру тут не описується. Опис винаходу Об'єктом представленого винаходу є промисловий спосіб одержання оптичноактивного амінопохідного з високим виходом і високою чистотою, в якому утворення побічних продуктів є контрольованим. Внаслідок інтенсивних досліджень спрямованих на вирішення цієї проблеми, винахідниками було знайдено, що на стадіях одержання оптичноактивного амінопохідного, утворення побічних продуктів представлених приведеними вище формулами (IIІ') і (IV') можна контролювати шляхом контролювання рН і температури реакційного розчину під час каталітичного відновлення Pd-C і під час його обробки і завершення представленого винаходу. Тобто, представлений винахід забезпечує: (1) Спосіб одержання (S)-2-(1,6,7,8-тетрагідро2Н-індено[5,4-b]фуран-8-іл)етиламіну або його 95598 4 солі, який включає стадію (і): асиметричне відновлення (Е)-2-(1,6,7,8-тетрагідро-2Н-індено[5,4b]фуран-8-іліден)етиламіну або його солі каталізатором, і стадію (іі): каталітичне відновлення продукту реакції одержаного на стадії (і) при температурі реакції від 40°С до 100°С і рН 3-9 в присутності каталізатора, (2) Спосіб згідно із згаданим вище в (1), де температура реакції на стадії (іі) становить 50°С70°С, (3) Спосіб згідно із згаданим вище в (1), де рН на стадії (іі) становить 5-7, (4) Спосіб згідно із згаданим вище в (1), де каталізатором на стадії (і) є Ru-BINAP каталізатор, (5) Спосіб згідно із згаданим вище в (1), де каталізатором на стадії (іі) є Pd-C каталізатор, (6) Спосіб одержання кристалів (S)-N-[2(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонаміду, що включає стадію (а): пропіонілювання аміногрупи (S)-2-(1,6,7,8-тетрагідро2Н-індено[5,4-b]фуран-8-іл)етиламіну або його солі одержаного в способі згідно із згаданим вище в (1), i стадію (б): кристалізація при додаванні водного розчинника до реакційного розчину одержаного на стадії (а), (7) Кристали (S)-N-[2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етил]пропіонаміду, де вміст кожної із сполук представлених наступними формулами (І), (II), (III) i (IV) становить 0,15 ваг.% або менше, i загальний вміст сполук представлених наступними формулами (І)-(IV) становить 0,2ваг.% або менше, 5 95598 6 (8) Кристали (S)-N-[2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етил]пропіонаміду, де вміст кожної із сполук представлених наступними формулами (І), (III) i (IV) становить 0,15 ваг.% або менше, а вміст сполуки представленої наступною формулою (II) становить 0,02-0,15 ваг.%, i загальний вміст сполук представлених наступними формулами (І)-(IV) становить 0,2 ваг.% або менше, (9) Кристали згідно із згаданим вище в (7) або (8), де вміст сполуки представленої формулою (І) становить 0,10 ваг.% або менше, (10) Композиція, що містить (S)-N-[2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонамід і сполуки представлені наступними формулами (І), (II), (III) і (IV), де на 100 вагових частин (S)-N-[2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етил]пропіонаміду приходиться від 0 до 0,15 вагових частин кожної з сполук представлених наступними формулами (І), (II), (III) і (IV), а загальний вміст сполук представлених наступними формулами (І)-(IV) становить від 0 до 0,2 вагових частин, 7 95598 8 (11) Композиція, що містить (S)-N-[2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонамід і сполуки представлені наступними формулами (І), (II), (III) і (IV), де на 100 вагових частин (S)-N-[2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етил]пропіонаміду приходиться від 0 до 0,15 вагових частин кожної з спо лук представлених наступними формулами (І), (III) і (IV), а вміст сполуки представленої наступною формулою (II) становить від 0,02 до 0,15 вагових частин, i загальний вміст сполук представлених наступними формулами (І)-(IV) становить від 0 до 0,2 вагових частин, (12) Композиція згідно із згаданим вище в (10) або (11), де вміст сполуки представленої формулою (І) становить від 0 до 0,10 вагових частин на 100 вагових частин (S)-N-[2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонаміду, (13) Кристали згідно із згаданим вище в (7) або композиція згідно із згаданим вище в (10), які одержують у промислових масштабах, (14) Спосіб одержання 1,2,6,7-тетрагідро-8Ніндено[5,4-b]фуран-8-ону, що включає стадію відновлення 4,5-дибром-1,2,6,7-тетрагідро-8Ніндено[5,4-b]фуран-8-ону Pd-C каталізатором за наступних умов: тиск водню (МПа)>-0,02газорідинний коефіцієнт масопередачі (1/г)+0,43, (15) Застосування кристалів згідно із згаданим вище в (7), для виготовлення профілактичного або терапевтичного агенту для розладів сну, 9 (16) Композиція згідно із згаданим вище в (10), яка є профілактичним або терапевтичним агентом для розладів сну, i (17) Спосіб профілактики або лікування розладів сну, що включає введення кристалів згідно із згаданим вище в (8) або композиції згідно із згаданим вище в (10). Короткий опис малюнків Фігура є ВЕРХ графіком, який показує вміст сполук (І)-(IV) в кристалах (S)-N-[2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонаміду Найкращі способи втілення винаходу Прикладами солі (S)-2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етиламіну в представленому винаході є солі з неорганічними кислотами, такими як хлорводнева кислота, сірчана кислота i азотна кислота, солі з органічними кислотами, такими як мурашина кислота, оцтова кислота i трифтороцтова кислота i їм подібні. Крім того, (Е)-2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іліден)етиламін, який є неочищеною сполукою, що використовується для одержання (S)-2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етиламіну або його солі представленого винаходу, можна одержати за способом описаним в JP-A 2002-212063, тобто, способом каталітичного відновлення 4,5-дибром1,2,6,7-тетрагідро-8Н-індено[5,4-b]фуран-8-ону з використанням каталізатора каталітичного відновлення, такого як Pd-C, з наступною реакцією одержаного 1,2,6,7-тетрагідро-8Н-індено[5,4b]фуран-8-ону з діетилціанометилфосфонатом, з наступним гідруванням в присутності кобальтового каталізатора або за допомогою аналогічних способів. На стадії каталітичного відновлення, каталітичне відновлення 4,5-дибром-1,2,6,7-тетрагідро8Н-індено[5,4-b]фуран-8-ону можна провести шляхом змішування 4,5-дибром-1,2,6,7тетрагідро-8Н-індено[5,4-b]фуран-8-ону, органічного розчинника і, якщо бажано, основи, потім переважно, систему промивають азотом, додають каталізатор каталітичного відновлення, після чого під тиском вводять водень i перемішують. Тут, з точки зору контролю утворення побічного продукту (специфічно, димеру), переважно реакцію слід проводити в умовах тиску водню i газорідинного коефіцієнта масопередачі, який визначається нерівністю: тиск водню (МПа)>-0,02газорідинний коефіцієнт масопередачі (1/г)+0,43 Тут далі, газорідинний коефіцієнт масопередачі можна визначити за допомогою способу Na2SO3, як детально описано в приведеному далі Прикладі 1. Крім того, тиск водню в представленій реакції зазвичай становить від 0,1 до 1 МПа, переважно від 0,3 до 0,5 МПа. В газорідинній системі, швидкість NA, з якою газ розчиняється в розчині на одиницю поверхні контакту можна виразити подібно до випадку швидкості розчинення в твердо-рідинній системі, 95598 10 швидкості екстракції в рідинно-рідинній системі i феномену передачі при передачі тепла завдяки конвекції, i дається у формі (коефіцієнт масопередачі)(різниця концентрацій). NA=KL(Cl-C) (1) Тут, KL є коефіцієнтом масопередачі для рідини, Cl є концентрацією, яка є в рівновазі з парціальним тиском газу в газі, що барботується, i С є концентрацією насичення в даний час, i (Cl-C) є рушійною силою для абсорбції газу Крім того, дано, що А є площею контакту газрідина, i VL є об'ємом рідини, оскільки збільшення швидкості VLdC/dt концентрації газу в розчині є еквівалентним швидкості розчинення газу, можна прийняти наступне рівняння. NAA=VLdC/dt (2) Таким чином, рівняння: dC/dt=KLA(Cl-C)/VL (3) є похідним від рівнянь формул (1) i (2) Крім того, дано, що A/VL представлено: поверхня розділу газ-рідина на одинцю площі, задається рівнянням: dC/dt=KLa(Cl-C) (4) Оскільки складно одержати площу поверхні розділу газ-рідина: незалежно в системі газрідина, що перемішується, значення коефіцієнту масопередачі для рідини KLa, яка є продуктом i коефіцієнт масопередачі для рідини KL використовується як показник для вираження абсорбційної здатності газу. Крім того, виходячи з того, що коли швидкість перемішування збільшується, площа поверхні розділу газ-рідина стає більшою, загалом можна сказати, що KLa стає більшим із збільшенням швидкості перемішування. Прикладами органічного розчинника, що використовується в представленому винаході є мурашина кислота, оцтова кислота, метанол, етанол, N-метилпіролідон i їм подібні, i особливо переважним є метанол. Ці розчинники можуть бути використані окремо або як суміш 2 або більшої кількостіз них. Кількість використовуваного розчинника становить від 5 до 100 мл, переважно від 15 до 25 мл, на 1 г неочищеної сполуки. Прикладами використовуваних в представленій реакцій основ є безводний ацетат натрію, Et3N, піридин, NaHCO3, Na2CO3 i їм подібні. Зокрема, переважними є безводний ацетат натрію i Et3N. Кількість використовуваної основи зазвичай становить від 2 до 3 моль еквівалентів. Прикладами каталізатора каталітичного відновлення, що використовується в представленій реакції, є Pd-C, PtO2, Rh-AI2O3, (RhCI[P(C6H5)3]3) i їм подібні. Кількість використовуваного каталізатора каталітичного відновлення становить від 1/10 моль еквівалентів до 5/1000 моль еквівалентів, переважно від 1/100 моль еквівалентів до 11 3/100 моль еквівалентів відносно 1 моля неочищеної сполуки, що використовується на стадії (і). Температура представленої реакції зазвичай становить від 10°С до 100°С, переважно від 30°С до 50°С, i час реакції зазвичай становить від 1 до 50 г, переважно від 2 до 10 г. (Е)-2-(1,6,7,8-тетрагідро-2Н-індено[5,4b]фуран-8-іліден)етиламін, що використовується в представленому винаході, може бути використаний у формі вільної сполуки або її солі. Прикладами такої солі є сіль з неорганічною кислотою, такою як хлорводнева кислота, сірчана кислота i азотна кислота, сіль з органічною кислотою, такою як мурашина кислота, оцтова кислоті i трифтороцтова кислота i їм подібні. Спосіб одержання (S)-2-(1,6,7,8-тетрагідро2Н-індено[5,4-b]фуран-8-іл)етиламіну або його солі представленого винаходу включає стадію (і) асиметричного відновлення неочищеної сполуки: (Е)-2-(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8іліден)етиламін або й сіль, i стадію (ii) перетворення побічного продукту в реакції одержання продуктів на стадії (і) у цільову сполуку шляхом каталітичного відновлення. Асиметричне відновлення на стадії (і) проводять використовуючи каталізатор i прикладами такого каталізатора для асиметричного відновлення є комплекс рутеній-оптичноактивний фосфін (Ru-BINAP), комплекс родій-оптичноактивний фосфін (Rh-BINAP), комплекс ірідійоптичноактивний фосфін (Ir-BINAP) i їм подібні. Як Ru-BINAP каталізатор, особливо слід відзначити Ru2CI4[(R)-BINAP]2N(C2H5)3, {RuСl(Бензол)[(R)-ВINАР]}СI, {RuCI(п-Kyмен)[(R)BINAP]}CI, {RuBr(п-Kyмен)[(R)-BINAP]}Br, {Rul(пKyмен)[(R)-BINAP]}l3, {Rul(п-Kyмен)[(R)-BINAP]}l i їм подібні. Ці каталізатори можна одержати згідно з відомою методикою, наприклад, використовуючи способи описані в JP-B 07-57758, JP-A 11140073 i т.i. Як каталізатора асиметричного відновлення, переважним є {RuСІ(Бензол)[(E)-BINAP]}CI. Коли використовується сіль (Е)-2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іліден)етиламіну, як неочищена сполука в реакції асиметричного відновлення стадії (і), й перетворюють у вільну сполуку шляхом обробки лугом, розчиняють в органічному розчинника i до розчину додають каталізатор асиметричного відновленням i потім проводять реакцію асиметричного відновлення під тиском в атмосфері водню. Прикладами органічного розчинника є ароматичні вуглеводні (наприклад, толуол, бензол i т.i.), спирти (наприклад, метанол, етанол i т.i.), аліфатичні естери (етилацетат, н-пропілацетат, нбутилацетат i т.i.), етери (наприклад, ізопропіловий етер, діетиловий етер, тетрагідрофуран (THF) i т.i.), галогеновані вуглеводні (наприклад, дихлорметан, дихлоретан i т.i.), аміди (наприклад, Ν,Ν-диметилформамід i т.i.), i їм подібні. Ці розчинники можна використовувати окремо або як суміш 2 або більше з них, i серед них, змішаний розчинник толуол i метанол, змішаний розчинник тетрагідрофуран i метанол, i їм подібні є переважними. Кількість використовуваного роз 95598 12 чинника становить від 1 до 1000 мл, переважно від 2 до 20 мл, на 1 г неочищеної сполуки. Кількість доданого каталізатора асиметричного відновлення, що використовується в представленій реакції, становить від 1/2 моль еквівалентів до 1/2000 моль еквівалентів, переважно від 1/10 моль еквівалентів до 1/1000 моль еквівалентів відносно 1 моля неочищеної сполуки i тиск водню становить від 0,5 до 15 МПа, переважно від 3 до 11 МПа. Крім того, температура реакції становить від 0 до 150°С, переважно від 10 до 80°С, i час реакції становить від 0,5 до 200 г, переважно від 5 до 50 г. Реакцію каталітичного відновлення згаданої вище стадії (ii) проводять використовуючи реакційний розчин одержаний на стадії (і) В реакційному розчині одержаному на стадії (і), сполука представлена наступною формулою (III') включена як побічний продукт, i на стадії (ii) цей побічний продукт перетворюється завдяки каталітичному відновленню у цільову сполуку, якою є (S)2-(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8іл)етиламін. Реакцію згаданої вище стадії (іі) проводять наступним чином. Тобто, до реакційного розчину одержаного на стадії (і) додають достатню кількість розведеної хлорводневої кислоти до розчинення продукту реакції при температурі нижче 10°С i продукт реакції переходить у водний шар шляхом при перемішуванні або збовтуванні, потім водний шар відокремлюють. Одержаний водний шар підлуговують до рН 3-9, переважно 5-7, використовуючи луг, такий як розведений водний розчин гідроксиду натрію, i додають каталізатор каталітичного відновлення для відновлення при тиску водню. Прикладами каталізатора каталітичного відновлення, що використовується в представленій реакції є Pd-C, PtO2, Rh-AI2O3, (RhСІ[Р(С6Н5)3]3), i їм подібні. Кількість використовуваного каталізатора каталітичного відновлення становить від 1/2 моль еквівалентів до 1/2000 моль еквівалентів, переважно від 1/10 моль еквівалентів до 1/500 моль еквівалентів відносно 1 моля неочищеної сполуки, що використовується на стадії (і), i тиск водню становить від 0,5 до 15 МПа, переважно від 3 до 11 МПа. Крім того, температура реакції становить від 40°С до 100°С, переважно від 50°С до 70°С, i час реакції становить від 0,5 до 200 г, переважно від 3 до 20 г. Реакційний розчин одержаний в реакції каталітичного відновлення фільтрують для видалення каталізатора i обробляють використовуючи способи відомі в цій галузі (наприклад, концентрування, кристалізація, перекристалізація, хромато 13 графія i т.i.) одержуючи (S)-2-(1,6,7,8-тетрагідро2Н-індено[5,4-b]фуран-8-іл)етиламін. Крім того, одержаний (S)-2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8-іл)етиламін можна перетворити у бажану сіль згідно з відомими методиками. Коли реакцію i наступну обробку згаданої вище стадії (ii) проводити без контролю рН, тобто, в сильно кислому середовищі з рН приблизно менше 1, згадане вище похідне бензофурану (III') утворюється в кількості від приблизно 5 до 10% i димер дигідробензофурану (IV') утворюється в кількості приблизно 0,2%, які є побічними продуктами. На відміну від цього, кількості цих побічних продуктів можна знизити до позначки менше 0,07% i менше 0,02%, відповідно, при проведенні реакції представленого винаходу при рН від 3 до 9, переважно при рН 5-7. Спосіб одержання кристалу (S)-N-[2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонаміду представленого винаходу буде описуватись нижче. Спосіб включає стадію (а) пропіонілювання аміногрупи (S)-2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8-іл)етиламіну i стадію (б) кристалізації реакційного розчину одержаного на стадії (а). Тобто, на стадії (а), аміногрупа (S)-2-(1,6,7,8-тетрагідро-2Н-індено[5,4b]фуран-8-іл)етиламіну, одержаного в згаданому вище способі, взаємодіє з пропіонілюючим агентом до утворення пропіонілату. Коли неочищений матеріал, (S)-2-(1,6,7,8-тетрагідро-2Н-індено[5,4b]фуран-8-іл)етиламін, використовується у формі солі, його перетворюють у вільну сполуку звичайним способом, після чого піддають реакції пропіонілювання. Прикладами пропіонілювальних агентів є пропіонілгалоїди, такі як пропілнілхлорид i пропіонілбромід. Кількість використовуваного пропіонілювального агенту становить від 1 до 2 моль на 1 моль (S)-2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етиламіну. Реакцію проводять в розчиннику i прикладами розчинника є етери, такі як тетрагідрофуран, діетиловий етер, діоксан i 1,2-диметоксиетан, 95598 14 спирнти, такі як метанол, етанол i пропанол, вуглеводні, такі як бензол, толуол, циклогексан i гексан, аміди, такі як Ν,Ν-диметилформамід i Ν,Ν-диметилацетамід, галогеновані вуглеводи, такі як дихлорметан, хлороформ, тетрахлорид вуглецю i 1,2-дихлоретан, нітрили, такі як ацетонітрил i пропіонітрил, сульфоксиди, такі як диметилсульфоксид, i їм подібні i змішані розчинники, між тим, переважним тетрагідрофуран. Час реакції зазвичай становить від 5 хвилин до 48 г, переважно від 30 хвилин до 6 г. Температура реакції зазвичай становить від -20 до 200°С, переважно від -10 до 50°С. На стадії (б), кристали (S)-N-[2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонаміду кристалізують додаючи водний розчинник до реакційного розчину одержаного на стадії (а). Прикладами водного розчинника є водопровідна вода, чиста вода, очищена вода i т.i. Кількість доданого водного розчинника становить 0,5-5 об'ємів відносно об'єму реакційного розчину одержаного на стадії (а). Температура кристалізації зазвичай становить від -20 до 60°С, переважно від -10 до 40°С. Кристали (S)-N-[2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етил]пропіонаміду одержують з високим виходом 97% збираючи кристали, що випали в осад, фільтруванням. Високочисті кристали (S)-N-[2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етил]пропіонаміду можна одержати наступною перекристалізацією одержаних кристалів з етанол-вода (1:2). Хоча кристали (S)-N-[2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етил]пропіонаміду одержані в способі представленого винаходу можуть містити сполуки представлені наступними формулами (I)-(IV), як домішки (в представленому описі, тут далі, іноді згадуються як сполуки (І)(IV), відповідно), вміст кожної з сполук (І)-(IV) становить 0,15 ваг.% або менше і загальний вміст сполук (І)-(IV) становить приблизно 0,20 ваг.% або менше. 15 Наприклад, в кристалах (S)-N-[2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонаміду одержаних в способі представленого винаходу, вміст кожної з сполук (III) і (IV) менше межі детектування, менше ніж 0,02ваг.% (ВЕРХ), вміст сполуки (І) становить приблизно 0,1 ваг.% або менше (переважно, 0,03ваг.% або менше), і вміст сполуки (II) становить від приблизно 0,02 до приблизно 0,15 ваг.%, і загальний вміст сполук (І)-(IV) становить приблизно 0,20 ваг.% або менше. Як описано вище, високоякісні кристали (S)N-[2-(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонаміду можна одержати шляхом контролювання вмісту домішок, і як результат, покращення кристалічності супроводжується покращенням чистоти, покращенням стабільності і їм подібних властивостей. Крім того, коли (S)-N-[2(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонамід використовується як медичний препарат, зменшення домішок є надзвичайно важливим з точки зору гарантування якості для пацієнтів. Згідно з представленим винаходом, такі кристали можна одержати в комерційних масштабах. Крім того, використовуючи такі кристали, можна виготовити композицію представленого винаходу згідно з відомою методикою. (S)-N-[2-(1,6,7,8-тетрагідро-2Н-індено[5,4b]фуран-8-іл)етил]пропіонамід представленого винаходу має фізіологічну активність, таку як спорідненість до рецептору мелатоніну, крім того, має низьку токсичність і незначні побічні ефекти. Крім того, він може використовуватись для попередження і лікування дисретмії сну-неспання, порушення добового ритму організму, порушення біоритму внаслідок роботи в три зміни і т.і, сезонної меланхолії, захворювання репродуктивної і нейроендокринної системи, старечої деменції, хвороби Альцгеймера, різних захворювань, що супроводжують старіння (наприклад, попередження старіння і т.і.), розладу мозкового кровообігу (церебральна апоплексія і т.і.), травми голови, травми кісткового мозку, стресу, епілепсії, конвульсії, тривоги, депресії, хвороби Паркінсона, гіпертензії, глаукоми, раку, безсоння, діабету, нападу головного болю і їм подібних, і крім того, він також ефективний для імуномодулювання, ноотропізму, стабілізування психічного стану і регулювання овуляції (наприклад, контрацепція). Сполуки представленого винаходу можуть бути використані в комбінації з антидепресантом (наприклад, іміпрамін, кломіпрамін, ноксиптилін, фенелзин, амітриптиліну гідрохлорид, нортрипиліну гідрохлорид, амоксапін, міансерну гідрохлорид, мапротиліну гідрохлорид, сульпірид, флувоксаміну малеат, тразодону гідрохлорид, пароксетину гідрохлорид, мілнаципрану гідрохлорид, флуоксетин, венлафаксин, Мітразапін, Сертралін, циталопрам, дулоксетин, ребоксетин, Моклобемід), седативним лікарським засобом (наприклад, діазепам, оксазолам, бромазепам, алпразолам, клоназепам, буспірон, тандоспірону цитрат), стабілізатором настрою (наприклад, літій, валпронова кислота, карбамазепін), агентом 95598 16 для лікування деменції (наприклад, такрин, денепезил, ривастигмін, галантамін, мемантин), антипсихотичним лікарським засобом (наприклад, галоперідол, оланзапін, рисперідон, кветіапін, зипразидон, хлорпромазин, сульпірид, Аріпіпразол), антиелептичним лікарським засобом (наприклад, фенобарбітал, габапентин, тіагабін, прегабалін), агентом, що покращує церебральний кровообіг, мозковим метаболічним стимулятором і їм подібними. Прикладами форм введення є (1) введення окремої рецептури одержаної шляхом формулювання разом сполуки представленого винаходу і лікарського засобу спільного застосування, (2) одночасне окреме введення двох видів рецептур одержаних шляхом формулювання сполуки представленого винаходу і лікарського засобу спільного застосування, із застосуванням ідентичних шляхів введення, (3) послідовне і почергове окреме введення двох видів рецептур одержаних шляхом формулювання сполуки представленого винаходу і лікарського засобу спільного застосування, із застосуванням ідентичних шляхів введення, (4) одночасне окреме введення двох видів рецептур одержаних шляхом формулювання сполуки представленого винаходу і лікарського засобу спільного застосування, із застосуванням різних шляхів введення і (5) послідовне і почергове введення двох видів рецептур одержаних шляхом формулювання сполуки представленого винаходу і лікарського засобу спільного застосування, із застосуванням різних шляхів введення (наприклад, введення в прядку сполука представленого винаходу лікарський засіб спільного застосування, або введення в зворотному порядку). Доза лікарського засобу спільного застосування може прийнятно вибиратись виходячи з клінічно використовуваної дози. Крім того, співвідношення змішаної сполуки представленого винаходу і лікарського засобу спільного застосування може прийнятно вибиратись в залежності від суб'єкта, якому вводиться, шляху введення, хвороби суб'єкта, симптому, комбінації і їм подібних факторів. Наприклад, коли суб'єктом є людина, можна використовувати від 0,01 до 100 вагових частин лікарського засобу спільного застосування стосовно 1 вагових частин сполуки представленого винаходу. (S)-N-[2-(1,6,7,8-тетрагідро-2Н-індено[5,4b]фуран-8-іл)етил]пропіонамід представленого винаходу можна використовувати як фармацевтичний сировинний матеріал подрібнений у струменевому млині і т.і., і однорідність рецептури і їм подібні параметри можна гарантувати шляхом доведення розміру частинок (середній розмір) до приблизно 1-10 мкм. Розмір частинок можна виміряти як показано далі використовуючи комерційно доступні пристрої для вимірювання. У 100 мл колбу Ерленмейера споряджену пробкою завантажують 0,05 г зразка і додають 50мл дисперсійного середовища. Суміш опромінюють ультразвуковими хвилями протягом приблизно 5 хвилин при струшуванні і перемішуванні 17 95598 18 одержуючи суспензію. До 40 мл дисперсійного середовища додають приблизно 100 мкл цієї суспензії і проводять тест за наступних умов. [Дисперсійне середовище] 0,1% розчин лаурилсульфату натрію насичений (S)-N-[2-(1,6,7,8-тетрагідро-2H-індено[5,4b]фуран-8-іл)етил]пропіонамідом [Пристрій] система HELOS KF (Sympatec GmbH) сенсор HELOS дисперсійна одиниця CUVETTE (вологий розпилювач) стандартне програмне забезпечення HELOS: WINDOX 3.2 (для Windows) або еквівалент [Умови вимірювання] Фокусна відстань: 100 мм Швидкість перемішування: 50% Час вибірки: 1 секунда Час вимірювання: 10 секунд Сполука представленого винаходу може безпечно вводитись перорально або парентерально (наприклад, місцево, ректально, внутрішньовенно і т.і.) як самостійно так і у вигляді рецептури, такої як таблетки (включаючи таблетки з цукровим покриттям, таблетки з плівковим покриттям), порошки, гранули, капсули, розчини, емульсії, суспензії, ін'єкційні рецептури, супозиторії, агенти тривалого вивільнення і адгезивні рецептури, що одержуються шляхом змішування з фармакологічно прийнятним носієм згідно із загальновідомим методом (наприклад, метод описаний в Японській фармакопеї і т.і.). Вміст сполуки у фармацевтичній композиції зазвичай становить від приблизно 0,01 до 100 ваг.% стосовно всієї композиції. Представлений винахід буде далі розкритий детально із застосуванням наступних Допоміжних прикладів і Прикладів, але представлений винахід не обмежується цими Прикладами. Крім того, кожна абревіатура в Допоміжних прикладах і Прикладах має наступне значення. DBF: 2,3-дигідробензофуран FBA: 2,3-дигідробензофуран-5-карбальдегід PPN: етил (Е)-3-(2,3-дигідробензофуран-5іл)пропеноат РРЕ: етил 3-(2,3-дигідробензофуран-5іл)пропіонат DBA: 3-(6,7-дибром-2,3-дигідробензофуран-5іл)пропіонова кислота BIF: 4,5-дибром-1,2,6,7-тетрагідро-8Ніндено[5,4-b]фуран-8-он ТНі: 1,2,6,7-тетрагідро-8Н-індено[5,4-b]фуран8-он ICN: (Е)-(1,6,7,8-тетрагідро-2Н-індено[5,4b]фуран-8-іліден)ацетонітрил ЕАІ·НСІ: (Е)-2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іліден)етиламіну гідрохлорид (S)-AMI·HCI: (S)-2-(1,6,7,8-тетрагідро-2Ніндено[5,4-b]фуран-8-іл)етиламіну гідрохлорид Допоміжний приклад 1 2,3-Дигідробензофуран-5-карбальдегід До розчину (340 г) 2,3-Дигідробензофуран-5карбальдегіду (832 ммоль) в толуолі одержаному на попередній стадії по краплям при охолодженні додавали триетилфосфоноацетат (205 г, 916 ммоль). Потім, по краплям додавали суспензію тбутилату натрію (88,0 г, 1187 ммоль) в толуолі (530 г) i перемішували протягом 1 г i потім додавали оцтову кислоту (20 г) i воду (500 г). Реакційну суміш нагрівали до кімнатної температури i розділяли шари. Органічний шар промивали послідовно насиченим водним розчином бікарбонату натрію i водою, i органічний шар концентрували до об'єму менше 300 мл у вакуумі. Потім до залишку додавали метанол (396 г) нагрівали i розчиняли. До розчину по краплям при кімнатній температурі додавали воду (500 г) i перемішували до утворення кристалів, які збирали фільтруванням i сушили при пониженому тиску одержуючи вказану в заголовку сполуку (кількість 161 г, вихід 88,1%). Допоміжний приклад 3 Етил 3-(2,3-дигідробензофуран-5іл)пропіонат 2,3-Дигідробензофуран (100 г, 832 ммоль) і Ν,Ν-диметилформамід (134 г, 1830 ммоль) змішували і нагрівали, і додавали оксихлорид фосфору (255 г, 1643 ммоль) при внутрішній температурі від 70 до 80°С протягом 2 г. Реакційну суміш нагрівали при внутрішній температурі від 80 до 90°С і перемішували протягом 7,5 г. Потім, одержану суміш по краплям додавали до води (1000 г) при охолодженні, і перемішували при кімнатній температурі протягом 5 г. Одержану суміш екстрагували толуолом, i екстракт промивали послідовно водою, насиченим водним розчином бікарбонату натрію i водою, i органічний шар концентрували у вакуумі одержуючи толуольний розчин вказаної в заголовку сполуки (кількість 340 г, явний вихід 100%). Допоміжний приклад 2 Етил (Е)-3-(2,3-дигідробензофуран-5іл)пропеноат 19 95598 20 Етил (Е)-3-(2,3-дигідробензофуран-5іл)пропеноат (50,0 г, 227 ммоль) розчиняли в оцтовій кислоті (312 г) i реакційну систему промивали азотом Потім, до розчину додавали 5% Pd/C (4,96 г, суха вага) i насичували воднем до тиску 196-294 кПа. Суміш реагувала при 50°С протягом 1 г при тиску 196-294 кПа. Каталізатора відфільт ровували i промивали оцтовою кислотою (208 г) одержуючи розчин вказаної в заголовку сполуки в оцтовій кислоті (кількість 569 г, явний вихід 100%). Допоміжний приклад 4 3-(6,7-Дибром-2,3-дигідробензофуран-5іл)пропіонова кислота До розчину РРЕ в оцтовій кислоті (569 г, 227 ммоль) одержаному на попередній стадії додавали безводний ацетат натрію (18,6 г) і по краплям при перемішуванні і охолодженні протягом 2 г додавали бром (222 г). Через приблизно 4 г витримування реакції при кімнатній температурі, реакційну суміш по краплям додавали до охолодженого 15% водного розчину сульфіту натрію (670 мл) і перемішували протягом 30 хвилин. До реакційного розчину додавали ацетонітрил (118 г) і давали взаємодіяти протягом 2 г при нагріванні із зворотнім холодильником, потім поступово охолоджували і перемішували протягом 1 г до кристалізації. Кристали збирали фільтруванням, промивали водою і сушили у вакуумі одержуючи вказану в заголовку сполуку (кількість 63,3 г, вихід 73,2%). Допоміжний приклад 5 4,5-Дибром-1,2,6,7-тетрагідро-8Н-індено[5,4b]фуран-8-он 3-(6,7-Дибром-2,3-дигідробензофуран-5іл)пропіонову кислоту (40,0 г, 1 14 ммоль), одихлорбензол (182 г) і Ν,Ν-диметилформамід (0,1 г) змішували і по краплям додавали тіонілхлорид (17,7 г, 149 ммоль) при внутрішній температурі 42°С, після чого перемішували протягом 30-40 хвилин одержуючи розчин хлориду кислоту. Потім, до розчину декількома порціями додавали безводний хлорид алюмінію (17,5 г, 132 ммоль) при охолодженні льодом і перемішували протягом 30 хвилин. Окремo одержували метанол (475 г) і реакційний розчин по краплям додавали до метанолу для кристалізації. До кристалізаційного розчину при охолодженні по краплям додавали воду (76 г) і перемішували протягом 30 хвилин. Кристали збирали фільтруванням і вологі кристали послідовно промивали метанолом, водою, насиченим водним розчином бікарбонату натрію, водою і метанолом, після чого сушили у вакуумі одержуючи 31,6 г вказаної в заголовку сполуки (вихід 92,2%). Приклад 1 1,2,6,7-Тетрагідро-8Н-індено[5,4-b]фуран-8он (1) 4,5-Дибром-1,2,6,7-тетрагідро-8Н-індено[5,4-b]фуран-8-он (280 кг, 843 моль), безводний ацетат натрію (173 кг, 2109 моль), метанол (6384 л) змішували і реакційну систему промивали азотом. Потім, до реакційної суміші додавали 10% Pd/C (30,8 кг, суха вага) і насичували воднем до тиску 0,29-0,49 МПа, і каталітично відновлювали приблизно при 40°С протягом 8г при перемішуванні, при такій швидкості перемішування, що газорідинний коефіцієнт масопередачі KLa (1/г) 21 становив приблизно 15. Каталізатор відфільтровували і фільтрат концентрували при пониженому тиску, і потім до залишку додавали воду, після чого концентрували при пониженому тиску для видалення розчинника, охолоджували і перемішували протягом 1 г для визрівання. Кристалізаційний розчин відфільтровували одержуючи вологі кристали вказаної в заголовку сполуки (кількість 127 кг, суха вага, вихід 86,6%). Вміст димеру у вологих кристалах був менше ніж 0,1ваг.%. (2) Стадія очищення Вологі кристали (127 кг, суха вага), активоване вугілля (6 кг, Shirasagi А: торгова назва) і метанол (1723 л) змішували і перемішували протягом 1 г із зворотнім холодильником і фільтрували. Фільтрат і промивні розчини концентрували при пониженому тиску, потім, залишок кип'ятили протягом 1 г і охолоджували. При охолодженні додавали воду (306 л), витримували 1 г і осад збирали фільтруванням, після чого сушили при пониженому тиску одержуючи вказану в заголовку сполуку (кількість 117 кг, вихід 92,1%). (3) Газорідинний коефіцієнт масопередачі Тут, газорідинний коефіцієнт масопередачі визначали на Na2SO3 методом. 1) Na2SO3 метод (сульфітно натрієвий метод) (а) Принцип Сульфіт натрію (Na2SO3), в вигляді його водного розчину, перетворюється у сульфат натрію (Na2SO4) при реакції з киснем, який поступає з повітря. Швидкість реакції є достатньо високою порівняно з швидкістю абсорбції кисню (абсорбція кисню є швидкістно-визначаючою стадією). Тому, швидкість абсорбції кисню (NA) можна одержати вимірюючи зміну концентрації сульфіту натрію. Зараз, значення газорідинного коефіцієнту масопередачі KLa визначається за наступним рівнянням. NA=KLa(C*-C) Оскільки фактично в цій системі вимірювання, концентрація розчиненого кисню у водному розчині сульфіту натрію може прийматись за 0, вірним є наступне рівняння. KLa=NA/C* З іншого боку, розчинність кисню у водному розчині можна виразити наступним чином, використовуючи закон Генрі. С*=р/Н З цього, можна розрахувати KLa. Крім того, символи у приведених вище рівняннях мають наступні значення. KLa: значення газорідинного коефіцієнту масопередачі [1/г] NA: швидкість абсорбції кисню [моль/л·г] С: концентрація кисню в рідині [моль/л] С*: розчинність кисню при насиченні [моль/л] р: парціальний тиск кисню в газовій фазі [Па] 95598 22 Н: константа Генрі [Па·л/г] (б) Спосіб вимірювання (і) Чисту воду (475 мл, той же самий об'єм рідини як шкала подачі BIF 23,34 g) завантажують в 1 л автоклав (Glass Reactor, тип TEM-V-1000). (іі) Додають Na2SO3 (9,5 г) і перемішують протягом приблизно 2 хвилин до розчинення. (ііі) До водного розчину Na2SO3 додають одержаний розчин 0,1 моль/л CuSO4 (4,75 мл) (кон-3 центрація CuSO4 після додавання=1x10 М) і реакційний розчин повільно перемішують протягом 1 хвилини (початок реакції). (iv) Негайно, чітко відбирають 10 мл розчину розчинення і титрують згідно з наступною методикою (с). (об'єм титрування=Τ1 [мл]) (ν) Реакційний розчин перемішують із заданою швидкістю обертання протягом зажаного часу (=1,0 [г]). В цей час, деяку кількість повітря впускали у верхню частину колби для попередження зменшення парціального тиску кисню в газовій фазі в аутоклаві (приблизно 200 мл/л). (vi) з розчину чітко відбирають 10 мл зразок (ν) і титрують згідно з методикою приведеною в (с). (об'єм титрування=Т2 [мл]) (vii) 3 результатів титрування, розраховують швидкість абсорбції кисню NA згідно з наступним рівнянням. Тут, F представляє собою фактор N/10 реагент розчину йоду. NA 0.1 F T1 T2 4 10 (с) Метод титрування (метод титрування су1 льфіту натрію)* (і) В 200 мл колбі Ерленмейєра попередньо одержували суміш, що містить чисту воду 2 (100мл), буфер оцтова кислота-ацетат натрію* (10 мл), i Ν/10 реагент розчину йоду (40 мл). (іі) Обережно додають зразок розчину (10мл). (ііі) Через приблизно 5 хвилин, зразок розчину титрують N/10 розчином тіосульфату натрію 3 використовуючи розчин крохмалю* (0,5-1 мл) як індикатор. *1: Принцип титрування базується на тому що після окислення сульфітного радикалу, що присутній у зразку розчину, йодом, йод, що залишився, титрується тіосульфатом натрію, i кожну стадію можна представити наступною формулою реакції. окислення сульфітного радикалу Na2SO3+І2+Н2О2Nal+H2SO4 титрування йоду І2+2Na2S2O32Nal+Na2S4O6 *2: 75 г ацетату натрію (CH3COONa·3Н2О) розчиняють в 500 мл водної оцтової кислоти (СН3СООН:Н2О=1:2). *3: 1,0 г крохмалю промивають i змішують з 10 мл води i одержану суміш подають в 200 мл гарячої води Після кип'ятіння до повернення напівпрозорого стану, розчин залишають охолоджуватись. Допоміжний приклад 6 (Е)-(1,6,7,8-Тетрагідро-2Н-індено[5,4b]фуран-8-іліден)ацетонітрил 23 95598 24 До розчину толуолу (184 г), 1,2,6,7тетрагідро-8Н-індено[5,4-b]фуран-8-ону (8,5 г, 48,9 ммоль) i діетил ціанометилфосфонату (10,4 г 58,7 ммоль) по краплям протягом 1 г при охолодженні льодом додавали 28% розчин метоксиду натрію в метанолі (11,3 г) i залишали на 4 г. До реакційного розчину по краплям додавали воду (85 г) i нагрівали, потім шари розділяли. Органічний шар промивали водою i фільтрували видаляючи порошок після відсмоктування. Органічний шар концентрували при пониженому тиску i до залишку додавали метанол i концентрували при пониженому тиску для заміни розчинника. Після перемішування протягом 1 г при нагріванні із зворотнім холодильником, розчинник охолоджували i витримували протягом 1 г. Кристалізаційний розчин відфільтровували i кристали сушили при пониженому тиску одержуючи вказану в заголовку сполуку (кількість 8,1 г вихід 84,4%). Допоміжний приклад 7 (Е)-2-(1,6,7,8-Тетрагідро-2Н-індено[5,4b]фуран-8-іліден)етиламіну гідрохлорид До змішаної суспензії (Е)-(1,6,7,8-тетрагідро2Н-індено[5,4-b]фуран-8-іліден)ацетонітрилу (10,0 г, 50,7 ммоль) в толуолі (37,5 мл) і метанолі (12,5 мл) додавали активований кобальт (7,22 г) і 14,4% водний розчин гідроксиду калію (1,4 г), і перемішували протягом 6,5 г при 34-50°С в атмосфері водню (0,2 МПа). Реакційний розчин фільтрували і до фільтрату додавали толуол (170 мл) і метанол (35 мл) для розділення шарів. До органічного шару додавали 0,5N хлорводневу кислоту (101 мл) і перемішували протягом 30 хвилин при 25-30°С. Потім, шари розділяли і до водного шару додавали активоване вугілля (1 г), після чого перемішували. Активоване вугілля видаляли фільтруванням одержуючи водний розчин вказаної в заголовку сполуки (246 г, Net 12,0 г, вихід 99,6%). Приклад 2 (S)-2-(1,6,7,8-Тетрагідро-2Н-індено[5,4b]фуран-8-іл)етиламін гідрохлорид До водного розчину (Е)-2-(1,6,7,8-тетрагідро2Н-індено[5,4-b]фуран-8-іліден)етиламіну гідрохлориду (1979 кг, Net 122 кг, 513 моль) додавали толуол (532 л) і 5% водний розчин гідроксиду натрію (456 л) і перемішували. Шари розділяли і до органічного шару в атмосфері азоту додавал и метанол (155 кг) і [RuCI(бензол)(R)-BINAP]CI (894 г), після чого перемішували при 80°С протягом 15 г в атмосфері водню (4,9 МПа). Реакційний розчин охолоджували і при температурі нижче 30°С додавали воду (330 л) і концентровану хлорводневу кислоту (52,3 кг), після чого перемішували протягом 30 хвилин, потім шари розділяли. Водний шар промивали толуолом (195 л) і рН доводили до приблизно 6,0 додаючи 5% водний розчин NaOH до водного шару (що містить 5,0% сполуки III'). Додавали 5% Pd-C (50% зволоже ний, 9,7 кг) і перемішували при 60°С протягом 6 г в атмосфері водню (4,9 МПа). Реакційну суміш відфільтровували і фільтрат доводили до приблизно рН 6,0 використовуючи 5% водний розчин NaOH або розведену хлорводневу кислоту, після чого концентрували при пониженому тиску. Залишок перекристалізували із змішаного розчинника н-бутанол і вода одержуючи вказану в заголовку сполуку (88,6 кг, вихід 7 3,0%, сполука (III') не детектувалась, сполука (IV') не детектувалась). Крім того, вміст сполуки (ІІI') і сполуки (IV') (димер) в одержаних кристалах вказаної в заголовку сполуки визначали за допомогою ВЕРХ за наступних умов. Детектор: ультрафіолетовий абсорбціометр (довжина хвилі при вимірюванні: 220 нм) 25 95598 26 колонка: Develosil UG-3, 4,6 мм в.д.75 мм температура колонки: задана температура приблизно 25°С рухома фаза: змішаний розчин 0,1 моль/л дигідрофосфату калію (рН 3,0)/метанол (75:25) Приклад 3 (і) (S)-N[2-(1,6,7,8-Тетрагідро-2Н-індено[5,4b]фуран-8-іл)етил]пропіонамід До змішаного розчину гідрохлориду (S)-2(1,6,7,8-тетрагідро-2Н-індено[5,4-b]фуран-8іл)етиламіну (74 кг, 309 моль) в тетрагідрофурані (185 л) і водопровідної води (259 л) додавали 30% водний розчин гідроксиду натрію (70 л) і пропіонілхлорид (32,8 кг), і перемішували при кімнатній температурі протягом 1 г. До реакційного розчину додавали водопровідну воду (592 л) і охолоджували. Кристали, що випали в осад, збирали фільтруванням і сушили при пониженому тиску одержуючи вказану в заголовку сполуку (78,0 кг, вихід 97,4%). (іі) Стадія очищення Кристали (77,3 кг, 298 моль) одержані в (і) розчиняли в змішаному розчиннику (178 кг) етанол і очищена вода (10:1), і додавали активоване вугілля (0,78 кг), потім перемішували протягом 10 хвилин, після чого фільтрували (промивали змішаним розчинником (74 кг) етанол і очищена вода (10:1)). До фільтрату додавали воду (588 л) при нагріванні, охолоджували і кристали, що випали в осад, збирали фільтруванням, і сушили при пониженому тиску. Одержані кристали подрібнювали використовуючи струменевий млин одержуючи вказану в заголовку сполуку (74,0 кг, вихід 95,7%, сполука (І) 0,02%, сполука (II) 0,06%, сполука (III) і (IV) менше ніж 0,02%, загальний вміст аналогічного матеріалу 0,08%). (ііі) Умови аналізу Вміст сполук (І)-(IV) в кристалах вказаної в заголовку сполуки одержаної в (іі) визначали за допомогою ВЕРХ за наступних умов. Детектор ультрафіолетовий абсорбціометр (довжина хвилі при вимірюванні: 288 нм) колонка YMC-Pack ODS-AM АМ-302,5 мкм, 4,6 мм в.д.150 мм (виготовляється YMC) температура колонки задана температура приблизно 25°С рухома фаза A, змішаний розчин 0,01 моль/л фосфатного буферу (рН 7,0)/ацетонітрил (4:1) B, змішаний розчин 0,01 моль/л фосфатного буферу (рН 7,0)/ацетонітрил (3:7) Градієнт час (хв ) 0 60 70 70,1 85 рухома фаза А 90% 40% 40% 90% 90% рухома фаза В 10% 60% 60% 10% 10% Одержані ВЕРХ графіки показані на Фігурі Як видно з Фігури, сполука (І) і (II) детектувались з кожного боку основного піку (S)-N-[2-(1,6,7,8тетрагідро-2Н-індено[5,4-b]фуран-8іл)етил]пропіонаміду, однак, вміст сполуки (III) i (IV) був нижчим ніж межа детектування, менше ніж 0,02%. Промислова придатність Згідно із способом представленого винаходу, шляхом контролювання рН реакційного розчину на стадії каталітичного відновлення i оброблюваного розчину, можна одержати з високим виходом високочисті оптичноактивні амінопохідні, які є корисними як медичні препарати, i можна забезпечити промислове одержання високоякісних фармацевтичних необроблених матеріалів. 27 Комп’ютерна верстка О. Гапоненко 95598 Підписне 28 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for production of optically active amine derivatives
Автори англійськоюUrayama Shinichi, Mutou Eigo, Inagaki Atsushi, Okada Takashi, Sugisaki Shigeharu
Назва патенту російськоюСпособ получения оптически активных аминопроизводных
Автори російськоюУраяма Шиничи, Мутоу Эйго, Инагаки Ацуши, Окада Такаши, Сугисаки Шигехару
МПК / Мітки
МПК: A61P 25/20, A61K 31/343, C07D 307/77
Мітки: амінопохідних, активних, оптично, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/14-95598-sposib-oderzhannya-optichno-aktivnikh-aminopokhidnikh.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання оптично активних амінопохідних</a>
Попередній патент: Спосіб виготовлення композитної лопатки газотурбінного двигуна та лопатка, виготовлена за цим способом
Наступний патент: Флавоноїдні сполуки та їх використання
Випадковий патент: Пристрій для утримання тварин