Похідні 1-трифторометил-4-гідрокси-7-піперидиніламінометилхроману
Формула / Реферат
1. Сполука формули (І):
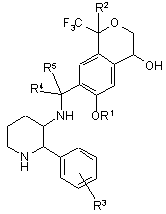 (І)
(І)
та її фармацевтично прийнятні солі, в яких:
R1 - C1-C6алкіл;
R2 - водень, C1-C6алкіл, галоC1-C6алкіл або феніл;
R3 - водень або галоген; та
R4 і R5 -, незалежно, водень, C1-C6алкіл або галоC1-C6алкіл.
2. Сполука за п.1, в якій
R1 - C1-C3алкіл;
R2 - водень, C1-C3алкіл, галоC1-C3алкіл або феніл;
R3 - водень або фтор; та
R4 і R5 -, незалежно, водень, C1-C6алкіл або галоC1-C6алкіл.
3. Сполука за п. 2, в якій R1 - метил; R2 - водень, метил, трифторметил або феніл; R3 - водень; і R4 та R5 - водень.
4. Сполука за п.1, яка є (2S,3S)-3-(6-метокси-4-гідрокси-1-метил-1-трифторметилізохроман-7-іл)метиламіно-2-фенілпіперидином або його фармацевтично прийнятною сіллю.
5. Фармацевтична композиція для лікування розладу чи стану, що потребують антагоністичної дії по відношенню до речовини Р, у ссавців, яка містить кількість сполуки за пунктом 1 або її фармацевтично прийнятної солі, що є ефективною при лікуванні такого розладу чи стану, а також фармацевтично прийнятний носій.
6. Фармацевтична композиція для лікування таких розладів або станів, як дистимія, основні депресивні розлади, педіатрична депресія, генералізований стан тривоги, нав’язливий невроз, панічні розлади, фобії, такі як соціальна фобія та агарофобія; посттравматичний стресовий стан, зміна особистості, гострий біль, хронічний біль, мігрень, ангіогенез, сонячний опік, нетримання сечі, запалення, такі як ревматоїдний артрит, остеоартрит, псоріаз, астма та алергічні стани; блювання, включаючи гостре, пізнє та попереднє блювання, коли блювання викликає хіміотерапія, опромінення, хірургія, рух, мігрень або інший блювотний засіб або стан; розлади, викликані Helicobacter pylori, серцевосудинні розлади, офтальмологічні розлади, запалення сечових шляхів, психози, шизофренія, розлади провідності, деструкційний розлад поведінки, біполярний розлад, розлади рухів, такі як синдром Тоуретта, синдром стійкого акінезу, розлади рухів, пов’язані з хворобою Паркінсона, пізня дискінезія та інші дискінезії; розлади пізнавальної здатності, такі як деменція і розлади пам’яті, розлади харчування, такі як невротична анорексія та невротична булімія, гіперактивність з розсіяною увагою, синдром хронічної втоми, передчасна еякуляція, передменструальний синдром, передменструальні дисфоричні розлади, хімічна залежність і звикання, соматичні розлади, викликані стресом, невралгія, периферійна нейропатія, розлади шлунково-кишкового рефлюксу, рефлексна симпатична дистрофія, така як синдром плече/рука; гіперчутливість, наприклад, до токсину плюща; фіброміалгія, стенокардія, хвороба Рейно, ревматичні захворювання, такі як фіброзит; екзема, риніти, алергії, постгерпетична невралгія, цистит, запалення кишечнику, синдром подразненого кишечнику, коліти, розлади, обумовлені фіброзом та колагеном, такі як склеродермія та еозинофільний фасциолез; порушення кровотоку внаслідок розширення кровоносних судин, а також розлади, пов’язані з імунною активацією або супресією, як, наприклад, системний ериматозний вовчак у ссавців, яка містить сполуку за п. 1 або її фармацевтично прийнятну сіль у кількості, що є ефективною при лікуванні такого розладу чи стану, а також фармацевтично прийнятний носій.
7. Спосіб лікування розладу або стану, що потребують антагоністичної дії по відношенню до речовини Р, у ссавців, який полягає у введенні ссавцеві, який має потребу у профілактиці чи лікуванні, сполуки за пунктом 1 чи її фармацевтично прийнятної солі, у кількості, що є ефективною при лікування такого розладу чи стану.
8. Спосіб лікування таких розладів та станів: дистимія, основні депресивні розлади, педіатрична депресія, генералізований стан тривоги, нав’язливий невроз, панічні розлади, фобії, такі як соціальна фобія та агарофобія; посттравматичні стресові стани, зміна особистості, гострий біль, хронічний біль, мігрень, ангіогенез, сонячний опік, нетримання сечі, запалення, такі як ревматоїдний артрит, остеоартрит, псоріаз, астма та алергічні стани; блювання, включаючи гостре, пізнє та попереднє блювання, коли блювання викликає хіміотерапія, опромінення, хірургія, рух, мігрень або інший блювотний засіб або стан; розлади, викликані Helicobacter pylori, серцевосудинні розлади, офтальмологічні розлади, запалення сечових шляхів, психози, шизофренія, розлади провідності, деструкційний розлад поведінки, біполярний розлад, розлади рухів, такі як синдром Тоуретта, синдром стійкого акінезу, розлади рухів, пов’язані з хворобою Паркінсона, пізня дискінезія та інші дискінезії; розлади пізнавальної здатності, такі як деменція і розлади пам’яті, розлади харчування, такі як невротична анорексія та невротична булімія, гіперактивність з розсіяною увагою, синдром хронічної втоми, передчасна еякуляція, передменструальний синдром, передменструальні дисфоричні розлади, хімічна залежність і звикання, соматичні розлади, викликані стресом, невралгія, периферійна нейропатія, розлади шлунково-кишкового рефлюксу, рефлексна симпатична дистрофія, така як синдром плече/рука; гіперчутливість, наприклад, до токсину плюща; фіброміалгія, стенокардія, хвороба Рейно, ревматичні захворювання, такі як фіброзит; екзема, риніти, алергії, постгерпетична невралгія, цистит, запалення кишечнику, синдром подразненого кишечнику, коліти, розлади, обумовлені фіброзом та колагеном, такі як склеродермія та еозинофільний фасциолез; порушення кровотоку внаслідок розширення кровоносних судин, а також розлади, пов’язані з імунною активацією або супресією, як, наприклад, системний ериматозний вовчак у ссавців, що полягає в призначенні ссавцеві, який потребує такої профілактики чи лікування, сполуки за п. 1 або її фармацевтично прийнятної солі у кількості, яка є ефективною для профілактики чи лікування такого розладу чи стану.
Текст
1. Сполука формули (І): R2 F 3C O 2 (19) 1 3 71004 4 ня кровотоку внаслідок розширення кровоносних деструкційний розлад поведінки, біполярний розсудин, а також розлади, пов’язані з імунною актилад, розлади рухів, такі як синдром Тоуретта, синвацією або супресією, як, наприклад, системний дром стійкого акінезу, розлади рухів, пов’язані з ериматозний вовчак у ссавців, яка містить сполуку хворобою Паркінсона, пізня дискінезія та інші дисза п. 1 або її фармацевтично прийнятну сіль у кікінезії; розлади пізнавальної здатності, такі як делькості, що є ефективною при лікуванні такого менція і розлади пам’яті, розлади харчування, такі розладу чи стану, а також фармацевтично прийняяк невротична анорексія та невротична булімія, тний носій. гіперактивність з розсіяною увагою, синдром хро7. Спосіб лікування розладу або стану, що потренічної втоми, передчасна еякуляція, передменстбують антагоністичної дії по відношенню до речоруальний синдром, передменструальні дисфоричвини Р, у ссавців, який полягає у введенні ссавцені розлади, хімічна залежність і звикання, ві, який має потребу у профілактиці чи лікуванні, соматичні розлади, викликані стресом, невралгія, сполуки за пунктом 1 чи її фармацевтично прийняпериферійна нейропатія, розлади шлунковотної солі, у кількості, що є ефективною при лікукишкового рефлюксу, рефлексна симпатична дисвання такого розладу чи стан у. трофія, така як синдром плече/рука; гіперчутли8. Спосіб лікування таких розладів та станів: дисвість, наприклад, до токсину плюща; фіброміалгія, тимія, основні депресивні розлади, педіатрична стенокардія, хвороба Рейно, ревматичні захворюдепресія, генералізований стан тривоги, вання, такі як фіброзит; екзема, риніти, алергії, нав’язливий невроз, панічні розлади, фобії, такі як постгерпетична невралгія, цистит, запалення кисоціальна фобія та агарофобія; посттравматичні шечнику, синдром подразненого кишечнику, колістресові стани, зміна особистості, гострий біль, ти, розлади, обумовлені фіброзом та колагеном, хронічний біль, мігрень, ангіогенез, сонячний опік, такі як склеродермія та еозинофільний фасциолез; нетримання сечі, запалення, такі як ревматоїдний порушення кровотоку внаслідок розширення кроартрит, остеоартрит, псоріаз, астма та алергічні воносних судин, а також розлади, пов’язані з імунстани; блювання, включаючи гостре, пізнє та поною активацією або супресією, як, наприклад, сиспереднє блювання, коли блювання викликає хіміотемний ериматозний вовчак у ссавців, що полягає терапія, опромінення, хірургія, рух, мігрень або в призначенні ссавцеві, який потребує такої проінший блювотний засіб або стан; розлади, виклифілактики чи лікування, сполуки за п. 1 або її фаркані Helicobacter pylori, серцевосудинні розлади, мацевтично прийнятної солі у кількості, яка є ефеофтальмологічні розлади, запалення сечових ктивною для профілактики чи лікування такого шляхів, психози, шизофренія, розлади провідності, розладу чи стану. Даний винахід стосується нових похідних 1трифторометил-4-гідрокси-7-піперідиніламінометилхроману та їх фармацевтично прийнятних солей, фармацевтичних композицій, що містять такі сполуки, а також використання таких сполук у якості антагоністів речовини Р. Передумови винаходу Речовина Ρ в природі зустрічається як ундекапептид, що належить до тахікінінового сімейства пептидів, останні мають таку назву через їхню швидку стимулюючу дію на гладку м'язову тканину. Більш специфічно те, що речовина Ρ є фармацевтично активним нейропептидом, що продукується у ссавців (при виділенні із кишок) і має характерну амінокислотну послідовність, як показано в (D.F. Veber et al. в патенті США №4680283). Широке включення речовини Ρ та інших та хікінінів до патофізіології ряду хвороб добре розкрито в даній галузі. Наприклад, нещодавно показали включення речовини Ρ до передачі болю або мігрені, а також до розладів центральної нервової системи, таких як тривога та шизофренія, респіраторних захворювань та запалень, таких як астма та ревматоїдний артрит, відповідно, та до шлунково-кишкових розладів та хвороб шлунково кишкового тракту, таких як неспецифічний виразковий коліт, синдром слизистого коліту, хвороба Крона тощо. Також повідомлялося, що антагоністи тахікініна є корисними при лікуванні серцевосудинних захворювань, алергічних станів, імунорегуляції, вазодилатації, бронхоспазмі, рефлексному та нейронному регулюванні внутрішні х органів, сенільної деменції типу хвороби Альцгеймера, блювання, сонячної еритеми та інфекції Helicobacter pylori. У Європейській заявці на патент №840732, опублікованій 13 травня 1998 року, та в Міжнародній заявці на патент РСТ/ІВ97/01466, поданій 19 листопада 1997 року, розкрито ряд заміщених піперідинових сполук, включаючи піперідинові сполуки з замінником, що містить частки конденсованого кільця, включаючи атоми кисню, як антагоністи речовини Р. Потрібні антагоністи речовини Ρ з покращеними властивостями та меншою кількістю побічних ефектів. Короткий опис винаходу. Даний винахід пропонує сполуки піперідиніламінометилтрифторометилциклічного ефіру з нижченаведеною хімічною формулою (І): 5 71004 6 шляхів, психози, шизофренія, розлади провідності, деструкційний розлад поведінки, біполярний розлад, порушення рухів, такі як синдром Тоуретта, синдром стійкого акінезу, порушення рухів, пов'язані з хворобою Паркінсона, пізня дискінезія та інші дискінезії; розлади пізнавальної здатності, такі як деменції (включаючи деменцію, пов'язану з віком, та сенільну деменцію типу Альцгеймера) і розлади пам'яті (наприклад, амнезія), розлади харчування, такі як невротична анорексія та невротична булімія, гіперактивність з розсіяною увагою, синдром хронічного втомлення, передчасна еякуляція, передменструальний синдром, передменструальні дисфоричні розлади, хімічна залежність і звикання, соматичні розлади викликані стресом, невралгія, периферійна нейропатія, шлунково-кишковий рефлюкс, рефлексна симпатична дистрофія, така як плечевий синдром; підвищена чутливість, наприклад, токсину плюща; фіброміалта їх фармацевтично прийнятні солі, в яких: гія, ангіна, хвороба Рейно, ревматизм такий як 1 R - це С 1С6алкіл; фіброз; екзема, реніти, алергії, постгерпетична R2 - це кисень, С1-С6алкіл, гало С1-C6алкіл або невралгія, цистит, запалення товстої кишки, синдфеніл; ром подразненої товстої кишки, коліти, розлади, 3 R - це кисень або галоген; та обумовлені фіброзом та колагеном, такі як склеR4 і R5 - це, незалежно, кисень, С1і-С6алкіл або родермія та еозинофільний фасциолез; порушенгало С1С6алкіл. ня кровотоку через розширення кровеносних суСполуки формули (І) містять, принаймні, два дин, а також розлади, пов'язані з імунною хіральні центри і, таким чином, існує, принаймні, активацією або послабленням, як, наприклад, сисдві діастереоізомерні пари оптичних ізомерів, що темний червоний вовчий лишай у ссавців, особлимістять епімери. Цей винахід стосується обох во у людей. Ці сполуки є особливо корисними як окремих ізомерів сполук формули (І) та сумішей протизапаленнєві та протиблювотні агенти, або як двох чи більше таких ізомерів. агенти для лікування розладів центральної нервоСполуки формули (І) цього винаходу, перевавої системи. жно, мають (2S,3S)-конфігурацію відносно піперіСполуки даного винаходу є особливо корисдинового кільця. ними при лікуванні блювання, включаючи гостре, Втіленнями цього винаходу є сполуки формупізнє та попереднє блювання, таке як блювання ли (І), в яких R1 - це С1-С3алкіл; R2 - це кисень, С1або нудота, викликані хіміотерапією, опромінен3 С3алкіл, гало C1-C3алкіл чи феніл; R - це кисень ням, хірургією, рухом, вестибулярними розладами, або фтор; R4 та R5 - це, незалежно, кисень, C1токсинами, мігренню та змінами внутрішньочерепС3алкіл або гало C1-С3алкіл. ного тиску. Більш специфічно, ці сполуки викорисІншими втіленнями даного винаходу є сполуки товуються при лікуванні блювання, викликаного формули (І), в якій R1 - це метил; R2 - це кисень, протипухлинними агентами, включаючи ті, що ви3 метил, трифторометил або феніл; R - це кисень; користовуються у терапії ракових захворювань, а R4 та R5 - кисень. також блювання, викликаного іншими фармаколоОсобливо переважною сполукою формули (І) є гічними агентами, такими як роліпрам або морфін. (2S,3S)-3-(6-метокси-1-метил-1Ці сполуки також є корисними при хронічному та трифторометилізохроман-7-іл)метиламіно-2гострому болі, включаючи гіпераналгезуючий біль, фенілпіперідин або його фармацевтично прийнятневропатичний біль, а також біль, пов'язаний з на сіль. пошкодженнями нерва. Сполуки винаходу є корисними у якості антаДаний винахід також стосується фармацевтигоністів речовини Р, і, таким чином, є корисними чної композицї для лікування розладів та станів, при лікуванні таких хвороб та станів: дистимія, для яких потрібна антагоністична дія на речовину основні депресивні розлади, педіатрична депресія, Р, у ссавців, що містить кількість сполуки формули генералізований стан тривоги, нав'язливий невроз, (І), або її фармацевтично прийнятну сіль, ефектипанічні розлади, фобії, такі як соціальна фобія та вну при лікуванні таких розладів та станів, а також агарофобія; післятравматичні стресові стани, зміфармацевтично прийнятний носій. на особистості, гострий біль, хронічний біль, мігВинахід також стосується способу лікування рень, розвиток кровеносних судин, сонячна ерирозладів чи станів, для яких потрібна антагоніститема, нетримання, запалення, такі як чна дія на речовину Р, у ссавців, що полягає в ревматоїдний артрит, остеоартрит, псоріаз, астма призначенні ссавцям кількості сполуки формули (І) та алергічні стани; блювання, включаючи гостре, або її фармацевтично прийнятної солі, ефективної пізнє та попереднє блювання, коли блювання випри лікуванні такого розладу чи стану. кликає хіміотерапія, опромінення, хірургія, рух, Цей винахід також стосується фармацевтичної мігрень або інший блювотний засіб або стан; розкомпозиції для лікування таких розладів та станів: лади, викликані Helicobacter pylori, серцевосудинні дистимія, основні депресивні розлади, педіатрична розлади, офтальмічні розлади, запалення сечових депресія, генералізований стан тривоги, нав'язли 7 71004 8 вий невроз, панічні розлади, фобії, такі як соціальсиндром стійкого акінезу, порушення рухів, пов'яна фобія та агарофобія; післятравматичні стресові зані з хворобою Паркінсона, пізня дискінезія та стани, зміна особистості, гострий біль, хронічний інші дискінезії; розлади пізнавальної здатності, такі біль, мігрень, розвиток кровеносних судин, сонячяк деменції (включаючи деменцію, пов'язану з віна еритема, нетримання, запалення, такі як ревком, та сенільну деменцію типу Альцгеймера) і матоїдний артрит, остеоартрит, псоріаз, астма та розлади пам'яті (наприклад, амнезія), розлади алергічні стани; блювання, включаючи гостре, пізхарчування, такі як невротична анорексія та ненє та попереднє блювання, коли блювання викливротична булімія, гіперактивність з розсіяною увакає хіміотерапія, опромінення, хірургія, рух, міггою, синдром хронічного втомлення, передчасна рень або інший блювотний засіб або стан; еякуляція, передменструальний синдром, передрозлади, викликані Helicobacter pylori, серцевосуменструальні дисфоричні розлади, хімічна залеждинні розлади, офтальмічні розлади, запалення ність і звикання, соматичні розлади викликані сечових шля хів, психози, шизофренія, розлади стресом, невралгія, периферійна нейропатія, шлупровідності, деструкційний розлад поведінки, біпонково-кишковий рефлюкс, рефлексна симпатична лярний розлад, порушення рухів, такі як синдром дистрофія, така як плечевий синдром; підвищена Тоуретта, синдром стійкого акінезу, порушення чутливість, наприклад, токсину плюща; фіброміалрухів, пов'язані з хворобою Паркінсона, пізня дисгія, ангіна, хвороба Рейно, ревматизм такий як кінезія та інші дискінезії; розлади пізнавальної фіброз; екзема, реніти, алергії, постгерпетична здатності, такі як деменції (включаючи деменцію, невралгія, цистит, запалення товстої кишки, синдпов'язану з віком, та сенільну деменцію типу Альцром подразненої товстої кишки, коліти, розлади, геймера) і розлади пам'яті (наприклад, амнезія), обумовлені фіброзом та колагеном, такі як склерозлади харчування, такі як невротична анорексія родермія та еозинофільний фасциолез; порушента невротична булімія, гіперактивність з розсіяною ня кровотоку через розширення кровеносних суувагою, синдром хронічного втомлення, передчасдин, а також розлади, пов'язані з імунною на еякуляція, передменструальний синдром, пеактивацією або послабленням, як, наприклад, сисредменструальні дисфоричні розлади, хімічна затемний червоний вовчий лишай у ссавців, особлилежність і звикання, соматичні розлади викликані во у людей, що полягає у призначенні ссавцям стресом, невралгія, периферійна нейропатія, шлукількості сполуки формули (І), або її фармацевтинково-кишковий рефлюкс, рефлексна симпатична чно прийнятної солі, ефективної для профілактики дистрофія, така як плечевий синдром; підвищена та лікування такого розладу чи стану. чутливість, наприклад, токсину плюща; фіброміалТермін "лікування", як вжито тут, стосується гія, ангіна, хвороба Рейно, ревматизм такий як реверсії, полегшення, інгібування розвитку, або фіброз; екзема, реніти, алергії, постгерпетична запобігання розладу та стану, для якого цей терневралгія, цистит, запалення товстої кишки, синдмін застосовується, або одного чи більше симптором подразненої товстої кишки, коліти, розлади, мів такого розладу чи стану. Термін "лікування", як обумовлені фіброзом та колагеном, такі як склевжито тут, стосується акту лікування, як "лікуванродермія та еозинофільний фасциолез; порушення" визначене вище. ня кровотоку через розширення кровеносних суТермін "галоген" - це F, СІ, Вr та I, переважно, дин, а також розлади, пов'язані з імунною СІ або F. активацією або послабленням, як, наприклад, сисТермін "алкіл", як вжито тут, стосується наситемний червоний вовчий лишай у ссавців, особличених радикалів з прямим або розгалуженим ланво у людей, що містить кількість сполуки формули цюгом, включаючи, але не обмежуючись, метил, (І), або її фармацевтично прийнятну сіль, ефектиетил, n-пропіл, ізопропіл, та t-бутил. вну при лікуванні такого розладу чи стану, а також Термін "гало C1-С6алкіл", як вжито тут, стосуфармацевтично прийнятний носій. ється прямого, розгалуженого або циклічного C1Винахід також стосуєься способу лікуванС6алкіла, заміщеного одним або більше (переважня таких розладів та станів: дистимія, основні дено 1-7) галогеном. Ці сполуки містять, але не обпресивні розлади, педіатрична депресія, генералімежуються, трифторометил, дифтороетил, тризований стан тривоги, нав'язливий невроз, панічні фтороетил, пентафтороетил, трифтороізопропіл, розлади, фобії, такі як соціальна фобія та агаротетрафтороізопропіл, пентафтороізопропіл, гекфобія; післятравматичні стресові стани, зміна ососафтороізопропіл тощо. бистості, гострий біль, хронічний біль, мігрень, Детальний опис винаходу. розвиток кровеносних судин, сонячна еритема, Сполуки піперідиніламінометилтрифтонетримання, запалення, такі як ревматоїдний артрометилциклічного ефіру формули (І) цього винарит, остеоартрит, псоріаз, астма та алергічні стаходу можна приготувати як описано в наступних ни; блювання, включаючи гостре, пізнє та попересхемах реакції та описі. У схемах реакцій та описі, днє блювання, коли блювання викликає що наведені нижче, R1, R2, R3, R4 та R5 - як визнахіміотерапія, опромінення, хірургія, рух, мігрень чено вище, і Ζ - це кисень або амінозахисна група. або інший блювотний засіб або стан; розлади, виНа схемі 1 показано спосіб приготування спокликані Helicobacter pylori, серцевосудинні розлалуки формули (VI), яку можна потім перетворити ди, офтальмічні розлади, запалення сечових шляна відповідні метаболіти формули (І) способами хів, психози, шизофренія, розлади провідності, біотрансформації, описаними нижче. Сполуки фодеструкційний розлад поведінки, біполярний розрмули (VI) можна приготувати шля хом гідроалкілулад, порушення рухів, такі як синдром Тоуретта, вання сполуки (II) зі сполукою (III). 9 71004 Сполуку формули (VI), в якій Ζ - це кисень або амінозахисна група, Q - це R4 або R5, як визначено вище, можна синтезувати шля хом гідроалкілування аміносполуки формули (II) зі сполукою формули (III), згідно відомих процедур, описаних в Міжнародній Патентній публікації №WO97/03066. Реакцію можна проводити в присутності прийнятного відновлюючого реагента в інертному розчиннику реакції. Прийнятними відновлюючи ми реагентами є, наприклад, борогідриди, такі як триацетоксиборогідрид натрію (NaB(OAc)3H), борогідрид натрію (NaBH 4) та ціаноборогідрид натрію (NaBH3CN), борани, алюмінієвий гідрид літію (LiAIH2) та триалкілсилани. Прийнятні розчинники включають полярні розчинники, такі як метанол, етанол, метиленхлорид, тетрагідрофуран (ТГФ), діоксан та етилацетат. Реакцію можна проводити при температурі від -78°С до температури кипіння розчинника, переважно при 0-25°С, протягом 5 хвилин-48 годин, переважно протягом 0,5-12 годин. Переважно, сполуки (VI), в яких Q - не є киснем, можна одержати шляхом реакції сполуки (II) зі сполукою (III), в якій W є прийнятною бациловою групою. Ця реакція може проводитися в присутності відновлюючого агента, такого як NaBH3CN та кислота Льюіса, така як хлорид олова (IV) (ТіCl4) в інертному розчиннику реакції, такому як дихлорометан (Tetrahedron Letter, Vol. 31, p. 5547, 1990). Коли Ζ – це амінозахисна група, амінозахисну гр упу можна 10 вилучи ти після гідроалкілування, використовуючи способи, відомі спеціалістам у даній галузі (див., наприклад, Protective Groups in Organic Synthesis, Т. W. Greene, et al., John Wiley & Sons, Inc., 1991), для одержання сполуки формули (VI). Особливо, коли Ζ - це трет-бутоксикарбоніл (абревіатура "Бок"), Бок можна виділити в присутності кислоти, такої як НСІ в інертному розчиннику реакції, такому як метанол, під інертним середовищем (наприклад, під азотом). Вихідний матеріал формули (II) можна приготувати шляхом азотного захисту сполуки (2S,3S)3-аміно-2-фенілпіперідину, яку можна приготувати відомими способами, описаними, наприклад, в Міжнародній патентній публікації №WO92/17449. Азотний захист піперідинового кільця сполук формули (II) можна провести відомими способами, описаними, наприклад, в Міжнародній патентній публікації №WO97/03066. Прийнятною захисною групою є, наприклад, Бок (t-бутоксикарбоніл), бензилоксикарбоніл (Cbz) або трифтороацетил. Наприклад, азотний захист t-бутоксикарбонілом може проводитися шляхом обробки сполуки (2S,3S)-3аміно-2-фенілпіперідину сполукою (t-BuOCO)2O в присутності основи, такої як гідроксид натрію, бікарбонат натрію або триетиламін. Сполуки формули (III) можна приготувати шляхом формілування або ацилювання сполук формули (IV), як показано на Схемі 2. 11 71004 Можна використовувати відомі способи формілування та ацилювання. Наприклад, безпосереднє формілування можна здійснювати шляхом взаємодії сполуки (IV) з прийнятним формілюючим агентом в присутності прийнятного каталізатора. Прийнятні системи формілюючий агент/каталізатор - включають дихлорметилметиловий ефір/хлорид титану (IV) (СН2СНОСН3/ТiСІ4), трифторооцтова кислота (CF3CO2H)/гексаметиленететрамід (змінені умови Даффа) та фосфориловий трихлорид (РОСІ3)/ДМФ (умови Вілсмеєра). Більш специфічно, формілування сполуки (IV) з СН2СНОСН3/TiCl4 можна проводити в інертному розчиннику реакції під азотом. Прийнятні розчинники включають дихлорометан та 1,2-дихлороетан при температурі 120°С - кімнатна температура протягом 1хв.-10 годин, переважно при -78°С протягом 5 хвилин - 4 години. Реакцію Даффа можна також застосовувати для формілування згідно умов реакції, розкритих в Міжнародній Патентній публікації №WO94/24081. Крім того, прийнятний спосіб опосередкованого формілування полягає в (І) галогенуванні сполуки (IV), (II) заміщенні атома галогена ціаногрупою, і (III) відновленню одержаної ціано-заміщеної сполуки. (І) Галогенування можна проводити відомими способами, як вказано в (G. A. Olah et al. J. Org. Chem., Vol. 58. pp. 3194-, 1983). (II) Заміщення атома галогена ціаногрупою може здійснюватися відомими способами, як вказано в (D. М. Tschaem 12 et al., Synth. Commun.. Vol. 24, pp. 887-, 1994) або в (К. Takagi et al, (Bull. Chem. Sec. Jpn., Vol. 64, pp. 1118-, 1991). (Ill) Відновлення, як тут вжито, можна здійснювати в присутності диізопропілалюмінієвого гідриду (DIBAL-H) в дихлорометані або нікелі Ренея у мурашиній кислоті. Ацилювання можна здійснити добре відомим способом ацилювання Фриделя-Крафтса, описаним, наприклад, в (Ad vanced Organic Chemistry, Jerry March, John Wiley & Sons, forth edition, 1992, p. 539). Більш специфічно, сполука (IV) може реагувати з ацилюючим агентом в присутності кислотного каталізатора для одержання сполуки (III). Прийнятні ацилюючі агенти включають ацилхлорид, ацилфторид та ангідриди, переважно ацилхлорид. Прийнятні кислотні каталізатори включають сірчану кислоту та кислоту Льюіса, таку як хлорид алюмінію, переважно хлорид алюмінію. Цю реакцію типово можна проводити при температурі від 10°С - до кімнатної температури протягом 5 хвилин - 2 години, переважно при 03С протягом 1 години. Циклічний ефір формули (IV) можна приготувати зі сполуки формул (Va) або (Vb) відомими способами, описаними в (W. Е. Parham ef al. (J. Org. Chem; Vol. 39, pp. 2048, 1974) або способами, зображеними на Схемі 3. 13 71004 14 Схема 3 На шляху А схеми З сполуку формули (IV) можна синтезувати зі сполуки формули (Va), в якій Y1 - це Вr, І або СІ (переважно Вr), ι Υ2 - це кисень або гідроксильна захисна група (переважно тетрапдропіраніл, абревіатура якого - "ТГП"). Сполуку формули (Va) можна металувати шляхом обробки органометалічною сполукою. Суміш реакції можна потім обробити карбонільної сполукою, представленою формулою CF3C(=O)R2, для одержання діола (Vc). Якщо необхідно, можна виділити гідроксильну захисну груп у Y2 діолу (Vc). Потім, діол (Vс) можна циклізувати для одержання циклічної ефірної сполуки (IV). Металування сполуки (Va) можна здійснювати в присутності органометалічних сполук, таких як nбутиллітій, втор-бутиллітій або трет-бутиллітій Металування та наступна реакція з CF3C(=O)R2 можна здійснювати в інертному розчиннику реакції, такому як ТГФ, ефір та гексан, під інертним середовищем, наприклад, під азотом, при температурі -150°С - кімнатна температура протягом 15 хвилин-12 годин, переважно при температурі від 120°С до -30°С протягом 10 хвилин - 6 годин. Захист гідроксильної групи та зняття захисту за хисною групою Y2 можна здійснювати за прийнятних умов, що залежать від захисної групи, вибраної згідно відомих способів (див, наприклад, Protecting Group in Organic Synthesis by T. W. Greene et еl., published from John Wiley & Sons, Inc.). Циклізацію діола (Vc) можна здійснювати в присутності кислоти відомими способами, як показано, наприклад, в (W. Е. Parham et al. (Synthesis, pp. 116-, 1976) або D. Seebach et al. (Chem. Ber., Vol. 116. pp. 8354-, 1994). Прийнятними кислотами є, наприклад, НСІ, H2SO4 або ртолуолсульфокислота трифторооцетна кислота (абревіатура -ТФО). Реакція може проходити при температурі від кімнатної температури до 200°С протягом 10 хвилин - 12 годин, переважно при температурі 60°С - 150°С протягом 30 хвилин - 6 годин. З іншогобоку, циклізацію можна здійснювати способами, відомими як реакція Міцунобу або способами, розкритими в (J. R. Falck et al. J. Am. Chem. Soc, Vol. 116, pp. 8354-, 1994). Наприклад, реакцію Міцунобу можна проводити в присутності трифенілфосфіну/діетилазодікарбоксилату у прийнятному розчиннику, такому як дихлорометан, під азотом при температурі 0°С протягом 5 хвилин - 6 годин. На шляху В Схеми 3, сполуку циклічного ефіру формули (IV) можна синтезувати шляхом одноступеневої циклізації сполуки формули (Vb), в якій Y3 - це група, що відходить, з CF3C(=O)R2 в присутності прийнятної основи (див., наприклад, J. Org. Chem., Vol. 41, pp. 1184-, 1976). Прийнятна група, що відходить, включає СІ, Вr, тозилат, мезилат і трифлат. Прийнятні основи включають алкіллітій, такий як n-BuLi, втор-BuLi або t-BuLi. Наприклад, реакція може проходити спочатку шляхом обробки сполуки формули (Vb) n-BuLi у прийнятному інертному розчиннику реакції, такому як ТГФ/гексан, під азотом при температурі від -120°С до 0°С протягом 5 хвилин - 12 годин, переважно при -100°С - 60°С протягом 10 хвилин - 6 годин. Після чого, до реакції можна додати карбонілову сполуку CF3C(=O)R2 і температур у можна підняти до -50°С - кімнатна температура. З іншого боку, наприклад, вихідний матеріал формул (Va) і (Vb), в яких R1 - це метил, можна одержати шляхом бромування в параположенні відомої або комерційно прийнятної сполуки анізолу відомими способами (наприклад, J. Org. Chem., Vol. 58, pp. 7507-, 1993. та J. Org. Chem., Vol. 46. pp. 118-. 1981). З іншого боку, інші способи приготування сполук формули (VI) знайдемо в заявці США №60/160226, поданої 18 жовтня 1999, включеної 15 71004 16 сюди шляхом посилання на її зміст у повному обклад, диметилсульфоксид, диметилформамід, сязі. етиловий спирт, метиловий спирт). До кожної поНезважаючи на інші визначення, тиск кожної з судини для біотрансформації асептично додається вищенаведених реакцій - не є критичним. Як праодержана речовина для одержання бажаної конвило, реакції будуть проходити при тиску 1-3 атцентрації субстрату (наприклад, 100-200мкг/мл). мосфери, переважно при зовнішньому тиску (приДозовану посудину установлюють на шейкері і близно 1 атмосфера). помішують як до цього, поки субстрат не перетвоСполуки формули (VI) та проміжні продукти, риться на продукт(и) під дією мікробів (наприклад, показані у вищезгаданих схемах реакцій, можна 1-10 днів). Вміст посудини для біотрансформації виділити і очистити звичайними способами, такиоброблюється механічним способом (наприклад, ми як рекристалізація або хроматографічне видішляхом фільтрування або центрифугування) для лення. відокремлення нерозчинних твердих речовин із Як вказано вище, сполуки формули (І) можна водної фази. Відокремлені тверді речовини екстприготувати шля хом біотрансформації із сполук рагують шля хом додавання прийнятних водорозодержаних шляхом біотрансформації (VI), які є чинних органічних розчинникив (наприклад, метаметаболітами. нол). Біотрансфомацію може провести фахівець у Розчинний екстракт твердої речовини та водн у даній галузі шляхом взаємодії речовини, яку потріфазу з посудин виділяють, з'єднують і концентрубно трансформувати, та інши х необхідних реагенють прийнятними способами, наприклад, екстратів з ферментами, одержаними з ряду живих оргагування твердої фази та просушування при понинізмів за умов, прийнятних для хімічної взаємодії. женому тиску. Просушений неочищений продукт Потім продукти реакції відокремлюють і потрібні з розчиняють у розчиннику, що є сумісним з спосоних очищають для пояснення їхньої хімічної струкбом очищення (наприклад, ацетонітрил, метанол, тури та фізичних і біологічних властивостей. Фервода, або рідинна фаза ВЕРХ). Виділення та очименти можна представити як очищені реагенти, щення продукту(ів) біотрансформації здійснюється вони можуть бути у вигляді неочищених екстрактів шляхом екстрагування твердої фази (ЕТФ) з наабо лізатів, у вигляді інтактних клітин, можуть бути ступним використанням ВЕРХ з оберненою фаприсутніми у розчинах, в суспензіях (наприклад, зою. Продукт(и) біотрансформації контролюються інтактні клітини), можуть ковалентно приєднуватипри відокремленні за допомогою хромотографії по ся до підтримуючої поверхні, їх можна заливати до УФ-поглинанню та спектральному профілю фотопроникної матриці (наприклад, гранули агарози діодного аналізу. Фракції мобільної фази ВЕРХ, або альгіната). Субстрат та інші необхідні реагенщо містять продукт(и), які потрібно одержати, зати (наприклад, вода, повітря) подаються як потріблишають, і продукт(и) екстрагують з мобільної фано. Як правило, реакція проходить в присутності зи прийнятними способами, наприклад, вакуумне однієї чи кількох рідких фаз, водної та/чи органічпросушування після ЕТФ. Розчинний елюат з екстної, для покращення масообміну реагентів та проракції ЕТФ виділяється, фільтрується для виділендуктів. Реакція може проходити асептично або ня твердих речовин, і концентрується при пониженеасептично. Умови керування процесом реакції ному тиску для одержання сухого очищеного та виділенням продуктів реакції можуть змінювапродукту біотрансформації. Хімічну стр уктур у витися залежно від фізичних власти востей системи діленого продукту визначають з даних, одержаних реакції та хімії реагентів і продуктів. з мас-спектрометрії та 1Н-ЯМР. Нижче наведено приклад лабораторного споОскільки сполуки піперідиніламінометилтрифсобу проведення аеробної біотрансформації, яку торометилового циклічного ефіру даного винаходу може здійснити фахівець у даній галузі для одермають, принаймні, два асиметричні центри, вони жання потрібних продуктів. Живильне середовище можуть існувати у різних стереоізомерних формах (наприклад, середовище IOWA: декстроза, дріжта конфігураціях (наприклад, діастереоізомери, джовий екстакт, гідрофосфат калію, хлорид навключаючи епімери). Таким чином, сполуки мотрію, соєве борошно, вода; скореговано нейтральжуть існувати в окремих (+)- та (-)-оптично активний рН) додається до одного чи кількох посудин них формах, а також у вигляді їх сумішей. Даний для культивування (наприклад, трубки і колби для винахід в своєму обсязі включає всі такі форми. бродіння), які потім стерилізуються парою. Кожну Всі оптичні ізомери та стереоізомери сполуки фопосудину асептично затравлюють вирощуванням рмули (І), а також їх суміші, розглядаються в даіз агарної культури, суспензією промитих клітин ному винаході. Щодо сполук формул (І), (VI) та (II), або спор, чи бульйоном з рідинної культури жививинахід включає використання рацемата, однієї чи льного середовища біотрансформуючого мікроорбільше енантіомерних форм, однієї чи більше діаганізма. Посудини установлюють на шейкері, пристереомеричних форм, або їх сумішей. Сполуки значеному для бродіння та струшують (наприклад, формул (І), (VI) та (II) можуть також існувати як операція обертання з частотою 100-300 оборотів таутомери. Даний винахід стосується використанза хвилину) при прийнятній температурі (наприня всіх таких та утомерів та їх сумішей. Окремі ізомери можна одержати відомими способами, такиклад, 20-40°С) протягом досить тривалого періоду ми як, оптичне розділення, фракційна для покращення росту мікроорганізмів до відповікристалізація, хроматографія або високоефективдного розміру популяції (наприклад, протягом 1-3 днів). на рідинна хроматографія діастереомеричної суміші проміжних продуктів, або сполуки формули (І) Вихідну сполуку, яку потрібно трансформуваабо її прийнятної солі. Крім того, окремі стереоізоти, (наприклад, субстрат) розчиняють у воді або мери можна синтезувати з прийнятного оптично прийнятному водорозчинному розчиннику (напри 17 71004 18 активного вихідного матеріалу або проміжних прорухів, пов'язані з хворобою Паркінсона, пізня дисдуктів, використовуючи загальні способи, згадані кінезія та інші дискінезії; розлади пізнавальної тут. До того ж, способи приготування збагачених здатності, такі як деменції (включаючи деменцію, діастереомерних сумішей або специфічних енанпов'язану з віком, та сенільну деменцію типу Альцтіомерних форм можна знайти в заявці США геймера) і розлади пам'яті (наприклад, амнезія), №60/160226, поданої 18 жовтня 1999 року, вклюрозлади харчування, такі як невротична анорексія чену сюди шляхом посилання на її зміст у повному та невротична булімія, гіперактивність з розсіяною обсязі. увагою, синдром хронічного втомлення, передчасОскільки сполуки піперідиніламінометилтрифна еякуляція, передменструальний синдром, петорометилового циклічного ефіру даного винаходу редменструальні дисфоричні розлади, хімічна зає основними сполуками, вони можуть утворювати лежність і звикання, соматичні розлади викликані ряд різних солей з різними неорганічними та оргастресом, невралгія, периферійна нейропатія, шлунічними кислотами. Хоча такі солі повинні бути нково-кишковий рефлюкс, рефлексна симпатична фармацевтично прийнятними для призначення дистрофія, така як плечевий синдром; підвищена тваринам, на практиці, бажано спочатку відокречутливість, наприклад, токсину плюща; фіброміалмити основну сполуку цього винаходу з суміші регія, ангіна, хвороба Рейно, ревматизм такий як акції як фармацевтично неприйнятну сіль, а потім фіброз; екзема, реніти, алергії, постгерпетична просто перетворити на вільну основну сполуку невралгія, цистит, запалення товстої кишки, синдшляхом обробки алкаліновим реагентом, після ром подразненої товстої кишки, коліти, розлади, чого перетворити вільну основу на фармацевтичобумовлені фіброзом та колагеном, такі як склено прийнятну кислу додаткову сіль. Кислі додаткородермія та еозинофільний фасциолез; порушенві солі основних сполук даного винаходу готуються ня кровотоку через розширення кровеносних сушляхом обробки основної сполуки еквівалентною дин, а також розлади, пов'язані з імунною кількістю вибраної неорганічної або органічної киактивацією або послабленням, як, наприклад, сисслоти у водному розчиннику, такому як метанол темний червоний вовчий лишай у ссавців, особлиабо етанол. Потрібну тверду сіль одержуємо після во у людей. Для лікуванння блювання ці сполуки ретельного випаровування розчинника. Кислоти, краще використовувати у комбінації з антагоністом що використовуються для приготування фармаце5НТ3-рецептора, такими як ондансетрон, гранісетвтично прийнятних кислих додаткових солей вирон або тропісетрон. щезгаданих основних сполук даного винаходу, є ті, Похідні 1-трифторометил-4-гідрокси-7що утворюють нетоксичні кислі додаткові солі, піперідиніламінометилхроману даного винаходу та наприклад, солі, що містять фармацевтично приїх фармацевтично прийнятні солі, можна признайнятні аніони солей, таких як гідрохлориди, гідрочати для орального, парентального застосування броміди, гідройодиди, нітрати, сульфати або бісу(наприклад, внутрішньовенно, внутрішньом'язово льфати, фосфати або кислі сульфати, ацетати, або підшкірно) або для місцевого застосування лактати, цитрати або кислі цитрати, тартрати або для ссавців. Як правило, ці сполуки краще признабі-тартрати, сукцинати, малеати, фумарати, глючати людині дозами 0,3-750мг на день, хоча дози конати, сахарати, бензоати, метансульфонати, можна змінювати залежно від ваги та стану хвороетансульфонати, бензолсульфонати, рго, а також від способу застосування. Однак, найтолуенсульфонати і памоати (наприклад, 1.1’краще застосовувати 0,06-6мг на 1кг ваги тіла на метилен-біс-(2-гідрокси-3-нафтоат). день. Похідні 1-трифторометил-4-гідрокси-7Незважаючи на це, дози можна змінювати запіперідиніламінометилхроману даного винаходу та лежно від виду тварини, що лікується, та індивідуїх фармацевтично прийнятні солі проявляють знаальної реакції на даний медикамент, залежно від чну активність у зв'язуванні рецептора речовини Р, вибраної технології приготування лікарського заі, таким чином, є важливими при лікуванні різних собу, а також періоду та інтервалу застосування клінічних станів, які характеризуються наявністю медикамента. У деяких випадках, рівні дозування, активності речовини Р. До таких станів належать: нижчі за нижню точку згаданого діапазону, можуть дистимія, основні депресивні розлади, педіатрична бути більше ніж достатніми, в той час як, у інших депресія, генералізований стан тривоги, нав'язливипадках, можна вживати більші дози без ствовий невроз, панічні розлади, фобії, такі як соціальрення шкідливого побічного ефекту, при початкона фобія та агарофобія; післятравматичні стресові вому розділенні більшої дози на кілька менших доз стани, зміна особистості, гострий біль, хронічний для застосування протягом дня. біль, мігрень, розвиток кровеносних судин, сонячПохідні 1-трифторометил-4-гідрокси-7на еритема, нетримання, запалення, такі як ревпіперідиніламінометилхроману даного винаходу, матоїдний артрит, остеоартрит, псоріаз, астма та та їх фармацевтично прийнятні солі, можна приалергічні стани; блювання, включаючи гостре, піззначати самостійно або в комбінації з фармацевнє та попереднє блювання, коли блювання виклитично прийнятними носіями чи розріджувачами кає хіміотерапія, опромінення, хірургія, рух, мігбудь-яким із вищезгаданих способів, і застосовурень або інший блювотний засіб або стан; вати можна разово або кількома дозами. Зокрема, розлади, викликані Helicobacter pylori, серцевосунові терапевтичні агенти винаходу можна признадинні розлади, офтальмічні розлади, запалення чати у різних лікарських формах, наприклад, їх сечових шля хів, психози, шизофренія, розлади можна комбінувати з різними фармацевтично припровідності, деструкційний розлад поведінки, біпойнятними інертними носіями у вигляді таблеток, лярний розлад, порушення рухів, такі як синдром капсул, пілюль, пастилок, льодяників, порошку, Тоуретта, синдром стійкого акінезу, порушення спреїв, кремів,мазей, супозиторіїв, желе, гелів, 19 71004 20 паст, лосьйонів, мазей, водних суспензій, розчинів ки, потрібної для зниження до 50% кількості реагедля ін'єкцій, елексирів, сиропів тощо. До таких нонтів речовини Ρ , міченої радіоактивним ізотопом, сіїв належать тверді розріджувачі або наповнювана їхніх рецепторних ділянках в згаданій виділеній чі, стерильне водне середовище та різні нетоксичбичачій тканині або клітинах ІМ-9, цим визначаючи ні органічні розчинники тощо. Крім того, характерні величини ІС50 для кожної сполуки. фармацевтичні композиції орального застосування Більш особливо, інгібування зв'язування [3Н]РР до можна підсолодити та ароматизувати. Як правило, людських ІМ-9 клітин сполуками визначається у терапевтично-ефективні сполуки цього винаходу буферному розчині для аналізу (50мМ Tris-НСІ зустрічаються у таких лікарських формах з рівнем (рН7.4), 1мМ МnСІ2 , 0,02% альбуміну бичачої сиконцентрації 5,0-70% від ваги. роватки, бацитрацин (40mг/мл), лейпептин Для орального застосування таблетки, що міс(4mг/мл), хімостатин (2mг/мл) та фосфорамідон тять різні наповнювачі, такі як мікрокристалічна (30mг/мл)). Реакцію починали шляхом додавання целюлоза, цитрат натрію, карбонат кальцію, двоклітин до буферного розчину для аналізу, що міскальцієвий фосфат та гліцин, можна використовутив 0,56нМ [ 3Н]РР та різні концентрації сполук (завати разом з різними дезінтегрантами, такими як гальний об'єм: 0,5мл) та інкубації протягом 120хв. крохмаль (переважно, кукурудзяний, картопляний при 4°С. Інкубацію завершили фільтруванням чекрохмаль або крохмаль із тапіоки), альгінова кисрез фільтри GF/B (попередньо замочивши в 0,1% лота та визначені комплексні силікати, разом з поліетиленіміну на 2 години). Неспецифічне зв'яв'яжучим матеріалом типу полівінілпіролідон, сазування визначали як радіоактивність в присутносхароза, желатин та акація. Крім того, мастильні ті 1мМ речовини Р. Фільтри поміщували на пробірагенти, такі як стеарат магнію, лауриловий сульки і підраховували за допомогою рідинного фат натрію і тальк, часто застосовуються при висцинтиляційного лічильника. готовленні таблеток. Тверді композиції такого типу З іншого боку, протизапаленнєву активність можна також застосовувати як наповнювачі для сполук цього винаходу , на органах ссавців, можна желатинових капсул; віддається перевага матеріпоказати аналізом екстравазації плазми, індуковаалам, що містять також лактозу або молочний цуної капсаіцином, способом, описаним в (A. кор, а також поліетиленгліколі з високою молекуNagahisa et al, European Journal of Pharmacology, лярною масою. Коли для орального застосування Vol. 217, pp. 191-195, 1992). В цьому досліді, пропотрібна водна суспензія та/чи елексир, активний тизапаленнєва активність визначається процентінгредієнт можна комбінувати з різними підсолоним інгібуванням екстравазації плазмового протеїджуючими або ароматизуючими агентами, та фану в сечоводі особин чоловічої статі морських рбниками, і, якщо необхідно, емульгуючими та/чи свинок Hartley (вагою 300-350г), анастезованих суспенгуючими агентами, разом з такими розріпентобарбітом (25мг/кг). джувачами як вода, етанол, пропіленгліколь, гліЕкстравазація плазми індукується інтраперицерин та різними їх комбінаціями. тонеальною ін'єкцією капсаїцину (30мМ в 0,1 альДля парентального застосування, розчини буміну бичачої сироватки, що містить буферний сполуки даного винаходу можна використовувати розчин, 10мл/тварина) у тварин, які не їли протяабо в кунжутній чи арахісовій олії, або у водному гом ночі. Сполуки цього винаходу розчиняли у пропіленгліколі. Водні розчини потрібно належним 0,1% метиловій целюлоза-воді давали за 1 годину чином буфер увати (переважно рН>8), якщо необперед контрольним зараженням капсаїцином. Сихідно, і рідинний розріджувач спочатку потрібно ній фарбник Evans (30мг/кг) призначали внутрішперетворити на ізотонний. Такі водні розчини є ньовенно за 5 хвилин перед зараженням. Тварин прийнятними для внутрішньовенних ін'єкцій. Масубивали через 10 хвилин після ін'єкції капсаїцину, і ляні розчини є прийнятними для внутрішньосуглодіставали правий і лівий сечоводи. Вміст фарбнибних, вн утрішньом'язових та підшкірних ін'єкцій. ка в тканині визначали при поглинанні 600нм після Приготування всіх цих розчинів при стерильних екстракції формаміду протягом ночі. умовах здійснюється за стандартними фармацевСполука, приготовлена за прикладом з цього тичними технологіями, добре відомими фахівцям у винаходу показала 98%-інгібування при 0,03мг/кг, даній галузі. в той час як структурно найближча сполука в приКрім того, сполуки даного винаходу можна такладі 18 заявки №WO97/08114 показала 72% при кож призначати для місцевого застосування при такій же дозі. лікуванні, наприклад, запалень шкіри, і для цього Зворотній ефект на здатність зв'язування краще застосовувати креми, желе, гелі, мазі тощо, кальцієвих каналів визначається вивченням зв'язгідно стандартної фармацевтичної практики. зування верапамілу в препаратах з серцевої мемАктивність сполук даного винаходу як антагобрани пацюків. Більш особливо, зв'язування вераністів речовини Ρ можна пояснити їх здатністю памілу здійснюється як попередньо описано в інгібувати зв'язування речовини Ρ на її кліткових (Reynolds et al, J. Pharmacol. Exp. Ther. Vol. 237. p. рецепторах в клітинах яєчника китайського хом'яч731, 1986). Коротко, інкубація починається шляхом ка, які експресували рецептори NK1 або клітини додавання тканини до пробірки, що містить 0,25нМ ІМ-9, які використовують в якості радіоактивних [3Н]дезметоксиверапаміл та різні концентрації реагентів. Активність сполук вищеописаного піпесполук (загальний об'єм - 1мл). Неспецифічне рідиніламінометилтрифторометилового циклічного зв'язування визначається як радіолігандне зв'язуефіру як антагоніста речовини Ρ можна визначити вання, що залишається в присутності 3-10нМ мешляхом аналізу, описаного в (D. G. Payan et al., J. токсиверапамілу. Immunology, Vol. 133. p. 3260, 1984). Цей спосіб Активність сполук цього винаходу проти розполягає у визначенні концентрації окремої сполуладів ЦНС визначається в [Sar9, 21 71004 22 Меt(O 2)11]речовина Р-індукованій пробі у піщанок, луки визначають (наприклад, T1/2 коефіцієнт=(Т1/2 використовуючи варіацію способу (Н.М. Рупняк N. контрольною векторною мікросомою)/(Τ1/2 М. J. Rupniak (European Journal of Pharmacology, СУР2D6-експресуючою мікросомою, доданої до Vol. 265, pp. 179-183, 1994) та (Л.Дж. Брістоу L. J. мікросоми печінки людини CM)). Bristow (European Journal of Pharmacology. Vol. Приклади. 253. pp. 245-252, 1994). Більш детально, перше, Даний винахід ілюструється наступними присполука цього винаходу підшкірно призначається кладами. Однак, зрозуміло, що винахід не обмепіщанкам. Друге, піщанок злегка анастезували жується окремими деталями даних прикладів. Тоефіром, поверхню черепа опромінювали. Третє, чки плавлення (тп) вимірювалися за допомогою апарата Бучі і не уточнювалися. Спектри погли[Sar9, Меt(O2)11]речовину Р (5mл) вводили безпонання інфрачервоних променів (ІЧ) вимірювалися середньо в латеральний шлуночок через голку інфрачервоним спектрометром Шімадзу (IR-470). розміром 25, вставлену нижче ламбди. Потім, піщанок поміщали в лабораторні мензурки місткістю Спектр ядерного магнітного резонансу (ЯМР) на атомах водню вимірювали в CDCI3 спектрометром 1 літр, і їх контролювали для періодичного постуядерного магнітного резонансу JEOL (JNM-GX270, кування по задній лапі. 270МГц для ‘H) і положення піків виражали в маПротиблювотну активність цього винаходу сових частках (м.ч.) відносно тетраметилсилану. можна продемонструвати аналізом викликання блювання цисплатином у африканського тхора. Форма сигналів вказувалася таким чином: с, синглет; д, дублет; т, триплет; м, мультиплет. Сполуку цього винаходу підшкірно вводили африПриклад 1. канським тхорам (особини чоловічої статі, маса Приготування (2S,3S)-3-(6-Meтокси-1-метил-1тіла=1,3-1,6кг) за 30 хвилин перед ін'єкцією цисптрифторометилізо-хроман-7-іл)метиламіно-2латину. Цисплатин інтраперитонеально вводили африканським тхорам, і їх приступи блювання (нафенілпіперідинін дигілрохлориду (І) 2-(2-Бромо-5-метоксифеніл)етанол. приклад, позив, блювання та блювальні рухи) заДо суміші 3-метоксифенетилового спирту писували на відеокамеру протягом 4 годин. Часто(1,18г, 7,8 ммоль) та піридину (0,75мл, 9,3 ммоль) ту приступів підраховували. в сухому дихлорометані (10мл), що помішували, Чутливість до метаболізму сполук цього винаходу можна визначити аналізом in vitro, що полядодавали по краплях бромін (0,47мл, 18,0 ммоль) гає у: (а) взаємодії сполуки зразка з композицією під азотом при 0°С. Жовтогарячий розчин переміреагента, одержаної шляхом додавання особливошували при кімнатній температурі протягом 4 гого ізозиму цитохрому Р-450 (наприклад, CYP2D6) дин. Суміш реакції гасили шляхом додавання 10%до мікросом печінки слабкого метаболізатора (CM) го водного розчину бісульфіту натрію, та екстрагу(наприклад, мікросоми печінки людини з недоставали шляхом додавання дихлорометану. Органічні чею згаданого ізозиму цитохрому Р-450) в носії, та екстракти промивали соляним розчином, просу(б) аналізуванні субстрату масспектрометром, шували над сульфатом магнію, і концентрували зв'язаним з ВЕРХ (високоефективною рідинною для одержання неочищеного продукту, який потім очищали хроматографією на силікагелі використохроматографією). Більш детально, субстрат (1mΜ) вуючи в якості елюента градієнт гексану та етилаінкубують мікросомою печінки людини CM (виготоцетату (10:1,8:1,5:1) для одержання сполуки, вкавленої Keystone Skin Bank), до якої додається резаної у заголовку у вигляді безбарвного масла комбінантна СУР2О6-експресуюча мікросома (00,1мг/мл) або контрольними векторними мікросо(1,5г, 83,2%). ¢Р-ЯМР (CDCI3):7,43 (д, J=8,8Гц, 1Н), мами в присутності 1,3мМ НАДФ (нікотинамідаде6,83 (д, J=3,3Гц, 1Η), 6,67 (дд, J=8,8, 3,3Гц, 1Η), ниндинуклеотидфосфат), 0,9мМ НАДГ (нікотина3,91 - 3,81 (м, 2Η), 3,78 (с, 3Н), 2,99 (т, J=6,6Гц, мідадениндинуклеотид відновлений), 3,3мМ 2Н). МgСІ2; та 8 одиниць/мл Г-6-ФДГ (глюкоза-6(ІІ)2-(2-(2-Бромо-5фосфа т дигідрогеназа) відповідно, загальним об'метоксифеніл)етокси)тетрагідропіран ємом 1,2мл 100мМ буферного розчину фосфату До суміші 2-(2-бромо-5-метоксифеніл)етанолу калію. рН розчину становить 7,4, температура ін(1,5г, 6,5 ммоль) та дигідропірану (13,0 ммоль) в сухому ди хлорометані (30мл), при помішуванні, кубування - 37°C. Протягом часу інкубування (0, 5, додавали камфорну сульфокислоту(0,3 ммоль) під 10, 30 і 60 хвилин), аліквотну пробу (100mΜ) беазотом при 0°С протягом 1 години. Суміш реакції руть з суміші реакції і змішують з 1мл ацетонітрілу гасили насиченим розчином бікарбонату натрію, та (АЦН), що містить 5нг/мл (2S,3S)-3-(2екстрагували шля хом додавання дихлорометану. метоксибензиламіно)-2-дифенілметил-1Органічні екстракти промивали соляним розчином, азабіцикло[2.2.2]октану як внутрішній стандарт просушували над сульфатом магнію, і концентру(приготовлений способами, описаними в вали для одержання неочищеного продукту, який WO90/05729). Протеїн застосовують при центрипотім очищали хроматографією на силікагелі вифугуванні (1,800 x г за 10хв.), і одержану надосакористовуючи в якості елюента суміш гексану та дову речовину збирають. Концентрацію субстратів етилацетату (20:1) для одержання сполуки, вказата продуктів в розчинах зразка аналізують массної у заголовку (2,05г, кількісно). 1Н-ЯМР (CDCI3): перктрометром Sciex API-Ill, сполученим з систе7,40 (д, J=8,8Гц, 1Η), 6,86 (д, J=2,9Гц, 1Η), 6,65 мою високоефективної рідинної хроматографії (дд, J=8,8, 2,9Гц, 1Η), 4,63 - 4,60 (м, 1Η), 3,99 - 3,90 Хьюлетта-Паккарда НР1090 HPLC. Концентрації (м, 1Η), 3,82 - 3,74 (м, 1Η), 3,78 (с, 3Н), 3,68 - 3,59 субстратів, що залишилися в кожному розчині зра(м, 1Η), 3,50 -3,45 (м, 1Η), 3,02 (τ, J=7,0Гц, 2Η), зка (%-залишок) позначають на графіку проти часу 1,83 - 1,52 (м, 6Н). інкубування. Величини Т1/2 одержують в кожному (Ill) 1,1,1-трифторо-2-(4-метокси-2-(2графіку. Коефіцієнти величин Т1/2 тестованої спо 23 71004 24 (тетрагідропіран-2-ілокси)етил)феніл-пропан-2-ол 3Н). До розчину 2-(2-(2-бромо-5-метоксифеніл)(VI) 1 -трет-бутоксикарбоніл-(2S,3S)-3-(6етокси)тетрагідропірану (1,0г, 3,17 ммоль) в сухометокси-1-метил-1-трифторметил-ізохроман-7му тетрагідрофурані (20мл), який помішували, доіл)метиламіно-2-фенілпіперідин давали по краплях n-бутиллітій (2,5мл, 4,12 До розчину 1-трет-бутоксикарбоніл-(2S,3S)-3аміно-2-фенілпіперідину (0,67 ммоль), одержаного ммоль) під азотом при -78°С. Суміш реакції поміспособом, описаним в WO97/03066, і 6-метоксишували при -40°С протягом 1 години. До реакції метил-1-трифторометилізохроман-7-карбальдегіду додавали краплями суспензію безводного хлориду (184мг, 0,67 ммоль) в сухому ди хлорметані (3мл), церію (884мг, 3,58 ммоль) в сухому тетрагідрофуякий перемішували, частинами додавали моляррані (15мл) при температурі -78°С і перемішували ний надлишок триацетоксиборогідриду натрію під протягом 1 години. До реакції додавали трифтоазотом при кімнатній температурі. Реакцію перерацетон (0, мл, 5,59 ммоль), і одержану суміш пемішували при кімнатній температурі протягом п'я ремішували при температурі -78°С протягом 1 готи годин. Суміш потім перетворювали на основу дини. Потім гасили насиченим розчином хлориду шляхом додавання насиченого розчину бікарбонаамонію та екстрагували дихлорметаном. З'єднані ту натрію, екстрагували ди хлорметаном, просушуорганічні екстракти просушували над сульфатом вали над сульфатом магнію, і концентрували для магнію, і концентрували для одержання неочищеодержання неочищеного продукту, який потім них продуктів, які потім очищали хроматографією очищали хроматографією на силікагелі використона силікагелі використовуючи в якості елюента вуючи в якості елюента градієнт дихлорметану та градієнт гексану та етилацетату метанолу (50:1, 25:1, 20:1) для одержання зазна(20:1,15:1,12:1,10:1) для одержання сполуки, заченої у заголовку сполуки (330мг, 91,8%). 1Нзначеної у заголовку (555мг, 50,3%). ¢НЯМР(СОСІ3) : 7,59 -7,55 (м, 2Н), 7,34 - 7,17 (м, 4Н), ЯМР(СОСІ3): 7,35 - 7,31 (м, 1Н), 6,78 - 6,74 (м, 2Н), 6,56 (с, 1Н), 5,44 (м, 1Н), 4,16 - 4,08 (м, 1Н), 3,99 5,70 та 5,62 (кожний с, разом 1Н), 4,63 і 4,48 (кож3,84 (м, 2Н), 3,80 (м, 2Н), 3,72 і 3,71 (кожний с, раний м, разом 1Н), 4,18 - 4,11 і 3,99 -3,92 (кожний м, зом 3Н), 3,06 - 2,98 (м, 2Н), 2,83 - 2,81 (м, 2Н), 1,85 разом 1Н), 3,80 (с, 3Н), 3,77 - 3,43 (м, 3Н), 3,33 -1,61 (м, 4Н), 1,63 і 1,61 (кожний с, разом 3Н), 1 50 2,90 (м, 2Н), 1,80 і 1,78 (кожний с, разом 3Н), 1,75 -1,40 (м, 1Н), 1,39 (с, 9Н). 1,26 (м, 6Н). (VII) (2S,3S)-3-(6-метокси-1-метил-1(IV) 6-метокси-1-метил-1трифторометилізохроман-7-іл)метиламіно-2трифторометилізохроман фенілпіперідин дигідрохлорид Суміш 1,1,1-трифторо-2-(4-метокси-2-(2До розчину 1-трет-бутоксикарбоніл-(2S,3S)-3(тетрагідропірану-2-ілокси)етил)феніл)-пропан-2(6-метокси-1-метил-1-трифторметилізохроман-7олу (470мг, 1,35 ммоль) та концентрованої соляної іл)метиламіно-2-фенілпіперідину (325мг, 0,61 кислоти (4мл) перемішували при температурі ммоль) в етилацетаті (5мл), який помішували, до120°С протягом 3 годин. Після охолодження реакдавали по краплях метанольний розчин соляної цію розріджували водою, і водний шар екстрагувакислоти під азотом при кімнатній температурі проли дихлорметаном. Органічні екстракти просушутягом 8 годин. Розчинник виділяли і перекристалівали над сульфатом магнію, і концентрували для зували з етанолу для одержання зазначеної в заодержання вказаної в заголовку сполуки у вигляді головку сполуки (88мг, 28,4%), точка плавлення коричневого масла (460мг), яку використовували 193-201°C. 1Н-ЯМР (основний ізомер, вільний далі без подальшого очищення. амін, CDCI3: 7,33 - 7,20 (м, 5Н), 6,95 (с, 1Н), 6,43 (с, (V) 6-метокси-1-метил-11Н), 4,13 - 4,09 (м, 1Н), 3,92 - 3,84 (м, 2Н), 3,62 (д, трифторометилізохроман-7-карбальдегід J=13,9Гц, 1Н), 3,51 (с, 3Н), 3,33 (d, J=13,9Гц, 1Н), До розчину 6-метокси-1-метил-13,31 - 3,24 (м, 1Н), 2,84 - 2,74 (м, 4Н), 2,12 - 2,07 трифторометилізохроману (460мг) в сухому дих(м, 1Н), 1,94-1,82 (м, 1Н), 1,67 - 1,62 (м, 1Н), 1,59 лорметані (5мл), який помішували, додавали хло(с, 3Н), 1,43-1,38 (м, 1Н). рид титану (І\/) під азотом при температурі -78°С. Діастереомерне відношення епімерів при 1Через 15 хвилин до жовтого розчину додавали позиції на кільці ізохроману визначали 1Н-ЯМР як: розчин дихлорометилметилового ефіру в сухому (1R:1S). Такими ізомерами є (2S,3S)-3-[(1R)-6дихлорометані при тій же температурі. Реакцію метокси-1-метил-1-трифторметилізохроман-7перемішували при -78°С протягом години, вливали іл]метиламіно-2-фенілпіперідин та (2S,3S)-3-[(1S)в льодяну воду, і перемішували при кімнатній тем6-метокси-1-метил-трифторметилізохроман-7пературі протягом 30 хвилин. Водний шар екстраіл]метиламіно-2-фенілпіперідин. Більш розчинний гували метиленовим хлоридом. Екстракти промиепімер виділяли із маточного розчину. Діастереовали соляним розчином, просушували над мерне відношення епімерів при 1-позиції на кільці сульфатом магнію, і концентрували для одержанізохроману визначали 1Н-ЯМР як 1:3 (1R:1S). Абня неочищеного продукту, який очищали хроматосолютна стереохімія сполуки, зазначеної у заголографією на силікагелі використовуючи в якості вку, визначалася рентгенівською кристалографією елюента градієнт гексану та етилацетату (10:1, (3R) ізомера після очищення перекристалізацією. 8:1, 6:1) для одержання вказаної в заголовку спо1 Н-ЯМР (основний ізомер, вільний амін, CDCI3): луки (179мг, 48,3% з 1,1,1-трифторо-2-(4-метокси7,33 - 7,20 (м, 5Н), 6,99 (с, 1Н), 6,40 (с, 1Н), 4,13 2-(2-(тетрагідропіран-2-ілокси)етил)феніл)-пропан4,09 (м, 1Н), 3,92 - 3,84 (м, 2Н), 3,62 (д, J=13,9Гц, 2-олу). 1Н-Я МР (CDCI3): 10,41 (с, 1 Η), 7,82 (с, 1Н), 3,45 (с, 3Н), 3,33 (д, J=13,9Гц, 1Н), 3,31 - 3,24 1Н),6,78 (с, 1 Η), 4,19 - 4,11 (м, 1Н), 3,94 (с, 3Н), (м, 1Н), 2,84 - 2,74 (м, 4Н), 2,12 - 2,07 (м, 1Н), 1,943,94 - 3,87 (м, 1Н), 2,91 (т, J=4,4Гц, 2H), 1,67 (с, 1,82 (м, 1Н), 1,67 - 1,62 (м, 1Н), 1,59 (с, 3Н), 1,43 25 71004 26 1,38 (м, 1Н). цього матеріалу був ідентичним спектру рацемату. Приклад 2. (IV) (1R)-6-Гідрокси-1-метил-1-трифторометил(2S,3S)-3-[(1R)-6-1-метокси-1-метил-1ізохроман трифторометилізохроман-7-іл]-метиламіно-2До суміші (1R)-6-ацетокси-1-метилфенілпіперідин дигідрохлорид трифторометил-ізохроману (35,5г, 0,129 моль), (I) 6-гідрокси-1-метил-1метанолу (860мл) і води (340), яку помішували, трифторометилізохроман додавали карбонат калію (35,7г, 0,258 моль) при До розчину 6-метокси-1-метил-10°С, потім суміш перемішували при кімнатній темтрифторометилізохроману (71г, 0,29 моль) в оцтопературі протягом 1 години. Одержану суміш підвій кислоті (600мл), який помішували, додавали кисляли 2 N соляною кислотою (рН 3), і випаровуводну 48% НВr (300мл) і суміш перемішували провали у вакуумі для виділення метанолу. Залишок тягом 13 годин при температурі 130°С. Після видіекстрагували етилацетатом. Органічний шар пролення оцтової кислоти у вакуумі реакцію оброблямивали водою і соляним розчином, і просушували ли водним NaOH (8Μ), поки рН не став 5-6. над сульфатом магнію. Після фільтрування фільтОдержаний розчин екстрагували етилацетатом рат концентрували при пониженому тиску для (400 мл х 2), і комбіновані екстракти етилацетату одержання зазначеної у заголовку сполуки у випромивали соляним розчином (100мл), просушугляді безбарвного масла (28,0г, 93%), яке викорисвали над MgSO4, і концентрували у вакуумі. Тонтовували без подальшого очищення. Спектр 1НЯМР цієї сполуки був ідентичним спектрові рацекошарова хроматографія (силікагель, 15´2 см, мата. 17% етилацетат/гексан) показала 6-гідрокси-1(V) (1R)-6-Метокси-1-метил-1-трифторометилметил-1-трифторметилізохроману (67г, 100%) у ізохроман вигляді безбарвного масла. 1Н-ЯМР(СОСІ3): 7,22 До суміші гідриду натрію (3,47г, 0,145 моль) в (д, J=9,1Гц, 1Н), 6,73 (дд, J=9,1, 2,6Гц, 1Н), 6,63 (д, N,N-диметилформаміді (50мл), яку помішували, J=2,6Гц, 1Н), 5,00 (с, 1Н), 4,17 - 4,07 (м, 1Н), 3,90 додавали розчин (1R)-6-гідрокси-1-метил-1(дт, J=11, 5,8Гц, 1Н), 2,84 - 2,78 (м, 2Н), 1,64 (с, трифторметилізохроману (28,0г, 0,121 моль) в 3Н). (II) 6-ацетокси-1-метил-1N,N-диметилформаміді (370мл) при 0°C, потім трифторометилізохроман суміш перемішували при кімнатній температурі До розчину 6-гідрокси-1-метил-1протягом 1 години. Реакцію гасили водою і розрітрифторометилізохроману (79г, 0,34 моль) і триджували насиченим водним хлоридом амонію, етиламіну (120мл, 0,88 моль) у тетрагідрофурані потім екстрагували етилацетат-толуолом (4:1). (680мл), який помішували, додавали ацетилхлоОрганічну фракцію промивали водою і соляним розчином, і просушували над сульфатом магнію. рид (31мл, 0,44 моль) при температурі 0°С, і суміш Розчинник виділяли у вакуумі, залишок очищали перемішували при кімнатній температурі протягом хроматографією на силікагелі використовуючи в 1 години. Реакцію гасили шляхом додавання водякості елюента гексан і етилацетат (40:1) для оденої 1 N-HCI (400мл), і екстрагували етилацетатом (500мл). Екстракти промивали водним насиченим ржання зазначеної у заголовку сполуки у вигляді безбарвного масла (29,1г, 98%). Спектр 1Н-ЯМР NaHCO3 (100мл) і соляним розчином (100мл), процього матеріалу був ідентичним зі спектром рацесушували над MgSO4, і концентрували у вакуумі. мата. Залишок очищали тонкошаровою хроматографією (VI) (2S,3S)-3-[(1R)-6-метокси-1-метил-1(силікагель, 15´20см, 6% етилацетат/гексан) для трифторометилізохроман-7-іл]метиламіно-2одержання 6-ацетокси-1-метил-1фенілпіперідин дигідрохлорид трифторметилізохроману (83г, 89%) у вигляді безВищезгаданий (1R)-6-метокси-1-метил-1барвного масла. 1H-ЯMP(CDCI3): 7,36 (д, J=7,2Гц, трифторометил-ізохроман далі перетворили на 1Н), 6,98 (дд, J=7,2, 2,5Гц, 1Н), 6,91 (д, J=2,5Гц, сполуку, зазначену у заголовку, способом приготу1Н), 4,18 - 4,08 (м, 1Н), 3,92 (дт, J=11, 5,4Гц, 1Н), вання прикладу 3 для одержання сполуки, зазна2,86 (τ, J=5,4Гц, 2Н), 2,30 (с, 1Н), 1,66 (с, 3Н). ченої у заголовку, у простій діастереометричній (III) (1R)-6-ацетокси-1-метил-1формі. Оптичне обертання: [a]27D= +75,44; трифторометил-ізохроман і (1S)-6-гідрокси-1(с=0,424, МеОН). метил-1-трифторметил-ізохроман Приклад 3 (Мікробіальна БіотрансформаСуміш рацемічного 6-ацетокси-1-метил-1ція) трифторометилізохроману (38,4г, 0,140 моль), 6-метокси-1-метил-7-[2-феніл-піперідин-310%-го розчину втор-бутанолу в гексані (1,3л), і іламіно)-метил]-1-трифторметилізохроман-4-ол ліпази PS (35г) ретельно перемішували при кімнаДвадцять п'ять мл середовища IOWA (безводтній температурі протягом 23 годин. Після фільтна декстроза - 20г; дріжджовий екстракт - 5г; гідрування фільтрат концентрували при пониженому рофосфат калію - 5г; хлорид натрію - 5г; соєве тиску для одержання суміші, яку очищали хромаборошно - 5г; дистильована вода -1л; скореговано тографією на силікагелі використовуючи в якості рН до 7,2 за допомогою 1N сірчаної кислоти) доелюента градієнт гексану та етилацетату давали до кожної з вісімнадцяти колб Делонга, (15:1,5:1,2:1) для одержання, спочатку, (1R)-6місткістю 125мл, з пробками Мортона, і одержані ацетокси-1-метил-1-трифторметил-ізохроману у комбінації сперелізували парою протягом 30 хвивигляді безбарвного масла (17,3г, 45%, 94%). Спектр 1Н-ЯМР цієї сполуки був ідентичним зі спелин при 15 псі та 121°С. Дві колби (стадія інокуляктром рацемату. Др уга фракція дала (1S)-6ції) асептично інокулювали 0,25мл стерильним гідрокси-1-метил-1-трифторметил-ізохроман у виміцелієм Streptomyces punipalus (NRRL 3529), що гляді кристалів (16,9г, 52%, 83%). Спектр 1Н-ЯМР зберігався при низькій температурі (-80°С). Іноку 27 71004 28 льовані колби встановили вертикально на роталу. Матеріал, що залишився після виділення меційному шейкері (радіус - 2 дюйми) і струшували з танолу, розчиняли у 20% метанолі у водному розчині і поміщали у вакуумі у картриджі зі смолою частотою 210 обертів за хвилину та 29°С протягом С18 (Waters Sep-Pak 6сс (1g)) С18 для екстракції 2 днів. Потім, 2,5мл живильного середовища зі твердої фази. [Картридж готували для розміщення стадії інокуляції асептично перемістили до решти в ньому сполуки шляхом промивання 15мл мета15 колб (стадія біотрансформації). Інокульовані нолу, а потім 15мл дистильованої води.] Заповнеколби для біотрансформації помістили вертикально на ротаційному шейкері (радіус - 2 дюйми) і ний картридж для екстракції твердої фази очищали від незв'язаних сполук 20мл 20% метанолу у струшували з часто тою 210 обертів за хвилину при водному розчині. Сполуки, що зв'язалися зі смотемпературі 29°С протягом 1 дня. Дигідрохлорид лою елюювали 10мл метанолу у водному розчині (6-метокси-1-метил-1-трифторометил-ізохроман-7зі зростаючою концентрацією розчинника (50, 55, ілметил)-(2-феніл-піперідин-3-іл)-аміну (напри60, 65, 70, 75, 80, 85, 90, 95, 100%). Майже всі клад, субстрат) розчиняли у дистильованій воді сполуки, в яких були зацікавлені, елюювали з кар(6,5мг/мл). До кожної із 15 колб для біотрансфортриджа для екстракції твердої фази в 60-70% мемації асептично додавали 0,75мл одержаного розтанолових елюатах (переважно в 55% елюаті). чину для одержання концентрації вихідного субЕлюенти, що містили зазначену у заголовку сполустрату 173мкг/мл (73,1мг разом в 15 колбах). Закриті колби поміщали вертикально на ротаційку об'єднували і просушували при 45°С потоком азоту. Під час просушування безводний етанол ному шейкері і струшували з частотою 210 оборододавали для випаровування води. Просушений тів за хвилину при температурі 29°С протягом 4 неочищений продукт важив 59мг. Його розчиняли днів. Хід утворення продукту біотрансформації у 75% метанолі у воді і хроматографували висококонтролювали шляхом високоефективної рідинної ефективною рідинною хроматографією з обернехроматографії з оберненою фазою проб (1мл) щоною фазою (Спосіб 1 ВЕРХ) для виділення сполуденно. Наприкінці четвертого дня періоду біотранки, зазначеної у заголовку. сформації до кожної колби додавали по 25мл метанолу, і перемішували з вмістом (наприклад, живильне середовище). Одержану суміш живильСпосіб 1 ВЕРХ ного середовища/метанолу з усіх 15 колб з'єднували, після чого колби двічі промивали, спочатку Колонка: Luna 5m С18(2), 21,2´250мм. 50мл метанолу, а потім 25мл метанолу. Рідину Лінійний градієнт з 2-30хв.; для промивки з'єднували з попереднім екстрактом (20-80)% ацетонітрил : (80для одержання загального об'єму майже 775мл. 20)% водного буферного Мобільна фаза: Резервуар з живильним середовищем/метанолом розчину [95% 20мМ ацетату центрифугували (центрифуга RC5B, 6000 оборотів амонію, скорегований рН 6,8 за хвилину, 8хв.) для виділення твердих речовин. / 5% МеОН]. Надосадову речовину(А) збирали. Тверді речовиШвидкість потоку: 9мл/хв. ни знову розчиняли в 100мл метанолу, перемішуУФ-поглинання при 281нм; вали, і центрифугували як до цього. Надосадову Контролювали фотодіодна проба при 200речовину (В) об'єднували з надосадовою речови400нм (щілина 4,8нм). ною (А) і фільтрували у вакуумі через скловолоТривалість: 30хв. конний фільтр (Whatman GF/B). Після чого, фільтрат дистилювали при пониженому тиску при Сполука, зазначена у заголовку, мала час температурі 45°С для відділення метанолу. Одерутримання майже 17,3. Елюючі фракції мобільної жані »300мл водного залишку застосовували під фази ВЕРХ , що містили сполуку, зазначену у затиском азоту (30 псі) для підготовленого картриголовку, збирали, виділяли з розчинника (ацетоніджа зі смолою С18 (Biotage KP-C18-WP, 20-40рМ) трілу) у вакуумі при температурі 45°С і поміщали у для екстакції твердої фази (ЕТФ). [Картрідж готусвіжий картридж для екстракції твердої фази вали для розміщення в ньому сполуки шляхом (Waters бес С18; підготовка описана вище), пропромивання 1250мл метанолу, а потім 2250мл мивали дистильованою водою для виділення солі, дистильованої води.] Після заповнення, колонку і елюювали 10мл метанолу. Цей елюат концентрупромивали 2050мл дистильованої води для вилували до сухого стану під потоком N 2. Просушений чення незв'язаного матеріалу. Заповнену колонку матеріал розчиняли в 50% розчині метанолу/води і промивали 975мл 50% розчину метанолу (1:1 Мехроматографували ВЕРХ з оберненою фазою ОН/Н2О) для вилучення небажаного матеріалу. (Спосіб 2 ВЕРХ) для виділення сполуки, зазначеСполуку, в якій були зацікавлені, елюювали 975мл ної у заголовку. метанолу. Елюат дистилювали під пониженим тиском при температурі 45°С для виділення метано 29 71004 Спосіб 2 ВЕРХ Колонка: Мобільна фаза: Швидкість потоку: Контролювали: Тривалість: Luna 5m С18(2), 21,2´250мм. Лінійний градієнт з 2-30хв.; (5-75)% ацетонітрил: (9525)% водного буферного розчину [20мМ оцтової кислоти в дистильованій воді, скореговано рН 4,0 шляхом додавання 1N H2S04 ]. 9мл/хв. УФ-поглинання при 281нм; фотодіодна проба при 200400нм (щілина 4,8нм). 30хв. Сполука, зазначена у заголовку, мала час утримання майже 21,8. Елюючі фракції мобільної фази ВЕРХ , що містили сполуку, зазначену у заголовку, збирали у посудину, що містила 20мл буферного розчину ацетату амонію (водна мобільна фаза способу 1 ВЕРХ). Резервуар з об'єднаними фракціями ВЕРХ, що містили сполуку, зазначену у заголовку, виділяли з розчинника (ацетонітрілу) у вакуумі при температурі 45°С, і поміщали у свіжий картридж для екстракції твердої фази (Waters бес С18; підготовка описана вище), промивали дистильованою водою для виділення солі, і елюювали 10мл метанолу. Метаноловий елюат виділяли із розчинника під потоком N2 при температурі 45°С. Просушений матеріал розчиняли в безводному етанолі і тримали до сухого стану при пониженому тиску. Одержали 19,3мг сполуки, зазначеної у заголовку. Загальний молярний вихід становив 29,7%. Сполука, зазначена у заголовку, мала час утримання 13,9хв, за способом 3 ВЕРХ. Сполука, зазначена у заголовку, мала час утримання 13,9хв. у Способі 3 ВЕРХ. Вихідна сполука мала час утримання 17,5хв. за цим способом. Спосіб 3 ВЕРХ Колонка: Summetry C18, 3,9´150мм. Лінійний градієнт з 2-30хв.; (15-90)% ацетонітрил: (8510)% водного буферного розМобільна фаза: чину [20 мМ оцтової кислоти в дистильованій воді, скореговано рН 4,0 шляхом додавання 1N H 2S04 ]. Швидкість потоку: 1мл/хв. УФ-поглинання при 281нм; Контролювали: фотодіодна проба при 200400нм (щілина 4,8нм). Комп’ютерна в ерстка А. Крижанівський 30 Тривалість: 30хв. Вона мала УФ-поглинання з максимумами на 205нм, 229нм (лише плече), та 280нм. MC(APCF):451,3(M+H). Приклад 4 (Мікросомальна Біотрансформація) 6-метокси-1-метил-7-[(2-феніл-піперідин-3іламіно)-метил]-трифторометил-ізохроман-4-ол Альтернативу синтезу мікробіальною біотрансформацією (Приклад 3) можна одержати шляхом використання мікросомальної реакційної суміші рекомбінантних клітин. Реакція містить такі компоненти: 100мМ буферного розчину фосфату 700 mл калію (рН 7,4) 200 mл кофакторний розчин 15мМ вихідної сполуки, розчиненої у 20 mл дистильованій воді мікросоми клітин комах, інфікованих бациловірусом, коексресуючі людсь80 mл ку Р450 (CYP2D6) та людську цитохроморедуктазу P450-NADPH 100мМ буферний розчин сульфату калію 8,1 мл 100 мМ К2НРО4 у дистильованій воді 1,9 мл 100 мМ К2НРО4 у дистильованій воді Кофакторний розчин 4 мл NADP+ (наприклад, Sigma N-0505) ізолимонна кислота (наприклад, 75 мл Sigma (1252) ізолимонна дегідрогеназа (напри198 мл клад, Sigma 1-2002 802 мл 125мМ MgCI2 у дистильованій воді Компоненти реакції додавали до скляної пробірки (16´125мм) із пробкою Мортона з нержавіючої сталі. Пробірку інкубували на ротаційному шейкері (радіус - 1 дюйм) з частотою 240 обертів за хвилину та при температурі 37°С. Хід реакції перевіряли через 0, 5 та 24 години після початку аналізу з використанням ВЕРХ з оберненою фазою (Спосіб 3; описаний в Прикладі 3). Для припинення реакції і підготовки проби для аналізу, 250мл пробу додавали до 250мл метанолу, перемішували, о холоджували на льоді протягом 15хв, центрифугували (мікрофуга Еппендорфа, 14000 оборотів за хвилину, 5хв.) для виділення присутніх протеїнів. Реакція тривала 5 годин. Розраховане молярне перетворення становило 9,9%. Характеристики ВЕРХ і АРСІ+ цього продукту були тими ж, що й для сполуки, зазначеної у заголовку, в прикладі 3. Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1-trifluoromethyl-4-hydroxy-7-piperidinylaminomethylchroman derivatives
Назва патенту російськоюПроизводные 1-трифторометил-4-гидрокси-7-пиперидиниламинометилхромана
МПК / Мітки
МПК: A61P 31/04, A61P 37/08, A61P 43/00, A61P 25/18, A61P 25/06, A61P 15/10, A61P 1/16, A61P 13/00, A61P 25/02, A61P 25/14, A61P 1/08, A61P 25/28, A61P 9/10, A61P 29/00, C07D 405/12, A61P 17/06, A61P 17/16, A61P 37/02, A61P 25/24, A61P 15/08, A61K 31/453, A61P 3/02, A61P 25/30, A61P 27/02, A61P 13/02, A61P 19/02, A61P 1/04, A61P 11/06, A61P 11/02, A61P 1/14, A61P 25/16, A61P 1/00, A61P 13/10, A61P 25/04
Мітки: похідні, 1-трифторометил-4-гідрокси-7-піперидиніламінометилхроману
Код посилання
<a href="https://ua.patents.su/15-71004-pokhidni-1-triftorometil-4-gidroksi-7-piperidinilaminometilkhromanu.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-трифторометил-4-гідрокси-7-піперидиніламінометилхроману</a>
Попередній патент: Теплиця
Наступний патент: Водорозчинний препарат вітаміну d3
Випадковий патент: Модульна електросистема "периметр" для обігріву приміщень












