Модулятори рецепторів прогестерону
Номер патенту: 88782
Опубліковано: 25.11.2009
Автори: Ревінкель Йоганнес Бернардус Марія, Гамерсма Йоганнес Антоніус Марія
Формула / Реферат
1. Сполука формули І
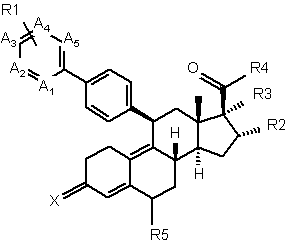 , Формула І
, Формула І
де
Х - О, NOH, NО(1-4)алкіл, NО(1-4С)ацил;
А1-А5 представляють С, заміщений R1, або N, за умови, що принаймні один та не більше трьох з А1-А5 представляють N; або
один або два з А1, А2 та А5 представляють N, а інші представляють С, заміщений R1, а A3 та А4 разом представляють конденсоване бензокільце або конденсоване 5- або 6-членне нітрогеновмісне ароматичне кільце, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом;
кожний R1 незалежно вибрано з групи: Н, галоген, (1-4С)алкіл та (1-4С)алкоксил;
R2 - Н, (1-4С)алкіл або (1-6С)алкеніл, які заміщені, як варіант, (6-10С)арилом, який заміщено, як варіант, одним або більше галогеном та/або (1-4С)алкілом;
R3 - Н або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном;
a R4 - циклопропіл або циклопропеніл, заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом; або
R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоциклічне кільце;
a R4 - циклопропіл або циклопропеніл, заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом;
або R2 - Н або (1-4С)алкіл; а
R3 разом з R4 утворює 5-, 6- або 7-членне насичене або ненасичене карбоциклічне кільце;
R5 - Н або (1-4С)алкіл;
або її фармацевтично прийнятна сіль та/або гідрат, та/або проліки.
2. Сполука за п. 1, яка відрізняється тим, що А1-А5 представляють С, заміщений R1, або N, за умови, що принаймні один та не більше трьох з А1-А5 представляють N.
3. Сполука за п. 1, яка відрізняється тим, що один або два з А1, А2 та А5 представляють N, а інші представляють С, заміщений R1, а A3 та А4 разом представляють конденсоване бензокільце або конденсоване 5- або 6-членне нітрогеновмісне ароматичне кільце, які заміщені, як варіант, галогеном та/або (1-4С)алкілом.
4. Сполука за п. 1, яка відрізняється тим, що
R2 - Н, (1-4С)алкіл або (1-6С)алкеніл, які заміщені, як варіант, (6-10С)арилом, який заміщено, як варіант, одним або більше галогеном та/або (1-4С)алкілом;
R3 - Н або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном;
a R4 - циклопропіл або циклопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом.
5. Сполука за п. 1, яка відрізняється тим, що
R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоциклічне кільце;
a R4 - циклопропіл або циклопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом.
6. Сполука за п. 1, яка відрізняється тим, що
R2 - Н або (1-4С)алкіл; а
R3 разом з R4 утворює 5-, 6- або 7-членне насичене або ненасичене карбоциклічне кільце.
7. Сполука за п. 2, яка відрізняється тим, що
R2 - Н, (1-4С)алкіл або (1-6С)алкеніл, які заміщені, як варіант, (6-10С)арилом, який заміщено, як варіант, одним або більше галогеном та/або (1-4С)алкілом;
R3 - Н або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном;
a R4 - циклопропіл або циклопропеніл, заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом.
8. Сполука за п. 2, яка відрізняється тим, що
R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоциклічне кільце;
a R4 - циклопропіл або циклопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом.
9. Сполука за п. 2, яка відрізняється тим, що R2 - Н або (1-4С)алкіл; а
R3 разом з R4 утворює 5-, 6- або 7-чпенне насичене або ненасичене карбоциклічне кільце.
10. Сполука за п. 3, яка відрізняється тим, що
R2 - Н, (1-4С)алкіл або (1-6С)алкеніл, які заміщені, як варіант, (6-10С)арилом, який заміщено, як варіант, одним або більше галогеном та/або (1-4С)алкілом;
R3 - Н або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном;
a R4 - циклопропіл або циклопропеніл, заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом.
11. Сполука за п. 3, яка відрізняється тим, що
R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоциклічне кільце; а
R4 - циклопропіл або циклопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом.
12. Сполука за п. 3, яка відрізняєтьсятим, що R2 - Н або (1-4С)алкіл; а
R3 разом з R4 утворює 5-, 6- або 7-членне насичене або ненасичене карбоциклічне кільце.
13. Сполука за п. 1, яка відрізняється тим, що X - О.
14. Сполука за п. 4, яка відрізняється тим, що R4 - циклопропіл.
15. Сполука за п. 5, яка відрізняється тим, що R4 - циклопропіл.
16. Сполука за п. 2, яка відрізняється тим, що А1, A3, А4 та А5 представляють С, заміщений R1, а А2 - N.
17. Сполука за п. 4, яка відрізняється тим, що
R2 - Н, (1-4С)алкіл або (1-4С)алкені.
18. Сполука за п. 13, яка відрізняється тим, що
А1, A3, А4 та А5 представляють С, заміщений R1, а А2 - N;
R2 - Н, (1-4С)алкіл або (1-4С)алкеніл; а
R3 - Н або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном; а
R4 - циклопропіл, або
R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоциклічне кільце; а
R4 - циклопропіл.
19. Сполука за п. 13, яка відрізняється тим, що
А1, A3, А4 та А5 представляють С;
A2 - N;
R1 - Н;
R2 - метил;
R3 - H;
R4 - циклопропіл;
R5 - H.
20. Сполука за п. 13, яка відрізняється тим, що А1, A3, А4 та А5 представляють С;
A2 - N;
R1 - Н;
R2 - етеніл;
R3 - Н;
R4 - циклопропіл;
R5 - H.
21. Сполука за будь-яким з пп. 1-20 для застосування у терапії.
22. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-20 та фармацевтично прийнятний носій.
23. Фармацевтична композиція за п. 22 для контрацепції.
24. Фармацевтична композиція за п. 22 для гормонозаміщувальної терапії.
25. Фармацевтична композиція за п. 22 для лікування гінекологічного розладу.
26. Застосування сполуки за будь-яким з пп. 1-20 для виробництва медикаменту.
27. Застосування сполуки за будь-яким з пп. 1-20 для виробництва контрацептива.
28. Застосування за п. 26, де медикамент призначений для гормонозаміщувальної терапії або лікування гінекологічного розладу.
29. Спосіб контрацепції, що полягає у введенні фармакологічно ефективної кількості сполуки за будь-яким з пп. 1-20 суб’єкту, який цього потребує.
30. Спосіб лікування гінекологічного розладу, що полягає у введенні фармакологічно ефективної кількості сполуки за будь-яким з пп. 1-20 суб’єкту, який цього потребує.
Текст
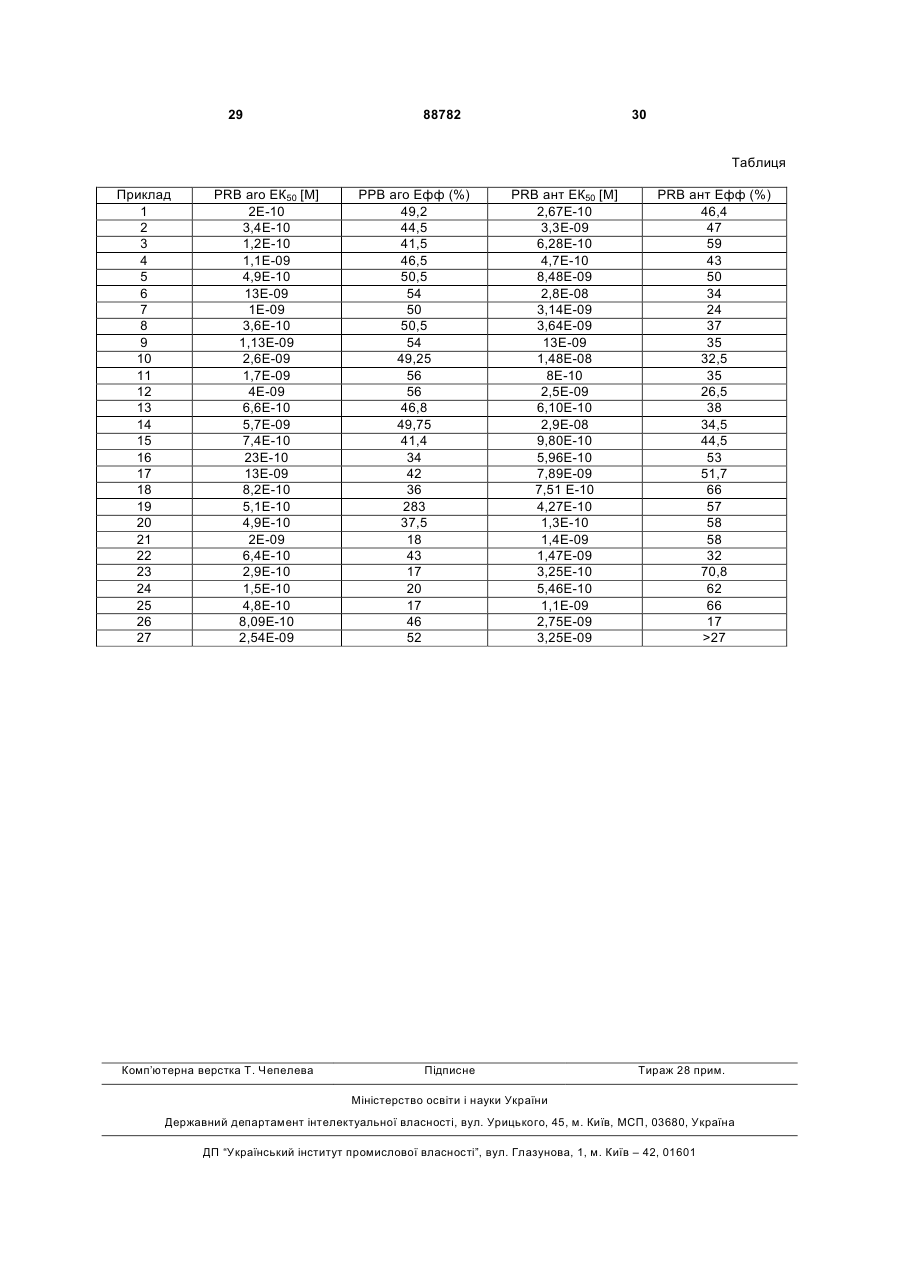
1. Сполука формули І C2 2 (19) 1 3 88782 4 R2 - Н або (1-4С)алкіл; а R3 разом з R4 утворює 5-, 6- або 7-членне насичене або ненасичене карбоциклічне кільце. 7. Сполука за п.2, яка відрізняється тим, що R2 - Н, (1-4С)алкіл або (1-6С)алкеніл, які заміщені, як варіант, (6-10С)арилом, який заміщено, як варіант, одним або більше галогеном та/або (14С)алкілом; R3 - Н або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном; a R4 - циклопропіл або циклопропеніл, заміщені, як варіант, одним або більше галогеном та/або (14С)алкілом. 8. Сполука за п.2, яка відрізняється тим, що R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоциклічне кільце; a R4 - циклопропіл або циклопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом. 9. Сполука за п.2, яка відрізняється тим, що R2 Н або (1-4С)алкіл; а R3 разом з R4 утворює 5-, 6- або 7-чпенне насичене або ненасичене карбоциклічне кільце. 10. Сполука за п.3, яка відрізняється тим, що R2 - Н, (1-4С)алкіл або (1-6С)алкеніл, які заміщені, як варіант, (6-10С)арилом, який заміщено, як варіант, одним або більше галогеном та/або (14С)алкілом; R3 - Н або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном; a R4 - циклопропіл або циклопропеніл, заміщені, як варіант, одним або більше галогеном та/або (14С)алкілом. 11. Сполука за п.3, яка відрізняється тим, що R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоциклічне кільце; а R4 - циклопропіл або циклопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (14С)алкілом. 12. Сполука за п.3, яка відрізняєтьсятим, що R2 Н або (1-4С)алкіл; а R3 разом з R4 утворює 5-, 6- або 7-членне насичене або ненасичене карбоциклічне кільце. 13. Сполука за п.1, яка відрізняється тим, що X О. 14. Сполука за п.4, яка відрізняється тим, що R4 циклопропіл. 15. Сполука за п.5, яка відрізняється тим, що R4 циклопропіл. 16. Сполука за п.2, яка відрізняється тим, що А1, A3, А4 та А5 представляють С, заміщений R1, а А2 N. 17. Сполука за п.4, яка відрізняється тим, що R2 - Н, (1-4С)алкіл або (1-4С)алкені. 18. Сполука за п.13, яка відрізняється тим, що А1, A3, А4 та А5 представляють С, заміщений R1, а А2 - N; R2 - Н, (1-4С)алкіл або (1-4С)алкеніл; а R3 - Н або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном; а R4 - циклопропіл, або R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоциклічне кільце; а R4 - циклопропіл. 19. Сполука за п.13, яка відрізняється тим, що А1, A3, А4 та А5 представляють С; A2 - N; R1 - Н; R2 - метил; R3 - H; R4 - циклопропіл; R5 - H. 20. Сполука за п.13, яка відрізняється тим, що А1, A3, А4 та А5 представляють С; A2 - N; R1 - Н; R2 - етеніл; R3 - Н; R4 - циклопропіл; R5 - H. 21. Сполука за будь-яким з пп.1-20 для застосування у терапії. 22. Фармацевтична композиція, що містить сполуку за будь-яким з пп.1-20 та фармацевтично прийнятний носій. 23. Фармацевтична композиція за п.22 для контрацепції. 24. Фармацевтична композиція за п.22 для гормонозаміщувальної терапії. 25. Фармацевтична композиція за п.22 для лікування гінекологічного розладу. 26. Застосування сполуки за будь-яким з пп.1-20 для виробництва медикаменту. 27. Застосування сполуки за будь-яким з пп.1-20 для виробництва контрацептива. 28. Застосування за п.26, де медикамент призначений для гормонозаміщувальної терапії або лікування гінекологічного розладу. 29. Спосіб контрацепції, що полягає у введенні фармакологічно ефективної кількості сполуки за будь-яким з пп.1-20 суб’єкту, який цього потребує. 30. Спосіб лікування гінекологічного розладу, що полягає у введенні фармакологічно ефективної кількості сполуки за будь-яким з пп.1-20 суб’єкту, який цього потребує. Заявлений винахід стосується галузі контрацепції, гормонозаміщувальної терапії (HRT) та терапії гінекологічних розладів, а також ад'юванттерапії раку та інших хвороб. Заявлений винахід стосується нових стероїдів, модулюючих рецептор прогестерону, які мають агоністичну та антагоністичну модулювальну активність стосовно рецептору прогестерону, способи їх отримання та їх застосування у терапії. Внутрішньоклітинні рецептори представляють клас структурно зв'язаних білків, залучених у регуляцію транскрипції гена. Стероїдні рецептори є підгрупою цих рецепторів, охоплюючи рецептор прогестерону (PR), рецептор андрогену (AR), рецептор естрогену (ER), глюкокортикоїдний рецептор (GR) та мінералокортикоїдний рецептор (MR). Регуляція гена потребує внутрішньоклітинного рецептору та відповідного ліганду, який має здат 5 ність селективно зв'язуватися з рецептором шляхом, що впливає на транскрипцію гена. Модулятори рецепторів прогестерону (прогестагени та антипрогестагени), як відомо, грають важливу роль у здоров'ї жінки. Природним лігандом для PR є стероїдний гормон прогестерон, але створені синтетичні сполуки, які також можутьбути лігандами (дивись, наприклад, Jones et al. U.S. Patent No.5,688,810). Прогестагени зараз широко застосовують для гормональної контрацепції та у HRT. Іншим важливим клінічним застосуванням прогестагенів є лікування гінекологічних розладів (наприклад, ендометріозу, дисменореї, дисфункціональної маткової кровотечі, суворого предменструального синдрому), раку молочних залоз, приливів жару та розладів настрою, та підтримки жовтого тіла при IVT. На додаток, їх застосовують у комбінації з іншими гормонами та/або іншими терапіями, охоплюючи без обмеження хемотерапевтичні агенти, як-то цитотоксичні та цитостатичні агенти, імунологічні модифікатори, як-то інтерферони та інтерлейкіни, гормони росту або інші цитокіни, гормональної терапії, хірургії та радіаційної терапії. Сучасні стероїдні прогестагени перевірені як цілком безпечні та є добре толерантними, іноді, однак, повідомлено про побічну дію (наприклад, чутливість грудних залоз, головні болі, депресія та збільшення маси), що приписують цим стероїдним прогестагенам, поодинці або у комбінації з естрогенними сполуками. На додаток, стероїдні ліганди для одного рецептору часто демонструють перехресну реактивність з іншими стероїдними рецепторами. Багато прогестагенів також зв'язуються, наприклад, з рецептором андрогену, тоді як багато антипрогестагенів мають афінність до глюкокортикоїдного рецептору. Антипрогестагени у комбінації з прогестагенами є також корисними у контрацептивних та гормонозаміщувальних режимах як описано наприклад, у WO 99/25360 та WO 97/49407. Це могло б тому бути корисним для пошуку сполук, які мають прогестагенні та антипрогестагенні властивості одної молекули. WO 99/45022 описує 20-кето-11βарилстероїди, які мають антагоністичну або агоністичну активність стосовно рецептору прогестерону. З багатьох сполук, розкритих у WO 99/45022, три або чотири сполуки мають прогестерон антагоністичну та агоністичну активність. Жодна з цих сполук не має заміснику у позиції 16; у позиції 17α вони мають ацетилоксил, ацетилоксиметил або метоксиметил. Сполуки, що описано у ЕР 349481, містять 4[(3-піридил)феніл] у позиції 11β та не мають заміснику у позиції 16; жодна з цих сполук не має цикпопропілкарбонілу або цикпопропенілкарбонілу у позиції 17, чи спіроциклоалканонового або спіроциклоалкенонового заміснику у позиції 17. Сполуки з ЕР 349481 мають тільки антипрогестагенні властивості. Заявлений винахід несподівано розкриває, що нові стероїдні сполуки з (11β)-[4-(азаарил)фенілом] у комбінації з різними замісниками у позиціях 16 та 17 демонструють змішаний про 88782 6 філь PR-агоністичної та PR-антагоністичної активності (далі позначений як змішаний Р/АР-профіль) одної сполуки. Ці сполуки є особливо корисними для контрацепції, HRT та лікування гінекологічних розладів. Cook et al. (Life Sciences 52 (1993), 155-162) описують можливість того, що стероїд, який має антипрогестагенний профіль з ацетилоксилом у позиції 17α, можна перетворити у сполуку зі змішаним профілем видаленням цього заміснику, в той час як уведення заміснику у позиції 16α перетворює сполуку у повний агоніст. Несподівано, цього нема у випадку нових сполук, розкритих у заявленому винаході, які постійно мають змішані профілі з різними комбінаціями (охоплюючи гідроген) 16α-та 17α-замісників. Заявлений винахід стосується сполуки структурної формули І де Х - О, NOH, І\Ю(1-4Салкіл, І\Ю(1-4С)ацил; А1-А5 - С, заміщений R1, або N, за умови, що принаймні один та не більше трьох з А1-А5 представляють N; або один або два з А1, А2 та А5 представляють N, а інші представляють С, заміщений R1, а A3 та А4 разом - конденсоване бензокільце або конденсоване 5- або 6-членне нітрогеновмісне ароматичне кільце, які заміщені, як варіант, одним або більше галогеном та/або (14С)алкілом; кожний R1 незалежно вибрано з групи: Н, галоген, (1-4С)алкіл та (1-4С)алкоксил; R2-Н, (1-4С) алкіл або (1-6С) алкеніл, які заміщені, як варіант, (6-10С)арилом, який заміщено, як варіант, одним або більше галогеном та/або (1-4C)алкілом; а R3 - Η або (1-4С)алкіл, заміщений, як варіант, одним або більше атомами галогену; а R4 - циклопропіл або цикпопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом та/або (1-4С)алкіл; або R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоцикпічне кільце; а R4 - циклопропіл або цикпопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом та/або (1-4С)алкіл; або R2 - Η або (1-4С)алкіл; а R3 разом з R4 утворює 5-, 6- або 7-членне насичене або ненасичене карбоциклічне кільце, R5 - Η або (1-4С)алкіл; або її фармацевтично прийнятна сіль, та/або гідрат, та/або проліки. Згідно з одним втіленням, А1-А5 представляють С, заміщений R1 або Ν, за умови, що принай 7 мні один та не більше трьох з А1-А5 представляють N. Згідно з ще одним втіленням, один або два з А1, А2 та А5 представляють Ν, а інші представляють С, заміщений R1, а A3 та А4 разом - конденсоване бензокільце або конденсоване нітрогеновмісне кільце, які заміщені, як варіант, галогеном та/або (1-4С)апкілом. Згідно з одним втіленням, R2 - Н, (1-4С)алкіл або (1-6С)алкеніл, які заміщені, як варіант, (610С)арилом, який заміщено, як варіант, одним або більше галогеном та/або (1-4С)алкілом; R3 - Η або (1-4С)алкіл, заміщений, як варіант, одним або більше галогеном; а R4 - циклопропіл або цикпопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом. Згідно з ще одним втіленням, R2 разом з R3 утворює 3-, 4-, 5- або 6-членне карбоцикпічне кільце; a R4 - циклопропіл або циклопропеніл, які заміщені, як варіант, одним або більше галогеном та/або (1-4С)алкілом. Згідно з ще одним втіленням, R2 - Η або (14С)алкіл; a R3 разом з R4 утворює 5-, 6-або 7членне насичене або ненасичене карбоциклічне кільце. Згідно з особливим втіленням X - О. Згідно з ще одним особливим втіленням R4 циклопропіл. Згідно з ще одним особливим втіленням А1, A3, А4 та А5 представляють С, заміщений R1, тa A2 Згідно з одним втіленням R2 - Н, (1-4С)алкіл або (1-4С)алкеніл. Згідно з особливим втіленням X - О, А1, A3, А4 та А5 представляють С, заміщений R1, А2 - N; R2 Н, (1-4С)алкіл або (1-4С)алкеніл; R3 - Η або (14С)алкіл, заміщений, як варіант, одним або більше галогеном; R4 - циклопропіл; або R2 разом з R3 утворює 3-, 4-, 5-або 6-членне карбоцикпічне кільце; a R4 - циклопропіл. Згідно з особливим втіленням X - О, А1, A3, А4 та А5 представляють С; А2 - N; R1 - Н; R2 - метил; R3 - Н; R4 - циклопропіл; a R5 - Н. Згідно з ще одним особливим втіленням X - О, А1, A3, А4 та А5 представляють С; А2 - N; R1 - Н; R2 - етеніл; R3 - Н; R4 - циклопропіл; a R5 - Н. Сполуки заявленого винаходу запропоновані для застосування у терапії. Заявлений винахід стосується фармацевтичної композиції, що містить сполуку · заявленого винаходу та фармацевтично прийнятний носій. Згідно з одним втіленням фармацевтичну композицію запропоновано для контрацепції. Згідно з ще одним втіленням фармацевтичну композицію запропоновано для гормонозаміщувальної терапії. Згідно з ще одним втіленням фармацевтичну композицію запропоновано для лікування гінекологічного розладу. Заявлений винахід крім того стосується застосування сполуки заявленого винаходу для виробництва медикаменту Згідно з одним втіленням застосування сполуки заявленого винаходу стосується виробництва контрацептиву. Згідно з ще одним втіленням застосування сполуки заявленого винаходу стосується виробництва медикаменту 88782 8 для гормонозаміщувальної терапії або для лікування гінекологічного розладу. Заявлений винахід крім того стосується способу контрацепції, що полягає у застосуванні фармакологічно ефективної кількості сполуки заявленого винаходу до суб'єкта, який цього потребує. Заявлений винахід крім того стосується способу лікування гінекологічного розладу, що полягає у застосуванні фармакологічно ефективної кількості сполуки заявленого винаходу до суб'єкта, який цього потребує. Сполуки формули І, де X - NOH, NО(алкіл) або NО(ацил) були отримані зі сполук формули І де X О, обробкою H2NOH, Н2NО(алкілом) або Н2NO(ацилом)або солями цих амінів. Як показано у схемі 1, сполуки формули І, де X - О (Формула І у схемі 1) були отримані зі сполук формули II. У цій схемі Рg - придатна захисна група карбонілу у позиції 3 стероїдів. Кілька захисних груп, відомих у рівні техніки, описані у "Protective Groups In Organic Synthesis" Greene T.W. та Wuts P.G.M. (John Wiley & Sons, New York). Придатними типами захисних груп є кеталі; зокрема, циклічні кеталі, як-то 1,3-діоксолани. Карбоніл у позиції 17 стероїду застосовували як такий у цій послідовності реакцій, або він був замаскованим у формі синтетичного еквіваленту, як-то гідроксиметил (який в останній момент у синтезі окиснювали назад до карбонілу). Ще одним варіантом є захист карбонілу захисною групою, як-то кеталь. Сполуки формули II окиснювали до епоксиду формули III застосуванням різних способів, відомих у рівні техніки, як-то обробка гідроген пероксидом у присутності трифлуорацетофенону. Обробка такого епоксиду (4-бромфеніл)магній бромідом у присутності придатної солі Cu(l), як-то купрум(І) хлорид, дає сполуки формули IV. Сполуки формули IV перетворювали у сполуки формули V застосуванням опосередкованих паладієм реакцій перехресного сполучення, як-то реакцій Сузукі, Стилла або Негіші. Видалення захисної групи зі сполуки формули V застосуванням способів, відомих у рівні техніки, як-то у випадку кеталів, водною кислотою давало сполуки формули І. Такі способи зняття захисту можна застосовувати до сполук формули IV для отримання сполук формули VI. Останні сполуки можна перетворювати у сполуки формули І застосуванням опосередкованих паладієм реакцій перехресного сполучення. Сполуки формули II, де R4 - циклопропіл або цикпопропеніл, були отримані зі сполук формули VII як показано у схемі 2. Сполуки формули VII описані у літературі (наприклад, van den Heuvel, MJ. та Groen, M.B. Rec. Trav. Chim. Pays-Bas, 112, 107 (1993), EP 289073, EP 277676, DE 3617883, EP 549041, EP 582338). Сполуки формули VII перетворювали у енольні трифлати застосуванням основи та трифлатного реагенту. Прикладом придатної комбінації реагентів є літій гексаметилдисилазан як основа та N-фенілбіс(трифлуорметансульфонімід) як трифлатний агент Утворені енольні три флати перетворювали у сполуки формули VTII застосуванням опосередкованого паладієм карбонілування у присутності Ν,Ο-диметилгідроксиламін. Обробка сполук фор 9 мули VIII циклопропільним реактивом Гріньяра, циклопропіллітієм, циклопропенільним реактивом Гріньяра, або циклопропеніллітієм дає сполуки формули IX. Обробка останніх сполук R2-літієм або R2-сполукою Гриньяра у присутності придатної солі Cu(l), а потім гасіння водою дає сполуки формули II, де R3 - Н; альтернативно, гасіння алкілувальним реагентом, як-то метилйодид або подібне дає сполуки формули II, де R3 - алкіл. Сполуки формули II де R3 разом з R4 утворює 5-членне карбоциклічне кільце, можна отримувати способом, описаним у патенті США №5,084,450. Загалом, сполуки формули II де R3 разом з R4 утворює 5-, 6-або 7-членне карбоциклічне кільце, можна отримувати від сполуки формули VII способом, описаним Mash, E.A. et al. у J. Org. Chem. 55,2045 (1990). У цій публікації спосіб застосовували для перетворення кетону у 6-членну спіросполуку. Цей спосіб можна поширювати на 5- або 7членні спіросполуки застосуванням 4-йодбутил трет-бутилдиметилсилілового етеру або 6йодгексил третбутилдиметилсилілового етеру замість 5-йодпентил трет-бутилдиметилсилілового етеру, застосованого у публікації, для отримання 6-членної спіросполуки. 88782 10 Сполукою згідно з винаходом є сполука, яку визначено вище у формулі І, її сіль, гідрат та/або проліки. У випадках, коли сполука винаходу містить атом нітрогену придатної основності, сполуку можна застосовувати як вільну основу або як фармацевтично прийнятну сіль. Термін фармацевтично прийнятна сіль-сіль, яка у рамках медичних норм придатна для застосування у контакті з тканинами людей та/або тварин без надмірної токсичності, подразнення, алергічної реакції тощо, та відповідає прийнятному співвідношенню корисність/ризик. Фармацевтично прийнятні солі добре відомі у рівні техніки їх можна отримувати при кінцевому виділенні та очистці сполук винаходу, або окремо реакцією вільної основи з придатною мінеральною кислотою, як-то хлоридна кислота, фосфатна кислота, або сульфатна кислота, або з органічною кислотою як-то, наприклад, аскорбінова кислота, лимонна кислота, винна кислота, молочна кислот, малеїнова кислота, малонова кислота, фумарова кислота, гліколева кислота, бурштинова кислота, пропіонова кислота, оцтова кислота, метансульфонова кислота, тощо. Проліки - сполуки, які швидко перетворюються in vivo у вихідну сполуку вищенаведеної формули, наприклад, гідролізом у шлунку та/або у крові, метаболізм у печінці або іншими способами, відомими фахівцям. Наприклад, фахівцям ясно, що сполуки формули І де X - Н2, як можна очікувати, метаболізуватимуться до аналогічних сполук де X - О, які демонструють · активність in vitro, навіть якщо проліки, де X - Н2, - ні. Терміни застосовані у визначенні сполук винаходу формули І мають такі значення: - (1-4С)алкіл - розгалужений чи нерозгалужений алкіл, що має 1-4 атоми карбону, наприклад, метил, етил, пропіл, ізопропіл, бутил, втор-бутил або трет-бутил; - (1-4С)алкоксил - (1-4С)алкілоксил, де (14С)алкіл має значення, яке визначено вище; - (1-6С)алкені - розгалужений чи нерозгалужений алкеніл, що має 1-6 атоми карбону, як-то етеніл, 1-метил-етеніл, 2-пропеніл, 2-бутеніл тощо; - (6-10)арил - карбоциклічна ароматична група, що має 6-10 атомів карбону, як-то феніл, 1- нафтил або 2-нафтил; - (1-4С)ацил - алкілкарбоніл, що має 1-4 атоми карбону, як-то форміл, ацетил або пропіоніл; - аза-арил - моноциклічна або дициклічна ароматична кільцева система, де принаймні одне з кілець містить принаймні один кільцевий атом нітрогену. Приклади охоплюють, але без обмеження, піридил, піримідиніл, хінолініл, нафтиридил тощо; - карбоцикл, коли його згадано у контексті кільця, означає, що усі атоми у кільці - атоми карбону; - спіроцикпоалкан - замісник, що складається з алкандіілу, у якому два кінцеві атоми приєднані до того ж атому (карбону), таким чином утворюючи спірокільцеву систему; - спіроциклоалкен - замісник, що складається з алкендііл, у якому два кінцеві атоми приєднані до 11 того ж атому (карбону), таким чином утворюючи спірокільцеву систему; - префікси (1-4С), (2-4С) мають звичайне значення, вказуючи на число атомів карбону 1-4, 2-4; - галоген означає флуор, хлор, бром та йод; - спіроциклоалканон - спіроциклоалканове кільце, де один з атомів карбону утворює карбоніл; - спіроцикпоалкенон є спіроциклоалкенове кільце, де один з атомів карбону утворює карбоніл. Афінність до рецептору прогестагену та ефективність сполук згідно з винаходом робить їх придатними для застосування у контролі фертильності та репродуктивності, наприклад, у контрацепції жінок, та крім того для HRT жінок, лікування гінекологічних розладів, як компонентів контрацепції чоловіків, та у діагностиці, що базується на кількості та/або локалізації рецепторів прогестерону у різних тканинах. Для останньої мети може бути переважним виробляти мічені ізотопами варіанти сполук згідно з винаходом. Сполуки винаходу можуть крім того бути корисними для лікування ендометріозу, менорагії, менометрорагії, дисменореї, вугрів, фіброїдів, остеопорозу, а також інших кісткових розладів, поновлення кісткових фракцій, саркопенії, крихкості, старіння шкіри, сексуальної дисфункції жінок, симптомів після менопаузи, атеросклерозу, апластичної анемії, ліподистрофії, побічної дії хемотерапії, пухлин (локалізованих, наприклад, у грудних залозах, яєчнику або матці) та інших. Сполуки винаходу можна застосовувати разом з естрогенами, андрогенами, прогестагенами, антипрогестагенами, та іншими придатними сполуками, як-то фолієва кислота, вітаміни, мінерали тощо. Способи визначення зв'язування рецептору, а також дослідження in vitro та in vivo для визначення біологічної активності сполук добре відомі. Загалом, експресований рецептор (або його функціональну частину) обробляють сполукою винаходу та вимірюють зв'язування, стимулювання або інгібування функціональної реакції. Для виміру функціональної реакції, виділену ДНК, що кодує ген рецептору прогестерону, переважно рецептору людини, експресують у придатних клітинах-хазяях. Такими клітинами можуть бути клітини яєчнику китайського хом'яка (СНО), але інші клітини є також придатними. Переважно клітини мають походження від ссавців. Способи створення лінії клітин, експресуючої рекомбінантний рецептор прогестерону, добре відомі у рівні техніки (Sambrook et al., Molecular Cloning: Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor). Експресії рецептору досягають експресією ДНК, що кодує потрібний білок. Способи сайт-спрямованого мутагенезу, лігування додаткових послідовностей, PCR, та створення придатних експресійних систем добре відомі у рівні техніки. Частини або усю ДНК, що кодує потрібний білок, можна створити синтетично застосуванням стандартних твердофазних способів, переважно для уведення рестрикційних сайтів для полегшення лігування. Придатні контрольні елементи для транскрипції та трансляції охоплених 88782 12 кодувальних послідовностей можна забезпечувати кодувальними ДНК-послідовностями. Як добре відомо, зараз доступні експресійні системи, які сумісні з дуже різними з хазяїв, охоплюючи прокаріоти, як-то бактерії та евкаріоти, як-то дріжджі, клітини рослин, комах, ссавців, птиць, тощо. Клітини, які експресують рецептор, тоді уводять у контакт зі сполукою винаходу для спостереження зв'язування, або стимулювання або інгібування функціональної реакції. Альтернативно, виділений цитозоль з вмістом експресованого рецептору можна застосовувати для виміру зв'язування сполуки винаходу. Для виміру зв'язування можна застосовувати радіоактивно або флуоресцентно мічені сполуки. Як контрольну сполуку можна застосовувати природний гормон, або інші сполуки, що зв'язують рецептор. Як альтернативне, можна також проводити дослідження конкурентного зв'язування. Ще одне дослідження стосується скринування сполук винаходу як змішаного агоністу/антагоністу рецептору прогестерону визначенням регуляції мРНК опосередкованого рецептором природного цільового гена, тобто генів, регульованих рецептором через зв'язування рецептору у промотерному регіоні гена. Рівні мРНК цільового гена будуть зменшеними або збільшеними залежно від інгібіторної або стимулювальної дії сполуки винаходу при зв'язуванні з рецептором. На додаток до безпосереднього виміру рівнів мРНК у клітинах, можна застосовувати клітини, які на додаток до трансфекції рецептором, що кодує ДНК, також трансфектовані другою ДНК, що кодує репортерний ген, експресія якого відповідає за зв'язування рецептору у напрямі чутливих елементів у промотері конкретного репортерного гена. Такі чутливі елементи могли б бути класичними гормон-чутливими елементами, добре відомими у рівні техніки та описаними наприклад, Beato, Μ, Cbalepakis, G, Schauer, Μ, Slater, ЕР J. Стероїд Biochem. 5 (1989)737-47, або їх можна створити таким шляхом, щоб їх було приєднано до нових чутливих елементів. Загалом, експресія репортерного гена могла б бути контрольованою будь-яким чутливим елементом, реагуючим на зв'язування рецептору прогестерону. Придатними репортерними генами є наприклад, LacZ, лужна фосфатаза, люцифераза світляка та білок зеленої флуоресценції. Для вибору сполуки заявленого винаходу зі змішаною модулюючою дією на рецептор прогестерону тестування в агоністичному режимі повинне призводити до притаманної активності між приблизно 15% та приблизно 85% максимальної активності, коли застосовують як контроль (16α)16-етил-21-гідрокси-19-норпрегн-4-ен-3,20-діон. Більш того, ця максимальна агоністична активність повинна бути при концентрації 10-6 або менше, а переважно при концентрації 10-8 або менше. В антагоністичному режимі тестування повинне призводити до притаманної активності між приблизно 85% та приблизно 15% максимальної активності, коли застосовують як контроль (6β,11β,17β)-11-[4-(диметиламіно)феніл]-4'-5' 13 дигідро-6-метилспіро[естра-4,9-дієн-17,2'(3'Н)фуран]-3-он. Додатковим критерієм є величина ІК50, яка повинна бути менше 10-6М, переважно менше 10-8М. Фахівцям ясно, що для заявленого винаходу сполуки зі змішаним профілем Р/АР повинні мати профіль у межах від комбінації мінімальної притаманної агоністичної активності приблизно 15% та максимальної притаманної антагоністичної активності приблизно 85% до комбінації максимальної притаманної агоністичної активності приблизно 85% та мінімальної притаманної антагоністичної активності приблизно 15%. Фахівцям також ясно, що, внаслідок біологічної варіації у дослідженні не завжди обов'язково, щоб притаманна агоністична активність та притаманна антагоністична активність разом були точно 100%. Фахівцям також ясно, що бажані величини ІК50 та EК50 залежні від сполук винаходу, які є тестованими. Наприклад, сполука з ЕК50, яка менше 10-6Μ є, загалом, кандидатом для вибору ліків. Переважно ця величина нижче 10-8М. Однак, сполука, яка має вищі EК50 та/або ІК50, але має придатну селективність (або комбінацію агоністичної та антагоністичної селективності) для конкретного рецептору, може ще бути кандидатом для вибору ліків. По суті будь-як трансактиваційне дослідження на клітинах ссавців (лінії клітин або первинній культурі), що може давати інформацію про можливу активацію рецептору, можна застосовувати для вибору потужних та придатних лігандів. Додаткове значення систем клітин, які походять з відмінних органів, буде в тому, що отримують інформацію про потенційну тканинну специфічність лігандів. Без обмеження, прикладами клітин, часто застосованих для цього, крім клітин СНО, є, наприклад, клітини T47D, клітини MCF7, клітини ЕСС-1, клітини HeLa, первинні культури внутрішньоматочних клітин, та клітини слизової. Придатними шляхами застосування сполук заявленого винаходу (активний інгредієнт) є пероральний, ректальний, назальний, місцевий (охоплюючи трансдермальний, букальний та сублінгвальний), вагінальний або парентеральний (охоплюючи підшкірний, внутрішньом'язовий, внутрішньовенний та інтрадермальний) або застосування як імплантату. Згідно з особливим втіленням сполуки можна застосовувати перорально. Точна доза та режим застосування активного інгредієнту, або його фармацевтичної композиції, залежатиме від потрібної терапевтичної дії (наприклад, контрацепції, HRT, ендометріозу) та може варіювати залежно від конкретної сполуки, шляху застосування, віку та стану індивідуального суб'єкта, до якого застосовують медикамент. Загалом, парентеральне застосування потребує нижчої дози, ніж інші способи застосування, які більш залежні від поглинання. Однак, доза для людей можливо містить 0,0001-25мг на кг маси тіла Потрібна доза може бути одною дозою або кількома поділеними дозами, застосовуваними з прийнятними інтервалами протягом доби, або, у випадку реципієнтів-жінок, дози застосовують з прийнятними інтервалами (добовими) протягом менструального циклу. 88782 14 Заявлений винахід також стосується фармацевтичної композиції, що містить сполуку формули І у суміші з фармацевтично прийнятними допоміжними добавками, та, як варіант, інші терапевтичні агенти. Допоміжні добавки повинні бути "прийнятними" у сенсі сумісності з іншими інгредієнтами композиції та нешкідливими для їх реципієнтів. Фармацевтичні композиції охоплюють придатні для перорального, ректального, назального, місцевого (охоплюючи трансдермальне, букальне та сублінгвальне), вагінального або парентерального (охоплюючи підшкірне, внутрішньом'язове, внутрішньовенне та інтрадермальне) застосування або застосування імплантатом. Композиції можна отримувати способами, відомими у рівні техніки фармацевтики, наприклад, застосуванням способів, як-то описаних Gennaro et al., Remington's Pharmaceutical Sciences (18th ed, Mack Publishing company, 1990, дивись особливо Part 8: Pharmaceutical Preparations and Their Manufacture). Такі способи мають етап асоціації активного інгредієнту з будь-якою допоміжною добавкою. Допоміжні добавки, також названі допоміжними інгредієнтами), охоплюють звичайні у рівні техніки (Gennaro, вище), як-то носії, наповнювачі, зв'язуючі, розріджувачі, дезінтегратори, лубриканти, барвники, ароматизатори, анти-оксиданти, та змочувальні агенти. Фармацевтичні композиції, придатні для перорального застосування можуть бути дискретними дозованими одиницями, як-то пілюлі, таблетки, драже або капсули, як порошок або гранули, або як розчин або суспензія. Активний інгредієнт може також бути у болюсі або пасті. Композиції можна крім того перетворювати у супозиторій або клізму для ректального застосування. Винахід крім того охоплює фармацевтичну композицію, яку описано вище, у комбінації з пакувальним матеріалом та інструкціями для застосування композиції як описано вище. Для парентерального застосування, придатні композиції охоплюють водні та неводні стерильні ін'єкції. Композиції можуть бути в одиничнодозових або багатодозових контейнерах, наприклад, герметизованих колбах та ампулах, та можуть зберігатися у висушеному сублімацією (ліофілізованому) стані, що потребує тільки додавання стерильного рідкого носія, наприклад, води, до застосування. Композиції, придатні для застосування назальною інгаляцією, охоплюють дрібний пил чи туман, які можна створювати за допомогою герметизованих аерозолів з виміряною дозою, розпилювачів або вдувачів. Сполуки винаходу можна також застосувати у формі пристроїв, що складаються з серцевини з активного матеріалу в оболонці з регулюючої швидкість вивільнення мембрани. Такі імплантати призначені для застосування підшкірно або локально та для вивільнення активного інгредієнту з приблизно сталою швидкістю протягом великих періодів часу, наприклад, від тижнів до років. Способи отримання фармацевтичних імплантатів відомі у рівні техніки, наприклад, як описано у ЕР 303,306. 15 Сполуки винаходу можна також застосувати у формі вагінального кільця, як описано, наприклад, у ЕР 876815. Сполуки винаходу можна продукувати різними способами, загалом відомими у рівні техніки органічної хімії. Більш конкретні шляхи синтезу ілюстровано у попередніх та наступних схемах та прикладах можна застосовувати. У схемах та прикладах застосовують наступні скорочення: ТГФ: тетрагідрофуран ДМФ: Ν,Ν-диметилформамід NaHCO3: натрій гідрокарбонат NH4CI: амоній хлорид Na2S2О3: натрій тіосульфат SiO2: силіцій діоксид (силікагель) Na2SO4: натрій сульфат MgSO4: магній сульфат РХ/МС: рідинна хроматографія/мас спектрометрія ВЕРХ: високоефективна рідинна хроматографія ЯМР: ядерний магнітний резонанс Заявлений винахід є далі описано наступними прикладами, які не обмежують рамок заявленого винаходу. Приклади Приклад 1 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(3-піридиніл)феніл]естра-4,9-дієн-3-ону а. 17-[[(Трифлуорметил)сульфоніл]окси]естра5(10),9(11),16-триєн-3-он циклічний 1,2етандіілацеталь Літій гексаметилдисилазан (1М у ТГФ, 478мл, 478ммоль) додавали до ТГФ (1л) та охолоджували до -40°С в атмосфері азоту. Розчин естра5(10),9(11)-дієн-3,17-діон циклічного 3-(1,2етандіілацеталю) (50г, 159ммоль) у сухому ТГФ (500мл) додавали краплями в той час, як температура реакції повільно зростала до -15°С. Після перемішування 30 хвилин при -15°С, N-фенілбіс(трифлуорметансульфонімід) (62,5г, 175ммоль) додавали порціями та реакційну суміш перемішували протягом 3 годин при 0°С. Насичений водний розчин натрій гідрокарбонату додавали краплями (екзотерм), а потім воду. Органічний шар відокремлювали та водний шар екстрагували тричі етилацетатом. Поєднані органічні шари промивали розсолом, сушили (Na2SO4) та випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (SiO2, гептан/етилацетат, 4/1) для отримання 17[[(трифлуорметил)сульфоніл]окси]естра5(10),9(11),16-триєн-3-он циклічного 1,2етандіілацеталю (90,1г, 159ммоль, 100% вихід, з деяким вмістом розчиннику). 1Н ЯМР (400МГц, CDCI3): δ 0,91 (s, 3Н), 1,20-2,55 (m, 16Н), 3,98 (s, 4H), 5,52 (m, 1H), 5,59 (m, 1H). b. N-метокси-N-метил-3,3-[1,2етандіілбіс(оксил)]оксо-естра-5(10),9(11), 16-триєн17-карбоксамід Триетиламін (221мл, 1,59моль), трифенілфосфін (6,67г, 25ммоль) та N,Oдиметилгідроксиламін.НСІ (82,2г, 843ммоль) додавали до розчину 17 88782 16 [[(трифлуорметил)сульфоніл]окси]естра5(10),9(11),16-триєн-3-он циклічного 1,2етандіілацеталю (70,9г, 159ммоль) у ДМФ (1,5л). Карбон моноксид пропускали через розчин протягом 10 хвилин, тоді додавали паладій(ІІ)ацетат (2,86г, 12,7ммоль) та реакційну суміш перемішували протягом ночі при 60°С в атмосфері CO. Реакційну суміш виливали у насичений водний розчин амоній хлориду та екстрагували тричі етилацетатом. Поєднані органічні шари промивали розсолом, сушили (Na2SO4) та випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (SiO2, гептан/етилацетат, 2/1) для отримання N-метокси-N-метил-3,3-[1,2етандіілбіс(оксил)]естра-5(10),9(11), 16-триєн-17карбоксаміду (59,7г, 139ммоль, 87% виходу, з деяким вмістом розчиннику). 1 Н ЯМР (400МГц, CDCI3): δ 0,97 (s, 3Н), 1,252,58 (m, 16Н), 3,25 (s, 3Н), 3,62 (s, 3Н), 3,99 (s, 4H), 5,58 (m, 1H), 6,41 (m, 1H). с. 17-(Циклопропілкарбоніл)естра5(10),9(11),16-триєн-3-он циклічний 1,2етандіілацеталь Розчин циклопропілброміду (22,3мл, 278ммоль) у діетиловому етері (20мл) повільно додавали до охолодженої суспензії (0°С) подрібненого літію (5,8г, 834ммоль) в етері (380мл) (екзотерм) в атмосфері азоту. Реакційну суміш перемішували протягом 90 хвилин в той час, як температура зростала до кімнатної температури. Розчин цієї сполуки літію повільно додавали до охолодженого розчину (0°С) N-метокси-N-метил3,3-[1,2-етандіілбіс(окси)]естра-5(10),9(11),16триєн-17-карбоксаміду (59,7г, 139ммоль) у ТГФ (260мл). Після перемішування цієї суміші протягом 2 годин при 0°С додавали краплями насичений водний розчин амоній хлориду (екзотерм), а потім воду. Органічний шар відокремлювали та водний шар екстрагували тричі етилацетатом. Поєднані органічні шари промивали розсолом, сушили (Na2SO4) та випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (SiO2, гептан/етилацетат, 4/1) для отримання 17(циклопропілкарбоніл)естра-5(10),9(11),16-триєн-3он циклічного 1,2-етандіілацеталю (33,9г, 93ммоль, 67% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,82-2,67 (m, 24Н), 3,99 (s, 4H), 5,59 (m, 1H), 6,88 (m, 1H). d. (16α,17β)-17-(Циклопропілкарбоніл)-16метилестрa-5(10),9(11)-дiєн-3-он циклічний 1,2етандіілацеталь Метилмагній хлорид (3М у ТГФ, 92,6мл, 278ммоль) додавали до перемішуваного та охолодженого розчину (0°С) купрум(ІІ)ацетату (1,7г, 9,3ммоль) у ТГФ (1л) в атмосфері азоту. Розчин 17-(циклопропілкарбоніл)естра-5(10),9(11),16триєн-3-он циклічного 1,2-етандіілацеталю (33,9г, 93ммоль) та триметилсилілхлориду (58,5мл, 463ммоль) у ТГФ (500мл) додавали краплями в той час, як температуру тримали при 0°С. Після 1 години ще один еквівалент метилмагній хлориду додавали краплями та перемішування продовжували протягом 30 хвилин при 0°С. Додавали насичений водний розчин амоній хлориду краплями, а потім воду. Органічний шар відокремлювали та 17 водний шар екстрагували тричі етилацетатом. Поєднані органічні шари промивали розсолом, сушили (Na2SO4) та випарювали до сухого стану для отримання (16α,17β)-17(циклопропілкарбоніл)-16-метилестра-5(10),9(11)дієн-3-он циклічного 1,2-етандіілацеталю (32,9г, 86ммоль, 93% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,61 (s, 3Н), 0,80-2,79 (m, 26Н), 3,99 (s, 4H), 5,55. e. (5α,10α,16α,17β)-17-(Циклопропілкарбоніл)5,10-епокси-16-метилестр-9(11)-ен-3-он циклічний 1,2-етандіілацеталь При перемішуванні до розчину (16α,17β)-17(циклопропілкарбоніл)-16-метилестра-5(10),9(11)дієн-3-он циклічного 1,2-етандіілацеталю (32,9г, 86ммоль) у дихлорметані (500мл), додавали піридин (2,1мл, 26,7ммоль), трифлуорацетофенон (12,1мл, 86,1ммоль) та гідроген пероксид (30% у воді, 96,1мл). Утворену двофазну систему інтенсивно перемішували при кімнатній температурі протягом 2 діб. Органічний шар відокремлювали та водний шар екстрагували двічі дихлорметаном. Поєднані органічні шари промивали двічі насиченим водним розчином натрій тіосульфату, промивали розсолом, сушили (Na2SO4) та випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (SiO2, гептан/етилацетат, 5/1) для отримання (5α,10α,16α,17β)-17(циклопропілкарбоніл)-5,10-епокси-16-метилестр9(11)-ен-3-он циклічного 1,2-етандіілацеталю (27,9г, 70,1ммоль, 81% виходу, присутні 16% пепоксиду). 1Н ЯМР (400МГц, CDCI3): δ 30 0,61 (s, 3Н), 0,81-2,78 (m, 26Н), 3,87-3,96 (m, 4H), 6,02 (m, 1H). f. (5α,11β,16α,17β)-11-(4-Бромфеніл)-17(циклопропілкарбоніл)-5-гідрокси-16-метилестр-9ен-3-он циклічний 1,2-етандіілацеталь Зернятко йоду додавали до магнію (8,4г, 350ммоль) та гріли протягом 1 хвилини. Розчин 1,4-дибромбензолу (85,1г, 350ммоль) та кілька крапель 1,2-диброметану у ТГФ (400мл) додавали краплями в атмосфері азоту в той час, як температуру тримали при 45°С. Після 1 години перемішування при 45°С цю суспензію сполуки Гриньяра додавали до охолодженого (-40°С) розчину (5α,10α,16α,17β)-17-(циклопропілкарбоніл)-5,10епокси-16-метилестр-9(11)-ен-3-он циклічного 1,2етандіілацеталю (27,9г, 70,1ммоль) та купрум(І) хлориду (3,4г, 35,1ммоль) у ТГФ (550мл) в атмосфері азоту в той час, як температуру тримали при -40°С. Реакційну суміш перемішували протягом 2 годин в той час, як температура зростала до кімнатної температури. Додавали насичений водний розчин амоній хлориду краплями (екзотерм), а потім воду. Органічний шар відокремлювали та водний шар екстрагували тричі етилацетатом. Поєднані органічні шари промивали насиченим водним розчином натрій гідрокарбонату та розсолом, сушили (Na2SO4) та випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (SiO2, гептан/етилацетат, 2/1) для отримання (5α,11β,16а,17β)-11-(4-бромфеніл)-17(циклопропілкарбоніл)-5-гідрокси-16-метилестр-9ен-3-он циклічного 1,2-етандіілацеталю (30,0г, 54,1ммоль, 77% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,24 (s, 3Н), 0,80-2,71 (m, 26Н), 3,89-4,05 (m, 4H), 88782 18 4,23 (d, J=6Гц, 1H), 4,37 (d, J=1Гц, 1H), 7,05-7,09, (m, 2H), 7,35-7,38 (m, 2H). g. (11β,16α,17β)-11-(4-бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-он 2Η Хпоридну кислоту (81,1мл, 162ммоль) додавали до розчину (5α,11β,16α,17β)-11-(4бромфеніл)-17-(циклопропілкарбоніл)-5-гідрокси16-метилестр-9-ен-3-он циклічного 1,2етандіілацеталю (30,0г, 54,1ммоль) в ацетоні (600мл). Після перемішування протягом 10 хвилин кімнатній температурі у цей розчин при додавали насичений водний розчин натрій гідрокарбонату. Реакційну суміш екстрагували тричі етилацетатом. Поєднані органічні шари промивали розсолом, сушили (Na2SO4) та випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (SiO2, гептан/етилацетат, 2/1) для отримання (11β,16α,17β)-11-(4-бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-ону (17,6г, 35,7ммоль, 66% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,30 (s, 3Н), 0,84-2,76 (m, 24Н), 4,34 (d, J=8Гц, 1H), 5,79 (s, 1H), 7,02-7,05 (m, 2H), 7,37-7,41 (m, 2H). h. (11β,16α,17β)-17-циклопропілкарбоніл-16метил-11-[4-(3-піридиніл)-феніл]естра-4,9-дієн-3он (11β,16α,17β)-11-(4-Бромфеніл)-17цикпопропілкарбоніл-16-метилестра-4,9-дієн-3-он (10г, 20,3ммоль), 3-піридинілборонову кислоту (3,7г, 30,4ммоль), калій фосфат (5,2г, 24,3ммоль), біс(трифенілфосфін)паладій(ІІ) хлорид (442мг, 0,61ммоль) та трифеніларсин (426мг, 1,4ммоль) розчиняли у суміші діоксану (240мл) та води (30мл) в атмосфері азоту. Реакційну суміш перемішували протягом 2 годин при 100°С та тоді охолоджували до кімнатної температури. Додавали воду та суміш екстрагували тричі етилацетатом. Поєднані органічні шари промивали розсолом, сушили (MgSO4) та випарювали до сухого стану. Очистка колонковою хроматографією (SiO2, гептан/етилацетат, градієнт 2/1-1/2) дала сирий продукт (8,3г, 16,9ммоль), який кристалізували з суміші ацетонітрил/вода для отримання (11β,16α,17β)17-циклопропілкарбон-іл-16-метил-11-[4-(3піридиніл)феніл]естра-4,9-дієн-3-ону (5,5г, 11,2ммоль, 55% виходу), т.пл. 206°С. 1Н ЯМР (400МГц, CDCI3): δ 0,35 (s, 3Н), 0,86-2,86 (m, 24Н), 4,46 (d, J=8Гц, 1H), 5,80 (s, 1H), 7,26-7,29 (m, 2H), 7,35 (dd, J=10 та 6Гц, 1Η), 7,49-7,53 (m, 2Η), 7,86 (dt, J=10 та 4Гц, 1Η), 8,57 (dd, J=6 та 4Гц, 1Η), 8,84 (d, J=4Γц,1Η). Приклад 2 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(3-піридиніл)феніл]естра-4,9-дієн-3-он хлориду До розчину (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(3піридиніл)феніл]естра-4,9-дієн-3-ону (40мг, 0,081ммоль) в ацетонітрилі (1мл) додавали 2Η хлоридну кислоту (40мкл) та воду (5мл). Ліофілізація цієї суміші дала (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(3піридиніл)феніл]естра-4,9-дієн-3-он хлорид з кількісним виходом (40мг, 0,08ммоль). 1Н ЯМР (400МГц, CDCI3): δ 0,34 (s, 3Н), 0,80-2,85 (m, 24Н), 19 4,47 (d, J=7Гц, 1H), 5,81 (s, 1H), 7,31-7,35 (m, 2H), 7,51-7,55 (m, 2H), 7,64 (dd, J=8 та 5Гц, 1Η), 8,18 (dt, J=8 та 1Гц, 1Н), 8,62 (d, J=5Гц, 1Η), 8,90 (d, J=1Гц, 1Η). Приклад 3 Отримання (11β,16α,17β)-17циклопропілкарбоніл-11-[4-(6-метоксипіридин-3іл)феніл]-16-метилестра-4,9-діон-3-он Реакція (11β,16α,17β)-11-(4-бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-ону та 6-метокси-3-піридинілборонової кислоти способом, описаним у прикладі 1 етап h дала заголовну сполуку (54% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,35 (s, 3Н), 0,84-0,99 (m, 6H), 1,08-1,15 (m, 1H), 1,33-1,39 (m, 1H), 1,45-1,54 (m, 1H), 1,62-1,70 (m, 2H), 1,91-1,97 (m, 1H), 2,01-2,08 (m, 1H), 2,24-2,53 (m, 6H), 2,58-2,64 (m, 2H), 2,68-2,85 (m, 3Н), 3,98 (s, 3Н), 4,44 (d, J=8Гц, 1Η), 5,80 (S, 1Η), 6,80 (d, J=8Гц, 1Η), 7,23 (d, J=7Гц, 2Н), 7,44 (d, J=7Гц, 2Н), 7,75-7,79 (m, 1H), 8,36-8,38 (m, 1H). Приклад 4 Отримання (11β,16α,17β)-11-[4-(6хлорпіридин-3-іл)феніл]-17-циклопропіл-карбоніл16-метилестра-4,9-дієн-3-ону Для отримання заголовної сполуки з (11β,16α,17β)-11-(4-бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-ону та 6-хлор-3-піридинілборонової кислоти спосіб, описаний у прикладі 1 етап h був слабко модифікований. Реакційну суміш гріли протягом 4 годин та ще 2 еквіваленти 6-хлор-3-піридинілборонової кислоти додавали 4 частинами. Очистка РХ-МС, а потім ліофілізація дали продукт (11% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,34 (s, 3Н), 0,84-2,84 (m, 24Н), 4,45 (d, J=7Гц, 1H), 5,80 (s, 1H), 7,25-7,30 (m, 2H), 7,38 (d, J=8Гц, 1H), 7,45-7,49 (m, 2H), 7,82 (dd, J=8 та 3Гц, 1H), 8,59 (d, J=3Гц, 1Н). Приклад 5 Отримання (11β,16α,17β)-17циклопропілкарбоніл-11-[4-(6-флуорпіридин-3іл)феніл]-16-метилестра-4,9-діен-3-ону (11β,16α,17β)-11-(4-Бромфеніл)-17цикпопропілкарбоніл-16-метилестра-4,9-дієн-3-он та 6-флуор-3-піридинілборонову кислоту застосовували як описано у прикладі 1 етап h. Очистка РХ-МС, а потім ліофілізація дали продукт (65% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,34 (s, 3Н), 0,80-2,85 (m, 24Н), 4,45 (d, J=7Гц, 1H), 5,80 (s, 1H), 7,00 (dd, J=8 та 3Гц, 1Н), 7,25-7,29 (m, 2Н), 7,447,48 (m, 2Н), 7,95 (dt, J=8 та 3Гц, 1Н), 8,41 (d, J=3Гц, 1Η). Приклад 6 Отримання (11β,16α,17β)-17-циклопропіл карбоніл-16-метил-11-[4-(5-метокси-піридин-3іл)феніл]естра-4,9-дієн-3-ону (11β,16α,17β)-11-(4-Бромфеніл)-17циклопропіл карбоніл-16-метилестра-4,9-дієн-3-он та 5-метокси-3-піридинілборонову кислоту застосовували як описано у прикладі 1 етап h. Очистка РХ-МС, а потім ліофілізація дали продукт (41% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,35 (s, 3Н), 0,80-2,86 (m, 24Н), 3,92 (s, 3Н), 4,46 (d, J=7Гц, 1H), 5,80 (s, 1H), 7,24-7,29 (m, 2H), 7,35 (dd, J=3 та 1Гц, 1Н), 7,48-7,53 (m, 2Н), 8,28 (d, J=3Гц, 1Н), 8,45 (d, J=1Гц, 1Н). 88782 20 Приклад 7 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(3хінолідиніл)феніл]естра-4,9-дієн-3-ону (11β,16α,17β)-11-(4-Бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-он та хінолін-3-боронової кислоти пінаколят гріли протягом 3 годин способом, описаним у прикладі 1 етап h. Очистка РХ-МС, а потім ліофілізація дали заголовну сполуку (18% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,38 (s, 3Н), 0,78-2,89 (m, 24Н), 4,49 (d, J=7Гц, 1H), 5,81 (s, 1H), 7,30-7,34 (m, 2H), 7,58 (dt, J=7 та 1Гц, 1H), 7,63-7,67 (m, 2Н), 7,72 (dt, J=8 та 1Гц, 1Н), 7,87 (dd, J=8 та 1Гц, 1Н), 8,13 (d, J=8Гц, 1Н), 8,29 (d, J=3Гц, 1Н), 9,17 (d, J=3Гц, 1Н). Приклад 8 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(4піридазиніл)феніл]естра-4,9-дієн-3-ону н-Бутиллітій (2,76мл, 6,9ммоль, 2,5Μ у гексан) додавали краплями до охолодженого (0°С) розчину діізопропіламіну (0,97мл, 6,9ммоль) у тетрагідрофурані (2мл) в атмосфері азоту. Після перемішування протягом 30 хвилин реакційну суміш охолоджували до -78°С та розчин піридазолону (452мкл, 6,3ммоль) та трибутилстанум хлорид (1,9мл, 6,9ммоль) додавали одночасно в той час, як температуру тримали нижче -70°С. Реакційну суміш перемішували протягом 2 годин при -78°С; далі додавали насичений водний розчин амоній хлориду та реакційну суміш екстрагували тричі етилацетатом. Поєднані органічні шари сушили (MgSO4) та випарювали до сухого стану. Сирий продукт очищали РХ-МС для отримання трибутилстанілпіридазину (197мг, 0,53ммоль, 8% виходу). Це станілпіридазин (183мг, 0,49ммоль), (11β,16α,17β)-11-(4-бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-ону (100мг, 0,20ммоль) та біс(трифенілфосфін)паладій(ІІ) хлорид (3мг, 0,004ммоль) розчиняли у діоксані (3мл) в атмосфері азоту. Реакційну суміш перемішували протягом ночі при 110°С та тоді охолоджували до кімнатної температури. Додавали воду та суміш екстрагували тричі дихлорметаном. Поєднані органічні шари сушили через фільтр та випарювали до сухого стану. Очистка РХ-МС, а потім ліофілізація дали (11β,16α,17β)-17-цикпопропілкарбоніл16-метил-11-[4-(4-піридазиніл)феніл]естра-4,9дієн-3-ону (78мг, 0,16ммоль, 79% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,33 (s, 3H), 0,85-2,84 (m, 26Н), 4,48 (d, J=7Гц, 1H), 5,81 (s, 1H), 7,33-7,37 (m, 2H), 7,60-7,64 (m, 3Н), 9,21 (dd, J=5 та 1Гц, 1Η), 9,46 (dd, J=3 та 1Гц, 1Η). Таку ж заголовну сполуку також отримували застосуванням 4-трибутилстанілпіридазину, отриманого способами, описаними у Eur. J. Org. Chem 2885-2896 (1998) та Tetrahedron Letters 38, 57915794 (1997). Приклад 9 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(піразин-2іл)феніл]естра-4,9-дієн-3-он Способом, описаним у прикладі 8, (11β,16α,17β)-11-(4-бромфеніл)-17 21 циклопропілкарбоніл-16-метилестра-4,9-дієн-3-он та 2-трибутилстанілпіразин гріли у мікрохвильовці при 135°С (150Вт, 25 хвилин) для отримання заголовної сполуки (35% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,33 (s, 3Н), 0,84-2,86 (m, 24Н), 4,47 (d, J=7Гц, 1Н), 5,81 (s, 1H), 7,30-7,34 (m, 2H), 7,92-7,96 (m, 2H), 8,49 (d, J=3Гц, 1H), 8,61 (dd, J=3 та 1Гц, 1Н), 9,01 (d, J=1Гц,1Н). Приклад 10 Отримання (11β,16α,17β)-17-циклопропіл карбоніл-16-метил-11-[4-(2-піридиніл)феніл]естра-4,9дієн-3-он (PPh3)2PdCl2 (4мг, 0,006ммоль), фероцен паладій дихлорид (6мг, 0,009ммоль) та 2піридилцинк бромід (2мл, 1,0ммоль) додавали до розчину (11β,16α,17β)-11-(4-бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-ону (200мг, 0,41ммоль) у ТГФ (4мл) в атмосфері азоту. Реакційну суміш перемішували протягом 5 годин при 60°С та тоді охолоджували до кімнатної температури. Додавали насичений водний розчин амоній хлориду та суміш екстрагували тричі дихлорметаном. Поєднані органічні шари сушили через фільтр та випарювали до сухого стану. Очистка ВЕРХ, а потім ліофілізація дали (11β,16α,17β)17-циклопропілкарбоніл-16-метил-11-[4-(2піридиніл)феніл]естра-4,9-діен-3-ону (80мг, 0,16ммоль, 40% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,33 (s, 3H), 0,80-2,87 (m, 24Н), 4,46 (d, J=7Гц, 1H), 5,80 (s, 1H), 7,20-7,23 (m, 1H), 7,25-7,29 (m, 2H), 7,68-7,77 (m, 2H), 7,89-7,92 (m, 2H), 8,67 (dt, J=5 та 1Гц, 1H). Приклад 11 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(5метилпіридин-2-іл)фенілестра-4,9-дієн-3-ону Заголовну сполуку (10% виходу) було отримано з (11β,16α,17β)-11-(4-бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-ону та 5-метил-2-піридинілцинк броміду способом, описаним у прикладі 10.1Н ЯМР (400МГц, CDCI3): δ 0,33 (s, 3H), 0,80-2,86 (m, 27Н), 4,45 (d, J=7Гц, 1H), 5,79 (s, 1H), 7,22-7,26 (m, 2H), 7,52-7,60 (m, 2H), 7,85-7,88 (m, 2H), 8,48-8,50 (m,1Η). Приклад 12 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(4піридиніл)феніл]естра-4,9-дієн-3-ону (11β,16α,17β)-11-(4-Бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-он та 4-піридинілборонову кислоту застосовували як описано у прикладі 1 етап h. Очистка ВЕРХ, а потім кристалізація (ацетонітрил/вода) дали продукт (44% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,33 (s, 3Н), 0,84-2,85 (m, 24Н), 4,46 (d, J=7Гц, 1H), 5,81 (s, 1H), 7,26-7,30 (m, 2H), 7,48-7,50 (m, 2H), 7,55-7,59 (m, 2H), 8,63-8,65 (m, 2H). Приклад 13 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-етеніл-11-[4-(3піридиніл)феніл]естра-4,9-дієн-3-ону а. (16α,17β)-17-(Циклопропілкарбоніл)-16етенілестра-5(10),9(11)-дієн-3-он циклічний 1,2етандіілацетапь 88782 22 Реакція 17-(циклопропілкарбоніл)естра5(10),9(11),16-триєн-3-он циклічного 1,2етандіілацеталю та вінілмагній хлориду способом, описаним у прикладі 1 етап d дала заголовну сполуку (48% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,63 (s, 3H), 0,80-2,66 (m, 21Н), 2,71 (d, J=9Гц, 1H), 3,303,39 (m, 1H), 3,99 (s, 4H), 4,84-4,97 (m, 2H), 5,545,58 (m, 1H), 5,71-5,81 (m, 1H). b. (11β,16α,17β)-17-Циклопропілкарбоніл-16етеніл-11-[4-(3-піридиніл)феніл]-естра-4,9-дієн-3он (16α,17β)-17-(Циклопропілкарбоніл)-16етенілестра-5(10),9(11)-дієн-3-он циклічний 1,2етандіілацеталь перетворювали у сиру заголовну сполуку способами, описаними у прикладі 1 етапи е, f, g та h. Очистка препаративною РХ-МС, а потім ліофілізація дали заголовну сполуку. (15% виходу за ці 4 етапи). 1Н ЯМР (400МГц, CDCI3): δ 0,38 (s, 3Н), 0,84-0,99 (m, 3Н), 1,08-1,15 (m, 1Η), 1,46-2,88 (m, 16H), 3,26-3,35 (m, 1Η), 4,47 (d, J=7Гц, 1Η), 4,86-4,97 (m, 2H), . 5,70-5,79 (m, 1H), 5,81 (s, 1H), 7,26-7,30 (m, 2H), 7,35 (dd, J=8 та 5Гц, 1Н), 7,497,53 (m, 2H), 7,86 (dt, J=8 та 1Гц, 1Η), 8,58 (dd, J=5 та 1Гц, 1Η), 8,84 (d, J=1Гц, 1Η). Приклад 14 Отримання [11β,16α(Е),17β]-17циклопропілкарбоніл-16-(2-фенілетеніл)-11-[4-(3піридиніл)феніл]естра-4,9-дієн-3-ону Очисткою (11β,16α,17β)-17циклопропілкарбоніл-16-етеніл-11-[4-(3піридиніл)феніл]естра-4,9-дієн-3-ону заголовну сполуку було виділено як побічний продукт (2% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,41 (s, 3Н), 0,83-1,15 (m, 4H), 1,50-2,91 (m, 16Н), 3,43-3,53 (m, 1H), 4,49 (d, J=7Гц, 1H), 5,82 (s, 1H), 6,12 (dd, J=16 та 8Гц, 1Н), 6,32 (d, J=16Гц, 1Н), 7,17-7,22 (m, 1H), 7,26-7,40 (m, 7H), 7,50-7,54 (m, 2H), 7,85-7,91 (m, 1H), 8,56-8,61 (m, 1Η), 8,83-8,87 (m, 1Η). Приклад 15 Отримання (11β,16α,17β)-17(циклопропілкарбоніл)-16-етеніл-11-[4-(6метоксипіридин-3-іл)феніл]естра-4,9-дієн-3-ону (16α,17β)-17-(Циклопропілкарбоніл)-16етенілестра-5(10),9(11)-дієн-3-он циклічний 1,2етандіілацетапь перетворювали у сиру заголовну сполуку способами, описаними у прикладі 1 етапи f, g та h (застосуванням 6-метокси-3піридинілборонової кислоти на останньому етапі). Очистка кристалізацією з гептану дала заголовну сполуку (24% виходу за ці 4 етапи), т.пл. 197°С. 1Н ЯМР (400МГц, CDCI3): δ 0,39 (s, 3Н), 0,84-2,87 (m, 20H), 3,26-3,34 (m, 1H), 3,98 (s, 3Н), 4,45 (d, J=7Гц, 1Н), 4,88 (d, J=11Гц, 1Н), 4,95 (d, J=16Гц, 1Н), 5,705,81 (m, 2Н), 6,81 (d, J=8Гц, 1Η), 7,23 (d, J=8Гц, 2Н), 7,45 (d, J=8Гц, 2Н), 7,77 (dd, J=8 та 3Гц, 1H), 8,37 (d, J=3Гц,1Н). Приклад 16 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-етил-11-[4-(3-піридиніл)феніл]-естра-4,9-дієн-3-ону a. (16α,17β)-17-(Циклопропілкарбоніл)-16етилестра-5(10),9(11)-дієн-3-он циклічний 1,2етандіілацеталь Реакція 17-(цикпопропілкарбоніл)естра5(10),9(11),16-триєн-3-он циклічного 1,2 23 етандіілацеталю та етилмагній хлориду способом, описаним у прикладі 1 етап d дала заголовну сполуку (87% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,60 (s, 3Н), 0,80-2,64 (m, 28Н), 3,99 (s,4H), 5,54-5,58 (m,1Η). b. (11β,16α,17β)-17-Циклопропілкарбоніл-16етил-11-[4-(3-піридиніл)феніл]-естра-4,9-дієн-3-он (16α,17β)-17-(Циклопропілкарбоніл)-16етилестра-5(10),9(11)-дієн-3-он циклічний 1,2етандіілацеталь перетворювали у сиру заголовну сполуку способами, описаними у прикладі 1 етапи f, g та h. Очистка препаративною РХ-МС, а потім ліофілізація дали заголовну сполуку. (22% виходу за ці 4 етапи). 1Н ЯМР (400МГц, CDCI3): δ 0,35 (s, 3Н), 0,82 (t, J=7Гц, 3Н), 0,87-0,98 (m, 3Н), 1,07-1,14 (m, 1H), 1,25-1,34 (m, 2H), 1,41-1,64 (m, 5H), 1,911,99 (m, 1H), 2,03-2,11 (m, 1H), 2,24-2,85 (m, ЮН), 4,46 (d, J=7Гц, 1H), 5,80 (s, 1H), 7,25-7,30 (m, 2H), 7,35 (dd, J=7 та 5Гц, 1H), 7,48-7,53 (m, 2Н), 7,46 (dt, J=8 та 1Гц, 1Н), 8,57 (dd, J=5 та 1Гц, 1Н), 8,84 (d, J=3Гц, 1Н). Приклад 17 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-етил-11-[4-(6-метоксипіридин-3-іл)феніл]-естра-4,9-дієн-3-ону (16α,17β)-17-(Циклопропілкарбоніл)-16етилестра-5(10),9(11)-дієн-3-он циклічний 1,2етандіілацеталь перетворювали у сиру заголовну сполуку способами, описаними у прикладі 1 етапи f, g та h застосуванням 6-метокси-3піридинілборонової кислоти на останньому етапі. Очистка колонковою хроматографією дала заголовну сполуку (14% виходу за ці 4 етапи). 8 0,35 (s, 3Н), 0,82 (t, J=8Гц, 3Н), 0,85-0,99 (m, 4H), 1,071,13 (m, 1H), 1,25-1,34 (m, 2H), 1,41-2,84 (m, 16Н), 3,98 (s, 3Н), 4,44 (d, J=7Гц, 1Н), 5,80 (s, 1H), 6,80 (d, J=8Гц, 1Н), 7,21-7,25 (m, 2Н), 7,42-7,46 (m, 2Н), 7,77 (dd, J=8 та 2Гц, 1Η), 8,37 (d, J=2Гц, 1Η). Приклад 18 Отримання (11β,17β)-17-циклопропілкарбоніл11-[4-(3-піридиніл)феніл]естра-4,9-дієн-3-он a. (17β)-17-(Цикпопропілкарбоніл)естра5(10),9(11)-дієн-3-он циклічний 1,2-етандіілацеталь К-селектрид (1М у ТГФ, 12,1мл, 12,1ммоль) додавали краплями до охолодженого розчину (78°С) 17-(циклопропілкарбоніл)естра5(10),9(11),16-триєн-3-он циклічного 1,2етандіілацеталю (3,7г, 10,0ммоль) у ТГФ (105мл) в атмосфері азоту, температуру реакції тримали нижче -70°С. Після перемішування розчину протягом 20 хвилин додавали краплями насичений водний розчин натрій сульфату, а потім воду. Органічний шар відокремлювали та водний шар екстрагували тричі етилацетатом. Поєднані органічні шари промивали розсолом, сушили (Na2SO4) та випарювали до сухого стану. Сирий продукт очищали колонковою хроматографією (SiO2, гептан/етилацетат, 4/1) для отримання (17β)-17(циклопропілкарбоніл)естра-5(10),9(11)-дієн-3-он циклічного 1,2-етандіілацеталю (2,1г, 5,8ммоль, 57% виходу), з деяким вмістом розчиннику ЯМР (400МГц, CDCI3): δ 0,59 (s, 3H), 0,80-2,59 (m, 23Н), 2,86 (t, J=9Гц, 1H), 3,99 (s, 4H), 5,55-5,60 (m, 1H). b. (17β)-17-(Циклопропілгідроксиметил)естра5(10),9(11)-дієн-3-он циклічний 1,2-етандіілацеталь 88782 24 Розчин 17-(цикпопропілкарбоніл)естра5(10),9(11)-дієн-3-он циклічного (1,2етандіілацеталю) (2,1г, 5,8ммоль) у діетиловому етері (54мл) додавали повільно до охолодженої (0°С) суспензії літій алюмогідриду (262мг, 6,9ммоль) у діетиловому етері (36мл) в атмосфері азоту. Після 1 години перемішування при 0°С додавали насичений водний розчин натрій сульфату, доки не зникав сірий колір. Твердий Na2SO4 додавали та суміш фільтрували, промивали етилацетатом та фільтрат випарювали до сухого стану для отримання циклічного (170)-17(циклопропілгідроксиметил)естра-5(10),9(11)-дієн3-он 1,2-етандіілацеталю (2,2г, 5,8ммоль, >100% виходу, продукт з деяким вмістом етилацетату). 1Н ЯМР (400МГц, CDCI3): δ 0,20-0,59 (m, 4H), 0,70 (s, 3Н), 0,82-2,59 (m, 21Н), 2,85 (dt, J=9 та 4Гц, 1Н), 3,99 (s, 4H), 5,53-5,58 (m, 1H). С. (5α,11β,17β)-11-(4-Бромфеніл)-17(циклопропілгідроксиметил)-5-гідроксіестр-9-ен-3он циклічний 1,2-етандіілацеталь Способами, описаними у прикладі 1 етапи е та f (17β)-17-(циклопропілгідроксиметил)естра5(10),9(11)-дієн-3-он циклічний 1,2-етандіілацеталь перетворювали у заголовну сполуку (26% виходу). 1 Н ЯМР (400МГц, CDCI3): δ 0,12-0,57 (m, 7H), 0,790,89 (m, 1H), 1,10-2,12 (m, 17Н), 2,27-2,40 (m, 2H), 2,65-2,76 (m, 2H), 3,88-4,03 (m, 4Н), 4,14 (d, J=7Гц, 1Н), 4,34 (s, 1H), 7,08-7,13 (m, 2H), 7,32-7,36 (m, 2H). d. (5α,11β,17β)-11-(4-Бромфеніл)-17(циклопропілкарбоніл)-5-гідроксіестр-9-ен-3-он циклічний 1,2-етандіілацеталь До розчину (5α,11β,17β)-11-(4-бромфеніл)-17(циклопропілгідроксиметил)-5-гідроксіестр-9-ен-3он циклічного (1,2-етандіілацеталю) (726мг, 1,3ммоль) в ацетоні (25мл), 4-метилморфолін Nоксид (438мг, 3,7ммоль) та тeтpa-N-пропіламоній перренат (VII) (28мг, 0,08ммоль) додавали та реакційну суміш перемішували протягом 2 годин при кімнатній температурі в атмосфері азоту. Силікагель та гептан (14мл) додавали та суміш перемішували протягом 1 години, тоді фільтрували через дикаліт та промивали належно з етилацетат. Фільтрат випарювали до сухого стану для отримання (5α,11β,17β)-11-(4-бромфеніл)-17(циклопропілкарбоніл)-5-гідроксіестр-9-ен-3-он циклічного 1,2-етандіілацеталю (732мг, 1,3ммоль, 100% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,21 (s, 3H), 0,80-2,39 (m, 22Н), 2,66-2,74 (m, 2H), 3,88-4,05 (m, 4H), 4,23 (d, J=7Гц, 1H), 4,37 (s, 1H), 7,06-7,10 (m, 2H), 7,34-7,38 (m, 2H). е. (11β,17β)-11-(4-Бромфеніл)-17циклопропілкарбоніл-4,9-діен-3-он Способом, описаним у прикладі 1 етап г (5α,11β,17β)-11-(4-бромфеніл)-17(циклопропілкарбоніл)-5-гідроксіестр-9-ен-3-он циклічний 1,2-етандіілацеталь перетворювали у заголовну сполуку (65% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,27 (s, 3H), 0,83-2,83 (m, 22Н), 4,34 (d, J=7Гц, 1H), 5,79 (s, 1H), 7,02-7,07 (m, 2H), 7,37-7,42 (m, 2H). f. (11β,17β)-17-Циклопропілкарбоніл-11-[4-(3піридиніл)феніл]естра-4,9-дієн-3-он 25 (11β,17β)-11-(4-Бромфеніл)-17циклопропілкарбоніл-4,9-дієн-3-он перетворювали у сиру заголовну сполуку способом, описаним у прикладі 1 етап h. Очистка препаративною РХ-МС, а потім ліофілізація дали заголовну сполуку (66% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,32 (s, 3Н), 0,84-2,82 (m, 21 Η), 2,92 (d, J=13Гц, 1Η), 4,46 (d, J=7Гц, 1Η), 5,80 (s, 1Η), 7,27-7,32 (m, 2Η), 7,34 (dd, J=8 та 5Гц, 1Η), 7,49-7,54 (m, 2H), 7,86 (dt, J=8 та 1Гц, 1Η), 8,58 (d, J=6Гц, 1Η), 8,84(d,J=1Гц, 1Н). Приклад 19 Отримання (11β,17β)-17-циклопропілкарбоніл1-[4-(6-метоксипіридин-3-іл)феніл]естра-4,9-дієн-3ону (11β,17β)-11-(4-Бромфеніл)-17циклопропілкарбоніл-4,9-дієн-3-он перетворювали у сиру заголовну сполуку способом, описаним у прикладі 1 етап h застосуванням 6-метокси-3піридинілборонової кислоти як реагенту. Очистка препаративною РХ-МС, а потім ліофілізація дали заголовну сполуку. (60% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,32 (s, 3Н), 0,83-2,81 (m, 21Н), 2,91 (d, J=13Гц, 1H), 3,98 (s, 3Н), 4,44 (d, J=7Гц, 1H), 5,80 (s, 1H), 6,80 (d, J=8Гц, 1Н), 7,22-7,26 (m, 2Н), 7,42-7,46 (m, 2Н), 7,77 (dd, J=8 та 2Гц, 1Н), 8,37 (d, J=2Гц, 1Н). Приклад 20 Отримання (11β,17β)-17-цикпопропілкарбоніл17-метил-11-[4-(3-піридиніл)-феніл]естра-4,9-дієн3-ону a. (173)-17-(Цикпопропілкарбоніл)-17метилестра-5(10),9(11)-дієн-3-он циклічний 1,2етандіілацеталь L-селектрид (3,0мл, 3,0ммоль, 1Μ у ТГФ) повільно додавали до охолодженого (-78°С) та перемішуваного розчину 17(циклопропілкарбоніл)естра-5(10),9(11),16-триєн-3он циклічного 1,2-етандіілацеталю (500мг, 1,4ммоль) та 1,3-диметил-3,4,5,6-тетрагідро-2(1Н)піримідинону (0,33мл, 2,7ммоль) у сухому ТГФ (20мл) в атмосфері азоту. Після 1 години при 78°С додавали метилйодид (1,7мл, 27ммоль). Реакційну суміш перемішували ще 1,5 години в той час, як температура підвищувалася до -30°С. Реакційну суміш виливали у воду та екстрагували етилацетатом. Поєднані органічні шари промивали насиченим водним розчином натрій гідрокарбонату та розсолом, сушили (MgSO4) та розчинники випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (SiO2, гептан/етилацетат 9/1, за об'ємом) для отримання (17β)-17-(циклопропілкарбоніл)-17-метилестра5(10),9(11)-дієн-3-он циклічного 1,2етандіілацеталю (255мг, 0,67ммоль, 49% виходу). ЯМР (400МГц, CDCI3): δ 0,67 (s, 3Н), 0,78-2,72 (m, 27Н), 1,23 (s, 3Н), 3,96-4,02 (m, 4H), 5,57-5,61 (m, 1Η). b. (11β,17β)-17-Циклопропілкарбоніл-17метил-11-[4-(3-піридиніл)феніл]естра-4,9-дієн-3-он (17β)-17-(Циклопропілкарбоніл)-17метилестра-5(10),9(11)-дієн-3-он циклічний 1,2етандіілацеталь перетворювали у сиру заголовну сполуку способами, описаними у прикладі 1 етапи f, g та h. Очистка ВЕРХ, а потім ліофілізація дали заголовну сполуку. (19% виходу за ці 4 етапи). 88782 26 ЯМР (400МГц, CDCI3): δ 0,42 (s, 3Н), 0,80-2,82 (m, 24Н), 2,28 (s, 3Н), 4,48 (d, J=8Гц, 1H), 5,80 (s, 1H), 7,30 (d, J=8Гц, 1Н), 7,34 (dd, J=4 та 8Гц, 1Н), 7,50 (d, J=8Гц, 1Н), 7,85 (dt, J=2 та 8Гц, 1Η), 8,57 (dd, J=2 та 4Гц, 1Η), 8,84 (d, J=2Гц, 1Η). Приклад 21 Отримання (11β,16α,17β)-17циклопроп1лкарбонт-16,17-дигідро-11-[4-(3піридиніл)феніл]-3-он циклопропа[16,17]естра4,9,16-триєн-3-он а. (16α,17β)-17-(Цикпопропілкарбоніл)-16,17дигідро-3'Н-циклопропа[16,17]естра-5(10),9(11),16триєн-3-он циклічний 1,2-етандіілацеталь Натрій гідрид (60% масляна дисперсія, 197мг, 4,9ммоль) додавали при перемішуванні до розчину триметилсульфоксоній йодиду (960мг, 1,1ммоль) у ДМСО (20мл) в атмосфері азоту. Після 30 хвилин додавали розчин 17(циклопропілкарбоніл)естра-5(10),9(11),16-триєн-3он циклічного (1,2-етандіілацеталю) (400мг, 1,1ммоль) у сухому ТГФ (4мл). Після 1 години реакційну суміш виливали у суміш лід-вода та екстрагували етилацетатом. Поєднані органічні шари промивали розсолом, сушили (MgSO4) та розчинники випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (SіO2 градієнт гептан/етилацетат 9/1, за об'ємом гептан/етилацетат 3/7, за об'ємом) для отримання (16α,17β)-17-(циклопропілкарбоніл)-16,17-дигідро3'Н-циклопропа[16,17]естра-5(10),9(11),16-триєн-3он циклічного 1,2-етандіілацеталю (102мг, 0,25ммоль, 91% виходу). ЯМР (400МГц, (CDCI3): δ 0,72-2,50 (m, 28Н), 0,98 (s, 3Н), 3,97-4,02 (m, 4H), 5,56-5,60 (m, 1Η). b. (11β,16α,17β)-17-циклопропілкарбоніл16,17-дигідро-11-[4-(3-піридиніл)феніл]-3'Нциклопропа[16,17]естра-4,9,16-триєн-3-он (16α,17β)-17-(цикпопропілкарбоніл)16,17дигідро-3'Н-цикпопропа[6,17]естра-5(10),9(11),16триєн-3-он циклічний 1,2-етандіілацеталь перетворювали у сиру заголовну сполуку способами, описаними у прикладі 1 етапи f, g та h. Очистка ВЕРХ, а потім ліофілізація дали заголовну сполуку. (24% виходу за ці 4 етапи). ЯМР (400МГц, CDCI3): δ 0,70 (s, 3Н), 0,68-2,78 (m, 23Н), 3,03 (d, J=12,1Н), 4,41 (d, J=8Гц, 1H), 5,78 (s, 1H), 7,31 (d, J=8Гц, 1Η), 7,35 (dd, J=4 та 8Гц, 1Η), 7,49 (d, J=8Гц, 1Η), 7,86 (dt, J=2 та 8Гц, 1Η), 8,57 (dd, J=2 та 5Гц, 1Η), 8,83 (d, J=3Гц, 1Н). Приклад 22 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(3-піридиніл)феніл]естра-4,9-дієн-3-он 3-оксиму Гідроксиламін хлорид (20мг, 0,30ммоль) та воду (1мл) додавали при перемішуванні до розчину 100мг (0,20ммоль) (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(3піридиніл)феніл]естра-4,9-дієн-3-ону у діоксані (2мл). Реакційну суміш перемішували протягом ночі при кімнатній температурі та тоді екстрагували тричі дихлорметаном. Поєднані органічні шари сушили через фільтр та випарювали до сухого стану. Очистка сирого продукту ВЕРХ, а потім ліофілізація дали (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(3 27 піридиніл)феніл]естра-4,9-дієн-3-он 3-оксим як E/Z-суміш (2:1) (85мг, 0,17ммоль, 84% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,31 та 0,32 (2х s, загалом 3Н), 0,83-2,95 (m, 25H), 4,37-4,42 (m, 1Н), 5,89 та 6,55 (2х s, загалом 1Н), 7,26-7,32 (m, 2Н), 7,35 (dd, J=8 та 5Гц, 1Н), 7,47-7,51 (m, 2Н), 7,86 (dt, J=8 та 1Гц, 1Н), 8,57 (dd, J=5 та 1Гц, 1Н), 8,84 (d, J=1Гц, 1Н). Приклад 23 Отримання (11β)-11-[4-(3-піридиніл)феніл]17,24-цикло-19,21-динорхола-4,9-дієн-3,20-діону Способами, описаними у прикладі 1 етапи f, g та h 17,24-цикло-19,21-динорхола-5(10),9(11)-дієн3,20-діон циклічний 3-(1,2-етандіілацеталь) (US 5 084 450) перетворювали у сиру заголовну сполуку. Очистка препаративною ВЕРХ, а потім ліофілізація дали заголовну сполуку (18% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,47 (s, 3H), 1,24-2,82 (m, 22Н), 4,48 (d, J=7Гц, 1H), 5,80 (S, 1H), 7,23-7,27 (m, 2H), 7,35 (dd, J=8 та 4Гц, 1Н), 7,46-7,51 (m, 2H), 7,84 (dt, J=8 та 1Гц, 1Η), 8,58 (dd, J=4 та 1Гц, 1Η), 8,82 (d, J=1Гц, 1Η). Приклад 24 Отримання (11β)-11-[4-(6-метоксипіридин-3іл)феніл]-17,24-цикло-19,21-динорхола-4,9-дієн3,20-діону Способами, описаними у прикладі 25 та застосуванням 6-метокси-3-піридинілборонової кислоти як борату на останньому етапі заголовну сполуку отримували з 17,24-цикло-19,21-динорхола5(10),9(11)дієн-3,20-діон циклічного 3-(1,2етандіілацеталю) (17% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,47 (s, 3Н), 1,25-2,81 (m, 22Н), 3,98 (s, 3Н), 4,46 (d, J=7Гц, 1Н), 5,80 (s, 1H), 6,80 (d, J=9Гц, 1H), 7,18-7,22 (m, 2H), 7,40-7,44 (m, 2H), 7,75 (dd, J=9 та 2Гц, 1H), 8,36 (4J=2Гц, 1Н). Приклад 25 Отримання (11β)-11-[4-(3-піридиніл)феніл]17,24-цикло-19,21-динорхола-4,9-дієн-3,20-діон хлориду Способом, описаним у прикладі 2 (11β)-11-[4(3-піридиніл)феніл]-17,24-цикло-19,21-динорхола4,9-дієн-3,20-діон перетворювали у (11β)-11-[4-(3піридиніл)феніл]-17,24-цикпо-19,21-динорхола-4,9дієн-3,20-діон хлорид (100% виходу). 1Н ЯМР (600МГц, CDCI3): δ 0,45 (s, 3Н), 1,33-2,80 (m, 22Н), 4,50 (d, J=7Гц, 1H), 5,82 (s, 1H), 7,30-7,33 (m, 2H), 7,50-7,53 (m, 2H), 7,69-7,72 (m, 1H), 8,25 (d, J=7Гц, 1Н), 8,64 (d, J=5Гц, 1Н), 8,90 (d, J=1Гц, 1Н). Приклад 26 (6β,11β,16α,17β)-17-циклопропілкарбоніл-6,16диметил-11-[4-(3-піридиніл)-феніл]естра-4,9-дієн3-он Способами, описаними у прикладі 1 (6β)-6метилестра-5(10),9(11)-дієн-3,17-діон циклічний 3(1,2-етандіілацеталь) перетворювали у сиру заголовну сполуку. Очистка препаративною ВЕРХ, а потім ліофілізація дали заголовну сполуку (14% 88782 28 виходу). ЯМР (400МГц, CDCI3): δ 0,38 (s, 3Н), 0,852,88 (m, 24Н), 0,99 (d, J=8Гц, 3Н), 1,32 (d, J=8Гц, 3Н), 4,46 (d, J=8Гц, 1Η), 5,84 (s, 1Η), 7,27 (d, J=8Гц, 1Η), 7,41 (dd, J=5 та 8Гц, 1Η), 7,53 (d, J=8Гц, 1Η), 7,94 (dt, J=2 та 8Гц, 1Η), 8,59 (dd, J=2 та 4Гц, 1Η), 8,90 (d, J=2Гц, 1Η). Приклад 27 Отримання (11β,16α,17β)-17циклопропілкарбоніл-16-метил-11-[4-(піримідин-2іл)феніл]естра-4,9-дієн-3-он Способом, описаним у прикладі 8, (11β,16α,17β)-11-(4-бромфеніл)-17циклопропілкарбоніл-16-метилестра-4,9-дієн-3-он та 2-трибутилстанілпіримідин гріли протягом 4 годин при 110°С для отримання заголовної сполуки (17% виходу). 1Н ЯМР (400МГц, CDCI3): δ 0,32 (s, 3Н), 0,83-2,87 (m, 24Н), 4,47 (d, J=7,0Гц, 1H), 5,80 (s, 1H), 7,18 (t, J=4,7Гц, 1H), 7,28-7,31 (m, 2H), 8,32-8,35 (m, 2H), 8,79 (d, J=4,7Гц, 2Н). Приклад 28 Активність рецептору-В прогестерону у трансактивації. Прогестагенну активність сполук винаходу (ЕК50 та притаманну агоністичну активність) визначали у біодослідженні in vitro клітин яєчнику китайського хом'яка (СНО), як описано W.G.E. J. Schoonen et al. (Anal. Biochem. 261 (1998), 222224). Антипрогестагенну активність сполуки винаходу (ІК50 та притаманну антагоністичну активність) визначали у порівнянні з агоністичним дослідженням, що описано вище, інгібуванням трансактивації через рецептор прогестерону-В ферменту люцифераза у присутності 0,1нМ індуктору (16α)-16-етил-21-гідрокси-19-норпрегн-4-ен3,20-діон. Ефективність антагоністичної дії виражали як процент дії, створеної стандартним антагоністом, (6β,11β,17β)-11-[4-(диметиламіно)феніл]4',5'-дипдро-6-метилспіро[естра-4,9-дієн-17,2'(3'Н)фуран]-3-он. Агоністичні ліганди не інгібують трансактивацію люциферазної активності, створеної індуктором, тоді як сильні та слабкі антипрогестагени, а також сполуки зі змішаним прогестагенним/антипрогестагенним профілем можуть інгібувати трансактивацію залежно від застосованого рівня доз антипрогестагену або сполуки змішаного профілю. Фахівцям ясно, що в описаному вище дослідженні визначений EК50 є більш або менш абсолютним та залежить від притаманних властивостей самої тестованої сполуки; однак, ІК50 залежить від кількості та агоністичного ЕК50 індуктору, а також від притаманних властивостей самої тестованої сполуки. Таким чином, з такою ж кількістю індуктору, відносно сильний антагоніст буде здатним продукувати вимірюваний ЕК50, тоді як відносно слабкий антагоніст може бути нездатним продукувати детектований результат. 29 88782 30 Таблиця Приклад 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 PRB aro EК50 [M] 2Е-10 3,4Е-10 1,2Е-10 1,1E-09 4,9E-10 13E-09 1E-09 3,6E-10 1,13E-09 2,6E-09 1,7E-09 4E-09 6,6E-10 5,7E-09 7,4E-10 23E-10 13E-09 8,2E-10 5,1E-10 4,9E-10 2E-09 6,4E-10 2,9E-10 1,5E-10 4,8E-10 8,09E-10 2,54E-09 Комп’ютерна верстка Т. Чепелева РРВ аго Ефф (%) 49,2 44,5 41,5 46,5 50,5 54 50 50,5 54 49,25 56 56 46,8 49,75 41,4 34 42 36 283 37,5 18 43 17 20 17 46 52 PRB ант EК50 [M] 2,67Е-10 3,3Е-09 6,28Е-10 4,7E-10 8,48E-09 2,8E-08 3,14E-09 3,64E-09 13E-09 1,48E-08 8E-10 2,5E-09 6,10E-10 2,9E-08 9,80E-10 5,96E-10 7,89E-09 7,51 E-10 4,27E-10 1,3E-10 1,4E-09 1,47E-09 3,25E-10 5,46E-10 1,1E-09 2,75E-09 3,25E-09 Підписне РRВ ант Ефф (%) 46,4 47 59 43 50 34 24 37 35 32,5 35 26,5 38 34,5 44,5 53 51,7 66 57 58 58 32 70,8 62 66 17 >27 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProgesterone receptor modulators
Автори англійськоюHamersma Johannes Antonius Maria, Rewinkel Johannes Bernardus Maria
Назва патенту російськоюМодуляторы рецепторов прогестерона
Автори російськоюГамерсма Йоганнес Антониус Мария, Ревинкель Йоганнес Бернардус Мария
МПК / Мітки
МПК: C07J 53/00, C07J 43/00, A61P 15/18, A61K 31/58
Мітки: модулятори, прогестерону, рецепторів
Код посилання
<a href="https://ua.patents.su/15-88782-modulyatori-receptoriv-progesteronu.html" target="_blank" rel="follow" title="База патентів України">Модулятори рецепторів прогестерону</a>
Попередній патент: Детектор нейтронів та матеріал для нього (варіанти)
Наступний патент: Контейнер для збору відпрацьованих масляних фільтрів
Випадковий патент: Спосіб виявлення неприпустимих напружень лопаток турбомашини