Тетразаміщені похідні імідазолу як модулятори рецепторів канабіноїдів св1 з високою селективністю підтипів рецепторів св1/св2
Номер патенту: 85239
Опубліковано: 12.01.2009
Автори: Ланге Йозефус Г.М., Валс Хендерік С., Крузе Корнеліс Г.
Формула / Реферат
1. Сполуки загальної формули (І)
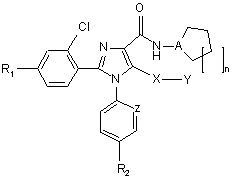 , (I)
, (I)
де
R1 представляє атом хлору, брому, фтору або водню,
R2 представляє атом хлору або брому або CF3 групу,
А представляє атом азоту або СН-групу,
X представляє атом сірки, або сульфоксид (S=O), або сульфон (SO2),
Y представляє атом водню або метильну, етильну, n-пропільну, ізопропільну, n-бутильну, t-бутильну, трифторметильну, фенільну, бензильну або піридильну групу,
Z представляє атом азоту або СН-групу,
n представляє величину 1, 2 або 3,
та їх таутомери, стереоізомери та їх фармацевтично прийнятні солі.
2. Сполуки за п. 1 загальної формули (І), у яких R1 представляє атом водню або атом хлору, R2 - атом хлору, Y представляє метильну або етильну групу, Z - СН, n представляє 1, 2 або 3, А та X мають значення, наведені у п. 1, та їх таутомери, стереоізомери та фармацевтично прийнятні солі.
3. Сполуки за п. 2 загальної формули (І), у яких R1 представляє атом хлору, Y представляє метильну групу, А - атом азоту, та їх таутомери, стереоізомери та фармацевтично прийнятні солі.
4. Фармацевтична композиція, яка містить поряд з фармацевтично прийнятним носієм та/або принаймні однією фармацевтично прийнятною допоміжною речовиною фармацевтично дійову кількість принаймні однієї сполуки за будь-яким з пп. 1-3 або її солі як діючу речовину.
5. Сполука за будь-яким з пп. 1-3 або її сіль для застосування як лікарський засіб.
6. Сполуки загальної формули (IV)
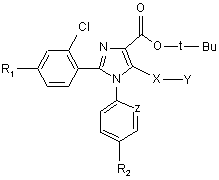 , (IV)
, (IV)
де Y представляє метильну, етильну, n-пропільну, ізопропільну, n-бутильну, t-бутильну, трифторметильну, фенільну, бензильну або піридильну групу, a R1, R2, X та Z мають значення, наведені у п. 1,
придатні для синтезу сполук загальної формули (І).
7. Сполуки загальної формули (V)
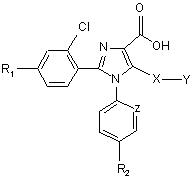 , (V)
, (V)
де Y представляє метильну, етильну, n-пропільну, ізопропільну, n-бутильну, t-бутильну, трифторметильну, фенільну, бензильну або піридильну групу, a R1, R2, X та Z мають значення, наведені у п. 1,
придатні для синтезу сполук загальної формули (І).
8. Застосування сполуки за будь-яким з пп.1-3 для приготування фармацевтичної композиції для лікування психозу, бентежності, депресії, дефіциту уваги, розладів пам’яті, розладів розуміння, розладів апетиту, опасистості, зокрема підліткової та спричиненої наркотиками, алкоголізму, гіперсексуальності, наркозалежності, нервових розладів, таких як нейродегенеративні розлади, слабоумство, дистонія, м’язова крепатура, дрижавка, епілепсія, розсіяний склероз, травматичне пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, епілепсія, хвороба Гантінгтона, синдром Туретта, мозкова ішемія, мозкова апоплексія, черепно-мозкова травма, інсульт, пошкодження хребта, нейрозапальні розлади, бляшковий склероз, вірусний енцефаліт, розлади, пов’язані з демієлінізацією, а також для лікування больових розладів, включаючи невропатичні больові розлади, та інших захворювань, пов’язаних з нейротрансмісією канабіноїдів, включаючи септичний шок, глаукому, рак, діабет, блювання, нудоту, астму, респіраторні захворювання, шлунково-кишкові розлади, виразку шлунка, діарею, статеві розлади та серцево-судинні розлади.
9. Застосування сполуки за пп. 1-3 для приготування фармацевтичної композиції для лікування розладів харчування, зокрема опасистості, підліткової опасистості та спричиненої наркотиками опасистості, яке відрізняється тим, що зазначена фармацевтична композиція містить також принаймні один інгібітор ліпази.
10. Застосування за п. 9, яке відрізняється тим, що зазначений інгібітор ліпази являє собою орлістат або ліпстатин.
Текст
1. Сполуки загальної формули (І) C2 2 UA 1 , 3 85239 4 де Y представляє метильну, етильну, n-пропільну, спричиненої наркотиками, алкоголізму, гіперсексуізопропільну, n-бутильну, t-бутильну, три фтормеальності, наркозалежності, нервових розладів, тильну, фенільну, бензильну або піридильну гр упу, таких як нейродегенеративні розлади, слабоумстa R1, R2, X та Z мають значення, наведені у п. 1, во, дистонія, м’язова крепатура, дрижавка, епілеппридатні для синтезу сполук загальної формули сія, розсіяний склероз, травматичне пошкодження (І). мозку, інсульт, хвороба Паркінсона, хвороба Альц7. Сполуки загальної формули (V) геймера, епілепсія, хвороба Гантінгтона, синдром O Туретта, мозкова ішемія, мозкова апоплексія, черепно-мозкова травма, інсульт, пошкодження хреCl бта, нейрозапальні розлади, бляшковий склероз, OH N вірусний енцефаліт, розлади, пов’язані з демієлініR1 зацією, а також для лікування больових розладів, N X Y включаючи невропатичні больові розлади, та ін(V) ших захворювань, пов’язаних з нейротрансмісією z канабіноїдів, включаючи септичний шок, глаукому, рак, діабет, блювання, нудоту, астму, респіраторні захворювання, шлунково-кишкові розлади, виразку шлунка, діарею, статеві розлади та серцевоR2 , судинні розлади. де Y представляє метильну, етильну, n-пропільну, 9. Застосування сполуки за пп. 1-3 для приготуізопропільну, n-бутильну, t-бутильну, три фтормевання фармацевтичної композиції для лікування тильну, фенільну, бензильну або піридильну гр упу, розладів харчування, зокрема опасистості, підлітa R1, R2, X та Z мають значення, наведені у п. 1, кової опасистості та спричиненої наркотиками придатні для синтезу сполук загальної формули опасистості, яке відрізняється тим, що зазначена (І). фармацевтична композиція містить також принай8. Застосування сполуки за будь-яким з пп.1-3 для мні один інгібітор ліпази. приготування фармацевтичної композиції для лі10. Застосування за п. 9, яке відрізняється тим, кування психозу, бентежності, депресії, дефіциту що зазначений інгібітор ліпази являє собою орлісуваги, розладів пам’яті, розладів розуміння, розтат або ліпстатин. ладів апетиту, опасистості, зокрема підліткової та Цей винахід стосується 1,2,4,5тетразаміщених похідних імідазолу як селективних модуляторів рецепторів канабіноїдів CB1, зокрема, антагоністів рецепторів CB1 або зворотних агоністів з високою селективністю підтипів рецепторів CB1/СВ2, способів одержання таких сполук та нових проміжних сполук, придатних для синтезу зазначених похідних імідазолу. Винахід також стосується застосування описаних тут сполук для виробництва лікарського засобу, що справляє позитивну дію. Позитивна дія є описана тут або стане очевидною для фахівця з опису винаходу та його професійних знань. Винахід також стосується застосування сполуки за винаходом для вироблення лікарського засобу для лікування або профілактики хвороб або хворобливих станів. Зокрема, винахід стосується нового застосування для лікування хвороб або хворобливих станів, які описані тут або стан уть очевидні для фахівця з опису винаходу та його професійних знань. У варіантах здійснення винаходу описані окремі сполуки, які використовуються для виготовлення лікарського засобу, придатного для лікування психічних та нервових розладів. Багатозаміщені похідні імідазолу із спорідненістю до рецептора CB1 відомі з [WO 03/027076 та WO 03/063781]. Більш того, у [WO 03/040107] описані імідазоли для лікування опасистості. Крім того, в опублікованій статті йдеться про дію імідазолів як антагоністів рецептора CB1 [Dyck et al., Bioorg. Med. Chem. Lett. 2004, 14, 1151-1154]. У зазначених заявках та статті немає даних щодо селективності описаних сполук відносно підтипів рецептора CB1/СВ2. Модулятори рецептора CB1 мають кілька потенційних застосувань при лікуванні таких захворювань, як психоз, бентежність, депресія, дефіцит уваги, розлади пам'яті, розлади розуміння, розлади апетиту, опасистість, залежність, підвищена сексуальність, наркозалежність, нейродегенеративні розлади, слабоумство, дистонія, м'язова крепатура, дрижавка, епілепсія, розсіяний склероз, травматичне пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, хвороба Гантінгтона, синдром Туретта, мозкова ішемія, мозкова апоплексія, черепно-мозкова травма, пошкодження хребта, нейрозапалювальні розлади, бляшковий склероз, вірусний енцефаліт, розлади, пов'язані з деміелінізацією, а також для лікуванні больових розладів, включаючи невропатичні больові розлади, септичний шок, глаукому, діабет, рак, блювання, нудоту, шлунково-кишкові розлади, виразку шлунку,діарею, статеві розлади, розлади координації рухів та серцево-судинні розлади. Рецептори СВ2 знаходяться переважно в імунній системі (селезінка, ніздрі, імунні клітини), а також у мікрогліальних клітинах та астроцитах і пов'язуються з відчуттям невропатичного болю. Потужні модулятори рецепторів CB1 з низькою спорідненістю до рецепторів СВ2 (тобто сполуки з високою селективністю відносно підтипів рецепторів CB1/СВ2) мають переваги перед неселективни 5 85239 6 ми або слабоселективними модуляторами рецепДо цих перешкод належать, зокрема, розчинність, торів канабіноїдів, бо вони не справляють небажапроникність, стабільність, пресистемний метабоних бічних дій, потенційно пов'язаних з рецептолізм та обмеження прицільності [Medicinal рами СВ2, наприклад, імунологічних бічних дій або Chemistry: Principles та Practice, 1994, ISBN 0запалювальних бічних дій при сприйнятті невропа85186-494-5, Ed.: F. D. King, p. 215; J. Stella, тичного болю. "Prodrugs as therapeutics", Expert Opin. Ther. В основу винаходу покладене завдання ствоPatents. 14(3), 277-280, 2004; P.Ettmayer et al, рити похідні імідазолу з високою селективністю "Lessons learned from mаrkеted mа investigational відносно підтипів рецепторів CB1/СВ2. prodrugs ", J. Med. Chem., 47, 2393-2404, 2004]. Нами несподівано встановлено, що модифікаПроліки, тобто сполуки, які, потрапивши будь-яким ція вихідної СН2 групи X у відомих імідазолах загашляхом до організму, метаболізуються на сполуки льної формули (І) шляхом введення частини, які формули (1), охоплюються обсягом винаходу. Зомістить атом сірки, дозволяє одержати нові сполукрема, це стосується сполук із первинними чи втоки, у яких селективність відносно підтипів рецепринними амінними або гідроксігрупами. Такі сполуторів СВ1/СВ2 збільшується принаймні у 10 разів, ки здатні реагувати з органічними кислотами, завдяки чому коефіцієнт спорідненості до CB1/СВ2 даючи сполуки формули (1), де присутня додаткостає набагато більше 100. Сполуки загальної фова група, яка легко відщеплюється після введення рмули (І): до організму, наприклад, такі, як амідин, енамін, основа Манніха, похідне гідроксилметилену, похідне О-(ацілоксіметиленкарбамату), карбамату, ефіру, аміду або енамінону. Зокрема, винахід стосується сполук загальної формули (І), де R1 - атом водню або атом хлору, R2 - атом хлору, Y - метильна або етильна група, Z - CH, n представляє 1, 2 або 3, А та X мають значення, наведені вище, та їх та утомерів, стереоізомерів, прекурсорів та фармацевтично прийнятних солей. Більш детально, винахід стосується сполук загальної формули (І), у яких R1 та R2 - атоми хлору, Y - метильна група, Z - CH, n представляє 1, 2 або 3, А та X мають значення, наведені вище, та їх де таутомерів, стереоізомерів, прекурсорів та фар- R1 представляє атом хлору, брому, фтор у мацевтично прийнятних солей. або водню, Загальні шляхи синтезу - R2 представляє атом хлору або брому або Синтез сполук формули (І) показано на схемі CF3 гр упу, 1. Карбонову кислоту загальної формули (II) мож- А представляє атом азоту або CH гр упу, на перетворити на відповідний трет-бутилефір (III). - X представляє атом сірки, абосульфоксид Цей ефір (III) можна обробити сильною ненуклео(S=O), або сульфон (SO2), фільною основою в інертному безводному розчин- Y представляє атом водню або групу метил, нику, а потім провести реакцію з сірковмістною етил, n-пропил, ізопропил, n-бутил, t-бутил, триелектрофільною YSSY, де Y представляє метил, фторметил, феніл, бензил або піриділ, етил, n-пропил, ізопропил, n-бутил, t-бутил, три- Z представляє атом азоту або CH групу, фторметил, феніл, бензил або піриділ, з одержан- n представляє величину 1, 2 або 3, ням сполуки загальної формули (IV). Цю сполуку та їх та утомери, стереоізомери, проліки та загальної формули (IV) можна окислити 1 молярфармацевтично прийнятні солі є новими потужниним еквівалентом мета-хлорпербензойної кислоти ми й селективними відносно CB1/СВ2 антагоністаз одержанням відповідного сульфоксидного анами або зворотніми агоністами рецепторів CB1. лога. Або ж реакцією сполуки загальної формули Усі сульфоксиди у межах цього винаходу міс(IV) з 2 молярними еквівалентами метатять центр хіральності. Винахід охоплює рацемахлорпербензойної кислоти можна перетворити ти, суміші діастереометрів, а також окремі стереосірковмістну частину на відповідну сульфонову ізомери сполук (І). Винахід також стосується E частину. Ефір загальної формули (IV) можна гідізомера, Z ізомера та сумішей Ε/Ζ ізомерів сполук ролізувати, переважно у кислих умовах, у відповіформули (І). дну карбонову кислоту (V). Одержану сполуку заПроліки зазначених сполук також входять до гальної формули (V) можна зв'язати з аміном у обсягу винаходу. Проліки - це лікарські засоби, які присутності активуючого або з'єднувального реане є активними самі по собі, але перетворюються гента й одержати сполуку загальної формули (І), на один або кілька активних метаболитів. Проліки де R1, R2, A, X, Y, Z та n мають вищенаведені знаце біозворотні похідні молекул лікарських засобів, чення. які використовуються для подолання тих чи інших перешкод на користь молекули вихідної речовини. 7 85239 а 8 Реагенти та умови: (a) Boc2O, DMAP, t-BuOH; (b) LDA, THF; (с) YSSY; (d) TFA, CH 2Cl2; (e) похідні аміну, HBTU, DIPEA, CH 3CN, rt; (f) 1 еквівалент m-CPBA, CH 2Cl2, rt; (g) 2 еквіваленти m-СРВА, CH2Cl2, rt Або можна провести реакцію сполуки загальної формули (VI), де R1, R2 , A, Z та n мають вищенаведені значення, з вильною ненуклеофільною основою, наприклад, LDA, в інертному безводному органічному розчиннику, а потім обробити сіркою (S8) або сірковмістною електрофільною YSSY, де Y представляє метил, етил, n-пропил, ізопропил, n-бутил, t-бутил, три фторметил, феніл, бензил або піриділ, з одержанням сполуки загальної формули (І), де X представляє атом сірки, Y представляє атом водню або групу метил, етил, n-пропил, ізопропил, n-бутил, t-бутил, трифторметил, феніл, бензил або піриділ, a R1, R2, A, Z та n мають вищенаведені значення (схема 2). а Реагенти та умови: (a) LDA, Et2O; (b) S8 або YSSY; b) K. Akaji et al., Tetrahedron Lett. (1994), 35,3315-3318; c) F. Albericio et al, Tetrahedron Lett. (1997), 38, 4853-4856]. Вибір конкеретного шляху синтезу залежить від факторів, відомих фахівцям, наприклад, сумісності функціональних груп із застосованими реагентами, можливостями захисту функціональних груп, каталізаторів, активуючих або з'єднувальних Додаткові дані про способи активування або зв'язування амінів з карбоновими кислотами можна знайти у: [a) M. Bodanszky та A. Bodanszky: The Practice Peptide Synthesis, Springer-Verlag, New York, 1994; ISBN: 0-387-57505-7; 9 85239 10 реагентів та особливостей структури цільових роба Альцгеймера, хвороба Гантінгтона, синдром сполук, що їх треба одержати. Туретта, мозкова ішемія, мозкова апоплексія, чеФармацевтично прийнятні солі можна одержурепно-мозкова травма, пошкодження хребта, нейвати відомими способами, наприклад, змішуванрозапалювальні розлади, бляшковий склероз, віням сполук за винаходом з відповідною кислотою, русний енцефаліт, розлади, пов'язані з неорганічною чи органічною. деміелінізацією, а також для лікування больових Фармацевтичні препарати розладів, включаючи невропатичні больові розлаСполукам за винаходом можна надати форми, ди, та інших захворювань, пов'язаних з нейротранпридатної для введення, відомими способами із смісією канабіноїдів, включаючи септичний шок, застосуванням допоміжних речовин, наприклад, глаукому, рак, діабет, блювання, нудоту, астму, рідких або твердих носіїв. Фармацевтичні компореспіраторні захворювання, шлунково-кишкові зиції за винаходом можна вводити ентерально, розлади, виразку шлунку, діарею, статеві розлади, орально, парентерально (внутрішньом'язово або розлади координації рухів та серцево-судинні розвнутрішньовенно), ректально або локально. Вони лади. можуть мати форму розчинів, порошків, таблеток, Та обставина, що сполуки за винаходом здатні капсул (у тому числі мікрокапсул), мазей (кремів чи модулювати рецептори канабіноїдів, робить їх гелів) або супозиторіїв. До складу таких композиособливо придатними при лікуванні опасистості, цій можуть входити звичайні рідкі або тверді напопідліткової опасистості та спричиненою наркотивнювачі, розчинники, емульгатори, мастила, смаками опасистості, зокрема, у сполученні з інгібітокові добавки, фарбники та/або буферні речовини. рами ліпази. Серед сполук, що можуть застосовуСеред найчастіше застосованих допоміжних речоватися у таких комбінованих препаратах, можна вин можна навести карбонат магнію, діоксид титанавести, зокрема, орлістат (синтетичний інгібітор ну, лактозу, манітол або інші сахари або цукрові ліпази), інгібітори ліпази, виділені з мікроорганізспирти, тальк, молочний білок, желатин, крохмаль, мів, як ліпстатин (із Streptomyces toxytricini), ебецелюлозу та її по хідні, тваринні масла, рослинні лактон В (із Streptomyces aburaviensis), синтетичні олії, наприклад, риб'ячий жир, соняшникову, арахіпохідні цих сполук, а також екстракти рослин, які сову або кунжутну олію, поліетиленгліколь та розздатні інгібувати ліпазу, наприклад, екстракти чинники, наприклад, стерильну воду, одно-чи баAlpinia qfficinarum або сполуки, виділені з таких гатоатомні спирти, як гліцерин. екстрактів, як 3-метилетергалангін (з A. Сполуки за винаходом звичайно вводять у виqfficinarum). гляді фармацевтичних композицій, які становлять Фармакологічні методи новий та важливий аспект винаходу завдяки приСпорідненість до рецепторів канабіноїдів CB1 сутності сполук, а саме нових сполук, описаних in vitro тут. Серед видів фармацевтичних композицій моСпорідненість сполук за винаходом до рецепжна навести, зокрема, таблетки, жуйні таблетки, торів канабіноїдів CB1 можна визначити за допокапсули, розчини, парентеральні розчини, супозимогою препаратів з мембран клітин яєчників киторії, суспензії та інші, які описані тут або є очевитайського хом'яка (ЯКХ), у яких людський дні для фахівця на підставі опису винаходу та рецептор канабіноїдів CB1 стабільно трансфектупрофесійних знань. Винахід також охоплює одерється у зв'язку з [3Н]СР-55,940 як радіоліганд. Пісжання або виробництво таких фармацевтичних ля інкубування свіжоприготовлених препаратів композицій. клітинних мембран з [3H]-лігандом, з доданням Для здійснення винаходу передбачений фарсполук за винаходом або без них, розділяють фімацевтичний набір або пачка, що містить одну або льтрацією крізь фільтри зі скловолокна зв'язані та кілька вмістищ (контейнерів), заповнених одним вільні ліганди. Радіоактивність фільтра вимірюють або кількома компонентами фармацевтичної комлічильником сцинтиляцій у рідині. позиції згідно з винаходом. До такого вмістища Спорідненість до рецепторів канабіноїдів СВ2 (вмістищ) можуть додаватися друковані матеріали, in vitro наприклад, інструкція із вживання або нотатка за Спорідненість сполук за винаходом до рецепформою, передбаченою державним органом, який торів канабіноїдів СВ2 можна визначити за допоконтролює виробництво, застосування або продаж могою препаратів з мембран клітин яєчників кифармацевтичних продуктів, причому ця нотатка тайського хом'яка (ЯКХ), у яких людський означає затвердження таким органом виробництрецептор канабіноїдів СВ2 стабільно трансфектува, застосування або продажу композиції для люється у зв'язку з [3Н]СР-55,940 як радіоліганд. Пісдей або тварин. ля інкубування свіжоприготовлених препаратів Завдяки потужній антагоністичній або зворотклітинних мембран з [3H]-лігандом, з доданням ній агоністичній дії щодо CB1 сполуки за винахосполук за винаходом або без них, розділяють фідом можуть використовуватися для лікування псильтрацією крізь фільтри зі скловолокна зв'язані та хічних захворювань, як от психоз, бентежність, вільні ліганди. Радіоактивність фільтра вимірюють депресія, дефіцит уваги, розлади пам'яті, розлади лічильником сцинтиляцій у рідині. розуміння, розлади апетиту, опасистість, зокрема, Антагонізм до рецепторів канабіноїдів CB1 in підліткова та спричинена наркотиками, алкоголізм, vitro гіперсексуальність, наркозалежність, нервових Антагонізм до рецепторів CB1 in vitro визначарозладів, як нейродегенеративні розлади, слабоють на людському рецепторі; CB1, клонованому в умство, дистонія, м'язова крепатура, дрижавка, клітинах яєчника китайського хом'яка (ЯКХ). Клітиепілепсія, розсіяний склероз, травматичне пошкони ЯКХ вирощують у модифікованому за Дульбекдження мозку, інсульт, хвороба Паркінсона, хвоко середовищі Ігла (DMEM) з доданням 10% інак 11 85239 12 тивованої нагріванням сироватки телячого зарод(16.83г, 98 % вихід), точка топлення 138-142°C ку. Середовище відсмоктують і заміняють DMEM, (розклад); 1Н-ЯМР (600МГц, DMSO-d6) d 7.08 (br d, до якої замість сироватки телячого зародку додана J=8Гц, 2Н), 7.31-7.37 (m, 4H), 7.45 (d, J=8Гц, 1H), [3Н]-арахідонова кислота, та інкубують усю ніч у 7.96 (s, 1H); 13С-ЯМР (150МГц, DMSO-d6) d 126.87, пічці з культурою клітин (5% СО2/95% повітря; 127.85, 127.91, 128.47, 129.36, 129.66, 133.56, 37°C; атмосфера насичена водою). Протягом цьо133.99, 134.44, 134.49, 135.54, 135.99, 143.77, го часу [3H]-арахідонова кислота вкорінюється до 163.67. фосфоліпідів мембран. У день випробування сеTрет-бутил-1-(4-хлорфеніл)-2-(2,4редовище відсмоктують і тричі промивають клітидіхлорфеніл)-1H-імідазол-4-карбоксилат ни 0.5мл DMEM з вмістом 0.2% альбуміну сироваДо магнітно перемішаної суміші 1-(4тки бика (BSA). Стимуляція рецепторів CB1 WIN хлорфеніл)-2-(2,4-діхлорфеніл)-1H-імідазол-455,212-2 призводить до активації PLA2 з наступним карбонової кислоти (20.77г, 0.0565моля) та Boc2O виділенням [3Н]-арахідонової кислоти до середо(24.63г, 0.113моля) у t-BuOH (275мл) додають вища. Цьому спричиненому WIN 55,212-2 виділенDMAP (2.07г, 0.017моля) та одержану суміш переню протидіють у залежності від концентрації антамішують 16 годин. Після концентрування у вакуумі гоністи рецептора CB1. додають толуол та знову концентрують суміш. Дозування Осад очищують колонковою хроматографією Спорідненість сполук за винаходом до рецеп(СН2Сl2/ацетон=95/5 (обс.)) та перекристалізують з торів CB1 визначають, як описано вище. З пов'язудіізопропилетеру, одержуючи трет-бутил-1-(4вальної спорідненості, виміряної для даної сполухлорфеніл)-2-(2,4-діхлорфеніл)-1H-імідазол-4ки формули (1), можна теоретично визначити карбоксилат (15.75г, 66 % вихід), точка топлення мінімальну ефективну дозу. При концентрації спо178-180°C; 1Н-ЯМР (200МГц, CDCl3) d 1.63 (s, 9H), луки, яка удвічі перевищує виміряну величину Ki, 7.05 (br d, J~8Гц, 2Н), 7.25-7.37 (m, 4H), 7.52 (d, вірогідно, що сполука займе 100% рецепторів каJ=8Гц, 1H), 7.80 (s, 1H). набіноідів. Перерахунком цієї концентрації у мг Tрет-бутил-1-(4-хлорфеніл)-2-(2,4сполуки на кг маси тіла хворого одержують теоредіхлорфеніл)-5-метилсульфаніл-1H-імідазол-4тичну мінімальну діючу дозу, виходячи з ідеальної карбоксилат біозасвоюваності. З фармакокінетичних, фармакоДо охолодженого (-20°C) та магнітно перемідинамічних та інших міркувань фактичну дозу мошаного розчину трет-бутил-1-(4-хлорфеніл)-2-(2,4жна зменшува ти чи збільшува ти. Доцільні дози діхлорфеніл)-1H-імідазол-4-карбоксилату (10.59г, знаходяться у межах 0.001-1000мг/кг, переважно 25.0ммолів) у безводному THF (100мл) додають 0.1-100мг/кг маси тіла хворого. LDA (15.0мл, 2M розчин у гептані/THF, Приклади 30.0ммолів), а одержану суміш перемішують 1 Приклад 1: Матеріали та методики годину в а тмосфері N2. Додають розчин (CH3S)2 ЯМР-спектри 1H та 13C визначають на приладі (2.7мл, 30.0ммолів) у THF (20мл), одержаний розBruker Avance DRX600 (600МГц), Varian UN400 чин послідовно перемішують при -40°C 1 годину, (400МГц) або Varian VXR200 (200МГц) з розчиннидають нагрітися до кімнатної температури та пеками DMSO-d6 або CDCl3 та внутрішнім еталоном ремішують 16 годин. Додають насичений водний тетраметилсиланом. Хімічні зсуви виражають у розчин NH4CI (250мл) та двічі екстрагують етилач.на млн. (шкала d) відносно тетраметилсилану. цетатом (EtOAc). Органічні фази з'єднують, проКонстанти взаємодії (J) виражають у Гц. Випарюмивають водою, сушать над MgSO4 , фільтрують та вальну хроматографію провадять з силікагелем 60 концентрують, одержуючи трет-бутил 1-(4(0.040-0.063мм, фірми Merck). Колонкову хроматохлорфеніл)-2-(2,4-діхлорфеніл)-5-метилсульфанілграфію провадять з силікагелем 60 (0.0631H-імідазол-4-карбоксилат з виходом 90% вихід у 0.200мм, фірми Merck). Точки топлення визначавигляді олії, яка повільно твердішає; 1Н-ЯМР ють на спеціальному приладі Büchi B-545. Мас(200МГц, CDCl3) d 1.66 (s, 9H), 2.28 (s, 3H), 7.05 (br спектри визначають на приладі Micromass QTOF-2 d, J~8Гц, 2Н), 7.25 (dd, J=8 та 2Гц, 1H), 7.28 (d, з використанням програмного забезпечення J=2Гц, 1H), 7.32-7.41 (m, 3H). MassLynx для збирання та відтворення даних. Tрет-бутил-1-(4-хлорфеніл)-2-(2,4Здійснюють точні вимірювання маси квазімолекудіхлорфеніл)-5-метилсульфоніл-1H-імідазол-4лярного іона [М+Н]+. карбоксилат Приклад 2: Синтез окремих сполук До магнітно перемішаного розчину трет-бутилСполуки 1-3 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-51-(4-хлорфеніл)-2-(2,4діхлорфеніл)-1Hметилсульфаніл-1H-імідазол-4-карбоксилату імідазол-4-карбонова кислота (6.00г, 12.8ммолів) у СН 2Сl2 (25мл) повільно додаДо магнітно перемішаного розчину етил-1-(4ють розчин m-СРВА (6.90г, міцність 70%, хлорфеніл)-2-(2,4-діхлорфеніл)-1Н-імідазол-40.282моля) у СН 2Сl2 та одержану суміш перемішукарбоксилату (18.44г, 0.0466моля) у THF (240мл) ють 16 годин. Ракуційну суміш двічі промивають додають LiOH (2.24г, 0.0932моля) та Н2О (240мл). розчином 2N NaOH, сушать над Na2SO4, фільтруОдержану суміш перемішують при 50°C 16 годин, ють та концентрують. Осад очищують випарюваодержуючи прозорий розчин. Після охолодження льною хроматографією (Еt2 О/петролейний до кімнатної температури, додають HCl (1N розетер=2/1 (обс.)), одержуючи трет-бугил 1-(4чин, 95мл) та Н2О (240мл), одержуючи осад, який хлорфеніл)-2-(2,4-діхлорфеніл)-5-метилсульфонілвідфільтровують, промивають водою та сушать у 1Н-імідазол-4-карбоксилат (4.76г, 74 % вихід) як вакуумі, одержуючи 1-(4-хлорфеніл)-2-(2,4білу тверду масу, точка топлення 130°C; 1Н-ЯМР діхлорфеніл)- 1H-імідазол-4-карбонову кислоту (400МГц, CDCl3) d 1.66 (s, 9Н), 3.34 (s, 3H), 7.15 (br 13 85239 14 d, J~8Гц, 2Н), 7.20-7.26 (m, 2H), 7.32-7.41 (m, 3H). Подібним чином готують трет-бутил 1-(4хлорфеніл)-2-(2,4-діхлорфеніл)-5-метилсульфініл1H-імідазол-4-карбоксилат реакцією з 1 молярним еквівалентом m-CPBA замість двох молярних еквівалентів; 1Н-ЯМР (400МГц, CDCl3) d 1.64 (s, 9H), 2.94 (s, 3H), 7.20-7.36 (m, 7H). 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5метилсульфоніл-1H-імідазол-4-карбонова кислота До магнітно перемішаного розчину трет-бутил1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5метилсульфоніл-1H-імідазол-4-карбоксилату (4.76г, 9.49ммолів) у СН 2Сl2 (60мл) додають з надПодібним чином одержують: 1-(4-хлорфеніл)лишком TFA (9.40мл, 0.2124моля) та Et3SiH 2-(2,4-діхлорфеніл)-5-метилсульфоніл-N(3.8мл, 0.0238моля). Після 16 годин реакції при (циклогексил)-1H-імідазол-4-карбоксамід (сполука кімнатній температурі розчин концентрують у ва2). Точка топлення: 191-192°C. куумі. Додають воду, одержаний осад відфільтровують та сушать, одержуючи 1-(4-хлорфеніл)-2(2,4-діхлорфеніл)-5-метилсульфоніл-1H-імідазол4-карбонову кислоту із 100% виходом, точка топлення ~130°C (розклад); 1Н-ЯМР (400МГц, CDCl3) d 3.45 (s, 3H), 3.50 (br s, 1H), 7.40 (br d, J~8Гц, 2H), 7.42 (dd, J=8 та 2Гц, 1H), 7.50 (br d, J~8Гц, 2H), 7.59 (d, J=2Гц, 1H), 7.61 (d, J=8Гц, 1H). Подібним чином одержують 1-(4-хлорфеніл)-2-(2,4діхлорфеніл)-5-метил-сульфініл-1Н-імідазол-4карбонову кислоту. 1Н-ЯМР (400МГц, CDCl3) d 2.99 (s, 3H), 7.37-7.60 (m, 7H), 13.20 (br s, 1H). 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5метилсульфоніл-N-(піперидин-1-іл)-1H-імідазол-4карбоксамід (сполука 1) Подібним чином одержують: 1-(4-хлорфеніл)До магнітно перемішаної суспензії 1-(42-(2,4-діхлорфеніл)-5-метилсульфініл-Nхлорфеніл)-2-(2,4-діхлорфеніл)-5-метилсульфоніл(піперидин-1-іл)-1H-імідазол-4-карбоксамід (сполу1H-імідазол-4-карбонової кислоти (2.23г, ка 3). Точка топлення: 218-221°C. 5.01ммолів) у безводному CH3CN (50мл) послідовно додають N,N-діізопропилетиламін (основу Гуніга) (1.90мл, 11.0ммолів), О-бензотриазол1-1-ілN,N,N',N'-тетраметилуронійгексафторфрсфат (HBTU) (2.27г, 5.99ммолів) та 1-амінопіперидин (0.65мл, 6.03ммолів). Після 16 годин перемішування одержану суміш концентрують у вакуумі. Осад розчиняють в EtOAc, послідовно промивають водним розчином NaHCO3, водою та розсолом, сушать над Na2SO4, фільтрують та концентрують, одержуючи тверду масу. Її очищують випарювальною хроматографією (силікагель, EtOAc) та розтирають з метил-трет-бутилетером, одержуючи 1-(4хлорфеніл)-2-(2,4-діхлорфеніл)-5-метилсульфонілN-(піперидин-1-іл)-1H-імідазол-4-каробоксамід з Сполуки 4-5 виходом 84%, точка топлення 181-185°C (розРацемічний 1-(4-хлорфеніл)-2-(2,4клад); 1Н-ЯМР (600МГц, DMSO-d6) d 1.35-1.41 (m, діхлорфеніл)-5-метилсульфініл-N-(піперидин-1-іл)2H), 1.61-1.66 (m, 4H), 2.80-2.84 (m, 4H), 3.52 (s, 1H-імідазол-4-карбоксамід (сполука 3, 3.86г, 3H), 7.38 (d, J=8Гц, 2Н), 7.42 (dd, J=8 та 2Гц, 1H), 0.0075моля) розділяють на його енантиомери (-)-17.46 (d, J=8Гц, 2Н), 7.57 (d, J=2Гц, 1H), 7.62 (d, (4-хлорфеніл)-2-(2,4-діхлорфеніл)-5J=8Гц, 1H), 9.40 (s, 1H); HRMS (C 22H22Cl3N4O3S) метилсульфініл-N-(піперидин-1-іл)-1H-імідазол-4[М+Н]+: виміряна m/z 527.0469, розрахована карбоксамід (сполука 4, 1.3г) ([(a D25]=-19°, с=0.94 527.0478. (г/100мл розчинника), метанол; надлишок енантіомера 97.2%: Точка топлення: 242-244°C) та (+)-1(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5метилсульфініл-N-(піперидин-1-іл)-1H-імідазол-4карбоксамід (сполука 5, 1.4г) ([a D25]=+23°, с=0.94 (г/100мл розчинника), метанол; надлишок енантіомера 99.5%:Точка топлення: 243-245°C) відповідно шляхом препаративної рідинної високоефективної хроматографії із хіральною стаціонарною 15 85239 16 фазою Chiralpak AD 20мкм. Рухома фаза містить Подібним чином одержують: 1-(4-хлорфеніл)суміш 25% етанолу з гептаном (25/75 (обс.)). 2-(2,4-діхлорфеніл)-5-метилсульфаніл-NСполуки 6-11 (циклогексил)-1H-імідазол-4-карбоксамід (сполука 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-57). Точка топлення: 152-154°C. метилсульфаніл-1H-імідазол-4-карбонова кислота До магнітно перемішаного розчину трет-бутил 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5метилсульфаніл-1H-імідазол-4-карбоксилату (4.00г, 8.53ммолів) у СН 2Сl2 (60мл) додають з надлишком TFA (8.40мл, 0.111моля). Реакцію ведуть при кімнатній температурі 16 годин, після чого концентрують розчин у вакуумі. Додають воду, одержаний осад відфільтровують та сушать, одержуючи 1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5метилсульфаніл-1H-імідазол-4-карбонову кислоту з 98% виходом, точка топлення ~100°C (розклад); 1 Н-ЯМР (400МГц, CDCl3) d 2.41 (s, 3H), 3.60 (br s, 1H), 7.08 (br d, J~8 Гц, 2Н), 7.26 (dd, J=8 та 2Гц, Подібним чином одержують: 1-(4-хлорфеніл)1H), 7.30 (d, J=8Гц, 1H), 7.35 (d, J=2Гц, 1H), 7.37 2-(2,4-діхлорфеніл)-5-етилсульфаніл-N(brd, J~8Гц, 2H). (піперидин-1-іл)-1H-імідазол-4-карбоксамід (сполу1-(4-хлорфеніл)-2-(2,4-діхлорфеніл)-5ка 8). 1Н-ЯМР (400МГц, CDCI3) d 1.09 (t, J=7Гц, метилсульфаніл-N-(піперидин-1-іл)-1H-імідазол-43H), 1.40-1.48 (m, 2H), 1.72-1.80 (m, 4H), 2.84-2.92 карбоксамід (сполука 6) (m, 4H), 3.00 (q, J=7Гц, 2H), 7.03 (dt, J=8 та 2Гц, До магнітно перемішаної суспензії 1-(42H), 7.23-7.35 (m, 5H), 8.02 (br s, 1H). хлорфеніл)-2-(2,4-діхлорфеніл)-5-метилсульфаніл1H-імідазол-4-карбонової кислоти (1.72г, 4.16ммолів) у безводному CH3CN (45мл) послідовно додають N,N-діізопропилетиламін (основу Гуніга) (1.60мл, 9.20ммолів), О-бензотриазол-1-ylN,N,N',N'-тетраметилуронійгексафторфосфат (HBTU) (1.89г, 4.99ммолів) та 1-амінопіперидин (0.54мл, 5.01ммолів). Після 40 годин перемішування додають воду та екстрагують одержану суміш діхлорметаном. Діхлорметанову фазу двічі промивають розчином 1N HCl та водою, сушать над MgSO4 , фільтрують та концентрують, одержуючи сиру олію. її очищують випарювальною хроматографією (силікагель, EtOAc) та розтирають з діетилетером, одержуючи 1-(4-хлорфеніл)-2-(2,4Подібним чином одержують: 1-(4-хлорфеніл)діхлорфеніл)-5-метилсульфаніл-N-(піперидин-12-(2,4-діхлорфеніл)-5-метилсульфаніл-Nіл)-1H-імідазол-4-карбоксамід з виходом 72%, точ(піролідин-1-іл)-1Н-імідазол-4-карбоксамід (сполука топлення 170°C (розклад); 1Н-ЯМР (600МГц, ка 9): Точка топлення: 158°C. DMSO-d6) d 1.35-1.42 (m, 2H), 1.62-1.67 (m, 4H), 2.35 (s, 3H), 2.80-2.84 (m, 4H), 7.29 (d, J=8Гц, 2H), 7.42 (dd, J=8 та 2Гц, 1H), 7.45 (d, J=8Гц, 2H), 7.52 (d, J=2Гц, 1H), 7.62 (d, J=8Гц, 1H), 8.90 (s, 1H); 13СЯМР (150МГц, DMSO-d6) d 19.26, 23.32, 25.63, 55.98, 127.52, 128.61, 129.14, 129.23, 129.86, 130.12, 130.18, 133.86, 134.45, 134.66, 136.01, 137.12, 144.04, 158.98; HRMS (C22H22Cl3N4OS) [М+Н]+: виміряна m/z 495.0592, розрахункова 495.0580. Подібним чином одержують: 1-(4-хлорфеніл)2-(2,4-діхлорфеніл)-5-метилсульфаніл-N-(азепан1-іл)-1Н-імідазол-4-карбоксамід (сполука 10). 1НЯМР (400МГц, CDCl3) d 1.63-1.68 (m, 4H), 1.74-1.81 (m, 4H), 2.42 (s, 3H), 3.17-3.22 (m, 4H), 7.04 (dt, J=8 та 2Гц, 2Н), 7.23-7.36 (m, 5H), 8.50 (br s, 1H). 17 85239 18 1мл 1% водного розчину метилцелюлози у воді та 2% (обс.) Poloxamer 188 (Lutrol F68) сполуку піддають вихровому суспендуванню протягом 10 хвилин. Доводять рН до 7 кількома краплинами водного розчину NaOH (0.1N). Решту часток у суспензії додатково суспендують на ультразвуковій бані. Для внутрішньочеревного (i.p.) введення: до потрібної кількості (0.5-15мг) твердої сполуки 1 у скляній трубці додають скляні кульки та піддають суміш вихровому помелу протягом 2 хвилин. Після додання 1мл 1% водного розчину метилцелюлози та 5% маннітолу у воді сполуку піддають вихровоПодібним чином одержують: 1-(4-хлорфеніл)му суспендуванню протягом 10 хвилин. Нарешті, 2-(2,4-діхлорфеніл)-5-метилсульфаніл-Nдоводять рН до 7. (піперидин-1-іл)-1H-імідазол-4-карбоксамід (сполуПриклад 5: Результати фармакологічних дока 11). Точка топлення: 192-193°C. сліджень У таблиці наведені деякі дані про спорідненість до рецепторів CB1/СВ2 (середні результати щонайменше трьох незалежних дослідів, проведених за процедурою, що описана нижче) відомих сполук та представницьких сполук за винаходом. Ці дані ілюструють вплив на селективність відносно рецепторів CB1/2 структурної модифікації, що становить основу цього винаходу: нові сполуки зберігають високу спорідненість до рецепторів CB1, водночас їх спорідненість до рецепторів CB2 дуже суттєво зменшена. Сполуки у таблиці мають таку загальну структурну формулу: Окремі сполуки, синтез яких описано вище, лише докладніше ілюструють винахід і ніяким чином не обмежують його обсяг. Фахівцеві очевидні інші варіанти здійснення винаходу на підставі цього опису та практики втілення описаного винаходу. Отже, опис та приклади наводяться лише для більшої наочності. Приклад 4: Композиції для дослідів на тваринах Для орального (р.о.) введення: до потрібної кількості (0.5-5мг) твердої сполуки 1 у скляній трубці додають скляні кульки та піддають суміш вихровому помелу протягом 2 хвилин. Після додання Таблиця Спорідненість до рецепторів CB1 та CB2 відомих сполук (позиції 1 та 2) та представницьких сполук за винаходом (позиції 3-6) Позиція Відома сполука Відома сполука Сполука 6 Сполука 1 Сполука 9 Сполука 10 X CH2 CH2 S SO2 S S Y H CH3 CH3 CH3 CH3 CH3 Комп’ютерна в ерстка О. Гапоненко n 2 2 2 2 1 3 CB1 (nM) 30 14 12 12 5 7 CB2 (nM) 608 430 2,057 7,652 >1,000 >1,000 Підписне Співвідношення CB1/СВ2 20 31 171 638 >200 >142 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюTetrasubstituted imidazole derivatives as cannabinoid cb1 receptor modulators with a high cb1/cb2 receptor subtype selectivity
Автори англійськоюLange Josephus H. M., Wals Henderik C., Kruse Cornelis G.
Назва патенту російськоюТетразамещенные производные имидазола как модуляторы рецепторов канабиноидов св1 с высокой селективностью подтипов рецепторов св1/св2
Автори російськоюЛанге Йозефус Г.М., Валс Хендерик С., Крузе Корнелис Г.
МПК / Мітки
МПК: C07D 233/90, A61P 25/00, A61K 31/4164, A61K 31/454
Мітки: тетразаміщені, імідазолу, похідні, модулятори, підтипів, рецепторів, св1, канабіноїдів, селективністю, високою
Код посилання
<a href="https://ua.patents.su/9-85239-tetrazamishheni-pokhidni-imidazolu-yak-modulyatori-receptoriv-kanabinodiv-sv1-z-visokoyu-selektivnistyu-pidtipiv-receptoriv-sv1-sv2.html" target="_blank" rel="follow" title="База патентів України">Тетразаміщені похідні імідазолу як модулятори рецепторів канабіноїдів св1 з високою селективністю підтипів рецепторів св1/св2</a>