Поліетиленгліколь-g-csf кон’югат
Номер патенту: 93284
Опубліковано: 25.01.2011
Автори: Кім Вьонг-Мун, Янг Хіе-Ін, Йоо Вун-Йонг, Джеон Хьюн-Кюю, Чоі Юн-Кюю, Йоо Му-Хі, Йо Єонг-Ву, Канг Су-Хьюнг, Лі Сунг-Хі
Формула / Реферат
1. Триланцюговий PEG-G-CSF кон'югат, що має формулу (1):
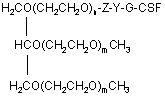 , (1)
, (1)
де відношення зв'язування триланцюгового поліетиленгліколю (PEG) із G-CSF (гранулоцитарний колонієстимулюючий фактор) становить 1:1 (мол/мол), a PEG має середню молекулярну масу від 200 до 45,000 дальтон,
де
n являє собою ціле число від 1 до 1,000;
m являє собою ціле число від 10 до 1,000;
Z являє собою (CH2)s чи (CH2)sNHCO(CH2)s як лінкер G-CSF та PEG, де S являє собою ціле число від 1 до 6; Y являє собою амідний зв'язок, утворений шляхом сполучення NH2 функціональної групи у G-CSF та функціональної групи похідного PEG.
2. Кон'югат за пунктом 1, де PEG має середню молекулярну масу від 20,000 до 45,000 дальтон.
3. Кон'югат за пунктом 1, де PEG має середню молекулярну масу від 23,000 до 43,000 дальтон.
4. Спосіб одержання кон'югата триланцюгового PEG-G-CSF загальної формули (1) за пунктом 1, при якому здійснюють реакцію з утворенням ковалентного зв'язку між похідним триланцюгового PEG наступної загальної формули (2) та G-CSF (гранулоцитарний колонієстимулюючий фактор), де PEG (поліетиленгліколь) має середню молекулярну масу від 200 до 45,000 дальтон,
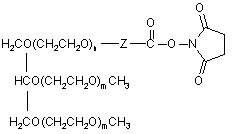 , (2)
, (2)
де
n являє собою ціле число від 1 до 1,000;
m являє собою ціле число від 10 до 1,000;
Z являє собою (CH2)s чи (CH2)sNHCO(CH2)s як лінкер G-CSF та PEG, де s являє собою ціле число від 1 до 6; та
функціональна група що хімічно реагує з протеїнами та пептидами, що містять G-CSF (гранулоцитарний колонієстимулюючий фактор), являє собою N-гідросукцинімід.
5. Спосіб за пунктом 4, де PEG має середню молекулярну масу від 20,000 до 45,000 дальтон.
6. Спосіб за пунктом 4, де PEG має середню молекулярну масу від 23,000 до 45,000 дальтон.
7. Спосіб за пунктом 4, де молекулярне відношення G-CSF до похідного триланцюгового PEG становить від 1: 0,5 до 1: 50.
8. Спосіб за пунктом 7, де молекулярне відношення G-CSF до похідного триланцюгового PEG у реакції становить від 1: 0,5 до 1: 5.
9. Фармацевтична композиція для лікування чи профілактики симптомів, спричинених зниженою гематопоетичною функцією та зниженою імунологічною функцією, що містить кон'югат за будь-яким з пунктів 1, 2 чи 3 як ефективний інгредієнт.
10. Фармацевтична композиція за пунктом 9, де симптомами, спричиненими зниженою гематопоетичною функцією та зниженою імунологічною функцією є твердий рак, нейтропенії, спричинені хіміотерапією раку та кров'яних пухлин, нейтропенії, спричинені мієлодисплазійним синдромом, нейтропенії, спричинені апластичною анемією, вроджені ідіопатичні нейтропенії та нейтропенії, спричинені лікуванням вірусу імунодефіциту людини.
11. Спосіб лікування нейтропенії, профілактики нейтропенії, сприяння підвищенню кількості нейтрофілів під час мобілізації гематопоетичних стовбурових клітин у периферичній крові та трансплантації гематопоетичних стовбурових клітин, при якому вводять кон'югат за будь-яким з пунктів 1, 2 чи 3 як ефективний інгредієнт.
Текст
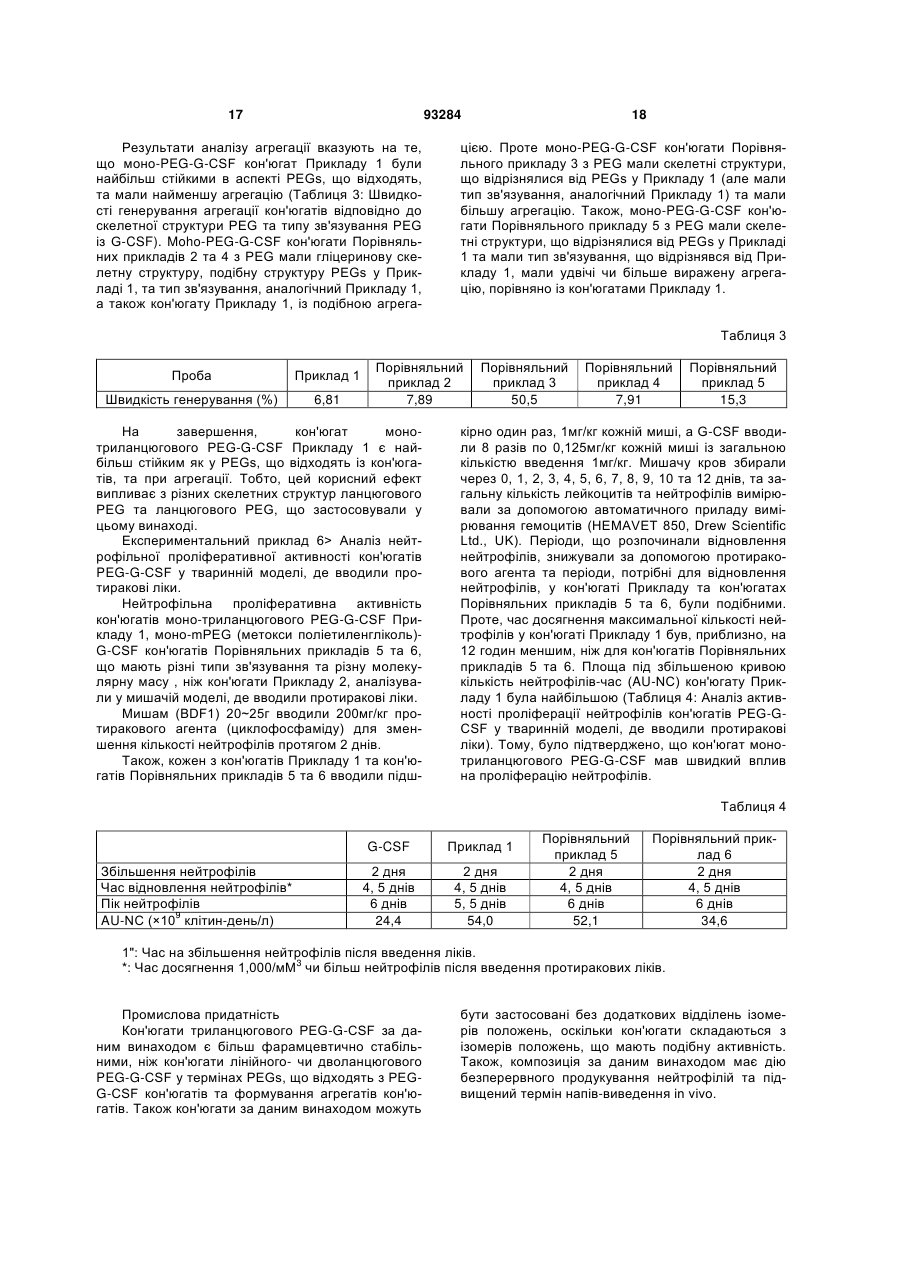
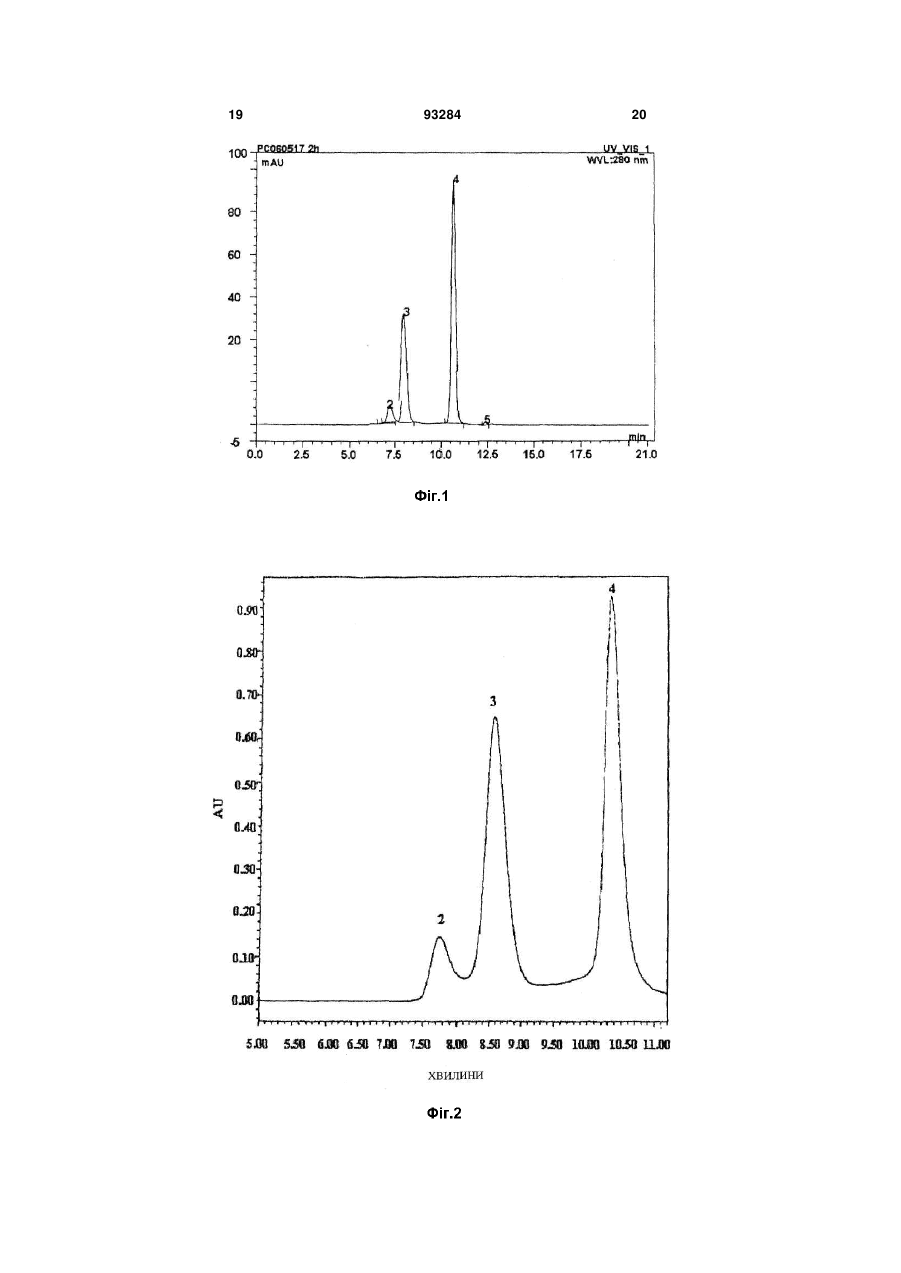
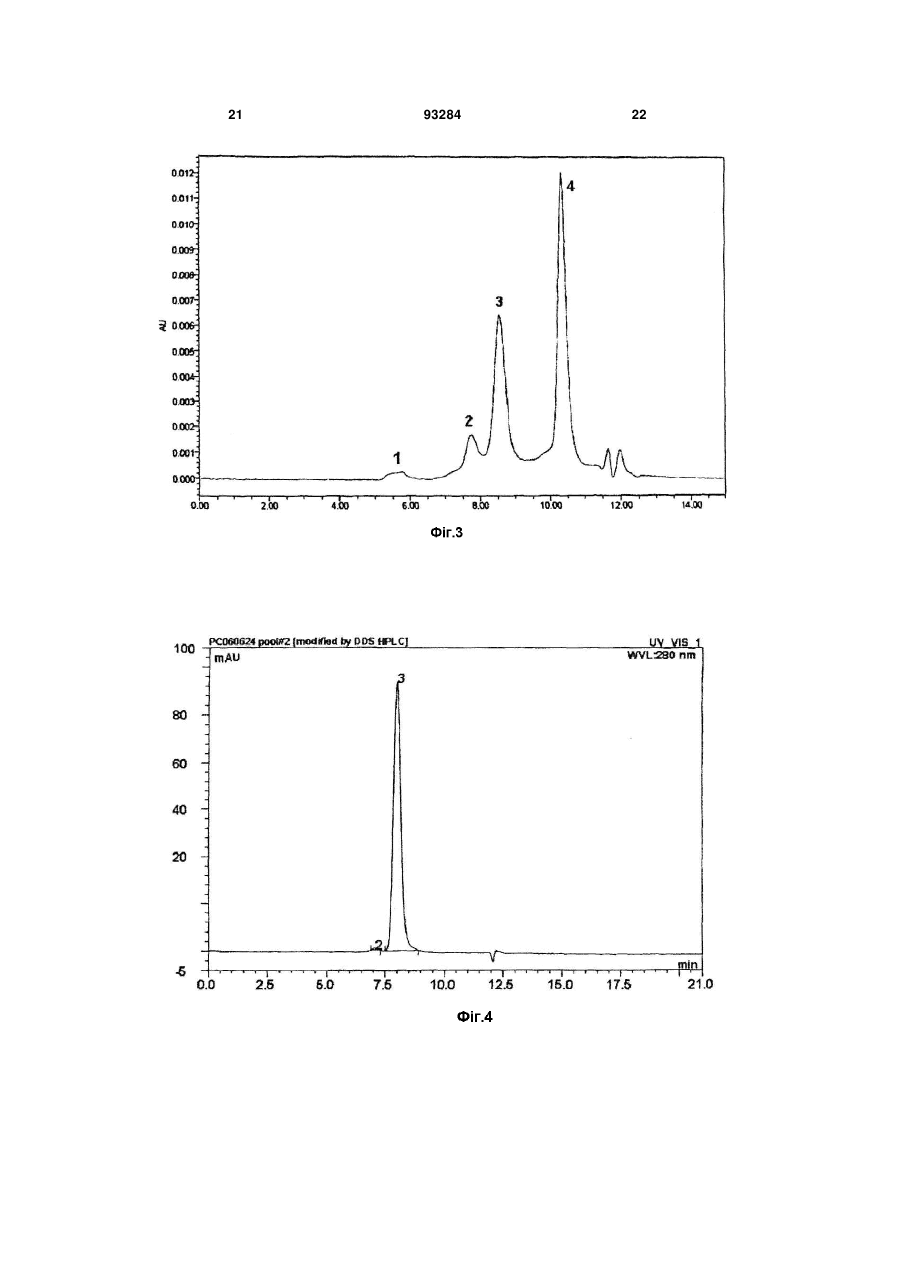
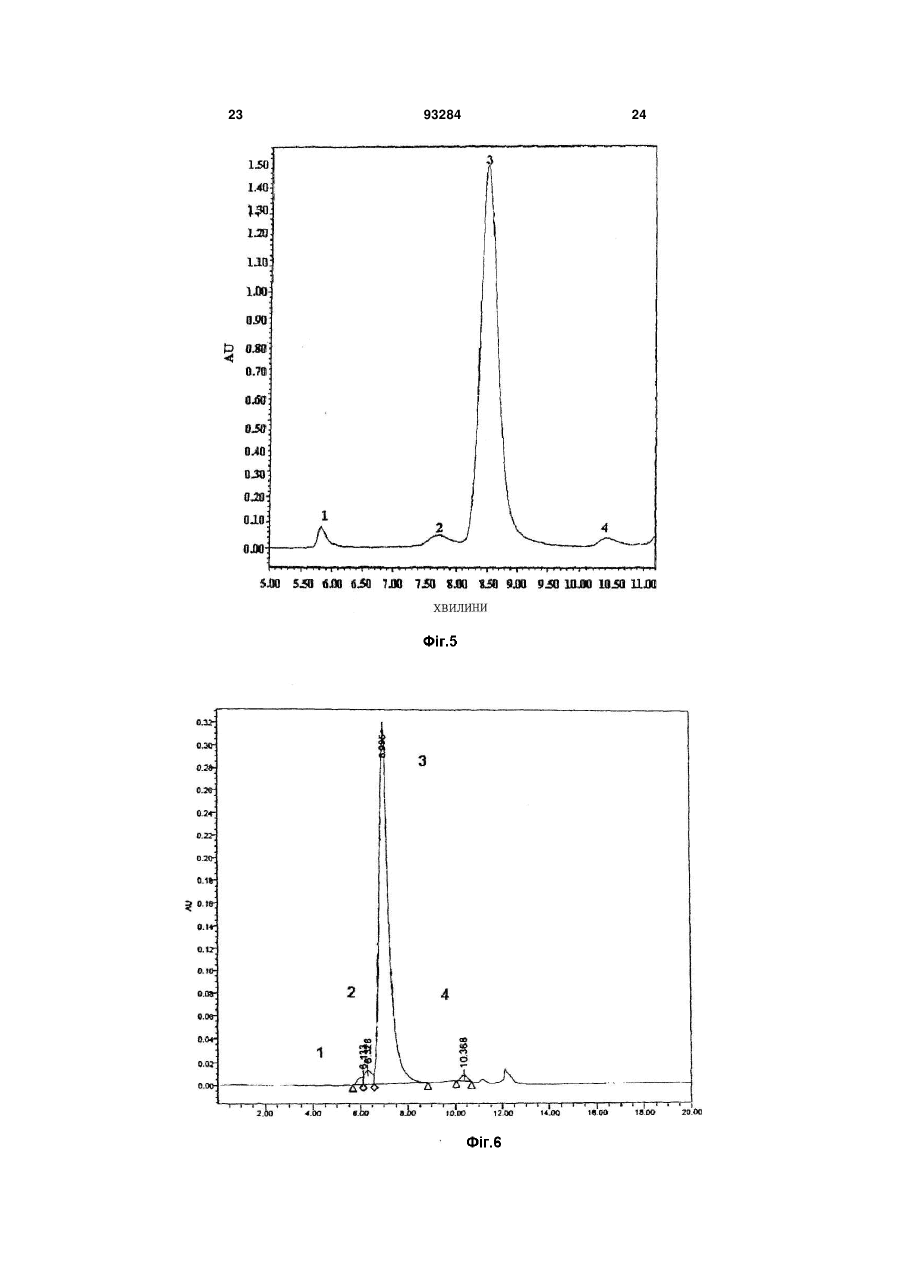
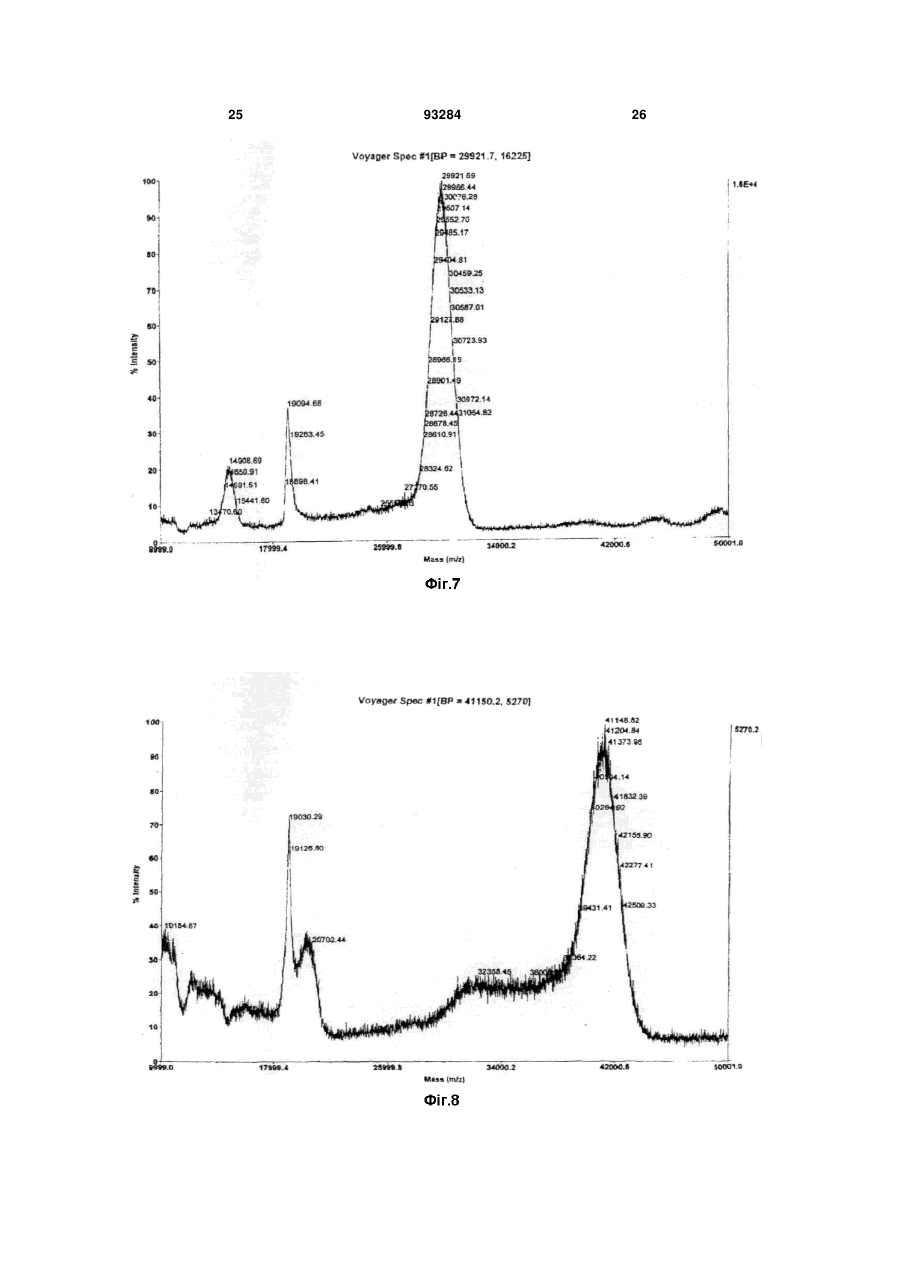
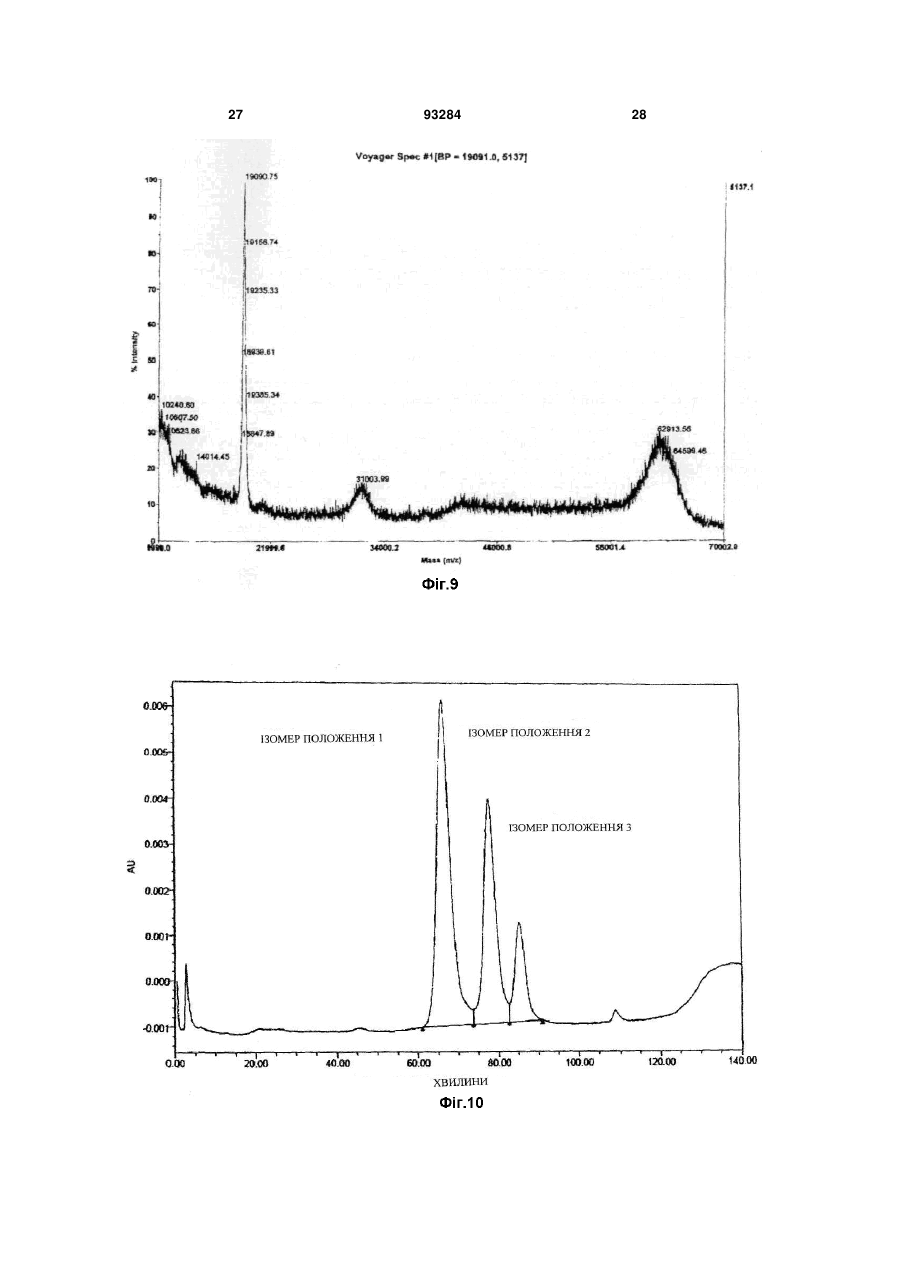
1. Триланцюговий PEG-G-CSF кон'югат, що має формулу (1): H2CO(CH2CH2O)n-Z-Y-G-CSF 2 3 93284 4 джені ідіопатичні нейтропенії та нейтропенії, спричинені лікуванням вірусу імунодефіциту людини. 11. Спосіб лікування нейтропенії, профілактики нейтропенії, сприяння підвищенню кількості нейтрофілів під час мобілізації гематопоетичних стов бурових клітин у периферичній крові та трансплантації гематопоетичних стовбурових клітин, при якому вводять кон'югат за будь-яким з пунктів 1, 2 чи 3 як ефективний інгредієнт. Даний винахід відноситься до триланцюгового PEG-G-CSF кон'югату. Колонієстимулюючий фактор (CSF), такий, як глюкопротеїн, що впливає на продукування, розподіл та активність гемопоетичної клітини, класифікують як гранулоцитарний колонієстимулюючий фактор (G-CSF), макрофаговий колонієстимулюючий фактор (M-CSF), гранул оцитарномакрофаговий колонієстимулюючий фактор (GMCSF), мультиколонієстимулюючий фактор (мульти-CSF), та інш. Відомо, що G-CSF підвищує вивільнення зрілих нейтрофілів у периферичну кров шляхом сприяння продукуванню та розподілу нейтрофільного прекурсору у кісному мозку; індукує активність фагоцитів шляхом активування зрілих нейтрофілів; репрезентує залежну від антитіл клітинноопосередковану цитотокисчність; генерує супероксиди; та підвищує реакційну здатність по відношенню до хемотактичного фактору. Людський гранулоцитарний колонієстимулюючий фактор (hG-CSF) був вперше відділений від карциномної клітинної лінії міхура 5637 Welt et al. у 1985, та рекомбінантний hG-CSF(rhG-CSF) був продукований шляхом клонування гену з кДНК бібліотеки ракової клітини Nagata et al., Souza et al. yl986. rhG-CSF, що використовують у клінічних випробуваннях, є філгастрім-зв'язуючим метіоніном на N-кінці протешу без гліколізації, що продукується у Escherichia coli, та леногастрімзв'язуючим з гліколізацією, що продукується у тваринних клітинах. У випадку клінічного застосування rhG-CSF, rhG-CSF має бути введений один раз чи більше на день для зменшення кількості лейкоцитів, оскільки rhG-CSF має короткотривалу фармакологічну дію. Таким чином, було проведено велику кількість досліджень для підвищення періоду напіввиведення з кровообігу rhG-CSF за допомогою водорозчинного полімеру, таким чином, було розроблено ліки з довготривалою активністю та високою стабільністю, та зменшеною частотою введень. Також поліетиленгліколь у водорозчинному полімері є сильно гідрофільним та може підвищувати розчинність під час зв'язування з протеїном для лікування. Також, поліетиленгліколь є ефективним для підвищення молекулярної кількості протеїну, що зв'язаний з ним, зі збереженням основних біологічних функцій, таких, як ферментна активність та зв'язування рецепторів. Таким чином, поліетиленгліколь може зменшувати фільтрацію нирок, та ефективно захищати протеїн від протеолітичного ферменту для розкладання протеїну. Тому, було проведено велику кількість дос ліджень для винаходження способів модифікації протеїну шляхом використання поліетиленгліколю, оскільки він має переваги для попередження розкладання протеїнів, підвищення стійкості та часу обігу протешу в кровоносній системі та зниження імуногенності. У Корейському патенті №0508358 описано кон'югати та способи їх одержання, де кон'югати мають біологічну активність та знаходяться у формі зв'язування біосумісного полімеру із тіолом цистеїнового залишку G-CSF, у молекулярному співвідношенні полімер: G-CSF до стехіометричного 0,7-1,3:1, переважно 1:1. Проте, оскільки цистеїновий залишок G-CSF, що не утворює дисульфідні зв'язки у G-CSF, є основною зв'язуючою частиною з G-CSF рецептором, кон'югат, що завіює цистеїновий залишок має недолік, що полягає у її слабкій фактичній проліферативній дії щодо нейтрофілів. Також, оскільки кон'югати негайно агрегатуються для зв'язування PEG із цистеїновим залишком G-CSF, його недолік полягає у тому, що невелика кількість SDS має бути додана до кон'югата для попередження агрегації для збереження активності та SDS видаляли ультрафільтрацією для введення in vivo. У Корейському патенті №0507796 описано PEG-гомодимерні кон'югати, що зв'язують біологічно активний поліпептид та PEG, для підвищення періоду напів-виведення in vivo поліпептидів. Зокрема, описано, що гомодимер зв'язує аміногрупу бетаїнових залишків біоативного поліпептиду двох молекул із PEG для підвищення залишкового часу та збереження біологічної активності на тривалий термін. Проте кон'югати мають меншу активність, ніж моно-PEG кон'югати, через кон'югацію експресивних PEGs та фізико-хімічні та біологічні властивості кон'югатів, що не є однорідними через неспецифічну кон'югацію. Також відомим є спосіб зв'язування rhG-CSF із лінійним SCM-MPEG (сукциніміділхлорид карбоксиметилового естеру метокси PEG). Моно-PEG-GCSF кон'югати одержували способом, що має 3 типи позиційних ізомерів, модифікованих на Nкінці, бетаїні 35, та бетаїн 45 залишками. Зокрема, кон'югат, модифікований на бетаїні 35, не має PEGs, що відходять з кон'югату (корейський патент №0248111, патент США №5,824,784). У патенті США №5,951,974 описано кон'югати зв'язування лінійного SC-РЕG (поліетиленглікольN-сукцинімід карбонат) із альфа-інтерфероном генної рекомбінації. Кон'югати складаються з ковалентних кон'югатів уретанового зв'язку на αаміногрупі бетаїнових залишків інтерферону, αаміногрупі N-кінцевих цистеїнових залишків, та аміногрупі гістидинових залишків. Проте, кон'югати 5 не мають PEGs, що відходять з кон'югату, оскільки уретанові зв'язки кон'югатів нестійкі. Загальновживаний лінійний поліетиленгліколь має молекулярну масу у, приблизно, 1,000-25,000 дальтон, але має обмеження у зв'язуванні багатьох лінійних великих молекул із протеїном чи пептидом, зі збереженням їх активності, через обмежені біологічно активні регіони протеїну чи пептиду. У Корейському патенті №0254097 описано кон'югати, що зв'язують дволанцюговий PEG бетаїнової скелетної структури із альфа-інтерфероном генної рекомбінації. Кон'югати мають перевагу у попередженні зв'язування PEG із мультичастинами інтерферону, та мають удвічі більшу молекулярну масу PEG, ніж лінійні PEG, оскільки два лінійні PEGs зв'язують одну частину інтерферону. Проте, дволанцюговий PEG може бути гідролізований до одного ланцюгу для збереження чи реакції за лужних умов, оскільки дволанцюговий PEG, що має бетаїнову скелетну структуру, має два уретанові зв'язки у PEG. Загалом, відомо, що біологічна активність, тривалість життя та інш. кон'югатів зв'язування PEG із ген-рекомбінантним протеїном залежить від розміру та частини, модифікованій у PEG. Проте, все ще невідомо, чи впливає розмір PEG у кон'югатах зв'язування PEG та rhG-CSF на біологічну активність протеїну. Тому, існувала необхідність у цій галузі в усуненні недоліків відомого способу шляхом контролю розміру PEG та зв'язування із різними скелетними структурами PEG без зниження біоактивності G-CSF та з підвищенням стабільності зв'язуючих частин. Технічна проблема Задачею даного винаходу є забезпечення кон'югатів триланцюгового поліетиленгліколю (PEG)-G-CSF, одержаних шляхом кон'югації триланцюгового PEG та G-CSF, що мають високу стабільність та подібну чи вищу біоактивність G-CSF, ніж G-CSF та PEG-G-CSF кон'югати, відомі з рівня техніки; способу їх одержання; та фармацевтичної композиції, що їх містить. Технічне рішення Для рішення поставленої задачі, даний винахід забезпечує кон'югати триланцюгового поліетиленгліколю (PEG)-G-CSF, кон'юговані між похідними триланцюгового PEG та G-CSF. Даний винахід також забезпечує спосіб одержання кон'югатів триланцюгового PEG-G-CSF, що включає кон'югацію похідних триланцюгового PEG та G-CSF. Даний винахід також забезпечує фармацевтичну композицію, що містить кон'югати. Даний винахід також забезпечує спосіб лікування нейтропенії, профілактики нейтропенії, чи сприяння зростанню кількості нейтрофілів під час мобілізації гематопоетичних стволових клітин у периферичній крові та трансплантації гематопоетичних стволових клітин, що включає введення кон'югату за даним винаходом як активного інгредієнта. Даний винахід детально описано нижче. Кон'югати триланцюгового PEG-G-CSF за даним винаходом можуть бути одержані шляхом 93284 6 кон'югації триланцюгового поліетиленгліколю (PEG), представленого наступною загальною формулою (1): де n являє собою ціле число від 1 до 1,000; m являє собою ціле число від 10 до 1,000; Ζ являє собою (CH2)s чи (CH2)sNHCO(CH2)s як лінкер G-CSF та PEG, де S являє собою ціле число від 1 до 6; Υ являє собою амідний зв'язок, утворений шляхом сполучення ΝN2 функціональної групи у G-CSF та функціональної групи похідного PEG. PEG має середню молекулярну масу від 200 до 45,000 дальтон, переважно, від 20,000 до 45,000 дальтон, більш переважно, від 23,000 до 43,000 дальтон. Оскільки медично ефективний період може бути змінений відповідно до середньої молекулярної маси PEG, середня молекулярна маса PEG, що застосовують у даному винаході, може бути змінена, в залежності від часу, що потребується для лікування. Спосіб одержання кон'югату триланцюгового PEG-G-CSF, що включає кон'югацію похідних триланцюгового PEG та G-CSF за даним винаходом, детально описано нижче. Кон'югати триланцюгового PEG-G-CSF загальної формули (1) одержують шляхом утворення ковалентного зв'язку між похідним триланцюгового PEG, що має формулу (2), та G-CSF, де PEG має середню молекулярну масу від 200 до 45,000 дальтон, переважно, від 20,000 до 45,000 дальтон, більш переважно, від 23,000 до 43,000 дальтон: де n являє собою ціле число від 1 до 1,000; m являє собою ціле число від 10 до 1,000; Ζ являє собою (CH2)S чи (CH2)sNHCO(CH2)s як лінкер G-CSF та PEG, де S являє собою ціле число від 1 до 6; та функціональна група, що хімічно реагує з протеїнами та пептидами, що містить G-CSF являє собою N-гідросукцинімід. Похідні триланцюгового PEG за даним винаходом активують великі молекули, що мають ланцюгову структуру, де сполучені три лінійні біологічно рецептивні великі молекули. Усі з трьох ОН (гідрокси) регіонів у гліцериновій скелетній структурі полімеризовані одними молекулами етиленгліколю, та кінець регіону активований як функціональна група. Інші два регіони, окрім активованого регіону, заміщені монометокси, для попередження 7 додаткових реакцій. При одержанні вищеописаних похідних ланцюгового PEG, розмір кожного лінійного PEG може бути легко контрольований способом, відомим з рівня техніки. Похідні триланцюгового PEG у даному винаході можуть бути використані як похідні PEG, де функціональна група хімічно реагує з протеїном та пептидом, відомими з рівня техніки. Похідні PEG загальної формули (2) (з N-гідроксисукцинімідом) є переважними у термінах виходу кон'югату за даним винаходом. G-CSF у даному винаході може бути відділений від організму ссавця чи синтезований способом, відомим з рівня техніки, таким, як клонування клонування gДHK, клонування к ДНК, та інш. Також G-CSF може бути придбаний на ринку. Крім того, ковалентний зв'язок між G-CSF та похідними триланцюгового PEG може бути утворений при низькій температурі. Реакцію припиняють шляхом додавання кислот, та одержані кон'югати триланцюгового PEG-G-CSF можуть бути очищені способом, відомим з рівня техніки , таким, як спосіб очищення за допомогою катіонобмінної смоли. У даному винаході, реакційне молярне відношення G-CSF до похідного триланцюгового PEG становить від 1:0,5 до 1:50. Переважне молярне відношення G-CSF до похідного триланцюгового PEG становить від 1:0,5 до 1:5, оскільки вихід моно PEG-G-CSF кон'югату підвищений, а молярне відношення поліетиленгліколю до G-CSF підвищено. Даний винахід також забезпечує фармацевтичну композицію для лікування чи попередження симптомів, спричинених зниженою гематопоетичною функцією чи зниженою імунологічною функцією. Зокрема, клінічні випробування із застосуванням кон'югату за даним винаходом ефективно показали, що кількість нейтрофілів була зменшена, а симптоми полегшені чи контрольовані, для хвороб, спричинених лікуванням, таким, як хіміотерапія раку чи радіотерапія; інфекційні захворювання, спричинені бактеріями, вірусами чи грибками; інші інфекційні захворювання; захворювання, спричинені генетичними факторами чи впливом навколишнього середовища, такі, як тяжкі хронічні нейтропенії та лейкемія; чи геріатричні хвороби, викликані цими ж причинами. Наприклад, симптоми, спричинені зниженою гематопоетичною функцією чи зниженою імунологічною функцією являють собою нейтропенії, спричинені хіміотерапією раку для кров'яних пухлин чи твердого раку, нейтропенії, спричинені мієлодисплазійним синдромом, нейтропенії, спричинені апластичною анемією, вроджені ідіопатичні нейтропенії, та нейтропенії, спричинені лікуванням вірусу імунодефіциту людини. Композиція може бути складена з PEG-G-CSF кон'югатів за даним винаходом чи фармацевтично прийнятного розріджувача, антисептиків, солюбілізатора, емульгатора, ад'юванта та/або носія. Композиції за даним винаходом можуть бути у вигляді агента введення, капсули, таблетки, рідких ліків, пігулки, мазі, очної мазі, очних крапель, че 93284 8 резкожного агента поглинання, пасти, катаплазм, аерозолів, та інш. Також, ефективне дозування G-CSF є дуже невеликим, таким, як 0,1-500мкг (переважно, 550мкг). Також, ліки, що містять 0,1-500мкг G-CSF, можуть бути введені дорослій людині, загалом, від 1 до 7 разів на тиждень. Таким чином, ефективне дозування фармацевтичної композиції за даним винаходом може бути розраховано за відомою кількістю введення G-CSF та молекулярною масою PEG, що застосовують у даному винаході. Ефективне дозування фармацевтичної композиції за даним винаходом може бути змінним, проте, загалом, становить раз на тиждень, та композиція може бути введені однин чи багато разів на день у ефективному денному діапазоні дозувань. Наступні приклади призначені для додаткової ілюстрації даного винаходу та не призначені для будь-якого обмеження обсягу даного винаходу. Корисні ефекти Кон'югати триланцюгового PEG-G-CSF за даним винаходом є більш фармацевтично стійкими, ніж кон'югати лінійного- чи дволанцюгового PEGG-CSF в аспекті PEGs, що відходять з PEG-G-CSF кон'югатів, та утворення агрегатів кон'югатів. Також, кон'югати за даним винаходом можуть бути застосовані без додаткових відділень ізомерів положень, кон'югати складаються з ізомерів положень , що мають подібну активність. Також, композиція за даним винаходом має дію безперервного продукування нейтрофілій та підвищений період напів-виведення i in-vivo. Фіг.1 є схематичним кресленням, що ілюструє аналітичні результати для суміші, утвореної для одержання кон'югатів триланцюгового PEG з MM 23,000Da та G-CSF відповідно до Прикладу 1, одержані шляхом гель-фільтраційної високопродуктивної рідинної хроматографії. Фіг.2 є схематичним кресленням, що ілюструє аналітичні результати для суміші, утвореної для одержання кон'югатів триланцюгового PEG з MM 43,000Da та G-CSF відповідно до Прикладу 2, одержані шляхом гель-фільтраційної високопродуктивної рідинної хроматографії. Фіг.3 є схематичним кресленням, що ілюструє аналітичні результати для суміші, утвореної для одержання кон'югатів лінійного PEG з MM 10,000Da та G-CSF відповідно до Порівняльного прикладу 1, одержані шляхом гель-фільтраційної високопродуктивної рідинної хроматографії. Фіг.4 є схематичним кресленням, що ілюструє аналітичні результати чистоти для моно кон'югатів триланцюгового PEG-G-CSF, відділених від суміші Прикладу 1, одержані шляхом гель-фільтраційної високопродуктивної рідинної хроматографії. Фіг.5 є схематичним кресленням, що ілюструє аналітичні результати чистоти для моно кон'югатів триланцюгового PEG-G-CSF, відділених від суміші Прикладу 2, одержані шляхом гель-фільтраційної високопродуктивної рідинної хроматографії. Фіг.6 є схематичним кресленням, що ілюструє аналітичні результати чистоти для моно кон'югатів лінійного PEG-G-CSF, відділених від суміші Порівняльного прикладу 1, одержані шляхом гель 9 фільтраційної високопродуктивної рідинної хроматографії. Фіг.7 є схематичним кресленням, що ілюструє аналітичні результати для моно кон'югатів триланцюгового PEG-G-CSF, відділених від суміші Прикладу 1, одержані шляхом мас-спектрометрії іонізації лазерної десорбції з використанням матриці (МАLДИ-TOF). Фіг.8 є схематичним кресленням, що ілюструє аналітичні результати для моно кон'югатів триланцюгового PEG-G-CSF, відділених від суміші Прикладу 2, одержані шляхом мас-спектрометрії іонізації лазерної десорбції з використанням матриці (МАLДИ-TOF). Фіг.9 є схематичним кресленням, що ілюструє аналітичні результати для моно кон'югатів лінійного PEG-G-CSF, відділених від суміші Порівняльного прикладу 1, одержані шляхом мас-спектрометрії іонізації лазерної десорбції з використанням матриці (МАLДИ-ТОF). Фіг.10 є схематичним кресленням, що ілюструє аналітичні результати для ізомерів положень, що містять моно кон'югати триланцюгового PEG-GCSF, відділені від суміші Прикладу 1, шляхом іонобмінної хроматографії. Фіг.11 є схематичним кресленням, що ілюструє аналітичні результати щодо біологічної активності ізомерів положень моно кон'югатів триланцюгового PEG-G-CSF, відділених від суміші Прикладу 1, відповідно до Експериментального прикладу 1, за допомогою способу Експериментального прикладу 2. Спосіб реалізації винаходу Одержання кон'югатів триланцюгового поліетиленгліколю (PEG MM 23,000Da)-GCSF 10мг rhG-CSF (Dong-Α Pharm. Co., Ltd.) фільтрували з рН8,5 та 50мМ буферного розчину борату натрію. Потім 9,2мг триланцюгового PEG, що містив N-гідроксисукцинімід (NOF corporation, Japan) та молекулярною масою 23,000 дальтон, додавали до розчину у молярному відношенні rhGCSF:триланцюговий PEG - 1:0,75. Також, розчин перемішували при 4°С протягом 90хв. Реакцію припиняли шляхом додавання 100мМ HCL з одержанням розчину з рН4 та шляхом розведення стерильною дистильованою водою у 5 разів більше, ніж об'єм розчину. Потім суміш поміщали у SPсефарозну катіон-обмінну хроматографічну комірку швидкого потоку (Amersham Pharmacia Biotech), стабілізовану 20мМ буферного розчину ацетату натрію (рН4,0), та відділяли кон'югат триланцюгового PEG-G-CSF. Суміш фракціонували шляхом використання 0 ~ 1М градієнта концентрації хлориду натрію(NaCl). Молярне співвідношення триланцюгового PEG із G-CSF у кон'югатах триланцюгового PEG-G-CSF підтверджували за допомогою ВЕРХ та SDS-PAGE. Також, ди- чи більш (три-, тетра-..) кон'югати триланцюгового PEG-G-CSF, залишки G-CSF, що не прореагував, що залишилися після реакції та інш. були виключені. Також, елюати концентрували та стерилізаційно фільтрували з одержанням моно кон'югатів триланцюгового PEG-G-CSF, де G-CSF та триланцюговий PEG 93284 10 (MM 23,000Da) кон'юговані (чи мають назву монокон'югат триланцюгового PEG-G-CSF). Було підтверджено, що реакційна суміш складалася з 35,4% моно-кон'югату триланцюгового PEG-G-CSF (моно-PEG-G-CSF кон'югат), приблизно 59,4% G-CSF немодифікованого PEG, та інших [ди- кон'югату триланцюгового PEG-G-CSF (диPEG-G-CSF кон'югату), та N-гідроксисукцинімід (NHS)], за допомогою гель-фільтраційної високопродуктивної хроматографії (див. Фіг.1, де 1 та 2 являють собою ди-PEG-G-CSF кон'югат, 3 являє собою моно-PEG-G-CSF кон'югат, 4 являє собою G-CSF, немодифікований PEG, a 5 являє собою NHS від триланцюгового PEG). Також, чистоту моно-триланцюгового PEG-G-CSF, відділеного від суміші, вимірювали шляхом гель-фільтраційної високопродуктивної рідинної хроматографії (див. Фіг.4, де 2 являє собою ди-PEG-G-CSF кон'югат, а 3 являє собою моно-PEG-G-CSF кон'югат) та молекулярну масу вимірювали за допомогою масспектрометрії іонізації лазерної десорбції з використанням матриці (MALДИ-TOF) (див., Фіг.7: аналітичний результат моно-триланцюгового PEG-GCSF одержували за допомогою MALДИ-TOF/MS). Також, ізомери положень відділяли за допомогою катіон-обмінної аналітичної колонки (SP-5WP, TOSOH) для підтвердження того, що відношення для кожного ізомеру положень становить, приблизно, 54%: 33%: 10% (див. Фіг.10). Також, було підтверджено, що кожен з ізомерів положень має подібну активність, в експерименті щодо біологічної активності для кожного ізомеру положень (див. Фіг.11). Одержання кон'югатів триланцюгового поліетиленгліколю (PEG MM 43,000Da)-GCSF 10мг rhG-CSF (Dong-Α Pharm. Co., Ltd.) фільтрували з рН8,5 та 50мМ буферного розчину борату натрію. Потім 17,2мг триланцюгового PEG з Nгідроксисукцинімідом (NOF corporation, Japan) та молекулярною масою 43,000 дальтон додавали до розчину з одержанням молярного співвідношення rhG-CSF:триланцюговий PEG 1:0,75. Також, розчин перемішували при 4°С протягом 90хв. Також, реакцію припиняли шляхом додавання 100мМ НСl з одержанням розчину з рН4 та шляхом розведення стерильною дистильованою водою у 5 разів від об'єму розчину. Також, суміш поміщали у SPсефарозну катіон-обмінну хроматографічну комірку швидкого потоку (Amersham Pharmacia Biotech), стабілізовану 20мМ буферного розчину ацетату натрію (рН4,0), та кон'югат триланцюгового PEGG-CSF відділяли від цього. Суміш фракціонували шляхом використання 0 ~ 1М градієнта концентрації хлориду натрію (NaCl). Молярне співвідношення триланцюгового PEG до G-CSF у кон'югатах триланцюгового PEG-G-CSF підтверджували за допомогою ВЕРХ та SDS-PAGE. Та ди- чи більш (три, тетра..)-кон'югати триланцюгового PEG-G-CSF, G-CSF, що не прореагував та залишився після реакції, та інш. виключали. Також, елюати концентрували та стерилізаційно фільтрували з одержанням моно-триланцюгового PEG-GCSF кон'югату, де G-CSF та триланцюговий PEG 11 (MM 43,000Da) кон'юговані (чи мають назву монотриланцюгового PEG-G-CSF кон'югату). Було підтверджено, що реакційна суміш складалася з 18,7% моно- кон'югату триланцюгового PEG-G-CSF (моно-PEG-G-CSF кон'югату), приблизно, 40,1% G-CSF, немодифікованого PEG, та інших [ди- кон'югату триланцюгового PEG-G-CSF (ди-PEG-G-CSF кон'югату), та Nгідроксисукциніміду (NHS)] за допомогою гельфільтраційної високопродуктивної хроматографії (див. Фіг.2, де 2 являє собою є ди-PEG-G-CSF кон'югат, 3 являє собою моно-PEG-G-CSF кон'югат, та 4 являє собою G-CSF, немодифікований PEG). Також, чистоту моно-триланцюгового PEGG-CSF, відділеного від суміші, вимірювали шляхом гель-фільтраційної високопродуктивної рідинної хроматографії (див. Фіг.5, де 1 являє собою олігоPEG-G-CSF кон'югат, 2 являє собою ди-PEG-GCSF кон'югат, та 3 являє собою моно-PEG-G-CSF кон'югат), та молекулярну масу вимірювали масспектрометрії іонізації лазерної десорбції з використанням матриці (MALДИ-TOF) (див. Фіг.8; аналітичний результат для моно-триланцюгового PEG-G-CSF одержували шляхом MALДИ-TOF/MS). Одержання кон'югатів лінійного поліетиленгліколю (PEG MM 10,000Da)-G-CSF 10мг rhG-CSF (Dong-Α Pharm. Co., Ltd.) фільтрували з рН8,5 та 50мМ буферного розчину борату натрію. Також, 5,2мг лінійного PEG з Nгідроксисукцинімідом (NOF corporation, Japan) та молекулярною масою 13,000 дальтон додавали до розчину з одержанням молярного співвідношення rhG-CSF:лінійний PEG 1:0,75. Також, розчин перемішували при 4°С протягом 90хв. Також, реакцію припиняли шляхом додавання 100мМ HCL з одержанням розчину з рН4 та шляхом розведення стерильною дистильованою водою у 5 разів від об'єму розчину. Також, суміш поміщали у SPсефарозну катіон-обмінну хроматографічну комірку швидкого потоку (Amersham Pharmacia Biotech), стабілізовану 20мМ буферного розчину ацетату натрію (рН4,0), та лінійно-ланцюговий PEG-G-CSF кон'югат був відділений від цього. Суміш фракціонували шляхом використання 0 ~ 1М градієнта концентрації хлориду натрію (NaCl). Молярне співвідношення лінійного PEG до G-CSF у лінійному PEG-G-CSF кон'югаті підтверджували за допомогою ВЕРХ та SDS-PAGE. Також, ди- чи більш (три, тетра..)-лінійні PEG-G-CSF кон'югати, G-CSF, що не прореагував та залишився після реакції, та інш., виключали. Також, елюати концентрували та стерилізаційно фільтрували з одержанням монолінійного PEG-G-CSF кон'югату, де G-CSF та лінійний PEG (MM 13,000Da) кон'юговані (чи мають назву моно-лінійний PEG-G-CSF кон'югат). Було підтверджено, що реакційна суміш складалася з 45,6% моно-лінійного PEG-G-CSF кон'югату (моно-PEG-G-CSF кон'югату), приблизно, 45,9% G-CSF, немодифікованого PEG, та інші [дилінійний PEG-G-CSF кон'югат (ди-PEG-G-CSF кон'югат), та N-гідроксисукцинімід (NHS)], за допомогою гель-фільтраційної високопродуктивної хроматографії (див. Фіг.3, де 1 являє собою олігоPEG-G-CSF кон'югат, 2 являє собою ди-PEG-G 93284 12 CSF кон'югат, 3 являє собою моно-PEG-G-CSF кон'югат, та 4 являє собою G-CS, немодифікований PEG). Також, чистоту моно-лінійноланцюгового PEG-G-CSF, відділеного від суміші, вимірювали шляхом гель-фільтраційної високопродуктивної рідинної хроматографії (див. Фіг.6, де 1 являє собою оліго-PEG-G-CSF кон'югат, 2 являє собою ди-PEG-G-CSF кон'югат, 3 являє собою MOHO-PEG-G-CSF кон'югат, та 4 являє собою GCSF, немодифікований PEG), та молекулярну масу вимірювали вимірювати мас-спектрометрії іонізації лазерної десорбції з використанням матриці (МАLДИ-ТОБ) (див. Фіг.9). Одержання кон'югатів лінійного поліетиленгліколю (PEG MM 20,000 Da)-G-CSF 10мг rhG-CSF (Dong-Α Pharm. Co., Ltd.) фільтрували з рН8,5 та 50мМ буферного розчину борату натрію, та потім 8,0мг лінійного PEG, що містив N-гідроксисукцинімід (NOF corporation, Japan) та молекулярною масою 20,000 дальтон додавали до розчину з одержанням молярного співвідношення rhG-CSF:лінійний PEG 1:0,75. Також, розчин перемішували при 4°С протягом 90хв. Реакцію припиняли шляхом додавання 100мМ HCL з одержанням розчину з рН4 та шляхом розведення стерильною дистильованою водою у 5 разів від об'єму розчину. Потім суміш поміщали у SPсефарозну катіон-обмінну хроматографічну комірку швидкого потоку (Amersham Pharmacia Biotech), стабілізовану 20мМ буферного розчину ацетату натрію (рН4,0), та лінійно-ланцюговий PEG-G-CSF кон'югат відділяли від цього. Суміш фракціонували шляхом використання 0 ~ 1М градієнта концентрації хлориду натрію (NaCl). Молярне співвідношення лінійного PEG до G-CSF у лінійному PEGG-CSF кон'югаті підтверджували за допомогою ВЕРХ та SDS-PAGE. Також, ди- чи більше (три, тетра..)-лінійних PEG-G-CSF кон'югатів, G-CSF, що не прореагував та залишився після реакції, та інш. виключали. Також, елюати концентрували та стерилізаційно фільтрували з одержанням монолінійного PEG-G-CSF кон'югату, де G-CSF та лінійний PEG (MM 20,000Da кон'юговані (чи мають назву моно-лінійного PEG-G-CSF кон'югату). Одержання кон'югатів дволанцюгового поліетиленгліколю (PEG MM 20,000Da, бетаїнова скелетна структура)-G-CSF 10мг rhG-CSF(Dong-A Pharm. Co., Ltd.) фільтрували з рН8,5 та 50мМ буферного розчину борату натрію, та потім 9,1мг дво-ланцюгового PEG, що містив N-гідроксисукцинімід (Nektar, USA) та молекулярною масою 20,000 дальтон додавали до розчину з одержанням молярного співвідношення rhG-CSF:лінійний PEG 1:0,75. Також, розчин перемішували при 4°С протягом 90хв. Реакцію припиняли шляхом додавання 100мМ HCL з одержанням розчину з рН4 та шляхом розведення стерильною дистильованою водою у 5 разів від об'єму розчину. Потім суміш поміщали у SPсефарозну катіон-обмінну хроматографічну комірку швидкого потоку (Amersham Pharmacia Biotech), стабілізовану 20мМ буферного розчину ацетату натрію (рН4,0), та лінійно-ланцюговий PEG-G-CSF кон'югат віддаляли від цього. Суміш фракціонува 13 ли шляхом використання 0 ~ 1М градієнта концентрації хлориду натрію (NaCl). Молярне співвідношення дво-ланцюгового PEG із G-CSF у дволанцюговому PEG-G-CSF кон'югаті підтверджували за допомогою ВЕРХ та SDS-PAGE. Також, ди- чи більше (три, тетра..) кон'югати -дволанцюгового PEG-G-CSF, G-CSF, що не прореагував та залишився після реакції, та інш., виключали. Також, елюати концентрували та стерилізаційно фільтрували з одержанням моно-лінійного PEG-G-CSF кон'югату, де G-CSF та дво-ланцюговий PEG (MM 20,000Da) кон'юговані (чи мають назву монолінійний PEG-G-CSF кон'югат). Одержання кон'югатів дво-ланцюгового поліетиленгліколю (PEG MM 20,000Da, гліцеринова скелетна структура)-GCSF 10мг rhG-CSF(Dong-A Pharm. Co., Ltd.) фільтрували з рН8,5 та 50мМ буферного розчину борату натрію. Також, 8,0мг дво-ланцюгового PEG, що містив N-гідроксисукцинімід (NOF, Japan) та молекулярною масою 20,000 дальтон додавали до розчину з одержанням молярного співвідношення rhG-CSF:лінійний PEG 1:0,75. Розчин перемішували при 4°С протягом 90хв. Також, реакцію припиняли шляхом додавання 100мМ HCL з одержанням розчину з рН4 та шляхом розведення стерильною дистильованою водою у 5 разів від об'єму розчину. Потім суміш поміщали у SPсефарозну катіон-обмінну хроматографічну комірку швидкого потоку (Amersham Pharmacia Biotech), стабілізовану 20мМ буферного розчину ацетату натрію (рН4,0), та кон'югат лінійно-ланцюгового PEG-G-CSF відділяли від цього. Суміш фракціонували шляхом використання 0 ~ 1М градієнта концентрації хлориду натрію (NaCl). Молярне співвідношення дво-ланцюгового PEG із G-CSF у дволанцюговому PEG-G-CSF кон'югаті підтверджували за допомогою ВЕРХ та SDS-PAGE. Також, дичи більше (три, тетра..) кон'югатів дволанцюгових PEG-G-CSF, -CSF, що не прореагував та залишився після реакції, та інш., виключали. Також, елюати концентрували та стерилізаційно фільтрували з одержанням моно-дво-ланцюгового PEG-G-CSF кон'югату, де G-CSF та дво-ланцюговий PEG (MM 20,000Da) (чи мають назву моно-лінійний PEG-GCSF кон'югат). Одержання кон'югатів моно-метоксиполіетиленгліколь-G-CSF зв'язування на N-кінцевому α-аміно залишку Титульний кон'югат одержували способом, описаним у Корейському патенті №0248111, та у патенті США №5,824,784. Спосіб стисло описано нижче. 100мМ фосфату натрію, що містив 20мМ NaCNBH3, та 5мг/мл rhG-CSF перемішували при 4°С. Також, 5 молів лінійного метоксиполіетиленгліколь (mPEG) альдегіду (Nektar, USA) додавали до розчину, який перемішували протягом 10 годин. Реакцію припиняли шляхом додавання 100мМ HCL з одержанням розчину з рН4 та шляхом розведення стерильною дистильованою водою у 5 разів від об'єму розчину. Потім суміш поміщали у SP-сефарозну катіон-обмінну хроматографічну комірку швидкого потоку (Amersham Pharmacia 93284 14 Biotech), стабілізовану 20мМ буферного розчину ацетату натрію (рН4,0), та кон'югат лінійноланцюгового PEG-G-CSF відділяли від цього. Суміш фракціонували шляхом використання 0 ~ 1М градієнта концентрації хлориду натрію (NaCl). Також, елюати концентрували та стерилізаційно фільтрували з одержанням моно-mPEG-G-CSF кон'югату, де G-CSF та дволанцюговий PEG (MM 20,000Da) кон'юговані (чи мають назву монолінійний PEG-G-CSF кон'югат). Одержання кон'югатів моно-метоксиполіетиленгліколь-G-CSF зв'язування на тіольній групі цистеїнового залишку GCSF Титульний кон'югат одержували способом, одержаним у Корейському патенті №0508358. Спосіб стисло описано нижче. 1мг rhG-CSF(Dong-A Pharm. Co., Ltd.) додавали до 1мл буферного розчину фосфату натрію (0,1 М) з рН8,5, та 52,6мг поліетиленгліколь малеіміду (NOF, Japan) додавати до розчину . Також, розчин перемішували протягом 1 години при кімнатній температурі. Потім PEG похідні, що залишилися після реакції, видаляли з розчину за допомогою центрикону 30 (Amicon, USA). Також, розчин концентрували та стерилізаційно фільтрували з одержанням моно-mPEG-G-CSF кон'югату. Тести на властивості та фармакологічну активність проводили шляхом використання кон'югатів, одержаних вище, та одержували наступні результати. Аналітичне відділення ізомерів положень кон'югатів триланцюгового PEG-G-CSF. 100мкг моно-триланцюгового PEG-G-CSF кон'югаті Прикладу 1 поміщали у катіон-обмінну аналітичну колонку (SP-5WP, TOSOH), стабілізовану 25мМ буферу ацетату натрію (рН4,0, контролювали крижаною оцтовою кислотою), та кожен ізомер положень кон'югатів відділяли за допомогою 100мМ буферу ацетату натрію, рН7,8). Було підтверджено, що співвідношення кожного ізомеру положень становить, приблизно, 54%: 33%: 10% (див. Фіг.10). Експериментальний приклад 2> Аналіз біологічної активності ізомерів положень кон'югатів триланцюгового PEG-G-CSF. Відносна біологічна активність ізомерів положень кон'югатів триланцюгового PEG-G-CSF Прикладу 1 вимірювали шляхом використання кон'югатів G-CSF. Клітинний штам NFS-60 культивували на ростовому RPMI 1640, що містив 10% FBS та 1нг/мл rmIL-3 промивали тричі тестовим RPMI 1640, що містив 5% FBS. Також, клітинний штам розділяли на 100мл (2×105клітин/мл) на планшету на 96 лунок. Потім пробу розводили тестовим середовищем з одержанням проби у 200нг/мл, та ще 9 проб по 200нг/мл у 5 разів, та проби розділяли на 3 лунки, кожна по 100мл концентрацій у планшети на 96 лунок, що містили клітинні розчини. Кожну лунку культивували при 37° та 5% СО2 інкубаторі протягом 48 годин, 40мкл MTS додавали у кожну лунку. Через 2 години, поглинання проби вимірювали при 490нм за допомогою рідеру 15 93284 ELISA. ЕС50 розраховували за допомогою кривої доза-відклик та аналізу лінійної регресії точок, що складають пряму на стандартній кривій, та визначали активність ізомерів положення (див. Фіг.11). Кон'югати триланцюгового PEG-G-CSF за даним винаходом мали ізомери положень, що мали подібну активність. Тобто, не має потребу у видаленні деяких ізомерів положень, що мають відносно нижчу активність, оскільки кон'югати триланцюгового PEG-G-CSF за даним винаходом складені з кон'югатів з однорідною активністю. Експериментальний приклад 3> Фармакокінетичний тест кон'югатів триланцюгового PEG-GCSF. Фармакодинамічний тест проводили для підшкірного введення кожного з кон'югатів G-CSF, PEGG-CSF Прикладу 1, та PEG-G-CSFкон'югати Прикладу 2, тестовим щурам (Спрага-Доулі), що мали 240~260г маси тіла. Після введення кожному з щурів кількості у 400мкг, відбирали проби крові у 16 щурів через 0хв., 30хв., 1 годину, 2 години, 3 години, 4 години, 8 години, 12 години, 1 день, 2 дні, 3 дні, 4 дні, 5днів, 6 днів, та 7 днів після введення. Також, концентрації G-CSF кон'югатів у пробі кількісно аналізували за допомогою набору для ферментного імуносорбентного аналізу (ELISA) (Biosource, USA). Період напів-виведення з крові PEG-G-CSF кон'югатів Прикладу 1 та Прикладу 2 збільшено у 3 рази та 10,8, відповідно, порівняно із періодом напів-виведення G-CSF, та площі під кривою концентрація-час у крові кон'югаті Прикладу 1 та Прикладу 2, також збільшено у 7,6 разів та 23,4 рази, відповідно, порівняно із площею G-CSF [Таблиця 1: Фармакокінетичний тест кон'югатів триланцюгового PEG-G-CSF та G-CSF у щурів (щури СпрагаДоулі)]. За допомогою цього тесту підтверджували, що фармакокінетика PEG-G-CSF кон'югату залежить від розміру PEG. Таблиця 1 rhG-CSF 1383,2 1,5 2,9 6246,9 Сmах (годин) Тmах (годин) Т1/2 (годин) АUС(нг* годин/мл) Приклад 1 1676, 8 12 8,7 47420, 3 Приклад 2 1710,6 36 31,2 146196, 1 Тmах: час досягнення максимальної концентрації Сmах: максимальна концентрація t1/2: період напів-виведення екскрецій AUC: площа під кривою концентрація-час. Експериментальний приклад 4> Тест стійкості кон'югатів триланцюгового PEG-G-CSF на PEGs, що відходять з кон'югатів PEG-G-CSF кон'югати Прикладів 1 та 2, та Порівняльних прикладів 2, 3, та 4 осаджували при рН7 та 37° протягом 7 днів, та аспекти PEGs, що відходять, потягом часу, аналізували зворотнофазовою високопродуктивною рідинною хроматографією, для оцінки ступеню PEGs, що відходять, по скелетній структурі, молекулярним масам та ланцюговим типам PEG. У скелетній структурі PEG's, PEGs, що відходять, зустрічалися більш часто у Порівняльному прикладі 2 з використанням лінійного PEG. Проте, PEGs, що відходять, від кон'югатів Прикладів 1 та 2, та Порівняльного прикладу 4, зустрічалися менш часто, ніж у Порівняльних прикладах 2 та 3 (Таблиця 2: Порівняння швидкостей генерації GCSF у PEG-G-CSF кон'югатів, що мають різні PEG скелетні структури). Цей тест підтвердив, що кон'югати триланцюгового PEG-G-CSF є більш стійкими, ніж лінійні-, дво-ланцюгові PEG-G-CSF кон'югати, та кон'югат з гліцериновою скелетною структурою є більш стійкими, ніж кон'югати з бетаїновою скелетною структурою. Таблиця 2 Приклад 1 Швидкість генерації,% Приклад 2 0,44 0,34 Експериментальний приклад 5> Тест стійкості кон'югатів триланцюгового PEG-G-CSF щодо агрегації відповідно до скелетної структури PEG та типу зв'язування PEG із G-CSF Кон'югат моно триланцюгового PEG-G-CSF Прикладу 1; моно PEG-G-CSF кон'югату Порівняльних прикладів 2 та 4, що має молекулярну масу, аналогічну кон'югату Прикладу 1 та скелетну структуру, що відрізняється від кон'югату Прикладу 1; та моно PEG-G-CSF кон'югат Порівняльного прик Порівняльний приклад 2 5,59 Порівняльний приклад 3 1,36 Порівняльний приклад 4 0,54 ладу 5, що мають тип зв'язування, що відрізняється від кон'югату Прикладу 1, піддавали тестування для вимірювання стабільності щодо агрегації. Кожну пробу збирали до 500мкг, та розчинник для проб замінювали 3 рази на 100мМ фосфатного буферного розчину з рН7. Також, проби осаджували при 37° протягом 14 днів, та агрегацію кон'югатів аналізували за допомогою гель-фільтраційної високопродуктивної рідинної хроматографії. 17 93284 Результати аналізу агрегації вказують на те, що моно-PEG-G-CSF кон'югат Прикладу 1 були найбільш стійкими в аспекті PEGs, що відходять, та мали найменшу агрегацію (Таблиця 3: Швидкості генерування агрегації кон'югатів відповідно до скелетної структури PEG та типу зв'язування PEG із G-CSF). Moho-PEG-G-CSF кон'югати Порівняльних прикладів 2 та 4 з PEG мали гліцеринову скелетну структуру, подібну структуру PEGs у Прикладі 1, та тип зв'язування, аналогічний Прикладу 1, а також кон'югату Прикладу 1, із подібною агрега 18 цією. Проте моно-PEG-G-CSF кон'югати Порівняльного прикладу 3 з PEG мали скелетні структури, що відрізнялися від PEGs у Прикладу 1 (але мали тип зв'язування, аналогічний Прикладу 1) та мали більшу агрегацію. Також, моно-PEG-G-CSF кон'югати Порівняльного прикладу 5 з PEG мали скелетні структури, що відрізнялися від PEGs у Прикладі 1 та мали тип зв'язування, що відрізнявся від Прикладу 1, мали удвічі чи більше виражену агрегацію, порівняно із кон'югатами Прикладу 1. Таблиця 3 Проба Приклад 1 Швидкість генерування (%) 6,81 Порівняльний приклад 2 7,89 На завершення, кон'югат монотриланцюгового PEG-G-CSF Прикладу 1 є найбільш стійким як у PEGs, що відходять із кон'югатів, та при агрегації. Тобто, цей корисний ефект випливає з різних скелетних структур ланцюгового PEG та ланцюгового PEG, що застосовували у цьому винаході. Експериментальний приклад 6> Аналіз нейтрофільної проліферативної активності кон'югатів PEG-G-CSF у тваринній моделі, де вводили протиракові ліки. Нейтрофільна проліферативна активність кон'югатів моно-триланцюгового PEG-G-CSF Прикладу 1, моно-mPEG (метокси поліетиленгліколь)G-СSF кон'югатів Порівняльних прикладів 5 та 6, що мають різні типи зв'язування та різну молекулярну масу , ніж кон'югати Прикладу 2, аналізували у мишачій моделі, де вводили протиракові ліки. Мишам (BDF1) 20~25г вводили 200мг/кг протиракового агента (циклофосфаміду) для зменшення кількості нейтрофілів протягом 2 днів. Також, кожен з кон'югатів Прикладу 1 та кон'югатів Порівняльних прикладів 5 та 6 вводили підш Порівняльний приклад 3 50,5 Порівняльний приклад 4 7,91 Порівняльний приклад 5 15,3 кірно один раз, 1мг/кг кожній миші, a G-CSF вводили 8 разів по 0,125мг/кг кожній миші із загальною кількістю введення 1мг/кг. Мишачу кров збирали через 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 та 12 днів, та загальну кількість лейкоцитів та нейтрофілів вимірювали за допомогою автоматичного приладу вимірювання гемоцитів (НЕМАVET 850, Drew Scientific Ltd., UK). Періоди, що розпочинали відновлення нейтрофілів, знижували за допомогою протиракового агента та періоди, потрібні для відновлення нейтрофілів, у кон'югаті Прикладу та кон'югатах Порівняльних прикладів 5 та 6, були подібними. Проте, час досягнення максимальної кількості нейтрофілів у кон'югаті Прикладу 1 був, приблизно, на 12 годин меншим, ніж для кон'югатів Порівняльних прикладів 5 та 6. Площа під збільшеною кривою кількість нейтрофілів-час (AU-NC) кон'югату Прикладу 1 була найбільшою (Таблиця 4: Аналіз активності проліферації нейтрофілів кон'югатів PEG-GCSF у тваринній моделі, де вводили протиракові ліки). Тому, було підтверджено, що кон'югат монотриланцюгового PEG-G-CSF мав швидкий вплив на проліферацію нейтрофілів. Таблиця 4 G-CSF Збільшення нейтрофілів Час відновлення нейтрофілів* Пік нейтрофілів AU-NC (×109 клітин-день/л) Приклад 1 2 дня 4, 5 днів 6 днів 24,4 2 дня 4, 5 днів 5, 5 днів 54,0 Порівняльний приклад 5 2 дня 4, 5 днів 6 днів 52,1 Порівняльний приклад 6 2 дня 4, 5 днів 6 днів 34,6 1": Час на збільшення нейтрофілів після введення ліків. *: Час досягнення 1,000/мМ3 чи більш нейтрофілів після введення протиракових ліків. Промислова придатність Кон'югати триланцюгового PEG-G-CSF за даним винаходом є більш фарамцевтично стабільними, ніж кон'югати лінійного- чи дволанцюгового PEG-G-CSF у термінах PEGs, що відходять з PEGG-CSF кон'югатів та формування агрегатів кон'югатів. Також кон'югати за даним винаходом можуть бути застосовані без додаткових відділень ізомерів положень, оскільки кон'югати складаються з ізомерів положень, що мають подібну активність. Також, композиція за даним винаходом має дію безперервного продукування нейтрофілій та підвищений термін напів-виведення in vivo. 19 93284 20 21 93284 22 23 93284 24 25 93284 26 27 93284 28 29 Комп’ютерна верстка Т. Чепелева 93284 Підписне 30 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPeg-g-csp conjugate
Автори англійськоюJo, Yeong-Woo, Yoo, Won-Young, Jeon, Hyun-Kyu, Choi, Yun-Kyu, Jang, Hye-In, Kim, Byong-Moon, Lee, Sung-Hee, Kang, Soo-Hyung, Yoo, Moo-Hi
Назва патенту російськоюПолиэтиленгликоль-g-csf конъюгат
Автори російськоюЙо Еонг-By, Йоо Вун-Йонг, Джеон Хьюн-Кюю, Чои Юн-Кюю, Янг Хие-Ин, Ким Вьонг-Мун, Ли Сунг-Хи, Канг Cy-Хьюнг, Йоо My-Хи
МПК / Мітки
МПК: A61P 37/04, A61K 31/765
Мітки: поліетиленгліколь-g-csf, кон'югат
Код посилання
<a href="https://ua.patents.su/15-93284-polietilenglikol-g-csf-konyugat.html" target="_blank" rel="follow" title="База патентів України">Поліетиленгліколь-g-csf кон’югат</a>
Попередній патент: Пристрій для виміру витрат газу
Наступний патент: Геліовітронагрівач текучих середовищ та плавких речовин
Випадковий патент: Засіб допосівної обробки насіння і рослин "біогет" і спосіб його отримання