Фторовані похідні катарантину, їх одержання та застосування як прекурсорів димерних алкалоїдів vinca
Номер патенту: 95649
Опубліковано: 25.08.2011
Автори: Джованеллі Емерсон, Дорі Ерік, Руссо Бернар, Ельє Поль, Муасан Льонель, Комесс Себастьєн
Формула / Реферат
1. Фторовані похідні катарантину, які відповідають загальній формулі І:
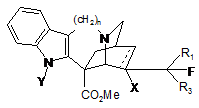 , I
, I
в якій:
- пунктирна лінія означає можливість присутності подвійного зв'язку, коли заміщення -X відсутнє, або простого зв'язку, коли -X означає заміщення групою:
•Н,
• OR,
• NR'R",
• SR або
• атомом галогену, де R, R' та R" незалежно один від одного означають атом водню або нормальну або розгалужену алкільну групу С1-С6,
- R1, R2 та R3 незалежно один від одного являють собою атом водню, фтору або метильовану групу, за умови, що за інших рівних умов щонайменше один з радикалів R1 та R2 являє собою атом фтору, і
- n=1 або 2.
2. Похідне 20,20-дифторкатарантин за п. 1 формули І, в якій подвійний зв'язок, позначений пунктирною лінією, присутній, R1 являє собою метильовану групу, кожен R2, R3 являє собою атом фтору, і n=2.
3. Похідне 20-фторкатарантин за п. 1 формули І, в якій подвійний зв'язок, позначений пунктирною лінією, присутній, R1, R2 та R3 являють собою відповідно атом водню, фтору і метильовану групу, та n=2.
4. Похідне 20,20-дифтор-4-гідроксикатарантин за п. 1 формули І, в якій подвійний зв'язок, позначений пунктирною лінією, відсутній, -Х являє собою групу -ОН, R1 являє собою метильовану групу, кожен R2, R3 являє собою атом фтору, і n=2.
5. Застосування фторованого похідного катарантину за будь-яким з пп. 1-4 як проміжної сполуки синтезу, що використовується для одержання фторованих димерних алкалоїдів Vinca, і, зокрема, вінфлуніну.
6. Застосування за п. 5, яке відрізняється тим, що одержання димерного алкалоїду включає реакцію сполучення з віндоліном або з похідним віндоліну.
7. Застосування за п. 6, яке відрізняється тим, що вінфлунін одержують шляхом сполучення віндоліну з 20,20-дифторкатарантином з одержанням в результаті 20',20'-дифтор-3',4' -ангідровінбластину.
8. Застосування за п. 7, яке відрізняється тим, що 20',20'-дифтор-3',4'-ангідровінбластин, одержаний в результаті вказаного сполучення, піддають реакції звуження кільця з подальшою реакцією відновлення внутрішньо кільцевого подвійного зв'язку в положенні С3'-С4'-.
9. Спосіб одержання фторованого похідного катарантину за будь-яким з пп. 1-4, який характеризується тим, що включає окиснення бічного ланцюга катарантину перед реакцією фторування.
10. Спосіб за п. 9, який відрізняється тим, що вказаному окисненню передує стадія активації бічного ланцюга шляхом ізомеризації внутрішньокільцевого подвійного зв'язку у внутрішньокільцевому положенні шляхом каталітичної гідрогенізації.
11. Спосіб за п. 10, який відрізняється тим, що позакільцевий подвійний зв'язок піддають реакції дигідроксилювання після захисту двох атомів азоту, що приводить в результаті до утворення діолу.
12. Спосіб за п. 11, який відрізняється тим, що одержаний діол активують у формі циклічного сульфату, перетворюють в аліловий спирт, потім окиснюють до відповідного енону, який піддають реакції дифторування, потім видаленню захисту індолу і відновленню амідної групи з одержанням в результаті 20,20-дифторкатарантину.
13. Спосіб за п. 9, який відрізняється тим, що включає захист двох атомів азоту катарантину з подальшим алільним окисненням бічного ланцюга катарантину до спирту або до кетону перед реакцією фторування.
14. Спосіб за п. 9, який відрізняється тим, що стадію окиснення здійснюють в умовах, що приводять до утворення окисненого похідного катарантину, який відповідає загальній формулі II:
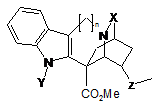 , II
, II
в якій:
- n=1 або 2,
- Х означає групу С=О або C=S,
- Y означає групу CO2R, SO2R або COR, де R означає арильну групу або нормальну або розгалужену С1-С4алкільну групу, і
- Z означає групу СН-ОН або С=О.
15. Окиснене похідне катарантину, яке відповідає загальній формулі II:
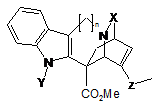 , II
, II
в якій:
- n=1 або 2,
- X означає групу С=О або C=S,
- Y означає групу CO2R, SO2R або COR, де R означає арильну групу або нормальну або розгалужену С1-С4алкільну групу, і
- Z означає групу СН-ОН або С=О.
16. Окиснене похідне катарантину за п. 15 формул II, в якій
- n=2,
- X означає групу С=О,
- Y означає групу CO2R, де R означає нормальну або розгалужену групу С1-С4,
- Z означає групу СН-ОН або С=О.
17. Застосування окисненого похідного катарантину за будь-яким з пп. 15 та 16 як проміжної сполуки синтезу, що використовується для одержання фторованих димерних алкалоїдів Vinca, і, зокрема, вінфлуніну.
18. Застосування за п. 17, яке відрізняється тим, що одержання димерного алкалоїду включає реакцію фторування окисненого похідного катарантину з подальшим видаленням захисту двох атомів азоту, що приводить в результаті до одержання фторованого похідного катарантину за будь-яким з пп. 1-4.
19. Застосування за п. 18, яке відрізняється тим, що одержання димерного алкалоїду додатково включає реакцію сполучення між вказаним фторованим похідним катарантину, одержаним в результаті реакцій фторування і видалення захисту, і віндоліном або похідним віндоліну.
20. Застосування за будь-яким з пп. 17-19, яке відрізняється тим, що вінфлунін одержують шляхом сполучення віндоліну з 20,20-дифторкатарантином, одержаним шляхом фторування і видалення захисту двох атомів азоту окисненого похідного катарантину за п. 16, для якого Z являє собою С=О, що приводить в результаті до одержання 20',20'-дифтор-3',4'-ангідровінбластину.
21. Застосування за п. 20, яке відрізняється тим, що 20',20'-дифтор-3',4'-ангідровінбластин, одержаний в результаті вказаного сполучення, піддають реакції звуження кільця з подальшою реакцією відновлення внутрішньокільцевого подвійного зв'язку в положенні С3'-С4'.
22. Ізокатарантин формули (10):
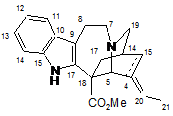 (10).
(10).
23. Застосування ізокатарантину як проміжної сполуки синтезу, що використовується для одержання фторованих димерних алкалоїдов Vinca, і, зокрема, вінфлуніну.
24. Застосування за п. 23, яке відрізняється тим, що одержання димерного алкалоїду включає реакцію сполучення з віндоліном або з похідним віндоліну.
25. Застосування за будь-яким з пп. 23 і 24, яке відрізняється тим, що вінфлунін одержують шляхом сполучення віндоліну з ізокатарантином з одержанням в результаті 4',20'-ангідровінбластину.
26. Застосування за п. 25, яке відрізняється тим, що 4',20'-ангідровінбластин, одержаний в результаті вказаного сполучення, піддають реакції звуження кільця з подальшою реакцією гем-дифторування, причому порядок цих двох стадій є зворотним.
Текст
1. Фторовані похідні катарантину, які відповідають загальній формулі І: C2 2 (19) 1 3 95649 12. Спосіб за п. 11, який відрізняється тим, що одержаний діол активують у формі циклічного сульфату, перетворюють в аліловий спирт, потім окиснюють до відповідного енону, який піддають реакції дифторування, потім видаленню захисту індолу і відновленню амідної групи з одержанням в результаті 20,20-дифторкатарантину. 13. Спосіб за п. 9, який відрізняється тим, що включає захист двох атомів азоту катарантину з подальшим алільним окисненням бічного ланцюга катарантину до спирту або до кетону перед реакцією фторування. 14. Спосіб за п. 9, який відрізняється тим, що стадію окиснення здійснюють в умовах, що приводять до утворення окисненого похідного катарантину, який відповідає загальній формулі II: X n N (II) N Y CO2Me z , в якій: - n=1 або 2, - Х означає групу С=О або C=S, - Y означає групу CO2R, SO2R або COR, де R означає арильну групу або нормальну або розгалужену С1-С4алкільну групу, і - Z означає групу СН-ОН або С=О. 15. Окиснене похідне катарантину, яке відповідає загальній формулі II: (II) N CO2Me 12 11 10 13 14 N Y фторованих димерних алкалоїдів Vinca, і, зокрема, вінфлуніну. 18. Застосування за п. 17, яке відрізняється тим, що одержання димерного алкалоїду включає реакцію фторування окисненого похідного катарантину з подальшим видаленням захисту двох атомів азоту, що приводить в результаті до одержання фторованого похідного катарантину за будь-яким з пп. 1-4. 19. Застосування за п. 18, яке відрізняється тим, що одержання димерного алкалоїду додатково включає реакцію сполучення між вказаним фторованим похідним катарантину, одержаним в результаті реакцій фторування і видалення захисту, і віндоліном або похідним віндоліну. 20. Застосування за будь-яким з пп. 17-19, яке відрізняється тим, що вінфлунін одержують шляхом сполучення віндоліну з 20,20дифторкатарантином, одержаним шляхом фторування і видалення захисту двох атомів азоту окисненого похідного катарантину за п. 16, для якого Z являє собою С=О, що приводить в результаті до одержання 20',20'-дифтор-3',4'-ангідровінбластину. 21. Застосування за п. 20, яке відрізняється тим, що 20',20'-дифтор-3',4'-ангідровінбластин, одержаний в результаті вказаного сполучення, піддають реакції звуження кільця з подальшою реакцією відновлення внутрішньокільцевого подвійного зв'язку в положенні С3'-С4'. 22. Ізокатарантин формули (10): 8 7 z , в якій: - n=1 або 2, - X означає групу С=О або C=S, - Y означає групу CO2R, SO2R або COR, де R означає арильну групу або нормальну або розгалужену С1-С4алкільну групу, і - Z означає групу СН-ОН або С=О. 16. Окиснене похідне катарантину за п. 15 формул II, в якій - n=2, - X означає групу С=О, - Y означає групу CO2R, де R означає нормальну або розгалужену групу С1-С4, - Z означає групу СН-ОН або С=О. 17. Застосування окисненого похідного катарантину за будь-яким з пп. 15 та 16 як проміжної сполуки синтезу, що використовується для одержання Даний винахід стосується фторованих похідних катарантину, їх одержання та їх застосування 15 N H 19 9 17 X n 4 17 18 N 5 14 15 (10). 4 CO2Me 20 21 23. Застосування ізокатарантину як проміжної сполуки синтезу, що використовується для одержання фторованих димерних алкалоїдов Vinca, і, зокрема, вінфлуніну. 24. Застосування за п. 23, яке відрізняється тим, що одержання димерного алкалоїду включає реакцію сполучення з віндоліном або з похідним віндоліну. 25. Застосування за будь-яким з пп. 23 і 24, яке відрізняється тим, що вінфлунін одержують шляхом сполучення віндоліну з ізокатарантином з одержанням в результаті 4',20'ангідровінбластину. 26. Застосування за п. 25, яке відрізняється тим, що 4',20'-ангідровінбластин, одержаний в результаті вказаного сполучення, піддають реакції звуження кільця з подальшою реакцією гемдифторування, причому порядок цих двох стадій є зворотним. як попередника (прекурсору) фторованих димерних алкалоїдів Vinca і, зокрема, вінфлуніну. 5 95649 6 Вінфлунін 1 являє собою протираковий засіб широкого спектру дії, розроблений лабораторіями Pierre Fabre. Ця молекула являє собою фторований аналог вінорельбіну 5 (Navelbine), який є стандартними ліками для лікування раку молочної залози і легені. Структура вінфлуніну є дуже схожою із структурою вінорельбіну, від якої вона відрізняється лише присутністю гем-дифторованої в положенні С20' групи, і відсутністю подвійного зв'язку С3'-С4'. Вінфлунін 1 (Javlor) є найбільш активною фторованою сполукою, відкритою останніми роками. В даний час він знаходиться у фазі III клі нічних випробувань при лікуванні раку молочної залози, сечового міхура і легені і на сьогоднішній день оголошений найбільш перспективною молекулою, яка має походження з сімейства алкалоїдів Vinca. Вінфлунін може бути одержаний з попередника 3',4'-ангідровінбластину 4, який одержують шляхом сполучення двох субодиниць катарантину 2 і віндоліну 3, які екстрагують безпосередньо з листя барвінку (схема 1). Альтернативно вінфлунін може бути одержаний шляхом прямого фторування вінорельбіну. Потім 3',4'-ангідровінбластин 4 може бути перетворений у вінорельбін 5 шляхом звуження кільця або у вінфлунін 1 шляхом введення двох атомів фтору на боковому ланцюзі «північного» фрагмента з подальшим звуженням кільця (схема 2). Ця реакція фторування має місце в надкислотному середовищі (HF-SbF5) у присутності хлорованого розчинника. Ці умови реакції є особливо сильнодіючими, такими, що призводять в результаті до часткового розпаду димерного ал калоїду 4 і, отже, до падіння загального хімічного виходу цього перетворення. Дифторування гема в С20' протікає із супутнім відновленням подвійного зв'язку С3'-С4. Стереохімічний центр, утворений при 4', має абсолютну конфігурацію (R). Вінфлунін може бути також одержаний шляхом фторування вінорельбіну 5 (Navelbine). Його синтез здійснюють шляхом звуження кільця 3',4' ангідровінбластину 4. 3',4'-ангідровінбластин 4 є дорогим продуктом. Стадія фторування, таким чином, викликає знищення значної кількості цієї цінної проміжної сполуки. Ця ситуація є ризикованою, призводячи 7 95649 8 в результаті час від часу до сильного зростання потреби в листі барвінку. Декілька стратегій знаходяться у стадії дослідження для продовження розробки вінфлуніну 1. На підставі спостереження, що фторування 3',4'-ангідровінбластину в надкислотній суміші модифікує лише його «північний» фрагмент, який має походження від катарантину, в обсязі даного винаходу запропоноване рішення, яке полягає у введенні атомів фтору безпосередньо в каркас катарантину 2. Цей підхід має ряд переваг: він вводить атом фтору на ранній стадії в синтезі в продукт з меншою вартістю, ніж 3',4'ангідровінбластин 4. Потім синтез вінфлуніну може бути досягнутий за допомогою сполучення, яке імітує біологічне, з віндоліном 3. Дійсно, 20'20'-дифторкатарантин 6 можна потім піддавати сполученню з віндоліном 3 з одержанням 3',4'ангідро-20',20'-дифторвінбластину 7. Останній, нарешті, перетворюють у вінфлунін 1 в процесі, знайомому фахівцям в даній галузі техніки шляхом реакції звуження кільця з подальшим відновленням ненасиченого подвійного зв'язку С3'-С4 (схема 3). Даний підхід також дає можливість одержання інших вихідних дифторованих похідних (3',4'ангідро-20',20'-дифторвінбластину 7, 20',20'дифторвінорельбіну 8), які неможливо одержати у загальноприйнятих надкислотних умовах. Ці молекули викликають все більший інтерес, оскільки дослідження взаємозв'язку структури та активності показало, що ділянка 4' та 20' алкалоїдів Vinca сильно пов'язана з їх протипухлинною активністю. Також в результаті сполучення проміжних сполук синтезу (і похідних) фторованого катарантину подібним чином одержують інші вихідні фторовані похідні димерних алкалоїдів Vinca. Таким чином, даний винахід стосується фторованих похідних катарантину, які відповідають загальній формулі І: - пунктирна лінія означає можливість присутності подвійного зв'язку, коли заміщення -X відсутнє, або простого зв'язку, коли -X означає заміщення групою: Н, OR, NR'R", SR або атомом галогену, де R, R' та R" незалежно один від одного означають атом водню, або нормальну або розгалужену алкільну групу С1-С6, - R1, R2 та R3 незалежно один від одного являють собою атом водню, фтору або метильовану групу, за умови, що щонайменше один з радикалів R1 та R2 являє собою атом фтору, і - n = 1 або 2. Даний винахід також стосується застосування цих фторованих похідних як проміжних сполук синтезу, корисних для одержання фторованих димерних алкалоїдів Vinca, зокрема, як учасників реакції в реакції сполучення з віндоліном або з похідним віндоліну. Зокрема, вінфлунін повинен бути одержаний шляхом сполучення віндоліну і 20,20-20,20-дифторкатарантину, що призводить в результаті до 20',20'-дифтор-3',4'ангідровінбластину, який, у свою чергу, слід піддавати реакції звуження кільця з подальшою реакці в якій: 9 95649 10 єю відновлення внутрішньокільцевого подвійного зв'язку в положенні С3'-С4'. Введення атомів фтору в катарантин 2 слід розглядати за допомогою окиснення бокового ланцюга катарантину і фторування. Одержання фторованих похідних катарантину за винаходом включає, таким чином, стадію окиснення бокового ланцюга катарантину, яку здійснюють в умовах, які призводять до окисненого похідного катарантину, який відповідає загальній формулі II: - Υ означає групу CO2R, де R означає нормальну або розгалужену алкільну групу С1-С4, і - Ζ означає групу СН-ОН або С=О. Даний винахід також стосується застосування цих окиснених похідних як проміжних сполук синтезу, корисних для одержання фторованих димерних алкалоїдів Vinca, зокрема, вінфлуніну. Дане одержання включає фторування окисненого похідного катарантину з подальшим видаленням захисту двох атомів азоту, що призводить в результаті до фторованого похідного катарантину за винаходом. Це одержання додатково включає реакцію сполучення між вказаним фторованим похідним і віндоліном або похідним віндоліну. Зокрема, вінфлунін одержують в результаті сполучення віндоліну і 20,20-дифторкатарантину одержаного шляхом фторування і видалення захисту двох атомів азоту окисненого похідного катарантину, як визначено вище, для якого n = 2, X = С=О, Υ = CO2R, де R є таким, як визначено вище, Ζ = С=О, що призводить в результаті до 20',20'-дифтор-3',4'ангідровінбластину, який, у свою чергу, слід піддавати реакції звуження кільця з подальшою реакцією відновлення внутрішньокільцевого подвійного зв'язку в положенні С3'-С4'. Термін «арил» стосується тут циклічної ароматичної групи з 5-7 атомів вуглецю, яка можливо містить гетероатом, зокрема, атом кисню або азоту, як, наприклад, фенільна або піридинільна група. Таким чином, як приклад, 20,20дифторкатарантин можна синтезувати, як описано нижче. Активація бокового ланцюга може бути досягнута шляхом ізомеризації внутрішньокільцевого подвійного зв'язку у внутрішньокільцевому положенні перед подальшим введенням функціональної групи. Реакцію ізомеризації сполуки 2 в сполуку 10 проводять при парціальному тиску водню у присутності паладію на вуглеці. Потім індольне кільце захищають у формі метилкарбамату 11, а третинний атом азоту у формі аміду 12. в якій: - n = 1 або 2, - X означає групу С=О або C=S, - Υ означає групу CO2R, SO2R або COR, де R означає арильну групу, або нормальну або розгалужену алкільну групу С1-С4, і - Ζ означає групу СН-ОН або C=O. Таким чином, даний винахід стосується також окиснених похідних катарантину, які відповідають загальній формулі II: в якій: - n = 1 або 2, - X означає групу С=O або C=S, - Υ означає групу CO2R, SO2R або COR, де R означає арильну групу, або нормальну або розгалужену алкільну групу С1-С4, і - Ζ означає групу СН-ОН або С=O. Переважним окисненим похідним катарантину відповідно до формули II є похідне, де: - n = 2, - X означає групу С=О, 11 Потім подвійний зв'язок сполуки 12 дигідроксилюють OsO4, і одержаний в результаті діол 13 двічі активують у формі циклічного сульфату 14. Аліловий спирт 15 одержують під дією тетрабутиламонію фториду з подальшою обробкою сірчаною кислотою. Потім функціональну групу спирту окиснюють ΜnO2, і одержаний в результаті енон 16 дифторують під дією Deoxofluor (біс(2-метоксіетил)аміносульфіду трифториду). Захисну групу індолу (карбамат) видаляють під дією карбонату калію в метанолі. Амідну групу 17, нарешті, відновлюють з одержанням в результаті 20,20-дифторкатарантину 6. Останній можна, таким самим шляхом, як катарантин природного 95649 12 походження, піддавати сполученню з віндоліном з одержанням фторованого аналога 3',4'ангідровінбластину (7), який після звуження кільця утворює в результаті фторований аналог вінорельбіну (8). Нарешті, селективне відновлення подвійного зв'язку північного фрагмента призводить в результаті до утворення вінфлуніну 1. Відповідно до одного з варіантів синтезу аліловий спирт 15 може бути також одержаний шляхом первинного захисту індольного кільця катарантину 2 метилкарбаматом (сполука 26) і третинного азоту у формі аміду 27. Останній потім можна окиснювати безпосередньо до алілового спирту 15 SeO2 (схема 6). 13 95649 14 Проміжні сполуки синтезу до 20,20дифторкатарантину 6 можна використовувати шляхом функціональних перегруповувань, які призводять в результаті не до 20,20дифторкатарантину, а до його структурних аналогів. Ці аналоги можна, таким самим шляхом, що і катарантин природного походження, піддавати сполученню з віндоліном з одержанням в результаті відповідних фторованих димерних алкалоїдів. Відповідно, починаючи з проміжної сполуки 13, в результаті окиснення функціональної групи вторинного спирту одержують кетон 18. В результаті фторування кетоспирту 18 DAST (діетиламіносульфіду три фторидом) утворюється дифторспирт 19. Останній можна, після звичайних стадій видалення захисту ( 20), піддавати сполученню з віндоліном з утворенням дифторованого аналога 21 вінбластину, який, подібно до цього алкалоїду, має істотні протиракові властивості (схема 7). Крім того, введення єдиного атома фтору в каркас катарантину можливо від проміжної сполуки 15 (схема 8). Коли останню обробляють DAST, утворюється монофторований продукт бокового ланцюга (22). Як вже згадано вище, цей продукт призводить в результаті до монофтор аналогів 3'4'-ангідро-20'-фторвінбластину 24 та 20'-фторвінорельбіну 25, які можуть призвести до монофторованого аналога вінфлуніну в результаті додаткової стадії відновлення подвійного зв'язку. 15 95649 16 Нарешті, ізокатарантин 10 можна також використовувати як проміжну сполуку синтезу при одержанні фторованих димерних алкалоїдів Vinca, і, зокрема, вінфлуніну. Дане одержання включає реакцію сполучення між вказаним ізокатарантином і віндоліном або похідним віндоліну. Таким чином, вінфлунін 1 може бути одержаний шляхом сполучення віндоліну 3 та ізокатарантину, що призводить в результаті до 4',20'ангідровінбластину 28. Потім дану проміжну сполуку можна піддавати дифторуванню, використовуючи умови, описані для фторування 3',4'ангідровінбластину 4 (J.-C. Jacquesy et al., Journal of Fluorine Chemistry, 2002, 114, 139). Одержаний продукт (4'R)-4'-дезокси-20',20'-дифторвінбластин 30, ідентичний продукту, утвореному шляхом фторування 3',4'-ангідровінбластину 4. Перетворення 30 у вінфлунін 1 шляхом звуження кільця описане в літературі (J.-C. Jacquesy et al., Journal of Fluorine Chemistry, 2002,114, 139) (Схема 9). Альтернативно вінфлунін 1 може бути також одержаний шляхом звуження кільця 4',20'ангідровінбластину 28, що призводить в результаті до сполуки 29, з подальшим гемдифторуванням відповідно до таких самих способів, як описано вище. Таким чином, виявляється, що в даному винаході запропонована альтернативна стратегія класичному синтезу вінфлуніну, що дає можливість використовувати більш ефективний і, отже, більш економічний спосіб. Крім того, використання фторованих проміжних сполук катарантину згідно з винаходом, наприклад: 20-фторкатарантину 23 і 20,20-дифтор-3-гідро-4-гідроксикатарантину 20, в реакціях сполучення з віндоліном 3 дозволяє одержати нові димерні алкалоїди, які мають потенційні протиракові активності. Інші конкретні структурні аналоги вінорельбіну і вінфлуніну також легко доступні за допомогою даного способу. Всі способи одержання і схеми реакцій, описані тут вище, деталізовані у випадку одержання фторованих похідних катарантину, які відповідають загальній формулі (І), в якій n = 2. Всі відповідні похідні, які відповідають загальній формулі (І), в якій n = 1 можуть бути легко одержані способом звуження кільця північної ділянки димерів, яка має походження від катарантину, за допомогою методик, відомих фахівцям в даній галузі техніки, і, зокрема, тих, які описані в Andriamialisoa, R.Z.; Langlois, N.; Langlois Y.; Potier P. Tetrahedron, 1980, 36, 3053-3060. 17 Далі даний винахід описаний детальніше за допомогою прикладів одержання, згаданих тут нижче шляхом ілюстрації основних стадій, що призводять в результаті до фторованих похідних катарантину, і, зокрема, до 20,20дифторкатарантину. Ізокатарантин (10) До суспензії паладію (10% мас/мас) на вуглеці (5,7 г, 5,4 ммоль, 0,2 екв.), заздалегідь активованою воднем в МеОН (150 мл), додають (+) катарантин 2 (9,0 г, 26,8 ммоль, 1 екв.) в розчині в МеОН (100 мл). Реакційну суміш поміщають при зниженому тиску в атмосферу водню (0,3 Бар), потім виділяють і залишають при зниженому тиску при перемішуванні при температурі оточуючого середовища. За реакцією стежать за допомогою 1 H ЯМР доти, доки вихідний продукт не зникне (близько 2 годин). Потім реакційну суміш фільтрують на целіті 545, потім перекристалізують в МеОН з одержанням сполуки 10 (6,5 г, 19,3 ммоль, 72%) у формі напівпрозорих кристалів. -1 Хімічна формула: C21H24N2O2 Μ=336 г.моль Rf=0.35 (Гексан/AcOEt 3/7) F=78°C-81°C 1 H ЯМР (CDCl3): 8.08 (sI, 1Н, NH); 7.53 (d, J=7.3 Гц, 1Н, H-11); 7.26 (d, J=7.3 Гц, 1Н, H-14); 7.22-7.10 (m, 2H, H-12 та H-13); 5.48-5.32 (m, 1H, H-20); 4.05 (s, 1H, H-5); 3.73 (s, 3H, CO2CH3); 3.623.46 (m, 1H, H-7); 3.44-3.24 (m, 2H, H-7 та H-8); 3.18-3.10 (m, 1H, H-19); 3.08-2.92 (m, 2H, H-19 та H-8); 2.88-2.74 (m, 1H, H-1); 2.44-2.26 (m, 2H, H-3); 2.20-2.08 (m, 1H, H-2); 1.90-1.78 (m, 1H, H-1); 1.62 (d, J=6.7 Гц, 3Н, H-21). 13 С ЯМР (CDCl3): 175.2; 137.7; 135.9; 129.5; 122.6; 120.1; 119.4; 119.0; 111.2; 111.1; 64.2; 56.1; 53.8; 53.3; 51.1; 38.0; 30.3; 27.9; 22.0; 13.4. IK (плівка): 3368, 2916, 2855, 1714, 1461, 1264, -1 740 см . + MS (ESI TOF): 337 [M+H ] (100). 20 []D =+35 (c=2,3;CHCl3) Na-карбометоксіізокатарантин (11) До суспензії гідриду калію (0,72 г, 6,3 ммоль, 1,5 екв.) в ТГФ (10 мл) при 0°С додають по краплях розчин 10 (1,35 г, 4 ммоль, 1 екв.) в ТГФ (20 мл). Після 30 хвилин при перемішуванні при 0°С додають по краплях метилхлорформіат (0,5 мл, 6,3 ммоль, 1,5 екв.). Після 1 години при перемішуванні при 0°С реакційну суміш доводять до темпе 95649 18 ратури оточуючого середовища, і перемішування підтримують протягом 18 годин. Додають водний розчин насиченого K2СО3 (10 мл). Водну фазу екстрагують СН2СІ2 (320 мл), органічні фази збирають, висушують на Na2SO4 і концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі (елюент: СН2СІ2/МеОН 97/3) з одержанням 11 (1,3 г, 3,3 ммоль, 82%) у формі білої твердої речовини. -1 Хімічна формула: C23H26N2O4 Μ=394 г.моль Rf=0,4 (СН2СІ2/MeOH 94/6) F=62°С-64°С 1 H ЯМР (CDCl3): 8.08 (d, J=7.9 Гц, 1Н, H-11); 7.48 (d, J=7.3 Гц, 1Н, Н-14); 7.38-7.16 (m, 2H, H-12 та Н-13); 5.32-5.18 (m, 1H, Н-20); 4.06 (s, 1H, Н-5); 3.86 (s, 3H, СО2СН3); 3.68 (m, 1Н, Н-7); 3.54 (s, 3Н, СО2СН3); 3.40-3.12 (m, 2Н, Н-7 та Н-8); 2.99 (m, 1H, Н-19); 2.86 (m, 1Н, Н-19); 2.80-2.65 (m, 2Н, Н-8 та Н-1); 2.44 (d, J=16 Гц, 1Н, Н-3); 2.30 (d, J=16 Гц, 1Н, Н-3); 2.06 (m, 1Н, Н-2); 1.76 (d, J=14 Гц, 1Н, Н1); 1.56 (d, J=6.7 Гц, 3Н, Н-21). 13 С ЯМР (CDCl3): 173.4; 151.8; 138.1; 135.8; 129.5; 124.6; 122.7; 119.7; 118.2; 115.5; 60.6; 57.9; 54.1; 53.0; 52.0; 37.5; 29.7; 27.9; 21.8; 12.6. + MS (ESI TOF): 395 [M+H ] (100). HRMS (TOF MS ES+): Значення, обчислене для C23H27N2O4 395,1971 Виявлене значення 395,1956 20 []D =+48(c=1,0; CHCl3) Nа-карбометокси-19-оксоізокатарантин (12) До 5 мл водного розчину Nа2СО3 (675 мг, 6,4 ммоль, 9,3 екв.) додають розчин 11 (270 мг, 0,69 ммоль, 1 екв.) в ТГФ (10 мл). Додають по краплях розчин йоду (800 мг, 3,2 ммоль, 4,6 екв.) в ТГФ (12 мл) при 0°С. Потім реакційну суміш доводять до температури оточуючого середовища і перемішують протягом 18 годин. Потім додають насичений водний розчин Nа2S2О3 (15 мл), і реакційну суміш залишають при перемішуванні на 30 хвилин. Потім водну фазу екстрагують СН2СІ2 (320 мл). Органічні фази об'єднують, висушують на Na2SO4 і концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі (Елюент: СН2СІ2/МеОН 98/2) з одержанням 12 (230 мг, 0,56 ммоль, 82%) у формі білої твердої речовини. -1 Хімічна формула: C23H24N2O5 Μ=408 г.моль Rf=0,4 (СН2СІ2/MeOH 94/6) F=94°С-96°С 1 H ЯМР (CDCl3): 8.04-7.97 (m, 1Н, H-11); 7.527.43 (m, 1Н, H-14); 7.36-7.21 (m, 2H, H-12 та Н-13); 5.53-5.41 (m, 1Н, Н-20); 4.66 (s, 1Н, Н-5); 4.32-4.17 (m, 1Н, Н-7); 3.93 (s, 3Н, СО2СН3); 3.60 (s, 3Н, СО2СН3); 3.28-3.15 (m, 3Н, Н-7 та Н-8); 2.97 (dd, J=14 Гц та J=1.8 Гц, 1Н, H-1); 2.84-2.76 (m, 1H, H2); 2.56-2.48 (m, 2H, H-3); 2.00-1.89 (m, 1H, H-1); 1.59 (d, J=6.7 Гц, 3Н, Н-21). 19 95649 20 13 C ЯМР (CDCI3): 174.6; 172.0; 151.6; 136.4; 135.1; 132.5; 129.2; 124.9; 122.8; 120.9; 118.1; 117.0; 115.6; 61.5; 60.1; 58.7; 53.2; 52.1; 40.3; 38.9; 37.2; 28.5; 21.2; 20.8; 13.9; 13.1. + + MS (ESI TOF): 409 [M+H ] (100); 817 [2M+H ] (34). 20 []D =+255 (c=0,4 ; CHCl3) (4R,20R)-Nа-карбометокси-3-гідро-4,20дигідрокси-19-оксокатарантин (13) До розчину 12 (1,26 г, 3,08 ммоль, 1 екв.) в суміші ацетон/вода (8/1) (27 мл) при 0°С додають OsO4 в розчині в t-ВuОН (2,5%, 1,9 мл, 0,154 ммоль, 0,05 екв.), потім порціями через 15 хвилин NMO (0,72 г, 6,2 ммоль, 2 екв.). Після 15 хвилин при 0°С реакційну суміш залишають при перемішуванні при температурі оточуючого середовища протягом 18 годин. Реакцію зупиняють додаванням насиченого водного розчину Na2S2O3 (15 мл) і води (15 мл) і залишають при перемішуванні на 20 хвилин. Реакційну суміш екстрагують СН2СІ2 (430 мл). Органічні фази об'єднують, висушують на Na2SO4 і концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі (Елюент: СН2СІ2/МеОН 97/3) з одержанням 13 (1,16 г, 2,61 ммоль, 85%) у формі білої твердої речовини. -1 Хімічна формула: C23H26N2O7 Μ=442 г.моль Rf=0,5 (СН2СІ2/MeOH 9/1) F=102°C-104°C 1 H ЯМР (CDCl3): 7.98 (d, J=7.9 Гц, 1Н, H-11); 7.44 (d, J=7.9 Гц, 1Н, Н-14); 7.35-7.20 (m, 2H, Н-12 та Н-13); 4.77 (s, 1H, Н-5); 4.30-4.18 (m, 1Н, Н-7); 4.05-3.93 (m, 1Н, Н-20); 3.92 (s, 3Н, СО2СН3); 3.63 (s, 3Н, СО2СН3); 3.34-3.08 (m, 3Н, Н-7 та Н-8); 2.88 (dd, J=14.0 Гц J=1.8 Гц, 1Н, Н-1); 2.65-2.60 (m, 1H, Н-2); 2.02-1.74 (m, 3Н, Н-1 та Н-3); 1.16 (d, J=6.1 Гц, 3Н, Н-21). 13 С ЯМР (CDCl3): 174.1; 172.5; 151.7; 135.3; 129.0; 125.1; 123.0; 118.2; 117.2; 115.6; 69.8; 59.2; 55.9; 53.4; 53.3; 52.9; 42.1; 38.5; 37.5; 36.7; 21.1; 17.8. IK (таблетка KBr): 3402, 2954, 1741, 1657, -1 1458, 760 см + + MS (ESI TOF): 443 [М+Н ] (11); 465 [M+Na ] + (100); 907 [2M+Na ] (36). HRMS (TOF MS ES+): Значення, обчислене для C23H26N2O7Na 465,1638 Виявлене значення 465,1631 20 []D =+97 (с=0,5 ; СНСl3) (4R,20R)-Nа-карбометокси-3-гідро-4,20дигідроксисульфат-19-оксокатарантин (14) До розчину діолу 13 (200 мг, 0,45 ммоль, 1 екв.) в СН2СІ2 (5 мл) при 0°С додають триетиламін (0,15 мл, 1,04 ммоль, 2,3 екв.), потім по краплях тіонілхлорид (43 мкл, 0,59 ммоль, 1,3 екв.). Після 30 хвилин при 0°С реакцію зупиняють додаванням насиченого розчину NaCl (5 мл) і води (5 мл). Водну фазу екстрагують СН2СІ2 (310 мл). Органічні фази об'єднують, висушують на Na2SO4 і концентрують у вакуумі. Потім сирий продукт поміщають безпосередньо в суміш 7,5 мл CH3CN і 6,5 мл Н2О та енергійно перемішують. Потім послідовно додають RuCl3 (5 мг, 0,023 ммоль, 0,05 екв.) та NaIO4 (242 мг, 1,13 ммоль, 2,5 екв.), і через 1 годину 30 хвилин додають Еt2О (12 мл). Перемішування продовжують протягом 10 хвилин. Водну фазу екстрагують 310 мл Еt2О, потім об'єднані органічні фази промивають водою (30 мл), насиченим розчином NaHCO3 (30 мл) і насиченим розчином NaCl (30 мл). Потім органічну фазу висушують на Na2SO4 і концентрують у вакуумі. В результаті очищення хроматографією на силікагелі (елюент СН2СІ2/МеОН 98/2) одержують 14 (137 мг, 0,27 ммоль, 60%) у формі білої твердої речовини. -1 Хімічна формула: C23H24N2O9S Μ=504 г.моль Rf=0,5 (СН2СІ2/MeOH 95/5) F=140°C-142°C 1 H ЯМР (CDCl3): 7.98 (d, J=7.3 Гц, 1Н, Н-11); 7.44 (d, J=7.3 Гц, 1Н, Н-14); 7.37-7.30 (m, 2Н, Н-12 та Н-13); 5.12 (s, 1Н, Н-5); 4.75 (q, J=6.7 Гц, 1Н, Н20); 4.24-4.13 (m, 1Н, Н-5); 3.99 (s, 3Н, СО2СН3); 3.68 (s, 3Н, СО2СН3); 3.53-3.47 (m, 1Н, Н-7); 3.352.95 (m, 2H, Н-8); 2.97 (dd, J=14.0 Гц та J=1.6 Гц, 1Н, Н-1); 2.90-2.85 (m, 1Н, Н-2); 2.45-2.38 (m, 2Н, Н-3); 2.02-1.96 (m, 1Н, Н-1); 1.64 (d, J=6.7 Гц, 3Н, Н-21).13 С ЯМР (CDCl3): 173.2; 171.5; 152.4; 136.1; 134.8; 129.3; 125.6; 123.5; 118.8; 117.5; 116.0; 94.8; 84.9; 56.9; 55.1; 54.0; 53.4; 40.9; 38.4; 37.7; 32.3; 21.2; 15.8. IK (таблетка KBr): 1735, 1687, 1459, 1382, -1 1215, 904 см . + + MS (ESI TOF): 505 [M+H ] (100); 1009 [M+Na ] (13). 20 []D =+165 (с=0,3; СНСI3) (20R)-Nа-карбометокси-20-гідрокси-19оксокатарантин (15) 21 До розчину сульфату 14 (1,59 г, 3,16 ммоль, 1 екв.) в ТГФ (25 мл) додають по краплях розчин NBu4F (1М в ТГФ, 6,3 мл, 6,3 ммоль, 2 екв.). Після 18 годин перемішування при температурі оточуючого середовища додають розчин H2SO4 2M в ТГФ (37 мл) і 3,7 мл води. Після 48 годин перемішування при температурі оточуючого середовища додають насичений розчин NaHCO3 (200 мл). Водну фазу екстрагують AcOEt (450 мл), органічні фази об'єднують, висушують на Na2SO4, фільтрують, потім концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі, і 15 (828 мг, 1,95 ммоль, 62%) виділяють у формі білої твердої речовини. -1 Хімічна формула: C23H24N2O6 Μ=424 г.моль Rf=0,3 (СН2СІ2/MeOH 95/5) F=188°C-190°C 1 H ЯМР (CDCl3): 7.98 (d, J=7.9 Гц, 1Н, Н-11); 7.44 (d, J=7.9 Гц, 1H, H-14); 7.35-7.20 (m, 2H, H-12 та H-13); 6.43 (d, J=6.3 Гц, 1H, H-3); 5.24 (d, J=1.7 Гц, 1Н, H-5); 4.41-4.33 (m, 1H, H-20); 4.17-4.03 (m, 1H, H-7); 3.94 (s, 3H, CO2CH3); 3.57 (s, 3H, CO2CH3); 3.47-3.17 (m, 4H, H-8, H-2 та H-7); 2.88 (dd, J=14.0 Гц та J=1.8 Гц, 1Н, Н-1); 2.02 (dd, J=14.0 Гц та J=1.8 Гц, 1Н, Н-1); 1.33 (d, J= 6.1 Гц, 3Н, Н-21). 13 С ЯМР (CDCl3): 174.1; 173.8; 152.0; 145.3; 136.6; 135.3; 129.3; 128.5; 125.1; 123.1; 118.4; 116.7; 115.8; 67.1; 58.0; 54.3; 53.6; 52.8; 44.0; 40.7; 38.4; 21.3; 21.1. IK (таблетка KBr): 3414, 2944, 1743, 1653, -1 1458, 1437, 1327, 1242, 754 см . + + MS (ESI TOF): 447 [M+Na ] (100); 871 [2M+Na ] (64). 20 []D =+181 (c=0,7 ; CHCI3) Na-карбометокси-19,20-діоксокатарантин (16) Розчин алілового спирту 15 (100 мг, 0,236 ммоль, 1 екв.) в 8 мл дихлорметану охолоджують до 0°С. До цього розчину в один прийом додають 140 мг активованого діоксиду марганцю (16 ммоль, 70 екв.). Одержану чорну суспензію перемішують при 0°С протягом 1 години 30 хвилин в атмосфері азоту, потім доводять до температури оточуючого середовища. Реакційну суміш фільтрують на целіті 545, потім ретельно промивають, використовуючи дихлорметан. Фільтрат концентрують при зниженому тиску з одержанням енону 16 (85 мг, 0,201 ммоль, 85%) у формі білої твердої речовини. -1 Хімічна формула: C23H22N2O6 Μ=422 г.моль Rf=0,4(EtOAc) F=108°C-110°C 1 H ЯМР (CDCl3): 8.01 (d, J=8.5 Гц, 1Н, Н-11); 7.49 (d, J=7.3 Гц, 1Н, H-14); 7.45 (d, J=6.7 Гц, 1H, H-3); 7.37-7.23 (m, 2H, H-12 та H-13); 5.80 (d, J=1.8 95649 22 Гц, 1Н, H-5); 4.18-4.02 (m, 1H, H-7); 3.91 (s, 3H, CO2CH3); 3.65 (m, 1H, H-2); 3.49 (s, 3H, CO2CH3); 3.48-3.34 (m, 1H, H-8); 3.32-3.16 (m, 2H, H-7 та Н8); 2.82 (dd, J=12.8 Гц та J=2.4 Гц, 1Н, Н-1); 2.35 (s, 3Н, Н-21); 2.07 (dd, J=13.4 Гц та J=3.0 Гц, 1Н, Н-1). 13 С ЯМР (CDCl3): 193.3; 172.2; 171.6; 151.9; 143.6; 142.3; 135.8; 135.3; 129.2; 125.2; 123.1; 118.4; 117.0; 115.8; 57.3; 53.5; 52.6; 52.5; 45.5; 41.3; 37.4; 24.6; 20.9. -1 IK (таблетка KBr): 1740, 1668, 1252, 751 см . + + MS (ESI TOF): 423 [М+Н ] (10); 445 [M+Na ] + (100); 867 [2M+Na ] (32). HRMS (TOF MS ES+): Значення, обчислене для C23H22N2О6Nа 445,1376 Виявлене значення 445,1357 20 []D =+183 (c=1,8; CHCl3) 20,20-дифтор-19-оксокатарантин (17) Фторування: Nа-карбометокси-20,20-дифтор19-оксокатарантин Енон 16 (300 мг, 0,71 ммоль, 1 екв.) поміщають в розчин в Deoxofluor (3 мл, 16,4 ммоль, 23 екв.). Потім додають три краплі етанолу, і реакційну суміш залишають при перемішуванні при 80°С на 24 години. Потім додають 0,6 мл Deoxofluor (3,3 ммоль, 5 екв.) і дві краплі етанолу і перемішування продовжують при цій температурі ще протя] гом 48 годин (за реакцією стежать по Н ЯМР до зникнення вихідного продукту). Реакційну суміш розводять в 200 мл дихлорметану, а потім додають 100 мл водного насиченого розчину K2СО3. Суміш залишають на 15 хвилин при перемішуванні при температурі оточуючого середовища, потім водну фазу екстрагують 350 мл дихлорметану. Органічні фази об'єднують висушують на Na2SO4 і концентрують у вакуумі. Потім сирий продукт очищають двома фільтраціями на силікагелі (СН2СІ2/МеОН 98/2 та С6Н12/АсОЕt 6/4), і залишок вступає в наступну стадію. -1 Хімічна формула: C23H22N2O5F2 Μ=444 г.моль Rf=0,3 (Гексан/AcOEt 40/60) 1 H ЯМР (CDCl3): 8.01-7.99 (m, 1Н, H-11); 7.537.47 (m, 1H, H-14); 7.38-7.28 (m, 2H, H-12 та H-13); 6.87-6.77 (m, 1H, H-3); 5.36 (d, J=1.8 Гц, 1H, H-5); 4.20-4.03 (m, 1H, H-7); 3.93 (s, 3Н, СО2СН3); 3.613.54 (m, 1Н, H-2); 3.57 (s, 3Н, СО2СН3); 3.45-3.20 (m, 3Н, Н-8 та Н-7); 2.93-2.83 (m, 1Н, Н-1); 2.091.98 (m, 1Н, Н-1); 1.81 (dd, J=18 Гц, J=18 Гц, 3Н, Н21). Видалення захисту індолу: 20,20-дифтор-19оксокатарантин (17) 23 До розчину вищеописаного захищеного 20,20дифторкатарантину в 100 мл метанолу додають в один прийом 2 г карбонату калію (14,5 ммоль), і суспензію перемішують при температурі оточуючого середовища протягом 18 годин. Потім до реакційної суміші, яка тепер стала прозорою, додають 50 мл води, і суміш екстрагують 350 мл дихлорметану. Об'єднані органічні фази висушують на Na2SO4 і концентрують при зниженому тиску. Одержаний залишок осаджують в суміші циклогексан/етилацетат 7/3 з одержанням 17 (118 мг, 0,307 ммоль, 43% в дві стадії) у формі білої твердої речовини. -1 Хімічна формула: C21H20F2N2O3 Μ=386 г.моль Rf=0,3 (СН2СІ2/MeOH 95/5) 1 H ЯМР (CDCl3): 7.95 (s, 1Н, NH); 7.52 (d, J=Гц, 1Н, H-11); 7.26 (d, J=Гц, 1Н, H-14); 7.16-7.11 (m, 2H, H-12 та Н-13); 6.83 (m, 1H, H-3); 5.55 (d, J=1 Гц, 1H, H-5); 4.24 (m, 1H, H-7); 3.67 (s, 3H, CO2CH3); 3.58 (m, 1H, H-2); 3.36-3.24 (m, 3Н, Н-8 та H-7); 2.82 (dd, J=13 Гц, J=2 Гц, 1H, H-1); 2.27 (dd, J=13 Гц, J=2 Гц, 1Η, Η-1); 1.82 (dd, J=18 Гц, J=18 Гц, 3Н, Н-21). 13 С ЯМР (CDCl3): 172.8; 171.6; 139.5 (t, J=30 Гц); 135.8; 135.2 (t, J=9 Гц); 133.8; 127.7; 122.4; 119.7; 119.1 (t, J=233 Гц); 118.4; 110.6; 108.8; 56.3; 53.6; 53.0; 44.0; 42.8; 35.6; 22.4 (t, J=28 Гц); 20.7. 20 []D =+155 (c=0,4;CHCl3). 20,20-дифторкатарантин (6) До розчину 17 (140 мг, 0,36 ммоль, 1 екв.) в 50 мл тетрагідрофурану додають в один прийом 360 мг боргідриду натрію (9,5 ммоль, 26,5 екв.)· Одержану в результаті суспензію охолоджують до 0°С і поміщають при перемішуванні в атмосферу азоту. Додають по краплях 1,9 мл (14,6 ммоль, 40,5 екв.) трифторборану діетилефірату, потім реакційну суміш доводять до температури оточуючого середовища і перемішують протягом 3 годин. Розчинник випаровують у вакуумі і замінюють 30 мл метанолу, до якого додають 6 мл води і 4,5 мл 10% розчину соляної кислоти. Все разом перемішують при температурі оточуючого середовища протягом 15 годин. Метанол випаровують і замінюють 20 мл дихлорметану. Суміш нейтралізують додаванням 40 мл насиченого водного розчину гідрокарбонату натрію, потім екстрагують 320 мл дихлорметану. Об'єднані органічні фази висушують на Na2SO4, 95649 24 концентрують при зниженому тиску. В результаті очищення залишку хроматографією на силікагелі (елюент: СН2СІ2/МеОН 98/2) одержують 74 мг (0,2 ммоль, 55%) 6 у формі білої твердої речовини. -1 Хімічна формула: C21H22F2N2O2 Μ=372 г.моль Rf=0,5 (СН2СІ2/MeOH 95/5) 1 H ЯМР (CDCl3): 7.68 (s, 1Н, NH); 7.53 (d, J=7.5 Гц, 1Н, H-11); 7.27 (d, J=7.5 Гц, 1Н, H-14); 7.20 (td, J=7.5 Гц, J=1.5 Гц, 1Н, H-13); 7.14 (td, J=7.5 Гц, J=1.5 Гц, 1Н, Н-12); 6.61 (m, 1Н, H-3); 4.64 (d, J=2 Гц, 1Н, Н-5); 3.72 (s, 3Н, СО2СН3); 3.63 (ddd, J=14 Гц, J=10 Гц, J=5 Гц, 1Н, Н-7); 3.43 (ddd, J=14 Гц, J=5 Гц, J=5 Гц, 1Н, Н-7); 3.32 (ddd, J=17 Гц, J=10 Гц, J=5 Гц, 1Н, Н-8); 3.01 (ddd, J=17 Гц, J=5 Гц, J=5 Гц, 1Н, Н-8); 2.88 (m, 3Н, Н-2 та Н-19);2.81 (dd, J=13 Гц, J=2 Гц, 1Н, Н-1); 1.84 (dd, J=18 Гц, J=18 Гц, 3Н, Н-21); 1.81 (d, J=13 Гц, 1H, Н-1). 13 С ЯМР (CDCl3): 173.4; 143.3 (t, J=28 Гц); 136.1; 135.3; 132.1 (t, J=9 Гц); 128.8; 122.1; 119.7 (t, J=232 Гц); 119.4; 118.3; 110.6; 110.4; 57.0; 55.3; 52.7; 52.3; 47.0; 37.0; 30.8; 22.6 (t, J=28 Гц); 21.6. + + SM (ESI TOF): 353 [M-HF+H ] (6) ; 373 [M+H ] (100). 20 []D =+43 (c=0,4; CHCI3). (4R)-Nа-карбометокси-3-гідро-4-гідрокси-19,20діоксокатарантин (18) До розчину оксалілхлориду (0,56 мл, 6,47 ммоль, 2,2 екв.) в СН2СІ2 (25 мл), що підтримується при -65°С (внутрішня температура), додають по краплях ДМСО (1,15 мл, 16,2 ммоль, 5,5 екв.) в розчині в СН2СІ2 (0,850 мл). Суміш перемішують протягом 20 хвилин, потім додають розчин діолу 13 (1,3 г, 2,94 ммоль 1 екв.) у СН2СІ2 (25 мл) по краплях, тоді як температуру регулюють між -60°С та -65°С. Після 45 хвилин перемішування додають триетиламін (3,7 мл, 26,5 ммоль, 9,0 екв.), потім температуру суміші доводять до температури оточуючого середовища за період 45 хвилин. Додають воду (20 мл) і розсіл (10 мл), потім реакційну суміш екстрагують СН2СІ2 (350 мл). Органічні фази об'єднують, висушують на Na2SO4 і концентрують у вакуумі. Потім сирий продукт очищають флеш-хроматографією на силікагелі (Елюент: СН2СІ2/МеОН 97/3) з одержанням кетоспирту 18 (647 мг, 1,47 ммоль 50%) у формі білої твердої речовини та 13 (520 мг, 1,17 ммоль, 40%). -1 Хімічна формула: C23H24N2O7 Μ=440 г.моль F=123°C-125°C Rf=0,2 (AcOEt) 1 H ЯМР (CDCl3): 7.97 (d, J=8.5 Гц, 1Н, H-11); 7.44 (d, J=7.3 Гц, 1Н, H-14); 7.35-7.20 (m, 2H, H-12 та H-13); 5.16 (sl, 1H, OH); 5.04 (s, 1H, H-5); 4.234.04 (m, 1H, H-7); 3.91 (s, 3H, CO2CH3); 3.48 (s, 3H, CO2CH3); 3.41-3.35 (m, 2H, H-7 та H-8); 3.35-3.11 (m, 1H, H-8); 2.85 (dd, J=14.0 Гц та J=1.8 Гц, 1Н, H 25 1); 2.79-2.71 (m, 1H, H-2); 2.59 (d, J=14.0 Гц, 1Н, H3); 2.25 (s, 3H, H-21); 2.26-2.15 (m, 1H, H-3); 1.911.79 (m, 1H, H-1). 13 C ЯМР (CDCl3): 204.5; 174.3; 173.0; 151.9; 137.1; 135.0; 129.3; 125.1; 123.1; 118.4; 116.6; 115.8; 57.6; 54.9; 53.5; 52.7; 42.1; 38.9; 38.6; 34.9; 24.7; 21.2. IK (таблетка KBr): 3270, 2953, 1732, 1652, -1 1461, 759,747 см . + MS (ESI TOF): 441 [M+H ] (100). HRMS (TOF MS ES+): Значення, обчислене для C23H24N2O7Na 463,1481 Виявлене значення 463,1472 20 []D =+121 (c=0,4;CHCl3) (4R)-Nа-карбометокси-20,20-дифтор-3-гідро-4гідрокси-19-оксокатарантин (19) До розчину кетоспирту 18 (44 мг, 0,1 ммоль, 1 екв.) в СН2СІ2 (1 мл) при -78°С додають DAST (67 мкл, 0,5 ммоль, 5 екв.). Потім реакційну суміш залишають при перемішуванні при температурі оточуючого середовища на 18 годин. Потім додають по краплях 10% водний розчин NaHCO3 (5 мл) при 0°С, суміш залишають на 15 хвилин при перемішуванні при температурі оточуючого середовища, потім водну фазу екстрагують СН2СІ2 (310 мл). Органічні фази об'єднують, висушують на Na2SO4 і концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі (Елюент: Гексан/AcOEt 6/4) з одержанням 19 (26 мг, 0,056 ммоль, 56%). -1 Хімічна формула: C22H24F2N2O6 Μ=462 г.моль Rf=0,3(EtOAc) 1 H ЯМР (CDCl3): 7.98 (d, J=8.5 Гц, 1Н, H-11); 7.49 (d, J=7.3 Гц, 1H, H-14); 7.36-7.26 (m, 2H, H-12 та Н-13); 5.74 (s, 1H, Н-5); 4.21-4.05 (m, 1H, Н-7); 3.97 (s, 3Н, СО2СН3); 3.66 (s, 3Н, СО2СН3); 3.303.15 (m, 4Н, Н-8, Н-7 та Н-1); 2.73 (m, 1Н, Н-2); 2.62-2.52 (m, 1Н, Н-1); 2.15-2.05 (m, 1Н, Н-3); 1.83 (d, J=14 Гц, 1Н, Н-1); 1.66 (dd, J=19 Гц, J=19 Гц, 3Н, Н-21). + MS (ESI TOF): 485 [M+Na ] (100). Nа-карбометокси-20-фтор-19-оксокатарантин (22) До розчину DAST (8 мкл, 0,06 ммоль, 1,2 екв.) в СН2СІ2 (0,1 мл) додають аліловий спирт 15 (20 95649 26 мг, 0,05 ммоль, 1 екв.) в СН2СІ2 (0,7 мл). Потім реакційну суміш залишають при перемішуванні при температурі оточуючого середовища на 15 хвилин. Потім додають по краплях насичений розчин K2СО3 (2 мл) при 0°С, суміш залишають на 15 хвилин при перемішуванні при температурі оточуючого середовища, потім водну фазу екстрагують СН2СІ2 (32 мл). Органічні фази об'єднують, висушують на Na2SO4 і концентрують у вакуумі. Потім сирий продукт очищають на препаративній пластині силікагелю (елюент СН2СІ2/МеОН 98/2) з одержанням 22 (10 мг, 0,023 ммоль, 49%) у формі двох епімерів А та В (біла тверда речовина). -1 Хімічна формула: C23H23FN2O5 Μ=426 г.моль Rf=0,4 (СН2СІ2/MeOH 95/5) 1 H ЯМР (CDCl3): 8.02 (d, J=7.9 Гц, 1Н, H-11); 7.49 (d, J=7.3 Гц, 1Н, H-14); 7.35-7.20 (m, 2H, H-12 та Н-13); 6.53-6.48 (m, 1H, H-3); 5.26 (d, J=1.8 Гц, 1Н A, H-5); 5.22 (d, J=1.8 Гц, 1Н В, Н-5); 4.98 (dq, J=47.6 Гц та J=6.1 Гц, 1Н, Н-20); 4.20-4.04 (m, 1Н, Н-7); 3.93 (s, 3Н, СО2СН3); 3.59 (s, 3Н, СО2СН3); 3.53-3.48 (m, 1Н, Н-7); 3.43-3.19 (m, 3Н, Н-8 та Н2); 2.89-2.77 (m, 1Н, Н-1); 1.90 (d, J=13.4 Гц, 1Н, Н1); 1.51 (dd, J=23.8 Гц, J=6.7 Гц, 1Н А, Н-21); 1.46 (dd, J=23.8 Гц, J=6.7 Гц, 1Н В, Н-21). 13 С ЯМР (CDCl3): 173.5; 171.8; 171.6; 151.9; 142.1; 141.9; 136.5; 136.4; 135.3; 130.0; 129.3; 125.1; 123.1; 118.3; 116.8; 115.8; 87.7 (d, J=161 Гц); 87.6 (d, J=161 Гц); 57.9; 57.7; 55.2; 54.7; 53.4; 53.3; 52.6; 44.3; 41.1; 40.9; 40.6; 38.7; 37.4; 29.6; 21.5; 21.1; 19.1 (d, J=23 Гц); 18.4 (d, J=23 Гц). + + MS (ESI TOF): 465 [M+K ] (100), 891 [2M+K ] (33). Na-карбометоксикатарантин (26) Розчин (+) -катарантину 2 (1,0 г, 3,0 ммоль, 1 екв.) в ТГФ (6 мл) додають по краплях до суспензії гідриду калію при 0°С (510 мг, 4,5 ммоль, 1,5 екв.) в ТГФ (5 мл). Після 1 години при перемішуванні при 0°С додають по краплях метилхлорформіат (0,35 мл, 4,5 ммоль, 1,5 екв.). Після 30 хвилин при перемішуванні при 0°С додають насичений водний розчин K2СО3 (10 мл). Водну фазу екстрагують СН2СІ2 (310 мл), органічні фази збирають, висушують на Na2SO4, фільтрують і концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі (Елюент: СН2СІ2/МеОН 97/3) з одержанням 26 (280 мг, 2,1 ммоль, 70%) у формі білої твердої речовини. -1 Хімічна формула: C23H26N2O4 Μ=394 г.моль 1 H ЯМР (CDCl3): 8.10 (d, J=7.3 Гц, 1Н, Н-11); 7.49 (d, J=7.3 Гц, 1Н, Н-14); 7.33-7.24 (m, 2Н, Н-12 та Н-13); 5.99 (m, 1Н, Н-3); 4.21 (s, 1Н, Н-5); 3.87 (s, 3Н, СО2СН3); 3.65 (m, 1Н, Н-7); 3.54 (s, 3Н, СО2СН3); 3.23 (m, 1Н, Н-8); 3.03-2.85 (m, 3Н, Н-7 та Н-19); 2.47 (m, 2H, Н-2 та Н-8); 2.48 (d, J=8.5 Гц, 27 1Н, Н-1); 2.24 (m, 1Н, Н-20); 1.91 (m, 1Н, Н-20); 1.71 (d, J=10.3 Гц, 1Н, Н-1); 1.08 (d, J=7.3 Гц, 3Н, Н-21). 13 С ЯМР (CDCl3): 172.9; 151.7; 147.3; 138.6; 135.9; 129.5; 124.5; 123.3; 122.7; 119.6; 118.2; 115.4; 58.5; 55.9; 55.8; 52.9; 52.7; 52.0; 38.2; 31.5; 26.7; 21.9; 10.3. Nа-карбометокси-9-оксокатарантин (27) До 15 мл водного розчину Na2CO3 (2,07 г, 19,5 ммоль, 9,3 екв.) додають розчин 26 (820 мг, 2,1 ммоль, 1 екв.) в ТГФ (30 мл). Додають по краплях розчин йоду (2,46 г, 9,7 ммоль, 4,6 екв.) в ТГФ (40 мл) при 0°С. Потім реакційну суміш доводять до температури оточуючого середовища і перемішують протягом 18 годин. Потім додають насичений водний розчин Na2S2O3 (30 мл), і реакційну суміш залишають при перемішуванні на 30 хвилин. Потім У пробірці під тиском на 25 мл 50 мг захищеного катарантину 27 (0,123 ммоль, 1 екв.) розчиняють в 1,5 мл етанолу 95%. Додають 51 мг діоксиду селену (0,459 ммоль, 3,7 екв.) в розчині в 2,5 мл 95% етанолу. Пробірку герметично закривають тефлоновою пробкою (обладнаною з'єднанням) і поміщають при 120°С (температура масляної бані) при магнітному перемішуванні. Через 24 години додають 40 мг (0,36 ммоль, 2,9 екв.) SеО2 однією порцією (у твердій формі). Дану операцію повторюють кожні 24 години протягом 4 діб (перед кожним додаванням пробірку доводять до температури оточуючого середовища для безпечного відкривання). Після 5 діб реакції вихідна речовина повністю витрачається. Реакційну суміш доводять до температури оточуючого середовища і розбавляють Et2O. Суміш промивають 20 мл розсолу. Водну фазу екстрагують Еt2О (320 мл мл). Органічні фази об'єднують, висушують на Na2SO4, фільтрують і концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі (Елюент: СН2СІ2/МеОН 98/2, потім 95/5) з одержанням 35 мг (0,083 ммоль, 67%) білої твердої речовини, яка відповідає аліловому спирту 15, спектральні характеристики якого ідентичні характеристикам алілового спирту, одержаним за протоколом з використанням ізокатарантину. 95649 28 водну фазу екстрагують СН2СІ2 (330 мл). Органічні фази об'єднують, висушують на Na2SO4, фільтрують і концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі (Елюент: СН2СІ2/MeOH 98/2) з одержанням 27 (787 мг, 1,93 ммоль, 92%) у формі білої твердої речовини. -1 Хімічна формула: C23H24N2O5 Μ=408 г.моль 1 H ЯМР (CDCl3): 8.06-7.98 (m, 1Н, Н-11); 7.537.44 (m, 1Н, Н-14); 7.36-7.22 (m, 2Н, Н-12 та Н-13); 6.23-6.17 (m, 1Н, Н-3); 4.84 (d, J=1.8 Гц, 1Н, H-5); 4.19-4.03 (m, 1Н, Н-7); 3.92 (s, 3H, CO2CH3); 3.60 (s, 3H, CO2CH3); 3.47-3.37 (m, 1H, H-2); 3.36-3.15 (m, 3H, H-8 та Н-7); 2.83-2.73 (m, 1H, H-1); 2.24-1.89 (m, 3H, H-20 та Н-1); 1.08 (t, J=7.3 Гц, 3Н, H-21). 13 C ЯМР (CDCl3): 174.5; 171.9; 151.8; 144.1; 136.8; 135.3; 129.3; 125.6; 125.0; 123.0; 118.2; 116.8; 115.7; 59.0; 57.7; 53.4; 52.4; 44.1; 41.0; 37.8; 26.5; 21.1; 11.0. IK (плівка): 2996, 2959, 2881, 1739, 1681, 1461, -1 1443 см . + MS (IС): 409 [M+H ] (100). 20 []D =+141 (c=1,9; CHCl3) Алілове окиснення захищеного катарантину (27) з одержанням (20R)-Na-карбометокси-20гідрокси-19-оксокатарантину (15) Таким чином, 20,20-дифторкатарантин (6) (4R)-Nа-карбометокси-20,20-дифтор-3-гідро-4гідрокси-19-оксокатарантин (19) після видалень захисту і Nа-карбометокси-20-фтор-19оксокатарантин (22) після видалень захисту можна піддавати сполученню способом, який сам по собі добре відомий на рівні техніки з віндоліном, потім піддавати реакції звуження кільця і, якщо необхідно, відновленню внутрішньокільцевого подвійного зв'язку С3'-С4', що, відповідно, призводить в результаті до вінфлуніну (1), 20',20'дифторвінбластину (21) і 20'-фторвінорельбіну (25), які, у свою чергу можна піддавати додатковій стадії відновлення подвійного зв'язку з одержанням в результаті монофторованого аналога вінфлуніну. 4',20'-Ангідровінбластін (28) 29 До суміші 60 мл гліцинового буфера і 100 мл 0,1 Μ водного розчину соляної кислоти додають в один прийом 1 г (2,98 ммоль, 1 екв.) ізокатарантину 10. Потім після повного розчинення 1,36 г (1 екв.) віндоліну додають 2,43 г (5 екв.) FeCI3. Реакційну суміш, поміщену в атмосферу азоту, перемішують при температурі оточуючого середовища протягом 15 годин. Реакцію зупиняють додаванням по краплях розчину 172 мг (1,5 екв.) NaBH4 в 15 мл 28% водного розчину NH3. Після 10 хвилин перемішування при температурі оточуючого середовища додають 30 мл СН2СІ2 і 30 мл розчину сегнетової солі, і суміш енергійно перемішують протягом 4 годин. Потім її екстрагують СН2СІ2 (480 мл). Органічні фази об'єднують, висушують на Na2SO4, фільтрують і концентрують у вакуумі. Потім сирий продукт очищають хроматографією на силікагелі (Елюент: СН2СІ2/МеОН 95/5) з одержанням 28 (1,18 г, 1,49 ммоль, 50%). -1 Хімічна формула: C46H56N4O8 Μ=792 г.моль 1 H ЯМР (CDCl3): 9.82 (sl, 1Н); 7.99 (sl, 1Н); 7.45 (d, J=7.6 Гц, 1Н); 7.20-7.05 (m, 3Н); 6.52 (s, 1H); 6.10 (s, 1H); 5.85 (dd, J=4 та 10 Гц, 1Н); 5.57 (q, J=6.4 Гц, 1H); 5.43 (s, 1H); 5.28 (d, J=12 Гц, 1H); 3.81 (s, 3H); 3.78 (s, 3H); 3.76 (s, 1H); 3.61 (s, 3H); 3.60-3.08 (m, 10H); 2.91-2.79 (m, 2H); 2.72 (s, 3H); 2.65 (s, 1H); 2.45-2.31 (m, 3H); 2.16-2.05 (m, 5H); 1.84-1.71 (m, 2H); 1.67 (d, J=6.4 Гц, 3Н); 1.35-1.29 (m, 1H); 1.24-1.18 (m, 1H); 0.78 (t, J=7.6 Гц, 3Н). 13 C ЯМР (CDCl3): 8.3; 12.8; 21.1; 24.6; 30.7; 31.8; 33.3; 34.7; 38.2; 42.6; 44.6; 47.5; 50.0; 50.2; 52.2; 52.4; 53.2; 55.2; 55.8; 56.9; 59.9; 65.2; 76.4; 79.7; 83.2; 94.0; 110.5; 116.8; 118.2; 119.0; 119.8; 120.6; 122.5; 122.7; 123.3; 124.6; 129.0; 129.9; 130.0; 133.1; 135.1; 152.8; 158.0; 170.9; 171.6; 174.6. + MS (ESI-TOF): 793 [M+H ] (100). ноp-7'-4',20'-Ангідровінбластін (29) Комп’ютерна верстка О. Гапоненко 95649 30 При 0°С розчин 30 мкл (1 екв.) трифтороцтової кислоти в 3 мл СН2СІ2 додають по краплях до розчину 296 мг (0,374 ммоль, 2 екв.) 4',20'ангідровінбластину 28, розчиненого в 3 мл безводного СН2СІ2. Після 10 хвилин перемішування суміш охолоджують до -78°С і додають по краплях 67 мг (1 екв.) NBS в розчині в 3 мл СН2СІ2. Після 20 хвилин при 78°С охолоджуючу баню видаляють, і через 15 хвилин додають 15 мл 10% водного розчину K2СО3. Суміш екстрагують СН2СІ2 (315 мл). Органічні фази об'єднують, висушують на Na2SO4, фільтрують і концентрують у вакуумі. Сирий продукт розчиняють в 40 мл суміші ТГФ/вода 1/1 і додають 182 мг (2,5 екв.) тетрафторборату срібла в один прийом. Суміш доводять до температури оточуючого середовища і додають 30 мл 10% водного розчину Nа2СО3. Суміш екстрагують Еt2О (230 мл), потім СН2СІ2 (230 мл). Органічні фази об'єднують, висушують на Na2SO4, фільтрують і концентрують у вакуумі. В результаті очищення хроматографією на силікагелі (Елюент: СН2СІ2/МеОН 93/7) одержують 29 (58 мг, 0,075 ммоль, 20%) у формі бежевої твердої речовини. -1 Хімічна формула: C45H54N4O8 Μ=778 г.моль 1 H ЯМР (CDCl3): 9.81 (s, 1Н); 8.40 (s, 1Н); 7.81 (d, J=8 Гц, 1Н); 7.18-7.09 (m, 3Н); 6.28 (s, 1Н); 6.09 (s, 1H); 5.84 (dd, J=4 та 10.4 Гц, 1H); 5.74 (q, J=6.4 Гц, 1H); 5.38 (s, 1H); 5.26 (d, J=10.8 Гц, 1H); 4.554.45 (m, 2H); 3.86 (d, J=13.6 Гц, 1H); 3.82 (s, 3H); 3.77 (s, 3H); 3.71 (s, 1H); 3.68 (s, 3H); 3.50-3.21 (m, 5H); 2.81-2.71 (m, 6H); 2.63-2.45 (m, 4H); 2.12-2.05 (m, 4H); 1.83 (m, 12H); 1.77 (d, J=6.4 Гц, 3Н); 1.91 (m, 1H); 1.41 (m, 1H); 1.23 (m, 1H); 0.69 (t, J=7.6 Гц, 3Н). 13 C ЯМР (CDCl3): 8.1; 13.0; 21.0; 30.0; 30.6; 32.4; 33.5; 38.1; 42.6; 44.5; 45.4; 47.5; 49.7; 50.2; 52.1; 52.7; 53.2; 55.0; 55.7; 59.8; 65.0; 76.3; 79.6; 83.0; 93.9; 110.4; 118.9; 119.8; 120.6; 122.2; 122.9; 123.3; 124.8; 128.4; 129.7; 133.5; 134.5; 152.9; 157.9; 170.8; 171.5; 174.0. + MS (ESI-TOF): 779 [M+H ] (100). Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFluorinated catharanthine derivatives, their preparation and their use as vinca dimeric alkaloid precursors
Автори англійськоюMoisan, Lionel, Comesse, Sebastien, Giovanelli, Emerson, Rousseau, Bernard, Doris, Eric, Hellier, Paul
Назва патенту російськоюФторированные производные катарантина, их получение и применение как прекурсоров димерных алкалоидов vinca
Автори російськоюМуасан Льонель, Комесс Себастьен, Джованелли Эмерсон, Руссо Бернар, Дори Эрик, Элье Поль
МПК / Мітки
МПК: C07D 471/22
Мітки: vinca, прекурсорів, застосування, алкалоїдів, димерних, катарантину, одержання, фторовані, похідні
Код посилання
<a href="https://ua.patents.su/15-95649-ftorovani-pokhidni-katarantinu-kh-oderzhannya-ta-zastosuvannya-yak-prekursoriv-dimernikh-alkalodiv-vinca.html" target="_blank" rel="follow" title="База патентів України">Фторовані похідні катарантину, їх одержання та застосування як прекурсорів димерних алкалоїдів vinca</a>
Попередній патент: Спосіб одержання гідропероксиду кумолу та фенолу
Наступний патент: Біарилетерсечовини, фармацевтична композиція та спосiб лікування захворювань, пов’язаних з активністю гідролази аміду жирної кислоти (faah)
Випадковий патент: Ігристе вино та спосіб його виробництва