Фармацевтична композиція, яка має протипухлинну активність, та способи
Формула / Реферат
1. Фармацевтична композиція, яка має протипухлинну активність, що включає дисахарид і сполуку загальної формули (І):
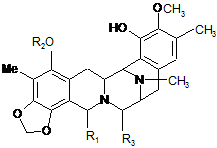 , (I)
, (I)
де R1 вибраний з групи, яка складається з -CH2-N(Ra)2 і -CH2-ORa, де кожний Ra незалежно вибраний з групи, яка складається з Н, алкіл-СО-, галогеналкіл-СО-, циклоалкілалкіл-СО-, галогеналкіл-О-СО-, арилалкіл-СО-, арилалкеніл-СО-, гетероарил-СО-, алкеніл-СО-, алкілу, алкенілу і амінокислотного ацилу, або дві Ra-групи разом з N-атомом фрагмента -CH2-N(Ra)2 утворюють гетероциклічну групу;
R2 вибраний з алкіл-СО-, циклоалкіл-СО- і галогеналкіл-СО-; і
R3 являє собою ОН або CN; або
її фармацевтично прийнятну сіль, похідне, проліки або стереоізомер, і де різні групи можуть бути незаміщеними або заміщеними.
2. Композиція за п. 1, де вказана сполука вибрана з РМ00104 і РМ00121 формули:
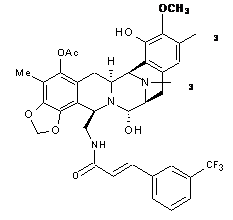
PM00104,
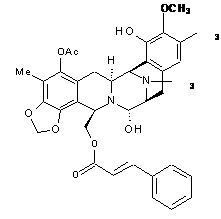
РМ00121.
3. Композиція за будь-яким з попередніх пунктів, де вказаний дисахарид вибраний з групи, яка складається з лактози, трегалози, сахарози і їх сумішей.
4. Композиція за п. 3, де вказаний дисахарид являє собою сахарозу.
5. Композиція за будь-яким з попередніх пунктів, де відношення (мас./мас.) сполуки до дисахариду дорівнює від приблизно 1:80 до приблизно 1:1500.
6. Композиція за п. 5, де співвідношення (мас./мас.) сполуки та дисахариду складає від приблизно 1:100 до приблизно 1:400.
7. Композиція за п. 6, де співвідношення (мас./мас.) сполуки та дисахариду складає приблизно 1:200.
8. Композиція за будь-яким з попередніх пунктів, яка додатково включає буферний агент.
9. Композиція за п. 8, де вказаний буферний агент являє собою фосфатний буфер.
10. Композиція за будь-яким з попередніх пунктів, яка додатково включає поверхнево-активну речовину.
11. Композиція за п. 10, де поверхнево-активна речовина являє собою поліоксіетиленсорбітанмоноолеат.
12. Композиція за будь-яким з попередніх пунктів, яка знаходиться в формі ліофілізованої композиції.
13. Композиція за п. 12, де ліофілізована композиція знаходиться у флаконі і включає кількість сполуки РМ00104 або РМ00121.
14. Композиція за п. 13, де вказана кількість сполуки РМ00104 дорівнює приблизно 2,5 мг.
15. Композиція за п. 14, де вказаний флакон містить композицію, що включає: приблизно 2,5 мг РМ00104, приблизно 500 мг сахарози і приблизно 34 мг фосфату, де вказані 34 мг фосфату розраховані як дигідрофосфат калію.
16. Спосіб виготовлення флакона, що містить ліофілізовану композицію за п. 12, що включає ліофілізацію основного розчину, який містить вказану сполуку і дисахарид.
17. Спосіб за п. 16, де сполука являє собою РМ00104.
18. Спосіб зменшення утворення домішок у ліофілізованій композиції за п. 12, що включає ліофілізацію основного розчину, який включає вказану сполуку і дисахарид.
19. Спосіб за п. 18, де сполука являє собою РМ00104.
20. Спосіб отримання розчину для внутрішньовенної інфузії, що включає забезпечення флакона, який містить ліофілізовану композицію за п. 12, додавання води для утворення відновленого розчину і розбавлення вказаного відновленого розчину водною системою.
21. Спосіб за п. 20, де сполука являє собою РМ00104.
22. Спосіб лікування раку, який включає внутрішньовенну інфузію розчину, отриманого способом за будь-яким з п. 20 або 21.
Текст
Реферат: Винахід належить до галузі фармацевтики та медицини і стосується фармацевтичної композиції, яка має протипухлинну активність, що містить сполуку, споріднену джоруміцину, ренієраміцину, сафрацину і сафраміцину, та дисахарид. Винахід також стосується флакона, заповненого ліофілізованою композицією, способу отримання розчину для внутрішньовенної інфузії та способу лікування раку. UA 97629 C2 (12) UA 97629 C2 UA 97629 C2 5 10 15 Даний винахід стосується препаратів. Зокрема, він стосується композицій і препаратів сполук, споріднених джоруміцину, ренієраміцину, сафрацину і сафраміцину, таких як сполуки PM00104 і PM00121. Передумови створення винаходу Джоруміцин являє собою природну сполуку, виділену з шкіри і з слизу тихоокеанського голозяберного молюска Jorunna funebris (Fontana А., et al., Tetrahedron (2000), 56, 7305-8). Крім того, відомо, що сімейство ренієраміцинів виділене з губок і оболонників (James M.F. et al. J. Am. Chem. Soc. (1982), 104, 265-269; Oku N., et al. Journal Natural Products (2003), 66, 1136-9). Сполуки сафрацину і сафраміцину розкриті в публікації: Manzanares I., et al. Curr. Med. Chem. Anti-Cancer Agents (2001), 1, 257-276, а також в WO 00/18233 і WO 01/87894. Внаслідок наявності докладного опису в даних публікаціях і наведених в них посиланнях, структурні характеристики даних сполук в даний заявці детально не наведені; будь-який кваліфікований фахівець в даній галузі здатний отримати таку інформацію безпосередньо з процитованих і споріднених джерел. Принаймні дві з даних сполук, PM00104 і PM00121, будуть спеціально згадані тут для ілюстрації відмітних характеристик даного винаходу. PM00104 і PM00121 являють собою синтетичні алкалоїди, споріднені джоруміцину і ренієраміцинам, а також сполукам сафрацину і сафраміцину. Вони мають наступні хімічні структури: 20 25 30 35 40 45 50 Фармацевтична композиція, що включає PM00104 або PM00121 разом з фармацевтично прийнятним носієм, заявлена в WO 01/87894. Сполука PM00104 продемонструвала значну активність in vitro проти клітинних ліній солідних і несолідних пухлин, а також значну активність in vivo в деяких ксенотрансплантованих мишам клітинних лініях людини, таких як лінії грудної залози і простати. Попередні уявлення про механізм дії PM00104 передбачали зміни в клітинному циклі, ДНК-зв'язуючі властивості і інгібування транскрипції. Крім того, в цей час для сполуки PM00104 проводяться клінічні випробування I етапу. Додаткові подробиці, що стосуються даних по активності PM00104 і PM00121, дивись в WO 01/87894. PM00104 і PM00121, а також споріднені сполуки, являють собою складні хімічні об'єкти, що виходить з їх структурних характеристик. Крім того, вони виявляють обмежену розчинність у воді, і їх стабільність, особливо в біосумісних формах і препаратах, є складнопередбачуваною і важкодосяжною. Дані характеристики створюють ускладнення для фахівців і для стандартних методологій в даній галузі, зокрема, коли справа стосується отримання препаратів даних сполук, які повинні без великих зусиль використовуватися в медичних цілях. Такі застосування переважно засновуються на препаратах, характеристики яких включають одне або більше з наступного: біосумісність, стабільність в умовах навколишнього середовища або в умовах, які наскільки це можливо близькі до умов навколишнього середовища, з максимально можливим терміном зберігання і здатністю до легкого відновлення з утворенням відновлених розчинів, які стабільні в умовам навколишнього середовища, або близьких до них умовах, протягом максимально можливого часу. У зв'язку з потенційною можливістю застосування даних сполук як протипухлинних агентів існує необхідність надати препарат, який може вирішити проблеми, які стандартні препарати і виробничі методології не вирішують або вирішують не повністю. Дані проблеми включають проблему стабільності даних сполук. Варіанти здійснення препаратів PM00104, PM00121 і споріднених сполук переважно повинні показувати сприятливі ліофілізаційні властивості, переважно повинні піддаватися легкому відновленню і вони переважно повинні володіти властивостями піддаватися розведенню, наприклад, розведенню інфузійною рідиною, виявляючи в той же час в максимально можливій мірі бажані характеристики препаратів для 1 UA 97629 C2 5 10 медичного застосування. Як вказано вище, варіанти здійснення даних препаратів повинні бути стабільними протягом тривалого зберігання. Крім того, препарат і технологія його отримання повинні задовольняти стандартам біосумісності і повинні, таким чином, допускати можливість ефективного застосування наповнювача препарату, який нетоксичний, принаймні, в концентраціях, що використовуються для інфузії. Загальний огляд взаємодій ексципієнт-лікарський засіб у вихідних препаратах наданий в роботі: Akers M.J., Journal of Pharmaceutical Sciences, 91, 2002, 2283-2300. Дана публікація містить серед іншого розділ про наповнювачі і ліопротектори, включаючи вказаний об'єкт в контексті ліофілізації. Передбачається, що методології і препарати, розроблені в контексті даного винаходу, застосовні до інших споріднених сполук крім PM00104 і PM00121. Об'єкти винаходу Винахід стосується композицій і препаратів сполук загальної формули (I): 15 20 25 30 35 40 45 50 де R1 вибраний з групи, яка складається з -CH2-N(Ra)2 і -CH2-ORa, де кожний Ra незалежно вибраний з групи, яка складається з Н, алкіл-СО-, галогеналкіл-СО-, циклоалкілалкіл-СО-, галогеналкіл-О-СО-, арилалкіл-СО-, арилалкеніл-СО-, гетероарил-СО-, алкеніл-СО-, алкілу, алкенілу і амінокислотного ацилу, або ж дві R a-групи разом з N-атомом фрагмента -CH2-N(Ra)2 утворюють гетероциклічну групу; R2 вибраний з алкіл-СО-, циклоалкіл-СО- і галогеналкіл-СО-; і R3 являє собою OH або CN; або їх фармацевтично прийнятної солі, похідного, проліків або стереоізомеру. Різні групи можуть бути незаміщеними або заміщеними. Таким чином, даний винахід надає стабільні препарати сполук загальної формули (I) і способи отримання таких препаратів. Мета даного винаходу полягає в тому, щоб надати новий стабільний препарат сполук загальної формули (I). Зокрема, необхідний препарат зі значним терміном зберігання. Крім того, особливо важливо уникнути утворення домішок. Суть винаходу Згідно з даним винаходом надані композиції, які включають сполуку загальної формули (I) і дисахарид, і способи отримання таких композицій. Переважні варіанти таких композицій володіють фармацевтичною чистотою. Деякі варіанти таких композицій представлені ліофілізованими препаратами, які включають сполуку загальної формули (I) і дисахарид. Дані способи отримання таких препаратів. Докладний опис винаходу У контексті даного винаходу було виявлено, що дисахариди стабілізують препарати сполук загальної формули (I), визначеної вище. У даних сполуках замісники можуть бути вибрані відповідно до наступного керівництва: Алкільні групи переважно містять від 1 до 12 атомів вуглецю. Один більш переважний клас алкільних груп містить від 1 до приблизно 6 атомів вуглецю, і, найбільш переважно, 1, 2, 3 або 4 атоми вуглецю. Метил, етил і пропіл, включаючи ізопропіл, являють собою особливо переважні алкільні групи в сполуках даного винаходу. Термін алкіл, якщо не вказано особливо, стосується як циклічних, так і нециклічних груп, хоча циклічні групи будуть включати, принаймні, три вуглецевих циклічних члена. Переважні алкенільні групи в сполуках даного винаходу містять один або декілька ненасичених зв'язків і від 2 до приблизно 12 атомів вуглецю. Один більш переважний клас алкенільних груп містить від 2 до приблизно 6 атомів вуглецю, і, найбільш переважно, 2, 3 або 4 атоми вуглецю. Термін алкеніл стосується як циклічних, так і нециклічних груп. Придатні арильні групи в сполуках даного винаходу включають моно- і поліциклічні сполуки, що включають поліциклічні сполуки, які містять ізольовані і/або конденсовані арильні групи. 2 UA 97629 C2 5 10 15 20 25 30 35 40 45 50 55 60 Типові арильні групи містять від 1 до 3 ізольованих або сконденсованих кілець і від 6 до приблизно 18 циклічних атомів вуглецю. Особливо переважні арильні групи включають заміщені або незаміщені феніл, нафтил, біфеніл, фенантрил або антрацил. Придатні гетероциклічні групи включають гетероароматичні і гетероаліциклічні групи. Придатні гетероароматичні групи в сполуках даного винаходу містять один, два або три гетероатоми, вибраних з атомів N, О або S, і включають, наприклад, кумаринільну, що включає 8-кумаринільну, хінолінільну, що включає 8-хінолінільну, піридильну, піразинільну, піримідильну, фурильну, піролільну, тієнільну, тіазолільну, оксазолільну, імідазолільну, індолільну, бензофуранільну і бензотіазольну групи. Придатні гетероаліциклічні групи в сполуках даного винаходу містять один, два або три гетероатоми, вибраних з атомів N, О або S, і включають, наприклад, тетрагідрофуранільну, тетрагідропіранільну, піперидинільну, морфолінову і піроліндинільну групи. Фталімідо являє собою іншу можливу гетероциклічну групу. Придатні амінокислотні ацильні групи включають аланіл, аргініл, аспартил, цистил, глутаміл, глутамініл, гліцил, гістидил, гідроксипроліл, ізолейцил, лейцил, лізил, метіоніл, фенілаланіл, проліл, серил, треоніл, тироніл, триптофіл, тирозил, валіл, а також інші амінокислотні групи, які можуть являти собою L- або D-. Згадані тут групи можуть бути заміщеними в одному або більш доступних положеннях однією або більше відповідними групами, такими як R', OR', =О, SR', SOR', SO 2R', NO2, NHR', N(R')2, =N-R', NHCOR', N(COR')2, NHSO2R', CN, галоген, С(=О)R', CO2R', °C(=О)R', де кожна з груп R' незалежно вибрана з групи, яка складається з водню, OH, NO 2, NH2, SH, CN, галогену, =О, С(=О)Н, С(=О)алкілу, CO2H, заміщеного або незаміщеного C1-C12-алкілу, заміщеного або незаміщеного C2-C12-алкенілу, заміщеного або незаміщеного C2-C12-алкінілу і заміщеного або незаміщеного арилу. Придатні галогенові замісники в сполуках даного винаходу включають F, Cl, Br і I. Якщо такі групи самі є заміщеними, замісники можуть бути вибрані з вищенаведеного списку. Термін "фармацевтично прийнятні солі, похідні, проліки" стосується будь-якої фармацевтично прийнятної солі, складного ефіру, сольвату, гідрату або будь-якої іншої сполуки, яке при введенні реципієнту здатне надавати (прямо або опосередковано) сполуку, як описано тут. Однак необхідно брати до уваги, що солі, що не є фармацевтично прийнятними, також входить в об'єм винаходу, оскільки вони можуть бути придатні для отримання фармацевтично прийнятних солей. Отримання солей, проліків і похідних може бути проведено способами, відомими в даній галузі. Наприклад, фармацевтично прийнятні солі наданих тут сполук синтезують з вихідної сполуки, яка містить основний або кислотний фрагмент, стандартними хімічними способами. Загалом, такі солі отримують, наприклад, проводячи реакцію вільних кислих або основних форм даних сполук зі стехіометричною кількістю відповідних основи або кислоти у воді або в органічному розчиннику або в суміші їх обох. Загалом, неводні середовища, такі як ефір, етилацетат, етанол, ізопропанол або ацетонітрил, є переважними. Приклади кислих адитивних солей включають адитивні солі мінеральних кислот, такі як, наприклад, гідрохлорид, гідробромід, гідройодид, сульфат, нітрат, фосфат, і адитивні солі органічних кислот, таких як, наприклад, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат і п-толуолсульфонат. Приклади лужних адитивних солей включають неорганічні солі, такі як, наприклад, натрієві, калієві, кальцієві і амонійні солі, і органічні лужні солі, такі як, наприклад, етилендіамінові, етаноламінові, N, N-діалкіленетаноламінові, триетаноламінові і основні амінокислотні солі. Сполуки винаходу можуть знаходитися в кристалічній формі або як вільні сполуки, або як сольвати (наприклад, гідрати), і передбачається, що обидві форми входять в об'єм даного винаходу. Способи сольватації, загалом, відомі в даній галузі. Будь-яка сполука, яка являє собою проліки сполуки формули (I), входить в об'єм і суть винаходу. Термін "проліки" використаний в своєму найбільш широкому значенні і охоплює такі похідні, які in vivo перетворюються в сполуки винаходу. Такі похідні легко уявили б собі фахівці в даній галузі, і вони включають, наприклад, сполуки, де вільна гідроксильна група перетворена в складноефірне похідне. Сполуки даного винаходу, представлені описаною вище формулою (I), можуть включати енантіомери в залежності від їх асиметрії або діастереоізомери. Стереоізомерія за рахунок подвійного зв'язку також можлива, отже, в деяких випадках молекула могла б існувати як (Е)ізомер або як (Z)-ізомер. Єдині ізомери і суміші ізомерів підпадають під об'єм даного винаходу. Приклади сполук даного винаходу включають сполуки, розкриті, наприклад, в WO 00/18233 і WO 01/87894. Автори даного винаходу включають за допомогою спеціального посилання кожну із сполук, визначених у відповідних прикладах даних РСТ-заявок. У більш загальному значенні 3 UA 97629 C2 5 10 15 20 25 30 35 40 45 50 автори даного винаходу включають за допомогою спеціального посилання зміст даних двох РСТ-заявок, оскільки вони розкривають сполуки даної формули (I). Автори визнають згадку переважних груп, даних у вказаних текстах, зокрема, оскільки вони стосуються даних груп R1 і R2, особливо R2. R3 звичайно являє собою OH. Переважні сполуки даного винаходу являють собою сполуки наступної хімічної структури: Сполуки загальної формули (I), включаючи сполуки PM00104 і PM00121, являють собою складні хімічні об'єкти, чия поведінка в препаратах непередбачувана в термінах поведінки інших неспоріднених хімічних речовин. Таку поведінку ще складніше передбачити, коли, принаймні, одна сполука загальної формули (I) включена як активна речовина в препарат, який повинен задовольняти стандартам біосумісності, включаючи медичні стандарти. Автори, далі, знайшли в даному відношенні, що застосування дисахаридів як наповнювачів може радикально зменшити утворення домішок в ході ліофілізації і зберігання композицій сполук PM00104 і PM00121. Крім того, застосування дисахаридів також поліпшує умови зберігання, роблячи можливим довготривале зберігання ліофілізованого препарату в широкому температурному діапазоні, включаючи умови охолоджування і кімнатну температуру. Термін "стабільний", використаний тут, наприклад, у виразі "стабільний препарат сполук PM00104 і PM00121", стосується препарату, який задовольняє характеристикам стабільності, наведеним тут, і їх еквівалентам, якими не володіють стандартні препарати, і які не досяжні, коли препарат отриманий стандартними виробничими методологіями. Приклади здійснень даного винаходу представлені новими фармацевтично прийнятними композиціями, що включають сполуку загальної формули (I) і дисахарид. Приклади відповідних дисахаридів включають лактозу, трегалозу, сахарозу і їх комбінації. Додаткові приклади дисахаридів, які можуть бути використані в деяких здійсненнях даного винаходу, включають, принаймні, одну з: мальтозу, ізомальтозу, целобіозу, ізосахарозу, ізотрегалозу, сорбозу, туранозу, мелібіозу, гентіобіозу і їх суміші. На даний момент переважна сахароза. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид лактозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид трегалозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид сахарозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид мальтозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид ізомальтозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид целобіозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид ізосахарозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид ізотрегалозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид сорбозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид туранозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид мелібіозу. В інших здійсненнях винаходу композиція включає сполуку загальної формули (I) і вільний дисахарид гентіобіозу. Таким чином, в деяких здійсненнях композиція даного винаходу містить, принаймні, один з дисахаридів, переважно, кожний з: лактози, трегалози, сахарози, мальтози, ізомальтози, целобіози, ізосахарози, ізотрегалози, сорбози, туранози, мелібіози і гентіобіози в кількості менше ніж 2 % або менше ніж 1 %, або менше ніж 0,5 %, або менше ніж 0,2 %, або менше ніж 0,1 % по масі. Терміни "їх суміші" і "їх комбінації", використані тут, стосуються, принаймні, двох об'єктів, які забезпечують антецедентний базис для термінів "їх суміші" або "їх комбінації". Як ілюстрація, 4 UA 97629 C2 5 10 15 20 25 30 35 40 45 50 55 60 але не як обмеження, терміни "продукт, що включає, принаймні, один з: А, В, С і їх суміші" стосується здійснень продукту, для яких виконаний будь-яке з наступного: А знаходиться в продукті; В знаходиться в продукті; С знаходиться в продукті; А і В знаходяться в продукті; А і С знаходяться в продукті; В і С знаходяться в продукті і А, В і С знаходяться в продукті. Більше того, зрозуміло, що терміни, такі як "реагування", "утворення" і споріднені терміни, застосовані в даний заявці до хімічного об'єкта, стосуються будь-якого з: (a) хімічного об'єкта самого по собі і (b) хімічного об'єкта в формі, в якій такий об'єкт присутній в реакційному середовищі. Аналогічно, щоб назвати хімічний об'єкт або дати його формулу в контексті операції або реакційної стадії або для того, щоб назвати його або дати його формулу, коли він знаходиться в середовищі, твердому або рідкому, що включає продукти, препарати і комбінації, необхідно врахувати, що в даний заявці назва стосується будь-якого з: (a) хімічного об'єкта самого по собі і (b) хімічного об'єкта в формі, в якій такий об'єкт присутній в середовищі. Наприклад, найменування кислого хімічного об'єкта стосується в даний заявці будь-якої форми або будь-яких форм, в яких такий об'єкт присутній в контексті, в якому він названий. Як ілюстрація, але не як обмеження, найменування хімічного об'єкта "хлорид натрію" або вказівка його хімічної формули стосується в даний заявці об'єкта NaCl як такої двохатомної молекули, якщо це являє собою форму, в якій хлорид натрію присутній в релевантному середовищі; найменування також стосується сукупності недисоційованих і/або дисоційованих хімічних частинок, якщо хлорид натрію в релевантному середовищі повністю або частково дисоційований, включаючи частинки в такому середовищі, які сольватовані, є частиною каркасів, асоційовані з іншими частинками і так далі. Щоб дати більш короткий опис, деякі кількісні вирази, дані тут, не кваліфікуються терміном "приблизно". Зрозуміло, що незалежно від того, використаний термін "приблизно" явно чи ні, мається на увазі, що кожна кількість, дана тут, стосується фактично даної величини, а також мається на увазі, що вона стосується наближеного значення такої даної величини, яке було б обґрунтовано включене на основі стандартних знань в даній галузі, включаючи еквіваленти і наближені значення, зумовлені умовами експериментів і/або вимірювань для такої даної величини. Активна речовина або активні речовини в контексті даного винаходу можуть мати природне, напівсинтетичне або синтетичне походження, включаючи комбінації походження. У здійсненнях, де активна речовина являє собою сполуку, таку як PM00104 або PM00121, дані сполуки мають синтетичне або напівсинтетичне походження і можуть бути отримані, з використанням розкриття публікації WO 01/87894, яка повністю включена за допомогою посилання. Відношення активної речовини до наповнювача в здійсненнях даного винаходу визначається відповідно до розчинності наповнювача і, коли препарат ліофілізований, також відповідно до здатності наповнювача до ліофілізації. Передбачається, що дане відношення (мас./мас.) може становити приблизно 1:1 в деяких здійсненнях, приблизно 1:5 в інших здійсненнях, приблизно 1:10 в ще одних інших здійсненнях, тоді як інші здійснення ілюструють відношення в діапазоні від приблизно 1:10 до приблизно 1:1. Передбачається, що інші здійснення мають такі відношення в діапазоні від приблизно 1:10 до приблизно 1:80, і інші додаткові здійснення мають такі відношення в діапазоні від приблизно 1:80 до приблизно 1:1500. Коли активна сполука являє собою PM00104 або PM00121, відношення (мас./мас.) активного інгредієнта до наповнювача типово дорівнює від приблизно 1:80 до приблизно 1:1500, переважно від приблизно 1:100 до приблизно 1:800, більш переважно від приблизно 1:100 до приблизно 1:400 і найбільш переважно приблизно 1:200. Ліофілізований матеріал звичайно присутній у флаконі, який містить певну кількість активної сполуки. Коли активна сполука являє собою PM00104, активні кількості ілюструються 2,5 мг/флакон. Коли активна сполука являє собою PM00121, активні кількості ілюструються 1 мг/флакон. Даний винахід не обмежений певними формами контейнера або дизайнами контейнера, якщо контейнер підходить для застосування за призначенням і задовольняє передбаченим стандартам. Здійснення даного винаходу представлені препаратом, що міститься у флаконах. Ліофілізовані препарати даного винаходу можуть бути відновлені і розбавлені, даючи композицію даного винаходу в формі розчину, готового для внутрішньовенної ін'єкції. Фактичні кількості відновленої рідини не є обмежуючими характеристиками здійснень даного винаходу. Як ілюстрація, але не як обмеження, здійснення ліофілізованих препаратів за даним винаходом відновлені з використанням деякого об'єму води. Більшість даних об'ємів не перевищують приблизно 20 мл, причому переважні об'єми знаходяться в діапазоні від приблизно 1 мл до приблизно 15 мл, більш переважно в діапазоні від приблизно 1 мл до приблизно 10 мл і навіть більш переважно в діапазоні від приблизно 3 мл до приблизно 8 мл і найбільш переважно 5 UA 97629 C2 5 10 15 20 25 30 35 40 45 50 55 60 об'єми дорівнюють приблизно 5 мл. Коли активна сполука представлена сполукою PM00104, відновлений розчин в таких здійсненнях містить концентрацію PM00104 аж до 5 мг/мл, причому концентрації приблизно 2,5 мг/мл, приблизно 1 мг/мл і приблизно 0,5 мг/мл є переважними. Відновлені здійснення даного винаходу можуть бути далі розбавлені за бажанням, причому дане подальше розбавлення не є обмеженням даного винаходу. Дане подальше розбавлення переважно здійснюють водною системою, яка звичайно являє собою 0,9 % хлорид натрію або 5 % глюкозу. Відновлений розчин буде розбавлений в залежності від концентрації у відновленому розчині і бажаної концентрації в розбавленому розчині. Здійснення препаратів сполук формули (I) за даним винаходом можуть бути використані для лікування різних ракових захворювань. Зрозуміло, що "лікування" в даному контексті стосується дії, яка веде до зменшення симптомів ракового(их) стану(ів). Більше того здійснення препаратів за даним винаходом можуть бути використані в дослідженнях з використанням лабораторних тканин, включаючи названі, але не обмежуючись ними: клінічні дослідження, аналітичні дослідження і моделюючі аналізи. Здійснення даного винаходу, які включають сполуки формули (I), переважно вводять інфузією. Інфузійну стадію типово повторюють по циклічному базису, який з потреби може бути повторюваний, наприклад, від 1 до 20 циклів. Цикл включає фазу інфузії препарату сполуки формули (I) і, звичайно, також фазу, що не включає інфузію активної речовини. Типово, цикл розробляють протягом декількох тижнів і, таким чином, цикл звичайно включає один або декілька тижнів фази інфузії активної речовини і один або декілька тижнів для завершення циклу. Автори вважають переважним, щоб були використані часи інфузії аж до 24 годин, більш переважно 1-12 годин, причому 1-6 годин є найбільш переважними часами. Короткі часи інфузії, які дозволяють провести лікування без необхідності нічного перебування в лікарні, є особливо бажаними. Однак інфузія може займати від 12 до 24 годин або навіть бути більш тривалою, якщо це необхідно. Здійснення препаратів даного винаходу, які містять сполуку формули (I), можуть бути отримані ліофілізацією композиції даного винаходу в формі основного розчину, що включає сполуку формули (I) і дисахарид. Звичайно основний розчин буде забуферений, наприклад, до pH приблизно 4. Придатні буферні агенти включають фосфатний буфер, цитратний буфер, фосфатний/цитратний буфер (суміш фосфатного буфера і цитратного буфера), лактатний буфер, аскорбатний буфер, тартарний/цитратний буфер, бікарбонатний/солянокислий буфер, ацетатний буфер, сукцинатний буфер і гліциновий/солянокислий буфер. Можуть бути використані суміші буферів. Біосумісні буфери, які дозволяють контролювати pH при бажаному значенні, являють собою додаткові здійснення даного винаходу. Інші компоненти можуть бути включені в основний розчин, наприклад, поверхнево-активні речовини, такі як поліоксіетиленсорбітанмоноолеат (також відомий як полісорбат) або поліоксил-40-стеарат. Інші можливі поверхнево-активні речовини включають фосфоліпіди, такі як лецитин; співполімери поліоксіетилену-поліоксипропілену, такі як поверхнево-активна речовина Pluronic; поліоксіетиленові складні ефіри 12-гідроксистеаринової кислоти, такі як поверхнево-активна речовина Solutol, етоксилати холестерину, такі як діацилгліцерин, діалкілгліцерин; солі жовчних кислот, такі як холат натрію, деоксихолат натрію; складні ефіри сахарози, такі як монолаурат сахарози, моноолеат сахарози; полівінілпіролідон (PVP) або полівініловий спирт (PVA). Препарат звичайно постачають у вигляді флакона, що містить ліофілізований продукт. Дана форма для постачання, однак, не є обмеженням даного винаходу. Щоб надати флакон, що містить ліофілізований продукт, основний розчин додають у флакон і проводять його ліофілізацію. Ліофілізацію проводять в деяких здійсненнях даного винаходу, використовуючи скорочені часи вторинного сушіння. Переважний протокол включає охолоджування до температури від приблизно -40 °C до приблизно -50 °C, первинне висушування при 80-85 мкбар протягом 25-50 годин і вторинне висушування при більш низькому тиску і при температурі вище 0 °C протягом 3-20 годин. Здійснення даного винаходу включають ліофілізацію охолоджуванням продукту нижче 40 °C. Первинне сушіння проводять при температурі від приблизно -20 °C до приблизно -27 °C і тиску, що дорівнює приблизно 85 мкбар, протягом приблизно 35-46 годин. Вторинне сушку виконують при температурі від приблизно 20 °C до приблизно 25 °C протягом приблизно 30-45 годин. Здійснення препаратів даного винаходу підходять для зберігання при температурах значно більших, ніж температури зберігання стандартних препаратів. Приклади температур зберігання препаратів за даним винаходом складають близько +5 °C. Дані температури легко 6 UA 97629 C2 5 10 забезпечуються звичайними холодильниками. Опис креслення винаходу Фіг. 1 Порівняльна еволюція чистоти PM00104 в % двох препаратів PM00104, причому один включає сахарозу, а інший - маніт, що зберігалися при 40 °C/відносний вологості 70 % протягом 3 місяців. Приклади Приклад 1 Даний приклад ілюструє даний винахід і розкриває порівняльне дослідження стабільності двох препаратів PM00104, де в одному препараті як наповнювач використаний маніт, а в іншому препараті використана сахароза, яка являє собою дисахарид. Композиція основного розчину кожного з препаратів мала наступний склад (Таблиця I): Таблиця I Компонент PM00104 Маніт D-(+)-сахароза Дигідрофосфат калію Фосфорна кислота Вода для ін'єкцій 15 20 25 Препарат з манітом 0,1 мг/мл 5% 6,8 мг/мл скільки потрібно до pH 4 Препарат із сахарозою 0,1 мг/мл 100 мг/мл 6,8 мг/мл скільки потрібно до pH 4 скільки потрібно до 1 мл Основні розчини отримували і ліофілізували стандартизованим способом. Препарат з манітом Отримували препарат з манітом в об'ємі 50 мл: 40 мл 0,05 М (pH 4) розчину дигідрофосфату калію додавали до 5,493 мг сполуки PM00104, і підтримували перемішування суміші протягом 1 години. Потім додавали 2,5 г маніту, промиваючи чашку 5 мл розчину фосфатного буфера (pH 4). Суміш перемішували протягом ще однієї години. Услід за цим, pH розчину доводили до pH 4, використовуючи 1 N фосфорну кислоту, і розчин доводили до кінцевої маси 52 г, використовуючи 0,05 M (pH 4) фосфатний буфер. Розчин фільтрували через PVDF-фільтр, і профільтрований розчин вміщували в скляні флакони об'ємом 10 мл в кількості 2 мл/флакон, і флакони ліофілізували згідно з наступною методикою (Таблиця II): Таблиця II Цикл Завантаження Заморожування Вакуум Сублімація ое 2 висушування 30 35 Стадія Тиск a Полиці T Заморожування 1 Заморожування 2 Ch вакуум 0,5 мілібар 0,150 1° висушування мілібар 0,150 1° висушування мілібар 2° висушування 2° висушування 2° висушування 2° висушування Задана T (°C) 5 °C -45 °C -45 °C -23 °C Нахил (хв.) 0,5 °C/хв. 2 год. 10 хв. 4 год. 0,5 °C/хв. 2 год. 30 хв. -23 °C 20 °C 20 °C 25 °C 25 °C Час витримування 30 год. 0,25 °C/хв. 3 год. 30 хв. 6 год. 30 хв. 40 год. Після ліофілізації флакони герметизували і переносили в місце, що охолоджується (- 20 °C). Препарат з сахарозою Отримували препарат з сахарозою в об'ємі 300 мл: 32,615 мг сполуки PM00104 додавали до 100 мл розчину 0,05 М (pH 4) дигідрофосфату калію, промиваючи чашку додатковими 110 мл розчину 0,05 М (pH 4) дигідрофосфату калію. Потім підтримували перемішування суміші протягом 1 години. Додавали 30 г сахарози, промиваючи чашку 30 мл розчину фосфатного буфера (pH 4). Підтримували перемішування суміші протягом ще однієї години. 7 UA 97629 C2 5 Услід за цим, pH розчину доводили до pH 4, використовуючи 1 M фосфорну кислоту, і розчин доводили до кінцевої маси 300 г, використовуючи воду для ін'єкцій. Розчин фільтрували через фільтр Millipore-Optiscale, і профільтрований розчин вміщували в скляні флакони об'ємом 10 мл в кількості 2 мл/флакон, і флакони ліофілізували. Випробування на стабільність проводили при температурі 5 °C, 25 °C/відносній вологості 60 % і 40 °C/відносній вологості 75 % у випадку препарату з сахарозою і при 40 °C/відносній вологості 75 % у випадку препарату з манітом. У Таблиці III і на Фіг.1 показана еволюція хроматографічної чистоти по сполуці PM00104 досліджуваних препаратів: 10 Таблиця III 5 °C Препарат із сахарозою t=0 96,70 % t=15 днів 96,85 % t=1 місяць 96,74 % t=2 місяці 97,23 % 15 Чистота (%) PM00104 25 °C/відносна вологість 40 °C/відносна вологість 75 % 60 % Препарат із Препарат з Препарат із сахарозою сахарозою манітом 96,70 % 96,70 % 96,89 % 96,44 % 96,50 % 91,79 % 96,71 % 96,36 % 90,79 % 97,10 % 97,24 % 85,26 % Дані Таблиці III і Фіг.1 свідчать, що препарат, що містить сахарозу, показував кращу стабільність при 40 °C і відносної вологості 75 % при незначному зниженні чистоти. Дане зниження значно менше, ніж зниження, помічене для препарату з манітом. Приклад 2 Отримували препарат сполуки PM00121, що включає сахарозу як наповнювач, і оцінювали його стабільність при температурі 5 °C, 25 °C/відносній вологості 60 % і 40 °C/відносній вологості 75 %. У кожному флаконі композиція основного розчину мала наступний склад (Таблиця IV): 20 Таблиця IV Компонент мг/флакон PM00121 1 мг Сахароза 200 мг Дигідрофосфат калію 13,6 мг Полісорбат 80 0,2 мг Фосфорна кислота скількі потрібно до pH 4 Вода для ін'єкцій скількі потрібно до 2 мл 25 30 35 Препарат сполуки PM00121 отримували таким чином: 100 мл 0,1 % (pH 2,5) розчину полісорбату 80 додавали до 161,05 мг сполуки PM00121 і згодом також додавали додаткові 110 мл 0,1 % (pH 2,5) розчину полісорбату 80. Підтримували перемішування суміші протягом 1 години. Потім додавали 2,04 г дигідрофосфату калію, промиваючи чашку 15 мл розчину 0,1 % (pH 2,5) розчину полісорбату 80. Услід за цим, 30 г сахарози зважували і додавали до розчину, промиваючи чашку 15 мл 0,1 % (pH 2,5) розчину полісорбату 80. Потім підтримували перемішування суміші більш ніж 1 годину. Услід за цим, pH розчину доводили до pH 4, використовуючи 1 M фосфорну кислоту, і розчин доводили до кінцевої маси 300 г, використовуючи воду для ін'єкцій. Розчин фільтрували, використовуючи фільтр Millipore-Optiscale. Профільтрований розчин вміщували в скляні флакони об'ємом 10 мл в кількості 2 мл/флакон, і флакони витримували при -20 °C до проведення ліофілізації. Ліофілізацію проводили згідно з нижченаведеною Таблицею V: 8 UA 97629 C2 Таблиця V Час заморожування до -45 °C: Первинне висушивання при 115 мілітор і -20 °C Вторичное висушивані при 75 мілітор і 25 °C 5 150 хв. 2300 хв. 600 хв. Після ліофілізації флакони герметизували і переносили в місце, що охолоджується (- 20 °C). Випробування на стабільність проводили при температурі 5 °C, 25 °C/відносній вологості 60 % і 40 °C/відносній вологості 75 %. У Таблиці VI наведена хроматографічна чистота по сполуці PM00121 досліджуваного препарату: Таблиця VI t=0 t=15 днів t=1 місяць t=2 місяці 10 15 Чистота (%) PM00121 25 °C/відносна вологість 5 °C 60 % 96,92 % 96,92 % 97,83 % 97,63 % 97,96 % 97,85 % 97,98 % 97,12 % 40 °C/відносна вологість 75 % 96,92 % 97,38 % 97,46 % 95,71 % Було зазначено, що препарат, що включає дисахарид стабільний при 5 °C і 25 °C/відносній вологості 60 %. Приклад 3 Отримували два препарати, 104-FA і 104-FB, сполуки PM00104, що включають сахарозу як наповнювач, і оцінювали їх стабільність при температурі -20 °C, 5 °C, 25 °C/відносній вологості 60 % і 45 °C/відносній вологості 75 %. Для кожного препарату композиція основного розчину в кожному флаконі мала наступний склад (Таблиця VII): Таблиця VII Компонент мг/флакон PM00104 2,5 мг D-(+)-сахароза 500 мг Дигідрофосфат калію 34 мг Фосфорна кислота скільки потрібно до pH 4 Вода для ін'єкцій скільки потрібно до 5 мл 20 25 30 Основні розчини отримували і ліофілізували, використовуючи наступні протоколи: Препарат 104-FA 1,750 л основного розчину отримували таким чином: 153,125 мл 0,05 N фосфорної кислоти додавали до 905,61 мг з'єднання PM00104. Суміш перемішували протягом 15 хвилин. Потім додавали 1400 мл води для ін'єкцій, за чим слідувало додання 11,9 г дигідрофосфату калію і 175 г сахарози. Суміш знову перемішували протягом 1 год. 15 хв. Не було необхідності доводити pH розчину до 3,8
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical formulation exhibiting antitumor activity and methods
Автори англійськоюCalvo Salve Pilar, Tobio Barreira Maria
Назва патенту російськоюФармацевтическая композиция, имеющая противоопухолевую активность, и способы
Автори російськоюКальво Сальве Пилар, Тобио Баррейра Мария
МПК / Мітки
МПК: A61P 35/00, A61K 47/26, A61K 9/19, A61K 31/4995, A61K 31/357, A61K 9/08
Мітки: має, фармацевтична, протипухлинну, яка, способи, активність, композиція
Код посилання
<a href="https://ua.patents.su/15-97629-farmacevtichna-kompoziciya-yaka-maeh-protipukhlinnu-aktivnist-ta-sposobi.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, яка має протипухлинну активність, та способи</a>
Попередній патент: Спосіб отримання fc-фрагмента імуноглобуліну, вільного від початкового метіонінового залишку, в масовому масштабі
Наступний патент: Пристрій для виготовлення конічної різьбової частини горловини балона
Випадковий патент: Спосіб виготовлення волоконного пластмасового стержня для засобів письма












