Способи одержання 3-оксо-прегнан-21,17-карболактонів та 3-оксо-прегн-4-ен-21,17-карболактонів, гемісольват, спосіб його одержання та спосіб одержання дроспіренону
Формула / Реферат
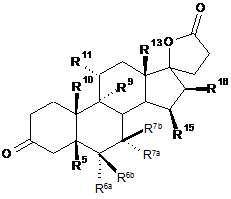
1. Спосіб одержання 3-оксо-прегнан-21,17-карболактонів формули II
 , II
, II
в якій
R5 являє собою водень, гідрокси;
R6a являє собою водень або разом з R7a - СН2 групу;
R6b являє собою водень, разом з R7b - СН2 групу або подвійний зв'язок;
R7a являє собою водень, С1-С4-алкіл, С1-С4-алкоксикарбоніл, С1-С4-тіоацил або разом з R6a -СН2 групу,
R7b являє собою водень або разом з R6b - СН2 групу;
R9 являє собою водень, разом з R11 подвійний зв'язок або разом з R11 епоксигрупу -О-;
R10 являє собою водень, метил або етил;
R11 являє собою водень, разом з R9 подвійний зв'язок або разом з R9 епоксигрупу -О-;
R13 являє собою водень, метил або етил;
R15 являє собою водень, С1-С4-алкіл, або разом з R16 - СН2 групу або подвійний зв'язок;
R16 являє собою водень, разом з R15 -СН2 групу або подвійний зв'язок;
який включає реакцію сполук формули І
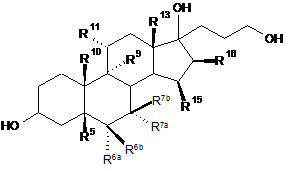 I
I
з принаймні 3 молярними еквівалентами органічного або неорганічного гіпохлориту як окислювального агента у присутності каталітичних кількостей похідного 2,2,6,6-тетраметилпіперидин-N-оксиду при рН принаймні 8,0.
2. Спосіб за п. 1 для одержання 3-оксо-17a-прегнан-21,17-карболактонів формули IIа
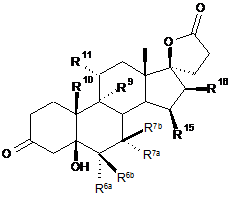 , IIa
, IIa
в якій
R6a являє собою водень або разом з R7a - СН2 групу;
R6b являє собою водень, разом з R7b - СН2 групу або подвійний зв'язок;
R7a являє собою водень, С1-С4-алкоксикарбоніл або С1-С4-тіоацил;
R7b являє собою водень або разом з R6b - СН2 групу,
R9 являє собою водень, разом з R11 подвійний зв'язок або разом з R11 епоксигрупу -О-;
R10 являє собою водень або метил;
R11 являє собою водень, разом з R9 подвійний зв'язок або разом з R9 епоксигрупу -О-;
R15 являє собою водень, разом з R16 - СН2 групу або подвійний зв'язок;
R16 являє собою водень або разом з R15 - СН2 групу або подвійний зв'язок;
де проводять реакцію сполук формули Іа
 Ia.
Ia.
3. Спосіб за п. 1 або 2 для одержання сполук формули IIb
 , IIb
, IIb
де сполуку формули Іb
 , Ib
, Ib
використовують як вихідний матеріал.
4. Спосіб за одним з попередніх пунктів, в якому використовують 3-6 молярних еквівалентів лужного гіпохлориту.
5. Спосіб за одним з попередніх пунктів, в якому використовують 3-4 молярних еквівалентів гіпохлориту натрію.
6. Спосіб за одним з попередніх пунктів, в якому рН реакційного розчину знаходиться в межах від 8,5 до 10,0.
7. Спосіб за одним з попередніх пунктів, в якому рН реакційного розчину встановлюють за допомогою бікарбонату калію.
8. Спосіб за одним з попередніх пунктів, в якому температура реакції становить від 0 до 15 °C.
9. Спосіб за одним з попередніх пунктів, в якому після завершення реакції окислення до реакційної суміші додають відновлювальний агент для нейтралізації надлишку гіпохлоритного реагенту.
10. Спосіб за п. 9, в якому відновлювальний агент додають разом з додаванням основи або основного буфера при рН більше ніж 5.
11. Спосіб за одним з пунктів 9 або 10, в якому як відновлювальний агент використовують водний розчин лужного гідросульфіту.
12. Спосіб за одним з пунктів 9-11, в якому як відновлювальний агент використають гідросульфіт натрію або гідросульфіт калію у формі водного розчину дисульфіту натрію або дисульфіту калію.
13. Спосіб за одним з пунктів 10-12, в якому як основу або основний буфер використовують фосфат натрію Na3PO4.
14. Спосіб одержання 3-оксо-прегн-4-ен-21,17-карболактонів формули III
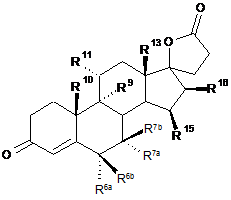 , III
, III
в якій
R6a являє собою водень або разом з R7a - СН2 групу;
R6b являє собою водень, разом з R7b - СН2 групу або подвійний зв'язок;
R7a являє собою водень, С1-С4-алкіл, С1-С4-алкоксикарбоніл, С1-С4-тіоацил або разом з R6a - СН2 групу,
R7b являє собою водень або разом з R6b - СН2 групу;
R9 являє собою водень, разом з R11 подвійний зв'язок або разом з R11 епоксигрупу -О-;
R10 являє собою водень, метил або етил;
R11 являє собою водень, разом з R9 подвійний зв'язок або разом з R9 епоксигрупу -О-;
R13 являє собою водень, метил або етил;
R15 являє собою водень, С1-С4-алкіл, разом з R16 - СН2 групу або подвійний зв'язок;
R16 являє собою водень, разом з R15 - СН2 групу або подвійний зв'язок;
що включає наступні стадії:
а) реакцію сполук загальної формули І
 , I
, I
в якій
R5 являє собою гідрокси;
R6a, R6b, R7a, R7b, R10, R11, R13, R15, R16 мають ті ж самі значення як і у формулі III,
з принаймні 3 молярними еквівалентами органічного або неорганічного гіпохлориту як окислювального агента у присутності каталітичних кількостей похідного 2,2,6,6-тетраметилпіперидин-N-оксиду при рН принаймні 8,0 у дихлорметані або у двофазній суміші дихлорметан-вода
з утворенням сполук формули II
 , II
, II
b) виділення сполук формули II;
c) наступне відщіплення води при рН < 5 у присутності кислоти.
15. Спосіб за п. 14 для одержання 3-оксо-17a-прегн-4-ен-21,17-карболактонів формули IIIа
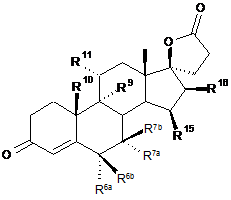 , IIIa
, IIIa
в якій
R6a являє собою водень або разом з R7a - СН2 групу;
R6b являє собою водень, разом з R7b - СН2 групу або подвійний зв'язок;
R7a являє собою водень, С1-С4-алкоксикарбоніл або С1-С4-тіоацил;
R7b являє собою водень або разом з R6b - СН2 групу,
R9 являє собою водень, разом з R11 подвійний зв'язок або разом з R11 епоксигрупу -O-;
R10 являє собою водень або метил;
R11 являє собою водень, разом з R9 подвійний зв'язок або разом з R9 епоксигрупу -О-;
R15 являє собою водень, разом з R16 - СН2 групу або подвійний зв'язок;
R16 являє собою водень, разом з R15 - СН2 групу або подвійний зв'язок,
у якому проводять реакцію сполуки формули Іа
 Ia.
Ia.
16. Спосіб за п. 14 або 15 для одержання сполуки формули IIIb
 , IIIb
, IIIb
де сполуку формули Іb
 Ib
Ib
використовують як вихідний матеріал.
17. Спосіб за одним з пунктів 14-16, в якому використовують 1-5 моль % похідного 2,2,6,6-тетраметилпіперидин-N-оксиду.
18. Спосіб за одним з пунктів 14-17, в якому використовують 1-1,5 моль % 2,2,6,6-тетраметилпіперидин-N-оксиду.
19. Спосіб за одним з пунктів 14-18, в якому використовують 3-6 молярних еквівалентів лужного гіпохлориту.
20. Спосіб за одним з пунктів 14-19, в якому використовують 3-4 молярних еквівалентів гіпохлориту натрію.
21. Спосіб за одним з пунктів 14-20, в якому рН реакційного розчину знаходиться в межах від 8,5 до 10,0.
22. Спосіб за одним з пунктів 14-21, в якому рН реакційного розчину встановлюють за допомогою бікарбонату калію.
23. Спосіб за будь-яким одним з пунктів 14-22, в якому температура реакції становить від 0 до 15 °C.
24. Спосіб за одним з пунктів 14-23, в якому після завершення реакції окислення до реакційної суміші додають відновлювальний агент для нейтралізації надлишку гіпохлоритного реагенту.
25. Спосіб за п. 24, в якому відновлювальний агент додають разом з додаванням основи або основного буфера при рН більше ніж 5.
26. Спосіб за одним з пунктів 24 або 25, в якому як відновлювальний агент використовують водний розчин лужного гідросульфіту.
27. Спосіб за одним з пунктів 24-26, в якому як відновлювальний агент використають гідросульфіт натрію або гідросульфіт калію у формі водного розчину дисульфіту натрію або дисульфіту калію.
28. Спосіб за одним з пунктів 25-27, в якому як основу або основний буфер використовують фосфат натрію Na3PO4.
29. Спосіб одержання дихлорметанового гемісольвату IV:
 , IV
, IV
що включає наступні стадії:
а) реакцію сполук загальної формули Іb
 , Ib
, Ib
з принаймні 3 молярними еквівалентами органічного або неорганічного гіпохлориту як окислювального агента у присутності каталітичних кількостей похідного 2,2,6,6-тетраметилпіперидин-N-оксиду при рН принаймні 8,0 у дихлорметані або у двофазній суміші дихлорметан-вода;
b) виділення сполук формули IV.
30. Спосіб за п. 29, в якому використовують 1-5 моль % похідного 2,2,6,6-тетраметилпіперидин-N-оксиду.
31. Спосіб за п. 29 або 30, в якому використовують 1-1,5 моль % 2,2,6,6-тетраметилпіперидин-N-оксиду.
32. Спосіб за одним з пп. 29-31, в якому використовують 3-6 молярних еквівалентів лужного гіпохлориту.
33. Спосіб за одним з пп. 29-32, в якому використовують 3-4 молярних еквівалентів гіпохлориту натрію.
34. Спосіб за одним з пп. 29-33, в якому рН реакційного розчину знаходиться в межах від 8,5 до 10,0.
35. Спосіб за одним з пп. 29-34, в якому рН реакційного розчину встановлюють за допомогою бікарбонату калію.
36. Спосіб за одним з пп. 29-35, в якому температура реакції становить від 0 до 15 °C.
37. Спосіб за одним з пп. 29-36, в якому після завершення реакції окислення до реакційної суміші додають відновлювальний агент для нейтралізації надлишку гіпохлоритного реагенту.
38. Спосіб за п. 37, в якому відновлювальний агент додають разом з додаванням основи або основного буфера при рН більше ніж 5.
39. Спосіб за одним з пунктів 37 або 38, в якому як відновлювальний агент використовують водний розчин лужного гідросульфіту.
40. Спосіб за одним з пунктів 37-39, в якому як відновлювальний агент використають гідросульфіт натрію або гідросульфіт калію у формі водного розчину дисульфіту натрію або дисульфіту калію.
41. Спосіб за одним з пп. 38-40, в якому як основу або основний буфер використовують фосфат натрію Na3PO4.
42. Гемісольват 6b,7b;15b,16b-диметилен-3-оксо-17a-прегнан-5b-ол-21,17-карболактон-дихлорметан.
43. Спосіб одержання дроспіренону, що включає реакцію гемісольвату 6b,7b;15b,16b-диметилен-3-оксо-17a-прегнан-5b-ол-21,17-карболактон-дихлорметан з кислотою.
44. Спосіб за п. 43, в якому як кислоту використають сірчану кислоту, хлороводневу кислоту або пара-толуолсульфонову кислоту.
Текст
Реферат: Цей винахід стосується способів одержання 3-оксо-прегнан-21,17-карболактонів формули (II), так само як і 3-оксо-прегн-4-ен-21,17-карболактонів формули (III) шляхом безметалевого окислення 17-(3-гідроксипропіл)-3,17-дигідроксіандростанів формули (І). Крім того, винахід стосується дихлорметанового гемісольвату 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол21,17-карболактону (IV), так само як і способу одержання дроспіренону. R13 OH R11 OH R9 R10 R16 R7b R15 R7a HO R5 R6b R6a ,I UA 100092 C2 (12) UA 100092 C2 O R13 O R11 R9 R10 R16 R7b O R15 R7a R5 R6b R6a , II O R13 O R11 R9 R10 R16 R7b R15 R7a O R6b R6a , III O O : 1/2 CH2Cl2 O OH IV. UA 100092 C2 5 10 Цей винахід стосується способів одержання 3-оксо-прегнaн-21,17-карболактонів, так само як і 3-оксо-прегн-4-ен-21,17-карболактонів, зокрема, способів одержання 3-оксо-17-прегнан-21,17карболактонів, так само як і 3-оксо-17-прегн-4-ен-21,17-карболактонів. Крім того, винахід стосується дихлорметанового гемісольвату 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол21,17-карболактону. Прикладами фармакологічно активних стероїд-21,17-карболактонів є еплеренон (9,11епокси-7-метоксикарбоніл-3-оксо-17-прегн-4-ен-21,17-карболактон), дроспіренон (6,7;15,16-диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон), спіронолактон (7-ацилтіо3-оксо-17-прегн-4-ен-21,17-карболактон), канренон (3-оксо-17-прегнa-4,6-дієн-21,17карболактон) і проренон (6,7-метилен-3-оксо-17-прегнa-4,6-дієн-21,17-карболактон). Одержати стероїд-21,17-спіролактон можна шляхом окислення відповідного 17-гідрокси-17(3-гідроксипропіл)стероїду O OH O OH 15 20 25 30 Окислення використовуючи придатні окислювальні агенти, такі як хромова кислота (Sam et al. J. Med. Chem. 1995, 38, 4518-4528), хлорхромат піридинію (EP 075189), дихромат піридинію (Bittler et al; Angew. Chem. [Applied Chem] 1982, 94, 718-719; Nickisch et al. Liebigs Ann. Chem. 1988, 579-584), або бромат калію в присутності рутенієвого каталізатора (EP 918791). Очевидним є утворення побічних продуктів у ряді другорядних реакцій, що негативним чином впливає на процес окислення відомий з попереднього рівня техніки, в якому використаються похідні хрому (VI), що перешкоджає виділенню чистого продукту і знижує вихід. Профіль побічних продуктів поліпшується при використанні окислення, що каталізується рутенієм (EP 918791), а також підвищується вихід. Однак, застосування перехідних металів при виробництві фармацевтично активних інгредієнтів звичайно має недолік, що полягає у видаленні слідів важких металів, що у свою чергу приводить до збільшення вартості виробництва. Крім того, при виробництві накопичуються великі кількості відходів, що містять важкі метали і згадані відходи можна видалити тільки використовуючи інтенсивну і дорогу методику. Тому, ціль цього винаходу полягає в розробці доступного альтернативного способу одержання 3-оксо-прегнан-21,17-карболактонів, так само як і 3-оксо-прегн-4-ен-21,17карболактонів з відповідних 17-(3-гідроксипропіл)-3,17-дигідрокси-андростанів, що уможливить одержання цільових сполук з високим виходом і чистотою. Ця ціль згідно до винаходом досягається шляхом взаємодії 17-(3-гідроксипропіл)-3,17дигідроксиандростанів загальні формули I 13 R 11 R OH OH 9 10 R R R 7b R HO 5 6b R R R 7a R 16 15 I 6a R 35 40 в якій 5 R являє собою водень, гідрокси; 6a 5 7a R являє собою водень, разом з R подвійний зв'язок або разом з R -CH2 групу; 6b 7b R являє собою водень, разом з R -CH2 групу або подвійний зв'язок; 7a 6a R являє собою водень, С1-С4-алкіл, С1-С4-алкоксикарбоніл, С1-С4-тіоацил або разом з R CH2 групу; 7b 6b R являє собою водень або разом з R -CH2 групу; 9 11 11 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу -O-; 10 R являє собою водень, метил або етил; 1 UA 100092 C2 11 5 9 9 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу -O-; 13 R являє собою водень, метил або етил; 15 16 R являє собою водень, С1-C4-алкіл, разом з R -CH2 групу або подвійний зв'язок, 16 15 R являє собою водень, разом з R -CH2 групу або подвійний зв'язок, с органічним або неорганічним гіпохлоритом, як окислювальним агентом, у присутності каталітичних кількостей похідного 2,2,6,6-тетраметилпіперидин-N-оксиду з утворенням 3-оксопрегнан-21,17-карболактонів формули II O O 13 R 11 R 9 10 R R R 7b R O 5 6b R R R 16 15 II 7a R 6a R 5 10 Якщо R являє собою гідроксигруппу, сполуки формули II можна перетворити в присутності кислоти, при pН < 5, після відщеплення води, у сполуки формули III O O 13 R 11 R 9 10 R R R 7b R O 6b R R 7a R 16 15 III 6a R 15 20 25 30 35 Безметалеве окислення спиртів у відповідні альдегіди, кетони, карбонові кислоти, лактоли і лактони загалом описано в оглядовій статті W. Adam et al., Chem. Rev. 2001, 101, 3499-3548. Безметалеве окислення в присутності 2,2,6,6-тетраметилпіперидин-N-оксиду (TEMPO) описується van Bekkum et al. в Synthesis 1996, 1153-1174. Первинні спирти можна окислити до альдегідів використовуючи броміт натрію (NaBr 2) або гіпохлорит кальцію [Ca(OCl2)] у присутності похідних TEMPO [S. Torii et al., J. Org. Chem. 1990, 55, 462-466]. Гіпохлорит натрію (NaOCl) також може бути використаний як окислювальний агент (Org. Synth. 69, 212). Окислення вторинних спиртів у кетони і, зокрема, окислення первинних спиртів у карбонові кислоти (або придатні діоли в лактони) вимагає співкаталізатора (P. L. Anelli et al., J. Org. Chem. 1987, 52, 2559-2562). Як співкаталізатор використовують бромід (в основному KBr або NaBr). Додавання іонів брому може бути корисно навіть при окислюванні первинних спиртів в альдегіди (P. L. Anelli et al., J. Org. Chem. 1987, 52, 2559-2562). Несприятливим фактом при використанні бромідів, як співкаталізаторов, є небезпека утворення, за умов реакції, бромвмісних побічних продуктів. Цей спосіб окислення особливо придатний для окислення первинних спиртів у відповідні альдегіди. Без додавання броміду, TEMPO-каталізоване окислення вторинних спиртів у відповідні кетони вимагає великого надлишку гіпохлориту [3-4 молярних еквівалентів Ca(OCl)2, у такий спосіб 6-8 молярних еквівалентів OCl ; (S. Torii et al., J. Org. Chem. 1990, 55, 462-466)]. Окисна лактонізація 1,4-діолів відбувається за безліч стадій через альдегід, що спочатку утворює на проміжній стадії лактол; квазівторинна гідроксигруппа згаданого лактолу повинна бути надалі окислена. Тому, окисна лактонізація 1,4-діолів вимагає ще більш жорстких умов (принаймні, еквімолярних кількостей похідного TEMPO (J. M. Bobbitt et al., J. Org. Chem. 1991, 56, 6110-6114) або інших окисних агентів, у зв'язку зі збільшенням кількості TEMPO каталізатора 2 UA 100092 C2 5 10 15 20 25 30 35 40 45 50 55 60 (J. Einhorn, J. Org. Chem. 1996, 61, 7452-7454; у присутності добавки броміду: S. D. Rychnovsky, J. Org. Chem. 1999, 64, 310-312; у присутності іонів брому одержуваних на місці з окислювального агента - броміту натрію: S. Torii, J. Org. Chem. 1990, 55, 462-466). Беручи до уваги рівень техніки, несподіваним було те, що окисна лактонізація на D-кільці і окислення вторинної 3-гідроксигрупи 17-(3-гідроксипропіл)-3,17-дигідроксиандростанів загальної формули I (загалом три стадії окислення) можна проводити, по суті, у теж самий час при м'яких умовах у присутності каталітичних кількостей похідних TEMPO. Крім того, несподіваним було те, що спосіб згідно з винаходом може бути здійснений у присутності тільки 1,0 - 2,0 еквівалентів гіпохлориту на стадії окислення, у такий спосіб загалом досить 3,0 - 6,0 молярних еквівалентів гіпохлориту без додавання співкаталізатора, такого як бромід. Спосіб згідно до винаходом проводять загалом в присутності, принаймні, 3 молярних еквівалентів лужного гіпохлориту, органічного гіпохлориту або, принаймні, 1,5 молярних еквівалентів лужноземельного гіпохлориту, як окислювального агента; переважно використовуючи 3-6 молярних еквівалентів лужного гіпохлориту або 1,5-3 молярних еквівалентів лужноземельного гіпохлориту, особливо переважно 3-4 молярних еквівалентів лужного гіпохлориту або 1,5-2 молярних еквівалентів лужноземельного гіпохлориту. Концентрацію водного розчину гіпохлориту під час окислення коригують переважно так, що вона становить від 0,8 до 1,1 моль гіпохлориту/кг. Як окислювальний агент переважно використають гіпохлорит натрію, гіпохлорит калію, гіпохлорит кальцію або трет-бутилгіпохлорит. Похідні 2,2,6,6-тетраметилпіперидин-N-оксиду (похідні TEMPO) використають у каталітичній кількості, де кількість становить переважно 1-5 моль%, особливо переважно 1-1,5 моль%. Придатними похідними TEMPO є 2,2,6,6-тетраметилпіперидин-N-оксид (TEMPO), 4-метокси2,2,6,6-тетраметилпіперидин-N-оксид (4-MeO-TEMPO), так само як і 4-бензилокси-2,2,6,6тетраметилпіперидин-N-оксид (4-BnO-TEMPO). Згідно з винаходом переважно використається TEMPO, особливо переважно в кількості 1-5 моль%, особливо переважно 1-1,5 моль%. Окислення проводять в органічному розчиннику або у двофазній суміші розчинник-вода, де розчинник вибирають таким чином, що похідне TEMPO і сполуки формули I можуть добре розчиняться в ньому. Реакцію переважно проводять у двофазній системі. Спосіб згідно з винаходом ще переважніше проводять у суміші дихлорметан-вода. Окислення згідно з винаходом проводять при температурі від 0 до 20C, переважно при 1020C. Під час окислення, pН реакційного розчину становить, принаймні, 8,0; переважно від 8,5 до 10,0; особливо переважно від 9,0 до 9,5. pН можна придатним образом коректувати використовуючи придатну кислоту Бронстеда, таку як органічні кислоти (наприклад, оцтова кислота) або неорганічні кислоти (HCl, H 2SO4, H3PO4) або кислі солі поліосновних кислот (бікарбонати, гідросульфати, гідрофосфати, і т.д.). Переважно використають лужні бікарбонати, особливо переважно бікарбонат калію. Реакцію окислення припиняли додаючи відновлювальний агент, для того щоб нейтралізувати надлишок гіпохлоритного реагенту. Для цієї мети придатний будь-який відновлювальний агент з відповідним окисно-відновлювальним потенціалом, відомий фахівцеві в даній області техніки. Відповідно до цього винаходу, переважно використають водний розчин лужного гідросульфіту. Особливо переважно використають гідросульфіт натрію або калію (NaHSO 3 або KHSO3), водний розчин дисульфіту натрію або калію (Na2SO2O5 або K2S2O5). Якщо, у реакційній суміші, погасити надлишок гіпохлоритного реагенту при pН 5, можна виділити 3-оксопрегнан-21,17-карболактони формули II. Завершення реакції окислення при pН більше ніж 5, 5 уможливлює специфічне одержання сполук формули II. Тому що у випадку R = OH, розчинність сполук формули II у порівнянні із сполуками формули III в органічних розчинниках нижче, специфічне виділення сполук формули II, як проміжної сполуки на шляху до сполук формули III, забезпечує особливі переваги, що полягає у можливості більш ефективного очищення, (наприклад, шляхом кристалізації). Очищені проміжні сполуки можуть взаємодіяти відповідно до методик відомих з літератури із придатними кислотами (такими як, наприклад, сірчана кислота, хлорводнева кислота, пара-толуолсульфоновая кислота і т.і.) з утворенням сполук формули III (EP 0918791). 3 UA 100092 C2 5 10 Для коректування pН, може бути використана будь-яка придатна неорганічна або органічна основа або будь-який придатний буфер або будь-яка придатна буферна система. Основа або буфер переважно додають до реакційної суміші разом або паралельно з відновлювальним агентом. Відповідно до цього винаходу, як основний буфер, переважно використають фосфат натрію (Na3PO4). Можна одержати 17-(3-гідроксипропіл)-3,17-дигідроксиандростани загальної формули I, наприклад, виходячи з відповідним чином заміщених 3-гідрокси-17-кетоандростанів, шляхом приєднання пропаргілового спирту по C-17 і наступного відновлення потрійного зв'язку (EP 918791, EP 51143, DE 3026783) або як описано N. W. Atwater в J. Org. Chem. 1961, 26, 3077 і в US 4,069,219 або в документах наведених тут. Відповідні 3-гідрокси-17-кетоандростани можна одержати, у свою чергу, з відповідним чином заміщеного 3-гідроксиандрост-5-ен-17-ону (EP 51143, DE 3026783). R R 11 R OH 10 R 9 R R HO OH 13 R 5 R R 6b 7b R R 16 15 I 7a 6a Окислення O R R 13 O R 11 10 R 9 R R O R 5 R R 6b 7b R R 7a 16 15 II 6a обробка при рН 5 O R R 13 O R 11 O R 10 R 9 R 16 R R5 = OH R O 15 R R 6b 7b R R 15 R 11 10 R 9 R R Кислота 7a O III 6a R 5 R R 13 O 6b 7b R R 7a 16 15 II 6a Спосіб згідно з винаходом особливо придатний для одержання 3-оксо-17-прегнан-21,17карболактонів формули IIa 4 UA 100092 C2 O O R 11 R 10 R 9 R R O OH R R 7b R R 6b 16 15 7a IIa 6a так само як і 3-оксо-17-прегн-4-ен-21,17-карболактонів формули IIIa, O O R 11 R 10 R 9 R R O R R 5 10 15 6b 7b R R 16 15 7a IIIa 6a в якій замісники R мають наступні значення: 6a 7a R являє собою водень або разом з R -CH2 групу; 6b 7b R являє собою водень, разом з R -CH2 групу або подвійний зв'язок; 7a R являє собою водень, C1-C4-алкоксикарбоніл або C1-C4-тіоацил; 7b 6b R являє собою водень або разом з R -CH2 групу, 9 11 11 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу -O-; 10 R являє собою водень або метил; 11 9 9 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу -O-; 15 16 R являє собою водень, разом з R -CH2 групу або подвійний зв'язок; 16 15 R являє собою водень, разом з R -CH2 групу або подвійний зв'язок; де як вихідні матеріали використаються 17-(3-гідроксипропіл)-3,17-дигідроксиандростани загальної формули Іa OH R 11 R OH 10 R 9 R R HO OH R R 20 6b 7b R R 7a 16 15 Ia 6a . Спосіб згідно з винаходом одержання сполук формул IIa і IIIa є ще більш придатним для сполук IIb, так само як і IIIb, де сполука формули Ib використовується як вихідний матеріал, і в якій 6a 7а 9 11 R , R , R , R являють собою водні; 6b 7b R і R разом являють собою -CH2 групу; 10 R являє собою метил; 15 16 R і R разом являють собою -CH2 групу. 5 UA 100092 C2 OH OH Ib HO OH Окислення O O O IIb OH обробка при рН > 5 дихлорметан обробка при рН 5. Під час окислення, цей поганорозчинний продукт випадає в осад, і в такий спосіб можна уникнути впливу окислювального агента, а також можливих додаткових реакцій, які можуть приводити до утворення побічних продуктів. Дихлорметан-гемісольват IV відрізняється точною і постійною температурою плавлення, що становить 121C, у той час як сполука IIb плавиться при 188°C. Вимірювання ДСК (диференціальна скануюча калориметрія) показали, що сполука IV стабільно до температури плавлення. Після завершення реакції, осадження сполуки IV з реакційного розчину завершують шляхом додавання неполярного розчинника, переважно, ефіру, особливо переважно, діізопропілового ефіру. Неполярні продукти окислення й елімінування, що утворюються в результаті залишкового окислення, добре розчиняються в суміші ефір-дихлорметан, що уможливлює надзвичайно легке виділення сполуки IV з високою чистотою. У цьому випадку, сполуку IV одержують із виходом 82%. Одержаний у такий спосіб продукт містить не більше ніж 6% стероїдних домішок і може легко вступати в реакції без додаткового очищення, відповідно до відомих способів, із придатними кислотами з утворенням дроспіренону IIIb (EP 918791). Синтез варіантів, що протікає через виділену сполуку IV, дає додаткові переваги - значно більший загальний вихід по IIIb завдяки простоті і більшій ефективності очищення на кінцевій стадії. Загальний вихід по IIIb становить 77%, приблизно на 7% вище, ніж у відповідності зі способом окислення, що каталізується Ru і наступним відщіпленням води й навіть приблизно на 21% вище, ніж відповідно до однореакторного способу згідно з EP 075189 (Таблиця 1). Як альтернатива, Ib може бути окислений до IIb і перетворений безпосередньо в IIIb у тієї ж самій реакційній суміші шляхом обробки в кислому середовищі при pН < 5. Таблиця 1: Порівняння виходів способу згідно з винаходом зі способами попереднього рівня техніки 6 UA 100092 C2 Спосіб Спосіб згідно з винаходом 5 10 15 20 25 30 35 40 45 50 Ib IIb 82 (у формі IV) Вихід (% від теорії) IIb IIIb Загалом (Ia IIIb) 94 77 Окислення, що каталізується Ru 75 94 70 відповідно до EP918791 Окислення Cr3 відповідно до не виділяли не виділяли 56 EP075189* * Дивіться Таблицю на сторінці 7 EP918791 Цей винахід пояснюється більш детально з використанням прикладів наведених нижче, без бажання обмежити його яким-небудь чином. Спосіб одержання Загальний технологічний процес 1 (ОТП1): Синтез сполук формули II 76,9 ммоль сполуки формули I розчиняють або суспендують в 135 мл дихлорметану. Спочатку до суміші при 15°C додають 0,15 г (1 ммоль) TEMPO. Додають розчин, що містить 134 г 15,25% водного розчину гіпохлориту натрію (230,7 ммоль) і 8,20 г (82 ммоль) бікарбонату калію в 114 мл води, внаслідок чого значення pН становить 9,1. Після завершення реакції, надлишок окислювального агента нейтралізують при 15°C додаючи водний розчин, що містить 12,5 г (76,5 ммоль) фосфату натрію і 10,6 г (55,8 ммоль) дисульфіту натрію (Na 2S2O5) і 121 мл води. Продукт формули II виділяють із органічної фази шляхом осадження з реакційного розчину додаючи 240 мл діізопропілового ефіру, наступного перемішування протягом 3 годин при 25°C, фільтрування і висушування. Як альтернатива, продукт який вже частково випав у осад під час реакції, що залежить від розчинності в дихлорметані, можна розчинити знову додавши дихлорметан, відокремити органічну фазу і відігнати діізопропіловий етер. Продукт, що випав у осад у цьому випадку, відфільтровують з 300 мл води, промивають і сушать. Загальний технологічний процес 2 (ОТП2): Синтез сполук формули III в однореакторному способі 76,9 ммоль сполуки формули I розчиняють або суспендують в 135 мл дихлорметану. Спочатку до суміші при 15°C додають 0,15 г (1 ммоль) TEMPO. Додають розчин, що містить 134 г 15,25% водного розчину гіпохлориту натрію (230,7 ммоль) і 8,20 г (82 ммоль) бікарбонату калію в 114 мл води, внаслідок чого значення pН становить 9,1. Після завершення реакції, надлишок окислювального агента нейтралізують при 15°C додаючи водний розчин, що містить 10,6 г (55,8 ммоль) дисульфіту натрію (Na2S2O5) і 121 мл води. pН реакційного розчину доводять до pН < 5 за допомогою додавання розведеної водної сірчаної кислоти і перемішування реакційної суміші при кімнатній температурі до завершення реакції. Виділення продукту формули III проводять аналогічно виділенню сполук формули II згідно з ОТП1, де з нейтральної промитої органічної фази відганяють діізопропіловий етер. Продукт, що випав в осад у цьому випадку, відфільтровують, промивають 300 мл води й сушать. Загальний технологічний процес 3 (ОТП3): Синтез сполук формули III виходячи зі сполук 5 формули II, в яких R = OH: 5 0,1 моль сполуки формули II, в якій R = OH, одержаній згідно з ОТП1, суспендують в 65 мл тетрагідрофурану або діоксану і підкислюють до pН = 1 додаючи 5 мл 20% сірчаної кислоти. При кімнатній температурі, перемішують реакційну суміш до завершення зневоднення. Виділення продукту формули III проводять шляхом осадження за допомогою додавання 90 мл води. Продукт, що випав у осад, відфільтровують з водою, промивають до нейтральної реакції і сушать. Приклад 1 Гемісольват 6,7β;15,16-Диметилен-3-оксо-17-прегнан-5-ол-21,17карболактон-дихлорметан (IV): Згідно з ОТП1, реагують 30 г (0,0769 моль) 17(-(3-гідроксипропіл)-6,7;15,16-диметиленандростан-3,5,17-триолу. Під час реакції, продукт 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол-21,17карболактон накопичується у формі його дихлорметанового гемісольвату. Після руйнування надлишку окислювального агента і після обробки згідно з ОТП1, виділяють 27 г гемісольвату 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол-21,17-карболактон-дихлорметан (0,0630 моль) = 82% від теорії. 20 []D = -61° (c = 1,0; CHCl3); температура плавлення = 121°C; 1 H-ЯМР (400 МГц, CDCl3): = 0,52 (к, J = 5,5 Гц, 1H, 21 -H [15,16-метиленовий місток]), 0,68-0,78 (м, 2H, 20-H [6,7-метиленовий місток]), 0,89-0,97 (м, 1H, 6-H), 0,93 (с, 3H, 19-H), 0,99 (с, 3H, 18-H), 1,19-1,52 (м, 7H), 1,54-1,85 (м, 6H), 1,92 (дд, J = 3,8 і 11,8 Гц, 1H, 14-H), 2,06-2,16 (м, 7 UA 100092 C2 5 10 15 20 25 1H, 22-H), 2,17-2,27 (м, 1H, 2-H), 2,32-2,69 (м, 5H), 2,96 (д, J = 15,6 Гц, 1H, 4-H), 5,30 (с, 1H, CH2Cl2). 13 C-ЯМР (400 МГц, CDCl3): = 9,97 (CH2, C-21), 11,63 (CH2, C-20), 16,74 (CH, C-15), 16,79 (CH, C-7), 17,29 (CH3, C-19), 19,83 (CH3, C-18), 21,75 (CH2, C-11), 24,31 (CH, C-16), 24,76 (CH, C6), 29,35 (CH2, C-23), 30,70 (CH2, C-22), 33,96 (CH, C-8), 34,47 (CH2, C-1), 36,26 (CH2, C-2), 37,31 (CH2, C-12), 40,25 (C, C-10), 41,81 (C, C-13), 47,59 (CH, C-9), 52,18 (CH, C-14), 53,44 (CH2Cl2), 53,48 (CH2, C-4), 75,57 (C, C-5), 96,24 (C, C-17), 176,63 (C, C-24), 210,56 (C, C-3). + + + + МС (ЕІ, 70 еВ) m/e = 384 (M ); m/e = 366 (M -H2O); m/e = 314 (M -C4H6O); m/e = 111 (C7C11O ); + + + m/e = 91 (C6H11O ); m/e = 55 (C3H3O ); m/e = 43 (C2H3O ). -1 -1 -1 -1 ІЧ: = 3483 см (OH); = 1757 см (C=O, лактон); = 1708 см (C=O); = 1200 см (O-1 C=O); = 1011 см (C-O) Приклад 2 6,7;15,16-Диметилен-3-оксо-17-прег-4-ен-21,17-карболактон (IIIb): Згідно з ОТП2, реагує 30 г (0,0769 моль) 17-(3-гідроксипропіл)-6,7;15,16-диметиленандростан-3,5,17-триолу. Після руйнування надлишку окислювального агента згідно з ОТП2, реакційну суміш підкислюють 10% розчином сірчаної кислоти до pН = 1 і перемішують протягом 30 хвилин при 25°C. Після обробки згідно з ОТП2, виділяють 21,5 г 6,7;15,16-диметилен-3оксо-17-прегн-4-ен-21,17-карболактону (0,059 моль) = 76,7% від теорії. 22 []D -182° (c = 0,5 CHCl3); температура плавлення = 201,3°C; УФ (MeOH): 265 = 19000; 1 найбільш важливі дані H-ЯМР (CDCl3): = 0,40-0,67 (м, 1H, циклопропіл H), 1,01 (с, 3H, 18-H), 1,11 (с, 3H, 19-H), 6,04 (с, 1H, 4-H) (D. Bittler, H. Hofmeister, H. Laurent, K. Nickisch, R. Nickolson, K. Petzoldt, R. Wiechert; Angew. Chem. Int. Ed. Engl. 1982, 21, 696-697]; + + + МС (EІ, 70 еВ) m/e = 366 (M ); m/e = 338 (M -CO); m/e = 351 (M -CH3); значні фрагменти: m/e = 111; m/e = 136; m/e = 199, m/e = 217; m/e = 242; m/e = 255; m/e = 268; m/e = 293 [Віднесення: дивіться W. Krause, G. Kuehne; Steroids 1982, 40, 81-90]. Приклад 3 6,7:15,16-диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон (IIIb): Згідно з ОТП3, реагують 30 г (70,25 ммоль) гемісольвату 6,7;15,16-диметилен-3-оксо17-прегнан-5-ол-21,17-карболактон-дихлорметану (з Прикладу 1) з утворенням 24,30 г дроспіренону (вихід: 94,5%). ФОРМУЛА ВИНАХОДУ 30 1. Спосіб одержання 3-оксо-прегнан-21,17-карболактонів формули II O R R R 11 10 R 13 9 R R7b O R 40 45 R 16 15 R7a 5 R6a 35 O R6b , II в якій 5 R являє собою водень, гідрокси; 6a 7a R являє собою водень або разом з R - СН2 групу; 6b 7b R являє собою водень, разом з R - СН2 групу або подвійний зв'язок; 7a R являє собою водень, С1-С4-алкіл, С1-С4-алкоксикарбоніл, С1-С4-тіоацил або 6a разом з R -СН2 групу, 7b 6b R являє собою водень або разом з R - СН2 групу; 9 11 11 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу О-; 10 R являє собою водень, метил або етил; 11 9 9 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу О-; 13 R являє собою водень, метил або етил; 8 UA 100092 C2 15 16 R являє собою водень, С1-С4-алкіл, або разом з R - СН2 групу або подвійний зв'язок; 16 15 R являє собою водень, разом з R -СН2 групу або подвійний зв'язок; який включає реакцію сполук формули І R R R 11 13 OH OH 10 R 9 R R7b HO 5 10 R R 16 15 R7a 5 R6a R6b I з принаймні 3 молярними еквівалентами органічного або неорганічного гіпохлориту як окислювального агента у присутності каталітичних кількостей похідного 2,2,6,6тетраметилпіперидин-N-оксиду при рН принаймні 8,0. 2. Спосіб за п. 1 для одержання 3-оксо-17-прегнан-21,17-карболактонів формули IIа O O 11 R R 10 R 9 R R7b O 20 15 R7a OH R6a 15 R 16 R6b , IIa в якій 6a 7a R являє собою водень або разом з R - СН2 групу; 6b 7b R являє собою водень, разом з R - СН2 групу або подвійний зв'язок; 7a R являє собою водень, С1-С4-алкоксикарбоніл або С1-С4-тіоацил; 7b 6b R являє собою водень або разом з R - СН2 групу, 9 11 11 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу О-; 10 R являє собою водень або метил; 11 9 9 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу О-; 15 16 R являє собою водень, разом з R - СН2 групу або подвійний зв'язок; 16 15 R являє собою водень або разом з R - СН2 групу або подвійний зв'язок; де проводять реакцію сполук формули Іа OH R R 11 OH 10 R 9 R R7b HO 25 R 16 15 R7a OH R6a R6b Ia. 3. Спосіб за п. 1 або 2 для одержання сполук формули IIb 9 UA 100092 C2 O O O OH , IIb де сполуку формули Іb OH OH HO 5 10 15 20 25 OH , Ib використовують як вихідний матеріал. 4. Спосіб за одним з попередніх пунктів, в якому використовують 3-6 молярних еквівалентів лужного гіпохлориту. 5. Спосіб за одним з попередніх пунктів, в якому використовують 3-4 молярних еквівалентів гіпохлориту натрію. 6. Спосіб за одним з попередніх пунктів, в якому рН реакційного розчину знаходиться в межах від 8,5 до 10,0. 7. Спосіб за одним з попередніх пунктів, в якому рН реакційного розчину встановлюють за допомогою бікарбонату калію. 8. Спосіб за одним з попередніх пунктів, в якому температура реакції становить від 0 до 15 °C. 9. Спосіб за одним з попередніх пунктів, в якому після завершення реакції окислення до реакційної суміші додають відновлювальний агент для нейтралізації надлишку гіпохлоритного реагенту. 10. Спосіб за п. 9, в якому відновлювальний агент додають разом з додаванням основи або основного буфера при рН більше ніж 5. 11. Спосіб за одним з пунктів 9 або 10, в якому як відновлювальний агент використовують водний розчин лужного гідросульфіту. 12. Спосіб за одним з пунктів 9-11, в якому як відновлювальний агент використають гідросульфіт натрію або гідросульфіт калію у формі водного розчину дисульфіту натрію або дисульфіту калію. 13. Спосіб за одним з пунктів 10-12, в якому як основу або основний буфер використовують фосфат натрію Na3PO4. 14. Спосіб одержання 3-оксо-прегн-4-ен-21,17-карболактонів формули III O R R R 11 10 R 13 O 9 R R7b O R 16 15 R7a R6a R6b , III в якій 10 UA 100092 C2 6a 5 10 15 7a R являє собою водень або разом з R - СН2 групу; 6b 7b R являє собою водень, разом з R - СН2 групу або подвійний зв'язок; 7a R являє собою водень, С1-С4-алкіл, С1-С4-алкоксикарбоніл, С1-С4-тіоацил або 6a разом з R - СН2 групу, 7b 6b R являє собою водень або разом з R - СН2 групу; 9 11 11 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу О-; 10 R являє собою водень, метил або етил; 11 9 9 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу О-; 13 R являє собою водень, метил або етил; 15 16 R являє собою водень, С1-С4-алкіл, разом з R - СН2 групу або подвійний зв'язок; 16 15 R являє собою водень, разом з R - СН2 групу або подвійний зв'язок; що включає наступні стадії: а) реакцію сполук загальної формули І R R R 11 13 OH OH 10 R 9 R R7b HO R 15 R7a 5 R6a 20 R 16 R6b ,I в якій 5 R являє собою гідрокси; 6a 6b 7a 7b 10 11 13 15 16 R , R , R , R , R , R , R , R , R мають ті ж самі значення як і у формулі III, з принаймні 3 молярними еквівалентами органічного або неорганічного гіпохлориту як окислювального агента у присутності каталітичних кількостей похідного 2,2,6,6тетраметилпіперидин-N-оксиду при рН принаймні 8,0 у дихлорметані або у двофазній суміші дихлорметан-вода з утворенням сполук формули II O R R R 11 10 R 13 9 R R7b O 25 R O R 16 15 R7a 5 R6a R6b , II b) виділення сполук формули II; c) наступне відщеплення води при рН < 5 у присутності кислоти. 15. Спосіб за п. 14 для одержання 3-оксо-17-прегн-4-ен-21,17-карболактонів формули IIIа 11 UA 100092 C2 O O R R 11 10 R 9 R R7b O 10 15 R7a R6a 5 R 16 R6b , IIIa в якій 6a 7a R являє собою водень або разом з R - СН2 групу; 6b 7b R являє собою водень, разом з R - СН2 групу або подвійний зв'язок; 7a R являє собою водень, С1-С4-алкоксикарбоніл або С1-С4-тіоацил; 7b 6b R являє собою водень або разом з R - СН2 групу, 9 11 11 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу O-; 10 R являє собою водень або метил; 11 9 9 R являє собою водень, разом з R подвійний зв'язок або разом з R епоксигрупу О-; 15 16 R являє собою водень, разом з R - СН2 групу або подвійний зв'язок; 16 15 R являє собою водень, разом з R - СН2 групу або подвійний зв'язок, у якому проводять реакцію сполуки формули Іа OH R R 11 OH 10 R 9 R R7b HO 15 R 16 15 R7a OH R6a R6b Ia. 16. Спосіб за п. 14 або 15 для одержання сполуки формули IIIb O O O , IIIb де сполуку формули Іb 12 UA 100092 C2 OH OH HO 5 10 15 20 25 OH Ib використовують як вихідний матеріал. 17. Спосіб за одним з пунктів 14-16, в якому використовують 1-5 моль % похідного 2,2,6,6-тетраметилпіперидин-N-оксиду. 18. Спосіб за одним з пунктів 14-17, в якому використовують 1-1,5 моль % 2,2,6,6тетраметилпіперидин-N-оксиду. 19. Спосіб за одним з пунктів 14-18, в якому використовують 3-6 молярних еквівалентів лужного гіпохлориту. 20. Спосіб за одним з пунктів 14-19, в якому використовують 3-4 молярних еквівалентів гіпохлориту натрію. 21. Спосіб за одним з пунктів 14-20, в якому рН реакційного розчину знаходиться в межах від 8,5 до 10,0. 22. Спосіб за одним з пунктів 14-21, в якому рН реакційного розчину встановлюють за допомогою бікарбонату калію. 23. Спосіб за будь-яким одним з пунктів 14-22, в якому температура реакції становить від 0 до 15 °C. 24. Спосіб за одним з пунктів 14-23, в якому після завершення реакції окислення до реакційної суміші додають відновлювальний агент для нейтралізації надлишку гіпохлоритного реагенту. 25. Спосіб за п. 24, в якому відновлювальний агент додають разом з додаванням основи або основного буфера при рН більше ніж 5. 26. Спосіб за одним з пунктів 24 або 25, в якому як відновлювальний агент використовують водний розчин лужного гідросульфіту. 27. Спосіб за одним з пунктів 24-26, в якому як відновлювальний агент використають гідросульфіт натрію або гідросульфіт калію у формі водного розчину дисульфіту натрію або дисульфіту калію. 28. Спосіб за одним з пунктів 25-27, в якому як основу або основний буфер використовують фосфат натрію Na3PO4. 29. Спосіб одержання дихлорметанового гемісольвату IV: O O : 1/2 CH2Cl2 O 30 OH , IV що включає наступні стадії: а) реакцію сполук загальної формули Іb 13 UA 100092 C2 OH OH HO 5 10 15 20 25 30 35 OH , Ib з принаймні 3 молярними еквівалентами органічного або неорганічного гіпохлориту як окислювального агента у присутності каталітичних кількостей похідного 2,2,6,6тетраметилпіперидин-N-оксиду при рН принаймні 8,0 у дихлорметані або у двофазній суміші дихлорметан-вода; b) виділення сполук формули IV. 30. Спосіб за п. 29, в якому використовують 1-5 моль % похідного 2,2,6,6тетраметилпіперидин-N-оксиду. 31. Спосіб за п. 29 або 30, в якому використовують 1-1,5 моль % 2,2,6,6тетраметилпіперидин-N-оксиду. 32. Спосіб за одним з пп. 29-31, в якому використовують 3-6 молярних еквівалентів лужного гіпохлориту. 33. Спосіб за одним з пп. 29-32, в якому використовують 3-4 молярних еквівалентів гіпохлориту натрію. 34. Спосіб за одним з пп. 29-33, в якому рН реакційного розчину знаходиться в межах від 8,5 до 10,0. 35. Спосіб за одним з пп. 29-34, в якому рН реакційного розчину встановлюють за допомогою бікарбонату калію. 36. Спосіб за одним з пп. 29-35, в якому температура реакції становить від 0 до 15 °C. 37. Спосіб за одним з пп. 29-36, в якому після завершення реакції окислення до реакційної суміші додають відновлювальний агент для нейтралізації надлишку гіпохлоритного реагенту. 38. Спосіб за п. 37, в якому відновлювальний агент додають разом з додаванням основи або основного буфера при рН більше ніж 5. 39. Спосіб за одним з пунктів 37 або 38, в якому як відновлювальний агент використовують водний розчин лужного гідросульфіту. 40. Спосіб за одним з пунктів 37-39, в якому як відновлювальний агент використають гідросульфіт натрію або гідросульфіт калію у формі водного розчину дисульфіту натрію або дисульфіту калію. 41. Спосіб за одним з пп. 38-40, в якому як основу або основний буфер використовують фосфат натрію Na3PO4. 42. Гемісольват 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол-21,17карболактон-дихлорметан. 43. Спосіб одержання дроспіренону, що включає реакцію гемісольвату 6,7;15,16-диметилен-3-оксо-17-прегнан-5-ол-21,17-карболактон-дихлорметан з кислотою. 44. Спосіб за п. 43, в якому як кислоту використають сірчану кислоту, хлороводневу кислоту або пара-толуолсульфонову кислоту. 40 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the production of 3-oxo-pregnane-21,17-carbolactones and 3-oxo-pregn-4-ene-21,17-carbolactones, hemisolvate, process for the preparation thereof and process for the production of drospirenone
Автори англійськоюSeilz Carsten, Seba Hartmut
Назва патенту російськоюСпособы получения 3-оксо-прегнан-21,17-карболактонов и 3-оксо-прегн-4-ен-21,17-карболактонов, гемисольват, способ его получения и способ получения дроспиренона
Автори російськоюЗайльц Карстен, Зеба Хартмут
МПК / Мітки
МПК: C07J 53/00
Мітки: дроспіренону, одержання, гемісольват, способи, 3-оксо-прегн-4-ен-21,17-карболактонів, 3-оксо-прегнан-21,17-карболактонів, спосіб
Код посилання
<a href="https://ua.patents.su/16-100092-sposobi-oderzhannya-3-okso-pregnan-2117-karbolaktoniv-ta-3-okso-pregn-4-en-2117-karbolaktoniv-gemisolvat-sposib-jjogo-oderzhannya-ta-sposib-oderzhannya-drospirenonu.html" target="_blank" rel="follow" title="База патентів України">Способи одержання 3-оксо-прегнан-21,17-карболактонів та 3-оксо-прегн-4-ен-21,17-карболактонів, гемісольват, спосіб його одержання та спосіб одержання дроспіренону</a>
Попередній патент: Спосіб центрування рейок у машині для контактного стикового зварювання
Наступний патент: Спосіб зниження надлишкової маси тіла
Випадковий патент: Спосіб відтворення повномасштабної моделі артеріальної системи нирок дрібних тварин