Похідні хроману як модулятори trpv3
Номер патенту: 104861
Опубліковано: 25.03.2014
Автори: Томас Абрахам, Хайраткар-Джоші Нііліма, Хатік Джавед Юсуф, Лінгам В.С. Прасада Рао, Каттіге Від'я Ганапаті
Формула / Реферат
1. Сполука формули (І):
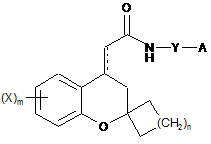 , (І)
, (І)
де пунктирна (- - - -) лінія відсутня;
А являє собою С3-С12циклоалкільну, С6-С14арильну, 3-15-членну гетероарильну або 3-15-членну гетероциклічну групу, необов'язково заміщену галогеном, С1-С8алкілом або OR2;
Y являє собою -(CHR1)r, де R1 являє собою водень, галоген або С1-С8алкіл;
X являє собою водень, нітро, ціано, галоген, С1-С8алкіл, -OR2, -NR3R4, -C(O)-R3, -C(O)O-R3, -C(O)NR3R4, -S(O)рNR3R4 або -S(O)рR3;
R3 та R4, які можуть бути однаковими або різними, в кожному випадку незалежно вибрані з водню, -OR2, С1-С8алкілу або С1-С8алкенілу;
R2 в кожному випадку незалежно вибраний з групи, що складається з водню, заміщеного або незаміщеного С1-С8алкілу або С2-С8алкенілу, або С3-С12циклоалкілу;
"m" дорівнює цілому числу від 0 до 2, обидва значення включені;
"n" дорівнює цілому числу від 0 до 2, обидва значення включені;
"p" дорівнює цілому числу від 0 до 2, обидва значення включені; та
"r" дорівнює цілому числу від 0 до 2, обидва значення включені;
або її фармацевтично прийнятні солі.
2. Сполука за п. 1, яка відрізняється тим, що Y являє собою -(CHR1)]r, де r дорівнює 0 або 1.
3. Сполука за п. 1 або 2, яка відрізняється тим, що R1 являє собою водень або С1-С8алкіл.
4. Сполука за пп. 1-3, яка відрізняється тим, що А являє собою С6-С14арил.
5. Сполука за пп. 1-3, яка відрізняється тим, що А являє собою 3-15-членний гетероарил.
6. Сполука за п. 1, яка відрізняється тим, що "n" дорівнює 1.
7. Сполука за пп. 1-6, яка відрізняється тим, що вибрана з:
2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-(2-метоксифеніл)ацетаміду,
2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-(2-циклопентилокси-3-метоксибензил)ацетаміду,
2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-1-(4-метоксинафтилметил)ацетаміду,
2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-[(4-метоксидибензо[b,d]фуран-1-іл)метил]ацетаміду,
2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-[(1S)-1-фенілетил]ацетаміду,
N-(2-циклопентилоксифеніл)-2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)ацетаміду,
N-(2,6-дифторбензил)-2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)ацетаміду,
2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-хінолін-6-ілацетаміду,
N-[4-(4-бромфеніл)-1,3-тіазол-2-іл]-2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)ацетаміду,
2-(6-метокси-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-1-нафтилацетаміду,
2-(6-метокси-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-1,3-тіазол-2-ілацетаміду та
2-(6-метокси-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-(6-метил-1,3-бензотіазол-2-іл)ацетаміду або
їх фармацевтично прийнятних солей.
8. Фармацевтична композиція, яка відрізняється тим, що містить сполуку за будь-яким з пп. 1-7 у формі вільної основи або у формі фармацевтично прийнятної солі та фармацевтично прийнятну допоміжну речовину.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що фармацевтично прийнятна допоміжна речовина являє собою носій або розріджувач.
10. Сполука за будь-яким з пп. 1-7, яка використовується для профілактики, полегшення або лікування опосередкованого ванілоїдним рецептором захворювання, розладу або синдрому у суб'єкта.
11. Сполука за п. 10, яка відрізняється тим, що ванілоїдним рецептором є TRPV3.
12. Сполука за п. 11, яка відрізняється тим, що симптоми захворювання, розладу, синдрому або стану, пов'язаного з функцією TRPV3, вибрані з групи, що складається з болю, гострого болю, хронічного болю, ноцицептивного болю, невропатичного болю, післяопераційного болю, зубного болю, болю при онкологічних захворюваннях, серцевого болю, що є наслідком ішемії міокарда, болю внаслідок мігрені, артралгії, різних видів невропатії, невралгії, тригемінальної невралгії, пошкодження нерва, діабетичної невропатії, нейродегенерації, ретинопатії, невротичного розладу шкіри, інсульту, гіперчутливості сечового міхура, нетримання сечі, вульводинії, розладів шлунково-кишкового тракту, таких як синдром подразнення кишечнику, гастроезофагеальна рефлюксна хвороба, ентерит, ілеїт, виразка шлунка/12-палої кишки, запальне захворювання кишечнику, хвороба Крона, глютенчутлива ентеропатія, запального захворювання, такого як панкреатит, розладу дихальних шляхів, такого як алергічний та неалергічний риніт, астма або хронічне обструктивне захворювання легень, подразнення шкіри, ока або слизової оболонки, дерматит, стану, що супроводжується свербежем, такого як уремічний свербіж, гарячкового стану, спазмів м'язів, блювання, дискінезій, депресії, хвороби Хантінгтона, погіршення пам'яті, обмеження функції мозку, аміотрофічного латерального склерозу (АЛС), деменції, артриту, остеоартриту, діабету, ожиріння, кропивниці, актинічного кератозу, кератоксантоми, алопеції, хвороби Меньє, дзвону у вухах, гіперакузії, тривожних розладів і доброякісної гіперплазії передміхурової залози.
13. Сполука за пп. 1-7, яка використовується для лікування болю у суб'єкта, при цьому сполука є в терапевтично ефективній кількості.
14. Сполука за п. 13, яка відрізняється тим, що біль являє собою гострий біль, хронічний біль, післяопераційний біль або невропатичний біль.
15. Сполука за пп. 1-7 для використання при лікуванні запалення у суб'єкта, при цьому сполука є в терапевтично ефективній кількості.
Текст
Реферат: В даному винаході запропоновані похідні хроману як модулятори тимчасового потенціалу ванілоїдного рецептора (TRPV). Конкретно, описані в даному винаході сполуки є придатними для лікування або профілактики модульованих TRPV3 захворювань, етапів та/або розладів. Також запропоновані способи одержання описаних в даному винаході сполук, проміжні сполуки, які використовуються в їх синтезі, фармацевтичні композиції, що їх містять, і способи лікування або профілактики захворювань, станів та/або розладів, модульованих TRPV3. UA 104861 C2 (12) UA 104861 C2 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 ЗВ’ЯЗАНІ ЗАЯВКИ Дана заявка претендує на пріоритет індійської патентної заявки № 1274/MUM/2008, поданої 17 червня 2008 р., і Тимчасової Заявки США № 61/078,603, поданої 7 липня 2008 р., всі з яких таким чином включені шляхом посилання. ГАЛУЗЬ ТЕХНІКИ Дана патентна заявка стосується похідних хроману, що володіють активністю тимчасового потенціалу рецептора ванілоїда 3 (TRPV3). РІВЕНЬ ТЕХНІКИ Рух іонів крізь мембрани клітин здійснюється спеціалізованими білками. Канали TRP є однією великою сім'єю неселективних катіонних каналів, функція яких полягає у сприянні регуляції потоку іона і мембранного потенціалу. Канали TRP підрозділяються на 6 підродин, в тому числі родину TRPV. TRPV3 є членом класу TRPV каналів TRP. TRPV3 являє собою проникний для кальцію канал, конкретно, проникний для кальцію неселективний катіонний канал. На додаток до іонів кальцію, канали TRPV3 проникні для інших катіонів, наприклад, натрію. Таким чином, канали TRPV3 модулюють мембранний потенціал, модулюючи потік катіонів, наприклад, іонів кальцію і натрію. Рецептори TRPV3 з механістичної точки зору є відмінними від регульованих напругою каналів кальцію. Загалом, регульовані напругою канали кальцію відповідають на деполяризацію мембрани і відкриваються, щоб дозволити вхідний потік кальцію з позаклітинного середовища, що приводить до збільшення внутріклітинних рівнів або концентрацій кальцію. І навпаки, канали TRP, що являють собою неселективні катіонні канали, загалом відкриваються лігандами (такими як 2аміноетоксидифенілборат [2-АФБ], тепло і ванілоїди), діють довго і спричиняють триваліші зміни концентрації іона. Вказані механістичні відмінності супроводжуються структурними відмінностями між каналами, що відкриваються напругою, і каналами TRP. Таким чином, хоча численні інші канали діють таким чином, щоб регулювати потік іонів і мембранний потенціал в різних типах клітини та у відповідь на численні стимули, важливо розпізнати структурні, функціональні і механістичні відмінності поміж різними класами іонних каналів. Білки TRPV3 являють собою термочутливі канали, що експресуються в клітинах шкіри (Peier et al. Science (2002), 296, 2046-2049) і гангліях корінців спинного мозку, тригемінальному ганглії, спинному мозку і мозку (Xu et al. Nature (2002), 418, 181-185; Smith et al. Nature (2002), 418, 186188). У лінії клітин кератиноцитів, стимуляція TRPV3 приводить до вивільнення медіаторів запалення, в тому числі інтерлейкіну-1. Таким чином, TRPV3 також може відігравати важливу роль в регуляції запалення і болю, що є результатом вивільнення запальних стимулів. Конкретні білки TRPV3, які можуть використовуватися в скринінгових аналізах, як описано в даному описі, для ідентифікації сполук, які модулюють функцію TRPV3, включають, не обмежуючись ними, TRPV3 людини, TRPV3 миші, TRPV3 щура і TRPV3 Drosophila. В US 2004/0009537 розкриті послідовності (заявка '537), що відповідають TRPV3 людини, миші та Drosophila. Наприклад, SEQ ID №№ 106 і 107 заявки '537 відповідають послідовностям нуклеїнових кислот і амінокислот людини, відповідно. SEQ ID №№ 108 і 109 заявки ‘537 відповідають послідовностям нуклеїнових кислот і амінокислот миші, відповідно. Функція TRPV3 в основному залучена до прийому і трансдукції больового сигналу. Відповідно, було б бажано ідентифікувати та одержувати сполуки, які можуть модулювати одну або більше функцій TRPV3. У WO 2007/056124, WO 2008/140750 та WO 2008/033564 розкриті модулятори TRPV3, зокрема, антагоністи, для лікування різноманітних захворювань, опосередкованих TRPV3. Незважаючи на зусилля з розробки більш досконалих болезаспокійливих засобів, все ще існує потреба в терапевтичному лікуванні захворювань, станів та/або розладів, модульованих TRPV3. КОРОТКИЙ ОПИС ВИНАХОДУ Дана патентна заявка стосується сполук формули (I): 1 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 55 60 (I) де пунктирна (….) лінія позначає необов’язковий зв’язок; A являє собою заміщену або незаміщену циклоалкільну, арильну, гетероарильну або гетероциклічну групу; 1 1 Y являє собою -(CHR ), де R являє собою водень, галоген, заміщений або незаміщений алкіл; 2 X являє собою водень, нітро, ціано, галоген, заміщений або незаміщений алкіл, -OR , 3 4 3 3 3 4 3 4 3 NR R , -C(O)-R , -C(O)O-R , -C(O)NR R , -S(O)pNR R , або -S(O)pR ; 3 4 R та R , які можуть бути однаковими або різними, в кожному випадку незалежно вибрані з 2 водню, -OR , заміщеного або незаміщеного алкілу, алкенілу, циклоалкілу, циклоалкілалкілу, циклоалкенілу, арилу, арилалкілу, гетероарилу, гетероарилалкілу, гетероциклічної групи або гетероциклілалкілу; 2 R в кожному випадку незалежно вибраний з групи, що складається з водню, заміщеного або незаміщеного алкілу, алкенілу, циклоалкілу, арилу, гетероарилу, гетероциклічної групи, циклоалкілалкілу, арилалкілу, гетероарилалкілу або гетероциклілалкілу; «m» дорівнює цілому числу від 0 до 2, обидва значення включені; «n» дорівнює цілому числу від 0 до 2, обидва значення включені; «p» дорівнює цілому числу від 0 до 2, обидва значення включені; та «r» дорівнює цілому числу від 0 до 2, обидва значення включені. Слід розуміти, що формула (I) структурно охоплює всі стереоізомери, енантіомери та діастереомери і фармацевтично прийнятні солі, які можуть бути передбачені на базі хімічної структури описаного в даному описі класу. У відповідності до одного з варіантів, конкретно запропоновані сполуки формули (I), де «A» являє собою заміщений або незаміщений арил. В даному варіанті, «A» переважно являє собою заміщений або незаміщений феніл або нафтил, де замісник(и) незалежно вибрані з галогену (наприклад, фтору або хлору), алкокси (наприклад, метокси), або циклоалкокси (наприклад, циклопентилокси). У відповідності до іншого варіанту, конкретно запропоновані сполуки формули (I), де «A» являє собою заміщений або незаміщений гетероарил. В даному варіанті, «A» переважно являє собою заміщений або незаміщений тіазол, бензотіазол, хінолін або дибензо[b,d]фуран, де замісник(и) незалежно вибрані з галогену, алкілу (наприклад, метилу), алкокси (наприклад, метокси), циклоалкокси або галогенфенілу (наприклад, бромфенілу). У відповідності до іншого варіанту, конкретно запропоновані сполуки формули (I), де «Y» являє собою CH2, CH(CH3) або зв’язок. У відповідності до іншого варіанту, конкретно запропоновані сполуки формули (I), де пунктирна лінія (….) позначає одинарний зв’язок або відсутність зв’язку. У відповідності до іншого варіанту, конкретно запропоновані сполуки формули (I), де X являє собою галоген (наприклад, фтор або хлор) або алкокси (наприклад, метокси); та «m» дорівнює 1. У відповідності до іншого варіанту, конкретно запропоновані сполуки формули (I), де «n» являє собою 1. Нижче наведені характерні сполуки, які показані тільки з метою ілюстрації і не призначені для обмеження контексту винаходу: 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-(2-метоксифеніл)ацетамід, 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-(2-циклопентилокси-3метоксибензил)ацетамід, 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-1-(4метоксинафтилметил)ацетамід, 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-[(4-метоксидибензо[b,d]фуран-1іл)метил]ацетамід, 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-[(1S)-1-фенілетил]ацетамід, (2E)-2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іліден)-N-[2(циклопентилокси)феніл]ацетамід, N-(2-циклопентилоксифеніл)-2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4іл)ацетамід, N-(2,6-дифторбензил)~2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)ацетамід, 2-(6-фтор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-хінолін-6-ілацетамід, N-[4-(4-бромфеніл)-1,3-тіазол-2-іл]-2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4іл)ацетамід, 2-(6-метокси-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-1-нафтилацетамід, 2-(6-метокси-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-1,3-тіазол-2-ілацетамід та 2 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-(6-метокси-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-(6-метил-1,3-бензотіазол-2іл)ацетамід, або аналог, таутомер, регіомер, геометричні ізомери, стереоізомер, енантіомер, діастереомер або фармацевтично прийнятна сіль сполук 1–13, які також включені. У відповідності до іншого варіанту, конкретно запропоновані сполуки Формули I або їх солі, які інгібують функцію TRPV3 із значенням IC50 менше 10 000 нМ. В інших варіантах конкретно запропоновані сполуки Формули I або їх солі, які інгібують функцію TRPV3 із значенням IC50 менше 1000 нМ. Також запропоновані способи одержання сполук, описаних в даному винаході. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ В даній патентній заявці пропонуються похідні хроману, які можуть застосовуватися як модулятори TRPV3, і способи синтезу вказаних сполук. Також запропоновані фармацевтично прийнятні солі, енантіомери, діастереомери вказаних сполук, які можуть володіти таким же видом активності. Додатково запропоновані фармацевтичні композиції, що містять описані сполуки разом з фармацевтично прийнятними носіями, допоміжними речовинами або розбавлювачами, які можуть застосовуватися для лікування захворювань, станів та/або розладів, опосередкованих TRPV3. Винахід визначений формулою винаходу та не обмежується наведеним нижче описом. Терміни, які застосовуються в доданій формулі винаходу, визначені в розділі глосарію нижче, за умови, що терміни у формулі винаходу можуть застосовуватися в іншому значенні, якщо це вказано у фразі. Терміни “гало” або “галоген” включають фтор, хлор, бром або йод Термін “алкіл” позначає вуглеводневий радикал з нерозгалуженим або розгалуженим ланцюгом, що складається виключно з атомів вуглецю і атомів водню, не містить кратних зв’язків, містить від 1 до 8 атомів вуглецю, що приєднаний до решти молекули одинарним зв'язком, наприклад, метил, етил, н-пропіл, 1-метилетил (ізопропіл), н-бутил, н-пентил та 1,1диметилетил (трет-бутил). Термін “C1-6 алкіл” позначає алкільний ланцюг, що містить від 1 до 6 атомів вуглецю. Якщо не вказано інше, всі алкільні групи, описані або заявлені в даному винаході, можуть бути лінійними або розгалуженими, заміщеними або незаміщеними. Термін “алкеніл” позначає вуглеводневий ланцюг, що містить від 2 до 10 атомів вуглецю, в тому числі щонайменше один вуглець-вуглецевий подвійний зв'язок. Необмежуючі приклади алкенільних груп включають етеніл, 1-пропеніл, 2-пропеніл (аліл), ізо-пропеніл, 2-метил-1пропеніл, 1-бутеніл і 2-бутеніл. Якщо не вказано інше, всі алкенільні групи, описані або заявлені в даному винаході, можуть бути лінійними або розгалуженими, заміщеними або незаміщеними. Термін “алкініл” позначає вуглеводневий радикал , що містить як мінімум один потрійний вуглець-вуглецевий зв'язок, і містить від 2 до приблизно 12 атомів вуглецю (переважними є радикали, що містять від 2 до приблизно 10 атомів вуглецю). Необмежуючі приклади алкінільних груп включають етиніл, пропініл та бутиніл. Якщо не вказано інше, всі алкінільні групи, описані або заявлені в даному винаході, можуть бути лінійними або розгалуженими, заміщеними або незаміщеними. Термін “алкокси” позначає алкільну групу, приєднану через кисневий мостик до решти молекули. Характерними прикладами таких груп є -OCH3 і -OC2H5. Якщо не вказано інше, всі алкоксильні групи, описані або заявлені в даному винаході, можуть бути лінійними або розгалуженими, заміщеними або незаміщеними. Термін “циклоалкіл” позначає неароматичну моно- або поліциклічну систему кілець, що містить від 3 до приблизно 12 атомів вуглецю, наприклад, циклопропіл, циклобутил, циклопентил і циклогексил. Приклади поліциклічних циклоалкільних груп включають, не обмежуючись ними, пергідронафтильну, адамантильну і норборнільну групи, сполучені мостом циклічні групи або спіробіциклічні групи, наприклад, спіро (4,4)нон-2-іл. Якщо не вказано інше, всі циклоалкільні групи, описані або заявлені в даному винаході, можуть бути заміщеними або незаміщеними. Термін “циклоалкілалкіл” позначає циклічний радикал, що містить кільце та від 3 до приблизно 8 атомів вуглецю, безпосередньо приєднаних до алкільної групи. Циклоалкілалкільна група може бути приєднана до основної структури при будь-якому атомі вуглецю в алкільній групі, що приводить до утворення стабільної структури. Необмежуючі приклади таких груп включають циклопропілметил, циклобутилетил і циклопентилетил. Якщо не вказано інше, всі циклоалкілалкільні групи, описані або заявлені в даному винаході, можуть бути заміщеними або незаміщеними. Термін “циклоалкеніл” позначає циклічний радикал, що містить кільце та від 3 до приблизно 8 атомів вуглецю, що містить як мінімум один вуглець-вуглецевий подвійний зв'язок, наприклад, 3 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 55 60 циклопропеніл, циклобутеніл і циклопентеніл. Якщо не вказано інше, всі циклоалкенільні групи, описані або заявлені в даному винаході, можуть бути заміщеними або незаміщеними. Термін “арил” позначає ароматичний радикал, що містить 6–14 атомів вуглецю, в тому числі моноциклічні, біциклічні і трициклічні ароматичні системи, такі як феніл, нафтил, тетрагідронафтил, інданіл і біфеніл. Якщо не вказано інше, всі арильні групи, описані або заявлені в даному винаході, можуть бути заміщеними або незаміщеними. Термін “арилалкіл” позначає арильну групу, як визначено вище, безпосередньо приєднану до алкільної групи як визначено вище, наприклад, -CH2C6H5 та -C2H4C6H5. Термін “гетероцикліл” та “гетероциклічне кільце”, “гетероциклічна група” позначає стабільний радикал 3–15-членного кільця, що складається з атомів вуглецю та з 1–5 гетероатомів, вибраних з азоту, фосфору, кисню і сірки. Для цілей даного винаходу, радикал гетероциклічного кільця може бути моноциклічною, біциклічною або трициклічною системою кілець, яка може включати системи конденсованих, з’єднаних містком або спірокілець, і атоми азоту, фосфору, вуглецю, кисню або сірки в радикалі гетероциклічного кільця можуть бути необов’язково окиснені до різних ступенів окиснення. Крім того, атом азоту необов’язково може бути кватернізованим; і радикал кільця може бути частково або повністю насиченим (тобто, гетероциклічний або гетероарильний). Приклади таких радикалів гетероциклічного кільця включають, не обмежуючись ними, азетидиніл, aкридиніл, бензодіоксоліл, бензодіоксаніл, бензофураніл, карбазоліл, цинолініл, діоксоланіл, індолізиніл, нафтиридиніл, пергідроазепініл, феназиніл, фенoтіазиніл, феноксазиніл, фталазиніл, піридил, птеридиніл, пуриніл, хіназолініл, хіноксалініл, хінолініл, ізохінолініл, тетразоліл, імідазоліл, тетрагідроізохінолініл, піперидиніл, піперазиніл, 2-оксопіперазиніл, 2-оксопіперидиніл, 2-оксопіролідиніл, 2-оксоазепініл, азепініл, піроліл, 4-піперидоніл, піролідиніл, піразиніл, піримідиніл, піридазиніл, оксазоліл, оксазолініл, оксазолідиніл, триазоліл, інданіл, ізоксазоліл, ізоксазолідиніл, морфолініл, тіазоліл, тіазолініл, тіазолідиніл, ізотіазоліл, хінуклідиніл, ізотіазолідиніл, індоліл, ізоіндоліл, індолініл, ізоіндолініл, октагідроіндоліл, октагідроізоіндоліл, хіноліл, ізохіноліл, декагідроізохіноліл, бензімідазоліл, тіадіазоліл, бензопіраніл, бензотіазоліл, бензоксазоліл, фурил, тетрагідрофураніл, тетрагідропіраніл, тієніл, бензотієніл, тіаморфолініл, тіаморфолініл сульфоксид, тіаморфолініл сульфон, діоксафосфоланіл, оксадіазоліл, хроманіл та ізохроманіл. Радикал гетероциклічного кільця може бути приєднаний до основної структури при будь-якому гетероатомі або атомі вуглецю, що приводить до утворення стабільної структури. Якщо не вказано інше, всі гетероциклічні групи, описані або заявлені в даному винаході, можуть бути заміщеними або незаміщеними, в тому числі ті з них, які включені в більш складні підструктури. Термін “гетероциклілалкіл” позначає радикал гетероциклічного кільця, безпосередньо приєднаний до алкільної групи. Гетероциклілалкільний радикал може бути приєднаний до основної структури при будь-якому атомі вуглецю алкільної групи, що приводить до утворення стабільної структури. Термін “гетероарил” позначає радикал ароматичного гетероциклічного кільця. Радикал гетероарильного кільця може бути приєднаний до основної структури при будь-якому гетероатомі або атомі вуглецю, що приводить до утворення стабільної структури. Якщо не вказано інше, всі гетероарильні групи, описані або заявлені в даному винаході, можуть бути заміщеними або незаміщеними, в тому числі ті з них, які включені в більш складні підструктури. Термін “гетероарилалкіл” позначає радикал гетероарильного кільця, безпосередньо приєднаний до алкільної групи. Гетероарилалкільний радикал може бути приєднаний до основної структури при будь-якому атомі вуглецю алкільної групи, що приводить до утворення стабільної структури. Якщо не вказано інше, термін “заміщений” в даному описі позначає групу або фрагмент, що містить один або більше замісників, приєднаних до структурного скелету групи або фрагменту, що включають, не обмежуючись ними, гідрокси, галоген, карбоксил, ціано, нітро, оксо (=O), тіо (=S), заміщений або незаміщений алкіл, заміщений або незаміщений алкокси, заміщений або незаміщений алкеніл, заміщений або незаміщений алкініл, заміщений або незаміщений арил, заміщений або незаміщений арилалкіл, заміщений або незаміщений циклоалкіл, заміщений або незаміщений циклоалкенілалкіл, заміщений або незаміщений циклоалкеніл, заміщений або незаміщений аміно, заміщений або незаміщений арил, заміщений або незаміщений гетероарил, заміщене або незаміщене гетероциклілалкільне кільце, заміщений або незаміщений гетероарилалкіл, заміщене або незаміщене гетероциклічне кільце, заміщений або незаміщений x x x x y x y x y z x y гуанідин, -COOR , -C(O)R , -C(S)R , -C(O)NR R , -C(O)ONR R , -NR CONR R , -N(R )SOR , x y x y x y x y x y x y x y z -N(R )SO2R , -(=N-N(R )R ), -NR C(O)OR , -NR R , -NR C(O)R , -NR C(S)R , -NR C(S)NR R , x y x y x x y z x y x x y -SONR R , -SO2NR R , -OR , -OR C(O)NR R , -OR C(O)OR , -OC(O)R , -OC(O)NR R , x y z x y x y x y z x y x y x x x -R NR C(O)R , -R OR , -R C(O)OR , -R C(O)NR R , -R C(O)R , -R OC(O)R , -SR , -SOR , -SO2R та 4 UA 104861 C2 x 5 10 15 20 25 30 35 40 45 50 55 y z -ONO2, де R , R та R незалежно вибрані з водню, заміщеного або незаміщеного алкілу, заміщеного або незаміщеного алкокси, заміщеного або незаміщеного алкенілу, заміщеного або незаміщеного алкінілу, заміщеного або незаміщеного арилу, заміщеного або незаміщеного арилалкілу, заміщеного або незаміщеного циклоалкілу, заміщеного або незаміщеного циклоалкенілу, заміщеного або незаміщеного аміно, заміщеного або незаміщеного арилу, заміщеного або незаміщеного гетероарилу, заміщеного гетероциклілалкільного кільця, заміщеного або незаміщеного гетероарилалкілу або заміщеного або незаміщеного гетероциклічного кільця. Термін “лікування” або “терапія” стану або розладу включає: (а) профілактику або затримку появи клінічних симптомів стану або розладу, що розвивається у суб’єкта, який може страждати на або бути схильним до стану або розладу, але ще не зазнає або не виявляє клінічних або субклінічних симптомів стану або розладу; (б) гальмування стану або розладу, тобто, зупинка або уповільнення розвитку захворювання або як мінімум одного його клінічного або субклінічного симптому; або (в) полегшення захворювання, тобто, регресу стану або розладу або як мінімум одного з його клінічних або субклінічних симптомів. Термін “суб’єкт” включає ссавців (особливо людину) та інших тварин, таких як домашні тварини (наприклад, домашні тварини, в тому числі коти і собаки) і не домашні тварини (наприклад, дикі тварини). “Терапевтично ефективна кількість” позначає кількість сполуки, яка при введенні суб’єкту для лікування стану або розладу є достатньою для здійснення такого лікування. “Терапевтично ефективна кількість” буде варіювати в залежності від сполуки, захворювання і його тяжкості, а також віку, маси, фізичного стану і чутливості суб’єкта, який підлягає лікуванню. Сполука, описана в даній патентній заявці, може утворювати солі. Необмежуючі приклади фармацевтично прийнятних солей, що є частиною цієї патентної заявки, включають солі неорганічних основ, солі органічних основ, солі хіральних основ, солі природних амінокислот і солі неприродних амінокислот. Щодо всіх сполук, описаних Формулою (I), дана патентна заявка охоплює вказані стереоізомерні форми та їх суміші. До тієї міри, в якій рівень техніки містить вказівки щодо синтезу або розділення конкретних стереоізомерів, різні стереоізомерні форми в даній патентній заявці можуть бути розділені за способом, відомим з рівня техніки, або даний ізомер може бути одержаний стереоспецифічним або асиметричним синтезом. Таутомерні форми і суміші сполук, описаних в даному описі, також включені. ФАРМАЦЕВТИЧНІ КОМПОЗИЦІЇ Фармацевтична композиція, запропонована в даному винаході, містить як мінімум одну сполуку, описану в даному описі, і як мінімум одну фармацевтично прийнятну допоміжну речовину (наприклад, фармацевтично прийнятний носій або розбавлювач). Переважно, включені фармацевтичні композиції містять сполуку(и), описану в даному описі, в кількості, достатній для інгібування рецептора TRPV3 у суб’єкта. Передбачені суб’єкти включають, наприклад, живу клітину і ссавця, в тому числі людину. Сполука за даним винаходом може бути сполучена з фармацевтично прийнятною допоміжною речовиною (наприклад, носій або розбавлювач) або може бути розбавлена носієм або вміщена в межі носія, який може набувати форми капсули, саше, паперової або іншої ємності. Приклади придатних носіїв включають, не обмежуючись ними, воду, сольові розчини, спирти, поліетиленгліколі, полігідроксиетоксильовану рицинову олію, арахісову олію, оливкову олію, желатин, лактозу, білу землю, сахарозу, декстрин, магнію карбонат, цукор, циклодекстрин, амілозу, магнію стеарат, тальк, желатин, агар, пектин, акацієву камедь, стеаринову кислоту або ефіри нижчих алкілів і целюлози, кремнієву кислоту, жирні кислоти, аміни жирних кислот, моногліцериди і дигліцериди жирних кислот, естери пентаеритритолу і жирних кислот, поліоксиетилен, гідроксиметилцелюлозу і полівінілпіролідон. Носій або розбавлювач може включати матеріал для контрольованого вивільнення, наприклад гліцерилмоностеарат або гліцерилдистеарат, окремо або в суміші з воском. Фармацевтична композиція також може містити один або більше фармацевтично прийнятних допоміжних засобів, зволожувальних засобів, емульгуючих засобів, суспендувальних засобів, консервантів, солей для регуляції осмотичного тиску, буферних речовин, підсолоджувачів, ароматизаторів, барвників або будь-які їх комбінації. Фармацевтична композиція за винаходом може набувати такої форми, щоб забезпечити швидке, контрольоване або затримане вивільнення активного інгредієнта після введення суб’єкту, із застосуванням способів, відомих з рівня техніки. 5 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтичні композиції, описані в даному описі, можуть бути одержані традиційними методами, відомими з рівня техніки. Наприклад, активна сполука може бути змішана з носієм або розбавлена носієм, або вміщена в межі носія, який може набувати форми ампули, капсули, саше, паперової або іншої ємності. Якщо носій служить розбавлювачем, він може бути твердим, напівтвердим, або рідким матеріалом, який діє, як носій, допоміжна речовина або середовище для активної сполуки. Активна сполука може бути адсорбована на гранульованій твердій ємності, наприклад, в саше. Фармацевтичні композиції можуть набувати традиційних форм, наприклад, капсули, таблетки, аерозолі, розчини, суспензії або продукти для місцевого застосування. Спосіб введення може бути будь-яким способом, який ефективно доставляє активну сполуку за винаходом до придатного або цільового місця дії. Придатні способи введення включають, не обмежуючись ними, пероральний, назальний, легеневий, букальний, підшкірний, внутрішньошкірний, трансдермальний, парентеральний, ректальний, депо, підшкірний, внутрішньовенний, інтрауретральний, внутрішньом'язовий, інтраназальний, очний (наприклад, за допомогою очного розчину) або місцевий (наприклад, за допомогою мазі для місцевого застосування). Тверді рецептури для перорального застосування включають, не обмежуючись ними, таблетки, капсули (м'які або тверді желатинові), драже (містять активний інгредієнт у формі порошку або гранул), пігулки і пастилки. Таблетки, драже або капсули, що містять тальк та/або вуглеводний носій або зв'язувальний засіб і т. п., є особливо придатними для перорального застосування. Рідкі препарати включають, не обмежуючись ними, сиропи, емульсії, м'який желатин і стерильні ін'єкційні рідини, такі як водні або безводні рідкі суспензії або розчини. Для парентерального застосування особливо придатними є ін'єкційні розчини або суспензії. Переважно, водні розчини з активною сполукою, розчиненою в полігідроксильованій рициновій олії. Придатні дози сполук для застосування в лікуванні захворювань та розладів, описаних в даному винаході, можуть бути визначені кваліфікованими фахівцями в даній галузі. Терапевтичні дози загалом ідентифікують в ході дослідження з визначення інтервалу доз за участю людей, яке базується на попередніх фактах, одержаних в результаті досліджень на тваринах. Дози повинні бути достатніми для забезпечення цільового терапевтичного ефекту без небажаних побічних ефектів. Наприклад, добові дози модулятора TRPV3 можуть варіювати від приблизно 0,1 до приблизно 30,0 мг/кг. Спосіб введення, лікарські форми, придатні фармацевтичні допоміжні речовини, розбавлювачі або носії також можуть бути застосовані та адаптовані кваліфікованими фахівцями. Всі зміни та модифікації знаходяться в межах даного винаходу. СПОСОБИ ЛІКУВАННЯ В даному винаході пропонуються сполуки та їх фармацевтичні препарати, що є придатними для лікування захворювань, станів та/або розладів, модульованих TRPV3. В даній патентній заявці додатково пропонується спосіб лікування захворювання, стану та/або розладу, модульованого TRPV3, у суб’єкта, що потребує такого лікування, шляхом введення суб’єкту терапевтично ефективної кількості сполуки або фармацевтичної композиції за даним винаходом. Вважається, що захворювання, стани та/або розлади, які модулюються TRPV3, включають, не обмежуючись ними, мігрень, артралгію, серцевий біль внаслідок ішемії міокарду, гострий біль, хронічний біль, невропатичний біль, післяопераційний біль, біль внаслідок невралгії (наприклад, постгерпетична невралгія або невралгія трійчастого нерва), біль внаслідок діабетичної невропатії, зубний біль і біль при онкологічних захворюваннях, болісні запальні стани (наприклад, артрит і остеоартрит), артралгію, невропатію, нейродегенерацію, ретинопатію, невротичний розлад шкіри, інсульт, гіперчутливість сечового міхура, нетримання сечі, вульводинію, шлунково-кишкові розлади, наприклад, синдром подразненого кишечнику, гастроезофагеальна рефлюксна хвороба, ентерит, ілеїт, виразка шлунку і 12-палої кишки, запальне захворювання кишечнику, хвороба Крона, глютен-чутлива ентеропатія, запальні захворювання, такі як панкреатит, розлад дихальних шляхів, такий як алергічний та неалергічний риніт, астма або хронічне обструктивне захворювання легень, подразнення шкіри, ока або слизової оболонки, дерматит, стани, що супроводжуються свербежем, такі як уремічний свербіж, гарячковий стан, спазми м’язів, блювання, дискінезії, депресії, хворобу Хантінгтона, погіршення пам’яті, обмеження функції мозку, аміотрофний латеральний склероз (АЛС), деменцію, артрит, остеоартрит, діабет, ожиріння, кропивницю, актинічний кератоз, кератоксантому, алопецію, хворобу Меньє, дзвін у вухах, гіперакузію, тривожні розлади і доброякісну гіперплазію передміхурової залози. 6 UA 104861 C2 5 10 15 20 25 30 35 40 Додаткові захворювання, стани та/або розлади, модульовані TRPV3, проілюстровані, наприклад, у WO2007/056124; Wissenbach, U. et al, Biology of the cell (2004), 96, 47-54; Nilius, B. et al., Physiol Rev (2007), 87, 165-217; Okuhara, D. Y. et al, Expert Opinion on Therapeutic Targets (2007), 11, 391-401; Hu, H. Z. et al, Journal of Cellular Physiology, (2006), 208, 201-212 і процитованих у даних джерелах посиланнях, всі з яких включені до даного опису шляхом посилання у всій їх повноті і для заявленої мети. ЗАГАЛЬНІ СПОСОБИ ОДЕРЖАННЯ Сполуки, описані в даному описі, в тому числі сполуки загальної формули (I) і сполуки за конкретними прикладами, одержують з використанням способів, відомих середньому фахівцю з рівня техніки. Сполуки, описані в даному описі, одержують, використовуючи послідовність реакцій, зображену на Схемі 1. Всі можливі стереоізомери також знаходяться в межах даного винаходу. Початкові матеріали для наведених нижче схем реакцій є комерційно доступними або можуть бути одержані у відповідності до способів, відомих фахівцю в даній галузі, або за способами, розкритими в даному описі. Загалом, сполуки за даним винаходом, можуть бути одержані у відповідності до схеми реакції, як вказано нижче, де всі позначення є такими, як визначено вище. Сполуки формули (I) можуть бути одержані у відповідності до Схеми синтезу 1. Таким чином, 2-гідроксиацетофенон формули (1) конденсують з циклічним кетоном формули (2) в присутності основи, такої як піролідин або піперидин, в спиртових розчинниках, з одержанням спіроциклічного кетону формули (3), який при реакції з триалкілфосфоноацетатом формули (4) в умовах реакції Віттіга, де R являє собою алкіл, дає акриловий естер формули (5), де R являє собою алкіл. Гідрoліз сполуки формули (5) з наступною каталітичною гідрогенацією (необов’язкова) дає сполуку формули (6). Сполуки загальної формули (I) одержують сполученням карбонової кислоти формули (6) з відповідним аміном формули (7) в присутності придатного агенту сполучення. Альтернативно, хлорангідрид кислоти проміжної сполуки (6) може бути сполученим з аміном формули (7) в присутності придатної основи з одержанням сполуки загальної формули (I). Схема 1 ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Даний винахід додатково проілюстрований наступними прикладами, які не повинні інтерпретуватися як будь-яким чином обмежуючі даний винахід, але призначені тільки для ілюстрації. Таким чином, кваліфікованому фахівцю буде зрозуміло, які експерименти і приклади можуть бути додатково впроваджені шляхом модифікації наступних прикладів, замісників, реагентів або умов. ПРОМПКНІ СПОЛУКИ Проміжна сполука 1 (6-Хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)оцтова кислота: Стадія 1: 6-Хлорспіро[хромен-2,1'-циклобутан]-4(3H)-он: При перемішуванні до розчину 5'хлор-2'-гідрокси ацетофенону (5,0 г, 29,308 ммоль) в метанолі (50 мл) додають піролідин (4,16 г, 58,616 ммоль) з наступним додаванням циклобутанону (4,1 г, 58,616 ммоль) при кімнатній температурі. Реакційну суміш кип’ятять із зворотним холодильником в атмосфері азоту протягом 14 год. Розчинник випарюють при зниженому тиску і отриманий залишок розбавляють 7 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 55 водою (100 мл) і суміш підкислюють до pH 4,0. Суміш екстрагують хлороформом (3 x 100 мл). Об’єднані органічні екстракти промивають водою (100 мл), сольовим розчином (50 мл) та сушать над безводним натрію сульфатом. Залишок, одержаний після випарювання розчинника, очищують хроматографією на колонці з силікагелем з використанням 15 % етилацетату в 1 петролейному ефірі з одержанням 6,3 г продукту у вигляді білої твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,69-1,88 (м, 5H), 1,96-2,04 (м, 1H), 2,88 (с, 2H), 6,91 (д, J = 9,0 Гц, 1H), 7,38 (д, J = 6,6 Гц, 1H), 7,76 (с, 1H). Стадія 2: Етил-(2E)-(6-хлорспіро[хромен-2,1'-циклобутан]-4(3H)-іліден)ацетат: триетилфосфоноацетат (4,03 г, 17,897 ммоль) додають протягом 15 хв при перемішуванні та охолодженні до суміші натрію гідриду (431 мг, 17,897 ммоль) в безводному тетрагідрофурані (25 мл). Реакційну суміш перемішують протягом 30 хв і потім додають 6-хлорспіро[хромен-2,1'циклобутан]-4(3H)-он (2 г, 8,948 ммоль) в безводному тетрагідрофурані. Реакційну суміш перемішують при тій же температурі в атмосфері азоту протягом 24 год. Реакційну суміш розбавляють метанолом та водою, та продукт екстрагують у етилацетат (3 x 100 мл). Органічну фракцію промивають водою (100 мл), сольовим розчином, сушать (Na 2SO4) та упарюють з одержанням 3,54 г неочищенного продукту, який використовують на наступній стадії без подальшого очищення. Стадія 3: (2E)-(6-Хлорспіро[хромен-2,1'-циклобутан]-4(3H)-іліден)оцтова кислота: При перемішуванні до розчину етил (2E)-(6-хлорспіро[хромен-2,1'-циклобутан]-4(3H)-іліден)ацетату (3 г, 10,22 ммоль) в етанолі (30 мл) додають I н розчин натрію гідроксиду (30 мл) при кімнатній температурі. Реакційну суміш перемішують при кімнатній температурі протягом 2 год. Отриманий залишок після випарювання розчинника при зниженому тиску підкислюють 1 н HCl. Цільовий продукт екстрагують у етилацетат (3 x 50 мл), промивають водою (100 мл), сольовим розчином, сушать (Na2SO4) та упарюють з одержанням 2,6 г продукту у вигляді білої твердої 1 речовини; H ЯМР (300 МГц, CDCl3) δ 1,68-1,78 (м, 5H), 1,86-1,96 (м, 1H), 3,96 (с, 2H), 6,36 (с, 1H), 6,80 (д, J = 8,1 Гц, 1H), 7,22 (д, J = 9,3 Гц, 1H), 7,51 (с, 1H). Стадія 4: (6-Хлор-3,4-дигідроспіро[хромен-2,l'-циклобутан]-4-іл)оцтова кислота: При перемішуванні до розчину (2E)-(6-хлорспіро[хромен-2,l'-циклобутан]-4(3H)-іліден)оцтової кислоти (2,5 г, 9,444 ммоль) в етилацетаті (25 мл) додають 10 % Pd/C (50 мг) при кімнатній 2 температурі. Реакційну суміш перемішують протягом 12 год при тиску водню 40 фунт/дюйм в апараті Парра для гідрогенізації. Реакційну суміш фільтрують крізь шар броунмілериту, фільтрат сушать (Na2SO4) та упарюють з одержанням 2,45 г продукту у вигляді білої твердої 1 речовини; H ЯМР (300 МГц, CDCl3) δ 1,68-1,78 (м, 5H), 1,86-1,96 (м, 1H), 2,09-2,21 (м, 2H), 2,292,38 (м, 1H), 2,99 (д, J = 13,2 Гц, 1H), 3,44 (ш с, 1H), 6,73 (д, J = 8,1 Гц, 1H), 7,04 (д, J = 9,3 Гц, 1H). Проміжна сполука 2 6-Фтор-3,4-дигідроспіро[хромен-2,1' -циклобутан]-4-іл)оцтова кислота: Названу в заголовку сполуку одержують в 4 стадії з 5'-фтор-2'-гідроксиацетофенону та циклобутанону за методикою, подібною описаній в Проміжній сполуці 1, з одержанням білої 1 твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,66-1,74 (м, 2H), 1,88-1,95 (м, 1H), 2,05-2,14 (м, 3H), 2,26-2,34 (м, 1H), 2,37-2,44 (м, 1H), 2,48-2,56 (м, 1H), 2,96 (дд, J = 4,2, 15,6 Гц, 1H), 3,35 (ш с, 1H), 6,74-6,82 (м, 3H). Проміжна сполука 3 (6-Mетокси-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)оцтова кислота: Стадія 1: 6-Гідроксиспіро[хромен-2,1'-циклобутан]-4-(3H)-он: Названу в заголовку сполуку одержують з 2',5'-дигідроксиацетофенону (10 г, 65,724 ммоль).та циклобутанону (13,29 мл, 131,44 ммоль) в присутності піролідину (10,79 мл) за методикою, подібною описаній на Стадії 1 1 Проміжної сполуки 1, з одержанням 10 г продукту; H ЯМР (300 МГц, CDCl3) δ 1,63-1,73 (м, 2H), 1,84-1,95 (м, 2H), 2,05-2,15 (м, 2H), 2,23-2,33 (м, 2H), 6,85 (д, J = 8,7 Гц, 1H), 7,06 (д, J = 9,0 Гц, 1H), 7,33 (с, 1H). Стадія 2: 6-Mетоксиспіро[хромен-2,1'-циклобутан]-4(3H)-он: При перемішуванні до розчину 6-гідроксиспіро[хромен –2,1'-циклобутан]-4-(3H)-ону (8 г, 39,215 ммоль) в сухому диметилформаміді (150 мл) додають калію карбонат (16,28 г, 117,64 ммоль) та метилйодид (4,88 мл, 78,431 ммоль) і реакційну суміш перемішують при кімнатній температурі в атмосфері азоту протягом 2 год. Після завершення реакції, реакційну суміш розбавляють водою (100 мл), екстрагують етилацетатом (3 x 300 мл), об’єднані органічні фракції промивають водою (3 x 100 мл), сольовим розчином (60 мл), сушать (Na 2SO4), фільтрують та упарюють з одержанням 8,13 г 1 продукту; H ЯМР (300 МГц, CDCl3) δ 1,67-1,77 (м, 1H), 1,85-1,97 (м, 1H), 2,11-2,18 (м, 2H), 2,232,34 (м, 2H), 2,87 (с, 2H), 3,77 (с, 3H), 6,88 (д, J = 9,6 Гц, 1H), 7,06 (д, J = 8,7 Гц, 1H), 7,25 (с, 1H). 8 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія 3: Кінцеву сполуку одержують з 6-метоксиспіро[хромен-2,1'-циклобутан]-4(3H)-ону за 1 методикою, подібною до описаної в Стадіях 2–4 Проміжної сполуки 1 ; H ЯМР (300 МГц, ДМСОd6) δ 1,53-1,65 (м, 2H), 1,78 (ш с, 1H), 1,96-2,05 (м, 3H), 2,18-2,23 (м, 2H), 2,30-2,39 (м, 1H), 2,93 (д, J = 15,9 Гц, 1H), 3,18 (ш с, 1H), 3,64 (с, 3H), 6,64 (с, 2H), 6,75 (с, 1H). Проміжна сполука 4 1-[2-(Циклопентилокси)-3-метоксифеніл]метиламіну гідрохлорид: Стадія 1: 2-(Циклопентилокси)-3-метоксибензальдегіду оксим: При перемішуванні до розчину 2-(циклопентилокси)-3-метоксибензaльдегіду (3 г, 13,636 ммоль) в етанолі додають гідроксиламіну гідрохлорид (1,758 г, 27,277 ммоль) та водний розчин натрію гідроксиду (18 мл, 34,091 ммоль). Реакційну суміш кип’ятять із зворотним холодильником протягом 6 год в атмосфері азоту. Розчинник випарюють при зниженому тиску і реакційну суміш розбавляють водою. Продукт екстрагують з використанням хлороформу (3x200 мл), об’єднані органічні фракції промивають водою (3x100 мл), сольовим розчином (50 мл), сушать (Na 2SO4), 1 фільтрують та упарюють під вакуумом з одержанням 3,12 г продукту. H ЯМР (300 МГц, CDCl3) δ 1,58-1,64 (м, 4H), 1,66-1,72 (м, 4H), 3,84 (с, 3H), 4,86 (ш с, 1H), 6,89 (д, J = 8,1 Гц, 1H), 6,99 (т, J = 7,8 Гц, 1H), 7,31 (д, J = 7,8 Гц, 1H), 8,43 (с, 1H). Стадія 2: 1-[2-(циклопентилокси)-3-метоксифеніл]метанаміну гідрохлорид: При перемішуванні до розчину 2-(циклопентилокси)-3-метоксибензaльдегіду оксиму (3 г, 12,448 ммоль) в метанолі (10 мл) додають каталітичну кількість нікелю Ренея (0,30 г) при кімнатній 2 температурі. Реакційну суміш перемішують протягом 3 год при тиску водню 50 фунт/дюйм в апараті Парра для гідрогенізації. Реакційну суміш фільтрують крізь шар броунмілериту, сушать (Na2SO4), фільтрують та упарюють з одержанням неочищеного продукту. Сирий продукт далі розчиняють в етилацетаті, і додають по краплях хлористоводневу кислоту в етилацетаті при 10 C та перемішують протягом 20 хв і потім фільтрують та сушать з одержанням 2,86 г продукту, 1 H ЯМР (300 МГц, ДМСО-d6) δ 1,57-1,63 (м, 4H), 1,65- 1,72 (м, 4H), 3,81 (с, 3H), 3,94 (с, 2H), 4,90 (ш с, 1H), 7,08 (с, 3H), 8,39 (ш с, 3H). Проміжна сполука 5 1-(4-Метокси-1-нафтил)метиламіну гідрохлорид: Названу в заголовку сполуку одержують в 2 Стадії з 4-метокси-1-нафтальдегіду (1 г, 5,376 ммоль) за методикою, подібною описаній в Проміжній сполуці 4, з одержанням 1,27 г продукту у 1 вигляді солі гідрохлориду; H ЯМР (300 МГц, CDCl3) δ 3,85 (с, 3H), 4,26 (с, 2H), 6,68 (д, J = 7,2 Гц, 1H), 7,40 (ш с, 2H), 7,53 (д, J = 7,8 Гц, 1H), 7,64 (д, J = 7,5 Гц, 1H), 8,19 (д, J = 6,6 Гц, 1H). Проміжна сполука 6 1-(4-Метоксидибензо[b,d]фуран-1-іл)метиламіну гідрохлорид: Названу в заголовку сполуку одержують в 2 стадії з 4-метокси-дибензо[b,d]фуран-1карбальдегіду (3 г, 13,274 ммоль) за методикою, подібною описаній в Проміжній сполуці 4, з 1 одержанням 2,97 г продукту у вигляді солі гідрохлориду; H ЯМР (300 МГц, CDCl3) δ 4,07 (с, 3H), 4,63 (с, 2H), 7,16 (д, J = 8,1 Гц, 1H), 7,36 (д, J = 7,8 Гц, 1H), 7,44 (т, J = 6,6 Гц, 1H), 7,56 (т, J = 7,5 Гц, 1H), 7,66 (д, J = 7,5 Гц, 1H), 8,22 (д, J = 7,8 Гц, 1H). ПРИКЛАДИ Загальна методика одержання похідних 3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-(2метоксифеніл)ацетаміду: Метод A При перемішуванні до суміші похідного (3,4-дигідроспіро[хромен-2,1’-циклобутан]-4іл)оцтової кислоти (1,0 ммоль) та ариламіну гідрохлориду (1,0 ммоль) в дихлорметані додають 3-(3-диметиламінопропіл)-1-етилкарбодіїміду гідрохлорид (ЕДКІ.HCl) (1,3 ммоль), 1гідроксибензотриазол (HOBt) (1,3 ммоль) і триетиламін (3,4 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 12 год. Після проходження реакції, реакційну суміш розбавляють водою та екстрагують хлороформом і об’єднані органічні фракції промивають водою, сольовим розчином, сушать (Na2SO4), фільтрують та упарюють під вакуумом з одержанням продукту. Метод B Стадія 1: При перемішуванні до розчину похідного (3,4-дигідроспіро[хромен-2,l'-циклобутан]4-іл)оцтової кислоти (1,0 ммоль) в дихлорметані додають оксалілхлорид (1,5 ммоль) та каталітичну кількість N,N-диметилформаміду. Реакційну суміш перемішують при кімнатній температурі протягом 2 год в атмосфері азоту. Розчинник та надлишок оксалілхлориду випаровують при зниженому тиску з одержанням хлорангідриду кислоти у вигляді твердої речовини, яку використовують в реакції сполучення без додаткового очищення. Стадія 2: До перемішаної та охолодженої суміші ариламіну (1,0 ммоль) і триетиламіну (1,7 ммоль) в дихлорметані додають проміжну сполуку із Стадії 1 (1,0 ммоль) в дихлорметані 9 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом 15 хв при 0° C. Реакційній суміші дозволяють нагрітися до кімнатної температури та перемішують при тій же температурі в атмосфері азоту протягом 2 год. Реакційну суміш розбавляють водою та продукт екстрагують хлороформом. Об’єднані органічні фракції промивають водою, сольовим розчином, сушать (Na2SO4) фільтрують та упарюють під вакуумом з одержанням продукту. Приклад 1 2-(6-Хлор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-(2-метоксифеніл)ацетамід Названу в заголовку сполуку одержують за реакцією сполучення 6-хлор-3,4дигідроспіро[хромен-2,1’- циклобутан]-4-іл)ацетил хлориду (230 мг, 0,812 ммоль), одержаного з Проміжної сполуки 1, з 2-метоксианіліном (100 мг, 0,812 ммоль) в присутності триетиламіну (225 мкл, 1,624 ммоль) в дихлорметані (10 мл), як описано в Методі B, з одержанням 159 мг продукту у вигляді твердої речовини майже білого кольору. ІЧ (KBr) 3301, 2941, 1656, 1542, 1247, 1030, -1 1 742 cm ; H ЯМР (300 МГц, CDCl3) δ 1,62-1,75 (м, 2H), 1,81-1,89 (м, 1H), 2,02-2,10 (м, 3H), 2,332,48 (м, 3H), 3,04 (дд, J = 4,8, 9,6 Гц, 1H), 3,50 (ш с, 1H), 3,81 (с, 3H), 6,72 (д, J = 8,7 Гц, 1H), 6,85 (д, J = 8,1 Гц, 1H), 6,93-7,04 (м, 3H), 7,14 (с, 1H), 7,75 (ш с, 1H), 8,37 (д, J = 6,9 Гц, 1H); іонізація + електророзпиленням/мас-спектроскопія (співідношення маси до заряду) 372,25 (M+H) . Приклад 2 2-(6-Хлор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-(2-циклопентилокси-3метоксибензил)ацетамід Названу в заголовку сполуку одержують за реакцією сполучення Проміжної сполуки 1 (207 мг, 0,828 ммоль) з Проміжною сполукою 4 (200 мг, 0,828 ммоль) в присутності ЕДКІ.HC1 (238 мг, 1,248 ммоль), HOBt (190 мг, 1,242 ммоль) та триетиламіну (460 мкл, 3,312 ммоль) в дихлорметані (5 мл), як описано в Методі A, з одержанням 157 мг продукту у вигляді білої -1 1 твердої речовини; ІЧ (KBr) 3279, 2938, 1646, 1478, 1269, 1077 cm ; H ЯМР (300 МГц, CDCl3) δ 1,50-1,67 (м, 5H), 1,81-2,06 (м, 6H), 2,09-2,19 (м, 4H), 2,28-2,39 (м, 1H), 2,75-2,82 (м, 1H), 3,40 (ш с, 1H), 3,83 (с, 3H), 4,47 (д, J = 6,0 Гц, 2H), 4,95 (ш с, 1H), 6,03 (ш с, 1H), 6,68 (д, J = 8,7 Гц, 1H), 6,82-6,90 (м, 2H), 6,95-7,04 (м, 3H); іонізація електророзпиленням/мас-пектроскопія (співідношення маси до заряду) 468,46 (M-H) . Приклад 3 2-(6-Хлор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-1-(4метоксинафтилметил)ацетамід Названу в заголовку сполуку одержують за реакцією сполучення Проміжної сполуки 1 (178 мг, 0,671 ммоль) з Проміжною сполукою 5 (150 мг, 0,671 ммоль) в присутності ЕДКІ.HCl (192 мг, 1,008 ммоль), HOBt (154 мг, 1,008 ммоль) та триетиламіну (375 мкл, 2,686 ммоль) в дихлорметані (5 мл) , як описано в Методі A, з одержанням 103 мг продукту у вигляді білої -1 1 твердої речовини; ІЧ (KBr) 3289, 2933, 1632, 1480, 1092, 760 cm ; H ЯМР (300 МГц, CDCl3) δ 1,42-1,68 (м, 5H), 1,80-1,85 (м, 1H), 2,03-2,16 (m. 3H), 2,74-2,81 (м, 1H), 3,44 (ш с, 1H), 3,98 (с, 3H), 4,76-4,90 (м, 2H), 5,66 (ш с, 1H), 6,65-6,73 (м, 2H), 6,96-7,04 (м, 2H), 7,33 (д, J = 8,7 Гц, 1H), 7,46-7,55 (м, 2H), 7,92 (д, J = 7,8 Гц, 1H), 8,28 (д, J = 8,1 Гц, 1H); іонізація електророзпиленням/мас-спектроскопія (співідношення маси до заряду) 434,40 (M-H) . Приклад 4 2-(6-Хлор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-[(4-метоксидибензо [b,d]фуран-1іл)метил]ацетамід Названу в заголовку сполуку одержують за реакцією сполучення Проміжної сполуки 1 (121 мг, 0,455 ммоль) з Проміжною сполукою 6 (100 мг, 0,379 ммоль) в присутності ЕДКІ.HCl (109 мг, 0,569 ммоль), HOBt (87 мг, 0,569 ммоль) та триетиламіну (158 мкл, 1,138 ммоль) в дихлорметані (5 мл) , як описано в Методі A, з одержанням 64 мг продукту у вигляді білої твердої речовини; ІЧ -1 1 (KBr) 3292, 2934, 1630, 1479, 1274, 747 cm ; H ЯМР (300 МГц, CDCl3) δ 1,50-1,67 (м, 3H), 1,902,02 (м, 3H), 2,17-2,29 (м, 3H), 2,79 (дд, J = 4,8, 9,6 Гц, 1H), 3,47 (ш с, 1H), 4,05 (с, 3H), 4,83-4,98 (м, 2H), 5,68 (ш с, 1H), 6,65 (д, J = 8,1 Гц, 1H), 6,91-7,04 (м, 3H), 7,16 (д, J = 7,8 Гц, 1H), 7,35 (т, J = 7,2 Гц, 1H), 7,46 (д, J = 7,8 Гц, 1H), 7,62 (д, J = 8,4 Гц, 1H), 7,96 (д, J = 7,8 Гц, 1H); іонізація + електророзпиленням/мас-спектроскопія (співідношення маси до заряду) 475,90 (M) . Приклад 5 2-(6-Хлор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-[(1S)-1-фенілетил] ацетамід Названу в заголовку сполуку одержують за реакцією сполучення хлорангідриду кислоти (117 мг, 0,412 ммоль) з Проміжної сполуки 1 з (S)-(-)-α-метилбензиламіном (50 мг, 0,412 ммоль) в дихлорметані (5 мл) в присутності триетиламіну (172 мкл, 1,238 ммоль) , як описано в Методі B, 1 з одержанням 98 мг продукту у вигляді білої твердої речовини. H ЯМР (300 МГц, CDCl3) δ 1,521,61 (м, 4H), 1,85 (ш с, 1H), 1,98-2,05 (м, 4H), 2,27-2,38 (м, 3H), 2,72 (ш с, 1H), 3,42 (ш с, 1H), 5,17 (ш с, 1H), 5,69 (ш с, 1H), 6,70 (д, J = 8,7 Гц, 1H), 7,00-7,09 (м, 2H), 7,31 (с, 5H). 10 UA 104861 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 6 (2E)-2-(6-Хлор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іліден)-N-[2(циклопентилокси)феніл] ацетамід Названу в заголовку сполуку одержують за реакцією сполучення етил (2E)-(6хлорспіро[хромен-2,1’-циклобутан]-4(3H)-іліден)ацетату (Стадія 2 з Проміжної сполуки 1) з 2(циклопентилокси)аніліном (120 мг, 0,681 ммоль) (150 мг, 0,565 ммоль) в присутності ЕДКІ.HC1 (163 мг, 0,851 ммоль), HOBt (130 мг, 0,851 ммоль) та триетиламіну (157 мкл, 1,134 ммоль) в дихлорметані (5 мл) , як описано в Методі A, з одержанням 95 мг продукту у вигляді білої 1 твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,53-1,65 (м, 8H), 1,74-1,90 (м, 4H), 2,22-2,30 (м, 2H), 2,47-2,57 (м, 2H), 3,50 (с, 2H), 4,67 (ш с , 1H), 6,75 (д, J = 8,1 Гц, 2H), 6,85-6,96 (м, 2H), 7,047,10 (м, 2H), 8,32(д, J = 7,8 Гц, 1H). Приклад 7 N-(2-Циклопентилоксифеніл)-2-(6-фтор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4іл)ацетамід Названу в заголовку сполуку одержують за реакцією сполучення хлорангідриду кислоти (121 мг, 0,451 ммоль) з Проміжної сполуки 2 з 2-(циклопентилокси) аніліном (80 мг, 0,451 ммоль) в присутності триетиламіну (188 мкл, 1,353 ммоль) в дихлорметані (5 мл) , як описано в Методі B, 1 з одержанням 89 мг продукту у вигляді білої твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,531,60 (м, 1H), 1,64-1,75 (м, 6H), 1,81-1,90 (м, 4H), 1,92-2,07 (м, 3H), 2,30-2,42 (м, 3H), 3,02 (дд, J = 4,8, 9,6 Гц, 1H), 3,52 (ш с, 1H), 4,81 (ш с, 1H), 6,74-6,81 (м, 2H), 6,87-7,04 (м, 4H), 7,76 (ш с, 1H), 8,36 (д, J = 8,1 Гц, 1H). Приклад 8 N-(2,6-Дифторбензил)-2-(6-фтор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)ацетамід Названу в заголовку сполуку одержують за реакцією сполучення хлорангідриду кислоти (250 мг, 0,931 ммоль) з Проміжної сполуки 2 з 2,6-дифторбензиламіном (133 мкл, 1,117 ммоль) в присутності триетиламіну (388 мкл, 2,793 ммоль) в дихлорметані (5 мл) , як описано в Методі B, 1 з одержанням 219 мг продукту у вигляді білої твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,58-1,70 (м, 3H), 1,79-1,89 (м, 1H), 2,00-2,07 (м, 2H), 2,16-2,21 (м, 2H), 2,29-2,39 (м, 1H), 2,75 (к, J = 5,1 Гц, 1H), 3,43 (ш с, 1H), 4,51- 4,66 (м, 2H), 6,66-6,77 (м, 3H), 6,89 (т, J = 7,8 Гц, 2H), 7,197,29 (м, 1H). Приклад 9 2-(6-Фтор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-хінолін-6-ілацетамід Названу в заголовку сполуку одержують за реакцією сполучення хлорангідриду кислоти (110 мг, 0,409 ммоль) з Проміжної сполуки 2 з 6-амінохіноліном (65 мг, 0,451 ммоль) в присутності триетиламіну (171 мкл, 1,229 ммоль) в дихлорметані (5 мл) , як описано в Методі B, з 1 одержанням 99 мг продукту у вигляді білої твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,641,70 (м, 3H), 1,75-1,88 (м, 1H), 2,06-2,12 (м, 2H), 2,37-2,42 (м, 2H), 2,50-2,55 (м, 1H), 3,04 (дд, J = 4,8, 10,2 Гц, 1H), 3,57 (ш с, 1H), 6,77-6,89 (м, 3H), 7,37-7,42 (м, 1H), 7,50 (д, J = 8,1 Гц, 1H), 7,76 (с, 1H), 8,07 (дд, J = 7,8, 10,2 Гц, 2H), 8,40 (с, 1H), 8,82 (с, 1H). Приклад 10 N-[4-(4-Бромфеніл)-lJ3-тіазол-2-іл]-2-(6-фтор-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4іл)ацетамід При перемішуванні до розчину Проміжної сполуки 2 (100 мг, 0,399 ммоль) в диметилформаміді (5 мл) додають 4-(4-бромфеніл)-l,3-тіазол-2-амін (122 мг, 0,679 ммоль) з наступним додаванням дициклогексилкарбодіміду (122 мг, 0,598 ммоль) та Nгідроксисукциніміду (67 мг, 0,598 ммоль). Реакційну суміш нагрівають до 80° C в атмосфері азоту протягом 24 год. Реакційну суміш охолоджують до кімнатної температури і залишок фільтрують крізь шар броунмілериту. Продукт екстрагують етилацетатом (3 x 50 мл) і об’єднані органічні фракції промивають водою, сольовим розчином і сушать (Na2SO4). Сирий продукт, отриманий після випарювання при зниженому тиску, очищують хроматографією на колонці з силікагелем з використанням 5 % етилацетату в петролейному ефірі з одержанням 79 мг 1 продукту у вигляді твердої речовини майже білого кольору; H ЯМР (300 МГц, CDCl3) δ 1,45-1,55 (м, 2H), 1,58-1,70 (м, 2H), 1,84-1,90 (м, 1H), 1,98-2,10 (м, 2H), 2,16-2,22 (м, 1H), 2,31-2,38 (м, 1H), 2,77 (дд, J = 4,2, 10,8 Гц, 1H), 3,40 (ш с, 1H), 6,56 (д, J = 8,7 Гц, 1H), 6,72-6,79 (м, 2H), 7,13 (с, 1H), 7,47 (д, J = 8,1 Гц, 2H), 7,60 (д, J = 8,4 Гц, 2H), 10,42 (ш с, 1H). Приклад 11 2-(6-Mетокси-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-1-нафтилацетамід Названу в заголовку сполуку одержують за реакцією сполучення хлорангідриду кислоти (195 мг, 0,698 ммоль) з Проміжної сполуки 3 з 1-аміноnaphthalene (100 мг, 0,698 ммоль) в присутності триетиламіну (291 мкл, 2,095 ммоль) в дихлорметані (5 мл) , як описано в Методі B, з 11 UA 104861 C2 1 5 10 15 20 25 30 35 40 45 50 одержанням 128 мг продукту у вигляді білої твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,631,70 (м, 2H), 1,76-1,84 (м, 2H), 2,03-2,10 (м, 3H), 2,34-2,40 (м, 2H), 2,73-2,80 (м, 1H), 3,09 (к, J = 4,8 Гц, 1H), 3,60 (ш с, 1H), 3,72 (с, 3H), 6,73-6,82 (м, 2H). 7,45-7,52 (м, 5H), 7,66 (д, J = 8,1 Гц, 1H), 7,82 (д, J = 7,5 Гц, 1H), 7,96 (д, J = 7,2 Гц, 1H). Приклад 12 2-(6-Mетокси-3,4-дигідроспіро[хромен-2,1’-циклобутан]-4-іл)-N-l,3-тіазол-2-ілацетамід Названу в заголовку сполуку одержують за реакцією сполучення хлорангідриду кислоти (100 мг, 0,356 ммоль) з Проміжної сполуки 3 з 2-аміно-l,3-тіазолом (35 мг, 0,356 ммоль) в присутності триетиламіну (149 мкл, 1,068 ммоль) в дихлорметані (5 мл) , як описано в Методі B, з 1 одержанням 85 мг продукту у вигляді білої твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,621,71 (м, 2H), 1,88 (ш с, 1H), 2,05-2,12 (м, 3H), 2,30-2,41 (м, 2H), 2,59-2,67 (м, 1H), 3,19 (к, J = 4,8 Гц, 1H), 3,58 (ш с, 1H), 3,69 (с, 3H), 6,68-6,75 (м, 3H), 6,93-6,70 (м, 1H), 7,28-7,35 (м, 1H). Приклад 13 2-(6-Mетокси-3,4-дигідроспіро[хромен-2,1’~циклобутан]-4-іл)-N-(6-метил-l ,3-бензотіазол-2-іл) ацетамід Названу в заголовку сполуку одержують за реакцією сполучення хлорангідриду кислоти (170 мг, 0,608 ммоль) з Проміжної сполуки 3 з 6-метил-l,3-бензотіазол-2-аміном (100 мг, 0,608 ммоль) в присутності триетиламіну (254 мкл, 1,826 ммоль) в дихлорметані (5 мл) , як описано в Методі 1 B, з одержанням 80 мг продукту у вигляді білої твердої речовини; H ЯМР (300 МГц, CDCl3) δ 1,60-1,68 (м, 3H), 1,86 (ш с, 1H), 1,98-2,05 (м, 3H), 2,28-2,35 (м, 2H), 2,46 (с, 3H), 2,55-2,60 (м, 1H), 3,10 (к, J = 4,8 Гц, 1H), 3,55 (ш с, 1H), 3,66 (с, 3H), 6,61 (ш с, 1H), 6,69-7,77 (м, 2H), 7,17 (д, J = 7,8 Гц, 1H), 7,53-7,60 (м, 2H). іонізація електророзпиленням/мас-спектроскопія (співідношення + маси до заряду) 409,43 (M+H) . ФАРМАКОЛОГІЧНА АКТИВНІСТЬ Здійснено скринінг ілюстративних прикладів сполук за даним винаходом щодо активності TRPV3 у відповідності до модифікованої методики, описаної в Tόth, A., Kedei, N., Wang, Y. and Blumberg, P. M. et al. Life Sciences (2003), 73, 487-498. Скринінг сполук може бути здійснений із застосуванням інших методів і методик, відомих фахівцю в даній галузі. Такі методи скринінгу можна знайти в (а) Hu, H-Z., et al. J. Biol. Chem. (2004), 279, 35741-35747; (б) Smith, G. D et al. Nature (2002), 418, 186-190 ; (в) Peier, A. M., et al. Science (2002), 296, 2046-2049. 45 : Скринінг для пошуку антагоніста TRPV3 з використанням експерименту із захопленням Ca Інгібування активації рецептора TRPV3 відслідковували як інгібування індукованого 2аміноетоксидифенілборатом (2-АФБ) захоплення радіоактивного кальцію клітинами. Досліджувані сполуки розчинили в ДМСО з одержанням 20 мМ запасного розчину, а потім розбавляли з використанням звичайного середовища, що містило 0,1% альбуміну телячої сироватки та 1,8 мМ CaCl2, до цільової концентрації. Кінцева концентрація ДМСО в реакційній суміші становила 0.5% (об/об). Клітини CHO, що експресують людський TRPV3, вирощували в модифікованому Дульбекко середовищі Ігла F-12 з вмістом 10% сироватки телячого ембріону, 1% розчину пеніциліну-стрептоміцину, 400 мкг/мл G-418. Клітини засівали за 24 год до випробування в 96-лункові планшети для одержання ~50 000 клітин на лунку на день експерименту. Клітини обробляли досліджуваними сполуками протягом 10 хв, з наступним 45 +2 додаванням 2-АФБ в кінцевій концентрації 500 мкМ і 5 мкКі/мл Ca на 4 хв. Клітини промивали і піддавали лізису з використанням буферного розчину, що містив 1% Тритон X-100, 0,1% дезоксихолату і 0,1% натрію додецилсульфату. Радіоактивність лізату вимірювали на лічильнику Packardt Top після додавання сцинтиляційної рідини. Графіки кривих «концентрація-відповідь» будували як % максимальної відповіді, одержаної за відсутності досліджуваного антагоніста. Значення IC50 були обчислені на базі кривої «концентрація-відповідь» апроксимацією нелінійною регресією , з використанням програмного забезпечення GraphPad PRISM. Одержані сполуки досліджували з використанням наведеної вище методики випробування, і одержані результати наведені в табл. 1. Відсоток інгібування при концентрації 1,0 мкМ і 10,0 мкМ наведений в таблиці-1. 12 UA 104861 C2 Таблиця 1 Результати скринінгу сполук за винаходом in vitro Відсоток інгібування при концентрації 1,0 мкМ при концентрації 10,0 мкМ 26,3 94,2 61,6 92,9 54,6 83,9 23,2 52,3 6,3 65,8 51,5 80,9 46,8 93,8 14,2 53,1 3,7 88,5 49,3 77,9 29,1 86,5 19,4 63,6 26,1 66,8 Приклад Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 6 Приклад 7 Приклад 8 Приклад 9 Приклад 10 Приклад 11 Приклад 12 Приклад 13 Значення IC50 (нМ) 725,3 ФОРМУЛА ВИНАХОДУ 5 1. Сполука формули (І): O N H Y A (X)m O 10 15 20 25 30 (CH2)n , (І) де пунктирна (- - - -) лінія відсутня; А являє собою С3-С12циклоалкільну, С6-С14арильну, 3-15-членну гетероарильну або 3-15-членну 2 гетероциклічну групу, необов'язково заміщену галогеном, С 1-С8алкілом або OR ; 1 1 Y являє собою -(CHR )r, де R являє собою водень, галоген або С1-С8алкіл; 2 3 4 3 3 X являє собою водень, нітро, ціано, галоген, С1-С8алкіл, -OR , -NR R , -C(O)-R , -C(O)O-R , 3 4 3 4 3 C(O)NR R , -S(O)рNR R або -S(O)рR ; 3 4 R та R , які можуть бути однаковими або різними, в кожному випадку незалежно вибрані з 2 водню, -OR , С1-С8алкілу або С1-С8алкенілу; 2 R в кожному випадку незалежно вибраний з групи, що складається з водню, заміщеного або незаміщеного С1-С8алкілу або С2-С8алкенілу, або С3-С12циклоалкілу; "m" дорівнює цілому числу від 0 до 2, обидва значення включені; "n" дорівнює цілому числу від 0 до 2, обидва значення включені; "p" дорівнює цілому числу від 0 до 2, обидва значення включені; та "r" дорівнює цілому числу від 0 до 2, обидва значення включені; або її фармацевтично прийнятні солі. 1 2. Сполука за п. 1, яка відрізняється тим, що Y являє собою -(CHR )r, де r дорівнює 0 або 1. 1 3. Сполука за п. 1 або 2, яка відрізняється тим, що R являє собою водень або С1-С8алкіл. 4. Сполука за пп. 1-3, яка відрізняється тим, що А являє собою С6-С14арил. 5. Сполука за пп. 1-3, яка відрізняється тим, що А являє собою 3-15-членний гетероарил. 6. Сполука за п. 1, яка відрізняється тим, що "n" дорівнює 1. 7. Сполука за пп. 1-6, яка відрізняється тим, що вибрана з: 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-(2-метоксифеніл)ацетаміду, 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-(2-циклопентилокси-3метоксибензил)ацетаміду, 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-1-(4-метоксинафтилметил)ацетаміду, 13 UA 104861 C2 5 10 15 20 25 30 35 40 45 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-[(4-метоксидибензо[b,d]фуран-1іл)метил]ацетаміду, 2-(6-хлор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-[(1S)-1-фенілетил]ацетаміду, N-(2-циклопентилоксифеніл)-2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)ацетаміду, N-(2,6-дифторбензил)-2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)ацетаміду, 2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-хінолін-6-ілацетаміду, N-[4-(4-бромфеніл)-1,3-тіазол-2-іл]-2-(6-фтор-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4іл)ацетаміду, 2-(6-метокси-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-1-нафтилацетаміду, 2-(6-метокси-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-1,3-тіазол-2-ілацетаміду та 2-(6-метокси-3,4-дигідроспіро[хромен-2,1'-циклобутан]-4-іл)-N-(6-метил-1,3-бензотіазол-2іл)ацетаміду або їх фармацевтично прийнятних солей. 8. Фармацевтична композиція, яка відрізняється тим, що містить сполуку за будь-яким з пп. 1-7 у формі вільної основи або у формі фармацевтично прийнятної солі та фармацевтично прийнятну допоміжну речовину. 9. Фармацевтична композиція за п. 8, яка відрізняється тим, що фармацевтично прийнятна допоміжна речовина являє собою носій або розріджувач. 10. Сполука за будь-яким з пп. 1-7, яка використовується для профілактики, полегшення або лікування опосередкованого ванілоїдним рецептором захворювання, розладу або синдрому у суб'єкта. 11. Сполука за п. 10, яка відрізняється тим, що ванілоїдним рецептором є TRPV3. 12. Сполука за п. 11, яка відрізняється тим, що симптоми захворювання, розладу, синдрому або стану, пов'язаного з функцією TRPV3, вибрані з групи, що складається з болю, гострого болю, хронічного болю, ноцицептивного болю, невропатичного болю, післяопераційного болю, зубного болю, болю при онкологічних захворюваннях, серцевого болю, що є наслідком ішемії міокарда, болю внаслідок мігрені, артралгії, різних видів невропатії, невралгії, тригемінальної невралгії, пошкодження нерва, діабетичної невропатії, нейродегенерації, ретинопатії, невротичного розладу шкіри, інсульту, гіперчутливості сечового міхура, нетримання сечі, вульводинії, розладів шлунково-кишкового тракту, таких як синдром подразнення кишечнику, гастроезофагеальна рефлюксна хвороба, ентерит, ілеїт, виразка шлунка/12-палої кишки, запальне захворювання кишечнику, хвороба Крона, глютенчутлива ентеропатія, запального захворювання, такого як панкреатит, розладу дихальних шляхів, такого як алергічний та неалергічний риніт, астма або хронічне обструктивне захворювання легень, подразнення шкіри, ока або слизової оболонки, дерматит, стану, що супроводжується свербежем, такого як уремічний свербіж, гарячкового стану, спазмів м'язів, блювання, дискінезій, депресії, хвороби Хантінгтона, погіршення пам'яті, обмеження функції мозку, аміотрофічного латерального склерозу (АЛС), деменції, артриту, остеоартриту, діабету, ожиріння, кропивниці, актинічного кератозу, кератоксантоми, алопеції, хвороби Меньє, дзвону у вухах, гіперакузії, тривожних розладів і доброякісної гіперплазії передміхурової залози. 13. Сполука за пп. 1-7, яка використовується для лікування болю у суб'єкта, при цьому сполука є в терапевтично ефективній кількості. 14. Сполука за п. 13, яка відрізняється тим, що біль являє собою гострий біль, хронічний біль, післяопераційний біль або невропатичний біль. 15. Сполука за пп. 1-7 для використання при лікуванні запалення у суб'єкта, при цьому сполука є в терапевтично ефективній кількості. Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюChromane derivatives as trpv3 modulators
Автори англійськоюLingam, V.C., Prasadarao, Thomas, Abraham, Khatik, Javed, Yusuf, Khairatkar-Joshi, Neelima, Kattige, Vidya Ganapati
Автори російськоюТомас Абрахам
МПК / Мітки
МПК: C07D 311/04
Мітки: модулятори, хроману, похідні, trpv3
Код посилання
<a href="https://ua.patents.su/16-104861-pokhidni-khromanu-yak-modulyatori-trpv3.html" target="_blank" rel="follow" title="База патентів України">Похідні хроману як модулятори trpv3</a>
Попередній патент: Двигун внутрішнього згоряння
Наступний патент: Звідний пристрій для ковзного затвора
Випадковий патент: Спосіб керування ризиками проектів




















