Карбени
Номер патенту: 68789
Опубліковано: 10.04.2012
Автори: Кнішевицький Артур Володимирович, Швайка Олексій Павлович, Коротких Микола Іванович, Глиняна Наталія Валеріївна, Попов Анатолій Федорович, Кисельов Артем Вікторович, Марічев Костянтин Олександрович
Формула / Реферат
1. Карбени загальної формули (L)n,
де L - карбенова ланка, вибрана з ряду (І-VI):
1,3,4-тризаміщений 1,2,4-триазол-5-іліден загальної формули
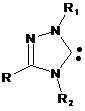 , (I),
, (I),
де R, R1, R2 означає алкіл, арил, гетерил,
1,3-дизаміщений імідазол-2-іліден загальної формули
 , (II),
, (II),
де R, R1 означає алкіл, арил, гетерил,
1,3-дизаміщений бензімідазол-2-іліден загальної формули
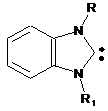 , (III),
, (III),
де R, R1 означає алкіл, арил, гетерил,
1,3-дизаміщений 5,6-дигідро-4Н-піримідин-2-іліден загальної формули
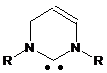 , (IV),
, (IV),
де R, R1 означає алкіл, арил, гетерил,
1,1,3,3-тетразаміщений діамінокарбен загальної формули
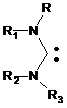 , (V),
, (V),
де R, R1, R2, R3 означає алкіл, арил, гетерил, незаміщений циклогептатриєніліден формули,
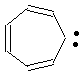 , (VI),
, (VI),
n дорівнює 1.
2. Карбени за п. 1,
де L - біскарбенова ланка, вибрана з ряду (VII-VIII):
1,3,4-тризаміщений біс-1,2,4-триазол-5-іліден загальної формули
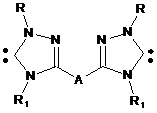 , (VII),
, (VII),
де R, R1 означає алкіл, арил, гетерил, А означає арилен, алкілен.
1,3-дизаміщений бісімідазол-2-іліден загальної формули
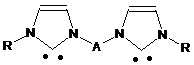 , (VIII),
, (VIII),
де R означає алкіл, арил, гетерил,
А означає алкіленовий або аралкіленовий двовалентний радикал,
n дорівнює 1.
3. Карбени за п. 1,
де L - карбенова ланка, вибрана з ряду (ІХ-ХІ):
1,3-дизаміщений імідазол-2-іліден загальної формули
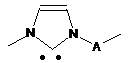 , (IX),
, (IX),
де А аралкіленовий двовалентний радикал в полімерному ланцюгу,
n дорівнює 70-400,
1,3-дизаміщений бісімідазол-2-іліден загальної формули
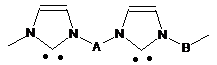 , (X),
, (X),
де А означає алкіленовий або ариленовий двовалентний радикал,
В означає аралкіленовий двовалентний радикал в полімерному ланцюгу,
n дорівнює 70-400,
біспіридин-2-іліден загальної формули
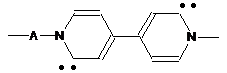 , (XI),
, (XI),
де А означає двовалентний аралкіленовий радикал А в полімерному ланцюгу,
n дорівнює 70-400.
Текст
Реферат: Корисна модель належить до органічної хімії, точніше, до нових карбонів, а саме - карбонів загальної формули (L)n, де L - карбенова ланка, що можуть використовуватися як каталізатори реакції трансестерифікації, зокрема для виробництва моторних біопалив. R N N R1 UA 68789 U (12) UA 68789 U UA 68789 U 5 10 15 20 Корисна модель належить до органічної хімії, точніше, до нових карбенів, що можуть використовуватися як каталізатори реакції трансестерифікації, зокрема для виробництва моторних біопалив. Відомо багато каталізаторів трансестерифікації, зокрема, кислот і основ Льюїса (Методы эксперимента в органической химии. - Μ.: Изд. Химия, 1969. - С. 352). Проте кислоти, як каталізатори, викликають корозію металевого обладнання та непридатні для трансестерифікації малостійких речовин, а основи малоефективні в цій реакції. Багато з цих відомих каталізаторів високотоксичні (похідні важких металів), вогненебезпечні (гідриди металів), нестійкі до кисню, вогненебезпечні та токсичні (фосфіни). Останнім часом став застосовуватися один із найпростіших промислово перспективних каталізаторів трансестерифікації - стабільні карбени (Ν-Heterocyclic carbenes in Synthesis/ Ed. S. Nolan. - Weinheim: Wiley-VCH-Verlag GmbH & Co KgaA. - 2006. - P. 285). Карбени - це сполуки двовалентного вуглецю загальної формули R1R2C:, де R1, R2 - алкільні, арильні або гетероциклічні радикали. R1, R2 також можуть складати карбо- та гетероцикли. Ефективність каталізу карбенами, як і іншими сполуками, оцінюється за максимальними значеннями показників TON і TOF [TON (turnover number) - число каталітичних циклів, що дорівнює відношенню числа молів продукту реакції до числа молів каталізатора; TOF (turnover frequency) - число каталітичних циклів за годину, тобто, відношення кількості каталітичних циклів до тривалості реакції] (Poyatos Μ., Mas-Marza Ε., Mata J.A. et al. / Eur. J. Inorg. Chem. 2003. - № 6. - P. 1215). Відомі карбени формули A (Nyce G. W., Lamboy J. Α., Connor E. F., Way-mouth R. M., Hedrick J. L. Org. Lett. - 2002. - V. 4, № 21. - С. 3587): R N N R1 25 30 , (A) де R=R1=Mes, R=R1=Me або R=Et, R1 = Me. Карбени формули (А) в кількості 3,6-4,4 моль % каталізують реакцію трансестерифікації у надлишку спирту (1:20) при кімнатній температурі. Таким способом отримують виходи етилових -1 естерів 79-85 %, забезпечуючи лише невисокі показники TON і TOF на рівні 17-19 і 1 год. відповідно. Каталізатори (А) застосовано для трансестерифікації вінілових естерів спиртами (Grasa G. Α., Gveli Т., Singh R., Nolan S. P. J. Org. Chem. - 2003. - V. 68, № 7. - P. 2812). В цьому випадку отримують високі виходи продуктів (93-100 %) і досягають найвищої каталітичної ефективності -1 (TON до 200, TOF до 800 год ). Але реакція не може бути застосована для переробки рослинних олій та одержання моторних палив. Відомі вибрані за найближчий аналог карбени формули (А1): R N N 35 40 45 R1 , (A1), де R=R1 = Су, Ad, t-Bu, Mes, R=R1 = Η. Відомі стабільні карбени формули (А1) (Grasa G. Α., Gveli Т., Singh R., Nolan S. P. J. Org. Chem. - 2003. - V. 68, № 7. - P. 2812) каталізують трансестерифікацію метилацетату різними спиртами у надлишку естеру або у співвідношеннях близьких до стехіометричних у присутності молекулярних сит 4Å. Застосування відомого каталізатора-найближчого аналога дозволяє переробляти олії. Недоліком відомих карбенів в цій реакції є їх недостатня ефективність (TON -1 20-60, TOF 25-220 год. ) та необхідність використання значних кількостей каталізатора (2,5 моль %), молекулярних сит (на 1 ммоль спирту 0,5 г сит) і надлишку естеру (до 12:1), який при переробці олій повинен бути в нестачі. В основу корисної моделі поставлено задачу запропонувати нові карбени, які проявляють високу каталітичну ефективність при короткій тривалості процесу, при кімнатній температурі, низьких витратах каталізатора, без використання додаткових засобів (молекулярних сит) та високому виході продукту каталітичної реакції трансестерифікації. Запропоновані карбени 1 UA 68789 U 5 10 забезпечують високу ефективність каталізу: показники TON і TOF для найкращих варіантів -1 нових каталізаторів досягають значень 2350-4000 і 588-5760 год. відповідно (за найближчим -1 аналогом 20-60 і 25-220 год. ), витрати карбену на два порядки нижчі, ніж за найближчим аналогом (0,04 моль % проти 2,5 моль %), з новими каталізаторами немає необхідності у застосуванні додаткових засобів, зокрема, молекулярних сит, карбени можна використовувати у синтезі моторного біопалива, завдяки високій ефективності каталізатора у надлишку спирту, в оптимальних варіантах проведення процесу виходи продуктів трансестерифікації досягають 8494 %. Поставлена задача вирішується тим, що створено карбени загальної формули (L)n, де L - карбенова ланка, вибрана з ряду (І-VI): 1,3,4-тризаміщений 1,2,4-триазол-5-іліден загальної формули R1 N N N R R2 , (I), де R, R1, R2 означає алкіл, арил, гетерил, 1,3-дизаміщений імідазол-2-іліден загальної формули R N N 15 R1 , (II), де R, R1 означає алкіл, арил, гетерил, 1,3-дизаміщений бензімідазол-2-іліден загальної формули R N N R1 20 , (III), де R, R1 означає алкіл, арил, гетерил, 1,3-дизаміщений 5,6-дигідро-4Н-піримідин-2-іліден загальної формули R N N R , (IV), де R, R1 означає алкіл, арил, гетерил, 1,1,3,3-тетразаміщений діамінокарбен загальної формули R R1 N R2 N R3 25 , (V), де R, R1, R2, R3 означає алкіл, арил, гетерил, незаміщений циклогептатриєніліден формули, , (VI), n дорівнює 1. 2 UA 68789 U Відмінністю рішення є також те, що створено карбени загальної формули (L)n, де L - біскарбенова ланка, вибрана з ряду (VII-VIII): 1,3,4-тризаміщений біс-1,2,4-триазол-5-іліден загальної формули R R N N N N N N A R1 5 , (VII), де R, R1 означає алкіл, арил, гетерил, А означає арилен, алкілен. 1,3-дизаміщений бісімідазол-2-іліден загальної формули R 10 R1 N N N 30 35 40 R A N A N N B , (X), де А означає алкіленовий або ариленовий двовалентний радикал, В означає аралкіленовий двовалентний радикал в полімерному ланцюгу, n дорівнює 70-400, біспіридин-2-іліден загальної формули A 25 N , (IX), де А аралкіленовий двовалентний радикал в полімерному ланцюгу, n дорівнює 70-400, 1,3-дизаміщений бісімідазол-2-іліден загальної формули N 20 N , (VIII), де R означає алкіл, арил, гетерил, А означає алкіленовий або аралкіленовий двовалентний радикал, n дорівнює 1. Ще однією відмінністю рішення є те, що створено карбени загальної формули (L)n, де L - карбенова ланка, вибрана з ряду (ІХ-ХІ): 1,3-дизаміщений імідазол-2-іліден загальної формули N 15 A N N , (XI), де А означає двовалентний аралкіленовий радикал А в полімерному ланцюгу, n дорівнює 70-400. Причинно-наслідковий зв'язок між сукупністю ознак, що заявляються, та технічним результатом полягає у такому. Запропоновані карбени мають переваги перед відомим (найближчим аналогом) карбеном загальної формули (АІ): -1 - вища каталітична ефективність (TON 2350-4000 і TOF 588-5760 год. проти 20-60 і 25-220 -1 год. , відповідно), - вища економічність каталізу через в 62 рази нижчі витрати каталізатора (0,04 моль % проти 2,5 моль. %), - з новими каталізаторами немає необхідності застосувати додаткові засоби, зокрема, молекулярні сита, - нові каталізатори можуть використовуватися у синтезі моторного біопалива завдяки високій ефективності каталізатора при надлишку спирту. Результати оцінки каталітичної ефективності синтезованих сполук (1)-(16) наведені в таблиці (приклади 1-22). Як видно з даних таблиці, каталітична ефективність ряду запропонованих карбенів у реакції трансестерифікації етилбензоату в метилбензоат в метанолі 3 UA 68789 U 5 10 15 виявилася значно вищою (за показниками TON і TOF), ніж у відомого (найближчий аналог) імідазол-2-ілідену (АІ) на прикладі реакції метилацетату з бензиловим спиртом (приклад 23). Виключно високою каталітична ефективність виявляється для карбенів (6)-(10), біскарбену (13), полімерних карбенів (14)-(16). В оптимальних умовах, при застосуванні 0,04 моль. % цих каталізаторів виходи метилбензоату досягають 84-94 %, каталітична ефективність зростає в 84-1 94 рази за TON (до 2100-2350) і в 21-23,5 разу за TOF (до 525-588 год ) в порівнянні з -1 найближчим аналогом (пор. № 23 таблиці) у реакції трансестерифікації (TON 25, TOF 25 год. ). Особливо велика різниця в показниках TON (в 62 рази) зумовлена саме каталітичним ефектом нових карбенів і, як наслідок, застосуванням низьких кількостей каталізатора при близькій тривалості процесу. У випадку каталізу карбенами (9),(10), біскарбеном (13) і полімерними карбенами (14)-(16) за 4 год. реакції при кімнатній температурі досягають майже кількісних виходів продукту (94 %, пор. №№ 9-11, 21 таблиці). Каталітичні властивості монокарбенів (1)-(10), біскарбенів (11)-(13) і полімерних карбенів (14)-(16) у реакції трансестерифікації етилбензоату в метилбензоат в метанолі (мольне співвідношення реагентів 1: 10) при кімнатній температурі (23 °C). Таблиця Концентрація каталізатора, моль % 3 Каталізатор 1 2 Тривалість реакції, год. 4 Вихід, TON TOF 5 6 7 % t-Bu N N 1 0,04 4 7 175 44 0,04 4 9 225 56 0,04 Ph 4 65 1625 406 0,04 4 72 1800 450 0,04 4 70 1750 438 N C6H4Br-p (1) CH2 C6 H4Br-p N N 2 Ph N C6 H4Br-p (2) Bn N 3 N Bn (3) Me N 4 N Me (4) Bn N 5 N Bn (5) 4 UA 68789 U 6 2100 525 4 88,5 2213 553 4 90 2250 563 4 93,5 2338 585 0,04 4 94 2350 588 0,04 4 25 625 156 0,04 4 52 1300 325 0,04 4 87 2175 544 0,5 4 94 188 47 0,04 Ad 84 0,04 N 4 0,04 Ad 0,04 0,04 N 4 84 2100 525 0,5 4 95 190 48 0,04 4 94 2350 588 (6) Ad Me N 7 Me N Ad (7) 8 (8) Ad N 9 N Ad (9) Ad Ph N Ph N 10 Ad (10) t-Bu t-Bu N N N 11 N N N Ph Ph (11) 12 N Me N (CH2)4 N N Me ·(12) Me 13 N N N N Me (13) N 14 N n (14) 15 (14) N 16 N N N n (15) 17 (15) 5 UA 68789 U N N 18 0,1 0,33 88 880 2667 0,01 0,01* 0,04 0.033** 2,5 0,33 4 4 4 1 19 40 94 88 100 1900 4000 2350 2667 25 5758 1000 588 667 25. n (16) 19 20 21 22 23 5 10 15 20 25 (16) (16) (16) (16) Відомий (найближчий аналог)(АІ) Примітки. Використовували співвідношення естер-метанол 1:20. **Експеримент на соняшниковій олії, де концентрація каталізатора і значення TON і TOF вказані на одну естерну групу олії. Найвищу ефективність серед нових карбенів виявляє полімерний карбен (16) (мол. маса 68800 за даними рідинної хроматографії): вихід 94 % при концентрації каталізатора 0,04 моль -1 %, TON 2350, TOF 588 год. (пор. № 21) і при концентрації каталізатора 0,01 моль % TON 4000, -1 TOF 5758 год. (пор. №№ 19, 20). Близькі за ефективністю також карбени (6)-(8), (13),(14), що при концентрації 0,04 моль% дають можливість отримати виходи продукту 84-90 % і показники TON 2100-2250 і TOF 525-563 -1 год. (пор. №№ 6-8, 14-16). Висока каталітична ефективність властива карбенам (3)-(5) і біскарбену (12) (при концентрації каталізатора 0,04 моль % за 4 год. реакції виходи продукту складають 52-72 %, -1 TON 1300-1800 і TOF 325-450 год. ) (пор. №№ 3-5, 12 таблиці). Значну, хоча й дещо меншу, ніж сполуки (3)-(5), (12), каталітичну ефективність показують сполуки (1),(2), (11) (пор. №№ 1, 2, 11 таблиці), що дозволяють досягти величин TON 175-625 і -1 TOF 44-156 год , які перевищують такі для найближчого аналога (пор. № 23 таблиці). Найкращий з карбенових каталізаторів (16) в кількості 0,033 моль % на кожну естерну групу застосовано для трансестерифікації соняшникової олії в метанолі при кімнатній температурі (4 год.). Отримано 88 % моторного палива, що містить в основному метилові естери жирних 1 кислот (за даними Н ЯМР спектроскопії 75 % метиллінолеату та 23 % метилолеату). Продукт після перегонки в вакуумі являє собою безбарвну рухливу рідину. Показники ефективності -1 каталізу TON 2667 і TOF 667 год. , навіть вище, ніж у випадку перетворення етилбензоату (TON -1 2350, TOF 588 год. ). Механізм каталізу карбенами реакції трансестерифікації точно не встановлено. Однак, на основі вивчення проміжних продуктів реакції можна передбачити, що він містить взаємодію карбену (1)-(16), що генерується з мезо-незаміщеної солі і основи, зі спиртом з утворенням аддукту карбену зі спиртом В (компоненти аддукту зв'язані між собою водневим зв'язком (Наддукт), або спорідненого алкоксіазоліну С (схема каталізу): 30 R3 Y R1 R2 X MeOH R 2 X R2 X -EtOH H R'COOMe+ H O F R'COOEt R R Et H O R3 Y R1 R2 X R' Me (+) H (-) O R3 Y R1 OMe E 35 OMe C R'COOEt R 2 X (+) R3 Y R1 Me B (1-15) H O R3 Y R1 R3 Y R1 Et R R R R R2 X O R' O(-) OEt D Схема каталізу Далі, ймовірно, відбувається взаємодія інтермедіатів В або С з естером, що перебігає через проміжні сполуки D, Ε і аддукт F. Останній здатний повертати активну форму каталізатора (В) шляхом обміну етанолу на метанол. Таким чином, пропоновані карбени загальної формули (L)n, де L - карбенова ланка, вибрана з ряду (І-VI): 6 UA 68789 U 1,3,4-тризаміщений 1,2,4-триазол-5-іліден загальної формули R1 N N N R R2 , (I), де R, R1, R2 означає алкіл, арил, гетерил, 1,3-дизаміщений імідазол-2-іліден загальної формули R N N 5 R1 , (II), де R, R1 означає алкіл, арил, гетерил, 1,3-дизаміщений бензімідазол-2-іліден загальної формули R N N R1 10 , (III), де R, R1 означає алкіл, арил, гетерил, 1,3-дизаміщений 5,6-дигідро-4Н-піримідин-2-іліден загальної формули N R N R , (IV), де R, R1 означає алкіл, арил, гетерил, 1,1,3,3-тетразаміщений діамінокарбен загальної формули R R1 N R2 N R3 15 , (V), де R, R1, R2, R3 означає алкіл, арил, гетерил, незаміщений циклогептатриєніліден формули, , (VI), n дорівнює 1, а також, коли L - біскарбенова ланка, вибрана з ряду (VII-VIII): 1,3,4-тризаміщений біс-1,2,4-триазол-5-іліден загальної формули R R N N 20 R1 N N A N N R1 , (VII), 7 UA 68789 U де R, R1 означає алкіл, арил, гетерил, А означає арилен, алкілен. 1,3-дизаміщений бісімідазол-2-іліден загальної формули R 5 N N N 25 30 35 R A N A N N B , (X), де А означає алкіленовий або ариленовий двовалентний радикал, В означає аралкіленовий двовалентний радикал в полімерному ланцюгу, n дорівнює 70-400, біспіридин-2-іліден загальної формули A 20 N , (IX), де А аралкіленовий двовалентний радикал в полімерному ланцюгу, n дорівнює 70-400, 1,3-дизаміщений бісімідазол-2-іліден загальної формули N 15 N , (VIII), де R означає алкіл, арил, гетерил, А означає алкіленовий або аралкіленовий двовалентний радикал, n дорівнює 1, та коли де L - карбенова ланка, вибрана з ряду (ІХ-ХІ): 1,3-дизаміщений імідазол-2-іліден загальної формули N 10 A N N , (XI), де А означає двовалентний аралкіленовий радикал А в полімерному ланцюгу, n дорівнює 70-400, є каталізаторами реакції трансестерифікації. В оптимальних варіантах використання карбенів (9), (10), (15), (16) досягають найвищого рівня каталітичної ефективності TON до 4000, -1 TOF до 5785 год. ) при концентрації каталізатора 0,04 моль % і кімнатній температурі протягом 1-4 год., що дає можливість застосувати каталізатори в промисловості. Способи одержання сполук відповідно до пропонованої корисної моделі. Звичайно сполуки відповідно до цього рішення одержують за відомими або новими методиками з використанням вихідних речовин, що наявні у продажу, які отримують відповідно до звичайних хімічних способів. Загальною стадією процесу є депротонування відповідної мезонезаміщеної солі (азолієвої, азинієвої, амідинієвої, тропілієвої) під дією основ. В даній корисній моделі використовували дію на відповідну сіль алкоксиду калію. Застосовувана методика одержання мезо-незаміщеної солі за корисною моделлю залежить від конкретної необхідної сполуки. Так, солі (1а), (2а), (11а), (13а)-(16а) для генерації карбенів (1), (2), (11), (13)-(16) отримано шляхом кватернізації відповідних азолів, або бісазолів, бісазинів під дією алкілуючих реагентів (наприклад, диметилсульфату, бензилхлориду, ксилілендихлориду) в органічних розчинниках (ацетонітрилі, диметилформаміді) згідно з відомими методиками алкілування гетероциклів (Общая органическая химия / под ред. Д. Бартона. - М.: Химия, 1985. - Т. 8 - С. 471). Для одержання біссолей та полімерних солей для карбенів (11)-(16) спочатку синтезують бісазоли (наприклад, (13b), приклад 6), які далі кватернізуються звичайними алкілуючими агентами за загальною схемою 1 (приклади 5, 6, 8, 9). 8 UA 68789 U R3 R2 NH N OH R3 R2 R'' R2 N N A 10 15 N (+) (+) 2X 5 N R3 R''-X XAX R3 R2 N N R'' R2 A N R3 XR'X R3 R2 N R' N N R2 A N R3 N (+) (+) (-) 2X (-) де R2, R3 складають двовалентний радикал, вибраний з ряду: CR4=CR5, C(CH)4C, де R4, R5 = Η, Alk, Аr; A, R' = алкілен, аралкілен, арилен; R" = Alk; X = галоген, CH3SO4 Схема 1 Вихідні 3,3'-біс-1,2,4-триазоли одержують шляхом рециклізації відповідних біс-1,3,4оксадіазолів з анілінами згідно з методикою роботи (Коротких Н. И., Киселев А. В., Книшевицкий А. В., Раенко Г. Ф., Пехтерева Т. М., Швайка О. П. // ХГС - 2005. - № 7. - С 1026). Біс(імідазол-1іл)и та біс(бензімідазол-1-іл)и отримано шляхом алкілування імідазолів і бензімідазолів в лужному середовищі в присутності четвертинних амонієвих солей згідно з відомою методикою (Короткіх М. І., Марічев К. О., Кисельов А. В., Швайка О. П. // Ukrai-nicabioorganica acta. - 2008. Т. 6, № 2 - С. 22). Солі (3а)-(5а), (9а), (10а) для отримання карбенів (3)-(5), (9), (10) синтезовано шляхом реакції N-незаміщених азолів з алкілуючими агентами в присутності основ (В - ацетат натрію, карбонат калію) в спиртах, оцтовій кислоті, ацетонітрилі, диметилформаміді або диметилсульфоксиді за відомою методикою (Раенко Г. Ф., Коротких Н. И., Пехтерева Т. М., Швайка О. П. // Журн. орг. хим. - 2001. - Т. 37, в. 8. - С. 1212-1216) (загальна схема 2, приклад 4). R N N R1 20 25 де R2, R3 складають двовалентний радикал, вибраний з ряду: CR4=CR5, C(CH)4C, де R4, R5 = Η, Alk, Аr, R = СН3, Bn, Ad; В - основа (NaOAc, K2CO3); X=MeSO4, Сl, Вr Схема 2 Тропілієву сіль (8) отримано з циклогептатриєну шляхом його нагрівання з пентахлоридом фосфору в тетрахлорметані за відомим способом (Дорофеенко Н. И., Жданов Ю. А., Дуленко В. И., Кривун С. В. Хлорная кислота и ее соединения в органическом синтезе. - Ростов-на-Дону: РГУ.-1965 - С. 32). Синтез нової солі (6а) для одержання карбену (6) здійснено шляхом циклізації 1,3-ді(1-адамантил)амідину (6b) з епіхлоргідрином в присутності перхлорату натрію з наступною дією на одержану 5-гідрокси-5,6-дигідро-4Н-піримідинієву сіль (6с) тіонілхлоридом (схема 3, приклад 2). Ad Ad N N H Ad Cl O 2.X N + Ad N Ad SOCl2 (-) X N + (-) 30 35 Ad X OH (6a) (-) Cl (6c) (6a) N , Схема 3 Вихідний 1,3-ді(1-адамантил)амідин (6b) синтезували шляхом розщеплення циклу 1,4-ді(1адамантил)-1,2,4-триазолієвих солей під дією алкоксидів металів згідно з даними роботи (Короткіх М. І., Кнішевицький А. В., Раєнко Г. Ф., Пехтерева Т. М. // Доп. HAH України. - 2003. № 1. - С. 139). Ациклічну амідинієву сіль (7а) для одержання карбену (7) синтезовано шляхом модифікованої реакції Вільсмайера-Хаака з формілметиламіноадамантану (7b) і метиладамантиламіну в розчині хлороксиду фосфору (схема 4, приклад 3). 9 UA 68789 U O C Ad N CH3 (7b) 5 10 15 20 25 30 35 40 45 50 H 1.POCl3 2.AdNHCH3 3.NaClO4,H2O Ad N N (+) CH3 Ad CH3 ClO4 (-) (7a) , Схема 4 Приклади одержання сполук відповідно до корисної моделі. 1 Спектри протонного ядерного магнітного резонансу ( H ЯМР) знімали на спектрометрі Bruker 13 Avance II 400 (400 МГц) з використанням стандарту Me4Si ( 0,00). Вуглецеві спектри С ЯМР (100 МГц) знімали на спектрометрі Bruker Avance II 400 (400 МГц) з використанням стандарту Me4Si ( 0,00). Позначення в спектрах ЯМР: с - синглет, д - дублет, м - мультиплет. Отримання вихідних солей для генерації або синтезу стабільних карбенів. Приклад 1. Одержання 1-n-бромбензил-3-феніл-4-n-бромфеніл-1,2,4-триазолій броміду (2а). Розчин 2 г (6,7 ммоль) 4-n-бромфеніл-1,2,4-триазолу (1b) і 1,67 г (6,7 ммоль) nбромбензилброміду у 3 мл диметилформаміду нагрівали при 80 С протягом 8 год. Отриманий осад відфільтровували, промивали сумішшю петролейного етеру і ізопропанолу (3:1), сушили. Вихід 2,91 г (79 %) солі (1а). Т. пл. 221-223 °C (диметилформамід). Знайдено, %: С 46,1; Η 2,8; 1 Br 43,7; Ν 7,5. С21Н16Вr3N3. Обчислено, %: С 45,9; Η 2,9; Br 43,6; Ν 7,6. Спектр H ЯМР (DMSOd6), , м.ч.: 5,81 д (2Н, CH2N), 7,34-7,74 м (11Н), 7,88 д (2Н, J8,58 Гц)(Аr), 10,83 с (1H, CHN). Приклад 2. Одержання 1,3-ді(1-адамантил)-5-хлоро-5,6-дигідро-4H-піримідиній перхлорату (6а). Стадія 1. Одержання 1,3-ді(1-адамантил)-5-гідрокси-5,6-дигідро-4H-піримідиній перхлорату (6b). Розчин 5 г (16,03 ммоль) 1,3-ді(1-адамантил)-формамідину (6с) кип'ятили протягом 20 хв. з 12,35 мл (160,3 ммоль) епіхлоргідрину. Реакційну масу охолоджували, кристали розтирали з 2530 мл етеру, відфільтровували, промивали етером, сушили. Вихід хлоридної солі 5,58 г (86 %). Отриманий хлорид переводили в перхлорат (6b) осадженням з гарячого водного розчину надлишком перхлорату натрію (6а). Вихід перхлоратної солі 6,47 г (86 %). Т. пл. 247-249 °C (етилцелозольв). Знайдено, %: С 61,4; Η 8,0; Сl 7,4; N 6,2. С24Н37ClN2О5. Обчислено, %: С 61,5; 1 Η 8,0; Сl 7,6; N 6,0. Спектр H ЯМР (DMSO-d6), , м.ч.: 1,65 (м, 12Н), 1,82-1,87 (м, 6Н), 1,97 (м, 2 6Н), 2,16 (м, 6Н) (Ad); 3,31 (д, 4Н, CH2N), 3,48 (д, 4Н, CH2N)(J 12,0 Гц); 4,27 (м, 1H, СНО); 5,39 (м, 1H, ОН); 7,77 (с, 1H, CHN). Стадія 2. Одержання 1,3-ді(1-адамантил)-5-хлоро-5,6-дигідро-4H-піримідиній перхлорату (6а). Розчин 2,6 г (6,43 ммоль) 1,3-ді(1-адамантил)-5-гідрокси-5,6-дигідро-4H-піримідиній хлориду (6b) в 4,2 мл (57,87 ммоль) тіонілхлориду кип'ятили протягом 1,5 год. Надлишок тіонілхлориду відганяли, залишок розтирали з гексаном (3 × 10-12 мл) і декантували гексановий розчин. Отриману олію сушили при кімнатній температурі, додавали до нього 250 мл води та після додавання невеликих порцій активованого вугілля водний розчин фільтрували. Продукт осаджували з води надлишком перхлорату натрію. Вихід солі (6а) 2,53 г (96 %). Т. пл. 273-274 °C (етилцелозольв). Знайдено, %: С 59,3; Η 7,5; Br 14,4; Ν 5,8. С24Н36Cl2N2О4. Обчислено, %: С 1 59,1; Η 7,4; Br 14,6; Ν 5,8. Спектр H ЯМР (DMSO-d6), , м.ч.: 1,65 (м, 12Н), 1,86 (м, 6Н), 2,00 (м, 2 6Η), 2,16 (м, 6Η) (Ad); 3,67 (д, 2Η, CH2N), 3,88 (д, 2Н, CH2N) (J 14,4 Гц); 5,06 (м, 1H, СНСl); 7,86 (с, 1Н, CHN). Приклад 3. Одержання 1,3-диметил-1,3-ді(1-адамантил)формамідиній перхлорату (7а). До розчину 1 г (5,18 ммоль) N-метил-N-(1-адамантил)формаміду в 2,5 мл бензену додавали по краплях протягом 10 хв. розчин 0,47 мл (5,18 ммоль) хлороксиду фосфору у 2,5 мл бензену й перемішували 40 хв. До реакційної маси додавали розчин 0,85 г (5,18 ммоль) N-метил-N-(1адамантил)аміну в 3 мл бензену й залишали суміш при кімнатній температурі на 16 год., після чого реакційну суміш кип'ятили 4 хв., бензен випаровували, залишок сушили в вакуумі при 90 °C протягом 1 год. Охолоджену олію промивали декілька разів невеликими порціями гексану й декантували гексановий розчин. Промитий гексаном продукт розчиняли в 50 мл киплячої води, після додавання невеликої порції активованого вугілля розчин солі фільтрували. Отриманий продукт осаджували з води надлишком перхлорату натрію, відфільтровували, сушили. Вихід солі (7а) 1,37 г (60 %). Т. пл. 229-231 °C (етилцелозольв). Знайдено, %: С 62,4; Η 8,6; Сl 8,1; Ν 1 6,4. C23H37ClN2O4 Обчислено, %: С 62,6; Η 8,5; Сl 8,0; Ν 6,4. Спектр H ЯМP (DMSO-d6), , мл.: 13 1,66 (м, 12Н), 1,96 (м, 12Н), 2,16 (м, 6Н) (Ad); 3,19 (с, 6Н, СН3); 7,80 (с, CHN). С ЯМР (DMSO-d6), , м.ч.: 28,7; 34,5; 39,1; 39,5; 61,6 (Ad); 32,7 (CH3N); 153,7 (CHN). 10 UA 68789 U 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 4. Одержання 1,3-ді(1-адамантил)-4,5-дифенілімідазолій броміду (10а). Суміш 3,3 г (15 ммоль) 4,5-дифенілімідазолу, 6,45 г (30 ммоль) 1-бромадамантану та 0,61 г (15 ммоль) гідриду кальцію кип'ятили в 3 мл о-дихлорбензену 4 год., додавали 1 г (4,65 ммоль) 1бромадамантану й продовжували кип'ятіння протягом 4 год. Реакційну суміш охолоджували до 80 °C й фільтрували в гарячому стані. Осад промивали 10 мл гарячого (біля 80 °C) ацетонітрилу. Об'єднані фільтрати випаровували досуха, осад розтирали з 10 мл петролейного етеру й відфільтровували. Вихід 4 г. Після перекристалізації з води з додаванням 5 % оцтової кислоти одержували 2,5 г (78 %) бромідної солі, яку переводили в перхлорат (10а) дією надлишку перхлорату натрію в водному розчині. Т. пл. 274-276 °C (етилцелозольв-вода, 4:1). Знайдено, %: С 74,1; Η 7,0; Br 13,8; Ν 5,1. С35Н41ВrN2. Обчислено, %: С 73,8; Η 7,3; Br 14,0; Ν 1 4,9. Спектр H ЯМР (DMSO-d6), , м.ч.: 1,54 (м, 12Н), 2,08 (м, 6Н), 2,16 (м, 12Н) (1-Ad); 7,25-7,50 (м, 10Н) (Аr); 8,92 (с, 1H, CHN). Приклад 5. Одержання 1,1'-диметил-1,4-біс-(1-імідазоліо)бутану перхлорату (12а). До розчину 0,3 г (1,58 ммоль) 1,4-ді(1-імідазоліл)бутану в 2 мл ацетонітрилу при перемішуванні додавали 0,4 г (3,16 ммоль) диметилсульфату. Реакційну суміш кип'ятили протягом 4 год., розводили 5 мл ацетонітрилу, додавали 0,4 г (3,16 ммоль) перхлорату натрію. Осад метил сульфату натрію, що утворився, відфільтровували. Маточний розчин концентрували до 2 мл, а перхлорат бісазолію осаджували 10 мл етеру. Вихід солі (4.2) 0,5 г (76 %). Тпл 85-88 °C. Знайдено, %: С 34,6, Η 4,7, Сl 16,8, N 13,4. С12Н20Cl2N4O8. Обчислено, %: С 34,4, Η 4,8, Сl 16,9, 1 Ν 13,4. H ЯМР (DMSO-d6), , м.ч.: 1.76 (с, 4Н, СН2С), 3,90 (с, 6Н, CH3N), 4,19 (с, 4Н, CH2N), 7,21 4,5 2 (д, 4Н, С Н, J 9,6 Гц), 9,05 (с, 2Н, С Н). Приклад 6. Одержання 3,3'-диметил-n-ксиліленді(1-імідазолій) перхлорату (13а). Стадія 1. Одержання и-ксилілен-1,1'-діімідазолу (13b). До реакційної суміші, яка містить 1,55 г (22,8 ммоль) імідазолу, 6,85 г (170 ммоль) гідроксиду натрію, 0,26 г (1.14 ммоль) триетилбензиламоній хлориду й 7 мл води при перемішуванні додавали розчин 2 г (11,4 ммоль) n-ксилілендихлориду в 10 мл ацетонітрилу. Суміш перемішували при 50 °C протягом 3 год. Утворювалася густа кристалічна маса. Продовжували нагрівання протягом 4 год. Реакційну суміш після охолодження обробляли 50 мл води. Осад відфільтровували й промивали 50 мл води й сушили. Вихід 2,3 г (85 %). Т. пл. 133-136 °C (толуен). Знайдено, %: С 70,4, Η 6,0, Ν 23,3. 1 C14H14N4. Обчислено, %: С 70,6, Η 5,9, Ν 23,5. H ЯМР (CDCl3), , м. д.: 5,10 с (CH2N), 6,88 с 4,5 2 (С Н), 7,13 м (Аr), 7,52 с (C HN). Стадія 2. Одержання 3,3'-диметил-n-ксиліленді(1-імідазолій) перхлорату (13а). До розчину 0,8 г (3,36 ммоль) n-ксилілен-1,1'-діімідазолу (13b) в 20 мл ацетонітрилу по краплях додавали 0,85 г (6,72 ммоль) диметилсульфату при охолодженні. Перемішували додатково 20 хв. при кімнатній температурі, потім кип'ятили протягом 4 год. Ацетонітрил випаровували, олієподібний продукт розчиняли в гарячій воді, додавали невелику кількість активованого вугілля, фільтрували та додавали 0,83 г (6,72 ммоль) перхлорату натрію. Отриманий осад відфільтровували. Вихід 0,93 г (59 %). Тпл 222-225 °C. Знайдено, %: С 40,7; Η 4,1; Сl 15,7; N 12,0. 1 C16H20Cl2N4O8. Обчислено, %: С 41,1; Η 4,3; Сl 15,2; Ν 12,0. Спектр H ЯМР (DMSO-d6), , м.ч.: 3,86 с (CH3N), 5,43 с (CH2N), 7,48 с (4Н), 7,69 с (2Н), 7,75 с (1H)(Аr), 9,18 с (2Н, CHN). Приклад 7. Одержання полі-,-1,4-ксилілен-4,4'-дипіридиній перхлорату (14а). Суміш 1,35 г (8,65 ммоль) 4,4'-дипіридилу й 1,5 г (8,65 ммоль) ,-1,4-ксилілендихлориду нагрівали в розплаві протягом 1 год. Потім додавали 5 мл диметилформаміду й нагрівали протягом 8 год. Осад, що випадав, відфільтровували, промивали 5 мл диметилформаміду, потім 20 мл діетилового етеру. Сіль із хлоридним аніоном розчиняли у воді, фільтрували з активованим вугіллям і обробляли 2,2 г (17,3 ммоль) перхлорату натрію. Перхлоратну сіль відфільтровували й сушили при 120 °C. Вихід 2,8 г (74 %). Тпл> 300 °C. Знайдено, %: С 47,4; Η 3,3; Сl 15,1; N 6,2. 1 C18H16Cl2N2O8. Обчислено, %: С 47,1; Η 3,5; Сl 15,4; Ν 6,1. Спектр H ЯМР (DMSO-d6), , м.ч.: 5,95 с (4Н, CH2N), 7,70 с (4Н), 8,64 с (1H), 8,73 с (3Н) (Аr), 9,33 с (1Н), 9,47 с (3Н) (CHN). Приклад 8. Одержання полі-[,-1,4-ксилілен-1,4-ді(1-імідазоліо-3,3'-діїл)-бензену] перхлорату (15а). Суміш 0,5 г (2,38 ммоль) 1,4-ді(1-імідазоліл)-бензену й 0,42 г (2,38 ммоль) ,1,4-ксилілендихлориду кип'ятили в 2 мл диметилформаміду протягом 2 год., в ході чого вже після 10 хв. кип'ятіння утворювався осад. Продукт відфільтровували, промивали 3 мл диметилформаміду й 15 мл діетилового етеру. Розчиняли в 20 мл води та додавали еквівалентну кількість перхлорату натрію. Осад перхлорату (15а) відфільтровували та сушили при 120 °C. Вихід 1,22 г (100 %). Тпл> 300 °C. Знайдено, %: С 46,6; Η 3,5; Сl 14,1; N 10,9. 1 C20H18Cl2N4O8. Обчислено, %: С 46,8; Η 3,5; Сl 13,8; Ν 10,9. Спектр H ЯМР (DMSO-d6), , м.ч.: 5,76 с (4Н, CH2N), 7,65 с (4Н), 8,07 с (1H), 8,14 с (3Н), 8,44 с (1Н) (Аr), 10,11 с (1Н, CHN). Приклад 9. Одержання полімеру n-ксиліленімідазолій перхлорату (16а). Суміш 0,3 г (1,26 ммоль) n-ксилілен-1,1'-діімідазолу (13b) та ,-1,4-ксилілендихлориду нагрівали в розплаві при 11 UA 68789 U 5 10 15 20 25 30 150 °C протягом 1 год. Потім додавали 2 мл диметилформаміду й нагрівали при 150 °C протягом 8 год. Диметилформамід розводили діетиловим етером і декантували. Далі полімерну сіль з хлоридним аніоном (X = Сl) розчиняли в воді й обробляли перхлоратом натрію. Перхлоратну сіль відфільтровували й сушили при 120 °C. Вихід 0,5 г (74 %). Тпл 256-258 °C. Знайдено, %: С 48,9; Η 4,2; Сl 13,0; N 10,5. C11H11ClN2O4. Обчислено, %: С 48,8; Η 4,1; Сl 13,1; N 1 4,5 2 10,4. H ЯМР (DMSO-d6), , м.ч.: 5,44 с (CH2N), 7,49 м (Аr), 7,78 с (С Н), 9,37 с (C HN). Mw 68800, Mn 63100, Mw/Mn 1.09. Приклад 10. Методика генерації карбену (1)-(16). До розчину 0,022 ммоль солі (1а)-(16а) в 90 мл метанолу додавали 0,00154 г (0,022 ммоль) метоксиду калію й перемішували розчин протягом 0,5 год. В ході реакції відбувається генерація карбену та перехід його у зв'язану форму (Н-аддукт зі спиртом або. мезо-метоксиазолін). Отриманий розчин придатний для проведення трансестерифікації. Замість солі у випадку сполук (1) та (11) додавали стабільні карбени, що синтезували згідно з методиками робіт (1. Korotkikh N. I., Glinyanaya Ν. V., Cowley Α. Η., Moore J. Α., Knishevitsky Α. V., Pekhtereva Τ. Μ., Shvaika Ο. P. // ARKIVOC - 2007. - V. 16. P. 156-172; 2. Kiselyov A. V., Korotkikh N. I., Cowley A. H. Moore J. A., Pekhtereva T. M., Shvaika O. P. // ARKIVOC - 2008. - V. 15. - P. 329-342) відповідно. Результати з каталізу реакції в обох випадках (при генерації карбенів з солей in situ та з самих карбенів) були однаковими. Приклад 11. Методика проведення каталітичної реакції. До розчину, що містить зв'язану форму карбену (приклад 10) додавали 3,1 мл (22 ммоль) етилбензоату і перемішували при кімнатній температурі від 0,33 до 4 год. (див. таблицю). Аналогічно до розчину, що містить зв'язану форму карбену (приклад 10) додавали соняшникову олію (пор. № 23 таблиці), розраховуючи кількість олії зі вмісту в ній естерних груп (0,0033 ммоль каталізатора на 10 ммоль естерної групи) і перемішували протягом 4 год. В обох випадках розчин розводили 10 мл діетилового етеру або бензену, додавали 0,05 л води, перемішували протягом 5 хв. і водний шар відділяли. До органічного шару додавали 1 г безводного сульфату натрію, перемішували протягом 15 хв., сіль відфільтровували, промивали етером або бензеном. Розчинник випаровували, а залишок переганяли в вакуумі. Таким чином отримували метилбензоат (при використанні етилбензоату) або суміш метилових естерів жирних кислот (при використанні олії). Склад основних компонентів суміші метилових естерів жирних кислот за 1 даними Н ЯМР спектроскопії у випадку використання соняшникової олії - 75 % метиллінолеату і 23 % метилолеату. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 35 1. Карбени загальної формули (L)n, де L - карбенова ланка, вибрана з ряду (І-VI): 1,3,4-тризаміщений 1,2,4-триазол-5-іліден загальної формули R1 N N N R R2 40 , (I), де R, R1, R2 означає алкіл, арил, гетерил, 1,3-дизаміщений імідазол-2-іліден загальної формули R N N R1 , (II), де R, R1 означає алкіл, арил, гетерил, 1,3-дизаміщений бензімідазол-2-іліден загальної формули 12 UA 68789 U R N N R1 , (III), де R, R1 означає алкіл, арил, гетерил, 1,3-дизаміщений 5,6-дигідро-4Н-піримідин-2-іліден загальної формули N R 5 N R , (IV), де R, R1 означає алкіл, арил, гетерил, 1,1,3,3-тетразаміщений діамінокарбен загальної формули R R1 N R2 N R3 , (V), де R, R1, R2, R3 означає алкіл, арил, гетерил, незаміщений циклогептатриєніліден формули, 10 , (VI), n дорівнює 1. 2. Карбени за п. 1, де L - біскарбенова ланка, вибрана з ряду (VII-VIII): 1,3,4-тризаміщений біс-1,2,4-триазол-5-іліден загальної формули R R N N N N N N A R1 15 , (VII), де R, R1 означає алкіл, арил, гетерил, А означає арилен, алкілен. 1,3-дизаміщений бісімідазол-2-іліден загальної формули R 20 N N A N N R , (VIII), де R означає алкіл, арил, гетерил, А означає алкіленовий або аралкіленовий двовалентний радикал, n дорівнює 1. 3. Карбени за п. 1, де L - карбенова ланка, вибрана з ряду (ІХ-ХІ): 1,3-дизаміщений імідазол-2-іліден загальної формули N 25 R1 N A , (IX), де А аралкіленовий двовалентний радикал в полімерному ланцюгу, n дорівнює 70-400, 13 UA 68789 U 1,3-дизаміщений бісімідазол-2-іліден загальної формули N 5 N A N N B , (X), де А означає алкіленовий або ариленовий двовалентний радикал, В означає аралкіленовий двовалентний радикал в полімерному ланцюгу, n дорівнює 70-400, біспіридин-2-іліден загальної формули A N N , (XI), 10 де А означає двовалентний аралкіленовий радикал А в полімерному ланцюгу, n дорівнює 70-400. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюCarbenes
Автори англійськоюKorotkikh Mykola Ivanovych, Marichev Kostyantyn Oleksandrovich, Kyselov Artem Viktorovych, Knishevits'kiy Artur Volodymyrovich, Hlyniana Natalia Valeriivna, Popov Anatiliy Fedorovich, Shvaika Oleksii Pavlovych
Назва патенту російськоюКарбены
Автори російськоюКоротких Николай Иванович, Маричев Константин Александрович, Киселев Артем Викторович, Книшевицкий Артур Владимирович, Глиняна Наталия Валериевна, Попов Анатолий Федорович, Швайка Алексей Павлович
МПК / Мітки
МПК: C07C 13/24, C07D 249/00, C07D 235/00, C07D 211/00, C07D 239/00, C07D 233/00, C07C 209/00
Мітки: карбени
Код посилання
<a href="https://ua.patents.su/16-68789-karbeni.html" target="_blank" rel="follow" title="База патентів України">Карбени</a>
Попередній патент: Пустотіле долото
Наступний патент: Спосіб дроблення агломерату ударом в одновалковій зубчастій дробарці
Випадковий патент: Сенсорний пристрій для визначення місцеположення та центра ваги об'єкта












