Застосування гетероаренкарбоксамідів як дофамін-d3 лігандів для лікування захворювань центральної нервової системи
Формула / Реферат
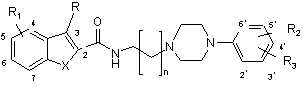
1. Сполука формули (І)
 , (I)
, (I)
де
n дорівнює 1-4, і
R є воднем, алкілом або галогеном, і
(а) X являє собою О або S:
(1) коли R1 являє собою гідрокси, алкілокси, алкеніл, алкініл, арил, ацил, алкоксикарбоніл або ціано, кожний з R2 і R3 незалежно вибраний з водню, гідрокси, алкілокси, алкілу, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу і ціано,
(2) коли R1 являє собою водень, алкіл, галоген або трифторметил, R2 вибраний з гідрокси, алкенілу, алкінілу, арилу, ацилу, алкоксикарбонілу і ціано, і R3 вибраний з водню, гідрокси, алкілокси, алкілу, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу і ціано,
або
(б) X являє собою NH:
R1 вибраний з водню, гідрокси, алкілу, алкілокси, алкенілу, алкінілу, арилу, трифторметилу, ацилу, алкоксикарбонілу, галогену і ціано, і кожний з R2 і R3 незалежно вибраний з водню, гідрокси, алкілокси, алкілу, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу і ціано, за умови, що n = 3 і ця сполука не є N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2-індолілкарбамідом,
або
(в) X являє собою Те:
R1 вибраний з водню, гідрокси, алкілу, алкілокси, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу і ціано, і кожний з R2 і R3 незалежно вибраний з водню, гідрокси, алкілокси, алкілу, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу і ціано, причому групи алкіл, алкеніл, алкініл і арил незалежно одна від одної можуть бути заміщеними,
і фармацевтично прийнятні солі цієї сполуки.
2. Сполука за п. 1, де
n дорівнює 1-4, і
X являє собою Те, коли R є воднем, алкілом або галогеном, і R1 вибраний з радикалів водню, гідрокси, алкілу, алкілокси, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу і ціано, i R2 і R3 окремо або одночасно вибрані з радикалів водню, гідрокси, aлкілокси, алкілу, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу та ціано,
або
n = 1-4, та
X являє собою S або О, коли R є воднем, алкілом або галогеном, і R1 вибраний з радикалів гідрокси, алкілокси, алкенілу, алкінілу, арилу, ацилу, алкоксикарбонілу та ціано, і R2 i R3 окремо або одночасно вибрані з радикалів водню, гідрокси, алкілокси, алкілу, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу та ціано,
або
n = 1-4, та
X являє собою S або О, коли R є воднем, алкілом або галогеном, і R1 вибраний з радикалів водню, алкілу, галогену та трифторметилу, і R2 i R3 окремо або одночасно вибрані з радикалів гідрокси, алкенілу, алкінілу, арилу, ацилу, алкоксикарбонілу або ціано,
або
n = 3, та
X являє собою NH, коли R є воднем, алкілом або галогеном, і R1 вибраний з радикалів гідрокси, алкілу, алкілокси, алкенілу, алкінілу, арилу, трифторметилу, ацилу, алкоксикарбонілу та ціано, при цьому алкіл i алкілокси містять щонайменше два атоми вуглецю, і R2 і R3 окремо або одночасно вибрані з радикалів водню, гідрокси, алкілокси, алкілу, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу і ціано, при цьому алкілокси містить щонайменше два атоми вуглецю.
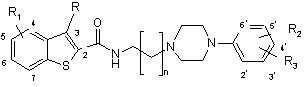
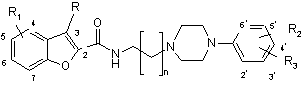
3. Сполука за п. 1, що має загальну формулу (Іа) або (Ib)
 , (Ia)
, (Ia)
 , (Ib)
, (Ib)
де:
n дорівнює 1-4,
R є воднем, С1-С6-алкілом або галогеном,
коли R1 являє собою гідрокси, С1-С6-алкілокси, С2-С6-алкеніл, С2-С6-алкініл, феніл, що необов’язково може бути заміщений метоксигрупою або галогеном, C1-C6-ацил, С1-С6-алкоксикарбоніл або ціано, кожний з R2 і R3 незалежно вибраний з водню, гідрокси, С1-С6-алкілокси, С1-С6-алкілу, С2-С6-алкенілу, С1-С6-алкінілу, фенілу, що необов’язково може бути заміщений метоксигрупою або галогеном, галогену, трифторметилу, С1-С6-ацилу, С1-С6-алкоксикарбонілу і ціано,
коли R1 являє собою водень, С1-С6-алкіл, галоген або трифторметил, R2 вибраний з гідрокси, С2-С6-алкенілу, С2-С6-алкінілу, фенілу, що необов’язково може бути заміщений метоксигрупою або галогеном, С1-С6-ацилу, С1-С6-алкоксикарбонілу і ціано, і R3 вибраний з водню, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2-С6-алкенілу, С2-С6-алкінілу, фенілу, що необов’язково може бути заміщений метоксигрупою або галогеном, галогену, трифторметилу, С1-С6-ацилу, С1-С6-алкокси карбонілу і ціано, причому групи С1-С6-алкіл, С2-С6-алкеніл і С2-С6-алкініл незалежно одна від одної необов’язково можуть бути заміщеними,
і її фармацевтично прийнятні солі.
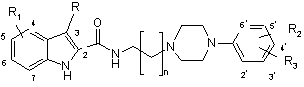
4. Сполука за п. 1 загальної формули (Іс):
 , (Ic)
, (Ic)
де:
n дорівнює 1-3,
R є воднем, С1-С6-алкілом або галогеном,
R1 вибраний з водню, гідрокси, С1-С6-алкілу, С1-С6-алкокси, С2-С6-алкенiлу, С2-С6-алкінілу, фенілу, що необов’язково може бути заміщений метоксигрупою або галогеном, трифторметилу, С1-С6-ацилу, С1-С6-алкоксикарбонілу, фтору, хлору, брому і ціано,
кожний з R2 і R3 незалежно вибраний з водню, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2-С6-алкенілу, С2-С6-алкінілу, фенілу, що необов’язково може бути заміщений метоксигрупою або галогеном, галогену, трифторметилу, С1-С6-ацилу, С1-С6-алкоксикарбонілу і ціано,
причому групи С1-С6-алкіл, С2-С6-алкеніл і С2-С6-алкініл незалежно одна від одної можуть бути заміщеними,
і фармацевтично прийнятні солі цієї сполуки, за умови, що ця сполука не є N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2-індолілкарбамідом.
5. Сполука за п. 4, де
(а) коли R1 являє собою гідрокси, С2-С6-алкеніл, С2-С6-алкініл, феніл, що необов’язково може бути заміщений метоксигрупою або галогеном, трифторметил, С1-С6-ацил, С1-С6-алкоксикарбоніл або ціано, кожний з R2 і R3 незалежно вибраний з водню, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2-С6-алкенілу, С2-С6- алкiніл, фенілу, що необов’язково може бути заміщений метоксигрупою або галогеном, галогену, трифторметилу, С1-С6-ацилу, С1-С6-алкоксикарбонілу і ціано,
та
(б) коли R1 являє собою водень, С1-С6-алкіл, С1-С6-алкілокси або галоген, R2 вибраний з гідрокси, С2-С6-алкенілу, С2-С6-алкінілу, фенілу, що необов’язково може бути заміщений метоксигрупою або галогеном, С1-С6-ацилу, С1-С6-алкоксикарбонілу і ціано, і R3 вибраний з водню, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2-С6-алкенілу, С2-С6-алкінілу, фенілу, що необов’язково може бути заміщений метоксигрупою або галогеном, галогену, трифторметилу, С1-С6-ацилу, С1-С6-алкоксикарбонілу і ціано,
причому групи С1-С6-алкіл, С2-С6-алкеніл і С2-С6-алкініл незалежно одна від одної можуть бути заміщеними,
і фармацевтично прийнятні солі цієї сполуки.
6. Сполука за будь-яким з попередніх пунктів, де
замісник R1 знаходиться в положенні 5 або 6 гетероциклу, і
замісники R2 і R3 знаходяться відповідно в положеннях 2 або 3 або відповідно в положеннях 2 або 4 фенільного кільця, i у випадку, коли один з двох замісників R2 і R3 є атомом водню, відповідний iнший замісник знаходиться в положенні 2 фенільного кільця.
7. Сполука за будь-яким з попередніх пунктів, де n дорівнює 3.
8. Сполука загальної формули (IV):
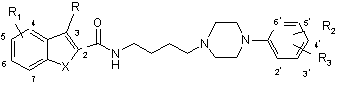 , (IV)
, (IV)
де:
X являє собою S, NH або О,
R вибраний з водню, С1-С6-алкілу, фтору, хлору і брому,
R1 вибраний з водню, С1-С6-алкокси, С1-С6-алкілу, фтору, хлору, брому, трифторметилу і ціано, причому R1 знаходиться в положенні 5 або 6 гетероциклу,
R2 і R3 незалежно вибрані з водню, С1-С6-алкілокси, С1-С6-алкілу, фтору, хлору, брому і трифторметилу, причому R2 і R3 знаходяться відповідно в положеннях 2 або 3 або відповідно в положеннях 2 або 4 фенільного кільця, й у випадку, коли один з двох замісників R2 і R3 є атомом водню, відповідний інший замісник знаходиться в положенні 2 фенільного кільця,
причому С1-С6-алкільні групи незалежно одна від одної є можливо заміщеними, і фармацевтично прийнятні солі цієї сполуки за умови, що ця сполука не є N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2-індолілкарбамідом.
9. Сполука за п. 8, де:
коли X являє собою NH, тоді R1 вибраний з водню, С1-С3-алкілокси, С1-С3-алкілу, фтору, хлору, брому і ціано, і
коли X являє собою S або О, тоді R1 вибраний з водню, С1-С3-алкілу, фтору, хлору, брому, ціано і трифторметилу.
10. Сполука за п. 8, яку вибирають з:
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5-ціано-2-бензо[b]тіофенілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5-ціано-2-бензо[b]тіофенілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-6-ціано-2-бензо[b]тіофенілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-6-ціано-2-бензо[b]тіофенілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2-бензо[b]тіофенілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-2-бензо[b]тіофенілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5-бром-2-бензо[b]тіофенілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5-бром-2-бензо[b]тіофенілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-2-індолілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5-ціано-2-індолілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5-бром-2-індолілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-6-ціано-2-індолілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5-бром-2-індолілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-6-ціано-2-індолілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5-ціано-2-індолілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5-ціано-2-бензо[b]фуранілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2-бензо[b]фуранілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-2-бензо[b]фуранілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5-бром-бензо[b]фуранілкарбаміду,
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5-бром-2-бензо[b]фуранілкарбаміду,
N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2-бензо[b]телурофенілкарбаміду і
N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-2-бензо[b]телурофенілкарбаміду,
і її фармацевтично прийнятні солі.
11. Терапевтичний агент, що містить одну або більше сполук за будь-яким з попередніх пунктів.
12. Терапевтичний агент за п. 11, що додатково містить L-ДОФА, для одночасного або послідовного введення пацієнтові.
13. Застосування сполуки за будь-яким з пп. 1-10 для приготування терапевтичного агента для лікування або попередження пристрасті до кокаїну, алкоголю, опіатів і нікотину, нейродегенеративних розладів, зокрема хвороби Паркінсона, сексуальної дисфункції, депресії або шизофренії.
14. Застосування сполуки за будь-яким з пп. 1-10 для приготування терапевтичного агента для лікування або попередження гіперпролактинемії, гіперпролактиноми, глаукоми, когнітивних розладів, синдрому неспокійних ніг, синдрому гіперактивності (ADHS), порушень локомоції, пов’язаних із хворобою Паркінсона, L-ДОФА-індукованих розладів, синдрому Сегави, пізніх порушень локомоції, а також для медикаментозної аблактації після вагітності.
15. Застосування за п. 14, де терапевтичний агент призначений для лікування або попередження синдрому Сегави, спонтанної дискінезії або дистонії, пов’язаної з хворобою Паркінсона, або пізньої або L-ДОФА-індукованої дискінезії або дистонії.
16. Застосування сполуки загальної формули (III):
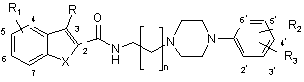 , (III)
, (III)
де:
n дорівнює 1-4, і X являє собою S, О або NH, коли R є воднем, алкілом або галогеном, і R1 вибраний з радикалів водню, алкілу, галогену, трифторметилу, і кожний з R2 і R3 окремо або одночасно вибраний з радикалів водню, гідрокси, алкілокси, алкілу, алкенілу, алкінілу, арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу та ціано, для приготування фармацевтичного агента для лікування або попередження пристрасті до кокаїну, алкоголю, опіатів і нікотину, нейродегенеративних розладів, зокрема хвороби Паркінсона, або сексуальної дисфункції.
17. Застосування за п. 16 для приготування терапевтичного агента для лікування або попередження депресії або шизофренії.
18. Застосування за п. 16 для приготування терапевтичного агента для лікування або попередження гіперпролактинемії, гіперпролактиноми, глаукоми, когнітивних розладів, синдрому неспокійних ніг, синдрому гіперактивності (ADHS), порушень локомоції, пов’язаних із хворобою Паркінсона, L-ДОФА-індукованих розладів, синдрому Сегави, пізніх порушень локомоції, а також для медикаментозної аблактації після вагітності.
19. Застосування за п. 18, де терапевтичний агент використовують для лікування або попередження синдрому Сегави, спонтанної дискінезії або дистонії, пов’язаної з хворобою Паркінсона, або пізньої або L-ДОФА-індукованої дискінезії або дистонії.
20. Застосування за будь-яким з пп. 16-19, де
R вибраний з водню, С1-С6-алкілу, фтору, хлору і брому,
R1 вибраний з водню, С1-С6-алкокси, С1-С6-алкілу, фтору, хлору, брому і трифторметилу, і
кожний з R2 і R3 незалежно вибраний з водню, С1-С6-алкокси, С1-С6-алкілу, фтору, хлору, брому і трифторметилу,
причому С1-С6-алкільні групи також необов’язково можуть бути заміщеними.
21. Застосування за будь-яким з пп. 16-20, де
замісник R1 знаходиться в положенні 5 або 6 гетероциклу, і
замісники R2 і R3 знаходяться відповідно в положеннях 2 або 3 або відповідно в положеннях 2 або 4 фенільного кільця, й у випадку, коли один з двох замісників R2 і R3 є атомом водню, відповідний інший замісник знаходиться в положенні 2 фенільного кільця.
22. Застосування за будь-яким з пп. 16-21, де сполука являє собою N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2-індолілкарбамід.
23. Спосіб одержання сполуки загальної формули (І), (III) або (IV), як вони визначені вище, що включає взаємодію сполуки загальної формули (А) в активованій формі, зокрема у формі галіду карбонової кислоти,
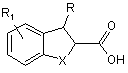 , (A)
, (A)
зі сполукою загальної формули (В):
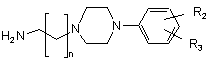 , (B)
, (B)
де n, R, R1 R2 і R3 та X такі, як визначено для загальних формул (І), (ІІІ) і (IV).
Текст
1. Сполука формули (І) 2 (19) 1 (13) (54) ЗАСТОСУВАННЯ ГЕТЕРОАРЕНКАРБОКСАМІДІВ ЯК ДОФАМІН-D3 ЛІГАНДІВ ДЛЯ ЛІКУВАННЯ ЗАХВОРЮВАНЬ ЦЕНТРАЛЬНОЇ НЕРВОВОЇ СИСТЕМИ C2 A61K 31/496 A61K 31/555 A61P 5/24 (2006.01) A61P 15/10 (2006.01) A61P 21/02 (2006.01) A61P 25/00 A61P 25/08 (2006.01) A61P 25/14 (2006.01) A61P 25/16 (2006.01) A61P 25/18 (2006.01) A61P 25/20 (2006.01) A61P 25/22 (2006.01) A61P 25/24 (2006.01) A61P 25/28 (2006.01) A61P 25/32 (2006.01) A61P 25/34 (2006.01) A61P 25/36 (2006.01) A61P 27/06 (2006.01) A61P 35/00 A61P 43/00 C07D 209/42 (2006.01) C07D 307/85 (2006.01) C07D 333/70 (2006.01) C07D 345/00 C07F 17/00 3 81630 4 або 3. Сполука за п. 1, що має загальну формулу (Іа) (б) X являє собою NH: або (Ib) R R1 вибраний з водню, гідрокси, алкілу, алкілокси, R1 , , алкенілу, алкінілу, арилу, трифторметилу, ацилу, 4 O 6 5 R2 3 5 алкоксикарбонілу, галогену і ціано, і кожний з R2 і , N 4 N R3 незалежно вибраний з водню, гідрокси, N 2 R3 6 H алкілокси, алкілу, алкенілу, алкінілу, арилу, S , , n 2 3 7 галогену, трифторметилу, ацилу, , (Ia) алкоксикарбонілу і ціано, за умови, що n = 3 і ця R сполука не є N-4-(4-(2-метоксифеніл)піперазин-1R1 , , 4 O іл)бутил-2-індолілкарбамідом, 6 5 R2 3 5 або , N 4 N (в) X являє собою Те: N 2 R3 6 H O R1 вибраний з водню, гідрокси, алкілу, алкілокси, , , n 2 3 7 алкенілу, алкінілу, арилу, галогену, , (Ib) трифторметилу, ацилу, алкоксикарбонілу і ціано, і де: кожний з R2 і R3 незалежно вибраний з водню, n дорівнює 1-4, гідрокси, алкілокси, алкілу, алкенілу, алкінілу, R є воднем, С1-С6-алкілом або галогеном, арилу, галогену, трифторметилу, ацилу, коли R1 ЯВЛЯЄ собою гідрокси, С1-С6-алкілокси, С2алкоксикарбонілу і ціано, причому групи алкіл, С6-алкеніл, С2-С6-алкініл, феніл, що необов’язково алкеніл, алкініл і арил незалежно одна від одної може бути заміщений метоксигрупою або можуть бути заміщеними, галогеном, C1-C6-ацил, С1-С6-алкоксикарбоніл або і фармацевтично прийнятні солі цієї сполуки. ціано, кожний з R2 і R3 незалежно вибраний з 2. Сполука за п. 1, де водню, гідрокси, С1-С6-алкілокси, С1-С6-алкілу, С2n дорівнює 1-4, і С6-алкенілу, С1-С6-алкінілу, фенілу, що X являє собою Те, коли R є воднем, алкілом або необов’язково може бути заміщений галогеном, і R1 вибраний з радикалів водню, метоксигрупою або галогеном, галогену, гідрокси, алкілу, алкілокси, алкенілу, алкінілу, трифторметилу, С1-С6-ацилу, С1-С6арилу, галогену, трифторметилу, ацилу, алкоксикарбонілу і ціано, алкоксикарбонілу і ціано, i R2 і R3 окремо або коли R1 ЯВЛЯЄ собою водень, С1-С6-алкіл, галоген одночасно вибрані з радикалів водню, гідрокси, або трифторметил, R2 вибраний з гідрокси, С2-С6aлкілокси, алкілу, алкенілу, алкінілу, арилу, алкенілу, С2-С6-алкінілу, фенілу, що необов’язково галогену, трифторметилу, ацилу, може бути заміщений метоксигрупою або алкоксикарбонілу та ціано, галогеном, С1-С6-ацилу, С1-С6-алкоксикарбонілу і або ціано, і R3 вибраний з водню, гідрокси, С1-С6n = 1-4, та алкілу, С1-С6-алкілокси, С2-С6-алкенілу, С2-С6X являє собою S або О, коли R є воднем, алкілом алкінілу, фенілу, що необов’язково може бути або галогеном, і R1 вибраний з радикалів гідрокси, заміщений метоксигрупою або галогеном, алкілокси, алкенілу, алкінілу, арилу, ацилу, галогену, трифторметилу, С1-С6-ацилу, С1-С6алкоксикарбонілу та ціано, і R2 i R3 окремо або алкокси карбонілу і ціано, причому групи С1-С6одночасно вибрані з радикалів водню, гідрокси, алкіл, С2-С6-алкеніл і С2-С6-алкініл незалежно одна алкілокси, алкілу, алкенілу, алкінілу, арилу, від одної необов’язково можуть бути заміщеними, галогену, трифторметилу, ацилу, і її фармацевтично прийнятні солі. алкоксикарбонілу та ціано, 4. Сполука за п. 1 загальної формули (Іс): або R n = 1-4, та R1 , , 4 O 6 X являє собою S або О, коли R є воднем, алкілом 5 R2 3 5 або галогеном, і R1 вибраний з радикалів водню, , N 4 N алкілу, галогену та трифторметилу, і R2 i R3 N 2 R3 6 H N , окремо або одночасно вибрані з радикалів , n 2 3 H 7 гідрокси, алкенілу, алкінілу, арилу, ацилу, , (Ic) алкоксикарбонілу або ціано, де: або n дорівнює 1-3, n = 3, та R є воднем, С1-С6-алкілом або галогеном, X являє собою NH, коли R є воднем, алкілом або R1 вибраний з водню, гідрокси, С1-С6-алкілу, С1-С6галогеном, і R1 вибраний з радикалів гідрокси, алкокси, С2-С6-алкенiлу, С2-С6-алкінілу, фенілу, що алкілу, алкілокси, алкенілу, алкінілу, арилу, необов’язково може бути заміщений трифторметилу, ацилу, алкоксикарбонілу та ціано, метоксигрупою або галогеном, трифторметилу, С1при цьому алкіл i алкілокси містять щонайменше С6-ацилу, С1-С6-алкоксикарбонілу, фтору, хлору, два атоми вуглецю, і R2 і R3 окремо або одночасно брому і ціано, вибрані з радикалів водню, гідрокси, алкілокси, кожний з R2 і R3 незалежно вибраний з водню, алкілу, алкенілу, алкінілу, арилу, галогену, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2-С6трифторметилу, ацилу, алкоксикарбонілу і ціано, алкенілу, С2-С6-алкінілу, фенілу, що необов’язково при цьому алкілокси містить щонайменше два може бути заміщений метоксигрупою або атоми вуглецю. 5 81630 6 галогеном, галогену, трифторметилу, С1-С6-ацилу, відповідно в положеннях 2 або 3 або відповідно в С1-С6-алкоксикарбонілу і ціано, положеннях 2 або 4 фенільного кільця, й у причому групи С1-С6-алкіл, С2-С6-алкеніл і С2-С6випадку, коли один з двох замісників R2 і R3 є алкініл незалежно одна від одної можуть бути атомом водню, відповідний інший замісник заміщеними, знаходиться в положенні 2 фенільного кільця, і фармацевтично прийнятні солі цієї сполуки, за причому С1-С6-алкільні групи незалежно одна від умови, що ця сполука не є N-4-(4-(2одної є можливо заміщеними, і фармацевтично метоксифеніл)піперазин-1-іл)бутил-2прийнятні солі цієї сполуки за умови, що ця індолілкарбамідом. сполука не є N-4-(4-(2-метоксифеніл)піперазин-15. Сполука за п. 4, де іл)бутил-2-індолілкарбамідом. (а) коли R1 являє собою гідрокси, С2-С6-алкеніл, 9. Сполука за п. 8, де: С2-С6-алкініл, феніл, що необов’язково може бути коли X являє собою NH, тоді R1 вибраний з водню, заміщений метоксигрупою або галогеном, С1-С3-алкілокси, С1-С3-алкілу, фтору, хлору, брому трифторметил, С1-С6-ацил, С1-С6-алкоксикарбоніл і ціано, і або ціано, кожний з R2 і R3 незалежно вибраний з коли X являє собою S або О, тоді R1 вибраний з водню, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2водню, С1-С3-алкілу, фтору, хлору, брому, ціано і С6-алкенілу, С2-С6алкiніл, фенілу, що трифторметилу. необов’язково може бути заміщений 10. Сполука за п. 8, яку вибирають з: метоксигрупою або галогеном, галогену, N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5трифторметилу, С1-С6-ацилу, С1-С6ціано-2-бензо[b]тіофенілкарбаміду, алкоксикарбонілу і ціано, N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5та ціано-2-бензо[b]тіофенілкарбаміду, (б) коли R1 являє собою водень, С1-С6-алкіл, С1N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-6С6-алкілокси або галоген, R2 вибраний з гідрокси, ціано-2-бензо[b]тіофенілкарбаміду, С2-С6-алкенілу, С2-С6-алкінілу, фенілу, що N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-6необов’язково може бути заміщений ціано-2-бензо[b]тіофенілкарбаміду, метоксигрупою або галогеном, С1-С6-ацилу, С1-С6N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2алкоксикарбонілу і ціано, і R3 вибраний з водню, бензо[b]тіофенілкарбаміду, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2-С6N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-2алкенілу, С2-С6-алкінілу, фенілу, що необов’язково бензо[b]тіофенілкарбаміду, може бути заміщений метоксигрупою або N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5галогеном, галогену, трифторметилу, С1-С6-ацилу, бром-2-бензо[b]тіофенілкарбаміду, С1-С6-алкоксикарбонілу і ціано, N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5причому групи С1-С6-алкіл, С2-С6-алкеніл і С2-С6бром-2-бензо[b]тіофенілкарбаміду, алкініл незалежно одна від одної можуть бути N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-2заміщеними, індолілкарбаміду, і фармацевтично прийнятні солі цієї сполуки. N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-56. Сполука за будь-яким з попередніх пунктів, де ціано-2-індолілкарбаміду, замісник R1 знаходиться в положенні 5 або 6 N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5гетероциклу, і бром-2-індолілкарбаміду, замісники R2 і R3 знаходяться відповідно в N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-6положеннях 2 або 3 або відповідно в положеннях 2 ціано-2-індолілкарбаміду, або 4 фенільного кільця, i у випадку, коли один з N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5двох замісників R2 і R3 є атомом водню, бром-2-індолілкарбаміду, відповідний iнший замісник знаходиться в N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-6положенні 2 фенільного кільця. ціано-2-індолілкарбаміду, 7. Сполука за будь-яким з попередніх пунктів, де n N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5дорівнює 3. ціано-2-індолілкарбаміду, 8. Сполука загальної формули (IV): N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5R ціано-2-бензо[b]фуранілкарбаміду, R1 , , 6 5 4 O N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2R2 3 5 , N бензо[b]фуранілкарбаміду, N 4 N 2 N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-2R3 6 , H , X 2 3 бензо[b]фуранілкарбаміду, 7 N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-5, (IV) бром-бензо[b]фуранілкарбаміду, де: N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-5X являє собою S, NH або О, бром-2-бензо[b]фуранілкарбаміду, R вибраний з водню, С1-С6-алкілу, фтору, хлору і N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2брому, бензо[b]телурофенілкарбаміду і R1 вибраний з водню, С1-С6-алкокси, С1-С6-алкілу, N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил-2фтору, хлору, брому, трифторметилу і ціано, бензо[b]телурофенілкарбаміду, причому R1 знаходиться в положенні 5 або 6 і її фармацевтично прийнятні солі. гетероциклу, 11. Терапевтичний агент, що містить одну або R2 і R3 незалежно вибрані з водню, С1-С6більше сполук за будь-яким з попередніх пунктів. алкілокси, С1-С6-алкілу, фтору, хлору, брому і трифторметилу, причому R2 і R3 знаходяться 7 81630 8 12. Терапевтичний агент за п. 11, що додатково розладів, синдрому неспокійних ніг, синдрому містить L-ДОФА, для одночасного або гіперактивності (ADHS), порушень локомоції, послідовного введення пацієнтові. пов’язаних із хворобою Паркінсона, L-ДОФА13. Застосування сполуки за будь-яким з пп. 1-10 індукованих розладів, синдрому Сегави, пізніх для приготування терапевтичного агента для порушень локомоції, а також для медикаментозної лікування або попередження пристрасті до аблактації після вагітності. кокаїну, алкоголю, опіатів і нікотину, 19. Застосування за п. 18, де терапевтичний агент нейродегенеративних розладів, зокрема хвороби використовують для лікування або попередження Паркінсона, сексуальної дисфункції, депресії або синдрому Сегави, спонтанної дискінезії або шизофренії. дистонії, пов’язаної з хворобою Паркінсона, або 14. Застосування сполуки за будь-яким з пп. 1-10 пізньої або L-ДОФА-індукованої дискінезії або для приготування терапевтичного агента для дистонії. лікування або попередження гіперпролактинемії, 20. Застосування за будь-яким з пп. 16-19, де гіперпролактиноми, глаукоми, когнітивних R вибраний з водню, С1-С6-алкілу, фтору, хлору і розладів, синдрому неспокійних ніг, синдрому брому, гіперактивності (ADHS), порушень локомоції, R1 вибраний з водню, С1-С6-алкокси, С1-С6-алкілу, пов’язаних із хворобою Паркінсона, L-ДОФАфтору, хлору, брому і трифторметилу, і індукованих розладів, синдрому Сегави, пізніх кожний з R2 і R3 незалежно вибраний з водню, С1порушень локомоції, а також для медикаментозної С6-алкокси, С1-С6-алкілу, фтору, хлору, брому і аблактації після вагітності. трифторметилу, 15. Застосування за п. 14, де терапевтичний агент причому С1-С6-алкільні групи також необов’язково призначений для лікування або попередження можуть бути заміщеними. синдрому Сегави, спонтанної дискінезії або 21. Застосування за будь-яким з пп. 16-20, де дистонії, пов’язаної з хворобою Паркінсона, або замісник R1 знаходиться в положенні 5 або 6 пізньої або L-ДОФА-індукованої дискінезії або гетероциклу, і дистонії. замісники R2 і R3 знаходяться відповідно в 16. Застосування сполуки загальної формули (III): положеннях 2 або 3 або відповідно в положеннях 2 R1 або 4 фенільного кільця, й у випадку, коли один з R , , 4 O 6 5 двох замісників R2 і R3 є атомом водню, R2 3 5 , відповідний інший замісник знаходиться в N 4 N N 2 положенні 2 фенільного кільця. R3 6 H X , , 22. Застосування за будь-яким з пп. 16-21, де n 2 3 7 сполука являє собою N-4-(4-(2, (III) метоксифеніл)піперазин-1-іл)бутил-2де: індолілкарбамід. n дорівнює 1-4, і X являє собою S, О або NH, коли 23. Спосіб одержання сполуки загальної формули R є воднем, алкілом або галогеном, і R1 вибраний (І), (III) або (IV), як вони визначені вище, що з радикалів водню, алкілу, галогену, включає взаємодію сполуки загальної формули (А) трифторметилу, і кожний з R2 і R3 окремо або в активованій формі, зокрема у формі галіду одночасно вибраний з радикалів водню, гідрокси, карбонової кислоти, алкілокси, алкілу, алкенілу, алкінілу, арилу, R R1 галогену, трифторметилу, ацилу, O алкоксикарбонілу та ціано, для приготування фармацевтичного агента для лікування або попередження пристрасті до кокаїну, алкоголю, OH X , (A) опіатів і нікотину, нейродегенеративних розладів, зі сполукою загальної формули (В): зокрема хвороби Паркінсона, або сексуальної дисфункції. R2 17. Застосування за п. 16 для приготування N N H2 N терапевтичного агента для лікування або R3 попередження депресії або шизофренії. n 18. Застосування за п. 16 для приготування , (B) терапевтичного агента для лікування або де n, R, R1 R2 і R3 та X такі, як визначено для попередження гіперпролактинемії, загальних формул (І), (ІІІ) і (IV). гіперпролактиноми, глаукоми, когнітивних Дофамін вважається важливим нейротрансміттером центральної нервової системи. Дофамін діє, зв'язуючись з п'ятьма різними дофаміновими рецепторами. За їх морфологією і способом сигнальної трансмісії їх можна класифікувати як D1-подібні (D1 і D5) і D2подібні (D2, D3 і D4) рецептори [Neve, K.A. The Dopamine Receptor. Human Press, 1997]. Зокрема, підтипи сімейства D2 відіграють важливу роль у регуляторних процесах центральної нервової системи. У той час як D2-рецептори головним чином експресуються в базальних гангліях, де вони контролюють нейромоторні ланцюги, D3рецептори головним чином знаходяться в 9 81630 10 лімбічній системі, де контролюються емоційні і когнітивні процеси. Порушення сигнальної трансдукції цих рецепторів приводять до численних невропатологічних ситуацій. Зокрема, D3-рецептор вважається перспективною мішенню для розробки активнихінгредієнтів для лікування психіатричних захворювань, таких як шизофренія де у формулі (І); або уніполярна депресія, розлади свідомості, а - n дорівнює 1-4, і також для лікування нейродегенеративних - R є воднем, алкілом або галогеном, і захворювань, таких як хвороба Паркінсона, а (а) X являє собою S або О: також для лікування наркоманії [Pulvirenti, L. et al. (1) коли Ні являє собою гідрокси, алкілокси, Trends Pharmacol. Sci. 2002, 23, 151-153]. алкеніл, алкініл, арил, ацил, алкоксикарбоніл або Сполуки, що мають арилпіперазинову ціано, кожний з R2 і R3 незалежно вибраний з структуру, вже описані як ліганди, активні у водню, гідрокси, алкілокси, алкілу, алкенілу, відношенні дофамінових рецепторів [Robarge, M.J. алкінілу, арилу, галогену, трифторметилу, ацилу, J. Med. Chem. 2001, 44, 3175-3186]. Бензаміди і алкоксикарбонілу і ціано, нафтаміди, що мають частково арилпіперазинову (2) коли R1 являє собою водень, алкіл, галоген структуру, також відомі як ліганди дофамінових або трифторметил, R2 вибраний з гідрокси, рецепторів [Perrone, R. J. Med. Chem. 1998, 41, алкенілу, алкінілу, арилу, ацилу, алкоксикарбонілу 4903-4909; ЕР 0779284 А1]. і ціано, і R3 вибраний з водню, гідрокси, алкілокси, Фенілпіперазинілнафтамід нещодавно був алкілу, алкенілу, алкінілу, арилу, галогену, описаний як селективний D3-частковий агоніст, що трифторметилу, ацилу, алкоксикарбонілу і ціано, демонструє у тваринних моделях перспективну або активність, яку можна використовувати для (б) X являє собою NH: лікування пристрасті до кокаїну [Pilla, M. et al. R1 вибраний з водню, гідрокси, алкілу, Nature 1999, 400, 371-375]. алкілокси, алкенілу, алкінілу, арилу, Описано кілька прикладів трифторметилу, ацилу, алкоксикарбонілу, арилпіперазиніламідів, які мають компоненти, що галогену і ціано, і кожний з R2 і R3 незалежно представляють собою кисень-, сірку- або вибраний з водню, гідрокси, алкілокси, алкілу, азотвмісні гетероаренові кислоти [ES 2027898, ЕР алкенілу, алкінілу, арилу, галогену, 343961, US 3646047, US 3734915]. З іншого боку, трифторметилу, ацилу, алкоксикарбонілу і ціано за ціан-заміщені і телур-вмісні похідні з частково умови, що ця сполука не є N-4-(4-(2фероценіловою структурою не відомі в літературі. метоксифеніл)-піперазин-1-іл)-бутил-2У ході експериментів з впливу структури індолілкарбамідом, або лігандів дофаміну автори даного винаходу (в) X являє собою Те: відкрили нові сполуки формул (I)-(IV), що R1 вибраний з водню, гідрокси, алкілу, виявляють раніше невідомі властивості алкілокси, алкенілу, алкінілу, арилу, галогену, високоафінного і високоселективного зв'язування з трифторметилу, ацилу, алкоксикарбонілу і ціано, і D3-рецептором в аналізах in vitro. Ці сполуки кожний з R2 і R3 незалежно вибраний з водню, можуть, таким чином, бути цінними гідрокси, алкілокси, алкілу, алкенілу, алкінілу, терапевтичними агентами для лікування арилу, галогену, трифторметилу, ацилу, захворювань центральної нервової системи, таких алкоксикарбонілу і ціано. В одному втіленні як шизофренія, різні форми депресії, винаходу у формулі (І) нейродегенеративні розлади, сексуальна - n дорівнює 1-4, і дисфункція, а також пристрасть до кокаїну, опіатів - X являє собою Те, коли R є воднем, алкілом і нікотину. або галогеном, і R1 заміщений радикалами водень, Іншими конкретними галузями застосування є гідрокси, алкіл, алкілокси, алкеніл, алкініл, арил, глаукома, когнітивні розлади, синдром неспокійних галоген, трифторметил, ацил, алкоксикарбоніл або ніг, синдром гіперактивності (ADHS), ціано, і R2 і R3 окремо або одночасно заміщені гіперпролактинемія, гіперпролактинома, радикалами водень, гідрокси, алкілокси, алкіл, порушення локомоції, пов'язані з хворобою алкеніл, алкініл, арил, галоген, трифторметил, Паркінсона, порушення локомоції, індуковані ацил, алкоксикарбоніл або ціано, лікуванням L-ДОФА (L-3,4або дигідроксифенілаланіном) і нейролептиками, - X являє собою S або О, коли R є воднем, наприклад акатизія, ригідність, дистонія і алкілом або галогеном, і R1 заміщений дискінезія. радикалами гідрокси, алкілокси, алкеніл, алкініл, Предметом даного винаходу є похідні амідів 2арил, ацил, алкоксикарбоніл або ціано, і R2 і R3 гетероаренкарбонових кислот, що мають частково окремо або одночасно заміщені радикалами арилпіперазинілову структуру, у формі вільної водень, гідрокси, алкілокси, алкіл, алкеніл, алкініл, основи й у формі солей, нижченаведених формул арил, галоген, трифторметил, ацил, (І) і (II): алкоксикарбоніл або ціано, або - X являє собою S або О, коли R є воднем, алкілом або галогеном, і R1 заміщений радикалами водень, алкіл, галоген або трифторметил, і R2 і R3 окремо або одночасно 11 81630 12 заміщені радикалами гідрокси, алкеніл, алкініл, 4, наприклад алкокси, трифторметилом або арил, ацил, алкоксикарбоніл або ціано, галогеном, переважно метокси. або "Ацил" зокрема містить групи -С(О)-алкіл і - X являє собою NH, коли R є воднем, алкілом С(О)-арил, де алкіл і арил переважно вибрані з або галогеном, і Ri R1 заміщений радикалами груп, зазначених для "алкілу" і "арилу" вище, гідрокси, алкіл, алкілокси, алкеніл, алкініл, арил, зокрема -С(О)-С1-С6.алкіл. Наприклад, ацил може трифторметил, ацил, алкоксикарбоніл або ціано, являти собою ацетил, пропіоніл, бутирил або при цьому алкіл і алкілокси містять щонайменше С(О)-феніл. два атоми вуглецю, і R2 і R3 окремо або одночасно "Алкоксикарбоніл" являє собою -С(О)-Озаміщені радикалами водень, гідрокси, алкілокси, алкільну групу, де алкіл переважно вибраний із алкіл, алкеніл, алкініл, арил, галоген, груп, зазначених для "алкілу" вище. Переважно, трифторметил, ацил, алкоксикарбоніл або ціано, алкоксикарбоніл являє собою (С1-С6при цьому алкілокси містить щонайменше два алкіл)оксикарбонільну групу. атоми вуглецю. "Галоген" являє собою переважно фтор, хлор, У формулі (II) бром або йод. n дорівнює 1-4, і R1 і R2 окремо або одночасно "Фізіологічно прийнятні солі" включають являють собою радикали водень, гідрокси, нетоксичні солі основи, зокрема солі сполуки алкілокси, алкіл, алкеніл, алкініл, арил, галоген, формули (І) у формі вільної основи з органічними трифторметил, ацил, алкоксикарбоніл або ціано. або неорганічними кислотами. Прикладами Зокрема, винахід відноситься до фізіологічно неорганічних кислот є НСІ, НВr, сірчана кислота і прийнятних солей сполук за винаходом. фосфорна кислота. Органічні кислоти включають Фахівець-практик знає, що в залежності від оцтову кислоту, пропіонову кислоту, вибору замісників сполуки можуть являти собою піровиноградну кислоту, масляну кислоту, a-, bоптично активні сполуки. У даному випадку або g-гідроксимасляну кислоту, валеріанову предметом даного винаходу є як рацемати, так і кислоту, гідроксивалеріанову кислоту, капронову кожна з чистих енантіомерних форм. кислоту, гідроксикапронову кислоту, каприлову Замісники, перераховані в цьому описі і кислоту, капринову кислоту, лауринову кислоту, прикладеній формулі винаходу, містять, зокрема, міристинову кислоту, пальмітинову кислоту, групи, що обговорюються нижче. стеаринову кислоту, гліколеву кислоту, молочну "Алкіл" може являти собою розгалужену або кислоту, D-глюкуронову кислоту, L-глюкуронову нерозгалужену алкільну групу, що переважно кислоту, D-галактуронову кислоту, гліцин, містить від 1 до 10 атомів вуглецю, особливо бензойну кислоту, гідроксибензойну кислоту, переважно від 1 до 6 атомів вуглецю і найбільш галову кислоту, саліцилову кислоту, ванілінову переважно 1, 2 або 3 атоми вуглецю, наприклад кислоту, кумаринову кислоту, кавову кислоту, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, гіпурову кислоту, оротову кислоту, L-винну втор-бутил, трет-бутил, н-пентил, ізопентил, кислоту, D-винну кислоту, D,L-винну кислоту, мезонеопентил, трет-пентил, 1-метилбутил, 2винну кислоту, фумарову кислоту, L-яблучну метилбутил, 1-етилпропіл, 1,2-диметилпропіл і нкислоту, D-яблучну кислоту, D,L-яблучну кислоту, гексил. Алкільні групи можуть також бути щавлеву кислоту, малонову кислоту, бурштинову заміщеними одним або більше замісниками, кислоту, малеїнову кислоту, щавелевооцтову наприклад галогеном або однією або більше кислоту, глутарову кислоту, гідроксиглутарову фенільними групами. кислоту, кетоглутарову кислоту, адипінову "Алкеніл" і "алкініл" мають щонайменше один кислоту, кетоадипінову кислоту, пімелінову подвійний або потрійний зв'язок. Вони можуть бути кислоту, глутамінову кислоту, аспарагінову розгалуженими або нерозгалуженими і переважно кислоту, фталеву кислоту, пропантрикарбонову містять від 2 до 6 атомів вуглецю. Алкеніли або кислоту, лимонну кислоту, ізолимонну кислоту, алкініли переважно зв'язані з гетероареновим або метансульфонову кислоту, толуолсульфонову фенільним кільцем каркасної структури сполуки кислоту і трифтометансульфонову кислоту. таким чином, що подвійний або потрійний зв'язок Сполуки формули (І), в якій X являє собою NH, сполучений з ароматичним кільцем. Алкеніл і S або О, можна назвати переважними алкініл можуть також бути заміщеними одним або структурами. більше замісниками, переважно фенілом, і в цьому Переважними втіленнями сполук формули (І) випадку фенільна група переважно локалізована за винаходом є такі сполуки загальної формули на атомі вуглецю 2 (якщо алкеніл або алкініл (Іа) або (Іb): зв'язані з гетероареновим або фенільним кільцем каркасної структури через атом вуглецю 1). Алкеніли або алкініли переважно є незаміщеними. "Алкілокси" являє собою О-алкільну групу, де алкіл переважно вибраний із груп, перерахованих вище для "алкілу". Переважно, алкілокси являє собою С1-С6-алкілоксигрупу, зокрема метокси. В іншому втіленні алкілокси може бути також С2-С6алкілоксигрупою. "Арил" переважно являє собою феніл. Можливо, феніл незалежно може також бути де: заміщеним в одному або більше положеннях 2, 3 і 13 81630 14 - n дорівнює 1-4, заміщений метоксигрупою або галогеном, - R є воднем, С1-С6-алкілом або галогеном, галогену, трифторметилу, С1-С6-ацилу, С1-С6- коли R1 являє собою гідрокси, С1-С6алкоксикарбонілу і ціано, алкілокси, С2-С6-алкеніл, С2-С6-алкініл, феніл, що і необов'язково може бути заміщений (б) коли R1являє собою водень, С1-С6алкіл, С1метоксигрупою або галогеном, С1-С6-ацил, С1-С6С6-алкілокси або галоген, R2 вибраний з гідрокси, алкоксикарбоніл або ціано, кожний з R2 і R3 С2-С6-алкенілу, С2-С6-алкінілу, фенілу, що незалежно вибраний з водню, гідрокси, С1-С6необов'язково може бути заміщений алкілокси, С1-С6-алкілу, С2-С6-алкенілу, С2-С6метоксигрупою або галогеном, С1-С6-ацилу, С1-С6алкінілу, фенілу, що необов'язково може бути алкоксикарбонілу і ціано, і R3 вибраний з водню, заміщений метоксигрупою або галогеном, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2-С6галогену, трифторметилу, С1-С6-ацилу, С1-С6алкенілу, С2-С6-алкінілу, фенілу, що необов'язково алкоксикарбонілу і ціано, може бути заміщений метоксигрупою або - коли R1 являє собою водень, С1-С6-алкіл, галогеном, галогену, трифторметилу, С1-С6-ацилу, галоген або трифторметил, R2 вибраний з гідрокси, С1-С6-алкоксикарбонілу і ціано. С2-С6-алкенілу, С2-С6-алкінілу, фенілу, що В іншому переважному втіленні винаходу, у необов'язково може бути заміщений сполуках загальних формул (І), (Іа), (Іb) і (Іс) метоксигрупою або галогеном, С1-С6-ацилу, С1-С6- замісник R1 знаходиться в положенні 5 або 6 алкоксикарбонілу і ціано, і R3 вибраний з водню, гетероциклу, і гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2-С6- замісники R2 і R3 знаходяться відповідно в алкенілу, С2-С6-алкінілу, фенілу, що необов'язково положеннях 2 або 3 або відповідно в положеннях 2 може бути заміщений метоксигрупою або або 4 фенольного кільця, і у випадку, коли один із галогеном, галогену, трифторметилу, С1-С6-ацилу, двох замісників R2 і R3 є атомом водню, С1-С6-алкоксикарбонілу і ціано, відповідний інший замісник знаходиться в і їх фармацевтично прийнятні солі, причому положенні 2 фенольного кільця. переважними замісниками-галогенами є фтор, В особливо переважному утіленні винаходу в хлор і бром. сполуках формул (І), (Іа), (Іb) і (Іс) n дорівнює 3. Іншим переважним втіленням сполук формули Переважні сполуки загальної формули (II), як (І) за винаходом є такі сполуки загальної формули визначено вище, являють собою сполуки, в яких (Іс): кожний з R1 і R2 незалежно вибраний з водню, гідрокси, С1-С6-алкілокси, С1-С6-алкілу, С1-С6алкенілу, С2-С6-алкінілу, арилу, фтору, хлору, брому, трифторметилу, С1-С6-ацилу, С1-С6алкоксикарбонілу і ціано. Конкретними сполуками загальної формули (II) є (В16): N-4-(4-(2-метоксифеніл)піперазин-1де: іл)бутил-2-фероценілкарбамід - n дорівнює 1-4, і -R є воднем, С1-С6-алкілом або галогеном, (В17): N-4-(4-(2,3-дихлорфеніл)піперазин-1- R1 вибраний з водню, гідрокси, С1-С6-алкілу, іл)бутил-2-фероценілкарбамід. С1-С6-алкокси, С2-С6-алкенілу, С2-С6-алкінілу, В іншому аспекті даний винахід відноситься до фенілу, що необов'язково може бути заміщений сполук загальної формули (IV): метоксигрупою або галогеном, трифторметилу, С 1 С6-ацилу, С1-С6-алкоксикарбонілу, фтору, хлору, брому і ціано, - кожний з R2 і R3 незалежно вибраний з водню, гідрокси, С1-С6-алкілу, С1-С6-алкілокси, С2С6-алкенілу, С2-С6-алкінілу, фенілу, що необов'язково може бути заміщений метоксигрупою або галогеном, галогену, трифторметилу, С1-С6-ацилу, С1-С6алкоксикарбонілу і ціано, і фармацевтично прийнятні солі цих сполук за умови, що сполука не є N-4-(4-(2метоксифеніл)піперазин-1-іл)бутил-2індолілкарбамідом. В іншому переважному утіленні винаходу, у сполуках загальної формули (Іс) (а) коли R1 являє собою гідрокси, С2-С6алкеніл, С2-С6-алкініл, феніл, що необов'язково може бути заміщений метоксигрупою або галогеном, трифторметил, С1-С6-ацил, С1-С6алкоксикарбоніл або ціано, кожний з R2 і R3 незалежно вибраний з водню, гідрокси, С1-С6алкілу, С1-С6-алкілокси, С2-С6-алкенілу, С2-С6алкінілу, фенілу, що необов'язково може бути де: - X являє собою S, NH або О, - R вибраний з водню, С1-С6-алкілу, фтору, хлору і брому, - R1 вибраний з водню, С1-С6-алкокси, С1-С6алкілу, фтору, хлору, брому, трифторметилу і ціано, причому R1 знаходиться в положенні 5 або 6 гетероциклу, - R2 і Яз незалежно вибрані з водню, С1-С6алкілокси, С1-С6-алкілу, фтору, хлору, брому і трифторметилу, причому R2 і R3 знаходяться відповідно в положеннях 2 або 3 або відповідно в положеннях 2 або 4 фенольного кільця, і у випадку, коли один із двох замісників R2 і R3 є атомом водню, відповідний інший замісник знаходиться в положенні 2 фенольного кільця, 15 81630 16 і фармацевтично прийнятних солей цих сполук або О, і сполукам формул (la), (Ib), (Іс) і (IV) або їх за умови, що сполука не є N-4-(4-(2фармацевтично прийнятним солям. метоксифеніл)піперазин-1-іл)бутил-2Термін "високоаффінні D3 ліганди" включає в індолілкарбамідом. себе сполуки, що показують зв'язування з У переважному аспекті винаходом є сполуки людськими дофаміновими D3-рецепторами, що загальної формули (IV), як визначено вище, де має величину Kі переважно не більш 10нМ, - коли X являє собою NH, тоді R1 вибраний з особливо переважно не більш 1нМ, в експерименті водню, С1-С3-алкілокси, С1-С3-алкілу, фтору, з радіолігандом [дивися Hubner, H. et al. J. Med. хлору, брому і ціано, і Chem. 2000, 43, 756-762, і наведений нижче розділ - коли X являє собою S або О, тоді R1 "Біологічна активність"]. вибраний з водню, С1-С3-алкілу, фтору, хлору, В одному аспекті даний винахід відноситься до брому, ціано і трифторметилу. селективних D3 лігандів. Термін "селективні D3 Такі сполуки є конкретними втіленнями сполук ліганди" включає в себе сполуки з величиною Kі в за винаходом: експерименті з радіолігандом для D3-рецептора, (В18): N-4-(4-(2-метоксифеніл)піперазин-1що описаний в наведеному нижче розділі іл)бутил-5-ціано-2-бензо[b]тіофеніл карбамід "Біологічна активність", яка нижче щонайменше в (В19): N-4-(4-(2,3-дихлорфеніл)піперазин-110 разів для щонайменше п'яти із семи наступних іл)бутил-5-ціано-2-бензо[b]тіофеніл карбамід рецепторів: дофамінових D1, D2long, D2short і (В20): N-4-(4-(2-метоксифеніл)піперазин-1D4.4 рецепторів, серотонінових 5-НТ1А і 5-НТ2 іл)бутил-6-ціано-2-бензо[b]тіофеніл карбамід рецепторів і альфа-1-адренорецепторів. (В21): N-4-(4-(2,3-дихлорфеніл)піперазин-1В іншому аспекті винахід відноситься до іл)бутил-6-ціано-2-бензо[b]тіофенілкарбамід високоселективних дофамін-D3 лігандів. Термін (В1): N-4-(4-(2-метоксифеніл)піперазин-1"високоселективні D3 ліганди" включає в себе іл)бутил-2-бензо[b]тіофенілкарбамід сполуки з величиною Kі в експерименті з (В2): N-4-(4-(2,3-дихлорфеніл)піперазин-1радіолігандом для D3-рецептора, що описаний в іл)бутил-2-бензо[b]-тіофеніл карбамід наведеному нижче розділі "Біологічний активність", (В22): N-4-(4-(2-метоксифеніл)піперазин-1яка нижче щонайменше в 100 разів для іл)бутил-5-бром-2-бензо[b]тіофенілкарбамід щонайменше трьох і переважно всіх дофамінових (B23): N-4-(4-(2,3-дихлорфеніл)піперазин-1D1, D2long, D2short і D4.4 рецепторів. іл)бугил-5-бром-2-бензо[b]тіофенілкарбамід D3 ліганди можуть виявляти агоністичну, (В10): N-4-(4-(2,3-дихлорфеніл)піперазин-1антагоністичну або частково агоністичну іл)бутил-2-індолілкарбамід активність по відношенню до D3-рецептора. (В11): N-4-(4-(2-метоксифеніл)піперазин-1Відповідні власні активності сполук за винаходом іл)бутил-5-ціано-2-індолілкарбамід можуть бути виміряні в аналізах мітогенезу як (В12): N-4-(4-(2-метоксифеніл)піперазин-1описано в літературі [Hubner, Η. et al. J. Med. іл)бутил-5-бром-2-індолілкарбамід Chem. 2000, 43, 4563-4569, і Lober, S. Bioorg. Med. (В13): N-4-(4-(2-метоксифеніл)піперазин-1Chem. Lett. 2002, 12.17, 2377-2380]. У залежності іл)бутил-6-ціано-2-індолілкарбамід від патофізіології основного захворювання може (В14): N-4-(4-(2,3-дихлорфеніл)піперазин-1бути бажаною більш сильна агоністична, більш іл)бутил-5-бром-2-індолілкарбамід сильна антагоністична або частково агоністична (В15): N-4-(4-(2,3-дихлорфеніл)піперазин-1активність. Даний винахід, таким чином, іл)бутил-6-ціано-2-індолілкарбамід забезпечує чудову можливість тонкого (В25): N-4-(4-(2,3-дихлорфеніл)піперазин-1настроювання бажаної активності. іл)бутил-5-ціано-2-індоліл карбамід Таким чином, ще одним предметом винаходу є (В7): N-4-(4-(2-метоксифеніл)піперазин-1терапевтичний агент, що містить одну або більше іл)бутил-5-ціано-2-бензо[b]фуранілкарбамід із сполук загальних формул (І), (la), (Ib), (Іс), (II) і (В3): N-4-(4-(2-метоксифеніл)піперазин-1(IV) або одну з конкретних сполук, як вони іл)бутил-2-бензо[b]фуранілкарбамід визначені вище, можливо у формі фармацевтично (В4): N-4-(4-(2,3-дихлорфеніл)піперазин-1прийнятної солі. Переважно, це одна або більше із іл)бутил-2-бензо[b]фуранілкарбамід сполук загальних формул (І), (la), (Ib), (Іс) і (IV) або (В5): N-4-(4-(2-метоксифеніл)піперазин-1їх фармацевтично прийнятних солей, у яких X іл)бутил-5-бром-бензо[b]фуранілкарбамід являє собою NH, S або О. (В6): N-4-(4-(2,3-дихлорфеніл)піперазин-1Даний винахід також відноситься до іл)бутил-5-бром-2-бензо[b]фуранілкарбамід застосування однієї або більше із сполук (В8): N-4-(4-(2-метоксифеніл)піперазин-1загальних формул (І), (la), (Ib), (Іс), (II) і (IV) або іл)бутил-2-бензо[b]телурофенілкарбамід однієї з конкретних перерахованих сполук, (В9): N-4-(4-(2,3-дихлорфеніл)піперазин-1можливо у формі фармацевтично прийнятної солі, іл)бутил-2-бензо[b]телурофенілкарбамід для лікування, включаючи лікування і і фармацевтично прийнятні солі цих сполук. попередження, за приведеними тут Зокрема, сполуки формул (І), (la), (Ib), (Іс), (II) і призначеннями і для приготування терапевтичного (IV), як вони визначені вище, придатні для агента для зазначених показань. терапевтичного застосування як дофамін-D3 Для приготування терапевтичних агентів ліганди. Особлива перевага віддається сполукам переважно вибирати сполуки за винаходом, що загальної формули (І) або їх фармацевтично являють собою селективні D3 ліганди. прийнятним солям, у яких X являє собою NH, S Високоселективні D3 ліганди є особливо переважними. 17 81630 18 Сполуки за винаходом мають потенційне таблеток. В міру необхідності ці два активних застосування в лікуванні або попередженні цілого інгредієнти можна вводити одночасно або в різні ряду розладів, зокрема розладів, що моменти часу. супроводжуються дисфункцією дофамінового У складному препараті послідовного введення метаболізму або дофамінегрічного сигнального можна досягти, надавши форму введення, каскаду. наприклад пероральну таблетку, що має два Прикладами таких розладів є пристрасть до різних шари з різними профілями вивільнення для кокаїну, алкоголю, опіатів і нікотину, різних фармацевтично активних компонентів. нейродегенеративні розлади, зокрема хвороба Фахівцеві-практикові зрозуміло, що в контексті Паркінсона, сексуальна дисфункція, зокрема даного винаходу можливі різні форми введення і еректильна дисфункція в чоловіків, депресія, схеми застосування, кожна з яких є предметом зокрема ендогенна монофазна депресія ("важка винаходу. депресія") і шизофренія. Одне з втілень даного винаходу, таким чином, Іншими прикладами розладів, що піддаються відноситься до терапевтичного агента, що містить лікуванню або попередженню сполуками за L-ДОФА або нейролептик, а також сполуки за винаходом, є гіперпролактинемія, винаходом для одночасного або послідовного гіперпролактинома, глаукома, когнітивні розлади, введення пацієнтові. синдром неспокійних ніг, синдром гіперактивності Загалом, терапевтичний агент за винаходом (ADHS), порушення локомоції, пов'язані з являє собою фармацевтичну композицію, що на хворобою Паркінсона, наприклад ригідність, додаток до D3 лігандів, описаних вище, містить дистонія і дискінезія, L-ДОФА-індуковані розлади, щонайменше один фармацевтично прийнятний такі як тривога, порушення сну, психози, дискинезії носій або ексципієнт. і дистонії, ідіопатичні дистонії, особливо синдром Фахівцеві-практикові ясно, що в залежності від Сегави, індукована нейролептиками (пізня) наміченого шляху застосування фармацевтичний дискінезія, дистонія й акатизія. препарат може мати різні форми. Наприклад, Сполуки за винаходом особливо добре фармацевтичний препарат може бути підходять для приготування терапевтичного адаптований для внутрішньовенного, агента для лікування чутливих до ДОФА порушень внутрішньом'язового, внутрішньошкірного, локомоції. Такими порушеннями локомоції можуть підшкірного, перорального, букального, бути, наприклад, дискінезії, дистонії, ригідність і сублінгвального, назального, трансдермального, тремор. Термін "чутливий до ДОФА" означає, що інгаляційного, ректального або на порушення локомоції можна сприятливим інтраперитонеального введення. чином впливати шляхом уведення лікарських Придатні препарати і фармацевтичні носії і засобів, що впливають на дофамінергічну ексципієнти, прийнятні для цієї мети, такі як сигнальну трансмісію. Типовим прикладом є наповнювачі, розпушувачі, зв'язувальні агенти, синдром Сегави, ідіопатична дистонія, при якій змащувальні агенти, стабілізатори, коригенти, відповідну реакцію на L-ДОФА можна антиоксиданти, консерванти, диспергуючі агенти використовувати як діагностичний критерій. або розчинники, буфери або електроліти, відомі Переважним застосуванням є приготування фахівцям у фармацевтичній галузі і розкриті в терапевтичного агента для лікування дискінезій і стандартний роботах, наприклад [Sucker, Fuchs дистоній, що можуть траплятися спонтанно в and Speiser ("Pharmazeutische Technologie", зв'язку з хворобою Паркінсона, але можуть також Deutscher Apotheker Verlag, 1991) і Remington бути індуковані лікарськими засобами. Серед ("The Science і Practice of Pharmacy", Lippincott, дискінезій і дистоній, індукованих лікарськими Williams & Wilkins, 2000)]. засобами, можна згадати зокрема ті з них, що У переважному втіленні винаходу індукуються нейролептиками й антагоністами фармацевтичні композиції, що містять сполуки за дофаміну або агоністами дофаміну, або L-ДОФА. винаходом, можна вводити перорально і можна Крім того, ці терапевтичні агенти можна надавати, наприклад, у формі капсули, таблетки, використовувати в медикаментозної аблактації порошку, гранулята, таблетки, покритої після вагітності. оболонкою, або в рідкій формі. Нарешті, терапевтичні агенти за винаходом Якщо бажано швидкий початок дії, препарат можна використовувати у вигляді складного може бути приготовлений для введення у формі препарату для одночасного або послідовного швидкого вивільнення. Придатні пероральні введення в залежності від захворювання, що препарати описані в [ЕР 0548356 або ЕР 1126821]. підлягає лікуванню. З іншого боку, якщо бажано розтягнуте в часі Наприклад, одна одиниця, що виставляється вивільнення, то можна вибрати препарат на продаж, що містить лікарський засіб L-ДОФА уповільненого вивільнення активного інгредієнта. для лікування хвороби Паркінсона, може також Такі пероральні препарати також відомі з містити фармацевтичний препарат, що містить попереднього рівня техніки. одну з сполук за даним винаходом, наприклад з Альтернативними фармацевтичними високоселективним, частково-агоністичним препаратами можуть бути, наприклад, розчини профілем дії. L-ДОФА і сполуки за даним для iнфузії або ін'єкції, олії, супозиторії, аерозолі, винаходом можуть бути присутніми у тому самому спреї, пластири, мікрокапсули або мікрочастинки. фармацевтичному препараті, наприклад у Іншим предметом винаходу є застосування складній таблетці, або в різних одиницях сполуки загальної формули (III): застосування, наприклад у формі двох окремих 19 де: n дорівнює 1-4, і X являє собою S, О або ΝΗ, коли R є воднем, алкілом або галогеном, і R-i заміщений радикалами водень, алкіл, галоген, трифторметил, і кожний з R2 і R3 окремо або одночасно заміщений радикалами водень, гідрокси, алкілокси, алкіл, алкеніл, алкініл, арил, галоген, трифторметил, ацил, алкоксикарбоніл або ціано, для приготування фармацевтичного агента для лікування одного з наступних захворювань або розладів: пристрасть до кокаїну, алкоголю, опіатів і нікотину, шизофренія, різні форми депресії, зокрема ендогенна монофазна депресія ("важка депресія") або депресивні фази біполярних (маніакально-депресивних) розладів, нейродегенеративні розлади, зокрема хвороба Паркінсона, сексуальна дисфункція, гіперпролактинемія, гіперпролактинома, глаукома, когнітивні розлади, синдром неспокійних ніг, синдром гіперактивності (ADHS), порушення локомоції, пов'язані с хворобою Паркінсона, наприклад ригідність, дистонія і дискінезія, LДОФА-індуковані розлади, такі як тривога, порушення сну, психози, дискінезії і дистонії, ідіопатичні дистонії, зокрема синдром Сегави, індукована нейролептиками (пізня) дискінезія, дистонія й акатизія. Зокрема, сполуки загальної формули (III) можна використовувати для приготування терапевтичного агента для лікування чутливих до ДОФА порушень локомоції. Вони можуть траплятися спонтанно в зв'язку з хворобою Паркінсона, але можуть також бути індуковані лікарськими засобами. Серед порушень локомоції, індукованих лікарськими засобами, можна згадати, зокрема, порушення, індуковані нейролептиками або антагоністами дофаміну, або L-ДОФАіндуковані дискінезії і дистонії. Для приготування терапевтичних агентів за винаходом переважно використовувати сполуки загальної формули (III), в яких - R вибраний з водню, С1-С6-алкілу, фтору, хлору і брому, - R1 вибраний з водню, С1-С6-алкокси, С1-С6алкілу, фтору, хлору, брому і трифторметилу, і - кожний з R2 і R3 незалежно вибраний з водню, С1-С6-алкілокси, С1-С6-алкілу, фтору, хлору, брому і трифторметилу. Переважно також використовувати сполуки формули (III), в яких - замісник R1 знаходиться в положенні 5 або 6 гетероциклу, і - замісники R2 і R3 знаходяться відповідно в положеннях 2 або 3 або відповідно в положеннях 2 або 4 фенольного кільця, і у випадку, коли один із двох замісників R3 і R3 є атомом водню, відповідний інший замісник знаходиться в положенні 2 фенольного кільця. 81630 20 Переважною сполукою загальної формули (III) для приготування терапевтичних агентів за даним винаходом, зокрема для лікування L-ДОФАіндукованої дискінезії, є нижченаведена сполука: (В24): N-4-(4-(2-метоксифеніл)піперазин-1іл)бутил-2-індолілкарбамід. Сполуки формул (I)-(IV) були отримані способами, описаними в літературі [Glennon, R.Aet al. J. Med. Chem. 1988, 31, 1968-1971]. Для цієї мети кислотні похідні типу (А), що або були придбані, або були синтезовані як описано в літературі, активували у формі хлорангідридів їхніх карбонових кислот, і піддавали взаємодії з вільною основою типу (В) з одержанням похідних формули (І) (у тому числі (Іа), (Іb) і (Іс)), (III) або (IV): де n, R, R1, R2 і R3 такі, як визначено вище для (І), (III) і (IV) відповідно. Як альтернативу вищезгаданому способові активації кислотних похідних можна використовувати інші реакції, наприклад активацію кислот гідроксіазабензтриазолом [Kienhofer, A. Synlett 2001, 1811-1812]. Наприклад, сполуки формули (II) можуть бути отримані активацією фероцен-2-карбонової кислоти HATU (О-(7азабензо-триазол-1-іл)-N,N,N',N'тетраметилуронію гексафторфосфатом) з наступною взаємодією з основами типу (В). Комерційно доступні 2-метокси- або 2,3дихлорфенілпіперазини можуть бути алкіловані бромбутилфталімідом у ксилолі з одержанням арилпіперазиніламінів типу (В). Наступний гідразиноліз фталімід-заміщених структур дає первинні аміни типу (В). Це ілюструється наступною ілюстративною реакційною схемою: Приклади Синтез амінів типу (В) 4-(4-(2,3-дихлорфеніл)піперазин-1іл)бутиламін 2,3г (10ммоль) 2,3-дихлорфенілпіперазину у формі вільної основи розчиняють у 10мл ксилолу і нагрівають до 70°С. Потім 1,4г (5ммоль) 4 21 81630 22 бромбутилфталіміду розчиняють у 20мл ксилолу і Розраховано: С 68,05; Η 6,90; Ν 9,92; S 8.15; повільно по краплях додають у розчин піперазину. Знайдено: С 68,11; Η 6,95; Ν 9,93; S 8,09. Цю реакційну суміш нагрівають при 125°С Приклад 2 протягом 24 годин. Після охолодження до 0°С N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутилсуміш фільтрують, і фільтрат упарюють. 2-6ензо[b]тіофенілкарбамід Отриманий N-4-(4-(2,3-дихлорфеніл)піперазин-1Синтез аналогічний прикладові 1. іл)бутилфталімід очищають флешВихід: 126мг (68% за 2 реакційні стадії). хроматографією на SiO2 з використанням Т.пл.: 153°С. МС: m/z 462 (М+). ІЧ (NaCI): 3298; етилацетату. Вихід: 4,0г (92%). 2967; 2934; 2809; 1640; 1599; 1576; 1530; 1442; Розчин 80% гідразингідрату (0,45мл, 2,5екв) у 1420; 1301; 1167; 1131; 962; 882; 808; 781; 712. 1Н5мл етанолу по краплях додають у суспензію N-4ЯМР: (CDCI3, 360МГц) d (м.ч.): 1.63-1.76 (m, 4Н, (4-(2,3-дихлорфеніл)піперазин-1-іл)бутилфталіміду СН2-СН2); 2.48 (t, J=6.9Гц, 2Н, CH2N); 2.66 (m, 4Н, в 40мл етанолу. Цю суміш нагрівають при піперазин); 3.05 (m, 4H, піперазин); 3.49-3.54 (m, температурі дефлегмації протягом 3 годин, потім 2H, CH2NCO); 6.79 (br, t, J=5.3Гц, 1H, NH); 6.84прохолоджують до кімнатної температури, тверду 6.86 (dd, J =1.6Гц, J =7.5Гц, 1H, феніл); 7.08-7.16 речовину, що випала в осад, відфільтровують, і (m, 2H, феніл); 7.37-7.44 (m, 2H, H5, H6); 7.77-7.78 етанольний розчин упарюють у вакуумі. (s, 1H, H3); 7.80-7.90 (m; 2H, H4, H7). 13C-ЯМР Очищення флеш-хроматографією з (CDCI3, 90МГц) d (м.ч.): 157.9; 156.1; 152.3; 151.1; використанням CH2C2-MeOH-Me2Et:90-8-2 дає 141.2; 129.9; 127.8; 123.0; 121.0; 11 -8.2; 113.0; основу 4-(4-(2,3-дихлорфеніл)піперазин-1112.3; 106.6; 109,7; 107.9; 57.9; 53.5; 50.5; 39.4; іл)бутиламін з виходом 900мг (60%). 27.4; 24.3. МС (мас-спектр): m/z 301 (М+); ІЧ С Η Ν (%): C23H25CI2N3OS (інфрачервоний спектр): (NaCI): 3397; 2939; 2817; Розраховано: С 60,25; Η 6,11; Ν 8,78; 1641; 1572; 1500; 1482; 1452; 1376; 1240; 1152; Знайдено: С 59,94; Η 6,04; Ν 8,81. 1118; 1023; 917; 791; 749; 698; 661. 1Н-ЯМР Приклад 3 (CDCI3, 360МГц) d (м.ч. (мільйонні частки)): 1.48N-4-(4-(2-метоксифеніл)піперазин-1-іл) бутил1.64 (m, 4Н, СН2-СН2); 2.41-2.46 (t, J=7.6, 2Н, 2-бензо[b]фуранілкарбамід CH2N); 2.64 (m, 4Н, піперазин); 2.72-2.76 (m, 2Н, Синтез аналогічний прикладові 1. CH2NCO); 3.07 (m, 4Н, піперазин); 6.93-6.99 (m, 1Н, Вихід: 75,2мг (вихід 56% за 2 реакційні стадії). Н5, феніл); 7.11-7.17 (m, 2Н, Н4, Н6, феніл). Т.пл.: 121°С. МС: m/z 431 (М+). ІЧ (NaCI): Приклад 1 3311,2; 3060; 2937; 2815; 2216; 1654; 1592; 1500; N-4-(4-(2-метоксифеніл)піперазин-1-іл) бутил1321; 1240; 1178; 1145; 748. 1Н-ЯМР (CDCI3, 2-бензо[b]тіофенілкарбамід 0,4ммоль бензтіофен360МГц) d (м.ч.): 1.67-1.74 (m, 4Н, СН2-СН2); 2.49 2-карбонової кислоти (0,071г) розчиняють у 4мл (t, 2Н, CH2N, J=6.9Гц); 2.69 (m, 4Н, піперазин); 3.13 сухого толуолу і 4мл сухого хлороформу. Додають (m, 4Н, піперпзин); 3.56-3.50 (m, 2Н, CH2NCO); 3.86 0,02мл сухого диметилформаміду (DMF) і 0,11мл (s, 3Н, ОСН3); 6.85-6.87 (m, 1Н, феніл); 6.90-6.93 (1,51ммоль) SOCI2, а потім нагрівають у масляній (m, 2Н феніл); 6.99-7.02 (m, 2Н, феніл mа NH); бані до 90°С протягом 30 хвилин. Розчинник потім 7.26-7.31 (m, 1Н, Н3); 7.37-7.42 (m, 1Н, Н6); 7.46видаляють відгоном на роторному випарнику і 7.48 (m, 2Н, Н4, Н3); 7.77-7.79 (m, 1Н, Н7). 13С-ЯМР сушать у глибокому вакуумі. Хлорангідрид кислоти (CDCI3, 90МГц) d (м.ч.): 158.9; 154.7; 152.3; 148.9; розчиняють у 40мл хлороформу і додають при 141.3; 127.7; 126.7; 123.6; 122.9; 122.7; 120.9; перемішуванні при 0°С до розчину 0,4ммоль 4-(4118.2; 111.7; 111.2; 110.2; 58.0; 55.3; 53.5; 50.5; (2-метоксифеніл)піперазин-1-іл)бутиламіну 39.2; 27.5; 24.3. (0,105г) і 0,17мл Et3N у 5мл хлороформу. Після С Η Ν (%): C24H29N3O3·0,3H2O взаємодії протягом 14 годин реакційне Розраховано: С 69,81; Η 7,23; Ν 10,18; середовище промивають водним розчином Знайдено: С 69,84; Η 7,33; Ν 10,21. NaHCO3, органічний розчинник сушать з Приклад 4 використанням MgSO4 і випарюють у вакуумі. N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутилОчищення флеш-хроматографією на силікагелі з 2-бензо[b]фуранілкарбамід використанням СН2СІ2-МеOН:9-1 дає 114мг (вихід Синтез аналогічний прикладові 1. 68% за 2 реакційні стадії) N-4-(4-(2Вихід: 105мг (вихід 58% за 2 реакційні стадії). метоксифеніл)піперазин-1-іл)бутил-2Т.пл.: 150°С. МС: m/z 446 (М+). ІЧ (NaCI): 3310; бенз[b]тіофенілкарбаміду. 2939; 2819; 1652; 1595; 1577; 1520; 1448; 1421; Т.пл.: 147°С; МС: m/z 423 (М+); ІЧ (NaCI): 3316; 1299; 1257; 1241; 1176; 1141; 1044; 960; 908; 780; 2938; 2817; 1735; 1629; 1544; 1500; 1241; 1026; 748; 713, 669, 645. 1Н-ЯМР (CDCI3, 360МГц) d 731. 1Н-ЯМР (CDCI3, 360МГц) d (м.ч.): 1.65-1.74 (m, (м.ч.): 1.67-1.75 (m, 4Н, СН2-СН2); 2.52 (t, J=6.7Гц, 4Н, СН2-СН2); 2.47 (t, 2Н, CH2N, J=6.7Гц); 2.65 (m, 2Н, CH2N); 2.69 (m, 4 Η, піперазин); 3.13 (m, 4H, 4H, піперазин); 3.08 (m, 4H, піперазин); 3.48-3.53 піперазин); 3.51-3.56 (m, 2H, CH2NCO); 6.92-6.95 (m, 2Н, CH2NCO); 3.85 (s, 3Н, ОСН3); 6.72 (t, 1H, (dd, J=2.3Гц, 7.3 Гц, 1Н, феніл); 7.00 (brt, J=4.3Гц, NH, J= 4.3Гц); 6.84-7.01 (m, 4H, феніл); 7.36-7.44 1Н, NHCO); 7.10-7.17 (m, 2H, феніл); 7.26-7.31 (m, (m, 2Н, Н5, Н6); 7.76 (s, 1Н, Н3); 7.79-7.85 (m, 2Н, 1H, H4); 7.38-7.43 (m, 1H, H6); 7.46-7.48 (m, 2H, H3, Н7, Н4). 13С-ЯМР (CDCI3, 90МГц) d (м.ч.): 162.4; H5); 7.66-7.68 (m; 1H, H7). 13С-ЯМР (CDCI3, 90МГц) 152.3; 141.2; 140.7; 139.1; 138.7; 126.2; 125.0; d (м.ч.): 158.9; 154.7; 151.2; 148.2; 134.0; 127.7; 124.9; 122.9; 122.7; 120.9; 118.2; 111.2; 57.9; 55.3; 127.5; 127.4; 126.8; 124.6; 123.7; 122.7; 118.6; 53.4; 50.5; 40.0; 27.4; 24.3. 111.6; 110.2; 57.9; 53.3; 51.1; 39.2; 27.5; 24.2. С Η Ν (%): C24H29N3O2S С Η Ν (%): C23H25Cl2N3O2 23 81630 24 хроматографією (SiO2; петролейний ефірРозраховано: С 61,89; Η 5,65; Ν 9,41; етилацетат:1-1, потім етилацетат). Знайдено: С 61,74; Η 5,86; Ν 9,05. Вихід: 41мг (28%). Приклад 5 Т.пл.: 96°С. МС m/z 432 (М+). ІЧ (NaCI): 3400; N-4-(4-(2-метоксифеніл)піперазин-1-іл) бутил2937; 2815; 2227; 1666; 1594; 1527; 1500; 1294; 5-бром-2-бензо[b]фуранілкарбамід 1240; 1141; 1118; 1025; 842; 746. 1Н-ЯМР (CDCI3, Синтез аналогічний прикладові 1. 5-Бром-2бензо[b]фуранілкарбонову кислоту одержували 360МГц) d (м.ч.): 1.67-1.74 (m, 4H, CH2-CH2); 2.49 способом, описаним у літературі [Dann, О. Liebigs (t, J=6.9Гц, 2H, CH2N); 2.69 (m, 4H, піперазин); 3.13 Ann. Chenz. 1986, 438-455]. (m, 4Н, піперазин); 3.56-3.60 (m, 2Н, CH2NCO); 3.86 Вихід: 107,8мг (вихід 56% за 2 реакційні (s, 3Н, ОСН3); 6.84-7.02 (m, 4Н, феніл); 7.12-7.15 стадії). (brt, J=5.1Гц, 1Н, NH); 7.50-7.51 (m, 1H, H4); 7.55Т.пл.: 124°С. МС m/z 485 (М+). ІЧ (NaCI): 7.57 (m, 1Н, Н3); 7.65-7.68 (m, 1Н, Н6); 8.03-8.04 (m, 3450,0; 3289,9; 3068,2; 2927,4; 2765; 1650; 1567; 1Н, Н7). 13С-ЯМР (CDCI3, 90МГц) d (м.ч.): 157.9; 1535; 1500; 1438; 1238; 1178; 1022; 802; 748. 1Н156.1; 152.3; 151.1; 141.2; 129.9; 127.8; 123.0; ЯМР (CDCI3, 360МГц) d (м.ч.): 1.67-1.74 (m, 4Н, 121.0; 118.2; 113.0; 112.3; 106.6; 109.7; 107.9; 57.9; СН2-СН2); 2.49 (t, J=6.9Гц, 2Н, CH2N); 2.69 (m, 4H, 55.4; 53.5; 50.5; 39.4; 27.4; 24.3; 21.0. піперазин); 3.13 (m, 4Н, піперазин); 3.56-3.60 (m, Приклад 8 2H, CH2NCO); 3.86 (s, 3H, OCH3); 6.85-6.87 (m, 1H, N-4-(4-(2-метоксифеніл)піперазин-1-іл) бутилфеніл); 6.91-6.93 (m, 2H, феніл); 6.97-7.00 (m, 1H, 2-бензо[b]телурофенілкарбамід феніл); 7.00 (brt, J=4.8Гц, 1H, NH); 7.32-7.35 (d, J= Синтез аналогічний прикладові 7. 8.9Гц, 1H, H4); 7.38-7.39 (m, 1H, H3); 7.48 (dd, Вихід: 73мг (58 %). J=8.7Гц, J=2.0Гц, 1H, H6); 7.79-7.80 (m, 1H, H7). Т.пл.: 85°С. МС m/z 521 (М+). ІЧ (KВr): 3320; 13 С-ЯМР (CDCI3, 90МГц) d (м.ч.): 158.4; 153.3; 3047; 2933; 2815; 1616; 1566; 1541; 1375; 1498; 152.3; 150.1; 141.2; 129.7; 129.6; 125.2; 122.9; 1240; 1023; 748. 1Н-ЯМР (CDCI3, 360МГц) d (м.ч.): 120.9; 120.9; 118.2; 116.7; 113.1; 111.2; 109.4; 64.8; 1.62-1.66 (m, 4Н, СН2-СН2); 2.42-2.45 (t, J= 6.7Гц, 57.9; 55.3; 53.5; 50.4; 39.3; 27.5; 24.3. 2Н, CH2N); 2.63 (m, 4H, піперазин); 3.04 (m, 4H, С Η Ν (%): C24H29BrN3O2 піперазин); 3.38-3.43 (m, 2Н, CH2NCO); 3.78 (s, 3Н, Розраховано: С 59,26; Η 5,80; Ν 8,64; ОСН3); 6.70-6.76 (brt, J=4.3Гц, 1Н, NH); 6.77-6.83 Знайдено: С 59,05; Η 5,81; Ν 8,68. (m, 3Н, феніл); 6.94-6.96 (m, 1H, феніл); 7.09-7.14 Приклад 6 (m, 1H, Н6); 7.28-7.32 (m, 1Н, Н5); 7.74-7.76 (d, N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)-бутилJ=7,5Гц, 1Н, Н4); 7.84-7.86 (d, J=7.8Гц, 1Н, Н7); 8.13 5-бром-2-бензо[b]фуранілкарбамід (s, 1H, Н3). 13С-ЯМР (CDCI3, 90МГц) d (м.ч.): 166.1; Синтез аналогічний прикладові 5. 152.3; 147.9; 141.2; 140.2; 134.8; 132.3; 129.3; Вихід: 102мг (вихід 47% за 2 реакційні стадії). 125.8; 125.5; 122.9; 121.0; 118.2; 111.2; 57.9; 55.3; Т.пл.: 145°С. МС m/z 524 (М+); ІЧ (NaCI): 3400; 53.3; 50.5; 40.4; 27.4; 24.4. 2937; 2815; 2227; 1666; 1594; 1527; 1500; 1294; Приклад 9 1240; 1141; 1118; 1025; 842; 746. 1Н-ЯМР (CDCI3, N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил360МГц) d (м.ч.): 1.63-1.74 (m, 4Н, СН2-СН2); 2.492-бензо[b]телурофенілкарбамід 2.52 (t, J=6,7Гц, 2Н, CH2N); 2.68 (m, 4H, піперазин); Синтез аналогічний прикладові 7. 3.09 (m, 4H, піперазин); 3.49-3.56 (m, 2Н, CH2NCO); Вихід: 92мг (45 %) 6.92-6.94 (dd, J=2.1Гц, J=7.5Гц, 1Н, феніл); 6.98Т.пл.: 92°С. МС m/z 560 (М+). 14 (NaCI): 3288; 7.01 (brt, J=3.0Гц, 1Н, NH); 7.33-7.36 (d, J=5.3Гц, 2938; 2819; 1651; 1578; 1557; 1448; 1242; 1044; 1H, H4); 7.39 (m, 1Н, Н3); 7.48-7.51 (dd, J=8.7Гц, 734. 1Н-ЯМР (CDCI3, 360МГц) d (м.ч.): 1.63-1.74 (m, J=2.0Гц, 1Н, Н6); 7.80-7.81 (d, J=2.0Гц; 1Н, Н7). 13С4Н, СН2-СН2); 2.48-2.52 (t, J=7.1Гц, 2Н, CH2N); 2.66 ЯМР (CDCI3, 90МГц) d (м.ч.): 157.9; 156.1; 152.3; (m, 4H, піперазин); 3.05 (m, 4Η, піперазин); 3.46151.1; 141.2; 129.9; 127.8; 123.0; 121.0; 118.2; 3.51 (m, 2H, CH2NCO); 6.70-6.72 (brt, J=4.8Гц, 1Н, 113.0; 112.3; 106.6; 109.7; 107.9; 57.9; 55.4; 53.5; NH); 6.83-6.86 (dd, J=1.8Гц, J=7.8Гц, 1H, феніл); 50.5; 39.4; 27.4; 24.3; 21.0. 7.07-7.22 (m, 3H, феніл, H6); 7.36-7.41 (m, 1H, H5); С Η Ν (%): C23H24BrCI2N3O2 7.81-7.83 (d, J=7.6Гц, 1H, Н4); 7.91-7.94 (d, J=7.6Гц, Розраховано: С 52,57; Η 4,67; Ν 8,03; 1Н, Н7); 8.17 (m, 1Н, Н3). 13С-ЯМР (CDCI3, 90МГц) d Знайдено: С 52,63; Η 4,67; Ν 8,03. (м.ч.): 166.1; 151.1; 147.9; 140.2; 135.0; 134.9; Приклад 7 134.0; 132.3; 129.2; 127.5; 127.4; 125.8; 125.5; N-4-(4-(2-метоксифеніл)піперазин-1-іл) бутил124.6; 118.6; 58.0; 53.3; 51.2; 40.4; 27.5; 24.4. 5-ціано-2-бензо[b]фуранілкарбамід Приклад 10 0,37ммоль (141мг) HATU і 0,37ммоль (69мг) 5Ν-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутилціано-2-бензо[b]фуранілкарбонової кислоти [Dann, 2-індолілкарбамід 0. Liebigs Ann. Chem. 1986, 438-455] розчиняють у Синтез аналогічний прикладові 1. 1мл DMF при 0°С і додають 0,74ммоль (0,13мл) Вихід: 48мг (вихід 58% з двох реакційних діізопропілетиламіну (DIEA). Потім 0,33ммоль стадій). (87мг) 4-(4-(2-метоксифеніл)піперазин-1Т.пл.: 148°С. МС m/z 444 (М+). ІЧ (NaCI): 3258; іл)бутиламіну розчиняють у DMF і по краплях 3059; 2938; 2821; 1636; 1577; 1555; 1507; 1448; додають у реакційний розчин при 0°С. Через одну 1420; 1308; 1241; 1139; 1044; 961; 908; 779; 747; годину реакційне середовище переносять у СНСІ3 733; 669; 647. 1Н-ЯМР (CDCI3, 360МГц) d (м.ч.): і промивають розчином NaHCO3 і водою. Після 1.67-1.74 (m, 4Н, СН2-СН2); 2.47-2.51 (t, J=6.9Гц, сушіння з використанням MgSO4 розчинник 2Н, CH2N); 2.67 (m, 4H, піперазин); 3.13 (m, 4H, випарюють, і залишок очищають флешпіперазин); 3.53-3.55 (m, 2H, CH2NCO); 6.59-6.66 25 81630 26 (brt, J=4.3Гц, 1H, NHCO); 6.85 (s, 1H, H3); 6.90-6.93 індолкарбонової кислоти розчиняють у 5мл DMF (m, 1H, феніл); 7.07-7.17 (m, 3H, феніл, H3); 7.28при 0°С і додають 0,48ммоль (0,094мл) DIEA. 7.30 (m, 1H, H6); 7.43-7.46 (m, 1H, H7); 7.62-7.65 (m, Потім 0,26ммоль (78мг) 4-(4-(2,3дихлорфеніл)піперазин-1-іл)бутиламіну 1H, H4); 9.56 (s, 1H, NH). 13С-ЯМР (CDCI3, 90МГц) d розчиняють у DMF і по краплях додають у (м.ч.): 161.7; 160.4; 151.1; 136.2; 134.0; 130.9; реакційний розчин при 0°С. Через три години 127.5; 127.4; 121.8; 120.8; 118.5; 111.9; 101.8; 68.2; реакційне середовище переносять у СНСІ3 і 57.9; 53.3; 51.1; 39.5; 27.5; 24.3. промивають розчином NaHCO3 і водою. Після Приклад 11 сушіння з використанням MgSO4 розчинник N-4-(4-(2-метоксифеніл)піперазин-1-іл) бутилвипарюють, і залишок очищають флеш5-ціан-2-індолілкарбамід хроматографією (SiO2; СНСІ3:ММ, 98:2). Вихід: Синтез аналогічний прикладові 7. 94мг (74%). Вихід: 109мг(42%). МС m/z 524 (М+). ІЧ (NaCI): 3234; 2932, 2821; Т.пл.: 170°С. МС m/z 431 (М+). 1Н-ЯМР (CDCI3, 1637; 1577; 1545; 1282; 1046; 733. 1Н-ЯМР (CDCI3, 360МГц) d (м.ч.): 1.74-1.78 (m, 4Н, СН2-СН2); 2.54360МГц) d (м.ч.): 1.57-1.73 (m, 4Н, СН2-СН2); 2.51 2.65 (t, J =6.7Гц, 2Н; CH2N); 2.79 (m, 4H, (t, J=6.9Гц, 2Н, CH2N); 2.66 (m, 4H, піперазин); 3.07 піперазин); 3.17 (m, 4H, піперазин); 3.55-3.59 (m, (m, 4H, піперазин); 3.51-3.63 (m, 2H, CH2NCO); 6.64 2Н, CH2NCO); 3.85 (s, 3H, OCH3); 6.84-6.87 (d, (brt, J=5.3Гц, 1Н, NHCO); 6.77 (d, J=1.8Гц, 1Н, J=8.5Гц, 1H, Н3); 6.88-6.90 (m, 3Н, феніл); 6.99-7.05 феніл, Н4); 6.90 (dd, J=2.1Гц, J=7.5Гц, 1H, феніл); (m, 2H, феніл, Н4); 7.07-7.12 (brt, J=3.9Гц, 1H, 7.10-7.17 (m, 2Н, феніл); 7.31-7.38 (m, 2Н, Н6, Н3); NHCO); 7.47-7.50 (dd, J=1.4Гц, J=8.5Гц, 1H, H6); 7,76-7,77 (m, 1Н, Н7); 9.68 (s, 1Н, NH). 7.52-7.54 (d, J=8.5Гц, 1H, Н7); 8.01 (s, 1H, Н3); 10.14 Приклад 15 (s, 1H, NH). 13С-ЯМР (CDCI3, 90МГц) d (м.ч.): 152.2; N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил140.7; 137.7; 133.3; 127.8; 127.3; 126.7; 123.4; 6-ціано-2-індолілкарбамід 121.1; 120.2; 118.3; 111.3; 103.9; 102.9; 57.6; 55.4; Синтез аналогічний прикладові 7. 53.5; 50.0; 39.2; 27.0; 24.2. Вихід: 102мг(59%). Приклад 12 Т.пл.: 174°С. МС m/z 470(М+). ІЧ (NaCI): 3215; N-4-(4-(2-метоксифеніл)піперазин-1-іл) 6утил2926; 2821; 1634; 1570; 1506; 1239; 1034; 734. 1Н5-бром-2-індолілкарбамід ЯМР (CDCI3, 360МГц) d (м.ч.): 1.69-1.82 (m, 4Н, Синтез аналогічний прикладові 7. СН2-СН2); 2.51 (t, J=6.9Гц, 2Н, CH2N); 2.66 (m, 4H, Вихід: 112 мг(60%). піперазин); 3.06 (m, 4H, піперазин); 3.58-3.63 (m, Т.пл.: 188°С. 1Н-ЯМР (CDCI3, 360МГц) d (м.ч.): 2Н, CH2NCO); 6.85 (brt, J=5.5Гц, 1H, NHCO); 6.881.64-1.74 (m, 4Н, СН2-СН2); 2.46-2.51 (t, J=7.1Гц, 6.91 (m, 2H, феніл, Н3); 7.09-7.17 (m, 2H, феніл); 2Н, CH2N); 2.68 (m, 4H, піперазин); 3.12 (m, 4H, 7.35 (dd, J=1.4Гц, J=8.2 Гц, 1H, Н5); 7.70 (d, піперазин); 3.49-3.64 (m, 2Н, CH2NCO); 3.83 (s, 3H, J=8.5Гц, Н4); 7.84 (s, 1Н, Н7); 10.65 (s, 1H, NH). OCH3); 6.68-6.71 (brt, J=5.3Гц, 1Н, NHCO); 6.76Приклад 16 6.77 (d, J=1.8Гц, 1H, H4); 6.85-6.87 (d, J=7.8Гц, 1Н, N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-2феніл); 6.92-6.93 (d, J=3.9Гц, 2Н, феніл); 6.98-7.03 фероценілкарбамід (m, 1H, феніл); 7.31-7.38 (m, 2H, Н6, Н7); 7.76-7.77 Синтез аналогічний прикладові 7. (m, 1H, H3);9.64(s, 1Н, NH). Вихід: 155мг (71%). Приклад 13 МС m/z 475 (М+). ІЧ (NaCI): 3318, 2939, 2816, N-4-(4-(2-метоксифеніл)піперазин-1-іл) бутил1630, 1543, 1500, 1241, 1027, 748. 1Н-ЯМР (CDCI3, 6-ціан-2-індолілкарбамід 360МГц) d (м.ч.): 1.66-1.69 (m, 4Н, СН2-СН2); 2.57 Синтез аналогічний прикладові 1. (t, J=6.7Гц, 2Н, CH2Nj; 2.77 (m, 4H, піперазин); 3.16 Вихід: 112мг (вихід 58% за 2 реакційні стадії). (m, 4H, піперазин); 3.39-3.44 (m, 2H, CH2NCO); 3.86 Т.пл.: 174°С. МС m/z 431 (М+). ІЧ (NaCI): 2940; (s, 3H, OCH3); 4.17-4.21 (m, 3Н, Ferr); 4.32-4.33 (m, 2909; 2803; 2753; 2216; 1645; 1548; 1498; 1321; 2H, Ferr); 4.68-4.69 (m, 2H, Ferr); 6.02 (brt, J=5.3Гц, 1237; 1148; 820; 754; 742. 1Н-ЯМР (CDCI3, 360МГц) 1Н, NH); 6.85-6.94 (m, 3Н, феніл); 6.99-7.03 (m, 1H, d (м.ч.): 1.67-1.82 (m, 4Н, СН2-СН2); 2.47-2.51 (t, феніл). 13С-ЯМР (CDCI3, 90МГц) d (м.ч.): 170.3; J=6.7Гц, 2Н, CH2N); 2.66 (m, 4H, піперазин); 3.68152.2; 140.9; 123.1; 120.9; 118.3; 111.2; 77.2; 76.3; 3.70 (m, 2H, CH2NCO); 3.85 (s, 3H, OCH3); 3.09 (m, 70.3; 69.7; 68.1; 57.9; 55.3; 53.4; 50.1; 39.2; 27.7; 4H, піперазин); 6.84-6.94 (m, 4H, феніл, H3); 6.9923.8. 7.02 (m, 1H, феніл); 7.13-7.16 (brt, J=5.5Гц, 1Н, Приклад 17 NHCO); 7.31-7.34 (m, 1H, H3); 7.67-7.69 (d, J=8.5Гц, N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутилH4); 7.84 (s, 1H, H7); 11.22 (s, 1H, NH). 13С-ЯМР 2-фероценілкарбамід (CDCI3, 90МГц) d (м.ч.): 161.2; 152.2; 141.1; 135.2; Синтез аналогічний прикладові 7. 134.3; 130.5; 123.0; 122.9; 122.7; 120.9; 120.2; Вихід: 85мг (69 %) 118.1; 117.4; 111.2; 106.6; 102.2; 57.8; 55.3; 53.8; МС m/z 514 (М+). 1Н-ЯМР (CDCI3, 360МГц) d 53.4; 50.4; 39.8; 30.1; 27.3; 24.3. (м.ч.): 1.63-1.66 (m, 4Н, СН2-СН2); 2.48 (t, J=6.9Гц, С Η Ν (%): C25H29N5O2·1,4H2O 2Н, CH2N); 2.65 (m, 4H, піперазин); 3.08 (m, 4H, Розраховано: С 65,74; Η 7,02; Ν 15,33; піперазин); 3.39-3.44 (m, 2Н, CH2NCO); 4.17-4.21 Знайдено: С 65,98; Η 7,30; Ν 14,87. (m, 3Н, Ferr); 4.33-4.34 (m, 2Н, Ferr); 4.64-4.65 (m, Приклад 14 2Н, Ferr); 5.38 (brt, J=5.1Гц, 1Н, NH); 6.92-6.98 (m, Ν-4-(4-(2,3-дихлорфеніл)піперазин-1-іл) бутил1Н, феніл); 7.11-7.17 (m, 2Н, феніл). 5-бром-2-індолілкарбамід Приклад 18 0,24ммоль (58мг) HATU, 0,24ммоль HOAt (33мг) і 0,24ммоль (69мг) 5-бром-2 27 81630 28 J=5.7, 1Н, NH); 7.53 (dd, J=1.4Гц, J=8.2Гц, 1H, H5); N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-57.84 (d, J=7.8Гц, 1H, Н4); 7.84 (s, 1Н, Н3); 8.10-8.11 ціано-2-бензо[b]тіофенілкарбамід Розчиняють 0,012ммоль (94мг) HATU і (m, 1Н, Н7). 13С-ЯМР (CDCI3, 90МГц) d (м.ч.): 161.5; 0,012ммоль (25мг) 5-ціано-2152.3; 141.9; 141.0; 140.4; 127.5; 127.4; 125.6; бензо[b]тіофенкарбонової кислоти [Bridges, A. J. 124.2; 123.1; 120.9; 118.8; 11,8.1; 111.3; 109.5; 77.2; Tetr. Lett. 1992, 7499-7502] у 1мл DMF і 4мл CH2CI2 76.3; 70.3; 69.7; 68.1; 57.9; 55.3; 53.4; 50.4; 40.1; при 0°С і додають 0,024ммоль (0,06мл) DIEA. 27.3; 24.2. Потім 0,013ммоль (34мг) 4-(4-(2Приклад 21 метоксифеніл)піперазин-1-іл)бутиламіну Ν-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутилрозчиняють у СН2СІ2 і по краплях додають у 6-ціано-2-бензо[b]тіофенілкарбамід реакційний розчин при 0°С. Через дві години Синтез аналогічний прикладові 18. реакційне середовище переносять у СНСІ3 і Вихід: 26мг (43 %). промивають розчином NаНСО3 і водою. Після Т.пл.: 137°С. МС m/z 486 (М+). ІЧ (KВr): 3335; сушіння з використанням MgSO4 розчинник 2933; 2821; 2226; 1638; 1544; 1448; 1242; 1044; випарюють, і залишок очищають флеш735. 1Н-ЯМР (СОСІ3, 360МГц) d (м.ч.): 1.67-1.74 (m, хроматографією (SiO2; метиленхлорид-метанол: 4Н, СН2-СН2); 2.49 (t, J=6.4Гц, 2Н, CH2N); 2.65 (m, 98-2). 4H, піперазин); 3.04 (m, 4H, піперазин); 3.49-3.54 Вихід: 60мг(91%). (m, 2H, CH2NCO); 6.75 (br, t, J=4.1Гц, 1Н, NH); 6.84 Т.пл.: 147°С. МС m/z 448 (М+). ІЧ (KВr): 3336; (dd, J=1.8Гц, 7.8Гц, 1H, феніл); 7.08-7.17 (m, 2H, 2929; 2816; 2225; 1635; 1500; 1240; 1028; 750. 1Нфеніл); 7.60-7.62 (m, 1H, Н5); 7.78 (s, 1H, Н3); 7.88ЯМР (CDCI3, 360МГц) d (м.ч.): 1.73-1.77 (m, 4Н, 7.90 (m, 1Н, H4); 8.19 (br, s, 1Н, Н7). 13С-ЯМР СН2-СН2); 2.59 (t, J=6.4Гц, 2Н, CH2N); 2.78 (m, 4H, (CDCI3, 90МГц) d (м.ч.): 161.4; 151.1; 143.6; 141.8; піперазин); 3.14 (m, 4H, піперазин); 3.49-3.53 (m, 140.3; 134.1; 127.5; 127.4; 125.2; 124.7; 124.2; 2Н, CH2NCO), 3.85 (s, 3Н, OCH3); 6.84-6.92 (m, 5Н, 118.7; 118.4; 109.5; 109.5; 58.0; 53.3; 51.3; 51.2; феніл, NH); 6.99-7.04 (m, 1Н, феніл); 7.60 (dd, 40.3; 27.4; 24.3. J=1.4Гц, J=8.5Гц, 1Н, Н6); 7.88 (s, 1H, Н3); 7.95 (d, С Η Ν (%): C24H25CI2N5O·H2O J=8.5Гц, 1Н, Н7); 8.12 (d, J=1.1Гц, 1Н, Н4). 13С-ЯМР Розраховано: С 59,02; Η 5,57; Ν 14,34. (CDCI3, 90МГц) d (м.ч.): 170.3; 152.2; 140.9; 123.1; Знайдено: С 58,76; Η 5,30; Ν 14,19. 120.9; 118.3; 111.2; 77.2; 76.3; 70.3; 69.7; 68.1; 57.9; Приклад 22 55.3; 53.4; 50.1; 39.2; 27.7; 23.8. N-4-(4-(2-метоксифеніл)піперазин-1-іл) бутилС Η Ν (%) C24H25CI2N5O·1H2O 5-6ром-2-бензо[b]тіофенілкарбамід Розраховано: С 64,35; Η 6,48; Ν 12,01; S 6.87. Синтез аналогічний прикладові 7. Знайдено: С 64,59; Η 6,13; Ν 11,77; S 6,44. Вихід: 73мг (58%). Приклад 19 Т.пл.: 156°С. МС m/z 502 (М+). ІЧ (KВr): 3316; N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутил2934; 2821; 1633; 1558; 1500; 1242; 1026; 750. 1Н5-ціан-2-бензо[b]тіофенілкарбамід ЯМР (CDCI3, 360МГц) d (м.ч.): 1.69-1.72 (m, 4Н, Синтез аналогічний прикладові 18. СН2-СН2); 2.57 (t, J=6.5Гц, 2Н, CH2N); 2.77 (m, 4H, Вихід: 57мг (96%). піперазин); 3.12 (m, 4H, піперазин); 3.49-3.51 (m, Т.пл.: 190°С. МС m/z 487 (М+). ІЧ (KВr): 3319; 2Н, C2NCO); 3.85 (s, 3Η, ОСН3); 6.83-6.91 (m, 4H, 2929; 2819; 2227; 1633; 1560; 1448; 1242; 1045; феніл); 7.01-7.06 (m, 1H, феніл); 7.15 (brt, J=4.9Гц, 755. 1Н-ЯМР (СВСІ3, 360МГц) d (м.ч.): 1.65-1.76 (m, 1Н, NH); 7.42 (dd, J=8.5Гц, J=1.8Гц, 1H, Н6); 7.60 (d, 4Н, СН2-СН2); 2.49 (t, J=6.7Гц, 2Н, CH2N); 2.65 (m, J=8.5Гц, 1Н, Н7); 7.73 (s, 1Н, Н3); 7.86 (d, J=1.7Гц, 4H, піперазин); 3.04 (m, 4H, піперазин); 3.49-3.55 1Н, Н4). 13С-ЯМР (CDCI3, 90МГц) d (м.ч.): 170.3; (m, 2H, CH2NCO); 6.78 (br, t, J=5.0Гц, 1Н, NH); 6.85 152.2; 140.9; 123.1; 120.9; 118.3; 111.2; 77.2; 76.3; (dd J=1.8Гц, J=7.8Hz, 1H, феніл); 7.09-7.17 (m, 2H, 70.3; 69.7; 68.1; 57.9; 55.3; 53.4; 50.1; 39.2; 27.7; феніл); 7.62 (dd, J=1.4Гц, J=8.5Гц, 1Н, H6); 7.77 (s, 23.8. 1H, H3); 7.95 (d, J=8.2Гц, H7); 8.13 (d, J=1.4Гц, 1H, С Η Ν (%): C24H28BrN3O2S 13 H4), С-ЯМР (CDCI3, 90МГц) d (м.ч.): 161.4; 151.1; Розраховано: С 57,37; Η 5,62; Ν 8.36. 144.5; 142.0; 138.8, 134.1; 129.4, 127.9; 127.5, Знайдено: С 65,98; Η 7,30; Ν 14.87. 127.4; 124.7; 123.9; 123.8; 118.9; 118.4; 108.9; 57.9; Приклад 23 53.3; 51.2; 40.2; 27.4; 24.3. N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл)бутилС Η Ν (%) C20H26CI2N4OS·1,46H2O 5-бром-2-бензо[b]тіофенілкарбамід Розраховано: С 56,11; Η 5,28; Ν 10,90. Синтез аналогічний прикладові 7. Знайдено: С 56,51; Η 5,06; Ν 10,45. Вихід: 78мг (60 %). Приклад 20 Т.пл.: 178°С. МС m/z 541 (М+). ІЧ (KВr): 3316; N-4-(4-(2-метоксифеніл)піперазин-1-іл)бутил-62929; 2821; 1631; 1560; 1242; 1068; 756. 1Н-ЯМР ціано-2-6ензо[b]тіофенілкарбамід (CDCI3, 360МГц) d (м.ч.): 1.63-1.69 (m, 4Н, СН2Синтез аналогічний прикладові 18. СН2); 2.48 (t, J=6.7Гц, 2H, CH2N); 2.64 (m, 4H, Вихід: 30мг (43%). піперазин); 3.04 (m, 4H, піперазин); 3.48-3.53 (m, Т.пл.: 124°С. МС m/z 448 (М+). ІЧ (KВr): 3290; 2Н, CH2NCO); 6.71 (br, t, J=5.1Гц, 1H, NH); 6.832937; 2816; 2225; 1619; 1543; 1500; 1242; 1026; 6.86 (m, 1H, феніл); 7.09-7.17 (m, 2H, феніл); 7.51 751. 1Н-ЯМР (СОСІ3, 360МГц) d (м.ч.): 1.72-1.90 (m, (dd, J=1.8Гц. J=8.5Гц, 1H, H6); 7.67 (s, 1H, H3); 7.72 4H, СН2-СН2); 2.90 (t, J=7.3Гц, 2Н, CH2N); 3.15 (m, (d, J=8.5Гц, 1H, H7); 7.95 (d, J=1.8Гц, 1H, H4). 13С4H, піперазин); 3.31 (m, 4H, піперазин); 3.50-3.56 ЯМР (CDCI3, 90МГц) d (м.ч.): 161.9; 160.8; 140.7; (m, 2Н, CH2NCO), 3.82 (s, 3Н, ОСН3); 6.84-6.92 (m, 140.6. 139.2; 134.1; 129.3; 127.4; 127.3; 124.6; 3Н, феніл); 7.01-7.07 (m, 1Н, феніл); 7.13 (br, t, 29 81630 30 124.1; 123.8. 118.9; 118.5; 57.9; 55.3; 51.2; 40.2; НТ1А) або [3Н]-кетансерин (5-НТ2) і сполуками за 27.5; 24.4. винаходом. Показники одночасного зв'язування С Η Ν (%): C23H24BrCI2N3OS·0,25H2O сполук із серотонінергічним 5-НТ2-рецептором і Розраховано: С 50,61; Η 4,52; Ν 7,70; S 5,87; адренергічним рецептором підтипу a1 при міченні Знайдено: С 50,61; Η 4,49; Ν 7,64; S 5,87. радіолігандом [3Н]-кетансерин підтверджували в Приклад 24 паралельному експерименті із селективним N-4-(4-(2-метоксифеніл)піперазин-1-іл)6утил-2блокуванням a1-рецепторів празозином. Тому індолілкарбамід величини Kі, визначені в присутності 10мкМ Синтез аналогічний прикладові 7. празозину, представляють зв'язок тільки з 5-НТ2Вихід: 89мг (55 %). рецептором. Крім того, афінність до a1-рецепторів МС m/z406 (M+). ІЧ (NaCI): 3251; 3055; 2935; свині визначали в окремому експерименті з 2809; 1639; 1549; 1241; 1016; 746. 1Н-ЯМР (CDCI3, використанням a1-селективного радіоліганду [3Н]360МГц) d (м.ч.): 1.67-1.74 (m, 4Н, СН2-СН2); 2.48 празозин. (t, J=6.7Гц, 2Н, CH2N); 2.67 (m, 4H, піперазин); 3.11 Результати аналізів зв'язування з (m, 4H, піперазин); 3.51-3.56 (m, 2H, CH2NCO); 3.85 рецепторами по підтипах дофамінових рецепторів (s, 1H, OCH3); 6.59 (br, t, J=4.9Гц, 1H, NHCO); 6.83підсумовані в таблиці 1. 6.94 (m, 3H, феніл); 6.97-7.02 (m, 1H, феніл); 7.11Усі сполуки, тестовані в аналізі зв'язування, 7.15 (m, 1H, H5); 7.25 (s, 1H, H3); 7.29 (dd, J=1.1Гц, показали гарні і дуже гарні афінності до J=7.1Гц, 1Н, H6); 7.43 (d, J=8.9Гц, 1Н, H7); 7.63 (d, дофамінових рецепторів з чіткою перевагою J=8.9Гц, 1Н, H4); 9.50 (s,1H). зв'язування з підтипами сімейства D2. Незалежно Приклад 25 від часткової структури, завжди очевидна чітка N-4-(4-(2,3-дихлорфеніл)піперазин-1-іл) бутилселективність стосовно D3-рецепторів. Найвища 5-ціано-2-індолілкарбамід афінність до D3 може бути досягнута, якщо як Синтез аналогічний прикладові 7. гетероареновий компонент використовувати Вихід: 102мг (59%). бензо[b]тіофен або індол. Наприклад, сполуки + Т.пл.: 96°С. МС m/z 470 (М ). ІЧ (КВг): 3315; прикладів 1, 2, 10-13 і 19-22 мають чудові 2926; 2821; 2218, 1634; 1570; 1506; 1239; 1043; величини Kі від 0,23 до 0,57нм. 1 734. Н-ЯМР (CDCI3, 360МГц) d (м.ч.): 1.69-1.82 (m, Паттерн заміщення арилпіперазинового 4Н, СН2-СН2); 2.51 (t, J=6.9Гц, 2Н, CH2N); 2.66 (m, компонента головним чином впливає на ступінь 4H, піперазин); 3.06 (m, 4H, піперазин); 3.58-3.63 селективності афінності до D3 у порівнянні з (m, 2Н, CH2NCO); 6.85 (br, t, J=5.5Гц, 1H, NHCO); іншими підтипами рецепторів. Маючи коефіцієнти 6.88-6.91 (m, 2H, феніл, Н3); 7.09-7.17 (m, 2H, селективності більш 1000, 2,3-дихлорфенілфеніл); 7.35 (dd, J=1.4Гц, J=8.2Гц, 1H, Н5); 7.70 (d, заміщені сполуки (приклади 2, 6, і 10) виявляють J=8.5Гц, Н4); 7.84 (s, 1Н, Н7); 10.65 (s, 1H, NH). 13Сраніше не описану селективність до D3 із ЯМР (CDCI3, 90МГц) d (м.ч.): 161.2; 151.1; 135.2; супутньої субнаномолярною афінністю. Цікаво, що 134.3; 134.0; 130.5; 127.5; 127.4; 124.6; 123.1; фероценілові похідні прикладів 16 і 17 122.8; 120.1; 118.5; 117.2; 106.9; 102.0; 58.7; 53.3; відрізняються високою афінністю до D4, причому 51.2; 41.1; 39.9; 24.4. сполука прикладу 17 з величиною Kі 0,47нМ для С Η Ν (%): C24H25CI2N5OH2O D3-рецептора і 0,63нМ для D4-рецептора Розраховано: С 59,02; Η 5,57; Ν 14,34. демонструє екстраординарний профіль Знайдено: С 58,76; Η 5,30; Ν 14,19. зв'язування з рецепторами. Біологічна активність Тести для визначення власної активності Біологічну активність сполук за винаходом сполук прикладів проводили в аналізі мітогенезу визначали аналізами зв'язування радіолігандів. Всі як описано в літературі [Hübner, Η. et al. J. Med. експерименти з радіолігандами проводили Chem. 2000, 43, 4563-4569; Löber, S. Bioorg. Med. методами, описаними авторами даного винаходу Chem.Lett. 2002, 12.17, 2377-2380]. Ілюстративною [Hiibner, Η. et al. J. Med. Chem. 2000, 43, 756-762]. для сполуки прикладу 1 є часткова агоністична Для виміру афінностей до рецепторів сімейства активність, що складає 49% від максимальної D2 використовували гомогенати мембран клітин стимуляції рецепторів, що може бути ініційована яєчників китайського хом'ячка (клітин СНО), що повним агоністом квінпиролом як еталонною стабільно експресували підтипи людських сполукою. У результаті обчислень за кривою рецепторів D2long, D2short [Hayes, G. et al. Мої. концентрація-активність, отриманій в цьому тесті, Endocrinol. 1992, 6, 920-926], D3 [Sokoloff, P. et al. одержали величину ЕС50 0,38нМ. Eur. J. Pharmacol. 1992, 225, 331-337] або D4.4 [Asghari, V. J. Neurochem. 1995, 65, 1157-1165]. В цілому, аналізи зв'язування проводили інкубацією гомогенатів рецепторів з радіолігандом [3Н]спиперон і тестованою сполукою у різних концентраціях. Афінності до D1-рецепторів визначали з використанням гомогенатів нативних мембран, отриманих зі смугастого тіла мозку свині, і D1-селективного радіоліганду [3H]-SCH23390. Для визначення сил зв'язування сполук із серотоніновими рецепторами підтипів 5-НТ1А і 5НТ2 інкубували мембрани кори головного мозку свині з радіолігандами [3H]-8-OH-DPAT (для 5 31 Результати дослідження афінності до серотонінових рецепторів підтипів 5-НТ1А і 5-НТ2 і до адренергічного рецептора a1 приведені в таблиці 2. Незалежно від часткової структури похідних можна спостерігати переважне зв'язування з підтипом 5-НТ1А у порівнянні з 5НТ2. Маючи виміряні величини Kі від 8 до 19нм, сполуки прикладів 1, 3, 7, 8 і 16 відрізняються високою афінністю до ос1-рецептора. Аналіз співвідношення структура/активність показує чітку залежність зв'язування цих рецепторів від паттерна заміщення арилпіперазинової частини структури. Як і у випадку з дофаміновими рецепторами, зв'язування з 5-НТ-рецептором і з a1-рецептором явно нижче в похідних з 2,3-дихлорфенільним радикалом, що приводить до розширення спектра селективності в порівнянні з афінністю цих сполук до D3-рецептора. 81630 32
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of heteroarene carboxamide as dopamine-d3 ligands for the treatment of cns diseases
Автори англійськоюGmeiner Peter, Huebner Harald, Schlotter Karin
Назва патенту російськоюПрименение гетероаренкарбоксамидов как дофамин-d3 лигандов для лечения заболеваний центральной нервной системы
Автори російськоюГмайнер Петер, Хюбнер Харалд, Шлоттер Карин
МПК / Мітки
МПК: A61P 25/16, A61P 25/22, A61P 27/06, A61K 31/555, C07D 333/70, A61P 25/32, A61P 25/00, C07F 17/00, A61P 25/14, A61P 25/36, A61P 15/10, A61P 25/24, C07D 209/42, A61K 31/496, A61P 25/20, A61P 25/18, A61P 43/00, A61P 25/08, A61P 35/00, C07D 345/00, A61P 25/28, A61P 5/24, A61P 21/02, C07D 307/85, A61P 25/34
Мітки: системі, дофамін-d3, застосування, лікування, нервової, захворювань, лігандів, гетероаренкарбоксамідів, центральної
Код посилання
<a href="https://ua.patents.su/16-81630-zastosuvannya-geteroarenkarboksamidiv-yak-dofamin-d3-ligandiv-dlya-likuvannya-zakhvoryuvan-centralno-nervovo-sistemi.html" target="_blank" rel="follow" title="База патентів України">Застосування гетероаренкарбоксамідів як дофамін-d3 лігандів для лікування захворювань центральної нервової системи</a>
Попередній патент: Застосування композиції і спосіб лікування інфекційних захворювань у великої рогатої худоби та свиней
Наступний патент: Спосіб та установка для високотемпературної теплової обробки та ущільнення вуглецевих конструкцій хімічною інфільтрацією із газової фази
Випадковий патент: Упаковка з декількома пачками, з'єднаними між собою












