Моногідрат 4-[4-({[4-хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3-фторфенокси]-n-метилпіридин-2-карбоксаміду
Номер патенту: 95984
Опубліковано: 26.09.2011
Автори: Кайль Біргіт, Штіль Юрген, Тенбіг Катаріна, Груненберг Альфонс
Формула / Реферат
1. Сполука формули (II)
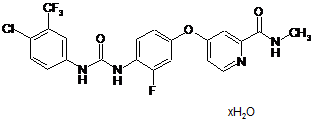 (ІІ).
(ІІ).
2. Сполука за п. 1, яка в рентгенівській дифрактометрії проявляє максимум піка при куті 2q 21,2.
3. Сполука за п. 1, яка у ДІЧ спектрі показує максимум піка при 353 см-1.
4. Спосіб одержання сполуки формули (II) за будь-яким з пп. 1-3, за яким 4-[4-({[4-хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3-фторфенокси]-N-метилпіридин-2-карбоксамід розчиняють і додають воду до утворення осаду.
5. Спосіб одержання сполуки формули (II) за будь-яким з пп. 1-3, за яким 4-[4-({[4-хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3-фторфенокси]-N-метилпіридин-2-карбоксамід суспендують у водному розчиннику, а потім перемішують або струшують до перетворення у сполуку формули (II).
6. Застосування сполуки формули (II) за будь-яким з пп. 1-3 для одержання лікарського засобу для лікування гіперпроліферативних розладів.
7. Застосування за п. 6, для лікування солідних пухлин, лімфоми, саркоми, лейкемії, раку грудей, дихальних шляхів, мозку, статевих органів, травного тракту, сечових шляхів, ока, печінки, шкіри, голови та шиї, щитовидної залози та/або паращитовидної залози.
8. Фармацевтична композиція для лікування гіперпроліферативних розладів, яка в основному містить сполуку формули (II) за будь-яким з пп. 1-3, незначні фракції інших форм 4-[4-({[4-хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3-фторфенокси]-N-метилпіридин-2-карбоксаміду, а також один або більшу кількість інертних, нетоксичних, фармацевтично прийнятних ексципієнтів.
9. Фармацевтична композиція за п. 8, яка містить більше ніж 90 вагових відсотків сполуки формули (II) за будь-яким з пп. 1-3 відносно загальної кількості сполука формули (II), присутньої у композиції.
10. Фармацевтична композиція за п. 8 або п. 9, яка містить один або кілька інших фармацевтичних агентів.
11. Фармацевтична композиція за п. 10, в якій один або кілька фармацевтичних агентів є антигіперпроліферативними агентами, цитотоксичними агентами, інгібіторами сигнальної трансдукції, протираковими агентами та/або протиблювотними засобами.
12. Комбінація для лікування гіперпроліферативних розладів, яка містить сполуку формули (II) за будь-яким з пп. 1-3 та один або кілька інших фармацевтичних агентів.
13. Комбінація за п. 12, в якій один або кілька фармацевтичних агентів є цитотоксичними агентами, інгібіторами сигнальної трансдукції, протираковими агентами, або протиблювотними засобами.
Текст
1. Сполука формули (II) C2 2 (19) 1 3 95984 Даний винахід стосується моногідрату 4-[4({[4-хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3-фторфенокси]-N-метилпіридин-2карбоксаміду, способу його одержання, фармацевтичних композицій, що його містять, а також його застосування для лікування розладів. 4-[4-({[4-Хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3-фторфенокси]-N-метилпіридин-2карбоксамід описаний в WO 2005/009961 та відповідає сполуці формули (І): (I) У публікації WO 2005/009961 описана сполука формули (І) у якості інгібітора ензиму Raf кіназа, яка може використовуватись для лікування розладів, при яких ангіогенез та гіперпроліферація відіграють важливу роль, наприклад при рості пухлин та раку. Сполуку формули (І) одержують у спосіб, описаний у WO 2005/009961, і вона відповідає поліморфу, який надалі зазначається як поліморф І із температурою плавлення 186-206°С, характеристичною рентгенівською дифрактограмою, ІЧ спектром, спектром Рамана, ДІЧ спектром, ЯМР спект13 ром та твердотільним спектром ЯМР на С (Таб. 2-7, Фіг. 2-7). Даний винахід стосується сполуки формули (І) у формі моногідрату, яка відповідає сполуці формули (II): (II) Сполука формули (II) містить воду у кількості 3,6 ваг.%. У порівнянні із поліморфом (І) сполуки формули (І), сполука формули (II) має характеристичну рентгенівську дифрактограму, БІЧ спектр, ДІЧ спектр, ІЧ спектр, твердотільний спектр ЯМР 13 на С та спектр Рамана (Фіг. 2-7). Несподівано, сполука формули (II) проявила високу стабільність при виробництві фармацевтичних композицій. Сполука формули (II) за винаходом, що використовується у фармацевтичних рецептурах, характеризується високим ступенем чистоти. Для цілей стабільності, фармацевтична рецептура містить в основному сполуку формули (II) і незначні фракції інших форм сполуки формули (І), наприклад іншого поліморфу сполуки формули (І). Фармацевтична композиція переважно містить більше, ніж 90 вагових відсотків, більш переважно більше, ніж 95 вагових відсотків сполуки формули (II) відносно загальної кількості сполуки формули (II), присутньої у композиції. 4 Спосіб лікування: Даний винахід також стосується способу застосування сполуки формули (II) та її композицій для лікування гіперпроліферативних розладів у ссавців. Цей спосіб включає введення ссавцю, якому необхідне таке лікування, включно із людиною, кількості сполуки формули (II) за цим винаходом або її композиції, ефективної для лікування такого розладу. Гіперпроліферативні розлади включають, без обмеження, солідні пухлини, такі як рак грудей, дихальних шляхів, мозку, статевих органів, травного тракту, сечових шляхів, ока, печінки, шкіри, голови і шиї, щитовидної та паращитовидної залоз та їх віддалені метастази. Такі розлади також включають лімфоми, саркоми і лейкемії. Приклади раку грудей включають, без обмеження, інвазійну протокову карциному, інвазійну лобулярну карциному, протокову карциному in situ та глобулярну карциному in situ. Приклади раку дихальних шляхів включають, без обмеження, дрібноклітинний та недрібноклітинний рак легень, а також бронхіальну аденому та плевролегеневу бластому. Приклади раку мозку включають, без обмеження, гліому мозкового ствола та гіпоталамусу, церебелярну та церебральну астроцитому, медулобластому, епендимому, а також нейроектодермальну пухлину і пухлину пінеальної області. Пухлини чоловічих статевих органів включають, без обмеження, рак простати та яєчка. Пухлини жіночих статевих органів включають, без обмеження, рак ендометрію, шийки матки, яєчок, піхви та вульви, а також саркому матки. Пухлини травного тракту включають, без обмеження, рак ануса, товстої кишки, колоректальний рак, рак стравоходу, жовчного міхура, шлунку, підшлункової залози, прямої кишки, тонкої кишки та слинної залози. Пухлини сечових шляхів включають, без обмеження, рак сечового міхура, пенісу, нирок, ниркової миски, сечоводу та уретри. Рак ока включають, без обмеження, внутрішньоочну меланому та ретинобластому. Приклади раку печінки включають, без обмеження, гепатоцелюлярну карциному (гепатоцелюлярні карциноми із або без фіброламелярного варіанту), холангіокарциному (карциному внутрішньопечінкових жовчних протоків), а також змішану гепатоцелюлярну холангіокарциному. Рак шкіри включає, без обмеження, пласкоклітинний рак, саркому Капоші, злоякісну меланому, рак шкіри із клітин Меркеля, а також немеланомний рак шкіри. Приклади раку голови та шиї включають, без обмеження, ларингеальний/ гіпофарингеальний / назофарингеальний / орофарингеальний рак, а також рак губ та ротової порожнини. Лімфоми включають, без обмеження, СНІДпов'язану лімфому, неходжкінську лімфому, Тклітинну лімфому шкіри, хворобу Ходжкіна, а також лімфому центральної нервової системи. Саркоми включають, без обмеження, саркому м'яких тканин, остеосаркому, злоякісну фіброзну гістіоцитому, лімфосаркому та рабдоміосаркому. 5 Лейкемії включають, без обмеження, гостру мієлоїдну лейкемію, гострий мієлобластний лейкоз, хронічну лімфоцитарну лейкемію, хронічну мієлогенну лейкемію та лейкемію волоскових клітин. Ці розлади були добре описані у людей, але також існують і у тварин із подібною етіологією, і можуть лікуватись шляхом введення фармацевтичних композицій за цим винаходом. На основі стандартних лабораторних методик, відомих для оцінки сполук, корисних для лікування гіперпроліферативних розладів, шляхом стандартних токсикологічних тестів і стандартних фармакологічних досліджень для визначення можливості лікування описаних вище станів у ссавців, а також шляхом порівняння цих результатів із результатами відомих лікарських засобів, які використовуються для лікування цих станів, можна визначити ефективний рівень дозування сполук за цим винаходом для лікування кожного бажаного показання. Кількість активного компонента для введення при лікуванні одного із цих станів може знаходитись у широкому діапазоні з огляду на такі чинники як конкретна сполука та одиниця дозування, що використовуються, шлях введення, строк лікування, вік та стать пацієнта, що проходить лікування, а також природу та стан захворювання, що лікується. Даний винахід також стосується застосування сполуки формули (II) для одержання фармацевтичних композицій для лікування вищевказаних розладів. Комбінування із іншими фармацевтичними агентами: Сполуку формули (II) за цим винаходом можна вводити як окремий фармацевтичний агент або у комбінації із одним або більшою кількістю фармацевтичних агентів, якщо така комбінація не обумовлює виникнення неприйнятних побічних ефектів. Наприклад, сполуку формули (II) за цим винаходом можна поєднати із добре відомими антигіперпроліферативними агентами або агентами для лікування інших станів, і т.п., а також із домішками та комбінаціями. Необов'язкові антигіперпроліферативні агенти, які можна додати до композиції, включають, без обмеження, сполуки, включені у перелік сполук, що використовуються у схемах лікування раку хіміотерапевтичними агентами, наведеному у 11-му виданні Merck Index, (1996), включеному до цього опису у якості посилання, такими як аспарагіназа, блеоміцин, карбоплатин, кармустин, хлорамбуцил, цисплатин, коласпаза, циклофосфамід, цитарабін, дакарбазин, дактиноміцин, даунорубіцин, доксорубіцин (адріаміцин), епірубіцин, етопозид, 5фторурацил, гексаметилмеламін, гідроксисечовина, iфосфамiд, іринотекан, лейковорин, ломустин, мехлоретамін, 6-меркаптопурин, месна, метотрексат, мітоміцин С, мітоксантрон, преднізолон, преднізон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тіогуанін, топотекан, вінбластин, вінкрістин і віндезин. Інші антигіперпроліферативні агенти, придатні для застосування із композиціями за цим винаходом, включають, без обмеження, сполуки, затвер 95984 6 джені для лікування неопластичних захворювань у виданні Goodman and Gilman's The Pharmacological Basis of Therapeutics (дев'яте видання), під редакцією Molinoff et al., опублікованому McGraw-Hill, сторінки 1225-1287, (1996), яке включено до цього опису у якості посилання, такі як аміноглутетімід, L-аспарагіназа, азатіоприн, 5азацидін, кладрибін, бусульфан, діетилстилбестрол, 2',2'-дифтордеоксицитидин, доцетаксел, еритрогідроксиноніладенін, етинілестрадіол, 5фтордеоксиурідин, 5-фтордеоксиурідину монофосфат, флударабіну фосфат, флуоксиместерон, флутамід, гідроксипрогестерону капроат, ідарубіцин, інтерферон, медроксипрогестерону ацетат, мегестролу ацетат, мелфалан, мітотан, паклітаксел, пентостатин, N-фосфоноацетил-L-аспартат (PALA), плікаміцин, семустин, теніпозид, тестостерону пропіонат, тіотепа, триметилмеамін, урідин і вінорелбін. Інші антигіперпроліферативні агенти для застосування із композиціями за винаходом, включають, без обмеження, інші протиракові агенти, такі як епотілон та його похідні, іринотекан, ралоксифен і топотекан. В цілому, застосування цитотоксичних та/або цитостатичних агентів у комбінації із сполукою або композицією за винаходом слугуватиме для досягнення наступних результатів: (1) підвищення ефективності пригнічення росту пухлини, або навіть ліквідувати пухлину у порівнянні із введенням будь-якого агента окремо; (2) уможливлення введення менших кількостей хіміотерапевтичних агентів, що вводяться; (3) забезпечення хіміотерапевтичного лікування, яке легше переноситься пацієнтом і викликає менше небезпечних фармакологічних ускладнень у порівнянні із хіміотерапією одним агентом або певними іншими комбінованими терапіями; (4) уможливлення лікування ширшого спектру різних видів раку у ссавців, особливо людей; (5) забезпечення більшої швидкості відповіді серед пацієнтів, що лікуються; (6) забезпечення довшої тривалості життя серед пацієнтів, що лікуються, у порівнянні із результатами застосування стандартних схем хіміотерапії; (7) гальмування прогресування розвитку пухлини; та/або (8) досягнення показників ефективності та переносимості принаймні не нижчих, ніж показники при використанні агента окремо, у порівнянні із відомими випадками, в яких інші комбінації протиракових агентів викликають антагоністичний ефект. Для цілей цього винаходу під терміном «комбінація» розуміють не лише дозовану форму, яка містить всі компоненти (так звані фіксовані комбінації), і набори нефіксованих комбінацій, які включають компоненти, окремі один від одного, а й компоненти, які вводяться одночасно або послідовно у випадках, коли вони застосовуються для профілактики або лікування одного і того ж захворювання. Активні компоненти комбінації за цим винаходом відомими способом можна перетворити у ста 7 ндартні рецептури, які можуть бути твердими або рідкими рецептурами. Приклади включають таблетки, таблетки із покриттям, капсули, гранули, аерозолі, сиропи, емульсії, суспензії, розчини. Оскільки комбінація за винаходом добре переноситься і у деяких випадах є ефективною навіть у низьких дозах, можливий широкий спектр різних рецептур. Тож, в одному випадку можна сформулювати окремі активні компоненти комбінації за винаходом окремо. У цьому разі не ε абсолютно необхідним приймати окремі активні компоненти одночасно; навпаки, послідовне вживання може бути переважним для досягнення найкращих результатів. У випадку окремого введення можна об'єднувати рецептури окремих активних компонентів, наприклад таблетки або капсули, одночасно разом у придатну первинну упаковку. Активні компоненти у первинній упаковці знаходяться в окремих контейнерах, якими можуть бути, наприклад, тюбики, пляшки або блістерні упаковки. Таке роздільне упакування компонентів в загальній первинній упаковці також називається набором. Іншими варіантами рецептур, придатних та переважних для композиції за винаходом, є також фіксовані комбінації. Під «фіксованими комбінаціями» тут розуміють фармацевтичні форми, в яких компоненти об'єднанні у фіксованому співвідношенні їх кількостей. Такі фіксовані комбінації можуть бути, наприклад, у формі пероральних розчинів, але переважно є твердими пероральними фармацевтичними рецептурами, наприклад капсулами або таблетками. Фармацевтичні композиції: Цей винахід також стосується фармацевтичних композицій, які містять сполуку формули (II) за цим винаходом. Ці композиції можна застосовувати для досягнення бажаного фармакологічного ефекту шляхом їх введення пацієнту, якому це необхідно. Для цілей цього винаходу пацієнтом є ссавець, включаючи людину, якому необхідне лікування певного стану або захворювання. Тож, даний винахід включає фармацевтичні композиції, які складаються із фармацевтично прийнятного носія і фармацевтично активної кількості сполуки формули (II) за цим винаходом. Фармацевтично прийнятним носієм є будь-який носій, який є відносно нетоксичним та безпечним для пацієнта у концентраціях, пропорційних ефективній кількості активного компонента, та таких, при яких будь-які побічні ефекти, що приписуються носію, не зашкоджують сприятливій дії активного компонента. Фармацевтично активна кількість сполуки відповідає кількості сполуки, дія якої відбивається або яка здійснює вплив на певний стан, який лікується. Сполука за формулою (II) за цим винаходом може вводитись із фармацевтично активними носіями, відомими у галузі, у будь-яких ефективних стандартних дозованих формах, включно із рецептурами негайного, повільного або розрахованого за часом вивільнення, пероральними, парентеральними, місцевими, назальними, офтальмологічними, очними, під'язиковими, ректальними, вагінальними і т.д. рецептурами. Для перорального введення сполуку формули (II) можна сформулювати у тверді або рідкі рецеп 95984 8 тури, такі як тверда дисперсія, капсули, пігулки, таблетки, облатки, лозенги, розплави, порошки, розчини, суспензії або емульсії, які можна приготувати способами, відомими у галузі, для виробництва фармацевтичних композицій. Одиницею твердих дозованих форм може бути капсула, яка може бути звичайною капсулою із твердим або м'яким желатиновим покриттям, що містить, наприклад, поверхнево-активні речовини, змащуючі агенти та інертні наповнювачі, такі як лактоза, цукроза, фосфат кальцію та кукурудзяний крохмаль. В іншому втіленні, сполуку формули (II) за цим винаходом можна таблетувати із стандартними компонентами, що утворюють основу таблеток, такими як лактоза, цукроза і кукурудзяний крохмаль у комбінації із зв'язуючими агентами, такими як гуміарабік, кукурудзяний крохмаль або желатин, дезінтегруючими агентами, призначеними для сприяння руйнуванню і розкладу таблетки після введення, такими як картопляний крохмаль, альгінова кислота, кукурудзяний крохмаль, а також гуарова смола, трагакантова камедь, гуміарабік, змащуючими агентами, призначеними для покращення текучості гранул таблетки та запобігання налипанню матеріалу, що таблетується, до поверхонь матриць та пуансонів для таблетування, наприклад тальк, стеаринова кислота, або стеарат магнію, кальцію або цинку, барвники, колоруючі агенти і смакоароматичні добавки, такі як м'ятне масло, вінтергрінове масло, або вишнева смакоароматична добавка, призначені для покращення естетичних характеристик таблетки і які роблять їх більш придатними для вживання пацієнтом. Придатні екціпієнти для застосування в пероральних рідких дозованих формах включають дикальцію фосфат та розріджувачі, такі як вода і спирти, наприклад етанол, бензиловий спирт і поліетиленові спирти, або із або без додання фармацевтично активної поверхнево-активної речовини, суспендуючого агента або емульгатора. Інші різноманітні матеріали можуть бути присутніми як покриття або для того, щоб іншим чином модифікувати фізичну форму дозованої одиниці. Наприклад, таблетки, пігулки або капсули можуть бути покритими шелаком, цукром, або обома речовинами. Розчинні порошки і гранули є придатними для приготування водної суспензії. Активний компонент в них присутній у суміші із диспергуючим або зволожуючим агентом, суспендуючим агентом і одним або більшою кількістю консервантів. Приклади придатних диспергуючих або зволожуючих агентів, а також суспендуючих агентів відповідають вже приведеним вище. Додаткові екціпієнти, наприклад вже описані підсолоджуючі агенти, смакоароматичні добавки і колоруючі агенти, також можуть бути присутніми. Фармацевтичні композиції за винаходом можуть також знаходитись у формі емульсії масло-уводі. Масляну фазу може утворювати рослинне масло, таке як вазелінове масло, або суміш рослинних масел. Придатними емульсифікуючими агентами можуть бути (1) природні смоли, такі як гуміарабік і трагакантова камедь, (2) природні фосфатиди, такі як соєві боби та лецитин, (3) естери або часткові естери, що походять від жирних кис 9 лот, та ангідриди гекситолу, наприклад моноолеат сорбіту, (4) продукти конденсування вказаних часткових естерів із етиленоксидом, наприклад моно олеат поліоксиетиленсорбіту. Емульсії можуть також містити підсолоджувані і смакоароматичні добавки. Масляні суспензії можна сформулювати шляхом суспендування активного компонента у рослинному маслі, такому як, наприклад, арахісове масло, оливкове масло, кунжутне масло або кокосове масло, або у мінеральному маслі, такому як вазелінове масло. Масляні суспензії можуть містити згущувач, такий як, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. Суспензії можуть містити один або більшу кількість консервантів, наприклад етил або н-пропіл ргідроксибензоат; один або більшу кількість колоруючих агентів; одну або більшу кількість смакоароматичних добавок; а також один або більшу кількість підсолоджуючих агентів, таких як цукроза або сахарин. Сиропи та еліксири можна сформулювати із підсолоджуючими агентами, такими як, наприклад, гліцерин, пропіленгліколь, сорбіт або цукроза. Такі рецептури можуть також містити заспокійливий засіб і консервант, такий як метил і пропілпарабени, а також смакоароматичні добавки та колоруючі агенти. Сполуку формули (II) за цим винаходом також можна вводити парентерально, тобто підшкірно, внутрішньовенно, внутрішньоочно, внутрішньосиновіально, внутрішньом'язово або внутрішньоочеревинно, у вигляді впорскуваних дозованих форм сполуки у фізіологічно прийнятному розріджувачі із фармацевтичним носієм, який може бути стерильною рідиною або сумішшю рідин, таких як вода, фізіологічний розчин, водний розчин декстрози та подібні цукрові розчини, спирт, такий як етанол, ізопропанол або гексадециловий спирт, гліколі, такі як пропіленгліколь або поліетиленгліколь, кеталі гліцерину, такі як 2,2-диметил-1,1-діоксолан-4метанол, етери, такі як полі(етиленгліколь) 400, масло, жирна кислота, естер жирної кислоти або гліцерид жирної кислоти, або ацетильований гліцерид жирної кислоти із або без додання фармацевтично прийнятної поверхнево-активної речовини, такої як мило або миючий засіб, суспендуючий агент, такий як пектин, карбомери, метилцелюлоза, гідроксипропілметилцелюлоза або карбоксиметилцелюлоза, або емульгатор та інші фармацевтичні допоміжні агенти. Ілюстративними прикладами масел, які можна застосувати у парентеральних рецептурах за цим винаходом, є мінеральні масла, масла тваринного, рослинного або синтетичного походження, наприклад арахісове масло, соєве масло, кунжутне масло, бавовняне масло, кукурудзяне масло, оливкове масло, вазелінове та мінерально масло. Придатні жирні кислоти включають олеїнову кислоту, стеаринову кислоту, ізостеаринову кислоту і міристинову кислоту. Придатними естерами жирних кислот є, наприклад, етиолеат і ізопропілміристат. Придатні мила включають солі жирних кислот і лужних металів, амонію та триетаноламіну, а придатні миючі засоби включають катіонні миючі 95984 10 засоби, наприклад галоїди диметилдіалкіламонію, галоїди алкілпіридинію і алкіламіноацетати; аніонні миючі засоби, наприклад, алкіл-, арил- і олефінсульфонати, алкіл, олефін, етер і моногліцерид сульфатів, а також сульфосукцинати; неіонні миючі засоби, наприклад, оксиди жирного аміну, алканоламіди жирної кислоти і полі(оксиетиленоксипропілен)и або споівполімери етиленоксиду або пропіленоксиду; та амфотерні миючі засоби, наприклад, алкіл-бета-амінопропіонати, а також солі 2-алкілімідазолін-четвертинного амонію, а також їх суміші. Парентеральні композиції за цим винаходом звичайно містять від приблизно 0,5% до приблизно 25 ваг.% активного компонента у розчині. Консерванти та буферуючі агенти також можуть застосовуватись за необхідності. Для зменшення або уникнення подразнення у місті ін'єкції такі композиції можуть містити неіонну поверхневоактивну речовину, яка має гідрофільноліпофільний баланс (ГЛБ) від приблизно 12 до приблизно 17. Кількість поверхнево-активної речовини у такій рецептурі варіюється від приблизно 5% до приблизно 15 ваг.%. Поверхнево-активна речовина може бути монокомпонентною, що має вищевказаний ГЛБ, або може бути сумішшю двох або більшої кількості компонентів, що мають бажаний ГЛБ. Ілюстративними прикладами поверхневоактивних речовин, що застосовуються в парентеральних рецептурах, є клас естерів поліетиленсорбіту і жирної кислоти, моноолеат сорбіту, а також адукти етиленоксиду із гідрофобною основою із високою молекулярною масою, утворені шляхом конденсування пропіленоксиду з пропіленгліколем. Фармацевтичні композиції можуть бути у формі стерильних водних суспензій для ін'єкцій. Такі суспензії можна сформулювати відомими способами, використовуючи для цих цілей придатні диспергуючі або зволожуючі агенти, а також суспендуючі агенти, такі як, наприклад, карбоксиметилцелюлоза натрію, метилцелюлоза, гідрокспропілметилцелюлоза, альгінат натрію, полівінілпіролідон, трагакантова камедь і гуміарабік; диспергуючими або зволожуючими агентами можуть бути природні фосфатиди, такі як лецитин, продукт конденсування алкіленоксиду і жирної кислоти, наприклад, поліоксиетиленстеарат, продукт конденсування етиленоксиду і довоголанцюгового аліфатичного спирту, наприклад, гептадекаетиленоксицетанол, продукт конденсування етиленоксиду із частковим естером, що походить із жирної кислоти і гекситу, такий як моноолеат поліоксиетиленсорбіту, або продукт конденсування етиленоксиду із частковим естером, що походить із жирної кислоти та ангідриду гекситу, наприклад моноолеат поліоксиетиленсорбіту. Стерильна рецептура для ін'єкцій може бути також стерильним розчином або суспензією для ін'єкцій в нетоксичному парентерально прийнятному розріджувачі або розчиннику. Розріджувачі та розчинники, що можуть застосовуватись, включають, наприклад, воду, розчин Рінгера, ізотонічний розчин хлориду натрію і ізотонічний розчин глюкози. Окрім того, у якості розчинників або середови 11 ща для суспендування звичайно використовують стерильні змішані масла. Для цих цілей може використовуватись будь-яке асептичне змішане масло, включаючи синтетичні моно- і дигліцериди. Окрім того, у рецептурі лікарських засобів для ін'єкцій можуть також використовуватись жирні кислоти, такі як олеїнова кислота. Композиції за винаходом також можуть вводитись у формі супозиторій для ректального введення лікарського засобу. Ці композиції можна одержати шляхом змішування лікарського засобу із придатним неподразнюючим екціпієнтом, що при звичайному температурному режимі знаходиться у твердому стані, але при ректальній температурі є рідким, тож який буде плавитись у прямій кишці, в результаті чого вивільнятиметься лікарський засіб. Таким матеріалом є, наприклад, кокосове масло і поліетиленгліколь. Інша рецептура, що застосовується у способах за цим винаходом, має форму засобів трансдеральної доставки («пластирів»). Такі трансдермальні пластирі можна застосовувати для забезпечення безперервної або перервної інфузії сполук за цим винаходом у контрольованих кількостях. Виготовлення і застосування трансдермальних пластирів для доставки фармакологічних агентів відоме у галузі (див., наприклад, патент США №5 023 252, виданий 11 червня 1991, який включений до опису у якості посилання). Такі пластирі можуть бути сконструйовані для безперервного, пульсуючого або необхідного вивільнення фармацевтичних агентів. Рецептури контрольованого вивільнення для парентерального введення включають ліпосомальні рецептури, рецептури полімерних мікросфер і полімерного гелю, які відомі у галузі. Може бути бажаним або необхідним вводити фармацевтичну композицію пацієнту через пристрій для механічної доставки. Конструкція і застосування пристроїв для механічної доставки фармацевтичних агентів є добре відомими у галузі. Методиками безпосереднього введення, наприклад лікарського засобу прямо у мозок, звичайно передбачається розміщення катетера для доставки лікарського засобу у вентрикулярній системі пацієнта для уникнення бар'єра між кров'ю і мозком. Одна така система доставки для імплантації, яка використовується для транспортування агентів до певних анатомічних частин тіла, описана у патенті США № 5 011 472, виданому 30 квітня 1991. Фармацевтична композиція за цим винаходом також може знаходитись у формі твердої дисперсії. Тверда дисперсія може бути твердим розчином, склоподібним розчином, склоподібною суспензією, аморфним осадом в кристалічному носії, евтектичною або монотеїстичною, сполукою або комплексним утворенням і їх комбінаціями. Одним із варіантів винаходу, що становить предмет особливого зацікавлення, є фармацевтична композиція, яка включає тверду дисперсію, матриця якої містить фармацевтично прийнятний полімер, такий як полівінілпіролідон, співполімер вінілпіролідон/вінілацетат, поліалкіленгліколь (тобто поліетиленгліколь), гідроксиалкілцелюлоза (тобто гідроксипропілцелюлоза), гідроксиалкілме 95984 12 тилцелюлоза (тобто гідроксипропілметилцелюлоза), карбоксиметилцелюлоза, натрій карбоксиметилцелюлоза, етилцелюлоза, поліметакрилати, полівініловий спирт, полівінілацетат, співполімер вініловий спирт/вінілацетат, полігліколізовані гліцериди, ксантанова гума, карагенін, хітозан, хітін, полідекстрин, декстрин, крохмаль та протеїни. Іншим варіантом винаходу є фармацевтична композиція, яка містить тверду дисперсію, в якій матриця включає цукор та/або цукровий спирт та/або циклодекстрин, наприклад цукрозу, лактозу, фруктозу, мальтозу, рафінозу, сорбіт, лактит, маніт, мальтит, еритрит, інозитол, трегалоза, ізомальт, інулін, мальтодекстрин, β-циклодекстрин, гідроксипропіл-β-циклодекстрин або сульфобутиловий етер циклодекстрину. Додаткові відповідні носії, придатні для утворення матриці твердої дисперсії, включають, без обмеження, спирти, органічні кислоти, органічні основи, амінокислоти, фосфоліпіди, віски, солі, естери поліоксиетиленсорбіту і жирних кислот, а також сечовину. Тверда дисперсія сполуки формули (II) у матриці може містити певні додаткові фармацевтично прийнятні компоненти, такі як поверхнево-активні речовини, наповнювачі, дезінтегруючі агенти, інгібітори перекристалізації, пластифікатори, агенти, що запобігають спінюванню, антиоксиданти, агенти, що запобігають склеюванню, модифікатори рівня рН, склеюючі агенти і змащуючі агенти. Тверду дисперсію за винаходом одержують відомими у галузі способами виробництва твердих дисперсій, такими як методика стоплення/розтоплення, екструзія гарячого розплаву, випарювання розчинника (тобто сублімація, висушування розпиленням або нашарування порошкового матеріалу з гранул), співосадження, надкритична флюїдна технологія та метод електростатичного осадження. Композиції за винаходом можуть також містити інші стандартні фармацевтично прийнятні компоненти суміші, до яких звичайно відносять носії або розріджувачі, у разі необхідності або якщо це є бажаним. Для одержання таких композицій у відповідних дозованих формах можна застосовувати стандартні методики. Такі компоненти та методики включають описані у наступних цитованих посиланнях, кожне з яких включене до опису у якості посилання: Powell, M.F. et al, "Compendium of Excipients for Parenteral Formulations" PDA Journal of Pharmaceutical Science & Technology 1998, 52(5), 238-311; Strickley, R.G "Parenteral Formulations of Small Molecule Therapeutics Marketed in the United States (1999)-Part-1" PDA Journal of Pharmaceutical Science & Technology 1999, 53(6), 324-349; та Nema, S. et al, "Excipients and Their Use in Injectable Products" PDA Journal of Pharmaceutical Science & Technology 1997, 51(4), 166-171. Загальнозастосовувані фармацевтичні компоненти, які можуть бути придатними для формулювання композиції для передбаченого шляху введення, включають: окислювачі (приклади включають, без обмеження, оцтову кислоту, лимонну кислоту, фумаролу кислоту, соляну кислоту, азотну кислоту); 13 підлужувані (приклади включають, без обмеження, аміачний розчин, карбонат амонію, діетаноламін, моноєтаноламін, гідроксид калію, борат натрію, карбонат натрію, гідроксид натрію, тріетаноламін, троламін); адсорбенти (приклади включають, без обмеження, порошкоподібну целюлозу і активоване вугілля); аерозольні пропеленти (приклади включають, без обмеження, діоксид вуглецю, CCI2F2, F2CICCCIF2 і CCIF3) заміщуючі повітря агенти (приклади включають, без обмеження, азот і аргон); протигрибкові консерванти (приклади включають, без обмеження, бензойну кислоту, бутилпарабен, етилпарабен, метилпарабен, пропілпарабен, бензоат натрію); антибактеріальні консерванти (приклади включають, без обмеження, хлорид бензалконію, хлорид безетонію, бензиловий спирт, хлорид цетилпіридинію, хлорбутанол, фенол, фенілетиловий спирт, нітрат фенілртуті і тімеросал); антиоксиданти (приклади включають, без обмеження, аскорбінову кислоту, аскорбілпальмітат, бутильований гідроксианізол, бутильований гідрокситолуол, фосфорнуватисту кислоту, монотіогліцерин, пропілгалат, аскорбат натрію, бісульфіт натрію, формальдегід сульфоксилат натрію, метабісульфіт натрію); зв'язуючі агенти (приклади включають, без обмеження, блок-полімери, природну та синтетичну гуму, поліакрилати, поліуретани, силікони, полісилоксани і стирен-бутадієнові співполімери); буферуючі агенти (приклади включають, без обмеження, метафосфат калію, дикалій фосфат, ацетат натрію, безводний цитрат натрію і дигідрат цитрату натрію); носії (приклади включають, без обмеження, сироп гуміарабіку, ароматичний сироп, ароматичний еліксир, вишневий сироп, сироп какао, апельсиновий сироп, сироп, кукурудзяне масло, мінеральне масло, арахісове масло, кунжутне масло, бактеріостатичний хлорид натрію для ін'єкцій та бактеріостатичну воду для ін'єкцій); хелатуючі агенти (приклади включають, без обмеження, едетат динатрію та едетову кислоту); барвники (приклади включають, без обмеження, FD&C Червоний № 3, FD&C Червоний № 20, FD&C Жовтий № 6, FD&C Синій № 2, D&C Зленений № 5, D&C Помаранчевий № 5, D&C Червоний № 8, карамельний барвник та оксид заліза червоний); прояснювальні агенти (приклади включають, без обмеження, бентоніт); емульгатори (приклади включають, без обмеження, гуміарабік, цетомакрогол, цетиловий спирт, моностеарат гліцерину, лецитин, моноолеат сорбіту, поліоксиетилен 50 моностеарат); інкапсулюючі агенти (приклади включають, без обмеження, желатин та ацетат фталат целюлози) смакоароматичні добавки (приклади включають, без обмеження, анісове масло, коричне масло, какао, ментол, апельсинове масло, м'ятне масло та ванілін); 95984 14 зволожувачі (приклади включають, без обмеження, гліцерин, пропіленгліколь і сорбіт); агенти, що сприяють розтиранню в порошок, (приклади включають, без обмеження, мінеральне масло та гліцерин); масла (приклади включають, без обмеження, арахісове масло, мінеральне масло, оливкове масло, масло земляного горіха, кунжутне масло та рослинне масло); мазеві основи (приклади включають, без обмеження, ланолін, мазь-емульсію, мазь на поліетиленгліколевій основі, вазелін, гідрофільний вазелін, мазь на основі вазелінового масла, жовту мазь, а також мазь на основі трояндової води); енхансери проникнення (трансдермальної доставки) (приклади включають, без обмеження, моногідрокси- або полігідроксиспирти, моно- або полівалентні спирти, насичені або ненасичені жирні спирти, насичені або ненасичені жирні естери, насичені або ненасичені дикарбонові кислоти, ефірні масла, похідні фосфатидилу, кефалін, терпени, аміди, етери, кетони та сечовини); пластифікатори (приклади включають, без обмеження, діетилфталат і гліцерин); розчинники (приклади включають, без обмеження, етанол, кукурудзяне масло, бавовняне масло, гліцерин, ізопропанол, мінеральне масло, олеїнову кислоту, арахісове масло, очищену воду, воду для ін'єкцій, стерильну воду для ін'єкцій та стерину воду для зрошування); згущувачі (приклади включають, без обмеження, цетиловий спирт, цетилові естери віску, мікрокристалічний віск, парафін, стеариновий спирт, білий віск та жовтий віск); основи для супозиторій (приклади включають, без обмеження, масло какао та поліетиленгліколі (суміші)); поверхнево-активні речовини (приклади включають, без обмеження, хлорид бензалконію, ноноксинол 10, окстоксинол 9, полісорбат 80, лаурилсульфат натрію і сорбіт монопальмітат); суспендуючі агенти (приклади включають, без обмеження, агар-агар, бентоніт, карбомери, натрій карбоксиметилцелюлозу, гідроксиетилцелюлозау, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, каолін, метилцелюлозу, трагакант і вігум); підсолоджуючі агенти (приклади включають, без обмеження, аспартам, декстрозу, гліцерин, маніт, пропіленгліколь, сахарин натрію, сорбіт і цукрозу); агенти, що запобігають налипанню матеріалу, що таблетується (приклади включають, без обмеження, стеарат магіню і тальк); зв'язуючі агенти для таблетування (приклади включають, без обмеження, гуміарабік, альгінову кислоту, натрій карбоксиметилцелюлозу, цукор, що стискується, етилцелюлозу, желатин, рідку глюкозу, метилцелюлозу, поперечно незв'язаний полівінілпіролідон, а також прежелатинізований крохмаль); розріджувачі для таблеток і капсул (приклади включають, без обмеження, двоосновний фосфат кальцію, каолін, лактозу, маніт, мікрокристалічну целюлозу, порошкоподібну целюлозу, осаджений 15 карбонат кальцію, карбонат натрію, фосфат натрію, сорбіт і крохмаль); агенти для покриття таблеток (приклади включають, без обмеження, рідку глюкозу, гідроксиетилцелюлозу, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, метилцелюлозу, етилцелюлозу, ацетат фталат целюлози і шелак), екципієнти для безпосереднього пресування таблеток (приклади включають, без обмеження, двоосновний фосфат кальцію); дезінтегруючі агенти для таблеток (приклади включають, без обмеження, альгінову кислоту, кальцій карбоксиметилцелюлозу, мікрокристалічну целюлозу, полакрилін калію, поперечно зв'язаний полівінілпіролідон, альгінат натрію, крохмаль натрію гліколят і крохмаль); агенти, що сприяють ковзанню, для таблеток (приклади включають, без обмеження, колоїдний діоксид кремнію, кукурудзяний крохмаль і тальк); змащуючі агенти для таблетування (приклади включають, без обмеження, стеарат кальцію, стеарат магнію, мінеральне масло, стеаринову кислоту і стеарат цинку); агенти для надання непрозорості оболонкам таблеток/капсул (приклади включають, без обмеження, діоксид титану); лискувальні агенти для таблеток (приклади включають, без обмеження, карнаубський віск і білий віск); згущувачі (приклади включають, без обмеження, бджолиний віск, цетиловий спирт і парафін); модифікатори тонічності (приклади включають, без обмеження, декстрозу і хлорид натрію); агенти, що підвищують в'язкість (приклади включають, без обмеження, альгінову кислоту, бентоніт, карбомери, натрій карбоксиметилцелюлозу, метилцелюлозу, полівінілпіролідон, альгінат натрію і трагакант); та зволожуючі агенти (приклади включають, без обмеження, гептадекаетиленоксицетанол, лецитин, сорбіту моноолеат, поліоксиетиленсорбіту моноолеат, а також поліоксиетилен стеарат). Вважається, що, ґрунтуючись на наведеній інформації, фахівець зможе втілити даний винахід у найширшому обсязі. Однак, нижче наведені приклади фармацевтичних рецептур, які можна застосовувати у способі за цим винаходом. Вони наведені виключно з ілюстративною метою і не повинні тлумачитись як якимось-чином обмежуючі винахід. Фармацевтичні композиції за цим винаходом можуть бути проілюстровані наступним чином: Стерильний розчин IV: 5 мг/мл розчин бажаної сполуки за винаходом одержують із застосуванням стерильної води для ін'єкцій, рівень рН регулюють за необхідності. Розчин розводять для введення до 1 - 2 мг/мл стерильною 5% декстрозою і вводять шляхом вливання IV протягом 60 хвилин. Ліофілізований порошок для ведення IV: Стерильну рецептуру можна одержати із (і) 100 - 1000 мг бажаної сполуки за винаходом у вигляді ліофілізованого порошку, (іі) 32 - 327 мг/мл цитрату натрію, а також (ііі) 300 - 3000 мг Декстрану 40. Рецептуру відновлюють стерильним соляним розчином для ін'єкцій або 5% декстрозою до концентрації 10 - 20 мг/мл, які додатково розводять 95984 16 соляним розчином або 5% декстрозою до 0,2 - 0,4 мг/мл, і ця рецептура вводиться або як болюс IV, або шляхом вливання IV протягом 15-60 хвилин. Внутрішньом'язова суспензія: Для внутрішньом'язової ін'єкції можна приготувати наступний розчин або суспензію: 50 мг/мл бажаної нерозчинної у воді сполуки за цим винаходом 5 мг/мл натрій карбоксиметилцелюлози 4 мг/мл TWEEN 80 9 мг/мл хлориду натрію 9 мг/мл бензилового спирту Капсули із твердим покриттям: Велику кількість капсул одержують шляхом наповнення кожної стандартної двокомпонентної твердої желатинової капсули 100 мг порошкоподібного активного компонента, 150 мг лактози, 50 мг целюлози і 6 мг стеарату магнію. М'які желатинові капсули: Суміш активного компонента у харчовому маслі, такому як соєве масло, бавовняне масло або оливкове масло, готують та впорскують за допомогою поршневої помпи у розплавлений желатин для одержання м'якої желатинової капсули, що містить 100 мг активного компонента. Капсули промивають і сушать. Активний компонент можна розчинити у суміші поліетиленгліколю, гліцерину і сорбіту для одержання розчинної у воді лікарської суміші. Таблетки: Велику кількість таблеток одержують стандартними методиками таким чином, щоб дозована одиниця містила 100 мг активного компонента, 0,2 колоїдного діоксиду кремнію, 5 мг стеарату магнію, 275 мг мікрокристалічної целюлози, 11 мг крохмалю та 98,8 мг лактози. Придатні водні і неводні покриття можуть застосовуватись для підвищення смакової привабливості, покращення зовнішнього вигляду і характеристик стабільності або для уповільненої абсорбції. Таблетки/капсули негайного вивільнення: Вони представляють собою тверді оральні дозовані форми, одержані відомими і новими способами. Ці одиниці приймаються орально без води для негайного розчинення і доставки лікарського засобу. Активний компонент змішують у рідині, яка містить такий компонент як цукор, желатин, пектин і підсолоджуючі агенти. Ці рідини затверджують у твердих таблетках або каплетах шляхом методик сублімації і екстрагування твердої речовини. Лікарські сполуки можуть спресовуватись із в'язкопружніми та термопластичним цукрами і полімерами, або шипучими компонентами для утворення пористих матриць, призначених для негайного вивільнення, що не потребують вживання води. Дозування фармацевтичних композицій за винаходом: Ґрунтуючись на стандартних лабораторних методиках, відомих для оцінки сполук, корисних для лікування гіперпроліферативних розладів, на основі стандартних токсикологічних тестів і стандартних фармакологічних досліджень для визначення лікування вищеописаних стані у ссавців, а також шляхом порівняння цих результатів із результатами відомих лікарських засобів, які використовуються для лікування цих станів, можна легко визначити дозу сполук за винаходом, ефективну 17 для лікування кожного із бажаних показань. Кількість активного компонента для вживання при лікуванні одного із цих станів може значно різнитись з огляду на такі чинники як вжита конкретна сполука та дозована лікарська форма, шлях введення, строк лікування, вік та стать пацієнта, що проходить лікування, а також природа та ступінь тяжкості стану, що лікується. Загальна кількість активного компонента для введення в цілому варіюється у межах від приблизно 0,001 мг/кг до приблизно 200 мг/кг, і переважно від приблизно 0,01 мг/кг до приблизно 20 мг/кг маси тіла на день. Дозована форма може містити від приблизно 0,5 мг до приблизно 1500 мг активного компонента, і може прийматись один або більше разів на день. Добова доза для введення шляхом ін'єкції, включно із внутрішньовенними, внутрішньом'язовими, підшкірними та парентеральними ін'єкціями, а також для використання у інфузійних техніках складатиме переважно від 0,01 до 200 мг/кг загальної маси тіла. Добова доза при ректальному введенні складатиме переважно від 0,01 до 200 мг/кг загальної маси тіла. Добова доза при інтравагінальному введенні складатиме переважно від 0,01 до 200 мг/кг загальної маси тіла. Добова доза при місцевому застосуванні складатиме переважно від 0,1 до 200 мг, що наноситься від одного до чотирьох разів на день. Трансдермальна концентрація переважно відповідатиме необхідній для підтримання добової дози у межах від 0,01 до 200 мг/кг. Добова інгаляційна доза складатиме переважно від 0,01 до 100 мг/кг загальної маси тіла. Звичайно, для кожного пацієнта початковий та тривалий режим дозування є індивідуальним і залежить від природи і ступеню важкості стану, визначеного лікуючим лікарем, від активності конкретної вжитої сполуки, віку та загального стану пацієнта, часу введення, шляху введення, швидкості виділення лікарського засобу, комбінацій лікарських засобів, і т.д. Бажаний спосіб лікування і кількість доз сполуки за винаходом або її фармацевтично прийнятної солі, або естера або композиції фахівець визначить на основі стандартних діагностичних досліджень. Спосіб одержання: Винахід також стосується способу одержання сполуки формули (II) шляхом розчинення сполуки формули (І) наприклад у формі поліморфу І, одержаного як описано у публікації WO 2005/009961, в інертному розчиннику та із доданням води поки сполука формули (II) не випаде в осад. Таким чином одержують сполуки формули (II). Подібним чином винахід включає спосіб одержання сполуки формули (II) шляхом суспендування сполуки формули (І), наприклад у формі поліморфу (І), одержаного як описано у публікації WO 2005/009961, у водному розчиннику із наступним перемішуванням до досягнення бажаного рівня перетворення. Кристали виділяють і сушать. Таким чином одержують сполуку формули (II). Придатними інертними розчинниками є нижчі спирти, наприклад метанол, етанол, п-пропанол, ізопропанол, п-бутанол, втop-бутанол, ізобутанол, 1-пентанол або кетони, такі як ацетон, або алкани, 95984 18 такі як п-пентан, циклопентан, п-гексан, циклогексан, або тетрагідрофуран, або ацетонітрил, або толуол, або етилацетат, або 1,4-діоксан, або суміші вказаних розчинників, або суміші вказаних розчинників із водою. Перевага надається ацетону, метанолу, етанолу, сумішам вказаних розчинників. Перевага надається одержанню сполуки формули (II) шляхом розчинення сполуки формули (І) у формі поліморфу І, одержаного як описано у публікації WO 2005/009961, в етанолі і додання води поки сполука формули (II) не випаде в осад. Таким чином одержують сполуку формули (II). Подібно, перевага надається одержанню сполуки формули (II) шляхом суспендування сполуки формули (І) у формі поліморфу І, одержаного як описано у публікації WO 2005/009961, у водному розчиннику із наступним перемішуванням або струшуванням до досягнення бажаного рівня перетворення при температурі 25 °С. Кристали виділяють і сушать. Таким чином одержують сполуку формули (II). Звичайно процеси проходять при атмосферному тиску. Однак, проходження процесів також можливе при підвищеному тиску або зниженому тиску (наприклад у межах від 0,5 до 5 бар). Вважають, що, ґрунтуючись на вищенаведеній інформації і відомій у галузі інформації, фахівець зможе втілити цей винахід у найширший спосіб. Звичайному фахівцю у галузі повинно бути очевидним, що у цей винахід можна внести зміни і модифікації, не відходячи від ідеї або об'єму винаходу як він тут викладений. Всі цитовані вище публікації, заяви та патенти включені до опису у якості посилання. Показники маси у наступних дослідженнях і прикладах виражені - якщо не вказано протилежне - у вагових відсотках, частини ε ваговими частинами. Співвідношення розчинників, співвідношення розведення, а також показники концентрації розчинів рідина/рідина у кожному випадку ґрунтуються на об'ємі. Ілюстративні приклади Термограми одержували із застосуванням DSC 7 або Pyris-1 диференційного скануючого калориметра і TGA 7 термогравіметричного аналізатора виробництва Perkin-Elmer. Рентгенівські дифрактограми реєстрували у трансмісійному дифрактометрі Stoe. ІЧ, ДІЧ, БІЧ спектри та спектри Рамана реєстрували із застосуванням спектрометрів фур'є IFS 66v (ІЧ, ДІЧ), IFS 28/N (БІЧ) і RFS 100 (спектри Рамана) виробництва Bruker. Твер13 дотільні спектри ЯМР на С реєстрували із застосуванням ЯМР спектрометра DRX400 від Bruker. Приклад 1: Одержання моногідрату 4-[4-(([4хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3фторфенокси]-N-метилпіридин-2-карбоксаміду Приклад 1.1 400 мг 4-[4-({[4-хлор-3(трифторметил)феніл]карбамоїл}аміно)-3фторфенокси]-2-метилпіридин-2-карбоксаміду у формі поліморфу І, одержаного як описано у публікації WO 2005/009961, розчиняють в ацетоні, розчин фільтрують. До однієї четвертої фільтрату додають воду до утворення осаду. Осад фільтру 19 95984 ють і сушать при кімнатній температурі при вологості навколишнього середовища. Зразок тестували гравіметрично і він відповідав вказаній в заголовку сполуці. Приклад 1.2 400 мг 4-[4-({[4-хлор-3(трифторметил)феніл]карбамоїл}аміно)-3фторфенокси]-N-метилпіридин-2-карбоксаміду у формі поліморфу І, одержаного як описано у публікації WO 2005/009961, розчиняють в 50 мл етанолу, а розчин фільтрують. Одну четверту розчину залишають у холодильнику при приблизно -20°С до випарювання розчинника. Залишок тестують методом рентгенівської дифрактометрії і він відповідає вказаній у заголовку сполуці. Приклад 1.3 100 мг 4-[4-({[4-хлор-3(трифторметил)феніл]карбамоїл}аміно)-3фторфенокси]-N-метилпіридин-2-карбоксаміду у формі поліморфу І, одержаного як описано у пуб 20 лікації WO 2005/009961, суспендують у 2 мл суміші ацетонітрил-вода (1:1) і струшують при 25°С. Через тиждень суспензію фільтрують і залишок сушать при кімнатній температурі і вологості навколишнього середовища. Залишок тестують гравіметричної він відповідає вказаній в заголовку сполуці. Приклад 1.4 100 мг 4-[4-({[4-хлор-3(трифторметил)фенiл]карбамот}амiно)-3фторфенокси]-N-метилпіридин-2-карбоксаміду у формі поліморфу І, одержаного як описано у публікації WO 2005/009961, суспендують у 2 мл суміші тетрагідрофуран-вода (1:1) і перемішують при 10°С. Через два тижні суспензію фільтрують і залишок сушать при кімнатній температурі і вологості навколишнього середовища. Залишок тестують методом рентгенівської дифрактометрії і він відповідає вказаній у заголовку сполуці. Таблиця 1 Диференційна скануюча калориметрія і термогравіметрія Моногідрат 3,6 Температура плавлення [°С] Втрата маси [ваг. %] Таблиця 2 Рентгенівська дифрактометрія Максимальні піки [2 θ] Моногідрат Поліморф 1 5,9 7,2 8,1 7,3 9,5 8,6 11,8 10,7 14,9 11,5 16,2 12,1 16,7 13,4 17,2 13,6 17,7 14,0 18,6 14,5 19,0 14,8 20,5 15,6 20,8 16,0 21,2 16,5 22,0 17,2 22,2 18,6 22,4 18,8 22,8 19,1 23,1 19,8 23,7 20,1 24,1 20,2 24,3 20,4 24,7 21,8 24,9 26,0 26,2 26,3 27,1 27,2 27,6 27,8 28,7 29,2 30,8 Поліморф І 186-206
ДивитисяДодаткова інформація
Назва патенту англійською4-[4-({[4-chloro-3-(trifluoromethyl)phenyl)]carbamoyl}amino)-3-fluorophenoxy]-n-methylpyridine-2-carboxamide monohydrate
Автори англійськоюGrunenberg, Alfons, Stiehl Juergen, Tenbieg, Katharina, Keil Birgit
Назва патенту російськоюМоногидрат 4-[4-({[ хлор-3-(трифторметил)фенил]карбамоил}амино)-3-фторфенокси]- метилпиридин-2-карбоксамида
Автори російськоюГруненберг Альфонс, Штиль Юрген, Тенбиг Катарина, Кайль Биргит
МПК / Мітки
МПК: C07D 213/81, A61K 31/44, A61P 35/00
Мітки: моногідрат, 4-[4-({[4-хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3-фторфенокси]-n-метилпіридин-2-карбоксаміду
Код посилання
<a href="https://ua.patents.su/16-95984-monogidrat-4-4-4-khlor-3-triftormetilfenilkarbamolamino-3-ftorfenoksi-n-metilpiridin-2-karboksamidu.html" target="_blank" rel="follow" title="База патентів України">Моногідрат 4-[4-({[4-хлор-3-(трифторметил)феніл]карбамоїл}аміно)-3-фторфенокси]-n-метилпіридин-2-карбоксаміду</a>
Попередній патент: Спосіб одержання заміщених бромбензолів
Наступний патент: База для зварювання труб в трубні секції
Випадковий патент: Осьовий агрегат для автомобільного причіпа












