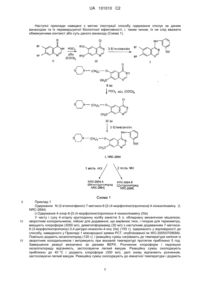
Похідна 6,7-діалкоксихіназоліну, придатна для лікування розладів, пов’язаних з раком
Номер патенту: 101010
Опубліковано: 25.02.2013
Автори: Йотхі Прасад Раманадхам, Нагешвара Рао Боллепаллі, Венкаіах Чоударі Наннапанені, Адібхатла Калі Сатія Бхуджанга рао
Формула / Реферат
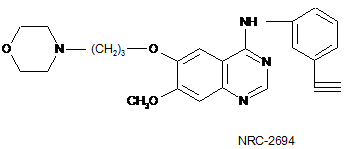
1. Застосування похідної хіназоліну, структура якої представлена формулою
 ,
,
або її фармацевтично прийнятної солі у виробництві медикаменту для лікування раку мозку, раку легені, плоскоклітинного раку, раку сечового міхура, раку шлунка, раку молочної залози, раку стравоходу або раку щитовидної залози.
2. Застосування за п. 1, де раком є рак легені, плоскоклітинний рак або рак молочної залози.
3. Застосування за п. 1, де раком є рак легені.
4. Застосування за п. 1, де фармацевтично прийнятна сіль являє собою моногідрохлорид (NRC-2694A).
5. Застосування за п. 1, де фармацевтично прийнятна сіль являє собою дигідрохлорид (NRC-2694B).
6. Спосіб одержання похідної хіназоліну формули NRC-2694

або її фармацевтично прийнятної солі, в якому здійснюють:
а) реакцію хіназоліну формули ІІ (а)
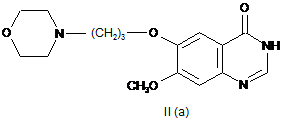
з фосфорилхлоридом або оксалілхлоридом з одержанням 4-хлорохіназоліну формули ІІІ (а)
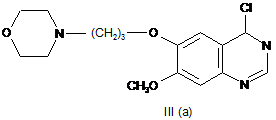 ,
,
b) реакцію конденсації 4-хлорхіназоліну формули ІІІ (а), наведеної вище, з 3-етиніланіліном з одержанням похідної хіназоліну NRC-2694.
Текст
Реферат: Було виявлено, що похідні хіназоліну, які містять 3-етиніланілінову групу в положенні 4 і специфічно заміщені алкоксигрупи в положеннях 6 і 7, мають більш потужні і специфічні антипроліферативні властивості в порівнянні з іншими відомими сполуками хіназолінового класу лікарських засобів. Також, сполуки за даним винаходом несподівано виявились набагато менш токсичними, а їх профіль безпечності - надзвичайно переважним для терапевтичного застосування. UA 101010 C2 (12) UA 101010 C2 Нові хімічні сполуки, описані у даному винаході, позначені загальною структурою (І) і не були синтезовані раніше, а також досліджені на предмет терапевтичної придатності і профілю безпечності. Сполука (І) являє собою NRC-2694, якщо вона має структуру (А). UA 101010 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід належить до похідних 6,7-діалкоксихіназоліну або їх фармацевтично прийнятних солей, які володіють протираковою активністю, і, таким чином, придатні для використання у методах лікування людини. Даний винахід також стосується способів одержання вказаних похідних хіназоліну і фармацевтичних композицій, що їх містять. У більшості схем, які застосовувалися в минулому для лікування захворювань, пов'язаних з проліферацією клітин, наприклад, псоріазу і раку, використовують сполуки, які інгібують синтез ДНК. Такі сполуки токсичні для клітин, і їх позитивна дія може виявлятися тільки, якщо вони демонструють селективність по відношенню до ракових клітин, які швидко діляться. В останні роки виявлено, що клітина може стати раковою внаслідок перетворення частини її ДНК на онкоген, тобто, ген, який при активації призводить до утворення клітин злоякісної пухлини (Bradshas, Mutagenesis, 1986, 1: 91). Декілька онкогенів кодують тирозинкіназні ферменти, і деякі рецептори фактору росту, що також являють собою тирозинкіназні ферменти (Larsen et al., Ann. Reports in Med. Chem. 1989, Chapt.l3). Рецепторні тирозинкінази є важливими для передачі біохімічних сигналів, що ініціюють реплікацію клітин. Вони включають позаклітинний домен зв'язування з факторами росту, наприклад, епідермальним фактором росту, і внутрішньоклітинну частину, яка функціонує, як кіназа з метою фосфорилування тирозинових амінокислот у білках і, таким чином, впливає на проліферацію клітин. Також відомо, що подібні кінази часто присутні у поширених видах раку людини, наприклад, раку молочної залози (Saimbury et al., Brit, J. Cancer, 1988, 58: 458), раку шлунково-кишечного тракту, такого як рак шлунку, ободової і прямої кишки (Bolen et al., Oncogene Res., 1987, 1: 149). Доведено, що тирозинкіназну активність (ТК активність) частіше виявляють у злоякісних клітинах, ніж у здорових клітинах (Hunter, Cell, 1987, 50: 823). Нещодавно продемонстровано, що рецептор епідермального фактору росту (EGFR, РЕФР), який володіє ТК активністю, великою мірою експресується у багатьох видах раку людини, наприклад, раку мозку, плоскоклітинному раку легені, сечового міхура, шлунку, молочної залози, голови і шиї, стравоходу, щитоподібної залози, тощо (WJ. Gullick, Brit. Med. Bull. 1991, 47: 87). Рецептор епідермального фактору росту (РЕФР), представник родини тирозинкіназних ферментів (RTK - РТК), складається з чотирьох рецепторів Erbl/HERI, Erb/HER2, Erb/HER3 і Erb/HER4. Важлива стратегія інгібування активності РЕФР-ТК залучає синтетичні молекули невеликого розміру (Arteaga CL, Exp. Cell Res., 2003, 284: 122-130). Деякі похідні хіназоліну, подібні до гефітинібу (Iressa™, Astra Zeneca), ерлотинібу (OSI-774, Tarceva™), PD-183805, РKІ-166, ЕKВ569, PD-168393, CGP-59362, широко досліджували з точки зору можливих варіантів лікування декількох типів раку (Baselga et al., Oncology 2002, 63: 6-16, Cohen RB., Clin. Colorectal Cancer, 2003, 2:246-251). В європейських патентних заявках, а саме ЕР 0566226, ЕР 0602851 Аi, ЕР 0635507 Аі, ЕР 0635498 Аі, ЕО 0520722 Aj розкриті деякі похідні хіназоліну, що володіють протираковими властивостями завдяки здатності інгібувати ТК. В патентах США 5475001, 5457105, 5616582, 5770599, 5747498, 6900221 і т.п. розглянуті похідні хіназоліну з такими структурними ознаками, як заміщений аніліновий фрагмент у положенні 4 і різноманітні функціоналізовані алкільні групи у положеннях 6 і 7 хіназолінового ядра. Конкретно, патенти США 5457105 і 5616582 стосуються N-(3-хлор-4-фторофеніл)-7-метокси6-[3-(4-морфолініл)пропокси]-4-хіназолінаміну (гефітиніб), а в патентах США 5747498 і 690221 розглянутий N-(3-етилнілфеніл)-6,7-біс(2-метоксиетокси)-4-хіназолінамін (ерлотиніб). WO 20005/070909, WO 2007/060691 А2 і WO 06/090413 з варіаціями синтезу або поліморфних форм вказаних двох популярних протиракових лікарських засобів. З урахуванням великого потенціалу, який пропонують вказані сполуки хіназолінового класу, нами розпочато синтез і скринінг великої кількості нових хімічних речовин з новими структурними ознаками. Несподівано було виявлено, що похідні хіназоліну, які містять 3етиніланілінову групу в положенні 4 і специфічно заміщені алкоксигрупи в положеннях 6 і 7, володіють більш потужними і специфічними антипроліферативними властивостями в порівнянні з іншими відомими сполуками хіназолінового класу лікарських засобів. Також, сполуки за даним винаходом несподівано виявились набагато менш токсичними, а їх профіль безпечності надзвичайно переважним для терапевтичного застосування. Нові хімічні сполуки, описані у даному винаході, позначені загальною структурою (І) і не були синтезовані раніше, а також досліджені на предмет терапевтичної придатності і профілю безпечності. 1 UA 101010 C2 2 і R =OCH3, OC2H5 Сполука (і) являє собою NRC-2694, де 5 10 15 20 25 30 35 2 і R =OCH3. Моногідрохлоридна сіль NRC-2694 являє собою NRC-2694 А. Дигідрохлоридна сіль NRC2694 являє собою NRC-2694 В. Нові сполуки за даним винаходом, особливо NRC-2694, володіють непередбаченими перевершуючими протираковими/антипроліферативними властивостями і пропонують додаткові терапевтичні переваги в порівнянні з відомими лікарськими засобами даного класу, як детально наведено нижче: 1) Нижча інгібувальна концентрація: Інгібувальна концентрація (ІС50) у способі кількісного визначення проліферації МТТ продемонструвала значення в інтервалі 40-90 нг/мл (при 100-200 нм), тоді як значення для ерлотинібу становить 836 нг/мл (при 1945 нм). Такий же висновок підтвердили Вестерн-блоттинг і випробування інвазії у клітину з використанням Matrigel. 2) Повна регресія пухлини: Спостерігали повну регресію пухлини після перорального введення сполук голим мишам, яким імплантували клітини А549 раку легені людини в дозі 10 мг/кг. У порівняльному дослідженні, навіть у дозі 100 мг/кг, ерлотиніб НСІ не був здатний індукувати повну регресію пухлини. Візуальний огляд тканини легені мишей, яким імплантували А549, і експерименти з експресуванням люциферази підтверджують ці спостереження. 3) Ефективність лікарських засобів: Оцінка ефективної дози показала значення (ED50) 6,3 мг/кг для типової сполуки за даним винаходом viz., NRC-2694, тоді як значення, одержане при введенні ерлотинібу НСІ, становило 22 мг/кг. Спостерігали 100 % лікувальний ефект RC-2694 проти 50-60 % ефекту у випадку ерлотинібу НСІ. 4) Додаткові унікальні показання: Сполуки за даним винаходом, типово NRC-2694, демонструють ефективність при додаткових показаннях, таких як рівні регуляції вниз експресії рецепторів ЕrbВ2, ЕrbB3, ЕrbВ4 і VEGFR. Вказаний специфічний, найбільш багатообіцяючий і несподіваний результат є повністю непередбачуваним і взагалі не спостерігався у випадку введення ерлотинібу НСІ. 5) Профіль безпечності: Профіль безпечності сполук за даним винаходом, типово NRC2694, виявився достатньо перспективним, несподівано широким і надзвичайно переважним для терапевтичного застосування, наприклад, NRC-2694 продемонструвала максимальну переносну дозу (МПД) 500 мг/кг проти дози 2000 мг/кг для ерлотинібу НСІ. Широке терапевтичне вікно, запропоноване NRC-2694, продемонстроване за її значенням LD50 2000 мг/кг проти 500 мг/кг для ерлотинібу НСІ. Значення LD 50 не могло бути точно визначено для NRC-2694, тоді як для ерлотинібу НСІ було визначене значення 805 мг/кг. 2 UA 101010 C2 Наступні приклади наведені з метою ілюстрації способу одержання сполук за даним винаходом та їх перевершуючої біологічної ефективності, і, таким чином, їх не слід вважати обмежуючими контекст або суть даного винаходу (Схема 1). 5 10 15 Приклад 1 Одержання N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну (І, NRC-2694) і) Одержання 4-хлор-6-[3-(4-морфолінил)пропокси-4-хіназолінаміну (ІІІа) У чисту і суху 4-хгорлу круглодонну колбу ємністю 5 л, обладнану механічною мішалкою, зворотним холодильником, лійкою для додавання, що вирівнює тиск, і гніздом для термометру, вміщують хлороформ (3000 мл), диметилформамід (30 мл) з наступним додаванням 7-метокси6-(3-морфолінопропокси)-3,4-дигідро-хіназолін-4-ону (IIа) (150 г), одержаного у відповідності до способу, наведеного у Прикладі 1 міжнародної заявки РСТ, опублікованої як WO.2005/070909Ai. Повільно додають оксалілхлорид (120 г), і реакційну суміш нагрівають до температури кипіння із зворотним холодильником і витримують при вказаній температурі протягом приблизно 5 год. Завершення реакції визначено за даними ВЕРХ. Розчинник хлороформ і надлишок оксалілхлориду відганяють, застосовуючи легкий вакуум. Реакційну суміш охолоджують приблизно до 40 °С і додають хлороформ (300 мл), далі знову відганяють розчинник, застосовуючи легкий вакуум. Реакційну суміш охолоджують до кімнатної температури і додають 3 UA 101010C2 5 10 15 20 25 30 35 40 45 50 55 60 ацетонітрил (3000 мл), перемішують протягом 10-15 хв і вміщують в атмосферу азоту для переходу до наступної стадії. іі) Одержання N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну (І, NRC-2694) У 4-хгорлу круглодонну колбу ємністю 5 л, обладнану механічною мішалкою, зворотним холодильником і гніздом для термометру, що містить хлорпохідне із стадії (і), згаданої вище, в ацетонітрилі додають повільно 3-етиніланілін (69 г) протягом приблизно 10-15 хв, реакційну суміш нагрівають до температури кипіння із зворотним холодильником і витримують при вказаній температурі протягом приблизно 4 год. Завершення реакції визначають за даними ВЕРХ. Потім реакційну суміш охолоджують до 25-35 °С і фільтрують, одержаний продукт промивають ацетонітрилом (500 мл) і висушують. Висушену неочищену сполуку вміщують в іншу круглодонну колбу ємністю 5 л і додають воду (2500 мл), повільно доводять температуру до 60-65 °С і доводять рН реакційної суміші до 10-12 за допомогою розбавленого розчину натрію гідроксиду. Твердий продукт відокремлюють фільтрацією і промивають водою, після чого висушують при температурі 70-75 °С з одержанням 173,0 г N-(3-етинілфеніл)-6-(3-морфілінпропокси)-7-метокси-4-хіназолінаміну у вигляді білої твердої речовини. iiі) Одержання N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну перекристалізацією з толуолу В 4-хгорлу круглодонну колбу ємністю 5 л, обладнану механічною мішалкою, зворотним холодильником і гніздом для термометра, вміщують толуол (3750 мл) з наступним додаванням N-(3-етинілфеніл)-6-(3-морфолінопропокси)-7-метокси-4-хіназолінаміну (50 г), одержаного у відповідності до способу, описаного у Прикладі І вище. Реакційну суміш нагрівають до температури 90-95 °С, таким чином, щоб тверда речовина повністю розчинилася. Потім обробляють вугіллям і фільтрують. Фільтрат охолоджують до 25-35 °С, витримують протягом приблизно 1 год., знову фільтрують, і матеріал висушують з одержанням 40,15 г N-(3етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну у вигляді білої кристалічної твердої речовини. Тпл:185-187 °С. Чистота: 99,72 % (ВЕРХ)/ -1 ІЧ (KBr) (см ): 3280,9; 2954,6; 2810,3; 1620,1; 1604,2; 1572,1; 1527,7; 1505,2; 1484; 1430,5; -1 1388,2; 1247,5; 1211,2; 1140,3; 1110,4; 1010,3; 953,4; 859,6; 784,2 см . 1 H ЯМР (300 МГц; ДMCO-d6); 9,57 (c, 1H); 8,48 (c, 1H); 7,99 (c, 1H); 7,86-7,92 (д, 2H); 7,34-7,44 (т, 1H) 7,18-7,21 (c, 2H); 4,15-4,21 (т, 4Н); 3,92 (с, 3Н) 3,5-3,6 (т, 4Н); 2,4-2,52 (м, 5Н); 1,95-2,01 (м, 2Н). МС: 419,4 (М+1). Приклад 2 Перекристалізація N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4хіназолінаміну з ацетонітрилу У 3-хгорлу круглодонну колбу ємністю 2 л, обладнану механічною мішалкою, зворотним холодильником і гніздом для термометра, вміщують ацетонітрил (1000 мл) з наступним додаванням N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну (25 г), одержаного у відповідності до способу, описаного у Прикладі І вище. Реакційну суміш повільно нагрівають до температури 65-70 °С, таким чином, щоб тверда речовина повністю розчинилася, потім реакційну суміш обробляють вугіллям і фільтрують. Фільтрат переносять в іншу круглодонну колбу, повільно охолоджують до 10-15 °С і витримують протягом 30 хв при вказаній температурі. Одержану суміш фільтрують і, після промивання охолодженим ацетонітрилом, висушують з одержанням 20,50 г N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4хіназолінаміну у вигляді білої кристалічної твердої речовини. Тпл: 186-187 °С. Чистота: 99,68 % (ВЕРХ). Приклад 3 Перекристалізація N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4хіназолінаміну з етилацетату В 3-хгорлу круглодонну колбу ємністю 3 л, обладнану механічною мішалкою, зворотним холодильником і гніздом для термометра, вміщують етилацетат (2000 мл) з наступним додаванням N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну (25 г), одержаного у відповідності до способу, описаного у Прикладі І вище. Реакційну суміш повільно нагрівають до температури 65-70 °С, таким чином, щоб тверда речовина повністю розчинилася, потім реакційну суміш обробляють вугіллям і фільтрують. Фільтрат переносять в іншу 4 UA 101010 C2 5 10 15 20 25 30 35 40 45 50 55 60 круглодонну колбу, повільно охолоджують до 10-15 °С і витримують протягом 30 хв при вказаній температурі. Кристалічну суміш фільтрують і, після промивання одержаної суміші охолодженим етилацетатом, висушують з одержанням 20,95 г N-(3-етилнілфеніл)-7-метокси-6-[3-(4морфолінил)пропокси]-4-хіназолінаміну у вигляді білої кристалічної твердої речовини. Тпл: 185-187 °C. Чистота: 99,7 % (ВЕРХ). Приклад 4 Одержання N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну моногідрохлориду (NRC-2694A) У 3-хгорлу круглодонну колбу ємністю 500 мл, обладнану механічною мішалкою, зворотним холодильником, гніздом для термометра і т.п., вміщують ізопропіловий спирт (250 мл) з наступним додаванням N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4хіназолінаміну (5 г), одержаного у відповідності до способу, описаного у Прикладі І. Температуру реакційної суміші доводять до 65-70 °С таким чином, щоб тверда речовина повністю розчинилася, потім обробляють вугіллям і фільтрують. Фільтрат охолоджують приблизно до 55-60 °С, і додають 1 моль газоподібного НСІ, розчиненого у розчині ізопропілового спирту при відокремленні солі моногідрохлориду. Реакційну суміш витримують при температурі кипіння із зворотним холодильником протягом приблизно 2 год., а потім охолоджують до кімнатної температури, фільтрують і висушують з одержанням 5,1 г N-(3етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну моногідрохлориду у вигляді білої кристалічної речовини. Чистота: 99,8 % (ВЕРХ). Вміст НСІ (хімічний): 8,19 % (теоретичне значення: 8,01 %). -1 ІЧ (KВr) (см ): 3407; 3305; 3259,5; 2934; 2619; 1625,9; 1593,8; 1579,9; 1530,8; 1512; 1476,9; 1392,2; 1356,8; 1282,1; 1242,1; 1207,9; 1141,3; 1100,8; 1076,1; 1042,1; 1026,5; 1011,5; 957,7; 941,5; 922,1; 857,3; 852; 838,1; 796; 782,4. Приклад 5 Одержання N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4-хіназолінаміну дигідрохлориду (NRC-2694B) У 3-хгорлу круглодонну колбу ємністю 500 мл, обладнану механічною мішалкою, зворотним холодильником, гніздом для термометра і т. п., вміщують ізопропіловий спирт (250 мл) з наступним додаванням N-(3-етилнілфеніл)-7-метокси-6-[3-(4-морфолінил)пропокси]-4хіназолінаміну (5 г), одержаного у відповідності до способу, описаного у Прикладі І. Температуру реакційної суміші доводять до 65-70 °С таким чином, щоб тверда речовина повністю розчинилася. Потім обробляють вуглецем і фільтрують. Фільтрат охолоджують до приблизно 55-60 °С, і додають 1 моль газоподібного НСІ, розчиненого у розчині ізопропілового спирту при відокремленні солі дигідрохлориду. Реакційну суміш витримують при температурі кипіння із зворотним холодильником протягом приблизно 2 год., після чого охолоджують до кімнатної температури, фільтрують і висушують з одержанням N-(3-етилнілфеніл)-7-метокси-6[3-(4-морфолінил)пропокси]-4-хіназолінаміну дигідрохлориду у вигляді білої кристалічної речовини. Чистота: 99,78 % (ВЕРХ). Вміст НСІ (хімічний): 14,9 % (теоретичне значення: 14,83 %). -1 ІЧ (КВr) (см ): 3406,8; 3194,1; 2942,7; 2681,9; 2623,6; 1633,7; 1566,2; 1528,6; 1512,5; 1438,6; 1359,6; 1282,3; 1218,3; 1157,1; 1132,7; 1105,9; 1075,6; 1001,9; 942,1; 875,3; 816,1; 787,2. Приклад 6 Оцінка максимально переносної дози (МПД) та гострої токсичності (табл. 1 і 2) Дослідження МПД, процитовані раніше, було проведене на самцях і самках мишей Swiss Albino (швейцарських білих) масою 20-25 г. Дослідження проведене згідно правилу 420 вказівок Організації економічного співробітництва та розвитку (OECD), дослідження проводили у період з 9 годин ранку до 17 годин з метою уникнення впливу циркадного циклу, сполуки Ерлотиніб і NRC-2694 суспендували у 2 % акацієвої камеді, вказані сполуки вводили в дозах 5, 50, 300 і 2000 мг/кг перорально. Проміжні дози вводили у залежності від смертності. За тваринами спостерігали щодо виражених поведінкових змін кожної години протягом 6 год. після введення лікарського засобу. Далі за тваринами спостерігали протягом 72 год. на випадок смертності. Тварин, що вижили, умертвляли і здійснювали розтин для підтвердження абсорбції сполуки в шлунковокишковому тракті. Гостру токсичність Ерлотинібу і NRC-2694 вивчали на самцях і самках мишей. Дози 500, 750, 1000 і 2000 мг/кг вводили перорально. Кожна група складалася з 5 мишей. За смертністю 5 UA 101010 C2 5 тварин спостерігали протягом 14 днів після введення сполуки. Тварин, що вижили, умертвляли і здійснювали розтин для підтвердження абсорбції сполуки через шлунково-кишковий шлях. LD50 визначали, використовуючи дослідження Litchfield і Wilcoxon (J. Pharmacol. Exp. Ther.1949, 96: 99-113). Результати досліджень токсичності наведені у табл. 1 і 2. Виявлено, що максимально переносна доза (МПД) ерлотинібу НСІ становить 500 мг/кг (п/о), тоді як для NRC-2694 вказана доза становить 2000 мг/кг (п/о). Аналогічно виявлено, що LD 0 становить 500 мг/кг (п/о) для ерлотинібу НСІ і 2000 мг/кг (п/о) для NRC-2694. Таким чином, виявлено непередбачену і несподівано низьку токсичність і профіль безпечності NRC-2694 в порівнянні з ерлотинібу НСІ. 10 Таблиця 1 Порівняльне дослідження ерлотинібу НСІ і NRC-2694 (на мишах), процитоване раніше Сполука МПД, мг/кг (п/о) 500 2000 Ерлотинібу НСІ NRC-2694 Таблиця 2 Дослідження гострої LD50 (період спостереження 7 днів після введення одноразової дози) у мишей Сполука Ерлотинібу НСІ NRC-2694 LD0, мг/кг (п/о)* 500 2000 LD50, мг/кг (п/о) 805 *LD0: Після проходження 7 днів смертності не спостерігали. 15 20 25 30 35 40 Приклад 7 Дослідження оцінки in vitro, in vivo і оцінки терапевтичної ефективності Зразки: Ерлотиніб використовували як контрольний лікарський засіб, біологічну активність нових сполук за даним винаходом перевіряли в порівнянні з даним лікарським засобом як позитивним контролем. і) Кількісне визначення проліферації МТТ: Кількісне визначення проліферації МТТ [3-(4,5-диметилтіазол-2-іл)-2,5-дифенілтетразолію бромід], вперше описане Mosmann у 1983 p., базується на здатності дегідрогеназного ферменту мітохондрій із життєздатних клітин розщеплювати кільця тетразолію МТТ блідо-жовтого кольору з утворенням синіх кристалів формазану, що практично не проникають у клітинні мембрани, в результаті чого вони акумулюються у здорових клітинах. Солюбілізація клітин шляхом додавання детергенту в результаті приводить до вивільнення солюбілізованих кристалів. Кількість клітин, що виживають, прямо пропорційна рівню утвореного продукту формазану. Далі колір можна визначити кількісно, використовуючи звичайний колориметричний аналіз. Вказаний аналіз проводять, використовуючи Ерлотиніб і досліджувану сполуку в клітинах А549 і Н 1299 у концентрації 0-1000 нМ/мл. Протокол базується на АТСС та інструкціях виробника (Каталог №: 30-1010К). В результаті кількісного визначення проліферації МТТ виявлено, що інгібувальна концентрація (ІС50) сполук за даним винаходом, варіює в межах 40-90 нМ/мл (100-200 нМ), тоді як ерлотиніб гідрохлорид, використаний як позитивний контроль, продемонстрував значення не більше 836 нМ/мл (1945 нМ). Таким чином, нові сполуки за даним винаходом як мінімум у 10 разів потужніші за ерлотиніб гідрохлорид. іі) Вестерн-блоттинг (фіг. 1) Ідеальні концентрації лікарських засобів, визначені за допомогою кількісного визначення 6 проліферації МТТ, використовували для обробки 1×10 клітин Н 1299 або А549 у відповідних середовищах протягом 72 год., після чого лізати клітин екстрагували і фракціонували у 10 % гелі SDS PAGE у відновлювальних умовах. Гелі наносили на оброблені нейлонові мембрани (Biorad) і виконували імунні проби на наявність EGFR, P13K і АКТ. Спостерігалися істотні дозозалежні зміни експресії EGFR. NRC-2694 в концентраціях 80 нМ (190 нМ) спричиняв інгібування експресії EGFR у порівнянні з ерлотинібу НСІ у концентраціях 6 UA 101010 C2 5 10 15 20 25 30 35 40 45 50 800 нМ (1860 нМ). Отже, очевидним є рівень ефективності NRC-2694, який є вищим на десять порядків. ііі) Дослідження інвазії з використанням Matrigel (фіг. 2) Інвазійність in vitro клітин Н 1299 і А549 в присутності різних концентрацій сполук NRC (визначають за допомогою кількісного визначення проліферації МТТ) оцінювали, використовуючи модифіковане випробування за допомогою камери Бойдена (Boyden). Клітини 6 обробляли вказаними сполуками протягом 48 год. 1×10 клітин суспендували у 600 мкл середовища, вільного від сироватки, у яке додавали 0,2 % бичачого сироваткового альбуміну (BSA), і вміщували у верхнє відділення камер Transwell (Corning Costar Fisher Scientific, кат. № 07-200-158, Pittsburgh PA), вкритих Matrigel (0,7 мг/мл). Нижнє відділення камери заповнювали 200 мкл середовища з вмістом сироватки, в якому клітини мігрували протягом 24 год. Після інкубації клітини фіксували і фарбували за допомогою Гема-3, далі підраховували їх кількість, як було описано раніш (Mohanam et al. 1993). Кількість клітин, що мігрували, визначали як відсоток інвазії. Сполука NRC-2694 продемонструвала значне, дозозалежне зменшення інвазії. iv) Оцінка in vivo підшкірних пухлин легені голих мишей (фіг. 3): 6 Голим мишам імплантували 2×10 клітин А549 у праву частину задньої кінцівки. Для спостереження за пухлиною (>2 мм) миші одержували досліджувані сполуки перорально або внутрішньочеревинно, в тому числі ерлотиніб НСІ, який використовували як позитивний контроль. Дозу 100 мг/кг ерлотинібу НСІ ідентифікували як початкову дозу. Вимірювали розміри пухлини і спостерігали повну регресію пухлин у мишей, яким вводили NRC-2694 в дозі 10 мг/кг. Однак, пухлини були все ще присутні у тварин контрольної групи, яким аналогічно вводили ерлотиніб НСІ, навіть при рівні дози 100 мг/кг. Таким чином, встановлено рівень ефективності сполуки за даним винаходом (NRC-2694), який є вищим на десять порядків. v) Оцінка тканини легені, відібраної у голих мишей після лікування (фіг. 4) Легені, вирізані у голих мишей, яким імплантували клітини А549 з експресуванням люциферази, обробляли різними концентраціями ерлотинібу НСІ і NRC-2694, при пероральному і внутрішньочеревинному веденні, та розглядали щодо залишкових пухлин. Спостерігали повну регресію пухлини у групі, що одержувала NRC-2694, тоді як у групі, яка одержувала ерлотинібу НСІ, пухлини все ще були присутні, отже, виявлена непередбачуванаі несподівана перевершуюча ефективність сполук за даним винаходом. vi) Візуальний огляд пухлин в тканині легені (фіг. 5) Голим мишам імплантували клітини А549 шляхом внутрішньолегеневих ін'єкцій. Пероральним і внутрішньочеревинним шляхом мишам вводили ерлотинібу НСІ і NRC 2694 у дозах 2,5 і 20 мг/кг. Через 30 днів щоденного введення вказаних лікарських засобів мишей умертвляли і вирізали легені. Тканини легень поміщали у 10 % буферизований розчин формальдегіду, заливали парафіном і розтинали на секції. Секції являли собою плями Н та Е, передбачені документально протоколами, для візуалізації солідних або дифузійних пухлин. Виживаність тварин в групі, яка одержувала NRC-2694, була набагато кращою, ніж в групі, яка одержувала ерлотинібу НСІ, при всіх рівнях доз, таким чином, демонструючи переважну ефективність NRC-2694. vii) Голі миші, яким імплантували клітини А549, що експресують люциферазу (фіг. 6 та 7) Спостерігали за ростом пухлин у голих мишей, яким імплантували клітини А549, що експресують люциферазу, після перорального і внутрішньочеревинного введення різних концентрацій ерлотинібу НСІ і NRC-2694. На фіг. 6 та 7 зображені результати даного спостереження. Спостерігали, що виживаність тварин в групі, яка одержувала NRC-2694, є набагато кращою, ніж в групі, яка одержувала ерлотинібу НСІ. В кінці лікування NRC-2694 протягом 42 днів не спостерігали росту пухлини, тоді як залишкові пухлини все ще були присутні в групі, яка одержувала ерлотинібу НСІ як пероральним, так і внутрішньочеревинним шляхом. viii) Терапевтичний вплив, який спостерігали у голих мишей в ході дослідження in vivo У табл. 3 лікувальний ефект представлений як співвідношення кількості вилікуваних тварин до кількості тварин, що приймали участь у дослідженні. 7 UA 101010 C2 Таблиця 3 Терапевтичний вплив NRC-2694 та ерлотинібу НСІ на рак легені Лікарські засоби Ерлотиніб внутрішньочеревинно Ерлотиніб перорально NRC-2694 внутрішньочеревинно NRC-2694 перорально Концентрація мг/кг 2,5 5 10 20 2,5 5 10 20 2,5 5 10 20 2,5 5 10 20 Співвідношення вилікування 1/5 2/5 2/5 3/5 2/5 0/5 1/5 2/5 1/5 1/5 3/5 5/5 (100 %) 1/5 2/5 3/5 3/5 Можна побачити, що співвідношення наближається до 100 % у випадку NRC-2694, тоді як у випадку групи, яка одержувала ерлотиніб НСІ, співвідношення становить 40-60 %. 5 10 15 20 25 іх) Оцінка ED50: Значення ED50 оцінювали, базуючись на вивченні зрізу легені і регресії пухлини. Для NRC2694 обчислене значення становить 6,3 мг/кг, а значення, одержане для Ерлотинібу НСІ при пероральному введенні, становило 22 мг/кг. Таким чином, встановлена перевершуюча ефективність сполуки за даним винаходом. х) Дослідження in vitro з використанням інших рецепторів, наприклад, HER-1, HER-2, HER-3, HER-4 і VEGFR (фіг. 8) Для визначення впливу NRC-2694 на різноманітні інші рецептори групи EGFR (Erb/HER), клітини А549 раку легені людини обробляли різними концентраціями NRC-2694 і ерлотинібу НСІ як препаратом порівняння. Рівні Erb-1, Erb-2, Erb-3, Erb-4 i VEGFR визначали за допомогою Вестерн-блоттингу. Спостерігалося, що NRC-2694 ефективно знижує рівні регуляції експресії рецепторів Erb B2, Erb В3, Erb B4 і VEGFR, тоді як у випадку ерлотинібу НСІ подібного явища не спостерігається. Додатковий показник інгібування у рівнях експресії вище згаданих рецепторів наочно демонструє непередбачувану і несподівану властивість головної молекули за даним винаходом viz., NRC 2694. хі) Висновок: В описаних вище експериментах були встановлені непередбачені, дивовижні і потужні протиракові властивості, а також додатковий терапевтичний потенціал сполуки за даним винаходом у порівнянні з ерлотинібу НСІ. Приклад 8 Даний приклад являє собою ілюстративну характерну дозовану лікарську форму, що містить сполуку формули NRC-2694 або її фармацевтично прийнятну сіль, для терапевтичного профілактичного застосування у людини. Таблетка Сполука NRC-2694 Лактоза безводна (Фарм. США) Мікрокристалічна целюлоза (Avicel pH 102) Натрію лаурилсульфат Натрію крохмальгліколят Повідон К-30 Гідроксипропіл целюлоза Магнію стеарат мг/таблетку 50 156 15 5 10 3 10 1 8 UA 101010 C2 ФОРМУЛА ВИНАХОДУ 1. Застосування похідної хіназоліну, структура якої представлена формулою NH O N (CH2)3 O N N CH3O NRC-2694 5 10 , або її фармацевтично прийнятної солі у виробництві медикаменту для лікування раку мозку, раку легені, плоскоклітинного раку, раку сечового міхура, раку шлунка, раку молочної залози, раку стравоходу або раку щитовидної залози. 2. Застосування за п. 1, де раком є рак легені, плоскоклітинний рак або рак молочної залози. 3. Застосування за п. 1, де раком є рак легені. 4. Застосування за п. 1, де фармацевтично прийнятна сіль являє собою моногідрохлорид (NRC2694A). 5. Застосування за п. 1, де фармацевтично прийнятна сіль являє собою дигідрохлорид (NRC2694B). 6. Спосіб одержання похідної хіназоліну формули NRC-2694 NH O N (CH2)3 O N N CH3O 15 NRC-2694 або її фармацевтично прийнятної солі, в якому здійснюють: а) реакцію хіназоліну формули ІІ (а) O O N (CH2)3 O NH N CH3O II (a) з фосфорилхлоридом або оксалілхлоридом з одержанням 4-хлорохіназоліну формули ІІІ (а) Cl O N (CH2)3 O N CH3O 20 N III (a) , b) реакцію конденсації 4-хлорхіназоліну формули ІІІ (а), наведеної вище, з 3-етиніланіліном з одержанням похідної хіназоліну NRC-2694. 9 UA 101010 C2 10 UA 101010 C2 11 UA 101010 C2 12 UA 101010 C2 13 UA 101010 C2 14 UA 101010 C2 Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійською6.7-dialkoxy ouinazoline derivatives useful for treatment of cancer related disorders
Автори англійськоюJyothi Prasad, Ramanadham, Adibhatla Kali Satya, Bhujanga, Rao, Nageshwara Rao, Bollepalli, Venkaiah Chowdary Nannapaneni
Назва патенту російськоюПроизводное 6,7-диалкоксихиназолина, пригодное для лечения расстройств, связанных с раком
Автори російськоюЙотхи Прасад Раманадхам, Адибхатла Кали Сатия Бхуджанга Рао, Нагешвара Рао Боллепалли, Венкаиах Чоудари Наннапанени
МПК / Мітки
МПК: A61P 35/00, A61K 31/517, C07D 239/94
Мітки: раком, розладів, пов'язаних, похідна, лікування, 6,7-діалкоксихіназоліну, придатна
Код посилання
<a href="https://ua.patents.su/17-101010-pokhidna-67-dialkoksikhinazolinu-pridatna-dlya-likuvannya-rozladiv-povyazanikh-z-rakom.html" target="_blank" rel="follow" title="База патентів України">Похідна 6,7-діалкоксихіназоліну, придатна для лікування розладів, пов’язаних з раком</a>
Попередній патент: Ефективна організація міжмережної взаємодії між мультимедійними службами з комутацією каналів і з пакетною комутацією
Наступний патент: Пристрій і спосіб обробки відходів, а також способи одержання біоспирту, палива для паливного елемента і авіаційного палива
Випадковий патент: Масогабаритний макет стрілецької зброї