Інгібітори передачі сигналів брасиностероїдів
Формула / Реферат
1. Сполука, що має формулу (І)
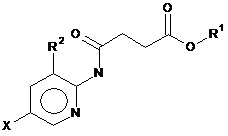 , (I)
, (I)
де
X позначає F, Сl, Вr або І;
R1 позначає CH3, C2H5, C2H4R3, C2H3R3R4, C3H7, C3H7R3 або C3H5R3R4;
R2 позначає Н, СН3, С2Н5, C2H4R3 або C2H3R3R4; і
R3 та R4 незалежно позначають X, ОН або NH2,
призначена для обробки рослин, особливо, для посилення росту рослин, збільшення врожайності та/або забезпечення стійкості до стресів.
2. Сполука за п. 1, яка відрізняється тим, що R1 позначає СН3, R2 позначає Н і X позначає І.
3. Сполука, що має формулу (II)
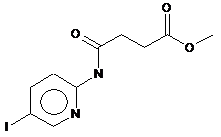 . (II)
. (II)
4. Спосіб одержання сполуки за п. 3, який відрізняється тим, що здійснюють реакцію 2-аміно-5-йодпіридину з хлорангідридом метилбурштинової кислоти.
5. Композиція для посилення росту рослин та/або врожайності, та/або стійкості до стресу, яка включає ефективну кількість сполуки за п. 1.
6. Композиція для посилення росту рослин та/або врожайності, та/або стійкості до стресу, яка включає ефективну кількість сполуки за п. 3.
7. Спосіб одержання сполуки формули (III)
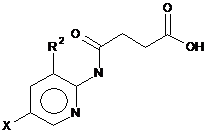 , (III)
, (III)
де X позначає І та R2 позначає Н,
який відрізняється тим, що здійснюють реакцію 2-аміно-5-І-піридину з бурштиновим ангідридом.
8. Спосіб одержання сполуки формули (II), в якому сполуку, що має формулу (III), де X позначає І та R2 позначає Н, алкілують галоїдметилом, диметилсульфатом чи діазометаном або естерифікують СН3ОН.
9. Сполука, що має формулу (І), визначену в п. 1, призначена для застосування як гербіцид.
10. Сполука за п. 3, що має формулу (II), яка відрізняється тим, що призначена для застосування як гербіцид.
Текст
Реферат: Винахід стосується інгібіторів передачі сигналів брасиностероїдів, в якому описано галогеновмісну похідну піридину, призначену для обробки рослин, особливо, для посилення росту рослин, збільшення врожайності та/або забезпечення стійкості до стресів та для застосування як гербіцид. UA 101490 C2 (12) UA 101490 C2 UA 101490 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується інгібіторів передачі сигналів брасиностероїдів. Брасиностероїди є рослинними стероїдними гормонами, які беруть участь у багатьох процесах, включаючи ріст та поділ клітин, ріст пилкової трубки, розвиток судинної тканини, старіння та модуляція стресових реакцій. Брасиностероїди утворюються зі стерольних прекурсорів. Багато ферментів, що беруть участь в біосинтезі брасиностероїдів, були ідентифіковані шляхом аналізу мутантів Arabidopsis thaliana, таких як dwf1, cbb1, dwf4, cpd, det2 та ste1/dwf7. Нещодавно, аналіз dx-мутації томатів дозволив ідентифікувати фермент, що бере участь в останній стадії біосинтезу брасиностероїдів, перетворенні кастастерону на брасинолід, найбільш активний брасиностероїд. Два гомологи Arabidopsis thaliana можуть бути ідентифіковані з використанням підходу "ген-кандидат". Ці ферменти і DWF4 та CPD належать до сімейства монооксигеназ цитохрому Р450. Брасинолід сприймається рецептором-кіназою BRI1 та його корецептором ВАK1, які, на відміну від тваринних стероїдних рецепторів, локалізовані у клітинній мембрані. Сигнал переноситься ще невідомими механізмми до ядра та регулює GSK-3/Shaggy-подібні кінази, які беруть участь в передачі сигналів брасиностероїдів: BIN2/UCU1, ASK, ΑSΚ та ASK (Vert and Chory, 2006). Ці кінази фосфорилюють фактори транскрипції, які належать до сімейства BES1/BZR1, у консервативному мотиві, що складається з восьми суміжних повторів послідовності SXXXS. Активність цих факторів транскрипції при цьому блокується, оскільки лише їх нефосфорильовані варіанти можуть зв'язуватися з ДНК та регулювати експресію генів. Дефосфорилювання промотується ядерною протеїнфосфатазою BSU1 та її гомологами BSL1BSL3. Крім того, білки 14-3-3 можуть зв'язувати фосфорильовані BZR1 та BES1, які можуть промотувати їх повторну локалізацію у цитоплазмі. Хоча відомий ряд ферментів, які беруть участь в синтезі брасиностероїдів та передачі сигналів, існує дуже мало інгібіторів. Першим відомим селективним інгібітором синтезу брасиностероїдів був KМ-01 (Kim et al., 1998). Через слабку активність його застосування було дуже обмеженим. Спостереження, що інгібітор біосинтезу гіберелінової кислоти уніконазол має слабкий інгібуючий ефект на біосинтез брасиностероїду, привело до розробки брасиназолу (Min et al., 1999) та Brz2001 (Sekimata et al., 2001). Аналогічно, інший інгібітор брасиностероїду був ідентифікований шляхом модифікації пропіконазолу (Sekimata et al., 2002). Мішенню брасиназолу є залізо гему цитохрому Р450 монооксигенази DWF4. Брасиназол широко використовувався для вивчення синтезу та ефектів брасиностероїдів. Крім того, брасиназол був використаний для генетичного скринінгу з метою ізоляції мутантів, які не реагують на цю сполуку. Це дало змогу ідентифікувати фактор транскрипції BZR1. 4-[(5-Бром-2-піридиніл)аміно]-4-оксобутанова кислота є моноамідом бурштинової кислоти та 2-аміно-5-бромпіридину. Бром у положенні 5 піридинового кільця та група карбонової кислоти були визначені як важливі складові її активності. Нещодавно, 4-[(5-бром-2-піридиніл)аміно]-4оксобутанова кислота була ідентифікована хіміко-генетичними методами як інгібітор передачі сигналів брасиностероїдів. 4-[(5-Бром-2-піридиніл)аміно]-4-оксобутанова кислота є нестероїдною сполукою, яка індукує конститутивні брасиностероїдні реакції у рослинах шляхом інгібування більшості GSK-S/Shaggy-подібних кіназ. A. thaliana має 10 ASK (A. thaliana GSK3/Shaggy-подібнi кінази), які можуть бути розділені на 4 групи. Група І кіназ (ASK, ASK та ASK) і група II кіназ (BIN2, ASK та ASK) є найбільш чутливими до 4-[(5-бром-2піридиніл)аміно]-4-оксобутанової кислоти. Кіназа ASK9 групи III інгібується в помірному ступені, у той час як друга кіназа групи III, ASK, не інгібується. ASK, кіназа групи IV, також є нечутливою до 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанової кислоти. Причина цієї специфічності є невідомою. Складний метиловий ефір 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанової кислоти має CAS Registry No. 697231-46-2. Burdulene et al. (Pharm. Chem. J., 30 (1996): 680-682) описують, поміж іншого, реакцію 2-аміно-5-бромпіридину з бурштиновим ангідридом з утворенням бікініну. GB 1162727A розкриває N-заміщені амідокислоти, які промотують ріст рослин. Asami et al. (глава 19 у "Pesticide Chemistry", (2007), WILEY-VCH) описує загальний рівень знань про малі молекули в хімії пестицидів. Ostaszewski et al. (J. Molec. Struct., 474 (1999): 197206) описують дослідження молекулярної конформації моно- та дизаміщених складних амідоефірів піридину. Roma et al. (Bioo. Med. Chem., 8 (2000): 751-768) повідомляють про заміщені піримідин-4-они. WO 2008/049729 А1 розкриває міметики нестероїдних брасиностероїдів. Метою даного винаходу є створення нових інгібіторів передачі сигналів брасиностероїдів, подібних до 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанової кислоти. Краще, in vivo інгібуюча активність нових інгібіторів має бути вищою, ніж інгібуюча активність 4-[(5-бром-2піридиніл)аміно]-4-оксобутанової кислоти. 1 UA 101490 C2 Таким чином, даний винахід передбачає застосування сполуки формули (І) 5 10 15 20 25 30 35 40 у якій X позначає F, СІ, Вr або І; 3 3 4 3 3 4 R позначає СН3, С2Н5, C2H4R , C2H3R R , C3H7, C3H5R або C3H5R R ; 2 3 3 4 R позначає Η, СН3, С2Н5, C2H4R або C2H3R R ; і 3 4 R та R незалежно позначають X, ОН або NH2, для обробки рослин, особливо, для посилення росту рослин, збільшення врожайності та/або забезпечення стійкості до стресів. 1 В сполуках, у яких R позначає залишок пропілу (тобто, у яких сполука є складним 3 3 4 пропіловим ефіром), С3Н7, C3H6R або C3H5R R можуть бути приєднані через атом О до карбонілу через зовнішні атоми С (н-пропіл) або через центральний атом С (і-пропіл). Даний винахід пропонує варіанти складних ефірів 4-[(5-бром-2-піридиніл)аміно]-4оксобутанової кислоти з малими аліфатичними спиртами, необов'язково заміщені галогеном, ОН або NH2. Члени цих складноефірних варіантів 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанової 1 кислоти (R = Н) відповідно до даного винаходу мають поліпшені фізико-хімічні властивості для введення рослинам (обробка та in vivo поглинання рослинами або рослинними клітинами). Можна показати за допомогою даного винаходу, що щонайменше деякі члени цієї групи несподівано виявили наявність поліпшеної in vivo (тобто, при введенні в рослини або рослинні клітини) інгібуючої активності по відношенню до кіназ, які беруть участь в передачі сигналів брасиностероїдів, порівняно з 4-[(5-бром-2-піридиніл)аміно]-4-оксобутановою кислотою. Конкретніше, сполука, що має формулу (II) а саме, метиловий складний ефір 4-[(5-йодпірид-2-ил)аміно]-4-оксобутанової кислоти, показав значно поліпшений in vivo ефект порівняно з 4-[(5-бром-2-піридиніл)аміно]-4оксобутановою кислотою. Також особливо кращими є СІ та Вr-варіанти формули (II). Іншою 1 2 кращою сполукою є етилатна форма формули (І), тобто, сполука, у якій R позначає С2Н5 і R позначає Н. Для цієї етилатної форми, І-, Вr- та СІ-сполуки є кращими. Сполуки відповідно до даного винаходу є міметиками брасиностероїду, що можуть бути використані у технології рослинництва, наприклад, для посилення росту рослин, стійкості до біотичних та/або абіотичних стресів або збільшення врожайності. За допомогою даного винаходу можна збільшити вихід біомаси. Інший аспект даного винаходу стосується композиції для посилення росту рослин та/або збільшення врожайності, яка включає ефективну кількість сполуки формул (І) або (II). "Ефективна кількість" може бути легко встановлена кваліфікованим фахівцем в цій області техніки шляхом застосування результатів лабораторних досліджень для проведення обробки в польових умовах. Сполука відповідно до даного винаходу може бути застосована в ефективній концентрації, що відповідає умовам у відповідному полі. Придатні концентрації можуть знаходитися в інтервалі від низьких до середніх значень величин порядку мкмоль/л, наприклад, від 1 до 500 мкмоль/л, краще, від 5 до 100 мкмоль/л. Сполуки відповідно до даного винаходу можуть бути розчинені в органічних розчинниках, придатних та допустимих в технології рослинництва та сільському господарстві, краще, ДМСО або етанолі, і розведені до бажаної 2 UA 101490 C2 5 10 15 20 25 30 35 40 45 50 концентрації водою або водними розчинами буферів та/або сполук, що промотують ріст рослин, та/або агентів захисту рослин. Відповідно до даного винаходу, композиція відповідно до даного винаходу використовується для обробки рослин. Відповідно до особливо кращого варіанта втілення, сполуки формули (І) або (II) використовуються як гербіциди. Якщо застосування з метою промотування росту рослин звичайно здійснюється в діапазоні концентрацій 1-10 мкМ або навіть нижче, використання як гербіциду краще проводиться при концентраціях 50 мкМ чи більше, наприклад, від 50 до 500 мкМ. Даний винахід також стосується способу одержання сполук формули (II), у якому проводять реакцію 2-аміно-5-йодпіридину з галогенангідридом метилбурштинової кислоти, краще, хлорангідридом метилбурштинової кислоти. Розчиняють 2-аміно-5-йодпіридин у придатному розчиннику, краще, тетрагідрофурані, який такожмістить третинний амін, краще, триетиламін (краще, з молярним надлишком (особливо від 10 до 40 %) порівняно з 2-аміно-5-йодпіридином). Потім додають галогенангідрид метилбурштинової кислоти (краще, в такому саме розчиннику, як і 2-аміно-5-йодпіридин) (краще, з невеликим молярним надлишком (особливо, 2-10 %), так щоб температура не зростала вище 50 °C, краще, не вище 45 °C, особливо, не вище 40 °C. Реакцію можна потім додатково перемішувати протягом 5-60 хв. при температурі від 20 до 40 °C, особливо, при кімнатній температурі (25 °C). Потім додають воду і рН знижують (краще, шляхом додавання хлористоводневої кислоти) до величини рН нижче 6,5, особливо, до приблизно 6. Після цього продукт може бути екстрагований придатним екстракційним розчинником, наприклад, діетиловим ефіром, та промитий (наприклад, розведеною слабкою кислотою, такою як 1 % оцтова кислота). Залишкова вода може бути видалена гігроскопічними речовинами, такими як безводний сульфат натрію, перед випаровуванням ефіру при зниженому тиску. Може бути проведена перекристалізація, наприклад, з 95 % етанолу або толуолу, з одержанням майже білого продукту. Даний винахід також стосується способу одержання сполук формули (III) та їх подальшої естерифікації або алкілування з одержанням сполуки формули (II) (X 2 позначає І і R позначає Н). Цей спосіб відповідно до даного винаходу відрізняється тим, що проводять реакцію 2-аміно-5-йодпіридину з бурштиновим ангідридом з одержанням сполуки, що має формулу (III). Карбоксигрупа цієї сполуки може бути згодом естерифікована або алкілована з одержанням сполуки, що має формулу (II). Більш детально, для одержання сполуки формули (III), 2-аміно-5-йодпіридин розчиняють у придатному розчиннику, краще, тетрагідрофурані. Потім додають бурштиновий ангідрид (краще, у такому саме розчиннику, як і 2-аміно-5-йодпіридин) (краще, з молярним надлишком (особливо, 10-40 % надлишку) порівняно з 2-аміно-5-йодпіридином) і суміш нагрівають зі зворотним холодильником протягом часу, достатнього для протікання реакції в бажаному ступені, краще, протягом від 30 хв. до 5 год., ще краще, протягом 1-4 год., особливо, 2 год. Сировий продукт може бути одержаний шляхом охолодження реакції, наприклад, до 4 °C, протягом декількох годин (наприклад, 1-10 годин). Сировий продукт може бути перекристалізований, наприклад, з 95 % етанолу. Вільна кислота формули (III) може бути потім алкілована з використанням галоїдметилу, диметилсульфату чи діазометану або естерифікована за допомогою СН 3-ОН з одержанням речовини формули (II). В кращому варіанті втілення даного винаходу, проводять реакцію 2-аміно-5-йодпіридину з хлорангідридом метилбурштинової кислоти. Винахід далі проілюстрований наступними прикладами та фігурами креслень. Фіг. 1: Декілька піридиламіно похідних інгібують ASK in vitro. Злиті білки GST-ASK інкубують з МВР як субстратом та -[32Р]-АТР як ко-субстратом без (-) або в присутності різних похідних (номери відповідають Таблиці 1). Сполуки 1-9 (ліва панель) відрізняються аліфатичними бічними ланцюгами. Вплив положення гетероциклічного азоту випробовували за допомогою 3 UA 101490 C2 5 10 15 20 25 30 35 40 45 50 сполук 3 та 11 (середня панель; наведена молекулярна структура зображує сполуку 11). Права панель показує вплив галогенового замісника піридинового кільця. Сполуки використовували в концентрації 10 мкМ. Білки виділяли методом SDS-PAGE та інкорпорований радіоактивний фосфат детектували за допомогою екрана формувача зображення на люмінофорі з тривалим післясвітінням. Фіг. 2: Сполука 15 виявляє найвищу дієвість. GST-BIN2 інкубують з МВР та -[32Ρ]-ΑΤΡ без або в присутності сполук 3, 14 та 15 в концентрації 10 мкМ. Білки виділяли методом SDS-PAGE і ступінь фосфорилювання МВР визначали кількісно за допомогою люмінесцентного екрана формувача зображення. Залишкову активність виражають в % від контролю. Середні значення та стандартні відхилення обчислювали для 4 незалежних вимірів. Фіг. 3: Вплив на фенотип брасиностероїдних мутантів. 7-Денні паростки мутанта cpd, що синтезує брасиностероїд, та мутанта brі1-1 передачі сигналів переносили на 1/2 MS середовище, що містить 1 мкМ епі-брасиноліду (Epi-BL), або сполуки 10 та 15 в концентрації 30 мкМ, та інкубували 7 днів в умовах тривалого дня. Усі фотографії були зроблені з однаковим збільшенням. Риска позначає 1 мм. Фіг. 4: Сполуки 10 та 15 є сильними інгібіторами in vivo. Протопласти A. thaliana котрансформують експресійними конструктами BZR1-CFP та Мус-міченим ASK, і обробляють зростаючими концентраціями сполук 10 та 15. BES1-CFP та ASK-Myc детектують методом вестерн-блот аналізу з використанням поліклональних анти-GFP та моноклональних анти-Мус антитіл, відповідно. Забарвлення кумасі (Coomassie) R250 наведено як контроль навантаження. В залежності від активності ΑSΚ кінази BZR1-CFP можна спостерігати в фосфорильованій або нефосфорильованій формі (показано стрілочками). Співвідношення двох ASK-Myc смуг, яке вказує на посттрансляційну модифікацію цього білка, не залежало від застосування інгібітора. Фіг. 5: Естерифіковані сполуки швидко гідролізуються в рослинах. Паростки A. thaliana інфільтрували 1/2 MS середовищем, що містить 50 мкМ сполуки 10. Контрольні зразки беруть перед інфільтрацією (А) та аналізують методом ВЕРХ. Продукт біотрансформації (помічений Р) сполуки 10 можна спостерігати через 15 хв. (В). Хроматограма суміші сполук 10, 15 та 17 (мічених С10, С15 та С17, відповідно) наведена для порівняння (С). Маленькі врізні поля на хроматограмах зображують УФ-спектри піків в діапазоні 220-360 нм. mAU, мілі-одиниці поглинання, зареєстровані при 250 нм. Фіг. 6: Метилування підвищує тканинну проникність. Паростки A. thaliana інкубують у 50 мкМ розчинах сполук 10 та 15 в 1/2 MS середовищі. Зразки беруть через вказані періоди часу та in situ рівні сполуки 15 аналізують методом ВЕРХ. Суцільна лінія показує результати для рослин, інкубованих зі сполукою 10, і пунктирна лінія показує результати для сполуки 15. Середні значення та стандартні відхилення обчислюють для 3 незалежних вимірів. Приклади: Важливість довжини та стеричної конфігурації аліфатичного бічного ланцюга, а також положення гетероциклічного азоту визначали шляхом синтезу ряду похідних із структурою, подібною до 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанової кислоти, та зміни довжини аліфатичного бічного ланцюга від 2 атомів вуглецю до 6. Крім того, їх стеричну структуру модифікували шляхом введення подвійного зв'язку. Для одержання більш активного інгібітора, були виготовлені похідні з фтором, хлором, бромом та йодом як замісниками у положенні 5 піридинового кільця. Синтезовані сполуки тестували in vitro та in vivo. Крім того, визначали клітинну проникність вибраних сполук. Матеріали та способи Хімікати Хімікати, що використовувалися для синтезу сполук, були придбані у фірм Fluka (Buchs, Switzerland) або Aldrich (Steinheim, Germany). Розчинники для ВЕРХ та ТШХ були придбані у фірми Roth (Karlsruhe, Germany). Синтез Реакційні сполуки та виходи продуктів наведені у Таблиці 1. Таблиця 1: Сполуки, синтезовані та випробувані на біологічну активність 4 UA 101490 C2 5 UA 101490 C2 5 10 15 20 25 30 35 40 Метод А: Розчин 25 мМ ангідриду дикарбонової кислоти, розчиненого в 15 мл тетрагідрофурану (10 мл для фталевого ангідриду), поміщають в круглодонну колбу, обладнану зворотним холодильником, і додають 20 мМ аміну, розчиненого в 10 мл тетрагідрофурану. Суміш нагрівають зі зворотним холодильником протягом 2 год. Продукт починає кристалізуватися наприкінці реакції. Кристалізацію завершують охолодженням до 4 °C протягом декількох годин. Сировий продукт фільтрують з відсмоктуванням та перекристалізовують з 95 % етанолу, за винятком похідного фталевої кислоти, яке перекристалізовують з 80 % ацетонітрилу. Метод В: Розчин 20 мМ 2-аміно-5-нітропіридину в 30 мл тетрагідрофурану поміщають в круглодонну колбу та додають 25 мМ твердого бурштинового ангідриду. Зворотний холодильник приєднують до колби і суміш нагрівають до слабкого кипіння протягом 2 год. Після цього, реакційну суміш охолоджують до -20 °C протягом декількох днів. Сировий продукт фільтрують з відсмоктуванням та перекристалізовують з гарячої води. Метод С: Двадцять мМ аміну розчиняють в суміші 40 мл тетрагідрофурану та 3,5 мл (25 мМ) триетиламіну і поміщають до тригорлої круглодонної колби, обладнаної зворотним холодильником, краплинною лійкою та термометром. Реакційну суміш перемішують магнітною мішалкою. Розчин 21 мМ хлорангідриду кислоти, розчиненого в 10 мл тетрагідрофурану, додають повільно через краплинну лійку з такою швидкістю, щоб температура не піднімалася вище 40 °C. Після завершення додавання хлорангідриду, реакцію перемішують протягом ще 15 хв. при кімнатній температурі. Після цього, суміш додають до 200 мл холодної води і встановлюють рН 6 розведеною хлористоводневою кислотою. Продукт екстрагують тричі кожного разу 50 мл діетилового ефіру і об'єднані ефірні екстракти промивають 50 мл 1 % оцтової кислоти. Залишкову воду видаляють безводним сульфатом натрію перед випаровуванням ефіру при зниженому тиску. Жовтуватий залишок перекристалізовують з 95 % етанолу (хлоровані похідні) або толуолу (йодоване похідне), одержуючи майже білий продукт. Метод D: Двадцять один мМ хлорангідриду кислоти розчиняють в 10 мл тетрагідрофурану та додають до суміші 20 мМ 2-аміно-5-хлорпіридину, 3,5 мл (25 мМ) триетиламіну та 40 мл тетрагідрофурану, як описано у способі С. Суміш перемішують протягом 15 хв., а потім фільтрують для видалення триетиламіну гідрохлориду. Тверду речовину промивають 10 мл тетрагідрофурану і об'єднані фільтрати випаровують при зниженому тиску. У випадку оксалільного похідного, залишок розчиняють в 90 мл гарячого 95 % етанолу і розчин фільтрують у гарячому стані. Суміш перемішують і додають 40 мМ КОН, розчиненого в 10 мл води, з такою швидкістю, щоб температура не піднімалася вище 40 °C. Реакцію завершують, перемішуючи її протягом ще 10 хв. Продукт виділяють як калієву сіль білого кольору, яку збирають відсмоктуванням. Осад розчиняють в 100 мл (йодоване похідне: 250 мл) гарячої води та фільтрують. До гарячого фільтрату додають хлористоводневу кислоту до рН 2. Продукт відокремлюють як вільну кислоту шляхом інкубування при 4 °C протягом ночі. Продукт додатково очищають перекристалізацією з 95 % етанолу. 6 UA 101490 C2 5 10 15 20 25 30 35 40 45 50 55 У випадку малонільних та адипоїльних похідних, залишок розчиняють в 200 мл МеОН та фільтрують. Розчин поміщають до тригорлої круглодонної колби, обладнаної зворотним холодильником, краплинною лійкою та термометром і нагрівають до 50 °C. При перемішуванні суміші швидко додають через краплинну лійку 40 мМ КОН, розчиненого в 40 мл води, і температуру підтримують близько 50 °C. Реакцію завершують, перемішуючи її при цій самій температурі протягом ще 10 хв. Надлишок КОН нейтралізують додаванням 40 мМ NH4CI, розчиненого в 10 мл води. Більшу частину розчинника видаляють при зниженому тиску і залишок розчиняють у воді (приблизно 200 мл) та фільтрують. Додають до прозорого фільтрату мурашину кислоту до рН 3. Продукт виділяють у вигляді білих кристалів шляхом інкубування при 4 °C протягом ночі. Малонільні та адипоїльні похідні очищають перекристалізацією з 95 % або 50 % етанолу, відповідно. Аналіз чистоти синтезованих сполук Тонкошарова хроматографія (ТШХ): Сполуки розчиняють в етанолі та наносять пляму на листи з попередньо нанесеним покриттям силікагелю 60 F254 (Merck, Darmstadt, Germany). Пластини проявляють у суміші етилацетату/петролейного ефіру/оцтової кислоти/води = 100/60/1/1. Гасіння флуоресценції спостерігають при опромінюванні пластини короткохвильовим УФ (254 нм). Деякі сполуки виявляли автофлуоресценцію, яку спостерігали при середньохвильовому УФ (302 нм). Високоефективна рідинна хроматографія (ВЕРХ): Система ВЕРХ складалася з помпи Dionex P680, автоматичного пробовідбирача ASI-100 та детектора з фотодіодною матрицею PDA-100. Система була обладнана колонкою Macherey-Nagel 250 мм x 4 мм Nucleosil 100-5 С18 з попереднім прохідним фільтром Valco 2 мкм. Підтримували постійну об'ємну витрату, рівну 1 мл/хв., з градієнтом розчинника А (20 мМ оцтова кислота, доведена до рН 4,8 за допомогою NaOH, в 15 % ацетонітрилі) та розчинника В (20 мМ оцтова кислота, доведена до рН 4,8 за допомогою NaOH, в 60 % ацетонітрилі). Елюювання починали з ізократичного потоку розчинника А протягом 1 хв. Концентрація розчинника В потім лінійно зростала до 100 % протягом 19 хв. та підтримувалася ізократичною протягом ще 2 хв. перед її зниженням до 0 % протягом 1 хв. Колонку врівноважували протягом 5 хв. розчинником А перед введенням наступного зразка. УФ-спектри реєстрували від 220 до 400 нм з інтервалами 1 нм. Для кількісного визначення використовували поглинання при 250 нм з шириною смуги пропускання 10 нм. Визначення величин рKа Від п'ятдесяти до 100 мг сполуки зважують та розчиняють в 50 мл 50 % (об./об.) метанолу. Криву титрування 50 мМ NaOH як стандартним розчином реєструють за допомогою рН-метра Greisinger Electonics GPHR 1400A. Точку еквівалентності визначають методом різницевого відношення (pH/VNaoH) і рKа зчитують з кривої титрування при ступені нейтралізації 50 %. In vitro та in vivo аналізи кінази ASK експресують як GST-злиті білки в Е. coli BL21. In vitro аналізи кінази проводять шляхом інкубування 50 нг GST-злитого білка, 10 мкг мієлінового основного білка (МВР; Sigma, St Louis, МО) як субстрата та 0,15 МБк -[32Р]-АТР як ко-субстрата при 25 °C протягом 30 хв. Реакційний буфер складався з 20 мМ HEPES рН 7,4, 15 мМ MgCI2, 5 мМ EGTA та 1 мМ DTT. Для початових експериментів включали нерадіоактивний ATP в концентрації до 3 мкМ. Продукти реакції відокремлюють методом SDS-PAGE та кількість радіоактивності, інкорпорованої в МВР, кількісно визначають з використанням екрана формувача зображення Amersham на люмінофорі з тривалим післясвітінням та формувача зображення Biorad Molecular Imager FX. In vivo активність кінази детектують методом затримки в гелі при фосфорилюванні з використанням BZR1-CFP як субстрату. Фізіологічні тести Паростки Arabidopsis thaliana Col0 або brі1-1 вирощували in vitro на 1/2 MS планшетах, що -2 -1 містять 1 % сахарози, в камері росту в умовах тривалого дня (16 год. світла з 50 мкЕм с , 8 год. темряви) протягом 7 днів. Після цього, їх переносили на планшети з добавкою інгібіторів в різних концентраціях та через 7 днів спостерігали вплив на фенотип. Аналіз рослинних екстрактів методом ВЕРХ Паростки A. thaliana Col0 у віці двох тижнів інфільтрують під вакуумом 1/2 MS або 1/2 MS, що містить 100 мкМ сполуки 10, як описано раніше (Rozhon et al., 2005). Через 15 хв. та через 48 год. відбирають зразки, промивають водою та розмелюють у рідкому азоті до дисперсного порошку. Зважують 100 мг порошку в хімічну пробірку і додають 1 мл буфера для екстракції (20 мМ TRIS/HCI, рН 6,8, розчиненого в 20 % ацетонітрилі). Після інкубування протягом 30 хв. на струшувачі, встановленому на 800 об./хв., суміш центрифугують і супернатант фільтрують 7 UA 101490 C2 5 10 15 20 25 30 35 40 45 50 55 через фільтр 0,2 мкм. Екстракти аналізують методом ВЕРХ за таких саме умов, як описано вище. Аналіз клітинної проникності Паростки A. thaliana Col0 у віці двох тижнів переносили на 1/2 MS середовище, що містить 50 мкМ інгібітора. Зразки відбирають у вказані моменти часу, промивають водою, висушують фільтрувальним папером та заморожують в рідкому азоті. Для аналізу рослинний матеріал розмелюють до тонкодисперсного порошку у ступці, попередньо охолодженій рідким азотом. Зважують приблизно 100 мг порошку в хімічні пробірки на 1,5 мл та додають 1 мл 20 мМ TRIS/HCI, рН 9,0. Додають 50 мкл 200 мкМ маточного розчину сполуки 4 як внутрішній стандарт. Екстракцію проводять при 80 °C протягом 30 хв. в змішувачі Eppendorf Thermo Mixer, встановленому на 800 об./хв. Екстракт центрифугують протягом 5 хв. при 15000хg і прозорий супернатант збирають. Прозорий розчин підкислюють шляхом додавання 25 мкл 4М фосфорної кислоти та центрифугують протягом 2 хв. при 15000хg. Супернатант негайно завантажують в картридж для твердофазової екстракції РН 100 мг (Varian, Lake Forest, СА), кондиціонований 1 мл ацетонітрилу та два рази по 1 мл 100 мМ фосфорною кислотою. Колонки промивають 1 мл 100 мМ фосфорною кислотою та висушують під вакуумом протягом 1 хв. Після цього проводять елюювання 1 мл 100 мМ TRIS/HCI, рН 9,0, що містить 5 % ацетонітрилу. Елюат підкислюють шляхом додавання 15 мкл 4М фосфорної кислоти та використовують для ВЕРХ, як описано вище. Результати Синтез 4-[(5-Бром-2-піридиніл)аміно]-4-оксобутанову кислоту та інші похідні одержують шляхом утворення амідів із заміщених амінопіридинів та циклічних ангідридів карбонових кислот або хлоридів монометилових складних ефірів дикарбонових кислот (Таблиця 1). В останньому випадку, метильну групу згодом видаляють лужним гідролізом, якщо це треба. Чистоту перевіряють методами ТШХ та ВЕРХ. Лише одна пляма спостерігається на проявлених ТШХ пластинах і пік бажаної сполуки відповідає щонайменше 95 % від загальної площі усіх піків на хроматограмі ВЕРХ. Інгібування ASK in vitro 4-[(5-Бром-2-піридиніл)аміно]-4-оксобутанова кислота є сильним інгібітором ASK групи І та групи II. ASK, який належить до групи III ASK, інгібується в помірному ступені. Друга кіназа цього класу, ASK, та кіназа групи IV ASK не інгібуються. Представників усіх груп експресують як рекомбінантні GST-злиті білки в Е. соlі. Активність синтезованих сполук по відношенню до вибраних ASK визначають за допомогою in vitro аналізів кінази з використанням МВР (мієліновий основний білок) як субстрату та -[32Ρ]-ΑΤΡ як ко-субстрату (Фіг. 1). Сполуки 1-5 були синтезовані для дослідження впливу зміни довжини аліфатичного бічного ланцюга. Найбільш активна сполука, № 3, мала ланцюг, що складається з 4 атомів вуглецю (Фіг. 1). Глутарильне (№ 4; 5 атомів вуглецю) та адипоїльне (№ 5; 4 атоми вуглецю) похідні мали значно нижчу активність, у той час як більш короткі похідні (№ 1 та 2; 2 або 3 атоми вуглецю, відповідно) майже не виявляли активності. Введення подвійного зв'язку в бічний ланцюг з оптимальною довжиною повністю знищувало активність (Фіг. 1, сполука 6). Це вказує на те, що стерична конфігурація є надзвичайно важливою. Для перевірки, чи є карбоксигрупа аліфатичного ланцюга критично важливою для активності, або чи є достатньою оксогрупа, були включені сполуки 9 та 10, які є метильованими варіантами сполук 3 та 15, відповідно. Крім того, протестували сполуку 8, яка є структурним ізомером сполуки 3. Як показано на Фігурі 1, метильовані варіанти виявляють різко знижену інгібуючу дію, підтверджуючи цим, що термінальна карбоксигрупа є суттєвою. Після ідентифікації оптимального бічного ланцюга було більш детально досліджене гетероциклічне кільце. Сполуки 3 та 11 обидві мають амідосукцинільні бічні ланцюгі, але відрізняються положенням гетероциклічного азоту. In vitro аналізи кінази показали, що сполука 3 є більш сильнодіючою (Фіг. 1), демонструючи, що гетероциклічний азот має бути розташований поряд з положенням, яке несе замісник амідобурштинової кислоти. Раніше одержані дані показують, що бром-замісник у положенні 5 піридинового кільця є критичним для біологічної активності 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанової кислоти. Для перевірки ефекту інших замісників були синтезовані сполуки 12-16. Як показано на Фігурі 1, хлороване, бромоване та, особливо, йодоване похідні були високоактивними. Цей порядок зміни активності може бути підтверджений кількісним визначенням залишкової кіназної активності BIN2 (Фіг. 2). На відміну від цього, фторована сполука виявляє дуже низьку дієвість, а незаміщене та нітропохідне були неактивними. 8 UA 101490 C2 5 10 15 20 25 30 35 40 45 50 55 60 Усі досліджені сполуки мали подібну специфічність по відношенню до ASK. Активні похідні сильно інгібували ASK, BIN2 та ΑβΚ, у той час як ASK інгібувався лише в помірному ступені. Вплив досліджених речовин на ΑβΚ та ASK був незначним. Інгібування ASK in vivo Знижувальна регуляція активності ASK є критичною для передачі сигналів брасиностероїдів. ASK є конститутивно активними у cpd та brі1-1 мутантах з дефектами біосинтезу брасиностероїду або передачі сигналів, відповідно. Це приводить до одержання в тяжкому ступені карликових рослин з темно-зеленим закрученим донизу листям та скороченими гіпокотилями. Застосування епі-брасиноліду, синтетичного брасиностероїду, рятує cpd, але не brі1-1, у той час як 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанова кислота рятує обидва мутанти. Для скринінгу in vivo дієвості, cpd та bri1-1 мутанти переносили на середовище, що містить похідні 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанової кислоти в концентрації 30 мкМ. Паростки, оброблені активними сполуками, мали розправлене листя, збільшену довжину гіпокотилю, та були світло-зеленими. Здатність рятувати фенотип корелює з результатами in vitro аналізу. Цікаво, однак, що сполука 10 була високоактивною in vivo, але виявляла низьку дієвість in vitro (Фіг. 3). Через цей неочікуваний результат, вплив інгібування на in vivo активність ASK аналізували за допомогою прямого способу. Було показано, що декілька ASK фосфорилюють фактори транскрипції BZR1, BES1 та ВЕН2 in vivo. Це приводить до зсуву електрофоретичної рухомості цих факторів транскрипції, що дозволяє детектувати in vivo активність кінази. Протопласти A. thaliana ко-трансформували конструктами CFP-міченого BZR1 та Мус-міченого ΑSΚ. Ці два білки були вибрані тому, що що вони гарно експресуються в системі протопластів. Трансформовані протопласти інкубують з різними концентраціями сполук 10 та 15 і BZR1-CFP та ASK-Myc, і потім аналізують методом вестерн-блотингу. Відповідно до фенотипичних тестів, естерифікована сполука 10 була високоактивною, як і її аналог вільної кислоти 15 (Фіг. 4). Подібні результати були також одержані для пари 3 та 9. Для дослідження цих суперечливих результатів, провели вивчення метаболічного шляху сполуки 10 in vivo. Паростки інфільтрували сполукою 10 і рослинні екстракти згодом аналізували методом ВЕРХ. Можна було спостерігати лише слідові кількості сполуки 10, але з'являвся новий пік, позначений Ρ (Фіг. 5Ата 5В). Цей пік може бути ідентифікований по його часу утримання, рівному 10,7 хв., та його УФ спектру з максимумами поглинання при 252 та 292 нм, як сполука 15 (Фіг. 5В та 5С). Сполука 10, таким чином, є нестабільною in vivo, але швидко перетворюється на високоактивну форму 10, що пояснює різну дієвість сполуки 10 in vitro та in vivo. Аналогічні результати були одержані для пари 3 та 9. Тканинна проникність Клітинна проникність речовини є важливою характеристикою, яка впливає на її in vivo дієвість. Поглинання сполук 10 та 15 рослинами визначали шляхом обробки паростків розчинами цих сполук та наступним кількісним вимірюванням концентрацій інтерналізованого інгібітора (Фіг. 6). Оскільки сполука 10 швидко перетворюється на 15, вимірювали лише in situ концентрацію 15. Концентрації in situ обох сполук зростають у перші 3 год. і потім досягають плато. Важливо відзначити, що внутрішні концентрації у рослині перевищували значення для середовища. У той час, коли 50 мкМ було присутньо у середовищі, in situ концентрації приблизно в 90 мкМ можуть бути виміряні у випадку сполуки 15 і до 190 мкМ у випадку застосування сполуки 10. Метильована сполука, таким чином, виявляє вищу тканинну проникність та досягає вищої концентрації у рослинах. Останніми роками був зроблений величезний прогрес у розумінні передачі сигналів брасиностероїдів в Arabidopsis thaliana завдяки аналізу мутантів. Зараз відомо три рецептора брасиностероїду та один ко-рецептор. Щонайменше чотири ASK, по-видимому, беруть участь в фосфорилюванні шести BES1/BZR1-подібних факторів транскрипції, і чотири фосфатази є компетентними для їх перетворення назад на нефосфорильовану форму. Ці білки є усі потенційними мішенями для інгібіторів. Значною перевагою інгібіторів порівняно з мутантами є їх безпосередня застосовність у різних генетичних середовищах та до різних видів. Крім того, одиночні мутанти часто не виявляють або виявляють слабкі фенотипи внаслідок функціональної надмірності. Оскільки гомологічні білки часто є мішенями для одних і тих самих сполук, функціональну надмірність можна подолати шляхом проведення досліджень інгібітора. Існує ряд інгібіторів для GSK-3 та GSK-3, людських гомологів ASK. Однак, спроби використання цих сполук для рослинних GSK-3/Shaggy-подібних кіназ не були успішними. При проведенні хімічного генетичного скринінгу, 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанова кислота була нещодавно ідентифікована як перша речовина, яка специфічно втручається в передачу сигналів брасиностероїдів. Генетичні та біохімічні підходи показали, що 4-[(5-бром-2 9 UA 101490 C2 5 10 15 20 25 30 35 40 45 50 55 60 піридиніл)аміно]-4-оксобутанова кислота діє у передачі сигналів брасиностероїдів шляхом інгібування ASK. GSK3/Shaggy-подібнi кінази є ключовими регуляторами передачі сигналів гормону та модулюють стійкість до стресу, і краще розуміння дії 4-[(5-бром-2-піридиніл)аміно]-4оксобутанової кислоти є дуже бажаним. Для вирішення цього питання та ідентифікації інгібіторів з підвищеною дієвістю було синтезовано ряд сполук з подібними до 4-[(5-бром-2-піридиніл)аміно]-4-оксобутанової кислоти структурами, і їх інгібуючу дію на GSK-3/Shaggy-подібні кінази дослідили in vitro та in vivo. Крім того, було вивчено фенотипичну реакцію рослин на ці сполуки. По-перше, був проаналізований ефект довжини аліфатичного бічного ланцюга, що містить карбонову групу. Оскільки попередні результати показали, що хлороване похідне може бути дещо сильнішим, ніж бромоване похідне, 2-аміно-5-хлорпіридин був використаний для синтезу ряду сполук, які відрізняються тільки довжиною аліфатичного бічного ланцюга. In vitro аналізи кінази показали, що інгібуюча дія цих сполуки була найвищою при бічному ланцюзі з 4 атомами вуглецю. Крім того, критичне значення мала стерична конфігурація. Введення цис-подвійного зв'язку в бічний ланцюг, який складається з 4 атомів вуглецю, що є оптимальним числом, приводило до одержання неактивної сполуки (№ 6). Цис-подвійний зв'язок спричинює згинання аліфатичного ланцюга, яке приводить до зміни положення термінальної карбоксигрупи. Це та результати для сполук з різною довжиною бічного ланцюга свідчать про те, що карбоксигрупа повинна мати точну геометричну конфігурацію по відношенню до гетероциклічного кільця для взаємодії з ASK. Свідчення значущості термінальної карбоксигрупи були одержані уперше для похідного з ненасиченим бічним ланцюгом. Однак, це не виключає того, що естерифікованої карбоксигрупи, яка ще може брати участь у водневих взаємодіях, може бути достатньо. Тому були включені сполуки 8, 9 та 10, які є метильованими варіантами сполук 2, 3 та 15, відповідно. Усі три речовини не виявляли або виявляли незначну активність in vitro по відношенню до досліджуваних ASK, що підтверджує необхідність присутності термінальної карбоксигрупи в аліфатичному ланцюгу. Сполуки 9 та 10 були активними in vivo, тому що метильна група швидко відщеплювалася, імовірно, естеразами, з відновленням при цьому карбоксигрупи. Оскільки карбоксигрупа аліфатичного ланцюга є зарядженою при внутрішньоклітинному рН, вона може брати участь в іонніх взаємодіях з ASK, наприклад, з лізиновим або аргініновим залишком. Альтернативно, вона може брати участь у водневому зв'язку. Аналогічно, азот піридинового кільця може також брати участь у водородному зв'язку або в іонній взаємодії з білком. Було показано, що заміщення піридинового кільця на бензольне кільце різко знижує інгібуючу активність. Для того, щоб більш детально вивчити значущість гетероциклічного кільця, була синтезована сполука 11, яка відрізняється від високоактивної сполуки 3 тільки положенням гетероциклічного азоту. Тести in vitro показали, що 11 є неактивною, вказуючи на те, що гетероциклічний азот для одержання сильного інгібітора має бути розташований поряд з амідосукцинільним бічним ланцюгом. Цікаво, що результати даного винаходу свідчать про те, що активність сполук зростає з атомним номером галогенового замісника в положенні 5 піридинового кільця, хоча попередні дані дають змогу припустити протилежний ефект. Йодоване похідне (№ 15) мало найвищу активність, у той час як фтороване похідне (№ 13) було більш слабким. Внаслідок своєї гідрофобності, ця структурна частина інгібітора може брати участь в вандерваальсових взаємодіях з кіназою. Для вандерваальсового притягання, відстань між взаємодіючими атомами має критичне значення. Воно швидко зменшується зі збільшенням відстані і є ефективним, тільки коли атоми розташовані досить близько один до одного. Вандерваальсов радіус, який описує оптимальну для взаємодії відстань, збільшується з періодом в групі періодичної таблиці елементів. Наприклад, вандерваальсови радіуси становлять 0,22 нм для йоду та 0,14 нм для атомів фтору. Крім цього, довжина ковалентного зв'язку між вуглецем піридинового кільця та йодом також є більшою, ніж для інших галогенів. Структура йодованого похідного тому може мати ідеальні властивості для зв'язування з гідрофобним карманом ASK. Крім того, гідрофобність сполук зростає є атомним номером галогенового замісника, про що свідчить зростання часу утримання при оберненофазовій ВЕРХ (Таблиця 1), що може додатково сприяти гідрофобним взаємодіям. Аналізи тканинної проникності показали, що поглинання сполук, особливо естерифікованих, було швидким. Цікаво, що in situ концентрації у декілька разів перевищували концентрації в навколишньому середовищі. Це можна пояснити значеннями рKа сполук (Таблиця 1). Наприклад, похідне 15 має величину рKа 5,8, тобто, при величині рН використовуваного середовища 5,8, 50 % сполуки є дисоційованими і тому негативно зарядженими, а 50 % недисоційованими. При внутрішньоклітинному рН 7,4 менш ніж 3 % сполуки є недисоційованими. Оскільки тільки недисоційована, ліпофільна форма може ефективно проходити через біомембрани, сполуки захоплюються клітиною та накопичуються в 10 UA 101490 C2 5 10 15 20 концентраціях, що перевищують концентрацію в навколишньому середовищі. Таке рН-залежне поглинання нагадує рослинний гормон ауксин, транспорт якого в клітини забезпечується дифузією, спричиненою різницею у рН. Естерифіковані сполуки, наприклад, № 10, є незалежними від рН, високоліпофільними і можуть проходити через мембрани. У клітині вони швидко гідролізуються до відповідних кислот, які депротонуються до гідрофільного аніона. Цікаво відзначити, що швидкість поглинання сполуки 10 приблизно удвічі перевищувала показники для сполуки 15, що корелює з часткою, здатною дифундувати через мембрану. У той час, як 100 % сполуки 10 є ліпофільними, лише 50 % сполуки 15 є недисоційованими і, внаслідок цього, достатньо ліпофільними. Це може пояснити різні швидкості поглинання. Загалом, сполука 15, яка також називається йод-4-[(5-бром-2-піридиніл)аміно]-4-оксобутановою кислотою, була найбільш сильнодіючою сполукою in vitro та виявляла високу інгібуючу активність in vivo. її метильований варіант, метилйод-4-[(5-бром-2-піридиніл)аміно]-4оксобутанова кислота (сполука 10), демонструвала дуже швидке поглинання і тому є кращим інгібітором ASK для in vivo досліджень. Відомо, що декілька GSK3/Shaggy-подібних кіназ швидко активуються у відповідь на стрес. Завдяки своїй чудовій та швидкій клітинній проникності, метилйод-4-[(5-бром-2-піридиніл)аміно]-4-оксобутанова кислота та споріднені сполуки будуть корисними при дослідженнях ролі цього сімейства кіназ в ранній передачі сигналів стресу. Посилання: Kim et al., Bioorg. Med. Chem. 6 (1998), 1975-1982. Min et al., Bioorg. Med. Chem. Lett. 9 (1999), 425-430. Rozhon et al., Anal. Bioanal. Chem. 382 (2005), 1620-1627. Sekimata et al., J. Agric. Food Chem. 50 (2002), 3486-3490. Sekimata et al., Planta 213 (2001), 716-721. Vert et al., Nature 441 (2006), 96-100. ФОРМУЛА ВИНАХОДУ 25 1. Сполука, що має формулу (І) O R 2 O O R 1 N X 30 35 N , (I) де X позначає F, Сl, Вr або І; 1 3 3 4 3 3 4 R позначає CH3, C2H5, C2H4R , C2H3R R , C3H7, C3H7R або C3H5R R ; 2 3 3 4 R позначає Н, СН3, С2Н5, C2H4R або C2H3R R ; і 3 4 R та R незалежно позначають X, ОН або NH2, призначена для обробки рослин, особливо, для посилення росту рослин, збільшення врожайності та/або забезпечення стійкості до стресів. 1 2 2. Сполука за п. 1, яка відрізняється тим, що R позначає СН3, R позначає Н і X позначає І. 3. Сполука, що має формулу (II) O O O N I 40 N . (II) 4. Спосіб одержання сполуки за п. 3, який відрізняється тим, що здійснюють реакцію 2-аміно-5йодпіридину з хлорангідридом метилбурштинової кислоти. 5. Композиція для посилення росту рослин та/або врожайності, та/або стійкості до стресу, яка включає ефективну кількість сполуки за п. 1. 6. Композиція для посилення росту рослин та/або врожайності, та/або стійкості до стресу, яка включає ефективну кількість сполуки за п. 3. 11 UA 101490 C2 7. Спосіб одержання сполуки формули (III) O R 2 O OH N X 5 10 N , (III) 2 де Xпозначає І та R позначає Н, який відрізняється тим, що здійснюють реакцію 2-аміно-5-І-піридину з бурштиновим ангідридом. 8. Спосіб одержання сполуки формули (II), в якому сполуку, що має формулу (III), де X позначає 2 І та R позначає Н, алкілують галоїдметилом, диметилсульфатом чи діазометаном або естерифікують СН3ОН. 9. Сполука, що має формулу (І), визначену в п. 1, призначена для застосування як гербіцид. 10. Сполука за п. 3, що має формулу (II), яка відрізняється тим, що призначена для застосування як гербіцид. 12 UA 101490 C2 13 UA 101490 C2 14 UA 101490 C2 Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;inhibitors for brassinosteroid signalling
Автори англійськоюJonak, Claudia, Rozhon, Wilfried
Назва патенту російськоюИнгибиторы передачи сигналов брасиностероидов
Автори російськоюЙонак Клаудия, Розхон Уилфред
МПК / Мітки
МПК: A01N 43/40, A01P 21/00, C07D 213/75
Мітки: брасиностероїдів, інгібітори, передачі, сигналів
Код посилання
<a href="https://ua.patents.su/17-101490-ingibitori-peredachi-signaliv-brasinosterodiv.html" target="_blank" rel="follow" title="База патентів України">Інгібітори передачі сигналів брасиностероїдів</a>
Наступний патент: Пачка для виробів тютюнової промисловості
Випадковий патент: Спосіб ізомеризації семикарбазонових сполук












