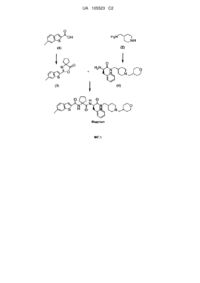
Спосіб отримання ібодутанту (men15596) і потрібних для цього інтермедіатів
Номер патенту: 105523
Опубліковано: 26.05.2014
Автори: Бонаккорсі Фабріціо, Феді Валентіна, Джіаннотті Даніло
Формула / Реферат
1. Спосіб отримання сполуки ібодутанту
 ,
,
в якому здійснюють:
а) отримання інтермедіату (12)
 (12)
(12)
такими операціями:
а') захист первинного аміну 4-амінометилпіперидину (2)
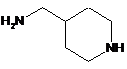 (2)
(2)
етилтрифлуорацетатом, потім відновлювальне амінування захищеного 4-амінометилпіперидину 4-формілтетрагідропіраном і бораном і зняття захисту в основному середовищі з отриманням інтермедіату діаміну (11)
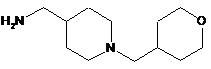 , (11)
, (11)
b') реакцію діаміну (11) з Boc-D-Phe з отриманням інтермедіату (12) або, в іншому варіанті,
такими операціями:
а") реакцію між 4-амінометилпіперидином (2)
 (2)
(2)
і Boc-D-Phe(OSu) з отриманням інтермедіату (17)
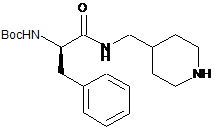 , (17)
, (17)
b") відновлювальне амінування (17) 4-формілтетрагідропіраном і бораном з отриманням інтермедіату (12),
b) зняття захисту з інтермедіату (12) з отриманням сполуки(4)
 , (4)
, (4)
c) реакцію між сполукою(4) і сполукою (3)
 (3)
(3)
з отриманням кінцевого продукту.
2. Спосіб за п. 1, який відрізняється тим, що реакцію між сполуками (3) і (4) в операції с) проводять у AcOEt як розчиннику протягом від 10 до 30 год.
3. Спосіб за п. 1, який відрізняється тим, що у відновлювальних амінуваннях операцій а') і b") використовують боран Na(AcO)3BH.
4. Спосіб за п. 1, який відрізняється тим, що додатково здійснюють кристалізацію ібодутанту в етанолі.
5. Спосіб за п. 1, який відрізняється тим, що додатково здійснюють такі операції з отриманням сполуки (3):
a) активацію 6-метил-2-бензо[b]тіофенкарбонової кислоти формули (1)
 (1)
(1)
до відповідного ацилхлориду,
b) реакцію між сполукою (1) і 1-амін-альфа,альфа-циклопентан-карбонової кислоти з отриманням інтермедіату (16)
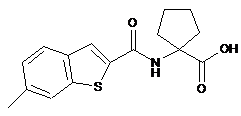 , (16)
, (16)
c) циклізацію сполуки (16) до відповідного оксазолону формули (3).
6. Спосіб за п. 5, який відрізняється тим, що додатково здійснюють отримання 6-метил-2-бензо[b]тіофенкарбонової кислоти (1) засобами каталітичного гідродегалогенування на Pd/C 3-хлор-6-метил-2-бензо[b]-тіофенкарбонової кислоти (18)
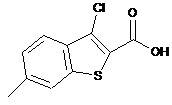 (18).
(18).
7. Спосіб за будь-яким з пп. 1 і 5, який відрізняється тим, що оксазолон формули (3) отримують із сполуки (16) і негайно вводять у реакцію без ізоляції і очищення з інтермедіатом (4), отримуючи кінцевий продукт ібодутант.
Текст
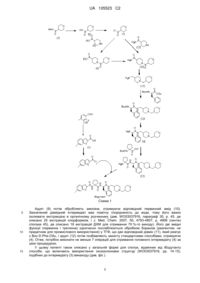
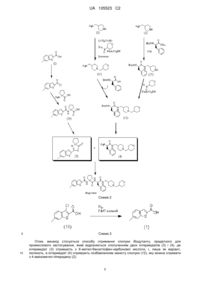
Реферат: Винахід стосується нового способу синтезу ібодутанту (див. фіг.), який складається з невеликої кількості операцій з високим виходом з використанням реагентів і розчинників з низьким впливом на довкілля, який відрізняється сполученням двох компонентів - сполук (3) і (4), одну з яких (3) синтезують сполученням 6-метил-2-бензо[b]тіофенкарбонової кислоти (1) з 1-амінальфа, альфа-циклопентанкарбоновою кислотою і подальшою циклізацією оксазолоном, а другу (4) отримують придатною високоселективною функціоналізацією 4-амінометилпіперидину (2). UA 105523 C2 (12) UA 105523 C2 UA 105523 C2 5 10 15 20 25 30 Винахід стосується нового способу синтезу ібодутанту (MEN15596), продукту, якому властива антагоністична активність до рецептора тахикініну NK2. Зазначений спосіб базується на високоефективному синтезі двох попередників (3) і (4), який проводиться способами і з реагентами придатними для виготовлення у промисловому масштабі. Зокрема, спосіб включає використання 4-амінoметилпіперидину, функціоналізованого для високої селективності (ацилюванням) до лише первинного аміну або лише вторинного аміну тимчасовим ацилюванням, з подальшим алкілуванням в умовах відновлювального амінування. Такий спосіб дозволяє здійснювати відновлення певною кількістю операцій і отримувати інтермедіати найвищої якості порівняно з існуючими. Крім того, запропоновані процедури дають головні інтермедіати з значно вищим виходом і, отже, забезпечують спосіб синтезу, значно економічніший у цілому, порівняно з існуючими способами. Винахід також включає альтернативний спосіб синтезу (1) гідродегалогенуванням відповідної 3-хлор-похідної в умовах гідрогенування, каталізованого Pd-каталізатором. [1-(2-феніл-1(R)-{[1-(тетрагідро-піран-4-ілметил)-піперидин-4-ілметил]-карбамоїл}етилкарбамоїл)-циклопентил]-амід 6-метил-бензо[b]тіофен-2-карбонової кислоти, відомий як "ібодутант" (MEN 15596), є сполукою з потужною антагоністичною активністю проти рецептора тахикініну NK2 і тому може бути використаний у приготуванні фармацевтичних композицій для лікування розладів, пов'язаних з тахикінінами, зокрема, нейрокініном A. Зазначена сполука і деякі її інтермедіати описано у патенті WO03037916. Зокрема, приклад 139 ілюструє синтез продукту згідно з описом, наведеним у прикладі 117 зазначеного патенту (Схема 1). Зазначений документ описує отримання кінцевого продукту способами, відомими фахівцям, спочатку приєднанням Boc-циклолейцину до інтермедіату (4), потім зняттям захисту Boc звичайними способами і нарешті ацилюванням інтермедіату (15) з отриманням ацил хлоридного інтермедіату (1). У зазначеному патенті інтермедіат 2-(R)-амінo-3-феніл-N-[1-(тетрагідро-піран4-ілметил)-іперидин-4-ілметил]-пропіонамід (4) отримують за наведеною далі процедурою. Метил-естер 4-тетрагідропіранкарбонової кислоти (5) гідролізують до (6) в основних умовах, потім перетворюють у відповідний ацил хлорид (7) і вводять у реакцію з 4-карб-етоксипіперидином (8). 1 UA 105523 C2 Схема 1 5 10 15 Адукт (9) потім обробляють амонієм, отримуючи відповідний первинний амід (10). Зазначений діамідний інтермедіат має помітну спорідненість до води, тому його важко ізолювати екстракцією в органічному розчиннику (див. WO03037916, параграф 30, p. 45, де описано 25 екстракцій хлорформом, і J. Med. Chem. 2007, 50, 4793-4807, p. 4806 (синтез сполуки 45), де описано 18 екстракцій ДХМ для отримання 70 %-го виходу). Його дві амідні функції (первинна і третинна) одночасно послаблюються обробкою бораном (реагентом, не придатним для промислового використання) у ТГФ, що дає відповідний діамін (11), який реагує з Boc-D-Phe-OSu, і адукт (12) потім позбавляють захисту стандартними способами, отримуючи (4). Отже, потрібно виконати не менше 7 операцій для отримання головного інтермедіату (4) за цією процедурою. У цьому патенті також описано у загальній формі для сполук, відмінних від ібодутанту способи, що включають використання оксазолонових структур (WO03037916, pp. 14-15), подібних до інтермедіату (3) винаходу (див. фіг.). 2 UA 105523 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, синтез даного продукту розглянуто у дослідженні J. Med. Chem, 2007, 50, 47934807 (Схема 1), яке вказує, що на відміну від синтезу описаного у згаданому вище патенті, амінну частину (11) отримують реакцією ацил хлориду (7) 4-тетрагідропіранкарбонової кислоти безпосередньо з ізоніпесот-амідом (13) у присутності тріетиламіну змішаного у ДХМ/ДМФ розчиннику, з подальшим відновленням діаміду (10) LiAlH 4 у ТГФ. Ця модифікація зменшує з 7 до 6 кількість операцій, потрібних для отримання (4), але все ж таки включає забагато операцій синтезу, деякі з яких проходять у розчинниках, наприклад, ДМФ,пов'язаних з токсичністю і проблемами їх ліквідації, неприйнятними у масштабному виготовленні, і у присутності, зокрема, небезпечних реагентів, наприклад, LiAlH4. Відомо, що відновлювальна обробка LiAlH4 також пов'язана з побічним невідворотним утворенням продуктів деалкілування при частковому відновленні третинного аміду, які забруднюють інтермедіат (11) через присутність 4амінoметилпіперидину. Щодо способів отримання 6-метил-2-бензо[b]тіофенкарбонової кислоти (1), у J. Med. Chem, 2007, 50, 4793-4807 зазначено, що за загальною процедурою один з можливих синтезів починається з 2-флуор-4-метилбензальдегід, який обробляють метил тіогліколатом в умовах ароматичного нуклеофільного заміщення у присутності основи (Cs 2CO3, ДМСО), і це дає результати, трохи відмінні від наведених у літературі (J. R. Beck et al., J. Org. Chem. 1972, 37, 3224-3226, A. J. Bridges, Tetrahedron Lett. 1992, 33, 7499-7502). У першому з цих досліджень описано синтез естерів 2-бензо[b]тіофенкарбонової кислоти з 2-нітро-бензонітрилів або 2нітробензальдегідів обробкою метил тіогліколататом, KOH у ДМФ і метил тіогліколатом, K 2CO3 і ДМФ, відповідно з дуже різними виходами залежно від використаних субстратів. У другому дослідженні описано синтез естерів 2-бензо[b]тіофенкарбонової кислоти з 2флуорбензальдегідів обробкою метил тіогліколатом з тріетиламіном або NaH у ДМСО при різних температурах і з різними виходами залежно від використаних субстратів. Хоча інтермедіат (1), отриманий цим способом, має високу якість і високий вихід, цей спосіб є не дуже стабільним у випадку невеликих змін часу і температури і змін або варіацій порядку додання реагентів, і ці фактори заважають заважають широкому застосуванню способу. У літературі описано і інші способи синтезу 6-метил-2-бензо[b]тіофен-карбонової кислоти як загальні способи отримання 2-бензо[b]тіофенкарбонових кислот: a) J. Heterocyclic Chem. 1975, 12, 889-891 і J. Heterocyclic Chem. 1983, 20, 55-59, згідно з якими належним чином функціоналізовані бензальдегіди вводять у реакцію з роданіном і гідролізують в основних умовах відповідними цинамовими меркаптокислотами, які циклізують відповідні бензо[b]тіофени гарячою окислювальною обробкою йодом у придатному розчиннику; b) WO03106462 і Org. Proc. Res. Dev, 2006, 10, 296-303, згідно з якими різні функціоналізовані 2-бензо[b]тіофенкарбонові кислоти можна отримувати (карбоксилюванням) з відповідних бензотіофенів, які отримують з бензолтіолів (функціоналізованих у мета- і пара-позиціх) алкілуванням бромацетальдегід діетил ацетaлем з подальшою циклізацією, наприклад, поліфосфорною кислотою у толуолі; ці способи синтезу також не є придатними для промислового застосування. 2-карбокси-бензо[b]тіофен гідрохлоридні сполуки у позиції 3, як відомо у літературі, отримують, починаючи від відповідних цинамових кислот, окисленням тіоніл хлоридом у присутності каталітичної кількості основи, наприклад, піридину (J. Org. Chem. 1975, 40, 30373045) або DIMAP (WO95/15323). Не було виявлено досліджень можливості гідродегалогенізації цих карбонових кислот (як таких або у формі солей) для видалення хлору; однак, відомим є відновлення естерів або амідів, часто у жорстких умовах (не придатних у великих масштабах), наприклад, використання Ni Рейні (Raney) (на амідах, WO9534551), Pd чорного як каталізатора або гідрогену під високим тиском. Наприклад, відновлення естерів 3-хлор-2бензотіофенкарбонової кислоти описано у Helv. Chim. Acta, 1994, 77, 100-110 і включає гідрогенування Pd/C у присутності основи, наприклад, тріетиламіну або AcONa, з дуже низьким виходом. Отже, з оглянутої літератури можна дійти висновку, що синтез сполуки ібодутанту досі пов'язаний з численними проблемами. Отже, існує нагальна потреба у розвитку нового способу синтезу, придатного для промислового застосування. Заявником був винайдений новий більш ефективний спосіб синтезу ібодутанту (Схема 2). Зазначений спосіб усуває вади описаних вище способів синтезу, а саме: i) зменшує велику кількість операцій синтезу: інтермедіату (4), який отримується лише 3 операціями (замість 7 або 6) з високим виходом і тому забезпечує очевидну перевагу цього способу синтезу ібодутанту. Інтермедіат (12) отримують з виходом від 95 % до 80 % порівняно з 45 %-м виходом описаних способів (див. J. Med. Chem, 2007, 50, 4793-4807). Отриманий продукт є якіснішим. ii) обмежує використання розчинників, не ідеальних для промислового синтезу, наприклад, 3 UA 105523 C2 5 10 15 ДМФ, який є тератогенним висококиплячим і здатним змішуватись з водою (у флегмі) на користь розчинників, які є безпечними, наприклад, ізопропанолу, низькокиплячими, наприклад, ТГФ, і/або нездатними змішуватись з водою, наприклад, ДХМ або AcOEt (етил ацетат). iii) не потребує використання дуже небезпечних гідридних відновлювачів, наприклад, BH 3 у ТГФ або LiAlH4, замінюючи їх для отримання сполуки (12) більш зручним Na(AcO) 3BH з відновлювальними реакціями амінування. iv) усуває стадію діамідного інтермедіату (схема 1, сполука (10)), який є добре розчинним у воді, і який тому важко екстрагувати, ізолювати і аналізувати. v) у випадку ацилування діаміну (11) усувається використання Boc-D-Phe-OSu заміщенням відповідною неактивованою амінoкислотою і активуванням in situ добре відомими способами, наприклад, ізобутил хлорформaтом або карбонілдіімідазолом, з суттєвою економією коштів, що дає значне зниження витрат на виготовлення активного інгредієнту. vi) 6-метил-2-бензо[b]тіофенкарбонова кислота (1) може бути приготовлена каталітичною гідрогенізацією безпосередньо з відповідної 3-хлорної кислоти (18) з високим виходом і з використанням процедур і реагентів, придатних для промислового масштабу (Схема 3) vii) здійснення описаного синтезу ібодутанту з виходом, значно більшим за виходи, що забезпечуються описаними вище системами (вихід інтермедіату (12): спосіб згідно з J. Med. Chem, 2007, 50, 4793-4807: 60 %; або спосіб, подібний описаному у WO03037916:
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of ibodutant (men15596) and related intermediates
Автори англійськоюBonaccorsi, Fabrizio, Fedi, Valentina, Giannotti, Danilo
Автори російськоюБонаккорси Фабрицио, Феди Валентина, Джианнотти Данило
МПК / Мітки
МПК: A61P 25/00, C07D 409/12, A61K 38/05
Мітки: спосіб, ібодутанту, отримання, men15596, цього, потрібних, інтермедіатів
Код посилання
<a href="https://ua.patents.su/17-105523-sposib-otrimannya-ibodutantu-men15596-i-potribnikh-dlya-cogo-intermediativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання ібодутанту (men15596) і потрібних для цього інтермедіатів</a>