Спосіб синтезу хлорпуринових інтермедіатів
Формула / Реферат
1. Спосіб одержання сполуки формули (І)
 (I),
(I),
як варіант, у формі її солі чи комплексу,
який включає гідроліз сполуки формули (IV)
![]() (IV),
(IV),
де Ρ - протектувальна група, у присутності кислоти, конденсацію утвореного продукту формули (V)
![]() (V)
(V)
in situ у полярному розчиннику у присутності основи зі сполукою формули (VI)
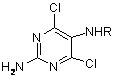 (VI),
(VI),
де R - СНО або Н, з наступним замиканням in situ циклу утвореного інтермедіату формули (VII)
 (VII),
(VII),
де R - СНО або Н, для утворення сполуки формули (І), яка далі, як варіант, може реагувати з кислотою чи комплексоутворювачем з утворенням своєї солі чи комплексу.
2. Спосіб за п. 1, який відрізняється тим, що R - СНО.
3. Спосіб за п. 1 чи 2, який відрізняється тим, що Ρ - ацил чи заміщений оксикарбоніл.
4. Спосіб за п. 3, який відрізняється тим, що Ρ - форміл, С1-4алканоїл або R'OC(O)-, де R' - алкіл чи аралкіл.
5. Спосіб за п. 4, який відрізняється тим, що Ρ - ацетил або R' - третбутил чи бензил.
6. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що гідроліз проводять в алканолі, циклічному етері чи хлорованому вуглеводні у присутності органічної чи мінеральної кислоти.
7. Спосіб за п. 6, який відрізняється тим, що гідроліз проводять у промисловому метильованому спирті, а кислотою є трифлуороцтова чи гідрохлоридна.
8. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що конденсацію проводять під зворотним холодильником.
9. Спосіб за п. 8, який відрізняється тим, що полярним розчинником є спирт, вода чи ацетонітрил, а основою тріалкіламін або карбонат чи гідрокарбонат лужного металу.
10. Спосіб за п. 9, який відрізняється тим, що основою є карбонат натрію чи калію або гідрокарбонат натрію.
11. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що реакцію замикання циклу проводять з використанням тріалкілортоформіату у присутності мінеральної кислоти та, як варіант, одного чи більше неводних розчинників.
12. Спосіб за п. 11, який відрізняється тим, що реакцію замикання циклу проводять з використанням тріетилортоформіату у присутності гідрохлоридної кислоти.
13. Спосіб за п. 11, який відрізняється тим, що неводним розчинником є тетрагідрофуран, етилацетат чи промисловий метильований спирт.
Текст
1 Спосіб одержання сполуки формули (І) як варіант, у формі її солі чи комплексу, який включає гідроліз сполуки формули (IV) (IV), де Р - протектувальна група, у присутності кислоти, конденсацію утвореного продукту формули (V) () V in situ у полярному розчиннику у присутності основи зі сполукою формули (VI) (VI), де R - СНО або Н, з наступним замиканням in situ циклу утвореного штермедіату формули (VII) (VII), (11,54550 (із) С2 (51)7CO7D473/OO ОПИС (54) СПОСІБ СИНТЕЗУ ХЛОРПУРИНОВИХ HO (19) U А де R - СНО або Н, для утворення сполуки формули (І), яка далі, як варіант, може реагувати з кислотою чи комплексоутворювачем з утворенням своєї солі чи комплексу 2 Спосіб за п 1, який відрізняється тим, що R СНО 3 Спосіб за п 1 чи 2, який в і д р і з н я є т ь с я тим, що Р - ацил чи заміщений оксикарбоніл 4 Спосіб за п 3, який в і д р і з н я є т ь с я тим, що Р форміл, Сі 4алканоіл або R'OC(O)-, де R' - алкіл чи а рал кіл 5 Спосіб за п 4, який відрізняється тим, що Р ацетил або R' -третбутил чи бензил 6 Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що гідроліз проводять в алканолі, циклічному етері чи хлорованому вуглеводні у присутності органічної чи мінеральної кислоти 7 Спосіб за п 6, який відрізняється тим, що гідроліз проводять у промисловому метильованому спирті, а кислотою є трифлуороцтова чи пдрохлоридна 8 Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що конденсацію проводять під зворотним холодильником 9 Спосіб за п 8, який відрізняється тим, що полярним розчинником є спирт, вода чи ацетонітрил, а основою тріалкіламш або карбонат чи гідрокарбонат лужного металу 10 Спосіб за п 9, який відрізняється тим, що основою є карбонат натрію чи калію або гідрокарбонат натрію 11 Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що реакцію замикання циклу проводять з використанням тріалкілортоформіату у присутності мінеральної кислоти та, як варіант, одного чи більше неводних розчинників 12 Спосіб за п 11, який відрізняється тим, що реакцію замикання циклу проводять з використанням тріетилортоформіату у присутності пдрохлоридної кислоти 13 Спосіб за п 11, який відрізняється тим, що неводним розчинником є тетрапдрофуран, етилацетат чи промисловий метильований спирт О о ю ю ю 54550 Згідно З винаходом запропоновано спосіб виготовлення аналогів карбоциклічного пуринового нуклеозиду формули (І), їх солей та фармацевтичне» прийнятних похідних Енантюмерно чисту сполуку формули (І) циклізації знов-таки без будь-якої обробки та виділення штермедіатів, згідно з винаходом зростає загальний вихід Згідно З подальшим аспектом винаходу запропоновано тому спосіб виготовлення сполуки формули (І) СІ) описано в GB-A-2217320, її можна використовувати у виробництві абакавіру, аналогу 2амінопуринового нуклеозиду структури (II) т (І) як варіант, у формі солі чи комплексу, спосіб включає гідроліз вище означеної сполуки формули (IV) у присутності кислоти, конденсуючи утворений продукт формули (V) J но (ПІ in situ у присутності основи зі сполукою формули (VI) (V) Його описано в ЕР 0434450 як маючого потужну активність проти вірусу імунодефіциту людини (ВІЛ) та вірусу гепатиту В (ВГВ) Існує необхідність у синтезі великої КІЛЬКОСТІ абакавіру для КЛІНІЧНИХ ДОСЛІДІВ, а після санкціонування абакавіру національним медичним регулювальним відомством велика КІЛЬКІСТЬ абакавіру також потрібна для продажу як рекомендований засіб для лікування ВІЛ-інфекцм Спосіб виробництва абакавіру, використовуючи енантюмеоно чисту сполуку , HHBoc через амшопуриновий штермедіат формули (І) описано в основному в міжнародних публікаціях РСТ WO 91 /15490, WO 95/21161, в ЕР 0434450 та в Tetrahedron Assymmetry Vol 4,1117(1993) Однак, описаний спосіб не пропонує задовільного способу одержання 2-амшопуринового похідного формули (І), оскільки він потребує виділення та очистки ряду штермедіатів, що призводить до відносно великої вартості та низького виходу в синтезі Згідно З запропонованим винаходом розроблено спосіб виготовлення штермедіату формули (І) з N-протектованих 4-амшо-циклопентенів формули (IV) т = / (IV» де Р - протектувальна група, який забезпечує високий вихід і є прийнятніше за вартістю Бажаною протектувальною групою є ацил чи заміщений оксикарбоніл Згідно З ОДНИМ аспектом винаходу запропоновано легке та зручне перетворення in situ циклопентенів формули (IV) у 2-амшопуринового ПОХІДНІ формули (І) без необхідності виділяти будь-який штермедіат За цим способом депротектування вихідного матеріалу формули (IV) in situ дає потрібний аміноспирт без будь-якої неекономічної обробки, а внаслідок безпосереднього сполучення та СІ де R - СНО або Н, з замиканням далі циклу in situ утвореного штермедіату формули (VII) де R - СНО або Н, з утворенням сполуки формули (І), яка далі, як варіант, може реагувати з кислотою чи комплексоутворювачем з утворенням своєї солі чи комплексу Як описано вище, кращими протектувальними групами для сполуки формули (IV) є ацил чи заміщений оксикарбоніл Ацил, переважно, включає форміл чи нижчий алканоїл (що має, наприклад 1 4 атоми карбону в складі алкілу), особливо ацетил Переважно, заміщений оксикарбоніл має формулу R'OC(O)-, де R' може бути алкілом чи аралкілом Кращим алкілом є mpem-бутил, кращим аралкілом - бензил Гідроліз переважно проводять в м'яких умовах з кислотним каталізатором в органічному розчиннику, як-то алканол, циклічний етер чи хлорований вуглеводень Краще використовувати такі органічні чи мінеральні кислоти, як трифлуороцтову чи пдрохлоридну, в такому спиртовому розчиннику, як промисловий метилований спирт (ПМС), як варіант, у присутності води Конденсацію далі проводять без виділення продукту гідролізу формули (V) Цю реакцію переважно проводять під зворотним холодильником в такому полярному розчиннику, як спирт, наприклад, етанол чи бутанол, вода чи ацетонітрил або їх суміш, у присутності щонайменше достатньої для нейтралізації використаної для нейтралізації 54550 та виділеної при конденсації кислоти основи Звичайно, повинно бути щонайменше 2 еквіваленти основи відносно сполуки формули (IV) Потрібною основою може бути тріалкіламш або карбонат чи гідрокарбонат лужного металу, наприклад, карбонат натрію чи калію, а краще - гідрокарбонат натрію Кращою комбінацією є тріе-тиламш чи гідрокарбонат натрію в ПМС Групою R сполуки формули (IV) переважно є СНО Реакцію замикання циклу далі проводять зновтаки без виділення будь-якого попереднього Інтермедіату формули (VII) Це зручно робити використанням тріалкілортоформіатів у присутності концентрованої водної чи безводної мінеральної кислоти, як варіант, у присутності одного чи більше неводних розчинників, наприклад, тетрапдрофурану, етилацетату чи ПМС Придатне невиділений продукт формули (VII) додавати до суміші кислоти та тріалкілортоформіату Краща комбінація включає використання переважно приблизно 1,5-3, краще приблизно 2 молярних еквіваленти пдрохлоридної кислоти у тріалкілортоформіаті, що призводить до осадження пдрохлориду 9заміщеного 2-амшопурину формули (І) За бажанням, вільну основу можна виділити обробкою основою Було встановлено, що спосіб згідно з винаходом забезпечує вихід сполуки формули (І), починаючи зі сполуки формули (IV), вище 80% Це дуже сприятливо у порівнянні з виходом сполуки формули (І), отриманої попереднім поетапним способом, згідно з яким штермедіати виділяли, який звичайно дає вихід приблизно 56% при використанні в якості вихідного матеріалу сполуки формули (III), та приблизно 75% при використанні в якості вихідного матеріалу сполуки формули (V) згідно зі способом, описаним в WO 95/21161 Сполуки формули (VI) можна синтезувати описаним в WO 95/21161 способом Сполуку можна синтезувати з легко доступного 2,5-діамшо-4,6дипдроксипіримідину реакцією з реагентом Вілсмеєра формули (VIII) Сполуку формули (VI), в якій R - Н, можна виготовити зі сполуки формули (IX) гідролізом в кислому розчині, наприклад, при рН 3 ± 0,5, додаванням такого змішуваного з водою співрозчиннику, як етанол Сполуку формули (VI), в якій R - СНО, можна також виготовити гідролізом сполуки формули (IX) в мінімумі води при вище означених значеннях рН В цих умовах утворена сполука формули (VI), в якій R - СНО, осаджується і її можна виділити фільтруванням Сполуку формули (IV) можна виготовити аналогічним описаному в Tetrahedron Assymmetry Vol 4, 1117 (1993) способом Нижченаведені приклади слугують тільки ілюстраціями і не обмежують рамок винаходу Приклад А Виготовлення пдрохлориду (13,4^-цис-4-(2-амІно-6-хпор-9Н-пурин-9-іл)-2циклопентен-1-метанолу Суспензію 100г 1,1-диметилетилового естеру іл]карбамовоі кислоти, в 600мл промислового метилованого спирту (ПМС) обробляли 48мл (1,2 молярних еквіваленти) концентрованої пдрохлоридної кислоти і нагрівали утворений розчин до кипіння протягом приблизно 0,5 години, гріли під зворотним холодильником протягом приблизно 2,5 годин, потім охолоджували до 20 - 25°С і розбавляли 600 мл ПМС Додавали 170мл тріетиламшу, потім 97г І\І-(2-аміно-4,6-дихлор-5піримідиніл)формаміду (WO 95/21161) Суспензію гріли під зворотним холодильником приблизно протягом 17 годин до отримання прозорого розчину, який охолоджували до 25 - 30°С і додавали 169г подрібненого карбонату калію Суспензію при цих температурах перемішували протягом 0,5 години, охолоджували до 0 - 5°С і відфільтровували тверду фазу, яку тричі по 180мл та один раз 140мл промивали ПМС, поєднані фільтрати та промивки концентрували під зниженим тиском до червоної гуми, яку знов розчиняли в ЮООмл ПМС і концентрували під зниженим тиском до гуми Розбавлення та концентрування повторювали ще ДВІЧІ а кінцеву гуму розчиняли в 350мл ПМС Між ТИМ, ВИГОТОВИЛИ та охолодили до 0 - 5°С s * з утворенням сполуки формули (IX) СІ де Ri та F 2 у формулах (VIII) та (IX) визначено ? у WO 95/21161 Ri та F?2, однакові чи різні, вибирають з ЛІНІЙНОГО Сі валкілу, розгалуженого Сі валкілу, Сз вциклоалкілу та арилу (як-то феніл чи нафтил), що як варіант, Може бути заміщено Сі 4алкілом чи галогеном, наприклад, хлором Згідно з кращим втіленням винаходу обидва Ri та R2 метил, а потім гідролізом Сполуки формули (VIII) можна виготовити з різних формамідів вторинних амінів з різними галогенанпдридами кислот, як-то оксихлорид фосфору, пентахлорид фосфору, тюнілхлорид, фосген та оксалілхлорид, наприклад, як деталізовано С М Marson в Tetrahedron 1992, 48 3660 - 3720 та наведених там посиланнях суміш 900мл тріетилортоформіату та 400мл тетрапдрофурану, додали, підтримуючи температуру 0 10°С, 80мл концентрованої пдрохлоридної кислоти, а потім додали ще ЮОмл тетрапдрофурану До цієї суміші додали виготовлений раніше концентрат в ПМС, який змивали ЮОмл ПМС Суміш нагрівали до 20 - 25°С та засівали автентичним (1S,4R)-4HC-4-(2-aMiHO-6-xnop-9H-nypHH-9-in)-2циклопентен-1-метанолом і перемішували протягом приблизно 20 годин Суспензію фільтрували, тверду фазу промивали сумішшю mpemбутилметилетеру та ПМС (9/1, 3 х ЗООмл) та сушили під вакуумом при 40 - 45°С, одержавши 117г (82%) потрібної сполуки як жовтувато-коричневу тверду речовину 1Н ЯМР (flMCO-d6) 5 8,38 (s, 1, СН пурину), 7,50 (br m, 5, NH 3 + , OH, HOD), 6,20 (т, 1, =СН), 5,94 ( т , 1, =СН) 5,49 ( т , 1, NCH), 3,46 ( т , 2, ОСН2), 2,91 (brm, 1, СН), 2,70 - 2,60 (т, 1, СН), 1,75-1,66 ( т , 1, СН) Приклад Б Виготовлення пдрохлориду (1S,4R)-4HC-4-(2-aMiHO-6-xnop-9H-nypHH-9-in)-2циклопентен-1-метанолу 54550 Суспензію 100г 1,1-диметилетилового естеру (1 Р,43)-цис-[4-(пдроксиметил)-2-циклопентен-1 іл]карбамовоі кислоти, в 600мл промислового метилованого спирту (ПМС) обробляли 48мл (1,2 молярних еквіваленти) концентрованої пдрохлоридної кислоти і нагрівали утворений розчин до кипіння протягом приблизно 0,5 години, гріли лід зворотним холодильником протягом приблизно З годин, потім охолоджували до 20 - 25°С Додавали 103,4г гідрокарбонату натрію, потім 97г І\І-(2-амшо4,6-дихлор-5-піримідиніл)формаміду (WO 95/21161) та 600мл ПМС Суспензію гріли під зворотним холодильником приблизно протягом 4 годин і охолоджували до - 5°С Після перемішування при цій температурі протягом приблизно 1 години тверду фазу відфільтровували та ДВІЧІ ПО ЮОМЛ промивали ПМС, Поєднані фільтрати та промивки концентрували під зниженим тиском до остаточного об'єму приблизно 400мл, знов розчиняли в ЮООмл ПМС і концентрували під зниженим тиском до гуми Розбавлення та концентрування повторювали ще ДВІЧІ а кінцеву гуму розчиняли в 350мл ПМС Між ТИМ, ВИГОТОВИЛИ та охолодили до 0 - 5°С 900мл тріетилортоформіату, додали, підтримуючи температуру 0 - 10°С, 80мл концентрованої пдрохлоридної кислоти До цієї суміші додали виготовлений раніше концентрат в ПМС, який змивали 600мл ПМС Суміш нагрівали до 20 - 25°С та засівали автентичним (13,4Р)-цис-4-(2-амшо-6-хлор9Н-пурин-9-іл)-2-циклопектен-1-метанолом і перемішували протягом приблизно 7 годин Суспензію фільтрували, тверду фазу ДВІЧІ ПО 250МЛ проми вали ПМС і сушили у вакуумі при 40 - 45°С, одержавши 114г (81%) потрібної сполуки як жовтуватокоричневу тверду речовину, ідентичну за спектром продукту з прикладу А Приклад В Виготовлення пдрохлориду (13,4Р)-цис-4-(2-амшо-6-хлор-9Н-пурин-9-іл)-2циклопентен-1-метанолу Суспензію 72,5кг 1,1-диметилетилового естеру (1 Р,43)-цис-[4-(пдроксиметил)-2-циклопентен-1 іл]карбамовоі кислоти, в 435л промислового метилованого спирту (ПМС) обробляли 36,5л (1,2 молярних еквіваленти) концентрованої пдрохлоридної кислоти і нагрівали утворений розчин до кипіння протягом приблизно 1,5 години, гріли під зворотним холодильником протягом приблизно 2 годин, потім охолоджували до 20 - 25°С Додавали 75кг гідрокарбонату натрію, потім 70кг І\І-(2-амшо4,6-дихлор-5-піримідиніл)формаміду (WO 95/21161) та 435л ПМС Суспензію гріли під зворотним холодильником приблизно протягом 4 годин і охолоджували до - 5°С Після перемішування при цій температурі протягом приблизно 1 години тверду фазу відфільтровували та ДВІЧІ ПО 1 4 4 Л про 8 мивали ПМС Поєднані фільтрати та промивки концентрували під зниженим тиском до остаточного об'єму приблизно 290л, знов розчиняли в приблизно 300л ПМС і концентрували під зниженим тиском до остаточного об'єму приблизно 290л Розбавлення та концентрування повторювали ще ДВІЧІ а кінцеву гуму розчиняли в 610л ПМС Між ТИМ, ВИГОТОВИЛИ при 0 - 8°С суміш 660л тріетилортоформіату, 58л концентрованої пдрохлоридної кислоти та 72л ПМС До цієї суміші додали виготовлений раніше концентрат в ПМС, який ДВІЧІ по 72л змивали ПМС Суміш нагрівали до 20 - 25°С та засівали, автентичним (1S 4Р)-цис4-(2-амшо-6-хлор-9Н-пурин-9-іл)-2-циклопентен-1метанолом і перемішували протягом приблизно 7 годин Суспензію охолоджували до 18 - 21 °С, фільтрували, тверду фазу ДВІЧІ (72л та 217л) промивали ПМС та сушили під вакуумом при 40 - 45°С, одержавши 81,7 (79,5%) потрібної сполуки як жовтувато-коричневу тверду речовину, ідентичну за спектром продукту з прикладу А Приклад Г Виготовлення пдрохлориду (1s,4r)цис-4-(2-амшо-6-хлор-9Н-пурин-9-іл)-2циклопентен-1-метанолу Суспензію 10г 1,1-диметилетилового естеру (1 Р,43)-цис-[4-(пдроксиметил)-2-циклолентен-1 іл]карбамовоі кислоти, в 60мл промислового метилованого спирту (ПМС) обробляли 5л (1,2 молярних еквіваленти) концентрованої пдрохлоридної кислоти і нагрівали утворений розчин до кипіння протягом приблизно 0,5 години, гріли під зворотним холодильником протягом приблизно 3 годин, потім охолоджували до 20 - 25°С і зважували (45,75г) Частину (14г)розбавляли 14мл ПМС Додавали 3,1г гідрокарбонату натрію, потім 2,0г N-(2амшо-4,6-дихлор-5-піримідиніл)формаміду (WO 95/21161) Суспензію гріли під зворотним холодильником приблизно протягом 7 годин і охолоджували до приблизно - 5°С Тверду фазу відфільтровували, а поєднані фільтрати та промивки концентрували під зниженим тиском до гуми, яку розчиняли в 17мл ПМС Між тим, охолодили до 0 - 5°С 21,4мл тріетилортоформіату, додали, підтримуючи температуру 0 - 10°С, 1,9мл концентрованої пдрохлоридної кислоти До цієї суміші додали виготовлений раніше розчин в ПМС, який змивали ДВІЧІ ПО 2,5МЛ ПМС Суміш нагрівали до 20 - 25°С та засівали автентичним (13,4Р)-цис-4-(2-амшо-6-хлор-9Нпурин-9-іл)-2-циклопентен-1-метанолом і перемішували протягом приблизно 19 годин Суспензію фільтрували, тверду фазу ДВІЧІ ПО 4,5МЛ промива ли ПМС та сушили під вакуумом при 40 - 45°С, одержавши 2,06г (61%) потрібної сполуки як жовтувату тверду речовину, ідентичну за спектром продукту з прикладу А Підписано до друку 03 04 2003 р Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for chlorpurine intermediates synthesis
Назва патенту російськоюСпособ синтеза хлорпуриновых интермедиатов
Автори російськоюJones, Martin, Francis
МПК / Мітки
МПК: C07D 473/40
Мітки: інтермедіатів, спосіб, хлорпуринових, синтезу
Код посилання
<a href="https://ua.patents.su/4-54550-sposib-sintezu-khlorpurinovikh-intermediativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу хлорпуринових інтермедіатів</a>
Попередній патент: Спосіб виготовлення вогнетривких виробів на нітридкремнієвмісній зв’язці
Наступний патент: Спосіб електролітичного осадження аморфних сплавів залізо-фосфор
Випадковий патент: Спосіб виробництва житньо-пшеничного хліба








