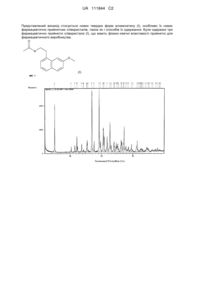
Фармацевтично прийнятні співкристали n-[2-(7-метокси-1-нафтил)етил]ацетаміду і способи їх одержання
Номер патенту: 111844
Опубліковано: 24.06.2016
Автори: Хвойка Томаш, Хейзе Вінфрід, Міллер Гері Джеймс, Пекарек Томаш, Ріхтер Індржих, Рідван Людек, Даммер Онджей, Нагель Норберт
Формула / Реферат
1. Співкристал N-[2-(7-метокси-1-нафтил)етил]ацетаміду відомого як агомелатин з утворювачем співкристала, вибраним з групи, що містить лимонну кислоту і бензолсульфонову кислоту.
2. Співкристал N-[2-(7-метокси-1-нафтил)етил]ацетаміду з лимонною кислотою за пунктом 1, який відрізняється тим, що має одну або більше наступних ознак:
i) порошкова рентгенограма з основними піками із значеннями 2-тета 5,2; 12,2; 17,0; 19,3; 20,6; 22,7 і 27,3 ± 0,2°;
ii) температура плавлення в інтервалі 123-127°C;
iii) піки раманівського розсіювання з хвильовими числами 2963, 1749, 1681, 944, 783 см-1.
3. Співкристал N-[2-(7-метокси-1-нафтил)етил]ацетаміду з бензолсульфоновою кислотою за пунктом 1, який відрізняється тим, що має одну або більше наступних ознак:
i) порошкова рентгенограма з основними піками із значеннями 2-тета 11,5, 15,7, 17,4, 19,0, 24,5 і 26,4 ± 0,2°;
ii) температура плавлення в інтервалі 128-132°C;
iii) піки раманівського розсіювання з хвильовими числами 3073, 1585, 1163, 997, 727 см-1.
4. Спосіб одержання співкристала, описаного в будь-якому з пунктів 1-3, що включає розчинення N-[2-(7-метокси-1-нафтил)етил]ацетаміду в розчиннику або суміші розчинників, вибраних з групи, що містить C3-C8 кетони, C1-C8 спирти або ефір-спирти, циклічні C5-C6 прості ефіри, C3-C8 складні ефіри та C2-C8 нітрили, з утворювачем співкристала і кристалізацію бінарного співкристала при охолодженні розчинуабо випарюванні розчинника.
5. Спосіб за пунктом 4, який відрізняється тим, що до розчину додають співкристал як затравку.
Текст
Реферат: UA 111844 C2 (12) UA 111844 C2 Представлений винахід стосується нових твердих форм агомелатину (І), особливо їх нових фармацевтично прийнятних співкристалів, також як і способів їх одержання. Були одержані три фармацевтично прийнятні співкристали (І), що мають фізико-хімічні властивості прийнятні для фармацевтичного виробництва. O N O (І) UA 111844 C2 5 10 15 20 25 30 35 40 45 50 Галузь винаходу Представлений винахід стосується нових твердих форм агомелатину, особливо їх нових фармацевтично прийнятних співкристалів, також як і способів їх одержання. Передумови створення винаходу N-[2-(7-Метокси-1-нафтил)етил]ацетамід, також відомий як агомелатин, формули I (I) є мелатогенним агоністом мелатонінового рецептора 1 (MT-1) і мелатонінового рецептора 2 (MT-2) і 5-HT2C антагоністом, що дозволений для лікування депресії або основного депресивного розладу. Фізико-хімічні властивості, що забезпечуються твердотільною структурою, є критичним параметром при розробці твердих дозованих форм фармацевтичних агентів, оскільки ці властивості впливають на біодоступність, стабільність і перероблюваність активного фармацевтичного інгредієнта. Відомо, що твердий активний фармацевтичний інгредієнт може потенційно існувати і в аморфній формі, і в кристалічній формі. Також відомо, що можливе існування різних полі морфів і сольватів кристалічної твердої речовини. Поліморфізм виникає при кристалізації речовини в більше ніж одній кристалічній формі, кожна форма є ідентичною в сенсі хімічного складу системи, але відрізняється розташуванням молекул в кристалічні решітці. Також можливий випадок, що молекули розчинника включаються в кристалічну структуру, на доданок до активних фармацевтичних молекул, утворюючи кристалічний сольват або, коли розчинником є вода, кристалічний гідрат. Загально прийнятне правило, що різні поліморфи, сольвати або гідрати активної фармацевтичної молекули можуть мати різні фізико-хімічні властивості. Як результат відмінностей кількості, типу і сили міжмолекулярних взаємодій між молекулами в різних кристалічних формах. Наприклад, було показано, що різні поліморфи і сольвати відрізняються за їх розчинністю, стабільністю, гігроскопічністю і різними механічними властивостями, що залежать від якостей, таких як їх фільтрувальна здатність і текучість. Для активних фармацевтичних молекул, що містять кислотну або основну функціональну групу, цей принцип може експлуатуватись шляхом одержання різних кристалічних солей активного фармацевтичного інгредієнта, для модуляції і оптимізації фізико-хімічних властивостей, одержуваної кристалічної твердої речовини для певного застосування. Зміни фізико-хімічних властивостей, що є результатом включення протиіону в кристалічну структуру, впливають і на молекулярну структуру, і на властивості активної фармацевтичної молекули і протиіону, і на міжмолекулярну взаємодію між молекулами в кристалічній структурі. Також можна змінити фізико-хімічні властивості кристалічної твердої речовини шляхом включення різних протиіонів, що забезпечує кристалічні солі з різними фізико-хімічними властивостями. Це все є добре дослідженою і важливою методикою створення фармацевтичного агента і існує стандартна практика розробки нових твердих форм активних фармацевтичних інгредієнтів (АФІ). Типовими протиіонами використовуваними при одержанні фармацевтичної солі є кислотні або основні молекули або іони, що вважаються фармацевтично прийнятними, завдяки їх низькій токсичності, доброї прийнятності при використанні як харчових добавок або їх природній розповсюдженості в людському організмі. Типовими прикладами використовуваних протиіонів є карбонові кислоти, сульфонові кислоти, гідроксикислоти, амінокислоти і неорганічні кислоти для основних активних фармацевтичних молекул і аміни, лужні метали, лужноземельні метали і амінокислоти для кислих активних фармацевтичних речовин. Основним обмеженням утворення солі є її неприйнятність щодо нейтральних AФI. Крім того, перелік можливих протиіонів для слабких кислот або слабких з основ AФI може бути обмежений константою іонізації кислотної або основної групи в молекулі. Нарешті, було показано, що склад кристалічних молекулярних солей може бути високо непередбачуваним, особливо щодо утворення гідрату і сольвату. З огляду на ці обмеження, утворення фармацевтично прийнятних співкристалів активних фармацевтичних молекул часто є альтернативних підходом до створення нових твердих форм 1 UA 111844 C2 5 10 15 20 25 30 35 40 45 50 55 60 активної речовини. В цьому контексті, під співкристалом або альтернативно спів-кристалом розуміють бінарний молекулярний кристал, що містить молекули AФI разом з іншими видами молекул у визначеному стехіометричному співвідношенні, де обидва компоненти знаходяться в їх нейтральному стані. В цьому випадку, терміни "співкристал" і "спів-кристал" розглядаються як синоніми щодо таких систем. Другий компонент в співкристалі (компонент інший ніж активний фармацевтичний інгредієнт) зазвичай згадується як "утворювач співкристалу". Фармацевтично прийнятними утворювачами співкристалів є будь-яка молекула, що вважається прийнятною як протиіон для фармацевтичної солі або відома як фармацевтичний ексціпієнт. Загально прийнятим визначенням фармацевтичного співкристалу є кристалічна система, що містить активну фармацевтичну молекулу і утворювач співкристалу, що є твердими при кімнатній температурі і тиску при визначеному стехіометричному співвідношенні, хоча співкристал не обмежується вмістом тільки двох компонентів. Компоненти співкристалу зв'язані водневими зв'язками і іншими нековалентними і неіонними взаємодіями. (Aakeroy and Salmon, CrystEngComm, 2005, 439-448). Це визначення відрізняє співкристали від кристалічних сольватів, в яких один з компонентів є рідким при кімнатній температурі і тиску. Також зрозуміло, що аналогічно до однокомпонентних кристалічних систем і солей, співкристали також можуть містити молекули розчинників або води, утворюючи співкристалічні сольвати або гідрати. Також зрозуміло, що аналогічно до всіх інших типів кристалічних систем, співкристали здатні існувати з різним упакуванням деяких молекулярних компонентів, утворюючи поліморфні форми певного співкристалу. Аналогічно до інших типів кристалічних систем, особливо кристалічних солей, на сьогодні неможливо передбачити, яка комбінація активної фармацевтичної сполуки і утворювача співкристалу буде кристалізуватись як співкристал або його кристалічну структуру. Крім того, неможливо передбачити фізико-хімічні властивості співкристалу або з молекулярних структур молекул компонентів, або з кристалічної структури співкристалу, якщо він відомий. Як наслідок, дослідження і відбір прийнятної співкристалічної форми активної фармацевтичної сполуки, що задовольняє певним вимогам до фізико-хімічних властивостей, є нетривіальним процесом і ідеальна співкристалічна форма не очевидна спочатку. N-[2-(7-Метокси-1-нафтил)етил]ацетамід класифікують як високорозчинний лікарський засіб, у відповідності з системою класифікації BCS, і критерієм для відбору придатної співкристалічної форми буде те, що вона проявляє біоеквівалентність пропонованій на ринку однокомпонентній формі N-[2-(7-Метокси-1-нафтил)етил]ацетаміду. Може бути забезпечений новий співкристал, з посиланням на новий поліморф, сіль або гідрат, з фізико-хімічними властивостями, що як вважається, переважає представлену на ринку тверду форму, якщо новий співкристал проявляє надзвичайну стабільність хімічної або твердої форми за умов зберігання, відтворюваність і чистоту одержаної твердої форми, що гарантує стійкість в ефективності лікарського продукту, що виготовляється, або механічних властивостей або фізичних характеристик, що поліпшують характеристики і відтворюваність твердої форми. Ідентифікація кристалічних форм може бути неочевидним способом і рекомендується використання додаткових методик включаючи порошкову рентгенографію (XRPD), диференційну скануючи калориметрію (ДСК) і коливальну спектроскопію (наприклад, спектроскопію Рамана) для чіткої і однозначної ідентифікації одержаної кристалічної форми. Порошкова рентгенографія є рутинним способом для однозначного характеризування кристалічних фаз і, після прийнятного калібрування, оцінки чистоти фази. Рентгенографія одного кристалу є оптимальним способом для характеризування кристалічної твердої речовини, що дає можливість визначити кристалографічну одиничну комірку і хімічну ідентичність, молекулярну структуру і стехіометрію молекул в кристалічній структурі і їх міжмолекулярні взаємодії. Однак, це потребує відносно великих і високоякісних одиничних кристалів, що обмежує використання цієї методики до систем здатних продукувати придатний кристалічний матеріал і це вже не рутинновикористовуваний спосіб. Остання публікація (Crystal Growth and Design, 2011, pages 466-471) описала дві бінарні кристалічні системи, що містять агомелатин з оцтовою кислотою і етиленгліколем. Беручи до уваги, що етиленгліколь і оцтова кислота є рідинами при кімнатній температурі і тиску, ці дві описані системи не відповідають критерію співкристали, розкритому вище, і є імовірно сольватами. В будь-якому випадку, обидві ці системи мають недоліки щодо використання в фармацевтичній рецептурі. Етиленгліколь не вважається фармацевтично прийнятним. В той час як оцтова кислота є фармацевтично прийнятною кристалізаційною системою, але у виробах спостерігалось повільна парова дифузія. Хоча існує практичний спосіб кристалізації в лабораторних масштабах дифракційно якісних окремих кристалів, він не придатний для кристалізації кількостей матеріалу, що задовольнили б фармацевтичне виробництво. Однак, 2 UA 111844 C2 5 10 15 20 25 30 35 40 його температура плавлення є низькою, що достатньо для ризиків при фармацевтичному виробництві. Крім того, високобажаною є розробка інших стабільних фармацевтично прийнятних співкристалів, що можуть надійно і відтворювано одержуватись з використанням масштабуємих методик кристалізації. Опис винаходу Представлений винахід стосується нових твердих форм N-[2-(7-Метокси-1нафтил)етил]ацетаміду у формі стабільних співкристалів з фармацевтично прийнятними органічними кислотами, що мають дві або більше карбоксильних груп або принаймні одну сульфонову групу. За визначенням співкристал повинен містити два компоненти в однорідному стехіометричному співвідношенні по всій кристалічній решітці; однак, різні поліморфи співкристалу можуть містити два компоненти з різними молярними співвідношеннями. Поліморфні співкристали можуть містити будь-яке молярне співвідношення агомелатину до утворювача співкристалу, але буде типово в інтервалі від 3:1 до 1:3. Неочікувано було встановлено, що згідно з цим винаходом, переважним і найбільш придатним стехіометричним співвідношенням є 1:1, безвідносно кількості функціональних груп присутніх на утворювачі співкристалу. Представлений винахід також стосується способів одержання співкристалів згідно з винаходом. Співкристали згідно з винаходом являють собою резервуар з високовмісних і стабільних форм агомелатину з яких найбільш придатна фізико-хімічна і фармацевтична форма, також як і фармакокінетичні властивості можуть бути вибрані для певного фармацевтичного застосування. Особливо цей винахід стосується, по суті, чистих кристалічних форм активного фармацевтичного інгредієнта N-[2-(7-метокси-1-нафтил)етил]ацетаміду як фармацевтично прийнятних співкристалів, способів одержання цих співкристалів і використання згаданих співкристалів при одержанні фармацевтичних рецептур для лікування депресії або глибокої депресії. Більш особливо, ці співкристали можна одержати повторювано і вони мають біодоступність, стабільність, гігроскопічність і механічні властивості, що роблять їх придатними для використання при одержанні фармацевтичних рецептур, що можна відповідним чином регулювати для керування якістю фармацевтичних рецептур. Вираз "по суті чиста кристалічна форма", використовувана тут, означає кристалічну форму, що характеризується порошковою рентгенограмою (XRPD), що містить не більше ніж сліди сигналів, що відповідають іншим кристалічним формам. Переважно, присутність таких сигналів є еквівалентною або нижче межі детектування (МД) використовуваного способу і, таким чином, у більшості випадків описаних тут, вираз "по суті чиста кристалічна форма" означає кристалічну форму з чистотою, принаймні, 90%. Термін "основні піки", використовуваний тут, означає піки з відносною інтенсивністю > 3%. Переважним втіленням винаходу є співкристал лимонної кислоти і N-[2-(7-Метокси-1нафтил)етил]ацетаміду, що має емпіричну формулу C 15H17NO2.C6H8O7, що характеризується за кімнатних умов моноклінною системою в просторовій групі P21/c з параметрами комірки a= 3 7,843(1) Å, b = 33,852 (2) Å, c = 8,288(1) Å, α= 90°, β = 109,40°, γ= 90°, V= 2075,5(2) Å з експериментальною порошковою рентгенограмою показаною на Фіг. 1 і містить основні піки приведені в Таблиці 1. Тривимірна структура цього співкристалу, одержана дифракцією рентгенівського випромінювання на одному кристалі (SXRD), показана на Фіг. 1a і порошкова рентгенограма розрахована з структури одного кристалу добре узгоджується з експериментальною рентгенограмою показаною на Фіг. 1b. 45 3 UA 111844 C2 Таблиця 1 Таблиця піків дифракції для співкристалу агомелатину з лимонною кислотою. Кут дифракції (°2θ) 10 15 20 25 Відносна інтенсивність (%) 5,18 10,40 11,55 12,19 13,70 15,38 15,54 16,99 17,68 19,31 19,72 20,57 20,93 21,81 22,73 24,00 24,71 25,18 26,25 26,48 27,25 27,78 28,59 29,56 31,34 34,45 37,89 5 d-відстань [Å] 17,033 8,497 7,656 7,256 6,457 5,757 5,697 5,213 5,012 4,592 4,498 4,314 4,241 4,072 3,909 3,706 3,601 3,534 3,393 3,363 3,270 3,209 3,120 3,020 2,852 2,602 2,373 71,9 8,7 10,6 26,2 14,2 18,0 17,1 96,6 16,7 100,0 15,3 32,6 21,3 25,0 45,5 16,3 12,9 11,9 16,7 13,1 23,9 8,3 7,9 11,6 15,4 6,5 5,1 Цей співкристал лимонної кислоти і N-[2-(7-Метокси-1-нафтил)етил]ацетаміду також характеризується термограмою диференціальної скануючої калориметрії (ДСК) показаною на Фіг. 2, що має ендотермічну подію, що відповідає плавленню з початковою температурою приблизно 124 °C. Температура плавлення є на приблизно 18 °C вищою, ніж у чистої Форми I поліморфу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду. Температура плавлення лікарського засобу може впливати на його сумісність з устаткуванням для одержання і формулювання, з твердими речовинами з нижчими температурами плавлення є більш придатними для плавлення на обладнанні під час рутинних процесів, таких як розмелювання і подрібнення. Крім того, форма з вищою температурою плавлення лікарської речовини може запропонувати переваги щодо легкості виготовлення і формулювання лікарського засобу. Цей співкристал лимонної кислоти і N-[2-(7-Метокси-1-нафтил)етил]ацетаміду також характеризується спектром Рамана приведеним на Фіг. 3, що має характеристичні піки приблизно при 2999, 2963, 2948, 1749, 1681, 1416, 1393, 1315, 1256, 1165, 1106, 1076, 944, 934, -1 905, 819, 783, 680, 570, 521, 441, 381 і 274 см . При виготовленні твердої оральної дозованої форми критично важливо, щоб лікарський засіб виготовлявся і вводився як визначено і містив кристалічну форму (ICH, Q6A: Test Procedures and Acceptance Criteria for New Drug Products) для того щоб гарантувати, що біодоступність, стабільність і механічні властивості лікарського засобу залишаться постійними під час виробництва. Кристалізація співкристалу лимонної кислоти і N-[2-(7-метокси-1-нафтил)етил]ацетаміду як описано в Прикладах 1, 2 і 3 демонструє його схильність до кристалізації як постійної і чистої кристалічної фази. Крім того, висока температура плавність і термічна стабільність співкристалу забезпечує висушування з мінімальними обмеженнями. 4 UA 111844 C2 Співкристал бензолсульфонової кислоти і N-[2-(7-Метокси-1-нафтил)етил]ацетаміду, що має емпіричну формулу C15H17NO2.C6H6SO3, характеризується порошковою рентгенограмою наведеною на Фіг. 5 з основними пікамии наведеними в Таблиці 2. Таблиця 2 Таблиця піків дифракції для співкристалу агомелатину з бензолсульфоновою кислотою. Кут дифракції (°2θ) 6,11 11,37 12,23 13,79 14,27 15,33 16,45 17,61 18,45 18,83 20,90 21,11 21,47 22,85 23,81 24,17 24,58 26,69 28,86 29,62 30,85 31,65 32,59 d-відстань [Å] 14,454 7,779 7,229 6,418 6,200 5,774 5,386 5,031 4,806 4,709 4,246 4,206 4,136 3,890 3,734 3,680 3,619 3,338 3,091 3,014 2,896 2,825 2,745 Відносна інтенсивність (%) 35,8 26,5 18,3 22,0 31,0 9,9 15,4 14,2 42,8 100,0 11,6 15,5 44,0 16,0 18,4 10,8 71,5 12,0 4,4 2,9 12,0 6,8 5,6 5 10 15 Цей співкристал бензолсульфонової кислоти і N-[2-(7-метокси-1-нафтил)етил]ацетаміду також характеризується термограмою диференціальної скануючої калориметрії (ДСК) показаною на Фіг. 6, що має ендотермічну подію, що відповідає плавленню з початковою температурою приблизно 128 °C. Цей співкристал бензолсульфонової кислоти і N-[2-(7-метокси-1-нафтил)етил]-ацетаміду також характеризується спектром Рамана показаним на Фіг. 7, що має характеристичні піки -1 приблизно при 3073, 1585, 1163, 1130, 1025, 997, 727, 615 і 320 см . Співкристал малеїнової кислоти і N-[2-(7-Метокси-1-нафтил)етил]ацетаміду має емпіричну формулу C15H17NO2.C4H4O4, що характеризується порошковою рентгенограммою показаною на Фіг. 8 з основними піками приведеними в Таблиці 3. 5 UA 111844 C2 Таблиця 3 Кут дифракції (°2θ) 8,76 11,53 15,69 16,14 17,39 17,86 18,23 18,96 19,93 21,97 22,51 23,01 23,71 24,18 24,54 26,05 26,42 27,22 30,18 32,34 5 10 15 20 25 30 d-відстань [Å] 10,081 7,667 5,645 5,486 5,095 4,962 4,863 4,678 4,450 4,042 3,947 3,861 3,749 3,678 3,625 3,417 3,371 3,274 2,959 2,766 Відносна інтенсивність (%) 6,2 50,5 100,0 20,2 53,3 11,9 13,4 23,4 5,0 10,3 5,3 10,2 6,3 13,6 30,2 14,3 39,5 6,5 19,5 4,1 Цей співкристал малеїнової кислоти і N-[2-(7-Метокси-1-нафтил)етил]ацетаміду також характеризується термограмою диференціальної скануючої калориметрії (ДСК) показаною на Фіг. 9, що має ендотермічну подію, що відповідає плавленню з початковою температурою приблизно 64 °C. Цей співкристал малеїнової кислоти і N-[2-(7-Метокси-1-нафтил)етил]ацетаміду також характеризується спектром Рамана показаним на Фіг. 10, що має характеристичні піки при 2989, 2945, 1675, 1634, 1445, 1422, 1378, 1350, 1309, 1221, 1186, 1098, 1033, 964, 912, 883, 794, 661, -1 611, 534, 440, 401, 345 і 267 см . Порошкові рентгенограми знімали використовуючи лабораторний дифрактометр X´PERT PRO MPD PANalytical, що працює в дифракційному режимі θ - θ з випромінюванням міді CuK (λ=1,542 Å, 45 кВ/40 мA), графітовий монохроматор, з інтервалом 2тета 2 – 40° 2θ, з розміром кроку 0,01° 2θ і часом на стадію 50 с. Первинні оптичні налаштування: щілина Соллера 0,02 рад, автоматичний PDS, 10 мм маска, 1/4° антирозсіювальна щілина, площа опромінюваного зразка 10 мм. Вторинні оптичні налаштування: 5,0 мм антирозсіювальна щілина, щілина Соллера 0,02 рад, детектор X´Celerator з максимальною активною довжиною. Зразки вимірювали планшетному тримачі з діоксиду кремнію. Всі ДСК термограми приведені тут отримували при швидкості сканування 10 °C/хв. Співкристали згідно з винаходом можна одержати шляхом розчинення агомелатину з утворювачем співкристалу в придатному розчиннику або суміші розчинників і охолодженні одержаного розчину або випарюванні розчинника. Останній спосіб особливо корисний для одержання першої порції кристалічного матеріалу, що може бути використаний для затравлювання наступних порцій. Додавання кристалу затравки є переважним, але не єдиним способом для стимулювання кристалізації співкристалів згідно з винаходом в промислових масштабах. Також успішно може використовуватись стимулювання кристалізації, використовуючи опромінення ультразвуком. В переважному способі, агомелатин розчиняють в розчиннику, що переважно вибирають з C3-C8 кетонів, таких як ацетон, бутанон, циклогексанон або ацетофенон, C1-C8 спирти або етер-спирти, такі як метанол, етанол, 1- або 2-пропанол, 1-бутанол, 2-бутанол, ізотиловий спирт, 2-метил-2-пропанол, аліловий спирт, циклогексанол, бензиловий спирт, 2-метоксиетанол або тетрагідрофурфуриловий спирт, циклічні C5-C6 етери, такі як тетрагідрофуран, метилтетрагідрофуран або діоксан, C3-C8 естери, такі як етилацетат або бутилацетат, C2-C8 нітрили, такі як ацетонітрил, пропіонітрил або бензонтірил, і змішування з розчином вибраного 6 UA 111844 C2 5 10 15 20 25 30 35 40 45 50 55 60 утворювача співкристалу в тому ж самому або іншому розчиннику, ніж розчинник використовуваний для агомелатину, де розчинник переважно вибирають з C1-C5 спиртів або етер-спиртів, як згадано вище, води і сумішей C1-C5 спиртів або етер-спиртів з водою. Переважно змішування проводять при температурі від 20 °C до температури кипіння із зворотнім холодильником одержаної суміші, більш переважно при температурі в інтервалі від температури, що є на 25 K нижчою, ніж температура кипіння одержаної суміші, до температури кипіння одержаної суміші. Одержану суміш можна безпосередньо охолодити до температури від температури змішування до температури плавлення розчинника або суміші розчинників, або частково упарюють і потім охолоджують. Переважна температура кристалізації є від -5 °C до 15 °C, більш переважно в інтервалі 0 - 5 °C. Необов‘язково, кристалізацію викликають додаючи антирозчинник до кристалізаційної суміші, переважно після охолодження до вибраної температури кристалізації і/або внесення затравки. Переважними антирозчинниками є C4-C8 аліфатичні етери, такі як діетиловий етер, метил-трет-бутиловий етер, діізопропіловий етер або анізол, і C6-C10 вуглеводні, такі як циклогексан, метилциклогексан, толуол або тетрагідронафталін. Перелік фігур Фіг. 1: Порошкова рентгенограма співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і лимонної кислоти. Фіг. 1a: Кристалічна структура співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і лимонної кислоти одержана за допомогою SXRD (рентгенограма одного кристалу). Окрема комірка (зліва), упакування (справа). Фіг. 1b: Порівняння порошкової рентгенограми розрахованої з SXRD структури і експериментальної порошкової рентгенограми. Фіг. 2: ДСК співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і лимонної кислоти. Фіг. 3: Спектр Рамана співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і лимонної кислоти. Фіг. 4: Ізотермічний графік ДСП для співкристалу агомелатину і лимонної кислоти. Фіг. 5: Порошкова рентгенограма співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і бензолсульфонової кислоти. Фіг. 6: ДСК співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і бензолсульфонової кислоти. Фіг. 7: Спектр Рамана співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і бензолсульфонової кислоти. Фіг. 8: Порошкова рентгенограма співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і малеїнової кислоти. Фіг. 9: ДСК співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і малеїнової кислоти. Фіг. 10: Спектр Рамана співкристалу N-[2-(7-Метокси-1-нафтил)етил]ацетаміду і малеїнової кислоти. Показові приклади одержання сполук винаходу приведені нижче. Приведені приклади не обмежують рамки винаходу. Приклади Приклад 1: Загальна методика одержання співкристалів 2-(7-метокси-1нафтил)етил]ацетаміду 500 мг N-[2-(7-метокси-1-нафтил)етил]ацетаміду розчиняли в 5 мл метанолу при кімнатній температурі і додавали один стехіометричний еквівалент утворювача співкристалу, що вибирають з лимонної, бензолсульфонової або малеїнової кислоти, як розчин в метанолі. Розчин нагрівали до температури від кімнатної до температури кипіння із зворотнім холодильником длягарантування повного розчинення і розчинник залишали випаровуватись при кімнатній температурі для кристалізації співкристалів N-[2-(7-Метокси-1нафтил)етил]ацетаміду з утворювачем співкристалів. Приклад 2: Одержання співкристалу N-[2-(7-метокси-1-нафтил)етил]ацетаміду і лимонної кислоти (спосіб A). 100 г N-[2-(7-Метокси-1-нафтил)етил]ацетаміду суспендували в 400 мл етилацетату при кімнатній температурі і нагрівали при температурі кипіння із зворотнім холодильником до розчинення всієї твердої речовини. Розчин охолоджували до 60° C і додавали розчин 78,9 г безводної лимонної кислоти, розчиненої в 300 мл метанолу. Розчин концентрували перегонкою до приблизно половини його об'єму, потім охолоджували до температури в інтервалі 2-5 °C і додавали 140 мг кристалів затравки, одержаних упарюванням метанольного розчину агомелатину і лимонної кислоти. Спостерігали утворення осаду і утворювалась густа біла суспензія протягом перемішування 1 годину. Білу тверду речовину виділяли фільтруванням і 7 UA 111844 C2 5 10 15 20 25 30 35 40 45 50 55 промивали 100 мл етилацетату, кінцевий вихід сухого матеріалу був 97 г (54%) і чистота агомелатину в твердій речовині була 99,6 % з домішками не вище 0,4% згідно з НЕРХ. Виділена тверда речовина мала порошкову рентгенограму показану на Фіг. 1, термограму ДСК показану на Фіг. 2 з початком плавлення приблизно при 123,5 °C і спектр Рамана показаний на Фіг. 3. Приклад 3: Одержання співкристалу N-[2-(7-метокси-1-нафтил)етил]ацетаміду і лимонної кислоти (спосіб B). 100 г N-[2-(7-метокси-1-нафтил)етил]ацетаміду розчиняли в 240 мл ацетону при 60 °C одержуючи прозорий жовтий розчин. Додавали суспензію 78,9 г лимонної кислоти в 300 мл ацетону при 40 °C одержуючи прозорий жовтий розчин. Розчин концентрували перегонкою до приблизно половини його початкового об‘єму і охолоджували до приблизно 2-5 °C. Приблизно 2 мл фракцію видаляли і поміщали в ультразвукову баню, викликаючи кристалізацію. Мутну фракцію повертали до маткового розчину і проводили 1 годинну кристалізацію, одержуючи білу суспензію. Суспензію витримували при перемішуванні при кімнатній температурі 48 годин і білу тверду речовину виділяли фільтруванням і промивали холодним діетиловим етером і потім сушили при 40 °C при тиску 150 мбар 20 годин. Кінцевий вихід сухого матеріалу був 148 г (83%) і чистота агомелатину в твердій речовині була 99,9 % з домішками не вище 0,1% згідно з НЕРХ. Виділена біла тверда речовина (маленькі подовжено-пластинчасті кристали) мала порошкову рентгенограму сумісну з показаною на Фіг. 1 і термограму ДСК сумісну з показаною на Фіг. 2 з початком плавлення приблизно при 123,5 °C. Приклад 4: Стабільність співкристалу N-[2-(7-метокси-1-нафтил)етил]ацетаміду і лимонної кислоти в суспензії. Зразки співкристалу агомелатину і лимонної кислоти витримували як суспензії в ряді органічних розчинників, що включають спирти, кетони, естери, алкани і ароматичні вуглеводні при температурі 30 °C протягом одного тижня. Аналіз виділених твердих речовин за допомогою спектроскопії Рамана, показав, що кристалічна фаза в основному стабільна в ряді розчинів. Приклад 5: Термічна стабільність співкристалу N-[2-(7-метокси-1-нафтил)етил]ацетаміду і лимонної кислоти. Зразок співкристалу агомелатину і лимонної кислоти нагрівали до 90 °C в скляному капілярі 7 годин. Аналіз виділеної твердої речовини за допомогою порошкової рентгенографії показав присутність чистої кристалічної фази співставимої з співкристалом агомелатину і лимонної кислоти. Приклад 6: Гігроскопічність і стійкість до вологи співкристалу N-[2-(7-метокси-1нафтил)етил]ацетаміду і лимонної кислоти. Зразок співкристалу агомелатину і лимонної кислоти піддавали аналізу ДСП (Диференційна Сорбція Пари). Зразок поміщали на мікроваги в камері з контрольованою вологою і піддавали дії двох циклів підвищення вологи (червона і зелена лінії) і двом циклам зменшення вологи (синя і пурпурова лінії) як показано на Фіг. 4. Можна бачити, що зразок, по суті, не гігроскопічний в інтервалі 20-80% ВВ, оскільки зміна маси є менше ніж 0,2%. Приклад 7: Швидкість вивільнення агомелатину в розчин з співкристалу з лимонною кислотою Зразок співкристалу агомелатину і лимонної кислоти суспендували у воді і тверду речовину аналізували за допомогою спектроскопії Рамана з 20 хв. інтервалами. Негайно після додавання до води виявляли смуги, що відповідають лимонній кислоті співкристалу, що вказують на те що лимонна кислота розчиняється у воді, в той час як смуги, що відповідають агомелатину вказують на зміну в присутній кристалічній фазі. Через 20 хвилин спектр Рамана показав майже повне розчинення лимонної кислоти з твердої фази агомелатинового компонента, що все же змінювався. Через 40 хвилин не спостерігали ніяких змін, що вказувало на те що вільний агомелатин стабілізувався в суспензії. Приклад 8: Одержання співкристалу N-[2-(7-метокси-1-нафтил)етил]ацетаміду і бензолсульфонової кислоти. 1 г N-[2-(7-метокси-1-нафтил)етил]ацетаміду розчиняли в 15 мл етилацетату при кімнатній температурі і додавали розчин 0,78 г бензолсульфонової кислоти в 1 мл метанолу. Спостерігали негайне утворення маленьких кристалів, розчин охолоджували до 2 °C і додавали 5 мл циклогексану як антирозчинник, для поліпшення виходу. Кристалічний продукт (світлокоричневі пластинчасті кристали) виділяли фільтруванням. Виділена тверда речовина мала порошкову рентгенограму показану на Фіг. 5, термограму ДСК показану на Фіг. 6 з початком плавлення приблизно при 128,5 °C і спектр Рамана показаний на Фіг. 7. 8 UA 111844 C2 5 10 15 20 25 30 Приклад 9: Одержання співкристалу N-[2-(7-метокси-1-нафтил)етил]ацетаміду і малеїнової кислоти. 1 г N-[2-(7-Метокси-1-нафтил)етил]ацетаміду розчиняли в 15 мл етилацетату при кімнатній температурі і додавали розчин 0,574 г малеїнової кислоти в 2 мл метанолу. Розчин повільно концентрували, одержуючи жовту олію, що кристалізувалась протягом тижня. Виділена тверда речовина (майже білі мікрокристали) мала порошкову рентгенограму показану на Фіг. 8, термограму ДСК показану на Фіг. 9 з початком плавлення приблизно при 65,5 °C і спектр Рамана показаний на Фіг. 10. ФОРМУЛА ВИНАХОДУ 1. Співкристал N-[2-(7-метокси-1-нафтил)етил]ацетаміду відомого як агомелатин з утворювачем співкристала, вибраним з групи, що містить лимонну кислоту і бензолсульфонову кислоту. 2. Співкристал N-[2-(7-метокси-1-нафтил)етил]ацетаміду з лимонною кислотою за пунктом 1, який відрізняється тим, що має одну або більше наступних ознак: i) порошкова рентгенограма з основними піками із значеннями 2-тета 5,2; 12,2; 17,0; 19,3; 20,6; 22,7 і 27,3 ± 0,2°; ii) температура плавлення в інтервалі 123-127°C; -1 iii) піки раманівського розсіювання з хвильовими числами 2963, 1749, 1681, 944, 783 см . 3. Співкристал N-[2-(7-метокси-1-нафтил)етил]ацетаміду з бензолсульфоновою кислотою за пунктом 1, який відрізняється тим, що має одну або більше наступних ознак: i) порошкова рентгенограма з основними піками із значеннями 2-тета 11,5, 15,7, 17,4, 19,0, 24,5 і 26,4 ± 0,2°; ii) температура плавлення в інтервалі 128-132°C; -1 iii) піки раманівського розсіювання з хвильовими числами 3073, 1585, 1163, 997, 727 см . 4. Спосіб одержання співкристала, описаного в будь-якому з пунктів 1-3, що включає розчинення N-[2-(7-метокси-1-нафтил)етил]ацетаміду в розчиннику або суміші розчинників, вибраних з групи, що містить C3-C8 кетони, C1-C8 спирти або ефір-спирти, циклічні C5-C6 прості ефіри, C3-C8 складні ефіри та C2-C8 нітрили, з утворювачем співкристала і кристалізацію бінарного співкристала при охолодженні розчину або випарюванні розчинника. 5. Спосіб за пунктом 4, який відрізняється тим, що до розчину додають співкристал як затравку. 9 UA 111844 C2 10 UA 111844 C2 11 UA 111844 C2 12 UA 111844 C2 13 UA 111844 C2 14 UA 111844 C2 Комп’ютерна верстка О. Гергіль Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutically acceptable cocrystals of n-[2-(7-methoxy-1-naphtyl)ethyl]acetamide and methods of their preparation
Автори англійськоюMiller, Gary James, Ridvan, Ludek, Richter, Jindrich, Dammer, Ondrej, Chvojka, Tomas, Pekarek, Tomas, Heyse, Winfried, Nagel, Norbert
Автори російськоюМиллер Гэри Джэймс, Ридван Людэк, Рихтер Индржих, Даммер Онджей, Хвойка Томаш, Пекарек Томаш, Хейзе Винфрид, Нагель Норберт
МПК / Мітки
МПК: C07C 233/18, C07C 309/29, C07C 59/265, A61P 25/24, A61K 31/185, A61K 31/165, A61K 31/194, C07C 57/145
Мітки: співкристали, фармацевтично, n-[2-(7-метокси-1-нафтил)етил]ацетаміду, способи, прийнятні, одержання
Код посилання
<a href="https://ua.patents.su/17-111844-farmacevtichno-prijjnyatni-spivkristali-n-2-7-metoksi-1-naftiletilacetamidu-i-sposobi-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтично прийнятні співкристали n-[2-(7-метокси-1-нафтил)етил]ацетаміду і способи їх одержання</a>
Попередній патент: Протимікробні сполуки і спосіб їх застосування (варіанти)
Наступний патент: Екзополісахарид бактерії shigella sonnei, спосіб його одержання та вакцина і фармацевтична композиція, що його містять
Випадковий патент: Склад цукру з функціональними властивостями любистку