Заміщені похідні (1,3-біс(циклогексилметил-1,2,3,6-тетрагідро- 2,6-діоксо-9н-пурин-8-іл)фенілу та фармацевтична композиція на їх основі
Номер патенту: 57767
Опубліковано: 15.07.2003
Автори: Делудж Сюзан Мері, Лівінгстон Даглас Алан, Волберг Джеральд
Формула / Реферат
1. Заміщені похідні (1,3-біс(циклогексилметил)-1,2,3,6-тетрагідро-2,6-діоксо-9Н-пурин-8-іл)фенілу формули (І)
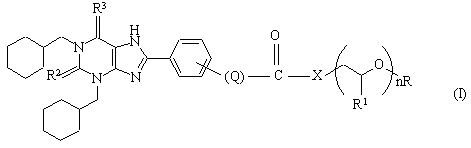
або їх сольвати, де
Х - -О- чи -NH-,
Q - (-СН2-)р, (-СН=СН-)р, або (-С=С-)р, де р приймає значення від 0 до 4,
R1 - гідроген чи метил, R2 та R3, незалежно, - О чи S,
n приймає значення від 1 до 50, а
R - гідроген чи метил.
2. Сполука за п.1, яка відрізняється тим, що Х - -О- чи -NH-, a R1 - гідроген.
3. Сполука за п.1 чи 2, яка відрізняється тим, що n приймає значення від 8 до 20.
4. Сполука за п.3, яка відрізняється тим, що n приймає значення від 8 до 15.
5. Сполука за будь-яким з пп.1-4, яка відрізняється тим, що R3 - О, а R2 - О чи S.
6. Сполука за п.5, яка відрізняється тим, що R2 та R3 - О.
7. Сполука за будь-яким з пп.1-6, яка відрізняється тим, що р дорівнює 0 чи 1.
8. Сполука за будь-яким з пп.1-7, яка відрізняється тим, що Q - (-СН=СН-)р.
9. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що замісник
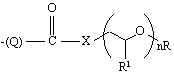
приєднаний до фенільного кільця в пара-положенні.
10. Заміщені похідні (1,3-біс(циклогексилметил)-1,2,3,6-тетрагідро-2,6-діоксо-9Н-пурин-8-іл)фенілу формули (Іа)
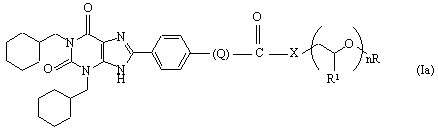
або їх сольвати, де
Х - -О- чи -NH-,
![]()
де р приймає значення від 1 до 4,
R1 - гідроген чи метил,
n приймає значення від 1 до 50, а
R - гідроген чи метил.
11. Сполука за п.1, яка відрізняється тим, що нею є
естер декаетиленглікольметилового етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6-тетрагідро-2,6-діоксо-9Н-пурин-8-іл)цинамової кислоти, та
естер нонаетиленглікольметилового етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6-тетрагідро-2,6-діоксо-9Н-пурин-8-іл)цинамової кислоти,
естер нонаетиленглікольметилового етеру та (Е)-3-(1,3-біс(циклогексилметил)-1,2,3,6-тетрагідро-2,6-діоксо-9Н-пурин-8-іл)цинамової кислоти,
нонаетиленглікольметилетерамід (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6-тетрагідро-2,6-діоксо-9Н-пурин-8-іл)цинамової кислоти,
естер нонаетиленглікольметилового етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6-тетрагідро-2,6-діоксо-9Н-пурин-8-іл)бензойної кислоти, або їх сольвати.
12. Сполука за будь-яким з пп.1-11 або її фармацевтично прийнятний сольват, яка відрізняється тим, що її призначено для використання в терапії.
13. Фармацевтична композиція, що включає активний компонент та фармацевтично прийнятний розріджувач чи носій, яка відрізняється тим, що як активний компонент вона містить сполуку або її фармацевтично прийнятний сольват за будь-яким з пп.1-11.
Текст
9 Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що замісник О до фенільного кільця в пара Заміщені ПОХІДНІ (1,3-біс(циклогексилметил) 1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8-іл)фенілу формули (Іа) ПОХІДНІ (1,3 біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)фенілу формули (І) R3 ( Q ) — С — X або їх сольвати, де Х-Ю-чи-NH-, Q - (-СН2-)Р, (-СН=СН-)Р, або (-С=С-)Р, де р приймає значення від 0 до 4, R1 - гідроген чи метил, R2 та R3, незалежно, - О чи S, п приймає значення від 1 до 50, а R - гідроген чи метил 2 Сполука за п 1, яка відрізняється тим, що X - О- чи -NH-, a R1 - гідроген 3 Сполука за п 1 чи 2, яка відрізняється тим, що п приймає значення від 8 до 20 4 Сполука за п 3, яка відрізняється тим, що п приймає значення від 8 до 15 5 Сполука за будь-яким з пп 1-4, яка відрізняється тим, що R3 - О, a R2 - О чи S 6 Сполука за п 5, яка відрізняється тим, що R2 та R3-0 7 Сполука за будь-яким з пп 1-6, яка відрізняється тим, що р дорівнює 0 чи 1 8 Сполука за будь-яким з пп 1-7, яка відрізняється тим, що Q - (-СН=СН-)Р або їх сольвати, де Х-Ю-чи-NH-, Q-(-CH 2 -) p ,(-CH = CH-) p ,(-C = C-) p , де р приймає значення від 1 до 4, R1 - гідроген чи метил, п приймає значення від 1 до 50, а R - гідроген чи метил 11 Сполука за п 1, яка відрізняється тим, що нею є естер декаетиленглікольметилового етеру та (Е)4-(1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти, та естер нонаетиленглікольметилового етеру та (Е)4-(1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти, естер нонаетиленглікольметилового етеру та (Е)3-(1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти, нонаетиленглікольметилетерамід (Е)-4-(1,3біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)цинамовоі кислоти, естер нонаетиленглікольметилового етеру та (Е)4-(1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро2,6-дюксо-9Н-пурин-8-іл)бензойноі кислоти, або їх сольвати 12 Сполука за будь-яким з пп 1-11 або и фармацевтично прийнятний сольват, яка відрізняється тим, що и призначено для використання в терапії 13 Фармацевтична композиція, що включає акти О і (О ю З 57767 4 вний компонент та фармацевтично прийнятний фармацевтично прийнятний сольват за будь-яким розріджувач чи носій, яка відрізняється тим, що з пп 1-11 як активний компонент вона містить сполуку або її Згідно З винаходом запропоновані комплексні естери та аміди феніл-ксантинових похідних, спосіб їх виготовлення, фармацевтичні композиції, що їх містять, та їх використання у медицині, зокрема при профілактиці та лікуванні септичного шоку, запальних станів, а також імунних розладів Септичний шок викликають багато чинників, включаючи багато різних шляхів та посередників виникнення хворобливого стану (див , наприклад, The Lancet, а також Annals of Internal Medicine, Vol 115 (1991) p 457 - 469), що включають серед іншого продукти метаболізму арахідонової кислоти та агрегацію тромбоцитів Адгезія циркулюючих лейкоцитів до ендотелію судин є критичним випадком у патогенезі запального відклику Запальні та імунні посередники можуть стимулювати адгезійний процес збільшенням адгезійної здатності лейкоцитів або ендотеліальних клітин шляхом активації, перерегуляцм або індукування різних адгезійних молекул на поверхні клітин Існуючі придатні антизапальні засоби мають обмежену ефективність, часто разом з побічною дією Викликані в експерименті для антіадгезійної терапії моноклональні антитіла теоретично мають недоліки при лікуванні хронічних захворювань Тому пошук та дослідження невеликих молекул, що специфічно блокують чи інгібують адгезійну взаємодію лейкоцитів та ендотелію є притягальними для застосування в терапії У заявці РСТ № GB 9501808 описана сполука формули раціях, і які тому показані для лікування запальних станів та імунних розладів Згідно З винаходом запропонована сполука формули (І) X Н R' або її сольвати, де Х-Ю-чи-NH-, Q - С-СН2-)Р, С-СН=СН-)р, або (-С=С-)р, де р приймає значення від 0 до 4, R1 - гідроген чи метил, R2 та R3, незалежно, - О чи S, п приймає значення від 1 до 50, а R - гідроген чи метил Згідно З подальшим аспектом винаходу запропонована вищеозначена сполука формули (І), в якій X - -О- чи -NH-, a R1 - гідроген, з цих сполук кращі ті, в яких п приймає значення від 8 до 20, а найкращі ті, в яких п приймає значення від 8 до 15 Звичайно, R3 - О, a R2 - О чи S, але краще, коли R2 та R3 обидва - О Згідно З подальшим аспектом винаходу Р, переважно, приймає значення від 0 чи 1 Згідно З подальшим аспектом винаходу запропонована вищеозначена сполука формули (І), в якій Q - (-СН=СН-)р краще, коли замісник О -{Q)-C~X Q)-COOH де m та п, незалежно, приймають значення від Одо 10, Хта Y, незалежно, - оксиген чи сульфур, (-Q-)-(-CH2-)p або (-СН=СН-)Р, де р приймає значення від 1 до 4, а А та В, незалежно, - метил, розгалужений Сз єалкіл, Сз 8-Циклоалкіл, або Сз s-циклоалкеніл, а також и солі, сольвати та фармацевтичне прийнятні естери та аміди, та їх використання при лікуванні септичного шоку, алергічних та запальних станів Було визначено, що сполуки інгібують один чи більше з ферментів 5-ліпоксигенази, циклооксигенази та лізо-PAF ацетил-СОАацетилтрансферази Нами несподівано виявлена серія комплексних естерів та амідів вибраних фенілксантинових похідних, що інгібують експресію адгезійних молекул на моношарах ендотеліальних клітин пуповинної вени людини (ЕКПВЛ) при дуже низьких концент 1 приєднанийR до к фенільного кільця в параположенні Винахід включає також суміші сполук формули (І), наприклад, такі, в яких п варіює в такому зразку, в будь-якому співвідношенні Особливою підгрупою є сполуки формули (Іа) (Q) С або и сольвати, де Х-Ю-чи-NH-, Q - С-СН2-)Р, С-СН=СН-)р, (-СЕС-)Р, де р приймає значення від 1 до 4, R1 - гідроген чи метил, п приймає значення від 1 до 50, а R - гідроген чи метил Особливо переважні сполуки згідно з винаходом включають Естер декаетиленглікольметилового етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі ки 57767 дина Згідно З винаходом запропоновано також слоти, використання сполуки формули (І) чи и фармацевЕстер нонаетиленглікольметилового етеру та тично прийнятного сольвату для профілактики та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6лікування септичного шоку у такого ссавця, як лютетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі кидина слоти, КІЛЬКІСТЬ сполуки формули (І) чи и фармацевЕстер нонаетиленглікольметилового етеру та тичне прийнятного сольвату, потрібна для досяг(Е)-3-(1,3-біс(циклогексилметил)-1,2,3,6нення бажаної біологічної дії, залежить від ряду тетрапдро-2,6-дюксо-9Н-пурин-8-т)цинамовоі кисфакторів, як-то и призначення, спосіб вживання та лоти, реципієнт Типова добова доза для лікування сепНонаетиленглікольметиловий етер-амід (Е)-4тичного шоку, наприклад, може бути в межах 0,005 (1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6- 100мг/кг, краще - 0,5 - 100мг/кг, а найкраще - 0,5 дюксо-9Н-пурин-8-іл)цинамовоі кислоти, та 20мг/кг Цю дозу можна вживати як разову, чи як Естер нонаетиленглікольметилового етеру та кілька окремих разових доз, або постійною інфузі(Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6єю Внутрішньовенна доза може бути в межах тетрапдро-2,6-дюксо-9Н-пурин-8-іл)бензойноі кис0,0025 - 200мг/кг, звичайно, з застосуванням інфулоти, або їх сольвати Сполуки згідно з винаходом зією Аналогічні дози можуть бути придатними при можуть бути геометричними чи оптичними ізомелікуванні інших хворобливих станів Для легеневорами Усі ЦІ ізомери, поодинці чи у суміші, включего вживання суб'єктом в аерозолі потрібна така ні в рамки винаходу Коли Q містить подвійний КІЛЬКІСТЬ використуваної сполуки, щоб досягти дозв'язок, кращими є Е-ізомери статньої концентрації в рідині на поверхні дихальЯк згадано вище, сполуки формули (І) та їх них шляхів суб'єкту приблизно 2 - ЮООцмоль сольвати використовують при профілактиці та лікуванні запальних станів та імунних розладів, що продемонстровано далі у біологічних випробуваннях, в яких представлені сполуки згідно з винаходом виявили активність Прикладами запальних станів та імунних розладів є ураження легенів, суглобів, очей, кишечнику, шкіри та серця, особливо ті, що асоційовані з проникненням лейкоцитів у нетекучі тканини Стани легенів включають астму, респіраторний дистрес-синдром дорослих, бронхіт та кистозний фіброз (який може додатково чи альтернативно включати тканини кишечнику та ІНШІ) Стани суглобів включають ревматоїдний артрит, ревматоїдний спондиліт, остеоартрит, подагричний артрит та ІНШІ артритні стани Запальні стани очей включають увеїт (включаючи ірит) та кон'юнктивіт Запальні стани кишечнику включають хворобу Крона, виразковий коліт та дистальний проктит Захворювання шкіри включають такі, що асоційовані з клітинною проліферацією, як псоріаз, екзема та дерматити (алергічного походження чи ні) Серцеві стани включають пошкодження від коронарного інфаркту Інші запальні стани та імунні розлади включають тканинний некроз при хронічному запаленні, ендотоксичний шок, проліфераційні розлади гладких м'язів (наприклад, рестеноз після анпопластики), а також відторгнення тканини після пересадки трансплантанту Згідно З винаходом, ВІДПОВІДНО, запропоновано спосіб профілактики та лікування запальних станів та імунних розладів у такого ссавця, як людина, який включає вживання терапевтичне ефективної КІЛЬКОСТІ сполуки формули (І) чи и фармацевтичне прийнятного сольвату Згідно з винаходом запропоновано також спосіб профілактики та лікування септичного шоку у такого ссавця, як людина, який включає вживання терапевтично ефективної КІЛЬКОСТІ сполуки формули (І) чи и фармацевтичне прийнятного сольвату З іншого боку, запропоноване використання сполуки формули (І) чи її фармацевтичне прийнятного сольвату для використання у терапії, особливо, для профілактики та лікування запальних станів та імунних розладів у такого ссавця, як лю Отже, згідно з подальшим аспектом винаходу запропонована фармацевтична композиція, що містить як активній інгредієнт сполуку формули (І) або и фармацевтичне прийнятні сіль чи сольват разом з щонайменше одним фармацевтичним носієм чи реципієнтом Такі фармацевтичні композиції можна використовувати при профілактиці та лікуванні станів, як-то септичного шоку, запальних станів, а також імунних розладів Носій повинен бути для реципієнта фармацевтичне прийнятним та сумісним з іншими інгредієнтами композиції, тобто не викликати відносно них шкідливого впливу Носій Є переважно твердим чи рідким і його звичайно сформовано в разову дозу, наприклад, таблетку, що може містити 0,05 -95% за масою активного інгредієнту За бажанням, у фармацевтичну композицію згідно з винаходом запропоновано можна також ввести ІНШІ фізіологічно активні інгредієнти Можливі КОМПОЗИЦІЇ включають придатні для перорального, під'язикового, защічного, парентерального (наприклад, підшкірного, внутрішньом'язового чи внутрішньовенного), ректального, місцевого, включаючи крізьшкірне, штраназального чи інгаляційного застосування Найпридатніший спосіб для конкретного пацієнта залежатиме від природи та суворості лікуємого стану, природи активної сполуки, але коли можливо, при лікуванні септичного шоку, наприклад, переважним є внутрішньовенне застосування При лікуванні таких станів, як астма, однак, переважним шляхом вживання буде пероральний або інгаляційний Придатні для перорального споживання композиції можна запропонувати дискретними, як-то таблетками, капсулами, пастилками, що містять попередньо визначену КІЛЬКІСТЬ активної сполуки, як порошки та гранули, як розчини чи суспензії у водних чи неводних розчинах, або як емульсії олія-у-воді чи вода-у-олм Придатні для під'язикового ЧИ защічного споживання композиції звичайно включають коржики, що містять активну сполуку та, звичайно, таку смакову основу, як цукор та аравійська камедь, пастилки з вмістом активної сполуки в такій інертній ос 57767 8 придатні смакові засоби Розпилювачі є комерційно доступними приДДЮ строями, що перетворюють розчин чи суспензію Придатні для парентерального споживання активного інгредієнту у туман терапевтичного аекомпозиції звичайно включають стерильні водні розолю за допомогою прискорення стисненим гарозчини з попередньо визначеною концентрацією зом, звичайно повітрям чи киснем, через звужуваактивної сполуки, розчин переважно є ІЗОТОНІЧНИМ льне трубчате сопло, або засобами з кров'ю лікуємого реципієнта Хоча такі розчини ультразвукового збудження У розпилювачі пороспоживають переважно внутрішньовенно, їх можна шок міститься у капсулах чи патронах, що зроблені також застосовувати підшкірними та внутрішньоз желатину чи пластмаси і які проколюють чи відм'язовими ІН'ЄКЦІЯМИ кривають на МІСЦІ, а порошок видувають потоком Придатні для ректального споживання компоповітря через пристрій при інгаляції або за допозиції можна запропонувати дискретними, як-то могою ручного насосу Застосований у розпилюсупозиторіями, що містять активну сполуку в одвачі порошок містить або тільки активний інгредіному чи більше носіїв, що створюють основу супоєнт, або є сумішшю активного інгредієнту, зиторію, наприклад, масло какао придатного порошкового розріджувачу, такого як Придатні для місцевого чи назального спожилактоза, та як варіант, ПАР Активний інгредієнт вання композиції включають мазі, креми, лосьйозвичайно складає 0,1 -100 від маси композиції ни, пасти, гелі, спреї, аерозолі та олії Придатними носіями для таких композицій є вазелін, ланолін, Отже, згідно з подальшим аспектом винаходу поліетиленгліколь, спирти та їх комбінації У таких запропоноване використання сполуки формули (І) композиціях активний інгредієнт звичайно присутчи и фармацевтичне прийнятного сольвату у виній у концентрації 0,1 -15% за масою робництві лікувального засобу для профілактики та лікування запальних станів, а також імунних Композиції згідно з винаходом запропоновано розладів можна виготовити всяким придатним способом, звичайно, тісним та однорідним змішуванням акСполуки згідно з винаходом можна виготовити тивної сполуки з рідким чи високодисперсним твевсяким придатним способом органічної хімії Тому рдим носієм, або обома ними, у потрібній пропорзгідно з подальшим аспектом винаходу для вигоції, а потім, за необхідністю, потрібним їх товлення сполуки формули (І) чи її сольвату, заформуванням пропонований спосіб, що включає реакцію сполуки формули Наприклад, таблетку можна виготовити пресуванням однорідної суміші порошку чи гранул активної сполуки та одного чи більше таких можливих інгредієнтів, як зв'язувальні, змащувальні засоби, інертні розріджувачі, або поверхнево-активні дис-он пергувальні засоби, або литтям однорідної суміші порошкоподібної активної сполуки та рідкого інертного розріджувачу Водні розчини звичайно виготовляють розчиабо и активованого похідного зі сполукою фоненням активної сполуки у фізіологічному розчині, рмули (III) до якого доданий циклодекстрин Придатні для застосування інгаляцією компо6 зиції включають високодисперсні пилоподібні поЛі рошки чи аерозолі, які можна отримувати різними 1 2 3 типами дозуючих аерозольних розпилювачів чи де X, Y, R, R , R , R та п визначені вище, інжекторів Для легеневого застосування через рот та як варіант, перетворення отриманої так для забезпечення доставки у бронхіальні шляхи сполуки формули (І) у іншу сполуку формули (І) чи розмір часток порошку чи крапель звичайно в меи сольват жах 0,5 - 10|JM, а краще - 1 - 5цм ДЛЯ назального Коли X - оксиген, естерифікацію можна здійсспоживання для забезпечення затримки у носовій нити стандартним способом, використовуючи, напорожнині розмір часток порошку чи крапель пеприклад, кислотний каталізатору та як варіант, у реважно в межах 10 - 500|JM такому інертному розчиннику, як бензол, толуол чи ксилол Придатні кислотні каталізатори включають Дозуючі інгалятори, що представлені аерозомінеральні, наприклад, сульфатну, пдрохлоридну льними розпилювачами під тиском, звичайно міста фосфатну кислоти, та органічні, наприклад, тять суспензію чи розчин активного інгредієнту в метансульфонову або толуолсульфонову Естезрідженому пропеленті При використанні ці пририфікацію звичайно здійснюють при підвищеній строї розпилюють композицію через клапан, що температурі, наприклад, 50 - 150°С, краще з видапристосований для подачі дозованого об'єму, звиленням утвореної води відгонкою чайно 10 - 150цл, для отримання високодисперсКоли X - -NH-, реакцію можна здійснити вигоного спрею з вмістом активного інгредієнту Притовленням спершу активованого похідного сполуки датні пропеленти включають деякі формули (II) Придатні активовані ПОХІДНІ включафлуорхлоркарбонові сполуки, наприклад, дифлуоють активовані естери або хлорангідриди, які можрдихлорметан, трихлорфлуорметан, тетрафлуорна виділити перед реакцією зі сполукою формули дихлоретан та їх суміші, Додатково композиція (III), або готувати на МІСЦІ Особливо корисні актиможе вміщувати один чи більше співрозчинників, вовані естери сполуки формули (II), що є ацилімінаприклад, таких етанольних ПАР, як олеїнова дазолами, які легко виготовити реакцією сполуки кислота, або трюлеатсорбіту, антиоксиданти та нові, як желатин та гліцерин або сахарози з каме 57767 формули (II) з ІЧМ'-карбонілдимідазолом Конверсію аісгивованого похідного сполуки формули (II) у сполуку формули (І) можна проводити в інертному розчиннику, оптимально в присутності такої ненуклеофільної основи, якт-бутоксид калію, гідрид натрію, або ненуклеофільної органічної основи, як-то 1,8-діазабіцикло[5,4,0]ундец-7-ен Сполуки формули (II) можна виготовити описаним у заявці РСТ № GB 9501808 способом Сполуки формули (III) комерційне доступні, або їх можна виготовити відомими з літератури способами, наприклад, Bartsch et al , J Org Chem 1989, 54 857-860 та J M Harris, Macromol J Sci Rev Polymer Phys Chem 1985, C25 (3) 325-373, a також S Zalopsky, Bioconjugate Chem 1995,6 150165 Інакше сполуки формули (І) можна виготовити конденсацією сполуки формули (IV) сно чи и ацетального похідного, де X, Y, R, R1 та п визначені вище, з 1,3-біс(циклогексилметил)-5юю6діамшоурацил (який можна виготовити описаним у прикладах способом) Конденсацію переважно проводять у полярному розчиннику при неекстремальній температурі, як описано у заявці РСТ № GB 9501808 Сполуки формули (IV) можна виготовити сполучанням сполуки формули (III) з прийнятою карбоновою кислотою, що (а також виготовлення карбонової кислоти) можна зробити описаним у заявці РСТ № GB 9501808 способом Перетворення сполуки формули (І) у и сольват можна здійснити відомими фахівцям способами Далі винахід описано прикладами, що є тільки ілюстративними ДОВІДКОВІ приклади Цинамовий Приклад 1 (Е)-4-(1,3-біс(циклогексилметил)1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8іл)цинамова кислота (а) (1 3-біс(циклогексилметил)сечовина Суміш циклогексанметиламшу (Aldnch, 68,66г) та 5Н гідроксиду натрію (Fisher, 200мл) енергійно перемішували при охолодженні (-10°С), швидко додаючи розчин 30г фосгену в 600мл толуолу Через 20 хвилин перемішування суміш профільтрували і твердий осад промили водою (приблизно 1500мл) та висушили при 67Па, отримавши 1,3біс(циклогексилметил)сечовину як білий порошок (72,72г, 95%), т пл 150 - 152°С, 1Н ЯМР (ДМСОde) 5 5,74 (brt, J = 5,8Гц, 2,2 NH), 2,81 (t, J = 6,3Гц, 4,2 NCH2), 1,62, 1,25 та 0,85 (усі m, 22,2 циклогексил) Аналіз розр для Ci5H28N2O С 71,38, Н 11,18, N 11,10, знайд С 71,22, Н 11,17, N 11,15 (б) б-амшо-1 3-біс(циклогексилметил)урацил 10 В 260мл оцтового ангідриду розчинили ціанооцтову кислоту (Aldnch, 21,0г) і додали цей розчин до 1,3-біс(циклогексилметил)сечовини (зі стадії (а), 54,5г), розчин при 80°С витримували протягом 2 годин під азотом Летючі продукти видалили під вакуумом, а залишкове масло сушили випарюванням порцій 10% суміші вода-етанол (3 х 400мл) Твердий залишок розчинили при 80°С в 600мл етанолу та ЗООмл води і довели рН до 10 додаванням 10% карбонату натрію Гарячий розчин розбавили 75мл води та охолодили до кімнатної температури Утворені безбарвні кристали відфільтрували, тричі по 500мл промили водою та висушили при 67Па, отримавши 6-амшо-1,3біс(циклогексилметил)урацил (64,98г, 94%), т пл 1 138-141 °С, НЯМР(ДМСО^ 6 ) 5 6,73 (brs, 2, NH2), 4,63 (s, 1, H-S), 3,67 (d, J = 7,3Гц, 2, NCH2), 3,57 (d, J = 7,3Гц, 2, NCH2), 1,55 та 1,09 (обидва m, 22, 2 циклогексил) Аналіз розр для Ci 8 H 29 N 3 O 2 С 64,07, Н 9,26, N12,45, знайд С 63,98, Н 9,27, N 12,48 (в) 6-амшо-1 3-біс(циклогексилметил)-5нітрозоурацил В 440мл оцтової кислоти, 440мл води та 440мл етанолу під зворотним холодильником розчинили 6-амшо-1,3-біс(циклогексилметил)урацил (зі стадії (б) і додали 5,65г нітриту натрію Суміш, поки вона повільно охолоджувалася до кімнатної температури, перемішували Блідо-лиловий осад відфільтрували, промили водою-етанолом 1 1 та висушили, отримавши 6-амшо-1,3біс(циклогексилметил)-5-нітрозоурацил як блідофюлетові кристали (23,46г, 86%), т пл 240 - 243°С з розкладанням з виділенням пухирців, 1Н ЯМР (ДМСО-de) 5 13,23 (br s, 1, =NOH), 9,00 (br s, 1, =NH), 3,73 (br t, J = 6,86Гц, 4, 2 NH2), 2,0 - 1,6 та 1,7-1,1 (обидва m, усього 22,2 циклогексил) Аналіз розр для Ci8H28N4O3 С 62,05, Н 8,10, N16,08, знайд 62,13, Н 8,12, N 16,0 (г) (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамова кислота Потрібну сполуку виготовили з 1,3біс(циклогексилметил)-5,6-діамшоурацилу описаним J Perutmattam, Syn Commun 1989,19 33673370 способом 1,3-біс(циклогексилметил)-5,6діамшоурацил виготовили безпосередньо перед цим струшуванням суміші 6-амшо-1,3біс(циклогексилметил)-5-нітрозоурацилу (зі стадії (в), 5,00г) у 250мл метанолу та 25мл води з 0,50г 10% паладію на вугіллі протягом 2 годин під воднем при 344,7кПа на Parr shacker Каталізатор відфільтровували (Cehte™), а безбарвний фільтрат концентрували до 25мл 4-формілцинамову кислоту (Aldnch, 2,53г, 14,35ммоль) додали до цього розчину 1,3-біс(циклогексилметил)-5,6діамшоурацилу, утворену жовту суміш концентрували і твердий жовтий залишок сушили випарюванням кількох порцій абсолютного етанолу Утворений жовтий порошок (проміжна Шифова основа) перемішували у 115мл диметоксіетану з 4,0г юду при 60°С (масляна баня) протягом 20 годин До гарячої суміші до знищення йодного забарвлення додавали насичений водний розчин тіосульфату натрію Блідо-жовтий осад відфільтрували і промили водою (приблизно 1500мл) та висушили при 12 11 57767 67Па, отримавши (Е)-4-(1,3перемішували протягом 1,75 години, а потім тричі по ЗОмл екстрагували дихлорметаном Поєднані біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6екстракти сушили сульфатом натрію та концентдюксо-9Н-пурин-8-іл)цинамову кислоту як блідо1 рували до воскоподібного продукту, який хроматожовтий порошок (6,73г, 91%), т пл >300°С, Н ЯМР графували на силікагелі С-18 з оберненою фазою (ДМСО-de) 5 13,80 та 12,40 (обидва br m, кожний (EM Separations LiCroprep RP-18) Колонку елюю1, СО2Н та NH), 8,12 (d, J = 8,3Гц, 2, 2 феніл СН), вали з градієнтом від 10% води-метанолу до чис7,84 (d, J = 8,4Гц, 2, 2 феніл СН), 7,64 (d, J = того метанолу, сирий продукт елюювали метано16,0Гц, 1, СН=), 6,64 (d, J = 16,0Гц, 1, СН=), 3,93 лом як жовтий воскоподібний продукт, який (d, J = 7,0Гц, 2, CH2N), 3,79 (d, J = 6,8Гц, 2, CH2N), суспендували у воді і випарювали воду у вакуумі, 2,0-1,4 та 1,3-0,85 (обидва br m, 22 загалом, 2 цикодержавши потрібну сполуку як жовтий воскоподіл о ге кс ил) 1 бний продукт (0,62г, 61%), т пл 147-154°С, Н ЯМР Аналіз розр для C28H34N4O4 С 68,55, Н 6,99, (ДМСО-de) 5 8,15 (d, J = 8,1Гц, 2, 2 феніл СН), N11,42, знайд С 68,45, Н 6,98, N 11,48 7,88 (d, J = 8,2Гц, 2, 2 феніл СН), 7,70 (d, J = Синтетичні приклади 16,0Гц, 1, СН=), 6,77 (d, J = 16,0Гц, 1, СН=), 4,28 Приклад 2 Естер метилтріетиленгліколевого (т, 2, СО2ОСН2), 3,91 (d, J = 7,0Гц, 2, CH2N), 3,78 етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6(d, J = 7,1 Гц, 2, CH2N), 3,68 (m, 2, CH2O), 3,6-3,38 тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі кис(m, ca 25, ca 12,5 CH2O), 3,22 (s, 3, CH3), 2,0 - 1,5 лоти та 1,3 - 0,9 (обидва br m, 22 загалом, 2 циклогекМонометилтріетиленгліколевий етер (Aldnch, сил) 80,0г) висушили випарюванням з трьома порціями ксилолу по 50мл під струмом азоту при 125°С, а Аналіз розр для C29H39N4O4(C2H4O)72*0,6H2O потім додали 4,00г (Е)-4-(1,3С 62,56, Н 8,00, N 6,69, знайд, С 62,62, Н 8,00, N 6,69 біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)цинамовоі кислоти (з приклаПриклад 4 Естер метилтетраетиленгліколеводу 1(г)) і знов висушили суміш випарюванням з го етеру та (Е)-4-(1,3-біс(циклогексилметил)ксилолу (50мл), а потім додали 0,41г сульфатної 1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8кислоти і нагріли суміш до 190°С Порціями по іл)цинамовоі кислоти 50мл додавали ксилол замість випареного Через 2,0г естеру метилполіетиленгліколевого(п = 2 години суміш знов обробили 0,2г сульфатної 7,2) етеру та (Е)-4-(1,3-біс(циклогексилметил)кислоти і через 3 години при 140°С дали охолону1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8ти до кімнатної температури, при цьому з коричнеіл)цинамовоі кислоти (з прикладу 3) розділяли на вого розчину випала велика КІЛЬКІСТЬ твердого компоненти повторним хроматографуванням на осаду Суміш розбавили 200мл хлороформу та 4 хроматотроні (Harrison Researh) Порції етерної рази по 50мл промили водою Органічний шар суміші (250 - 350)мг в етилацетаті наносили на сушили сульфатом натрію та концентрували, попередньо витриману в гексані пластинку дюксиотримавши тверду жовту речовину, яку хроматогду СИЛІЦІЮ товщиною 1мм, і елюювали етилацетарафували на силікагелі Потрібну сполуку елюютом в гексані з градієнтом 5 - 20% Фракції конкревали 1 - 4% метанолом в етилацетаті та перекристних олігомерів збирали окремо, ідентичні фракції талізовували з етилацетату додаванням гексану, з різних пластинок поєднували та концентрували одержавши потрібну сполуку як білий порошок Всі змішані фракції поєднували та рехроматогра(3,2г, 62%), т пл 189 - 192°С, 1 Н ЯМР (flMCO-d6) 5 фували Естер метилтетраетиленгліколевого (п = 8,16 (d, J = 8,0 Гц, 2,2 феніл СН), 7,88 (d, J = 8,3Гц, 7,2) етеру та (Е)-4-(1,3-біс(циклогексилметил)1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-82, 2 феніл СН), 7,70 (d, J = 16,1Гц, 1, СН=), 6,77 (d, іл)цинамовоі кислоти отримали як білий порошок J = 16,1Гц, 1, СН=), 3,92 (d, J = 6,8Гц, 2, CH2N), (0,043г), т п л 171 - 174°С, 1Н ЯМР (flMCO-d6) 5 3,78 (d, J = 6,8Гц, 2, CH2N), 3,68 (m, 2, CH2O), 3,68,18 (d, J = 8,4Гц, 2, 2 феніл СН), 7,91 (d, J = 8,4Гц, 3,5 (m, 6, 3 CH2O), 3,40 (2, CH2O), 3,23 (s, 3, CH3), 2, 2 феніл СН), 7,72 (d, J = 16,1Гц, 1, СН=), 6,80 (d, 2,0-1,5 та 1,3-0,9 (обидва br m, 22 загалом, 2 цикJ = 16,1Гц, 1, СН=), 4,30 (ш, 2, СО2ОСН2), 3,94 (d, J л о re кс ил) = 7,1 Гц, 2, CH2N), 3,80 (d, J = 7,1 Гц, 2, CH2N), 3,71 Аналіз розр для C35H48N4O7 С 66,02, Н 7,60, (m, 2, CH2O), 3,58-3,42 (m, 12, 6 CH2O), 3,24 (s, 3, N8,80, знайд С 65,91, Н 7,58, N 8,76 CH3), 2,0-1,5 та 1,3-0,9 (обидва br m, 22 загалом, 2 Приклад 3 Естер циклогексил) метилполіетиленгліколевого(п = 7,2) етеру та (Е)4-(1,3-біс(циклогексилметил)-1,2,3,6-тетрапдроАналіз розр для С29Нзб^О4(С2Н4О)4*0,6Н2О 2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти С 64,25, Н 7,75, N 8,10, знайд С 64,11, Н 7,56, N8,07 Густу суспензію у 21г монометилполіетиленгліколевого етеру (Aldnch, середня молекулярна Приклад 5 Естер метилпентаетиленгліколевомаса 350, висушений попередньо випарюванням з го етеру та (Е)-4-(1,3-біс(циклогексилметил)толуолом) 0,50г (Е)-4-(1.3-біс(циклогексилметил)1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-81,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8іл)цинамовоі кислоти іл)цинамовоі кислоти (з прикладу 1(г)) з вмістом Хроматографічним розділенням естеру ме0,051г сульфатної кислоти перемішували протягом тилполіетиленгліколевого (п = 7,2) етеру та (Е)-415 хвилин при 133Па, а потім 3 години при 190°С (1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6(масляна баня) та 133Па, при цьому тверда фаза дюксо-9Н-пурин-8-іл)цинамовоі кислоти (з прикларозчинилася з утворенням коричневого розчину ду 3, 2,0г) розділяли на компоненти як описано в Суміші дали охолонути до кімнатної температури, і прикладі 4 Потрібний продукт отримали як жовту темний розчин вилили у ЮОмл води Водну фазу воскоподібну речовину (0,092г), т пл 166 - 161 °С, 14 13 57767 Н ЯМР (ДМСО-de) 5 8,18 (d, J = 8,2Гц, 2, 2 феніл (m, 2, СО2ОСН2), 3,94 (d, J=7,0 Гц, 2, CH2N), 3,80 СН), 7,91 (d, J = 8,2Гц, 2, 2 феніл СН), 7,72 (d, J = (d, J=7,2 Гц, 2, CH2N), 3,70 (m, 2, CH2O), 3,60-3,40 16,0Гц, 1, СН=), 6,79 (d, J = 16,1 Гц, 1, СН=), 4,30 (m, 28, 14CH 2 O), 3,24 (s, 3, CH3), 2,0-1,5 та 1,3-0,9 (m, 2, СО2ОСН2), 3,94 (d, J =7,0Гц, 2, CH2N), 3,80 (обидва br m, 22 загалом, 2 цикпогексил) (d, J = 7,0Гц, 2, CH2N), 3,70 (m, 2, CH2O), 3,60-3,40 Аналіз розр для С29НзбМ4О4(С2Н4О)8*0,25Н2О (m, 16, 8CH 2 O), 3,24 (s, 3, СНз), 2,0- 1,5 та 1,3-0,9 С 62,73, Н 8,01, N 6,50, знайд С 62,65, Н 8,10, N (обидва br m, 22 загалом, 2 цикпогексил) 6,56 Приклад 9 Естер метилдекаетиленгліколевого Аналіз розр для C29H36N4O4(C2H4O)5*0,15H2O етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6С 64,38, Н 7,80, N 7,70, знайд С 64,44, Н 7,90, N тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі ки7,57 слоти Приклад 6 Естер метилгексаетиленгліколевого етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6(а) Монометилдекаетиленгліколевий етер тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі кит-Бутоксид калію (Aldnch, 95%, 239,24г) додаслоти вали порціями протягом 1,25 годин до розчину монометилтріетиленгліколевого етеру (Aldnch, Хроматографічним розділенням естеру ме300мл, 1,9моль) та 1,2-біс(2-хлоретоксі)етану (Alтилполіетиленгліколевого (п = 7,2) етеру та (Е)-4dnch, 500г), підтримуючи температуру 16 - 20°С (1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6(льодяна баня) Після видалення бані температуру дюксо-9Н-пурин-8-іл)цинамовоі кислоти (з приклапідвищували до 30°С перед подальшим охолоду 3, 2,0г) розділяли на компоненти як описано в дженням до кімнатної температури і перемішували прикладі 4 Потрібний продукт отримали як жовту при цій температурі 2 години, а потім 18 годин при воскоподібну речовину (0,092г), т пл 160 - 162°С, 1 110°С, а далі видаляли летючі продукти (2,5кПа, Н ЯМР (ДМСО-de) 5 8,18 (d, J = 8,2Гц, 2, 2 феніл 110 - 125°С) В'язкий залишок розбавляли 1,7л СН), 7,91 (d, J = 8,2Гц, 2, 2 феніл СН), 7,72 (d, J = толуолу та фільтрували крізь Cehte™ Толуол від16,0Гц, 1, СН=), 6,79 (d, J = 16,1 Гц, 1, СН=), 4,30 ганяли так, щоб температура реактору не переви(m, 2, СО2ОСН2), 3,93 (d, J = 6,8Гц, 2, CH2N), 3,80 щувала 165°С, і метилгексаетиленглікольхлорид (d, J = 7,2Гц, 2, CH2N), 3,70 (m, 2, CH2O), 3,60-3,40 виділяли фракційною перегонкою світлокоричне(m, 20, ЮСН2О), 3,24 (s, 3, CH3), 2,0-1,5 та 1,3-0,9 вого залишку (80Па, 155 - 190°С, 95,78г,16%) (обидва br m, 22 загалом, 2 цикпогексил) 1 Аналіз розр для С29НзбМ4О4(С2Н4О)б*0,20Н2О С 63,74, Н 7,88, N 7,35, знайд С 63,69, Н 7,92, N 7,34 Приклад 7 Естер метилгептаетиленгліколевого етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-1л)цинамовоі кислоти Хроматографічним розділенням естеру метилполіетиленгліколевого (п = 7,2) етеру та (Е)-4(1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)цинамовоі кислоти (з прикладу 3, 2,0г) розділяли на компоненти як описано в прикладі 4 Потрібний продукт отримали як жовту воскоподібну речовину (0,092г), т пл 154-156°С, 1 Н ЯМР (ДМСО-de) 5 8,18 (d, J = 8,4Гц, 2, 2 феніл СН), 7,91 (d, J = 8,4Гц, 2, 2 феніл СН), 7,73 (d, J = 16,0Гц, 1, СН=), 6,79 (d, J = 16,1 Гц, 1, СН=), 4,30 (m, 2, СО2ОСН2), 3,94 (d, J = 7,0Гц, 2, CH2N), 3,80 (d, J = 7,2Гц, 2, CH2N), 3,70 (m, 2, CH2O), 3,60-3,40 (m, 24, 12, CH2O), 3,24 (s, 3, CH3), 2,0-1,5 та 1,3-0,9 (обидва br m, 22 загалом, 2 цикпогексил) Аналіз розр для С29НзбМ4О4(С2Н4О)7*0,25Н2О С 63,18, Н 7,95, N 6,85, знайд С 63,15, Н 7,97, N6,93 Приклад 8 Естер метилоктаетиленгліколевого етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти Хроматографічним розділенням естеру метилполіетиленгліколєвого (п = 7,2) етеру та (Е)-4(1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)цинамовоі кислоти (з прикладу 3, 2,0г) розділяли на компоненти як описано в прикладі 4 Потрібний продукт отримали як жовту воскоподібну речовину (0,092г), т пл 150 - 151 °С, 1 Н ЯМР (ДМСО-de) 5 8,18 (d, J=8,4 Гц, 2, 2 феніл СН), 7,91 (d, J=8,6 Гц, 2, 2 феніл СН), 7,73 (d, J=16,0 Гц, 1, CH=), 6,79 (d, J=16,1 Гц, 1, CH=), 4,30 т-Бутоксид калію (Aldnch, 95%, 39,0г) додали протягом 25 хвилин до розчину тетраетиленгліколю (Aldnch, 412,7г) та 95,8г одержаного вище метил гексаетиленгліколь-хлориду при температурі 18°С (ацетоно-льодяна баня) і перемішували при 120°С протягом ночі, доводили рН до 7 додаванням 11,7мл 12Н пдрохлоридної кислоти, а далі видаляли летючі продукти (64Па, до 185°С) Темний маслоподібний залишок розбавляли 250мл толуолу, обробляли 38,1г хлориду кальцію і через 18 годин перемішування фільтрували крізь Cehte™ і концентрували до темного масла, яке фракційне переганяли з одержанням 64,4г (45%) янтарного масла Аналітичний зразок отримували хроматографією на силікагелі, елююючи 4% метанолом у 1 хлороформі з одержанням безбарвного масла Н ЯМР (ДМСО-de) 5 4,58 (t, J=5,5 Гц, 1, ОН), 3,583,38 (m, 40, 20 СН2О), 3,24 (s, 3, ОСН3) Аналіз розр для С 2 іН 44 Оц С 53,37, Н 9,38, знайд С 53,09, Н 9,47 (б) (Е)-метил[4-(диметоксиметил)цинамат] Диметилацеталь 4-формілцинамовоі кислоти (Cleeland Jr et al , патент США 3969373, 20,00г) та 12,44г карбонату калію перемішували в 190мл безводного N.N-диметилформаміду протягом 5 хвилин, додавали 12,8г метилюдиду і енергійно перемішували суміш з обережним нагріванням (масляна баня при 40°С) протягом 18 годин Летючі продукти випарювали у вакуумі і розподіляли залишок між 400мл гексану та ЮОмл води Гексановий шар сушили сульфатом магнію та випарювали, одержавши (Е)-метил[4(диметоксиметил)цинамат] як блідо-жовте масло (18,98г, 89%) 1Н ЯМР (ДМСО-сІб)підтверджує структуру Аналіз розр для Сі 3 Ні 6 0 4 С 66,09, Н 6,83, знайд С 65,96, Н 6,86 16 15 57767 (в) Естер метилдекаетиленгліколевого етеру іл)цинамовоі кислоти та 4-формілцинамовоі кислоти Розчин 4,96г ме(а) Монометилнонаетиленгліколевий етер тил [4-(диметоксиметил)цинамату] з операції (б), Суміш гексаетиленгліколю (Aldnch, 100г) та 14,87г монометилдекаетиленгліколевого етеру з бензилброміду (Aldnch, 12г) у 80мл 50% за масою операції (а) та 1,05мл ізопропоксиду титану (IV) водного гідроксиду натрію перемішували при (Aldnch) перемішували при 110°С у високому ваку100°С (масляна баня) під азотом протягом 2 годин, умі протягом 18 годин, охолоджували отримане охолоджували до кімнатної температури, розбавчорне масло до 35°С, обробляли 24,5мл 1Н пдроляли водою до об'єму 500мл та екстрагували хлоридної кислоти та тричі по ЮОмл екстрагували 200мл діетилового етеру для видалення дибензитолуолом Поєднані екстракти концентрували до лованого продукту До водного шару додавали темного масла, яке хроматографували на силіка100г хлориду натрію і 6 разів по ЮОмл екстрагувагелі, елююючи 10% метанолом у хлороформі з ли діетиловим етером Поєднані екстракти сушили одержанням 4,60г (34%) жовтого масла Н ЯМР сульфатом натрію та концентрували, одержавши (ДМСО-de) 5 10,54 (s, 1, СНО), 7,98 ( т , 4, 4 феніл 25г (20% відносно гліколю) монобензилгексаети1 СН), 7,76 (d, J=16 Гц, 1, СН=), 6,88 (d, J=16 Гц, 1, ленгліколевого етеру як масло Н ЯМР (CDCI3) 5 CH=), 4,31 ( т , 2, СО2ОСН2), 3,70 ( т , 2, СН2О), 3,51 7,30 ( т , 5, 5 феніл СН), 4,53 (s, 2, бензил СН2), ( т , 36, 18СН2О), 3,25 (s, З, ОСН3) 3,69-3,54 ( т , 22, 11 СН2О), 3,06 (br s, З, ОН та ОСНз) Аналіз розр для С іН оОіз*0,65Н 0 С 537,96, 3 5 2 Н8.05, знайд С 57,95, Н 7,95 (г) Естер метилдекаетиленгліколевого етеру та (Е)-4-(1,3-бю(циклогексилметил)-1,2,3,6тетрапдро-2,6-діоксо-9Н-пурин-8-іл)цинамовоі кислоти Потрібну сполуку виготовили з 1,3біс(циклогексилметил)-5,6-діамшоурацилу способом J Perutmattam, Syn Commun 1989,19 33673370 Згідно ЗІ способом з прикладу 1 (г) 2г 6-аміно1,3-біс(циклогексилметил)-5-нітрозоурацилу з прикладу 1 (в) перетворили у 1,3біс(циклогексилметил)-5,6-діамшоурацил, який далі комбінували з 3,62г естеру метилдекаетиленгліколевого етеру та 4-формілцинамовоі кислоти з прикладу 9(в) у 50мл етанолу Утворену жовту суміш концентрували і напівтвердий жовтий залишок сушили випарюванням кількох порцій абсолютного етанолу Утворений напівтвердий жовтий продукт (проміжна Шифова основа) перемішували у 60мл диметоксіетану з 1,6г юду (6,31 ммоль) при 50°С (масляна баня) протягом 18 годин До гарячої суміші до знищення йодного забарвлення додавали насичений водний розчин тіосульфату натрію Водну суміш концентрували до 20мл, розбавляли 50мл води та 4 рази по 50мл екстрагували хлороформом Поєднані органічні фази сушили сульфатом магнію та концентрували, одержавши твердий маслянистий продукт, який хроматографували на силікагелі, елююючи 6% метанолом у хлороформі з одержанням 3,60г жовтого масла, яке розподіляли між 150мл хлороформу та 50мл води, концентрували органічний шар і залишок масла осаджували з дихлорметану гексаном, отримавши потрібну сполуку як жовтий порошок, який промивали гексаном та сушили у вакуумі при 56°С (2,57г, 47%), т пл 143 - 145°С, 1Н ЯМР (flMCO-d6) 5 8,16 (d, J=8,4 Гц, 2, 2 феніл СН), 7,88 (d, J=8,5 Гц, 2, 2 феніл СН), 7,70 (d, J=16,0 Гц, 1, СН=), 6,78 (d, J=16,0 Гц, 1, СН=), 4,29 (m, 2, С02ОСН2), 3,92 (d, J=7,0 Гц, 2, CH2N), 3,78 (d, J=7,1 Гц, 2, CH2N), 3,69 (t, J=4,6 Гц, 2, CH2O), 3,60-3,35 (m, 36, 18 CH2O), 3,23 (s, 3, СНз), 2,0-1,5 та 1,3-0,9 (обидва br m, 22 загалом, 2 циклогексил) Аналіз розр для C49H76N4OI4 С 62,28, Н 8,10, N5,93, знайд С 62,14, Н 8,06, N 6,02 Приклад 10 Естер метилнонаетиленгдіколевого етеру та (Е)-4-(1,3-біс(циклогексилметил)1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8 Розчин 38г толуолсульфонілхлориду (Aldnch) та 16,4г монометилтріетиленгліко-левого етеру (Aldnch) у 150мл сухого піридину перемішували при 0°С (льодяна баня) 4 години, а потім 18 годин перемішували при кімнатній температурі і виливали в 500мл льодяної води та тричі по ЗООмл екстрагували діетиловим етером Поєднані екстракти промивали З Н НСІ та водою, сушили сульфатом натрію та концентрували, одержавши 20,0г (62% відносно гліколю) метилтозилтріетиленгліколевого етеру як безбарвне масло 1Н ЯМР (СОСІз) 5 7,75 (d, J=8,0 Гц, 2, 2 феніл СН), 7,30 (d, J=8,1 Гц, 2, 2 феніл СН), 4,11 (t, J=4,8 Гц, 2, CH2OS), 3,65-3,41 (m, 10, 5 CH2O), 3,32 (s, 3, OCH3), 2,40 (s, 3, бензил СНз) Розчин 22,3г отриманого раніше монобензилгексаетиленгліколевого етеру у ЮОмл безводного тетрапдрофурану додали до суспензії 3,5г 50% NaH у ЮОмл безводного тетрапдрофурану та ЗО хвилин перемішували при кімнатній температурі і краплями додали 22,0г отриманого раніше метилтозилтріетиленгліколевого етеру у ЮОмл безводного тетрапдрофурану, кип'ятили під азотом протягом ночі під зворотним холодильником, охолоджували до кімнатної температури гасили 500мл води та тричі по ЗООмл екстрагували діетиловим етером Поєднані екстракти промивали З Н НСІ та водою, сушили сульфатом натрію та концентрували, одержавши 27,0г (88%) метилбензилового етеру нонаетиленгліколю як масло 1Н ЯМР (СОСІз) 5 7,31 ( т , 5, 5 феніл СН), 4,54 (s, 2, бензил СН2), 3,62-3,52 ( т , 36, 18 СН2О), 3,35 (s, З, СНз) Розчин 22,3г отриманого раніше метилбензилового етеру нонаетиленгліколю у 200мл метанолу струшували з 1,0г 10% паладію на активованому вугіллі (Aldnch) протягом ночі під воднем при 344,7кПа в апараті Парра Каталізатор відфільтровували (Cehte™) а безбарвний фільтрат концентрували у вакуумі, одержавши 23г (74%) монометилового етеру нонаетиленгліколю як масло 1Н ЯМР (СОСІз) 5 3,67-3,47 (m, 36,18CH2O), 3,32(s, З, СНз) Аналіз розр для Ci 9 H 4 oOi 0 С 53,26, Н 9,41, знайд С 53,25, Н 9,41 (б) Естер метилнонаетиленгліколевого етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі ки 18 17 57767 слоти оранжевий воскоподібний продукт далі хроматографували на силікагелі, потрібну сполуку елююваСуміш 22,0г 4-формілцинамовоі кислоти (АІли 1 - 5% метанолом у хлороформі як жовтий восdnch), 60г (74%) монометилового етеру нонаетикоподібний продукт який розчиняли у хлороформі і ленгліколю з операції (а) та 10г толуолсульфоноосаджували додаванням гексану, одержавши пової кислоти (Aldrich), у 600мл безводного ксилолу трібну сполуку як жовтий воскоподібний продукт гріли під зворотним холодильником (масляна ба1 (6,34г, 56%), т пл 140-143°С, Н ЯМР (flMCO-d6) 5 ня) протягом 4годин, поки в пастці Дина-Старка не 8,15 (d, J=8,5 Гц, 2, 2 феніл СН), 7,88 (d, J=8,5 Гц, набиралося приблизно 2мл (НОммоль) води, кон2, 2 феніл СН), 7,70 (d, J=16,0 Гц, 1, СН=), 6,77 (d, центрували до приблизно ЮОмл, охолоджували J=16,1 Гц, 1, СН=), 4,28 (m, 2, СО2ОСН2), 3,92 (d, до кімнатної температури та пропускали через J=7,0 Гц, 2, CH2N), 3,78 (d, J=17,2 Гц, 2, CH2N), колонку з силікагелем Естер метилнонаетиленглі3,70 (m, 2, CH2O), 3,6-3,35 (m, ca 42, ca 10,5 колевого етеру та 4-формілцинамовоі кислоти CH2CH2O), 3,23 (s, 3, СНз), 2,0-1,5 та 1,3-0,9 (обиелюювали сумішшю 60 40 хлороформу та ацето1 два br m, 22 загалом, 2 циклогексил) ну, одержавши його як масло (72г, 97) Н ЯМР (CDCI3) 5 10,01 (s, 1, СНО), 7,89 (d, J=8,1 Гц, 2, 2 Аналіз розр для феніл СН), 7,71 (d, J=16,1 Гц, 1, CH=), 7,66 (d, С29Нзб^О4(С2Н4О)ііб*0,4Н2О С 61,30, Н 8,20, N J=8,1 Гц, 2, 2 феніл СН), 6,57 (d, J=16,1 Гц, 1, 5,48, знайд С 61,24, Н 8,26, N5,54 СН=), 4,37 (m, 2, СО2ОСН2), 3,77 (m, 2, СН2О), Приклад 12 Естер гексаетиленгліколюта (Е)-43,67-3,521 (m, 32, 16 СН2О), 3,35 (s, З, СН3) (1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)цинамовоі кислоти Аналіз розр для С3іН5оОіз*0,65Н20 С 537,96, Н8.05, знайд С 57,95, Н 7,95 (а) Естер гексаетиленгліколю та 4формілцинамової кислоти Потрібну сполуку виготовили з 1,3біс(циклогексилметил)-5,6-діамшоурацилу спосоРозчин 16,1г (68,1ммоль) (Е)-метил[4бом J Perutmattam, Syn Commun 1989,19 3367(диметоксиметил)цинамату] з операції 9(6) та 3370 Згідно ЗІ способом з прикладу 9(г) 10, 4г 1,36,34мл ізопропоксиду титану (Aldrich) перемішувабіс(циклогексилметил)-5,6-діамшоурацилу з прили в надлишку (52,76г) сирого мокладу 1(г) конденсували з 18,0 одержаного вище но(тетрапдрофураніл)гексаетиленгліколевого етеестеру метилнонаетиленгліколевого етеру з 4ру (JW Cornforth, E D Morgan, K E Potts, R J W формілцинамовою кислотою, отримавши потрібну Rees, Tetrahedron 1973, 29 1659-1667) при кімнатсполуку як світло-жовтий твердий продукт (20,0 г, ній температурі протягом 3 діб, а потім перемішу74%), т п л 143-145°С, 1Н ЯМР (flMCO-d6) 5 8,28 вали при 120°С у вакуумі 267Па протягом 4 годин, (d, J=8,3 Гц, 2, 2 феніл СН), 7,74 (d, J=16,2 Гц, 1, охолоджували до 32°С, додавали 80мл (80ммоль) CH=), 7,67 (d, J=8,4 Гц, 2, 2 феніл СН), 6,55 (d, 1 Н пдрохлоридної кислоти, а потім утворений J=15,9 Гц, 1, СН=), 4,40 (m, 2, СО2ОСН2), 4,08 (d, водний розчин перемішували при 32 - 40°С протяJ=6,9 Гц, 2, CH2N), 4,00 (d, J=7,3 Гц, 2, CH2N), 3,80 гом 1,5 годин і розбавляли Юмл води, перемішу(m, 2, CH2O), 3,72-3,52 (m, 32, 16 CH2O), 3,35 (s, 3, вали ще ЗО хвилин і ще розбавляли Юмл води CH3), 2,05-1,03 (m, 22, 2 циклогексил) Через 2,5 години розчин охолоджували до кімнатної температури та тричі по ЮОмл екстрагували Аналіз розр для C47H72N4Oi3 С 62,65, Н 8,05, толуолом Поєднані екстракти сушили сульфатом N6,32, знайд С 62,40, Н 7,92, N6,42 натрію та концентрували до 33,81г масла, яке Приклад 11 Естер метилполіетиленгліколевого хроматографували на силікагелі, елююючи 10% (n = 11,7) етеру та (Е)-4-(1,3метанолом у хлороформі, і сушили випарюванням бю(циклогексилметил)-1,2,3,6-тетрапдро-2,6етанолу з одержанням 8,80г (29%) жовтого воскодюксо-9Н-пурин-8-т)цинамовоі кислоти подібного твердого продукту Н ЯМР (ДМСО-de) 5 Густу суспензію у 365г монометилполіетиленг10,06 (s, 1, СНО), 7,98 ( т , 4, 4 феніл СН), 7,77 (d, ліколевого етеру (Aldrich, середня молекулярна J=16,0 Гц, 1, СН=), 6,88 (d, J=16,0 Гц, 1, CH=), 4,60 маса 550, висушений попередньо випарюванням з ( т , 1, ОН), 4,31 ( т , 2, СО2ОСН2), 3,71 ( т , 2, СН2О), толуолом) 5,50г (Е)-4-(1.3-біс(циклогексилметил)3,51 ( т , 20, ЮСН 2 О) 1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8іл)цинамовоі кислоти (з прикладу 1(г)) з вмістом Аналіз розр для 0,57г сульфатної кислоти перемішували протягом С22Н32О9*0,35Н2О*0,25С2Н5ОН С 58,97, Н 7,52, 15 хвилин при 133Па, а потім жовту реакційну сузнайд С 58,43, Н 7,40 міш перемішували протягом 3 годин при 190°С (б) Естер гексаетиленгліколю та (Е)-4-(1,3(масляна баня) та 133Па, при цьому тверда фаза біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6розчинилася з утворенням коричневого розчину дюксо-9Н-пурин-8-іл)цинамовоі кислоти Після охолодження до кімнатної температури темПотрібну сполуку виготовили з 1,3ний розчин вилили у 150мл води Водну фазу пебіс(циклогексилметил)-5,6-діамшоурацилу спосоремішували протягом 1,5 години, а потім тричі по бом J Perutmattam, Syn Commun 1989,19 3367120мл екстрагували дихлорметаном Поєднані 3370 Згідно ЗІ способом з прикладу 9(г) 7,68г 1,3екстракти промивали 150мл води і доводили рН біс(циклогексилметил)-5,6-діамшоурацилу з приводного шару до 6,5 концентрованим гідроксидом кладу 1(г) конденсували з 10,52г естеру гексаетиамонію Екстракти сушили сульфатом натрію та ленгліколю та 4-формілцинамовоі кислоти з опеконцентрували до масла, яке хроматографували рації (а), отримавши потрібну сполуку як світлона силікагелі С-18 з оберненою фазою (EM Sepaжовтий твердий продукт (8,0г, 45%), т п л 165rations LiCroprep RP-18) Колонку елюювали з гра168°С, 1Н ЯМР (ДМСО-de) 5 8,17 (d, J=8,4 Гц, 2, 2 дієнтом від 30% води-метанолу до чистого метафеніл СН), 7,90 (d, J=8,4 Гц, 2, 2 феніл СН), 7,78 нолу, сирий продукт елюювали метанолом Цей (d, J=16,0 Гц, 1, CH=), 6,80 (d, J=16,0 Гц, 1, CH=), 19 4,30 (m, 2, СО 2 ОСН 2 ), 3,93 (d, J=6,9 Гц, 2, CH 2 N), 3,80 (d, J=7,2 Гц, 2, CH 2 N), 3,71 (m, 2, CH 2 O), 3,653,40 (m, 20, 10 CH 2 O), 2,10-1,5 та 1,6-0,9 (обидва br m, 22 загалом, 2 циклогексил) Аналіз розр для C 4 oH58N40io*0,9H 2 0 С 62,30, Н 7,82, N 7,27, знайд С 62,33, Н 7,80, N 7,26 Приклад 13 Естер метилполіетиленгліколевого (п = 23,9) етеру та (Е)-4-(1,3біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)цинамовоі кислоти (а) (Е)-1,3-біс(циклогексилметил)-8-(4-(2-(1 Німідазол-1-ілкарбоніл)вшіл)феніл)-9Н-пурин2,6(1 Н,ЗН)-дюн Густу суспензію 2,97 г (Е)-4-(1,3біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)цинамовоі кислоти (з прикладу 1(г)) у 50мл безводного N.N-диметилформаміду швидко нагріли під зворотним холодильником майже до кипіння під азотом і додали до блідожовтої суспензії 1,17г г\І,г\Г-карбонілдіімідазолу (Lancaster Synthasis), яка рідшала та ставала оранжевою з виділенням газу, а через хвилину стала ярко-жовтою і загусла з утворенням жовтого твердого продукту Суміш перемішували протягом 18 годин розбавляли ЗОмл дихлорметану та фільтрували Ярко-жовтий продукт на фільтрі промивали ЗОмл дихлорметану та частково сушили на повітрі, а далі при 13Па та 40°С, одержавши (Е)-1,3біс(циклогексилметил)-8-(4-(2-(1 Н-імідазол-1 ілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюн як жовтий порошок (3,25г, 96%), т пл 310°С (розк л ) , 1 Н ЯМР (ДМСО-de) 5 8,74 (s, 1, імідазол СН), 8,20 (d, J=8,9 Гц, 2, 2 феніл СН), 8,06 (d, J=7,7 Гц, 2, 2 феніл СН), 8,03 (d, J=14,8 Гц, 1, CH=), 7,93 (s, 1, імідазол СН), 7,72 (d, J=15,7 Гц, 1, СН=), 7,14 (s, 1, імідазол СН), 3,92 (d, J=7,0 Гц, 2, CH 2 N), 3,77 (d, J=7,4 Гц, 2, CH 2 N), 3,70 (m, 2, CH 2 O), 3,6-3,35 (m, ca 42, ca 10,5 CH 2 CH 2 O), 3,23 (s, 3, CH 3 ), 2,0-1,5 та 1,25-0,9 (обидва br m, 22 загалом, 2 циклогексил) Аналіз розр для С3іНзбМбОз*0,35СзН7ОМ С 67,98, Н 6,84, N 15,91, знайд С 67,93, Н 6,67, N 15,92 (б) Естер метилполіетиленгліколевого (п=23,9) етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти Густу суспензію 2,25г (Е)-1,3біс(циклогексилметил)-8-(4-(2-(1 Н-імідазол-1 ілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюну з операції (а) у 50мл безводного N,Nдиметилформаміду нагріли до 60°С (масляна баня) під азотом і додали до ярко-жовтої суспензії 4,80г монометил пол іетиленгліколевого етеру (Sheatwater Pohmer, середня молекулярна маса 1100г, висушений попередньо випарюванням з толуолом), а потім 658мл 1,8діазабіцикло[5,4,0]ундец-7-ену (Aldnch) Добавка основи призвела до появи інтенсивно-червоного кольору та практично повного розчинення ацилімідазолу Червону суміш перемішували протягом 2,5 діб при 60°С, при цьому уся тверда фаза розчинилася рН світло-червоного розчину довели до 5 сульфатною кислотою і видалили з утвореного світло-жовтого розчину летючі продукти при 32Па та 47°С, отримавши 11,47г жовтого масла, яке хроматографу вал и на силікагелі С-18 з оберне 57767 20 ною фазою (EM Separations LiCroprep RP-18) Колонку елюювали з градієнтом від 40% водиметанолу до чистого метанолу, сирий продукт елюювали метанолом з одержанням 10,25г жовтого твердого продукту, який далі хроматографували на силікагелі, потрібну сполуку елюювали 4 - 10% метанолом у дихлорметані як блідо-жовтий склоподібний продукт (5,73г, 92%), який розтирали у гексані, отримавши жовтий твердий воскоподібний продукт, т п л 97-98°С, 1 Н ЯМР (flMCO-d 6 ) 5 8,18 (d, J=8,2 Гц, 2, 2 феніл СН), 7,91 (d, J=8,6 Гц, 2, 2 феніл СН), 7,72 (d, J=15,8 Гц, 1, СН=), 6,79 (d, J=15,9 Гц, 1, СН=), 4,30 (m, 2, СО 2 ОСН 2 ), 3,94 (d, J=7,0 Гц, 2, CH 2 N), 3,80 (d, J=7,8 Гц, 2, CH 2 N), 3,70 (m, 2, CH 2 O), 3,57-3,41 (m, ca 88, ca 44 CH 2 O), 3,25 (s, З, СН3), 2,0-1,5 та 1,3-0,9 (обидва br m, 22 загалом, 2 циклогексил) Аналіз розр для C29H36N4O4(C2H4O)23 4*0,3OH 2 O С 59,02, Н 8,53, N 3,58, знайд С 59,05, Н 8,57, N 3 , 6 2 Приклад 14 Естер метилполіетиленгліколевого (п = 23,9) етеру та (Е)-4-(1,3біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6дюксо-9Н-пурин-8-іл)цинамовоі кислоти Способом з прикладу 13 2,16г (Е)-1,3біс(циклогексилметил)-8-(4-(2-(1 Н-імідазол-1 ілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюну з прикладу 13(а) сполучали з 9,60г монометилполіетиленгліколевого етеру (Aldnch, середня молекулярна маса 2000г), отримавши 6,80г (76%) потрібної сполуки як жовтий порошок, т пл 56-64°С, 1 Н ЯМР (ДМСО-de) 5 8,18 (d, J=8,2 Гц, 2, 2 феніл СН), 7,91 (d, J=8,2 Гц, 2, 2 феніл СН), 7,72 (d, J=16,0 Гц, 1, CH=), 6,80 (d0 (m, ca 160, ca 80 CH 2 O), 3,25 (s, 3, CH3), 2,0-1,5 та 1,3-0,9 (обидва br m, 22 загалом, 2 циклогексил) АнаЛІЗ рОЗр ДЛЯ С29Нзб^О4(С2Н4О)41 5 С 57,67, Н 8,73, N 2,40, знайд С 57,51, Н 8,51, N2,31 Приклад 15 Естер метилполіетиленгліколевого етеру та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти Способом з прикладу 13 2,16г (3,84ммоль) (Е)1,3-біс(циклогексилметил)-8-(4-(2-(1 Н-імідазол-1 ілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюну з прикладу 13(а) сполучали з 3,30г (4,40ммоль) монометил поліетиленгліколевого етеру (Aldnch, середня молекулярна маса 750г), отримавши 3,30г (74%) потрібної сполуки як жовтий твердий воскоподібний продукт, т пл 124-125°С, 1 Н ЯМР (ДМСОde) 5 8,18 (d, J=8,2 Гц, 2, 2 феніл СН), 7,91 (d, J=8,4 Гц, 2, 2 феніл СН), 7,72 (d, J=16,0 Гц, 1, СН=), 6,80 (d, J=16,0 Гц, 1, СН=), 4,31 (m, 2, СО 2 ОСН 2 ), 3,94 (m, 2, CH 2 N), 3,80 (m, 2, CH 2 N), 3,70 (m, 2, CH 2 O), 3,6-3,4 (m, ca 58, ca 29 CH 2 O), 3,25 (s, 3, CH3), 1,8-1,5 та 1,3-0,9 (обидва br m, 22 загалом, 2 циклогексил) Аналіз розр для С 2 9Нзб^О 4 (С 2 Н4О)і 5 *0,5Н 2 О С 57,67, Н 8,73, N 2,40, знайд С 57,51, Н 8,51, N2,31 Приклад 16 Естер поліетиленгліколю (п = 32,2) та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти 1,69г (Е)-1,3-біс(циклогексилметил)-8-(4-(2 21 (1 Н-імідазол-1 -ілкарбоніл)вшіл)феніл)-9Н-пурин2,6(1 Н,ЗН)-дюну з прикладу 13(а) додали під азотом до 90,0г (60,0ммоль) розплавленого поліетиленгліколю (Aldnch, середня молекулярна маса 1500г, висушений попередньо випарюванням з толуолом), розбавили жовту густу суспензію 40мл безводного N.N-диметилформаміду, нагріли до 60°С (масляна баня) і додали 494мл 1,8діазабіцикло[5,4,0]ундец-7-ену (Aldnch), що призвело до появи інтенсивно-червоного кольору та практично повного розчинення ацилімідазолу Суміш перемішували протягом 16,5 годин при 60°С, при цьому уся тверда фаза розчинилася рН оранжевого розчину довели до 5 сульфатною кислотою і видалили з утвореного світло-жовтого розчину летючі продукти при 93Па та 50°С, отримавши залишок оранжевого масла, яке хроматографували на силікагелі С-18 з оберненою фазою (ЕМ Separations LiCroprep RP-18) Колонку елюювали з градієнтом від 40% води-метанолу до чистого метанолу, сирий продукт елюювали метанолом з одержанням 8,50г жовтої плівки, яку далі хроматографували на силікагелі, потрібну сполуку елюювали 6 - 15% метанолом у дихлорметані як блідожовтий склоподібний продукт (5,83г), який розтирали у гексані, отримавши жовтий твердий воскоподібний продукт (4,773г, 83%), т пл 83-84°С, 1 Н ЯМР (ДМСО-de) 5 13,92 (s, 1, NH), 8,14 (d, J=8,4 Гц, 2, 2 феніл СН), 7,87 (d, J=8,5 Гц, 2, 2 феніл СН), 7,68 (d, J=15,7 Гц, 1, СН=), 6,76 (d, J=16,1 Гц, 1, СН=), 4,56 (t, J=5,5 Гц, 1, ОН), 4,26 (m, 2, СО 2 ОСН 2 ), 3,90 (d, J=7,3 Гц, 2, CH 2 N), 3,76 (d, J=6,9 Гц, 2, CH 2 N), 3,66 (m, 2, CH 2 O), 3,6-3,2 (m, ca 120, c a 6 0 C H 2 O ) , 3,25 (s, 3, CH 3 ), 2,0-1,5 та 1,3-0,8 (обидва br m, 22 загалом, 2 циклогексил) Аналіз розр для C28H34N4O4(C2H4O)32 2*0,2H2O С 58,02, Н 8,60, N 2,93, знайд С 58,01, Н 8,59, N 2 , 9 2 Приклад 17 Естер поліетиленгліколю (п = 18,9) та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі кислоти Способом з прикладу 16 1,69г (Е)-1,3біс(циклогексилметил)-8-(4-(2-(1 Н-імідазол-1 ілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюну з прикладу 13(а) сполучали з 60г поліетиленгліколю (Aldnch, середня молекулярна маса 1000г), отримавши 2,747г (85%) потрібної сполуки як жовтий твердий воскоподібний продукт, т пл 350°С, Н ЯМР (ДМСО-de) відповідає струкнтрованою пдрохлоридною кислотою (рН=1) і турі утворену суспензію перемішували 15 хвилин, відАналіз розр для C28H34N4O4*0,10H2O C 68,30, фільтровували і тричі по 50мл промивали водою Н 7,00, N 11,38, знайд С 68,33, Н 6 93 N 11 34 Твердий продукт сушили під зниженим тиском, (б) Естер метилнонаетиленгліколевого етеру одержавши 1,63г (81%) потрібної сполуки 1Н ЯМР та (Е)-3-(1,3-біс(циклогексилметил)-1,2,3,6(ДМСО-de) 5 8,15 (d, J=8,0 Гц, феніл СН, 2Н), 7,73 тетрапдро-2,6-дюксо-9Н-пурин-8-т)цинамовоі кис(d, J=8,0 Гц, феніл СН, 2Н), 3,87 (d, J=6,6 Гц, лоти CH2N, 2H), 3,74 (d, J=6,8 Гц, CH2N, 2H), 1,88 (br s, Густу суспензію 0,50г (Е)-3-(1,3ц-гексил CH, 1H), 1,4-1,8 (m, ц-гексил СН, СН2, біс(циклогексилметил)-1,2,3,6-тетрапдро-2,611Н), 0,8-1,2 (m, ц-гексил СН2, ЮН) МС (ES) 487 дюксо-9Н-пурин-8-іл)цинамовоі кислоти (з операції (М-1), 443(М-1-СО2) (а) у Юмл безводного N.N-диметилформаміду швидко нагріли під зворотним холодильником (в) Естер метилнонаетиленгліколевого етеру майже до кипіння під азотом і додали до блідота 3-{4-[1,3-біс(циклогексилметил)-1,2,3,6жовтої суспензії 1,17г г\І,г\Г-карбонілдіімідазолу тетрапдро-2,6-дюксо-9Н-пурин-8-іл]феніл}2,3(Aldnch), суспензія рідшала та ставала оранжевою дибромпропюнової кислоти з виділенням газу, а через хвилину стала яркоРозчин 0,324г (2,0ммоль) 1,1іжовтою і загусла з утворенням жовтого твердого карбонілдммідазолу у Юмл ацетонітрилу додали продукту Суміш перемішували протягом 18 годин при перемішуванні до розчину 0,650г (1,33ммоль) розбавляли ЗОмл дихлорметану та фільтрували 3-{4-[1,3-біс(циклогексилметил)-1,2,3,6-тетрапдроЯрко-жовтий продукт на фільтрі промивали ЗОмл 2,6-дюксо-9Н-пурин-8-іл]феніл}2,3дихлорметану та сушили при 40°С, одержавши дибромпропюнової кислоти у 40мл безводного (Е)-1,3-біс(циклогексилметил)-8-(3-(2-(1 Н-імідазолтетрапдрофурану та 4 години перемішували, до1-ілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюн дали 40мл ацетонітрилу та перемішували суспеняк жовтий порошок (0,403г) До суміші цієї сполуки зію ще ЗО хвилин та профільтровували Твердий та 0,350г монометилнонаетиленгліколевого етеру продукт ДВІЧІ по Юмл промивали ацетонітрилом з прикладу 10(а) у Юмл N.N-диметилформаміду сушили протягом ночі під зниженим тиском і змідодали 0,112г 1,8-діазабіцикло[5,4,0]ундец-7-ену шували з Юмл безводного диметилформаміду, до (Aldnch), і утворений розчин перемішували 20 госуспензії додали 0,857г метилнонаетидин при 55°С Розчин охолодили до кімнатної темленгліколевого етеру і перемішували суміш під ператури та довели рН 1 Н НСІ до 7 Додали азотом Краплями додали ЗООцл 1,8500мл хлороформу та ДВІЧІ ПО 20МЛ промили водіазабіцикло[5,4,0]ундец-7-ену і червоний розчин дою Поєднані органічні фази промили розсолом, перемішували при кімнатній температурі годину, а сушили сульфатом магнію, концентрували під потім ще годину при 40°С Розчин охолодили до зниженим тиском і твердий воскоподібний залишок 20°С, додали ЮОмл метиленхлориду та довели хроматографували на силікагелі, елююючи 10% рН до 5 1М гідросульфатом калію Фази розділили метанолом у хлороформі, з одержанням 0,421г і водну ДВІЧІ по 20мл промили метиленхлоридом (63%) естеру метилнонаетиленгліколевого етеру Поєднані органічні фази сушили сульфатом магта (Е)-3-(1,3-біс(циклогексилметил)-1,2,3,6нію і фільтрували Фільтрат концентрували під зниженим тиском і хроматографували на силікагететрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі килі, елююючи етилацетат/етанолом (9 1), з одерслоти як твердий воскоподібний продукт 1Н ЯМР жанням 0,105г потрібного твердого продукту (9%) 1 (ДМСО-de) 5 8,53 (s, 1, арил СН), 8,13 (d, J=7,7 Гц, Н ЯМР (CDCI3) 5 8,27 (d, J=8,3 Гц, феніл СН, 2Н), 1, арил СН), та 7,80 (d, J=8,5 Гц, 1, арил СН), 7,71 7,71 (d, J=8,3 Гц, феніл СН, 2Н), 4,41 (t, J=4,6 Гц, (d, J=16,1 Гц, 1, СН=), 7,58 (m, 1, арил СН), 6,78 (d, СО2ОСН2, 2Н), 4,06 (d, J=7,3 Гц, CH2N, 2H), 3,97 (d, J=15,9 Гц, 1, СН=), 4,28 (т, 2, СН2О), 3,91 (d, J=7,2 J=7,2 Гц, CH2N, 2Н), 3,78 (d, J=4,8 Гц, CH2O, 2Н), Гц, 2, CH2N), 3,77 (d, J=7,2 Гц, 2, CH2N), 3,68 (m, 2, 3,7-3,6 (m, 15 СН2, ЗОН), 3,52 (d, CH2O, 2H), 3,34 CH2O), 3,70-3,40 (m, 32, 16CH2), 3,21 (s, 3,CH3), (s, СНз, ЗН), 2,04 (br s, ц-гексил СН, 1Н), 1,85 ( т , ц2,1-1,бта 1,4-1,0 (m, 22, цикпогексил СН 2 таСН) гексил СН, 1Н), 1,6-1,8 ( т , ц-гексил СН, СН2, ЮН), + Аналіз розр для C47H72N4Oi3 С 62,65, Н 8,05, 1,0-1,2 ( т , ц-гексил СН2, ЮН) МС (FAB ) 899 N6,22, знайд С 62,57, Н 7,83, N 6,50 (М+1), 921 (M+Na) Приклад 22 Метилнонаетиленглікольетерамід (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6Приклад 21 Естер метилнонаетиленглікотетрапдро-2,6-дюксо-9Н-пурин-8-іл)цинамовоі килевого етеру та (Е)-3-(1,3-бю(циклогексилметил) 26 25 57767 слоти СН2О), 3,2 (s, З, ОСН3), 2,40 (s, 3, СНз) (а) 2,5,8,11,14,17,20,23,26-нонаоксо-октакозилДо розчину 2,6г (4,42ммоль) метилтозилнона28-амін етиленгліколевого етеру у Юмл N,Nдиметилформаміду додали 0,35г азиду натрію 8,6г (344ммоль) 95% гідриду натрію додали до (Aldnch) та 0,020г йодиду натрію (Aldnch), гріли під розчину гексаетиленгліколю (Aldnch, 100г) у зворотним холодильником протягом 18 годин, ЮООмл безводного тетрапдрофурану при 15°С і охолоджували до кімнатної температури та розбаперемішували протягом години для повернення до вляли 50мл хлороформу Цей розчин ДВІЧІ ПО Ю М Л кімнатної температури та краплями протягом гопромивали водою, органічний шар сушили сульдини додавали 59,9г бензилброміду (Aldnch) і пефатом магнію і концентрували до 2,25г безбарвноремішували при кімнатній температурі протягом 16 го масла, яке розчиняли в ЮОмл етанолу та перегодин Охолоджену суміш розбавляли 200мл води мішували у присутності 0,2г 10% паладію на та тричі по 350мл екстрагували діетиловим етеактивованому вугіллі (Aldnch) протягом 48 годин ром Поєднані екстракти ДВІЧІ ПО ЮОМЛ промивали під воднем при ЮЗ,4кПа в апараті Буші Каталізаводою Поєднані водні шари насичали хлоридом тор відфільтровували (Cehte™) а розчинник випанатрію та 4 рази по 400мл екстрагували дихлоррювали, одержавши 1,59г (77%) метаном Поєднані дихлорметанові фази проми2,5,8,11,14,17,20,23,26-нонаоксо-октакозил-28вали 200мл насиченого хлориду натрію, сушили аміну як безбарвне масло 1Н ЯМР (ДМСО-de) 5 сульфатом магнію та видаляли летючі продукти 3,6-3,3 ( т , 36, 18 СН 2 та NH2), 3,2 (s, З, під зниженим тиском, одержавши 80,5г (64%) моСНз) МС(СІ) 428(100%, М+1) 6,27 нобензилгексаетиленгліколевого етеру 1Н ЯМР ідентичний представленому в прикладі 10(а) Роз(б) Метил нонаетиленглікольетерамід (Е)-4чин 80г монобензилгексаетиленгліколевого етеру (1,3-біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6в 750мл безводного ТГФ додавали до суспензії дюксо-9Н-пурин-8-іл)цинамовоі кислоти 5,4г 95% гідриду натрію у тетрапдрофурані, переДо суміші 0,43г (1,0ммоль) мішували при кімнатній температурі ЗО хвилин 2,5,8,11,14,17,20,23,26-нонаоксо-октакозил-28краплями додавали розчин у ЮОмл ТГФ 68,4г виаміну та 0,5г (0,92ммоль) (Е)-1,3готовленого способом за прикладом 1(а) метилтобіс(циклогексилметил)-8-(4-(2-(1 Н-імідазол-1 зилтріетиленгліколевого етеру і кип'ятили під азоілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюну том протягом ночі під зворотним холодильником, з прикладу 13(а) у Юмл N.N-диметилформаміду додавали ще 2,5г гідриду натрію і кип'ятили під додали 0,168г 1,8-діазабіцикло[5,4,0]ундец-7-ену і азотом протягом ще 24 годин Суміш охолоджуваутворений червоний розчин перемішували при ли (льодяна баня), гасили 2л води та ДВІЧІ ПО 55°С 18 годин, Додали ще 0,43г аміну та гріли ще 200мл екстрагували діетиловим етером Водну 20 годин Розчин охолодили до кімнатної темперафазу ДВІЧІ по 250мл промивали метиленхлоридом тури, та довели 1Н НСІ рН до 7,0 Додали 25мл Поєднані екстракти промивали ЗН НСІ та водою, води і промили розчин 50мл етилацетату Органісушили сульфатом магнію та концентрували до чний шар промили розсолом, висушили сульфакоричневого масла, яке фільтрували крізь шар том магнію і концентрували під зниженим тиском, силікагелю з промивкою метиленхлоридом, який а потім хроматографували на силікагелі, елююючи випарювали, одержавши 63,1г (57%) метилбензи10% метанолом у хлороформі Випарюванням 1 лового етеру нонаетиленгліколю як масло Н ЯМР розчиннику одержали 0 064г потрібного жовтого (ДМСО-de) 5 7,23 ( т , 5, 5 феніл СН), 4,38 (s, 2, твердого продукту (8%) Н ЯМР (flMCO-d6) 8,24 (t, бензил СН2), 3,50-3,30 ( т , 36, 18СН2О), 3,13 (s, З, СНз) 1, NH), 8,15 (d, J=8,4 Гц, 2, 2 арилу СН), та 7,69 (d, J=8,3 Гц, 2, 2 арилу СН), 7,47 (d, J=15,5 Гц, 1, СН=), 6,75 (d, J=15,8 Гц, 1, СН=), 3,92 (d, J=7,1 Гц, Розчин Юг (19,3ммоль) метилбензилового етеру нонаетиленгліколю у 200мл етанолу стру2, CH2N), 3,78 (d, J=7,2 Гц, 2, CH2N), 3,6-3,3 (m, 36, шували з 1,0г 10% паладію на активованому вугіл18CH 2 ), 3,23 (s, 3, СНз), 2,0-1,5 та 1,25-0,95 (обидлі (Aldnch) протягом 3 годин під воднем при ва m, 22, циклогексил СН 2 та СН) 344,7кПа в апараті Парра Каталізатор відфільтАналіз розр для C47H73N5Oi2*0,85H2O C ровували (Cehte™), а фільтрат концентрували у 61,67, Н 8,22, N 7,65, знайд С 61,66, Н 8,07, N вакуумі та сушили випарюванням з толуолом, 7,67 одержавши 8,17г (99%) монометилового етеру Приклад 23 Естер метилнонаетиленглікононаетиленгліколю як масло 1Н ЯМР (ДМСО-Ьє) левого етеру та (Е)-3-(1,3-біс(циклогексилметил)5 4,56 (t, 1, ОН), 3,60-3,35 ( т , 36, 18 СН2О), 3,22 1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8(s, 3, СНз) іл)бензойноі кислоти 1,35г толуолсульфонілхлориду додали при (а) (Е)-3-(1,3-біс(циклогексилметил)-1,2,3,60°С до розчину 2,0г (4,7ммоль) монометилнонаететрапдро-2,6-дюксо-9Н-пурин-8-іл)бензойна кистиленгліколевого етеру у 15мл сухого піридину, лота перемішували при кімнатній температурі протягом Аналогічно операції (г) прикладу 1 2,00г 6ночі, охолодили до 0°С та довели 12Н НСІ рН до амшо-1,3-біс(циклогексилметил)-5-нітрозоурацилу 2 Додали 200мл води і тричі по 50мл промили відновили до 1,3-біс(циклогексилметил)-5,6метиленхлоридом Поєднані органічні фази продіамшоурацилу і негайно конденсували з 1,424г 3мивали розсолом, сушили сульфатом магнію та формілбензойної кислоти (Aldnch) описаним J концентрували, одержавши 2,7г метилтозилнонаеPerutmattam, Syn Commun 1989, 19 3367-3370 тиленгліколевого етеру як безбарвне масло 1Н способом, отримавши потрібну сполуку як білувату ЯМР (ДМСО-de) 5 7,85 та 7,55(2d, J=8,0 Гц, 4, тверду речовину (2,27г, 85%), т пл >250°С, 1Н С6Н4), 4,18 (m, 2, СНзОТоз), 3,7-3,45 (m, 34, 17 ЯМР (ДМСО-do) відповідає структурі 28 27 57767 Аналіз розр для C26H32N4O4 С 67,22, Н 6,94, біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6N12,06, знайд С 67,10, Н 6,97, N 12,04 дюксо-9Н-пурин-8-іл)бензойноі кислоти (з операції (а) у Юмл безводного N.N-диметилформаміду (б) Естер метилнонаетиленгліколевого етеру швидко нагріли під зворотним холодильником та (Е)-3-(1,3-біс(циклогексилметил)-1,2,3,6майже до кипіння під азотом і додали до блідотетрапдро-2,6-дюксо-9Н-пурин-8-іл)бензойноі кисжовтої суспензії 1,17г N,N'-Kap6oHinfliiMifla3ony лоти (Aldnch), суспензія рідшала та ставала оранжевою Густу суспензію 0,500г (Е)-3-(1,3з виділенням газу, а через хвилину стала яркобіс(циклогексилметил)-1,2,3,6-тетрапдро-2,6жовтою і загусла з утворенням жовтого твердого дюксо-9Н-пурин-8-іл)бензойноі кислоти (з операції продукту Суміш перемішували протягом 18 годин, (а) у Юмл безводного N.N-диметилформаміду розбавляли ЗОмл дихлорметану та фільтрували швидко нагріли під зворотним холодильником Ярко-жовтий продукт на фільтрі промивали ЗОмл майже до кипіння під азотом і додали до блідодихлорметану та сушили при 40°С, одержавши жовтої суспензії 1,17г г\І,г\Г-карбонілдіімідазолу (Е)-1,3-біс(циклогексилметил)-8-(3-(2-(1 Н-імідазол(Aldnch), суспензія рідшала та ставала оранжевою 1-ілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюн з виділенням газу, а через хвилину стала яркояк жовтий порошок (0,32г) Суміш 0,32г цієї сполужовтою і загусла з утворенням жовтого твердого ки, 0,277г монометилнонаетиленгліколевого етеру продукту Суміш перемішували протягом 18 годин, з прикладу 10(а) та 0,170г безводного карбонату розбавляли ЗОмл дихлорметану та фільтрували калію в Юмл ацетонітрилу гріли 20 годин під звоЯрко-жовтий продукт на фільтрі промивали ЗОмл ротним холодильником Додали 50мл хлороформу дихлорметану та сушили при 40°С, одержавши та промили 20мл 1Н НСІ Органічний шар промили (Е)-1,3-біс(циклогекеилметил)-8-(3-(2-(1 Н-імідазолрозсолом, сушили сульфатом магнію та хроматог1-ілкарбоніл)вшіл)феніл)-9Н-пурин-2,6(1Н,ЗН)-дюн рафували на силікагелі, елююючи 10% метанолом як жовтий порошок (0,46г) Суміш 0,45г цієї сполуу хлороформі, з одержанням після випарювання ки, 0,393г мономе-тилнонаетиленгліколевого етеру розчиннику жовтої воскоподібної твердої речовиз прикладу 10(а) та 0,242г безводного карбонату ни, яку переосаджували з етилацетату-гексану, калію в Юмл ацетонітрилу перемішували 20 годин Жовтий твердий воскоподібний продукт фільтрупід зворотним холодильником Додали 50мл хловали та сушили до 0,355г (65%) естеру метилнороформу та промили 20мл 1Н НСІ Органічний наетиленгліколевого етеру та (Е)-4-(1,3шар промили розсолом, сушили сульфатом магнію біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6та хроматографували на силікагелі, елююючи 10% дюксо-9Н-пурин-8-іл)бензойноі кислоти як білий метанолом у хлороформі, з одержанням після витвердий воскоподібний продукт 1Н ЯМР (ДМСОпарювання розчиннику 0,262г (38%) естеру метилde) 5 8,24 (d, J=8,4 Гц, 2, 2 СН), 8,06 (d, J=8,6 Гц, нонаетиленгліколевого етеру та (Е)-3-(1,32, 2 СН), 4,40 (m, 2, СН2О), 3,90 (d, J=7,3 Гц, 2, біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6CH2N), 3,75 (m, 4, CH2N та СН2О), 3,70-3,40 (m, 32, дюксо-9Н-пурин-8-іл)бензойноі кислоти як білий 16 CH2), 3,19 (s, 3, СНз), 2,1-1,6 та 1,4-1,0 (m, 22, твердий воскоподібний продукт 1Н ЯМР (ДМСОциклогексил СН 2 та СН) de) 5 8,79 (s) та 8,43 (d, J=7,9), 8,11 (d, J=8,0), та 7,57 (m, кожний 1, C6H4), 4,50 (m, 2, СН20), 3,99 (d, Аналіз розр для C45H7oN4Oi3 С 61,77, Н 8,06, J=7,1 Гц, 2, CH2N), 3,83 (m, 4, CH2N та СН2О), 3,70N6,40, знайд С 61,55, Н 7,99, N6,52 3,40 (m, 32, 16CH2), 3,28(s, 3, CH3), 2,1-1,6 та 1,4Приклад 25 Естер метилнонаетиленгліколево1,0 (обидва m, 22, циклогексил СН 2 та СН) Аналіз го етеру та (Е)-2-(1,3-біс(циклогексилметил)розр для C45H7oN4Oi3*0,52H20 С 61,05, Н 8,10, N 1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-86,33, знайд С 61,05, Н 8,09, N6,25 т)бензойноі кислоти Приклад 24 Естер метилнонаетиленгліколево(а) (Е)-2-(1,3-біс(циклогексилметил)-1,2,3,6го етеру та (Е)-4-(1,3-біс(циклогексилметил)тетрапдро-2,6-дюксо-9Н-пурин-8-іл)бензойна кис1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8лота іл)бензойноі кислоти Аналогічно операції (г) прикладу 1 2,00г 6(а) (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6амшо-1,3-біс(циклогексилметил)-5-нітрозоурацилу тетрапдро-2,6-дюксо-9Н-пурин-8-іл)бензойна кисвідновили до 1,3-біс(циклогексилметил)-5,6лота діамшоурацилу і негайно конденсували з 1,424г 2формілбензойної кислоти (Aldnch) описаним J Аналогічно операції (г) прикладу 1 1,00г 6Perutmattam, Syn Commun 1989, 19 3367-3370 амшо-1,3-біс(циклогексилметил)-5-нітрозоурацилу способом, отримавши потрібну сполуку як білувату відновили до 1,3-біс(циклогексилметил)-5,6тверду речовину (1,22г, 46%), т пл 271-274°С, 1Н діамшоурацилу і негайно конденсували з 1,424г 4ЯМР (ДМСО-do) відповідає структурі формілбензойної кислоти (Aldnch) описаним J Perutmattam, Syn Commun 1989, 19 3367-3370 Аналіз розр для C 26 H 32 N 4 O 4 С 67,22, Н 6,94, способом, отримавши потрібну сполуку як білувату N12,06, знайд С 67,25, Н 6,99, N 12,11 1 тверду речовину (0,720г, 54%), т пл >300°С, Н (б) Естер метилнонаетиленгліколевого етеру ЯМР (ДМСО-do) відповідає структурі та (Е)-2-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)бензойноі кисАналіз розр для C 26 H 32 N 4 O 4 С 67,23, Н 6,94, лоти N12,06, знайд С 67,29, Н 6,98, N 12,02 (б) Естер метилнонаетиленгліколевого етеру 0,100г (Е)-2-(1,3-біс(циклогексилметил)-1,2,3,6та (Е)-4-(1,3-біс(циклогексилметил)-1,2,3,6тетрапдро-2,6-дюксо-9Н-пурин-8-іл)бензойноі кистетрапдро-2,6-дюксо-9Н-пурин-8-іл)бензойноі кислоти (з операції (а) способом з прикладу 24(а) пелоти ретворили в 0,82г (47%) естеру метилнонаетиленгліколевого етеру та (Е)-4-(1,3Густу суспензію 0,500г (Е)-4-(1,3 ЗО 29 57767 біс(циклогексилметил)-1,2,3,6-тетрапдро-2,6А В С дюксо-9Н-пурин-8-іл)бензойноі кислоти у вигляді Активний інгредієнт 25 25 25 1 - 7 янтарного масла Н ЯМР (flMCO-d6) 5 7,80-7,50 Avicel™ 13 (m, 4, 4 ароматичних СН), 4,20 ( т , 2, СН2О), 3,80Лактоза 78 47 3,60 (т, 4, 2 CH2N), 3,50-3,20 (т, 34, 17 СН2), 3,20 Крохмаль (кукур) 9 (s, 3, СНз), 1,9-1,4 та 1,2-0,8 (т, 22, цикпогексил - 32 Крохмаль (желатинов , NF15) СН 2 таСН) 5 Натрій-гліколят крохмалю Аналіз розр для 3 3 Povidon™ С45Н7оМ40із*0,85(етилацетат)*0,64Н20 С 60,50, Н Стеарат магнію 1 1 1 8,18, N 5,83, знайд С 60,50, Н 8,198, N 5,83 125 85 65 Приклад 26 Естер метилнонаетиленгліколево(м) Під'язично го етеру та (Е)-2-(1,3-біс(циклогексилметил)D Е 1,2,3,6-тетрапдро-6-оксо-2-тюксо-9Н-пурин-8Активний інгредієнт 25 25 іл)цинамовоі кислоти Avicel™ 10 . (Е)-2-(1,3-біс(циклогексилметил)-1,2,3,6Лактоза 36 тетрапдро-6-оксо-2-тюксо-9Н-пурин-8-іл)цинамову маніт 51 57 кислоту (WO 96/04280, 0,5г, 0,99ммоль) естерифіСахароза 3 кували метилнонаетиленгліколевим етером ана3 Аравійська камедь логічно операції (б) прикладу 24 Потрібну сполуку 3 Povidon™ виділили як жовтий твердий воскоподібний проСтеарат магнію 1 1 дукт (0,145г, 20%) 1Н ЯМР (ДМСО-de) 5 8,17 (d, Композиції А-Е можна виготовити вологою J=8,4 Гц, 2, 2 арильний СН), 7,90 (d, J=8,4 Гц, 2, 2 грануляцією перших 6 інгредієнтів з Povidon™, a арильний СН), 7,69 (d, J=15,9 Гц, 1, СН=), 6,77 (d, потім додаванням стеарату магнію та пресуванJ=16,1 Гц, 1, СН=), 4,53 (d, J=7,0 Гц, 2, CH2N), 4,40 ням (d, J=7,0 Гц, 2, CH2N), 4,25 (m, 2, CH2O), 3,70 (m, 2, (їм) защічно мг^аблетку CH2O), 3,6-3,3 (m, 32, 16 CH2), 3,23 (s, 3, CH3), 2,4Активний інгредієнт 25 2,0 (2m, 2, 2 СН циклогексилу) 1,80-1,60 та 1,20Гід роксипропіл метил целюлоза 1,0 (обидва m, 22, циклогексил СН2) (ГПМЦ) 25 Аналіз розр для C47H73N4Oi2S*0,89H2O C Polycarbophil™ 39 60,49, Н 7,97, N 6,00, S 3,44, знайд С 60,49, Н Стеарат магнію 1 7,70, N6,31,53,55 90 Приклад 27 Естер метилнонаетиленгліколевоКомпозицію можна виготовити безпосереднім го етеру та (Е)-4-(1,3-біс(циклогексилметил)пресуванням суміші інгредієнтів 1,2,3,6-тетрапдро-2,6-дюксо-9Н-пурин-8(2) Композиції капсул іл)цинамовоі кислоти (і) порошок мг/капсулу як жовтий порошок (0,32г) До суміші 60,75г F G (112 ммоль) (Е)-1,3-біс(циклогексилметил)-8-(3-(2Активний інгредієнт 25 25 (1 Н-імідазол-1 -ілкарбоніл)вшіл)феніл)-9Н-пуринAvicel™ 45 2,6(1 Н,ЗН)-дюну, та 31,0г (225ммоль) карбонату Лактоза 153 калію в 650мл ацетонітрилу додали 10,57г Крохмаль (1500 NF) 117 (135ммоль) монометил нонаетиленгліколевого Натрій-гліколят крохмалю 6 етеру з прикладу 10(а) гріли 18 годин під зворотСтеарат магнію 2 2 ним холодильником, охолоджували до кімнатної 225 150 температури і додали 1200мл хлороформу та Композиції F та G можна виготовити змішупромили 800мл 1Н НСІ, 500мл води та ДВІЧІ ПО ванням інгредієнтів та заповненням двочастинних 200мл розсолом Органічний шар сушили сульфатвердих желатинових капсул утвореною сумішшю том магнію, випарювали хлороформ і одержали (м) заповнення рідиною мг/капсулу сиру потрібну сполуку як жовтий твердий воскопоН І дібний продукт, який ДВІЧІ хроматографували на Активний інгредієнт 25 25 силікагелі, елююючи 10% метанолом у хлорофорMacrogol™4000BP 200 мі, а потім 10% метанолом у етилацетаті, з одерЛецитин 100 жанням після випарювання розчиннику жовтої восАрахісова олія 100 коподібної твердої речовини, яку переосаджували 225 225 з етил ацетату-гексан у та сушили у вакуумі, отриКомпозицію Н можна виготовити плавленням мавши 64,5г (65%) потрібної речовини як жовтий Macrogol™ 4000 ВР, диспергуванням активного твердий воскоподібний продукт 1Н ЯМР ідентичінгредієнту у розплаві та заповненням двочастинний зразку з прикладу 10(6) них твердих желатинових капсул утвореною сумішшю Аналіз розр для C47H72N4Oi3 С 62,65, Н 8,05, N6,22, знайд С 62,33, Н 7,94, N 6,25 Композицію І можна виготовити диспергуванПриклади фармацевтичних композицій ням активного інгредієнту у лецитині та арахісовій олії та заповненням м'яких еластичних желатиноУ нижченаведених прикладах активним інгревих капсул утвореною дисперсією дієнтом може бути всяка сполуки формули (І) або и фармацевтичне прийнятна сіль чи сольват, пе(їм) регульоване вивільнення мг/капсулу реважно сполука з прикладів 2 - 26 Активний інгредієнт 25 (1) Композиції таблеток Avicel™ 123 (і) перорально мг^аблетку Лактоза 62 57767 32 З трш-сахарин диспергували у суміші, яку далі пере12 несли у придатний аерозольний балон, який через 225 клапан заповнили дихлордифлуорметаном КомКомпозицію можна виготовити екструзією пепозиція забезпечує 0,5мг активного інгредієнту на рших 4 активних інгредієнтів, сфероідизацією та кожні 100|лі дози сушкою екструдату Сухі кульки покривають етилБіологічна активність целюлозою як регулюючою вивільнення мембраКарагенанове плевральне дослідження Антиною та заповнюють ними двочастинні тверді желазапальну активність сполук згідно з винаходом тинові капсули запропоновано визначали описаним Vinegar R et al , Proc Soc Exp Biol Med , 1981,168,24-32 спо(3) Композиції для внутрішньовенних ІН'ЄКЦІЙ собом, використовуючи самців щурів Lewis масою (І) % за масою 150 ± 20г Доза на базі карагенану складала Активний інгредієнт 25 0,075мг/щура Плевральний ексудат збирали чеГідроксид натрію за потребою до рез 4 години після ін'єкції карагенану Гостра антирН 7 запальна активність була визначена інгібуванням Вода для ІН'ЄКЦІЙ ДО 100 плеврального набряку та запальних клітин (нейтАктивний інгредієнт вносять в цитратний бурофілів) у порівнянні з контрольною (тільки серефер і додають достатньо НСІ для доведення рН довище) групою до 7 Розчин доводять до потрібного об'єму та фільтрують крізь мікропористий фільтр у стерильні Дослідження викликаного оцтовою кислотою склянки, яки закривають та упаковують коліту Антизапальну активність сполук згідно з винаходом визначали на моделі викликаного оцПриклад G Порошкові капсули для інгаляцій товою кислотою коліту у щурів описаним Frethland Активний інгредієнт (порошок 0,5R et al , 1990,255 572-576, способом, використовуючи самців щурів Lewis масою 275±20г Сполуки Лактоза (порошок 30-90цм) 49,0МГ застосовували перорально чи ректально за 24, 16 Порошки змішують до досягнення однорідності та 4 години перед 40-секундною уведенням 3% та заповнюють ними тверді желатинові капсули оцтової кислоти у проксимальні 6см товстої кишки придатного розміру Приклад Н Аерозоль для інпід слабкою анестезією Шлунок негайно промивагаляцій ли 5мл фізіологічного розчину Через 24 години Активний інгредієнт (порошок 0,5щурів умертвляли та вирізали 6 см проксимальної ділянки товстої кишки для зважування набряку 100,00мг Нейтрофільне запалення визначали вимірюванНатрій-сахарин (порошок 0,5-7,0|JM) 5,0МГ ням рівнів МРО в зчищеній слизовій товстої кишки Метанол 2,0мг цих пацюків Антизапальну активність оцінювали Трихлорфлуорметан 4,2г за інгібуванням утворення набряку та рівнів МРО в Дихлордифлуорметан до 10,0мл слизовій у порівнянні з групою негативного контТрюлеат сорбіту та метанол розчиняють у ролю трихлорфлуорметані, а активний інгредієнт та на31 Тріетилцитрат Етилцелюлоза 7 , 0 | J M ) 7 , 0 [ J M 1 , 0 М Г ) 5 0 , 0 М Г Результати Сполука ПЕГ п (чи сер) дексаметазон Карагенан-плеврит(4год) лежал ЕДбо (мг/щура) КЛІТИНИ набряк 0,02 0,015 приклад 9 СНз 10 0,02 0,2 приклад 10 СНз 9 0,5 0,5 приклад 15 СНз 15чи 16 0,4 0,2 приклад 14 приклад 18 приклад 17 прикладі 6 СНз ОН ОН ОН 41,5 13 18,9 32,2 неакт 0,5 0,1 0,1 0,2 0,5 0,1 0,1 0,2 НАс-коліт(24год) активи доза (мг/кг), увед МРО ЇТІтканини 0,03 0,17 внутр кишк внутр кишк 5,0 5,0 внутр кишк внутр кишк 50 50 пероральн пероральн 50 50 пероральн пероральн не визнач не визнач не визнач не визнач не визнач не визнач не визнач не визнач 33 57767 Вихідна кислота, тобто сполука з прикладу 1 не є активною в обох дослідах 3) Модель септичного шоку in vivo С Рагvum/LPS-шок Самцям мишей масою 25 - 30г (Charles River Raleigh, NC) уводили внутрішньовенно (їв) Юьг вбитого С Parvurn (Coparvax, Burroughs Wellcome, RTP, NC) Через 10 діб мишам і в уводили 20ur E Соїі 026 В6 ліпополісахариду (LPS, Difco Labs, Detroit, МІ) разом з аналгезуючим буторфенолом (150и/мишу) Тест-сполуку розчиняли в ДМСО та розбавляли 0,5% метилцелюлозою і давали перо Комп'ютерна верстка М Клюкш 34 рально за 2 години до LPS та разом з ним Результати Сполука/перор доза контроль Приклад 9\75мг/кг Приклад 1\75мг/кг 0/8 % виживання 0 4/8 50 2/8 25 живих/усього Підписано до друку 05 08 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted derivatives of (1,3-bis(cyclohexylmethyl-1,2,3,6-tetrahydro- 2,6-dioxo-9h-purin-8-yl)phenyl, preparation thereof and application in treatment in cases of inflamatory conditions and immune system disorders
Назва патенту російськоюЗамещенные производные (1,3-бис(циклогексилметил-1,2,3,6-тетрагидро- 2,6-диоксо-9н-пурин-8-ил)фенила, их получение и применение при лечении в случаях воспалительных состояний и расстройства иммунной системы
МПК / Мітки
МПК: C07D 473/22, A61K 31/52, C07D 473/06, A61P 37/06, C07D 473/20, A61P 29/00, A61P 43/00, A61P 37/02, A61K 31/522, A61P 29/02
Мітки: основі, фармацевтична, композиція, 2,6-діоксо-9н-пурин-8-іл)фенілу, заміщені, похідні, 1,3-біс(циклогексилметил-1,2,3,6-тетрагідро
Код посилання
<a href="https://ua.patents.su/17-57767-zamishheni-pokhidni-13-bisciklogeksilmetil-1236-tetragidro-26-diokso-9n-purin-8-ilfenilu-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Заміщені похідні (1,3-біс(циклогексилметил-1,2,3,6-тетрагідро- 2,6-діоксо-9н-пурин-8-іл)фенілу та фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб кування заготовок і чотирибойковий кувальний пристрій для його здійснення
Наступний патент: Спосіб одержання азотної кислоти
Випадковий патент: Апарат для замочування зерна












