Похідні заміщеного дигідропіраноіндол-3,4-діону як інгібітори інгібітора-1 активатора плазміногена (pai-1)
Формула / Реферат
1. Сполуки формули І і формули II:
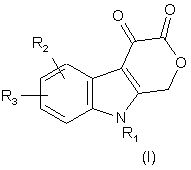
та
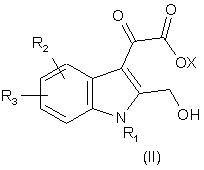 ,
,
де X - водень, лужний метал або основна аміногрупа;
R1 - C1-C8-алкіл, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, піридиніл, -СН2-піридиніл, феніл або бензил, причому цикли згаданих циклоалкілу, піридинілу, фенілу і бензилу можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, C1-C6-алкіл, С1-С6-перфторалкіл, -О-С1-С6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і -NO2;
R2 - водень, галоген, С1-С6-алкіл, С1-С3-перфторалкіл, С1-С6-алкоксигрупа, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, гідроксил, -NH2 або -NO2;
R3 - водень, галоген, С1-С6-алкіл, С1-С3-перфторалкіл, С1-С6-алкоксигрупа, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, гідроксил, -NH2, -NO2, феніл, бензил, бензилоксигрупа, піридиніл або -СН2-піридиніл, причому цикли цих груп можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять феніл, галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -O-C1-C6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і -NO2; або фармацевтично прийнятні солі або складні ефіри цих сполук.
2. Сполука за п. 1 формули (IV)
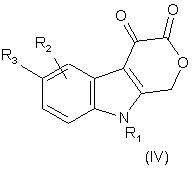 ,
,
де R1, R2 і R3 відповідають визначенням п. 1, або фармацевтично прийнятна сіль або складний ефір такої сполуки.
3. Сполука за п. 1 або п. 2, де R3 - гідроксил, феніл або бензилоксигрупа, причому цикли цих фенілу і бензилоксигрупи можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять феніл, галоген, С1-С3-алкіл, С1-С3-перфторалкіл, -О-С1-С3-перфторалкіл, С1-С3-алкоксигрупа, -ОН, -NH2 і -NO2; або фармацевтично прийнятна сіль або складний ефір такої сполуки.
4. Сполука за будь-яким із пп. 1-3, де R2 - водень, або фармацевтично прийнятна сіль або складний ефір такої сполуки.
5. Сполука за будь-яким із пп. 1-4, де R1 - водень або бензил, причому цикл згаданого бензилу може бути факультативно заміщений 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С3-алкіл, C1-С3-перфторалкіл, -О-С1-С3-перфторалкіл, С1-С3-алкоксигрупа, -ОН, -NH2 і -NO2, або фармацевтично прийнятна сіль або складний ефір такої сполуки.
6. Сполука формули III:
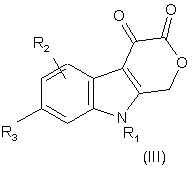 ,
,
де R1 - C1-C8-алкіл, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, піридиніл, -СН2-піридиніл, феніл або бензил, причому цикли згаданих циклоалкілу, піридинілу, фенілу і бензилу можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -О-С1-С6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і -NO2;
R2 - водень, галоген, С1-С6-алкіл, С1-С3-перфторалкіл, С1-С6-алкоксигрупа, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, -NH2 або -NO2;
R3 - водень, галоген, С1-С6-алкіл, С1-С3-перфторалкіл, C1-C6-алкоксигрупа, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, гідроксил, -NH2, -NO2, феніл, бензил, бензилоксигрупа, піридиніл або -СН2-піридиніл, причому цикли цих груп можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -О-С1-С6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і -NO2; або фармацевтично прийнятна сіль або складний ефір такої сполуки.
7. Сполука формули (IV)
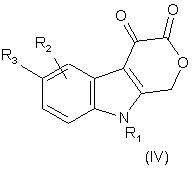 ,
,
де R1 - C1-C8-алкіл, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, піридиніл, -СН2-піридиніл, феніл або бензил, причому цикли згаданих циклоалкілу, піридинілу, фенілу і бензилу можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -O-C1-C6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і -NO2;
R2 - водень, галоген, С1-С6-алкіл, С1-С3-перфторалкіл, С1-С6-алкоксигрупа, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, -NH2 або -NO2;
R3 - феніл, бензил, бензилоксигрупа, піридиніл або -СН2-піридиніл, причому цикли цих груп можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, C1-С6-алкіл, С1-С6-перфторалкіл, -О-С1-С6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і -NO2; або фармацевтично прийнятна сіль або складний ефір такої сполуки.
8. Сполука формули (V):
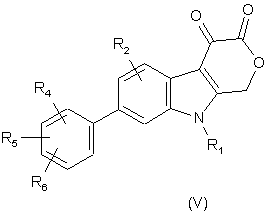 ,
,
де R1 - C1-C8-алкіл, за варіантом, якому віддають перевагу, С1-С6-алкіл, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл або бензил, причому цикли згаданих циклоалкілу і бензилу можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -О-С1-С6-перфторалкіл, C1-С6-алкоксигрупа, -ОН, -NH2 і -NO2;
R2 - водень, галоген, C1-С6-алкіл, С1-С3-перфторалкіл, якому віддають перевагу, -CF3, С1-С6-алкоксигрупа, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, гідроксил, -NH2 або -NO2;
R4, R5 і R6 - незалежно один від одного водень, феніл, галоген, С1-С3-алкіл, С1-С3-перфторалкіл, -О-С1-С3-перфторалкіл, С1-С3-алкоксигрупа, -ОН, -NH2 або -NO2; або фармацевтично прийнятна сіль або складний ефір такої сполуки.
9. Сполукаформули VI:
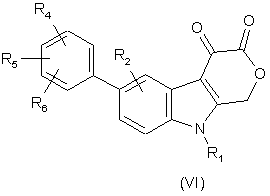 ,
,
де R1 - C1-C8-алкіл, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл або бензил, причому цикли згаданих циклоалкілу і бензилу можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, якому віддають перевагу, -CF3, -О-С1-С6-перфторалкіл, за варіантом, якому віддають перевагу, -O-CF3, С1-С6-алкоксигрупа, -ОН, -NH2 і -NO2;
R2 - водень, галоген, С1-С6-алкіл, С1-С3-перфторалкіл, за варіантом якому віддають перевагу, -CF3, С1-С6-алкоксигрупа, С3-С6-циклоалкіл, -СН2-С3-С6-циклоалкіл, гідроксил, -NH2 або -NO2;
R4, R5 і R6 - незалежно один від одного водень, феніл, галоген, С1-С3-алкіл, С1-С3-перфторалкіл, за варіантом, якому віддають перевагу, -CF3, -О-С1-С3-перфторалкіл, за варіантом, якому віддають перевагу, -O-CF3, C1-C3-алкоксигрупа, -ОН, -NH2 або -NO2; або фармацевтично прийнятна сіль або складний ефір такої сполуки.
10. Сполука за п. 1, яка є будь-якою з нижчеперелічених:
9-(4-метилбензил)-6-[4-(трифторметокси)феніл]-1,9-дигідропірано[3,4-b]індол-3,4-діон,
9-бензил-6-[4-(трифторметокси)феніл]-1,9-дигідропірано[3,4b]індол-3,4-діон,
9-(4-метилбензил)-6-(3-метилфеніл)-1,9-дигідропірано[3,4-b]індол-3,4-діон,
9-(4-трет-бутилбензил)-6-(3-метилфеніл)-1,9-дигідропірано[3,4-b]-індол-3,4-діон,
6-(бензилокси)-9-(4-метилбензил)-1,9-дигідропірано[3,4-b]індол-3,4-діон,
6-(бензилокси)-1,9-дигідропірано[3,4-b]індол-3,4-діон,
6-(бензилокси)-9-(4-трет-бутилбензил)-1,9-дигідропірано[3,4-b]індол-3,4-діон,
9-(4-трет-бутилбензил)-6-гідрокси-1,9-дигідропірано[3,4-b]індол-3,4-діон,
9-бензил-6-(4-хлорфеніл)-1,9-дигідропірано[3,4-b]індол-3,4-діон,
[1-бензил-5-(4-хлорфеніл)-2-(гідроксиметил)-1H-індол-2-іл]-(оксо)оцтова кислота,
9-бензил-6-(3-метилфеніл)-1,9-дигідропірано[3,4-b]індол-3,4-діон,
9-бензил-6-(1,1’-біфеніл-4-іл)-1,9-дигідропірано[3,4-b]індол-3,4-діон або
[1-бензил-5-(1,1’-біфеніл-4-іл)-2-(гідроксиметил)-1H-індол-3-іл]-(оксо)оцтова кислота,
або фармацевтично прийнятна сіль або складний ефір такої сполуки.
11. Спосіб інгібування інгібітора активатора плазміногена в організмі ссавця, який включає введення в організм ссавця, що потребує такого інгібування, терапевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
12. Фармацевтична композиція, що містить сполуку за будь-яким із пп. 1-10 і фармацевтичний носій.
13. Спосіб лікування тромбозу або фібринолітичної недостатності у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
14. Спосіб за п. 13, де згаданий тромбоз або фібринолітична недостатність пов'язані з утворенням атеросклеротичних бляшок, тромбозом вен і артерій, ішемією міокарда, фібриляцією передсердя, глибоким тромбозом вен, синдромами коагуляції, фіброзом легенів, церебральним тромбозом, тромбоемболічними ускладненнями при хірургічних операціях або з оклюзією периферичних артерій.
15. Спосіб лікування захворювання периферичних артерій у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
16. Спосіб лікування нападу, пов'язаного з фібриляцією передсердя або такого, що виникає внаслідок такої фібриляції у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
17. Спосіб лікування глибокого тромбозу вен у ссавця, що включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
18. Спосіб лікування ішемії міокарда у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
19. Спосіб лікування серцево-судинного захворювання, викликаного інсулінонезалежним цукровим діабетом у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за п. 1.
20. Спосіб лікування утворення атеросклеротичних бляшок у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
21. Спосіб лікування хронічного обструктивного легеневого захворювання у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
22. Спосіб лікування фіброзу нирок у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
23. Спосіб лікування синдрому полікістозу яєчників у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
24. Спосіб лікування хвороби Альцгеймера у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
25. Спосіб лікування раку у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10.
Текст
1. Сполуки формули І і формули II: O O та O O 3 O 80453 O R2 O 4 но прийнятна сіль або складний ефір такої сполуки. 8. Сполука формули (V): O O R2 N R1 R3 R4 (III) , де R1 - C1-C8-алкіл, С3-С6-циклоалкіл, -СН2-С3-С6циклоалкіл, піридиніл, -СН2-піридиніл, феніл або бензил, причому цикли згаданих циклоалкілу, піридинілу, фенілу і бензилу можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -О-С1С6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і NO2; R2 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкіл, С1-С6-алкоксигрупа, С3-С6циклоалкіл, -СН2-С3-С6-циклоалкіл, -NH2 або -NO2; R3 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкіл, C1-C6-алкоксигрупа, С3-С6циклоалкіл, -СН2-С3-С6-циклоалкіл, гідроксил, NH2, -NO2, феніл, бензил, бензилоксигрупа, піридиніл або -СН2-піридиніл, причому цикли цих груп можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1С6-перфторалкіл, -О-С1-С6-перфторалкіл, С1-С6алкоксигрупа, -ОН, -NH2 і -NO2; або фармацевтично прийнятна сіль або складний ефір такої сполуки. 7. Сполука формули (IV) O O R3 O R2 O N R5 R1 R6 (V) , де R1 - C1-C8-алкіл, за варіантом, якому віддають перевагу, С1-С6-алкіл, С3-С6-циклоалкіл, -СН2-С3С6-циклоалкіл або бензил, причому цикли згаданих циклоалкілу і бензилу можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -О-С1-С6перфторалкіл, C1-С6-алкоксигрупа, -ОН, -NH2 і NO2; R2 - водень, галоген, C1-С6-алкіл, С1-С3перфторалкіл, якому віддають перевагу, -CF 3, С1С6-алкоксигрупа, С3-С6-циклоалкіл, -СН2-С3-С6циклоалкіл, гідроксил, -NH2 або -NO2; R4, R5 і R6 - незалежно один від одного водень, феніл, галоген, С1-С3-алкіл, С1-С3-перфторалкіл, О-С1-С3-перфторалкіл, С1-С3-алкоксигрупа, -ОН, NH2 або -NO2; або фармацевтично прийнятна сіль або складний ефір такої сполуки. 9. Сполука формули VI: R4 O O R2 R5 O R6 N R1 N (IV) , де R1 - C1-C8-алкіл, С3-С6-циклоалкіл, -СН2-С3-С6циклоалкіл, піридиніл, -СН2-піридиніл, феніл або бензил, причому цикли згаданих циклоалкілу, піридинілу, фенілу і бензилу можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -O-C1C6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і NO2; R2 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкіл, С1-С6-алкоксигрупа, С3-С6циклоалкіл, -СН2-С3-С6-циклоалкіл, -NH2 або -NO2; R3 - феніл, бензил, бензилоксигрупа, піридиніл або -СН2-піридиніл, причому цикли цих груп можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, C1-С6-алкіл, С1-С6перфторалкіл, -О-С1-С6-перфторалкіл, С1-С6алкоксигрупа, -ОН, -NH2 і -NO2; або фармацевтич R1 (VI) , де R1 - C1-C8-алкіл, С3-С6-циклоалкіл, -СН2-С3-С6циклоалкіл або бензил, причому цикли згаданих циклоалкілу і бензилу можуть бути необов’язково заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, якому віддають перевагу, -CF3, -О-С1-С6-перфторалкіл, за варіантом, якому віддають перевагу, -O-CF3 , С1С6-алкоксигрупа, -ОН, -NH2 і -NO2; R2 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкіл, за варіантом якому віддають перевагу, -CF3, С1-С6-алкоксигрупа, С3-С6-циклоалкіл, СН2-С3-С6-циклоалкіл, гідроксил, -NH2 або -NO2; R4, R5 і R6 - незалежно один від одного водень, феніл, галоген, С1-С3-алкіл, С1-С3-перфторалкіл, за варіантом, якому віддають перевагу, -CF3, -ОС1-С3-перфторалкіл, за варіантом, якому віддають перевагу, -O-CF3, C1-C3-алкоксигрупа, -ОН, -NH2 5 80453 6 або -NO2; або фармацевтично прийнятна сіль або складний ефір такої сполуки. 10. Сполука за п. 1, яка є будь-якою з нижчеперелічених: 9-(4-метилбензил)-6-[4-(трифторметокси)феніл]1,9-дигідропірано[3,4-b]індол-3,4-діон, 9-бензил-6-[4-(трифторметокси)феніл]-1,9дигідропірано[3,4b]індол-3,4-діон, 9-(4-метилбензил)-6-(3-метилфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діон, 9-(4-трет-бутилбензил)-6-(3-метилфеніл)-1,9дигідропірано[3,4-b]-індол-3,4-діон, 6-(бензилокси)-9-(4-метилбензил)-1,9дигідропірано[3,4-b]індол-3,4-діон, 6-(бензилокси)-1,9-дигідропірано[3,4-b]індол-3,4діон, 6-(бензилокси)-9-(4-трет-бутилбензил)-1,9дигідропірано[3,4-b]індол-3,4-діон, 9-(4-трет-бутилбензил)-6-гідрокси-1,9дигідропірано[3,4-b]індол-3,4-діон, 9-бензил-6-(4-хлорфеніл)-1,9-дигідропірано[3,4b]індол-3,4-діон, [1-бензил-5-(4-хлорфеніл)-2-(гідроксиметил)-1Hіндол-2-іл]-(оксо)оцтова кислота, 9-бензил-6-(3-метилфеніл)-1,9-дигідропірано[3,4b]індол-3,4-діон, 9-бензил-6-(1,1’-біфеніл-4-іл)-1,9дигідропірано[3,4-b]індол-3,4-діон або [1-бензил-5-(1,1’-біфеніл-4-іл)-2-(гідроксиметил)1H-індол-3-іл]-(оксо)оцтова кислота, або фармацевтично прийнятна сіль або складний ефір такої сполуки. 11. Спосіб інгібування інгібітора активатора плазміногена в організмі ссавця, який включає введення в організм ссавця, що потребує такого інгібування, терапевтично ефективної кількості сполуки за будь-яким із пп. 1-10. 12. Фармацевтична композиція, що містить сполуку за будь-яким із пп. 1-10 і фармацевтичний носій. 13. Спосіб лікування тромбозу або фібринолітичної недостатності у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10. 14. Спосіб за п. 13, де згаданий тромбоз або фібринолітична недостатність пов'язані з утворенням атеросклеротичних бляшок, тромбозом вен і артерій, ішемією міокарда, фібриляцією передсердя, глибоким тромбозом вен, синдромами коагуляції, фіброзом легенів, церебральним тромбозом, тромбоемболічними ускладненнями при хірургічни х операціях або з оклюзією периферичних артерій. 15. Спосіб лікування захворювання периферичних артерій у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10. 16. Спосіб лікування нападу, пов'язаного з фібриляцією передсердя або такого, що виникає внаслідок такої фібриляції у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10. 17. Спосіб лікування глибокого тромбозу вен у ссавця, що включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 110. 18. Спосіб лікування ішемії міокарда у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10. 19. Спосіб лікування серцево-судинного захворювання, викликаного інсулінонезалежним цукровим діабетом у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за п. 1. 20. Спосіб лікування утворення атеросклеротичних бляшок у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10. 21. Спосіб лікування хронічного обструктивного легеневого захворювання у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10. 22. Спосіб лікування фіброзу нирок у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10. 23. Спосіб лікування синдрому полікістозу яєчників у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 110. 24. Спосіб лікування хвороби Альцгеймера у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 110. 25. Спосіб лікування раку у ссавця, який включає введення в організм ссавця, що потребує такого лікування, фармацевтично ефективної кількості сполуки за будь-яким із пп. 1-10. Даний винахід стосується похідних заміщеного дигідропіраноіндол-3,4-діону, корисних як інгібітори інгібітора-1 активатора плазміногена (РАІ-1), і фармацевтичних композицій, що містять такі сполуки, для лікування хворобливих станів, які є наслідками фібринолітичних розладів, наприклад, глибокого венозного тромбозу і ішемічної хвороби серця, а також фіброзу легенів. Інгібітор-1 активатора плазміногена (РАІ-1) є основним регуляторним компонентом плазміногенплазмінної системи. РАІ-1 є головним фізіологічним інгібітором як активатора плазміногена тка 7 80453 нинного типу (tPA), так і активатора плазміногена типу урокінази (uPA). Підвищені рівні РАІ-1 в плазмі зв'язані з тромботичними явищами; це показане в експериментах на тваринах (Крішнамурті Krishnamurti, Blood, 69, 798 (1987); Рейлі - Reilly, Arteriosclerosis and Thrombosis, 11, 1276 (1991); Кармельє — Carmeliet, Journal of Clinical Investigation, 92, 2756 (1993)), а також в клінічних дослідженнях (Роша - Rocha, Fibrinolysis, 8, 294, 1994; Азнар - Aznar, Haemostasis 24, 243 (1994)). Нейтралізація дії РАІ-1 антитілами призводить до посилення ендогенного тромболізу і реперфузії (Бімонд - Biemond, Circulation, 91, 1175 (1995); Леві - Levi, Circulation 85, 305, (1992)). Підвищені рівні РАІ-1 відіграють роль також при деяких жіночих хворобах, наприклад, при синдромі полікістозу яєчників (Нордт - Nordt, Journal of clinical Endocrinology and Metabolism, 85, 4, 1563 (2000)) і остеопорозі, індукованому дефіцитом естрогенів (Дачі - Daci, Journal of Bone and Mineral Research, 15, 8, 1510 (2000)). Відповідно, агенти, що інгібують РАІ-1, можуть виявитися корисними при лікуванні хворобливих станів, які виникають внаслідок фібринолітичних розладів, наприклад, глибокого венозного тромбозу, ішемічної хвороби серця, фіброзу легенів, хвороби Альцгеймера, синдрому полікістозу яєчників тощо. У WO 99/43654 і WO 99/43651 як інгібітори фосфоліпаз, корисні при профілактиці запальних станів, запропоновані похідні індолу нижченаведеної формули: У патенті США № 4,851,406 розкриті кардіотонічні сполуки нижченаведеної формули: де А - п'ятичленний або шестичленний гетероцикл; X - зв'язок, алкілен або вінілен; R1 - Η, алкіл, алкеніл, циклоалкіл, циклоалкеніл, карбоксил, ціаногрупа, алкілкарбоніл, алкоксикарбоніл, амінокарбоніл, алкіламінокарбоніл, діалкіламінокарбоніл або арил; R2 - Н, алкіл, тригалогенметил, гідроксил, циклоалкіл, ціаногрупа, карбоксил, циклоалкеніл, карбоксил, ціаногрупа, алкілкарбоніл, алкоксикарбоніл, амінокарбоніл, алкіламінокарбоніл, діалкіламінокарбоніл або арил; і R3 - атом водню. У WO 96/32379 описані сполуки - інгібітори PDE нижченаведеної формули: де R1 - Η, галоген, нітрогрупа, карбоксил, захи щений карбоксил, нижчий алкеніл або ацил; R2 8 Н, галоген, карбоксил, нижчий алкеніл або ацил; R3 - нижчий алкеніл або нижчий алкеніл, обидва факультативно заміщені; і R4 - карбоксил, захищений карбоксил або ацил. WO 9928297 стосується заміщених індолів нижчеприведеної формули, що діють як інгібітори тромбіну і антагоністи рецепторів фібриногену: де Ra — галоген, карбоксил, R3R4N-CO-, R3R4SO2- або R4R5N-; Rb і Rd - або алкіли, або групи R2-A, де R2 - факультативно заміщений феніл і А - алкілен або заміщений алкілен; і Rс - водень або алкіл. У патенті ЕР 0 655 439 описані 5,6конденсовані біциклічні сполуки, в тому числі індоли, бензофурани і бензотіофени, які відповідають нижчеприведеній формулі, як інгібітори агрегування еритроцитів. Даний винахід стосується сполук формули І і формули II: де X - водень, лужний метал або основна аміногрупа; R1 – С1-С8-алкіл, за варіантом, якому віддають перевагу, С1-С6-алкіл, С3-С6-циклоалкіл, -СН2-С3С6-циклоалкіл, піридиніл, -СН2-піридиніл, феніл або бензил, причому цикли згаданих циклоалкілу, піридинілу, фенілу і бензилу можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -О-С1С6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і NO2; R2 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкіл, С1-С6-алкоксигрупа, С3-С6циклоалкіл, -СН2-С3-С6-циклоалкіл, гідроксил, -NH2 або -NO2; R3 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкіл, С1-С6, С3-С6-циклоалкіл, -СН2-Сз-С6циклоалкіл, гідроксил, -NH2, -NO2, феніл, бензил, бензилоксигрупа, піридиніл або -СН2-піридиніл, причому цикли цих груп можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять феніл, галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -О-С1С6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і NO2; або фармацевтично прийнятні солі або складні ефіри цих сполук. 9 80453 10 Варіантами сполук за даним винаходом, яким віддають перевагу, є сполуки формули (III) і формули (IV): де R1, R2 і R3 відповідають вищенаведеним визначенням, або фармацевтично прийнятні солі або складні ефіри цих сполук. Варіантами сполук за даним винаходом, яким віддають більшу перевагу, є сполуки формули (V) і формули (VI): де R1 - С1-С6-алкіл, за варіантом, якому віддають перевагу, С1-С6-алкіл, С3-С6-циклоалкіл, -СН2С3-С6-циклоалкіл або бензил, причому цикли згаданих циклоалкілу і бензилу можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С6-алкіл, С1-С6-перфторалкіл, -О-С1С6-перфторалкіл, С1-С6-алкоксигрупа, -ОН, -NH2 і NO2; R2 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкіл, за варіантом, якому віддають перевагу, -CF3, С1-С6-алкоксигрупа, С3-С6-циклоалкіл, СН2-С3-С6-циклоалкіл, гідроксил, -NH2 або -NO2; R4, R5 і R 6 - незалежно один від одного водень, феніл, галоген, С1-С3-алкіл, С1-С3-перфторалкіл, за варіантом, якому віддають перевагу, -CF3, -ОС1-С3-перфторалкіл, С1-С3-алкоксигрупа, -ОН, -NH2 або -NO2; або фармацевтично прийнятні солі або складні ефіри цих сполук. До лужних металів, придатних для застосування за даним винаходом, належать: натрій, калій, літій, кальцій, магній тощо. До придатних основних аміногруп належать: аміак, первинні аміни, вторинні аміни, третинні аміни, піридин, ароматичні аміни, бензиламіни тощо. Термін "алкіл" охоплює як нерозгалужені, так і розгалужені вуглецеві ланцюги. С1-С3-перфторалкільним замісником, якому віддають перевагу, є -CF3 , а -О-С1-С3перфторалкільним замісником, якому віддають перевагу є -OCF 3. Далі, даний винахід включає спосіб інгібування інгібітора активатора плазміногена типу 1 (РАІ-І) в організмі ссавця, який включає введення в організм ссавця, що потребує такого втручання, терапевтично ефективної кількості сполуки формули (І) і формули (II): де X - лужний метал або основна аміногрупа, що відповідають вищенаведеним визначенням; R1 - С1-С8-алкіл, за варіантом, якому віддають перевагу, С1-С6-алкіл, С3-С6-циклоалкіл, -СН2-С3С6-циклоалкіл, піридиніл, -СН2-піридиніл, феніл або бензил, причому цикли згаданих циклоалкілу, піридинілу, фенілу і бензилу можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С3-алкіл, С1-С3-перфторалкіл, -О-С1С3-перфторалкіл, С1-С3-алкоксигрупа, -ОН, -NH2 і NO2; R2 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкш, С1-С6-алкоксигрупа, С3-С6циклоалкіл, -СН2-С3-С6-циклоалкіл, гідроксил, -NH2 або -NO2; R3 - водень, галоген, С1-С6-алкіл, С1-С3перфторалкіл, С1-С6, С3-С6-циклоалкіл, -СН2-С3-С6циклоалкіл, гідроксил, -NH2, -NO2, феніл, бензил, бензилоксигрупа, піридиніл або –СН2-піридиніл, причому цикли цих груп можуть бути факультативно заміщені 1-3 замісниками, вибраними незалежно один від одного з групи, до якої входять галоген, С1-С3-алкіл, С1-С3-перфторалкіл, -О-С1-С3перфторалкіл, С1-С3-алкоксигрупа, -ОН, -NH2 і NO2; або фармацевтично прийнятні солі або складні ефіри цих сполук. Необмежувальними прикладами сольових форм сполук за даним винаходом, яким віддають перевагу, є натрієві і калієві солі. До інших придатних сольових форм цих сполук належать солі з фармацевтично прийнятними неорганічними і органічними основами, відомими в галузі. До неорганічних основ, вживаних для одержання сольових форм, належать гідроксиди, карбонати і бікарбонати терапевтично прийнятних лужних металів, наприклад, натрію, калію, магнію, кальцію тощо. До прийнятних органічних основ відносяться аміни, наприклад, бензиламін, моно-, ди- і триалкіламіни, за варіантом, якому віддають перевагу, такі, що містять алкільні групи, які включають від 1 до 6 атомів вуглецю, за варіантом, якому віддають більшу перевагу, від 1 до 3 атомів вуглецю, наприклад, метиламін, диметиламін, триметиламін, етиламін, діетиламін, триетиламін, моно-, ди- і триетаноламін. Придатні також алкілендіаміни, що містять до 6 атомів вуглецю, наприклад, гексаметилендіамін; циклічні насичені або ненасичені основи, що містять до 6 атомів вуглецю, в тому числі піролідин, піперидин, морфолін, піперазин і їхні Nалкіл- і N-гідроксіалкіл-похідні, наприклад, Nметилморфолін і N-(2-гідроксіетил)- піперидин, або піридин. Можуть бути одержані також четвертинні солі, наприклад, тетраалкільні форми, тетраметильні форми, алкіл-алканольні форми, наприклад, метилтриетанольні або триметилмоноетанольні форми, і циклічні амонієві сольові форми, наприклад, солі N-метилпіридинію, N-метил-(2 11 80453 гідроксіетил)-морфолінію, Ν,Ν-диметилморфолінію, N-метил-(2-гідроксіетил-морфолінію або Ν,Ν-диметилпіперидинію. Ці сольові форми можна одержувати, застосовуючи кислотні форми сполук формули І і відомі в галузі способи. Складноефірні форми сполук за даним винаходом включають складні ефіри, що містять нерозгалужені алкіли з 1-6 атомами вуглецю або розгалужені алкіли з 3-6 атомами вуглецю, в тому числі метилові, етилові, пропілові, бутилові, 2метилпропілові і 1,1-диметилетилові складні ефіри. До інших складних ефірів, придатних для цілей даного винаходу, належать складні ефіри формули -CQOR 7, де R7 вибраний з груп, що мають формули: де R8, R9, R10, R11 вибрані незалежно один від одного з групи, до якої входять водень, алкіл з 110 атомами вуглецю, арил з 6-12 атомами вуглецю, арилалкіл з 6-12 атомами вуглецю; гетероарил і алкілгетероарил, де гетероарильний цикл зв'язаний з іншою частиною молекули алкільним ланцюгом з 1-6 атомів вуглецю. Необмежувальними прикладами складноефірних форм сполук за даним винаходом є С1-С6алкілові складні ефіри, розгалужені С3-С6-алкілові складні ефіри, бензилові складні ефіри тощо. Термін "арил" в даному описі стосується ненасиченої ароматичної карбоциклічної групи, що складається з 6-14 атомів вуглецю і містить один цикл (наприклад, феніл) або декілька конденсованих циклів (наприклад, нафтил або антрил) До арилів, якому віддають перевагу, належать феніл, нафтил то що. Термін "гетероарил" в даному описі стосується ароматичної гетероциклічної системи (моноциклічної або біциклічної), де гетероарильні групи є п'яти- або шестичленними циклами, що містять від 1 гетероатому до 4 гетероатомів, вибраних з групи, яку складають S, N і О. Такі гетероарили можуть містити один цикл, наприклад, піридил, піроліл або фурил, або декілька конденсованих циклів, як, наприклад, індоліл, індолізиніл, бензофураніл або бензотієніл. До гетероарилів, яким віддають перевагу, належать піридил, піроліл і фурил. У разі відсутності відповідних обмежень у визначеннях арилів або гетероарилів, згаданих в даному описі, ці групи можуть бути факультативно заміщені замісниками в кількості від 1 до 5, вибраними з групи, до якої входять ацилоксигрупа, гідроксил, ацил, алкіл, що містить від 1 атому до 6 атомів вуглецю, алкоксигрупа, що містить від 1 атому до 6 атомів вуглецю, алкеніл, що містить від 2 атомів до 6 атомів вуглецю, алкініл, що містить від 2 атомів до 6 атомів вуглецю, заміщений алкіл, заміщена алкоксигрупа, заміщений алкеніл, заміщений алкініл, аміногрупа, аміногрупа, заміщена одним або двома алкілами, що містять від 1 атому до 6 атомів вуглецю, аміноацил, ациламіногрупа, азидогрупа, ціаногрупа, галоген, нітрогрупа, тіоалкоксигрупа, що містить від 1 атому до 6 атомів вуг 12 лецю, заміщена тіоалкоксигрупа, що містить від 1 атому до 6 атомів вуглецю, і тригалогенметил. До замісників при вищезазначених алкілах, алкенілах, алкінілах, тіоалкокси- і алкоксигрупах належать галогени, CN, ОН і аміногрупи. Замісниками, яким віддають перевагу, при згаданих арилах є алкіл, що містить від 1 атому до 6 атомів вуглецю, алкоксигрупа, що містить від 1 атому до 6 атомів вуглецю, галоген, ціаногрупа, нітрогрупа, тригалогенметил і тіоалкоксигрупа. Сполуки за даним винаходом є інгібіторами інгібітора серинпротеази РАІ-1, і тому корисні при лікуванні, пригніченні, запобіганні або профілактиці процесів, що включають продукування і/або дію РАІ-1, в організмах ссавців, за варіантом, якому віддають перевагу, людини. Таким чином, сполуки за даним винаходом корисні при лікуванні або профілактиці інсулінонезалежного цукрового діабету і запобіганні тромботичним явищам, пов'язаним з ішемічною хворобою серця і захворюванням судин мозку. Ці сполуки можуть бути корисними також для пригнічення хворобливих процесів, в тому числі тромботичних і протромботичних станів, необмежувальний перелік яких включає утворення атеросклеротичних бляшок, тромбоз вен і артерій, ішемію міокарда, фібриляцію передсердя, глибокий тромбоз вен, синдроми коагуляції, фіброз легенів, церебральний тромбоз, тромбоемболічні ускладнення при хірургічних операціях (наприклад, при заміні суглоба) і оклюзію периферичних артерій. Ці сполуки корисні також при лікуванні нападів, пов'язаних із фібриляцією передсердя або таких, що виникають внаслідок такої фібриляції. Сполуки за даним винаходом можуть виявитися корисними також при лікуванні захворювань, пов'язаних із накопиченням позаклітинної матриці, необмежувальний перелік яких включає фіброз нирок, хронічне обструктивне легеневе захворювання, синдром полікістозу яєчників, рестеноз, захворювання ниркових судин і відторгнення трансплантованих органів. Сполуки за даним винаходом можуть виявитися корисними також при лікуванні злоякісних новоутворень і захворювань, пов'язаних із неоангіогенезом (наприклад, діабетичної ретинопатії). Сполуки за даним винаходом можна застосовувати також в зв'язку з процесами або процедурами, що включають підтримування прохідності кровоносних судин (в тому числі з хірургічними операціями на судинах, відновленням прохідності шляхом трансплантації і розширення судин), з імплантацією і трансплантацією органів, тканин і клітин, або після таких процесів або процедур. Сполуки за даним винаходом можуть бути застосовані також при лікуванні хвороби Альцгеймера. Цей спосіб можна охарактеризувати також як інгібування активатора плазміногена під дією РАІ-1 в організмі ссавця, зокрема, людини, що страждає на хворобу Альцгеймера або схильної до неї. Цей спосіб можна охарактеризувати також як спосіб підвищення або нормалізації концентрації плазміну в організмі ссавця, зокрема, людини, що страждає на хворобу Альцгеймера або схильна до неї. 13 80453 Сполуки за даним винаходом корисні при обробці крові або продуктів крові, застосовуваних при діалізі, при зберіганні крові в рідкому стані, особливо при агрегуванні еритроцитів ex vivo. Сполуки за даним винаходом можна також додавати до плазми крові людини в процесі аналізу хімії крові в клінічних лабораторіях із метою визначення її фібринолітичної здатності. Сполуки за даним винаходом можна застосовувати також в сполученні з протромболітичними, фібринолітичними і антикоагуляційними агентами. Сполуки за даним винаходом можна застосовувати також при лікуванніракових пухлин, необмежувальний перелік яких включає рак молочної залози і яєчників, а також як проявляючі агенти для ідентифікації метастатичних ракових пухлин. Сполуки за даним винаходом можуть виявитися корисними також при лікуванні мієлофіброзу з мієлоїдною метаплазією шляхом регулювання гіперплазії клітин строми і збільшення кількості протеїнів позаклітинної матриці. Сполуки за даним винаходом можна застосовувати також в сполученні з інгібіторами протеаз у схемі високоактивної антиретровірусної терапії (HAART) для лікування захворювань, що виникають внаслідок фібринолітичної недостатності і внаслідок схильності до гіперкоагуляції у інфікованих ВІЛ-1 пацієнтів, що одержують таку терапію. Сполуки за даним винаходом можна застосовувати для лікування діабетичної невропатії і при діалізі нирок, зв'язаному з нефропатією. Сполуки за даним винаходом можна застосовувати для лікування раку, сепсису, ожиріння, резистентності до інсуліну, проліферативних захворювань, наприклад, псоріазу, підвищеної коагуляції, гомеостазу, захворювань судин мозку, захворювання мікросудин, гіпертензії, деменції, остеопорозу, артриту, астми, серцевої недостатності, аритмії, стенокардії, як агент заміщення гормонів, для лікування, профілактики або обернення розвитку атеросклерозу, хвороби Альцгеймера, остеопенії, для зниження рівня маркерів запалення, для зниження рівня С-реактивного білка, для профілактики або лікування запалення судин у легкій формі, інсульту, ішемічної хвороби серця, для первинної і вторинної профілактики інфаркту міокарда, стійкої і нестійкої стенокардії, для первинної профілактики серцево-судинних явищ, для вторинної профілактики серцево-судинних явищ, захворювання периферичних судин, захворювання периферичних артерій, гострих судинних синдромів, для зниження ризику необхідності процедури відновлення судин міокарда, мікром'язових захворювань, наприклад, нефропатії, невропатії, ретинопатії, нефротичного синдрому, діабету типу 1 і типу 2 і споріднених захворювань; гіперглікемії, гіперінсулінемії, злоякісних пошкоджень, передзлоякісних пошкоджень, шлунково-кишкових злоякісних захворювань, ліпосарком і епітеліальних пухлин, проліферативних захворювань, наприклад, псоріазу, підвищеної коагуляції, гомеостазу і/або підвищеної функції ендотелію і всіх форм захворювань судин головного мозку. 14 Сполуки за даним винаходом можна застосовувати також для місцевого нанесення при лікуванні ран із метою запобігання утворенню рубців. Способи лікування, пригнічення, запобігання або профілактики кожного з перелічених в даному описі захворювань або станів у ссавців є частиною даного винаходу. Кожний спосіб включає введення в організм ссавця, що потребує такого втручання, фармацевтично або терапевтично ефективної кількості сполуки за даним винаходом або фармацевтично прийнятної сольової або складноефірної форми такої сполуки. Сполуки за даним винаходом можна одержати, застосовуючи спосіб, показаний на Схемі І, або модифікацію цього способу, із застосуванням легко доступних вихідних матеріалів, реагентів і звичайних методик синтезу. Можливе також варіювання цих стадій процесу, які самі по собі відомі і знаходяться в межах знань і досвіду хімікафа хівця в галузі медичної хімії. У нижченаведених схемах реакцій R1, R2, R4 , R5 і R6 вибрані з груп, що відповідають вищенаведеним визначенням. Як видно зі Схеми І, броміндол-2-карбоксилати (II) вводять у реакцію з галогеналкілами або галогеналкіларилами із застосуванням основи, наприклад, гідриду натрію, в середовищі диметилформаміду (ДМФ) або тетрагідрофурану (ТГФ), і одержують N-заміщені броміндолкарбоксилати (III). Ці N-заміщені броміндолкарбоксилати (III) потім піддають перехресному сполученню з різними заміщеними арилгалогенідами в присутності паладієвих каталізаторів, і одержують N-заміщені ариліндолкарбоксилати (V). Згідно з альтернативним варіантом, шляхом проведення реакції броміндол-2-карбоксилатів (II) з різними заміщеними арилборними кислотами в умовах перехресного сполучення в присутності паладієвих каталізаторів одержують ариліндолкарбоксилати (IV). Алкілуванням сполук (IV) галогеналкілами або галогеналкіларилами в основному середовищі, як описано вище, одержують N-заміщені ариліндолкарбоксилати (V). Відновлення сполук V у відповідні спирти (VI) виконують, обробляючи сполуки V алюмогідридом літію в діетиловому ефірі або ТГФ. Провівши реакцію спирту (VI) з ацетилхлоридом у присутності основи, наприклад, триетиламіну або Ν,Νдіізопропілетиламіну, в інертному розчиннику, наприклад, у дихлорметані, одержують ацетат VII. Шляхом проведення реакції сполуки VII з оксалілхлоридом в ТГФ або дихлорметані з подальшим гасінням водою одержують кетокислоту VIII. Обробкою ацетату (VIII) водним розчином основи, наприклад, КОН або NaOH, в середовищі розчинника, наприклад, ТГФ, одержують сіль карбонової кислоти (IX). Лактонізацію сполук (IX) у відповідні похідні піраноіндолу (І) виконують шляхом обробки сполуки IX водним розчином кислоти, наприклад, хлористоводневої, в органічному розчиннику, наприклад, в дихлорметані. 15 80453 Даний винахід пропонує також фармацевтичні композиції, що містять фармацевтично або терапевтично ефективну кількість сполуки за даним винаходом або фармацевтично прийнятної сольової або складноефірної форми такої сполуки, в чистому вигляді або в сполученні з одним або декількома фармацевтично прийнятними носіями або наповнювачами (тобто з фармацевтично прийнятними матеріалами, що не мають фармакологічної дії). Мається на увазі, що в даному описі вираз "фармацевтично або терапевтично ефективна кількість сполуки" означає кількість сполуки, що розглядається, достатню для інгібування інгібітора серинпротеази РАІ-1 в організмі ссавця, що потребує такого інгібування, в достатній мірі для забезпечення бажаного поліпшення стану, що розглядається, або для забезпечення інгібування інгібітора серинпротеази РАІ-1 з метою запобігання, пригнічення або обмеження виникнення фізіологічної основи захворювання або стану, що розглядається. Точні дози сполук, що підлягають застосуванню, залежать від декількох чинників, в тому числі від особливостей пацієнта (як у ветеринарії, так і в медицині), природи і важкості стану, що підлягає лікуванню, способу введення лікарського засобу в організм і конкретної вживаної активної речовини. Згадані сполуки можна вводити в організм хворого будь-яким відомим способом, зокрема, ентеральним, за варіантом, якому віддають перевагу, пероральним в формі таблеток або капсул. Для застосування як лікарський засіб згадані сполуки можуть бути у вільному вигляді або в формі фармацевтично прийнятної солі; зокрема, це відноситься до застосування для профілактики або лікування атеросклерозу або його ускладнень (стенокардії, інфаркту міокарда, аритмій, серцевої недостатності, ниркової недостатності, інсульту, оклюзії периферичних артерій і аналогічних патологічних станів). Ці заходи сповільнюють розвиток хворобливого стану і сприяють організму в зміні напряму процесу під впливом природних чинників. Для приготування фармацевтичних композицій можна застосувати будь-який придатний для даного випадку носій, відомий в галузі. Носій в таких композиціях може бути твердою речовиною, рідиною або сумішшю твердої речовини з рідиною. До 16 твердих композицій належать порошки, таблетки і капсули. Твердий носій може являти собою одну або декілька речовин, які можуть також діяти як ароматизатор, змащувальний агент, солюбілізатор, суспензатор, в'яжуча речовина або дезинтегратор таблеток. У порошках носієм є тонкоподрібнена тверда речовина, що знаходиться в суміші з тонкоподрібненим активним інгредієнтом. У таблетках активний інгредієнт змішаний у відповідному співвідношенні з носієм, що має необхідні в'яжучі властивості, і суміш спресована в компактні одиниці бажаної форми і величини. До придатних носіїв належать карбонат магнію, стеарат магнію, тальк, цукор, лактоза, пектин, декстрин, крохмаль, желатин, трагакант, метилцелюлоза, гідроксиметилцелюлоза, натрієва карбоксиметилцелюлоза, низькоплавкий віск, какаова олія тощо. В сполученні зі сполуками за даним винаходом можуть бути застосовані також капсулювальні матеріали, і термін "композиція" охоплює активний інгредієнт в сполученні з капсулювальним матеріалом у вигляді лікарської форми, що містить або не містить інші носії. Для введення в організм протиатеросклеротичних лікарських засобів за даним винаходом можуть застосовуватися також крохмальні облатки. До стерильних рідких композицій належать розчини, суспензії, емульсії, сиропи і еліксири. Сполуки за даним винаходом можуть бути розчинені або суспендовані в фармацевтично прийнятному носії, наприклад, в стерильній воді, стерильному органічному розчиннику або в їх суміші. Перевагу віддають рідким носіям, придатним для парентеральних ін'єкцій. Якщо сполуки мають достатню розчинність, вони можуть бути розчинені безпосередньо в нормальному фізіологічному розчині із застосуванням або без застосування придатних органічнихрозчинників, наприклад, пропіленгліколю або поліетиленгліколю. При бажанні можуть бути приготовані дисперсії тонкоподрібнених сполук у водному розчині крохмалю або натрієвої карбоксиметилцелюлози або у придатній олії, наприклад, в арахісовій олії. Рідкі фармацевтичні композиції, якими є стерильні розчини або суспензії, можна застосовувати шля хом внутрішньом'язових, внутрішньоочеревинних або підшкірних ін'єкцій. У багатьох випадках рідкі форми композицій можуть бути застосовані замість такого, якому віддають перевагу, перорального способу введення твердого препарату. Перевагу віддають приготуванню одиничних дозованих форм сполук для стандартних схем застосування. Таким способом композиції можна легко поділяти на менші дози відповідно до рекомендацій лікаря. Одиничні дози можуть бути приготовані, наприклад, у формі фасованих порошків, флаконів або ампул, а за варіантом, якому віддають перевагу, у формі капсул або таблеток. Активна сполука може бути присутньою в ци х одиничних дозованих формах у кількостях від приблизно 1 г до приблизно 15 г або більш, розрахованих на однократне або багаторазове вживання протягом діб, відповідно до конкретної потреби пацієнта. Добова доза активної сполуки варіює в залежності від способу введення в організм, маси тіла, віку і 17 80453 статі пацієнта, важкості хворобливого стану і реакції на лікування, контрольованої за аналізом крові і швидкістю видужання пацієнта. Починаючи лікування з мінімальної добової дози приблизно 1 г, можна застосувати дані рівня РАІ-1 в крові і полегшення симптомів захворювання для визначення необхідності застосування більшої дози. Виходячи з даних, поданих нижче, розрахункова добова доза як у ве теринарії, так і в медицині становить від приблизно 25 мг до приблизно 200 мг на кг маси тіла на добу, більш звичайні дози становлять від приблизно 50 мг до приблизно 100 мг на кг маси тіла на добу. Здатність сполук за даним винаходом інгібувати інгібітор-1 активатора плазміногена була встановлена нижченаведеними експериментальними процедурами: Первинний скринінг на інгібування РАІ-1 Випробувані сполуки розчиняли в диметилсульфоксиді (ДМСО) в кінцевій концентрації 10 мМ, після чого розбавляли 100Х в буферному фізіологічному розчині. Випробування на інгібування починали шляхом додавання випробуваної сполуки (кінцева концентрація 1-100 мкМ, максимальна концентрація ДМСО 0,2%) до буферного розчину рН 6,6, що містив рекомбінантний інгібітор-1 активатора плазміногена людини в концентрації 140 нМ {Molecular Innovations, Royal Oak, Ml). Після інкубування протягом 1 год при кімнатній температурі додавали рекомбінантний тканинний активатор плазміногена (tPA) людини в концентрації 70 нМ, і суміш випробуваної сполуки, РАІ-1 і tPA інкубували додатково протягом 30 хв. Після повторного інкубування додавали хромогенний субстрат для tPA - Spectrozyme-tPA {American Diagnostica, Greenwich, CT), і вимірювали поглинання на довжині хвилі 405 нм в початковий момент часу (момент 0) і через 60 хв. Відносний ступінь інгібування РАІ-1 характеризувався залишковою активністю tPA в присутності випробуваної сполуки і РАІ-1. Контрольні проби включали повне інгібування tPA під дією РАІ-1 при використовуваному молярному співвідношенні (2:1) і відсутність якого-небудь впливу випробуваної сполуки на сам по собі tPA. Випробування для визначення ІС50 для інгібування РАІ-1 Це випробування побудоване на взаємодії між tPA і активним РАІ-1 у відсутності дисоціації під впливом SDS. Випробувальні планшети спочатку покривали tPA людини (10 мкг/мл). Випробувані сполуки розчиняли в ДМСО в концентрації 10 мМ, потім розбавляли фізіологічним буферним розчином (рН 7,5) до кінцевої концентрації 1-50 мкМ. Випробувані сполуки інкубували з РАІ-1 людини протягом 15 хв при кімнатній температурі. Покритий tPA планшет промивали розчином 0,05% Твін20 і 0,1% бичачого сироваткового альбуміну (BSA), а потім блокували 3% розчином BSA. Потім на планшет, покритий tPA, вміщували аліквотну кількість розчину випробуваної сполуки/РАІ-1, інкубували при кімнатній температурі протягом 1 год і промивали. Кількість активного РАІ-1, зв'язаного на планшеті, визначали шляхом додання аліквотної кількості розведення 1:1000 моноклонального антитіла ЗЗВ8 проти РАІ-1 людини (Molecular 18 Innovations, Royal Oak, Ml) і інкубування планшета при кімнатній температурі протягом 1 год. Планшет знову промивали і додавали розчин кон'югата козячої лужної фосфатази проти мишачого IgG в розведенні 1:50000 в козячій сироватці крові. Інкубували планшет протягом 30 хв при кімнатній температурі, промивали і додавали розчин субстрату лужної фосфатази. Інкубували планшет протягом 45 хв при кімнатній температурі і визначали розвиток фарбування шляхом вимірювання оптичної густини на довжині хвилі 405 нм (OD405нм ). Кількісне визначення активного РАІ-1, зв'язаного з tPA, при різних концентраціях випробуваної сполуки застосовували для визначення ІС 50. Результати аналізували із застосуванням апроксимації логарифмічним рівнянням. Чутливість випробування, визначена за калібрувальною кривою, що охоплює діапазон 0-100 нг/мл, становила 5 нг/мл РАІ-1 людини. Сполуки за даним винаходом інгібували інгібітор-1 активатора плазміногена з ефективністю, охарактеризованою в Таблиці 1. Таблиця 1 Приклад ІС50, мкМ 1 2 3 4 5 6 7 8 9 10 11 12 13 2,3 29,5 26,6 34,8 4,83 Процент інгібування в концентрації 25мкМ 34 22 6 40 59 30 40 36 Приклад 1 9-(4-метилбензил)-6-[4(трифторметокси)феніл]-1,9-дигідропірано[3,4-b]індол-3,4-діон Стадія 1 Етил-5-бром-1-(4-метилбензил)-1Н-індол-2карбоксилат NaH (60%, 3,88 г, 96,98 ммоль) додавали частинами при перемішуванні цо розчину етил-5бром-1Н-індол-2-карбоксилату (20,0 г, 74,6 ммоль) в ДМФ (140 мл) при 0°С в атмосфері азоту протягом 10 хв. Потім суміш нагрівали цо кімнатної температури. Після перемішування реакційної суміші при кімнатній температурі протягом 1 год додавали 4-метилбензилбромід (14,2 г, 74,6 ммоль), і суміш перемішували при кімнатній температурі протягом ночі. Гасили реакційну суміш водним розчином хлориду амонію і розбавляли водою. Водну суміш екстрагували етилацетатом. Органічний екстракт промивали водою і розсолом і сушили над безводним сульфатом магнію. Цю суміш концентрували, і одержували напівтверду речови 19 80453 ну, що містить 0,8 моль-еквівалента ДМФ. Масспектр (ESI, [M+H]+) m/z 372. 1H ЯМР (400 МГц, DMSO-d6) δ 7,93 (d, 1H, J=7,94 Гц), 7,55 (d, 1H, J=9,01 Гц), 7,40 (dd, 1H, J=8,85 Гц і 1,98 Гц), 7,32 (s, 1H), 7,04 (d, 2H, J=7,96 Гц), 6,90 (d, 2H, J=7,94 Гц), 5,79 (s, 2H), 4,28 (q, 2H), 2,20 (s, 3H) і 1,28 млн1 (t, 3H). Стадія 2 Етил-1-(4-метилбензил)-5-[4(трифторметокси)феніл]-1Н-індол-2-карбоксилат Суміш етил-5-бром-1-(4-метилбензил)-1Ніндол-2-карбоксилату (5,8 г, 15,54 ммоль), 4(трифторметокси)фенілборної кислоти (8,2 г, 38,85 ммоль), карбонату калію (5,4 г, 38,85 ммоль), комплексу [1’1’-біс(дифенілфосфіно)фероцен]дихлорпаладію (II) з дихлорметаном (1:1) (4,41 г, 5,44 ммоль) в суміші діоксану з водою (10:1, 154 мл) перемішували при 70°С протягом 2 днів. Реакційну суміш розбавляли водою і екстрагували етилацетатом. Органічний екстракт промивали водою і розсолом, після чого концентрували, одержуючи масло. Цей залишок кристалізували з діетилового ефіру і одержували вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини, т.пл. 77-78°С. Мас-спектр (ESI, [М+Н]+) m/z 454. 1H ЯМР (400 МГц, DMSO-d6) δ 8,00 (s, 1H), 7,78 (d, 2H, J=8,70 Гц), 7,67 (d, 1H, J=8,85 Гц), 7,61 (dd, 1H, J=8,70 і 1,68 Гц), 7,44 (s, 1H), 7,427,41 (m, 3H), 7,06 (d, 2H, J=7,94 Гц), 6,94 (d, 2H, J=8,09 Гц), 5,83 (s, 2H), 4,29 (q, 2H), 2,21 (s, 3H) і 1,30 млн-1 (t, 3H). Елементний аналіз для C26H22F3NO 3: Розраховано: С, 68,87; Η, 4,89; Ν, 3,09. Знайдено: С, 69,00; Η, 4,66; Ν, 3,06. Стадія 3 {1-(4-метилбензил)-5-[4(трифторметокси)феніл]-1Н-івдол-2-іл}метанол Алюмогідрид літію (0,244 г, 6,1 ммоль) додавали частинами при перемішуванні до розчину етил-1-(4-метилбензил)-5-[4-(трифторметокси)феніл]-1Н-індол-2-карбоксилату (2,0 г, 4,4 ммоль) у діетиловому ефірі (17 мл) при 0°С в атмосфері азоту протягом 5 хв. Потім суміш нагрівали до кімнатної температури. Після перемішування реакційної суміші при кімнатній температурі протягом 5 год, суміш обережно гасили водою і фільтрували. Фільтрат екстрагували етилацетатом. Органічний екстракт промивали водою і розсолом, сушили над безводним сульфатом магнію і випарювали, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини (1,56 г, 86%). Мас-спектр (ESI, [M+H]+) m/z 412. 1Я ЯМР (400 МГц, D MSO-d6): δ 7,81 (s, 1H), 7,76 (d, 2H, J=6,71 Гц), 7,45-7,35 (m, 4H), 7,08 (d, 2H, J=7,74 Гц), 6,96 (d, 2H, J=8,09 Гц), 6,50 (s, 1H), 5,44 (s, 2H), 5,35 (t, 1H), 4,60 (d, 2H) і 2,23 млн-1 (t, 3H). Елементний аналіз для C24H20F3NO 2: Розраховано: С, 70,07; Η, 4,90; Ν, 3,40. Знайдено: С, 69,80; Η, 4,75; Ν, 3,34. Стадія 4 {1-(4-метилбензил)-5[4(трифторметокси)феніл] Ш-індол-2іл}метилацетат Ацетилхлорид (0,222 мл, 3,08 ммоль) добавали при перемішуванні до розчину {1-(4 20 метилбензил)-5-[4-(трифторметокси)феніл]-1Ніндол-2-іл}метанолу (0,507г, 1,23 ммоль) та Ν,Νдіізопропілетиламіну (0,547 мл, 3,08 ммоль) у дихлорметані (8 мл) при 0°С в атмосфері азоту протягом 5 хв. Після перемішування реакційної суміші при кімнатній температурі протягом ночі суміш обережно гасили водою. Водну суміш екстрагували етилацетатом. Органічний екстракт промивали водою і розсолом, сушили над безводним сульфатом магнію і випарювали, одержуючи вказану в заголовку сполуку в вигляді твердої речовини (0,557г, 99,6%), т.пл.: 125-126°С. Мас-спектр (ESI, [M+H]+) m/z 454. 1H ЯМР (400 МГц, DMSO-d6): δ 7,86 (s, 1H), 8,77 (d, 2H, J=8,96 Гц), 7,48-7,40 (m, 4H), 7,09 (d, 2H, J=7,94 Гц), 6,90 (d, 2H, J=7,94 Гц), 6,70 (s, 1H), 5,44 (s, 2H), 5,23 (s, 2H), 2,23 (s, 3H) и 1,85 млн -1 (s, 3H). Елементний аналіз для C26H22F3NO 3: Розраховано: С, 68,32; Η, 4,94; Ν, 3,07. Знайдено: С, 67,96; Η, 4,57; Ν, 2,96. Стадія 5 {2-[(ацетилокси)метил]-1-(4-метилбензил)-5-[4(трифторметокси)феніл]-1Н-індол-3іл}(оксо)оцтова кислота Оксалілхлорид (1,05 мл) додавали краплями при перемішуванні до розчину {1-(4-метилбензил)5-[4-(трифторметокси)феніл1Н-індол-2-іл}метилацетату (0,515 г) в ТГФ (17 мл) при кімнатній температурі в атмосфері азоту протягом 5 хв. Після перемішування реакційної суміші при кімнатній температурі протягом 4 год суміш обережно гасили водою. Водну суміш екстрагували етилацетатом. Органічний екстракт промивали водою і розсолом, сушили над безводним сульфатом магнію і концентрували, одержуючи вказану в заголовку сполуку у вигляді світло-коричневої твердої речовини, т.пл.: 79-80°С. Мас-спектр (ESI, [М-Н]-) m/z 524. 1H ЯМР (400 МГц, DMSO-d6): δ 14,50 (br s, 1H), 8,20 (s, 1H), 7,74 (d, 2H, J=8,55 Гц), 7,70 (d, 1H, J=8,69 Гц), 7,62 (d, 1H, J=8,55 Гц), 7,47 (d, 2H, J=8,25 Гц), 7,15 (d, 2H, J=7,88 Гц), 6,99 (d, 2H, J=7,78 Гц), 5,64 (s, 2H), 5,53 (s, 2H), 2,25 (s, 3H) і 1,83 млн-1 (s, 3H). Елементний аналіз для C28H22F3NO 6: Розраховано: С, 64,00; Η, 2,67; Ν, 2,67. Знайдено: С, 63,77; Η, 3,99; Ν, 2,65. Стадія 6 {2-(гідроксиметил)- 1-(4-метилбензил)-5- [4(трифторметокси)феніл] Ш-індол-3іл}(оксо)оцтова кислота, калієва сіль Розчин {2- [ (ацетил окси)метил] -1 - (4метилбензил) -5-[4-(трифторметокси)-феніл]-1Ніндол-3-іл}(оксо)оцтової кислоти (0,50 г, 0,96 ммоль) і водний розчин гідроксиду калію (1,0-н., 2,38 мл, 2,38 ммоль) в суміші ТНF:вода (1:1, 16 мл) перемішували при кімнатній температурі протягом 4 год. Випарювали реакційну суміш досуха. Твердий залишок перемішували в суміші вода:гексан (8:92, 100 мл) і фільтрували, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини (0,4 г), т.пл.: 248-249,5°С. Мас-спектр (ESI, [М-Н]-) m/z 482. 1Н Я МР (400 МГц, D MSO-d6): δ 8,51 (s, 1H), 7,73 (d, 2H, J=8,86 Гц), 7,50 (d, 1H, J=8,56 Гц), 7,45 (d, 1H, J=8,55 Гц), 7,43 (d, 2H, 21 80453 J=7,94 Гц), 7,09 (d, 2H, J=8,09 Гц), 7,05 (d, 2H, J=8,09 Гц), 5,74 (t, 1H), 5,55 (s, 2H), 4,80 (d, 2H, J=6,80 Гц) і 2,23 млн-1 (s, 3Н). Елементний аналіз для C26H20F3NO5×1,0 Κ×0,8 Н2О: Розраховано: С, 58,27; Н, 3,87; Ν, 2,61. Знайдено: С, 58,14; Н, 3,82; Ν, 2,59. Стадія 7 9-(4-метилбензил)-6-[4(трифторметокси)феніл]-1,9-дигідропірано[3,4-b]індол-3,4-діон Калієву сіль {2-(гідроксиметил)-1-(4метилбензил)-5-[4-(трифторметокси)феніл]-1Ніндол-3-іл}-(оксо)оцтової кислоти (0,355 г) розподіляли між дихлорметаном (400 мл) і 15% водним розчином НСl (100 мл) при перемішуванні. Органічний шар відділяли, промивали водою і випарювали, одержуючи вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини (0,304 г), т.пл.: 243-244°С. Мас-спектр (ESI, [М-Н]-) m/z 464. 1Н ЯМР (400 МГц, DMSO-d6): δ 8,23 (s, 1H), 7,81 (d, 2H, J=7,49 Гц), 7,77 (d, 1H, J=8,40 Гц), 7,67 (d, 1H, J=8,71 Гц), 7,46 (d, 2H, J=7,94 Гц), 7,16 (s, 4H,), 5,92 (s, 2H), 5,50 (s, 2H) і 2,25 млн -1 (s, 3Н). Елементний аналіз для C26H18F3NO 4: Розраховано: С, 67,10; Н, 3,90; N, 3,01. Знайдено: С, 66,82; Н, 3,71; N, 2,91. Приклад 2 9-бензил-6-[4-(трифторметокси)феніл]-1,9дигідропірано[3,4-b]індол-3,4-діон Стадія 1 Етил-5-бром-1-бензил-1H-індол-2карбоксилат Вказану в заголовку сполуку одержували з етил-5-бром-1Н-індол-2-карбоксилату і бензилброміду в основному за способом, описаним для Стадії 1 Прикладу 1. Продукт одержували у вигляді світло-жовтої твердої речовини. Мас-спектр (ESI, [М+Н]+) m/z 358. 1Н ЯМР (300 МГц, DMSO-d6) δ 7,94 (s, 1H), 7,55 (d, 1H, J=9,01 Гц), 7,42 (d, 1H, J=8,85 Гц), 7,34 (s, 1H), 7,30-7,21 (m, 3H), 6,99 (d, 2H, J=7,94 Гц), 5,85 (s, 2H), 4,28 (q, 2H) і 1,28 млн -1 (t, 3H). Елементний аналіз для С 18Н16ВrNO2: Розраховано: С, 60,35; Η, 4,50; Ν, 3,91. Знайдено: С, 69,19; Η, 4,51; Ν, 3,75. Стадія 2 Етил-1-бензил-5-[4(трифторметокси)феніл]-1Н-індол-2-карбоксилат Вказану в заголовку сполуку одержували з етил-5-бром-1-бензил-1Н-індол-2-карбоксилату і 4(трифторметокси)фенілборної кислоти в основному за способом, описаним для Стадії 2 Прикладу 1. Продукт одержували у вигляді масла. Масспектр (ESI, [M+H]+) m/z 440. 1H ЯМР (400 МГц, DMSO-d6) δ 8,01 (s, 1H), 7,79 (d, 2H, J=8,86 Гц), 7,67 (d, 1H, J=8,85 Гц), 7,62 (dd, 1H, J=8,70 Гц і 1,68 Гц), 7,44-7,42 (m, 2H), 7,28-7,20 (m, 3Н), 7,04 (d, 2H, J=7,94 Гц), 5,88 (s, 2H), 4,28 (q, 2H), 1,29 (t, 3Н). Стадія 3 {1-бензил-5-[4-(трифторметокси)феніл]-1Ніндол-2-іл}метанол Вказану в заголовку сполуку одержували з етил-1-бензил-5-[4-(трифторметокси)феніл]-1Ніндол-2-карбоксилату (Стадія 3 Прикладу 1) і алюмогідриду літію в основному за способом, описа 22 ним для Стадії 1 Прикладу 21. Продукт одержували у вигляді білої твердої речовини, т.пл.: 108109°С. Мас-спектр (ESI, [М+Н]+) m/z 398. 1H ЯМР (400 МГц, DMSO-d6) δ 7,82 (s, 1H), 7,76 (d, 2H, J=8,86 Гц), 7,42-7,36 (m, 4H), 7,29 (d, 1H, J=7,03 Гц), 7,27 (d, 1H, J=7,63 Гц), 7,23-7,20 (m, 1H), 7,06 (d, 2H, J=7,03 Гц), 6,52 (s, 1H), 5,50 (s, 2H), 5,36 (t, 1H) і 4,60 млн -1 (d, 2H). Елементний аналіз для C23H18F3NO 2: Розраховано: С, 69,52; Н, 4,57; N, 3,52. Знайдено: С, 69,21; Н, 4,38; N, 3,40. Стадія 4 {1-бензил-5-[4-(трифторметокси)феніл]-1Ніндол-2-іл}метилацетат Вказану в заголовку сполуку одержували з {1бензил-5-[4-(трифторметокси)феніл]-1Н-індол-2іл}метанолу і ацетилхлориду в основному за способом, описаним для Стадії 4 Прикладу 1. Продукт одержували у вигляді масла. Мас-спектр (ESI, [M+H]+) m/z 440. 1H Я МР (300 МГц, D MSO-d6) δ 7,88 (s, Ш), 7,77 (d, 2H, J=8,87 Гц), 7,48-7,40 (m, 4H), 7,29-7,22 (m, 3Н), 7,00 (d, 2Н, J=7,01 Гц), 6,72 (s, 1Н), 5,50 (s, 2H), 5,24 (s, 2H) і 1,80 млн-1 (s, 3Н). Елементний аналіз для C25H20F3NO 3: Розраховано: С, 68,33; Н, 4,59; N, 3,19. Знайдено: С, 68,19; Н, 4,70; N, 3,06. Стадія 5 {2- [(ацетилокси)метил] - 1-бензил-5- [4{трифторметокси)феніл] – 1H-індол-3-іл}(оксо)оцтова кислота Вказану в заголовку сполуку одержували з {1бензил-5-[4-(трифторметокси)феніл]-1Н-індол-2іл}метилацетату і оксалілхлориду в основному за способом, описаним для Стадії 5 Прикладу 1. Продукт одержували у вигляді коричневої твердої речовини; т.пл.: 85-86°С. Мас-спектр (ESI, [М-Н]-) m/z 510. 1H ЯМР (400 МГц, DMSO-d6) δ 14,40 (br s, 1H), 8,20 (s, 1H), 7,76 (d, 2H, J=6,72 Гц), 7,72 (d, 1H, J=8,70 Гц), 7,63 (d, 1H, J=8,70 Гц), 7,48 (d, 2H, J=8,24 Гц), 7,34-7,25(m, 3H), 7,08(d, 1H, J=7,23 Гц), 5,70 (s, 2H), 5,53 (s, 2H) і 1,78 млн -1 (s, 3Н). Елементний аналіз для C27H20F3NO 6: Розраховано: С, 63,41; Н, 3,94; N, 2,74. Знайдено: С, 63,02; Н, 3,97; N, 2,64. Стадія 6 {2-(гідроксиметил)-1-бензил-5-[4(трифторметокси)феніл]-1Н-індол-3-іл}(оксо)оцтова кислота, калієва сіль Вказану в заголовку сполуку одержували з {2[(ацетилокси)метил]-1-бензил-5-[4(трифторметокси)феніл]-1 Η-індол-3іл}(оксо)оцтової кислоти і водного розчину гідроксиду калію в основному за способом, описаним для Стадії 6 Прикладу 1. Продукт одержували у вигляді білої твердої речовини, т.пл.: 280-282°С. Мас-спектр (ESI, [М-Н]-) m/z 468. 1H ЯМР (400 МГц, DMSO-d6) δ 8,51 (s, 1H), 7,72 (d, 2H, J=8,70 Гц), 7,52 (d, 1H, J=8,55 Гц), 7,47-7,43 (m, 3H), 7,31-28 (m, 2H), 7,23 (d, 1H, J=7,18 Гц), 7,15 (d, 2H, J=7,18 Гц), 5,75 (t, 1H), 5,62 (s, 2H) і 4,81 млн-1 (d, 2H, J=6,72 Гц). Елементний аналіз для C25H18F3NO5×1,0 Κ×1,0 Η2Ο: Розраховано: С, 57,14; Η, 3,64; Ν, 2,67. Знайдено: С, 57,05; Η, 3,42; Ν, 2,55. 23 80453 Стадія 7 9-бензил-6-[4(трифторметокси)феніл]-1,9-дигідропірано[3,4Ь]індол-3,4-діон Вказану в заголовку сполуку одержували з калієвої солі {2-(гідроксиметил)-1-бензил-5-[4(трифторметокси)феніл]-1Н-індол-3-іл}(оксо)оцтової кислоти і водного розчину НСl в основному за способом, описаним для Стадії 7 Прикладу 1. Продукт одержували у вигляді злегка забарвленої твердої речовини; т.пл.: 239-240°С. Мас-спектр (ESI, [М+Н]+) m/z 452. 1H ЯМР (400 МГц, DMSO-d 6) δ 8,24 (s, 1H), 7,81 (dd, 2H, J=8,86 і 2,14 Гц), 7,74 (d, 1H, J=8,56 Гц), 7,68 (dd, 1H, J=8,54 і 1,83 Гц), 7,46 (d, 2H, J=7,94 Гц), 7,37-7,26 (m, 5H,), 5,93 (s, 2H) і 5,56 млн-1 (s, 2H). Елементний аналіз для C25H16F3NO 4: Розраховано: С, 66,52; Η, 3,57; Ν, 3,10. Знайдено: С, 66,59; Η, 3,50; Ν, 3,04. Приклад 3 9-(4-метилбензил)-6-(3-метилфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діон Стадія 1 Етил-1-(4-метилбензил)-5-(3-метилфеніл)-1Ніндол-2-карбоксилат Вказану в заголовку сполуку одержували з етил-5-бром-1-(4-метилбензил)-1Н-індол-2карбоксилату (Стадія 1 Прикладу 1) і 3-метилфенілборної кислоти в основному за способом, описаним для Стадії 2 Прикладу 1. Продукт одержували у вигляді твердої речовини. Мас-спектр (ESI, [M+H]+) m/z 384. 1H ЯМР (400 МГц, DMSO-d6) δ 7,95 (s, 1H), 7,63 (d, 1H, J=7,70 Гц), 7,60 (d, 1H, J=8,47 Гц), 7,48 (s, 1H), 7,44 (d, 1H, J=7,95 Гц), 7,39 (s, 1H), 7,33 (t, 1H, J=7,63 Гц), 7,14 (d, 1H, J=7,49 Гц), 7,07 (d, 2H, J=7,94 Гц), 6,93 (d, 2H, J=7,94 Гц), 5,82 (s, 2H), 4,29 (q, 2H, J=7,17 Гц), 2,37 (s, 3H), 2,21 (s, 3H) і 1,30 млн-1 (t, 3H, J=7,18 Гц). Стадія 2 [1 -(4-метилбензил) - 5 - (3-метилфеніл) – 1Hіндол-2-іл] метанол Вказану в заголовку сполуку одержували з етил-1-(4-метилбензил)-5-(3-метилфеніл)-1Ніндол-2-карбоксилату і алюмогідриду літію в основному за способом, описаним для Стадії 3 Прикладу 1. Продукт одержували у вигляді білої твердої речовини. Мас-спектр (ESI, [M+H]+) m/z 342. 1 H ЯМР (400 МГц, DMSO-d6) δ 7,77 (s, 1H), 7,46 (s, 1H), 7,42 (d, 1H, J=7,79 Гц), 7,37 (d, 1H, J=8,55 Гц), 7,33 (d, 1H, J=8,56 Гц), 7,31 (d, 1H, J=7,02 Гц), 7,29 (d, 1H, J=7,48 Гц), 7,10-7,07 (m, 4H), 6,96 (d, 2H, J=7,94 Гц), 6,48 (s, 1H), 5,54 (s, 2H), 5,33 (s, 1H), 4,60 (s, 2H), 2,36 (s, 3H) і 2,23 млн -1 (s, 3H). Елементний аналіз для C24H23NO 0,5 Н2О: Розраховано: С, 82,25; Η, 6,90; Ν, 4,00. Знайдено: С, 82,05; Η, 6,98; Ν, 3,88. Стадія 3 [1 - (4-метилбензил) -5-(3-метилфеніл) – 1Hіндол-2-іл] метилацетат Вказану в заголовку сполуку одержували з [1-(4-метилбензил)-5-(3метилфеніл)-1Н-індол-2-іл]метанолу і ацетилхлориду в основному за способом, описаним для Стадії 4 Прикладу 1. Продукт одержували у вигляді коричневого масла. Мас-спектр (ESI, [M+H]+) m/z 384. 1H ЯМР (400 МГц, DMSO-d6) δ 7,82 (s, 1H), 7,47 (s, 1H), 7,45-7,40 (m, 3H), 7,31 (t, 1H, J=7,74 24 Гц), 7,13-7,08 (m, 3H), 6,90 (d, 2H, J=8,09 Гц), 6,68 (s, 1H), 5,43 (s, 2H), 5,22 (s, 2H), 2,36 (s, 3H), 2,23 (s, 3H) і 1,85 млн -1 (s, 3H). Елементний аналіз для C26H25NO 2: Розраховано: С, 81,43; Η, 6,57; Ν, 3,65. Знайдено: С, 81,75; Η, 6,67; Ν, 3,26. Стадія 4 [2-[(ацетилокси)метил]-1-(4-метилбензил)-5-(3метилфеніл)-Ш-індол-3-іл]-(оксо)оцтова кислота Вказану в заголовку сполуку одержували з [1(4-метилбензил)-5-(3-метилфеніл)-1Н-індол-2іл]метилацетату і оксалілхлориду в основному за способом, описаним для Стадії 5 Прикладу 1. Продукт одержували у вигляді коричневої твердої речовини; т.пл.: 89-90°С. Мас-спектр (ESI, [M-H]-) m/z 454. 1Н ЯМР (400 МГц, D MSO-d6) δ 8,18 (s, 1H), 7,67 (d, 1H, J=8,69 Гц), 7,59 (dd, 1H, J=7,17 і 1,53 Гц), 7,44-7,41 (m, 2H), 7,36 (t, 1H, J=7,48 Гц), 7,18 (d, 1H, J=7,23 Гц), 7,13 (d, 1H, J=7,94 Гц), 5,63 (s, 2H), 5,53 (s, 2H), 2,39 (s, 3H), 2,24 (s, 3H) і 1,83 млн -1 (s, 3H). Елементний аналіз для C28H25NO5S 0,5 Н 2О: Розраховано: С, 72,40; Н, 5,64; N, 3,02. Знайдено: С, 72,41; Н, 5,44; N, 2,96. Стадія 5 9-(4-метилбензил)-6-(3-метилфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діон Вказану в заголовку сполуку одержували з [2[(ацетилокси)метил]-1-(4-метилбензил)-5-(3метилфеніл)-1Н-індол-3-іл](оксо)оцтової кислоти і водного розчину гідроксиду калію в основному за способом, описаним для Стадії 6 Прикладу 1, з подальшою обробкою водним розчином НСl в основному за способом, описаним для Стадії 7 Прикладу 1. Продукт одержували у вигляді білої твердої речовини; т.пл.: 216-217°С. Мас-спектр (ESI, [М+Н]+) m/z 396. 1H ЯМР (400 МГц, DMSO-d 6) δ 8,21 (s, 1H), 7,71 (d, 1H, J=8,56 Гц), 7,64 (dd, 1H, J=8,75 і 1,28 Гц), 7,49 (s, 1H), 7,46 (d, 1H, J=8,09 Гц), 7,36 (t, 1H, J=7,63 Гц), 7,19-7,14 (m, 5H,), 5,91 (s, 2H) і 5,49 (s, 2H), 2,39 (s, 3H), 2,26 млн-1 (s, 3H). Елементний аналіз для C26H21NO3S×0,4 H 2 O: Розраховано: С, 77,56; Η, 5,46; Ν, 3,48. Знайдено: С, 77,41; Η, 5,46; Ν, 3,49. Приклад 4 9-(4-іиреіи-бутилбензил)-6-(3-метилфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діон Стадія 1 (5-бром-1H-індол-2-іл)метанол Вказану в заголовку сполуку одержували з етил-5-бром-1Н-індол-2-карбоксилату і алюмогідриду літію в основному за способом, описаним для Стадії 3 Прикладу 1. Продукт одержували у вигляді твердої речовини; т.пл.: 111-112°С. Мас-спектр (ESI, [M-H]-) m/z 224. 1H ЯМР (400 МГц, D MSO-d6) δ 7,62 (s, 1H), 7,27 (d, 1H, J=8,02 Гц), 7,12 (d, 1H, J=8,02 Гц), 6,25 (s, 1H), 5,29 (t, 1H, J=5,50 Гц), 4,59 млн -1 (d, 2H, J=5,65 Гц). Елементний аналіз для C9H8BrNO: Розраховано: С, 47,82; Η, 3,57; Ν, 6,20. Знайдено: С, 47,94; Η, 3,42; Ν, 6,20. Стадія 2 [5-(3-метилфеніл)-1Н-індол-2-іл]метилацетат Суміш (5-бром-1Н-індол-2-іл)метанолу (9 г, 39,8 ммоль), 3-метилбензол-борної кислоти (6,14 25 80453 г, 43,78 ммоль), карбонату калію (13,75 г, 99,5 ммоль), ацетату паладію (II) (0,045 г) і тетрабутиламонійброміду (12,84 г, 39,8 ммоль) у суміші 10% діоксану з водою (знегаженої, 0,38 л) перемішували при 70°С. Ход реакції контролювали хроматографією в тонкому шарі (TLC). Додавали додаткову кількість 3-метил-бензолборної кислоти (5,6 г, 39,8 ммоль). Після припинення виявляння 5-бром-1-(4трет-бутилбензил)-1Н-індолу методом TLC реакційну масу охолоджували до кімнатної температури і видаляли розчинник декантацією. Густе масло, що залишилося, перемішували з гексаном. Гексан видаляли декантацією, а залишок розподіляли між водою і етилацетатом. Етилацетатний шар відділяли, промивали водою, фільтрували і концентрували. Залишок очищали флешхроматографією на колонці, застосовуючи як елюент суміш гексану з етилацетатом (55:45), і одержували [5-(3-метилфеніл)-1Н-індол-2-іл]метанол у вигляді коричневої твердої речовини (6,0 г). Провівши реакцію [5-(3-метилфеніл)-1Н-індол-2іл]метанолу з ацетилхлоридом за способом, описаним для Стадії 4 Прикладу 1, одержували вказану в заголовку сполуку у вигляді масла (3,94 г). Мас-спектр (ESI, [М-Н]-) m/z 278. 1Н ЯМР (400 МГц, DMSO-d 6) δ 7,76 (s, 1H), 7,46 (s, 1H), 7,427,36 (m, 3H), 7,30 (s, 1H), 7,10 (d, 1H, J=7,48 Гц), 6,50 (s, 1H), 2,37 (s, 3H) і 2,07 млн -1 (s, 3H). Стадія 3 [1-(4-іяреіи-бутилбензил)-5-(3-метилфеніл)1Н-індол-2-іл]метилацетат Карбонат калію (0,3 г, 2,15 ммоль) додавали при перемішуванні до 5-(3-метилфеніл)-1Н-індол2-іл]метилацетату (0,5 г, 1,79 ммоль) в ДМФ (5 мл) при кімнатній температурі в атмосфері азоту. Додавали 4-трет-бутилбензилбромід (0,356 г, 1,88 ммоль), і суміш перемішували при кімнатній температурі протягом ночі. Хід реакції контролювали TLC. Додавали додаткову кількість 4-третбутилбензилброміду (0,34 г, 1,8 ммоль), і продовжували перемішування при кімнатній температурі протягом 3 днів. Реакційну суміш гасили водним розчином хлориду амонію, розбавляли водою і екстрагували етилацетатом. Органічний екстракт промивали водою і розсолом, сушили над безводним сульфатом магнію і випарювали досуха. Залишок очищали флеш-хроматографією на колонці, застосовуючи як елюент суміш гексану з етилацетатом (85:15), і одержували вказану в заголовку сполуку у вигляді світло-коричневого масла (0,284 г). Мас-спектр (ESI, [М+Н]+) m/z 426. 1Н Я МР (400 МГц, DMSO-d 6) δ 7,83 (s, 1H), 7,49-7,47 (m, 2H), 7,44-7,41 (m, 2H), 7,32-7,29 (m, 3H), 7,11 (d, 1H, J=7,49 Гц), 6,91 (d, 2H, J=8,24 Гц), 6,69 (s, 1H), 5,44 (s, 2H), 5,23 (s, 2H), 2,36 (s, 3H), 1,78 (s, 3H) і 1,21 млн -1 (s, 9H). Елементний аналіз для C29H31NO2×0,3 H 2 O: Знайдено: С, 80,82; Η, 7,39; Ν, 3,25. Розраховано: С, 80,90; Η, 7,45; Ν, 3,17. Стадія 4 [2-[(ацетилокси)метил]-1-(4-трет-бутилбензил)5-(3-метилфеніл)-1Н-індол-3-іл]-(оксо)оцтова кислота Вказану в заголовку сполуку одержували з [1(4-трет-бутилбензил)-5-(3-метилфеніл)-1Н-індол-2 26 іл]метилацетату і оксалілхлориду в основному за способом, описаним для Стадії 5 Прикладу 1. Продукт одержували у вигляді світло-коричневої твердої речовини; т.пл.: 91-92°С. Мас-спектр (ESI, [М-Н]-) m/z 496. 1Н ЯМР (400 МГц, DMSO-d6) δ 8,18 (s, 1H), 7,72 (d, 2H, J=8,71 Гц), 7,61 (dd, 1H, J=8,70 і 1,38 Гц), 7,45-7,41 (m, 2H), 7,38-7,33 (m, 3H), 7,18 (d, 1H, J=8,70 Гц), 7,00 (d, 2H, J=8,24 Гц), 5,64 (s, 2H), 5,53 (s, 2H), 2,39 (s, 3H), 1,76 (s, 3H) і 1,22 млн -1 (s, 9H). Елементний аналіз для С 31Н31NO5×0,5 Н2 О: Розраховано: С, 73,50; Н. 6,37; N. 2,77. Знайдено: С, 73,43; Н, 6,57; N, 2,64. Стадія 5 9-(4-трет-бутилбензил)-6-(3-метилфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діон Розчин [2-[(ацетилокси)метил]-1-(4-третбутилбензил)-5-(3-метилфеніл)-1Н-індол-3іл](оксо)оцтової кислоти (0,27 г, 0,63 ммоль) і водний розчин карбонату калію (1,0-н., 1,1 мл, 1,1 ммоль) в суміші ТГФ:МеОН (1:1, 6,6 мл) перемішували при кімнатній температурі протягом 4 год. Випарювали реакційну суміш досуха. Залишок промивали водою і гексаном, одержуючи масло. Це масло розподіляли при перемішуванні між дихлорметаном (80 мл) і 15% водним розчином НСl (15 мл). Органічний шар відділяли, промивали водою і випарювали, одержуючи вказану в заголовку сполук у у вигляді злегка забарвленої твердої речовини, т.пл.: 196-197°С. Мас-спектр (ESI, [M+H]+) m/z 438. 1H ЯМР (400 МГц, D MSO-d6): δ 8,21 (s, 1H), 7,75 (d, 2H, J=8,55 Гц), 7,66 (dd, 1H, J=8,70 і 1,52 Гц), 7,50 (s, 1H), 7,47 (d, 1H, J=8,71 Гц), 7,38-7,35 (m, 3H), 7,20-7,17 (m, 3H), 5,92 (s, 2H), 5,50 (s, 2H) і 2,39 млн-1 (s, 3H). Елементний аналіз для C29H27NO3 0,5 Н 2О: Розраховано: С, 78,64; Η, 6,28; Ν, 3,16. Знайдено: С, 78,54; Η, 6,46; Ν, 3,04. Приклад 5 6-(бензилокси)-9-(4-метилбензил)-1,9дигідропірано[3,4-b]індол-3,4-діон Стадія 1 [5-(бензилокси)-Ш-індол-2-іл]метанол Вказану в заголовку сполуку одержували з етил-5-(бензилокси)-1Н-індол-2-карбоксилату і алюмогідриду літію за методикою, описаною для Стадії 3 Прикладу 1. Продукт одержували у вигляді білої твердої речовини, т.пл.: 106-107°С. Масспектр (ESI, [M+H]+) m/z 254. 1H ЯМР (400 МГц, DMSO-d6) δ 10,80 (s, 1H), 7,45 (d, 2H, J=7,33 Гц), 7,37 (t, 2H, J=7,49 Гц), 7,30 (d, 1H, J=7,18 Гц), 7,20 (d, 1H, J=8,71 Гц), 7,04 (s, 1H), 6,74 (dd, 1H, J=8,70 і 1,46 Гц), 6,16 (s, 1H), 5,16 (t, 1H, J=5,49 Гц), 5,01 (s, 2H), 4,55 млн -1 (d, 2H, J=5,50 Гц). Елементний аналіз для C6H15NO2: Розраховано: С, 75,87; Η, 5,97; Ν, 5,53. Знайдено: С, 75,96; Η, 6,11; Ν, 5,41. Стадія 2 [5-(бензилокси)-1Н-індол-2-іл]метилацетат Вказану в заголовку сполуку одержували з [5(бензилокси)-1Н-індол-2-іл]метанолу і ацетилхлориду в основному за способом, описаним для Стадії 4 Прикладу 1. Продукт одержували у вигляді сірої твердої речовини. Мас-спектр (ESI, [М+Н]+) т/г 296. 1H Я МР (400 МГц, DMSO-d6) δ 11,03 (s, 27 80453 1H), 7,45 (d, 2H, J=7,33 Гц), 7,38 (t, 2H, J=7,49 Гц), 7,30 (d, 1H, J=7,20 Гц), 7,24 (d, 1H, J=8,71 Гц), 7,08 (s, 1H), 6,81 (dd, 1H, J=8,70 і 1,45 Гц), 6,34 (s, 1H), 5,13 (s, 2H), 5,06 (s, 2H), 2,04 млн -1 (s, 3H). Елементний аналіз для С 18Н17NО3×0.2 Н2 О: Розраховано: С, 72,32; Η, 5,87; Ν, 4,69. Знайдено: С, 72,21; Η, 5,75; Ν, 4,66. Стадія 3 [5-(бензилокси)-1-(4-метилбензил)-1Н-індол-2іл]метилацетат Вказану в заголовку сполуку одержували з [5(бензилокси)-1Н-індол-2-іл]метилацетату і 4метилбензилброміду в основному за способом, описаним для Стадії 3 Прикладу 4. Продукт одержували у вигляді білої твердої речовини. Масспектр (ESI, [M+H]+) т/г 400. 1H Я МР (300 МГц, DMSO-d6) δ 7,45 (d, 2H, J=8,34 Гц), 7,37 (t, 2H, J=7,19 Гц), 7,31 (d, 1H, J=7,30 Гц), 7,26 (d, 1H, J=7,56 Гц), 7,15 (d, 1H, J=2,44 Гц), 7,07 (d, 2H, J=8,76 Гц), 6,85 (d, 2Н, J=8,81 Гц), 6,84 (s, 1H), 6,25 (s, 1H), 5,35 (s, 2H), 5,17 (s, 2H), 5,09 (s, 2H), 2,22 (s, 3Н), 1,84 млн -1 (s, 3Н). Елементний аналіз для C26H25NO3: Розраховано: С, 78,17; Η, 6,31; Ν, 3,51. Знайдено: С, 78,01; Η, 6,35; Ν, 3,46. Стадія 4 [2-[(ацетилокси)метил]-5-(бензилокси)-1-(4метилбензил)-1Н-індол-3-іл](оксо)-оцтова кислота Вказану в заголовку сполуку одержували з [5(бензилокси)-1-(4-метилбензил)-1Н-індол-2іл]метилацетату і оксалілхлориду в основному за способом, описаним для Стадії 5 Прикладу 1. Продукт одержували у вигляді злегка забарвленої твердої речовини; т.пл.: 91-92°С. Мас-спектр (ESI, [M-H]-) m/z 470. 1H ЯМР (400 МГц, DMSO-d6) δ 7,61 (s, 1Н), 7,50 (s, 1H), 7,47 (d, 2H, J=8,24 Гц), 7,39 (t, 2H, J=7,64 Гц), 7,32 (d, 1H, J=7,02 Гц), 7,11 (d, 2H, J=8,10 Гц),), 7,03 (d, 1H, J=8,99 Гц), 6,95 (d, 2H, J=7,79 Гц), 5,54 (s, 2H), 5,46 (s, 2H), 5,10 (s, 2H), 2,23 (s, 3H), 1,82 млн -1 (s, 3H). Елементний аналіз для C28H25NO6×0,6 Н2 О: Розраховано: С, 69,73; Н, 5,48; N, 2,90. Знайдено: С, 69,60; Н, 5,30; N, 2,80. Стадія 5 6-(бензилокси)-9-(4-метилбензил)-1,9дигідропірано[3,4-b]індол-3,4-діон Вказану в заголовку сполуку одержували з [2[(ацетилокси)метил]-5-(бензилокси)1-(4метилбензил)- 1Н-індол-3-іл](оксо)оцтової кислоти і водного розчину гідроксиду калію за методикою, описаною для Стадії 6 Прикладу 1, з подальшою обробкою водним розчином НС1 в основному за способом, описаним для Стадії 7 Прикладу 1. Продукт одержували у вигляді злегка забарвленої твердої речовини; т.пл.: 206-207°С. Мас-спектр (ESI, [М+Н]+) m/z 412. 1H ЯМР (400 МГц, DMSO-d6) δ 7,58 (s, 1H), 7,54 (d, 1H, J=9,01 Гц), 7,47 (d, 2H, J=7,33 Гц), 7,38 (t, 2H, J=8,63 Гц), 7,31 (t, 1H, J=7,18 Гц), 7,15-7,11 (m, 4H,), 7,05 (dd, 2H, J=9,44 і 2,44 Гц), 5,86 (s, 2H), 5,41 (s, 2H), 5,16 (s, 2H), 2,25 млн -1 (s, 3H). Елементний аналіз для C26H21NO4×0,8 H 2 O: Розраховано: С, 73,33; Η, 5,35; Ν, 3,29. Знайдено: С, 73,16; Η, 4,95; Ν, 3,20. Приклад 6 28 6-(бензилокси)-1,9-дигідропірано[3,4-b)]індол3,4-діон Стадія 1 [2[{ацетилокси)метил] -5(бензилокси)-1H-індол-3-іл] (оксо)оцтова кислота Вказану в заголовку сполуку одержували з [5(бензилокси)-1H-індол-2-іл]метилацетату (С тадія 2 Прикладу 5) і оксалілхлориду за методикою, описаною для Стадії 5 Прикладу 1. Продукт одержували у вигляді коричневої твердої речовини; т.пл.: >165°С (з розкладанням). Мас-спектр (ESI, [M-H]-) m/z 366. 1H Я МР (400 МГц, D MSO-d6) δ 12,42 (s, 1H), 7,51 (s, 1H), 7,48 (d, 2H, J=7,33 Гц), 7,43 (d, 1H, J=8,85 Гц), 7,39 (t, 2H, J=7,33 Гц), 7,32 (d, 1H, J=7,17 Гц), 6,99 (d, 1H, J=7,86 Гц), 5,41 (s, 2H), 5,10 (s, 2H), 2,13 млн -1 (d, 3Н). Елементний аналіз для С 20Н17NO6: Розраховано: С, 65,39; Η, 4,66; Ν, 3,81. Знайдено: С, 65,37; Η, 4,68; Ν, 3,83. Стадія 2 6-(бензилокси)-1,9-дигідропірано[3,4-b]індол3,4-діон Вказану в заголовку сполуку одержували з [2[(ацетилокси)метил]-5-(бензилокси)-1H-індол-3іл](оксо)оцтової кислоти і водного розчину гідроксиду калію за методикою, описаною для Стадії 6 Прикладу 1, з подальшою обробкою водним розчином НСl в основному за способом, описаним для Стадії 7 Прикладу 1. Продукт одержували у вигляді жовтої твердої речовини; т.пл.: >291°С (з розкладанням). Мас-спектр (ESI, [М-Н]-) m/z 306. 1 H ЯМР (400 МГц, DMSO-d6 δ 12,37 (s, 1H), 7,54 (s, 1H), 7,49 (s, 1H), 7,48 (d, 2H, J=8,86 Гц), 7,39 (t, 2H, J=7,64 Гц), 7,32 (d, 1H, J=7,18 Гц), 7,04 (dd, 1H, J=8,71 і 2,59 Гц), 5,82 (s, 2H) і 5,16 млн -1 (s, 2H). Елементний аналіз для C18H13NO4: Розраховано: С, 70,35; Н, 4,26; N, 4,56. Знайдено: С, 70,07; Н, 4,17; N, 4,49. Приклад 7 6-(бензилокси)-9-{4-треда-бутилбензил)-1,9дигщропірано[3,4-b]шдол-3,4-діон Стадія 1 [5-(бензилокси)-1-(4-трет-бутилбензил)-1Ншдол-2-іл]метилацетат Вказану в заголовку сполуку одержували з [5(бензилокси)-1Н-індол-2-іл] метил ацетату і 4-третбутилбензилброміду в основному за способом, описаним для Стадії 3 Прикладу 4. Продукт одержували у вигляді білої твердої речовини; т.пл.: 132-133°С. Мас-спектр (ESI, [M+H]+) m/z 442. 1Н ЯМР (400 МГц, DMSC-d6) δ 7,45 (d, 2H, J=7,33 Гц), 7,38 (t, 2H, J=7,33 Гц), 7,32-7,27 (m, 4Н), 7,16 (d, Ш, J=2,30 Гц), 6,88-6,84 (m, 3Н), 6,53 (s, 1Н), 5,36 (s, 2H), 5,18 (s, 2H), 5,08 (s, 2H), 1,77 (s, ЗН) і 1,21 млн -1 (s, 9H). Елементний аналіз для C29H31NO3: Розраховано: С, 78,88; Η, 7,08; Ν, 3,17. Знайдено: С, 78,79; Η, 7,07; Ν, 3,04. Стадія 2 [2-[(ацетилокси)метил]-5-(бензилокси)-1-(4трет-бутилбензил)-1Н-індол-3-іл](оксо)-оцтова кислота Вказану в заголовку сполуку одержували з [5(бензилокси)-1-(4-трет-бутилбензил)-1Н-індол-2іл]метилацетату і оксалілхлориду в основному за способом, описаним для Стадії 5 Прикладу 1. 29 80453 Продукт одержували у вигляді злегка забарвленої твердої речовини; т.пл.: 145-146°С. Мас-спектр (ESI, [М-Н]-) m/z 512. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,61 (d, 1H, J=2,14 Гц), 7,56 (d, 1Н, J=9,16 Гц), 7,48 (d, 2H, J=7,18 Гц), 7,39 (t, 2H, J=7,33 Гц), 7,337,31 (m, 4H) 7,05 (dd, 1H, J=9,01 і 2,45 Гц), 6,96 (d, 1H, J=8,25 Гц), 5,56 (s, 2H), 5,46 (s, 2H), 5,11 (s, 2H), 1,75 (s, 3H) і 1,21 млн'1 (s, 9H). Елементний аналіз для С 31Н31NO6×0,7 Н2 О: Розраховано: С, 70,76; Н, 6,21; N, 2,66. Знайдено: С, 70,76; Н, 6,39; N, 2,64. Стадія 3 6-(бензімокси)-9-(4-трет-бутіілбензил)-1,9дигідропірано[3,4-6]індол-3,4-діон Вказану в заголовку сполуку одержували з [2[(ацетилокси)метил]-5-(бензилокси)-1-(4-третбутилбензил)-1Н-індол-3-іл](оксо)оцтової кислоти і водного розчину гідроксиду калію в основному за способом, описаним для Стадії 6 Прикладу 1, з подальшою обробкою водним розчином НСl, як описано для Стадії 7 Прикладу 1. Продукт одержували у вигляді злегка забарвленої твердої речовини; т.пл.: 233-234°С. Мас-спектр (ESI, [М+Н]+) m/z 454. 1H ЯМР (400 МГц, D MSO-d 6) δ 7,59-7,56 (m, 2H), 7,47 (d, 1H, J=7,33 Гц), 7,39 (t, 2H, J=7,33 Гц), 7,35-7,30 (m, 3H), 7,15 (d, 2H, J=8,40 Гц), 7,07 (dd, 1H, J=9,05 Гц і 2,45 Гц), 5,87 (s, 2H), 5,42 (s, 2H), 5,16 (s, 2H) і 1,22 млн-1 (s, 9H). Елементний аналіз для C29H27NO4: Розраховано: С, 76,80; Н, 6,00; N, 3,09. Знайдено: С, 76,55; Н, 6,07; N, 2,98. Приклад 8 9-(4-трет-бутилбензил)-6-гідрокси-1,9дигідропірано[3,4-b]індол-3,4-діон Стадія 1 Етил1-(4-трет-бутилбензил)-5-метокси-1Ніндол-2-карбоксилат Вказану в заголовку сполуку одержували з етил-5-метокси-1Н-індол-2-карбоксилату і 4-(третбутил)бензилброміду в основному за способом, описаним для Стадії 1 Прикладу 1. Продукт одержували у вигляді твердої речовини. Мас-спектр (ESI, [M-H]-) m/z 364. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,48 (d, Ш, J=9,20 Гц), 7,27 (s, 1H), 7,24 (d, 2H, J=7,18 Гц), 7,16 (d, 1H, J=2,44 Гц), 6,96-6,92 (m, 3H), 5,77 (s, 2H), 4,28 (q, 2H), 3,76 (s, 3H), 1,28 (s, 3H) і 1,20 млн -1 (s, 9H). Елементний аналіз для C23H27NO3: Розраховано: С, 75,59; Η, 7,45; Ν, 3,83. Знайдено: С, 75,94; Η, 7,67; Ν, 3,66. Стадія 2 [1-(4-трет-бутилбензил)-5-метокси-1Н-індол-2іл]метанол Вказану в заголовку сполуку одержували з етил-1-(4-трет-бутилбензил)-5-метокси-1Н-індол-2карбоксилату і алюмогідриду літію в основному за способом, описаним для Стадії 3 Прикладу 1. Продукт одержували у ви гляді масла. Мас-спектр (ESI, [М-Н]-) m/z 322. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,27 (d, 2H, J=8,14 Гц), 7,20 (d, 1H, J=8,70 Гц), 7,01 (d, 1H, J=2,45 Гц), 6,94 (d, 2H, J=8,24 Гц), 6,68 (dd, 1H, J=8,85 і 2,44 Гц), 6,34 (s, 1H), 5,37 (s, 2H), 5,26 (t, 1H), 4,56 (d, 2H, J=4,43 Гц), 3,72 (s, 3H) і 1,21 млн-1 (s, 9H). Стадія 3 30 [1-(4-трет-бугалбензил)-5-метюкси-1Н-індол-2іл]метилацетат Вказану в заголовку сполуку одержували з [1(4-трет-бугилбензил)-5-метокси-1Н-індол-2іл]метанолу і ацетилхлориду в основному за способом, описаним для Стадії 7 Прикладу 1. Продукт одержували у вигляді білої твердої речовини. Масспектр (ESI, [М+Н]+) m/z 366. 1Н ЯМР (400 МГц, DMSO-d6) ( 7,30 (s, 1Н), 7,28 (d, 2H, J=8,10 Гц), 7,07 (d, 1H, J=2,45 Гц), 7,86 (d, 2H, J=8,24 Гц), 7,76 (dd, 1H, J=8,86 і 2,29 Гц), 6,54 (s, 1H), 5,36 (s, 2H), 5,18 (s, 2H), 3,74 (s, 3H), 1,77 (s, 3H) і 1,20 млн -1 (s, 9H). Елементний аналіз для C23H27NO3: Розраховано: С, 75,59; Н, 7,45; N, 3,83. Знайдено: С, 75,37; Н, 7,65; N, 3,70. Стадія 4 [2-[(ацетилокси)метил]-1-(4-трет-бутилбензил)5-метокси-1Н-індол-3-іл](оксо)-оцтова кислота Вказану в заголовку сполуку одержували з [1(4-трет-бутилбензил)-5-метокси-1Н-індол-2іл]метилацетату і оксалілхлориду в основному за способом, описаним для Стадії 5 Прикладу 1. Продукт одержували у вигляді коричневої твердої речовини; т.пл.: >105°С (з розкладанням). Масспектр (ESI, [М-Н]-) т/г 436. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,54 (d, 1H, J=8,10 Гц), 7,51 (d, 1H, J=1,68 Гц), 7,32 (d, 2H, J=8,25 Гц), 6,97-6,94 (m, 3H), 5,56 (s, 2H), 5,46 (s, 2H), 3,78 (s, 3H), 1,75 (s, 3H) і 1,21 млн -1 (s, 9H). Елементний аналіз для C25H27NO6 0,12 Н2 О: Розраховано: С, 68,3; Η, 6,25; Ν, 3,19. Знайдено: С, 69,00; Η, 6,66; Ν, 2,99. Стадія 5 9-(4-дареіи-бутилбензил)-6-метокси-1,9дигідропірано[3,4-b)індол-3,4-діон Вказану в заголовку сполуку одержували з [2[(ацетилокси)метил]-1-(4-трет-бутилбензил)-5метокси-1Н-індол-3-іл](оксо)оцтової кислоти і водного розчину гідроксиду калію в основному за способом, описаним для Стадії 6 Прикладу 1, з подальшою обробкою водним розчином НСl в основному за способом, описаним для Стадії 7 Прикладу 1. Продукт одержували у вигляді злегка забарвленої твердої речовини; т.пл.: 238-239°С. Мас-спектр (ESI, [М-Н]-) т/г 376. 1H Я МР (400 МГц, DMSO-d6) δ 7,56 (d, Ш, J=9,01 Гц), 7,48 (d, 1Н, J=2,45 Гц), 7,35 (d, 2H, J=8,40 Гц), 7,14 (d, 2H, J=8,25 Гц), 6,98 (dd, 1Н, J=8,86 і 2,44 Гц), 5,87 (s, 2H), 5,42 (s, 2H), 3,81 (s, 3Н), 1,22 млн -1 (s, 9Н). Елементний аналіз для C23H23NO4: Розраховано: С, 73,19; Н, 6,14; N, 3,71. Знайдено: С, 73,23; Н, 6,11; N, 3,60. Стадія 6 9-(4-трет-бутилбензил)-6-гідрокси-1,9дигідропірано[3,4-b]індол-3,4-діон Трибромід бору (2,2 мл, 23,3 ммоль) додавали краплями при перемішуванні до суспензії 9-(4трет-бутилбензил)-6-метокси-1,9дигідропірано[3,4-b]індол-3,4-діону (4,92 г, 13,0 ммоль) в дихлорметані (25 мл) при -78°С в атмосфері азоту протягом 20 хв. Потім суміш нагрівали до кімнатної температури. Після перемішування при кімнатній температурі протягом 6,5 год, реакційну суміш обережно гасили невеликою кількістю 31 80453 води і випарювали досуха. Залишок розмішували в діетиловому ефірі і фільтрували, одержуючи коричневу тверду речовину. Кристалізацією з водно-метанольної суміші одержували вказану в заголовку сполуку у вигляді коричневої твердої речовини (1,72 г). Мас-спектр (ESI, [M-H]-) m/z 362. 1H ЯМР (400 МГц, D MSO-d 6): δ 9,39 (s, 1H), 7,44 (d, 1H, J=8,85 Гц), 7,40 (d, 1H, J=2,29 Гц), 7,34 (d, 2H, J=8,25 Гц), 6,80 (dd, 1H, J=8,86 і 2,29 Гц), 5,84 (s, 2H), 5,37 (s, 2H), 1,22 млн -1 (s, 9H). Елементний аналіз для C22H21NO4S 0,7 H 2O: Розраховано: С, 70,27; Η, 6,00; Ν, 3,73. Знайдено: С, 70,01; Η, 5,62; Ν, 3,81. Приклад 9 9-бензил-6-(4-[хлорфеніл)-1,9дигідропірано[3,4-b]івдол-3,4-діон Стадія 1 (1-бензил-5-бром-1H-індол-2-іл)метанол Вказану в заголовку сполуку одержували з етил-5-бром-1 -бензил- 1Н-індол-2-карбоксилату і алюмогідриду літію в основному за способом, описаним для Стадії 3 Прикладу 1. Продукт одержували у вигляді напівтвердої речовини. Мас-спектр (ESI, [M-H]-) m/z 314. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,67 (s, 1H), 7,58-7,15 (m, 4H), 7,12 (d, 1H, J=8,69 Гц і 1,97 Гц), 6,98 (d, 2H, J=8,34 Гц), 6,41 (s, 1Н), 5,43 (s, 2H), 5,33 (t, 1H, J=5,57 Гц) і 4,54 млн -1 (d, 2H, J=5,43 Гц). Стадія 2 (1-бензил-5-бром-1H-шдол-2-іл)метилацетат Вказану в заголовку сполуку одержували з (1бензил-5-бром-1Н-індол-2-іл)метанолу і ацетилхлориду в основному за способом, описаним для Стадії 4 Прикладу 1. Продукт одержували у вигляді напівтвердої речовини. Мас-спектр (ESI, [M-H]-) m/z 356. 1H ЯМР (400 МГц, DMSO-d 6) δ 7,78 (d, 1H, J=2,13 Гц), 7,38 (d, 1H, J=8,86 Гц), 7,29-7,20 (m, 4H), 6,94 (d, 2H, J=7,17 Гц), 6,64 (s, 1H), 5,47 (s, 2H), 5,21 (s, 2H) і 1,79 млн-1 (s, 3H). Стадія 3 [1-бензил-5-бром-2-(гідроксиметил)-ІН-індол-3іл](оксо)оцтова кислота, калієва сіль Оксалілхлорид (30,2 мл) додавали краплями при перемішуванні до розчину (1-бензил-5-бром1Н-індол-2-іл)метилацетату (31,5 г, 88,0 ммоль) в ТГФ (890 мл) при кімнатній температурі в атмосфері азоту протягом ЗО хв. Хід реакції контролювали методом TLC. За потребою додавали додатково ацетилхлорид. Після завершення реакції суміш обережно гасили водою і екстрагували етилацетатом. Органічний екстракт промивали водою і розсолом, сушили над безводним сульфатом магнію і випарювали, одержуючи тверду речовину. Цю речовину обробляли при перемішуванні водним розчином гідроксиду калію (2,0-н., 96,8 мл, 193,6 ммоль) в суміші ТГФ:МеОН (1:1, 800 мл) при кімнатній температурі протягом 2год. Концентрували суміш, і одержували напівтверду речовину. Шляхом розтирання з водою і відділення твердого продукту фільтруванням одержували вказану в заголовку сполуку у вигляді світло-коричневої твердої речовини (32,2 г), т.пл.: >160°С (з розкладанням). Мас-спектр (ESI, [M-H]-) m/z 386. 1H ЯМР (400 МГц, DMSO-d6) δ 8,35 (d, 1H, J=1,99 Гц), 7,40 (d, 1Н, J=8,70 Гц), 7,29-7,26 (m, 4H), 7,23 (d, 2H, 32 J=7,33 Гц), 7,10 (d, 2Н, J=7,18 Гц), 5,72 (b, 1Н), 5,59 (s, 2H) і 4,81 млн -1 (s, 2H). Елементний аналіз для С 18Н13ВrNO 1,0 Κ·1,0 Η2Ο: Розраховано: С, 48,66; Н, 3,40; N, 3,15. Знайдено: С, 48,61; Н, 3,36; N, 2,89. Стадія 4 9-бензил-6-(4-хлорфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діон Суміш калієвої солі [1-бензил-5-бром-2(гідроксиметил)-1Н-індол-3-іл](оксо)оцтової кислоти (3,15 г, 7,4 ммоль), 4-хлорфенілборной кислоти (1,74 г, 2,6 ммоль), карбонату калію (2,55 г, 13,7 ммоль), ацетату паладію (II) (0,032 г) і тетрабутиламонійброміду (2,4 г, 7,4 ммоль) в суміші 15% діоксану з водою (45 мл) перемішували при 70°С. Ход реакції контролювали TLC. Після припинення виявлення [1-бензил-5-бром-2-(гідроксиметил)-1Ніндол-3-іл](оксо)оцтової кислоти за даними TLC, реакційну суміш о холоджували і видаляли розчинник декантацією. Темне каучукоподібне масло розподіляли між етилацетатом і 10% водним розчином НСl. Верхній органічний шар відділяли, промивали водою і фільтрували. Одержаний фільтрат випарювали, одержуючи тверду речовину. Цей продукт розтирали з діетиловим ефіром і сушили у вакуумі при 60°С протягом 8 год, одержуючи вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини (0,77 г), т.пл. 263264°С. Мас-спектр (ESI, [М+Н]+) т/г 402. 1H ЯМР (400 МГц, DMSO-d6) δ 8,19 (s, 1H), 7,71-7,67 (m, 3H), 7,63 (dd, 1H, J=8,66 Гц і 1,83 Гц), 7,49 (dd, 2H, J=8,54 Гц і J=1,95 Гц), 7,34-7,25 (m, ЗН), 7,22 (d, 2H, J=7,46 Гц), 5,88 (s, 2H) і 5,52 млн -1 (s, 2H). Елементний аналіз для С 24Н16СlNO3×0,4 Н2О: Розраховано: С, 70,47; Η, 4,14; Ν, 3,42. Знайдено: С, 70,57; Η, 4,19; Ν, 3,12. Приклад 10 [1-бензил-5-(4-хлорфеніл)-2-(гідроксиметил)1Н-індол-3-іл](оксо)-оцтова кислота, калієва сіль Стадія 1 [1-бензил-5-(4-хлорфеніл)-2-(гідроксиметил)1Н-індол-3-іл](оксо)-оцтова кислота, калієва сіль Розчин 9-бензил-6-(4-хлорфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діону (0,613 г, 0,1,53 ммоль) і водний розчин гідроксиду калію (1,0-н., 1,6 мл, 1,6 ммоль) в суміші ТГФ:МеОН (1:1, 14 мл) перемішували при кімнатній температурі протягом 2 год. Хід реакції контролювали з допомогою ЯМР. За потребою додавали додатково водний розчин гідроксиду калію. Після припинення виявлення вихідного матеріалу реакційну суміш випарювали досуха. Твердий залишок розтирали з діетиловим ефіром, і одержували вказану в заголовку сполуку у вигляді світло-сірої твердої речовини, т.пл.: 225226°С. Мас-спектр (ESI, [M-H]-) m/z 418. 1H ЯМР (400 МГц, DMSO-d6) δ 8,51 (s, 1H), 7,64 (d, 2H, J=8,55 Гц), 7,52-7,49 (га, 3Н), 7,45 (d, 1H, J=8,55 Гц), 7,31-7,28 (m, 2H), 7,18 (d, 1H, J=7,64 Гц), 7,15 (d, 2H, J=7,64 Гц), 5,75 (t, 1Н, J=7,57 Гц),), 5,61 (s, 2H) і 4,81 млн -1 (d, 2H, J=5,95 Гц). Елементний аналіз для C24H17ClNO4 1,0 Κ×1,6 Н2О: Розраховано: С, 59,22; Н, 4,18; Ν, 2,88. Знайдено: С, 59,02; Н, 3,90; Ν, 2,70. 33 80453 Приклад 11 9-бензил-6-(3-метилфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діон Стадія 1 9-бензил-6-(3-метилфеніл)-1,9дигідропірано[3,4-b]індол-3,4-діон Вказану в заголовку сполуку одержували з калієвої солі [1-бензил-5-бром-2-(гідроксиметил)-1Ніндол-3-іл](оксо)оцтової кислоти і 4-біфеніл-борної кислоти в основному за способом, описаним для Стадії 4 Прикладу 9. Продукт одержували у вигляді сірої твердої речовини, т.пл.: 225-226°С. Масспектр (ESI, [М+Н]+) т/г 382. 1Н Я МР (400 МГц, DMSO-d6) δ 8,22 (s, 1H), 7,22 (d, 1H, J=8,40 Гц), 7,65 (dd, 1H, J=8,45 і 1,83 Гц), 7,49 (s, 1H), 7,477,34 (m, 3H), 7,31 (d, 1H, J=7,33 Гц), 7,27 (d, 2H, J=8,40 Гц), 7,18 (d, Ш, J=7,48 Гц), 5,92 (s, 2H), 5,55 (s, 2H) і 2,39 млн -1 (s, 3H). Елементний аналіз для С 25Н19NO3×0,4 Н2 О: Розраховано: С, 77,26; Н, 5,14; N, 3,60. Знайдено: С, 77,45; Н, 5,09; N, 3,51. Приклад 12 9-бензил-6-(1,1'-біфеніл-4-іл)-1,9дигідропірано[3,4-b]індол-3,4-діон Стадія 1 9-бензил-6-(1,1'-біфеніл-4-іл)-1,9дигідрошрано[3,4-b]індол-3,4-діон Вказану в заголовку сполуку одержували з калієвої солі [1-бензил-5-бром-2-(гідроксиметил)-1Ніндол-3-іл](оксо)оцтової кислоти і 4-біфенілборної кислоти в основному за способом, описаним для Стадії 4 Прикладу 9. Продукт одержували у вигляді білої твердої речовини, т.пл.: 254-255°С. Мас Комп’ютерна в ерстка Д. Шев ерун 34 спектр (ESI, [М+Н]+) m/z 444. 1H ЯМР (400 МГц, DMSO-d6) δ 8,26 (s, 1H), 7,75-7,68 (га, 8H), 7,457,43 (m, 2H), 7,36-7,23 (m, 6H), 5,89 (s, 2H), 5,53 млн -1 (s, 2H). Елементний аналіз для С 30Н21NO3×0,2 Н2 О: Розраховано: С, 80,59; Н, 4,82; N, 3,13. Знайдено: С, 80,70; Η, 4,60; Ν, 2,82. Приклад 13 [1-бензил-5-(1,1'-біфеніл-4-іл)-2(гідроксиметил)-1Н-індол-3-іл]-(оксо)оцтова кислота, калієва сіль Стадія 1 [1-бензил-5-(1,1'-біфеніл-4-іл)-2(гідроксиметил)-1Н-індол-3-іл]-(оксо)оцтова кислота, калієва сіль Вказану в заголовку сполуку одержували з 9бензил-6- 1,1’ -біфеніл-4-іл)-1,9-дигідропірано[3,4b]індол-3,4-діону і водного розчину гідроксиду калію в основному за способом, описаним для Стадії 1 Прикладу 10. Продукт одержували у вигляді сірої твердої речовини, т.пл.: 266-268°С. Мас-спектр (ESI, [М-Н]-) m/z 460. 1H ЯМР (400 МГц, D MSO-d6) δ 8,58 (s, 1H), 7,70-7,72 (m, 6H), 7,52 (s, 2H), 7,48 (t, 2H, J=7,63 Гц), 7,36 (t, 1H, J=7,33 Гц), 7,32-7,29 (m, 2H), 7,24 (t, 1H, J=7,02 Гц), 7,17 (d, 1H, J=7,63 Гц), 5,76 (t, 1H), 5,62 (s, 2H) і 4,83 млн-1 (d, 2H, J=5,34 Гц). Елементний аналіз для C30H23NO4 1,0 Κ×1,50 Η2Ο: Розраховано: С, 68,42; Н, 4,79; N, 2,66. Знайдено: С, 68,24; Н, 4,85; N, 2,46. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of substituted dyhydropyranoindol-3,4-dion as inhibitors of plasminogen activator inhibitor-1 (раі-1)
Автори англійськоюIlokdakh Khassan Mahmud, Lee David Zenan
Назва патенту російськоюПроизводные замещенного дигидропираноиндол-3.4-диона как ингибиторы ингибитора-1 активатора плазминогена (pai-1)
Автори російськоюИлокдах Хассан Махмуд, Ли Дэви Зенан
МПК / Мітки
МПК: A61P 7/02, C07D 209/22, C07D 491/04
Мітки: похідні, інгібітора-1, заміщеного, pai-1, інгібітори, активатора, плазміногена, дигідропіраноіндол-3,4-діону
Код посилання
<a href="https://ua.patents.su/17-80453-pokhidni-zamishhenogo-digidropiranoindol-34-dionu-yak-ingibitori-ingibitora-1-aktivatora-plazminogena-pai-1.html" target="_blank" rel="follow" title="База патентів України">Похідні заміщеного дигідропіраноіндол-3,4-діону як інгібітори інгібітора-1 активатора плазміногена (pai-1)</a>
Попередній патент: Спосіб обробки золи-виносу
Наступний патент: Поршень для двигуна внутрішнього згоряння
Випадковий патент: Набір для визначення mage-а3












