Заміщені нафтиліндольні похідні як інгібітори активатора плазміногена типу 1 (pai-1)
Номер патенту: 78708
Опубліковано: 25.04.2007
Автори: Мейєр Скотт Крістіан, Кренделл Девід Лєрой, Елокдах Хассан Махмуд, Гандерсен Ерік Гаулд
Формула / Реферат
1. Сполука формули І:
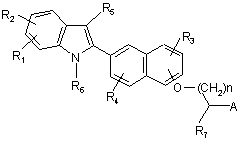 I,
I,
де:
R1, R2, R3 та R4, кожний незалежно, являють собою водень, алкіл, що містить 1-3 атоми вуглецю, циклоалкіл, що містить 3-5 атомів вуглецю, -СН2-циклоалкіл, що містить 3-5 атомів вуглецю, алканоїл, що містить 1-3 атоми вуглецю, галоген, гідрокси, арил, необов'язково заміщений 1-3 групами, вибраними з R8, перфторалкіл, що містить 1-3 атоми вуглецю, алкокси, що містить 1-3 атоми вуглецю, аміно, алкіламіно, що містить 1-3 атоми вуглецю, діалкіламіно, що містить 1-3 атоми вуглецю, перфторалкокси, що містить 1-3 атоми вуглецю;
R5 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, перфторалкіл, що містить 1-6 атомів вуглецю, арил, заміщений R8, алканоїл, що містить 1-6 атомів вуглецю, ароїл, необов'язково заміщений 1-3 групами, незалежно вибраними з R8;
R6, являє собою водень, алкіл, що містить 1-6 атомів вуглецю, алкіларил, (4-трет-бутил)бензил, бензил, заміщений R8, алканоїл, що містить 1-6 атомів вуглецю, ароїл, необов'язково заміщений 1-3 групами, незалежно вибраними з R8;
R7 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, алкіларил, арил, необов'язково заміщений 1-3 групами, незалежно вибраними з R8;
n являє собою ціле число, що має значення 0-6;
А являє собою СООН або сполуку, що імітує кислоту, таку як тетраазол, SO3Н, РО3Н2, тетронова кислота і т. д.;
R8 являє собою водень, алкіл, що містить 1-3 атоми вуглецю, циклоалкіл, що містить 3-5 атомів вуглецю, -СН2-циклоалкіл, що містить 3-5 атомів вуглецю, алканоїл, що містить 1-3 атоми вуглецю, галоген, гідрокси, перфторалкіл, що містить 1-3 атоми вуглецю, алкокси, що містить 1-3 атоми вуглецю, аміно, алкіламіно, що містить 1-3 атоми вуглецю, діалкіламіно, що містить 1-3 атоми вуглецю, перфторалкокси, що містить 1-3 атоми вуглецю;
або її фармацевтично прийнятна сіль або складний ефір.
2. Сполука за п. 1 формули
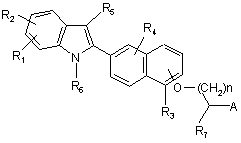 (1),
(1),
де R1, R2, R3, R4, R5, R6, R7,А, n і R8 визначені в п. 1, або її фармацевтично прийнятна сіль або складний ефір.
3. Сполука за пп. 1 або 2, де R4 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, перфторалкіл, що містить 1-6 атомів вуглецю, арил, заміщений R8, алканоїл, що містить 1-6 атомів вуглецю, ароїл, необов'язково заміщений 1-3 групами, незалежно вибраними з R8.
4. Сполука за будь-яким з пп. 1-3, де R1 являє собою водень.
5. Сполука за будь-яким з пп. 1-4, де R2 являє собою водень.
6. Сполука за будь-яким з пп. 1-5, де R3 являє собою бром.
7. Сполука за будь-яким з пп. 1-6, де R3 являє собою водень.
8. Сполука за будь-яким з пп. 1-7, де R4 являє собою водень.
9. Сполука за будь-яким з пп. 1-8, де R5 являє собою пентил.
10. Сполука за будь-яким з пп. 1-9, де R6 вибирають з групи, що включає бензил, метил, ацил, (2-трифторметил)бензил і (4-трет-бутил)бензил.
11. Сполука за будь-яким з пп. 1-10, де R7 являє собою водень.
12. Сполука за будь-яким з пп. 1-11, де n=0.
13. Сполука за будь-яким з пп. 1-12, де А являє собою СО2Н або тетразол.
14. Сполука за п. 1 формули:
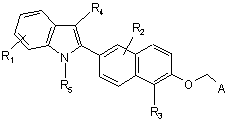 ,
,
де:
R1, R2 і R3, кожний незалежно, являють собою водень, алкіл, що містить 1-3 атоми вуглецю, циклоалкіл, що містить 3-5 атомів вуглецю, алканоїл, що містить 1-3 атоми вуглецю, галоген, гідрокси, арил, необов'язково заміщений 1-3 групами, незалежно вибраними з R6, перфторалкіл, що містить 1-3 атоми вуглецю, алкокси, що містить 1-3 атоми вуглецю, аміно, алкіламіно, що містить 1-3 атоми вуглецю, діалкіламіно, що містить 1-3 атоми вуглецю в алкільній групі, перфторалкокси, що містить 1-3 атоми вуглецю;
R4 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, перфторалкіл, що містить 1-6 атомів вуглецю, арил, заміщений R6, алканоїл, що містить 1-6 атомів вуглецю, ароїл, необов'язково заміщений 1-3 групами, незалежно вибраними з R6;
R5 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, алкіларил, бензил, необов'язково заміщений 1 -3 групами, незалежно вибраними з R6, алканоїл, що містить 1-6 атомів вуглецю, ароїл, заміщений R6;
А являє собою СООН або тетраазол;
R6, являє собою водень, алкіл, що містить 1-3 атоми вуглецю, циклоалкіл, що містить 3-5 атомів вуглецю, -СН2-циклоалкіл, що містить 3-5 атомів вуглецю, алканоїл, що містить 1-3 атомів вуглецю, галоген, гідрокси, перфторалкіл, що містить 1-3 атоми вуглецю, алкокси, що містить 1-3 атоми вуглецю, аміно, алкіламіно, що містить 1-3 атоми вуглецю, діалкіламіно, що містить 1-3 атоми вуглецю, перфторалкокси, що містить 1-3 атоми вуглецю;
або її фармацевтично прийнятна сіль або складний ефір.
15. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
6-(1-бензил-3-пентил-1Н-індал-2-іл)-1-бром-2-нафтилу 1Н-тетраазол-5-ілметилового ефіру,
1-бензил-2-[5-бром-6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-3-пентил-1Н-індолу,
1-метил-3-пентил-2-[6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-1Н-індолу,
2-[5-бром-6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-1-метил-3-пентил-1Н-індолу,
1-бром-6-(1-метил-3-пентил-1Н-індол-2-іл)-2-нафтилу 1Н-тетраазол-5-ілметилового ефіру,
1-ацетил-3-пентил-2-[6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-1Н-індолу,
1-ацетил-2-[5-бром-6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-3-пентил-1Н-індолу,
3-пентил-2-[6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-1-[2-(трифторметил)бензил]-1Н-індолу,
2-[5-бром-6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-3-пентил-1-[2-(трифторметил)-бензил]-1Н-індолу,
1-(4-трет-бутилбензил)3-пентил-2-[6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-1Н-індолу,
2-[5-бром-6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-1-(4-трет-бутилбензил)-3-пентил-1Н-індолу,
([1-бром-6-(1-метил-3-пентил-1Н-індол-2-іл)-2-нафтил]оксі)оцтової кислоти.
16. Сполука за п. 1, яка являє собою сполуку 1-бензил-3-пентил-2[6-(1Н-тетраазол-5-ілметокси)-2-нафтил]-1Н-індолу, та її фармацевтично прийнятні солі.
17.Спосіб лікування тромбозу або фібринолітичного порушення у ссавця, що включає введення ссавцеві, потребуючому цього, фармацевтично ефективної кількості сполуки за пп. 1-15.
18. Спосіб за п. 16, де тромбоз або фібринолітичне порушення пов'язане з утворенням атеросклеротичних бляшок, венозним або артеріальним тромбозом, ішемією міокарда, фібриляцією передсердя, глибоким тромбофлебітом, синдромами коагуляції, фіброзом легень, церебральним тромбозом, тромбоемболічними ускладненнями при хірургічному втручанні або оклюзією периферичних артерій.
19. Фармацевтична композиція, що містить фармацевтично ефективну кількість сполуки за будь-яким з пп. 1-16 або її фармацевтично прийнятної солі або складного ефіру і фармацевтично прийнятний ексципієнт або носій.
20. Застосування сполуки за будь-яким з пп. 1-15 як лікарського засобу.
21. Застосування сполуки за будь-яким з пп. 1-15 для отримання лікарського засобу для лікування тромбозу або фібринолітичного порушення у ссавця.
22. Спосіб отримання сполуки формули
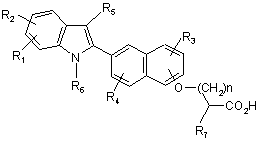 (2) ,
(2) ,
де R1, R2, R3, R4, R5, R6, R7 і n визначені в п. 1, або її фармацевтично прийнятної солі або складного ефіру, що включає
(a) гідроліз сполуки формули
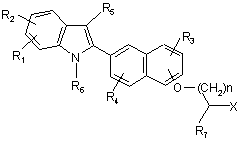 ,
,
де Х являє собою CN, СОгалоген, СООR12, CONR13R14, де R12 вибраний з С1-С6 алкілу, СО(С1-С6 алкілу), бензилу, необов'язково заміщеного однією або декількома групами, незалежно вибраними з С1-С6 алкілу, С1-С6 алкокси, фенілу, галогену, трифторметилу і трифторметокси, і фенілу, необов'язково заміщеного
однією або декількома групами, незалежно вибраними з С1-С6алкілу, С1-С6алкокси, фенілу, галогену, трифторметилу і трифторметокси;
R13 і R14 незалежно вибрані з С1-С6алкілу, С1-С6алкокси, водню, СО(С1-С6алкілу), бензилу, необов'язково заміщеного однією або декількома групами, незалежно вибраними з С1-С6алкілу, С1-С6алкокси, фенілу, галогену, трифторметилу і трифторметокси; і фенілу, необов'язково заміщеного однією або декількома групами, незалежно вибраними з С1-С6алкілу, С1-С6алкокси, фенілу, галогену, трифторметилу і трифторметокси; і при необхідності
(b) перетворення сполуки формули (2) в її фармацевтично прийнятний складний ефір або основно-адитивну сіль;
якщо необхідно:
(c) розділення рацемічної суміші сполук формули (2) з виділенням енантіомера сполуки формули (2) або її фармацевтично прийнятної солі або складного ефіру.
23. Спосіб отримання сполуки формули
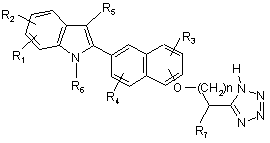 ,(3)
,(3)
де R1, R2, R3, R4, R5, R6 і n визначені в п. 1, або її фармацевтично прийнятної солі, що включає
(a) взаємодію сполуки формули
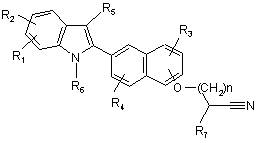
з азидом;
якщо необхідно
(b) перетворення сполуки формули (3) в її фармацевтично прийнятну основно-адитивну сіль;
якщо необхідно
(c) розділення рацемічної суміші сполук формули (3) з виділенням енантіомера сполуки формули (3) або її фармацевтично прийнятної солі.
Текст
Даний винахід відноситься до композиції і застосування заміщених нафтиліндольних похідних як інгібіторів інгібітору-1 активатора плазміногена (РАІ-1) і як терапевтичних композицій для лікування станів, пов'язаних з фібринолітичними порушеннями, такими як глибокий тромбофлебіт і коронарне захворювання серця, та фіброзом легень, а також до способів їх одержання. Інгібітор-1 активатора плазміногена (РАІ-1) є основним регуляторним компонентом системи плазміногена-плазміну. РАІ-1 є основним фізіологічним інгібітором як активатора плазміногена тканинного типу (tPA), так і активатора плазміногена урокіназного типу (uPA). Підвищені рівні вмісту у плазмі РАІ-1 зв'язували з виявленнями тромбозу, як було показано в експериментах з використанням тварин [Krishnamurti, Blood, 69, 798 (1987); Reilly, Arteriosclerosis and Thrombosis, 11, 1276 (1991); Carmeliet, Journal of Clinical Investigation, 92, 2756 (1993)] і у клінічних дослідженнях [Rocha, Fibrinolysis, 8, 294, 1994; Aznar, Haemostasis 24, 243 (1994)]. Активність РАІ-1 по нейтралізації антитіл промотує ендогенний тромболіз і реперфузію [Biemond, Circulation, 91, 1175 (1995); Levi, Circulation 85, 305, (1992)]. Підвищені рівні РАІ-1 також зв'язані із захворюваннями жінок, такими як синдром полікістозу яєчників [Nordt, Journal of Clinical Endocrinology and Metabolism, 85, 4, 1563 (2000)] та остеопороз, викликаний дефіцитом естрогену [Daci, Journal of bone and Mineral Research, 15, 8, 1510 (2000)]. Отже, речовини, що інгібують РАІ-1, були б корисні для лікування станів, зв'язаних з фібринолітичним порушенням, таким як глибокий тромбофлебіт, коронарне захворювання серця, емболія легень, синдром полікістозу яєчників і т.д. [WO 98/08818] розкриває заміщені індоли та бензімідазоли формул І, II і III, що є хімічними інгібіторами різних фосфоліпазних ферментів (такі як PLA2), корисні для лікування запалення. [WO 96/21656] розкриває сполуки формули І, корисні для лікування або профілактики ожиріння, раку молочної залози, остеопорозу, ендометріозу, серцево-судинних захворювань і захворювань передміхурової залози. Крім того, даний винахід може бути використаний для різних цілей. [ЕР 0655439 (Eli Lilly and Company)] відноситься до 5,6 конденсованих біциклічних сполук, включаючи індоли, бензофурани та бензотіофени, які відповідають загальній формулі І, як інгібітори агрегації тромбоцитів. [WO 95/10513 (Pfizer, Inc.)] розкриває заміщені індоли, бензофурани та бензотіофени формули І як агоністи естрогену, корисні для лікування синдромів і захворювань, викликаних дефіцитом естрогену. [WO 94/26738 і ЕР 0512570 (Fujisawa Pharmaceutical Co., Ltd.)] розкриває одержання заміщених індолів, бензофуранів і бензотіофенів (формула І), що володіють інгібіторною активністю проти АСАТ (фермент холестеринацилтрансфераза), які корисні для профілактики і/або лікування гіперхолестеринемії, гіперліпідемії, атеросклерозу або викликаних ними захворювань. [US 5151435] розкриває заміщені імідазоло/бензімідазоло-індоли та дигідроіндоли формули І, корисні як антагоністи ангіотензину II для лікування гіпертензії. [ЕР 0416609] розкриває сполуки, що містять індол, бензофуран і бензотіофен (формула І), які інгібують ліпоксигеназу, а також проліки даних сполук, що містять метаболічно відщеплювані групи. Даний винахід включає сполуки формули І: де: R1, R2, R3 і R4, кожний незалежно, являють собою водень, алкіл, що містить 1-3 атоми вуглецю, циклоалкіл, що містить 3-5 атомів вуглецю, -СН2-циклоалкіл, що містить 3-5 атомів вуглецю, алканоїл, що містить 1-3 атоми вуглецю, галоген, гідрокси, арил, необов'язково заміщений 1-3 групами, незалежно вибраними з R8, перфторалкіл, що містить 1-3 атоми вуглецю, алкокси, що містить 1-3 атоми вуглецю, аміно, алкіламіно, що містить 1-3 атоми вуглецю, діалкіламіно, що містить 1-3 атоми вуглецю, перфторалкокси, що містить 1-3 атоми вуглецю; R5 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, арил, заміщений R8, алканоїл, що містить 1-6 атомів вуглецю, ароїл, необов'язково заміщений 1-3 групами, вибраними з R8; R6 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, алкіларил, бензил, заміщений R8, алканоїл, що містить 1-6 атомів вуглецю, ароїл, необов'язково заміщений 1-3 групами, незалежно вибраними з R8; R7 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, алкіларил, арил, необов'язково заміщений 1-3 групами, вибраними з R8; n являє собою ціле число, що має значення 0-6; А являє собою СООН або сполуку, що імітує кислоту, таку як тетразол, SO3H, РО3Н, тетронова кислота і т.д.; R8 являє собою водень, алкіл, що містить 1-3 атоми вуглецю, циклоалкіл, що містить 3-5 атомів вуглецю, -СН2-циклоалкіл, що містить 3-5 атомів вуглецю, алканоїл, що містить 1-3 атоми вуглецю, галоген, гідрокси, перфторалкіл, що містить 1-3 атоми вуглецю, алкокси, що містить 1-3 атоми вуглецю, аміно, алкіламіно, що містить 1-3 атоми вуглецю, діалкіламіно, що містить 1-3 атоми вуглецю, перфторалкокси, що містить 1-3 атоми вуглецю; або їх фармацевтично прийнятні солі або складні ефіри. Як використовується у даному описі, алкіл включає алкільні групи як з прямим, так і з розгалуженим ланцюгом, а галоген включає бром, хлор, фтор і йод. Складноефірні форми сполук за даним винаходом включають фармацевтично прийнятні складноефірні форми, відомі в області техніки для кислотних груп формули І, вказаної вище. Такі складні ефіри включають складні алкілові ефіри з прямим ланцюгом, що містять 1-6 атомів вуглецю, або алкільні групи з розгалуженим ланцюгом, що містять 3-6 атомів вуглецю, які включають метилові, етилові, пропілові, бутилові, 2-метилпропілові та 1,1-диметилетилові складні ефіри. Інші необмежувальні приклади складних ефірів, що використовуються у даному винаході, включають складні ефіри, в яких А являє собою карбонову кислоту і складноефірна форма має формулу -COOR9, де R9 вибраний з формул: де: R9, R10, R11 і R12 незалежно вибрані з водню, алкілу, що містить 1-10 атомів вуглецю, арилу, що містить 6-12 атомів вуглецю, арилалкілу, що містить 6-12 атомів вуглецю, гетероарилу або алкілгетероарилу, де гетероарильне кільце зв'язане алкільним ланцюгом, що містить 1-6 атомів вуглецю. З переважних складноефірних форм, сполуки за даним винаходом включають, але не обмежуються ними, C1-С6 алкілові ефіри, С3-С6 алкілові ефіри з розгалуженим ланцюгом, бензилові ефіри і т.д. Кислотні імітатори, або міметики, включені у кислотні групи за даним винаходом, як вказано у визначенні А вище, зокрема, включають фармацевтично корисні імітатори карбонових кислот, або міметики, відомі з рівня техніки, такі як описані у [R.Silverman, The Organic Chemistry of Drug design and Drug Action, Academic Press (1992), зміст якого включений у даний опис за допомогою посилання]. Необмежувальні приклади таких кислотних міметиків включають, наприклад, тетразол, SO3H, PO3H, тетронову кислоту і т.д. або групи формул: де R13 являє собою C1-С6 алкіл, С2-С6 алкеніл, С3-С6 циклоалкіл, -СН2 -(С3-С6 циклоалкіл), -С3-С6 циклоалкеніл, -СН2 -(С3-С6 циклоалкеніл), необов'язково заміщену арильну або гетероарильну групу або необов'язково заміщений C1-С6 алкіларил або C1-С6 алкілгетероарил, де арильна і гетероарильна групи та їх необов'язкові замісники визначені нижче. Як використовується у даному описі, термін алкіл відноситься до аліфатичного вуглеводневого ланцюга і включає лінійні і розгалужені ланцюги, наприклад, з 1-6 атомів вуглецю, такі як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил, неопентил, н-гексил та ізогексил. Галоген, галогенід або гало- відноситься до йоду, брому, хлору і фтору. Як використовується у даному описі, термін "арил" відноситься до ненасиченої ароматичної карбоциклічної групи з 6-14 атомів вуглецю, яка має одне кільце (наприклад, феніл), або декілька конденсованих (злитих) кілець (наприклад, нафтил або антрил). Переважні арильні групи включають феніл, нафтил і т.п. Як використовується у даному описі, термін "гетероарил" відноситься до моноциклічної або біциклічної ароматичної групи з 1-9 атомів вуглецю і 1-4 гетероатомів, незалежно вибраних з кисню, азоту і сірки у межах, щонайменше, одного кільця (якщо є більше, ніж одне кільце). Такі гетероарильні групи можуть мати єдине кільце, наприклад, піридильна, піролільна або фурильна групи, або декілька конденсованих кілець, наприклад, індолільна, індолізинільна, бензофуранільна або бензотієнільна групи. Переважні гетероарили включають піридил, піроліл і фурил. Має бути зрозумілим, що визначення арилу і гетероарилу також відносяться і до таких частин будь-якої ароїльної або гетероароїльної груп, які описані нижче. Якщо немає іншого обмеження при визначенні арильних або гетероарильних груп у даному описі, такі групи є необов'язково заміщеними 1-5 замісниками, незалежно вибраними з групи, що включає ацилкокси, гідрокси, ацил, форміл, алкіл, що містить 1-6 атомів вуглецю, алкокси, що містить 1-6 атомів вуглецю, алкеніл, що містить 2-6 атомів вуглецю, алкініл, що містить 2-6 атомів вуглецю, заміщений алкіл, заміщений алкокси, заміщений алкеніл, заміщений алкініл, аміно, аміно, заміщений однією або двома алкільними групами, що містять 1-6 атомів вуглецю, аміноацил, ациламіно, азидо, ціано, галоген, нітро, тіоалкокси, що містить 1-6 атомів вуглецю, заміщений тіоалкокси, що містить 1-6 атомів вуглецю, і тригалогенметил. Замісники на вказаних вище алкільних, алкенільних, алкінільних, тіоалкокси- і алкоксигрупах включають атоми галогенів, CN, ОН та аміногрупи. Переважними замісниками на арильних групах за даним винаходом є алкіл, алкокси, галоген, ціано, нітро, тригалогенметил і тіоалкокси. Фармацевтично прийнятні солі сполук за даним винаходом, що містять основну групу, таку як аміно або алкіламіногрупа, можуть бути утворені з органічних або неорганічних кислот, наприклад, оцтової, пропіонової, молочної, лимонної, винної, бурштинової, фумарової, малеїнової, малонової, мигдалевої, яблучної, фталевої, хлористоводневої, бромистоводневої, фосфорної, азотної, сірчаної, метансульфонової, нафталінсульфонової, бензолсульфонової, толуолсульфонової, камфорсульфонової і подібних відомих прийнятних кислот. Солі також можуть бути утворені з органічних і неорганічних основ, переважно, солі лужних металів, наприклад, натрію, літію або калію. Інші корисні сольові форми сполук за винаходом включають солі, утворені з фармацевтично прийнятними органічними або неорганічними основами, відомими з рівня техніки. Форми солей, одержаних з використанням неорганічних основ, включають гідроксиди, карбонати або бікарбонати терапевтично прийнятних лужних металів або лужноземельних металів, таких як натрій, калій, магній, кальцій і т.п. Прийнятні органічні основи включають аміни, такі як бензиламін, моно-, ді- і триалкіламіни, переважно, такі, які містять алкільні групи з 1-6 атомів вуглецю, більш переважно, 1-3 атомів вуглецю, такі як метиламін, диметиламін, триметиламін, етиламін, діетиламін, триетиламін, моно-, ді- і триетаноламін. Також корисними є алкілендіаміни, що містять до 6 атомів вуглецю, такі як гексаметилендіамін; циклічні насичені або ненасичені основи, що містять до 6 атомів вуглецю, які включають піролідин, піперидин, морфолін, піперазин та їх N-алкільні і N-гідроксіалкільні похідні, такі як N-метилморфолін і N-(2-гідроксіетил)піперидин, або піридин. Також можуть бути утворені четвертинні солі, такі як метилтриетанольні або триметилмоноетанольні форми, і циклічні форми солей амонію, такі як форми солей N-метилпіридинію, Nметил-N-(2-гідроксіетил)морфолінію, Ν,Ν-диметилморфолінію, Ν-метил-Ν-(2-гідроксіетил)морфолінію або Ν,Ν-диметилпіперидинію. Такі форми солей можуть бути одержані з використанням кислотних(ої) сполук(и) формули І і методів, відомих з рівня техніки. Сполуки за даним винаходом можуть містити асиметричний атом вуглецю або сульфоксидну групу, і деякі із сполук за даним винаходом можуть містити один або декілька асиметричних центрів і, таким чином, можуть бути утворені оптичні ізомери та діастереомери. Хоча на формулі І не показана стереохімія, даний винахід включає такі оптичні ізомери і діастереомери; також як і рацемічні суміші і розділені, енантіомерно чисті R і S стереоізомери; також як і інші суміші R і S стереоізомерів та їх фармацевтично прийнятні солі. Також має бути зрозумілим, що можуть існувати таутомери заявлених сполук. Обсяг вимог даної заявки, у тому що стосується вказаних у заголовку сполук або їх проміжних сполук, повинен охоплювати обидва з таутомерів, також як і їх суміші. Сполуки за даним винаходом є інгібіторами інгібітору серинпротеази РАІ-1, і тому вони корисні для лікування або профілактики тих процесів, в яких відбувається продукування і/або дія РАІ-1. Так, сполуки за даним винаходом корисні для лікування або профілактики інсулін незалежних типів цукрового діабету і серцево-судинних захворювань, викликаних таким станом, і для профілактики виявлень тромбозу, зв'язаних із захворюванням коронарної артерії та серцево-судинними захворюваннями. Дані сполуки також корисні для інгібування процесу(ів) захворювання, що включає тромболітичний і протромбозний стан, які включають, але не обмежуються цим, утворення атеросклеротичних бляшок, венозний і артеріальний тромбоз, ішемію міокарда, фібриляцію передсердя, глибокий тромбофлебіт, синдроми коагуляції, легеневий тромбоз, церебральний тромбоз, тромбоемболічні ускладнення при хірургічному втручанні (такому як вправлення суглобів) і оклюзію периферичних артерій. Дані сполуки також корисні для лікування удару, зв'язаного з, або що є результатом, фібриляції передсердь. Сполуки за даним винаходом також можуть бути корисні для лікування захворювань, зв'язаних з накопиченням позаклітинного матриксу, що включають, але не обмежуються цим, фіброз нирок, хронічне обструктивне захворювання легень, реноваскулярне захворювання і відторгнення трансплантата органів. Сполуки за даним винаходом також можуть бути корисні для лікування злоякісних захворювань і захворювань, зв'язаних з неоангіогенезом (таких як діабетична ретинопатія). Сполуки за даним винаходом також можна використовувати у зв'язку з процесами або процедурами, що включають підтримку розкритого стану кровоносних судин, включаючи судинну хірургію, судинний трансплантат і стент, імплантацію і трансплантацію органів, тканин і клітин. Сполуки за даним винаходом також можуть бути корисні для лікування хвороби Альцгеймера. Цей спосіб також можна охарактеризувати як інгібування активатора плазміногена за допомогою РАІ-1 у ссавця, зокрема, людини, яка страждає або схильна до хвороби Альцгеймера. Цей спосіб також можна охарактеризувати як спосіб підвищення або нормалізації рівнів концентрації плазміну у ссавця, зокрема такого, який страждає або схильний до хвороби Альцгеймера. Сполуки за даним винаходом також можна використовувати для лікування мієлофіброзу з мієлоїдною метаплазією шляхом регулювання гіперплазії стромальних клітин і збільшення білків позаклітинного матриксу. Сполуки за даним винаходом також можна використовувати у поєднанні з високоактивною антиретровірусною терапією (HAART), яка містить інгібітор протеази, для лікування захворювань, що є результатом фібринолітичного порушення і гіперкоагуляції у ВІЛ-інфікованих пацієнтів, які приймають таке лікування. Сполуки за даним винаходом можна використовувати для лікування діабетичної ретинопатії і ниркового діалізу, зв'язаного з нефропатією. Сполуки за даним винаходом можна використовувати для лікування раку, септисемії, ожиріння, резистентності до інсуліну, проліферативних захворювань, таких як псоріаз, гомеостаз, що поліпшує коагуляцію, серцево-судинних захворювань, мікросудинних захворювань, гіпертонії, деменції, остеопорозу, артриту, астми, серцевої недостатності, аритмії, стенокардії та як гормонозамісний засіб, для лікування, профілактики або реверсії розвитку атеросклерозу, хвороби Альцгеймера, остеопорозу, остеопенії; зменшення запальних маркерів, зменшення С-реактивного білка або для профілактики або лікування судинного запалення початкової стадії, удару, деменції, коронарного захворювання серця, первинної і вторинної профілактики інфаркту міокарда, стабільної або нестабільної стенокардії, первинної профілактики коронарних явищ, вторинної профілактики серцево-судинних явищ, захворювання периферичних судин, захворювання периферичних артерій, гострого судинного синдрому, зниження ризику зазнати процедури реваскуляризації міокарда, мікросудинних захворювань, таких як нефропатія, нейропатія, ретинопатія і нефротичний синдром, гіпертонії, діабету тину 1 і 2 і зв'язаних з цим захворювань, гіперглікемії, гіперінсулінемії, злоякісних змін, передзлоякісних змін, злоякісних уражень шлунковокишкового тракту, ліпосарком і епітеліальних нухлин, і/або для поліпшення функції ендотелію і всіх форм серцево-судинних захворювань. Сполуки за даним винаходом можна використовувати для місцевого нанесення при лікуванні ран для запобігання утворенню рубців. Сполуки за даним винаходом також можна використовувати для лікування запальних захворювань, септичного шоку і ушкодження судин, зв'язаних з інфекціями, і для лікування крові та продуктів крові, що використовуються при діалізі, зберіганні крові у рідкій фазі, особливо ex vivo агрегації тромбоцитів. Сполуки за даним винаходом також можна додавати до людської плазми у процесі хімічного аналізу крові у лікарняних установках для визначення фібринолітичної здатності. Сполуки за даним винаходом також можна використовувати у комбінації з протромболітичними, фібринолітичними засобами і антикоагулянтами. Даний винахід, крім того, включає способи лікування, профілактики, поліпшення або інгібування кожного з вказаних захворювань у ссавця, переважно, людини, при цьому кожний такий спосіб(оби) включає введення ссавцеві, який потребує такого лікування, профілактики, поліпшення або інгібування, фармацевтично або терапевтично ефективної кількості сполуки за даним винаходом або її фармацевтично прийнятної солі або складного ефіру. Ще в одному аспекті даний винахід відноситься до сполуки за винаходом для використання як лікарського засобу. У наступному аспекті даний винахід відноситься до використання сполуки за винаходом для одержання лікарського засобу для лікування тромбозу або фібринолітичного порушення у ссавця. У наступному аспекті даний винахід відноситься до способів одержання сполуки формули: де R, R1, R2, R3, R4, R5, R6, R7 і n визначені вище, або її фармацевтично прийнятної солі або складного ефіру, що включають гідроліз сполуки формули: де X являє собою CN, СОгалоген, COOR12, CONR13R14, де R12 вибраний з C1-С6 алкілу, СО(C1-С6 алкілу), бензилу, необов'язково заміщеного однією або декількома групами, незалежно вибраними з C1-С6 алкілу, C1-С6 алкокси, фенілу, галогену, трифторметилу і трифторметокси, і фенілу, необов'язково заміщеного однією або декількома групами, незалежно вибраними з C1-С6 алкілу, C1-С6 алкокси, фенілу, галогену, трифторметилу і трифторметокси; R13 і R14 незалежно вибрані з C1-С6 алкілу, C1-С6 алкокси, галогену, СО(C1-С6 алкілу), бензилу, необов'язково заміщеного однією або декількома групами, незалежно вибраними з C1-С6 алкілу, C1-С6 алкокси, фенілу, галогену, трифторметилу і трифторметокси; і фенілу, необов'язково заміщеного однією або декількома групами, незалежно вибраними з C1-С6 алкілу, C1-С6 алкокси, фенілу, галогену, трифторметилу і трифторметокси; або (b) перетворення сполуки формули (2) в її фармацевтично прийнятний складний ефір або основноадитивну сіль; або (c) розділення рацемічної суміші сполук формули (2) для виділення енантіомера сполуки формули (2) або її фармацевтично прийнятної солі або складного ефіру. У наступному аспекті даний винахід відноситься до способів одержання сполуки формули: де R, R1, R2, R3, R4, R5, R6 і n визначені вище, або її фармацевтично прийнятної солі, що включають взаємодію сполуки формули: з азидом; або (b) перетворення сполуки формули (3) в її фармацевтично прийнятну основно-адитивну сіль; або (c) розділення рацемічної суміші сполук формули (3) для виділення енантіомера сполуки формули (3) або її фармацевтично прийнятної солі. Сполуки за даним винаходом також можна використовувати для лікування раку, що включає, але не обмежується цим, рак молочної залози, рак яєчників, і як контрастну речовину для ідентифікації метастазуючих ракових захворювань. Має бути зрозумілим, що фармацевтично або терапевтично ефективна кількість сполуки у даному описі відноситься до кількості сполуки, що розглядається, яка здатна по суті інгібувати інгібітор серинпротеази РАІ-1 у ссавця, який потребує цього, значною мірою для забезпечення бажаного поліпшення стану, що розглядається, або забезпечення достатнього інгібування інгібітору серинпротеази РАІ-1 для запобігання, інгібування або обмеження появи фізіологічної основи для захворювання або стану, що розглядається. У переважному варіанті здійснення даного винаходу R4 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, перфторалкіл, що містить 1-6 атомів вуглецю, арил, заміщений R8, алканоїл, що містить 1-6 атомів вуглецю, або ароїл, необов'язково заміщений 1-3 групами, незалежно вибраними з R8; У ще одному переважному варіанті втілення даного винаходу R4 являє собою водень. У ще одному переважному варіанті втілення даного винаходу R2 являє собою водень. У ще одному переважному варіанті втілення даного винаходу R3 являє собою бром або водень. У ще одному переважному варіанті втілення даного винаходу R4 являє собою водень. У ще одному переважному варіанті втілення даного винаходу R5 являє собою пентил. У ще одному переважному варіанті втілення даного винаходу R6 вибраний з бензилу, метилу, ацилу, (2трифторметил)бензилу і (4-трет-бутил)бензилу. У ще одному переважному варіанті втілення даного винаходу R7 являє собою водень. У ще одному переважному варіанті втілення даного винаходу n=0. У ще одному переважному варіанті втілення даного винаходу А являє собою СО2Н або тетразол. Однією підгрупою сполук за даним винаходом є сполуки формули І: де R1, R2, R3, R4, R5, R6, A, n і R8 визначені вище, або їх фармацевтично прийнятні солі. Ще однією підгрупою переважних сполук за даним винаходом є сполуки формули І: де: R1, R2 і R3, кожний незалежно, являють собою водень, алкіл, що містить 1-3 атоми вуглецю, циклоалкіл, що містить 3-5 атомів вуглецю, алканоїл, що містить 1-3 атоми вуглецю, галоген, гідрокси, арил, необов'язково заміщений 1-3 групами, незалежно вибраними з R6, перфторалкіл, що містить 1-3 атоми вуглецю, алкокси, що містить 1-3 атоми вуглецю, аміно, алкіламіно, що містить 1-3 атоми вуглецю, діалкіламіно, що містить 1-3 атоми вуглецю на алкільну групу, перфторалкокси, що містить 1-3 атоми вуглецю; R4 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, перфторалкіл, що містить 1-6 атомів вуглецю, арил, заміщений R6, алканоїл, що містить 1-6 атомів вуглецю, ароїл, необов'язково заміщений 1-3 групами, незалежно вибраними з R6; R5 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, алкіларил, бензил, необов'язково заміщений 1-3 групами, незалежно вибраними з R6, алканоїл, що містить 1-6 атомів вуглецю, ароїл, заміщений R6; А являє собою СООН або тетразол; R6 являє собою водень, алкіл, що містить 1-3 атоми вуглецю, циклоалкіл, що містить 3-5 атомів вуглецю, -СН2-циклоалкіл, що містить 3-5 атомів вуглецю, алканоїл, що містить 1-3 атоми вуглецю, галоген, гідрокси, перфторалкіл, що містить 1-3 атоми вуглецю, алкокси, що містить 1-3 атоми вуглецю, аміно, алкіламіно, що містить 1-3 атоми вуглецю, діалкіламіно, що містить 1-3 атоми вуглецю, перфторалкокси, що містить 1-3 атоми вуглецю; або їх фармацевтично прийнятні форми солей або складних ефірів. З особливо переважних сполук за даним винаходом можна вказати наступні: 1-бензил-3-феніл-2[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол або його фармацевтично прийнятна сіль; 6-(1-бензил-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил 1Н-тетразол-5-ілметиловий ефір або 1-бензил-2[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-Ш-індол або його фармацевтично прийнятна сіль; 1-метил-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол або його фармацевтично прийнятна сіль; 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-метил-3-пентил-1Н-індол або 1-бром-6-(1-метил-3пентил-Ш-індол-2-іл)-2-нафтил 1Н-тетразол-5-ілметиловий ефір або його фармацевтично прийнятна сіль; 1-ацетил-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол або його фармацевтично прийнятна сіль; 1-ацетил-2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-1Н-індол або його фармацевтично прийнятна сіль; 3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-[2-(трифтор-метил)бензил]-1Н-індол або його фармацевтично прийнятна сіль; 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-1-[2-(трифторметил)бензил]-1Н-індол або його фармацевтично прийнятна сіль; 1-(4-трет-бутилбензил)-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол або його фармацевтично прийнятна сіль; 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-(4-трет-бутилбензил)-3-пентил-1Н-індол або його фармацевтично прийнятна сіль; {[1-бром-6-(1-метил-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}оцтова кислота або її фармацевтично прийнятна сіль. Даний винахід описує композицію і застосування заміщених нафтиліндольних похідних формули І: де: R1, R2, R3, R4 незалежно являють собою одну або декілька груп, вибраних з водню, алкілу, циклоалкілу, алканоїлу, галогену, гідрокси, арилу, заміщеного арилу, перфторалкілу, алкокси, аміно, алкіламіно, діалкіламіно, перфторалкокси, R5 являє собою водень, алкіл, що містить 1-6 атомів вуглецю, перфторалкіл, арил, заміщений арил, алканоїл, ароїл, R6 являє собою групу, вибрану з водню, алкілу, алкіларилу, бензилу, заміщеного бензилу, алканоїлу, ароїлу, R7 являє собою групу, вибрану з водню, алкілу, алкіларилу, арилу, заміщеного арилу, n є цілим числом, що має значення 0-6, А являє собою СООН або сполуку, що імітує кислоту, таку як тетразол, SO3H, РО3Н2, тетронова кислота і т.д. Сполуки за даним винаходом, наприклад, можна одержати відповідно до наступних схем реакцій або їх модифікацією з використанням легко доступних вихідних речовин, реагентів і традиційних методів синтезу. Також можливі варіанти таких стадій способу, які самі по собі добре відомі і які може здійснити хімік, що займається одержанням лікарських засобів. У наведених нижче схемах реакцій R1, R2, R3, R4, R5, R6 i R7 вибрані з груп, які визначені вище. На Схемі І, метоксинафтальдегіди (1) перетворюють у кетони (2) у дві стадії. У першій частині використовують хімію Гриньяра для одержання проміжного спирту, який перетворюють у кетони шляхом окислення, що включає РСС або МnО2. Сполуки 2 потім використовують у синтезі індолів за методом Фішера для утворення структур нафтиліндольного ядра (3) з використанням або арилгідразину, або Nарилгідразону. У випадку, коли використовують гідразон, в індольний каркас можна включати різні заміщення; гідразони можуть бути одержані з використанням нещодавно описаної процедури в JACS, [S.Wafaw; B.H.Yang; S.L.Buchwald. JACS, 121, 1999, 10251-10263]. У цьому місці стратегія синтезу передбачає вибір одного з двох можливих шляхів: А і/або В. На шляху А, нафтиліндоли 3 піддають Nалкілуванню (R6Х дорівнює алкілгалогеніду, такому як метилйодид) або N-ацилюванню ((R6)2O дорівнює ангідриду, такому як оцтовий ангідрид) з одержанням проміжних сполук, таких як сполуки 4. Дані сполуки піддають деметилюванню за допомогою триброміду бору з одержанням нафтолів 5. Сполуки 5 піддають Оалкілуванню з використанням різних алкілгалогенідів і карбонату цезію в ацетоні з одержанням сполук 8, що є попередниками цільових кислот 9. Група Ζ сполук 8 є кислотним попередником, таким як ефір або нітрил карбонової кислоти, які можуть бути перетворені у карбонові кислоти або тетразоли (9), відповідно, шляхом гідролізу або утворення тетразолу. Альтернативний шлях до кислот 9, який включає шлях В, також виходить з нафтиліндолів 3. Дані індоли спочатку деметилюють за допомогою триброміду бору з одержанням нафтолів 6. Сполуки 6 піддають О-алкілуванню з використанням різних алкілгалогенідів і карбонату цезію в ацетоні з одержанням індолів 7. Ці сполуки піддають N-алкілуванню або N-ацилюванню, як на шляху А, також з одержанням сполук-попередників 8. На даному етапі групи Ζ перетворюють у кислоти сполук 9, як описано вище. Даний винахід забезпечує композиції, що включають заміщені нафтиліндольні сполуки (І), або окремо, або у поєднанні з ексципієнтами (тобто фармацевтично прийнятними речовинами, які не володіють фармакологічною дією). Такі композиції призначені для лікування станів, що є результатом фібринолітичного порушення, такого як глибокий тромбофлебіт і коронарне захворювання серця, фіброз легень і т.д. Конкретна доза, яка використовується, залежить від різних факторів, що включають хазяїна, або у ветеринарії, або у медицині - людину, природу і тяжкість стану, який підлягає лікуванню, шляхи введення, і від конкретної використовуваної активної речовини. Сполуки можна вводити будь-яким традиційним шляхом, зокрема, парентерально, переважно, перорально у формі таблеток або капсул. Сполуки, що вводяться, можуть бути у вільній формі або у формі фармацевтично прийнятної солі, як придатно, для їх застосування як фармацевтичних засобів, зокрема, для застосування для профілактики або лікування атеросклерозу і його ускладнень (стенокардії, інфаркту міокарда, аритмії, серцевої недостатності, ниркової недостатності, удару, оклюзії периферичних артерій і зв'язаних з цим хворобливих станів). Такі заходи уповільнять прогресування хворобливого стану і сприятимуть природному оберненню процесу у зворотному напрямку. Будь-який відомий з рівня техніки носій можна використовувати для одержання фармацевтичних композицій. У таких композиціях носій може бути твердим, рідким або сумішшю твердої речовини і рідини. Тверді композиції включають порошки, таблетки і капсули. Твердий носій може являти собою одну або декілька речовин, які можуть також діяти як віддушка, барвник, змащувальна речовина, стабілізатор, суспендуючий агент, зв'язувальна речовина або розпушувач для таблеток. У порошках носій є тонко подрібненою твердою речовиною, що знаходиться у суміші з тонко подрібненим активним інгредієнтом. У таблетках активний інгредієнт змішаний з носієм, що має необхідні зв'язувальні властивості, у відповідних пропорціях і спресований у бажану форму і розмір. Придатними твердими носіями є карбонат магнію, стеарат магнію, тальк, цукор, лактоза, пектин, декстрин, крохмаль, желатин, трагакант, метилцелюлоза, гідроксиметилцелюлоза, натрій карбоксиметилцелюлоза, низькоплавкий віск, олія какао і т.п. Зі сполуками за даним винаходом можна також використовувати інкапсулюючі речовини і термін "композиція" передбачає включення активного інгредієнта у поєднанні з інкапсулюючим матеріалом у вигляді лікарського препарату, з або без інших носіїв. Також для доставки протиатеросклеротичного лікарського засобу за даним винаходом можна використовувати саше. Стерильні рідкі композиції включають розчини, суспензії, емульсії, сиропи та еліксири. Сполуки за даним винаходом можуть бути розчинені або суспендовані у фармацевтично прийнятному носії, такому як стерильна вода, стерильний органічний розчинник або їх суміш. Переважно рідкий носій є придатним для парентеральної ін'єкції. Коли сполуки є достатньо розчинними, їх можна розчиняти безпосередньо у нормальному фізіологічному розчині, з або без використання придатних органічних розчинників, таких як пропіленгліколь або поліетиленгліколь. Якщо бажано, дисперсії тонко подрібнених сполук можна одержувати у водному розчині крохмалю або натрій карбоксиметилцелюлози або у відповідній олії, такій як арахісова олія. Рідкі фармацевтичні композиції, що являють собою стерильні розчини або суспензії, можна застосовувати для внутрішньом'язового, внутрішньочеревинного або підшкірного введення шляхом ін'єкції. У багатьох випадках рідку форму композиції можна використовувати замість переважного перорального способу введення твердої композиції. Переважним є одержання дозованої лікарської форми сполук для стандартних схем введення. Таким чином, композиція може бути легко поділена на дрібніші дози за призначенням лікаря. Наприклад, дозовані лікарські форми можуть бути у формі упаковок порошку, пляшечках або ампулах, і переважно, у формі капсул або таблеток. Активна сполука, присутня у цих дозованих лікарських формах композиції, може бути присутньою у кількості від близько одного грама до близько п'ятнадцяти грамів або більше, для одноразового або декількох щоденних прийомів, відповідно до конкретної потреби пацієнта. Добова доза активної сполуки варіює в залежності від шляху введення, розмірів, віку і статі пацієнта, тяжкості захворювання і реакції у відповідь на лікування, що відстежується за результатами аналізів крові, і швидкості одужання пацієнта. Починаючи схему прийому з мінімальної щоденної дози близько одного грама, можна використовувати показники рівня у крові РАІ-1 і аналіз полегшення симптомів у пацієнта для визначення, необхідно чи ні збільшення дози. На основі даних, представлених нижче, передбачувана добова доза як для застосування у медицині, так і у ветеринарії, складає від близько 25 до 200 міліграм/кілограм на добу, і більш звичайно, від близько 50 до близько 100 міліграм/кілограм на добу. Здатність сполук за даним винаходом інгібувати інгібітор-1 активатора плазміногена була встановлена у наступних експериментальних процедурах: Первинний скринінг на інгібування РАІ-1 Сполуки, що випробовуються, розчиняють у ДМСО при кінцевій концентрації 10мМ, потім розводять 100Х у фізіологічному буфері. Аналіз інгібування починають додаванням сполуки, що випробовується (кінцева концентрація 1-100мкМ, максимальна концентрація ДМСО 0,2%) у рН 6,6 буфері, який містить 140нМ інгібітору-1 рекомбінантного активатора плазміногена людини (РАІ-1; Molecular Innovations, Royal Oak, MI). Після інкубації протягом 1 години при кімнатній температурі, додають 70нМ рекомбінантного активатора тканинного плазміногена людини (tPA) і комбінацію сполуки, що випробовується, РАІ-1 і tPA інкубують протягом ще 30 хвилин. Після другої інкубації додають Spectrozyme-tPA (American Diagnostica, Grrenwich, CT), хромогенний субстрат для tPA, і поглинання зчитують при 405нм на 0 і 60 хвилинах. Відносне інгібування РАІ-1 дорівнює залишковій активності tPA у присутності сполуки, що випробовується, та РАІ-1. Контрольні обробки включають повне інгібування tPA за допомогою РАІ-1 при використовуваному молярному співвідношенні (2:1) і відсутність якого-небудь ефекту сполуки, що випробовується, тільки на tPA. Аналіз для визначення ІК50 інгібування РАІ-1 Даний аналіз базується на взаємодії між tPA і активним РАІ-1, що не розкладається під дією SDS. Планшети для аналізу спочатку покривають людським tPA (10мкг/мл). Сполуки, що випробовуються, розчиняють у ДМСО при концентрації 10мМ, потім розбавляють фізіологічним буфером (рН 7,5) до кінцевої концентрації 1-50мкМ. Сполуки, що випробовуються, інкубують з людським РАІ-1 (50нг/мл) протягом 15 хвилин при кімнатній температурі. Покриті tPA планшети промивають розчином 0,05% Tween 20 і 0,1% BSA, потім планшети блокують розчином 3% BSA. Аліквоти розчину сполука/РАІ-1, що тестується потім додають до покритих tPA планшетів, інкубують при кімнатній температурі протягом 1 години і промивають. Зв'язаний на планшеті активний РАІ-1 аналізують, додаючи аліквоту, при розведенні 1:1000, 33В8 моноклонального антитіла проти людського РАІ-1 та інкубуючи планшет при кімнатній температурі протягом 1 години (Molecular Innovations, Royal Oak, MI). Планшет знову промивають і додають розчин кон'югату козлиного анти-мишачого IgG-лужної фосфатази при розведенні 1:50000 у козлиній сироватці. Планшет інкубують протягом 30 хвилин при кімнатній температурі, промивають і додають розчин субстрату лужної фосфатази. Планшет інкубують протягом 45 хвилин при кімнатній температурі, проявлення кольору визначають при OD405нм. Кількісні значення активного РАІ-1, який зв'язався з tPA при різних концентраціях сполуки, що випробовується, використовують для визначення ІК50. Результати аналізують з використанням логарифмічного рівняння. Чутливість аналізу складає 5нг/мл людського РАІ-1, як визначено по стандартній кривій у діапазоні 0-100нг/мл. Сполуки за даним винаходом, що інгібують інгібітор-1 активатора плазміногена, узагальнено представлені у таблиці: Таблиця Сполука прикладу ІК50 (мкМ) % інгібування при 25мкМ 1 2 3 4 5 6 7 8 9 10 11 9,85а 8,8b 16,2а 17,4bb 9,2b 5,22а 24,88а 10,73а 16а 57а 60а а ІК50 визначали за допомогою аналізу антитіл, описаного вище b ІК50 визначали за допомогою модифікації первинного скринінгу для інгібування РАІ-1. Експериментальні приклади Нижче описане одержання репрезентативних сполук за даним винаходом. Приклад 1 1-бензил-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол Стадія 1 1-(6-метокси-2-нафтил)гептан-1-ол У тригорлу колбу, обладнану зверху мішалкою, краплинною лійкою і термометром, додавали 6-метокси2-нафтальдегід (70,760г, 380моль) і Et2O (1400мл). Суспензію, що перемішується, в атмосфері N2 охолоджували на льодяній бані з подальшим повільним додаванням гексилмагнійброміду (228мл 2М розчину в Et2O) протягом 1 години. Температуру підтримували нижче 12°С. Після додавання реакційну суміш перемішували 3 години при кімнатній температурі, потім охолоджували на льодяній бані і повільно гасили водою/насиченим водним розчином NH4Cl (250мл). Після гасіння реакції, льодяну баню видаляли і суміш перемішували протягом півгодини, потім розбавляли Н2О (750мл) для розчинення всіх твердих частинок. Шари розділяли і водний шар екстрагували за допомогою Et2O (3´200мл). Об'єднані органічні шари промивали водою (3´200мл) і насиченим сольовим розчином (2´200мл), сушили над Na2SO4, фільтрували, випаровували вологу на роторному випарнику і сушили у вакуумі з одержанням бажаного продукту не зовсім білого кольору (101,1г, 371,2моль, 98%) з т.пл. 71-74°С. 15г неочищеного спирту перекристалізовували з гексану з одержанням бажаного продукту у вигляді білої твердої речовини (11,7г) з т.пл. 71-73°С. 1 Н ЯМР (DMSO-d6) d 0,82 (т, J=6,7Гц, 3Н) , 1,15-1,38 (м, 8Н), 1,58-1,71 (м, 2Н) 3,85 (с, 3Н), 4,58-4,64 (м, 1Н) , 5,14 (д, J=4,3Гц, 1Н), 7,12 (дд, J=2,6, 9,0Гц, 1Н), 7,26 (д, 2,4Гц, 1Н), 7,42 (дд, J=1,5, 8,4Гц, 1Н), 7,70 (с, 1Н), 7,74 (д, J=8,6Гц, 1Н), 7,77 (д, J=8,9Гц, 1Н), ІЧ (тверда речовина) 3280, 2920, 2860, 1610, 1270, 1170, 1040, і 860см-1; мас-спектр [ESI], m/z 255 (МН-Н2O)+; Анал. Розраховано для С18Н24О2: С, 79,37; Н, 8,88; N, 0,00, Знайдено: С, 79,27; Н, 8,94; N, -0,03. Стадія 2 1-(6-метокси-2-нафтил)гептан-1-он До розчину 1-(6-метокси-2-нафтил)гептан-1-олу (101,1г, 371моль), що перемішується, у СН2СI 2 (1000мл) в атмосфері N2 додавали хлорхромат піридинію (120,02г, 556,74моль). Реакційну суміш перемішували протягом 3 годин і потім виливали на колонку з оксидом алюмінію (2000г, basic Brockman activity, 60-325меш). Колонку елюювали СН2СI 2. Продукт збирали, випаровували вологу на роторному випарнику і сушили у вакуумі з одержанням бажаного продукту у вигляді білої твердої речовини (81,5г, 301,44моль, 81%) з т.пл. 69-72°С. 177мг неочищеного кетону перекристалізовували з метанолу з одержанням бажаного продукту у вигляді білої твердої речовини (105мг), т.пл. 70-72°С. 1 Н ЯМР (DMSO-d6) d 0,86 (м, 3Н), 1,25-1,40 (м, 6Н) , 1,60-1,70 (м, 2Н), 3,07 (т, J=7,3Гц, 2Н), 3,90 (с, 3Н), 7,24 (д, J=9Гц, 1Н), 7,39 (с, 1Н), 7,87 (д, J=8,7Гц, 1Н) , 7,93 (д, J=8,7Гц, 1Н), 8,02 (д, J=8,9, 1Н) 8,58 (с, 1Н) ІЧ (тверда речовина) 2910, 2870, 1660,1630, 1470, і 1180см-1; мас-спектр [ΕΙ], m/z 271 (M+H)+; Анал. Розраховано для С18Н22О2: С, 79,96; Н, 8,20; N, 0,00, Знайдено: С, 80,27; Н, 8,16; N, 0,02. Стадія 3 2-(6-метокси-2-нафтил)-3-пентил-1Н-індол До суспензії 1-(6-метокси-2-нафтил)гептан-1-ону (81,5г, 301,44моль), що перемішується, в етанолі (2000мл) в атмосфері N2 додавали фенілгідразин (35,857г, 331,58моль) і моногідрат птолуолсульфокислоти (120,41г, 633,02моль). Реакційну суміш кип'ятили зі зворотним холодильником. Нагрівання давало гомогенний розчин. (Модифікація цієї реакції Фішера синтезу індолів для введення різних заміщень на індольне кільце використовує N-арилгідразон замість арилгідразину - подробиці одержання гідразону в [JACS, S.Wagaw; B.H.Yang; S.L.Buchwald. JACS, 121, 1999, 10251-10263]). Після кип'ятіння зі зворотним холодильником протягом 92 годин нагрівання припиняли і реакційну суміш охолоджували і сушили на роторному випарнику до одержання залишку. Залишок розподіляли між EtOAc (1700мл) та 1н НСI (500мл). Шари струшували, розділяли і органічний шар промивали 1н НСl (2´300мл), насиченим водним розчином NaHCO3 (3´250мл), Н2О (3´250мл), насиченим сольовим розчином (2´250мл), сушили над Na2SO4, фільтрували, видаляли вологу на роторному випарнику і сушили у вакуумі з одержанням темної в'язкої олії (106,2г). Залишок розтирали з гексаном з одержанням не зовсім білої твердої речовини, яку збирали, промивали і сушили у вакуумі з одержанням не зовсім білого твердого продукту (95,5г, 279,21моль, 93%) з розкл. при 93-96°С. 400мг неочищеного індолу перекристалізовували з гексану з одержанням продукту у вигляді білої твердої речовини (298мг), т.пл. 95-97°С. 1 Н ЯМР (DMSO-d6) d 0,82 (т, J=7,0Гц, 3Н), 1,31 (м, 4Н), 1,66 (м, 2Н), 2,89 (т, J=7,6Гц, 2Н), 3,90 (с, 3Н), 6,98-7,02 (м, 1Н), 7,07-7,10 (м, 1Н), 7,21 (дд, J=2,4, 8,9Гц, 1Н), 7,34-7,37 (м, 2Н), 7,54 (д, J=7,94Гц, 1Н), 7,73 (дц, J=1,5, 8,6 Гц, 1Н), 7,88 (д, J=9,00Гц, 1Н), 7,93 (д, J=8,55Гц, 1Н), 8,03 (с, 1Н), 11,17 (с, 1Н); ІЧ (тверда речовина) 3350, 2960, 2920, 2840, 1600, 1200, 740см-1; мас-спектр [ESI], m/z 344 (М+Н)+; Анал. Розраховано для C24H25NO: С, 83,93; Η, 7,34; Ν, 4,08, Знайдено: С, 83,59; Η, 7,51; Ν, 3,86. Стадія 4 1-бензил-2-(6-метокси-2-нафтил)-3-пентил-1Η-індол До розчину 2-(6-метокси-2-нафтил)-3-пентил-1Н-індолу (95,5г, 278,04моль), що перемішується, у сухому ДМФА (1000мл) в атмосфері Ν2 при 0°С (льодяна баня) додавали по порціях протягом 20 хвилин третбутоксид калію (32,762г, 291,95моль). Після додавання бутоксиду реакційну суміш перемішували протягом 20 хвилин з подальшим додаванням бензилброміду (50,110г, 291,95моль) однією порцією. Через 10 хвилин баню видаляли. Реакційну суміш перемішували протягом ~5 годин і потім гасили водою/конц. НОАс (0,05екв., 13,902моль, 0,8мл) і перемішували протягом ночі. Реакційну суміш сушили на роторному випарнику до одержання залишку, який розподіляли між ЕtOАс (2л) і 0,1н НСI (600мл). Шари розділяли і органічний шар промивали 0,1н НСl (2´250мл), Н2О (1´250мл) і насиченим сольовим розчином (2´250мл), сушили над Na2SO4, фільтрували, видаляли вологу на роторному випарнику і сушили з одержанням коричневого в'язкого залишку (123,5г). Залишок розчиняли у гексані і обробляли флеш-хроматографією на силікагелі (2000г). Колонку елюювали 1% EtOAc/гексаном. Продукт збирали, фільтрували, видаляли вологу на роторному випарнику і сушили у вакуумі з одержанням продукту у вигляді в'язкої жовтої олії (109,3г, 252моль, 91%). 300мг жовтої олії піддавали подальшому очищенню препаративною хроматографією на пластинках. Пластинки елюювали 15% етилацетатом/гексаном. Продукт збирали, фільтрували, видаляли вологу на роторному випарнику і сушили у вакуумі при кімнатній температурі з одержанням бажаного продукту у вигляді воскоподібної твердої речовини білого кольору, т.пл. 76-80°C. 1 H ЯМР (DMSO-d6) d 0,72 (т, J=6,9Гц, 3Н), 1,10-1,20 (м, 4Н), 1,51-1,60 (м, 2Н), 2,67 (т, J=7,5Гц, 2Н) , 3,89 (с, 3Н) , 5,30 (с, 2Н), 6,81 (д, J=7,0Гц, 2Н) , 7,04-7,22 (м, 6Н), 7,34 (д, J=7,9Гц, 1Н), 7,36 (д, J=2,3Гц, 1Н), 7,41 (дд, J=1,4, 8,4Гц, 1Н), 7,60 (д, J=7,3Гц, 1Н), 7,80-7,84 (м, 2Н) , 7,87 (д, J=8,4Гц, 1Н); ІЧ (тверда речовина) 2910, 1305, 1460, 1200, i 740см-1; мас-спектр [ESI], m/z 434 (М+Н)+; Анал. Розраховано для C31H31NO: С, 85,87; Η, 7,21; Ν, 3,23, Знайдено: С, 85,43; Η, 7,31; Ν, 3,14. Стадія 5 6-(1-бензил-3-пентил-Ш-індол-2-іл)-2-нафтол До розчину 1-бензил-2-(6-метокси-2-нафтил)-3-пентил-1Н-індолу (109,0г, 251моль), що перемішується, у СН2Сl2 (1000мл) в атмосфері Ν2 при -78°С додавали по краплях протягом 1,5 години ВВr3 (1М в СН2СI 2, 302мл). Після додавання реакційну суміш нагрівали до 0°С і перемішували протягом 2,5 годин з подальшим нагріванням до кімнатної температури. Після 5 годин протікання реакції реакційну суміш охолоджували до 0°С і гасили водою (250мл). Суміш перемішували протягом ночі і сушили на роторному випарнику до одержання залишку. Залишок розподіляли між ЕtOАс (1500мл) і Н2О (500мл). Шари струшували, розділяли і органічний шар промивали Н2О (2´250мл), насиченим сольовим розчином (2´250 мл), сушили над Na2SO4, фільтрували, видаляли вологу на роторному випарнику і сушили у вакуумі з одержанням чорної в'язкої клейкої речовини (114г). Залишок розчиняли у СНСl3 і обробляли флеш-хроматографією на силікагелі (2000г). Колонку елюювали гексаном і 8% EtOAc/гексаном. Продукт збирали, фільтрували, видаляли вологу на роторному випарнику і залишок розтирали з гексаном, потім сушили з одержанням продукту у вигляді не зовсім білої твердої речовини (89,2г, 213моль, 85%) з т.пл. 96-100°С. 400мг сирої твердої речовини перекристалізовували з гексану з одержанням бажаного продукту у вигляді не зовсім білої твердої речовини (311мг), т.пл. 97-100°С. 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=6,7Гц, 3Н), 1,10-1,20 (м, 4Н), 1,51-1,60 (м, 2Н), 2,67 (т, J=7,3Гц, 3Н), 5,29 (с, 2Н), 6,82 (д, J=7,2Гц, 2Н), 7,04-7,20 (м, 7Н), 7,30-7,35 (м, 2Н), 7,59 (д, J=7,8Гц, 1H) , 7,73-7,78 (м, 3Н); ІЧ (тверда речовина) 3380, 2920, 1610, 1200, 740см-1; мас-спектр [ES], m/z 420 (М+Н)+; Анал. Розраховано для C30H29NO: С, 85,88; Η, 6,97; Ν, 3,34, Знайдено: С, 85,85; Η, 7,10; Ν, 3,20. Стадія 6 {[6-(1-бензил-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрил До розчину 6-(1-бензил-3-пентил-1Н-індол-2-іл)-2-нафтолу (19,245г, 45,868моль) в ацетоні (200мл) в атмосфері Ν2 при кімнатній температурі додавали Cs2CO3 (16,439г, 50,455моль) з подальшим додаванням бромацетонітрилу (6,052г, 50,455моль). Після перемішування протягом 4,5 годин реакційну суміш сушили на роторному випарнику до одержання залишку. Залишок розподіляли між EtOAc (350мл) і Н2О (150мл). Шари струшували, розділяли і органічний шар промивали Н2О (2´80мл), насиченим сольовим розчином (2´80мл), сушили над Na2SO4, фільтрували, видаляли вологу на роторному випарнику і сушили з одержанням в'язкої коричневої олії (20,664г). Залишок забирали у СНСl3 і обробляли флешхроматографією на силікагелі (435г). Колонку елюювали гексаном і 8% ЕtOАс/гексаном. Продукт збирали, фільтрували, видаляли вологу на роторному випарнику і залишок розтирали з гексаном, потім сушили з одержанням продукту у вигляді білої твердої речовини (18,78г, 40,95моль, 89%) з т.пл. 111-113°С. 400мг сирого продукту перекристалізовували з МеОН з одержанням бажаного продукту у вигляді білої твердої речовини (0,362мг), т.пл. 109-112°С. 1 Н ЯМР (DMSO-d6) d 0,72 (т, J=6,9Гц, 3Н), 1,10-1,20 (м, 4Н), 1,52-1,59 (м, 2Н), 2,68 (т, J=7,5Гц, 2Н), 5,31 (с, 4Н), 6,81 (д, J=7,2Гц, 2Н), 7,05-7,19 (м, 5Н), 7,31 (дд, J=2,6, 9,0Гц, 1Н), 7,36 (д, J=8,1Гц, 1Н), 7,47 (дд, J=1,4, 8,2Гц, 1Н) 7,56 (д, J=2,4Гц, 1Н), 7,6 (д, J=7,6Гц, 1Н) 7,88-7,94 (м, 3Н); ІЧ (тверда речовина) 2940, 1610, 1460, і 1200см-1; мас-спектр [ESI], m/z 459 (M+H)+; Анал. Розраховано для C32H30N2O: С, 83,81; Η, 6,59; Ν, 6,11, Знайдено: С, 83,93; Η, 6,60; Ν, 6,05. Стадія 7 1-бензил-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол До розчину {[6-(1-бензил-3-пентил-1Н-індол-2-іл)-2-нафтил]-окси}ацетонітрилу (87,0г, 189,71моль), що перемішується, у ДМФА (900мл) в атмосфері Ν2 додавали NaN3 (61,665г, 948,54моль) і NH4Cl (50,737г, 948,54моль). Реакційну суміш нагрівали при температурі між 95-100°С протягом 1,33 години, потім охолоджували. Реакційну суміш сушили на роторному випарнику до одержання залишку і залишок розподіляли між ЕtOАс (2000мл) і 1н НСl (600мл). Шари струшували, розділяли і органічний шар промивали 1н НСl (2´300мл), Н2О (3´300мл) і насиченим сольовим розчином (2´300мл), сушили над Na2SO4, фільтрували, видаляли вологу на роторному випарнику і розтирали з гексаном з одержанням не зовсім білої твердої речовини (97,5г). Продукт очищали за допомогою кип'ятіння зі зворотним холодильником твердої речовини у діетиловому ефірі (2000 мл), концентрували до приблизно одного літра і охолоджували. Тверду речовину збирали і сушили у вакуумі з одержанням продукту у вигляді білої твердої речовини (77,4г, 154,3моль, 81%) з розкл. при 111-114°С. 1 Н ЯМР (DMSO-d6) d 0,72 (т, J=6,9Гц, 3Н) 1,10-1,20 (м, 4Н), 1,50-1,60 (м, 2Н), 2,67 (т, J=7,8Гц, 2Н), 5,30 (с, 2Н), 5,62 (с, 2Н), 6,81 (д, J=7,3Гц, 2Н), 7,02-7,20 (м, 5Н), 7,30 (дд, J=2,4, 9,0Гц, 1Н), 7,35 (д, J=7,9Гц, 1Н), 7,44 (дд, J=1,5, 8,2Гц, 1Н), 7,55 (д, J=2,3Гц, 1Н) , 7,60 (д, J=7,6Гц, 1Н), 7,84-7,90 (м, 3Н) 16,9 (с, 1Н); ІЧ (тверда речовина) 2920, 2850, 1610, 1390, 1200, 860, і 750см1; мас-спектр [ESI], m/z 502 (Μ+Η)+ Анал. Розраховано для C32H31N5O: С, 76,62; Η, 6,23; Ν, 13,96, Знайдено: С, 76,43; Η, 6,12; Ν, 14,19. Приклад 2 6-(1-бензил-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил 1Н тетразол-5-ілметиловий ефір або 1-бензил-2[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-1Η-індол Стадія 1 2-(6-гідрокси-2-нафтил)-3-пентил-1Н-індол До розчину 2-(6-метокси-2-нафтил)-3-пентил-1Н-індолу (0,915г, 2,66моль), що перемішується, у СН2Сl2 (30мл), охолодженому до -78°С, додавали по краплях ВВr3 (9,86мл, розчин 1,0М у СН2Сl2, 9,86моль). Реакційну суміш перемішували при цій температурі протягом 0,5 години і потім нагрівали протягом 2 годин до кімнатної температури. Реакційну суміш гасили МеОН (~5мл) з подальшим розбавленням Н2О (20мл) і EtOAc (200мл). Органічний шар промивали насиченим сольовим розчином (20мл) і потім сушили (Na2SO4). Після концентрування, залишок очищали з використанням апарату очищення Biotage Flash 40 (градієнт 1020% EtOAc:петролейний ефір) з одержанням продукту (0,677г, 77%) у вигляді піноподібної твердої речовини; 1 Н ЯМР (DMSO-d6) d 0,83 (т, J=7,3Гц, 3Н) , 1,23-1,42 (м, 4Н), 1,58-1,76 (м, 2Н), 2,89 (т, J=8,2Гц, 2Н), 7,00 (т, J=8,2Гц, 1Н), 7,06-7,19 (м, 3Н), 7,35 (д, J=8,2Гц, 1Н), 7,53 (д, J=8,2, 1Н), 7,67 (д, J=9,1Гц, 1Н), 7,74-7,88 (м, 2Н), 7,98 (с, 1Н), 9,83 (с, 1Н), 11,14 (с, 1Н); мас-спектр [(+)ESI], m/z 330 (М+Н)+ і [(-)ESI], m/z 328 (M-H)- . Стадія 2 2-(5-бром-6-гідрокси-2-нафтил)-3-пентил-1Н-індол До розчину 2-(6-метокси-2-нафтил)-3-пентил-1Η-індолу (1,27г, 3,85моль), що перемішується, в НОАс (25мл), при 0°С додавали КОАс (0,453г, 4,62моль). Реакційну суміш перемішували при цій температурі протягом 10 хвилин і потім по краплях протягом ~10 хвилин додавали розчин Вr2 (0,218мл, 4,24моль) в НОАс (5мл). Реакційній суміші давали нагрітися до кімнатної температури і перемішували протягом 4 годин. Потім реакційну суміш розбавляли Н2О (50мл) і екстрагували EtOAc (200мл). Органічний шар промивали насиченим сольовим розчином (20мл) і потім сушили (Na2SO4). Після концентрування, залишок очищали з використанням апарату очищення Biotage Flash 40 (градієнт 10-30% EtOAc:петролейний ефір) з одержанням продукту (0,782г, 50%) у вигляді твердої речовини (суміш, що не розділяється, моно- і дибромзаміщених аналогів, яку розділяли на наступній стадії); монобромзаміщена сполука: мас-спектр [()ESI], m/z 406/408 (M-H) - і дибромзаміщений аналог: мас-спектр [(-)ESI], m/z 486 (М-Н) -. Стадія 3 {[1-бром-6-(3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрил і {[1-бром-6-(5-бром-З-пентил-1Н-індол2-іл)-2-нафтил]окси} ацетонітрил До розчину 2-(5-бром-6-гідрокси-2-нафтил)-3-пентил-1Н-індолу (0,740г, 1,81моль), що перемішується, в ацетоні (20мл), при кімнатній температурі додавали Cs2CO3 (1,30г, 3,98моль) з подальшим додаванням бромацетонітрилу (1,39мл, 1,99моль). Реакційну суміш перемішували при цій температурі протягом 6 годин і потім розбавляли EtOAc (200мл). Органічний шар промивали Н2О (20мл), насиченим сольовим розчином (20мл) і потім сушили (Na2SO4). Після концентрування, залишок очищали з використанням апарату очищення Biotage Flash 40 (20% ЕtOАс петролейний ефір) з одержанням продукту (0,315г, 39%) у вигляді твердої піноподібної речовини, а також її дибромзаміщеного аналога (0,141г, 15%); монобромзаміщена сполука: 1 Н ЯМР (DMSO-d6) d 0,82 (т, J=7,3Гц, 3Н) , 1,22-1,42 (м, 4Н), 1,60-1,74 (м, 2Н), 2,93 (т, J=8,2Гц, 2Н), 5,46 (с, 2Н), 7,02 (т, J=7,3Гц, 1Н), 7,13 (т, J=7,3Гц, 1Н), 7,39 (д, J=8,2Гц, 1Н), 7,58 (д, J=8,2Гц, 1Н), 7,67 (д, J=9,1Гц, 1Н), 7,97 (д, J=9,1Гц, 1Н), 8,10-8,28 (м, 3Н), 11,31 (с, 1Н) ; мас-спектр [(-)ESI], m/z 445/447 (М-Н)- і дибромзаміщений аналог: 1 Н ЯМР (DMSO-d6) d 0,81 (т, J=7,7Гц, 3Н), 1,21-1,40 (м, 4Н), 1,57-1,73 (м, 2Н), 2,92 (т, J=8,7Гц, 2Н), 5,46 (с, 2Н), 7,16 (d, J=8,7Гц, 1Н), 7,51-7,59 (м, 2Н), 7,69 (д, J=8,7Гц, 1Н), 7,95 (д, J=9,7Гц, 1Н), 8,12-8,31 (м, 3Н), 11,50 (с, 1Н); мас-спектр [(-)ESI], m/z 525 (М-Н)Стадія 4 {[6-(1-бензил-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил]окси}ацетонітрил До розчину {[1-бром-6-(3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу (0,135г, 0,257моль), що перемішується, у ТГФ (5мл) при 0°С додавали KOt-Bu (0,32г, 0,283моль) з подальшим додаванням ВnВr (0,019мл, 0,308моль). Реакційну суміш нагрівали до кімнатної температури і залишали перемішуватися на 24 години. Після закінчення цього часу реакційну суміш гасили 1н НСl (~2мл). Одержаний розчин розбавляли ЕtOАс (100мл). Органічний шар промивали 1н НСl (10мл), насиченим водним розчином NaHCO3 (10мл) і насиченим сольовим розчином (10мл) і потім сушили (MgSO4). Після концентрування, залишок очищали препаративною хроматографією на пластинках (20% EtOAc:петролейний ефір) з одержанням продукту (0,105г, 56%) у вигляді твердої речовини; 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=7,4Гц, 3Н) , 1,09-1,23 (м, 4Н), 1,47-1,63 (м, 2Н), 2,70 (т, J=7,7Гц, 2Н), 5,34 (с, 2Н), 5,46 (с, 2Н), 6,81 (д, J=7,4Гц, 2Н), 7,04-7,23 (м, 5Н), 7,41 (д, J=8,1Гц, 1Н), 7,62-7,73 (м, 3Н), 8,02 (с, 1Н) , 8,12 (д, J=9,2Гц, 1Н) , 8,20 (д, J=9,2Гц, 1Н) ; мас-спектр [(+)ESI], m/z 537/539 (M+H)+. Стадія 5 6-(1-бензил-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил 1Н-тетразол-5-ілметиловий ефір або 1-бензил-2[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-1Н-індол До розчину {[6-(1-бензил-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил]окси}ацетонітрилу (0,101г, 0,188моль), що перемішується, у ДМФА (7мл) при кімнатній температурі додавали NaN3 (0,061г, 0,940моль) з подальшим додаванням NH4Cl (0,050г, 0,940моль). Реакційну суміш нагрівали протягом 2 годин до 100°С. Після закінчення цього часу, суміш концентрували і розбавляли 2н НСl (~5мл). Цю суміш перемішували при кімнатній температурі і потім екстрагували ЕtOАс (100мл). Органічний шар промивали 2н НСl (10мл) і насиченим сольовим розчином (10мл) і потім сушили (MgSO4). Одержаний розчин концентрували з одержанням продукту (0,065г, 60%) у вигляді жовтої піни, т.пл.>70°С (розкл.); 1 Н ЯМР (DMSO-d6) d 0,72 (т, J=6,9Гц, 3Н) , 1,09-1,20 (м, 4Н), 1,50-1,59 (м, 2Н), 2,68 (т, J=7,3Гц, 2Н), 5,32 (с, 2Н), 5,71 (с, 2Н), 6,77-6,81 (м, 2Н), 7,07 (т, J=7,6Гц, 1Н) , 7,10-7,18 (м, 4Н), 7,38 (д, J=8,1Гц, 1Н), 7,58-7,64 (м, 2Н), 7,70 (д, J=9,0Гц, 1Н), 7,97 (с, 1Н), 8,03 (д, J=9,2Гц, 1Н), 8,15 (д, J=8,9Гц, 1Н), 15,90-17,70 (ушир, с, 1Н); ІЧ (чистий) 3030, 2950, 2925, 2855, 1600, 1565, 1495, 1475, 1465, 1455, 1405, 1330, 1270, 1745, 1195, 1145, 1050, 1030, 1020, 975, 920, 895, 830, 800, 740, 700, і 675см-1; мас-спектр [(-)ESI], m/z 578 (Μ-Η)+; Анал. Розраховано для C32H30BrN5O·1,5Н2О: С, 63,26; Η, 5,47; Ν, 11,53, Знайдено: С, 63,16; Η, 5,11; Ν, 11,33. Приклад 3 1-метил-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол Стадія 1 {[6-(3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрил Вказану у заголовку сполуку одержували у вигляді твердої речовини (0,633г, 84%), виходячи з 2-(6гідрокси-2-нафтил)-3-пентил-1Н-індолу, використовуючи процедуру стадії 3 Прикладу 2; 1 Н ЯМР (DMSO-d6) d 0,83 (т, J=7,5Гц, 3Н), 1,24-1,42 (м, 4Н), 1,60-1,75 (м, 2Н), 2,93 (т, J=8,4Гц, 2Н), 5,33 (с, 2Н), 7,02 (т, J=8,4Гц, 1Н), 7,11 (т, J=8,4Гц, 1Н) , 7,28-7,41 (м, 2Н), 7,52-7,62 (м, 2Н), 7,80 (д, J=9,3Гц, 1Н), 7,99 (д, J=9,3Гц, 2Н), 8,13 (с, 1Н), 11,23 (с, 1Н); мас-спектр [(-)ESI], m/z 367 (М-Н)-. Стадія 2 {[6-(1-метил-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрил Вказану у заголовку сполуку одержували у вигляді твердої речовини (0,412г, 83%), виходячи з {[6-(3пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи МеІ та процедуру стадії 4 Прикладу 2; 1 Н ЯМР (DMSO-d6) d 0,74 (т, J=7,5Гц, 3Н) , 1,07-1,27 (м, 4Н), 1,47-1,65 (м, 2Н), 2,68 (т, J=8,3Гц, 2Н), 3,59 (с, 3Н), 5,34 (с, 2Н), 7,08 (т, J=8,3Гц, 1Н), 7,19 (т, J=8,3Гц, 1Н), 7,34 (дд, J=1,5, 9,0Гц, 1Н), 7,48 (д, J=9,0Гц, 1Н), 7,53-7,66 (м, 3Н), 7,92-8,08 (м, 3Н) ; мас-спектр [(+ )ESI], m/z 383 (М+Н)+. Стадія 3 1-метил-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол Вказану у заголовку сполуку одержували у вигляді твердої речовини рудувато-коричневого кольору (0,311г, 74%), виходячи з {[6-(1-метил-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи процедуру стадії 5 Прикладу 2; т.пл. 120-122°С; 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=6,9Гц, 3Н), 1,09-1,24 (м, 4Н), 1,48-1,60 (м, 2Н), 2,66 (т, J=7,2Гц, 2Н), 3,58 (с, 3Н), 5,65 (с, 2Н), 7,06 (т, J=7,6Гц, 1Н), 7,18 (т, J=7,4Гц, 1Н), 7,33 (дд, J=2,5, 8,9Гц, 1Н), 7,45 (д, J=8,1Гц, 1Н), 7,51-7,62 (м, 3Н), 7,91-8,01 (м, 3Н), 15,08-17,10 (ушир, с, 1Н); ІЧ (чистий) 3130, 3040, 2950, 2930, 2890, 2860, 2795, 1625, 1605, 1565, 1500, 1485, 1470, 1440, 1430, 1390, 1360, 1340, 1325, 1265, 1230, 1220, 1200, 1170, 1135, 1100, 1045, 1035, 1015, 965, 930, 905, 845, 830, 785, 740, 705, і 680см-1; мас-спектр [(+)APCI], m/z 426 (M+H)+; Анал. Розраховано для C26H27N5O: С, 73,39; Η, 6,40; Ν, 16,46, Знайдено: С, 73,08; Η, 6,57; Ν, 16,45. Приклад 4 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-метил-3-пентил-1Н-індол або 1-бром-6-(1-метил-3пентил-1Н-індол-2-іл)-2-нафтил 1Н-тетразол-5-ілметиловий ефір Стадія 1 {[6-(1-метил-3-пентил-1Н-індол-2-іл)-1Н-бром-2-нафтил]окси}ацетонітрил Вказану у заголовку сполуку одержували у вигляді твердої речовини світло-рудувато-коричневого кольору (0,111г, 69%), виходячи з {[1-бром-6-(3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи МеІ та процедуру стадії 4 Прикладу 2; 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=7,4Гц, 3Н), 1,08-1,26 (м, 4Н), 1,47-1,62 (м, 2Н), 2,69 (т, J=8,2Гц, 2Н), 3,61 (с, 3Н), 5,48 (с, 2Н), 7,09 (т, J=7,4Гц, 1Н); 7,21 (т, J=7,4Гц, 1Н), 7,49 (д, J=8,2Гц, 1Н), 7,61 (д, J=8,2Гц, 1Н), 7,68-7,80 (т, 2Н), 8,08 (с, 1Н), 8,22 (д, J=8,9Гц, 1Н) , 8,27 (д, J=8,9Гц, 1Н) ; мас-спектр [(+ )ESI], m/z 461/463 (М+Н)+. Стадія 2 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-метил-3-пентил-1Н-індол або 1-бром-6-(1-метил-3пентил-1Н-індол-2-іл)-2-нафтил 1Н-тетразол-5-ілметиловий ефір Вказану у заголовку сполуку одержували у вигляді твердої речовини світло-коричневого кольору (0,070г, 61%), виходячи з {[6-(1-метил-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил]окси}ацетонітрилу, використовуючи процедуру стадії 5 Прикладу 2; т.пл.>125°С (розкл.); 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=6,9Гц, 3Н), 1,11-1,21 (м, 4Н), 1,50-1,57 (м, 2Н), 2,66 (т, J=7,5Гц, 2Н) , 3,59 (с, 3Н), 5,60 (С, 2Н), 7,07 (т, J=7,2Гц, 1Н), 7,19 (т, J=7,3Гц, 1Н), 7,46 (д, J=8,2Гц, 1Н), 7,58 (д, J=7,9Гц, 1Н), 7,68 (д, J=8,7Гц, 1Н), 7,81 (д, J=9,0Гц, 1Н), 8,01 (с, 1Н), 8,09 (д, J=9,0Гц, 1Н), 8,20 (д, J=8,7Гц, 1Н), 15,9517,95 (ушир, с, 1Н); ІЧ (чистий) 3050, 2950, 2920, 2855, 1600, 1565, 1475, 1470, 1405, 1365, 1330, 1270, 1245, 1185, 1160, 1150, 1135, 1100, 1055, 1020, 975, 915, 895, 825, 800, 765, 740, 700, i 670см-1; мас-спектр [(-)ESI], m/z 502 (М-Н)-; Анал. Розраховано для C26H26BrN5O·1,25Н2О: С, 59,26; Н, 5,45; N, 13,29, Знайдено: С, 58,89; Н, 5,07; N, 12,83. Приклад 5 1-ацетил-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол Стадія 1 {[6-(1-ацетил-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрил До розчину {[6-(3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу (0,300г, 0,814моль), що перемішується, в Ас2О (3мл, 3,18моль) при кімнатній температурі додавали каталітичну кількість CSA (0,019г, 0,0814моль). Реакційну суміш нагрівали до 70°С протягом 18 годин, і аналіз ТСХ показав, що реакція наполовину завершена. Додавали ще 19мг CSA і витримували при 70°С ще 24 години. Після закінчення цього часу реакційну суміш гасили 1н НСl (~2мл). Одержаний розчин екстрагували EtOAc (100мл). Органічний шар промивали 1н НСl (10мл), насиченим водним розчином NaHCO3 (10мл) і насиченим сольовим розчином (10мл), потім сушили (MgSO4). Після концентрування залишок очищали з використанням апарату очищення Biotage Flash 40 (градієнт 10-20% EtOAc:петролейний ефір) з одержанням продукту (0,164г, 49%) у вигляді твердої речовини; 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=7,2Гц, 3Н), 1,03-1,23 (м, 4Н), 1,47-1,61 (м, 2Н), 1,92 (с, 3Н), 3,24-3,42 (м, 2Н) , 5,34 (с, 2Н), 7,27-7,43 (м, 3Н), 7,52-7,70 (м, 3Н), 7,94-8,08 (м, 3Н), 8,33 (д, J=8,8Гц, 1Н); мас-спектр [(+)ESI], m/z 411 (М+Н)-, 433 (M+Na)+. Стадія 2 1-ацетил-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Н-індол Вказану у заголовку сполуку одержували у вигляді твердої жовтої піноподібної речовини (0,097г, 56%), з {[6-(1-ацетил-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи процедуру стадії 5 Прикладу 2; т.пл.>95°С (розкл.); 1 Н ЯМР (DMSO-d6) d 0,71 (т, J=7,0Гц, 3Н) , 1,08-1,19 (м, 4Н), 1,47-1,56 (м, 2Н), 1,90 (с, 3Н), 2,51 (т, J=7,6Гц, 2Н), 5,55 (С, 2Н), 7,29-7,38 (м, 3Н), 7,52 (дд, J=1,5, 8,4Гц, 1Н), 7,60 (д, J=2,1Гц, 1Н), 7,63 (д, J=7,2Гц, 1Н) , 7,92-7,98 (м, 3Н), 8,31 (д, J=7,8Гц, 1Н), 14,75-17,75 (ушир, с, 1Н); ІЧ (чистий) 3050, 2955, 2925, 2860, 1695, 1630, 1610, 1575, 1500, 1475, 1455, 1370, 1335, 1305, 1265, 1240, 1200, 1170, 1155, 1130, 1100, 1060, 1025, 950, 920, 900, 865, 810, 750, 700, і 675см-1; мас-спектр [(+)ESI], m/z 454 (М+Н)+; Анал. Розраховано для С27Н27N5О2·2,0Н2О: С, 66,24; Н, 6,38; N, 14,30, Знайдено: С, 65,85; Н, 5,76; N, 13,53. Приклад 6 1-ацетил-2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-1Н-індол Стадія 1 {[6-(1-ацетил-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил]окси}ацетонітрил Вказану у заголовку сполуку одержували у вигляді твердої речовини (0,093г, 31%) з {[1-бром-6-(3пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи процедуру стадії 1 Прикладу 5; 1 Н ЯМР (DMSO-d6) d 0,72 (т, J=7,2Гц, 3Н), 1,07-1,21 (т, 4Н), 1,48-1,59 (т, 2Н), 1,97 (с, 3Н), 2,42-2,57 (т, 2Η), 5,48 (с, 2Н), 7,27-7,46 (т, 2Η), 7,63-7,80 (т, 3Н), 8,13 (с, 1Н), 8,15-8,36 (т, 3Н); мас-спектр [(+)ESI], m/z 489/491 (М+Н)+, 511/513 (M+Na)+. Стадія 2 1-ацетил-2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-1Н-індол Вказану у заголовку сполуку одержували у вигляді світло-жовтої піни (0,028г, 29%) з {[6-(1-ацетил-3пентил-1Н-індол-2-іл)-2-нафтил]окси}ацето-нітрилу, використовуючи процедуру стадії 5 Прикладу 2; т.пл.>79°С (розкл.); 1 Н ЯМР (DMSO-d6) d 0,71 (т, J=7,0Гц, 3Н), 1,08-1,18 (т, 4Η), 1,48-1,56 (т, 2Η), 1,95 (с, 3Н), 2,48-2,56 (т, 2Η), 5,73 (с, 2Н), 7,32 (тд, J=1,1, 7,5Гц, 1Н), 7,37 (тд, J=1,2, 7,3Гц, 1Н), 7,65 (д, J=7,8Гц, 1Н), 7,70 (дд, J=1,7, 8,7Гц, 1Н), 7,74 (д, J=9,0Гц, 1Н), 8,08 (д, J=1,5Гц, 1Н), 8,12 (д, J=9,0Гц, 1Н), 8,20 (д, J=8,7Гц, 1Н), 8,30 (д, J=7,8Гц, 1Н), 14,75-17,75 (ушир, с, 1Н); ІЧ (чистий) 3140, 3050, 2950, 2920, 2860, 2630, 1695, 1630, 1600, 1570, 1475, 1450, 1370, 1340, 1300, 1270, 1245, 1205, 1195, 1140, 1095, 1045, 1020, 980, 915, 900, 875, 830, 805, 750, 700, i 670см-1; мас-спектр [(+)ESI], m/z 532/534 (М+Н)+; Анал. Розраховано для C27H26BrN5O2·1,0Н2О: С, 58,92; Н, 5,13; N, 12,72, Знайдено: С, 58,74; Н, 4,76; N, 12,21. Приклад 7 3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-[2-(трифторметил)-бензил]-1Н-індол Стадія 1 {[6-(3-пентил-1-[2-(трифторметил)бензил]-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрил Вказану у заголовку сполуку одержували у вигляді твердої речовини (0,147г, 34%) з {[6-(3-пентил-1Ніндол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи 2-трифторметилбензилбромід і процедуру стадії 4 Прикладу 2; 1 Н ЯМР (DMSO-d6) d 0,72 (т, J=7,8Гц, 3Н), 1,08-1,29 (м, 4Н), 1,51-1,67 (м, 2Н), 2,71 (т, J=8,6Гц, 2Н), 5,29 (с, 2Н), 5,47 (с, 2Н), 6,37 (д, J=8,6Гц, 1Н), 7,08-7,21 (м, 2Н), 7,23-7,32 (м, 2Н), 7,35-7,45 (м, 2Н) , 7,48 (т, J=7,8Гц, 1Н), 7,53 (д, J=1,7Гц, 1Н), 7,63-7,75 (м, 2Н), 7,83-7,92 (м, 3Н); мас-спектр [(+)ESI], m/2 527 (М+Н)+. Стадія 2 3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-[2-(трифторметил)-бензил]-1Η-індол Вказану у заголовку сполуку одержували у вигляді твердої світло-коричнювато-рудої речовини (0,097г, 66%) з {[6-(3-пентил-1-[2-(трифторметил)бензил]-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи процедуру стадії 5 Прикладу 2; т.пл.>100°С (розкл.); 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=7,0Гц, 3Н), 1,11-1,27 (м, 4Н), 1,53-1,63 (м, 2Н), 2,70 (т, J=7,5Гц, 2Н), 5,46 (с, 2Н), 5,60 (с, 2Н), 6,36 (д, J=7,8Гц, 1Н), 7,09-7,17 (м, 2Н), 7,24 (д, J=7,5Гц, 1Н), 7,28 (дд, J=2,4, 9,0Гц, 1Н), 7,34-7,40 (м, 2Н), 7,46 (т, J=7,6Гц, 1Н), 7,52 (д, J=2,3Гц, 1Н), 7,64 (д, J=7,6Гц, 1Н), 7,67 (д, J=6,9Гц, 1Н), 7,797,85 (м, 3Н), 16,15-17,50 (ушир.с, 1Н); ІЧ (чистий) 3040, 2950, 2930, 2860, 1630, 1605, 1570, 1480, 1460, 1445, 1390, 1340, 1310, 1255, 1230, 1205, 1165, 1120, 1060, 1035, 930, 900, 865, 805, 775, 745, 725, і 660см-1; масспектр [(-)ESI], m/z 568 (M-H)-; Анал. Розраховано для С33С30F3N5О·0,5Н2О: С, 68,50; Н, 5,40; N, 12,10, Знайдено: С, 68,63; Н, 5,34; N, 11,87. Приклад 8 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-1-[2-(трифторметил)бензил]-1Н-індол Стадія 1 {[6-(3-пентил-1-[2-(трифторметил)бензил]-1Н-індол-2-іл)-1-бром-2-нафтил]окси} ацетонітрил Вказану у заголовку сполуку одержували у вигляді твердої речовини (0,053г, 14%) з {[1-бром-6-(3пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи 2-трифторметилбензилбромід і процедуру стадії 4 Прикладу 2; 1 Н ЯМР (DMSO-d6) d 0,72 (т, J=7,0Гц, 3Н), 1,11-1,22 (м, 4Н), 1,54-1,62 (м, 2Н), 2,71 (т, J=7,4Гц, 2Н), 5,42 (с, 2Н), 5,48 (с, 2Н), 6,34 (д, J=7,9Гц, 1Н), 7,11-7,20 (м, 2Н), 7,28 (д, J=7,8Гц, 1Н), 7,37 (т, J=7,8Гц, 1Н), 7,45 (т, J=7,8Гц, 1Н), 7,57 (дд, J=1,7, 8,9Гц, 1Н), 7,63-7,68 (м, 2Н), 7,69 (д, J=7,2Гц, 1Н), 7,95 (д, J=1,2Гц, 1Н), 8,03 (д, J=9,2Гц, 1Н), 8,12 (д, J=8,7Гц, 1Н). Стадія 2 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-3-пентил-1-[2-(трифторметил)бензил]-1Η-індол Вказану у заголовку сполуку одержували у вигляді жовтої піни (0,013г, 25%) з {[6-(3 -пентил-1-[2(трифторметил)бензил]-1Н-індол-2-іл)-1-бром-2-нафтил]окси}ацетонітрилу, використовуючи процедуру стадії 5 Прикладу 2; т.пл.>85°С (розкл.) 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=6,9Гц, 3Н), 1,10-1,23 (м, 1Н), 1,54-1,62 (м, 2Η), 2,70 (т, J=7,33Гц, 2Н), 5,47 (с, 2Н), 5,70 (с, 2Н), 6,34 (д, J=7,8Гц, 1Н), 7,11-7,18 (м, 2Н), 7,27 (д, J=7,6Гц, 1Н), 7,37 (т, J=7,5Гц, 1Н), 7,45 (т, J=7,6Гц, 1Н), 7,54 (дд, J=1,5, 8,7Гц, 1Н), 7,63 (д, J=7,6Гц, 1Н), 7,65-7,70 (м, 2Н), 7,91 (д, J=1,4Гц, 1Н), 7,97 (д, J=9,0Гц, 1H), 8,08 (д, J=8,7Гц, 1Н), 15,75-17,85 (ушир.с, 1H); ІЧ (чистий) 3050, 2950, 2920, 2855, 1600, 1565, 1475, 1460, 1415, 1355, 1335, 1310, 1270, 1245, 1195,1160, 1115, 1075, 1060, 1035, 970, 925, 895, 830, 795, 770, 740, i 650см-1; мас-спектр [(+)ESI], m/z 648 (М+Н)+ і [(-)ESI], m/z 646 (M-H)-; Анал. Розраховано для С33Н29ВrF3N5О·3,3Н2О: С, 55,99; Η, 5,07; Ν, 9,89, Знайдено: С, 56,14; Η, 4,36; Ν, 9,44. Приклад 9 1-(4-трет-бутилбензил)-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1H-індол Стадія 1 {[6-(1-[4-трет-бутилбензил]-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрил Вказану у заголовку сполуку одержували у вигляді твердої речовини (0,191г, 46%) з {[6-(3-пентил-1Ніндол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи 4-трет-бутилбензилбромід і процедуру стадії 4 Прикладу 2; 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=7,4Гц, 3Н), 1,08-1,27 (м, 4Н), 1,17 (с, 9Н), 1,48-1,65 (м, 2Н), 2,69 (т, J=8,1Гц, 2Н), 5,29 (с, 2Н), 5,52 (с, 2Н), 6,78 (д, J=8,1Гц, 2Н), 7,05-7,14 (м, 2Н), 7,18 (д, J=8,1Гц, 2Н), 7,32 (дд, J=1,4, 9,9Гц, 1H), 7,38 (д, J=7,4, 1Н), 7,53 (д, J=8,5Гц, 1Н), 7,58-7,67 (м, 2Н), 7,90-8,00 (м, 3Н); мас-спектр [(+)ESI], m/z 515 (M+H)+, 537 (M+Na)+ і [(-)ESI], m/z 513 (M-H)-. Стадія 2 1-(4-трет-бутилбензил)-3-пентил-2-[6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1Η-індол Вказану у заголовку сполуку одержували у вигляді жовтої твердої піни (0,144г, 73%) з {[6-(1-[4-третбутилбензил]-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи процедуру стадії 5 Прикладу 2; т.пл.>95°С (розкл.) 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=6,7Гц, 3Н), 1,12-1,20 (м, 4Н), 1,16 (с, 9Н), 1,52-1,58 (м, 2Н), 2,67 (т, J=7,5Гц, 2Н), 5,26 (с, 2Н), 5,60 (т, 2Н), 6,76 (д, J=8,2Гц, 2Н), 7,05 (т, J=7,5Гц, 1Н), 7,10 (т, J=7,8Гц, 1Н), 7,17 (д, J=8,2Гц, 2Н), 7,30 (дд, J=2,3, 9,0Гц, 1Н), 7,35 (д, J=7,9Гц, 1Н), 7,47 (дд, J=1,2, 8,6Гц, 1Н), 7,56 (д, J=2,3Гц, 1Н), 7,59 (д, J=7,8Гц, 1Н), 7,87-7,92 (м, 3Н), 14,75-17,75 (ушир, с, 1Н); ІЧ (чистий) 3060, 2950, 2925, 2850, 1630, 1605, 1565, 1515, 1500, 1480, 1465, 1445, 1410, 1395, 1365, 1345, 1305, 1270, 1235, 1200, 1170, 1130, 1105, 1030, 1010, 965, 930, 900, 855, 810, 740, і 670см-1; мас-спектр [(-)ESI], m/z 556 (М-Н)- ; Анал. Розраховано для C36H39N5O·0,75Н2О: С, 75,69; Н, 7,15; N, 12,26, Знайдено: С, 75,84; Н, 6,92; N, 12,30. Приклад 10 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-(4-трет-бутилбензил)-3-пентил-1Η-індол Стадія 1 {[6-(1-[4-трет-бутилбензил]-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил]окси}ацетонітрил Вказану у заголовку сполуку одержували у вигляді твердої речовини (0,070г, 19%), виходячи з {[1-бром6-(3-пентил-1Н-індол-2-іл)-2-нафтил]окси}ацетонітрилу, використовуючи 4-трет-бутилбензилбромід і процедуру стадії 4 Прикладу 2; 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=7,3Гц, 3Н), 1,06-1,30 (м, 4Н), 1,15 (с, 9Н), 1,48-1,63 (м, 2Н) , 2,69 (т, J=8,4Гц, 1Н), 5,31 (с, 2Н), 5,47 (с, 2Н), 6,74 (д, J=8,4Гц, 2Н), 7,05-7,17 (м, 3Н), 7,17 (д, J=8,4Гц, 2Н), 7,42 (д, J=8,7Гц, 1Н), 7,66 (д, J=8,0Гц, 1Н), 7,70 (д, J=9,1Гц, 2Н), 8,05 (с, 1Н), 8,13 (д, J=8,0Гц, 1Н), 8,23 (д, J=8,0Гц, 1Н) ; мас-спектр [(+)ESI], m/z 593/595 (Μ+Η)+. Стадія 2 2-[5-бром-6-(1Н-тетразол-5-ілметокси)-2-нафтил]-1-(4-трет-бутилбензил)-3-пентил-1H-індол Вказану у заголовку сполуку одержували у вигляді жовтої піни (0,042г, 56%), виходячи з {[6-(1-[4-третбутилбензил]-3-пентил-1Н-індол-2-іл)-1-бром-2-нафтил]окси}ацетонітрилу, використовуючи процедуру стадії 5 Прикладу 2; т.пл.>90°С (розкл.) 1 Н ЯМР (DMSO-d6) d 0,72 (т, J=7,0Гц, 3Н) , 1,11-1,18 (м, 4Н), 1,15 (с, 9Н), 1,52-1,58 (м, 2Н), 2,68 (т, J=7,3Гц, 2Н) , 5,28 (с, 2Н), 5,72 (с, 2Н) , 6,74 (д, J=8,2Гц, 2Н), 7,06 (т, J=7,2Гц, 1Н), 7,11 (т, J=7,6Гц, 1Н), 7,17 (д, J=8,2Гц, 2Н), 7,38 (д, J=8,1Гц, 1Н), 7,61 (д, J=7,6Гц, 1Н), 7,65 (дд, J=1,7, 8,9Гц 1Н), 7,71 (д, J=9,2Гц, 1Н), 7,98 (д, J=1,4Гц, 1Н), 8,04 (д, J=9,2Гц, 1Н), 8,17 (д, J=8,7Гц, 1Н), 14,85-17,55 (ушир, с, 1Н); ІЧ (чистий) 3130, 3055, 2960, 2925, 2855, 2620, 1600, 1565, 1515, 1480, 1465, 1445, 1410, 1395, 1365, 1330, 1305, 1270, 1245, 1195, 1145, 1105, 1050, 1015, 975, 920, 895, 825, 800, 760, 740, 700, і 665см-1; .мас-спектр [(-)ESI], m/z 634/636 (М-Н)-; Анал. Розраховано для C36H38BrN5O·1,25Н2О: С, 65,60; Н, 6,19; N, 10,62, Знайдено: С, 65,49; Н, 5,92; N, 10,29. Приклад 11 {[1-бром-6-(1-метил-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}оцтова кислота Стадія 1 Метиловий ефір {[1-бром-6-(3-пентил-1Н-індол-2-іл)-2-нафтил]окси}оцтової кислоти Вказану у заголовку сполуку одержували у вигляді твердої речовини (0,410г, 58%) з 2-(5-бром-6гідрокси-2-нафтил)-3-пентил-1Н-індолу, використовуючи метилбромацетат і процедуру стадії 3 Прикладу 2; 1 Н ЯМР (DMSO-d6) d 0,82 (т, J=7,0Гц, 3Н), 1,27-1,39 (м, 4Н), 1,64-1,74 (м, 2Н), 2,93 (т, J=7,3Гц, 2Н), 3,73 (с, 3Н), 5,12 (с, 2Н), 7,02 (т, J=7,5Гц, 1Н), 7,12 (т, J=7,0Гц, 1Н), 7,38 (д, J=8,0Гц, 1Н), 7,48 (д, J=9,2Гц, 1Н),7,57 (д, J=7,9Гц, 1Н), 7,93 (д, J=7,9Гц, 1Н), 8,03 (д, J=9,0Гц, 1H), 8,14 (д, J=1,6Гц, 1Н), 8,22 (д, J=8,9Гц, 1Н), 11,26 (с, 1Н); мас-спектр [(+)ESI], m/z 480/482 (М+Н)+ i [(-)ESI], m/z 478/480 (ΜΗ)- . Стадія 2 {[1-бром-6-(1-метил-3-пентил-1Н-індол-2-іл)-2-нафтил]окси}оцтова кислота До розчину метилового ефіру {[1-бром-6-(3-пентил-1Н-індол-2-іл)-2-нафтил]окси}оцтової кислоти (0,410г, 0,853моль), що перемішується, у ТГФ (20мл) при 0°С додавали KOt-Bu (0,105г, 0,938моль) з подальшим додаванням МеІ (0,064мл, 1,02моль). Реакційну суміш нагрівали до кімнатної температури і залишали перемішуватися на 1 годину. Аналіз ТСХ і МС-аналіз показали, що весь вихідний матеріал був витрачений; однак через гідроліз у цих лужних умовах були утворені дві полярні кислоти (одна N-Me і одна N-H). Після концентрування залишок поглинали у ДМФА (20мл). Додавали NaH (0,075г, 60%мас, 1,88моль) з подальшим додаванням надмірної кількості МеІ для перетворення всієї проміжної речовини в одну кислоту (N-Me). Через 1 годину реакційну суміш концентрували, потім розбавляли ЕtOАс (200мл) і 1н НСl (20мл). Органічний шар промивали Н2О (20мл) і насиченим сольовим розчином (20мл), потім сушили (Na2SO4). Після концентрування, залишок очищали препаративною хроматографією на пластинках (10% МеОН:СНСl3) з одержанням продукту (0,232г, 57%) у вигляді жовтувато-оранжевої твердої піноподібної речовини, т.пл.>73°С (розкл.); 1 Н ЯМР (DMSO-d6) d 0,73 (т, J=7,0Гц, 3Н), 1,11-1.20 (м, 4Н), 1,50-1,58 (м, 2Н), 2,66 (т, J=7,3Гц, 2Н), 3,58 (с, 3Н), 4,93 (с, 2Н), 7,07 (т, J=7,6Гц, 1Н), 7,19 (т, J=7,1Гц, 1Н), 7,42-7,48 (м, 2Н), 7,58 (д, J=7,9Гц, 1Н), 7,68 (дд, J=1,7, 8,7Гц, 1Н), 7,99 (с, 1Н), 8,04 (д, J=9,0Гц, 1Н), 8,21 (д, J=8,7Гц, 1Н) , 11,95-14,75 (ушир.с, 1Н) ; ІЧ (чистий) 3050, 2955, 2925, 2850, 1725, 1670, 1600, 1480, 1470, 1430, 1370, 1325, 1275, 1220, 1190, 1145, 1095, 1015, 980, 925, 895, 830, 800, 765, 735, 700, і 665см-1; мас-спектр [(+)ESI], m/z 480/482 (М+Н)+; Анал. Розраховано для C26H26BrNO3·0,5Н2О: С, 63,81; Н, 5,56; N, 2,86, Знайдено: С, 63,67; Н, 5,30; N, 2,77.
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted naphtyl indol derivatives as inhibitors of plasminogen activator inhibitor type i (pai-1)
Автори англійськоюElokdah Hassan Mahmoud
Назва патенту російськоюЗамещенные нафтилиндольные производные как ингибиторы активатора плазминогена типа 1 (pai-1)
Автори російськоюЭлокдах Хассан Махмуд
МПК / Мітки
МПК: A61K 31/404, A61P 9/00, A61P 7/02, A61P 11/00, C07D 209/04, A61P 9/10, C07D 403/12, A61K 31/41
Мітки: інгібітори, pai-1, плазміногена, активатора, заміщені, типу, нафтиліндольні, похідні
Код посилання
<a href="https://ua.patents.su/17-78708-zamishheni-naftilindolni-pokhidni-yak-ingibitori-aktivatora-plazminogena-tipu-1-pai-1.html" target="_blank" rel="follow" title="База патентів України">Заміщені нафтиліндольні похідні як інгібітори активатора плазміногена типу 1 (pai-1)</a>
Попередній патент: Засіб для лікування виразок шкіри у тварин
Наступний патент: Протималярійні сполуки спіро- і диспіро- 1,2,4-триоксолану, спосіб їх одержання, фармацевтична композиція на їх основі, спосіб її одержання
Випадковий патент: Спосіб визначення жорсткості судин за допомогою "індексу віку судин"












