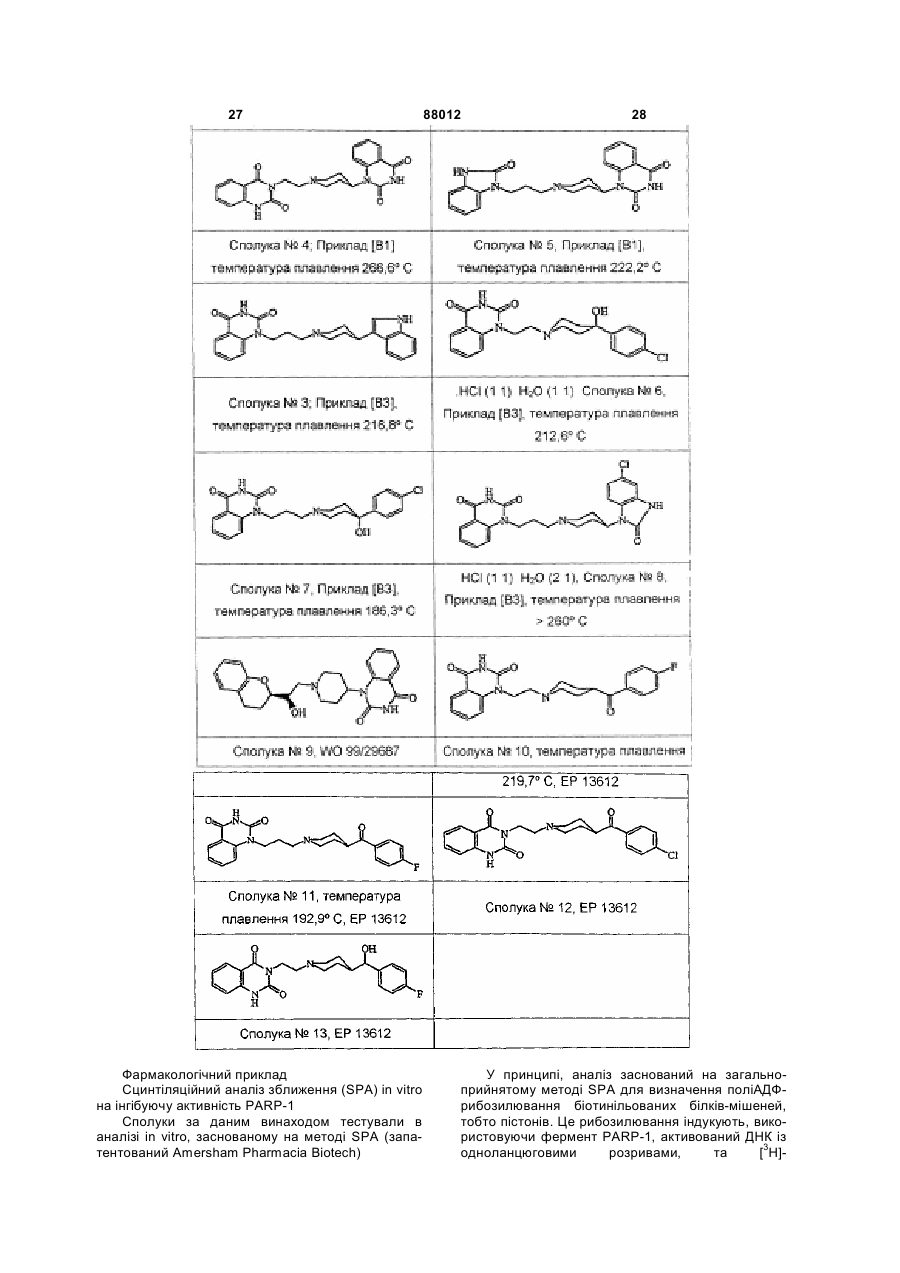
Похідні хіназоліндіону як інгібітори parp
Номер патенту: 88012
Опубліковано: 10.09.2009
Автори: Вутерс Вальтер Будевійн Леопольд, Мертенс Джозефус Каролус, ван Дун Якобус Альфонсус Йозефус, Сомерс Марія Вікторіна Франціска, Кенніс Людо Едмон Жозефін
Формула / Реферат
1. Сполука формули (І)
 , (I)
, (I)
її форми N-оксидів, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де
кожний X незалежно позначає  або
або  ;
;
та, коли X позначає  , то Y позначає
, то Y позначає  ;
;
кожний Y незалежно позначає  або
або  ;
;
за винятком випадку, коли X позначає  , тоді Y позначає
, тоді Y позначає  ;
;
L1 являє собою прямий зв'язок або двовалентний радикал, вибраний з -С1-6алкандіїлу-;
L2 являє собою прямий зв'язок або двовалентний радикал, вибраний з карбонілу, -С1-6алкандіїлу-, -(гідроксі)С1-6алкандіїлу-, -С(О)-С1-6алкандіїлу-або -С1-6алкандіїл-С(О)-;
R1 являє собою атом водню або гідроксильну групу;
Z являє собою атом водню або радикал, вибраний з групи, що складається з
 ,
,
де кожний R2 незалежно вибрано з атома водню, атома галогену або С1-6алкілу,
за умови, що хіназоліндіоновий фрагмент приєднаний до частини молекули, що залишилася, по NH-фрагменту в 1-му положенні, та у цьому випадку він заміщує атом водню; та за умови, що виключаються сполуки
1-[1-[(2S)-2-[(2R)-3,4-дигідро-2H-1-бензопіран-2-іл]-2-гідроксіетил]-4-піперидиніл]-2,4(1Н,3Н)-хіназоліндіон,
1-[2-4-[(4-фторбензоіл)-1-піперидиніл]етил]-2,4-(1Н,3Н)-хіназоліндіон та
1-[3-[4-(4-фторбензоїл)-1-піперидиніл]пропіл]-2,4-(1Н,3Н)-хіназоліндіон.
2. Сполука за п. 1, яка відрізняється тим, що
кожний X незалежно позначає  або
або  ;
;
кожний Y незалежно позначає  або
або  ;
;
L1 являє собою прямий зв'язок або двохвалентний радикал, вибраний з -С1-6алкандіїлу-;
L2 являє собою прямий зв'язок або двохвалентний радикал, вибраний з карбонілу, -С1-6алкандіїлу-, -С1-6алкандіїлу-, -(гідроксі)С1-6алкандіїлу- або -С(О)-С1-6алкандіїлу-;
R1 позначає атом водню або гідроксильну групу;
Z позначає атом водню або радикал, вибраний з (а-1), (а-2), (а-3), (а-4) або (а-5); та
кожний R2 незалежно вибрано з атома водню, атома галогену або С1-6алкілу.
3. Сполука за п. 1 або 2, яка відрізняється тим, що
кожний X позначає  ;
;
кожний Y позначає  ;
;
L1 позначає прямий зв'язок;
L2 позначає прямий зв'язок;
R1 позначає атом водню та
Z позначає атом водню.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що являє собою сполуку № 1
 Сполука № 1.
Сполука № 1.
5. Сполука за будь-яким з пп. 1-4 для застосування як лікарського засобу.
6. Фармацевтична композиція, яка містить фармацевтично прийнятні носії та терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4 як активний інгредієнт.
7. Спосіб отримання фармацевтичної композиції за п. 6, який відрізняється тим, що ретельно перемішують фармацевтично прийнятні носії та сполуку за будь-яким з пп. 1-4.
8. Застосування сполуки для виготовлення лікарського засобу для лікування захворювання, опосередкованого PARP, де зазначена сполука являє собою сполуку формули (І)
 , (І)
, (І)
її N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де кожний X незалежно позначає  або
або  ; та
; та
коли X позначає  , тоді Y позначає
, тоді Y позначає  ;
;
кожний Y незалежно позначає  або
або  ;
;
за винятком випадку, коли X позначає  , тоді Y позначає
, тоді Y позначає  ;
;
L1 позначає прямий зв'язок або двовалентний радикал, вибраний із -С1-6алкандіїлу-,
L2 позначає прямий зв'язок або двовалентний радикал, вибраний із карбонілу, -С1-6алкандіїлу-, -(гідроксі)С1-6алкандіїлу-, -С(О)-С1-6алкандіїлу-або -С1-6алкандіїл-С(О)-;
R1 позначає атом водню або гідроксильну групу;
Z позначає атом водню або радикал, вибраний із
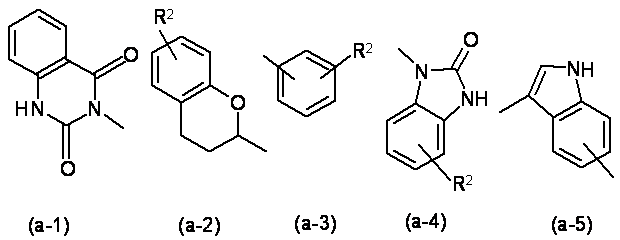 ,
,
де кожний R2 незалежно вибрано з атома водню, атома галогену або С1-6алкілу.
9. Застосування за п. 8 інгібітора PARP формули (І) для виготовлення лікарського засобу для лікування захворювання, опосередкованого PARP-1.
10. Застосування за п. 8 або 9, яке відрізняється тим, що лікування включає хемосенсибілізацію.
11. Застосування за п. 8 або 9, яке відрізняється тим, що лікування включає радіосенсибілізацію.
12. Комбінація сполуки разом із хіміотерапевтичним засобом, яка відрізняється тим, що зазначена сполука являє собою сполуку формули (І)
 , (І)
, (І)
її N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де
кожний X незавлежно позначає  або
або  ;
;
та, коли X позначає  , тоді Y позначає
, тоді Y позначає  ;
;
кожний Y незалежно позначає  або
або  ;
;
за винятком випадку, коли X позначає  , тоді Y позначає
, тоді Y позначає  ;
;
L1 позначає прямий зв'язок або двовалентний радикал, вибраний із -С1-6алкандіїлу-,
L2 позначає прямий зв'язок або двовалентний радикал, вибраний із карбонілу, -С1-6алкандіїлу-, -(гідроксі)С1-6алкандіїлу-, -С(О)-С1-6алкандіїлу-або -С1-6алкандіїл-С(О)-;
R1 позначає атом водню або гідроксильну групу;
Z позначає атом водню або радикал, вибраний із
 ,
,
де кожний R2 незалежно вибрано із атома водню, атома галогену або С1-6алкілу.
13. Спосіб отримання сполуки формули (І), в якому здійснюють
a) взаємодію проміжної сполуки формули (II) із проміжною сполукою формули (III), де W позначає придатну кінцеву групу, з утворенням сполуки формули (1-а), де X позначає  , в інертному розчиннику та при додаванні придатної основи
, в інертному розчиннику та при додаванні придатної основи
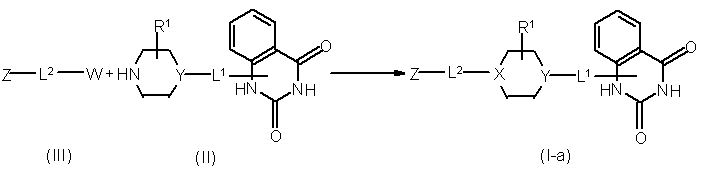 ;
;
b) взаємодію проміжної сполуки формули (IV) із проміжною сполукою формули (V), де W позначає придатну кінцеву групу, з утворенням сполуки формули (І-b), де Y позначає  , в інертному розчиннику та при додаванні придатної основи.
, в інертному розчиннику та при додаванні придатної основи.
Текст
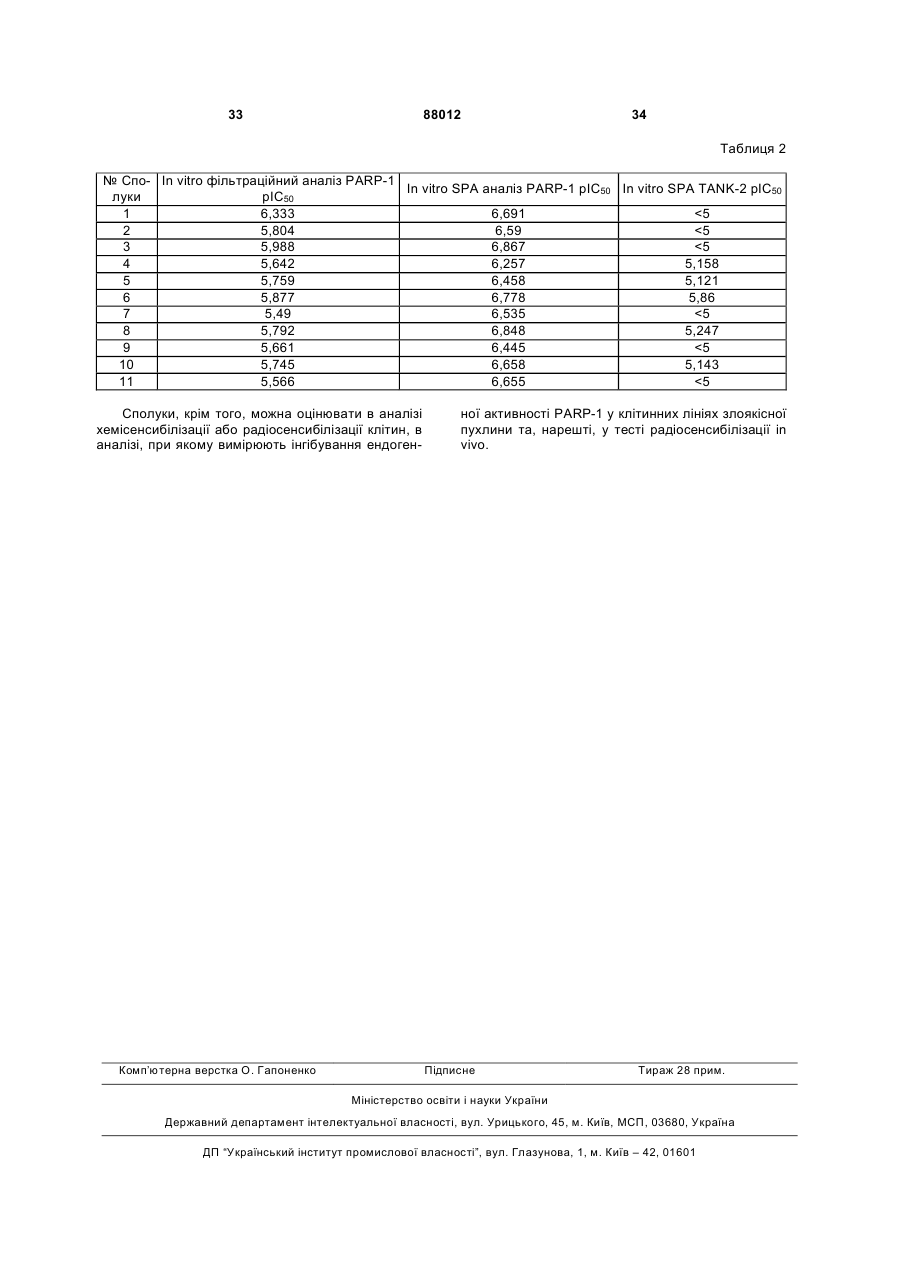
1. Сполука формули (І) 3 88012 4 1-[1-[(2S)-2-[(2R)-3,4-дигідро-2H-1-бензопіран-2-іл]R1 2-гідроксіетил]-4-піперидиніл]-2,4(1Н,3Н)O хіназоліндіон, L2 Z X Y L1 (І) 1-[2-4-[(4-фторбензоіл)-1-піперидиніл]етил]-2,4HN NH (1Н,3Н)-хіназоліндіон та 1-[3-[4-(4-фторбензоїл)-1-піперидиніл]пропіл]-2,4O , (1Н,3Н)-хіназоліндіон. її N-оксидні форми, фармацевтично прийнятні 2. Сполука за п. 1, яка відрізняється тим, що адитивні солі та стереохімічно ізомерні форми, де кожний X незалежно позначає або N N або кожний X незалежно позначає CH ; кожний CH Y незалежно позначає N або коли X позначає ; L1 являє собою прямий зв'язок або двохвалентний радикал, вибраний з -С1-6алкандіїлу-; L2 являє собою прямий зв'язок або двохвалентний радикал, вибраний з карбонілу, -С1-6алкандіїлу-, С1-6алкандіїлу-, -(гідроксі)С1-6алкандіїлу- або -С(О)С1-6алкандіїлу-; R1 позначає атом водню або гідроксильну групу; Z позначає атом водню або радикал, вибраний з (а-1), (а-2), (а-3), (а-4) або (а-5); та кожний R2 незалежно вибрано з атома водню, атома галогену або С1-6алкілу. 3. Сполука за п. 1 або 2, яка відрізняється тим, що кожний X позначає N кожний Y позначає CH ; ; L1 позначає прямий зв'язок; L2 позначає прямий зв'язок; R1 позначає атом водню та Z позначає атом водню. 4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що являє собою сполуку № 1 N NH Сполука № 1. O 5. Сполука за будь-яким з пп. 1-4 для застосування як лікарського засобу. 6. Фармацевтична композиція, яка містить фармацевтично прийнятні носії та терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4 як активний інгредієнт. 7. Спосіб отримання фармацевтичної композиції за п. 6, який відрізняється тим, що ретельно перемішують фармацевтично прийнятні носії та сполуку за будь-яким з пп. 1-4. 8. Застосування сполуки для виготовлення лікарського засобу для лікування захворювання, опосередкованого PARP, де зазначена сполука являє собою сполуку формули (І) CH , тоді Y позначає ; N кожний Y незалежно позначає або N ; CH за винятком випадку, коли X позначає тоді Y позначає N CH , ; 1 L позначає прямий зв'язок або двовалентний радикал, вибраний із -С1-6алкандіїлу-, L2 позначає прямий зв'язок або двовалентний радикал, вибраний із карбонілу, -С1-6алкандіїлу-, (гідроксі)С1-6алкандіїлу-, -С(О)-С1-6алкандіїлу-або С1-6алкандіїл-С(О)-; R1 позначає атом водню або гідроксильну групу; Z позначає атом водню або радикал, вибраний із R2 R2 O HN N O O HN ; та CH O O NH N NH R2 (a-4) (a-3) (a-5) , (a-1) (a-2) де кожний R2 незалежно вибрано з атома водню, атома галогену або С1-6алкілу. 9. Застосування за п. 8 інгібітора PARP формули (І) для виготовлення лікарського засобу для лікування захворювання, опосередкованого PARP-1. 10. Застосування за п. 8 або 9, яке відрізняється тим, що лікування включає хемосенсибілізацію. 11. Застосування за п. 8 або 9, яке відрізняється тим, що лікування включає радіосенсибілізацію. 12. Комбінація сполуки разом із хіміотерапевтичним засобом, яка відрізняється тим, що зазначена сполука являє собою сполуку формули (І) 5 88012 6 L1 позначає прямий зв'язок або двовалентний раR1 дикал, вибраний із -С1-6алкандіїлу-, O L2 позначає прямий зв'язок або двовалентний ра2 L X Z Y L1 (І) дикал, вибраний із карбонілу, -С1-6алкандіїлу-, HN NH (гідроксі)С1-6алкандіїлу-, -С(О)-С1-6алкандіїлу-або С1-6алкандіїл-С(О)-; O , R1 позначає атом водню або гідроксильну групу; її N-оксидні форми, фармацевтично прийнятні Z позначає атом водню або радикал, вибраний із адитивні солі та стереохімічно ізомерні форми, де R2 кожний X незавлежно позначає HN CH ; CH CH , тоді Y позначає ; кожний O N Y незалежно позначає або NH O N R2 R2 (a-4) (a-3) (a-5) (a-1) (a-2) , де кожний R2 незалежно вибрано із атома водню, атома галогену або С1-6алкілу. 13. Спосіб отримання сполуки формули (І), в якому здійснюють a) взаємодію проміжної сполуки формули (II) із проміжною сполукою формули (III), де W позначає придатну кінцеву групу, з утворенням сполуки фо рмули (1-а), де X позначає ; NH N O та, коли X позначає N R2 O або N , в інертному N розчиннику та при додаванні придатної основи за винятком випадку, коли X позначає тоді Y позначає N , CH ; R1 R1 O Z L2 W + HN Y L1 HN NH O Z L2 X Y O (III) (II) (I-a) L1 HN NH O ; b) взаємодію проміжної сполуки формули (IV) із проміжною сполукою формули (V), де W позначає придатну кінцеву групу, з утворенням сполуки фо рмули (І-b), де Y позначає Даний винахід відноситься до інгібіторів PARP та представляє сполуки та композиції, що містять описані сполуки. Більш того, даний винахід відноситься до застосування описаних інгібіторів PARP, наприклад, як лікарський засіб. Ядерний фермент полі(Адфрибоза)полімераза-1 (PARP-1) є членом сімейства ферментів PARP. Зазначене сімейство ферментів, що збільшується, складається з PARP таких як, наприклад: PARP-1 PARP-2, PARP-3 таVaultPARP; та танкираз (TANK), таких як, наприклад: TANK-1, TANK-2 та TANK-3. PARP також називають полі(аденозин-5'дифосфорибоза)полімеразою або PARS (полі(Адф-рибоза) синтетазою). Танкирази (TANK) були ідентифіковані як компоненти тіломерного комплексу людини. Також передбачалося, що вони беруть участь у везикулярному транспорті та можуть служити як каркас для білків, залучених у безлічі інших клітинних процесів. Тіломери, які необхідні для підтримки цілісності та стабільності хромосом, підтримуються за допомогою тіломерази, спеціалізованої зворотної транскриптази. TANK являють собою (Адфрибоза)трансферазу з деякими властивостями як сигнальних білків, так й білків цитоскелету. Вони містять домен PARP, що каталізує поліадфрибозилювання субстратных білків, альфа-мотив стерильності, що належить певним сигнальним молекулам, та домен ANK, що містить 24 анкіринових повторів, гомологічних білку цитоскелета анкірину Домен ANK взаємодіє з тіломерним білком, що зв'язує тіломерні повтори фактором-1 (TRF-1). Таким чином, зазначені білки називають N , в інертному розчиннику та при додаванні придатної основи. 7 88012 8 взаємодіючими з TRF1, анкірин-з'вязаними поліПолі(Адф-рибози) синтаза також залучена до меразами Адф-рибози (TANK) індукованої експресії ряду генів, необхідних для Однієї з більш конкретних функцій TANK є запального відклику. Інгібітори PARP придушують Адф-рибозилювання в TRF-1 Для здійснення фунпродукцію індуцибельної синтетази оксиду азоту кції тіломер у людини необхідно два специфічних (iNOS) у макрофагах, селектина Р-типу та молекудля тіломер Днк-єднального білка, TRF-1 та TRFли міжклітинної адгезії-1 (ІСАМ-1) в ендотеліаль2. TRF-2 захищає кінці хромосом, та TRF-1 регуних клітинах. Така активність лежить в основі силює довжину тіломери. Рибозилювання АДФ прильних протизапальних ефектів, які проявляються водить до інгібування здатності TRF-1 зв'язуватися інгібіторами PARP. Інгібування PARP може привез тіломерною ДНК. Це рибозилювання полі-адф в сти до зменшення некрозу за допомогою запобіTRF-1 приводить до від'єднання TRF-1 від тілогання транспорту та інфільтрації нейтрофілів в мер, відкриваючи тіломерний комплекс та ствоушкоджені тканини. рюючи можливість доступу для тіломерази. Таким PARP активується ушкодженими фрагментами чином, TANK функціонує як позитивний регулятор ДНК та після активації каталізує приєднання аж до довжини тіломери, створюючи можливість для 100 залишків АДФ-рибози до безлічі ядерних білелонгації тіломер тіломеразою. ків, включаючи гістони та саму PARP. При значних PARP-1 є основним ядерним білком з масою стресових впливах на клітини надмірна активація 116кДа, що складається із трьох доменів NPARP може швидко привести до ушкодження та кінцевого Днк-єднального домену, що містить два загибелі клітин внаслідок виснаження запасів енецинкових пальці, домен аутомодифікації та Сргії. Тому що на відновлення кожної молекули кінцевої каталітичний домен. Він представлений NAD+ витрачається чотири молекули АТФ, та мапрактично у всіх еукаріот. Фермент здійснює синсова активація PARP приводить до виснаження тез полі(АДФ-рибози), розгалуженого полімеру, що запасів NAD+, то при спробах ресинтезувати NAD+, складається з більш ніж 200 залишків АДФ-рибози. запаси АТФ також виснажуються. Білкові акцептори полі(АДФ-рибози) безпосередПовідомлялося, що активація PARP відіграє ньо або побічно залучені в підтримку цілісності ключову роль у нейротоксичності, яка індукується ДНК. Вони включають гистони, топоізомерази, ДНК як NMDA, так й NO. Це було показано на кортиката РНК полімерази, ДНК-лігази та Са2+- та Мg2+льній культурі та на зрізах гіпокампу, де запобіганзалежні ендонуклеази. Білок PARP експресується ня токсичності прямо корелює зі здатністю інгібуна високому рівні в багатьох тканинах, особливо в вати PARP. Можлива роль інгібіторів PARP для клітинах імунної системи, серця, головного мозку лікування нейродегенеративних захворювань та та у клітинах зародкової лінії. У нормальних фізіотравми голови, таким чином, була встановлена логічних умовах активність PARP мінімальна. Однавіть при відсутності пояснення їхнього механізму нак ушкодження ДНК приводить до негайного піддії. вищення активації PARP більш ніж у 500 разів. Аналогічно було показано, що разові ін'єкції інСеред безлічі функцій, які приписують PARP гібіторів PARP приводили до зниження розміру та особливо PARP-1, його головна роль складаобласті інфаркту внаслідок ішемії та реперфузії у ється в полегшенні репарації ДНК за допомогою серці або в кістяковому м'язі у кроликів. У цих дорибозилювання АДФ та, таким чином, координуслідженнях однократна ін'єкція 3-амінобензаміду вання ряду білків репарації ДНК. У результаті ак(10мг/кг) або за одну хвилину до оклюзії, або за тивації PARP, рівні NAD+ значно знижуються. одну хвилину до реперфузії, приводила до подібНадмірна активація PARP приводить до важкого ного зниження розміру області інфаркту у серці виснаження запасів NAD+ у клітинах, у яких відбу(32-42%), а 1,5-дигідроксиізохінолін (1мг/кг), ще лося велике ушкодження ДНК. Короткий час напіводин інгібітор PARP, викликав зниження розміру розпаду полі(АДФ-рибози) приводить до великої області інфаркту на порівнянному рівні (38-48%). швидкості кругообігу. Після утворення полі(АДФЦі результати роблять доцільним припущення про рибози), вона швидко деградується конститутивно те, що інгібітори PARP можуть відновлювати попеактивною полі(АДФ-рибоза)глікогідролазою редньо ішемізоване серце або кістякову м'язову (PARG) разом з фосфодіестеразою та (АДФтканину після реперфузійного ушкодження. рибоза)ліазою білка. PARP та PARG утворюють Активацію PARP також можна використовувацикл, що перетворює велику кількість NAD+ в АДФти як показник ушкодження після нейротоксичних рибозу Менш ніж за одну годину надлишкова стиушкоджень внаслідок впливу кожного з наведених муляція PARP може привести до падіння рівня нижче індукторів, таких як глутамат (через стимуNAD+ та АТФ до менш ніж 20% від нормального ляцію рецепторів NMDA), реакційно-здатні промірівня. Такий сценарій є особливо небезпечним при жні сполуки кисню, b-амілоїдний білок, N-метил-4ішемії, коли недолік кисню вже істотно порушив фенiл-1,2,3,6-тетрагідропіридин (МРТР) або його вироблення енергії. Наступна продукція вільних активний метаболіт N-метил-4-фенілпіридин радикалів у процесі реперфузії, як думають, є ос(МРР+), що бере участь у розвитку патологічних новною причиною ушкодження в тканинах. Часткостанів, таких як інсульт, хвороба Альцгеймера та во зниження рівня АТФ, що є типовим для безлічі хвороба Паркінсона. В інших дослідженнях було органів у процесі ішемії та реперфузії, може бути продовжене дослідження ролі активації PARP на пов'язане з виснаженням NAD+ внаслідок кругообізернистих клітинах мозочка in vitro та у нейротокгу полі(АДФ-рибози). Таким чином, очікується, що сичності з МРТР. Надмірний вплив на нейрони інгібування PARP або PARG буде зберігати рівень глутамату, що виконує роль переважного нейротенергії клітини, тим самим, збільшуючи виживарансмітера центральної нервової системи та діє ність ішемізованих тканин після ушкодження. через рецептори N-метил-D-аспартату (NMDA) та 9 88012 10 інші підтипи рецепторів, часто відбувається як репри якому відбувається транссинаптична зміна зультат інсульту або іншого нейродегенеративного дорзального рогу спинного мозку, що характеризупроцесу. Позбавлені кисню нейрони в більших ється гіперхроматозом цитоплазми та нуклеоплакількостях вивільняють глутамат у процесі ішемічзми (так називані "темні" нейрони) ного ушкодження головного мозку, такого як інТакож існують докази того, що інгібітори PARP сульт, або після інфаркту міокарда. корисні для лікування запальних порушень кишечЦе надлишкове вивільнення глутамату у свою нику, таких як коліти. Конкретно, коліти викликали чергу викликає надлишкову стимуляцію (ексайтов пацюків за допомогою введення в просвіт гаптетоксичність) рецепторів N-метил-D-аспартату ну тринітробензолсульфонової кислоти в 50% ета(NMDA), AMPA, Kainate та MGR, що приводить до нолі. Після введення пацюкам вводили 3відкриття іонних каналів та забезпечують неконтамінобензамід, специфічний інгібітор активності рольований потік іонів (наприклад, Са2+ й Na+ у PARP. Інгібування активності PARP приводило до клітини та K+ із клітин), що приводить до надмірної зниження запальної відповіді та відновленню стимуляції нейронів. Нейрони при надмірній стиморфології та активності дистального кишечнику. муляції секретують більшу кількість глутамату, Крім того, докази дозволяють припустити, що створюючи ланцюг зі зворотним зв'язком або інгібітори PARP корисні для лікування артриту. ефект "доміно", що, в остаточному підсумку, приКрім того, інгібітори PARP, очевидно, корисні для водить до ушкодження клітини або смерті внаслілікування діабету. Було показано, що інгібітори док продукції протеаз, ліпаз та вільних радикалів. PARP корисні для лікування ендотоксичного шоку Надмірна активація рецепторів глутамату залучеабо септичного шоку. на в різні неврологічні захворювання та стани, Інгібітори PARP також використовуються для включаючи епілепсію, інсульт, хворобу Альцгейзбільшення строку життя та проліферативної здамера, хворобу Паркінсона, бічний аміотрофичний тності клітин, включаючи лікування захворювань, склероз (ALS), хворобу Гентингтона, шізофренію, таких як старіння шкіри, хвороба Альцгеймера, хронічний біль, ішемію та втрату нейронів після атеросклероз, остеоартрит, остеопороз, м'язова гіпоксії, гіпоглікемії, ішемії, травми та ушкодження дистрофія, дегенеративні захворювання кістякової нерва. Вплив глутамату та стимуляція глутаматом мускулатури, що включають реплікативні вікові також беруть участь у якості основи в компульсивзміни, пов'язану з віком м'язову дегенерацію, вікові них порушеннях, зокрема, залежно від лікарських зміни імунної системи, СНІД та інші захворювання засобів. Доказу того, що антагоністи рецепторів імунної системи, зв'язані зі старінням; та для зміни глутамату (тобто, сполуки, які блокують зв'язуванекспресії генів у старіючих клітинах. ня глутамату або активацію глутаматом його реТакож відомо, що інгібітори PARP, такі як 3цепторів) блокують ушкодження нейронів після амінобензамід, діють на репарацію ДНК у цілому, судинного інсульту, включають результати дослінаприклад, у відповідь на вплив пероксиду водню джень на тваринах багатьох видів, а також на цеабо іонізуючої радіації. ребральній кортикальній культурі, обробленої глуКлючова роль PARP у репарації розривів лантаматом або NMDA. При спробах запобігти цюгів ДНК твердо встановлена, особливо, при реексайтотоксичності блокуванням рецепторів парації, викликаної безпосередньо іонізуючою раNMDA, АМРА, Kainate та MGR зіштовхнулися зі діацією або побічно після ферментативної складностями внаслідок того, що кожний рецептор репарації ушкоджень ДНК, викликаних метилююмає безліч ділянок, з якими може зв'язуватися глучими агентами, інгібіторами топоізомерази І та тамат та, таким чином, пошук ефективного сполуіншими хемотерапевтичними засобами, такими як чення антагоністів або універсального антагоніста цисплатин та блеоміцин. Безліч досліджень із видля запобігання зв'язування глутамату з усіма рекористанням "нокауту" мишей, моделей із трансцепторами та для того, щоб отримати можливість домінантним інгібуванням (сверхекспресія Днкдослідження цієї теорії, є утрудненим. Більш того, єднального домену), антизначеннєвих та низькобезліч композицій, які є ефективними відносно молекулярних інгібіторів показало роль PARP у блокування рецепторів, також є токсичними для репарації та виживанні клітин після індукції ушкотварин. Власне кажучи, у цей час не існує відомого дження ДНК. Інгібування ферментативної активноефективного способу лікування аномалій, пов'язасті PARP повинне привести до посилення чутлиних із глутаматом. вості клітин пухлини до способів лікування з Стимуляція глутаматом рецепторів NMDA, наушкодженням ДНК. приклад, приводить до активації ферменту, нейПовідомлялося, що інгібітори PARP ефективні рональної синтетази оксиду азоту (nNOS), що прив радіосенсибилізації (гипоксичних) клітин пухлини водить до утворення оксиду азоту (NO), що також та ефективні в запобіганні відновлення клітин пухбере участь у нейротоксичності. Нейротоксичності, лини при потенційно летальному та сублетальнопов'язаної з NMDA, можна запобігти введенням му ушкодженні ДНК після променевої терапії, очеінгібіторів синтетази оксиду азоту (NOS) або за видно, внаслідок їхньої здатності запобігати допомогою спрямованого генетичного ушкодження возз'єднанню розривів ДНК та внаслідок їхнього nNOS in vitro. впливу на ряд сигнальних шляхів, зв'язаних ушкоІнше використання інгібіторів PARP являє содженням ДНК. бою лікування ушкоджень периферичних нервів та Інгібітори PARP використовуються для лікусиндрому, що є їхнім наслідком, патологічного бовання злоякісної пухлини. Крім того, у патенті США лю, відомого як невропатичний біль, такого як біль, No.5177075 описані невелика кількість ізохіолінів, викликаний ушкодженням внаслідок тривалого які використовуються для посилення летальних здавлювання (ССІ) загального сідничного нерва та ефектів іонізуючої радіації або хемотерапевтичних 11 88012 12 засобів на клітини злоякісної пухлини. Weltin et al. в "Effect of 6(5-Phenanthridmone), an Inhibitor of Poly(ADP-ribose) Polymerase, on Cultured Tumor Cells", Oncol. Res., 6:9, 399-403 (1994), описують інгібування активності PARP, зниження проліферації пухлинних клітин та виражений синергічний ефект при додатковому введенні в пухлинні клітини алкілюючого лікарського засобу. Огляди рівня техніки опубліковані Li та Zhang в IDrugs 2001, 4(7): 804-812, Аmе et al. в Bioassays 2004, 26: 882-883 та Nguewa et al. в Progress in Biophysic & Molecular Biology 2005, 88: 143-172. Зберігається потреба в ефективних та потужних інгібіторах PARP та, більш конкретно, інгібіторах PARP-1, які викликають мінімальні побічні дії. Даний винахід відноситься до сполук, композицій для інгібування активності PARP та способів інгібування активності PARP для лікування злоякісної пухлини та/або профілактики ушкодження клітин, тканин та/або органа або загибелі внаслідок, наприклад, некрозу або апоптозу. Сполука та композиції за даним винаходом корисні, особливо, для посилення ефективності хемотерапії та променевої терапії, де основний ефект лікування являє собою ефект внаслідок ушкодження ДНК у клітинах-мішенях. Патент ЕР 2036073, який опубліковано 17 червня 1999, розкриває заміщені похідні хіназолідіону. Зазначені сполуки мають фундальні релаксуючі властивості. Зокрема, розкривається сполука 1-[1[(2S)-2-[(2R)-3,4-дигідро-2H-1-бензопіран-2-іл]-2гідроксиетил]-4-піперидиніл]-2,4(1Н,3H)Даний винахід відноситься до сполук формули хіназоліндіон (сполука №9 у даному описі). (І) Патент ЕР 13612, який опубліковано 11 листопада 1983, розкриває заміщені похідні сполуки піперидинілкілхіназоліну. Сполуки, які описуються, являють собою антагоністи серотоніну. Зокрема, розкриваються сполуки 1-[2-4-[(4-фторбензоїл)-1піперидиніл]етил]-2,4-(1Н,3H)-хіназоліндіон (сполука №10 у даному описі), 1-[3-[4-(4-фторбензоїл)-1піперидиніл]пропіл]-2,4-(1Н,3H)-хіназоліндіон (сполука №11 у даному описі), 3-[2-[4-(4-хлорбензоїл)1-піперидиніл]етил]-2,4-(1Н,3H)-хіназоліндіон (сполука №12 у даному описі), 3-[2-[4-(4фторфеніл)гідроксиметил]-1-піперидиніл]етил]-2,4(1Н,3H)-хіназоліндіон (сполука №13 у даному описі). їхніх форм N-оксидів, фармацевтично прийнятних адитивних солей та стереохімічно ізомерних форм, де кожний X незалежно позначає ; та, коли X позначає або , то Υ позначає ; кожний Υ незалежно позначає ; за винятком випадку, коли X позначає або , ; та тоді Υ позначає L1 являє собою прямий зв'язок або двовалентний радикал, обраний з -С1-6алкандіїлу-; L2 являє собою прямий зв'язок або двовалентний радикал, обраний з карбонілу, -С1-6алкандіїлу, -(гідрокси)С1-6алкандіїлу-, -С(О)-С1-6алкандіїлуабо - С1-6алкандіїл-С(О)-; R1 являє собою атом водню або гідроксильну групу; Ζ являє собою атом водню або радикал, обраний з групи, що складається з 13 88012 14 як 2-метилпентандіїл, 3-метилпентандіїл, 2,2диметилбутандіїл, 2,3-диметилбутандіїл та інші їм подібні. Під терміном "фармацевтично прийнятні солі" мають на увазі фармацевтично прийнятні кислотно- або основно-адитивні солі. Під фармацевтично прийнятними кислотно- або основно-адитивними солями, як зазначено вище, мають на увазі, що вони включають терапевтично активні нетоксичні форми кислотно-адитивної солі та нетоксичні форми основно-адитивної солі, які сполуки формули (І) здатні утворювати. Сполуки формули (І), які мають властивості основ, можуть бути перетворені в їх фармацевтично прийнятні кислотно-адитивні солі за допомогою обробки зазначеної основної форми відповідною кислотою. Придатні кислоти де кожний R2 незалежно обрано з атома водвключають, наприклад, неорганічні кислоти, такі як ню, атома галогену або С1-6алкілу, за умови, що галогенводневі кислоти, наприклад, хлористоводвиключаються сполуки 1-[1-[(2S)-2-[(2R)-3,4нева кислота або бромисто-воднева кислота; сірдигідро-2Н-1-бензопіран-2-іл]-2-гідроксиетил]-4чана кислота; азотна кислота, фосфорна кислота пфперидинфл]-2,4(1Н,3H)-хіназоліндіон, 1-[2-4-[(4та інші кислоти; або органічні кислоти, такі як, нафторбензоіл)-1-піперидиніл]етил]-2,4-(1Н,3H)приклад, оцтова, пропіонова кислота, гідрооцтова хіназоліндіон, 1-[3-[4-(4-фторбензоіл)-1кислота, молочна кислота, піровиноградна кислопіперидиніл]пропіл]-2,4-(1Н,3H)-хіназоліндіон, 3-[2та, щавлева кислота, малонова кислота, буршти[4-(4-хлорбензоіл)-1-піперидиніл]етил]-2,4-(1Н,3H)нова кислота (тобто бутандіонова кислота), малеїхіназоліндіон та 3-[2-[4-(4нова кислота, фумарова кислота, яблучна фторфеніл)гідроксиметил]-1-піперидиніл]етил]-2,4кислота, виннокаменна кислота, лимонна кислота, (1Н,3H)-хіназоліндіон. метансульфонова кислота, етансульфонова кисУ тому випадку, коли Ζ являє собою гетероцилота, бензолсульфонова кислота, пклічну кільцеву систему, яка включає фрагмент толуолсульфонова кислота, цикламова кислота, 2 СН2-, -СН= або -ΝΗ-, то замісник R та/або частина саліцилова кислота, п-аміносалицилова кислота, молекули, що залишилася, можуть бути приєднані памова кислота та інші їм подібні кислоти. до цього атому вуглецю/або атому азоту, та у цьоСполуки формули (І) з кислотними властивосму випадку заміщені один або обидва атоми водтями можна перетворювати в їхні фармацевтично ню. прийнятні основно-адитивні солі за допомогою В сполуках формули (І) хіназоліндіоновий обробки зазначеної кислотної форми відповідною фрагмент може бути приєднаним до частини моорганічною або неорганічною основою. Придатні лекули, що залишилася, по -NH-фрагментам у 1форми основних солей включають, наприклад, му або 3-му положенні, та у цьому випадку він засолі амонію, солі лужних та лужноземельних меміщує атом водню. талів, наприклад, солі літію, натрію, калію, магнію, Сполуки формули (І) можуть також існувати в кальцію та ініш їм подібні, солі з органічними осноїхніх таутамерних формах. Мається на увазі, що вами, наприклад, солі бензатину, N-метил-Dтакі форми, хоча й не явно показані в наведеній глюкаміну, гідрабаміну та солі з амінокислотами, вище формулі, входять до обсягу даного винахотакими як. наприклад, аргінін, лізин та інші їм подіду. бні. На ряд термінів, які використовуються у зазнаТерміни "кислотна" або "основна адитивна чених вище визначеннях та надалі, роз'яснення сіль" також включають гідрати та адитивні сольванаводяться нижче. Ці терміни іноді використовутні форми, які сполуки формули (І) здатні утворюються самі по собі або в складних термінах. вати. Прикладами таких форм є, наприклад, гідраЯк використовується в зазначених вище вити, алкоголяти та інші їм подібні. значеннях та надалі, галоген є загальною назвою Термін "стереохімічно ізомерні форми сполук для фтору, хлору, брому та йоду; тригалогенметил формули (І)", який використовується в даному відноситься до метилу, що містить три однакових описі, відноситься до всіх можливих сполук, що або різних замісники галогену, наприклад, трискладаються із тих самих атомів, зв'язаних однієї й фторметил; С1-6алкіл відноситься до нерозгалужетією же послідовністю зв'язків, але із тривимірними них та розгалужених насичених вуглеводневих структурами, що відрізняються, що не є рівнозначрадикалів з кількістю атомів вуглецю від 1 до 6, ними, які сполуки формули (І) можуть мати. Якщо таким як, наприклад, метил, етил, пропіл, бутил, не згадано або не зазначене інше, хімічне познапентил, гексил, 1-метилетил, 2-метилпропіл, 2чення сполуки включає суміш всіх можливих стеметилбутил, 2-метилпентил та подібні; -С1реохімічних ізомерних форм, які зазначена сполу6алкандіїл- відноситься до двовалентних нерозгака може мати. Зазначена суміш може містити всі лужених та розгалужених насичених вуглеводнедіастереомери та/або енантіомери базової молевих радикалів з кількістю атомів вуглецю від 1 до кулярної структури зазначеної сполуки. Мається 6, таким як, наприклад, метилен, 1,2-етандіїл, 1,3на увазі, що всі стереохімічно ізомерні форми спопропандіїл, 1,4-бутандіїл, 1,5-пентандіїл, 1,6лук формули (і) як у чистій формі, так й у суміші гександіїл та їхнім розгалуженим ізомерам, таким одна з іншою, входять до обсягу даного винаходу. 15 88012 16 Під формами N-оксидів сполук формули (І) мають на увазі, що вони включають сполуки форa) кожний X позначає ; мули (І), де один або кілька атомів азоту окислені до так званих N-оксидів, зокрема, до N-оксидів, у b) кожний Υ позначає ; яких один або кілька атомів азоту піперидину або c) L1 позначає прямий зв'язок; піперазину N-оксидовані. d) L2 позначає прямий зв'язок; Під терміном "сполука формули (І)", який виe) R1 позначає атом водню; користовується у даному описі, мають на увазі, що f) Z позначає атом водню. він також включає форми N-оксидів, фармацевтиГрупа переважних сполук складається з таких чно прийнятні кислотно- або основно-адитивні солі сполук формули (І), де кожний X незалежно позната всі стереоізомерні форми. Сполуки, наведені у ЕР 1036073, мають фунчає або ; кожний Υ незалежно позначає дальні релаксуючі властивості 1-[1-[(2S)-2-[(2R)3,4-дигідро-2H-1-бензопіран-2-ил]-2-гідроксиетил]або ; L1 позначає прямий зв'язок або 4-піперидиніл]-2,4(1Н,3H)-хіназоліндіон (сполука двовалентний радикал, обраний з -С1-6алкандіїлу-, №9 в даному описі) розкрито у ЕР 1036073. СпоL2 позначає прямий зв'язок або двовалентний ралуки, наведені у ЕР 13612, являють собою антагодикал, обраний з -С1-6алкандіїлу; R1 позначає атом нисти серотоніну Розкриті сполуки 1-[2-[4-(4водню або гідроксильну групу; фторбензоїл)-1-піперидиніл]етил]-2,4-(1Н,3H)Ζ позначає атом водню або радикал, обраний хіназоліндіон (сполука №10 в даному описі), 1-[3з (а-1), (а-2), (а-3), (а-4) або (а-5); та кожний R2 [4-(4-фторбензоїл)-1-піперидиніл]пропіл]-2,4незалежно обрано з атома водню, атома галогену (1Н,3H)-хіназоліндіон (сполука №11 в даному опиабо С1-6алкілу. сі), 3-[2-[4-(4-хлорбензоіл)-1-піперидиніл]етил]-2,4Група більш переважних сполук складається з (1Н,3H)-хіназоліндіон (сполука №12 в даному опитаких сполук формули (І), де кожний X позначає сі), 3-[2-[4-(4-фторфеніл)гідроксиметил]-1піперидиніл]етил]-2,4-(1Н,3H)-хіназоліндіон (сполу; кожний Υ позначає ; L1 позначає пряка №13 в даному описі). мий зв'язок; L2 позначає прямий зв'язок; R1 познаЗненацька було виявлено, що сполуки за дачає атом водню; та Ζ позначає атом водню. ним винаходом проявляють інгібуючу активність Найбільш переважною сполукою є сполука по відношенню до PARP. №1. Перша група з розглянутих сполук складається з таких сполук формули (І), де накладають одне або декілька наведених нижче обмежень: a) кожний X незалежно позначає або , b) кожний Υ незалежно позначає або ; c) L1 являє собою прямий зв'язок або двохвалентний радикал, обраний з -С1-6алкандіїлу-; d) L2 являє собою прямий зв'язок або двохвалентний радикал, обраний з карбонілу, -С1-С1-6алкандиила-, -(гідрокси)С16алкандіїлу-, 6алкандіїлу- або -С(О)-С1-6алкандіїлу-; e) R1 позначає атом водню або гідроксильну групу, f) Z позначає атом водню або радикал, обраний з (а-1), (а-2), (а-3), (а-4) або (а-5); g) кожний R2 незалежно обрано з атома водню, атома галогену або С1-6алкілу. Другу групу сполук, що представляють інтерес, складають такі сполуки формулы (І), до яких може бути застосовано одне або декілька з наступних обмежень: a) L2 позначає прямий зв'язок або двовалентний радикал, обраний з -С1-6алкандіїлу- або -С(О)С1-6алкандіїлу-; b) Z позначає атом водню або радикал, обраний з (а-1), (а-4) або (а-5). Третю групу сполук, що представляють інтерес, складають такі сполуки формули (І), до яких може бути застосовано одне або декілька з наступних обмежень: Сполуки формули (І) можуть бути отримані у відповідності зі способами, що носять загальний характер, описаними в ЕР 1036073 та ЕР 13612. Вихідні речовини та деякі з похідних являють собою відомі сполуки та є комерційно доступними або можуть бути отримані відповідно до загальноприйнятих способів проведення реакцій, що є широко відомими у даній галузі. Деякі способи одержання будуть описані у цьому опису далі більш докладно. Інші способи одержання цільових сполук формули (І) описані в прикладах. Сполуки формули (І), де X позначає , які в описі даного винаходу відносяться до сполук формули (1-а), можуть бути отримані за допомогою взаємодії проміжної сполуки формули (II) з проміжною сполукою формули (III), де W позначає придатну кінцеву групу, таку як, наприклад, атом галогену, зокрема, атом фтору, хлору, брому або йоду, або сульфонілокси-радикал, такий як метилсульфонілокси група, 4-метилфенілсульфонілокси група та інші їм подібні. Реакцію можна проводити в інертному для даної реакції розчиннику, такому як, наприклад, спирт, зокрема, метанол, етанол, 2метоксиетанол, пропанол, бутанол та інші їм подібні, простий ефір, зокрема, 4,4-діоксан, 1,1' 17 88012 18 оксибіспропан та інші їм подібні.; або кетон, зокнатрію. Для прискорення реакції може бути додана рема, 4-метил-2-пентанон, Ν,Ν-диметилформамід, невелика кількість відповідного йодиду металу, нітробензол та інші їм подібні. Для зв'язування зокрема, йодид натрію або калію. Швидкість реаккислоти, яка виділяється під час проведення реакції можна прискорити за допомогою перемішуванції, можна використовувати додавання придатної ня. Реакцію звичайно можна проводити в інтервалі основи, такої як, наприклад, карбонат або гідрокавід кімнатної температури та до температури кирбонат лужного або лужноземельного металу, піння реакційної суміші та, якщо це необхідно, резокрема, додавання триетиламіну або карбонату акцію можна проводити при підвищеному тиску Аналогічно сполуки формули (І), де Υ позначає , які у даному описі відносяться до сполук формули (І-b), можуть бути отримані за допомогою Сполуки формули (І) також можуть бути перетворені одна в одну за допомогою відомих в даній галузі реакцій або трансформацій функціональних груп. Деякі з таких трансформацій уже описані вище. Інші приклади являє собою гідроліз складних ефірів карбонових кислот до відповідних карбонових кислот або спиртів; гідроліз амідів до відповідних карбонових кислот або амінів; гідроліз нітрилів до відповідних амідів; аміногрупи імідазолу або фенілу можуть бути замінені воднем відомими в даній галузі реакціями діазотування та наступною заміною діазогруп воднем; спирти можуть бути перетворені в складні та прості ефіри; первинні аміни можуть бути перетворені у вторинні або третинні аміни; подвійні зв'язки можуть бути гідрогенізовані до відповідного одинарної зв'язку, радикал йоду на фенільній групі може бути перетворений у складноефірну групу вставкою монооксиду вуглецю в присутності придатного паладієвого каталізатора. Даний винахід також відноситься до сполук формули (І), як визначено вище, для застосування як лікарський засіб Як можна бачити з експериментальної частини, яку наведено нижче, сполуки за даним винаходом мають властивості інгібування PARP. Термін "PARP" використовується в даному описі для позначення білка з активністю у відношенні поліАДФ-рибозилювання. В обсязі значення цього терміна, PARP включає все білки, які кодуються геном рагр, їхні мутантні форми та їхні білки, отримані в результаті альтернативного сплайсингу. Крім того, як використовується у описі даного винаходу, термін "PARP" включає аналоги PARP, гомологи та аналоги інших тварин. взаємодії проміжної сполуки формули (IV) з проміжною сполукою формули (V), де визначення W вказано раніше. Термін "PARP", включає, але не обмежується тільки ними, PARP-1. В обсяг значення цього терміна можуть бути включені PARP-2, PARP-3, VaultPARP (PARP-4), PARP-7 (TiPARP), PARP-8, PARP9 (Bal), PARP-10, PARP-11, PARP-12, PARP-13, PARP-14, PARP-15, PARP-16, TANK-1, TANK-2 та TANK-3. Сполуки, які інгібують PARP-1 та танкиразу-2 можуть мати кращі властивості в тім відношенні, що вони мають посилену активність стосовно інгібування росту злоякісних клітин. Даний винахід також включає застосування сполук для одержання лікарського засобу для лікування будь-якого захворювання та порушення у описаних тут тварин, де зазначені сполуки являють собою сполуки формули (І) їхні N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де кожний X незалежно позначає та коли X позначає , то Υ позначає жний Υ незалежно позначає винятком випадку, коли X позначає позначає ; або ; ; ко або ; за , та тоді Υ 19 88012 20 L1 позначає прямий зв'язок або двовалентний R1 позначає атом водню або гідроксильну грурадикал, обраний з -С1-6алкандіїлу-, пу, L2 позначає прямий зв'язок або двовалентний Ζ позначає атом водню або радикал, обраний радикал, обраний з карбонілу, -С1-6алкандіїлу-, з (гідрокси)С1-6алкандіїлу-, -С(О)-С1-6алкандіїлу- або -С1-6алкандіїл-С(О)-; де кожний R2 незалежно обрано з атома водню, атома галогену або С1-6алкілу. З погляду властивостей відносно зв'язування PARP сполуки за даним винаходом можуть використовуватися як контрольні сполуки або сполуки, що містять ізотопний індикатор, у випадку яких один з атомів молекули може бути замінений, наприклад, радіоактивним ізотопом. Для одержання фармацевтичних композицій за даним винаходом ефективну кількість конкретної сполуки у формі кислотної або основної адитивної солі як активний інгредієнт комбінують в однорідну суміш із фармацевтично прийнятним носієм, що може приймати широку розмаїтість форм залежно від бажаної форми препарату для введення. Бажано, щоб ці фармацевтичні композиції перебували в одиничних дозованих формах, переважно придатних для перорального, ректального, підшкірного введення або парентеральної ін'єкції. Наприклад, при одержанні композицій у вигляді пероральної дозованої форми, можуть використовуватися будь-які зі звичайних фармацевтичних середовищ, таких як, наприклад, вода, гліколі, масла, спирти та інші їм подібні, у випадку пероральних рідких препаратів, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, цукри, каолін, речовини, що змащують, зв'язувальні речовини, дезінтегруючі агенти та інші їм подібні, у випадку порошків, пігулок, капсул та таблеток. Внаслідок простоти введення, таблетки та капсули являють собою найбільш кращі пероральні одиничні дозовані форми, у випадку яких звичайно використовують тверді фармацевтичні носії. У випадку композицій для парентерального введення носій звичайно містить стерильну воду, принаймні в більшості випадків, хоча для забезпечення розчинності до складу можуть бути включені інші інгредієнти. Наприклад, можуть бути отримані розчини для ін'єкцій, у яких носій містить фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину та розчину глюкози. Також можуть бути отримані суспензії для ін'єкцій, у випадку яких можуть використовуватися придатні рідкі носії, суспендуючі агенти та інші їм подібні. У композиціях, придатних для підшкірного введення, носій необов'язково містить агент, що збільшує проникність, та/або придатний зволожуючий агент, необов'язково комбінований з придатними добавками будь-якої природи в невеликих кількостях, при цьому добавки не приводять до значних шкідливих впливів на шкіру. Зазначені добавки можуть полегшувати введення через шкіру та/або можуть бути корисними для одержання бажаних композицій. Ці композиції можуть бути введені різними способами, наприклад, у вигляді трансдермального пластиру, у вигляді крапель, у вигляді мазі. Особливо кращим є виготовлення вищевказаних фармацевтичних композицій в одиничних дозованих формах для простоти введення та однаковості дозування. Одиничні дозовані форми, як це використовується в описі та формулі даного винаходу, відносяться до фізично дискретних одиниць, що підходять як одиничні дози, де кожна одиниця містить визначену кількість активного інгредієнта, обчислена для одержання бажаного терапевтичного ефекту, разом з необхідним фармацевтичним носієм. Прикладами таких одиничних дозованих форм є таблетки (включаючи шорсткуваті або покриті таблетки), капсули, пігулки, пакетики з порошками, пластинки, розчини або суспензії для ін'єкцій, форми для введення за допомогою чайних та столових ложок та інші їм подібні, та їх окремі кратні одиниці. За допомогою сполук за даним винаходом можна лікувати або запобігати ушкодженню тканин у результаті ушкодження або смерті клітин внаслідок некрозу або апоптозу; можна зменшувати ушкодження нервової тканини або тканин серцевосудинної системи, включаючи ушкодження після локальної ішемії, інфаркту міокарда та ушкодження при реперфузії; можна лікувати різні захворювання та стани, які викликані або посилені внаслідок активності PARP; можна продовжувати або збільшувати тривалість життя або проліферативну здатність клітин; можна змінювати експресію генів старіючих клітин; можна підвищувати у клітинах радіочутливість та/або чутливість до хемотерапевтичних засобів. Як правило, інгібування активності PARP захищає клітини від втрати енергії, запобігаючи, у випадку нервових клітин, необоротну деполяризацію нейронів й, таким чином, забезпечуючи нейропротекцію. За наведеними нижче причинами, даний винахід, крім того, відноситься до способу введення терапевтично ефективної кількості зазначених вище сполук у кількості, достатній для інгібування активності PARP, для лікування або профілактики ушкодження тканин внаслідок ушкодження або смерті клітин внаслідок некрозу або апоптозу, для впливу на активність нейронів, не опосередковану токсичністю NMDA, для впливу на активність нейронів, опосередковану токсичністю NMDA, для 21 88012 22 лікування ушкодження нервової тканини внаслідок здійснення ослаблення симптомів захворювання ішемії та ушкодження при реперфузії, неврологічта/або стану. них порушень та нейродегенеративних захворюЯк використовується в даному описі, термін вань; для профілактики або лікування судинного "радіосенсибілізатор" визначається як молекула, інсульту, для лікування або профілактики серцевопереважно низькомолекулярна молекула, яку ввосудинних порушень, для лікування інших станів дять тварині в терапевтично ефективних кількоста/або порушень, таких як м'язова дегенерація, тях для підвищення чутливості клітин до іонізуючої зв'язана зі старінням, СНІД та інші захворювання радіації та/або для забезпечення лікування захвоімунної системи, зв'язані зі старінням, запалення, рювань, які піддаються лікуванню іонізуючою радіподагра, артрит, атеросклероз, кахексія, злоякісна ацією. Захворювання, які піддаються лікуванню пухлина, дегенеративні захворювання кістякової іонізуючою радіацією включають захворювання, мускулатури, що включають порушення реплікації, що відносяться до новотворів, доброякісні та злозв'язані зі старінням, діабет, травму голови, запаякісні пухлини та злоякісні клітини. Лікування іонільні порушення кишечнику (такі як коліти та хвозуючою радіацією інших захворювань, які не навероба Крона), м'язова дистрофія, остеоартрит, осдені в даному описі, також охоплюється даним теопороз, хронічна та/або гострий біль (такий як винаходом. невропатичний біль), ниркова недостатність, ішеЯк використовується в даному описі, термін мія сітківки, септичний шок (такий як ендотоксич"хемосенсибілізатор", визначається як молекула, ний шок), та старіння шкіри, для продовження житпереважно низькомолекулярна молекула, яку ввотя та проліферативної здатності клітин; для зміни дять тварині в терапевтично ефективних кількосекспресії генів старіючих клітин; для хемосенсибітях для підвищення чутливості клітин до хемотелізації та/або радіосенсибілізації (гіпоксичних) злорапії та/або для забезпечення лікування якісних клітин. Даний винахід також відноситься до захворювань, які піддаються лікуванню хемотералікування захворювань та станів у тварин, що певтичними засобами. Захворювання, які піддавключає введення зазначеній тварині терапевтичються лікуванню хемотерапією, включають захвоно ефективної кількості зазначених вище сполук. рювання, що відносяться до новотворів, Зокрема, даний винахід відноситься до спосодоброякісним та злоякісним пухлинам та злоякісбу лікування, профілактики або вповільнення розним клітинам. Лікування хемотерапією інших завитку неврологічного порушення у тварини, що хворювань, які не наведені в даному описі, також включає введення зазначеній тварині терапевтичохоплюється даним винаходом. но ефективної кількості зазначених вище сполук. Сполуки, композиції та способи за даним виНеврологічне порушення обране із групи, що находом є, зокрема, корисними для лікування або складається з периферичної невропатії внаслідок профілактики ушкодження тканин у результаті зафізичного ушкодження або хворобливого стану, гибелі або ушкодження клітин внаслідок некрозу травматичного ушкодження головного мозку, фізиабо апоптозу. чного ушкодження спинного мозку, інсульту, асоціСполуки за даним винаходом можуть являти йованого з ушкодженням головного мозку, місцевій собою "засоби проти злоякісної пухлини", та цей ішемії, загальній ішемії, ушкодження при реперфутермін також включає "засоби проти росту пухлинзії, деміелінізуючлго захворювання та неврологічних клітин" та "засоби проти новотворів". Наприного порушення, пов'язаного з нейродегенерацією. клад, способи за даним винаходом корисні для Даний винахід також включає застосування лікування злоякісних пухлин та хемосенсибілізації сполук формули (І) для інгібування активності та/або радіосенсибілізації клітин пухлини при злоPARP для лікування, профілактики або вповільякісних пухлинах, таких як пухлини, які продукують нення ушкодження тканин у результаті ушкодженАСТН, гострий лімфоцитарний лейкоз, гострий ня або загибелі клітин внаслідок некрозу або апопнелімфоцитарний лейкоз, рак кори надпочечників, тозу, для лікування, профілактики або рак сечового міхура, злоякісна пухлина мозку, рак вповільнення розвитку неврологічного порушення молочної залози, рак шийки матки, хронічний ліму тварин. фоцитарний лейкоз, хронічний міелоцитарний Термін "профілактика нейродегенерації" вклюлейкоз, рак ободочної та прямої кишки, Т-клітинна чає здатність запобігати нейродегенерації у пацієлімфома шкіри, рак ендометрія, рак стравоходу, нтів, яким недавно поставили діагноз нейродегесаркома Юинга, рак жовчного міхура, волосатоклінеративного захворювання, або при ризику тинний лейкоз, рак голови та шиї, лімфома Ходжрозвитку нового дегенеративного захворювання та кина, саркома Капоши, рак нирки, рак печінки, рак для запобігання подальшої нейродегенерації у легені (дрібноклітинний та/або недрібноклітинний), пацієнтів, які вже страждають від нейродегенеразлоякісний перітонеальний вилив, злоякісний плетивного захворювання або мають симптоми нейвральний вилив, меланома, мезотеліома, множинродегенеративного захворювання. на мієлома, нейробластома, лімфома не ХоджкиЯк використовується в даному описі, термін на, остеосаркома, рак яєчника, рак яєчника із "лікування" включає будь-який спосіб лікування зародкових клітин, рак передміхурової залози, рак захворювання та/або стану у тварини, зокрема, у підшлункової залози, рак полового члена, ретинолюдини, та включає: (і) профілактику захворюванбластома, рак шкіри, саркома м'яких тканин, плосня та/або стану в суб'єкта, що може бути схильний коклітинний рак, рак шлунка, рак яєчка, рак щитодо захворювання та/або стану, що ще не діагносвидної залози, трофобластичний новотвір, рак тіла тується; (іі) уповільнення розвитку захворювання матки, рак піхви, рак зовнішніх жіночих полових та/або стану, тобто припинення його розвитку; (ііі) органів та пухлина Вільмса. зм'якшення захворювання та/або стану, тобто 23 88012 24 Таким чином, сполуки за даним винаходом вуватися разом з радіосенсибілізаторами, вклюможуть бути використані в якості "радіосенсибілічають, але не обмежуються тільки ними: адріамізаторів" та/або "хемосенсибілізаторів". цин, камптотецин, карбоплатин, цисплатин, Відомо, що радіосенсибілізатори підвищують даунорубицин, доцетаксел, доксорубицин, інтерчутливість злоякісних клітин до токсичних ефектів ферон (альфа, бета, гама), інтерлейкин-2, іриноіонізуючої радіації. У літературі передбачається текан, паклітаксел, топотекан та терапевтично кілька механізмів для способу дії радіосенсибілізаефективні аналоги та похідні зазначених вище торів, включаючи: радіосенсибілізатори ппоксичзасобів. них клітин (наприклад, сполука 2-нітроімідазолу та Хемосенсибілізатори можуть бути введені располука діоксида бензотріазину), що імітують кизом з терапевтично ефективною кількістю одного сень або, які альтернативно поводятьсебе подібабо декількох інших сполук, включаючи, але не но біологічним відновлювачам при гіпоксії; радіообмежуючись тільки ними: сполуки, які забезпечусенсибілізатори негіпоксичних клітин (наприклад, ють транспортування хемосенсибілізаторів у клігалогеновані піримідини), які можуть бути аналотини-мішені; сполуки, які контролюють доставку гами основ ДНК та переважно вбудовуються в лікарських засобів, харчових добавок та/або кисню ДНК злоякісних пухлин та, таким чином, забезпев клітини-мішені; хемотерапевтичні засоби, які чують індукуемий опроміненням розрив молекули впливають на пухлину, або інші терапевтично ДНК та/або запобігають розвитку нормальних меефективні сполуки для лікування злоякісної пухлиханізмів репарації ДНК; та різні інші можливі механи або іншого захворювання. Приклади додатконізми дії можуть бути припущені для радіосенсибівих терапевтичних засобів, які можуть застосовулізаторів при лікуванні захворювання. ватися разом з хемосенсибілізаторами, У цей час у безлічі різних протоколів лікування включають, але не обмежуються тільки ними: мерадіосенсибілізатори використовуються разом з тилюючі агенти, інгібітори топоізомерази І та інші опроміненням рентгенівськими променями. Прихемотерапевтичні засоби, такі як цисплатин та клади радіо сенсибілізаторів, які активуються ренблеоміцин. тгенівськими променями, включають, але не обСполуки формули (І) також можуть використомежуються тільки ними, наступні- метронідазол, вуватися для виявлення або ідентифікації PARP мізонідазол, десметилмізонідазол, пімонідазол, та, більш конкретно, рецептора PARP-1. Для цієї етанідазол, німоразол, мітоміцин С, RSU 1069, SR мети до сполук формули (І) можна приєднувати 4233, ЕО9, RB 6145, нікотинамід, 5мітку. Зазначена мітка може бути обрана із групи, бромдезоксиуридин (BUd), 5-йоддезоксиуридин що складається з радіоізотопної мітки, спінової (IUd), бромдезоксицитидин, фтордезоксиуридин мітки, антигенної мітки, ферментної мітки, флуо(Fud), гідроксимочевину, цисплатин та терапевтиресцентної групи або хемілюмінесцентної групи. чно ефективні аналоги та похідні зазначених вище Фахівці в даній галузі легко можуть визначити речовин. ефективну кількість із результатів тесту, предстаПри фотодинамічній терапії (PDT) злоякісних вленого нижче. Як правило, передбачається, що пухлин як радіаційний активатор сенсибілізатора ефективна кількість може складати від 0,001мг/кг використовують видиме світло. Приклади фотодидо 100мг/кг маси тіла, та, зокрема, від 0,005мг/кг намічних радіосенсибілізаторів включають, але не до 10мг/кг маси тіла. Може бути доцільним ввеобмежуються тільки ними, наступнi: похідні гемадення необхідної дози у вигляді двох, трьох, чотитопорфірину, фотофрин, похідні бензопорфірину, рьох або більше суб-доз протягом доби з відповідетіопорфірин олова, феофорбид-а, бактеріохлоними інтервалами. Зазначені суб-дози можуть рофілл-а, нафталоціаніни, фталоціаніни, фталоцібути включені до складу в якості одиничних дозоанін цинку та терапевтично ефективні аналоги та ваних форм, наприклад, що містять від 0,05 до похідні зазначених вище речовин. 500мг, та, зокрема, від 0,1мг до 200мг активного Радіосенсибілізатори можуть бути введені раінгредієнта в одиничній дозованій формі. зом з терапевтично ефективною кількістю одного Наступні нижче приклади ілюструють даний або декількох інших сполук, включаючи, але не винахід. обмежуючись тільки ними: сполуки, які забезпечуЕкспериментальна частина ють введення радіосенсибілізаторів у клітиниНадалі в даному описі, "DCM" визначається як мішені; сполуки, які контролюють доставку лікардихлорметан, "DIPE" визначається як діізопропіських засобів, харчових добавок та/або кисню в ловий ефір, "ДМФА" визначається як Ν,Νклітини-мішені; хемотерапевтичні засоби, які вплидиметилформамід, "EtOH" визначається як етавають на пухлину з додатковим опроміненням або нол, "EtOAc" визначається як етилацетат, "МеОН" без нього; або інші терапевтично ефективні сполувизначається як метанол та "TEA" визначається як ки для лікування злоякісної пухлини або іншого триетиламін, "ТГФ" визначається як тетрагідрофузахворювання. Приклади додаткових терапевтичран. них засобів, які можуть використовуватися разом з А. Одержання проміжних сполук радіосенсибілізаторами, включають, але не обмеПриклад А1 жуються тільки ними: 5-фторурацил, лейковорин, Одержання проміжної сполуки 1 5'-аміно-5'дезокситімидин, кисень, карбоген, трансфузію еритроцитів, перфторвуглеці (наприклад, флюосол 10 DA), 2,3-DPG, BW12C, блокатори кальцієвих каналів, пентоксифіллін, антіангіогенні сполуки, гідралазин та LBSO. Приклади хемотерапевтичних засобів, які можуть використо 25 Суміш 2-[[1-(фенілметил)-4піперидиніл]аміно]бензаміду (0,03моль) та 1,1'карбонілбіс-1Н-імідазолу (0,033моль) у диметилацетаміді (25мл) нагрівали до кипіння зі зворотним холодильником при перемішуванні протягом 5 годин, потім додавали додаткову кількість 1,1'карбонілбіс-1Н-імідазолу (0,003моль) та реакційну суміш залишали на нічь при перемішуванні та при нагріванні до кипіння зі зворотним холодильником. Суміш виливали у воду (300мл), осад, що утворився, відфільтровували, промивали водою та DIPE та висушували (на виході отримали 9,1г, 91%). Частину продукту потім кристалізували із ДМФА та води, виділяли кінцевий продукт, отримуючи на виході 0,8г проміжної сполуки 1 з температурою плавлення 233,5°С. В. Отримання кінцевих продуктів Приклад В1 Отримання сполуки 1 Суміш проміжної сполуки 1 (0,15моль) у ТГФ (250мл) та МеОН (250мл) гідривали в апараті Пара над 10%-м Pd/C (5г) у якості каталізатора. Після поглинання Н2 (1еквів.) каталізатор відфільтровували та отримували фільтрат (І) та осад, що залишився на фільтрі. Отриманий осад перемішували у киплячому гідроксиацетоні та суміш фільтрували у гарячому вигляді. Отриманий фільтрат об'єднували із фільтратом (І) та суміш випарювали. Залишок перемішували у воді, потім додавали NH4OH та суміш перемішували протягом 1 години разом із трихлорметаном. Осад відфільтровували та висушували, отримуючи на виході 31г (84%) сполуки 1, температура плавлення 253,7°С. Приклад В2 Отримання сполуки 2 88012 26 Сполуку 1 (0,038моль) у 2-метоксиетанолі (150мл) перемішували при нагріванні до повного розчинення, потім по краплях при нагріванні додавали розчин 1-(4-фторфеніл)-4-йод-1-бутанону (0,019моль) у 2-метоксезтанолі (10мл), при цьому утворювався осад. Реакційну суміш нагрівали до кипіння зі зворотним холодильником при перемішуванні протягом 1,5 годин. Осад відфільтровували та фільтрат випарювали. Осад очищували за допомогою силікагелю через воронку зі скляним фільтруючим днищем (елюент: СНСІ3/МеОН 90/10). Збирали фракції з продуктом та вилучали розчинник. Залишок кристалізували із 2пропанолу, отриманий осад збирали та висушували, отримуючи на виході 2,3г (29%) сполуки 2, температура плавлення 195°С. Приклад В3 Отримання сполуки 3 Суміш 1-(3-хлорпропіл)-2,4(1Н,3H)хіназоліндіону (0,015моль), 3-(4-піперидиніл)-1Ніндолу (0,015моль) та карбонату натрія (0,030моль) у 4-метил-2-пентаноні (150мл) нагрівали до кипіння зі зворотним холодильником при перемішуванні протягом 24 годин, потім реакційну суміш охолоджували та додавали воду. Відділяли органічний шар, висушували та вилучали розчинник. Залишок очищували за допомогою колоночної хроматографії на силікагелі (елюент: СНСІ3/МеОН 95/5). Збирали фракції з продуктом та вилучали розчинник. Залишок кристалізували із EtOH та збирали отриманий осад, отримуючи на виході 2г (33%) сполуки 3, температура плавлення 216,8°С. У Таблиці 1 наведені сполуки, які отримують у відповідності з одним із наведених вище прикладів. 27 Фармакологічний приклад Сцинтіляційний аналіз зближення (SPA) in vitro на інгібуючу активність PARP-1 Сполуки за даним винаходом тестували в аналізі in vitro, заснованому на методі SPA (запатентований Amersham Pharmacia Biotech) 88012 28 У принципі, аналіз заснований на загальноприйнятому методі SPA для визначення поліАДФрибозилювання біотинільованих білків-мішеней, тобто пістонів. Це рибозилювання індукують, використовуючи фермент PARP-1, активований ДНК із одноланцюговими розривами, та [3Н] 29 88012 30 нікотинамідадениндинуклеотидом ([3H]-NAD+) як муючі фермент PARP-1 та ДМСО без сполуки), донором АДФ-рибозилів. просту інкубацію (яка включала ДМСО, але без В якості індуктора активності ферменту PARPферменту PARP-1 або сполуки) та зразки (які 1, одержували ДНК із одноланцюговими розривавключали фермент PARP-1 та сполуки розчинені в ми. Для цього 25мг ДНК (постачальник Sigma) розДМСО). Всі сполуки, що тестувалися, розчиняли та чиняли в 25мл буферу для ДНК (10мМ Tris-HCI, pH із часом додатково розчиняли в ДМСО. У першому 7,4, 0,5мг/мл бичачі сироваткові альбуміни (BSA), прикладі, сполуки тестували при концентрації 105 5мМ МgСІ2·6Н2О та 1мМ KСІ), до якого додавали М. Якщо сполуки показували активність при 10-5М, 50мкл розчину ДНК (1мг/мл в 0,15М NaCI). После будували криву доза-відповідь, де сполуки тестуінкубації протягом 90 хвилин при температурі вали при концентраціях між 10-5М та 10-8М. У кож37°С, реакцію зупиняли за допомогою додавання ному тесті зі значень для контролю та зразка від1,45г NaCI, з наступною додатковою інкубацією німали значення для простого розчину. при температурі 58°С протягом 15 хвилин. РеакКонтрольний зразок показував максимальну актиційну суміш охолоджували на льоду та проводили вність ферменту PARP-1. Для кожного зразка кільдіаліз при температурі 4°С протягом відповідно 1,5 кість срm виражали у вигляді процентної частки та 2 годин проти 1,5л 0,2М KСІ, та двічі проти 1,5л від середнього значення срm для контролів. Коли 0,01Μ KСІ протягом 1,5 та 2 годин, відповідно. це доцільно, обчислювали значення ІС50 (концентСуміш розділяли на аліквоти та зберігали при темрація лікарського засобу, необхідна для зниження пературі -20°С. Гістони (1мг/мл, тип ІІ-А постачаактивності ферменту PARP-1 до 50% від активносльник Sigma) біотинільовали з використанням наті в контролі) з використанням лінійної інтерполяції бору для біотинілювання Amersham та зберігали між експериментальними крапками безпосередньо розділеними на аліквоти, при температурі -20°С. вище та нижче за рівень 50%. Ефекти сполук, які Отримували вихідний розчин 100мг/мл гранул SPA тестувалися, представлені у вигляді pIC50 (значеніз полівінілтолуолу (PVT) (постачальник ня негативного логарифма значення IC50). Для Amersham) у PBS. Вихідний розчин [3H]-NAD+ перевірки аналізу SPA як контрольні сполуки викоотримували при додаванні 120мкл [3H]-NAD+ ристовували 4-аміно-1,8-нафталімід. Сполуки, які (0,1мКи/мл, постачальник: NEN) до 6мл буферу тестували, показували інгібіторну активність при для інкубації (50мМ Tris/HCI, pH 8; 0,2мМ DTT; початковій досліджуваній концентрації 10-5М (див. + 4мМ МgСІ2). Отримували розчин 4мМ NAD (потаблицю 2). стачальник Roche) у буфері для інкубації (із Аналіз фільтрування in vitro на інгібіторну ак100мМ вихідного розчину у воді, який зберігали тивність PARP-1 при температурі -20°С). Фермент PARP-1 отримуСполуки за даним винаходом тестували в вали з використанням відомих в даній галузі метоаналізі фільтрування in vitro, оцінюючи активність дик, тобто клонування та експресія білку, з викоPARP-1 (що запускали у присутності ДНК із однористанням на початковому етапі кДНК печінки ланцюговими розривами) за допомогою його актилюдини. Інформацію, яка стосується білкової повності у відношенні поліАДФ-рибозилювання гістослідовності фермента PARP-1, що використовунів з використанням [32P]-NAD як донора АДФється, включаючи посилання на літературні джерибозилів Радіоактивні рибозильовані гістони осарела, можна знайти в базі даних Swiss-Prot з джували за допомогою трихлороцтової кислоти первинним номером доступу Р09874. Біотинільо(ТСА) у 96-планшетах для фільтрації та проводили вані гістони та гранули PVT-SPA перемішували та вимір вбудованого [32Р] з використанням сцинтипопередньо інкубували протягом 30 хвилин при ляційного лічильника. кімнатній температурі. Фермент PARP-1 (концентОтримували суміш гістонів (вихідний розчин: рація залежить від партії) змішували з ДНК з од5мг/мл в Н2О), NAD+ (вихідний розчин: 100мМ в ноланцюговими розривами та суміш попередньо Н2О), та [32P]-NAD+ у буфері для інкубації (50мМ інкубували протягом 30 хвилин при температурі Tris/HCI, pH 8; 0,2мМ DTT; 4мМ МgСІ2). Також 4°С. Рівні частини розчину гістони/гранули PVTодержували суміш ферменту PARP-1 (5-10мкг/мл) SPA та розчину фермент PARP-1/ДНК змішували та ДНК із одноланцюговими розривами. ДНК із та у 96-лункові мікротитраційні планшети додаваодноланцюговими розривами одержували, як опили 75мкл отриманої суміші разом із 1мкл сполуки в сано для SPA in vitro для інгібуючої активності ДМСО та 25мкл [3H]-NAD+ на одну лунку. Кінцеві PARP-1. 75мкл суміші ферменту PARP-1/ДНК раконцентрації в інкубаційній суміші складали зом з 1мкл сполуки в ДМСО та 25мкл суміші гісто2мкг/мл для біотинільованих гістонів 2мг/мл для ни-NAD7[32P]-NAD+ додавали на кожну лунку 96гранул PVT-SPA, 2мкг/мл для ДНК із одноланцюлункового планшета для фільтрування (0,45мкм, говими розривами та між 5 та 10мкг/мл для ферпостачальник Millipore) Кінцеві концентрації в інкументу PARP-1. Після інкубації суміші протягом 15 баційній суміші становили 2мкг/мл для гістонів, хвилин при кімнатній температурі, реакцію зупиня0,1мМ для NAD+, 200мкМ (0,5мкКю) для [32P]-NAD+ + ли за допомогою додавання 100мкл 4мМ NAD у та 2мкг/мл для ДНК із одноланцюговими розривабуфері для інкубації (кінцева концентрація 2мМ) та ми. Планшети інкубували протягом 15 хвилин при вміст планшетів перемішували. кімнатній температурі, реакцію зупиняли за допоГранулам давали можливість осаджуватися могою додавання 10мкл крижаного 100% ТСА та протягом щонайменше 15 хвилин та планшети потім додавали 10мкл крижаного розчину BSA (1% в Н2О) Білкової фракції давали можливість випаспереносили у TopCountNXTÔ (Packard) для сцинти в осад протягом 10 хвилин при температурі 4°С тиляційного виміру, значення виражалися як число та планшети фільтрували у вакуумі. Планшети імпульсів у хвилину (срm). Для кожного експерипослідовно промивали, для кожної лунки, 1мл 10% менту, паралельно досліджували контролі (утри 31 88012 32 крижаного ТСА, 1мл 5% крижаного ТСА та 1мл 5% при температурі -20°С, постачальник Roche) до ТСА при кімнатній температурі. Нарешті, у кожну 1888,7мкл буфера для аналізу (60мМ Tris/HCI, p лунку додавали 100мкл розчину для сцинтиляції 7,4; 0,9мМ DTT; 6мМ MgCI2). Фермент ΤΑΝΚ-2 (Microscint 40, Packard), планшети переносили в одержували, як описано в ЕР 1238063. 60мкл буфера для аналізу разом з 1мкл сполуки в ДМСО, TopCountNXTÔ (постачальник Packard) для сцин20мкл [3H]-NAD+/NAD та 20мкл ферменту TANK-2 тиляційних вимірів та значення виражали в кілько(кінцева концентрація 6мкг/мл) додавали на лунку сті імпульсів у хвилину (cpm). Для кожного експев 96-лунковий планшет з покриттям Ni (Perkin рименту паралельно досліджували контрольну Elmer). Після інкубації суміші протягом 120 хвилин інкубацію (що містить фермент PARP-1 та ДМСО при кімнатній температурі реакцію зупиняли за без сполуки), просту інкубацію (що містить ДМСО, допомогою додавання 60мкл стоп-реагенту (42,6мг але без ферменту PARP-1 або сполуки) та зразки NAD в 6мл Н2О). Планшети накривали пристосу(що містить фермент PARP-1 та сполуку розчинені ванням для накривання планшетів та поміщали в в ДМСО). Всі сполуки, що тестували, розчиняли та TopCountNXTÔ (Packard) для сцинтиляційного із часом додатково розбавляли в ДМСО. У першому прикладі, сполуки тестували при концентрації виміру. Значення виражали в кількості імпульсів у 10-5М. Якщо сполука показували активність при 10хвилину (cpm). Для кожного експерименту парале5 М, будували криву доза-відповідь, де сполуки льно досліджували контролі (що містять фермент тестували при концентраціях між 10-5М и 10-8М. У TANK-2 та ДМСО без сполуки), просту інкубацію кожному тесті зі значень для контролю та зразка (що містить ДМСО, але без ферменту TANK-2 або віднімали значення для простого розчину. Контросполуки) та зразки (що містять фермент TANK-2 та льний зразок показував максимальну активність сполуки розчинені в ДМСО). Всі сполуки, які тестуферменту PARP-1. Для кожного зразка кількість вали, розчиняли та із часом додатково розбавляли cpm виражали у вигляді відсоткової частки від сев ДМСО. У першому прикладі, сполуки тестували реднього значення cpm для контролів. Коли це при концентрації 10-5М. Якщо сполуки показували доцільно, обчислювали значення IC50 (концентраактивність при 10-5М, будували криву дозація лікарського засобу, необхідна для зниження відповідь, де сполуки тестували при концентраціях активності ферменту PARP-1 до 50% від активносміж 10-5М та 10-8М. У кожному тесті зі значень для ті в контролі) з використанням лінійної інтерполяції контролю та зразка віднімали значення для пороміж експериментальними крапками безпосередньо жнього розчину. Контрольний зразок показував вище та нижче за рівень 50%. Ефекти сполук, що максимальну активність ферменту TANK-2. Для тестували, представлені у вигляді pIC50 (значення кожного зразка кількість cpm виражали у вигляді негативного логарифма значення IC50). Для перевідсоткової частки від середнього значення cpm вірки аналізу фільтрування як контрольну сполуку для контролів. Коли це доцільно, обчислювали використовували 4-аміно-1,8-нафталімід. Сполуки, значення IC50 (концентрація лікарського засобу, які тестували, показували інгібіторну активність необхідна для зниження активності ферменту при початковій досліджуваній концентрації 10-5М TANK-2 до 50% від активності в контролі) з вико(див. таблицю 2). ристанням лінійної інтерполяції між експериментаСцинтиляційний аналіз зближення (SPA) in льними крапками безпосередньо вище та нижче за vitro на інгібіторну активність TANK-2 рівень 50%. Ефекти сполук, які тестували, предСполуки за даним винаходом тестували в ставлені у вигляді pIC50 (значення негативного аналізі in vitro, заснованому на методі SPA з викологарифма значення IC50). Для перевірки аналізу ристанням планшетів Ni Flash (96- або 384SPA як контрольні сполуки використовували 3лункових) амінобензамід та 4-аміно-1,8-нафталімід. У даноУ принципі, аналіз заснований на методі SPA му випадку описаний аналіз із використанням 96для визначення поліАДФ-рибозилювання білка лункових планшетів. В аналізі з використанням TANK-2 з використанням й [3Н]384-лункових планшетів використовували такі ж нікотинамідаденіндінуклеотиду ([3H]-NAD+) як докінцеві концентрації та значення були адаптовані. нор АДФ-рибозилів. Якщо результати досліджень із 96-лунковими Вихідний розчин [3H]-NAD+/NAD одержували планшетами були доступні, ці результати включаза допомогою додавання 64,6мкл [3H]-NAD+ ли в таблицю 2, в іншому випадку показані резуль(0,1мС/мл, постачальник: Perkin Elmer) та 46,7мкл тати аналізу з 384-лунковими планшетами. вихідного розчину NAD (10,7мМ, що зберігається 33 88012 34 Таблиця 2 № Спо- In vitro фільтраційний аналіз PARP-1 In vitro SPA аналіз PARP-1 pIC50 In vitro SPA TANK-2 pIC50 луки pIC50 1 6,333 6,691
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinazolinedione derivatives as parp inhibitors
Автори англійськоюKennis Ludo Edmond Josephine, Mertens Josephus Carolus, van Dun Jacobus Alphonsus Josephus, Somers Maria Victorina Francis, Wouters Walter Boudewijn Leopold
Назва патенту російськоюПроизводные хиназолиндиона как ингибиторы parp
Автори російськоюКеннис Людо Эдмон Жозефин, Мертенс Джозефус Каролус, ван Дун Якобус Альфонсус Йозефус, Сомерс Мария Викторина Франциска, Вутерс Вальтер Будевийн Леопольд
МПК / Мітки
МПК: C07D 401/04, A61K 31/517, A61P 35/00, C07D 401/14
Мітки: інгібітори, похідні, хіназоліндіону
Код посилання
<a href="https://ua.patents.su/17-88012-pokhidni-khinazolindionu-yak-ingibitori-parp.html" target="_blank" rel="follow" title="База патентів України">Похідні хіназоліндіону як інгібітори parp</a>
Попередній патент: Генератор віброакустичного захисту
Наступний патент: Спосіб цементації сталевих виробів та склад для його здійснення
Випадковий патент: Спосіб очистки стічних вод за допомогою вищих водяних рослин