Похідні хіназолінону як інгібітори parp
Номер патенту: 85593
Опубліковано: 10.02.2009
Автори: Мертенс Джозефус Каролус, Кенніс Лудо Едмонд Джозефін, Сомерс Марія Вікторіна Франціска, Жільмон Жером Еміль Жорж, ван Дун Якобус Алфонсус Джосепхус, Воутерс Валтер Боудевіджн Леопольд
Формула / Реферат
1. Сполука формули (І)
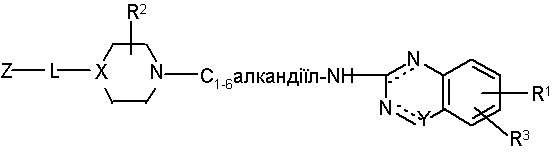 , (І)
, (І)
її N-оксиди, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, де
пунктирні лінії означають необов'язкові зв'язки;
X є >N- або >СН-;
-![]() - є -N-C(O)- або -N=CR4-, де R4 є гідрокси;
- є -N-C(O)- або -N=CR4-, де R4 є гідрокси;
L є прямим зв'язком або двовалентним радикалом, вибраним з -С(О)-, -С(О)-NH-, -NH-, -С(О)-С1-6алкандіїлу-, -С(О)-О-С1-6алкандіїлу- або -С1-6aлкандіїлу-;
R1 є воднем, галогеном, С1-6алкілокси або С1-6алкілом;
R2 є воднем, гідрокси, С1-6алкілокси або амінокарбонілом;
якщо X заміщений R2, то R2, взятий разом з -L-Z, може утворювати двовалентний радикал формули
-C(O)-NH-CH2-NR10-, (а-1)
де R10 є фенілом;
R3 є воднем або С1-6алкілокси;
Z є аміно, ціано або радикалом, вибраним з
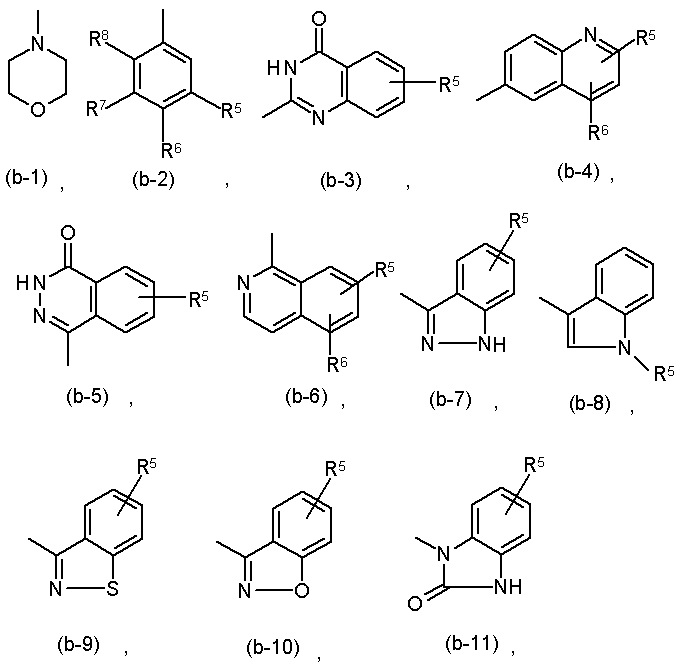
де кожний з R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6алкілу або С1-6алкілокси; або
R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули
-CH2-CR92-O-, (с-1)
-(СН2)3-О-, (с-2)
-О-(СН2)2-О- (с-3) або
-СН=СН-СН=СН-, (с-4)
де кожен R9 незалежно вибирають з водню або С1-6алкілу;
за умови, що
якщо X є >N-, то Z є відмінним від радикала (b-2), і
якщо X є >СН-, та L є -C(O)-NH- або -С(О)-О-С1-6алкандіїлом, та Z є радикалом (b-2), та R7 та R8, взяті разом, утворюють двовалентний радикал формули (с-1), (с-2) або (с-3), то R5 відмінний від хлору.
2. Сполука за п. 1, в якій
L є прямим зв'язком або двовалентним радикалом, вибраним з -С(О)-, -С(О)-NH- або -С(О)-С1-6алкандіїлу-; R2 є воднем, гідрокси або С1-6 алкілокси; Z є радикалом, вибраним з (b-2), (b-3), (b-4), (b-5), (b-6), (b-7), (b-8) або (b-9); кожен R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6 алкілу або С1-6 алкілокси;
або R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули (с-1), (с-2), (с-3) або (с-4).
3. Сполука за будь-яким з пп. 1 або 2, в якій
L є прямим зв'язком; R1 є воднем, галогеном або С1-6 алкілом; R2 є воднем; R3 є воднем; Z є радикалом, вибраним з (b-5) або (b-7); і кожен R5 незалежно вибирають з водню або галогену.
4. Сполука за будь-яким з пп. 1, 2 або 3, де сполуку вибирають зі сполук № 35, № 36, № 39, № 1 і № 43:
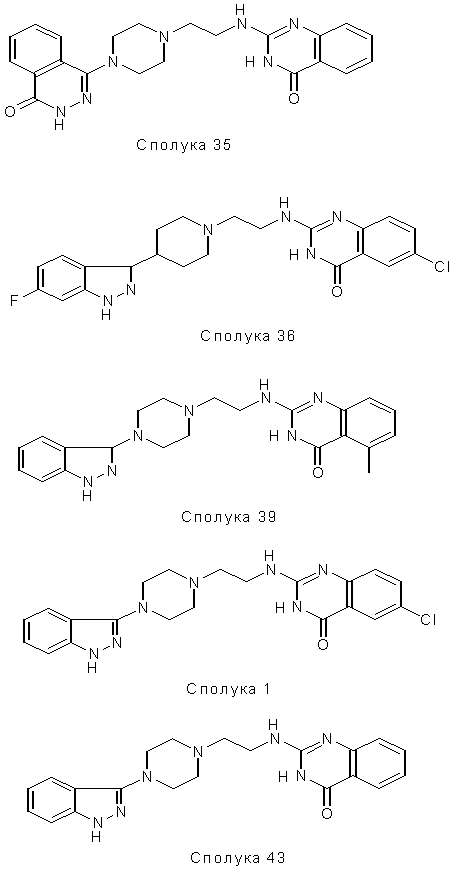
5. Застосування сполуки за будь-яким з пп. 1-4 як лікарського засобу.
6. Фармацевтична композиція, що містить фармацевтично прийнятний носій і, як активний інгредієнт, терапевтично ефективну кількість сполуки за пп. 1-4.
7. Спосіб одержання фармацевтичної композиції за п. 6, де фармацевтично прийнятний носій і сполуку за пп. 1-4 ретельно змішують.
8. Застосування сполуки для виробництва лікарського засобу для лікування захворювання, опосередкованого PARP, де зазначеною сполукою є сполука формули (І)
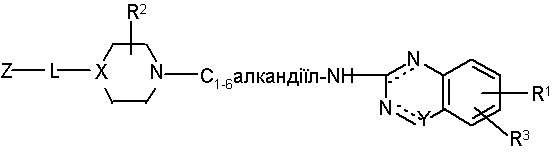 , (I)
, (I)
її N-оксиди, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, де
пунктирні лінії означають необов'язкові зв'язки;
X є >N- або >СН-;
-![]() - є -N-C(O)- або -N=CR4-, де R4 є гідрокси;
- є -N-C(O)- або -N=CR4-, де R4 є гідрокси;
L є прямим зв'язком або двовалентним радикалом, вибраним з -С(О)-, -С(О)-NH-, -NH-, -С(О)-С1-6алкандіїлу-, -С(О)-О-С1-6алкандіїлу- або -С1-6aлкандіїлу-;
R1 є воднем, галогеном, С1-6алкілокси або С1-6алкілом;
R2 є воднем, гідрокси, С1-6алкілокси або амінокарбонілом;
якщо X заміщений R2, то R2, взятий разом з -L-Z, може утворювати двовалентний радикал формули
-C(O)-NH-CH2-NR10-, (а-1)
де R10 є фенілом;
R3 є воднем або С1-6алкілокси;
Z є аміно, ціано або радикалом, вибраним з
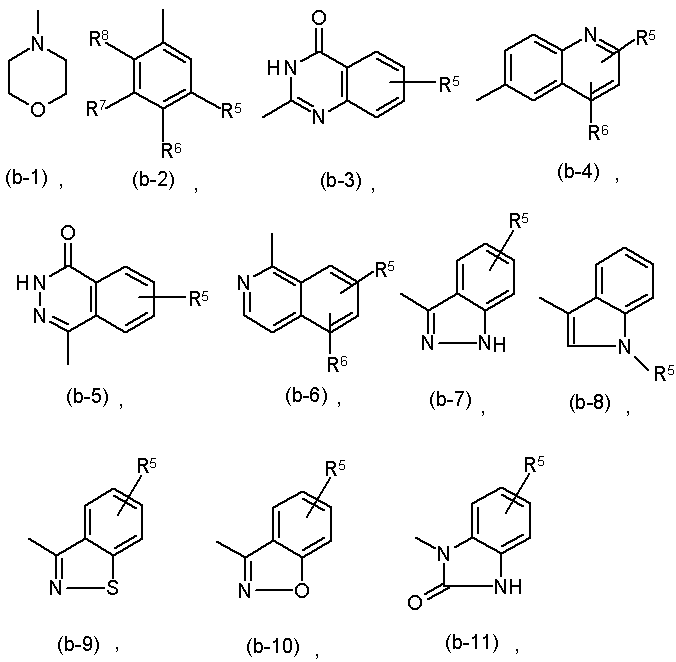
де кожний з R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6алкілу або С1-6алкілокси; або
R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули
-CH2-CR92-O-, (с-1)
-(СН2)3-О-, (с-2)
-О-(СН2)2-О- (с-3) або
-СН=СН-СН=СН-, (с-4)
де кожен R9 незалежно вибирають з водню або С1-6алкілу.
9. Застосування за п. 8 інгібітору PARP формули (І) для виробництва лікарського засобу для лікування захворювання, опосередкованого PARP-1.
10. Застосування за будь-яким з пп. 8 або 9, де лікування включає хіміосенсибілізацію.
11. Застосування за будь-яким з пп. 8 або 9, де лікування включає радіосенсибілізацію.
12. Комбінація сполуки з хіміотерапевтичним агентом, де зазначеною сполукою є сполука формули (І)
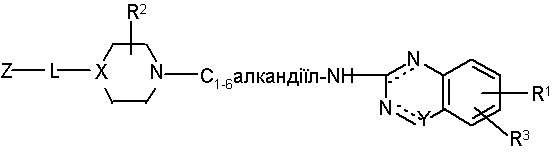 , (I)
, (I)
її N-оксиди, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, де
пунктирні лінії означають необов'язкові зв'язки;
X є >N- або >СН-;
-![]() - є -N-C(O)- або -N=CR4-, де R4 є гідрокси;
- є -N-C(O)- або -N=CR4-, де R4 є гідрокси;
L є прямим зв'язком або двовалентним радикалом, вибраним з -С(О)-, -С(О)-NH-, -NH-, -С(О)-С1-6алкандіїлу-, -С(О)-О-С1-6алкандіїлу- або -С1-6aлкандіїлу-;
R1 є воднем, галогеном, С1-6алкілокси або С1-6алкілом;
R2 є воднем, гідрокси, С1-6алкілокси або амінокарбонілом;
якщо X заміщений R2, то R2, взятий разом з -L-Z, може утворювати двовалентний радикал формули
-C(O)-NH-CH2-NR10-, (а-1)
де R10 є фенілом;
R3 є воднем або С1-6алкілокси;
Z є аміно, ціано або радикалом, вибраним з

де кожний з R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6алкілу або С1-6алкілокси; або
R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули
-CH2-CR92-O-, (с-1)
-(СН2)3-О-, (с-2)
-О-(СН2)2-О- (с-3) або
-СН=СН-СН=СН-, (с-4)
де кожен R9 незалежно вибирають з водню або С1-6алкілу.
13. Спосіб одержання сполуки за п. 1, який відрізняється тим. що здійснюють взаємодію проміжної сполуки формули (II) із проміжною сполукою формули (III), в якій W є прийнятною групою, що відходить, з одержанням сполуки формули (I), де L є -С1-6алкандіїл-NH- і обидві пунктирні ліній можуть бути зв'язками, в реакційноінертному розчиннику з додаванням відповідної основи
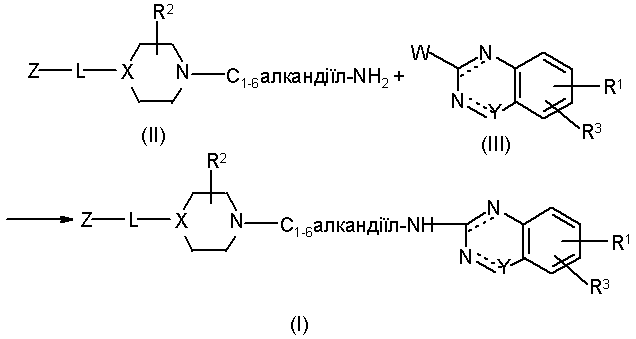 .
.
Текст
1. Сполука формули (І) N C1-6 aлкандіїл-NH N її N-оксиди, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, де пунктирні лінії означають необов'язкові зв'язки; X є >N- або >СН-; -N Y - є -N-C(O)- або -N=CR4-, де R4 є гідрокси; L є прямим зв'язком або двовалентним радикалом, вибраним з -С(О)-, -С(О)-NH-, -NH-, -С(О)-С1-С(О)-О-С1-6алкандіїлу- або -С16алкандіїлу-, 6aлкандіїлу-; (І) R1 Y R3 (13) N , R1 є воднем, галогеном, С1-6алкілокси або С16алкілом; R2 є воднем, гідрокси, С1-6алкілокси або амінокарбонілом; якщо X заміщений R2, то R2, взятий разом з -L-Z, може утворювати двовалентний радикал формули -C(O)-NH-CH 2-NR10-, (а-1) де R10 є фенілом; R3 є воднем або С 1-6алкілокси; Z є аміно, ціано або радикалом, вибраним з 85593 X (11) L UA Z C2 R2 (19) (21) a200612700 (22) 28.06.2005 (24) 10.02.2009 (86) PCT/EP2005/053029, 28.06.2005 (31) 04076887.1 (32) 30.06.2004 (33) EP (46) 10.02.2009, Бюл.№ 3, 2009 р. (72) ЖІЛЬМОН ЖЕРОМ ЕМІЛЬ ЖОРЖ, КЕННІС ЛУДО ЕДМОНД ДЖОЗЕФІН, BE/BE, МЕРТЕНС ДЖОЗЕФУС КАРОЛУС, BE/BE, ВАН ДУН ЯКОБУС АЛФОНСУС ДЖОСЕПХУС, BE/BE, СОМЕРС МА 3 85593 N O R8 O 4 R7 N HN R5 R5 R6 (b-2) (b-1) , R5 N , R6 (b-4) , , (b-3) R5 O HN N R5 N R5 N R6 (b-5) , N R5 (b-6) , R5 NH (b-7) , (b-8) , R5 R5 N N (b-9) S N , O (b-11) , (b-10) , де кожний з R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6алкілу або С 16алкілокси; або R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули -CH2-CR92-O-, (с-1) -(СН2)3-О-, (с-2) -О-(СН2)2-О- (с-3) або -СН=СН-СН=СН-, (с-4) де кожен R9 незалежно вибирають з водню або С16алкілу; за умови, що якщо X є >N-, то Z є відмінним від радикала (b-2), і якщо X є >СН-, та L є -C(O)-NH- або -С(О)-О-С17 8 6алкандіїлом, та Z є радикалом (b-2), та R та R , взяті разом, утворюють двовалентний радикал формули (с-1), (с-2) або (с-3), то R5 відмінний від хлору. 2. Сполука за п. 1, в якій N H N HN N O L є прямим зв'язком або двовалентним радикалом, вибраним з -С(О)-, -С(О)-NH- або -С(О)-С12 6алкандіїлу-; R є воднем, гідрокси або С 1-6 алкілокси; Z є радикалом, вибраним з (b-2), (b-3), (b-4), (b-5), (b-6), (b-7), (b-8) або (b-9); кожен R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6 алкілу або С 1-6 алкілокси; або R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули (с-1), (с-2), (с-3) або (с-4). 3. Сполука за будь-яким з пп. 1 або 2, в якій L є прямим зв'язком; R1 є воднем, галогеном або С1-6 алкілом; R2 є воднем; R3 є воднем; Z є радикалом, вибраним з (b-5) або (b-7); і кожен R5 незалежно вибирають з водню або галогену. 4. Сполука за будь-яким з пп. 1, 2 або 3, де сполуку вибирають зі сполук № 35, № 36, № 39, № 1 і № 43: H N N NH O N O С п о л ук а 3 5 N H N N H N F N H N Cl O С по л ука 3 6 5 85593 N H N N HN N N H 6 N O С п о л у ка 3 9 N H N N N H N HN Cl N O С п о лук а 1 N N N H H N N H N N O С п ол ука 4 3 5. Застосування сполуки за будь-яким з пп. 1-4 як лікарського засобу. 6. Фармацевтична композиція, що містить фармацевтично прийнятний носій і, як активний інгредієнт, терапевтично ефективну кількість сполуки за пп. 1-4. 7. Спосіб одержання фармацевтичної композиції за п. 6, де фармацевтично прийнятний носій і сполуку за пп. 1-4 ретельно змішують. 8. Застосування сполуки для виробництва лікарського засобу для лікування захворювання, опосередкованого PARP, де зазначеною сполукою є сполука формули (І) R2 Z L X N N C1-6aлкандіїл-NH N її N-оксиди, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, де пунктирні лінії означають необов'язкові зв'язки; X є >N- або >СН-; 4 4 -N Y - є -N-C(O)- або -N=CR -, де R є гідрокси; L є прямим зв'язком або двовалентним радикалом, вибраним з -С(О)-, -С(О)-NH-, -NH-, -С(О)-С1-С(О)-О-С1-6алкандіїлу- або -С16алкандіїлу-, 6aлкандіїлу-; (I) R1 Y R3 , R1 є воднем, галогеном, С1-6алкілокси або С16алкілом; R2 є воднем, гідрокси, С1-6алкілокси або амінокарбонілом; якщо X заміщений R2, то R2, взятий разом з -L-Z, може утворювати двовалентний радикал формули -C(O)-NH-CH 2-NR10-, (а-1) де R10 є фенілом; R3 є воднем або С 1-6алкілокси; Z є аміно, ціано або радикалом, вибраним з 7 85593 O R8 N 8 N HN O R7 R5 R5 N R6 (b-2) , (b-1) , R5 R6 (b-4) , (b-3) , R5 O HN R5 N R5 N N R6 (b-5) , N R5 (b-6) , R5 NH (b-7) , (b-8) , R5 R5 N N S N (b-9) , O NH O (b-11) , (b-10) , де кожний з R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6алкілу або С 16алкілокси; або R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули -CH2-CR92-O-, (с-1) -(СН2)3-О-, (с-2) -О-(СН2)2-О- (с-3) або -СН=СН-СН=СН-, (с-4) де кожен R9 незалежно вибирають з водню або С16алкілу. 9. Застосування за п. 8 інгібітору PARP формули (І) для виробництва лікарського засобу для лікування захворювання, опосередкованого PARP-1. 10. Застосування за будь-яким з пп. 8 або 9, де лікування включає хіміосенсибілізацію. 11. Застосування за будь-яким з пп. 8 або 9, де лікування включає радіосенсибілізацію. 12. Комбінація сполуки з хіміотерапевтичним агентом, де зазначеною сполукою є сполука формули (І) R2 Z L X N N C1 -6aлкандіїл-NH N її N-оксиди, фармацевтично прийнятні адитивні солі і стереохімічно ізомерні форми, де пунктирні лінії означають необов'язкові зв'язки; X є >N- або >СН-; -N Y - є -N-C(O)- або -N=CR4-, де R4 є гідрокси; L є прямим зв'язком або двовалентним радикалом, вибраним з -С(О)-, -С(О)-NH-, -NH-, -С(О)-С1-С(О)-О-С1-6алкандіїлу- або -С16алкандіїлу-, 6aлкандіїлу-; (I) R1 Y R3 , R1 є воднем, галогеном, С1-6алкілокси або С16алкілом; R2 є воднем, гідрокси, С1-6алкілокси або амінокарбонілом; якщо X заміщений R2, то R2, взятий разом з -L-Z, може утворювати двовалентний радикал формули -C(O)-NH-CH 2-NR10-, (а-1) де R10 є фенілом; R3 є воднем або С 1-6алкілокси; Z є аміно, ціано або радикалом, вибраним з 9 85593 O R8 N 10 N HN O R7 R5 R5 N R6 R6 (b-1) , (b-2) R5 , (b-3) (b-4) , , R5 O HN R5 N R5 N R6 (b-5) N R5 N R5 (b-6) , , NH (b-7) , (b-8) , R5 R5 N N S (b-9) N , O (b-11) , (b-10) , де кожний з R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6алкілу або С 16алкілокси; або R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули -CH2-CR92-O-, (с-1) -(СН2)3-О-, (с-2) -О-(СН2)2-О- (с-3) або -СН=СН-СН=СН-, (с-4) NH O де кожен R9 незалежно вибирають з водню або С16алкілу. 13. Спосіб одержання сполуки за п. 1, який відрізняється тим. що здійснюють взаємодію проміжної сполуки формули (II) із проміжною сполукою формули (III), в якій W є прийнятною групою, що відходить, з одержанням сполуки формули (I), де L є С1-6алкандіїл-NH- і обидві пунктирні ліній можуть бути зв'язками, в реакційноінертному розчиннику з додаванням відповідної основи R2 Z L X N C1-6aлкандіїл-NH2 + N W N (II) (III) R2 Z L X R1 Y N N C1-6aлкандіїл-NH N (I) Даний винахід відноситься до інгібіторів PARP і представляє сполуки та композиції, що містять розкриті сполуки. Далі, даний винахід представляє способи застосування розкритих інгібіторів PARP, наприклад, як лікарського засобу. Ядерний фермент полі(ADPрибоза)полімерази-1 (PARP-1) являє собою член сімейства ферментів PARP. Це зростаюче сімейство ферментів складається з таких PARP як, на R3 R1 Y R3 . приклад, PARP-1, PARP-2, PARP-3 і Vault-PARP; і танкіраз (TANK), таких як, наприклад, TANK-1, TANK-2 і TANK-3. PARP також позначають як полі(аденозин 5’-дифосфорибоза)полімераза або PARS (полі(ADP-рибоза)синтетаза). PARP-1 є основним ядерним білком 116кДа, що складається з трьох доменів: N-кінцевого ДНКзв’язуючого домену, що містить два цинкових «пальці», аутомодифікаційного домену і С-кінцевого 11 85593 12 каталітичного домену. Він присутній практично у від нормального рівня. Такий сценарій особливо всіх еукаріотах. Фермент синтезує полі(ADPпагубний при ішемії, коли втрата кисню вже надмірибозу), розгалужений полімер, що може складарно підриває вихід клітинної енергії. Подальше тися з близько 200 одиниць ADP-рибози. Білкові утворення вільних радикалів під час реперфузії акцептори полі(ADP-рибози) безпосередньо або вважається основною причиною ушкодження ткаопосередковано залучені в збереження цілісності нин. Деяке падіння АТФ, що типово в багатьох ДНК. Вони включають гістони, топоізомерази, ДНК органах під час ішемії і реперфузії, може бути і РНК полімерази, ДНК лігази та Ca2+- і Mg2+пов’язане зі зменшенням NAD+ внаслідок круговозалежні ендонуклеази. PARP білок експресується роту полі(ADP-рибози). Таким чином, очікується, в значних кількостях в багатьох тканинах, найбіщо інгібування PARP і PARG зберігає рівень клільше помітно в імунній системі, серці, мозку та тинної енергії, тим самим підсилюючи виживання лініях зародкових клітин. У нормальних фізіологічішемічних тканин після інсульту. них умовах активність PARP мінімальна. Однак Синтез полі(ADP-рибози) також залучений в ушкодження ДНК викликає негайну активацію індуковану експресію ряду генів, істотних для заPARP практично в 500-кратному розмірі. пальної реакції. Інгібітори PARP придушують виТанкірази (TANK) ідентифіковані як компоненроблення індуцибельної синтази окису азоту ти людського теломерного комплексу. Було при(iNOS) у макрофагах, селектину Р-типу та молекупущено, що вони також відіграють роль у трансполи-1 міжклітинної адгезії (ICAM-1) в ендотеліальрті везикул і можуть служити як каркас для білків, них клітинах. Така активність лежить в основі сизалучених у різні інші клітинні процеси. Теломери, льної протизапальної дії, що викликається що є істотними для збереження і стабільності хроінгібіторами PARP. Інгібування PARP здатне знимосом, зберігаються теломеразою, спеціалізовано жувати некроз шляхом запобігання транслокації та зворотною транскриптазою. TANK являють собою інфільтрації нейтрофілів в ушкоджених тканинах. (ADP-рибоза)трансферази, що мають деякі харакPARP активується ушкодженими фрагментами теристики як сигнальних, так і цитоскелетних білДНК і, при активації, каталізує приєднання аж до ків. Вони містять PARP домен, що каталізує полі100 одиниць ADP-рибози до безлічі ядерних білків, ADP-рибозилювання субстратних білків, стерильвключаючи гістони та самі PARP. Під час основних ного альфа-мотиву, загального з деякими сигнаклітинних стресів значна активація PARP може льними молекулами, та ANK-домен, що містить 24 швидко привести до ушкодження або смерті клітин повтори анкірину, що є гомологами цитоскелетночерез виснаження запасів енергії. Оскільки чотири го білка анкірина. ANK-домен взаємодіє з теломемолекули АТФ використовуються для кожної регерним білком, що зв’язує теломерний повтор факнерованої молекули NAD+, NAD+ виснажується при тором-1 (TRF-1). Тому ці білки названі TRF1значній активації PARP, при спробах повторно взаємодіючими, анкірин-спорідненими ADPсинтезувати NAD+ АТФ також може виснажитися. рибоза-полімеразами (TANK). Було описано, що активація PARP відіграє Однієї з найбільш специфічних функцій TANK ключову роль як у NMD A-, так і NO-викликаній є ADP-рибозилювання TRF-1. Функція людського нейротоксичності. Це було продемонстровано в теломера вимагає два теломер-специфічних ДНКкоркових культура х та в гіпокампальних зрізах, де зв’язуючих білків, TRF-1 і TRF-2. TRF-2 захи щає попередження токсичності прямо співвідноситься з кінці хромосом і TRF-1 регулює довжину теломера. ефективністю інгібування PARP. Так була визнаADP-рибозилювання інгібує здатність TRF-1 чена потенційна роль інгібіторів PARP у лікуванні зв’язуватися з теломерною ДНК. Таке полі-ADPнейродегенеративних захворювань і травм голови, рибозилювання TRF-1 вивільняє TRF-1 з теломенавіть якщо точний механізм дії усе ще не був рів, відкриваючи теломерний комплекс і забезпез’ясований. чуючи доступ до теломерази. Тому TANK діє як Так само було продемонстровано, що одиничпозитивний регулятор довжини теломеру, дозвоні ін’єкції інгібіторів PARP знижують розмір інфаркляючи подовження теломерів за допомогою телоту, викликаного ішемією та реперфузією серця або мерази. кістякових м’язів у кроликів. У цих дослідженнях Серед багатьох функцій, що приписуються одинична ін’єкція 3-амінобензаміду (10 мг/кг), або PARP, та особливо PARP-1, його основна роль за хвилину до оклюзії, або за хвилину до реперфуполягає у сприянні репарації ДНК шляхом ADPзії, викликає подібне зниження розміру інфаркту в рибозилювання і, отже, координування ряду білків серці (32-42 %), у той час як 1,5репарації ДНК. У результаті активації PARP значно дигідроксіізохінолін (1 мг/кг), інший інгібітор PARP, зменшуються рівні NAD+. Тривала активація PARP знижує розмір інфаркту в порівнянному ступені веде до важкого виснаження NAD+ у клітинах, що (38-48 %). Ці результати дозволяють зробити ростраждають від значного ушкодження ДНК. Коротзумне припущення, що інгібітори PARP можуть кий період напіврозпаду полі(ADP-рибози) дає відновлювати серце з вже наявною ішемією або швидку інтенсивність кругообігу. Як тільки поушкоджену реперфузією тканину кістякових м’язів. лі(ADP-рибоза) сформується, вона швидко деграАктивація PARP також може застосовуватися дує за допомогою конститутивно активної пояк міра ушкодження після нейротоксичного інсульлі(ADP-рибози)глікогідролази (PARG), разом з ту в результаті впливу кожного з наступних індукфосфодіестеразою і (ADP-рибоза)протеїнліазою. торів, таких як глутамат (через стимулювання реPARP і PARG утворюють цикл, що перетворює цептора NMDA), реакційноздатні проміжні сполуки велику кількість NAD+ у ADP-рибозу. Менш чим за кисню, амілоїдного b-білка, N-метил-4-фенілгодину надмірне стимулювання PARP може при1,2,3,6-тетрагідропіридину (МРТР) або його активвести до падіння NAD+ та АТФ менш ніж до 20 % ний метаболіт N-метил-4-фенілпіридин (МРР+), що 13 85593 14 беруть участь у патологічних станах, таких як як невропатичний біль, такий як біль, викликаний удар, хвороба Альцгеймера та хвороба Паркінсохронічним ушкодженням скорочень (CCI) загальнона. Інші дослідження були продовжені для аналізу го сідничного нерва, та при якому відбувається ролі активації PARP у мозжечкових нервових клітранссиноптична зміна спинного рогоподібного тинах-зернах in vitro, та в МРТР нейротоксичності. відростка спинного мозку, що характеризується Надлишковий вплив на нерви глутамата, що слувиникненням гіперхроматозу цитоплазми і нуклеожить переважним нейротрансмітером центральної плазми (так звані «темні» нейрони). нервової системи і діє на рецептори N-метил-DТакож існує доказ того, що інгібітори PARP коаспартата (NMDA) та рецепторів інших підтипів, рисні для лікування запального захворювання кинайбільш часто виникає в результаті удару або шечнику, такого як коліт. Більш конкретно, коліт інших нейродегенеративних процесів. Позбавлені викликають у пацюків внутрішньопорожнинним кисню нейрони виділяють глутамат у великих кільвведенням гаптену тринітробензолу сульфонової костях під час ішемічного інсульту мозку, наприкислоти в 50 % етанолі. Оброблені пацюки одерклад, під час удару або серцевого приступу. Таке жують 3-амінобензамід, специфічний інгібітор акнадлишкове виділення глутамату, у свою чергу, тивності PARP. Інгібування активності PARP знивикликає надмірне стимулювання (ексцитотоксичжує запальну реакцію і відновлює морфологію та ність) N-метил-D-аспартата (NMD A), AMPA, Каїнаенергетичний статус дистальної частини товстої та та MGR рецепторів, що відкривають іонні канакишки. ли і викликають неконтрольований потік іонів Інші докази дозволяють припустити, що інгібі(наприклад, Са2+ і Na+ у клітини і К+ із клітин), що тори PARP придатні для лікування артриту. Далі, приводить до надмірного стимулювання нейронів. схоже, що інгібітори PARP придатні для лікування Надмірно стимульовані нейрони виділяють більше діабетів. Було показано, що інгібітори PARP приглутамату, створюючи контур зворотного зв’язку датні для лікування ендотоксичного шоку або сепабо ефект доміно, що зрештою викликає ушкотичного шоку. дження або смерть клітин через утворення протеІнгібітори PARP також застосовують для проаз, ліпаз і вільних радикалів. Надлишкова активадовження ресурсу і проліферативної здатності ція рецепторів глутамату залучена в різні клітин, включаючи лікування захворювань, таких неврологічні захворювання і стани, включаючи як старіння шкіри, хвороба Альцгеймера, атероепілепсію, удар, хворобу Альцгеймера, хворобу склероз, остеоартрит, остеопороз, м’язова дисПаркінсона, бічний аміотрофічний склероз (ALS), трофія, дегенеративні захворювання кістякових хворобу Хантингтона, шизофренію, хронічний біль, м’язів, включаючи реплікативне старіння, вікову ішемію та втрату нейронів внаслідок гіпоксії, гіподегенерацію м’язів, імунне старіння, СНІД і інші глікемії, ішемії, травми та ушкодження нервів. імунні вікові захворювання; і для зміни експресії Вплив глутамату і стимулювання також розглядагенів у старіючих клітинах. ється як основа для нав’язливих розладів, особлиТакож відомо, що інгібітори PARP, такі як 3во залежності від лікарських засобів. Докази вклюамінобензамід, діють на загальну репарацію ДНК у чають відкриття, зроблені для багатьох видів відповідь на, наприклад, пероксид водню або іонітварин, а також для культур кори головного мозку, зуюче випромінювання. підданих впливові глутамату або NMDA, про те, Основна роль PARP у репарації обірваних лащо антагоністи рецептора глутамату (тобто сполунцюгів ДНК добре відома, особливо якщо викликаки, що блокують зв’язування глутамату або актиється безпосередньо іонізуючим випромінюванням вацію його рецептора) блокують ушкодження нерабо, опосередковано, після ферментної репарації вів внаслідок інсульту судин. Спроби запобігти ушкоджень ДНК, викликаних метилуючими агентоксичності ex cito блокуванням NMDA, AMPA, тами, інгібіторами топоізомерази I та іншими хіміокаїнату і MGR рецепторів виявилися важкими, тотерапевтичними агентами, такими як цисплатин і му що кожен рецептор має безліч місць, з якими блеоміцин. Безліч досліджень із застосуванням може зв’язуватися глутамат, та, отже, пошук ефек«нокаутованих» мишей, моделей трансдомінанттивної суміші антагоністів або універсального анного інгібування (надекспресії ДНК-зв’язуючого тагоніста, що запобігає зв’язуванню глутамату з домену), антисенсових інгібіторів та інгібіторів з усіма рецепторами і що дозволяє перевірити цю низькою молекулярною масою продемонстрували теорію, утр уднений. Більш того, багато композицій, роль PARP у репарації і виживанні клітин після що е фективні при блокуванні рецепторів, також ушкодження ДНК. Інгібування ферментативної токсичні для тварин. В даний час не існує відомого активності, опосередкованої PARP, повинне приефективного лікування глутаматних аномальносвести до посилення чутли вості пухлинних клітин тей. до лікування, що ушкоджує ДНК. Стимулювання рецепторів NMDA глутаматом, Було показано, що інгібітори PARP є ефективнаприклад, активує фермент синтазу нейронного ними при радіосенсибілізації (гіпоксичних) пухлинокису азоту (nNOS), що приводить до утворення них клітин, та є ефективними в запобіганні відновокису азоту (NO), що також опосердковує нейротолення пухлинних клітин після потенційно ксичність. NMDA нейротоксичність може бути відлетального і сублетального ушкодження ДНК після вернена обробкою інгібіторами синтази окису азорадіаційної терапії, очевидно завдяки їх здатності ту (NOS) або через цільове генетичне руйнування запобігати воз’єднанню розривів ланцюгів ДНК і nNOS in vitro. впливати на деякі сигнальні шляхи ушкодження Іншим застосуванням інгібіторів PARP є лікуДНК. вання ушкоджень периферійних нервів і результуІнгібітори PARP застосовували для лікування ючого патологічного больового синдрому, відомого раку. Крім того, у патенті US 5177075 описано де 15 85593 16 кілька ізохінолінів, які застосовують для посилення властивості, що стимулюють шлунково-кишкову летального впливу іонізуючого випромінювання моторику. Зокрема, описані сполуки №№ 8, 6 і 9 або хіміотерапевтичних агентів на пухлинні клітиданої заявки. ни. В «Effect of 6-(5-Phenanthridinone), an Inhibitor В ЕР 885190, опублікованому 23 грудня 1998, of Poly(ADP-ribose)Polymerase, on Cultured Tumor описані 1,4-дизаміщені похідні піперидину, що маCells», Oncol. Res., 6:9, 399-403 (1994), обговорюють гастрокінетичні властивості. Зокрема, описана ється інгібування активності PARP, зниження просполука №7 даної заявки. ліферації пухлинних клітин і значний синергетичВ ЕР 1036073, опублікованому 17 червня ний ефект при спільній обробці пухлинних клітин 1999, описані заміщені похідні хіназоліндіону. Опиалкілуючим лікарським засобом. сані сполуки мають фундальні розслаблюючі влаОгляди відомого рівня техніки представлені в стивості. Li and Zhang in IDrugs 2001, 4 (7): 804-812, by Ame В ЕР 1355888, опублікованому 20 червня et al in Bioassays 2004, 26: 882-883 and by Nguewa 2002, описані похідні хіназолінону як інгібітори et al., in Progress in Biophysic & Molecular Biology PARP. 2005, 88: 143-172. Даний винахід відноситься до сполук формули Дотепер існує необхідність в ефективних та (I) сильнодіючих інгібіторах PARP, більш конкретно, в інгібіторах PARP-1, що дають мінімальні побічні ефекти. У даному винаході представлені сполуки, (І) композиції і способи інгібування активності PARP для лікування раку і/або профілактики ушкодження , клітин, тканин і/або органів внаслідок ушкодження їх N-оксидів, фармацевтично прийнятних адиабо смерті клітин, викликаних, наприклад, некротивних солей і стереохімічно ізомерних форм, де зом або апоптозом. Сполуки та композиції відповіпунктирні лінії означають необов’язкові дно до даного винаходу особливо корисні для позв’язки; силення ефективності хіміотерапії і радіотерапії, Х є >N- або >CH-; де первинним ефектом лікування є ушкодження -N---Y- є –N-C(O)- або –N=CR4-, де R4 є гідроДНК в цільових клітинах. кси; У GB 1062357, опублікованому 22 березня L є прямим зв’язком або двовалентним ради1967, описані похідні хіназолону, що мають антигікалом, вибраним з -C(O)-, -C(O)-NH-, -NH-, -C(O)пертензивну дію. С1-6 алкандіїлу-, -C(O)-O-С 1-6 алкандіїлу- або -С1У DE 2258561, опублікованому 20 червня 6 алкандіїлу-; 1973, описані заміщені похідні піридинону з антигіR1 є воднем, галогеном, С1-6 алкілокси або С 1пертензивною дією. 6 алкілом; В ЕР 13612, опублікованому 11 листопаду R2 є воднем, гідрокси, С1-6 алкілокси або амі1983, описані заміщені похідні піперидинілалкілхінокарбонілом; назоліну. Описані сполуки є антагоністами серотоякщо Х заміщений R2, то R2, взятий разом з – ніну. L-Z, може утворювати двовалентний радикал фоВ ЕР 669919, опублікованому 9 червня 1994, рмули описані диметилбензофурани і диметилбензопіра-C(O)-NH-CH 2-NR10(a-1) ни як антагоністів 5-НТ3. Більш конкретно, описані де R10 є фенілом; сполуки №№ 8, 4, 5, 10, 11, 12, 13, 15, 16, 17 і 14 R3 є воднем або С 1-6 алкілокси; даної заявки. Z є аміно, ціано або радикалом, вибраним з У US 5374637, опублікованому 20 грудня 1994, описані похідні бензаміду. Описані сполуки мають , 17 85593 де кожний з R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6 алкілу або С 16 алкілокси; або R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули -CH2-CR92-O(с-1), -(CH2)3-O(c-2), -O-(CH2)2-O(c-3) або -CH=CH-CH=CH(c-4), де кожен R9 незалежно вибирають з водню або С1-6 алкілу; за умови, що якщо Х є >N-, то Z є відмінним від радикалу (b2) і якщо Х є >CH- і L є -C(O)-NH- або -С(O)-O-С17 8 6 алкандіїлом і Z є радикалом (b-2) і R та R , взяті разом, утворюють двовалентний радикал формули (с-1), (с-2) або (с-3), то R5 є відмінним від хлору. Сполуки формули (I) також можуть існувати в таутомерних формах. Такі форми, хоча і не зазначені докладно в представленій вище формулі, включені в обсяг даного винаходу. Ряд термінів, що застосовуються у представлених вище визначеннях і далі в описі, пояснені нижче. Ці терміни іноді застосовуються як такі або в складі складних термінів. У представлених вище визначеннях і далі в описі галоген відноситься до фтору, хлор у, брому та йоду; С1-6 алкіл відноситься до прямих та розгалужених насичених вуглеводневих радикалів, що містять від 1 до 6 атомів вуглецю, таким як, наприклад, метил, етил, пропіл, бутил, пентил, гексил, 1метилетил, 2-метилпропіл, 2-метилбутил, 2метилпентил та подібні; С1-6 алкандіїл відноситьсядо двовалентних прямих та розгалужених насичених вуглеводневих радикалів, що містять від 1 до 6 атомів вуглецю, таким як, наприклад, метилен, 1,2-етандіїл, 1,3-пропандіїл, 1,4-бутандіїл, 1,5пентандіїл, 1,6-гександіїл, та до їх розгалужених ізомерів, таких як 2-метилпентандіїл, 3метилпентандіїл, 2,2-диметилбутандіїл, 2,3диметилбутандіїл та подібні. Термін «фармацевтично прийнятні солі» означає фармацевтично прийнятні кислотно- або основно-адитивні солі. Фармацевтично прийнятні кислотно- або основно-адитивні солі в даному описі включають терапевтично активні нетоксичні кислотно- і нетоксичні основно-адитивні солі, що можуть утворювати сполуки формули (I). Сполуки формули (I), що мають основні властивості, можуть бути перетворені в їх фармацевтично прийнятні кислотно-адитивні солі обробкою зазначеної основної форми відповідною кислотою. Прийнятні кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад, хлороводнева або бромоводнева кислота; сірчана; азотна; фосфорна і подібна кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропанова, гідроксіоцтова, молочна, піровиноградна, щавлева, малонова, бурштинова (тобто бутандіонова кислота), малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламінова, саліцилова, п-аміносаліцилова, памова та подібні кислоти. 18 Сполуки формули (I), що мають кислотні властивості, можуть бути перетворені в їх фармацевтично прийнятні основно-адитивні солі обробкою кислотної форми прийнятною органічною або неорганічною основою. Прийнятні основні солі можуть включати, наприклад, амонієві солі, солі лужних і лужноземельних металів, наприклад, солі літію, натрію, калію, магнію, кальцію і подібних, солі з органічними основами, наприклад, солі бензатину, N-метил-D-глюкаміну, гідробаміну, та солі з амінокислотами, такими як, наприклад, аргінін, лізин та подібні. Терміни «кислотно- або основно-адитивна сіль» включають гідрати і сольватні адитивні форми, що можуть утворювати сполуки формули (I). Приклади таких солей включають, наприклад, гідрати, алкоголяти та подібні. Термін «стереохімічно ізомерні форми» сполук формули (I) у даному описі визначає всі можливі сполуки, утворені тими ж атомами, зв’язаними тими ж послідовностями зв’язків, але які мають різні тривимірні структури, що не є взаємозамінними, котрі можуть утворювати сполуки формули (I). Якщо не зазначено інше, хімічні позначення сполук включають суміш усіх можливих стереохімічно ізомерних форм, які зазначена сполука може мати. Зазначена суміш може містити всі діастереомери і/або енантіомери основної молекулярної структури зазначеної сполуки. Усі стереохімічно ізомерні форми сполук формули (I), у чистій формі та у суміші одна з одною, включені в обсяг даного винаходу. N-оксиди сполук формули (I) включають сполуки формули (I), в яких один або декілька атомів азоту окиснені до так названого N-оксиду, особливо ті N-оксиди, в яких один або більше атомів азоту піперидина або піперазина N-окиснені. Як застосовується в даному описі, термін «сполуки формули (I)» включає також N-оксиди, фармацевтично прийнятні кислотно- або основноадитивні солі та всі стереоізомерні форми. У GB 1062357 описані похідні хіназолону, що мають антигіпертензивні властивості. У DE 2258561 описані заміщені похідні піридинону з антигіпертензивною дією. В ЕР 13612 описані заміщені похідні піперидинілалкілхіназоліну, що є антагоністами серотоніну. В ЕР 669919 описані диметилбензофурани і диметилбензопірани як антагоністи 5-НТ3. В US 5374637 описані похідні бензаміду, що мають властивості, які стимулюють моторику шлунково-кишкового тракту. В ЕР 885190 описані 1,4-дизаміщені похідні піперидину, що мають гастрокінетичні властивості. В ЕР 1036073 описані заміщені похідні хіназоліндіону, що мають фундальні розслаблюючі властивості. Несподівано було виявлено, що сполуки відповідно до даного винаходу демонструють інгібуючу дію по відношенню до PARP. Перша група сполук, що представляють інтерес, включає такі сполуки формули (I), до яких застосовується одне або більше з наступних обмежень: а) кожен Х є >N-; b) L є двовалентним радикалом, вибраним з C(O)-, -C(O)-NH-, -NH-, -C(O)-С1-6 алкандіїлу-, 19 85593 20 C(O)-O-С1-6 алкандіїлу- або С1-6 алкандіїлу-; а) L є прямим зв’язком або двовалентним рас) R1 є воднем; дикалом, вибраним з -C(O)-, -C(O)-NH- або -C(O)d) R2 є гідрокси, С1-6 алкілокси або амінокарбоС1-6 алкандіїлу-; нілом; b) R 2 є воднем, гідрокси або С 1-6 алкілокси; е) Z є аміно, ціано або радикалом, вибраним з с) Z є радикалом, вибраним з (b-2), (b-3), (b-4), (b-1), (b-3), (b-4), (b-5), (b-6), (b-7), (b-8) або (b-9); (b-5), (b-6), (b-7), (b-8) або (b-9); f) кожен R5 та R6 незалежно вибирають з водd) кожен R5, R6, R7 та R8 незалежно вибирають ню або аміно. з водню, галогену, аміно, С1-6 алкілу або С 1Друга гр упа сполук, що представляють інте6 алкілокси; або рес, включає такі сполуки формули (I), до яких е) R7 та R8, взяті разом, можуть утворювати застосовується одне або більше з наступних обдвовалентний радикал формули (с-1), (с-2), (с-3) межень: або (с-4). а) кожен Х є >СН-; П’ята група сполук, що представляють інтерес, b) L є прямим зв’язком або двовалентним равключає такі сполуки формули (I), до яких застодикалом, вибраним з -C(O)-, -NH-, -C(O)-С1совується одне або більше з наступних обмежень: а) L є прямим зв’язком; 6 алкандіїлу- або С 1-6 алкандіїлу-; с) Z є аміно, ціано або радикалом, вибраним з b) R 1 є воднем, галогеном або С1-6 алкілом; (b-1), (b-3), (b-4), (b-5), (b-6), (b-7), (b-8) або (b-9); с) R2 є воднем; 5 d) кожен R незалежно вибирають з водню, d) R 3 є воднем; фтор у, йоду, брому, аміно, С1-6 алкілу або С1е) Z є радикалом, вибраним з (b-5) або (b-7); f) кожен R5 незалежно вибирають з водню або 6 алкілокси; 6 е) кожен R незалежно вибирають з водню, галогену. хлору, йоду, брому, аміно, С1-6 алкілу або С1Група переважних сполук включає такі сполуки формули (I), в яких L є прямим зв’язком або дво6 алкілокси. Третя група сполук, що представляють інтевалентним радикалом, вибраним з -C(O)-, -C(O)рес, включає такі сполуки формули (I), до яких NH- або -C(O)-С1-6 алкандіїлу-; R 2 є воднем, гідрозастосовується одне або більше з наступних обкси або С1-6 алкілокси; Z є радикалом, вибраним з межень: (b-2), (b-3), (b-4), (b-5), (b-6), (b-7), (b-8) або (b-9); а) L є прямим зв’язком або двовалентним ракожен R5, R6, R7 та R8 незалежно вибирають з водикалом, вибраним з -C(O)- або -C(O)-NH-; дню, галогену, аміно, С1-6 алкілу або С 1-6 алкілокси; b) R 2 є воднем, гідрокси або С 1-6 алкілокси; або R7 та R8, взяті разом, можуть утворювати двос) Z є радикалом, вибраним з (b-2), (b-3), (b-4), валентний радикал формули (с-1), (с-2), (с-3) або (b-5), (b-6), (b-7), (b-8) або (b-9); (с-4). d) кожен R5, R6, R7 та R8 незалежно вибирають Група більш переважних сполук включає такі з водню, галогену, С1-6 алкілу або С 1-6 алкілокси; сполуки формули (I), в яких L є прямим зв’язком; або R1 є воднем, галогеном або С 1-6 алкілом; R2 є воде) R7 та R8, взяті разом, можуть утворювати нем; R3 є воднем; Z є радикалом, вибраним з (b-5) двовалентний радикал формули (с-1) або (с-4). або (b-7); і кожен R5 незалежно вибирають з водню Четверта група сполук, що представляють інабо галогену. терес, включає такі сполуки формули (I), до яких Найбільш переважними сполуками є сполуки застосовується одне або більше з наступних об№35, №36, №39, №1 і №43. межень: Сполука 35 Сполука 36 Сполука 39 Сполука 1 Сполука 43 21 85593 22 Сполуки формули (I) можуть бути отримані за допомогою загальних методів, описаних в ЕР 1036073, ЕР 885190, US 5374637, ЕР 669919 і ЕР 13612. Вихідні речовини та деякі проміжні сполуки є відомими сполуками і комерційно доступні або можуть бути отримані звичайними реакційними методиками, відомими в даній області техніки. Деякі способи одержання більш докладно представлені нижче. Інші способи одержання кінцевих сполук формули (I) описані в прикладах. Сполуки формули (I) можуть бути отримані взаємодією проміжної сполуки формули (II) із проміжною сполукою формули (III), в якій W є прийнятною групою, що відходить, такою як, наприклад, галоген, наприклад, фтор, хлор, бром або йод, або сульфонілокси радикалом, таким як метилсульфонілокси, 4-метилфенілсульфонілокси та подібні. Реакція може проводитися в реакційноінертному розчиннику, такому як, наприклад, спирт, напри клад, метанол, етанол, 2-метоксіетанол, пропанол, бутанол та подібні; простий ефір, наприклад, 4,4діоксан, 1,1’-оксибіспропан та подібні; або кетон, наприклад, 4-метил-2-пентанон, N,Nдиметилформамід, нітробензол та подібні. Додавання прийнятної основи, такої як, наприклад, карбонат або гідрокарбонат лужного або лужноземельного металу, наприклад, триетиламіну або карбонату натрію, може застосовуватися для зв’язування кислоти, що вивільняється під час реакції. Невелика кількість прийнятного йодиду металу, наприклад, йодиду натрію або калію, може бути додана для прискорення реакції. Перемішування може поліпшити швидкість реакції. Реакція прийнятним чином може бути проведена при температурі в інтервалі від кімнатної температури до температури кипіння реакційної суміші зі зворотним холодильником і, при бажанні, реакція може бути проведена при підвищеному тиску. Сполуки формули (I) також можуть бути перетворені одна в одну відомими в даній області техніки реакціями або трансформаціями функціональних груп. Деякі з подібних трансформацій вже описані вище. Інші приклади включають гідроліз складних ефірів карбонової кислоти до відповідної карбонової кислоти або спирту; гідроліз амідів до відповідних карбонових кислот або амінів; гідроліз нітрилів до відповідних амідів; аміногрупи на імідазолі або фенілі можуть бути замінені на водень відомими в даній області техніки реакціями діазотування і наступною заміною діазогрупи на водень; спирти можуть бути перетворені в складні ефіри та прості ефіри; первинні аміни можуть бути перетворені у вторинні або третинні аміни; подвійні зв’язки можуть бути гідровані до відповідних одинарних зв’язків; йодорадикал на фенільній групі може бути перетворений у гр упу складного ефіру введенням моноксиду вуглецю в присутності прийнятного паладієвого каталізатора. Даний винахід також відноситься до сполуки формули (I), такої як описано вище, для застосування в медицині. Сполуки відповідно до даного винаходу мають інгібуючі властивості у відношенні PARP, як може бути видно з експериментальної частини, представленої нижче. Термін «PARP» у даному описі відноситься до білка, що має полі-АDР-рибозилюючу дію. У межах значення цього терміна PARP включають усі білки, кодовані parp геном, їх мутанти та їх альтернативні фрагменти білків. Крім того, у даному описі термін «PARP» включає аналоги PARP, гомологи PARP і аналоги PARP інши х тварин. Термін «PARP» включає, але не обмежується, PARP-1. В значення даного терміна також можуть бути включені PARP-2, PARP-3, Vault-PARP (PARP-4), PARP-7 (TiPARP), PARP-8, PARP-9 (Bal), PARP-10, PARP-11, PARP-12, PARP-13, PARP-14, PARP-15, PARP-16, TANK-1, TANK-2 і TANK-3. Сполуки, що інгібуют як PARP-1, так і танкіразу 2, можуть мати переважні властивості в тому, що вони мають поліпшену дію, інгібуючи ріст в ракових клітинах. Даний винахід також включає застосування сполук при одержанні лікарських засобів для лікування будь-яких описаних в даній заявці захворювань і розладів у тварин, де зазначені сполуки є сполуками формули (I) (І) , їх N-оксидами, фармацевтично прийнятними адитивними солями і стереохімічно ізомерними 23 85593 24 формами, де С1 6алкілом; пунктирні лінії означають необов’язкові R2 є воднем, гідрокси, С1-6 алкілокси або амізв’язки; нокарбонілом; Х є >N- або >CH-; якщо Х заміщений R2, то R2, взятий разом з 4 4 -N---Y- є –N-C(O)- або -N=CR -, де R є гідроL-Z, може утворювати двовалентний радикал фокси; рмули L є прямим зв’язком або двовалентним ради-C(O)-NH-CH 2-NR10(a-1) калом, вибраним з -C(O)-, -C(O)-NH-, -NH-, -C(O)де R10 є фенілом; С1-6 алкандіїлу-, -C(O)-O-С1-6 алкандіїлу- або - С1R3 є воднем або С 1-6 алкілокси; алкандіїлу-; Z є аміно, ціано або радикалом, вибраним з 6 R1 є воднем, галогеном, С1-6 алкілокси або , де кожний з R5, R6, R7 та R8 незалежно вибирають з водню, галогену, аміно, С1-6 алкілу або С 16 алкілокси; або R7 та R8, взяті разом, можуть утворювати двовалентний радикал формули -CH2-CR92-O(с-1), -(CH2)3-O(c-2), -O-(CH2)2-O(c-3) або -CH=CH-CH=CH(c-4), де кожен R9 незалежно вибирають з водню або С1-6 алкілу. Далі, даний винахід також відноситься до застосування сполуки, описаної вище, для виробництва лікарського засобу для лікування розладу, опосередкованого PARP. Зокрема, даний винахід відноситься до застосування сполуки, описаної вище, для виробництва лікарського засобу для лікування розладу, опосередкованого PARP. Сполуки, що інгібують як PARP-1, так і TANK-2, можуть мати переважні властивості в тому, що вони мають підвищену рост-інгібуючу дію в ракових клітинах. У світлі їх PARP-зв’язуючих властивостей, сполуки відповідно до даного винаходу можуть застосовуватися як стандартні сполуки або ізотопні індикатори, коли один з атомів молекули може бути замінений на, наприклад, радіоактивний ізотоп. Для одержання фармацевтичних композицій відповідно до даного винаходу, е фективну кількість визначеної сполуки, у вигляді основно- або кислотно-адитивної солі, як активний інгредієнт, поєднують в однорідну суміш з фармацевтично прийнятним носієм, де носій може мати безліч форм в залежності від форми композиції, бажаної для введення. Такі фармацевтичні композиції мають, бажано, одиничну дозовану форму, що підходить, переважно, для перорального, ректального, трансдермального або парентерального введення. Наприклад, при одержанні композицій у пероральній дозованій формі може застосовуватися будьяке звичайне фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти та подібні для пероральних рідких композицій, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, цукри, каолін, лубриканти, зв’язуючі агенти, агенти дезинтеграції та подібні для порошків, пігулок, капсул і таблеток. Завдяки простоті їх введення, таблетки і капсули є найбільш переважною пероральною дозованою формою, та для них, можуть застосовуватись тверді фармацевтичні носії. Для парентеральних композицій носій звичайно включає стерильну воду, принаймні, в більшій частині, хоча можуть бути включені й інші інгредієнти, наприклад, для додання розчинності. Можуть бути о тримані, наприклад, розчини для ін’єкцій, в яких носій являє собою фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину і розчину глюкози. Також можуть бути отримані суспензії для ін’єкцій, в яких застосовуються прийнятні рідкі носії, суспендуючі агенти та подібні. У композиціях, що підходять для трансдермального введення, носій необов’язково містить агент, що поліпшує проникнення, і/або прийнятний зволожуючий агент, необов’язково об’єднаний з прийнятними добавками будь-якої природи в невеликих пропорціях, де добавки не 25 85593 26 повинні створювати значний шкідливий вплив на ри, для продовження ресурсу і проліферативної шкіру. Такі добавки можуть сприяти нанесенню на здатності клітин; для зміни експресії генів у старішкіру і/або можуть бути корисні для одержання ючих клітинах; для хіміосенсибілізації і/або радіобажаних композицій. Такі композиції можуть ввосенсибілізації (гіпоксичних) пухлинних клітин. Дадитись різними шляхами, наприклад, у вигляді ний винахід також відноситься до лікування трансдермального пластиру, крапкового нанесензахворювань і станів у тварин, що включає ввеня або у вигляді мазі. Особливо переважно одердення зазначеній тварині терапевтично ефективжувати зазначені фармацевтичні композиції у виної кількості зазначених вище сполук. гляді одиничних дозованих форм для полегшення Зокрема, даний винахід відноситься до спосовведення та однорідності дозування. Одиничні бу лікування, профілактики або інгібування невродозовані форми, зазначені в описі і формулі виналогічних розладів у тварин, що включає введення ходу, відносяться до фізично дискретних одиниць, зазначеній тварині терапевтично ефективної кільщо підходять для введення у вигляді одиничної кості зазначених вище сполук. Неврологічний роздози, де кожна одиниця містить визначену кільлад вибирають із групи, що включає периферійну кість активного інгредієнта, розраховану для наневропатію, викликану фізичним ушкодженням або дання бажаної дії, в сполученні із необхідним фахворобливим станом, травматичне ушкодження рмацевтичним носієм. Приклади таких одиничних мозку, фізичне ушкодження спинного мозку, удар дозованих форм включають таблетки (включаючи пов’язаний з ушкодженням мозку, осередкову ішетаблетки з надсічками або оболонкою), капсули, мію, загальну ішемію, реперфузію, демієлінізуюче пігулки, пакетики з порошком, брикети, розчини захворювання та неврологічний розлад, для ін’єкцій або суспензій, дози в чайних ложках, пов’язаний із нейродегенерацією. дози в столових ложках та подібні, та їх форми Даний винахід також відноситься до застосурозділених багаторазових доз. вання сполук формули (I) для інгібування активноСполуки відповідно до даного винаходу мості PARP, для лікування, попередження або інгібужуть лікувати або запобігати ушкодженню тканин в вання ушкодження тканин у результаті результаті ушкодження або смерті клітин внасліушкодження клітин внаслідок некрозу або апоподок некрозу або апоптозу; можуть поліпшува ти тозу, для лікування, профілактики або інгібування ушкодження нервових або серцево-судинних тканеврологічного розладу у тварини. нин, включаючи ушкодження внаслідок осередкоТермін «профілактика нейродегенерації» вої ішемії, інфаркту міокарда та реперфузії; мовключає здатність запобігати нейродегенерації у жуть лікувати різні захворювання і стани, викликані пацієнтів, в яких нейродегенеративне захворюабо загостені активністю PARP; можуть продовжування щойно діагнозовано, або при ризику розвитвати або збільшувати ресурс або проліферативну ку нового дегенеративного захворювання, та для здатність клітин; можуть змінювати експресію генів профілактики подальшої нейродегенерації у пацістаріючих клітин; можуть радіосенсибілізувати єнтів, що вже страждають від або мають симптоми і/або хіміосенсибілізувати клітини. Загалом, інгібунейродегенеративного захворювання. вання активності PARP береже клітини від втрати Термін «лікування» у даному описі відноситься енергії, запобігаючи, у випадку нервових клітин, до будь-якого лікування захворювання і/або стану необоротній деполяризації нейронів, та, таким у тварини, особливо людини, та включає (і) профічином, забезпечуючи нейропротективну дію. лактику захворювання і/або стану від виникнення у Тому даний винахід також відноситься до спопацієнта, що може бути схильний до захворювансобу введення терапевтично ефективної кількості ня і/або стану, але в якого воно ще не діагнозовазазначених ви ще сполук у кількості, ефективній но; (ii) інгібування захворювання і/або стану, надля інгібування активності PARP, для лікування приклад, зупинка його розвитку; (iii) полегшення або попередження ушкодження тканин у результазахворювання і/або стану, наприклад, виклик реті ушкодження або смерті клітин внаслідок некрозу гресії захворювання і/або стану. або апоптозу, для впливу на активність нейронів, Термін «радіосенсибілізатор» у даному описі не опосередковану NMDA токсичністю, для впливу визначає молекулу, переважно молекулу з низьна активність нейронів, опосередковану NMDA кою молекулярною масою, що вводиться тварині в токсичністю, для лікування ушкодження нервової терапевтично ефективних кількостях для підвитканини внаслідок ішемії та реперфузії, неврологіщення чутливості клітин до іонізуючого випромічних розладів і нейродегенеративних захворюнювання і/або для сприяння лікуванню захворювань; для профілактики або лікування інсульту вань, що лікують іонізуючим випромінюванням. судин; для лікування або профілактики серцевоЗахворювання, що лікують іонізуючим випромінюсудинних захворювань; для лікування інших станів ванням, включають неопластичні захворювання, і/або розладів, таких як вікова м’язова дегенерадоброякісні і злоякісні пухлини та ракові клітини. ція, СНІД та інші імунні вікові захворювання, запаЛікування іонізуючим випромінюванням інших залення, подагра, артрит, атеросклероз, загальна хворювань, не перерахованих вище, також вклюатрофія, рак, дегенеративні захворювання кістякочено в обсяг даного винаходу. вих м’язів, включаючи реплікативне старіння, діаТермін «хіміосенсибілізатор» у даному описі бет, травма голови, запальне захворювання кишевизначає молекулу, переважно молекулу з низьчнику (таке як коліт і хвороба Крона), м’язова кою молекулярною масою, що вводиться тварині в дистрофія, остеоартрит, остеопороз, хронічний терапевтично ефективних кількостях для підвиі/або гострий біль (такий як невропатичний біль), щення чутливості клітин до хіміотерапії і/або для ниркова недостатність, ішемія сітківки, септичний сприяння лікуванню захворювань, що лікують хішок (такий як ендотоксичний шок) та старіння шкіміотерапевтичними агентами. Захворювання, що 27 85593 28 лікують хіміотерапією, включають неопластичні німоразол, мітоміцин С, RSU 1069, SR 4233, EO9, захворювання, доброякісні і злоякісні пухлини та RB 6145, нікотинамід, 5-бромдезоксіурідин (BUdR), ракові клітини. Лікування хіміотерапією інших за5-йоддезоксіурідин (IUdR), бромдезоксицитидин, хворювань, не перерахованих вище, також вклюфтордезоксіурідин (FudR), гідроксисечовину, цисчено в обсяг даного винаходу. платин та їх терапевтично ефективні аналоги і Сполуки, композиції і способи відповідно до похідні. даного винаходу особливо корисні для лікування Фотодинамічна терапія (ФДТ) ракових захвоабо профілактики ушкодження тканин в результаті рювань включає видиме світло як випромінюючий смерті або ушкодження клітин внаслідок некрозу активатор сенсибілізуючого агенту. Приклади фоабо апоптозу. тодинамічних агентів радіосенсибілізаторів вклюСполуки відповідно до даного винаходу мочають, але не обмежуються ними, наступні: похідні жуть бути «протираковими агентами», де даний гематопорфірину, фото фірин, похідні бензопорфітермін також включає «агенти проти росту пухлинрину, етиопорфірин олова, феоборбід-а, бактеріоних клітин» і «протипухлинні агенти». Наприклад, хлорофіл-а, нафталоціаніни, фталоціаніни, фтаспособи відповідно до даного винаходу застосолоціанін цинку та їх терапевтично ефективні вуються для лікування раку і хіміосенсибілізації аналоги і похідні. і/або радіосенсибілізації пухлинних клітин при раРадіосенсибілізатори можуть вводитись в кових захворюваннях, таких як ACTH-виробляючі комбінації з терапевтично ефективною кількістю пухлини, гостра лімфоцитарна лейкемія, гостра однієї або більше інших сполук, включають, але не нелімфатична лейкемія, рак кори надниркової заобмежуються ними, сполуки, що сприяють впролози, рак сечового міхура, рак мозку, рак грудей, вадженню радіосенсибілізаторів у цільові клітини; рак шийки матки, хронічна лімфоцитарна лейкесполуки, що контролюють потік терапевтичних мія, хронічна мієлоцитарна лейкемія, рак ободочагентів, живильних речовин і/або кисню в цільові ної і прямої кишки, лімфома Т-клітин шкіри, ендоклітини; хіміотерапевтичні агенти, що діють на пуметріальний рак, рак стравоходу, саркома Евінга, хлину з або без додаткового опромінення; або інші рак жовчного міхура, лейкоз ворсистих клітин, рак терапевтично ефективні сполуки для лікування голови і шиї, лімфома Ходжкіна, саркома Капоши, раку або інших захворювань. Приклади додаткорак нирок, рак печінки, рак легень (дрібноклітинний вих терапевтичних агентів, що можуть застосовуі недрібноклітинний), злоякісний очеревинний виватися в комбінації з радіосенсибілізаторами, пот, злоякісний плевральний випот, меланома, включають, але не обмежуються ними, 5мезотеліома, множинна мієлома, нейробластома, фтор урацил, лейковорин, 5’-аміно-5’неходжкінська лімфома, остеосаркома, рак яєчнидезокситімідин, кисень, карбоген, агенти трансфуків, рак яєчника (ембріона), рак простати, рак підзії еритроцитів, перфторовані вуглеці (наприклад, шлункової залози, рак полового члена, ретиноблаFluosol 10 DA), 2,3-DPG, BW12C, блокатори кальстома, рак шкіри, саркома м’яких тканин, цієвих каналів, пентоксифілін, антіангіогенезні карциноми плоских клітин, рак шлунку, рак яєчок, сполуки, гідралазин та LBSO. Приклади хіміотерарак щитовидної залози, трофобластичні неоплазпевтичних агентів, що можуть застосовуватися в ми, рак матки, рак піхви, рак вульви та пухлина комбінації з радіосенсибілізаторами, включають, Вілма. але не обмежуються ними, адріаміцин, камптотеТаким чином, сполуки відповідно до даного цин, карбоплатин, цисплатин, даунорубіцин, доцевинаходу можуть застосовуватися як «радіосенситаксел, доксорубіцин, інтерферон (альфа, бета, білізатор» і/або «хіміосенсибілізатор». гама), інтерлейкін 2, іринотекан, паклітаксел, топоВідомо, що радіосенсибілізатори підвищують текан та їх терапевтично ефективні аналоги і похічутливість ракових клітин до токсичної дії іонізуюдні. чого випромінювання. Декілька механізмів способу Хіміосенсибілізатори можуть вводитись в комдії радіосенсибілізаторів запропоновані в літерабінації з терапевтично ефективною кількістю однієї турі, включаючи радіосенсибілізатори гіпоксичних або більше інших сполук, включають, але не обклітин (наприклад, сполуки 2-нітроімідазолу та межуються ними, сполуки, що сприяють впровасполуки діоксиду бензотриазину), що імітують кидженню хіміосенсибілізаторов у цільові клітини; сень або, альтернативно, що діють як біовідновні сполуки, що контролюють потік терапевтичних агенти при гіпоксії; радіосенсибілізатори негіпоксиагентів, живильних речовин і/або кисню в цільові чних клітин (наприклад, галогеновані піримідини), клітини; хіміотерапевтичні агенти, що діють на пущо можуть бути аналогами ДНК основ і, переважхлину; або інші терапевтично ефективні сполуки но, вбудовуватися в ДНК ракових клітин і, тим садля лікування раку або інших захворювань. Примим, сприяти викликаному радіацією розпаду моклади додаткових терапевтичних агентів, що молекул ДНК і/або оберігати нормальні механізми жуть застосовуватися в комбінації з хіміосенсибілірепарації ДНК; та різні інші ймовірні механізми дії заторами, включають, але не обмежуються ними, були припущені для радіосенсибілізаторів при ліметилюючі агенти, інгібітори топоізомерази I та куванні захворювань. інші хіміотерапевтичні агенти, такі як цисплатин і Багато протоколів лікування рака в даний час блеоміцин. включають радіосенсибілізатори в поєднанні з Сполуки формули (I) також можуть застосовуопроміненням рентгенівськими променями. Приватися для визначення або ідентифікації PARP, клади активізованих рентгенівськими променями більш конкретно, рецептора PARP-1. Для цієї мети радіосенсибілізаторів включають, але не обмежусполуки формули (I) можуть бути міченими. Такі ються ними, наступні: метронідазол, мізонідазол, індикатори можуть бути вибрані з групи, що вклюдезметилмізонідазол, пімонідазол, етанідазол, чає радіоізотопи, спини-індикатори, індикатори 29 85593 30 антигену, ферментні індикатори флуоресцентної ють при температурі 5 °С до ДМФ (81,5 мл). Суміш групи або хемілюмінесцентної групи. перемішують до повного розчинення. Додають Фахівець у даній області техніки легко визнаетиловий ефір 4-[(1-оксобутил)аміно]бензойної чить ефективну кількість з результатів тестування, кислоти (0,34 моль). Суміш перемішують при темпредставлених нижче. У цілому вважається, що пературі 100 °С протягом 15 годин, потім охолоефективна кількість складає від 0,001 мг/кг до 100 джують до кімнатної температури і виливають у мг/кг маси тіла, зокрема, від 0,005 мг/кг до 10 мг/кг крижану воду. Осад відфільтровують, промивають маси тіла. Може бути зручним вводити необхідну водою і сушать з одержанням 42,35 г (47 %) продозу два, три, чотири або більше разів з відповідміжної сполуки 3. ними інтервалами протягом доби. Такі суб-дози b) Одержання проміжної сполуки 4 можуть бути у ви гляді одиничних дозованих форм, наприклад, що містять від 0,05 до 500 мг, зокрема від 0,1 мг до 200 мг активного інгредієнта на одиничних дозовану форму. Далі «ДХМ» означає дихлорметан, «ДМФ» означає N,N-диметилформамід, «МеОН» означає Суміш проміжної сполуки 3 (0,1606 моль) у меметанол, «МІК» означає метилізобутилкетон, тилаті натрію, 30 % розчину в МеОН (152,8 мл) і «МЕК» означає метилетилкетон, «ТЕА» означає МеОН (400 мл) перемішують і кип’ятять зі звороттриетиламін і «ТГФ» означає тетрагідрофуран. ним холодильником протягом 15 годин, потім охоА. Одержання проміжних сполук лоджують і виливають у крижану воду. Осад відПриклад А1 фільтровують, промивають водою і поміщають у а) Одержання проміжної сполуки 1 ДХМ. Органічний шар відокремлюють, сушать (MgSO4), фільтрують і розчинник випарюють насухо з одержанням 31,64 г (85 %) проміжної сполуки 4. с) Одержання проміжної сполуки 5 Суміш 3-(1-піперазиніл)-1Н-індазолу (0,11 моль), хлорацетонітрилу (0,16 моль) і ТЕА (13 г) у толуолі (200 мл) і ацетонітрилі (200 мл) перемішують і кип’ятять зі зворотним холодильником протягом 3 годин. Охолоджену реакційну суТетрагідроалюмінат літію (0,1288 моль) порціміш промивають водою (250 мл). Органічний шар ями додають при температурі 0 °С у потоці N2 до відокремлюють, суша ть (MgSO4), фільтрують і розчину проміжної сполуки 4 (0,1288 моль) у ТГФ розчинник випарюють. Залишок розчиняють у три(263 мл). Суміш перемішують протягом 30 хв, вихлорметані та очищають, пропускаючи через силіливають у крижану воду та екстрагують ДХМ. Оркагель на скляному фільтрі (елюент: трихлормеганічний шар відокремлюють, сушать (MgSO4), тан/МеОН 90/10). Найбільш чисту фракцію фільтрують і розчинник випарюють насухо з одерзбирають і розчинник випарюють. Залишок крисжанням 27,4 г (98 %) проміжної сполуки 5. талізують з ацетонітрилу. Кристали відфільтровуd) Одержання проміжної сполуки 6 ють і сушать з одержанням 26 г (99 %) проміжної сполуки 1, температура плавлення 136 °С. b) Одержання проміжної сполуки 2 Суміш проміжної сполуки 1 (0,11 моль) у NH3/МеОН (600 мл) гідрують при температурі 50 °С із застосуванням нікелю Ренея (4 г) як каталізатору. Після поглинання Н2 (2 екв.) каталізатор відфільтровують, та фільтрат випарюють. Залишок кристалізують з ацетонітрилу. Кристали відфільтровують і сушать з одержанням 21 г (77,5 %) проміжної сполуки 2, температура плавлення 121 °С. Приклад А2 а) Одержання проміжної сполуки 3 Фосфорилхлорид (110,9 мл) по краплях дода Метансуль фонілхлорид (0,104 моль) по краплях додають при температурі 0 °С у потоці N2 до суміші проміжної сполуки 5 (0,069 моль) і ТЕА (0,207 моль) у ДХМ (120 мл). Суміш перемішують при температурі 0 °С протягом 4 годин. Розчинник випарюють насухо (без нагрівання). Продукт застосовують без подальшого очищення з одержанням 20,4 г проміжної сполуки 6. Приклад А3 а) Одержання проміжної сполуки 7 Етиловий ефір 4-(2-аміноетил)-1піперазинкарбонової кислоти (0,0586 моль) і 2(метилтіо)-4-(1Н)-хіназолінон (0,0588 моль) нагрівають при температурі 180 °С протягом 2 годин 31 85593 32 при перемішуванні, обробляючи жавелевою воровують і сушать з одержанням 0,2 г (58 %) дою, та потім поміщають у ДХМ і МеОН. Розчинник сполуки 1, температура плавлення 186 °С. випарюють насухо. Залишок очищають хроматогПриклад В2 рафією на колонці із силікагелем (15-35 мкм) Одержання сполуки 2 (елюент: ДХМ/МеОН/NH4OH 94/6/0,5). Чисті фракції збирають і розчинник випарюють. Маслянистий залишок кристалізують з діетилового ефіру. Осад відфільтровують і сушать з одержанням проміжної сполуки 7, температура плавлення 138 °С. b) Одержання проміжної сполуки 8 Суміш 1-(3-амінопропіл)-4-(4-хлорфеніл)-4піперидинолу (0,015 моль) і 2-хлор-4-(1Н)хіназолінону (0,018 моль) в диметилацетаміді (5 мл) перемішують при температурі 120 °С протягом 1 години. Реакційну суміш о холоджують, розчиняють у ДХМ і промивають водним аміаком. ОрСуміш проміжної сполуки 7 (0,0223 моль) і гідганічний шар відокремлюють, сушать (MgSO4), роксиду калію (0,223 моль) у 2-пропанолі (100 мл) фільтрують і розчинник випарюють. Залишок очиперемішують і кип’ятять зі зворотним холодильнищають колоночною хроматографією на силікагелі ком протягом 4 днів. Розчинник випарюють насухо. (елюент: ДХМ/(МеОН/NH3) 92/8). Чисті фракції Залишок поміщають у МеОН при перемішуванні збирають і розчинник випарюють. Залишок супри температурі 60 °С. Сіль відфільтровують. Розспендують у DIPE. Осад відфільтровують і сушать чинник випарюють з одержанням 6,5 г проміжної (вакуум; 70 °С), з одержанням 3,72 г (60 %) сполусполуки 8. ки 2, температура плавлення 178,4 °С. В. Одержання кінцевих сполук Приклад В3 Приклад В1 Одержання сполуки 3 Одержання сполуки 1 Проміжну сполуку 2 (0,000815 моль) і 6-хлор-2(метилтіо)-4(1Н)-хіназолінон (0,00097 моль) нагрівають при температурі 160 °С протягом 1 години, потім поміщають у воду і карбонат калію 10 % і екстрагують ДХМ/МеОН 90/10. Органічний шар відокремлюють, суша ть (MgSO4), фільтрують і розчинник випарюють. Залишок (0,3 г) очищають колоночною хроматографією на силікагелі (1540 мкм) (елюент: ДХМ/МеОН/NH4 OH 92/8/0,5). Чисті фракції збирають і розчинник випарюють. Залишок кристалізують з МЕК і DIPE. Осад відфільт Сполука № 1; Пр. [B1]; т. пл. 186 °C H2O (1:1); Сполука № 3; Пр. [B3]; т. пл. 118 °C Суміш проміжної сполуки 6 (0,0124 моль), проміжної сполуки 8 (0,0137 моль) і карбонату калію (0,0373 моль) у ДМФ (80 мл) перемішують при температурі 60 °С протягом 1 години, виливають у крижану воду і перемішують при кімнатній температурі протягом 30 хв. Осад відфільтровують, промивають водою і поміщають у 2-пропанон. Осад відфільтровують і сушать з одержанням 1,5 г (26 %) сполуки 3, температура плавлення 118 °С. У таблиці F-1 перераховані сполуки, отримані за методикою одного з зазначених вище прикладів. Сполука № 2; Пр. [B2]; т. пл. 178,4 °C 33 85593 34 Сполука № 19; Пр. [B1]; т. пл. 206,3 °C Сполука № 20; Пр. [B1]; т. пл. 164,6 °C Сполука № 21; Пр. [B1]; т. пл. 193 °C Сполука № 22; Пр. [B1]; т. пл. 254 °C Сполука № 23; Пр. [B1]; т. пл. 243,1 °C Сполука № 24; Пр. [B1]; т. пл. 133,6 °C Сполука № 25; Пр. [B1]; т. пл. 274,4 °C H2O (2:1) C 4H4O 4 (2:1); Сполука № 26; Пр. [B1]; т. пл. 147,1 °C Сполука № 27; Пр. [B1]; т. пл. 274 °C Сполука № 28; Пр. [B1]; т. пл. 119,5 °C Сполука № 29; Пр. [B1]; т. пл. 255,5 °C Сполука № 30; Пр. [B1]; т. пл. 230 °C C2H2O4 (1:2), H 2O (1:1); Сполука № 31; Пр. [B1]; т. пл. 142 °C H2O (1:1); Сполука № 32; Пр. [B1]; т. пл. 154 °C H2O (1:5); Сполука № 33; Пр. [B1]; т. пл. 190 °C 35 85593 36 C2H2O4 (1:2) H 2O (l:2)Сполука № 34; Пр. [B1]; т. пл. 156 °C Сполука № 35; Пр. [B1]; т. пл. > 260 °C C2H2O4 (1:2) H 2O (1:1); Сполука № 36; Пр. [B1]; т. пл. 134 °C C2H2O4 (1:1); Сполука № 37; Пр. [B1]; т. пл. 148 °C H2O (1:1); Сполука № 38; Пр. [B1]; т. пл. 205 °C Сполука № 39; Пр. [B1]; т. пл. 172 °C Сполука № 40; Пр. [B1] Сполука № 41; Пр. [B1]; т. пл. 242,2 °C Сполука № 42; Пр. [B1] Сполука № 43; Пр. [B1]; т. пл. 254 °C Сполука № 44; Пр. [B1]; т. пл. 172 °C H2O (2:1); Сполука № 45 ; Пр. [B2]; т. пл. 192,6 °C HCl (1:2); Сполука № 46; Пр. [B1]; т. пл. 253,8 °C (B-CIS); Сполука № 18; Пр. [B2]; т. пл. 145,8 °C Сполука № 4; EP 669919 37 85593 38 Сполука № 5; EP 669919 (CIS); Сполука № 6; US 5374637 Сполука № 7; EP 885190 Сполука № 8; EP 669919, US 5374637 Сполука № 9, US 5374637 Сполука № 10, EP 669919 Сполука № 11, EP 669919 Сполука № 12, EP 669919 Сполука № 13, EP 669919 Сполука № 14, EP 669919 Сполука № 15, EP 669919 Сполука № 16, EP 669919 Сполука № 17, EP 669919 Фармакологічний приклад Аналіз PARP-1-інгібуючої активності методом сцинтиляційного ефекту близькості (SPA) in vitro Сполуки відповідно до даного винаходу тестують у in vitro аналізі, основаному на технології SPA (власність Amersham Pharmacia Biotech). В принципі, аналіз базується на загальноприй нятій SPA те хнології виявлення полі(ADPрибозил)ування білків-мішенів, тобто гістонів. Таке рибозилування індукують, використовуючи фермент PARP-1, активований ДНК з одноланцюговим розривом, та [3H]-никотинамідадениндинуклеотид ([3H]-NAD+) як донора ADP-рибозила. Як індуктор активності ферменту PARP-1 оде 39 85593 40 ржують ДНК з одноланцюговим розривом. Для концентрації 10-5 М. Коли сполуки показують актицього 25 мг ДНК (постачальник: Sigma) розчинявність при 10-5 М, одержують криву доза-реакція, у ють у 25 мл буферу ДНКази (10 мМ Tris-HCl, рН якій сполуки тестують при концентраціях від 10-5 М 7,4; 0,5 мг/мл альбуміну бичачої сироватки (АБС); до 10-8 М. У кожному тесті нульове значення відні5 мМ MgCl2 • 6H 2O і 1 мМ KCl), до якого додають мають зі значень контролю та зразка. Контрольний 50 мкл розчину ДНКази (1 мг/мл у 0,15М NaCl). зразок представляє максимальну активність ферПісля інкубування протягом 90 хв при температурі менту PARP-1. Для кожного зразка кількість імп./хв 37 °С реакцію зупиняють додаванням 1,45 г NaCl, виражають як відсоток від середнього значення з наступним додатковим інкубуванням при темпеімп./хв для контролю. У прийнятний момент знаратурі 58 °С протягом 15 хв. Реакційну суміш о хочення IC50 (концентрація лікарського засобу, необлоджують на льоді і діалізують при температурі хідна для зниження активності ферменту PARP-1 4 °С протягом, відповідно, 1,5 і 2 годин з 1,5 л до 50 % від контрольного) розраховують із засто0,2 М KCl і двічі з 1,5 л 0,01 М KCl протягом 1,5 і 2 суванням лінійної інтерполяції між експериментагод, відповідно. Суміш поділяють на аліквоти та льними значеннями безпосередньо вище і нижче зберігають при температурі -20 °С. Гістони 50 % рівня. Дію тестових сполук виражають як (1 мг/мл, тип II-A, постачальник: Sigma) біотинілюpIC50 (негативний логарифм значення IC50). Як ють із застосуванням набору для біотинілування стандартну сполуку застосовують 4-аміно-1,8від Amersham, та зберігають аліквоти при темпенафталімід для підтвердження аналізу SPA. Тесратурі -20 °С. Матковий розчин 100 мг/мл SPA тові сполуки демонструють інгібуючу дію при почакульок полі(вінілтолуола) (PVT) (постачальник: тковій експериментальній концентрації 10-5 М (див. Amersham) одержують у ФРФБ. Матковий розчин таблицю 2). [3H]-NAD+ одержують додаванням 120 мкл [3H]Фільтраційний аналіз на PARP-1 інгібуючу акNAD+ (0,1 мКі/мл, постачальник: NEN) до 6 мл інтивність in vitro кубаційного буферу (50 мМ Tris/HCl, рН 8,0; 0,2 мМ Сполуки відповідно до даного винаходу тестуDTT; 4 м М MgCl2). Розчин 4 мМ N AD+ (постачальють на основі фільтраційного аналізу in vitro, оціник: Roche) одержують в інкубаційному буфері (з нюючи PARP-1-активність (ініційовану в присутно100 мМ маткового розчину у воді, що зберігається сті ДНК з одноланцюговим розривом) за при температурі -20 °С). Фермент PARP-1 одердопомогою активності в полі(ADP-рибозил)уванні жують за допомогою методик, відомих з рівня техгістонів із застосуванням [32P]-N AD як ADPніки, наприклад, клонуванням та експресією білка, рибозил-донору. Радіоактивні рибозильованні гіпочинаючи з кДНК печінки людини. Інформацію, стони осаджують трихлороцтовою кислотою (ТХК) що відноситься до застосування білкової послідоу 96-лункових фільтрувальних планшетах, та ввевності ферменту PARP-1, включаючи літературні дений [32P] вимірюють на сцинтиляційному лічильпосилання, можна знайти в базі даних Swiss-Prot нику. під номером первинного доступу Р09874. БіотиніОдержують суміш гістонів (матковий розчин: 5 льованні гістони та кульки PVT-SPA змішують і мг/мл у Н2О), N AD + (матковий розчин: 100 мМ у попередньо інкубують протягом 30 хв при кімнатН2О) і [32P]-NAD + в інкубаційному буфері (50 мМ ній температурі. Фермент PARP-1 (концентрація Tris/HCl, рН 8; 0,2 мМ DTT; 4 мМ MgCl2). Також залежить від партії) змішують з ДНК з одноланцюодержують суміш ферменту PARP-1 (5–10 мкг/мл) говим розривом, та суміш попередньо інкубують і ДНК з одноланцюговим розривом. ДНК з однолапротягом 30 хв при температурі 4 °С. Рівні частини нцюговим розривом одержують як описано в в отриманого розчину гістонів/PVT-SPA кульок і розSPA in vitro для PARP-1-інгібуючої активності. Сімчину ферменту PARP-1/ДНК змішують, та 75 мкл десят п’ять мкл суміші ферменту PARP-1/ДНК рацієї суміші разом з 1 мкл сполуки в ДМСО і 25 мкл зом з 1 мкл сполуки в ДМСО і 25 мкл суміші гісто[3H]-NAD+ додають у кожну лунку 96-лункового ни-NAD+/[32P]-NAD + додають у кожну лунку 96титровального мікропланшету. Кінцеві концентралункового фільтрувального планшета (0,45 мкм, ції в інкубаційній суміші складають 2 мкг/мл для постачальник: Millipore). Кінцеві концентрації в біотинільованих гістонів, 2 мг/мл для PVT-SPA інкубаційній суміші складають 0,2 мкг/мл для гістокульок, 2 мкг/мл для ДНК з одноланцюговим рознів, 0,1 мМ для NAD+, 200 мкМ (0,5 мкС) для [32P]ривом та від 5 до 10 мкг/мл для ферменту PARP-1. NAD+ і 2 мкг/мл для ДНК з одноланцюговим розриПісля інкубування суміші протягом 15 хв при кімвом. Планшети інкубують протягом 15 хв при кімнатній температурі реакцію зупиняють додаванням натній температурі, та реакцію зупиняють дода100 мкл 4 мМ NAD+ в інкубаційному буфері (кінцеванням 10 мкл льодяної 100 % ТХК із наступним ва концентрація 2 мМ) і планшети змішують. додаванням 10 мкл льодяного розчину АБС (1 % у Кульки залишають осаджуватися протягом, Н2О). Білкову фракцію осаджують протягом 10 хв принаймні, 15 хв, та планшети переносять у при температурі 4 °С, та планшети фільтрують у TopCountNXT™ (Packard) для сцинтилляційного вакуумі. Планшети послідовно промивають, кожну зчитування, значення виражають як імпульси на лунку, 1 мл 10 % льодяної ТХК, 1 мл 5 % льодяної хвилину (імп./хв). Для кожного експерименту параТХК і 1 мл 5 % ТХК при кімнатній температурі. Налельно запускають контроль (містять фермент решті, у кожну лунку додають 100 мкл сцинтиляPARP-1 і ДМСО без сполуки), порожню інкубаційну ційного розчину (Microscint 40, Packard), та плансуміш (містить ДМСО, але не містить фермент шети переносять у TopCountNXT™ (постачальник: PARP-1 або сполуку) і зразки (містять фермент Packard) для сцинтиляційного зчитування, та знаPARP-1 і сполуку, розчинену в ДМСО). Усі тестові чення виражають як імпульси на хвилину (імп./хв). сполуки розчиняють і остаточно потім розбавляДля кожного експерименту паралельно запускають ють ДМСО. У першому випадку сполуки тестують у контроль (містить фермент PARP-1 і ДМСО без 41 85593 42 сполуки), порожню інкубаційну суміш (містить разом з 1 мкл сполуки в ДМСО, 20 мкл [3H]ДМСО, але не містить фермент PARP-1 або споNAD+/NAD і 20 мкл ферменту TANK-2 (кінцева луку) і зразки (містять фермент PARP-1 і сполуку, концентрація 6 мкг/мл) додають у кожну лунку 96розчинену в ДМСО). Усі тестові сполуки розчинялункового флеш-планшету з Ni покриттям (Perkin ють та остаточно потім розбавляють ДМСО. У Elmer). Після інкубування суміші протягом 120 хв першому випадку сполуки тестують при концентпри кімнатній температурі реакцію зупиняють дорації 10-5 М. Коли сполуки показують активність даванням 60 мкл зупиняючого розчину (42,6 мг при 10-5 М, одержують криву доза-реакція, у якій NAD в 6 мл H2O). Планшети накривають герметисполуки тестують при концентраціях від 10-5 М до ком для планшетів і поміщають у TopCountNXT™ 10-8 М. У кожнім тесті нульове значення віднімають (Packard) для сцинтиляційного зчитування. Зназі значень контролю та зразка. Контрольний зразок чення виражають як імпульси на хвилину (імп./хв). представляє максимальну активність ферменту Для кожного експерименту паралельно запускають PARP-1. Для кожного зразка кількість імп./хв вираконтроль (містить фермент TANK-2 і ДМСО без жають як відсоток від середнього значення імп./хв сполуки), порожню інкубаційну суміш (містить для контролю. У прийнятний момент значення IC50 ДМСО, але не містить фермент TANK-2 або спо(концентрація лікарського засобу, необхідна для луку) і зразки (містять фермент TANK-2 і сполуку, зниження активності ферменту PARP-1 до 50 % розчинену в ДМСО). Усі тестові сполуки розчинявід контрольного) розраховують із застосуванням ють і остаточно далі розбавляють ДМСО. У перлінійної інтерполяції між експериментальними знашому випадку сполуки тестують при концентрації ченнями безпосередньо вище і нижче 50 % рівня. 10-5 М. Коли сполуки показують активність при 105 Дію тестових сполук виражають як pIC50 (негативМ, одержують криву доза-реакція, у якій сполуки ний логарифм значення IC50). Як стандартну спотестують при концентраціях від 10-5 М та 10-8 М. У луку застосовують 4-аміно-1,8-нафталімід для кожнім тесті нульове значення віднімають зі знапідтвердження фільтраційного аналізу. Тестові чень контролю і зразка. Контрольний зразок предсполуки демонструють інгібуючу дію при початкоставляє максимальну активність ферменту TANKвій експериментальній концентрації 10- 5 М (див. 2. Для кожного зразка кількість імп./хв виражають таблицю 2). як відсоток від середнього значення імп./хв для Аналіз TANK-2-інгібуючої активності методом контролю. У прийнятний момент значення IC50 сцинтиляційного ефекту близькості (SPA) in vitro (концентрація лікарського засобу, необхідна для Сполуки відповідно до даного винаходу тестузниження активності ферменту TANK-2 до 50 % ють у in vitro аналізі, основаному на технології SPA від контрольного) розраховують із застосуванням із застосуванням планшетів Ni Flash (96 або 384 лінійної інтерполяції між експериментальними зналунок). ченнями безпосередньо вище і нижче 50 % рівня. В принципі, аналіз базується на загальноприйДію тестових сполук виражають як pIC50 (негативнятій SPA технології виявлення авто-полі(ADPний логарифм значення IC50). Як стандартну спорибозил)ування білка TANK-2 із застосуванням луку застосовують 3-амінобензамід і 4-аміно-1,8[3H]-нікотинамідаденіндинуклеотидe ([3H]-NAD+) як нафталимид для підтвердження аналізу SPA. Дадонора ADP-рибозила. ний аналіз представлений для 96-лункового планМатковий розчин [3H]-NAD+/NAD одержують шету. В аналізі із застосуванням 384-лункового додаванням 64,6 мкл [3H]-NAD+ (0,1 мКі/мл, постапланшету застосовуються ті ж самі кінцеві конценчальник: Perkin Elmer) і 46,7 мл маткового-NAD трації та об’єми адаптують. Результати із застосу(10,7 мМ, зберігається при температурі -20 °С, ванням 96-лункового планшета, при їх наявності, постачальник: Roche) до 1888,7 мкл буфера для представлені в таблиці 2, у противному випадку досліджень (60 мМ Tris/HCl, рН 7,4; 0,9 мМ DTT; 6 показані результати аналізу в 384-лунковому мМ MgCl 2). Фермент TANK-2 одержують як описапланшеті. но в ЕР 1238063. 60 мкл буфера для досліджень Таблиця 2 Сполука № 1 1 2 3 4 5 6 7 8 11 12 13 16 In vitro фільтраційний аналіз PARP-1 pIC50 2 6,012 5,438 5,579 5,563 5,464 5,676 In vitro SPA аналіз PARP-1 pIC50 3 8,11 6,876 6,272 6,144 6,195 6,412 6,228 6,272 In vitro SPA аналіз TANK-2 pIC50 4
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinazolinone derivatives as parp inhibitors
Автори англійськоюGuillemont Jerome Emile Georges, Kennis Ludo Edmond Josephine, Mertens Josephus Carolus, van Dun Jacobus Alphonsus Josephus, Somers Maria Victorina Francis, Wouters Walter Boudewijn Leopold
Назва патенту російськоюПроизводные хиназолинона как ингибиторы parp
Автори російськоюЖильмон Жером Эмиль Жорж, Кенніс Лудо Эдмонд Джозефин, Мертенс Джозефус Каролус, ван Дун Якобус Алфонсус Джосепхус, Сомерс Мария Викторина Франциска, Воутерс Валтер Боудевиджн Леопольд
МПК / Мітки
МПК: C07D 403/12, A61P 25/00, C07D 401/12, A61K 31/517, C07D 239/91, C07D 405/12
Мітки: похідні, хіназолінону, інгібітори
Код посилання
<a href="https://ua.patents.su/22-85593-pokhidni-khinazolinonu-yak-ingibitori-parp.html" target="_blank" rel="follow" title="База патентів України">Похідні хіназолінону як інгібітори parp</a>
Попередній патент: Спосіб та система виставляння рахунків з урахуванням вмісту в ip-мережах
Наступний патент: Застосування похідної індолінону для регулювання росту рослин та спосіб регулювання росту сільськогосподарських рослин
Випадковий патент: Карусельна кокільна машина