Похідні 7-азабіциклохінолонкарбонової кислоти або їх фармацевтично прийнятні кислотно-адитивні солі, що мають антибактеріальні властивості, та проміжні сполуки для їх отримання
Текст
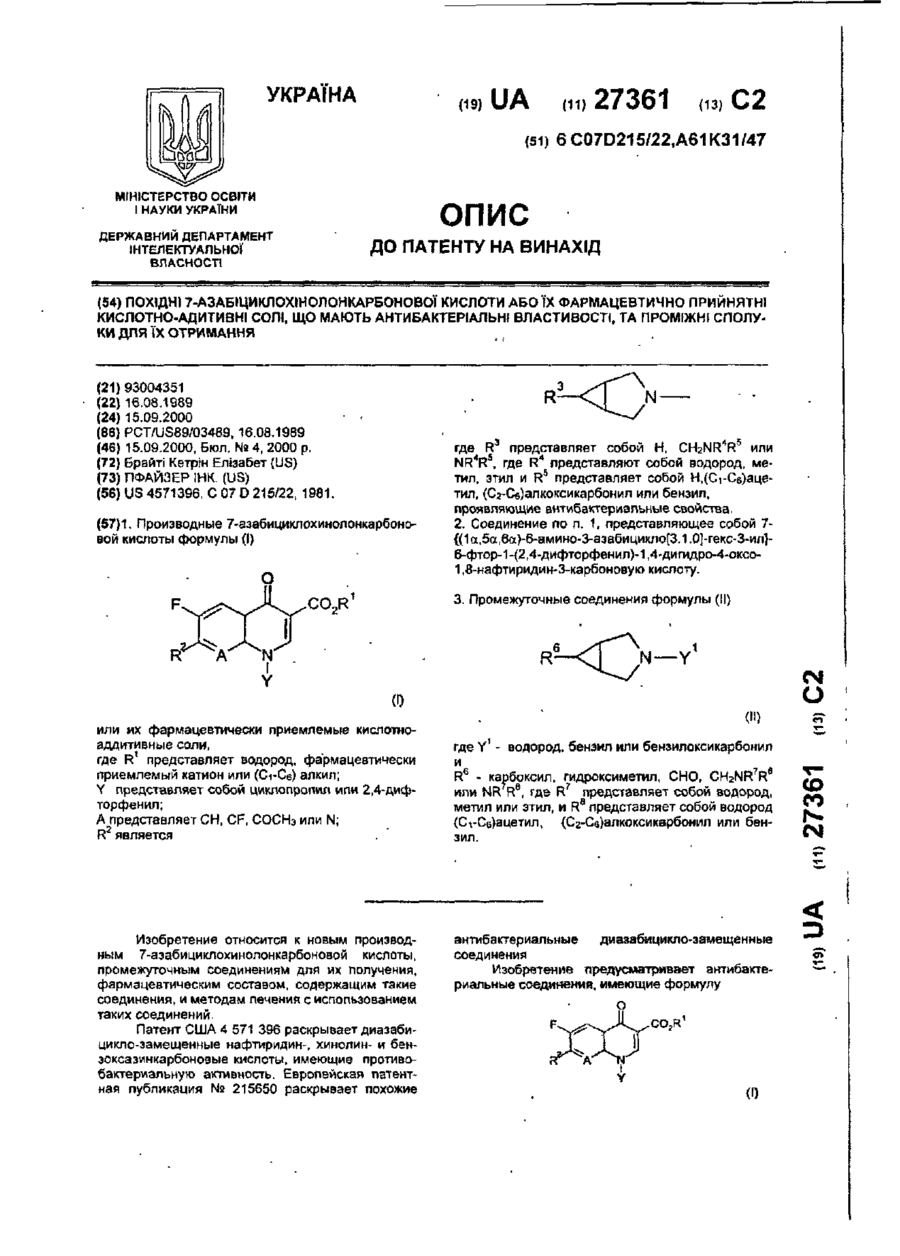
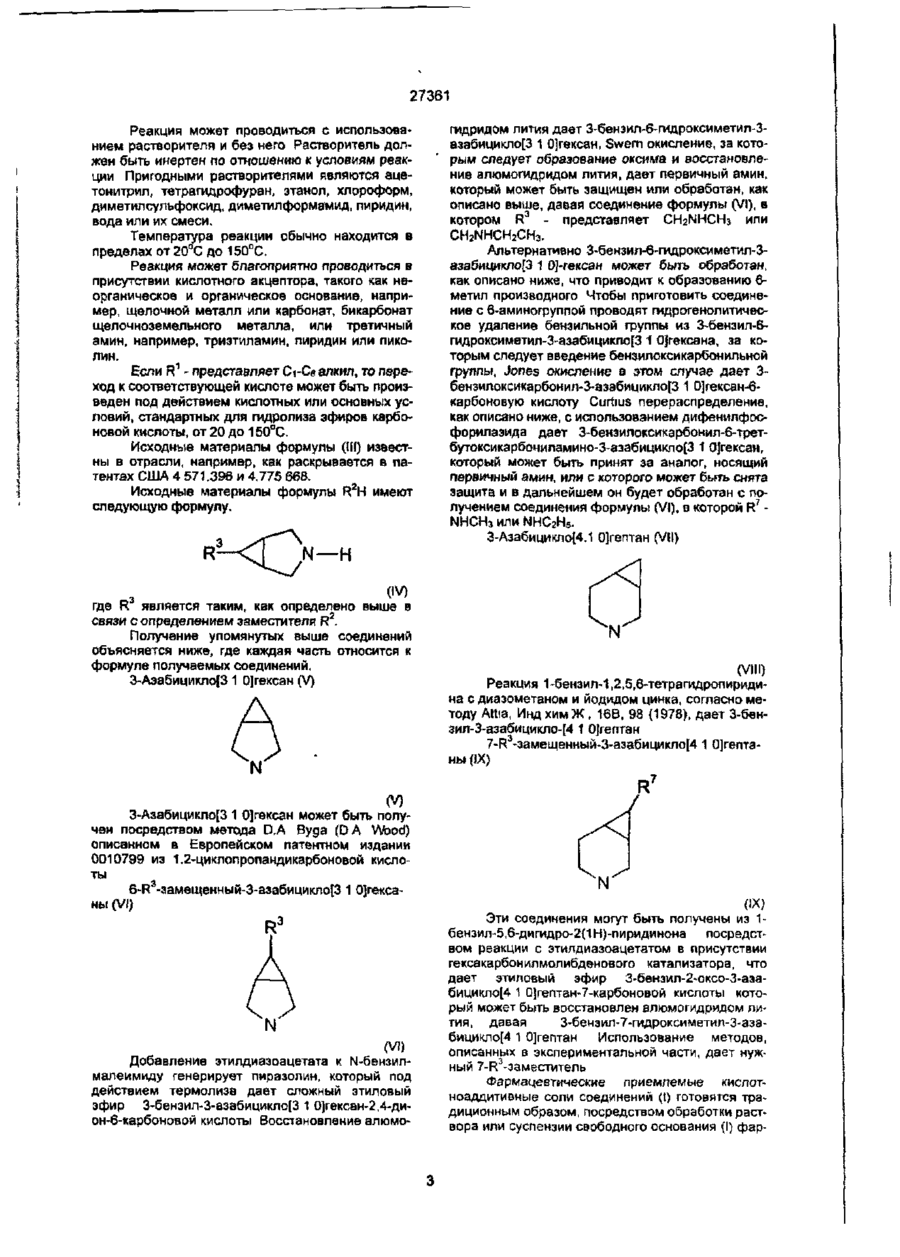
1. Производные 7-азабициклохинолонкарбоновой кислоты формулы (I) хст 3. Промежуточные соединения формулы (II) CO2R N Y где R3 представляет собой Н, CH2NR4R5 или NR*RS, где R4 представляют собой водород, метил, этил и R5 представляет собой Н,(Сі-Сє)ацетил, (Сг-Сб)алкоксикарбонил или бензил, проявляющие антибактериальные свойства. 2. Соединение по п. 1, представляющее собой 7{(1а.5а,6а)-6-амино-3-азабицикло[3.1.0]-гекс-3-ил}6-фтор-1-{2,4-дифторфенил)-1,4-дигидро-4-оксо1,8-нафтиридин-З-карбоновую кислоту. R 0) или их фармацевтически приемлемые кислотноаддитивные соли, где R1 представляет водород, фармацевтически приемлемый катион или (Сч-Се) алкил; Y представляет собой циклопропил или 2,4-дифторфенил; А представляет СИ, CF, СОСНЭ или N; R2 является Изобретение относится к новым производным 7-азабициклохинолонкарбоновой кислоты, промежуточным соединениям для их получения, фармацевтическим составом, содержащим такие соединения, и методам печения с использованием таких соединений. Патент США 4 571 396 раскрывает диазабицикло-замещенные нафтиридин-, хинолин- и бенэоксазинкарбоновые кислоты, имеющие противобактериальную активность. Европейская патентная публикация № 215650 раскрывает похожие N—Y СМ (II) где Y1 - водород, бензил или бензилоксикарбонил и 6 Rfc - карбоксил, гидроксиметил, СНО, CH2NR7Ra или NR R8, где R7 представляет собой водород, метил или этил, и Ra представляет собой водород (СгСе)ацетил, (Сг-Св)алкоксикарбонил или бензил. антибактериальные диазабицикло-замещенные соединения Изобретение предусматривает антибактериальные соединения, имеющие формулу (Г) О со со N. СМ 27361 ипи их фармацевтически приемлемые кислотноаддитивные соли, где R' • представляет водород, фармацевтически приемлемый катион ипи (Сі-Сє)алкил; Y - представляет собой циклопропил или ? 4-дифтпрфениЛ, А - представляет СН, CF, СОСНз или Н, R2 является где R3 представляет собой Н, CH2NR R или NR4R5, где RA представляют собой водород, метил, этил и R5 представляет собой Н, C-t-Ce ацетил, С?-С6 алкоксикарбонил или бензил Предпочтительными соединениями изобретения являются те по формуле (І), в которых R1 представляет водород или фармацевтически приемлемый катион, такой как натрий или калий. Другими предпочтительными соединениями формулы (I) являются те, в которых Y - представляет циклопропил или 2,4-дифторфенил Характерными соединениями изобретения являются - 7-{3-азабицикло[3.1 0]гекс-3-ил)-1-циклопропи n-6-фтор-1,4- диги дро-4-сксокарбостири п3-карбонован кислота. 7-{( 1 а ,2а,5а)-1 -аминометил-2-метил-З-азабицикло[3.1 0]-гекс-3-ил}-6-фтор-1-(2,4-дифторфенил)-1,4~дигидро-4-оксо~1,8-нафтиридин-З-карбоновая кислота, 7-{(1а,2[ї,5а)1-аминомєтил-2-метил-3-азабицикло[3 1.0]гекс-3-ил}-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3~карбоновэя кислота, 7-{(1а,2«,5и)-1-амино 2-метил-З-азабицикло[3 1 0]гекс-3-иЯ}-6-фтор-1-(2,4-дифторфенил)1,4-дигидро-4-оксо-1,8-нафтиридин-З-карбоновая кислота, 7-{(1а,2а,5а)-1-амино-2-метил-3-азабицикло[3.1.0]гекс-3-ил}-6-фтор-1-(2,4-дифторфенил)1,4-дигидро-4-оксо-1,8-нафтиридин-З-карбоновая кислота, 10-{(1-амино-3-азабицикло[3.1 0]гекс-3-ил}-9фтор-2,3-дигидро-3-метил-7-оксо-7Н-пиридо[1,2,3де]-1,4-бенэоксазин-б-карбоновая кислота, 10-{(1 га.ба.баНЗ-аминометил-З-аэабицикло[3 1 0]гекс-3-иЛ}-9-фтор-2,3-дигидро-3-метил-7оксо-7Н-пиридо-[1,2,3-де1-1,4-бензоксаэин-6-карбовая кислота. 7-{(1а,5а,6«)-6-амино-3-азабицикло[3 1 О]гекс-3ил}-6-фтор-1 (2.4-дифторфенил)-1,4-дигидроЧ-оксохинолин-3-карбоновая кислота, 1СК(1ч,5а,6(ї)-С'-амино-3-азабициклоіЗ 1 0]гекс-3ил]-9-фггор-2,3-дигидрскЗ-метиі>7чжсс-7Н-пиридо-{1,2,3де]-1,4-бензоксазин-6-карбоновая кислота, 7-{6-аминометил-3-азабициклоИ. 1 0]гепт-3ип}-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-З-карбоновая кислота, 7-{6-аминО-3-азабицикло[4 1 0]гепт-3-ил}-6фтор-1-{2,4-дифторфенил)-1,4-дигидро-4-оксо-1.8нафтиридин-3-карбоновая кислота, 7-{(1а,2а,5а,6а)-6-амино-2-метил-3-аэабицикло[3 1.0]-гекс-3-ил}-6-фтор-1-(2,4-дифторфе нил)-1,4-дигидро-4 оксо-1,8-нафтиридин-З-карбоновая кислота и 7-{(1и,2г( 5И,6а)-6-амино-2-метил-3-аэабицикло[3 I О] гекс 3-ил}-6-фтор-1-(2,4-дифторфеновая кислотэ Изобретение включает фармацевтический состав, содержащий фармацевтически приемлемый носитепь 'или разбавитель, и соединение формулы (І) в антибактериально эффективном количестве. Кроме того, изобретение включает в себя метод лечения "хозяина", такого как животное или человек, имеющего бактериальную инфекцию, который включает в себя назначение "хозяину" антибактериального эффективного количества соединения формулы 1, или фармацевтического состава, как определено выше Изобретение также включает промежуточные продукты, используемые в приготовлении соединения формулы (I) Промежуточные продукты имеют формулу (II) N—Y R где Y - водород, бензил или бензипоксикарбонил и R6 - карбоксил, гидроксиметил, СНО, CH2NR7R8 или NR7Re, где R7 представляет собой водород, метил или этил, и Re представляет собой водород, CI-CG ацетил, Сг-Се алкоксикарбонил или бензил. Термин "Сі-Сб алкил", используемый в определении R1, обозначает насыщенные одновалентные прямые или разветвленные алифатические углеводородные радикалы, имеющие от 1 до 6 атомов углерода, такие, как метил, этил, пропил, изопропил, t-бутил и т д Соединения формулы (I) согласно изобретению могут быть получены посредством взаимодействия соединения формулы (III). о CO 2 R («О с соединением формулы R Н, где R!, R2, А и Y определены выше в соответствии с формулой (I), за исключением того, что R2 включает в себя определение Н3-защитных групп NH2, CH 2 NH 2 , NHCH3, CH2NHCH3, NHC3H5 и CH2NHC2H5. a X - остаточные группы, такие как фторо-, хлоро-, бромгруппы или Сі-Сз-алкилсульфонил. Азотзащитные группы известны в отрасли. Примерами подходящих азотзащитных групп являются. d-Свацил, Сг-Сбалкоксикарбонил, возможно замещенный бензилоксикарбонил, арилоксикарбонил, силил, тритил, тетрагидропиранил, винилоксикарбонил, о-нитровинилсульфонилдифенилфосфонил, п-толуилсульфонил и бензил. Азотзащитные группы устраняются посредством таких методов, как гидрирование или гидролиз. 27361 Реакция может проводиться с использованием растворителя и без него Растворитель должен быть инертен по отношению к условиям реакции Пригодными растворителями являются ацетонитрил, тетрагидрофуран, этанол, хлороформ, дим етил сульфоксид, диметилформамид, пиридин, вода или их смеси. Температура реакции обычно находится в р пределах от 20 С до 150°С. Реакция может благоприятно проводиться в присутствии кислотного акцептора, такого как неорганическое и органическое основание, например, щелочной металл или карбонат, бикарбонат щелочноземельного металла, или третичный амин, например, триэтиламин, пиридин или пиколин. 1 Если R - представляет Сі-Св алкил, то переход к соответствующей кислоте может быть произведен под действием кислотных или основных условий, стандартных для гидролиза эфиров карбоновой кислоты, от 20 до 150°С. Исходные материалы формулы (Ш) известны в отрасли, например, как раскрывается в патентах США 4 571.395 и 4.775 668. Исходные материалы формулы R2H имеют следующую формулу. (IV) где R является таким, как определено выше в связи с определением заместителя R2. Получение упомянутых выше соединений объясняется ниже, где каждая часть относится к формуле получаемых соединений. 3-Азабицикло[3 1 0]гексан (V) (V) 3-Азабицикло[3 1 0]гексан может быть получен посредством метода D,A Byga (DA Wood) описанном в Европейском патентном издании 0010799 из 1.2-циклопропандикарбоновой кислоты 6-Р3-замещенный-3-азабицикло13 1 0]гексаны (VI) (V!) Добавление этилдиаэоацетата к N-бемзилмалеимиду генерирует пиразолин, который под действием термолиза дает сложный этиловый эфир 3-бенэил-3-азабицикло(3 1 0]гексан-2,4-дион-6-карбоновой кислоты Восстановление алюмс гидридом лития дает 3-6ензил-6-гидроксиметил-3азабицикло[3 1 0)гексан, Swern окисление, за которым следует образование охсима и восстановление алюмогидридом лития, дает первичный амин, который может быть защищен или обработан, как описано выше, давая соединение формулы (VI), в 3 котором R - представляет CH2NHCH3 или СНзМ-ГСНгСНэ. Альтернативно З-бензил-6-гидроксиметил-Зазабицикло[3 1 0]-гексан может быть обработан, как описано ниже, что приводит к образованию 6метил производного Чтобы приготовить соединение с 6-аминогруппой проводят гидрогенолитическое удаление бенэильной группы из З-бенэил-6гидроксиметил-3-азабицикло[3 1 0]гексана, за которым следует введение бензилокси карбонильной группы, Jones окисление в этом случае дает 3бензилоксикарбонил-3-азабицикло[3 1 0]гексан-6карбоновую кислоту Curtius перераспределение, как описано ниже, с использованием дифенилфосфорилаэида дает З-бензилоксикарбонил-6-трет6утоксикарбочиламино-3-азабицикло[3 1 ОІгексан, который может быть принят за аналог, носящий первичный амин, или с которого может быть снята защита и в дальнейшем он будет обработан с получением соединения формулы (VI), в которой R7 NHCH3 или NHC2H5. 3-Азабицикло[4.1 0]гептан (VII) (VIII) Реакция 1 -бензил-1,2,5,6-тетра гидропиридина с диазометаном и йодидом цинка, согласно методу Attia, Инд хим Ж , 16В, 98 (1978), дает 3-бензил-3-азабицикло-[4 1 0]гепган 7-Р3-замещенный-3-азабицикло|4 1 0]гептаны (IX) R7 (IX) Эти соединения могут быть получены из 1бензил-5,6-дигидро-23-бензил-3-азабицик-ло{3.1 .0|гексан6-карбоксапьдегид, Диметилсульфоксид (0,4В мл, 6,8 ммолей) было добавлено к хлориду щавелевой кислоты (0,33 мл, 3,8 ммоли), имеющего температуру -65°, в хлориде метилена (80 мл). Раствор названного соединения препарата Е.З. (0,75 г, 3,7 ммоли) в хлориде метилена (20 мл) затем был добавлен к реакционной смеси, также при -65°. После добавления триэтиламина (2,0 мл, 16 ммолей), смесь нагревалась до комнатной температуры. Затем растворитель удалялся в вакууме, а остаток разделялся на части водой и диэтиловым эфиром. Комбинированные органические слои высушивались сульфатом натрий, фильтровались и концентрировались, давая светло-коричневое масло. Колоночная хроматография (растворитель для элюирования: 20% уксусный этил в гексане) давала названный продукт в виде светло-зеленого масла (574 мг, 2,85 ммолей. выход 77%) }Н ЯМР (CDCIa): 9,26 (g, J = 5 Гц, 1Н), 7,24 (м, 5Н), 3,59 (с, 2Н), 3,03 (д, J - 9 Гц, 2Н), 2,45 (шир.д, J = 9 Гц, 2Н), 2,40 (м, 1Н). 2,06 (шир.с, 2Н) 5. {1а,5а.6а]-3-бензил-3-азабицикло[3.1 0]гексан-6-карбоксальдегидоксим. Раствор названного соединения препарата Е.4. (3,2 г, 16 ммолей) в этаноле (160 мл) обрабатывался ацетатом натрия (4,25 г, 60 ммолей) и гидрохлоридом гидроксиламина {3,2 г, 46 ммолей) и перемешивался 18 ч. После удаления растворителя в вакууме, остаток разделялся на части между хлоридом метилена и водным карбонатом калия. Комбинированные органические слои высушивались сульфатом натрия и концентрировались, давая названный продукт (3,29 г, 15,2 ммолей, выход 95%). *Н ЯМР (CDCb. смесь геометрических изомеров вокруг оксима): 7,28 (м, 5Н), 7,07 и 6,06 (g, J = 8,9 Гц, 1Н), 3,61 и 3,60 (с, 2Н), 3,07 и 3,04 (д, J = 9 Гц, 2Н). 2,75 и 2,10 (м, 1Н); 2,41 (м. 2Н), 1,64 (М.2Н). 6. [1 а, 5 а , 6 а ] -6- ам и но м е т и л- 3 -бен зил^3-аэабицикло[3.1.0]-гексан. Названное соединение препарата Н.5. (3,2 г, 14 ммолей) растворялось в тетрагидрофуране (150 мл) и обрабатывалось алюмогидридом лития (1,85 г, 49 ммолей). Результирующая суспензия грелась с обратным холодильником в течение 12 ч. Добавлялась вода (5 мл) и насыщенный натриево-калиевый раствор винной кислоты (2 мл); смесь перемешивалась 1 ч. Добавлялся сульфат магния и смесь фильтровалась; устранение растворителя из фильтрата давало названный продукт в виде желтого масла (2,3 г, 11 ммолей, выход 78%). 'Н ЯМР (CDCI3): 7,27 (м, 5Н>, 3,58 (с, 2Н), 2,96 (g, J = 9 Гц, 2Н), 2.50 (д, J = 7 Гц, 2Н), 2,34 (д, J = Э Гц, 2Н), 1,38 (м. 1Н), 1,32 (шир.с, 2Н), 1,19 (шир.с, 2Н). 7. [1а,5а,6а]-3-бензил-6-1трет-6утоксикарбонил)аминометил]-3-азабицикло[3.1.0]гексан. Названное соединение препарата Е.6. (150 мг, 0,74 ммоли) растворялось в диоксане (9 мл) и воде (1 мл) и обрабатывалось триэтиламином (0,15 мл, 1,1 ммоли) и дикарбонатом ди-трет-бутила (165 мг, 0,76 ммоли). Результирующий раствор взбалтывался в течение 15 ч, а затем делился на две части диэтиловым эфиром и водой. Комбинированные органические слои высушивались сульфатом натрия, фильтровались, концентрировались в вакууме, давая названный продукт в виде бледно-зеленого масла {216 мг, 0,71 ммоли. выход 96%) 1Н ЯМР (CDCb): 7,27 (м, 5Н). 4,73 27361 (шир.с., 1Н), 3,57 (с, 2Н), 2,97 (м, 4Н). 2,34 (шир.д., J = 9 Гц, 2Н), 1,44 (м, ЮН), 1,25 (шир.с., 2Н). 8. (1а,5а,6а]-6-[трвт-бутоксикарбонил)амимометил-3-аэабицикло[3.1.0]гексан Смесь названного соединения препарата Е.7. (240 мг, 0,79 ммоли), 10% палладий в углероде (240 мг) vt муравьиной аммоний (240 мг, 3,8 ммоли) в этанояе (10 мл) перемешивались при комнатной температуре 0,5 ч. Смесь фильтровалась и концентрировалась, давая липкое твердое вещество, которое смешивалось с хлоридом метилена и фильтровалось. Удаление растворителей под действием пониженного давления давало желтое масло, которое выкристаллизовывалось иэ этилового эфира, давая, названный продукт в виде белого твердого вещества с температурой плавления 95-97°С (148 мг, 0,70 ммоли, выход 89%. 1 Н ЯМР (СОСІз): 8,47 (шире, 1Н), 4,80 (шир.с, 1Н)( 3,33 (м, 4Н), 3,06 (м, 2Н), 1,66 (шир.с, 2Н), 1,43 (с, ЭН), 1,23 (шир.с. 1Н). Пример F, [1а,5а,6а]-6-гидроксиметил-3-азабицикло[3.1.0]гексан Соединение [1 а,5а,6а]-3-бензил-6-гидроксиметип-3-азабицикло[3.1.0]гексан - (2,5 г, 12 ммоли) растворялось в метаноле (200 мл), обрабатывалось гидроокисью аммония в углероде (20% содержания палладия, 500 мг) и перемешивалось при 1 атм водорода в течение 4,5 ч. Реакционная смесь фильтровалась и концентрировалась в вакууме: остаток смешивался с ацетонитрилом и кристаллизовался. Фильтрация давала названный продукт в виде аморфного белого твердого тела, температура плавления - 9В-1ОО0 (1,16 г, 10,2 ммоли, выход 85%). 1 Н ЯМР (CDCb): 3,49 (g, J = 7 Гц, 2Н), 2,98 (g, J " 11 Гц, 2Н), 2,85 (шир.с, J = 12 Гц, 2Н), 1,67 (шир.с, 2Н), 1,33 (м. 2Н), 0,89 (м, 1Н). 2, [1а,5а,6а]-3-бензилоксикарбонил-6~гидроксиметил-3-аэабицикло[3.1.0]гексан. Названное соединение препарата F.1. (1,0 г, 8,8 мыюпи) растворялось в диоксане (40 мл) и воде (40 мл) и обрабатывалось бикарбонатом натрия (3 г, 36 ммоли) и эфиром бензила хлоруксусной кислоты (1,3 мл, 9',1 ммоли). После 30 мин. реакционная смесь экстрагировалась ацетатом этила; комбинированные органические слои высушивались сульфатом натрия, фильтровались и концентрировались, давая названный продукт в виде масла (2,15 г, 8,7 ммоли, выход 99%). 1 Н ЯМР (СОСІз): 7,32 (шир.с., 5Н), 5,08 (с, 2Н), 3,65 (м, 2Н), 3,46 (м, 4Н), 1,45 (м, 2Н), 0,91 (м, 1Н). 3. [1 а,5а,6а]-3-бензилоксикзрбонил-3аэабицикло[3,1,0]гексан-6-карбоновая кислота 4. [1а,5а,6а]-3-бензипоксикарбонил-6~третбутоксикарбониламино-3-азабицикло[3.1,0]гексан Диэтил фосфор ил азид (865 мл, 4 ммоля), триэтиламин (1,1 мл, 8 ммоли) и названное соединение препарат F.3. (1,0 г, 3,83 ммоля) растворялись в t-бутаноле (45 мл) и грелись с обратным холодильником 18 ч. Затем растворитель удалялся в вакууме, а остаток разделялся на части водой и уксусным этилом, Комбинированные органические слои высушивались сульфатом натрия и концентрировались, давая остаток, который очищался колоночной хроматографией (растворитель для элюирования: 40% уксусный этил в гексане). Названный продукт был получен в виде масла (772 мг, 2,3 ммоли. выход 60%). 1 Н ЯМР (CDCI3): 7,31 (с, 5Н), 5,06 (с, 2Н), 4,65 (шир.с, 1Н), 3,70 (м, 2Н), 3,46 (м, 2Н), 2.26 (шир.с, 1Н), 1,67 (шир.с, 2Н), 1,41 (с,9Н). 5. [1а,5а,6а]-6-трет-бутоксикзрбониламино3-азабицикло-[3. 1.0]гексан Раствор названного соединения препарата F.4. (58 мг, 0,17 ммоли) обрабатывался палладием в углероде (10% к весу, 60 мг) и муравьиным аммонием (60 мг, 1 ммоли) и грелся 15 мин при 65°. Затем реакционная смесь фильтровалась через Супер-сель, а фильтрат концентрировался в вакууме, давая названный продукт в виде твердого вещества (28 мг, 0,14 ммоли, выход 82%). Н ЯМР (CDCI3). 4,65 (шир.с, 1Н), 3,14 (g, J - 12 Гц, 2Н), 2,93 (м, 2Н), 2,30 (шир.с, 1Н), 1,59 (шир.с. 2Н), 1,44 (с, 9Н). Следующие примеры иллюстрируют изобретение. Пример 1. 7-(3-азабицикло[3.1.0]гекс-3-ил)1-циклолропил-6-фтор-1,4-дигидро-4-оксо-хинолин-3-карбоновая кислота Раствор солянокислой соли 3азабицикло[3.1.0]гексана (157 мг, 1,31 ммоли), приготовленного также, как описано в (патенте США 4.183.857) в д и мети л сульфоксиде (13 мл) обрабатывался 1 -цикпопропил-6,7-дифтор-1,4-дигидро-4-оксо-хинолин-З-карбоновой кислотой (348 мг, 1,31 ммоля) и триэтиламином (0,58 мл, 3,9 ммопи) и грепся в течение 18 ч. Фильтрация реакционной смеси привела к образованию белого твертого в-ва, которое очищалось колоночной хроматографией (растворитель для элюирования: 1% уксусная кислота в хлороформе, 5% уксусная кислота в хлороформе, метанол), давая названный продукт в виде белого твердого вещества, точка плавления 290° (186 г, 0,43 ммоли. 33% выход). 'Н ЯМР (ДМСО-de): 8,54 (с, 1Н), 7,75 (g, J = 14 Гц, 1Н), 7,08 (д, J = 9 Гц, 1Н), 3,83 (дд, J = 4,10 Гц. 2Н), 3,73 (шир.с, 1Н), 3,62 (шир.д., J = 10 Гц, 2Н), 1,77 (м, 2Н), 1,30 (д, J = 6 Гц, 2Н), 1,14 (шир.с, 2Н), 0,77 (м, 1Н), 1,30 (м, 1Н). Пример 2, А. 7-{1-(М-трет-бутоксикарбонил/аминомсіил]-3-азабицикло[3 1.0]-гекс-3-ил}-1циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3карбоновая киспота Смесь 1-[{М-трет-бутоксикарбонил)аминометил]-3-азабицикло[3.1.0]гексана (0,30 г, 1,41 ммопи) и тризтиламина (0,39 мл, 2,8 ммоли) в ацетонитриле (20 мл) обрабатывалась 1-циклопропил-6,7-дифтор-1,4-дигидро-4-оксо-хинолин-3карбоновой кислотой (0,375 г, 1,41 ммоли) и грелась при 50 е в течение 21 ч. Затем температура Раствор названного соединения препарата F.2. (2,1 г, 8.5 ммоли) в ацетоне (50 мл) обрабатывалось по каплям реактивом Джонса до тех пор, пока оранжевый цвет не стал постоянным. Затем добавлялся иэопропанол для того, чтобы погасить избыток окислителя, и результирующая смесь разделялась на части водой и хлоридом метилена. Органические слои высушивались сульфатом натрия, фильтровались и концентрировались, давая названный продукт в виде масла (2,08 г, 8,0 ммоли. выход 94%). 1 Н ЯМР (CDCI3): 7,32 (шир.с., 5Н), 5,08 (с, 2Н), 3,72 (м, 2Н), 3,50 (шир.с, 2Н), 2,13 (шир.с, 2Н), 1,47 (т, J = 3Гц, 1Н). 8 27361 повысилась до 80°, грелась 24 ч. Затем фильтрация реакционной смеси дала названный продукт в виде белого твердого вещества. *Н ЯМР (CDCb/CDaOD): 8,62 (с, 1Н), 7,84 (g, J = 14 Гц, 1Н), 6,88 (д, J = 7 Гц, 1Н), 5,06 (очень шир.с, 1Н), 3,84 (м, 2Н),3,68(м, 1Н), 3,58 (м. 1Н),3,48(м, 1Н), 3,36 (шир.с, 2Н), 1.64 (м, 1Н), 1,45 (с, 9Н), 1,36 (м, 2Н), 1,17 (м, 2Н), 0,87 (м, 1Н), 0,66 (м, 1Н). В. Солянокислая соль 7-(1-аминометил-3азабицикло[3.1.0]гекс-3-ил)-1-циклопропил-бфтор-1,4-дигидро-4-оксо-хинолин-3-карбоновой кислоты Названное соединение примера 2А (442,8 мг, 0,97 ммоли) было смешано с соляной кислотой (3,0 мл 6М раствора) и уксусной кислотой (3,0 мл), и грелось 1 ч при 100а. Результирующий раствор охлаждался и концентрировался в вакууме посредством азеотропной дистилляции с толуолом, давая желтый остаток, который растирался в порошок с изопропанолом и фильтровался. Получался названный продукт в виде белого твердого вещества, температура плавления 250-261° с разложением (350 мг, 0,89 ммоли, выход 92%). *Н ЯМР (DMCO-ds): 8,57 (с, 1Н), 7,79 (g, J = 13 Гц, 1Н), 7,11 (д, J = 7 Гц, 1Н), 4,00 (м, 1Н), 3.81 (м, 1Н), 3,71 (д, J = 9 Гц, 2Н), 3,70 (м, 1Н), 3,18 (д, J = =11 Гц, 1Н), 3,06 (д, J = 11 Гц, 1Н), 1,88 (м, 1Н), 1,38 (шир.д., J = 7 Гц, 2Н), 1.16 (шир.с., 2Н), 1,0 (м, 1Н),0,68(м, 1Н). Пример 3. А. 7-{(1-[г4-трет-бутоксикзрбонил)аминометил]-3-аэабицикло[3.1.0]гекс-3-ил)-1циклопропил-6,8-дифтор-1,4-дигидро-4-оксо-хинолин-3-карбоновая кислота. Смесь 1 -[(М-трет-бутоксикарбонил)аминометил]-3-азабицикло[3.1.0]гексана (501 мг, 2,35 ммоли) и триэтиламин (0,655 мл, 4,7 ммоли) в ацетонитриле обрабатывались 1 -циклопропил6,7,В-трифтор-1,4-дигидро-4-оксо-хинолин-3-карбоновой кислотой (668,3 мг. 2,35 ммоли) и грелось при 80°С 24 ч, Фильтрация реакционной смеси дала названный продукт в виде белого твердого вещества, температура плавления 188-189,5° (851 мг, 1,79 ммоли, 76% выход). 1 Н ЯМР (CDCb): 14,6 (с, 1Н), 8,72 (с. 1Н), 7,80 (gg, J = 13,2 Гц, 1Н), 4,67 (шир.с, 1Н), 3,94 (м, 1Н), 3,83 (д, J = 10 Гц, 1Н), 3,76 (с, 2Н), 3,66 (g, J = 10 Гц, 1Н;, 3,42 (gg, J = 14,6 Гц, 1Н), 3,29 (шир. gg, J = 14,6 Гц, 1Н), 1,44 (шир.с, ЮН), 1,24 (м, 2Н), 1,12 (м, 2Н), 0,70 (м, 2Н). В. 7-(1-аминометил-3-азабицикло[3.1.01гекс3-ил]-1-циклопропил-6,8-дифтор-1,4-дигидро-4-оксо-хинолин-3-карбоновой кислоты, солянокислая соль. Названное соединение примера ЗВ (779,4 мг, 1,63 ммоли) смешивалось с соляной кислотой (5,0 мл 6М раствора) и уксусной кислотой (5,0 мл) и грелось при 100° 1,75 ч. Результирующий раствор охлаждался и концентрировался в вакууме азеотропной дистилляцией с толуолом, давая остаток, который растирался в порошок вместе с изопропанолом и фильтровался. Названный продукт получался в виде светло-желтого твердого тела, температура плавления 251° с разложением (555 мг, 1,35 ммоли, 83% выход). *Н ЯМР (DMCOde): 8,63 (с. 1Н), 7,74 (шир. g, J = 13,2 Гц, 1Н), 4,08 (м, 1Н), 3,90 (g, J = 10 Гц, 1Н), 3,70 (м, ЗН), 3,17 (д, J = 13 Гц, 1Н), 3,03 (д, J = 13 Гц,1Н), 1,73 (м, 1Н), 1,15 (м, 4Н), 0,93 (м, 1Н), 0,66 (м. 1Н). Пример 4. А. 7-(Н(М-трет-бутоксикарбонил)аминометил]-3-аэабицикло[3 1.0]гекс-3-ил)-1циклопрогшл-О-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота Смесь 1 -[(г^-трет-бутоксикарбонил(аминометил}-3-азабицикло13.1.0]гексана (52,5 мг, 0,24 ммоли) и триэтиламина (66 мл, 0,48 ммоли) в ацетонитриле (3 мл) обрабатывалась 7-хлор-1циклопропил-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислотой (70 мг, 0,24 ммоли) и грелось при 80° 20 ч' Фильтрация реакционной смеси давала названный продукт в виде белого твердого вещества, температура плавления 234° с разложением (89,0 мг, 0,19 ммоли, 79% выход). *Н ЯМР (CDCb): 8,66 (с, 1Н). 7,96 (g, J = 12 Гц, 1Н), 4,72 (шир.с, 1Н), 4,11 (м, 2Н), 3,80 (м, 2Н). 3,58 (м, 1Н), 3,36 (д, J = 6 Гц, 2Н), 1.60(м, 1Н), 1,43 (с, 9Н), 1,22 (м, 2Н), 1,02 (м, 2Н), 0,88 (м, 1Н). 0,58 (м,1Н). В. 7-[1-амииометил-3-азабицикло[3.1 0]гекс3-ил]-1-циклопропил-6-фтор-1,4-дигидро-4-оксо1,8-нафтиридин-З-карбоновой кислоты солянокислая соль Названное соединение примера 4А (89 мг, 0,194 ммоли) смешивалось с соляной кислотой (1,5 мл, 6М раствор) и уксусной кислотой (1,5 мл) и грелось при 100° в течение 1 ч Результирующий раствор охлаждался и концентрировался в вакууме посредством азеотропной дистилляции с толуолом, давая остаток, который растирался в порошок с изопропанолом и фильтровался Названный продукт получался в виде светло-желтого твердого вещества, температура плавления 283° с разложением (48,4 мг, 0,122 ммоли, 64% выход). *Н ЯМР (DMCOde): 8,52 (с, 1Н), 8,16 (шир.с, 1Н). 7,95 (g, J = 13 Гц. 1Н), 4,18 (м, 1Н), 4,02 (м, 1Н), 3,86 (м, 2Н), 3,66 (м. 1Н), 3,08 (м, 2Н), 1,86 (м, 1Н), 1,24 (м, 2Н), 1,06 (м, ЗН), 0,61 (м, 1Н). Пример 5. А. 7-(1-[(М-трет-бутоксикарбонил)аминометил]-3-азабицикло[3 1.0]гекс-3-ил)-1циклопропил-6-фтор-8-метокси-1,4-дигидро-4-оксо-хинолин-3-карбоновая кислота. Смесь 1-ЦМ-трет-бутоксикарбонил)аминометил]-3-азабицикло-[3.1.0]гексана (209,6 мг, 0,99 ммоли) и триэтиламина (0,273 мл, 1,96 ммоли) в диметилсульфокоиде (10 мл обрабатывалась 1циклолропил-6,7-дифтор-8-метокси-1,4-дигидро-4оксо-хинолином-3-карбоновой кислотой (242,9 мг, 0,82 ммоли) и грелось при 80° в течение 42 ч. Затем реакционная смесь концентрировалась в вакууме и результирующее твердое вещество растиралось в порошок с изолропанолом, давая продукт в виде белого твердого вещества, температура плавления 212-213° с разложением (183 мг, 0,376 ммоли, 46% выход). 1 Н ЯМР (CDCI3): 8,79 (с, 1Н), 7,79 (д, J = 13 Гц, 1Н), 4,69 (м, 1Н), 3,99 (м, 1Н), 3,66 (м, 4Н), 3,57 (с, ЗН), 3,48 (м, 1Н), 3,27 (м, 1Н). 1,58(шир.м., 1Н), 1,46 (с, 9Н), 1,19 (м, 2Н), 0,98 (м, 2Н),0,72(м, 2Н). В. 7-[1-аминометил-3-азабицикло[3.1.0]гекс3-ил]-1-циклопролил-6-фтор-8-метокси-1,4-оксохинолин-3-карбоновая кислота Названное соединение примера 5А. (166,7 мг, 0,34 ммоли) смешивалось с соляной кислотой (2,5 мл, 6М раствор) и уксусной кислотой (2,5 мл) и грелось при 100° в течение 3,5 ч Результирующий раствор охлаждался и концентрировался в 27361 вакууме посредством азеотропной дистилляции с гептаном, давая остаток, который растирался в порошок вместе с изопропанолом и эфиром. Затем продукт растворялся в воде (2 мл), доводился до рН 8,5 раствором гидроокиси натрия (0,1 н) и фильтровался, давая названный продукт в виде з'еленованого твердого вещества, температура плавления 194-196° (36,5 мг, 0,095 ммоли, 28% выход). 'Н ЯМР (D2O)NaOD): 8,50 (с. 1Н), 7,62 (д, J = 14 Гц, 1Н), 4,05 (шир.с, 1Н), 3,71 (д. J = 10 Гц, 1Н), 3,55 (С, ЗН), 3,5 (м, ЗН), 2,90 (шир. J = 13 Гц, 1Н), 2,70 (ЩИр.д.. J = 13 Гц, 1Н), 1,44 (шир.с, 1Н), 1.11 (м, 2Н), 0,90 (шир.с. 2Н), 0,62 (м, 2Н). Пример6. А. Этиловый эфир 7-(1-[{N-aueтип)8Микометил1-3-азабицикло[3.1.0}гекс-4-ил)-6фтор-1-(2,4-дифторметил)-1,4-дигидро-4-оксо-1,8нафтиридин-3-карбоновой кислоты Смесьі -І(Іі4-ацетил)аминометил]-3-азабицикло[3,1.0]гексан (115,5 мг, 0,75 ммоли) и триэтиламина (312 мл, 2,25 ммоли) в ацетонитриле (20 мл) обрабатывался этиловым эфиром 7-хлор-6-фтор-1-(2,4-дифторфенилМ,4-дипідрсь4-ока>1 ,8-нэфтиридин-З-карбоновой кислоты (283 мг, 0,74 ммоли) и грелась при 80° 20 ч. Дополнительный 1-(М-ацетил)-аминометил-3азабицикло[3.1,0]гексан (97 мг) добавлялся порциями около 2,5 ч, пока тонкослойная хроматография не подтвердила отсутствие исходного нафтиридина. Реакционная смесь концентрировалась в вакууме и остаток хроматографировался на силикагеле (растворитель для элюирования: 189 : 10 : 1 хлороформ : метанол : концентрированная гидроокись аммония). Названный продукт получался в виде бесцветного масла (280,3 мг, 0,56 ммоли, 76% выход). 1 Н ЯМР (CDCb): 8,36 (с, 1Н), 7,93 (д, J = 13 Гц, 1Н), 7,37 (ширс.,1Н), 7,07 (шир.с, 2Н), 6,15 (шир.с, 1Н), 4,36 (кв. J = 7 Гц, 2Н), 3,48 (м., 6Н), 2,02 (с, ЗН), 1,50 (м, 1Н), 1,37 (т. J = 7 Гц, ЗН), 0,81 (м., 1Н), 0,43 (м, 1Н). В. Солянокислая соль 7-[1 -аминометил-3азабицикло[3.1.0]гекс-3-ил]-6-фтор-1-(2,4-дифторфенип)1,4-дигидро-4-оксо-1,8-нафтиридин-З-карбоновой кислоты Названное соединение примера 6А (231,2 мг, 0,46 ммоли) смешивалось с соляной кислотой (3 мл, 6М раствора) и уксусной кислотой (3 мл) и подогревалось при 100° а течение 24 часов. Результирующий раствор охлаждался и концентрировался в вакууме, давая остаток, который смешивался с изопропанолом и изопропиловым эфиром, и фильтровался. Фильтрат концентрировался, а продукт растирался в порошок с малым количеством холодного изопропанола, давая белое твердое вещество, которое растворялось в минимальном количестве раствора гидроокиси натрия и подкислялось соляной кислотой до тех пор, пока не появлялся осадок. Фильтрация давала названный продукт в виде желтого твердого вещества, температура плавления 201-203° (40 мг, 0,086 ммоли, выход 19%). 1 Н ЯМР (D2O/NaOD): 8,25 (с, 1Н), 7,80 (д. J = 13 Гц, 1Н), 7,45 (м, 1Н), 7,15 (м. 2Н), 3,5 (очень шир. м., 4Н), 2,70 (шир.д., J = 13 Гц, 1Н). 2,60 (uiHp.fl...J = 13 Гц, 1Н), 1,39 (шир.с, 1Н), 0,68 (шир. с , 1Н), 0,20 (шир с , 1Н). Пример 7. А. 7-1-[М-(трет-бутоксикарбонил)этиламинометил1-3-эзабицикло[3.1.0]гекс-3 ил)-1-циклопропил-6-фтор~1,4-дигидро-4-оксо-хинолин-3-карбоновая кислота Смесь 1-[М-(трет-бутоксикарбонил)этиламинометил]-3-азабицикло[3.1.0]гексана (45,3 мг, 0,18 ммоли) и триэтиламина (50 мл, 0,36 ммоли) в ацетонитриле (5 мл) обрабатывалась 1-циклопропип-6,7-дифтор~1,4-дигидро-4-оксо-кинопин-3-карбоновой кислотой (50,0 мг, 0,18 ммоли) и грелась при 80° 18 ч. Фильтрация реакционной смеси приводила к образованию названного продукта в виде белого твердого вещества (26,8 мг, 0,055 ммоли, выход 31%). ' н ЯМР (CDCb): 8,67 (с, 1Н), 7,90 (д. J = 15 Гц, 1Н), 6,89 (д. J = 7 Гц, 1Н), 3,87 (шир.с, 2Н), 3,5 (м, 5Н), 3,3 (шир.с, 2Н), 1,6 (м, 1Н), 1,49 , 1,59 (с. 1Н). Пример 23. А. Этиловый эфир 7-(11га,5а,6а]6-[(Ы-трет-бутоксикарбонил)аминометип]-3-азабицикло[3.1 0]гекс-3-ил)-1-циклопропил-6-фтор-1,4дигидро-4-оксохинолин-З-карбоновой кислоты нометил]-3-азабицикло[3.1 0]гексана (350 мг, 1,6 ммоля) в диметилсульфоксиде (8 мл) и триэшламин (1 мл) обрабатывались этиловым эфиром 1-циклопропип-6,7дифтор-1 .ФдищцроЧ-оксо-хинолин-З-карбоновой кислоты (352 мг, 1,2 ммоля), как описано в примере 22.А, давая целевой продукт в виде твердого вещества, т.пл. 135-137°С (296 мг, 0.61 ммоля, 51% выход). 1 Н ЯМР (CDCb). 8,43 (с, 1Н), 7,93 (д., J = =14,9 Гц, 1Н), 6,79 (д., J = 7,3 Гц, 1Н), 4,69 (шир.с, 1Н), 4,35 (кв., J - 6,8 Гц, 2Н>, 3,82 (дд., J = 9,9, 2,9 Гц, 2Н), 3,48 (м., 2Н), 3,32 (м , 1Н), 3,08 (м., 2Н), 1,61 (с, 2Н), 1,43 (с, 9Н), 1,37 (т, J = 7 Гц, ЗН), 1,25(м.,2Н), 1,0В (м ,2Н), 1.00 (м., 1Н) В Хлоргидратная соль 7-([1a,5a,6a]-6аминометип-3-азабицикло[3.1.0]-гекс-3-ил)-циклолропил-6-фтор-1,4-дигидро-4-оксо-хинолин-3-карбоновой кислоты Соединение примера 23.А (225 мг, 0,46 ммоля) превращалось по способу примера 22.В в целевой продукт в виде желтого твердого вещества, т.пл. выше 275°С (146 мг, 0,39 ммоля, 85% выход). Н ЯМР (MeOD-d,): 8,57 ( с , 1Н), 7,66 (д., J = =14,7 Гц, 1Н), 7,05 (д., J = 7,7 Гц, 1Н), 3,96 (шир.д., J = 7 Гц. 2Н), 3,69 (шир д., J = 9 Гц, 2Н), 3,69 (шир.д., J = 9 Гц, 2Н), 2,97 (д , J = 7,6 Гц, 2Н), 1,92 * (с, 2Н), 1.39 (м . 2Н), 1,20 (м., ЗН). Пример 2 4 А 10-([1а,5а,6а>6-Е(Ы-трет-бутоксикарбонил)аминометил]-3-азабицикпо[3.1.0^екс-3-ил}-9чЬтсі>2,3-диі^ідро-3'Метил-7-оксс-7Н-пиридо-(1,2,3Іав)1,4-бензоксазин-б-карбоноаая кислота Смесь (1а,5а,6а)-6-[(М-трет-бутоксикар- бонил)аминометил]-3-азабицикло[3.1,0]гексана (300 мг, 1,5 ммоля) и 9,10-дифтор-2,3-дигидро-3метил-8-оксо-7Н-пиридо-(1,2,3-de)-1,4-бензосазин6-карбоновой кислоты (260 мг, 0,92 ммоля) в диметилсульфоксиде (5 мл) и триэтиламине (1 мл) обрабатывалась, как в примере 22 А, давая целевой продукт (96 мг, 0,22 ммоля, 24% выход). 'Н ЯМР (CDCb): 8,54 ( с , 1Н), 7.67 (д., J = 13 Гц, 1Н), 4,60 (шир.с.. 1Н), 4,41 (м., 2Н), 4,28 (м., 1Н), 3,80 (м., 2Н), 3,63 (м., 2Н), 3,08 (м,, 2Н). 1,58 (Д., J = 6,4 Гц, ЗН), 1,54 (с, 2Н), 1,43 (с, 9Н), 1,10 (м., 1Н). В. 10-([1 сс,5а,6а]-6-аминометил-3-азабицикло-[3.1.0]-гбкс-3-ил)-9-фтор-2,3-дигидро-3'Метил-7оксо-7Н-пиридо(1,2,3-de)-1,4-бензоксазин-6-карбоновая кислота, соль метансульфокислоты Суспензия соединения примера 24 А (80 мг, 0,17 ммоля) а ацэтоне (2,5 мл) и воде (2,5 мл) обрабатывалась метансуль фоки ел отой (0,10 мл, 1,5 ммоля) и нагревалась на паровой бане в течение 1,5 ч. Растборители удалялись в вакууме, и остаток растирался с ацетоном, давая целевой продукт в виде желтого твердого вещества, т.пл. 276°С с разложением (38 мг, 0,08 ммолн, 47% выход). Н ЯМР (D2O): 8,66 (с , 1Н), 7,18 (д., J = 13,6 Гц, 1Н), 4,78 (м , 1Н), 4,57 (м., 1Н), 4,37 (м , 1Н), 3,91 (м , 2Н), 3,67 (м., 2Н), 3,03 (д , J = 7,3 Гц, 2Н), 2,82 (с, ЗН), 1,73 (с, 2Н), 1,58 (д . J = 6,1 Гц, ЗН), 1,27 (м , 1Н) Пример 25 А. 7-([1а,5и,6а]-6-[(г4-трет-бутоксикарбонил)аминометил]-3-азабицикло[3 1 0]гекс-3-ил>6-фтор-1Ч2,Фдифторфенил)1,4-дигидрс>4ч)ксо-хинолин-3-карбоновая кислота, этиловый эфир 15 27361 (1а,5а,6а)-6-[(Ы-трет-бутоксикзрбонил)аминометил]-3-азабицикло[3.1.0]гексан (225 мг, 1,06 ммоля) в диметилсульфоксиде (5 мл) и триэтиламине (1 мл) обрабатывался этиловым эфиром 1циклопропил-6,7-дифтор-1,4-дигидро-4-оксохинапин-3-карбоновой кислоты (365 нг, 1,0 ммоль), как в примере 22.А, давая целевой продукт в виде пены (226 мг, 0,406 ммоля, 41 выход). ! Н ЯМР (CDCfe): 8,22 (с, 1Н), 7,96 (д.. J = 13 Гц, 1Н), 7,45 (м., 1Н), 7,12 (м., 2Н), 5,67 (шир.д., J = 7 Гц, 1Н), 4,60 (шир с , 1Н), 4,37 (кв., J = 7 Гц, 2Н), 3,60 (м„ 2Н), 3,32 (м., 2Н), 3.05 (м., 2Н), 1,55 (с, 2Н), 1,45 (с, 9Н), 1,40 (т., J = 7 Гц, ЗН), 0,92 (н.. 1Н) В. Соль 7-[(1а,5а,6а)-6-аминометил-3-аэабицикло-^З. 1.0]гекс-3-ил)-6-фтор-1 -(2,4-дифторфенил)-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и метансульфокислоты Соединение примера 25.А (200 мг, 0,35 ммоля) обрабатывалось метансульфокислотой (95,1 мг, 1,43 ммоля), как в примере 24.В, давая целевой продукт в виде желтого порошка, т.пл. 255°С с разложением (82 мг, 0,16 ммоля, 44% выход). 1 Н ЯМР (D2O, 97°С): 9,43 (с, 1И), 8.47 (м., 2Н), 8,16 (м., 2Н), 6,64 (м„ 1Н), 4,39 (м., 2Н), 4,24 (м., 2Н), 3.79 (м., 2Н), 3,57 ( с , ЗН), 2,60 ( с , 2Н), 1,80 (м., 1Н). Пример 26А Этиловый эфир 7-Q1a,2lJl5a,6a>6[^трет-бугоксикзрбонил)аминометил}-2-метил-3-азабицикло{3.1. д р ф р ч киспоты Смесь (1а,2р,5а,6а)-6-1(К-трет-бутоксикарбонил)аминометип}-2-метил-3-азабі+-цикпо[3.1 .Оїгексана (400 мг, 1,75 ммоля) и триэтиламина (5 мл в ацетонитриле) 50 мл обрабатывалась этиловым эфиром 7-хлор6~фтор-1 -(2,4-дифторфенил)-1,4-дигиДро-4-оксо-1,8нафтири-дин-3-карбоновой кислоты (625 мг, 1,63 ммоля) по способу примера 22 А, давая целевой продукт (687 мг, 1,2 ммоля, 74% выход). 1 Н ЯМР (CDCb, смесь ротамеров); 8,35 и 8.34 ( с , 1Н), 6,04 и 8,02 (д., J = 12,5 Гц, 1Н), 7.38 ( м , 1Н), 7,03 (м., 2Н), 4,63 (шир с , 1Н), 4,33 (кв., J = 7 Гц, 2Н), 3,95 (м., 2Н), 3,53 (м., 1Н), 2,99 (м., 2Н), 1,55 (м., 2Н), 1,41 (м., 9Н), 1,35 (т., J = 7 Гц, ЗН), 0,94 (м., 1Н), 0,91 и 0,79 (д.. J = 5,9 Гц, ЗН). В. 7-([1а,2р,5а,6а]-6-аминометил-2-метил-3азабицикло[3.1.0]гекс-3-ил)-6-фтор-1-(2,4-дифторфенип)-1,4-дигидро-4-оксо-1,8-нафтиридин-З-карбоновая кислота, хлоргидратная соль Соединение примера 26.А {650 мг, 1.13 ммоля) подвергалось превращениям, как в примере 22-В, давая целевой продукт (78 мг, 0,16 ммоля, выход 14%) 1 Н ЯМР (MeOD-d^ смесь ротамеров); 8,73 и 8,71 (с , 1Н), 8,00 (д , J = 12 Гц, 1Н). 7,57 (м., 1Н), 7,22 (м , 2Н), 4,02 (м., 2Н), 3,70 (м , 1Н), 2,87 (м , 2Н), 1,83 (м ,2Н), 1,11 (м., 1И), 0,96 и 0.85 (д,, J = 6 Гц, ЗН). 1,38 ммоля) и 1-циклопропил-6,7-дифтор-1,4дигидро-4-оксо-хинолин-З-карбоновой кислоты (335 мг, 1,14 ммоля) в диметилсульфоксиде (10 мл) и триэтиламине (2 мл) обрабатывалась, как в примере 22.А, давая целевой продукт в виде твердого вещества, т. пп. 202-204°С (261 мг. 0,625 ммоля, 55% выход), *Н ЯМР (CDCb): 8,44 (с, 1Н), 7.93 (д., J = 13 > Гц, 1Н), 6,78 (д., J = 6 Гц, 1Н), 4,80 (шир.с. 1Н), 4,40 (кв, J - 7 Гц, 2Н). 3,91 (М., 2Н). 3,55 (шир.д.. J = 8 Гц, 2Н). 3,31 (м., 1Н), 2.45 (с, 1Н), 1,88 ( с , 2Н). 1,45 (с, 9Н), 1,39 (т., J = 7 Гц, ЗН), 1,25 (м„ 2Н), 1,09 (м., 2Н). В. 7ЧГ1а,5а,6а}^^минс)-3^оабициклор.1.0]гекс-3илЬ1чі|иклопрс
ДивитисяДодаткова інформація
Назва патенту англійською7-azabicycloquinoloncarboxylic acid derivatives or pharmaceutically acceptable acid-additive salts thereof having antibacterial properties, and intermediate compounds for obtaining thereof
Автори англійськоюBrighty Katherine Elisabeth
Назва патенту російськоюПроизводные 7-азабициклохинолонкарбоновой кислоты либо их фармацевтически приемлемые кислотно-аддитивные соли, имеющие антибактериальные свойства, и промежуточные соединения для их получения
Автори російськоюБрайти Кэтрин Элизабет
МПК / Мітки
МПК: C07D 471/04, C07D 498/04, C07D 498/06, A61K 31/535, C07D 401/04, A61K 31/435, C07D 209/52, C07D 209/02, A61K 31/47
Мітки: кислоти, сполуки, фармацевтично, солі, проміжні, прийнятні, властивості, похідні, антибактеріальні, 7-азабіциклохінолонкарбонової, мають, отримання, кислотно-адитивні
Код посилання
<a href="https://ua.patents.su/18-27361-pokhidni-7-azabiciklokhinolonkarbonovo-kisloti-abo-kh-farmacevtichno-prijjnyatni-kislotno-aditivni-soli-shho-mayut-antibakterialni-vlastivosti-ta-promizhni-spoluki-dlya-kh-otrimann.html" target="_blank" rel="follow" title="База патентів України">Похідні 7-азабіциклохінолонкарбонової кислоти або їх фармацевтично прийнятні кислотно-адитивні солі, що мають антибактеріальні властивості, та проміжні сполуки для їх отримання</a>
Попередній патент: Спосіб промивання фільтраційних модулів установки для просвітлення рідин
Випадковий патент: Спосіб пошарової обробки насіння рослин різними рідкими препаратами