5-фенілпіримідини, способи їх одержання, проміжні продукти, засіб та спосіб боротьби з фітопатогенними грибами
Номер патенту: 76453
Опубліковано: 15.08.2006
Автори: Шівек Франк, Розе Інго, Гіпсер Андреас, Штірль Райнхард, Штратманн Зігфрид, Гевер Маркус, Мюллер Бернд, Гроте Томас, Райнхаймер Йоахим, Шефер Петер, Тормо І Бласко Йорді, Лоренц Гізела, Аммерманн Еберхард, Заутер Хуберт
Формула / Реферат
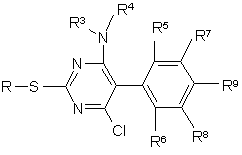
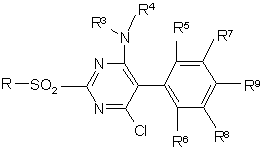
1. 5-фенілпіримідини формули І
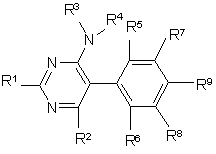 ,
,
де замісники мають наступні значення:
R1 означає пірол, піразол, імідазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3-триазин, 1,2,4-триазин, оксазол, ізоксазол, 1,3,4-оксадіазол, фуран, тіофен, тіазол, ізотіазол, причому гетероцикл може бути зв'язаний з піримідиновим кільцем через С або N, піридазин, піримідин або піразин, причому R1 може бути заміщений однією-трьома однаковими або різними групами Rа,
Rа означає галоген, гідрокси, ціано, оксо, нітро, аміно, меркапто, C1-C6-алкіл, C1-C6-галогеналкіл, C2-C6-алкеніл, C2-C6-алкініл, C3-C6-циклоалкіл, C1-C6-алкокси, C1-C6-галогеналкокси, карбоксил, С1-С7-алкоксикарбоніл, карбамоїл, С1-С7-алкіламінокарбоніл, C1-C6-алкіл-C1-C6-алкіламінокарбоніл, морфолінокарбоніл, піролідинокарбоніл, С1-С7-алкілкарбоніламіно, C1-C6-алкіламіно, ді-(C1-C6-алкіл)аміно, C1-C6-алкілтіо, C1-C6-алкілсульфініл, C1-C6-алкілсульфоніл, гідроксисульфоніл, аміносульфоніл, C1-C6-алкіламіносульфоніл або ді-(C1-C6-алкіл)аміносульфоніл;
R2 означає галоген, ціано, C1-C6-алкіл, C1-C6-галогеналкіл, C1-C6-алкокси, C1-C4-галогеналкокси або C3-C6-алкенілокси;
R3, R4 означають незалежно один від одного водень, C1-C6-алкіл, C1-C6-галогеналкіл, C3-C6-циклоалкіл, C3-C6-галогенциклоалкіл, C2-C6-алкеніл, C2-C6-галогеналкеніл, C3-C6-циклоалкеніл, C2-C6-алкініл, C2-C6-галогеналкініл або C3-C6-циклоалкініл;
R3 і R4 разом з атомом азоту, з яким вони зв'язані, можуть утворювати п'яти- або шестичленний цикл, який може бути перерваний гетероатомом із групи, яка включає О, N або S та/або може мати один або кілька замісників із групи, яка включає галоген, C1-C6-алкіл, C1-C6-галогеналкіл і оксі-C1-C3-алкіленокси, або в якому два суміжних С-атоми або один N-атом і один суміжний С-атом можуть бути зв'язані C1-C4-алкіленовим ланцюгом;
R5, R6 незалежно один від одного означають водень, галоген, C1-C6-алкіл, C1-C6-галогеналкіл або C1-C6-алкокси;
R7, R8 незалежно один від одного означають водень, галоген, C1-C6-алкіл або C1-C6-галогеналкіл;
R9 означає водень, галоген, C1-C6-алкіл, C1-C6-алкокси, C3-C6-циклоалкокси, C1-C6-галогеналкокси, C1-C6-алкоксикарбоніл або C1-C6-алкіламінокарбоніл.
2. Сполука формули І за п. 1, яка відрізняється тим, що замісники мають наступні значення:
R1 означає піразол, пірол, імідазол, 1,2,3-триазол, 1,2,4-триазол або тетразол, які зв'язані через С або N, або 2-пиримідин, піразин або 3-піридазин,
причому R1 має до трьох замісників Ra¢,
Ra¢ означає галоген, гідрокси, ціано, нітро, аміно, меркапто, C1-C6-алкіл, C1-C6-галогеналкіл, C2-C6-алкеніл, C2-C6-алкініл, C3-C6-циклоалкіл, C1-C6-алкокси, C1-C6-галогеналкокси, карбоксил, С1-С7-алкоксикарбоніл, карбамоїл, С1-С7-алкіламінокарбоніл, C1-C6-алкіл-C1-C6-алкіламінокарбоніл, морфолінокарбоніл, піролідинокарбоніл, С1-С7-алкілкарбоніламіно, C1-C6-алкіламіно, ді-(C1-C6-алкіл)аміно, C1-C6-алкілтіо, C1-C6-алкілсульфініл, C1-C6-алкілсульфоніл, гідроксисульфоніл, аміносульфоніл, C1-C6-алкіламіносульфоніл або ді-(C1-C6-алкіл)аміносульфоніл;
R2 означає галоген, C1-C6-алкіл або C1-C6-алкокси;
R3, R4 означають незалежно один від одного водень, C1-C6-алкіл, C1-C6-галогеналкіл, C3-C6-циклоалкіл або C2-C6-алкеніл;
R3 і R4 можуть разом з атомом азоту, з яким вони зв'язані, утворювати п'яти- або шестичленний цикл, який може бути перерваний атомом кисню і може мати C1-C6-алкільний замісник;
R5, R6 означають незалежно один від одного водень, галоген або C1-C6-алкіл;
R7, R8 означають незалежно один від одного водень або галоген;
R9 означає водень, галоген, C1-C6-алкіл або C1-C6-алкокси.
3. Сполука формули І за п. 1 або 2, яка відрізняється тим, що R2 означає хлор.
4. Сполука формули І за будь-яким з пп. 1-3, яка відрізняється тим, що комбінації замісників R5-R9 мають наступні значення: 2-хлор, 6-фтор; 2,6-дифтор; 2,6-дихлор; 2-метил, 4-фтор; 2-метил, 6-фтор; 2-фтор, 4-метил; 2,4,6-трифтор; 2,6-дифтор, 4-метокси; 2,4-диметил і пентафтор.
5. Спосіб одержання 5-фенілпіримідинів формули І за п. 1, де R1 зв'язаний через азот і R2 означає хлор, який відрізняється тим, що тіосечовину циклізують складним фенілмалоналкільним ефіром формули II
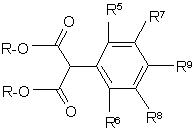 ,
,
де R означає C1-C6-алкіл, з одержанням сполук формули III
 ,
,
які піддають взаємодії з агентом алкілування формули IV
R-X,
де R означає C1-C6-алкіл і Χ - нуклеофільнозамінну групу, з одержанням сполук формули V
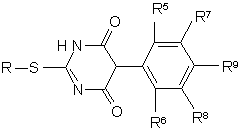 ,
,
які за допомогою агента хлорування переводять у дихлорпіримідини формули VI
 ,
,
які взаємодією з аміносполуками формули VII
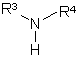
перетворюють у похідні піримідину формули VIII
 ,
,
і сполуки формули VIII оксидують з одержанням сульфонів формули IX
 ,
,
які взаємодією з гетероциклічними сполуками формули Χ
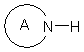 ,
,
де цикл А означає 5- або 6-членний гетероарил, який містить від одного до чотирьох атомів, вибраних з азоту, кисню або сірки, який вибирають із групи, що включає пірол, піразол, імідазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3-триазин, 1,2,4-триазин, оксазол, ізоксазол, 1,3,4-оксадіазол, фуран, тіофен, тіазол, ізотіазол, піридазин, піримідин або піразин, причому А може бути заміщений однією-трьома однаковими або різними групами Rа, переводять у сполуки формули І.
6. Спосіб одержання 5-фенілпіримідинів формули І за п. 1, де R1 зв'язаний через вуглець, який відрізняється тим, що дихлорпіримідин формули IVa
 ,
,
де замісники мають приведені в п. 1 значення, а ![]() означає 5- або 6-членний гетероарил, який містить від одного до чотирьох атомів, вибраних з азоту, кисню або сірки, який вибирають із групи, що включає пірол, піразол, імідазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3-триазин, 1,2,4-триазин, оксазол, ізоксазол, 1,3,4-оксадіазол, фуран, тіофен, тіазол, ізотіазол, причому гетероцикл, зв’язаний з піримідиновим кільцем через С, піридазин, піримідин або піразин, причому В може бути заміщений однією-трьома однаковими або різними групами Rа, піддають взаємодії з аміном формули VII за п. 5.
означає 5- або 6-членний гетероарил, який містить від одного до чотирьох атомів, вибраних з азоту, кисню або сірки, який вибирають із групи, що включає пірол, піразол, імідазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3-триазин, 1,2,4-триазин, оксазол, ізоксазол, 1,3,4-оксадіазол, фуран, тіофен, тіазол, ізотіазол, причому гетероцикл, зв’язаний з піримідиновим кільцем через С, піридазин, піримідин або піразин, причому В може бути заміщений однією-трьома однаковими або різними групами Rа, піддають взаємодії з аміном формули VII за п. 5.
7. Проміжний продукт формули VI згідно із п. 5, який відрізняється тим, що комбінації замісників від R5-R9 мають значення згідно із п. 4.
8. Проміжний продукт формули VIa згідно із п. 6, який відрізняється тим, що комбінації замісників від R5-R9 мають значення згідно із п. 4.
9. Засіб, придатний для боротьби з фітопатогенними грибами, який містить твердий або рідкий носій і сполуку загальної формули І за п. 1.
10. Спосіб боротьби з фітопатогенними грибами, який відрізняється тим, що гриби або матеріали, рослини, ґрунт або посівний матеріал, які підлягають захисту від фітопатогенних грибів, обробляють ефективною кількістю сполуки загальної формули І за п. 1.
Текст
1. 5-фенілпіримідини формули І 2 (19) 1 3 76453 4 галогеналкокси, C1-C6-алкоксикарбоніл або C1-C6де R означає C1-C6-алкіл і Χ - нуклеофільнозаміналкіламінокарбоніл. ну групу, з одержанням сполук формули V R5 2. Сполука формули І за п. 1, яка відрізняється R7 O тим, що замісники мають наступні значення: HN R1 означає піразол, пірол, імідазол, 1,2,3-триазол, R9 R S 1,2,4-триазол або тетразол, які зв'язані через С N або N, або 2-пиримідин, піразин або 3-піридазин, O причому R1 має до трьох замісників Ra , R8 R6 , Ra означає галоген, гідрокси, ціано, нітро, аміно, які за допомогою агента хлорування переводять у меркапто, C1-C6-алкіл, C1-C6-галогеналкіл, C2-C6дихлорпіримідини формули VI алкеніл, C2-C6-алкініл, C3-C6-циклоалкіл, C1-C6R5 алкокси, C1-C6-галогеналкокси, карбоксил, С1-С7R7 Cl алкоксикарбоніл, карбамоїл, С1-С7N алкіламінокарбоніл, C1-C6-алкіл-C1-C6R9 R S алкіламінокарбоніл, морфолінокарбоніл, піролідиN нокарбоніл, С1-С7-алкілкарбоніламіно, C1-C6Cl алкіламіно, ді-(C1-C6-алкіл)аміно, C1-C6-алкілтіо, R8 R6 , C1-C6-алкілсульфініл, C1-C6-алкілсульфоніл, гідроякі взаємодією з аміносполуками формули VII ксисульфоніл, аміносульфоніл, C1-C6R3 R4 алкіламіносульфоніл або ді-(C1-C6N алкіл)аміносульфоніл; H R2 означає галоген, C1-C6-алкіл або C1-C6-алкокси; 3 4 перетворюють у похідні піримідину формули VIII R , R означають незалежно один від одного воR4 день, C1-C6-алкіл, C1-C6-галогеналкіл, C3-C6R3 R5 R7 N циклоалкіл або C2-C6-алкеніл; 3 4 N R і R можуть разом з атомом азоту, з яким вони R9 зв'язані, утворювати п'яти- або шестичленний R S цикл, який може бути перерваний атомом кисню і N може мати C1-C6-алкільний замісник; Cl R8 R6 , R5, R6 означають незалежно один від одного воі сполуки формули VIII оксидують з одержанням день, галоген або C1-C6-алкіл; сульфонів формули IX R7, R8 означають незалежно один від одного воR4 день або галоген; R3 R5 R9 означає водень, галоген, C1-C6-алкіл або C1-C6R7 N алкокси. N 3. Сполука формули І за п. 1 або 2, яка відрізня2 R SO2 R9 ється тим, що R означає хлор. N 4. Сполука формули І за будь-яким з пп. 1-3, яка відрізняється тим, що комбінації замісників R5-R9 Cl R8 R6 мають наступні значення: 2-хлор, 6-фтор; 2,6, дифтор; 2,6-дихлор; 2-метил, 4-фтор; 2-метил, 6які взаємодією з гетероциклічними сполуками фофтор; 2-фтор, 4-метил; 2,4,6-трифтор; 2,6-дифтор, рмули Χ 4-метокси; 2,4-диметил і пентафтор. A N H 5. Спосіб одержання 5-фенілпіримідинів формули І за п. 1, де R1 зв'язаний через азот і R2 означає , хлор, який відрізняється тим, що тіосечовину де цикл А означає 5- або 6-членний гетероарил, циклізують складним фенілмалоналкільним ефіякий містить від одного до чотирьох атомів, вибром формули II раних з азоту, кисню або сірки, який вибирають із R5 групи, що включає пірол, піразол, імідазол, 1,2,4R7 O триазол, 1,2,3-триазол, тетразол, 1,2,3-триазин, R-O 1,2,4-триазин, оксазол, ізоксазол, 1,3,4-оксадіазол, R9 фуран, тіофен, тіазол, ізотіазол, піридазин, піриміR-O дин або піразин, причому А може бути заміщений O 8 R R6 однією-трьома однаковими або різними групами , Rа, переводять у сполуки формули І. де R означає C1-C6-алкіл, з одержанням сполук 6. Спосіб одержання 5-фенілпіримідинів формули І формули III R5 за п. 1, де R1 зв'язаний через вуглець, який відріз7 R O няється тим, що дихлорпіримідин формули IVa HN Cl R9 S R5 R7 N HN O R6 R8 , які піддають взаємодії з агентом алкілування формули IV R-X, R9 B N Cl R6 R8 , 5 76453 6 де замісники мають приведені в п. 1 значення, а 7. Проміжний продукт формули VI згідно із п. 5, який відрізняється тим, що комбінації замісників B від R5-R9 мають значення згідно із п. 4. означає 5- або 6-членний гетероарил, який 8. Проміжний продукт формули VIa згідно із п. 6, містить від одного до чотирьох атомів, вибраних з який відрізняється тим, що комбінації замісників азоту, кисню або сірки, який вибирають із групи, 5 9 від R -R мають значення згідно із п. 4. що включає пірол, піразол, імідазол, 1,2,4-триазол, 9. Засіб, придатний для боротьби з фітопатоген1,2,3-триазол, тетразол, 1,2,3-триазин, 1,2,4ними грибами, який містить твердий або рідкий триазин, оксазол, ізоксазол, 1,3,4-оксадіазол, фуносій і сполуку загальної формули І за п. 1. ран, тіофен, тіазол, ізотіазол, причому гетероцикл, 10. Спосіб боротьби з фітопатогенними грибами, зв’язаний з піримідиновим кільцем через С, піриякий відрізняється тим, що гриби або матеріали, дазин, піримідин або піразин, причому В може бурослини, ґрунт або посівний матеріал, які підлягати заміщений однією-трьома однаковими або різють захисту від фітопатогенних грибів, обробляа ними групами R , піддають взаємодії з аміном ють ефективною кількістю сполуки загальної форформули VII за п. 5. мули І за п. 1. Даний винахід відноситься фенілпіримідинів формули І, до 5 у якій замісники мають наступні значення: R1 позначає від п'яти- до десятичленний насичений, частково ненасичений або ароматичний моно- або біциклічний гетероцикл, який містять від одного до двох гетероатомів із групи, яка включає О, N або S, за винятком піридилу, причому R1 може бути заміщений однією або декількома однаковими або різними групами Ra, Ra позначає галоген, гідрокси, ціано, оксо, нітро, аміно, меркапто, С1-С6-алкіл, С1-С6галогеналкіл, С2-С6-алкеніл, С2-С6-алкініл, С3-С6циклоалкіл, С1-С6-алкокси, С1-С6-галогеналкокси, карбоксил, С1-С7-алкоксикарбоніл, карбамоїл, С1С7-алкіл-амінокарбоніл, С1-С6-алкіл-С1-С6алкіламінкарбоніл, морфолінокарбоніл, піролідинокарбоніл, С1-С7-алкіл-карбоніламіно, С1-С6алкіламіно, ді-(С1-С6-алкіл)аміно, С1-С6-алкілтіо, С1-С6-алкілсульфініл, С1-С6-алкілсульфоніл, гідроксисульфоніл, аміносульфоніл, С1-С6-алкіламіносульфоніл, ді-(С1-С6-алкіл)аміносульфоніл; R2 позначає водень, галоген, ціано, С1-С6алкіл, С1-С6-галогеналкіл, С1-С6-алкокси, С1-С4галогеналкокси або С3-С6-алкенілокси; R3, R4 позначають незалежно один від одного водень, С1-С6-алкіл, С1-С6-галогеналкіл, С3-С6циклоалкіл, С3-С6-галогенциклоалкіл, С2-С6алкеніл, С2-С6-галогеналкеніл, С3-С6-циклоалкеніл, С2-С6-алкініл, С2-С6-галогеналкініл або С3-С6циклоалкініл; R3 і R4 разом з атомом азоту, з яким вони зв'язані, можуть утворювати п'яти- або шестичленний цикл, який може бути перерваний гетероатомом із групи, яка включає О, N або S та/або може мати один або кілька замісників із групи, яка включає галоген, Сі-Сб-алкіл, СгСє-галогеналкіл та оксі-Сі С3-алкіленокси або в якій два суміжних С-атоми або один N-атом та один суміжний С-атом можуть бути зв'язані С1-С4-алкіленовим ланцюгом; R5, R6 незалежно один від одного позначають водень, галоген, С1-С6-алкіл, С1-С6-галогеналкіл або С1-С6-алкокси; R7, R8 незалежно один від одного позначають водень, галоген, С1-С6-алкіл або С1-С6галогеналкіл; R9 позначає водень, галоген, С1-С6-алкіл, С1С6-алкокси, С3-С6-циклоалкокси, С1-С6галогеналкокси, С1-С6-алкоксикарбоніл або С1-С6алкіламінокарбоніл. Крім того, винахід відноситься до способу і до проміжних продуктів для одержання цих сполук, а також до їхнього застосування для боротьби з фітопатогенними грибами. Похідні 2-піридил-4-амінопіримідину з фунгіцидною дією відомі з ЕР-А 407899, похідні піридилпіримідину описані у DE-A 3937284, DE-А 3937285, DE-A 4029649, DE-A 4034762, DE-A 4227811, ЕР-А 481405 та WО-A 92/10490. Описані у вищенаведених публікаціях сполуки придатні як засоби захисту рослин проти фітопатогенних грибів. Їхня дія в багатьох випадках не є задовільною. Тому задачею даного винаходу є розробка сполук з більш вдосконаленою дією. У відповідності з цим були розроблені похідні фенілпіримідину формули І. Крім того, були розроблені спосіб і проміжні продукти, а також засоби, яки їх містять, для боротьби з фітопатогенними грибами та їхнє застосування для цих цілей. Сполуки формули І мають у порівнянні з відомими сполуками підвищену ефективність проти фітопатогенних грибів. Сполуки формули І можуть бути отримані різним чином. Сполуки формули І, у якій R1 позначає зв'язані 2 азотом гетероцикли і R позначає хлор, можна одержувати, наприклад, у такий спосіб: Шляхом циклоконденсації тіосечовини складними алкіловими ефірами феніл-малонової кислоти фомули II одержують сполуки формули III, 7 причому у формулі II R позначає С1-С6-алкіл. Реакцію здійснюють звичайно в протонному розчиннику, такому, як спирти, зокрема, етанол. Вона може проводитися також і в апротонному розчиннику, такому, як піридин, Ν,Ν-диметилформамід, Ν,Ν-диметилацетамід або їх суміші [порівн. патент US 4,331,590; публікацію Org. Prep, and Proced. Int., т.10, стор.21-27 (1978); Collect. Czech. Chem. Commun., т.48, стор.137-143 (1983); Heteroat. Chem., Bd. 10, стор.17-23 (1999); Czech. Chem. Commun., т.58, стор. 2215-2221 (1993)]. Може давати перевагу проведення реакції в присутності основи, яка застосовується у еквімолярній або ж надлишковій кількості. Як основи придатні, наприклад, карбонати і гідрокарбонати лужних та лужноземельних металів, наприклад, калієві та натрієві солі, зокрема, Na2CO3 і NaНСО3, або ж азотні основи, як наприклад, піридин та трибутиламін. Температура реакції становить звичайно від 20°С до 250°С, переважно від 70°С до 220°С. Звичайно компоненти застосовують у близькому до стехіометричного співвідношенні. Може давати перевагу застосування тіосечовини в надлишковій кількості. Необхідні арилмалонові спирти відомі (порівн. ЕР-А 1002788) або можуть бути отримані відомими з публікацій методами. Сполуки формули III перетворюються алкілювальними агентами формули IV у похідні тіобарбітурової кислоти. У цій формулі R позначає С1-С6алкіл і X групу, яка нуклеофільно відщеплюється. Формула IV у загальному позначає звичайні алкілювальні агенти, такі, як С1-С6-алкілгалогеніди, зокрема, метилхлорид та метилбромід, складні ді(С1-С6-алкіл)ові ефіри сірчаної кислоти, такі, як диметилсульфат або складні С1-С6-алкілові ефіри метансульфокислоти, такі, як складний метиловий ефір метансульфокислоти. Реакція може проводитися у воді або ж у диполярному апротонному розчиннику, такому, як, наприклад, Ν,Ν-диметилформамід [порівн. патент US 5,250,689], переважно вона відбувається у присутності основи, яка може застосовуватися у еквімолярній або ж надлишковій кількості. Як основи придатні гідроксиди, гідрокарбонати і карбонати лужних або лужноземельних металів, як наприклад, КОН, NaOH, NаНСО3 та Na2CO3, a також азотні основи, такі, як піридин. Температура реакції становить звичайно від 0°С до 100°С, переважно від 10°С до 60°С. Звичайно компоненти застосовують у близькому до стехіометричного співвідношенні. Може давати переваги застосування алкілювальних агентів у надлишку. Сполуки формули V перетворюються на дихлорпіримідини формули VI [порівн. US 4,963,678; 76453 8 ЕР-А 745593; DE-A 19642533; WO-A 99/32458; J.Org. Chem. Bd. 58, S. 3785-3786 (1993); Helv. Chim. Acta, т.64, стор.113-152(1981)]. Як хлорувальні агенти [СІ] придатні, наприклад, РОСI3, РСІ3/СІ2 або РСІ5, або суміші цих реагентів. Реакція може проводитися з надлишковою кількістю холорувального агента (РОСI3) або в інертному розчиннику, наприклад, ацетонітрилі або 1,2-дихлоретані. Проведення реакції в РОСІ3 є кращим. Цю взаємодію здійснюють звичайно при температурі між 10°С і 180°С. З практичних розумінь звичайно температура реакції відповідає температурі кипіння застосовуваного агента, що хлорує, (РОСІ3) або розчинника. Спосіб здійснюють переважно з додаванням Ν,Ν-диметилформаміду у каталітичній або підстехіометричній кількості або азотної основи, наприклад, Ν,Ν-диметиланіліну. Амінуванням сполукою формули VII дихлорсполуки формули VI переводять у сполуки формули VIII. Цю взаємодію здійснюють звичайно при температурі від 0°С до 150°С, переважно від 20°С до 120°С [порівн. публікації J. Chem. Res. S (7), стор.286-287 (1995), Liebigs Ann. Chem., стор.17031705 (1995)] в інертному розчиннику, у разі потреби в присутності допоміжної основи. Як розчинник придатні протонні розчинники, такі, як спирти, наприклад, етанол, або апротонні розчинники, такі, як ароматичні вуглеводні або прості ефіри, наприклад толуол, о-, м- та п-ксилол, простий діетиловий ефір, діізопропіловий ефір, трет.-бутилметиловий ефір, діоксан або тетрагідрофуран, зокрема, трет.-бутилметиловий ефір або тетрагідрофуран. Як допоміжні основи придатні, наприклад, NaHCО3, Nа2СО3, Na2HPO4, Nа2B4О7, діетиланілін або етилдіізо-пропіламін. Звичайно компоненти застосовують у близькому до стехіометричного співвідношенні. Однак, амін може застосовуватися також і в надлишку. Аміни формули VII є у продажу або відомі з публікацій і можуть бути отримані відомими методами. Тіосполуки формули VIII окисляють у сульфони IX. 9 76453 10 Реакцію звичайно здійснюють при температурі чений, частково ненасичений або ароматичний від 0°С до 100°С, переважно від 10°С до 50°С у цикл. присутності протонного або апротонного розчинРеакцію звичайно здійснюють при температурі ника [порівн. публікації: В. Kor. Chem. Soc, т.16, від 50°С до 250°С, переважно від 100°С до 200°С у стор.489-492 (1995); Ζ. Chem., т.17, стор.63 присутності інертного розчинника [порівн. публіка(1977)]. ції: Austr. J. Chem., т.32, стор.669-679 (1979); J. Як розчинники придатні при цьому алкіл карOrg. Chem., т.58, стор.3785-3786 (1993); Arm. Xim. бонові кислоти, такі, як оцтова кислота або спирти, ZH, т.38, N11, стор.718-719 (1985)]. такі, як метанол, вода або галогеновані вуглеводЯк розчинник придатні протонні розчинники, ні, такі, як дихлорметан або хлороформ. Можуть такі, як спирти, переважно метанол або етанол, застосовуватися також і суміші наведених розчинапротонні розчинники, такі, як трибутиламін або ників. Кращими є оцтова кислота і суміш метанолу простий етиленглікольдиметиловий ефір. з водою. Як правило, має перевагу застосування осноПридатними оксислювальними агентами є при ви, яка береться в еквімолярній або надлишковій цьому, наприклад, перекис водню, первольфракількості. Як основи придатні алкоголяти лужних і мова кислота, пероцтова кислота, 3лужноземельних металів, такі, як метанолят нахлорпербензойна кислота, перфталева кислота, трію, етанолят натрію, етанолят калію, трет.бутанолят калію, зокрема, метилят натрію або ж хлор, кисень та оксони (KHSO5). Агент, що окисазотні основи, такі, як триетиламін, триізопропілеляє, звичайно застосовується у стехіометричному тиламін і N-метилпіперидин, зокрема, піридин та співвідношенні. Можна працювати також і з надтрибутиламін. лишковою кількістю окислювального агента. Звичайно компоненти застосовують у близьПохідні піримідину формули IX переводять кому до стехіометричного співвідношенні. Однак взаємодією з гетероциклами формули X у сполуки може давати перевагу застосування компонентів у формули І. У формулі X позначає цикл А для від надлишку. п'яти-до десятичленного насиченого, частково ненасиченого або ароматичного кільця, яке містить азот. Ця реакція взаємодії проводиться звичайно при температурі від 0°С до 200°С, переважно від 10°С до 150°С у присутності диполярного, апротонного розчинника, такого, як Ν,Νдиметилформамід, тетрагідрофуран або ацетонітрил [порівн. публікації DE-A 3901084; Chimia, т.50, стор.525-530 (1996); Khim. Geterotsikl. Soedin, т.12, стор.1696-1697(1998)]. Звичайно компоненти застосовують у близькому до стехіометричного співвідношенні. Однак, може давати перевагу застосування гетероцикла азоту формули X у надлишку. Звичайно реакцію здійснюють у присутності основи, яка може бути у еквімолярній, а також надлишковій кількості. Як основи придатні гідрокарбонати лужних і лужноземельних металів, наприклад, Nа2СО3 і NaHCO3, азотні основи, такі, як триетиламін, трибутиламін і піридин, алкоголяти лужних металів, такі, як метилят натрію або трет.бутилат калію, аміди лужних металів, такі, як NaNH2 або ж гідриди лужних металів, такі, як LiH або NaH. Сполуки формули І, у якій R1 зв'язаний через атом вуглецю з піридиновим кільцем, можна одержувати, наприклад, завдяки наступного синтезу: У формулах Vb та XII цикл В позначає зв'язаний вуглецем від п'яти- до десятичленний, наси Хлорування сполуки Vb у сполуку Vlb здійснюють за тих самих умов, що і хлорування сполуки V у сполуку VI. Амінування дихлорпіримідину Vlb з одержанням сполуки VII здійснюють за тих самих умов, що й амінування сполуки VI у сполуку VIII. Сполуки формули І, де R2 позначає алкокси, одержують із відповідних хлорних сполук формули VI (R2=СІ) взаємодією з алкоголятами лужних або лужноземельних металів [порівн. публікації: Heterocycles, Bd. 32, стор.1327-1340 (1991); J. Heterocycl. Chem. Bd. 19, стор.1565-1567 (1982); Geterotsikl. Soedin, стор.400-402 (1991)]. Сполуки формули І, у якій R2 позначає ціано, одержують із відповідних хлорних сполук формули VI (R2=СІ) шляхом реакції взаємодії з ціанідами лужних, лужноземельних металів або такими ціанідами металів, як NaCN, KCN або Zn(CN)2. [ср. публікації Heterocycles, Bd. 39, стор.345-356 (1994); Collect. Czech. Chem. Commun. Bd. 60, стор.1386-1389 (1995); Acta Chim. Scand., Bd. 50, стор.58-63 (1996)]. Сполуки формули І, у якій R2 позначає водень, одержують із відповідних хлорних сполук формули VI (R2=СІ) за допомогою каталітичного гідрування [порівн. публікації: J. Fluorine Chem. Bd. 45, 11 76453 12 стор.417-430 (1989); J. Heterocycl. Chem. Bd. 29, хлорметил, бромметил, дихлорметил, трихлорместор.1369-1370 (1992)], або шляхом відновлення тил, фторметил, дифторметил, трифторметил, цинку в оцтовій кислоті [порівн. публікації: Org. хлорфторметил, дихлорфторметил, хлордифторPrep. Proced. Int., Bd. 27, стор.600-602 (1995); паметил, 1-хлоретил, 1-брометил, 1-фторетил, 2тент JP-A 09/165379]. фторетил, 2,2-дифторетил, 2,2,2-трифторетил, 22 Сполуки формули І, у якій R позначає С1-С6хлор-2-фторетил, 2-хлор-2,2-дифторетил, 2,2алкіл або С1-С6-галогеналкіл, можуть бути отримадихлор-2-фторетил, 2,2,2-трихлоретил, пентафтоні відповідним перетворенням вихідних матеріалів ретил і 1,1,1-трифторпроп-2-іл; формули II аналогічно описаному синтезу з одералкеніл: позначає ненасичені, лінійні або розжанням сполук формули І, у якій R2 позначає хлор. галужені вуглеводневі залишки з від 2 до 4, 6 або 8 Замість складного фенілмалонового ефіру форатомами вуглецю і подвійним зв'язком у будьякому положенні, наприклад, С2-С6-алкеніл, такий, мули II складний феніл- -кетоефір формули XIII, у як етилен, 1-пропеніл, 2-пропеніл, 1-метилетеніл, якій R2 позначає алкіл, піддають взаємодії з тіосе1-бутеніл, 2-бутеніл, 3-бутеніл, 1-метил-1човиною або амідином XII. Наступні реакції взаєпропеніл, 2-метил-1-пропеніл, 1-метил-2-пропеніл, модії проводять аналогічно сполукам з R2=хлор. 2-метил-2-пропеніл, 1-пентеніл, 2-пентеніл, 3пентеніл, 4-пентеніл, 1-метил-1-бутеніл, 2-метил1-бутеніл, 3-метил-1-бутеніл, 1-метил-2-бутеніл, 2метил-2-бутеніл, 3-метил-2-бутеніл, 1-метил-3бутеніл, 2-метил-3-бутеніл, 3-метил-3-бутеніл, 1,1диметил-2-пропеніл, 1,2-диметил-1-пропеніл, 1,2диметил-2-пропеніл, 1-етил-1-пропеніл, 1-етил-2пропеніл, 1-гексеніл, 2-гексеніл, 3-гексеніл, 4гексеніл, 5-гексеніл, 1-метил-1-пентеніл, 2-метил1-пентеніл, 3-метил-1-пентеніл, 4-метил-1пентеніл, 1-метил-2-пентеніл, 2-метил-2-пентеніл, 3-метил-2-пентеніл, 4-метил-2-пентеніл, 1-метилРеакційні суміші переробляють звичайними 3-пентеніл, 2-метил-3-пентеніл, 3-метил-3методами, наприклад, шляхом змішування з вопентеніл, 4-метил-3-пентеніл, 1-метил-4-пентеніл, дою, поділом фаз і, у разі потреби, хроматографі2-метил-4-пентеніл, 3-метил-4-пентеніл, 4-метилчним очищенням сирих продуктів. Проміжні і кін4-пентеніл, 1,1-диметил-2-бутеніл, 1,1-диметил-3цеві продукти присутні у формі безбарвних або бутеніл, 1,2-диметил-1-бутеніл, 1,2-диметил-2коричнюватих, в'язких олій, які при пониженому бутеніл, 1,2-диметил-3-бутеніл, 1,3-диметил-1тиску і по можливості при підвищеній температурі бутеніл, 1,3-диметил-2-бутеніл, 1,3-диметил-3звільняються від летучих часток і очищаються. бутеніл, 2,2-диметил-3-бутеніл, 2,3-диметил-1Якщо проміжні і кінцеві продукти одержують у вибутеніл, 2,3-диметил-2-бутеніл, 2,3-диметил-3гляді твердої речовини, очищення можна проводибутеніл, 3,3-диметил-1-бутеніл, 3,3-диметил-2ти перекристалізацією або дигерируванням. бутеніл, 1-етил-1-бутеніл, 1-етил-2-бутеніл, 1-етилЯкщо окремі сполуки формули I не можуть бу3-бутеніл, 2-етил-1-бутеніл, 2-етил-2-бутеніл, 2ти отримані шляхом, який описаний вище, їх можетил-3-бутеніл, 1,1,2-триметил-2-пропеніл, 1-етилна одержати дериватизацією інших сполук форму1-метил-2-пропеніл, 1-етил-2-метил-1-пропеніл та ли І. 1-етил-2-метил-2-пропеніл; Для приведених у даних формулах символів алкініл: означає лінійні або розгалужені вуглезастосовуються збірні поняття, які дійсні для нижводневі групи з від 2 до 4, 6 або 8 атомами вуглеченаведених замісників: цю і потрійним зв'язком у будь-якому положенні, галоген: означає фтор, хлор, бром та йод; наприклад, С2-С6-алкініл, такий, як етиніл, 1алкіл: означає насичені, лінійні або розгалужепропініл, 2-пропініл, 1-бутиніл, 2-бутиніл, 3ні вуглеводневі залишки з від 1 до 4, 6 або 8 атобутиніл, 1-метил-2-пропініл, 1-пентиніл, 2мами вуглецю, наприклад, С1-С6-алкіл, такий як пентиніл, 3-пентиніл, 4-пентиніл, 1-метил-2метил, етил, пропіл, 1-метилетил, бутил, 1-метилбутиніл, 1-метил-3-бутиніл, 2-метил-3-бутиніл, 3пропіл, 2-метилпропіл, 1,1-диметилетил, пентил, метил-1-бутиніл, 1,1-диметил-2-пропініл, 1-етил-21-метилбутил, 2-метилбутил, 3-метилбутил, 2,2пропініл, 1-гексиніл, 2-гексиніл, 3-гексиніл, 4диметилпропіл, 1-етилпропіл, гексил, 1,1гексиніл, 5-гексиніл, 1-метил-2-пентиніл, 1-метилдиметилпропіл, 1,2-диметилпропіл, 13-пентиніл, 1-метил-4-пентиніл, 2-метил-3метилпентил, 2-метилпентил, 3-метилпентил, 4пентиніл, 2-метил-4-пентиніл, 3-метил-1-пентиніл, метилпентил, 1,1-диметилбутил, 1,23-метил-4-пентиніл, 4-метил-і-пентиніл, 4-метил-2диметилбутил, 1,3-диметилбутил, 2,2пентиніл, 1,1-диметил-2-бутиніл, 1,1-диметил-3диметилбутил, 2,3-диметилбутил, 3,3бутиніл, 1,2-диметил-3-бутиніл, 2,2-диметил-3диметилбутил, 1-етилбутил, 2-етилбутил, 1,1,2бутиніл, 3,3-диметил-1-бутиніл, 1-етил-2-бутиніл, триметилпропіл, 1,2,2-триметилпропіл, 1-етил-11-етил-3-бутиніл, 2-етил-3-бутиніл і 1-етил-1метилпропіл і 1-етил-2-метилпропіл; метил-2-пропініл; галогеналкіл: позначає лінійні або розгалужені циклоалкіл: позначає моноциклічні, насичені алкільні групи з від 1 до 8 атомами вуглецю (привуглеводневі групи з від 3 до 6 вуглецевими члеведені вище), причому в цих групах атоми водню нами кільця, такі, як циклопропіл, циклобутил, цикможуть бути частково або цілком замінені атомами лопентил і циклогексил; галогену, наприклад, С1-С2-галогеналкіл, такий, як алкоксикарбоніл: позначає алкоксигрупу з від 1 13 76453 14 до 6 атомами вуглецю (як наведено вище), яка го до чотирьох атомів азоту або від одного до через карбонільну групу (-СО-) зв'язана із скелетрьох атомів азоту й один атом сірки або кисню: 5том; членні гетероарильні групи, які поряд з атомами оксіалкіленокси: двовалентний, лінійний ланвуглецю можуть містити від одного до чотирьох цюг з від 1 до 3 СН2-групами, причому обидві ваатомів азоту або від одного до чотирьох атомів лентності зв'язані через атом кисню зі скелетом, азоту й один атом сірки або кисню як члени кільця, наприклад: ОСН2О, ОСН2СН2О та ОСН2СН2СН2О; наприклад, 2-фурил, 3-фурил, 2-тієніл, 3-тієніл, 2від п'яти до десятичленного, насичений або піроліл, 3-піроліл, 3-ізоксазоліл, 4-ізоксазоліл, 5частково ненасичений гетероцикл, який містить від ізоксазоліл, 3-ізотіазоліл, 4-ізотіазоліл, 5одного до чотирьох гетероатомів із групи, яка ізотіазоліл, 3-піразоліл, 4-піразоліл, 5-піразоліл, 2включає кисень, азот або сірку: моно- або біцикліоксазоліл, 4-оксазоліл, 5-оксазоліл, 2-тіазоліл, 4чні гетероцикли (гетероцикліл), які містять поряд з тіазоліл, 5-тіазоліл, 2-імідазоліл, 4-імідазоліл, вуглеводневими членами кільця від одного до 1,2,4-оксадіазол-3-іл, 1,2,4-оксадіазол-5-іл, 1,2,4трьох атомів азоту та/або атом кисню або атом тіадіазол-3-іл, 1,2,4-тіадіазол-5-іл, 1,2,4-триазол-3сірки, або один або два атоми кисню та/або сірки, іл, 1,3,4-оксадіазол-2-іл, 1,3,4-тіадіазол-2-іл і 1,3,4наприклад: 2-тетрагідрофураніл, 3-тетрагідротриазол-2-іл; фураніл, 2-тетрагідротієніл, 3-тетрагідротієніл, 2- бензоконденсований 5-членний гетероарил. піролідиніл, 3-піролідиніл, 3-ізоксазолідиніл, 4який містить від одного до трьох атомів азоту або ізоксазолідиніл, 5-ізоксазолідиніл, 3один атом азоту й один атом кисню або сірки: 5ізотіазолідиніл, 4-ізотіазолідиніл, 5-ізотіазолідиніл, членні гетероарильні групи, які поряд з атомами 3-піразолідиніл, 4-піразолідиніл, 5-піразолідиніл, 2вуглецю можуть містити від одного до чотирьох оксазолідиніл, 4-оксазолідиніл, 5-оксазолідиніл, 2атомів азоту або від одного до трьох атомів азоту тіазолідиніл, 4-тіазолідиніл, 5-тіазолідиніл, 2й один атом сірки або кисню як члени кільця, і в імідазолідиніл, 4-імідазолідиніл, 1,2,4якій два суміжних вуглецевих члени або кільця, оксадіазолідин-3-іл, 1,2,4- оксадіазолідин-5-іл, один азотний і один суміжний вуглецевий член 1,2,4-тіадіазолідин-3-іл, 1,2,4-тіадіазолідин-5-іл, кільця можуть бути зв'язані за допомогою бута-1,31,2,4-триазолідин-3-іл, 1,3,4-оксадіазолідин-2-іл, дієн-1,4-діілгрупу, у якій один або два атоми вуг1,3,4-тіадіазолідин-2-іл, 1,3,4-триазолідин-2-іл, 2,3лецю можуть бути замінені атомами азоту; дигідрофур-2-ил, 2,3-дигідрофур-3-ил, 2,4- зв'язаний через азот 5-членний гетероарил. дигідрофур-2-ил, 2,4-дигідрофур-3-ил, 2,3який містить від одного до чотирьох атомів азоту дигідротієн-2-іл, 2,3-дигідротієн-3-іл, 2,4або зв'язаний азотом бензоконденсований 5дигідротієн-2-іл, 2,4-дигідротієн-3-іл, 2-піролін-2-іл, членний гетероарил, який містить від одного до 2-піролін-3-іл, 3-піролін-2-іл, 3-піролін-3-іл, 2трьох атомів азоту: 5-членні гетероарильні групи, ізоксазолін-3-іл, 3-ізоксазолін-3-іл, 4-ізоксазолін-3які поряд з атомами вуглецю можуть містити від іл, 2-ізоксазолін-4-іл, 3-ізоксазолін-4-іл, 4одного до чотирьох атомів азоту, відповідно, від ізоксазолін-4-іл, 2-ізоксазолін-5-іл, 3-ізоксазолін-5одного до трьох атомів азоту як члени кільця, і в іл, 4-ізоксазолін-5-іл, 2-ізотіазолін-3-іл, 3якій два суміжних вуглецевих члени кільця або ізотіазолін-3-іл, 4-ізотіазолін-3-іл, 2-ізотіазолін-4-іл, азотний та суміжний вуглецевий член кільця мо3-ізотіазолін-4-іл, 4-ізотіазолін-4-іл, 2-ізотіазолін-5жуть бути зв'язані містком за допомогою бута-1,3іл, 3-ізотіазолін-5-іл, 4-ізотіазолін-5-іл, 2,3дієн-1,4-діілової групи, у якій один або два атоми дигідропіразол-1-іл, 2,3-дигідропіразол-2-іл, 2,3вуглецю можуть бути замінені атомами азоту, придигідропіразол-3-іл, 2,3-дигідропіразол-4-іл, 2,3чому ці кільця зв'язані зі скелетом через один з дигідропіразол-5-іл, 3,4-дигідропіразол-1-іл, 3,4азотних членів кільця; дигідропіразол-3-іл, 3,4-дигідропіразол-4-іл, 3,4- 6-членний гетероарил, який містить від однодигідропіразол-5-іл, 4,5-дигідропіразол-1-іл, 4,5го до трьох, відповідно, від одного до чотирьох дигідропіразол-3-іл, 4,5-дигідропіразол-4-іл, 4,5атомів азоту: 6-членні гетероарильні групи, які дигідропіразол-5-іл, 2,3-дигідрооксазол-2-іл, 2,3поряд з атомами вуглецю можуть містити від однодигідрооксазол-3-іл, 2,3-дигідрооксазол-4-іл, 2,3го до трьох, відповідно, від одного до чотирьох дигідрооксазол-5-іл, 3,4-дигідрооксазол-2-іл, 3,4атомів азоту як члени кільця, наприклад: 3дигідрооксазол-3-іл, 3,4-дигідрооксазол-4-іл, 3,4піридазиніл, 4-піридазиніл, 2-піримідиніл, 4дигідрооксазол-5-іл, 3,4-дигідрооксазол-2-іл, 3,4піримідиніл, 5-піримідиніл, 2-піразиніл, 1,3,5дигідрооксазол-3-іл, 3,4-дигідрооксазол-4-іл, 2триазин-2-іл та 1,2,4-триазин-3-іл; піперидиніл, 3-піперидиніл, 4-піперидиніл, 1,3Особливо кращі форми виконання проміжних діоксан-5-іл, 2-тетрагідропіраніл, 4продуктів у відношенні замісників відповідають тетрагідропіраніл, 2-тетрагідротієніл, 3залишкам від R1 до R9 формули І. гексагідропіридазиніл, 4-гексагідропіридазиніл, 2При урахуванні відповідного їхньому признагексагідропіримідиніл, 4-гексагідропіримідиніл, 5ченню застосування для фенілпіримідинів формугексагідропіримідиніл, 2-піперазиніл, 1,3,5ли І особливо кращими є наступні значення замісгексагідротриазин-2-іл та 1,2,4-гексагідротриазинників, як по окремості, так і в сполученні один з 3-іл; одним : від п'яти- до десятичленний ароматичний геКращими є сполуки формули І, у яких R1 являє тероцикл, який містить від одного до чотирьох гесобою ароматичний гетероцикл. тероатомів із групи, яка включає кисень, азот або Крім того кращими є сполуки формули І, у яких сірку: одно- або двохядерний гетероарил, наприR1 являє собою п'яти- або шестичленний, зокрема, клад: п'ятичленний гетероцикл. - 5-членний гетероарил, який містить від одноОсобливо кращими є сполуки формули І, у 15 76453 16 яких R1 являє собою гетероцикл, який містить R3 позначає водень і R4 позначає С1-С4азот. галогеналкіл. Поряд з цим кращими є сполуки формули І, у Далі кращими є сполуки формули І, у яких R3 і 1 4 яких R являє собою гетероцикл, який зв'язаний з R разом з атомом азоту, з яким вони зв'язані, піримідиновим кільцем через азот. утворюють п'яти або шестичленне кільце, яке моВ однаковому ступені кращими є сполуки фоже бути перервано атомом кисню і може мати рмули І, у яких R1 позначає наступні групи: піроліл, один або два С1-С6-алкільних замісники. піразоліл, імідазоліл, 1,2,4-триазоліл, 1,2,3Далі кращими є сполуки формули І, у яких як тризоліл, тетразоліл, 1,2,3-триазиніл, 1,2,4R5 так і R6 не позначають водень. триазиніл, оксазоліл, ізоксазоліл, 1,3,4Особливо кращими є сполуки формули І, у оксадіазоліл, фураніл, тіофеніл, тіазоліл, ізотіазояких R5 позначає водень. ліл, причому гетероцикл може бути зв'язаний з В однаковому ступені кращими є сполуки фопіримідиновим кільцем через С або N. рмули І, у яких R5 позначає водень і R6 галоген Далі кращими є сполуки формули І, у яких або метил. цикл R1 позначає піридазиніл, піримідиніл або піДалі кращими є сполуки формули І, у яких R7 і 8 разиніл, зокрема, 2-піримідиніл. R однакові або різні й позначають водень або В однаковому ступені кращими є сполуки фогалоген. рмули І, у яких R1 позначає необов'язково заміщеКрім того, кращими є сполуки формули І, у ний однією або трьома групами Ra або Ra' піразояких R9 позначає водень, галоген або С1-С4ліл, піроліл, імідазоліл, 1,2,3-триазоліл, 1,2,4алкокси. триазоліл, тетразоліл, 2-піридиніл, 2-піримідиніл, Далі кращими є сполуки формули I', у яких від пиразиніл або 3-піридазиніл. R1 до R4 мають приведені у формулі І значення та Особливо кращими є сполуки формули І, у RA позначає наступні залишки: 2-хлор, 6-фтор; 2,61 яких R позначає піразоліл, 1,2,3-триазоліл або дифтор; 2,6-дихлор; 2-метил, 4-фтор; 2-метил, 61,2,4-триазоліл, зокрема, 1-піразоліл. фтор; 2-фтор, 4-метил; 2,4,6-трифтор; 2,6-дифтор, Поряд з цим кращими є сполуки формули І, у 4-метокси, 2,4-диметил та пентафтор. яких цикл R1 заміщений від однієї до трьох однаковими або різними наступними групами Ra': галоген, гідроксил, ціано, нітро, аміно, меркапто, С1-С6-алкіл, С1-С6-галогеналкіл, С2-С6-алкеніл, С2-С6-алкініл, С3-С6-циклоалкіл, С1-С6-алкокси, С1С6-галогеналкокси, карбоксил, С1-С7алкоксикарбоніл, карбамоїл, С1-С7алкіламінокарбоніл, С1-С6-алкіл-С1-С6алкіламінокарбоніл, морфолінокарбоніл, піролідинокарбоніл, С1-С7алкілкарбоніламіно, С1-С6Крім того, кращими є сполуки формули I', у алкіламіно, ди-(С1-С6-алкіл)аміно, С1-С6-алкілтіо, яких RA позначає 2,4,6-трифтор. С1-С6-алкілсульфініл, С1-С6-алкілсульфоніл, гідроЗокрема, переважні сполуки І приведені в никсисульфоніл, аміносульфоніл, С1-С6жченаведених таблицях. Наведені в цих таблицях алкіламіносульфоніл або ди-(С1-С6групи являють собою особливо кращі замісники. алкіл)аміносульфоніл. Таблиця 1 Зокрема, кращими є сполуки формули І, у яких Сполуки формули I-1, у яких R5 позначає цикл R1 заміщений від однієї до трьох однаковими фтор, R6 позначає хлор і R7, R8 та R9 позначають або різними наступними групами Ra' водень та комбінація залишків R3 і R4 відповідає галоген, ціано, нітро, аміно, С1-С6-алкіл, С1-С6сполуці одного рядка таблиці А. галогеналкіл, С -С -алкоксикарбоксил, С -С 1 6 1 7 алкоксикарбоніл, карбамоїл, С1-С7алкіламінокарбоніл, ди-(С1-С6-алкіл)амінокарбоніл або С1-С7-алкілкарбоніламіно. Особливо кращими є сполуки формули І, у яких R1 незаміщений або заміщений одноразово галогеном, ціаногрупою, нітрогрупою, метилом або метоксигрупою. В однаковому ступені кращими є сполуки формули І, у яких R2 не позначає водень. Крім того, кращими є сполуки формули І, у яких R2 позначає галоген, С1-С6-алкіл або С1-С6алкокси, зокрема, галоген. Особливо кращими є сполуки формули І, у 2 яких R позначає хлор. Крім того, кращими є сполуки формули І, у яких R3 позначає водень. В однаковому ступені кращими є сполуки формули І, у яких R3 і R4 незалежно один від одного позначають С1-С6-алкіл, С1-С6-галогеналкіл, С3-С6циклоалкіл, С2-С6-алкеніл. Зокрема, кращими є сполуки формули І, у яких Таблиця 2 Сполуки формули I-1, у яких R5 та R6 позначають фтор і R7, R8 та R9 позначають водень та 3 4 комбінація залишків R і R відповідає сполуці одного рядка таблиці А. Таблиця 3 Сполуки формули I-1, у яких R5 і R6 позначають хлор і R7, R8 та R9 позначають водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. 17 76453 18 Таблиця 4 рядка таблиці А. Сполуки формули I-1, у яких R5 позначає фтор Таблиця 16 6 і R метил та R7, R8 і R9 позначають водень та Сполуки формули I-2, у яких R5 і R6 познача3 4 комбінація залишків R і R відповідає сполуці одють, R7 і R8 - водень і R9 метокси та комбінація ного рядка таблиці А. залишків R3 і R4 відповідає сполуці одного рядка Таблиця 5 таблиці А. Сполуки формули I-1, у яких R5, R6 і R9 познаТаблиця 17 чають фтор та R7 і R8 позначають водень та комбіСполуки формули I-2, у яких R5, R6, R7, R8 і R9 3 4 нація залишків R і R відповідає сполуці одного позначають фтор і комбінація залишків R3 і R4 відрядка таблиці А. повідає сполуці одного рядка таблиці А. Таблиця 6 Таблиця 18 Сполуки формули I-1, у яких R5 і R6 позначаСполуки формули I-2, у яких R5 позначає меють фтор, R7 і R8 позначають водень і R9 - метокси тил, R6, R7 і R8 позначають водень і R9 - фтор та та комбінація залишків R3 і R4 відповідає сполуці комбінація залишків R3 і R4 відповідає сполуці ододного рядка таблиці А. ного рядка таблиці А, Таблиця 7 Таблиця 19 Сполуки формули I-1, у яких R5, R6, R7, R8 і R9 Сполуки формули I-2, у яких R5 позначає позначають фтор і комбінація залишків R3 і R4 відфтор, R6, R7 і R8 позначають водень і R9 - метил та повідає сполуці одного рядка таблиці А. комбінація залишків R3 і R4 відповідає сполуці одТаблиця 8 ного рядка таблиці А. Сполуки формули I-1, у яких R5 позначає меТаблиця 20 тил, R6, R7 і R8 позначають водень і R9 позначає Сполуки формули I-2, у яких R5 і R9 позначафтор та комбінація залишків R3 і R4 відповідає ють метил і R6, R7 і R8 позначають водень та комсполуці одного рядка таблиці А. бінація залишків R3 і R4 відповідає сполуці одного Таблиця 9 рядка таблиці А. Сполуки формули I-1, у яких R5 позначає Таблиця 21 фтор, R6, R7 і R8 позначають водень і R9 - метил та Сполуки формули I-3, у яких R5 позначає комбінація залишків R3 і R4 відповідає сполуці одфтор, R6 позначає хлор і R7, R8 і R позначають ного рядка таблиці А. водень та комбінація залишків R3 і R4 відповідає Таблиця 10 сполуці одного рядка таблиці А. Сполуки формули I-1, у яких R5 і R9 позначають метил і R6, R7 та R8 позначають фтор та ком3 4 бінація залишків R і R відповідає сполуці одного рядка таблиці А. Таблиця 11 Сполуки формули I-2, у яких R5 позначає фтор, R6 позначає хлор і R7, R8 і R9 позначають водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 22 Сполуки формули I-3, у яких R5 і R6 позначають фтор і R7, R8 і R9 позначають водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 23 Сполуки формули I-3, у яких R5 і R6 позначають хлор і R7, R8 і R9 - водень та комбінація залишків R3 і R4 відповідає споТаблиця 12 луці одного рядка таблиці А. Сполуки формули I-2, у яких R5 і R6 позначаТаблиця 24 ють фтор і R7, R8 і R9 позначають водень та комбіСполуки формули I-3, у яких R5 позначає фтор 3 4 6 нація залишків R і R відповідає сполуці одного і R позначає метил і R7, R8 і R9 позначають водень рядка таблиці А. та комбінація залишків R3 і R4 відповідає сполуці Таблиця 13 одного рядка таблиці А. Сполуки формули I-2, у яких R5 і R6 позначаТаблиця 25 ють хлор і R7, R8 і R9 позначають водень та комбіСполуки формули I-3, у яких R5, R6 і R9 позна3 4 нація залишків R і R відповідає сполуці одного чає фтор і R7 і R8 позначають водень та комбінація рядка таблиці А. залишків R3 і R4 відповідає сполуці одного рядка Таблиця 14 таблиці А. Сполуки формули I-2, у яких R5 позначає фтор Таблиця 26 і R6 метил і R7, R8 і R9 позначають водень та комСполуки формули I-3, у яких R5 і R6 познача3 4 бінація залишків R і R відповідає сполуці одного ють фтор, R7 і R8 позначає водень і R9 позначає рядка таблиці А. метокси та комбінація залишків R3 і R4 відповідає Таблиця 15 сполуці одного рядка таблиці А. Сполуки формули I-2, у яких R5, R6 і R9 познаТаблиця 27 чають фтор та R7 і R8 позначають водень та комбіСполуки формули I-3, у яких R5, R6, R7, R8 і R9 3 4 нація залишків R і R відповідає сполуці одного позначають фтор і комбінація залишків R3 і R4 від 19 76453 20 повідає сполуці одного рядка таблиці А. комбінація залишків R3 і R4 відповідає сполуці одТаблиця 28 ного рядка таблиці А. Сполуки формули I-3, у яких R5 позначає меТаблиця 40 тил, R6, R7 і R8 позначають водень і R9 позначає Сполуки формули I-4, у яких R5 і R9 познача3 4 фтор та комбінація залишків R і R відповідає ють метил і R6, R7 та R8 позначають водень та 3 4 сполуці одного рядка таблиці А. комбінація залишків R і R відповідає сполуці одТаблиця 29 ного рядка таблиці А. Сполуки формули I-3, у яких R5 позначає фтор, R6, R7 і R8 позначають водень і R9 позначає метил та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 30 Сполуки формули I-3, у яких R5 і R9 позначають метил і R6, R7 і R8 позначають водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 31 Сполуки формули I-4, у яких R5 позначає фтор, R6 позначає хлор і R7, R8 і R9 позначають водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 32 Сполуки формули I-4, у яких R5 і R6 позначають фтор і R7, R8 і R9 позначають водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 33 Сполуки формули I-4, у яких R5 і R6 позначають хлор і R7, R8 і R9 позначають водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 34 Сполукиформули I-4, у яких R5 позначає фтор 6 і R позначає метил і R7, R8 і R9 позначають водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 35 Сполуки формули I-4, у яких R5, R6 і R9 позначають фтор і R7 і R8 позначає водень та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 36 Сполуки формули I-4, у яких R5 і R6 позначають фтор, R7 і R8 позначають водень та R9 - метокси та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 37 Сполуки формули I-4, у яких R5, R6, R7, R8 і R9 позначають фтор і комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 38 Сполуки формули I-4, у яких R5 позначає метил, R6, R7 і R8 позначають водень і R9 позначає фтор та комбінація залишків R3 і R4 відповідає сполуці одного рядка таблиці А. Таблиця 39 Сполуки формули I-4, у яких R5 позначає фтор, R6, R7 і R8 позначають водень і R9 - метил та 21 76453 22 Сполуки І придатні як фунгіциди. Вони відрізняються прекрасною активністю проти широкого спектра фітопатогенних грибів, зокрема, із класу аскоміцетів, дейтероміцетів, фікоміцетів і базидіоміцетів. Вони є частково систематично активними і можуть застосовуватися при захисті рослин у якості ґрунтових і листяних фунгіцидів. Вони мають особливе значення при боротьбі з рядом фітопатогенних грибів на різних культурних рослинах, таких, як пшениця, жито, ячмінь, овес, рис, кукурудза, злаки, банани, бавовник, соєві, кава, цукровий очерет, виноград, плодові і декоративні рослини, і на овочевих культурах, таких, як огірки, бобові, томати, картопля і гарбузові, а також на насінні цих рослин. Особливо вони придатні для боротьби проти наступних хвороб рослин: - види Alternaria на овочевих і плодових рослинах, - Botrytis cinerea (сіра гнилизна) на полуничних, овочевих, декоративних культурах і на виноградній лозі, - Cercospora arachidicola на земляних горіхах, - Erysiphe cichoracearum і Sphaerotheca fuliginea на гарбузових, - Erysiphe graminis (борошниста роса) на зернових культурах, - види Fusarium і Verticillium на різних рослинах, - види Helminthosporium на зернових культурах, - види Mycosphaerella на бананах і земляних горіхах, - Phytophthora infestans на картоплі і томатах, - Plasmopara viticola на виноградній лозі, - Podosphaera leucotricha на яблуневих, - Pseudocercosporella herpotrichoides на пшениці і ячмені, - види Pseudoperonospora на хмелі й огірках, - види Puccinia на зернових, - Pyricularia oryzae на рисі, - види Rhizoctonia на бавовнику, рисі і дернині, - Septoria nodorum на пшениці, - Uncinula necator на виноградній лозі, 23 76453 24 - види Ustilago на зернових і цукровому очереамонієві солі лігнінсульфокислоти, нафталінсульті, а також фокислоти, фенолсульфокислоти, дибутилнафта- види Venturia (парша) на яблуневих і грушелінсульфокислоти, алкіларилсульфонати, алкілсувих. льфати, алкілсульфонати, сульфати спиртів Крім того, сполуки І придатні для боротьби з жирного ряду, кислоти жирного ряду, а також їхні фітопатогенними грибами, такими, як Paecilomyces солі лужних і лужноземельних металів, солі сульvariotii при захисті матеріалів (наприклад, деревифатованого гліколевого ефіру жирного ряду, прони, папера, у дисперсіях для покрить, волокон, дукти конденсації сульфонованого нафталіну і відповідно, тканин) і при захисті складованих запапохідних нафталіну з формальдегідом, продукти сів. конденсації нафталіну, відповідно, нафталінсульСполуки І застосовуються таким чином, що фокислот з фенолом і формальдегідом, поліоксіегриби або рослини, які підлягають захисту від уратиленоктилфенольний ефір, етоксильований ізооження ними, матеріали або ґрунт обробляють фуктилфенол, октилфенол, нонілфенол, нгіцидно активною кількістю діючої речовини. Заалкілфенолполігліколевий ефір, трибутилфенілстосування може здійснюватися як перед, так і полігліколевий ефір, алкіларилполіефірні спирти, після ураження грибами матеріалів, рослин або ізотридециловий спирт, продукти конденсації етинасiнь. леноксиду жирних спиртів, етоксильована кастоФунгіцидні засоби містять у загальному між 0,1 рова олія, поліоксіетиленалкіловий ефір, етоксиі 95, переважно, між 0,5 і 90мас.% діючої речольований поліоксипропілен, ацеталь вини. полігліколевого ефіру лаурилового спирту жирного Норми витрати становлять при застосуванні ряду, складний ефір сорбіту, лігнінисульфітні відпдля захисту рослин у залежності від бажаного рацьовані луги і метилцелюлоза. ефекту між 0,01 і 2,0кг діючої речовини на гектар. Для одержання призначених для безпосередПри обробці посівного зерна в загальному понього розприскування розчинів, емульсій, паст, трібно кількості діючої речовини від 0,001 до 0,1г, або масляних дисперсій застосовуються фракції переважно від 0,01 до 0,05г на кг посівного матерімінеральних олій ізсередньою і високою точками алу. кипіння, такі, як гас або дизельне паливо (олія), При застосуванні для захисту матеріалів, віддьогтьові олії рослинного або тваринного похоповідно, складованих запасів норма витрати орієндження, аліфатичні, циклічні й ароматичні вуглетується на область застосування і на бажаний водні, наприклад, бензол, толуол, ксилол, параефект. Звичайні норми витрати при захисті матефін, тетрагідронафталін, алкільовані нафталіни ріалів складають, наприклад, від 0,001 г до 2кг, або їхні похідні, метанол, етанол, пропанол, бутапереважно, від 0,005г до 1кг діючої речовини на нол, хлороформ, тетрахлорвуглець, циклогексакубометр матеріалу, якій піддають обробці. нол, циклогексанон, хлорбензол, ізоформ, сильно Сполуки І можуть бути переведені в звичайні полярні розчинники, наприклад, диметилформапрепаративні форми, наприклад, розчини, емульмід, діетилсульфоксид, N-метилпіролідон, вода. сії, суспензії, тонкі порошки, порошки, пасти і граПорошкові препарати, препарати для обпилюнулят. Препаративна форма залежить від мети вання й обпудрювання можуть бути виготовлені застосування, вона повинна в будь-якому випадку шляхом змішування або спільного розмелювання забезпечувати тонкий і рівномірний розподіл сподіючих речовин із твердим наповнювачем. луки згідно із винаходом. Гранулят, наприклад, оболонковий, просочеПрепаративні форми одержують відомим чиний або гомогенний гранулят може бути отриманом, наприклад, шляхом розведення діючої речоний шляхом зв'язування діючої речовини з твервини в розчинниках та/або наповнювачах, за бадими наповнювачами. Твердими наповнювачами жанням із застосуванням емульгаторів або можуть бути, наприклад, мінеральні землі, такі, як диспергаторів, причому при застосуванні як розрісилікагель, кремнієві кислоти, силікати, тальк, каоджувача води, інші органічні розчинники також лін, атаклау, вапняк, вапно, крейда, болюс, лес, можуть застосовуватися як допоміжні агенти. У глина, доломіт, діатомова земля, сульфат кальцію якості допоміжних агентів придатні в основному: і магнію, окис магнію, подрібнена пластмаса, доброзчинники, такі, як ароматичні (наприклад, ксирива, такі, як сульфат амонію, фосфат амонію, лол), хлоровані ароматичні (наприклад, хлорбеннітрат амонію, сечовини і рослинні продукти, такі, золи), парафіни (наприклад, фракції нафти), спиряк зернове борошно, борошно деревної кори, дети (наприклад, метанол, бутанол), кетони ревне борошно і борошно горіхової шкарлупи, по(наприклад, циклогексанон), аміни (наприклад, рошок целюлози й інші тверді наповнювачі. етаноламін, диметилформамід) і вода; наповнюПрепаративні форми містять у загальному між вачи, такі, як природні подрібнені породи (напри0,01 і 95мас.%, переважно між 0,1 і 90мас.% діючої клад, каолін, глинозем, тальк, крейда) і штучні поречовини. Діючі речовини мають при цьому чистодрібнені породи (наприклад, високодисперсна ту від 90% до 100%, переважно, від 95% до 100% кремнієва кислота, солі кремнієвої кислоти); ему(за спектром ЯМР). льгатори, такі, як неіоногенні й аніонні емульгатоПриклади препаративних форм: ри (наприклад, поліоксіетиленовий ефір спирту I. 5ваг. часток сполуки відповідно до винаходу жирного ряду, алкілсульфонати й арилсульфонаретельно перемішують з 95ваг. частками тонкого ти) і диспергатори, такі, як лігнінсульфітні відпракаоліну. У такий спосіб одержують засіб для обпицьовані луги та метилцелюлоза. лювання, який містить 5мас.% діючої речовини. Як поверхнево-активні речовини застосовуII. 30ваг. часток сполуки відповідно до винахоються солі лужних, лужноземельних металів і ду ретельно перемішують з 92ваг. частками поро 25 76453 26 шкового силікагелю і 8ваг. частками парафінової дом. олії, яку наприскують на поверхню цього силікагеВодні препаративні форми можуть бути приголю. У такий спосіб одержують препаративну фортовлені з концентратів емульсій, паст або порошму діючої речовини з гарною адгезивною здатнісків, які змочуються, (порошки для розприскування, тю (вміст діючої речовини 23мас.%). масляні дисперсії) шляхом додавання води. Для III. 10ваг. часток сполуки відповідно до винавиготовлення емульсій, паст або масляних диспеходу розчиняють у суміші, яка складається з 90ваг. рсій речовини як такі, або ж розчинені в олії, мочасток ксилолу, 6ваг. часток продукту приєднання жуть гомогенізуватися у воді за допомогою змочувід 8 до 10молів етиленоксиду до 1моля Nвальних агентів, активаторів адгезії, диспергаторів моноетаноламіду олеїнової кислоти, 2ваг. частки або емульгаторів. Можуть також приготовлятися кальцієвої солі додецилбензолсульфокислоти і концентрати, які можна розбавляти водою, які 2ваг. частки продукту приєднання 40молів етилескладаються з діючої речовини, змочувального ноксиду до 1моля касторової олії (вміст діючої агента, активатора адгезії, диспергатора або емуречовини 9мас.%). льгатора і, можливо, з розчинника й олії. IV. 20ваг. часток сполуки відповідно до винаКонцентрація діючої речовини у готових до заходу розчиняють у суміші, яка складається з 60ваг. стосування препаратах може варіювати у широких часток циклогексанону, 30ваг. часток ізобутанолу, межах. У загальному вона складає від 0,0001 до 5ваг. часток продукту приєднання 7молів етилено10%, переважно, від 0,01 до 1%. ксиду до 1моля ізооктилфенолу і 5ваг. часток проДіючі речовини можуть застосовуватися з усдукту приєднання 40молів етиленоксиду до 1 моля піхом при особливо низьких нормах витрати, прикасторової олії (вміст діючої речовини 16мас.%). чому існує можливість використовувати препарати V. 80ваг. часток сполуки відповідно до винахоз більш, ніж 95мас.% діючої речовини або навіть ду добре перемішують з 3ваг. частками натрієвої застосовувати діючу речовину без добавок. До діючих речовинам можуть додаватися олії солі діізобутилнафталін- -сульфокислоти, 10ваг. різного типу, гербіциди, фунгіциди, інші засоби частками натрієвої солі лігнінсульфокислоти із боротьби зі шкідниками, бактерициди, у разі потсульфітної відпрацьованої луги і 7ваг. частками реби, також і безпосередньо перед застосуванням порошкового силікагелю і перемелюють у молот(суміші в баці). Ці засоби можуть домішуватися до ковому млині (вміст діючої речовини 80мас.%)· сполук згідно із винаходом у ваговому співвідноVI. Перемішують 90ваг. часток сполуки відпошенні від 1:10 до 10:1. відно до винаходу з 10ваг. частками N-метил- Сполуки згідно із винаходом у формі застосупіролідону й одержують розчин, який придатний вання як фунгіциди можуть використовуватися для застосування у формі дрібних крапель (вміст разом з іншими діючими речовинами, наприклад, діючої речовини 90мас.%). гербіцидами, інсектицидами, регуляторами росту, VII. 20ваг. часток сполуки відповідно до винафунгіцидами або ж добривами. При змішуванні ходу розчиняють у суміші, яка складається з 40ваг. сполук І, відповідно, фунгіцидних засобів, які місчасток циклогексанону, 30ваг. часток ізобутанолу, тять їх, з іншими фунгіцидами в багатьох випадках 20ваг. часток продукту приєднання 7молів етилезабезпечується збільшення спектра фунгіцидноксиду до 1моля ізооктилфенолу і 10ваг. часток ної дії. продукту приєднання 40молів етиленоксиду до Нижченаведений перелік фунгіцидів, які можна 1моля касторової олії. Шляхом концентрації і тонзастосовувати разом зі сполуками згідно із винакого розподілу розчину в 100000ваг. часток води ходом, пояснює можливості їхнього комбінування, одержують водну дисперсію, яка містить 0,02ваг.% однак не обмежує їх. До таких фунгіцидів віднодіючої речовини. сяться наступні: VIII. 20ваг. часток сполуки відповідно до вина- сірка, дитіокарбонати і їхні похідні, таки, як ходу добре перемішують з 3ваг. частками натрієферідиметилдитіокарбамат, цинкдиметилдитіокавої солі діізобутилнафталін- -сульфокислоти, рбамат, цинкдиметилдитіокабамат, марганець17ваг. частками натрієвої солі лігнінсульфокислоетиленбісдитіокарбамат, марганецьцинкетилендіти із сульфітної відпрацьованої луги і 60ваг. частамінбісдитіокарбамат, тетраметилтіурамдисульфіками порошкового силікагелю і перемелюють у ди, аміачний комплекс цинк(N,N-етиленмолотковому млині. Шляхом тонкого розподілу бісдитіокарбамату), аміачний комплекс цинк-(N,N'суміші в 20000ваг. частках води одержують розчин пропіленбіс-дитіокарбамату), полімер цинк-(N,N'для обприскування, який містить 0,1мас.% діючої пропіленбісдитіокарбамату), Ν,Ν'речовини. пропіленбіс(тіокарбомоїл)дисульфід; Діючі речовини можуть застосовуватися як та- нітропохідні, такі, як динітро-(1-метилгептил)кі, у їхній препаративній формі або ж у приготовфенілкротонат, 2-втор.-бутил-4,6-динітрофенілленій з них формі застосування, наприклад, у фо3,3-диметилакрилат, 2-втор.-бутил-4,6-динітрормі розчинів, які підлягають безпосередньому фенілізопропілкарбонат, діізопропіловий ефір 5розпиленню, порошків, суспензій або дисперсій, нітроізо-фталевої кислоти; емульсій, масляних дисперсій, паст, препаратів - гетероциклічні сполуки, такі, як 2-гептадецилдля обпилювання, препаратів для обпудрювання, 2-імідазолін-ацетат, 2,4-дихлор-6-(о-хлораніліно)гранулятів шляхом обприскування, дрібнокрапs-триазин, О,О-діетилфталімідофосфонотіоат, 5линного обприскування, обпилювання, обпудрюаміно-1-[біс-(диметиламіно)фосфініл]-3-фенілвання або поливу. Форми, які використовують, 1,2,4-триазол, 2,3-диціано-1,4-дитіоантрахінон, 2залежать від мети застосування, але у всіх випадтіо-1,3-дитіоло[4,5-b]хіноксалін, метиловий ефір 1ках повинний бути забезпечений максимально (бутилкарбамоїл)-2-бензімідазол карбамінової тонкий розподіл діючих речовин згідно із винахо 27 76453 28 кислоти, 2-метокси-карбоніламінобензімідазол, 2метиловий ефір DL-N-(2,6-диметилфеніл)-N-(2'(фурил-(2))-бензімідазол, 2-(тіазоліл-(4))метоксіацетил)аланіну, N-(2,6-диметил-феніл)-Nбензімідазол, N-(1,1,2,2хлорацетил-D,L-2-амінобутиролактон, метиловий тетрахлоретилтіо)тетрагідрофталімід, Nефір DL-N-(2,6-диметилфеніл)-Nтрихлорметилтіотетрагідрофталімід, Ν(фенілацетил)аланіну, 5-метил-5-вініл-3-(3,5трихлорметилтіофталімід, дихлорфеніл)-2,4-діоксо-1,3-оксазолідин, 3-[3,5- діамид N-дихлорфторметилтіо-N,N'-диметилдихлорфеніл(-5-метил-5-метоксиметил]-1,3N-фенілсірчаної кислоти, 5-етокси-3оксазолідин-2,4-діон, 3-(3,5-дихлорфеніл)-1трихлорметил-1,2,3-тіадіазол, 2ізопропілкарбамоїл-гідантоїн, імід N-(3,5роданметилтіобензтіазол, 1,4-дихлор-2,5дихлорфеніл)-1,2-диметил-циклопропан-1,2диметоксибензол, 4-(2-хлорфенілгідразоно)-3дикарбонової кислоти, 2-ціано-[Nметил-5-ізоксазолон, піридин-2-тіо-1-оксид, 8(етиламінокарбоніл)-2-метокси-іміно]ацетамід, 1гідроксихінолін, відповідно його мідна сіль, 2,3[2-(2,4-дихлорфеніл)пентил]-1Н-1,2,4-триазол, 2,4дигідро-5-карбоксанілідо-6-метил-1,4-оксатіїн, 2,3дифтор-(-(1Н-1,2,4-триазоліл-1-метил)дигідро-5-карбоксанілідо-6-метил-1,4-оксатіїн-4,4бензгідриловий спирт, N-(3-хлор-2,6-динітро-4діоксид, анілід 2-метил-5,6-дигідро-4Н-піран-3трифторметилфеніл)-5-трифторметил-3-хлор-2карбонової кислоти, анілід 2-метилфуран-3аміно-піридин, 1-((біс-(4-фторфеніл)карбонової кислоти, анілід 2,5-диметилфуран-3метилсиліл)метил)-1Н-1,2,4-триазол. карбонової кислоти, анілід 2,4,5-триметилфуран-3Приклади синтезу карбонової кислоти, циклогексиламід 2,5Приведені в нижче представлених прикладах диметилфуран-3-карбонової кислоти, амід Nстадії синтезу застосовують при відповідних змінах циклогексил-N-метокси-2,5-диметилфуран-3вихідних сполук для одержання інших сполук фокарбонової кислоти, 2-анілід метилбензойної кисрмули І. Отримані в такий спосіб сполуки зі своїми лоти, анілід 2-йод-бензойної кислоти, N-форміл-Nфізичними даними представлені в нижченаведеморфолін-2,2,2-трихлоретилацеталь, піперазинних таблицях. 1,4-діілбіс-1-(2,2,2-трихлоретил)-формамід, 1-(3,4Приклад 1: 6-хлор-5-(2-хлор-6-фторфеніл)-4дихлораніліно)-1-форміламіно-2,2,2-трихлоретан, ізопропіламіно-2-(1-піразоліл)-піримідин [I-1] 2,6-диметил-N-тридецилморфолін, відповідно його а) 5-(2-хлор-6-фторфеніл)-2-метилтіосолі, 2,6-диметил-N-циклододецилморфолін, від4,6(1Н,5Н)-піримідиндіон повідно, його солі, N-[3-(п-трет.-бутилфеніл)-260,0г (208ммолів) складного етилового ефіру метилпропіл]-цис-2,6-диметилморфолін, N-[3-(п2-(2-хлор-6-фторфеніл)-малонової кислоти і 19,0г трет.-бутилфеніл)-2-метилпропіл]піперидин, 1-[2(249ммолів) тіосечовини нагрівають у 77г (2,4-дихлорфеніл)-4-етил-1,3-діоксолан-2-іл-етил](416ммолів) н-трибутиламіну протягом 2,5 годин 1Н-1,2,4-триазол, 1-[2-(2,4-дихлорфеніл)-4-ндо 150°С. Отриманий етанол відганяють. До охопропіл-1,3-діоксолан-2-іл-етил]-1Н-1,2,4-триазол, лодженого реакційного розчину подають 180мл N-(н-пропіл)-N-(2,4,6-трихлорфеноксіетил)-N'водного розчину 24,9г (623ммолів) NaOH. Після імідазолілсечовина, 1-(4-хлорфенокси)-3,3змішування з 50мл циклогексану і перемішування диметил-1-(1Н-1,2,4-триазол-1-іл)-2-бутанон, 1-(4приблизно протягом 30 хвилин відокремлюють хлорфенокси)-3,3-диметил-1-(1Н-1,2,4-триазол-1водну фазу, змішують з 35,4г (142ммолів) метиліл)-2-бутанол, (2RS,3RS)-1-[3-(2-хлорфеніл)-2-(4йодиду і перемішують протягом 16 годин при темфторфеніл)-оксиран-2-ілметил]-1Н-1,2,4-триазол, пературі від 20°С до 25°С. Після підкислення розведеним розчином НСІ і перемішування протягом -(2-хлорфеніл)- -(4-хлорфеніл)-530 хвилин відфільтровують осад. Після промиванпіримідинметанол, 5-бутил-2-диметил-аміно-4ня і сушіння одержують 16,7г приведеної в загологідрокси-6-метил-піримідин, біс-(п-хлорфеніл)-3вку сполуки у вигляді білих кристалів із Тпл. 250° С піридинметанол, 1,2-біс-(3-етокси-карбоніл-2(такий, що розкл.). тіоуреїдо)бензол, 1,2-біс-(3-метоксикарбоніл-2б) 4,6-дихлор-5-(2-хлор-6-фторфеніл)-2тіоуреїдо)-бензол, метилтіо-піримідин - стробілурини, такі, як метил-Е-метоксііміноРозчин з 48,8г (170ммолів) продукту стадії а) у [ -(о-толілокси)-о-толіл]ацетат, метил-Е-2-{2-[6-(2200мл фосфороксихлориду нагрівають зі зворотціанофенокси)піримідин-4-ілокси]феніл}-3ним холодильником після додавання 3мл диметиметокси-акрилат, метил-Е-метоксііміно-[ -(2лформаміду протягом 40 годин. Після відгону осфеноксифеніл)]ацетамід, метил-Е-метоксііміно-[ новної кількості фосфороксихлориду і розведення (2,5-диметилфенокси)-о-толіл]ацетамід, залишку складним етиловим ефіром оцтової кисанілінопіримідини, такі, як N-(4,6лоти при перемішуванні додають при температурі диметилпіримідин-2-іл)анілін, N-[4-метил-6-(1від 15°С до 20°С воду. Після поділу фаз органічну пропініл)піримідин-2-іл]анілін, N-[4-метил-6фазу промивають водою і розведеним розчином циклопропіл-піримідин-2-іл]анілін, NaHCO3, потім сушать і відокремлюють розчинник. - фенілпіроли, такі, як 4-(2,2-дифтор-1,3Одержують 37,5г приведеної в заголовку сполуки у бензодіоксол-4-іл)пірол-3-карбонітрил, вигляді олії, яку без подальшого очищення засто- аміди коричної кислоти, такі, як морфолід 3совують на стадії в). (4-хлорфеніл)-3-(3,4-диметоксифеніл)акрилові ІЧ (плівка): [см-1] = 1558, 1477, 1449, 1353, кислоти, 1252, 900, 816, 783. - а також різні фунгіциди, такі, як додецилгуав)6-хлор-5-(2-хлор-6-фторфеніл)-4-ізонідинацетат, 3-[3-(3,5-диметил-2-оксициклогексил)пропіламіно-2-метилтіо-піримідин 2-гідроксіетил]глютарімід, гексахлорбензол, DLРозчин з 37,5г (324ммолів) продукту стадії б) у метил-N-(2,6-диметилфеніл)-N-фуроїл(2)аланінат, 29 76453 30 150мл безводного дихлорметану змішують з 24г сушіння звільняють від розчинника. Після хромато(406ммолів) ізопропіламіну і перемішують протяграфії на силікагелі (циклогексан, потім циклогекгом 5 годин при температурі приблизно від 20°С сан/метил-трет.бутиловий ефір у співвідношенні до 25°С. Потім відганяють розчинник. Залишок 85:15) одержують 90г приведеної в заголовку спозавантажують у складний етиловий ефір оцтової луки у вигляді безбарвних кристалів із Тпл. 94кислоти і промивають розведеною НСІ, водою і 96°С. розведеним розчином NaHCO3, потім сушать і виг) (S)-6-хлор-5-(2,4,6-трифторфеніл)-4-(2,2,2даляють розчинник. З залишку після хроматогратрифтор-1-метилетиламіно)-2фії на силікагелі (циклогексан/метилметилсульфонілпіримідин трет.бутиловий ефір від 100:1 до 19:1) одержують Аналогічно прикладу 1 (стадія г) з 90,0г 3,4г приведеної в заголовку сполуки у вигляді без(424ммолів) продукту стадії в) одержують 89г (92% барвних кристалів із Тпл. 94-98°С, які без подальвід теорії) білих кристалів із Тпл. 159°С. шого очищення застосовують на наступній стадії. д) (S)-6-хлор-4-(2,2,2-трифтор-1г) 6-хлор-5-(2-хлор-6-фторфеніл)-4метилетил)аміно-5-(2,4,6-трифторфеніл)-2-(1ізопропіламіно-2-метилсульфоніл-піримідин піразоліл)-піримідин Розчин з 13,3г (38,4ммолів) продукту стадії в) у Аналогічно прикладу 1 (стадія д) з 17,0г 240мл безводного дихлорметану змішують при від (39,2ммолів) продукти стадії г) і 4,00г (58,8ммолів) 0°С до 5°С з 17,2г (76,8ммолів) 3піразолу одержують 14,9г (90 % від теорії) привехлорпербензойної кислоти. Протягом 1 години деної в заголовку сполуки у формі безбарвних перемішують при від 0°С до 5°С і 14 годин при кристалів із Тпл. 209°С (97%-ої за РХВТ аналізом). температурі приблизно від 20°С до 25°С. Після Приклад 3: (S)-6-хлор-4-(2,2,2-трифтор-1відгону розчинника залишок завантажують у етиметилетил)аміно-5-(2,4,6-трифторфеніл)-2-(1лацетат, потім промивають 10%-вим розчином імідазоліл)-піримідин [І-3] NaHCO3. Після відділення фаз органічну фазу суАналогічно прикладу 1 (стадія д) з 89,8мг імішать і з її видаляють розчинник. Залишок дигерудазолу і 249,5мг сульфону з приклада 1, стадія г) ють сумішшю діізопропілового ефіру і гексану. одержують 0,22г (91% від теорії) зазначеної в заОдержують 11,3г приведеної в заголовку сполуки у головку сполуки у вигляді безбарвних кристалів із вигляді безбарвних кристалів із Тпл. 145°С-149°С. Тпл. 172-173°С д) 6-хлор-5-(2-хлор-6-фторфеніл)-4Приклад 4: (S)-6-хлор-4-(2,2,2-трифтор-1ізопропіламіно-2-(1-піразоліл)-піримідин метилетил)аміно-5-(2,4,6-трифторфеніл)-2-(1,2,4Розчин з 180мг (2,64ммолів) піразолу в 4мл триазол-1-іл)-піримідин [І-4] безводного диметилформаміду при охолодженні Аналогічно прикладу 1 (стадії д) з 91,1мг 1,2,4льодом змішують з 106мг (2,64ммолів) Na (з 60%триазолу і 24,95г сульфону з приклада 1, стадії г) вою суспензією в мінеральній олії). Після переміодержують 0,22г (91 % від теорії) зазначеної в зашування протягом 1 години до реакційної суміші головку сполуки у формі безбарвних кристалів із додають 500мг (1,32ммолів) продукту стадії г) і Тпл. 176-177°С суміш перемішують протягом 14 годин при темпеПриклад 5: 6-хлор-5-(2,4,6-трифторфеніл)-4ратурі від 20°С до 25°С. Додаванням води продукт [(S)-1,2-диметилпропіл]аміно-2-(піридазин-3-іл)осаджують. Після фільтрації, промивання водою і піримідин [І-5] сушіння одержують 450мг приведеної в заголовку а) піридазин-3-карбоксамідин сполуки у вигляді безбарвних кристалів із Тпл. Розчин з 1,60г (0,068моль) натрію в 300мл 185°С-187°С. безводного метанолу змішують з розчином з 53,5г Приклад 2: (S)-6-хлор-4-(2,2,2-трифтор-1(0,510молів) піридазин-3-карбонітрилу в 100мл метилетил)аміно-5-(2,4,6-трифтор-феніл)-2-(1метанолу і перемішують протягом 8 годин при піразоліл)-піримідин [І-2] 35°С потім до реакційної суміші додають 29г хлоа) 5-(2,4,6-трифторфеніл)-2-метилтїориду амонію і нагрівають зі зворотним холодиль4,6(1Н,5Н)-піримідиндіон ником приблизно протягом 14 годин. Суміш відфіАналогічно прикладу 1 (стадія а) з 200,0г склальтровують у гарячому стані і тверду речовину дного діетилового ефіру 2-(2,4,6-трифторфеніл)видаляють з охолодженого маткового розчину фімалонової кислоти, 62,9г тіосечовини і 117,4г мельтрацією, і одержують 53,3г зазначеної в заголотилйодиду одержують 115г білих кристалів із Тпл. вку сполуки. 1 275°С (такі, що здатні розкл.). Н-ЯМР: (міл. част., ДMCO-d6) = 9,75 (bs); 9,6 б) 4,6-дихлор-5-(2,4,6-трифторфеніл)-2(d); 8,6 (d); 8,1 (m). метилтіо-піримідин б) 4,6-дигідрокси-5-(2,4,6-трифторфеніл)-2-(3Відповідно до приклада 1 (стадія б) з 64,8г піридазиніл)-піримідин продукту стадії а) після хроматографії на силікагеСуміш з 18,1г (0,063молів) складного діетилолі з циклогексаном одержують 43г білих кристалів вого ефіру 2-(2,4,6-трифтор-феніл)-малонової кисіз Тпл. 75°С. лоти, 12г (0,063молів) трибутиламіну і 10,0г в) (5)-6-хлор-5-(2,4,6-трифторфеніл)-4-(2,2,2(0,063молів) амідину з приклада 5а) нагрівають трифтор-2-метилетиламіно)-2-метилтіопіримідин приблизно протягом 6 годин до 180°С, при цьому Розчин з 90,0г (277ммолів) продукту стадії б) і відганяють етанол. Після охолодження до 60°С120,0г (113ммолів) 2,2,2-трифтор-1-метил70°С реакційну суміш змішують з 6,3г (0,158молів) етиламіну перемішують протягом п'яти днів при гідроксиду натрію, розчиненого в 70мл води і пе150°С. Після розведення метил-трет.бутиловим ремішують ще протягом 30 хвилин. Після охолоефіром і промивання за допомогою 5М-соляної дження до 20°С-25°С реакційну суміш екстрагують кислоти розділяють фази. Органічну фазу після метилтрет.-бутиловим ефіром і підкисленням оса 31 76453 джують з водної фази. Фільтрацією одержують 6,0г зазначеної в заголовку сполуки. 1 Н-ЯМР: (міл. част., ДMCO-d6) = 9,5 (d); 8,2 (d); 8,0 (dd); 7,2 (m). в) 4,6-дихлор-5-(2,4,6-трифторфеніл)-2-(3піридазиніл)-піримідин Суспензію з 5,7г (0,018молів) дигідроксипіримідину з приклада 56) у 37г (0,23молів) фосфороксихлориду нагрівають протягом 8 годин до 120°С, потім концентрують у вакуумі. Залишок завантажують у дихлорметан і воду, органічну фазу сушать і від неї видаляють розчинник. Після хроматографії на силікагелі (циклогексан/етилацетат) одержують 2,0г зазначеної в заголовку сполуки. 1 Н-ЯМР: (міл. част., CDCI3) = 9,2 (d); 8,7 (d); 7,8 (dd); 6,9 (t). г) 6-хлор-5-(2,4,6-трифторфеніл)-4-[(S)-1,2диметилпропіл]аміно-2-(піридазин-3-іл)-піримідин Розчин з 200мг (0,568ммолів) дихлориду з приклада 5 в) у 5мл диметилформаміду після змішування в 100мг (1,2ммоля) (S)-3-метил-2бутиламіну перемішують протягом 72 годин при 50°С, потім охолоджують до 20-25°С. Додаванням води осаджують продукт реакції. Фільтрацією одержують 200мг (100% від теорії) зазначеної в заголовку сполуки. 1 Н-ЯМР: (міл. част., CDCI3) = 9,3 (d); 8,5 (d); 7,6 (dd); 6,9 (t); 4,5 (m); 4,4 (m);1,8(m);1,1(d);0,9(d). 32 33 76453 34 пель водною суспензією діючої речовини, приготовленої з вихідного розчину, який містить 10% діючої речовини, 63% циклогексанону і 27% емульгатора. Наступного дня листи інфікують водною суспензією зооспор Alternaria solani у 2%-вому ро6 зчині біосолода 0,17 10 спор/мл. Після цього рослини розміщують у паронасичену камеру з температурою між 20°С і 22°С. Через 5 днів фітофтороз на необроблених інфікованих контрольних рослинах розвився настільки сильно, що ураження можна було визначати візуально у %. У цьому тесті оброблені 63част./млн. діючою речовиною l-1, l-4, від l-12 до l-14, від l-19 до І-23, І29, l-31, І-32, від І-35 до І-37, І-40, 1-41, І-46, І-47, l51, І-52, І-54 і І-60 рослини взагалі не мали ураВизначення ліпофільних параметрів ження або мали ураження до 7%, у той час як неоlogk'/logPow (таблиця І) здійснюють відповідно до броблені рослини мали ураження в 100%. правил OECD (Міжн. Угоди по економічному розПриклад 2 Дія проти Puccinia recondita на витку) за методом зворотнофазної РХВТ. пшениці (іржа пшениці) Для цього будують кореляційну криву Листи вирощених у горщиках паростків пшеlogk'/logPow, засновану на десятьох опорних речониці сорту "Kanzler" обпилювали спорами іржі винах і оцінюють її за допомогою визначених ме(Puccinia recondita). Після цього горщики поміщали тодом екстракції ліпофільних параметрів восьми на 24 години в камеру з високою вологістю повітря порівняльних речовин. (від 90 до 95%) і з температурою від 20°С до 22°С. Як стаціонарну фазу застосовують наявну у Протягом цього часу спори проростали і паросткопродажу зворотну фазу С18. Хроматографічне відві трубочки проникали в тканину листів. Наступноділення проводять метанолом і буферним розчиго дня інфіковані рослини рясно до утворення краном як рухливу фазу при значенні рН 7,4 при умопель обприскували водною композицією діючої вах постійного складу елюенту. речовини, приготовленої з вихідного розчину, який Час утримання опорних значень tR переводять містить 10% діючої речовини, 63% циклогексанону відповідно до рівняння Φ у фактори ємності k' , і 27% емульгатора. Після підсихання наприсканого причому t0 як час утримання неуповільненого на шару досліджувані рослини культивували протязворотній фазі С18 розчинника являє собою мертгом 7 днів у теплиці з температурою між 20°С і вий час хроматографічної системи: 22°С і з вологістю повітря від 65 до 70%. Після цього визначали ступінь розвитку грибів на листах. tR t0 k' Ф Оброблені у цьому досліді за допомогою t0 63част./млн. діючою речовиною l-1 і l-2 рослини були уражені максимально на 7%, у той час як Лінійна кореляція значення logk' - з опубліконеоброблені рослини мали ураження у 90%. ваними в додатку до правил Європейського союзу Приклад застосування 3 - Ефективність проти 92/69 значенням logPow опорних величин дає косітчастої плямистості ячменя реляційну криву лінійної регресії. Листи вирощених у горщиках проростків ячмеЛіпофільні параметри logPow аналітів інтерпоня сорту "Igri" рясно до утворення крапель обприслюють після розрахунку логарифмічного фактора кують водною композицією діючої речовини, приємності logk' з кореляційної кривої опорних велиготовленої з вихідного розчину, який містить 10% чин. діючої речовини, 63% циклогексанону і 27% емуОцінка описаних методів аналізу і застосовальгатора і через 24 години після підсихання наних опорних величин відбувається за допомогою присканого шару інокулюють водною суспензією восьми порівняльних речовин, розподіл яких виPyrenophora teres, збудника сітчастої плямистості значають за допомогою екстракційного методу. ячменя. Приклади дії проти фітопатогенних грибів. Потім досліджувані рослини поміщають у тепФунгіцидну дію сполук загальної формули І лицю з температурою між 20°С і 24°С і відносною можна показати за допомогою наступних тестів. вологістю повітря від 95 до 100%. Через 6 днів Діючі речовини підготовлялися окремо або визначають візуально у % ступінь розвитку хвороспільно у вигляді 10%-вої емульсії в суміші з би на загальній поверхні листів. 70мас.% циклогексанону, 20мас.% Nekanil LN У цьому тесті оброблені за допомогою (Lutensol AP6, змочувальний агент із емульгува63част./млн. діючої речовини l-1, I-4, від l-12 до lльною та диспергувальною дією на базі етокси14, від l-19 до І-23, І-29, І-32, від І-35 до І-37, І-40, lльованих алкілфенолів) і 10мас.% Wettol EM 41, І-47, I-51, І-52, І-54 і І-60 рослини не мали ура(неіоногенного емульгатора на базі етоксильоваження або мали ураження до 10%, у той час як ної касторової олії) і розбавляли водою у відповіднеоброблені рослини мали ураження у 90%. ності з бажаною концентрацією. Приклад застосування 4: Ефективність проти Приклад застосування 1 - Ефективність проти Botrytis cinerea на листах перцю Alternaria solani на томатах Проростки перцю сорту "Neusiedler Ideal Elite" Листи горшкових рослин сорту "Великі м'ясисті після того, як вони добре розвились від 4 до 5 листомати St. Pierre" обприскують до утворення кратів, обприскують рясно до утворення крапель вод 35 76453 36 ною композицією діючої речовини, приготовленої з Листи вирощених у горщиках проростків огірків вихідного розчину, який містить 10% діючої речосорту "Chinesische Schlange" у стадії сім'ядоль вини, 63% циклогексанону і 5% емульгатора. Наобприскують рясно до утворення крапель водною ступного дня оброблені рослини інокулюють сукомпозицією діючої речовини, приготовленої з виспензією спор Botrytis cinerea, яка містить хідного розчину, який містить 10% діючої речови6 ни, 63% циклогексанону і 5% емульгатора. Через 1,7 10 спор/мл 2%-вого водного розчину біосоло20 годин після підсихання наприсканого шару росда. Після цього досліджувані рослини поміщають у лини інокулюють водною суспензією спор борошкамеру з температурою від 22°С до 24°С і високою нистої роси огірків (Sphaerotheca fuliginea). Потім вологістю повітря. Через 5 днів визначають стерослини культивують у теплиці з температурою рень ураження листів візуально у %. між 20°С і 24°С і відносною вологістю від 60 до У цьому тесті оброблені 250ч./млн. діючою ре80% протягом 7 днів. Визначають візуально у % човиною l-1, l-3, І-4, від І-7 до І-9, від l-11 до l-14, ступінь ураження поверхні листів проростків. від l-18 до І-23, від І-29 до І-32, від І-35 до І-37, І-40, У цьому тесті оброблені за допомогою І-47, l-51, І-52, І-54, І-60, І-77, І-78 і І-80 рослини не 63част./млн. діючою речовиною l-1, І-4, від l-12 до мали ураження або мали ураження тільки до 7%, у l-14, від l-19 до І-23, І-29, 1-31, І-32, І-35, І-36, l-41, той час як необроблені рослини були уражені на І-47, І-52, I-54 і І-60 рослини не мали ураження, у 90%. той час як необроблені рослини були уражені на Приклад застосування 5: Протективна дія про100%. ти викликаної Sphaerotheca fuliginea борошнистої роси огірків Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською5-phenylpyrimidines, methods for producing thereof, intermediary compounds, agent and a method for controlling phyto pathogenic fungi
Автори англійськоюGrote Thomas, Rheinheimer Joachim, Schaefer Peter, Schieweck Frank, Sauter Hubert, Gewehr Markus, Mueller Bernd, Tormo I Blasco Jordi, Ammermann Eberhard, Strathmann Siegfried, Lorenz Gisela, Stierl Reinhard
Назва патенту російською5-фенилпиримидины, способы их получения, промежуточные продукты, средство и способ борьбы с фитопатогенными грибами
Автори російськоюГроте Томас, Райнхаймер Йоахим, Шефер Петер, Шивек Франк, Заутер Хуберт, Гевер Маркус, Мюллер Бернд, Тормо И Бласко Йорди, Аммерманн Эберхард, Штратманн Зигфрид, Лоренц Гизелла, Штирль Райнхард
МПК / Мітки
МПК: C07D 487/04, A01N 43/54, C07D 403/04, C07D 239/42, C07D 473/06, A01P 3/00
Мітки: продукти, одержання, боротьби, способи, засіб, 5-фенілпіримідини, проміжні, спосіб, грибами, фітопатогенними
Код посилання
<a href="https://ua.patents.su/18-76453-5-fenilpirimidini-sposobi-kh-oderzhannya-promizhni-produkti-zasib-ta-sposib-borotbi-z-fitopatogennimi-gribami.html" target="_blank" rel="follow" title="База патентів України">5-фенілпіримідини, способи їх одержання, проміжні продукти, засіб та спосіб боротьби з фітопатогенними грибами</a>
Попередній патент: Застосування інгібітора дипептидилпептази iv для лікування ранніх стадій діабету типу 2
Наступний патент: Пристрій для очищення внутрішніх каналів (варіанти) та спосіб очищення внутрішніх каналів
Випадковий патент: Спосіб автоматичної діагностики пакетів електротехнічної сталі електричних машин та пристрій для його здійснення












