Спосіб одержання 3-гало-4,5-дигідро-1н-піразолів
Формула / Реферат
1. Спосіб одержання 3-гало-4,5-дигідро-1Н-піразолової сполуки формули Іа
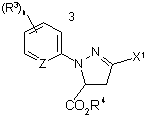 , (Ia)
, (Ia)
де
Х1 є галогеном;
кожний R3 незалежно є C1-С4 алкілом, С2-С4 алкенілом, C2-C4 алкінілом, C3-C6 циклоалкілом, C1-С4 галоалкілом, С2-С4 галоалкенілом, C3-C6 галоалкінілом, C3-C6 галоциклоалкілом, галогеном, CN, NO2, C1-С4 алкокси групою, C1-С4 галоалкокси групою, C1-С4 алкілтіо групою, C1-С4 алкілсульфінілом, C1-С4 алкілсульфонілом, C1-С4 алкіламіно групою, С2-С8 діалкіламіно групою, C3-C6 циклоалкіламіно групою, (C1-С4 алкіл)(C3-C6 циклоалкіл)аміно групою, С2-С4 алкілкарбонілом, C1-C6 алкоксикарбонілом, C3-C6 алкіламінокарбонілом, C3-C6 діалкіламінокарбонілом або C3-C6 триалкілсилілом;
R4 є Н або необов’язково заміщеною вуглецевою складовою;
Z є N або CR5;
R5 є Н або R3 ; та
n є цілим числом від 0 до 3,
що включає етап, на якому піддають взаємодії 4,5-дигідро-1Н-піразолову сполуку формули ІІа
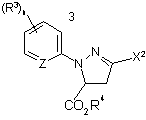 , (IIa)
, (IIa)
де
X2 є OS(O)mR1, OP(O)p(OR2)2 або галогеном, який відрізняється від X1;
m дорівнює 1 або 2;
р дорівнює 0 або 1;
R1 вибирають із алкілу та галоалкілу, та фенілу, необов’язково заміщеного 1-3 замісниками, які вибирають із алкілу та галогену;
кожний R2 незалежно вибирають із алкілу та галоалкілу, та фенілу, необов’язково заміщеного 1-3 замісниками, які вибирають із алкілу та галогену;
зі сполукою формули НХ1 у присутності придатного розчинника.
2. Спосіб за п. 1, який відрізняється тим, що m дорівнює 2, р дорівнює 1.
3. Спосіб за п. 2, який відрізняється тим, що X2 є галогеном або OS(O)mR1.
4. Спосіб за п. 3, який відрізняється тим, що X2 є Сl або OS(O)mR1, та R1 є С1-С2 алкілом, фенілом або 4-метилфенілом.
5. Спосіб за п. 1, який відрізняється тим, що X1 є Сl або Br.
6. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що R4 є C1-С4 алкілом.
7. Спосіб за п. 6, який відрізняється тим, що Z є N, n дорівнює 1, та R3 є Сl або Br і знаходиться у 3-му положенні.
8. Спосіб за п. 7, який відрізняється тим, що X1 є Br, X2 є Сl або OS(O)mR1, m дорівнює 2, та R1 є фенілом або 4-метилфенілом.
9. Спосіб одержання сполуки формули IIІ
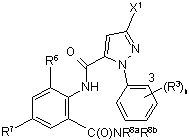 , (III)
, (III)
де
X1 є галогеном;
кожний R3 незалежно є C1-С4 алкілом, С2-С4 алкенілом, C2-C4 алкінілом, C3-C6 циклоалкілом, C1-С4 галоалкілом, С2-С4 галоалкенілом, C3-C6 галоалкінілом, C3-C6 галоциклоалкілом, галогеном, CN, NO2, C1-С4 алкокси групою, C1-С4 галоалкокси групою, C1-С4 алкілтіо групою, C1-С4 алкілсульфінілом, C1-С4 алкілсульфонілом, C1-С4 алкіламіно групою, С2-С8 діалкіламіно групою, C3-C6 циклоалкіламіно групою, (C1-С4 алкіл)(C3-C6 циклоалкіл)аміно групою, С2-С4 алкілкарбонілом, C1-C6 алкоксикарбонілом, C3-C6 алкіламінокарбонілом, C3-C6 діалкіламінокарбонілом або C3-C6 триалкілсилілом;
Z є N або CR5;
R5 є Н або R3;
R6 є СН3, F, Сl або Br;
R7 є F, Сl, Br, І або СF3;
R8а є C1-C4 алкіл;
R8b є Н або СН3; та
n є цілим числом від 0 до 3,
який відрізняється тим, що одержують сполуку формули Іа
 , (Ia)
, (Ia)
де
R4 є Н або необов’язково заміщеною вуглецевою складовою,
шляхом взаємодії 4,5-дигідро-1Н-піразолової сполуки формули ІІа
 , (IIa)
, (IIa)
де
X2 є OS(O)mR1, OP(O)p(OR2)2 або галогеном, який відрізняється від X1;
m дорівнює 1 або 2;
р дорівнює 0 або 1;
R1 вибирають із алкілу та галоалкілу, та фенілу, необов’язково заміщеного 1-3 замісниками, які вибирають із алкілу та галогену;
кожний R2 незалежно вибирають із алкілу та галоалкілу, та фенілу, необов’язково заміщеного 1-3 замісниками, які вибирають із алкілу та галогену;
зі сполукою формули НХ1 у присутності придатного розчинника, а потім зі сполуки формули Іа одержують сполуку формули ІІІ за допомогою відомих способів.
10. Спосіб за п. 9, який відрізняється тим, що R4 є C1-С4 алкілом.
11. Спосіб за п. 10, який відрізняється тим, що Z є N, n дорівнює 1, та R3 є Сl або Вr і знаходиться у 3-му положенні.
12. Спосіб за п. 10, який відрізняється тим, що X1 є Сl або OS(O)mR1, m дорівнює 2, і R1 є фенілом або 4-метилфенілом.
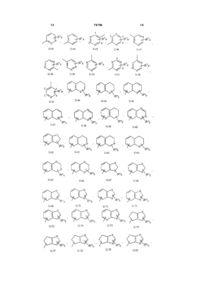
Текст
1. Спосіб одержання 3-гало-4,5-дигідро-1Нпіразолової сполуки формули Іа 2 3 X1 R6 N NH R7 3 (R 3) n C(O)NR 8aR8b , (III) де X1 є галогеном; кожний R3 незалежно є C1-С4 алкілом, С2-С4 алкенілом, C2-C4 алкінілом, C3-C6 циклоалкілом, C1С4 галоалкілом, С2-С4 галоалкенілом, C3-C6 галоалкінілом, C3-C6 галоциклоалкілом, галогеном, CN, NO2, C1-С4 алкокси групою, C1-С4 галоалкокси групою, C1-С4 алкілтіо групою, C1-С4 алкілсульфінілом, C1-С4 алкілсульфонілом, C1-С4 алкіламіно групою, С2-С8 діалкіламіно групою, C3-C6 циклоалкіламіно групою, (C1-С4 алкіл)(C3-C6 циклоалкіл)аміно групою, С2-С4 алкілкарбонілом, C1C6 алкоксикарбонілом, C3-C6 алкіламінокарбонілом, C3-C6 діалкіламінокарбонілом або C3-C6 триалкілсилілом; Z є N або CR5; R5 є Н або R3; R6 є СН3, F, Сl або Br; R7 є F, Сl, Br, І або СF3 ; R8а є C1-C 4 алкіл; R8b є Н або СН 3; та n є цілим числом від 0 до 3, який відрізняється тим, що одержують сполуку формули Іа (R 3) n 3 Z N N CO2R X1 4 4 де R4 є Н або необов’язково заміщеною вуглецевою складовою, шляхом взаємодії 4,5-дигідро-1Н-піразолової сполуки формули ІІа N O 79799 (R3) n 3 Z N N CO2 R X2 4 , (IIa) де X2 є OS(O) mR1, OP(O) p(OR2) 2 або галогеном, який відрізняється від X1; m дорівнює 1 або 2; р дорівнює 0 або 1; R1 вибирають із алкілу та галоалкілу, та фенілу, необов’язково заміщеного 1-3 замісниками, які вибирають із алкілу та галоген у; кожний R2 незалежно вибирають із алкілу та галоалкілу, та фенілу, необов’язково заміщеного 13 замісниками, які вибирають із алкілу та галогену; зі сполукою формули НХ1 у присутності придатного розчинника, а потім зі сполуки формули Іа одержують сполуку формули ІІІ за допомогою відомих способів. 10. Спосіб за п.9, який відрізняється тим, що R4 є C1-С4 алкілом. 11. Спосіб за п.10, який відрізняється тим, що Z є N, n дорівнює 1, та R3 є Сl або Вr і знаходиться у 3-му положенні. 12. Спосіб за п.10, який відрізняється тим, що X1 є Сl або OS(O)mR1 , m дорівнює 2, і R1 є фенілом або 4-метилфенілом. , (Ia) Існує потреба у додаткових способах одержання 3-гало-4,5-дигідро-1Н-піразолів. Такі сполуки включають корисні проміжні сполуки для виготовлення агентів-протекторів урожаю, фармацевтичних препаратів та інших хімічних продуктів тонкого органічного синтезу. У літературі є відомості про кілька способів одержання 3-гало-4,5-дигідро-1Н-піразолів. [Наприклад, J.P. Chupp, J. Heterocyclic Chem. 1994, 31, 1377-1380], повідомляє про одержання 3хлоро-4,5-дигідро-1Н-піразолу шляхом контактування відповідного оксопіразолідину з оксихлоридом фосфору. [M.V. Gorelik et al., Journal of Organic Chemistry U.S.S.R. 1985, 21, 773-781 (англійський переклад із Журнала органической химии 1985, 21(4), 851-859)] розкривають одержання 3-хлоро-4,5-дигідро-1Н-піразолів через проміжні діазонієві солі, одержані із відповідних 3-аміно-4,5-дигідро-1Н-піразолів. [K.K. Bach et al., Tetrahedron 1994, 50(25), 7543-7556], розкривають одержання 3-хлоро-4,5-дигідро-1Н-піразолу шляхом диполярного циклоприєднання акрилатного ефіру та гідразидоїл хлоридного проміжного продукту, утвореного шляхом декарбоксилативного хлорування гідразону гліоксилової кислоти з використанням N-хлоросукциніміду. Залишається потреба в альтернативних методах, зокрема, методах широкого хімічного структурного узагальнення, в яких використовуються відносно дешеві реагенти, що є у продажу у промислових кількостях. Даний винахід стосується способу одержання 3-гало-4,5-дигідро-1Н-піразолової сполуки Формули І де L являє собою заміщену, при потребі, вуглецеву складову; кожна R вибирається, незалежно, із заміщених, при потребі, вуглецеви х складових; k є цілим числом від 0 до 4; і X1 являє собою галоген. 5 Даний спосіб включає контактування 4,5дигідро-1Н-піразолової сполуки Формули II де X2 являє собою OS(O) mR1 , OP(O)p(OR 2)2 або галоген, що відрізняється від X1; m дорівнює 1 або 2; p дорівнює 0 або 1; R1 вибирається із алкілу та галоалкілу; та фенілу, що заміщений, при потребі, 1-3 замісниками, котрі вибираються із алкілу та галогену; і кожна R2 вибирається, незалежно, із алкілу та галоалкілу; та фенілу, що заміщений, при потребі, 1-3 замісниками, котрі вибираються із алкілу та галогену; зі сполукою формули НХ1 у присутності придатного розчинника. Даний винахід також стосується способу одержання сполуки Формули III, де X1 являє собою галоген; кожна R3 являє собою, незалежно, С1С4алкіл, С2-С4алкеніл, С2-С4алкініл, С3С6циклоалкіл, С1-С4галоалкіл, С2-С4галоалкеніл, С2-С4галоалкініл, С3-С6галоциклоалкіл, галоген, CN, NO2, С1-С4алкокси, С1-С4галоалкокси, С1С4алкілтіо, С1-С4алкілсульфініл, С1С4алкілсульфоніл, С1-С4алкіламіно, С2С8діалкіламіно, Сз-С6циклоалкіламіно, (C1C4алкіл)(С3-С6циклоалкіл)аміно, С2С4алкілкарбоніл, С2-С6алкоксикарбоніл, С2С6алкіламінокарбоніл, C3-C8діалкіламінокарбоніл або С3-С6триалкілсиліл; Ζ являє собою N або CR5; R5 являє собою Η або R3; R6 являє собою СН 3, F, СІ або Вr;R7 являє собою F, СІ, Вr, І або CF3; R8a являє собою С 1-С4алкіл; R8b являє собою Η або СН 3; і n є цілим числом від 0 до 3, з використанням сполуки Формули Іа де R4 являє собою Η або заміщену, при потребі, вуглецеву складову. 79799 6 Цей спосіб характеризується одержанням сполуки Формули Іа (тобто підроду Формули І) у спосіб, що зазначений вище. У наведених у даному тексті переліках вираз "вуглецева складова" стосується радикала, в якому вуглецевий атом приєднаний до остову 4,5-дигідро-1Н-піразолового кільця. Оскільки вуглецеві складові L та R (включаючи R4) є замісниками, котрі відокремлені від реакційного центру, вони можуть охоплювати широкий різновид груп на основі вуглецю, котрі можуть бути одержані з використанням сучасних методів синтетичної органічної хімії. Спосіб даного винаходу, загалом, може застосовуватись до широкої області вихідних сполук Формули І та продуктів Формули II. Фахівцеві у даній галузі зрозуміло, що деякі групи чутливі до галоїдоводнів і можуть перетворюватись за реакційних умов. Фа хівцеві у даній галузі також зрозуміло, що деякі групи є основними і можуть утворювати солі з галоїдоводнями, і тому спосіб даного винаходу може потребувати додаткового галоїдоводню. Таким чином, вираз "вуглецева складова" включає алкіл, алкеніл та алкініл, котрі можуть бути з прямими або розгалуженими ланцюгами. "Вуглецева складова" також включає карбоциклічні та гетероциклічні кільця, котрі можуть бути насичені, частково насичені або цілком ненасичені. Крім того, за умов задоволення правила Гюккеля ненасичені кільця можуть бути ароматичними. Зазначені карбоциклічні та гетероциклічні кільця вуглецевої складової можуть утворювати поліциклічні кільцеві системи, що включають множини зв'язаних між собою кілець. Вираз "карбоциклічне кільце" означає кільце, де атоми, що утворюють остов кільця, вибираються лише із вуглецю. Вираз "гетероциклічне кільце" означає кільце, де принаймні один із кільцевих остовних атомів є відмінним від вуглецю. "Насичене карбоциклічне" стосується кільця, що має остов, який складається із вуглецевих атомів, зв'язаних один з одним за допомогою простих зв'язків; якщо не зазначено інше, решта вуглецевих валентностей зайнята атомами водню. Вираз "ароматична кільцева система" стосується цілком ненасичених карбоциклів та гетероциклів, в яких принаймні одне кільце у поліциклічній кільцевій системі є ароматичним. Ароматичний вказує на те, що кожен із кільцевих атомів знаходиться суттєво у тій самій площині і має р-орбіталь, перпендикулярну до даної площини кільця, і в якій (4n+2)p електронів, де n дорівнює 0 або позитивному цілому числу, зв'язані з даним кільцем для дотримання правила Гюккеля. Вираз "ароматична карбоциклічна кільцева система" включає цілком ароматичні карбоцикли та карбоцикли, в яких принаймні одне кільце поліциклічної кільцевої системи є ароматичним. Вираз "неароматична карбоциклічна кільцева система" означає цілком насичені карбоцикли, так само як і частково або цілком ненасичені карбоцикли, де жодне із кілець у даній кільцевій системі не є ароматичним. Вирази "ароматична гетероциклічна кільцева система" та "гетероароматичне кільце" включають цілком ароматичні гетероцикли та гетероцикли, в 7 яких принаймні одне кільце поліциклічної кільцевої системи є ароматичним. Вираз "неароматична гетероциклічна кільцева система" означає цілком насичені гетероцикли, так само як і частково або цілком ненасичені гетероцикли, в яких жодне із кілець у даній кільцевій системі не є ароматичним. Вираз "арил" означає карбоциклічне або гетероциклічне кільце, або кільцеву систему, в якій принаймні одне кільце є ароматичним, і зазначене ароматичне кільце запроваджує зв'язок з рештою даної молекули. Вуглецеві складові, визначені для L, R та R4, є, при потребі, заміщеними. Вираз "при потребі, заміщений" у зв'язку з цими вуглецевими складовими стосується вуглецевих складових, що є незаміщеними або мають принаймні одного неводневого замісника. Такі ілюстративні замісники включають алкіл, алкеніл, циклоалкіл, циклоалкеніл, арил, гідроксикарбоніл, форміл, алкілкарбоніл, алкенілкарбоніл, алкінілкарбоніл, алкоксикарбоніл, гідрокси, алкокси, алкенілокси, алкінілокси, циклоалкокси, арилокси, алкілтіо, алкенілтіо, алкінілтіо, циклоалкілтіо, арилтіо, алкілсульфініл, алкенілсульфініл, алкінілсульфініл, циклоалкілсульфініл, арилсульфініл, алкілсульфоніл, алкенілсульфоніл, алкінілсульфоніл, циклоалкілсульфоніл, арилсульфоніл, аміно, алкіламіно, алкеніламіно, алкініламіно, ариламіно, амінокарбоніл, алкіламінокарбоніл, алкеніламінокарбоніл, алкініламінокарбоніл, ариламінокарбоніл, алкіламінокарбоніл, алкеніламінокарбоніл, алкініламінокарбоніл, ариламінокарбонілокси, алкоксикарбоніламіно, алкенілоксикарбоніламіно, алкінілоксикарбоніламіно та арилоксикарбоніламіно, котрі, при потребі, додатково заміщені; та галоген, ціано і нітро. Додаткові замісники вибираються, незалежно, із груп, подібних до вищенаведених для самих замісників, що дає для L, R та R4 додаткові групи замісників, такі як галоалкіл, галоалкеніл та галоалкокси. Як додатковий приклад, алкіламіно може бути додатково заміщена алкілом, що дає діалкіламіно. Зазначені замісники можуть бути також зв'язані один з одним шляхом фігурального вилучення одного або двох атомів водню від кожного із двох зазначених замісників або замісника та опорної молекулярної структури і поєднання даних радикалів з утворенням циклічної та поліциклічної структур, що злиті або прикріплені до молекулярної структури, котра слугує опорою для даних замісників. Наприклад, зв'язування сусідніх гідрокси та метокси груп, що приєднані, наприклад, до фенольного кільця, дає злиту діоксоланову структуру, яка містить зв’язувальну груп у -О-СН2-О-. Зв'язування гідрокси групи та молекулярної структури, до якої вона приєднана, може дати циклічні ефіри, включаючи епоксиди. Ілюстративні замісники також включають кисень, котрий, коли він приєднаний до вуглецю, утворює карбонільну функціональну груп у. Подібно до цього, сірка, приєднана до вуглецю, утворює тіокарбонільну функціональну групу. Усередині вуглецевої складової L або R сумісне зв'язування замісників може утворювати циклічні та поліциклічні структури. Також ілюструють вуглецеві складові L та R варіанти, в яких 79799 8 принаймні дві R складових або L складова та принаймні одна R складова містяться у тому самому радикалі (тобто утворюється кільцева система). Оскільки 4,5-дигідропіразолова складова утворює одне кільце, дві розміщені поряд R складові, або L та R складові, що містяться у тому самому радикалі, дадуть злиту біциклічну або поліциклічну кільцеву систему. Дві парно розміщені R складові, що містяться у тому самому радикалі, дадуть спіро кільцеву систему. Як застосовується у даному тексті, вираз "алкіл", що використовується або окремо або у складних словах, таких як "аікілтіо" або "галоалкіл", включає прямий або розгалужений алкіл, такий як метил, етил, n-пропіл, і-пропіл, або різні бутилові, пентилові або гексилові ізомери. Вираз "1-2 алкіл" вказує на те, що одне або два наявних положення для цього замісника можуть бути алкілом, котрі вибираються незалежно. "Алкеніл" включає прямі або розгалужені алкени, такі як етеніл, 1пропеніл, 2-пропеніл, та різні бутенілові, пентенилові та гексенілові ізомери. "Алкеніл" також включає полієни, такі як 1,2-пропадієніл та 2,4гексадієніл. "Алкініл" включає прямі або розгалужені алкіни, такі як етиніл, 1-пропініл, 2-пропініл та різні бутинілові, пентинілові та гексинілові ізомери. "Алкініл" може також включати складові, що містять множину потрійних зв'язків, наприклад, 2,5-гексадіініл. "Алкокси" включає, наприклад, метокси, етокси, n-пропілокси, ізопропілокси та різні бутокси, пентокси та гексилокси ізомери. "Алкенілокси" включає прямі або розгалужені алкенілокси складові. Приклади "алкенілокси" включають Н 2С= СНСН2О, (СН3)2С= СНСН2О, (СН3)СН= СНСН2О, (СН3)СН С(СН3)СН2О = та СН2 СНСН2СН2О. "Алкінілокси" включає прямі = або розгалужені алкінілокси складові. Приклади "алкінілокси" включають НСºССН2О, СН3СºССН2О та CH3CºCCH2OCH2O. "Алкілтіо" включає розгалужені або прямі алкілтіо складові, такі як метилтіо, етилтіо, та різні пропілтіо, бутилтіо, пентилтіо та гексилтіо ізомери. "Алкілсульфініл" включає обидва енантіомери алкілсульфінільної групи. Приклади "алкілсульфонілу" включають CH3S(O)2, CH3CH2S(O)2, CH3CH2CH2S(O)2, (CH3)2CHS(O)2 та різні бутилсульфонілові, пентилсульфонілові та гексилсульфонілові ізомери. "Алкіламіно", "алкенілтіо", '"алкенілсульфініл"', "алкенілсульфоніл", "'алкінілтіо'", "алкінілсульфініл", "алкінілсульфоніл" і таке подібне визначаються аналогічно до вищенаведених прикладів. Приклади "алкілкарбонілу" включають С(О)СН 3, С(О)СН2СН2СН3 та С(О)СН(СН3)2. Приклади "алкоксикарбонілу" включають СН 3ОС(=О), СН3СН2ОС(=О), СН3СН2СН2ОС(=О), (СН3)2СНОС(=О) та різні бутоксиабо пентоксикарбонільні ізомери."Циклоалкіл" включає, наприклад, циклопропіл, циклобутил, циклопентил та циклогексил. Вираз "циклоалкокси" включає ті самі групи, що зв'язані через атом кисню, такі як циклопентилокси та циклогексилокси. "Циклоалкіламіно" означає, що атом амінного азоту приєднаний до циклоалкільного радикала та атому водню, і включає групи, такі як циклопропіламіно, циклобутиламіно, 9 циклопентиламіно та циклогексиламіно. "(Алкіл)(циклоалкіл)аміно" означає циклоалкіламінну груп у, де атом водню замінений алкіл радикалом; приклади включають групи, такі як (метил)(циклопропіл)аміно, (бутил)(циклобутил)аміно, (пропіл)циклопентиламіно, (метил)циклогексиламіно і таке подібне. "Циклоалкеніл" включає групи, такі як циклопентеніл та циклогексеніл, так само як і групи з більш ніж одним подвійним зв'язком, такі як 1,3- та 1,4-циклогексадієніл. Вираз "галоген", що використовується або окремо або у складних словах, таких як "галоалкіл", включає фтор, хлор, бром або йод. Вираз "12 галоген" вказує на те, що одне або два наявних положення для цього замісника можуть бути галогенами, котрі вибираються незалежно. Крім того, при використанні у таких складних слова х як "галоалкіл", зазначений алкіл може бути частково або цілком заміщений галогеновими атомами, які можуть бути однаковими або різними. Приклади "галоалкілу" включають F3C, ClCH2, CF3CH2 та CF3CCl2. Загальна кількість вуглецевих атомів у групі замісника позначається префіксом "Сi-Сj", де і та j є, наприклад, числами від 1 до 3; наприклад, С1С3 алкіл визначає групи від метилу до пропілу. Хоча визначеної границі щодо розмірів Формул І та II, придатних для процесів даного винаходу, не існ ує, звичайно, Формула II включає 4100, більш типово 4-50, найбільш типово, 4-25 вуглецевих атомів, та 3-25, більш типово, 3-15, і найбільш типово, 3-10 гетероатомів. Зазначені гетероатоми звичайно вибираються із галогену, кисню, сірки, азоту та фосфор у. Два гетероатоми у Формулах І та II являють собою дигідропіразолові кільцеві азотні атоми; X1 являє собою галоген, і X2 містить принаймні один гетероатом. Хоча визначеної границі щодо розміру L та R (включаючи R4) не існує, заміщені, при потребі, алкільні складові у L та R (включаючи R4) звичайно включають від 1 до 6 вуглецевих атомів, більш типово, від 1 до 4 вуглецевих атомів, і найбільш типово, від 1 до 2 вуглецеви х атомів у даному алкільному ланцюгу. Заміщені, при потребі, алкенільна та алкінільна складові у L та R (включаючи R4) звичайно включають від 2 до 6 вуглецеви х атомів, більш типово, від 2 до 4 вуглецевих атомів, і найбільш типово, від 2 до 3 вуглецеви х атомів у даному алкенільному або алкінільному ланцюгу. Крім того, визначеної границі щодо розміру груп, які перелічені для R1 та R2, не існує, але алкіл, включаючи похідні, такі як алкокси та галоалкіл, є, типово, Сі-С6, більш типово, С1-С4, і найбільш типово, C1-C2. Як зазначалось вище, вуглецеві складові L, R та R4 можуть бути (серед інших) ароматичним кільцем або кільцевою системою. Приклади ароматичних кілець або кільцевих систем включають фенільне кільце, 5- або 6-членні гетероароматичні кільця, ароматичні 8-, 9- або 10-членні злиті карбобіциклічні кільцеві системи та ароматичні 8, 9- або 10-членні злиті гетеробіциклічні кільцеві системи, де кожне кільце або кільцева система є, 79799 10 при потребі, заміщеними. Вираз "при потребі, заміщений" у зв'язку з цими L та R вуглецевими складовими стосується вуглецевих складових, котрі є незаміщеними або мають принаймні одного неводневого замісника. Ці вуглецеві складові можуть бути заміщені такою кількістю можливих замісників, яка може бути розміщена при заміні атому водню неводневим замісником на будьякому наявному атомі вуглецю або азоту. Звичайно, кількість можливих замісників (коли вони присутні) варіює від одного до чотирьох. Прикладом фенілу, що, при потребі, заміщений однимчотирма замісниками, є кільце, проілюстроване як U-1 на Ілюстрації 1, де Rv є будь-яким неводневим замісником, і r дорівнює цілому числу від 0 до 4. Приклади ароматичних 8-, 9- або 10членних злитих карбобіциклічних кільцевих систем, котрі, при потребі, заміщені одним-чотирма замісниками, включають нафтильну груп у, що заміщена, при потребі, одним-чотирма замісниками і проілюстрована структурою U-85, і 1,2,3,4тетрагідронафтильну групу, що заміщена, при потребі, одним-чотирма замісниками і проілюстрована структурою U-86 на Ілюстрації І, де Rv є будь-яким замісником, і r дорівнює цілому числу від 0 до 4. Приклади 5- або 6-членних гетероароматичних кілець, що заміщені, при потребі, одним-чотирма замісниками, включають кільця U-2 - U-53 на Ілюстрації І, де Rv є будь-яким замісником, і r дорівнює цілому числу від 1 до 4. Приклади ароматичних 8-, 9-або 10-членних злитих гетеробіциклічних кільцевих систем, що заміщені, при потребі, одним-чотирма замісниками, включають U-54 - U-84 на Ілюстрації І, де Rv є будьяким замісником, і r дорівнює цілому числу від 0 до 4. Інші приклади L та R включають бензильну груп у, котра заміщена, при потребі, однимчотирма замісниками і проілюстрована як U-87, та бензоїльну групу, що заміщена, при потребі, одним-чотирма замісниками і проілюстрована як структура U-88 на Ілюстрації І, де Rv є будь-яким замісником, і r дорівнює цілому числу від 0 до 4. Хоча Rv гр упи зображені у структурах U-1 - U85, слід зазначити, що нема потреби їх представляти, оскільки вони є лише можливими замісниками. Атоми азоту, що потребують заміщення для заповнення їх валентностей, заміщуються Η або Rv. Зазначимо, що деякі U групи можуть бути заміщені менше ніж 4 Rv групами (наприклад, U14, U-15, U-18 - U-21 та U-32 - U-34 можуть бути заміщені лише однією Rv). Зазначимо, що коли точка приєднання між (Rv)r та U гр упою зображена як плаваюча, (Rv)r може бути приєднана до будь-якого наявного вуглецевого атома або азотного атома даної U групи. Зазначимо, що коли точка приєднання на U групі зображена як плаваюча, дана U група може бути приєднана до залишку Формул І та II через будь-який наявний атом вуглецю даної U гр упи шля хом заміни атома водню. Як зазначалось вище, вуглецеві складові L, R та R4 можуть бути (серед інших) насиченими або частково насиченими карбоциклічними та гетероциклічними кільцями, котрі можуть бути додатково, при потребі, заміщені. Вираз "при потребі, 11 заміщений" у зв'язку з цими L та R вуглецевими складовими стосується вуглецевих складових, котрі є незаміщеними або мають принаймні одного неводневого замісника. Ці вуглецеві складові можуть бути заміщені такою кількістю можливих замісників, яка може бути розміщена при заміні атому водню неводневим замісником на будьякому наявному атомі вуглецю або азоту. Звичайно, кількість можливих замісників (коли вони присутні) варіює від одного до чотирьох. Приклади насичених або частково насичених карбоцик 79799 12 лічних кілець включають заміщений, при потребі, С3-С8циклоалкіл та заміщений, при потребі, С3С8циклоалкіл. Приклади насичених або частково насичених гетероциклічних кілець включають 5або 6-членні неароматичні гетероциклічні кільця, що включають, при потребі, один або два кільцевих члени, які вибираються із групи, котра складається із заміщених, при потребі, С(=О), SO або S(O)2. Приклади таких L та R вуглецевих складових включають структури, що зображені як G-1 G-35 на Ілюстрації 2. 13 79799 14 15 Зазначимо, що коли точка приєднання на цих G гр упах зображена як плаваюча, дана G гр упа може бути приєднана до залишку Формул І та II через будь-який наявний атом вуглецю або азоту даної G групи шляхом заміни атома водню. Можливі замісники можуть бути приєднані до будьякого наявного атома вуглецю або азоту шля хом заміни атома водню (зазначені замісники не зображені на Ілюстрації 2, оскільки вони є лише можливими замісниками). Зазначимо, що коли G включає кільце, яке вибирається із структур G-24 - G-31, G-34 та G-35, Q2 може вибиратись із О, S, NH або заміщеного N. Зазначимо, що L, R та R4 вуглецеві складові можуть бути, при потребі, заміщені. Як зазнача 79799 16 лось вище. L та R вуглецеві складові можуть, звичайно, включати, серед інших груп, U груп у або G групу, що, при потребі, додатково заміщені одним-чотирма замісниками. Так, L та R вуглецеві складові можуть включати U групу або G групу, вибрану із U-1 - U-88 або G-1 - G-35 і додатково заміщену додатковими замісниками, включаючи від однієї до чотирьох U або G груп (котрі можуть бути однаковими або різними) як з остовом U або G гр упи, так і замісником U або G груп, що при потребі, додатково заміщені. Особливо увагу привертають L вуглецеві складові, що включають U групу, заміщену, при потребі, одним-трьома замісниками. Наприклад, L може являти собою груп у U-41. 17 Як показано на Схемі 1, згідно зі способом даного винаходу, 4,5-дигідро-1Н-піразол Формули II контактує з НХ1 з утворенням іншої 3-гало4,5-дигідро-1Н-піразолової сполуки Формули І де L, R, Xі, X2 та k є такими, як визначено у розділі вище. Дана реакція проводиться у придатному розчиннику. Для одержання найкращих результатів розчинник має бути ненуклеофільним, відносно інертним до НХ1 та здатним розчиняти сполуку Формули II. Придатні розчинники включають дибромометан, дихлорометан, оцтову кислоту, етилацетат та ацетонітрил. Дана реакція може проводитись під атмосферним тиском або під тиском, що близький до атмосферного, або під тиском, що вище атмосферного, в автоклаві. Вихідний НХ1 матеріал може додаватись у ви гляді газу до реакційної суміші, що містить сполуку Формули II та розчинник. Коли X2 у сполуці Формули II являє собою галоген, такий як СІ, дана реакція проводиться, краще, у такий спосіб, що НХ2, який генерується у ході даноїреакції, вилучається шляхом барботування або з допомогою інших придатних засобів. Як альтернатива, вихідний НХ1 матеріал може спочатку розчинятись в інертному розчиннику, в якому він має високу розчинність (такому як оцтова кислота), перед тим як контактувати зі сполукою Формули II у чистому вигляді або у розчиннику. Крім того, коли X у сполуці Формули II являє собою галоген, такий як СІ, звичайно потрібно значно більше одного еквівалента НХ1 (наприклад, від 4 до 10 еквівалентів), у залежності від рівня бажаного перетворення. Один еквівалент НХ1 може запровадити високий ступінь перетворення, коли X2 являє собою OS(O)mR1 або OP(O)р(OR2)2 , але коли сполука Формули II включає принаймні одну основну функціональну груп у (наприклад, гетероцикл, що містить азот), звичайно потрібно більше одного еквівалента НХ1. Дана реакція може проводитись при температурі у межах приблизно від 0 до 100°С, найбільш зручно, при температурі, близькій до температури навколишнього середовища (наприклад, приблизно 10-40°С), і найкраще, у межах від приблизно 20 до 30°С. Добавка каталізатора на основі льюїсових кислот (наприклад, броміду алюмінію для одержання сполуки Формули І, де X1 є бромом) може сприяти проведенню даної реакції. Продукт Формули І виділяють з 79799 18 використанням методів, що відомі фахівцям у даній галузі, включаючи екстракцію, дистиляцію та кристалізацію. Для способу даного винаходу вихідні сполуки, яким віддається перевага, включають сполуки Формули II, де m дорівнює 2, і р дорівнює 1. Крім того, перевага віддається вихідним сполукам Формули II, де X2 являє собою галоген або OS(O)mR1 (особливо де m дорівнює 2). Крім того, перевага віддається вихідним сполукам Формули II, де X2 являє собою СІ або OS(O)mR1, де m дорівнює 2, і R1 являє собою С1-С6алкіл, CF3 або феніл, що заміщений, при потребі, 1-3 замісниками, котрі вибираються із С 1-С4алкілу, і краще, R1 являє собою С 1-С2 алкіл, феніл або 4-метилфеніл. Способи даного винаходу, яким віддається особлива перевага, включають такі з них, де як вихідна сполука використовується сполука Формули II, де X являє собою СІ або OS(O)2R1, і R1 являє собою метил, феніл або 4-метилфеніл. Спосіб даного винаходу, якому віддається особлива перевага, включає застосування вихідної сполуки Формули II, де X2 являє собою СІ або OS(O)2R1, і R1 являє собою феніл або 4-метилфеніл. Для способу даного винаходу сполукипродукти, яким віддається перевага, включають сполуки Формули І, де X1 являє собою СІ, Вr або І. Сполуки-продукти, яким віддається більша перевага, включають сполуки Формули І, де X1 являє собою СІ або Вr. Сполуки-продукти, яким віддається найбільша перевага, включають сполуки Формули І, де X1 являє собою Вr. Особливо корисні варіанти способу даного винаходу включають одержання сполуки Формули І, де X1 являє собою СІ або Вr, із сполуки Формули II, де X2 являє собою OS(O)2R1, де R1 являє собою, наприклад, метил, феніл або 4-метилфеніл, краще, феніл або 4-метилфеніл. Способи даного винаходу, яким віддається перевага, включають спосіб, де вихідною сполукою Формули II є сполука Формули IIа, і сполукою-продуктом Формули І слугує сполука Формули Іа, як показано на Схемі 2 нижче. де X1 та X2 є такими як визначено для Формул І та II; кожна R3 являє собою, незалежно, С1С4алкіл, С2-С4алкеніл, С2-С4алкініл, С3С6циклоалкіл, С1-С4галоалкіл, С2-С4галоалкеніл, 19 С2-С4галоалкініл, С3-С6галоциклоалкіл, галоген, CN, NO2, С1-С4алкокси, С1-С4галоалкокси, С1С4алкілтіо, С1-С4алкілсульфініл, С1С4алкілсульфоніл, С1-С4алкіламіно, C2C8діалкіламіно, С3-С6циклоалкіламіно, (С1С4алкіл)(С3-С6циклоалкіл)аміно, С2С4алкілкарбоніл, С2-С6алкоксикарбоніл, С2С6алкіламінокарбоніл, С3-С8діалкіламінокарбоніл або С3-С6триалкілсиліл; R4 являє собою Η або заміщену, при потребі, вуглецеву складову; Ζ являє собою N або CR5; R5 являє собою Η або R3; і n дорівнює цілому числу, що вибирається із 0-3. Фахівцеві у даній галузі зрозуміло, що Формула Іа являє собою підвид Формули І, і Формула IIа являє собою підвид Формули II. Хоча широкий різновид заміщених, при потребі, вуглецевих складових, як вже описано, є корисним як R4 в ефірах Формули Іа для способу за Схемою 2, звичайно R4 являє собою радикал, котрий містить до 18 вуглецевих атомів і вибирається із алкілу, алкенілу та алкінілу; та бензилу і фенілу, кожен, при потребі, заміщений алкілом та галогеном. Найкраще, коли R4 являє собою С1-С4 алкіл. Заслуговує на увагу спосіб, показаний на Схемі 2, де Ζ являє собою Ν, n дорівнює 1, і R3 являє собою СІ або Br і розміщена у 3-му положенні. Крім того, заслуговує на увагу спосіб, показаний на Схемі 2, де X2 являє собою галоген або OS(O)2R1 , особливо де R1 являє собою метил, феніл або 4-метилфеніл. Крім того, заслуговує на увагу спосіб, показаний на Схемі 2, де X1 являє собою Br або СІ, та особливо, де X1 являє собою Вr. На особливу ува гу заслуговує спосіб, показаний на Схемі 2, де X1 являє собою Вr, X2 являє собою СІ або OS(O)mR1, m дорівнює 2, і R1 є фенілом або 4-метилфеніл ом. Коли у сполуці Формули IIа присутня основна функціональна група (наприклад, Ζ являє собою Ν, і/або R3 являє собою алкіламіно, діалкіламіно, циклоалкіламіно або (алкіл)(циклоалкіл)аміно), звичайно потрібно більше одного еквівалента НХ1 для задовільного перетворення, навіть коли X2 являє собою OS(O)mR1 або OP(O)p(OR2) 2. Коли Ζ являє собою N, R3 відрізняється від алкіламіно, діалкіламіно, циклоалкіламіно та (алкіл)(циклоалкіл)аміно), і X2 є S(O) 2R1 у Формулі ІІа, високий ступінь перетворення досягається з використанням від 1,5 до 2 еквівалентів НХ1. Вихідні сполуки Формули II, де X2 являє собою галоген, можуть бути одержані із відповідних сполук Формули 1, як показано на Схемі 3 де X2 являє собою галоген, і L, R та k є такими, як визначено вище. 79799 20 Обробка сполуки Формули 1 галогенуючим агентом, звичайно у присутності розчинника, дає відповідну гало сполуку Формули II. Галогенуючі агенти, що можуть бути використані, включають оксигалогеніди фосфору, тригалогеніди фосфору, пентагалогеніди фосфору, тіонілхлорид, дигалотриалкілфосфорани, дигалодифенілфосфорани, оксалілхлорид, фосген, тетрафторид сірки та (діетиламіно)сірка трифторид. Перевага віддається оксигалогенідам фосфору та пентагалогенідам фосфору. Для досягнення повного перетворення відносно сполуки Формули 1 має застосовуватись принаймні 0,33 еквівалента оксигалогеніду фосфор у (тобто мольне відношення оксигалогеніду фосфор у до сполуки Формули 1 складає принаймні 0,33), краще, від 0,33 до 1,2 еквівалентів. Для досягнення повного перетворення принаймні 0,20 еквівалента пентагалогеніду фосфору має бути використано щодо сполуки Формули 1, краще, від приблизно 0,20 до 1,0 еквівалента. Типові розчинники для цього галогенування включають галогеновані алкани, такі як дихлорометан, хлороформ, хлоробутан і таке подібне, ароматичні розчинники, такі як бензол, ксилол, хлорбензол і таке подібне, прості ефіри, такі як тетрагідрофуран, р-діоксан, діетиловий ефір і таке подібне, та полярні апротонні розчинники, такі як ацетонітрил, Ν,Ν-диметилформамід і таке подібне. При потребі, може додаватись органічна основа, така як триетиламін, піридин, Ν,Ν-диметиланілін або таке подібне. Можливим може бути також додавання каталізатора, такого як Ν,Ν-диметилформамід. Перевага віддається процесу, в якому розчинником слугує ацетонітрил, і основа відсутня. Звичайно, при використанні ацетонітрилу не потрібна ані основа ані каталізатор. Процес, якому віддається перевага, проводиться шляхом перемішування сполуки Формули 1 в ацетонітрилі. Потім на протязі зручного часу додають агент галогенування, і дану суміш витримують при потрібній температурі до завершення даної реакції. Температуру реакції типово підтримують на рівні від приблизно 20°С до точки кипіння ацетонітрилу, і час реакції складає, звичайно, менше 2 годин. Потім реакційну масу нейтралізують неорганічною основою, такою як бікарбонат натрію, гідроксид натрію і таке подібне, або органічною основою, такою як ацетат натрію. Потрібний продукт, сполука Формули II, може виділятись з використанням способів, що відомі фахівцям у даній галузі, включаючи екстракцію, кристалізацію та дистиляцію. Як показано на Схемі 4, вихідні сполуки Формули II, де R1 являє собою OS(O)mR1 або OP(O)p(OR 2)2, можуть бути у подібний спосіб одержані із відповідних сполук Формули 1 шля хом контактування з X3S(O)mR 1 (2) або X3P(O) p(OR2) 2 (3), відповідно, де X3 являє собою нуклеофільну реакційну відщеплювальну груп у. Як X3 особливо корисні галогеніди, такі як СІ. Також для X3S(O)mR 1 корисно, коли X3 являє собою OS(O)mR1 (тобто Формулою 2 є R1S(O)mOS(O)mR 1); якщо R1 являє собою CF3, особливо корисно, коли X3 є OS(O) mR1. З ура ху 21 ванням легкості синтезу та відносно низької ціни, краще, коли X являє собою СІ. де X2 являє собою OS(O)mR1 або OP(O)p(OR 2)2, X3 являє собою відщеплювальну груп у, і L, R, R1 , k, m та p є такими, як визначено вище. У цьому способі сполука Формули 1 контактує зі сполукою Формули 2 (X2 являє собою OS(O)mR1) або Формули 3 (X2 являє собою OP(O)p(OR 2)2), типово у присутності розчинника та основи. Придатні розчинники включають дихлорометан, тетрагідрофуран, ацетонітрил і таке подібне. Придатні основи включають третинні аміни (наприклад, триетиламін, Ν,Νдіізопропілетиламін) та іонні основи, такі як карбонат калію і таке подібне. Як основі, перевага віддається третинному аміну. Для одержання повного перетворення, загалом, використовується принаймні один еквівалент (краще, невеликий надлишок, наприклад, 5-10%) сполуки Формули 2 або Формули 3 та основи щодо сполуки Формули 1. Дана реакція звичайно проводиться при температурі у межах від приблизно -50°С до точки кипіння даного розчинника, більш типово, від 0°С до температури навколишнього середовища (тобто від приблизно 15 до 30°С). Дана реакція звичайно завершується за дві години - кілька діб; хід реакції може контролюватись за допомогою методів, що відомі фахівцям у цій галузі, таких як тонкошарова хроматографія та аналіз 1H ЯМР спектрів. Потім дану реакційну суміш обробляють, наприклад, промивають водою, осушують органічну фазу та випарюють розчинник. Потрібний продукт, сполука Формули II, може виділятись за допомогою методів, відомих фа хівцям у цій галузі, включаючи екстракцію, кристалізацію та дистиляцію. Оскільки Формула IIа є підвидом Формули II, сполуки Формули ІІа можуть бути одержані із відповідних сполук Формули 1а, котра є підвидом Формули 1, з використанням способів, що вже описувались для Схем 3 та 4. де R3, R4, Ζ та n є такими, як визначено для Формули IIа. Сполуки Формули 1 можуть бути одержані з використанням широкого різновиду сучасних синтетичних методологій, що відомі фахівцям у даній галузі. Наприклад, сполуки Формули 1а можуть 79799 22 бути одержані із сполук Формул 4 та 5 як окреслено на Схемі 5. де R3, R4, Ζ та n є такими, як визначено для Формули IIа. У цьому способі гідразинова сполука Формули 4 контактує зі сполукою Формули 5 (може використовуватись фумарат-ефір або малеат-ефір, або їх суміш) у присутності основи та розчинника. Основою звичайно слугує металалкоксидна сіль, така як натрій метоксид, калій етоксид, натрій етоксид, калій етоксид, калій трет-бутоксид, літій трет-бутоксид і таке подібне. Щодо сполуки Формули 4 має використовува тись більше 0,5 еквівалента основи, краще, у межах від 0,9 до 1,3 еквівалента. Сполука Формули 5 має використовува тись у кількості більше 1,0 еквівалента, краще, від 1,0 до 1,3 еквівалента. Можуть застосовуватись полярні протонні та полярні апротонні органічні розчинники, такі як спирти, ацетонітрил, тетрагідрофуран, Ν,Νдиметилформамід, диметилсульфоксид і таке подібне. Розчинниками, яким віддається перевага, є спирти, такі як метанол та етанол. Особлива перевага віддається, коли даний спирт є тим самим, що утворює фумарат- або малеат-ефір та алкоксидну основу. Дана реакція звичайно проводиться шляхом змішування сполуки Формули 4 та основи у розчиннику. Дана суміш може нагріватись або охолоджуватись до потрібної температури, і сполуку Формули 5 додають протягом деякого періоду часу. Типові температури реакції лежать у межах від 0°С до точки кипіння використаного розчинника. Дана реакція може проводитись під тиском, вищим за атмосферний, для підвищення температури кипіння даного розчинника. Загалом, перевага віддається температурам у межах приблизно 30-90°С. Час уведення залежить від швидкості теплопередачі. Типовий час уведення складає від 1 хвилини до 2 годин. Оптимальна температура реакції та час уведення варіюють у залежності від ідентичності сполук Формули 4 та Формули 5. Після введення реакційна суміш може витримуватись протягом деякого часу при заданій температурі реакції. У залежності від температури реакції потрібний час витримки варіює від 0 до 2 годин. Типовий час витримки складає 10-60 хвилин. Потім реакційна маса може бути підкислена шляхом додавання органічної кислоти, такої як оцтова кислота і таке подібне, або неорганічної кислоти, такої як хлористоводнева кислота, сірчана кислота і таке подібне. У залежності від умов реакції та засобів виділення, функціональна група -CO2R4 сполуки Формули 1а може бути піддана гідролізу до СО2Н; наприклад, присутність води у даній реакційній суміші може активувати такий гідроліз. Якщо утворюється карбонова кислота (-СО2Н), вона 23 може бути знову перетворена у -CO2R4, де R4 являє собою, наприклад, С1-С4 алкіл, з використанням методів етерифікації, добре відомих у даній галузі. Потрібний продукт, сполука Формули 1а, може виділятись за допомогою відомих у даній галузі методів, таких як кристалізація, екстракція або дистиляція. Мається на думці, що фа хівець у даній галузі, користуючись попереднім описом, може застосувати даний винахід у самому повному обсязі. Тому наступні Приклади слід розглядати як просто ілюстративні, а не такі, що у будь-якій мірі обмежують розкриття даного винаходу. Стадії у наступних Прикладах ілюструють методику для кожної стадії у повному синтетичному перетворенні, і зовсім необов'язково, щоб вихідний матеріал для кожної стадії одержувався лише згідно з методикою, що описана в інших Прикладах або стадіях. Наведені відсотки є ваговими відсотками, за виключенням для хроматографічних сумішей розчинників або коли це спеціально оговорено. Якщо не зазначено інше, частини та відсотки для хроматографічних сумішей розчинників подані в об'ємних величинах. 1НЯМР спектри подані у млн.-1 у нижньому напрямі енергетичного спектру від тетраметилсилану; s = синглет, d = дублет, t = триплет, q = квартет, m = мультиплет, dd = дублет дублетів, dt = дублет триплетів, br s = широкий синглет. Приклад 1 Одержання етил 3-бромо-1-(3-хлоро-2піридиніл)-4,5-дигідрс-1Н-піразол-5-карбоксилату шляхом заміни хлору бромом Стадія А: Одержання етил 2-(3-хлоро-2піридиніл)-5-оксо-3-піразолідин-карбоксилату 2-л чотиригорлову колбу, обладнану механічною мішалкою, термометром, краплинною лійкою, зворотним холодильником та патрубком для напуску азоту, завантажували абсолютним етанолом (250мл) та етаноловим розчином етоксиду натрію (21%, 190мл, 0,504моль). Дану суміш нагрівали зі зворотним холодильником при температурі близько 83°С. Потім її обробляли 3-хлоро2(1Н)-піридинон гідразоном (68,0г, 0,474моль). Потім дану суміш повторно нагрівали зі зворотним холодильником протягом 5 хвилин. Потім жовту суспензію обробляли по краплях діетилмалеатом (88,0мл, 0,544моль) протягом 5 хвилин. Підчас уведення швидкість відгону помітно зростала. Наприкінці введення весь вихідний матеріал розчинявся. Утворений в результаті помаранчево-червоний розчин нагрівали зі зворотним холодильником ще 10 хвилин. Після охолодження до 65°С реакційну суміш обробляли льодяною оцтовою кислотою (50,0мл, 0,873моль). Утворився осад. Дану суміш розводили водою (650мл), що спричинило розчинення осаду. Помаранчевий розчин охолоджували на льодяній бані. Продукт почав випадати при 28°С. Дану суспензію витримували приблизно при 2°С протягом 2 годин. Даний продукт виділяли шляхом фільтрації, промивали водним етанолом (40%, 3´50мл) і потім сушили на повітрі протягом приблизно 1 години. Сполуку титульного продукту одержували у вигляді сильно кристалічного світло-помаранчевого 79799 24 порошку (70,3г, 55% вихід) Як було встановлено методом 1H ЯМР, значних домішок не спостерігалось. 1 H ЯМР (DMSO-d6) δ 1,22 (t, 3Н), 2,35 (d, 1Н), 2,91 (dd, 1H), 4,20 (q, 2H), 4,84 (d. 1H), 7,20 (dd, 1H), 7,92 (d, 1H), 8,27 (d, 1H), 10,18 (s, 1H). Стадія В: Одержання етил 3-хлоро-1-(3хлоро-2-піридиніл)-4,5-дигідро-1Н-піразол-5карбоксилату 2-л чотиригорлову колбу, обладнану механічною мішалкою, термометром, краплинною лійкою, зворотним холодильником та патрубком для напуску азоту, завантажували ацетонітрилом (1000мл), етил 2-(3-хлоро-2-піридиніл)-5-оксо-3піразолідинкарбоксилатом (тобто продуктом зі Стадії А) (91,0г, 0,337моль) та оксихлоридом фосфору (35,0мл, 0,375моль). Після уведення оксихлориду фосфору дана суміш саморозігрівалась від 22 до 25°С, і утворювався осад. Світло-жовту суспензію нагрівали зі зворотним холодильником при 83°С протягом 35 хвилин, після чого осад розчинився. Утворений в результаті помаранчевий розчин нагрівали зі зворотним холодильником протягом 45 хвилин, після чого він набув чорно-зеленого кольору. Замість зворотного холодильника була змонтована дистиляційна насадка, і 650мл розчинника було вилучено шляхом дистиляції. Другу 2-л чотиригорлову колбу, обладнану механічною мішалкою, завантажували бікарбонатом натрію (130г, 1,55моль) та водою (400мл). Протягом 15 хвилин зазначену концентровану реакційну суміш додавали до суспензії бікарбонату натрію. Утворену в результаті дво хфазову суміш енергійно перемішували протягом 20 хвилин, і за цей час виділення газу припинилось. Дану суміш розводили дихлорометаном (250мл) і потім перемішували протягом 50 хвилин. Суміш обробляли прискорювачем фільтрування на основі Целіт® 545 діатомової землі (11г) і потім фільтрували для вилучення чорної смолистої речовини, котра інгібувала розділення фаз. Оскільки розділення фільтрату на дві чіткі фази відбувалось повільно, його розводили дихлорометаном (200мл) та водою (200мл) і ще додавали Целіт® 545 (15г). Дану суміш фільтрували, і фільтрат переносили у ділильну лійку. Більш важкий органічний шар глибокого зеленого кольору відокремився. Роздроблений шар (50мл) фільтрували повторно і потім додавали до зазначеного органічного шару. Даний органічний розчин (800мл) обробляли сульфатом магнію (30г) та силікагелем (12г), і суспензію перемішували з допомогою магнітної мішалки протягом 30 хвилин. Дану суспензію фільтрували для вилучення сульфату магнію та силікагелю, і вона набула глибокого блакитно-зеленого кольору. Фільтрувальний осад промивали дихлорометаном (100мл). Фільтрат концентрували на роторному випарнику. Отриманий продукт складався із масла темнобурштинового кольору (92,0г, 93% вихід). Як було встановлено методом Ή ЯМР, єдиними домішками були 1% вихідного матеріалу та 0,7% ацетонітрилу. 25 1 H ЯМР (DMSO-d6) δ 1,15 (t, 3Н), 3,26 (dd, 1Н), 3,58 (dd, 1H), 4,11 (q, 2H), 5,25 (dd, 1H), 7,00 (dd, 1H), 7,84 (d, 1H), 8,12 (d, 1H). Стадія С: Одержання етил 3-бромо-1-(3хлоро-2-піридиніл)-4,5-дигідро-1Н-піразол-5карбоксилату Бромистий водень перепускали через розчин етил 3-хлоро-1-(3-хлоро-2-піридиніл)-4,5-дигідро1Н-піразол-5-карбоксилату (тобто продукту зі Стадії В) (8,45г, 29,3ммоль) у дибромометані (85мл). За 90 хвилин струмінь газу зупиняли, і реакційну суміш промивали водним розчином бікарбонату натрію (100мл). Органічну фазу осушували та випарювали під зниженим тиском з одержанням титульного продукту у вигляді масла (9,7г, 99% вихід), що кристалізувалось при витримці. 1 H ЯМР (CDCl3) δ 1,19 (t, 3Н), 3,24 (1/2 АВ у зразку АВХ, J=9,3, 17,3Гц, 1Н), 3,44 (1/2 АВ у зразку АВХ, J=11,7, 17,3Гц, 1Н), 4,18 (q, 2H), 5,25 (X АВХ, 1Н, J=9,3, 11,9Гц), 6,85 (dd, J=4,7, 7,7Гц, 1Н), 7,65 (dd, J=1,6, 7,8Гц, 1Н), 8,07 (dd, J=1,6, 4,8Гц, 1Н). Приклад 2 Одержання етил 3-бромо-1-(3-хлоро-2піридиніл)-4.5-дигідро-1Н-піразол-5-карбоксилату шляхом заміни тозилату бромом Стадія А: Одержання етил 1-(3-хлоро-2піридиніл)-4,5-дигідро-3-[[(4-метилфеніл)сульфоніл]окси]-1Н-піразол-5карбоксилату Триетиламін (3,75г, 37,1ммоль) додавали по краплях до суміші етил 2-(3-хлоро-2-шридиніл)-5оксо-3-піразолідинкарбоксилату (тобто продукту з Прикладу 1, Стадія А) (10,0г, 37,1ммоль) та ртолуолсульфонілхлориду (7,07г, 37,1ммоль) у дихлорометані (100мл) при 0°С. Уводили додаткові порції р-толуолсульфонілхлориду (0,35г, 1,83ммоль) та триетиламіну (0,19г, 1,88ммоль). Потім дану реакційну суміш нагрівали до кімнатної температури та перемішували протягом ночі. Потім суміш розводили дихлорометаном (200мл) та промивали водою (3´70мл). Органічну фазу осушували та випарювали з одержанням титульного продукту як масла (13,7г, 87% вихід), котре повільно кристалізувалось. Продукт, підданий рекристалізації із суміші етилацетат/гексани, мав Тпл. 99,5-100°С. ІK (нуйол): 1740, 1638, 1576, 1446, 1343, 1296, 1228, 1191, 1178, 1084, 1027, 948, 969, 868, 845см -1. 1 H ЯМР (CDCl3) δ 1,19 (t, 3Н), 2,45 (s, 3Н), 3,12 (1/2 АВ у зразку АВХ, J=17,3, 9Гц, 1Н), 3,33 (1/2 АВ у зразку АВХ, J=17,5, 11,8Гц, 1Н), 4,16 (q, 2H), 5,72 (X АВХ, J=9, 11,8Гц, 1Н), 6,79 (dd, J=4,6, 7,7Гц, 1Н), 7,36 (d, J=8,4Гц, 1Н), 7,56 (dd, J=1,6, 7,8Гц, 1Н), 7,95 (d, J=8,4Гц, 2Н), 8,01(dd,J=1,4, 4,6Гц, 1H). Стадія В: Одержання етил 3-бромо-1-(3хлоро-2-шридиніл)-4,5-дигідро-1Н-піразол-5карбоксилату Бромистий водень перепускали через розчин етил 1-(3-хлоро-2-піридиніл)-4,5-дигідро-3-[[(4метилфеніл)сульфоніл]окси]-1Н-піразол-5карбоксилату (тобто продукту зі Стадії А) (5г, 11,8ммоль) у дибромометані (50мл). За приблиз 79799 26 но 60 хвилин струмінь газу зупиняли, і реакційну суміш промивали водним розчином бікарбонату натрію (50мл). Органічну фазу осушували та випарювали під зниженим тиском з одержанням титульного продукту у вигляді масла (3,92г, 100% вихід), що кристалізувалось при витримці. 1Н ЯМР спектр даного продукту був такий самий як і для продукту із Прикладу 1. Стадія С. Приклад 3 Одержання етил 3-бромо-1-(3-хлоро-2піридиніл)-4,5-дигідро-1Н-піразол-5-карбоксилату шляхом заміни бензолсульфонату бромом Стадія А: Одержання етил 1-(3-хлоро-2піридиніл)-4,5-дигідро-3-[(фенілсульфоніл)окси]1Н-піразол-5-карбоксилату Триетиламін (1,85г, 18,5ммоль) додавали по краплях протягом 1 години до суміші етил 2-(3хлоро-2-піридиніл)-5-оксо-3піразолідинкарбоксилату (тобто продукту із Прикладу 1, Стадія А) (5,0г, 18,5ммоль) та бензолсульфонілхлориду (3,27г, 18,5ммоль) у ди хлорометані (20мл) при 0°С. Температуру контролювали у такий спосіб, щоб вона не перевищувала 1°С. Після перемішування даної реакційної суміші ще протягом 2 годин уводили додаткову порцію бензолсульфонілхлориду (0,5г, 1,85ммоль). Потім до зазначеної суміші додавали по краплях додаткову порцію триетиламіну (0,187г, 1,85ммоль). Після розмішування ще протягом 0,5 години дану суміш розподіляли між водою (100мл) та дихлорометаном (100мл). Органічний шар осушували (MgSO4) та випарювали з одержанням титульного продукту як помаранчевої твердої речовни (7,18г, 94% вихід). Продукт, рекристалізований із суміші етилацетат/гексани, плавився при 84-85°С. ІK (нуйол): 1737, 1639, 1576, 1448, 1385, 1346, 1302, 1233, 1211, 1188, 1176, 1088, 1032, 944, 910, 868, 846см -1. 1 H ЯМР (CDCl3) δ 1,19 (t, 3Н), 3,15 (1/2 АВ у зразку АВХ, J=8,8, 17,3Гц, 1Н), 3,36 (1/2 АВ у зразку АВХ, J=11,8, 17,3Гц, 1Н), 4,17 (q, 2H), 5,23 (Χ ΑΒΧ, J=8,8, 11,8Гц, 1Н), 6,78 (dd, J=2,8, 4,8Гц, 1H), 7,71-7,55 (m, 4H), 8,01 (dd, J=1,6, 4,6Гц, 2Н), 8,08 (dd, J=1,0, 2,6Гц, 2Н). Стадія В: Одержання етил 3-бромо-1-(3хлоро-2-піридиніл)-4,5-дигідро-1Н-піразол-5карбоксилату Розчин етил 1-(3-хлоро-2-піридиніл)-4,5дигідро-3-[(фенілсульфоніл)окси]-1Н-піразол-5карбоксилату (тобто продукту зі Стадії А) (1,0г, 2,44ммоль) в оцтовій кислоті (4мл) додавали до розчину бромистоговодню в оцтовій кислоті (33%, 1,2г, 4,89ммоль). Приблизно за 1 годину дану реакційну суміш додавали до насиченого водного розчину бікарбонату натрію (100мл). Потім дану суміш екстрагували етилацетатом (2´50мл), і поєднані екстракти осушували (MgSO4) та випарювали з одержанням титульного продукту у вигляді масла (0,69г, 85% вихід), що повільно кристалізувалось. 1H ЯМР спектр був таким самим як і для продукту із Прикладу 1, Стадія С. З використанням процедур, що описані у даному тексті, та відомих у даній галузі методів сполуки Формули II можуть бути перетворені у 27 сполуки Формули І як проілюстровано для Формул Іа та IIа у Таблиці 1. У даній Таблиці використані наступні скорочення: t -третинний, s - вто 79799 28 ринний, η - нормальний, і - ізо, Me - метил, Et етил, Рr - пропіл, і-Рr -ізопропіл, t-Bu - третинний бутил та Ph - феніл. 29 Спосіб даного винаходу щодо одержання 3гало-4,5-дигідро-1H-піразолу може бути використаний для одержання широкого різновиду сполук Формули І, що корисні як проміжні сполуки для одержання агентів-протекторів урожаю, фармацевтичних препаратів та інших хімічних продуктів тонкого органічного синтезу. Ілюстрація 3 дає перелік прикладів 3-гало-4,5-дигідро-1Нпіразолів, що можуть бути одержані згідно зі спо 79799 30 собом даного винаходу із відповідних 4,5-дигідро1Н-піразолів, які мають OS(O)mR1 (наприклад, OS(O)2CH3 або OS(O)2Ph), OP(O) p(OR2) 2 (наприклад, ОР(О)(ОМе)2) або інший галогенний замісник (наприклад, СІ, що замінює Вr, або Вr, що замінює СІ), включаючи 3-гало-4,5-дигідро-1Нпіразоли, що корисні для одержання продуктів фунгіцидного, гербіцидного призначення або продуктів, котрі регулюють ріст рослин. Дані при 31 79799 32 клади слід розглядати як такі, що ілюструють, без будь-яких обмежень, різні сфери застосування способу даного винаходу. Інші сполуки, що можуть бути одержані згідно зі способом даного винаходу, можуть використовуватись для виготовлення фармацевтичних препаратів, таких як протизапальні засоби, інгібітори алергії, протисудомні, седативні засоби і так далі. де Z, X1, R3 та n є такими, як визначено вище; R являє собою СН 3, F, СІ або Br; R 7 являє собою F, СІ, Br І або CF3; R8a являє собою С1-С4алкіл; і R8b є Η або СН3. Краще, коли Ζ являє собою Ν, n дорівнює 1, і R3 являє собою СІ або Br і знаходиться у 3-положенні. Сполуки Формули III корисні як інсектициди, як описано, [наприклад, у РСТ публікації № WO 01/70671 від 27 вересня 2001 року, так само як і у патентній заявці США за номером 60/324173 від 21 вересня 2001 року, патентній заявці США за номером 60/323941 від 21 вересня 2001 року та патентній заявці США за номером 60/369661 від 2 квітня 2002 року]. Одержання сполук Формули 8 та Формули III [описано у патентній заявці США за номером 60/400352 від 31 липня 2002 року [ВА9308 US PRV], та патентній заявці за номером 60/446438 від 11 лютого 2003 року [ВА9308 US PRV1], на які у даному тексті робиться посилання; так само як і у патентній заявці США за номером 60/369660 від 2 квітня 2002 року]. Сполуки Формули III можуть бути одержані із відповідних сполук Формули Іа з використанням процесів, що окреслені на Схемах 6-9. Як показано на Схемі 6, сполука Формули Іа обробляється окисником, при потребі, у присутності кислоти. 6 Серед сполук, що можуть бути одержані згідно зі способом даного винаходу, сполуки Формули Іа особливо корисні для одержання сполук Формули III де R3, R4, Z, X1 та n є такими як визначено раніше для Формули Іа. Для цієї стадії як вихідному матеріалу перевага віддається сполуці Формули Іа, де R4 являє собою С 1-С4алкіл. Агентом окиснення може бути пероксид водню, органічні пероксиди, персульфат калію, персульфат натрію, персульфат амонію, моноперсульфат калію (наприклад, Оксон (Охопе®) або перманганат калію. Для досягнення повного перетворення щодо сполуки Формули Іа має бути використаний принаймні один еквівалент окиснювального агента, краще, від приблизно одного до двох еквівалентів. Це окиснення проводиться, типово, у присутності розчинника. Даний розчинник може бути ефіром, таким як тетрагідрофуран, р-діоксан і таке подібне, органічним ефіром, таким як етилацетат, диметилкарбонат і таке подібне, або полярним апротонним органічним розчинником, таким як Ν,Νдиметилформамід, ацетонітрил і таке подібне. 33 Кислоти, придатні для використання на стадії окиснення, включають неорганічні кислоти, такі як сірчана кислота, фосфорна кислота і таке подібне, та органічні кислоти, такі як оцтова кислота, бензойна кислота і таке подібне. Кислота, якщо вона застосовується, має використовуватись у кількості більше 0,1 еквівалента щодо сполуки Формули Іа. Для досягнення повного перетворення може використовуватись від одного до п'яти еквівалентів кислоти. Для сполук Формули Іа, де Ζ являє собою CR5, окисником, якому віддається перевага, є пероксид водню, і окиснення проводиться, переважно, за відсутності кислоти. Для сполук Формули Іа, де Ζ являє собою Ν, окисником, якому віддається перевага, є персульфат калію, і окиснення проводиться, переважно, у присутності сірчаної кислоти. Дана реакція може проводитись шляхом змішування сполуки Формули Іа у потрібному розчиннику та, при потребі, кислоти. Окисник може потім додаватись зі зручною швидкістю. Температура реакції типово варіює від приблизно 0°С до точки кипіння даного розчинника для забезпечення прийнятного часу реакції до її завершення, краще, менше 8 годин. Потрібний продукт, сполука Формули 6, може бути виділена за допомогою методів, що відомі фа хівцям у даній галузі, включаючи екстракцію, хроматографію, кристалізацію та дистиляцію. Карбоновокислотні сполуки Формули 6, де R4 являє собою Н, можуть бути одержані шляхом гідролізу із відповідних ефірних сполук Формули 6, де, наприклад, R4 являє собою С1-С4алкіл. Карбоновоефірні сполуки можуть бути перетворені у карбоновокислотні сполуки з використанням множини методів, включаючи нуклеофільне розщеплення за безводних умов, або гідролітичних методів, що включають використання як кислот, так і основ [див. огляд методів у T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons, Inc., New York, 1991, pp.224-269]. Для сполук Формули 6 перевага віддається гідролітичним методам, що каталізуються основою. Придатні основи включають гідроксиди лужних металів (таких як літій, натрій або калій). Наприклад, даний ефір може бути розчинений у суміші води та спирту, такого як етанол. Після обробки гідроксидом натрію або гідроксидом калію даний ефір піддається омиленню для отримання натрієвої або калієвої солі даної карбонової кислоти. Підкислення сильною кислотою, такою як хлористоводнева або сірчана кислота, дає карбонову кислоту Формули 6, де R4 являє собою Н. Дана карбонова кислота може бути виділена за допомогою методів, що відомі фа хівцям у даній галузі, включаючи екстракцію, дистиляцію та кристалізацію. Сполучення піразолкарбонової кислоти Формули 6, де R4 являє собою Н, з антраніловою кислотою Формули 7 дає бензоксазинон Формули 8. На Схемі 7 бензоксазинон Формули 8 одержується безпосередньо шляхом послідовного додавання метансульфонілхлориду у присутності третинного аміну, такого як триетиламін або піридин, до піразолкарбонової кислоти Формули 6, де R4 являє собою Н, з наступним додаванням антра 79799 34 нілової кислоти Формули 7, з наступним повторним додаванням третинного аміну та метансульфонілхлориду. де R3, R6, R7, X1 , Ζ та n є такими, як визначено у Формулі III. Ця процедура дає, загалом, високі виходи бензоксазинону. Схема 8 зображує альтернативне одержання бензоксазинонів Формули 8, включаючи сполучення хлориду піразолової кислоти Формули 10 з ізатоєвим ангідридом Формули 9 з прямим одержанням бензоксазинону Формули 8. де R3, R6, R7, X1 , Ζ та n є такими, як визначено у Формулі III. Для цієї реакції придатні такі розчинники як піридин або піридин/ацетонітрил. Кислотні хлориди Формули 10 можуть отримуватись із відповідних кислот Формули 6, де R4 являє собою Н, з використанням відомих методик, таких як хлорування тіонілхлоридом або оксалілхлоридом. Сполуки Формули III можуть бути одержані за реакцією бензоксазинонів Формули 8 з C1C4алкіламінами та (C1-C4алкіл)(метил)амінами Формули 11, як окреслено на Схемі 9. де R3, R6, R7 , R8a, R8b, Χ1, Ζ та n є такими, як визначено вище. Дана реакція може проводитись у чистому вигляді або у різновиді придатних розчинників, включаючи ацетонітрил, тетрагідрофуран, діетиловий ефір, дихлорометан або хлороформ, при оптимальних температурах, що варіюють від кімнатної температури до точки відгону даного розчинника. Загальна реакція бензоксазинонів з амі 35 79799 нами для одержання антраніламідів добре задокументована у хімічній літературі. Огляд хімії бензоксазинонів [див. у Jakobsen et al., Biorganic and Medicinal Chemistry 2000, 8, 2095-2103 та Комп’ютерна в ерстка Т. Чепелев а 36 цитованих там посиланнях. Дивись також Coppola, J. Heterocyclic Chemistry 1999, 36, 563588]. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing 3-halo-4,5-dihydro-1h-pyrazoles
Назва патенту російськоюСпособ получения 3-гало-4,5-дигидро-1н-пиразолов
Автори російськоюAnnis, Gary, David
МПК / Мітки
МПК: C07D 401/04, C07D 231/06
Мітки: 3-гало-4,5-дигідро-1н-піразолів, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/18-79799-sposib-oderzhannya-3-galo-45-digidro-1n-pirazoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3-гало-4,5-дигідро-1н-піразолів</a>
Попередній патент: Давач лічення кількості та напрямку обертів
Наступний патент: Спосіб виготовлення гнучких фотоелектричних перетворювачів на основі cdte
Випадковий патент: Спосіб регулювання температури прес-форми машини лиття під тиском