Похідні 2-піперазин-1-іл-3н-імідазо[4,5-b]піридину
Номер патенту: 101149
Опубліковано: 11.03.2013
Автори: Жільмон Жером Еміль Жорж, Янссенс Франс Едуард, Бонфанті Жан-Франсуа, Соммен Франсуа Марія
Формула / Реферат
1. Сполука формули (І)
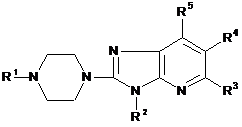 , (I)
, (I)
що включає її будь-яку стереохімічно ізомерну форму,
де
R1 є воднем, фенілметилом, піридинілметилом або бензо[1,3]діоксолілметилом;
R2 є С1-4алкілом;
R3 є воднем, галогеном або С1-4алкілом;
R4 є воднем, галогеном або С1-4алкілом; і
R5 є воднем, аміногрупою, С1-4алкіламіногрупою або ді(С1-4алкіл)аміногрупою;
або її фармацевтично прийнятна сіль приєднання кислоти, або її сольват.
2. Сполука за п. 1, де R1 є воднем.
3. Сполука за п. 1 або за п. 2, де R1 є фенілметилом.
4. Сполука за будь-яким з пп. 1-3, де R2 є метилом.
5. Сполука за п. 1, де сполука є 2-(4-бензилпіперазин-1-іл)-3-метил-3H-імідазо[4,5-b]піридином або його фармацевтично прийнятними солями приєднання кислоти.
6. Фармацевтична композиція, що містить фармацевтично прийнятний носій і терапевтично активну кількість сполуки за будь-яким з пп. 1-5.
7. Спосіб отримання фармацевтичної композиції за п. 6, де терапевтично активну кількість сполуки за будь-яким з пп. 1-5 змішують до отримання однорідної маси з фармацевтично прийнятним носієм.
8. Сполука за будь-яким з пп. 1-5 як лікарський препарат.
9. Застосування сполуки за будь-яким з пп. 1-5 для виробництва лікарського препарату для лікування гастроезофагеального рефлюксу, печії, диспепсії, відчуття швидкого насичення, здуття живота/метеоризму і анорексії.
10. Спосіб отримання сполуки Формули (І), де
проміжну сполуку формули (II) піддають N-алкілуванню з проміжною сполукою формули (III), в реакційно інертному розчиннику
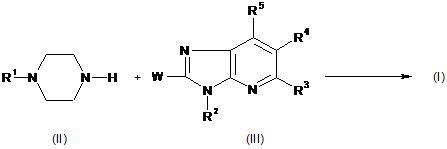 ,
,
де в наведеній вище реакційній схемі радикал R1 є воднем, фенілметилом, піридинілметилом або бензо[1,3]діоксолілметилом, і R2, R3, R4 і R5 є такими ж, як визначені в пункті 1, і W є відповідною відхідною групою;
або, якщо бажано, сполуку формули (І) перетворюють на фармацевтично прийнятну сіль приєднання кислоти, або навпаки, сіль приєднання кислоти сполуки формули (І) перетворюють на форму вільної основи за допомогою обробки лугом; і, якщо бажано, отримують її стереохімічно ізомерні форми.
11. Спосіб отримання сполуки Формули (І), де
проміжну сполуку формули (V) піддають N-алкілуванню зі сполукою формули (I-а) в реакційно інертному розчиннику
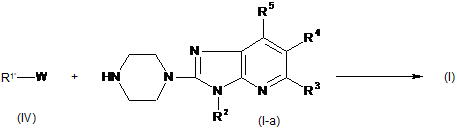 ,
,
де в наведеній вище реакційній схемі радикал R1' є фенілметилом, піридинілметилом або бензо[1,3]діоксолілметилом, і R2, R3, R4 і R5 є такими ж, як визначені в пункті 1, і W є відповідною відхідною групою;
або, якщо бажано, сполуку формули (І) перетворюють на фармацевтично прийнятну сіль приєднання кислоти, або навпаки, сіль приєднання кислоти сполуки формули (І) перетворюють на форму вільної основи за допомогою обробки лугом; і, якщо бажано, отримують її стереохімічно ізомерні форми.
Текст
Реферат: Даний винахід пов'язаний з новими сполуками формули (І), що мають релаксаційну активність відносно фундальної частини шлунка. Винахід додатково стосується способів отримання таких сполук, фармацевтичних композицій, що містять згадані сполуки, а також застосування згаданих сполук як лікарського препарату. R 5 R R 1 N 4 R 3 N N N R 2 (I) UA 101149 C2 (12) UA 101149 C2 UA 101149 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід відноситься до нових сполук формули (I), що мають фундальну релаксаційну активність. Додатково винахід відноситься до способів отримання таких сполук, до фармацевтичних композицій, що містять згадані сполуки, а також до застосування згаданих сполук як лікарського засобу. EP-A-0079545 розкриває піперазинілзаміщені бензімідазольні похідні з антигістамінною активністю. EP-0397613 розкриває аміноімідазопіридини, що мають антигістамінну активність, і EP-0512939 розкриває 2-піперазинілбензімідазольні похідні у якості антагоністів серотонінових 5НТ3 рецепторів. EP-1250337 розкриває заміщені гомопіперидинільні бензімідазольні аналоги у якості фундальних релаксантів. Даний винахід стосується сполук формули (I) що включає їх будь-яку стереохімічно ізомерну форму, де 1 R є воднем, фенілметилом, піридинілметилом або бензо[1,3]діоксолілметилом; 2 R є С1-4алкілом; 3 R є воднем, галогеном або С1-4алкілом; 4 R є воднем, галогеном або С1-4алкілом; і 5 R є воднем, аміногрупою, С1-4алкіламіногрупою або ді(С1-4алкіл) аміногрупою; або її фармацевтично прийнятна сіль приєднання кислоти, або її сольват. Як використано в наведених вище визначеннях: - галоген є загальним терміном, що включає фтор, хлор, бром і йод; - С1-4алкіл означає насичені вуглеводневі радикальні групи з нерозгалуженим і розгалуженим ланцюгом, що мають від 1 до 4 атомів вуглецю, такі як, наприклад, метил, етил, пропіл, бутил, 1-метилетил, 2-метилпропіл і тому подібне. Термін «стереохімічно ізомерні форми», використаний вище в даному документі, визначає всі можливі ізомерні форми, які можуть мати сполуки формули (I). Якщо не згадано або не вказано інше, хімічне позначення сполук означає суміш усіх можливих стереохімічно ізомерних форм, де згадані суміші містять усі діастереомери і енантіомери основної молекулярної структури. Конкретніше, стереогенні центри можуть мати R- або S-конфігурацію; замісники на двовалентних циклічних (частково) насичених радикальних групах можуть мати або цис-, або транс-конфігурацію. Поза сумнівом мається на увазі, що стереохімічно ізомерні форми сполук формули (I), включені в обсяг цього винаходу. Абсолютна стереохімічна конфігурація сполук формули (I) і проміжних сполук, використаних в їх приготуванні, може бути легко визначена фахівцями в даній галузі при використанні загальновідомих способів, таких як, наприклад, дифракція рентгенівських променів. Крім того, деякі сполуки формули (I) і деякі з проміжних сполук, використаних в їх приготуванні, можуть проявляти поліморфізм. Слід розуміти, що даний винахід охоплює будьякі поліморфні форми, що мають властивості, корисні в лікуванні станів, відмічених у цьому документі вище. Фармацевтично прийнятні солі приєднання кислоти, які згадані вище в цьому документі, призначені для включення терапевтично активних нетоксичних форм на основі солей приєднання кислоти, які здатні утворювати сполуки формули (I). Такі фармацевтично прийнятні солі приєднання кислоти можуть бути легко отримані шляхом обробки основної форми відповідною кислотою. Відповідні кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад, хлористоводнева або бромистоводнева кислота, сірчана, азотна, фосфорна і тому подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропіонова, гідроксиоцтова, молочна, піровіноградна, щавлева (тобто етандіова кислота), малонова, бурштинова (тобто бутандіова кислота), малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова, саліцилова, п-аміносаліцилова, памова і тому подібні кислоти. І навпаки, вищезазначені сольові форми можуть бути перетворені у форму вільної основи шляхом обробки відповідною основою. 1 UA 101149 C2 5 10 15 20 25 30 35 40 Сполуки формули (I) можуть існувати як у несольватованих, так і в сольватованих формах. Термін «сольват» використовують у цьому документі для опису асоціації молекул, що включає сполуки за винаходом і одну або більше молекул фармацевтично прийнятного розчинника, наприклад, води або етанолу. Термін «гідрат» використовують у тому випадку, коли згаданий розчинник є водою. Цікаві сполуки формули (I), що включають одне або більше з наступних обмежень: 1 a) R є фенілметилом; або 1 b) R є піридинілметилом; або 1 с) R є воднем; або 2 d) R є метилом; або 3 4 5 е) R , R і R є воднем. Сполуки формули (I) взагалі можуть бути приготовані шляхом N-алкілування проміжної сполуки формули (II) проміжною сполукою формули (III). У формулі (III) і надалі у цьому документі присутня група W у якості відповідної групи, що відходить, такої як, наприклад, галоген, наприклад, хлор, бром і т.п.; або сульфонілоксигрупа, така як, наприклад, метансульфонілоксигрупа, 4-метилбензолсульфонілоксигрупа і т.п. Згадана реакція N-алкілування може бути легко проведена в реакційно інертному розчиннику, такому як, наприклад, ароматичний вуглеводень, наприклад, бензол, метилбензол, диметилбензол і т.п.; алканол (спирт), наприклад, метанол, етанол, 1-бутанол і т.п.; кетон, наприклад, 2-пропанон, 4метил-2-пентанон і т.п.; простий ефір, наприклад, тетрагідрофуран, 1,4-діоксан, 1,1‟-оксибізетан і т.п.; диполярний апротонний розчинник, наприклад, N,N-диметилформамід, N,Nдиметилацетамід, диметилсульфоксид, нітробензол, 1-метил-2-пірролідинон і т.п.; або суміш таких розчинників. Додавання відповідної основи, такої як, наприклад, карбонат лужноземельного металла, гідрокарбонат, алкоксид, гідрид, амід, гідроксид або оксид, наприклад, карбонат натрію, гідрокарбонат натрію, карбонат калію, метоксид натрію, етоксид натрію, трет-бутоксид калію, гідрид натрію, амід натрію, гідроксид натрію, карбонат кальцію, гідроксид кальцію, оксид кальцію і т.п.; або органічної основи, такої як, наприклад, амін, наприклад, N,N-діетилетанамін, N-(1-метилетил)-2-пропанамін, 4-етилморфолін, піридин і т.п., може використовуватись для зв‟язування кислоти, що вивільняється в ході реакції. У деяких випадках підходить додавання солі йодистоводневої кислоти, бажано йодида лужного металла. Злегка підвищені температури і перемішування можуть збільшувати швидкість реакції. Альтернативно, вищезгадане N-алкілування може бути проведене шляхом застосування відомих у даній галузі умов реакцій міжфазного каталіза. Сполуки формули (I) також можуть бути отримані шляхом N-алкілування сполуки формули 1‟ 1 (I-а) проміжною сполукою формули (IV), де R визначений так само, як радикал R , відмінний від водню. У формулі (IV) і надалі в цьому документі група W є відповідною групою, що відходить, такою як, наприклад, галоген, наприклад, хлор, бром і т.п.; або сульфонілоксигрупою, такою як, наприклад, метансульфонілоксигрупа, 4-метилбензолсульфонілоксигрупа і тому подібне Згадана реакція N-алкілування може бути легко проведена так, як описано вище. 1 Сполуки формули (I-а), що визначаються як сполуки формули (I), де R є воднем, можуть бути отримані шляхом гідрогенізації сполук формули (I-b), що визначаються як сполуки 2 UA 101149 C2 1 формули (I), де R є фенілметилом, у присутності прийнятного каталізатора, такого як палладійна-вугіллі. 5 10 15 20 25 30 35 40 45 50 Проміжні сполуки формули (III) є відомими, такими як 2-хлор-3-етил-3Н-імідазо[4,5-b]піридин (Bollettino Chimico Farmaceutico (1970), 109, (11), 665-73), або є отриманими так, як викладено в Прикладах А.1, А.2, А.3, А.4, А.5 і А.6. Сполуки формули (I), що отримані вищеописаними способами, можуть бути синтезовані у формі рацемічних сумішей енантіомерів, які можуть бути відділені один від одного з використанням відомих у даній галузі методик розділення. Такі сполуки формули (I), що отримані в рацемічній формі, можуть бути перетворені у відповідні діастереомерні сольові форми через реакцію з прийнятною хіральною кислотою. Вищезгадані діастереомерні сольові форми надалі розділяють, наприклад, селективною або фракційною кристалізацією, і енантіомери виділяють за допомогою луги. Альтернативний спосіб розділення енантіомерних форм сполук формули (I) включає рідинну хроматографію з використанням хіральної стаціонарної фази (носія). Вищезгадані чисті стереохімічно ізомерні форми також можуть бути отримані з відповідних чистих стереохімічно ізомерних форм відповідних вихідних речовин, за умови, що реакція протікає стереоспецифічно. Переважно, якщо бажаний специфічний стереоізомер, згадана сполука буде синтезована за допомогою стереоспецифічних спосібов отримання. У таких способах будуть переважно застосовуватись енантіомерно чисті вихідні речовини. З точки зору здатності сполук за даним винаходом викликати релаксаційний ефект у фундальній частині органу, яка продемонстрована у Фармакологічному Прикладі С.1, що відносяться до сполук за винаходом, є корисними для лікування станів, пов'язаних з утрудненою або порушеною релаксацією фундальної частини органу, таких як, наприклад, гастроезофагеальний рефлюкс, печія (у тому числі епізодична печія, нічна печія і печія, що викликається прийомом їжі), диспепсія, відчуття швидкого насичення, здуття живота/метеоризм і анорексія. Диспепсія може бути викликана сповільненою евакуацією шлункового вмісту зі шлунку в дванадцятипалу кишку, порушеною релаксацією фундальної частини органу при вживанні їжі або гіперчутливістю до релаксації шлунку. Диспептичними симптомами є, наприклад, відсутність апетиту, відчуття переповнювання, відчуття швидкого насичення, нудота, блювота, здуття живота/метеоризм і відрижка повітрям. Теплокровні тварини, у тому числі люди (як правило, названі в цьому документі пацієнти), страждаючі від диспептичних симптомів у результаті сповільненої евакуації шлункового вмісту зі шлунку в дванадцятипалу кишку, зазвичай мають нормальну релаксацію фундальної частини органу і можуть бути позбавлені від їх диспептических симптомів шляхом введення лікарського препарату, що нормалізує перистальтику кишечника, такого як, наприклад, цисаприд. Пацієнти можуть мати диспептичні симптоми, не маючи порушену евакуацію шлункового вмісту зі шлунку в дванадцятипалу кишку. Їх диспептичні симптоми можуть бути результатом гіперзморщеної/гіперскороченої фундальної частини органу, що призводить до зниженої розтяжності і до порушень адаптивної релаксації фундальної частини органу. Також диспептичні симптоми можуть виникати внаслідок гіперчутливості фундальної частини органу до релаксації. Гіперзморщена/гіперскорочена фундальна частина органу призводить до зниженої розтяжності шлунку. «Розтяжність шлунку» може бути виражена як відношення об'єму шлунку до тиску, що надається стінкою шлунку. Розтяжність шлунку має взаємозв'язок з тонусом шлунку, який є результатом тонічного скорочення м'язових волокон проксимальної частини шлунку. Ця проксимальна частина шлунку за допомогою прояву регульованого тонічного скорочення (тонус шлунку) виконує резервуарну функцію шлунку. Пацієнти, які страждають від відчуття швидкого насичення, не можуть довести до завершення нормальний прийом їжі, оскільки вони відчувають насичення перш, ніж вони здатні довести до завершення згаданий нормальний прийом їжі. Зазвичай на початку прийому їжі 3 UA 101149 C2 5 10 15 20 25 30 35 40 45 50 55 60 об'єктом шлунок проявлятиме адаптивну релаксацію, тобто шлунок буде релаксувати для прийому їжі, що проковтується. Така адаптивна релаксація є неможливою у тому випадку, коли розтяжність шлунку утруднена, що призводить до порушеної релаксації фундальної частини органу. Звідси випливає, що, з точки зору корисності сполук формули (I), даний винахід також забезпечує спосіб лікування теплокровних тварин, у тому числі людей (як правило, названі у цьому документі пацієнтами), які страждають на порушену релаксацію фундальної частини шлунку при прийомі їжі. Отже, забезпечують спосіб лікування, що дозволяє надавати допомогу пацієнтам, які страждають на стани, такі як, наприклад, гастроезофагеальний рефлюкс, печія (у тому числі епізодична печія, нічна печія і печія, що викликана прийомом їжі), диспепсія, відчуття швидкого насичення, здуття живота/метеоризм і анорексія. Отже, забезпечують застосування сполук формули (I) як лікарський препарат, і, особливо, застосування сполуки формули (I) для виробництва лікарського препарату для лікування станів, що відносяться до порушеної релаксації фундальної частини органу при прийомі їжі, таких як, наприклад, гастроезофагеальний рефлюкс, печія (у тому числі епізодична печія, нічна печія і печія, що викликається прийомом їжі), диспепсія, відчуття швидкого насичення, здуття живота/метеоризм і анорексія. Передбачається як профілактичне, так і терапевтичне лікування. Симптоми порушеної релаксації фундальної частини шлунку також можуть виникати внаслідок прийому хімічних речовин, наприклад, селективних інгібіторів зворотнього захвату серотоніна (SSRI), таких як флуоксетин, пароксетин, флувоксамін, циталопрам, сертралін; або еритроміцину і еритроміцин-подібних, таких, що володіють антибіотичною дією макролідів, таких як, наприклад, ЕМ-523, ЕМ-574, АВТ-229, GM-611 (8R)-4‟‟-дезокси-6,9-епоксиеритроміцин А, (8S)-4‟‟-дезокси-6,9-епоксиеритроміцин А, А-81648, А-173508, А-182061, і КС-11458. Іншим функціональним гастроінтестинальним розладом є синдром роздатованої кишки (IBS), відповідно до чого вважають, що одна з його ознак пов'язана з гіперчутливістю кишки до розтягування. Виходячи з цього, отже, вважають, що модуляція згаданої гіперчутливості за допомогою сполук за даним винаходом, що володіють релаксаційними властивостями відносно фундальної частини органу, може привести до зниження прояву симптомів в об'єктів, які страждають на IBS. Відповідно, забезпечують застосування сполуки формули (I) для виробництва лікарського препарату для лікування IBS (синдром роздатованої кишки). Крім того, сполуки формули (I) також можуть зменшити біль, супутній до гастроінтестинальної гіперчутливості. Для приготування фармацевтичних композицій за даним винаходом ефективну кількість конкретної сполуки, в формі основи або в формі приєднання кислоти, у якості активного інгредієнта комбінують при ретельному змішуванні з фармацевтично прийнятним носієм, де носій може приймати різноманітні форми залежно від отриманої при приготуванні форми, бажаної для введення. Ці фармацевтичні композиції бажано знаходяться у стандартній лікарській формі, прийнятній переважно для перорального введення, ректального введення або введення за допомогою парентеральної ін‟єкції. Наприклад, при отриманні композиції в лікарській формі для перорального введення можуть бути застосовані будь-які звичайні фармацевтичні середовища, такі как, наприклад, вода, гліколі, масла, спирти і т.п., у випадку рідких препаратів для перорального введення, таких як суспензії, сиропи, еліксири і розчини; або тверді носії, такі як крохмалі, сахара, каолін, ковзкі речовини, зв'язуючі речовини, розрихлюючі речовини і т.п., у випадку порошків, пілюль, капсул і таблеток. Унаслідок простоти введення таблетки і капсули являють собою найбільш переважну стандартну лікарську форму для однократного прийому при пероральному введенні, у цьому випадку, як зрозуміло, застосовуються тверді фармацевтичні носії. Для парентеральних композицій зазвичай носій буде містити стерильну воду, щонайменше, більшою частиною, хоча інші інгредієнти, наприклад, для покращення розчинності, можуть бути включені. Наприклад, можуть бути приготовані розчини для ін'єкцій, у яких носій містить фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину і розчину глюкози. Також можуть бути приготовані суспензії для ін‟єкцій, у випадку яких можуть бути застосовані відповідні рідкі носії, суспендуючі речовини і т.п. У композиціях, прийнятних для трансдермального введення, носій необов‟язково містить речовину, що сприяє проникненню всередину, та/або прийнятну змочуючу речовину, необов‟язково зкомбіновані(е) з прийнятними добавками будь-якої природи в менших пропорціях, де добавки не спричиняють суттєвої шкідливої дії на шкіру. Згадані добавки можуть полегшувати нанесення на шкіру та/або можуть бути корисними в приготуванні бажаних композицій. Такі композиції можуть бути введені різними шляхами, наприклад, у вигляді трансдермального пластиру, у вигляді точечного місцевого введення, у вигляді мазі. Солі приєднення кислот сполуки формули (I) внаслідок їх підвищеної розчинності у воді в порівнянні 4 UA 101149 C2 5 10 15 20 25 30 35 40 45 50 55 з відповідною формою основи очевидно є більш прийнятними в приготуванні водних композицій. Для простоти введення і для рівномірності дозування особливо переважним є складання вищезгаданих фармацевтичних композицій у стандартній лікарській формі для однократного прийому. Стандартна лікарська форма для однократного прийому, що використовується в описі винаходу і в пунктах формули у цьому документі, відноситься до фізично дискретних одиниць, що підходять у якості одиничних дозувань, де кожна одиниця містить задану кількість активного інгредієнта, розраховану для отримання бажаного терапевтичного ефекта, у сполученні з вимагаємим фармацевтичним носієм. Прикладами таких стандартних лікарських форм для однократного прийому є таблетки (включаючи таблетки з рискою або в оболонці), капсули, пілюлі, пакети з порошком, облатки, розчини або суспензії для ін‟єкцій, чайні ложки с фармацевтичною композицією, столові ложки з фармацевтичною композицією і т.п., і їх відокремлені лікарські форми для багаторазового прийому. Для перорального введення фармацевтичні композиції можуть приймати форми твердих лікарських форм, наприклад, таблеток (як тільки проковтувані, так і жувальні форми), капсул або гель-капсул, приготованих з використанням звичайного засобу за допомогою фармацевтично прийнятних ексципієнтів, таких як зв'язуючі речовини (наприклад, заздалегідь желатинізований маїсовий крохмаль, полівінілпірролідон або гідроксипропілметилцеллюлоза); наповнювачів (наприклад, лактоза, мікрокристалічна целюлоза або фосфат кальцію); ковзких речовин (наприклад, стеарат магнію, тальк або діоксид кремнію); розрихлюючих речовин (наприклад, картопляний крохмаль або крахмалгліколят натрію); або змочуючих/зволожуючих речовин (наприклад, лаурилсульфат натрію). Таблетки можуть бути вкриті оболонкою загальновідомими в даній галузі способами. Рідкі препарати для перорального введення можуть набувати форми, наприклад, розчинів, сиропів або суспензій, або вони можуть бути представлені у вигляді сухого продукту для розведення водою або іншим прийнятним середовищем перед застосуванням. Такі рідкі препарати можуть бути приготовані з використанням звичайного засобу, необов'язково за допомогою фармацевтично прийнятних добавок, таких як суспендуючі речовини (наприклад, сорбітовий сироп, метилцелюлоза, гідроксипропілметилцеллюлоза або гідрогенізовані харчові жири); емульгуючі речовини (наприклад, лецитин або камедь акації); неводні середовища (наприклад, мигдалеве масло, складні ефіри жирних кислот або етиловий спирт); і консерванти (наприклад, метил або пропіл-п-гідроксибензоати або сорбінова кислота). Фармацевтично прийнятні підсолоджуючі речовини включають переважно, щонайменше, одну підсолоджуючу речовину з інтенсивним смаком, таку як сахарин, сахарин натрію або кальцію, аспартам, ацесульфам калію, цикламат натрію, алітам, підсолоджуючу речовину на основі дигідрохалькону, монелін, стевіозид або сукралоза (4,1‟,6‟-трихлор-4,1‟,6‟тридезоксигалактосахароза), бажано сахарин, сахарин натрію або кальцію, і необов'язкова сипка підсолоджуючи речовина, така як сорбіт, манніт, фруктоза, сахароза, мальтоза, ізомальт, глюкоза, гідрогенізований глюкозний сироп, ксиліт, карамель або мед. Підсолоджуючі речовини з інтенсивним смаком є зручними у застосуванні при низьких концентраціях. Наприклад, у випадку сахарину натрію концентрація може змінюватись у діапазоні від 0,04% до 0,1% (маса/об'єм), виходячи із загального об'єму кінцевого складу, і бажано складає приблизно 0,06% в складах з низьким дозуванням і приблизно 0,08% в складах з високим дозуванням. Сипка підсолоджуюча речовина може бути ефективно використана у великих кількостях, що коливаються в діапазоні від приблизно 10% до приблизно 35%, бажано від приблизно 10% до 15% (маса/об'єм). Фармацевтично прийнятними смаковими ароматизуючими речовинами, які можуть маскувати гіркий присмак інгредієнтів у складах із заниженим дозуванням, є фруктові смакові ароматизуючі речовини, такі як вишнева, малинова, чорносмородинова або полунична ароматизуюча речовина. Комбінація двох смакових ароматизуючих речовин може давати дуже добрі результати. У складах з високим дозуванням можуть вимагатись сильніші смакові ароматизуючі речовини, такі як карамелево-шоколадна ароматизуюча речовина (Caramel Chocolate), м'ятна охолоджуюча ароматизуюча речовина (Mint Cool), фантазійна ароматизуюча речовина (Fantasy) і тому подібні фармацевтично прийнятні сильні смакові ароматизуючі речовини. Кожна ароматизуюча речовина може бути присутньою в кінцевій композиції в концентрації, що коливається в діапазоні від 0,05% до 1% (маса/об'єм). Переважно використовують комбінації згаданих сильних смакових ароматизуючих речовин. Бажано використовують смакову ароматизуючу речовину, яка не зазнає жодної зміни присмаку і кольору або не зазнає жодної втрати присмаку і кольору в кислотних умовах складу. 5 UA 101149 C2 5 10 15 20 25 30 35 40 45 Сполуки за винаходом можуть бути складені для парентерального введення за допомогою ін'єкції, зручно за допомогою внутрішньовенної, внутрішньом'язової або підшкірної ін'єкції, наприклад, за допомогою болюсной ін'єкції або безперервного внутрішньовенного вливання. Склади для ін'єкції можуть бути представлені в стандартній лікарській формі, наприклад, в ампулах або в упаковках для багатократного прийому, з доданим консервантом. Композиції можуть приймати такі форми, як суспензії, розчини або емульсії в масляних або водних середовищах, і можуть містити речовини, сприяючі складанню композицій, такі як ізотонізуючі, суспендуючі, стабілізуючі та/або диспергуючі речовини. Альтернативно, активний інгредієнт може знаходитися в порошковій формі для розведення відповідним середовищем, наприклад, стерильною апірогенною водою перед застосуванням. Сполуки за винаходом також можуть бути складені в ректальні композиції, такі як супозиторії або утримуючі клізми, наприклад, такі що містять звичайні основи для супозиторіїв, такі як кокосову олію або інші гліцериди. Фахівці в лікуванні станів, пов'язаних з утрудненою або порушеною релаксацією фундальної частини органу, можуть легко визначити ефективну добову кількість сполуки з результатів випробувань, представлених надалі в цьому документі. Як правило, передбачається, що терапевтично ефективна доза складатиме від 0,001 мг/кг до 5 мг/кг маси тіла, переважніше від 0,01 мг/кг до 0,5 мг/кг маси тіла. Може бути прийнятним введення терапевтично ефективної дози у вигляді двох, трьох, чотирьох або більше субдоз через відповідні інтервали протягом дня. Згадані субдози можуть бути складені у вигляді стандартних лікарських форм, наприклад, що містять 0,1 мг - 350 мг, і особливо 1-200 мг активного інгредієнта на стандартну лікарську форму. Точне дозування і частота введення залежить від конкретної сполуки формули (I), що використовується, від конкретного стану, що підлягає лікуванню, від серйозності стану, що підлягає лікуванню, від віку, ваги і від загального фізичного стану конкретного пацієнта, а також від інших лікарських препаратів, які пацієнт може приймати, що добре відоме фахівцям у даній галузі. Крім того, вочевидь, що вищезазначена ефективна добова кількість може бути знижена або збільшена залежно від реакції пацієнта, якого лікують, та/або залежно від висновку лікаря, що лікує і прописує сполуки за даним винаходом. Отже, діапазони ефективної добової кількості, вказані вище в цьому документі, є лише загальними рекомендаціями. Залежно від способу введення фармацевтична композиція бажано міститиме від 0,05 до 99% по масі, більш бажано від 0,1 до 70% по масі, ще більш бажано від 0,1 до 50% по масі активного(их) інгредієнта(ів), і, від 1 до 99,95% по масі, більш бажано від 30 до 99,9% по масі, ще більш бажано від 50 до 99,9% по масі фармацевтично прийнятного носія, де всі процентні вмісти розраховані, виходячи з усієї композиції. Експериментальна частина У методиках, описаних надалі в цьому документі, використовують наступні скорочення: „DCM‟ позначає дихлорметан; „DMF‟ означає N,N-диметилформамід; „DIPE‟ позначає діізопропіловий ефір. Для деяких хімічних сполук використовують хімічну формулу, наприклад, CH2Cl2 позначає дихлорметан; NH4OH означає гідроксид амонія, СН3ОН означає метанол, К2СО3 означає карбонат калія; і MgSO4 означає сульфат магнію. А. Синтез проміжних сполук Приклад А.1 а) Отримання проміжної сполуки (1) 50 3-гексанон (1,627 моль) и етилформіат (1,79 моль) додавали повільно при 5°С до розчину метанолята натрію (30%) (1,79 моль) у діетиловому ефірі (1500 мл). Суміш перемішували при кімнатній температурі протягом 18 годин (в результаті випадає осад). Розчинник випарювали досуха. Продукт використовують без додаткової очистки, з виходом 260 г проміжної сполуки (1). b) Отримання проміжної сполуки (2) 55 Суміш проміжної сполуки (1) (1,732 моль), 2-цианоацетаміда (0,868 моль) і піперидинійацетата (0,65 моль) у воді (1500 мл) перемішували та кип‟ятили зі зворотним холодильником протягом 8 годин. Додавали оцтову кислоту (200 мл). Осад відфільтровували, промивали водою і сушили, що давало вихід 85 г (27%) продукта. Частину (3 г) кристалізували з 6 UA 101149 C2 2-пропанона і діізопропілового ефіра. Осад відфільтровували и сушили, що дає вихід 1,5 г проміжної сполуки (2) (температура плавлення 220°С). с) Отримання проміжної сполуки (3) 5 10 15 20 25 30 35 Суміш проміжної сполуки (2) у соляній кислоті (1000 мл) перемішували і кип'ятили із зворотним холодильником протягом 6 днів, потім виливали на лід, підлужували за допомогою NH4OH і екстрагували дихлорметаном. Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випаровували, що давало 31 г залишку. Частину (1 г) кристалізували з суміші 2пропанона і діізопропілового ефіру. Осад фільтрували і сушили, що давало 0,3 г проміжної сполуки (3) (температура плавлення 101°С). d) Отримання проміжної сполуки (4) До розчину проміжної сполуки (3) (0,185 моль) у сірчаній кислоті (280 мл) повільно додавали азотну кислоту (0,37 моль) при 5°С. Суміш перемішували при 5°С протягом 1 години, потім виливали на лід і екстрагували дихлорметаном. Органічний шар відділяли, сушили (MgSO4), фільтрували і розчинник випарювали, що давало 25,6 г залишку. Частину (1 г) кристалізували з ацетонітрила і діізопропілового ефіру. Осад фільтрували і сушили, що давало 0,5 г проміжної сполуки (4) (температура плавлення 218°С). е) Отримання проміжної сполуки (5) До розчину проміжної сполуки (4) і N,N,N-триетилбензолметанамонійхлорида (0,06 моль) в ацетонітрилі (400 мл) повільно додавали трихлористий фосфор (0,595 моль) при кімнатній температурі. Суміш перемішували при 80°С протягом 8 годин. Розчинник випарювали. Залишок виливали на лід. Суміш підлужували за допомогою NH 4OH і екстрагували дихлорметаном. Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали. Продукт використовували без додаткової очистки, с виходом 26 г проміжної сполуки (5). f) Отримання проміжної сполуки (6) Суміш проміжної сполуки (5) (0,093 моль) в розчині амінометану у воді (40%) (100 мл) перемішували при кімнатній температурі протягом ночі і виливали в крижану воду. Осад фільтрували, промивали водою і сушили, що давало 17 г (87%) проміжної сполуки (6) (температура плавлення 97°С). g) Отримання проміжної сполуки (7) Суміш проміжної сполуки (6) (0,0812 моль) і нікелевий каталізатор Ренея (20 г) в метанолі (200 мл) перемішували при кімнатній температурі протягом 2 годин під тиском водню 3 бар 5 (3•10 Па), потім фільтрували через целіт. Целіт промивали водою. Фільтрат упарювали досуха, що давало 14,5 г проміжної сполуки (7). h) Отримання проміжної сполуки (8) 7 UA 101149 C2 5 10 15 20 25 30 35 40 Суміш проміжної сполуки (7) (0,082 моль) і сечовини (0,089 моль) в ксилолі (150 мл) перемішували і кип‟ятили зі зворотним холодильником протягом ночи, потім охолоджували до кімнатної температури. Осад фільтрували, промивали водою і сушили. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH/NH4OH; 97/3/0,5; 15-355 мкм). Чисті фракції збирали і розчинник випарювали. Залишок кристалізували з ацетонітрила/діізопропілового ефіра. Осад відфільтровували і сушили, що давало 0,9 г (5,5%) проміжної сполуки (8) (температура плавлення 230°С). i) Отримання проміжної сполуки (9) До суміші проміжної сполуки (8) (0,053 моль) в трихлористому фосфорі (100 мл) дуже повільно додавали соляну кислоту (2N) (2 мл) при 100°С. Суміш перемішували при 120°С протягом ночі, потім охолоджували і розчинник випарювали. Залишок змивали водним розчином K2CO3 (10%) і екстрагували за допомогою CH2Cl2/CH3OH (95/5). Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали досуха, що давало 8,5 г (72%) проміжної сполуки (9). Приклад А.2 а) Отримання проміжної сполуки (10) 2-метил-3-пентанон (0,998 моль) і етилформіат (1,098 моль) додавали повільно при 5°С до розчину метанолята натрію (30%) (1,098 моль) у діетиловому ефірі (1000 мл). Суміш перемішували при кімнатній температурі протягом 8 годин. Розчинник випарювали. Продукт використовували без додаткового очищення із отриманням проміжної сполуки (10). b) Отримання проміжної сполуки (11) Проміжну сполуку (10) (0,998 моль) і 2-цианоацетамід (0,998 моль) додавали до розчину піперидинійацетата (0,749 моль) у воді (1000 мл). Суміш перемішували і кип‟ятили зі зворотним холодильником протягом 8 годин. Додавали оцтову кислоту (150 мл). Осад відфільтровували, промивали водою і сушили, що давало вихід 44 г продукта у якості фракції (1). Частину згаданої фракції (1) (2 г) кристалізували з діетилового ефіра. Осад відфільтровували і сушили, що давало вихід 1,3 г проміжної сполуки (11) (температура плавлення 241°С). с) Отримання проміжної сполуки (12) Суміш проміжної сполуки (11) (0,238 моль) у соляній кислоті (6N) (400 мл) перемішували і кип'ятили із зворотним холодильником протягом 6 днів, потім виливали на лід і підлужували за допомогою NH4OH. Осад фільтрували, промивали водою і сушили із отриманням фракції (1). Фільтрат екстрагували за допомогою суміші CH2Cl2/CH3OH 90/10. Органічний шар відділяли, сушили (MgSO4), фільтрували і розчинник випарювали. Залишок об'єднують з фракцією (1) із отриманням 33 г продукту. Частину цього продукту (3 г) кристалізували з діетилового ефіру. Осад фільтрували і сушили, що давало 2,6 г проміжної сполуки (12) (температура плавлення 197°С). d) Отримання проміжної сполуки (13) 8 UA 101149 C2 5 10 15 20 25 30 35 До розчину проміжної сполуки (12) (0,198 моль) у сірчаній кислоті (300 мл) повільно додавали азотну кислоту (0,391 моль) при 5°С, при цьому температуру підтримували нижче 15°С. Суміш перемішували при 5°С протягом 1 години і виливали на лід. Осад відфільтровували, промивали водою і сушили із отриманням фракції (1). Фільтрат екстрагували дихлорметаном. Органічний шар відділяли, сушили (MgSO4), фільтрували і розчинник випарювали. Залишок об'єднували з фракцією (1), що давало 35 г проміжної сполуки (13). е) Отримання проміжної сполуки (14) До розчину проміжної сполуки (13) (0,168 моль) і N,N,N-триетилбензолметанамонійхлорида (0,084 моль) в ацетонітрилі (350 мл) повільно додавали трихлористий фосфор (0,505 моль) при кімнатній температурі. Суміш перемішували при 80°С протягом 8 годин. Розчинник випарювали досуха. Залишок змивали на лід. Суміш підлужували за допомогою NH 4OH і екстрагували дихлорметаном. Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали, із отриманням 37 г проміжної сполуки (14). f) Отримання проміжної сполуки (15) До розчину проміжної сполуки (14) (0,172 моль) в метанолі (350 мл) повільно додавали метанолят натрію (30%) (0,517 моль) при кімнатній температурі. Суміш перемішували при кімнатній температурі протягом 8 годин, виливали на лід і екстрагували дихлорметаном. Органічний шар відділяли, сушили (MgSO4), фільтрували, і розчинник випарювали, що давало 32 г проміжної сполуки (15). g) Отримання проміжної сполуки (16) Суміш проміжної сполуки (15) (0,055 моль) в амінометані (200 мл) перемішували при 100°С протягом 48 годин, потім охолоджували. Додавали лід. Осад фільтрували, промивали водою і сушили, що давало 11,45 г проміжної сполуки (16). Цей продукт використовували безпосередньо на наступній реакційній стадії. h) Отримання проміжної сполуки (17) Суміш проміжної сполуки (16) (0,055 моль) і нікелевого каталізатора Ренея (15 г) в метанолі (150 мл) перемішували при кімнатній температурі протягом 1 години під тиском водню 3 бар 5 (3•10 Па), потім фільтрували через целіт. Целіт промивали водою. Фільтрат упарювали досуха із отриманням 10 г проміжної сполуки (17). i) Отримання проміжної сполуки (18) 9 UA 101149 C2 5 10 15 20 25 30 35 Суміш проміжної сполуки (17) (0,055 моль) і сечовини (0,066 моль) у ксилолі (100 мл) перемішували і кип‟ятили зі зворотним холодильником протягом ночі, потім охолоджували. Осад фільтрували, промивали диізопропіловим ефіром і сушили, що давало вихід 7,5 г проміжної сполуки (18). j) Отримання проміжної сполуки (19) Суміш проміжної сполуки (18) (0,0365 моль) у трихлористому фосфорі (75 мл) перемішували при 100°С. Дуже обережно додавали по краплинах соляну кислоту (12N) (0,75 мл). Суміш перемішували при 120°С протягом ночі. Розчинник випарювали досуха. Залишок змивали на лід, насичували розчином K2CO3, і екстрагували за допомогою суміші CH2Cl2/CH3OH (95/5). Органічний шар відділяли, сушили (MgSO4), фільтрували, і розчинник випарювали досуха, що давало вихід 9 г проміжної сполуки (19). Приклад А.3 а) Отримання проміжної сполуки (20) Суміш 2-хлор-4-метокси-3-нітропіридину (0,0509 моль) в розчині амінометану у воді (40%) (100 мл) перемішували при 60°С протягом 2 годин, потім виливали в крижану воду. Осад фільтрували, промивали водою і сушили, з отриманням 9,1 г проміжної сполуки (20) (температура плавлення 156°С). b) Отримання проміжної сполуки (21) Суміш проміжної сполуки (20) (0,0764 моль) і нікелевого каталізатора Ренея (15 г) в метанолі (150 мл) перемішували протягом 2 годин під тиском водню 3 бар (3•105 Па). Осад фільтрували через целіт. Фільтрат упарювали досуха, з отриманням 10,8 г проміжної сполуки (21). с) Отримання проміжної сполуки (22) Суміш проміжної сполуки (21) (0,07 моль) і сечовини (0,084 моль) у ксилолі (100 мл) перемішували при 160°С протягом ночі, потім охолоджували до кімнатної температури. Осад фільтрували, промивали диізопропіловим ефіром і сушили. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH 97/7; 15-35 мкм). Збирали три фракції и розчинник випарювали. Фракцію (1) (0,6 г) кристалізували з ацетонітрила/діізопропілового ефіра. Осад відфільтровували і сушили, що давало вихід 0,47 г проміжної сполуки (22) (температура плавлення >260°С). d) Отримання проміжної сполуки (23) Проміжну сполуку (22) (0,028 моль) у трихлористому фосфорі (100 мл) перемішували при 100°С. Повільно по краплинах додавали соляну кислоту (12N) (2 мл). Суміш перемішували і кип‟ятили зі зворотним холодильником протягом ночі. Розчинник випарювали досуха. Залишок 10 UA 101149 C2 5 змивали на лід, підлужували 10%-ным розчином K2CO3 (10%) і екстрагували за допомогою суміші CH2Cl2/CH3OH. Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали досуха, що давало вихід 9,9 г проміжної сполуки (23). Приклад А.4 а) Отримання проміжної сполуки (24) 10 Суміш 2-хлор-5-етил-6-метил-3-нітропіридина (0,0747 моль) в амінометані (0,249 моль) перемішували при 80°С протягом ночі і виливали в крижану воду. Осад фільтрували, промивали водою і сушили із отриманням 15,2 г проміжної сполуки (24) (температура плавлення 124°С). b) Отримання проміжної сполуки (25) 15 20 25 30 35 40 45 Суміш проміжної сполуки (24) (0,046 моль) і нікелевого каталізатора Ренея (10 г) в метанолі (100 мл) гідрогенізували при кімнатній температурі протягом 2 годин під тиском водню 3 бар 5 (3•10 Па). Нікелевий каталізатор Ренея видаляли фільтрацією через целіт. Фільтрат упарювали досуха, з отриманням 7,7 г проміжної сполуки (25). с) Отримання проміжної сполуки (26) Суміш проміжної сполуки (25) (0,046 моль) і сечовини (0,0552 моль) в ксилолі (80 мл) перемішували і кип‟ятили зі зворотним холодильником протягом ночі і охолоджували до кімнатної температури. Осад фільтрували, промивали диізопропіловим ефіром і сушили. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH; 96/4; 1535 мкм). Збиралидві фракції і розчинник випарювали. Залишок кристалізували з ацетонітрила/діізопропілового ефіра. Осад відфільтровували і сушили, що давало вихід 5,8 г продукта. Продукт кристалізували з ацетонітрила/діізопропілового ефіра. Осад відфільтровували і сушили, з отриманням 0,85 г проміжної сполуки (26) (температура плавлення 121°С). d) Отримання проміжної сполуки (27) Суміш проміжної сполуки (26) (0,027 моль) в трихлористому фосфорі (40 мл) перемішували при 100°С. Повільно додавали соляну кислоту (12N) (0,8 мл). Суміш перемішували і кип'ятили із зворотним холодильником протягом ночі, охолоджували і упарювали досуха. Залишок змивали в крижану воду, насичували розчином K2CO3 і екстрагували за допомогою суміші CH2Cl2/CH3OH: 95/5. Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали, що давало 3,6 г проміжної сполуки (27). Приклад А.5 а) Отримання проміжної сполуки (28) Суміш 3-аміно-5-хлор-2-метиламінопіридина (0,117 моль) і сечовини (0,129 моль) в ксилолі (150 мл) перемішували и кип‟ятили зі зворотним холодильником протягом ночі. Розчинник випарювали досуха. Залишок змивали в дихлорметан. Органічний шар відділяли, промивали водою, сушили (MgSO4), фільтрували і розчинник випарювали досуха. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH; 98/2; 15-35 мкм). Збирали дві фракції і розчинник випарювали, що давало вихід 0,5 г фракції (1) и 18 г (86%) фракції (2). Фракцию (1) кристалізували з 2-пропанона/ацетонітрила/діізопропілового ефіра. Осад відфільтровували і сушили з отриманням 0,4 г проміжної сполуки (28). 11 UA 101149 C2 b) Отримання проміжної сполуки (29) 5 10 15 20 25 30 35 40 45 Суміш проміжної сполуки (28) (0,098 моль) в трихлористому фосфорі (180 мл) перемішували при 100°С. Дуже обережно по краплях додавали соляну кислоту (12N) (2 мл). Суміш перемішували і кип'ятили із зворотним холодильником протягом ночі. Розчинник випарювали досуха. Залишок виливали на лід, насичували розчином K 2CO3 і екстрагували за допомогою суміші CH2Cl2/CH3OH: 95/5. Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали досуха, що давало 12,5 г проміжної сполуки (29). Приклад А.6 Отримання проміжної сполуки (30) До суміші 1,3-дигідро-3-ізопропіл-2Н-імідазо[4,5-b]піридин-2-она (0,0846 моль) в трихлористому фосфорі (150 мл) дуже обережно додавали по краплях соляну кислоту (1,5 мл) при 100°С. Суміш перемішували при 120°С протягом ночі і розчинник випарювали досуха. Залишок виливали на лід, насичували розчином K2CO3 і екстрагували дихлорметаном. Органічний шар відділяли, сушили (MgSO4), фільтрували і розчинник випарювали досуха, з отриманням 14 г проміжної сполуки (30). B. Отримання кінцевих сполук Приклад B.1 Отримання сполуки (1) Суміш проміжної сполуки (9) (0,038 моль) і 1-(фенілметил)піперазина (0,057 моль) перемішували при 120°С протягом 3 годин, потім змивали дихлорметаном. Осад фільтрували. Фильтрат випарювали досуха. Залишок (17 г) очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH/NH4OH; 95/5/0,1; 15-35 мкм). Збирали чисті фракції і розчинник випарювали, що давало 1,3 г залишку. Залишок кристалізували з 2пропанона/ацетонітрила/діізопропілового ефіра. Осад відфільтровували і сушили, з отриманням 1,25 г сполуки (1) (температура плавлення 127°С). Сполуку (2) отримують аналогічним чином із заміною проміжної сполуки (9) на проміжну сполуку (23). Сполуку (5) отримують аналогічним чином із заміною проміжної сполуки (9) на проміжну сполуку (30). Сполуку (6) отримують аналогічним чином із заміною проміжної сполуки (9) на проміжну сполуку (19). Сполуку (7) отримують аналогічним чином із заміною проміжної сполуки (9) 2-хлор-3-етил3Н-імідазо[4,5-b]піридином. Сполуку (8) отримують аналогічним чином із заміною проміжної сполуки (9) на проміжну сполуку (27). Сполуку (13) отримують аналогічним чином із заміною проміжної сполуки (9) на проміжну сполуку (29). Приклад B.2 Отримання сполуки (11) Суміш 2-хлор-3-метил-3Н-імідазо[4,5-b]піридина (0,0335 моль) і 1-(фенілметил)піперазина (0,0505 моль) перемішували при 120°С протягом 1 години. Додавали суміш водного розчину К2СО3 (10%) і дихлорметана. Суміш перемішували при кімнатній температурі протягом 10 12 UA 101149 C2 5 10 15 20 25 30 35 40 45 50 хвилин. Органічний шар відділяли, промивали дихлорметаном, сушили (MgSO 4), фільтрували і розчинник випарювали. Залишок (35 г) очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH/NH4OH; 96/3/0,1; 15-35 мкм). Збирали чотири фракції і розчинник випарювали. Залишок очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH/NH4OH; 98/2/0,1; 15-40 мкм). Збирали чисті фракції і розчинник випарювали. Залишок (1,5 г) кристалізували з діізопропілового ефіра. Осад відфільтровували і сушили, з отриманням 1 г сполуки (11) (температура плавлення 98°С). Приклад B.3 Отримання сполуки (3) Суміш проміжної сполуки (31) (0,005 моль), 2-(хлорметил) піридингідрохлорида (1:1) (0,006 моль) і N,N-діетилетанаміна (0,0253 моль) в диметилформаміді (60 мл) перемішували при 40°С протягом ночі. Розчинник випарювали досуха. Залишок змивали за допомогою суміші DCM/CH3OH. Осад промивали водним розчином К2СО3 (10%). Органічний шар відділяли, сушили (MgSO4), фільтрували і розчинник випарювали досуха. Залишок (2,3 г) очищали колонковою хроматографією на силікагелі (елюент: СН 2Cl2/CH3OH/NH4OH; 96/4/0,4; 15-40 мкм), із отриманням 1,5 г (96%). Цю фракцію розчиняли в суміші 2-пропанола/HCl (5N) і перетворювали на сіль соляної кислоти. Осад фільтрували і сушили. Залишок кристалізували з етанола/діізопропілового ефіру. Осад фільтрували і сушили, із отриманням 1,7 г сполуки (3) (температура плавлення 182°С). Приклад В.4 Отримання сполуки (9) До суміші сполуки (2) (0,012 моль) і формальдегіда (0,12 моль) в ацетонітрилі (80 мл) в тоці азота додавали по краплинах цианотригідроборат натрію (0,036 моль), потім оцтову кислоту (4 мл). Суміш перемішували при кімнатній температурі протягом ночі. Додавали оцтову кислоту (4 мл). Суміш перемішували при 40°С протягом 12 годин, потім охолоджували до кімнатної температури. Додавали водний розчин К2СО3 (10%). Суміш екстрагували дихлорметаном. Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали досуха. Залишок змивали метанолом (80 мл). Додавали 2-пропанол и 5N-ий розчин HCl (10 мл). Суміш перемішували і кип‟ятили зі зворотним холодильником протягом ночі. Розчинник випарювали досуха. Залишок змивали дихлорметаном і промивали водним розчином К2СО3 (10%). Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали досуха. Залишок (4 г) очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH/NH4OH; 97/3/0,1; 15-40 мкм). Чисті фракції збирали і розчинник випарювали. Залишок (3,1 г) кристалізували з 2-пропанона/ацетонітрила/діізопропілового ефіра. Осад відфільтровували і сушили з отриманням 2,7 г сполуки (9) (температура плавлення 128°С). Приклад В.5 Отримання сполуки (10) Суміш солянокислої соли проміжної сполуки (31) (0,0046 моль), 5-(хлор-метил)-1,3бензодіоксола (0,005 моль) и карбоната калію (0,007 моль) в ацетонітрилі (80 мл) перемішували при 80°С протягом 4 годин і розчинник випарювали. Залишок змивали сумішшю води і дихлорметана. Органічний шар відділяли, сушили (MgSO 4), фільтрували і розчинник випарювали. Залишок (2 г) очищали колонковою хроматографією на силікагелі (елюент: СН2Cl2/CH3OH/NH4OH; 97/3/0,1; 15-40 мкм). Чисті фракції збирали і розчинник випарювали. Залишок (0,95 г) кристалізували з 2-пропанона/діізопропілового ефіра. Осад відфільтровували и сушили, з отриманням 0,51 г сполуки (10) (температура плавлення 114°С). Приклад В.6 Отримання сполуки (14) 13 UA 101149 C2 5 10 Суміш сполуки (11) (0,0153 моль) і палладія-на-активованому вугіллі (1,4 г) у метанолі (70 5 мл) перемішували при 50°С протягом 12 годин під тиском водню 5 бар (5•10 Па), потім охолоджували, фільтрували через целіт, промивали метанолом і концентрували. Залишок (8 г) очищали колонковою хроматографією на силікагелі (елюент: СН 2Cl2/CH3OH/NH4OH; 90/10/1; 1540 мкм). Чисті фракції збирали і розчинник випарювали з отриманням 5 г сполуки (14) (температура плавлення 136°С). Сполуки (15) і (16) отримували з використанням аналогічної методології, виходячи із сполук (7) і (5), відповідно, проте стадію очищення за допомогою колонкової хроматографії замінювали розчиненням залишку в 2-пропанолі, насиченому HCl, з тим, щоб отримати сіль приєднання соляної кислоти згаданих сполук (15) і (16) у вигляді осаду. У таблиці F-1 наведений перелік сполук, які отримують відповідно до одного з вищезазначених Прикладів. Термін «С2Н2О4» означає сіль щавлевої кислоти (оксалат). Таблиця F-1 Спол. № 1; Пр.В.1; Т. пл. 127°С Спол. № 9; Пр.В.4; Т. пл. 128°С Спол. № 2; Пр.В.1; Т. пл. 138°С Спол. № 10; Пр.В.5; Т. пл.114°С Спол. № 3; Пр.В.3; .4HCl.H2O; Т. пл. 185°С Спол. № 11; Пр.В.2; Т. пл. 98°С Спол. № 4; Пр.В.2; Т. пл. 156°С Спол. № 12; Пр.В.2; .HCl Спол. № 5; Пр.В.1; .5/2С2Н2О4; Т. пл. 124°С Спол. № 13; Пр.В.1; Т. пл. 150°С Спол. № 6; Пр.В.1; Т. пл. 131°С Спол. № 14; Пр.В.6; Т. пл. 136°С Спол. № 7; Пр.В.1; .2С2Н2О4; Т. пл. 215°С Спол. № 15; Пр.В.6; .HCl; Т. пл. 162°С Спол. № 8; Пр.В.1; Т. пл. 83°С Спол. № 16; Пр.В.6; .HCl; Т. пл. 162°С 14 UA 101149 C2 5 10 15 20 25 30 35 40 С. Фармакологічні приклади С.1. Тонус шлунку, виміряний за допомогою електронного баростата, у собак, що знаходились у свідомості Тонус шлунку не може бути виміряний манометричними способами. Тому використовували електронний баростат. Він дозволяє дослідити фізіологічну схему і регуляцію тонусу шлунку у собак, що знаходяться у свідомості, і вплив тест-сполук на цей тонус. Баростат складається з системи впускання повітря, яка зв'язана за допомогою двопросвітної інтубаційнної полівінілової трубки калібром 14 за французькою шкалою з ультратонким обвислим поліетиленовим мішком (максимальний об'єм: ±700 мл). Коливання тонусу шлунку вимірювали за допомогою реєстрації змін об'єму повітря у внутрішньошлунковому мішку, що підтримується при постійному тиску. Баростат підтримує постійний тиск (заздалегідь вибраний) в обвислому наповненому повітрям мішку, введеному в шлунок, змінюючи об'єм повітря усередині мішка за допомогою електронної системи із зворотним зв'язком. Таким чином, баростат вимірює моторику шлунку (скорочення або релаксацію) у вигляді змін внутрішньошлункового об‟єму (зменшення або збільшення, відповідно) при постійному внутрішньошлунковому тиску. Баростат складається з тензіометричного датчика, що з‟єднаний за допомогою електронного реле з системою впуску-аспірації повітря. Как тензіометричний датчик, так і система впуску, з‟єднані за допомогою двопросвітної інтубаційної трубки з ультратонким поліетиленовим мішком. Шкала в баростаті дозволяє вибирати рівень тиску, що повинен підтримуватись у внутрішньошлунковому мішку. Самок собак породи бігль, що мають вагу 7-17 кг, навчали стояти спокійно в рамках Павлова. Їм імплантували шлункову канюлю під загальною анестезією і з асептичними запобіжними засобами. Після медіанної лапаротомії розріз робили в стінці шлунку в поздовжньому напрямку між великою і малою кривизною, на 2 см вище нервів Латарже. Канюлю прикріпляли до стінки шлунку за допомогою подвійного кисетного шва і виймали через патрубок раневого каналу в лівому квадраті гіпохондрію. Собакам давали відновлювальний період два тижні. На початку експерименту канюлю відкривали для того, щоб видалити будь-який шлунковий сік або залишки їжі. При необхідності шлунок очищали за допомогою 40-50 мл теплуватої води. Ультратонкий мішок баростата поміщали на дно шлунку за допомогою шлункової канюлі. Для гарантованого забезпечення легкого розгортання внутрішньошлункового мішка під час експерименту в мішок вводять повітря об'ємом 150-200 мл шляхом дуже короткочасного підвищення тиску максимально до 14 мм.рт.ст. (приблизно 1,87 кПа). Цю процедуру повторювали двічі. Після стабілізаційного періоду тривалістю 60 хвилин при внутрішньошлунковому тиску 6 мм.рт.ст. (приблизно 0,81 кПа), вводили тестову сполуку підшкірно, або інтрадуоденально (у порожнину дванадцятипалої кишки), при тиску 2 мм.рт.ст. (0,27 кПа). Тестові сполуки перевіряли з відбором, тобто вимірювали зміни об'єму шлунку, при 0,63 мг/кг (підшкірне введення (s.c.)). Інші дози і шляхи введення випробовують, якщо показано, що тестова сполука є активною під час процедури відбору. Таблиця С-1 об'єднує дані по середній максимальній зміні об'єму (у мл) при релаксації фундальної частини органу, через 1 годину після інтрадуоденального (I.D.) введення тестової сполуки (0,63 мг/кг). Таблиця С-1 Спол.№ Спол.№ 1 Спол.№ 2 Спол.№ 3 Спол.№ 4 Спол.№ 5 Спол.№ 6 Спол.№ 7 Спол.№ 8 Максимальна зміна об'єму (середнє) 237 220 154 112 206 206 167 239 Спол.№ Спол.№ 9 Спол.№ 10 Спол.№ 11 Спол.№ 13 Спол.№ 14 Спол.№ 15 Спол.№ 16 (*): введено при дозі 0,16 мг/кг 45 15 Максимальна зміна об'єму (середнє) 185 251 220 247 154,6(*) 78,3(*) 22,3(*) UA 101149 C2 Сполуку (11) випробовують при різних концентраціях, і результати наводять у Таблиці С-2 нижче і порівнюють зі сполукою (72) міжнародної публікації WO-01/46189. Обидві сполуки вводять інтрадуоденально (I.D.) Таблиця C-2 Сполука 0,63 220 (11) за даним винаходом (72) міжн. публ. WO-01/46189 0,16 180 45 Доза мг/кг 0,04 0,01 146 157 0,0025 83 5 Порівняння структур: (11) за даним винаходом (72) міжнародної публікації WO-01/46189 ФОРМУЛА ВИНАХОДУ 10 1. Сполука формули (І) R R N R 1 N R 20 25 30 35 4 R 3 N N N 15 5 2 , (I) що включає її будь-яку стереохімічно ізомерну форму, де 1 R є воднем, фенілметилом, піридинілметилом або бензо[1,3]діоксолілметилом; 2 R є С1-4алкілом; 3 R є воднем, галогеном або С1-4алкілом; 4 R є воднем, галогеном або С1-4алкілом; і 5 R є воднем, аміногрупою, С1-4алкіламіногрупою або ді(С1-4алкіл)аміногрупою; або її фармацевтично прийнятна сіль приєднання кислоти, або її сольват. 1 2. Сполука за п. 1, де R є воднем. 1 3. Сполука за п. 1 або за п. 2, де R є фенілметилом. 2 4. Сполука за будь-яким з пп. 1-3, де R є метилом. 5. Сполука за п. 1, де сполука є 2-(4-бензилпіперазин-1-іл)-3-метил-3H-імідазо[4,5-b]піридином або його фармацевтично прийнятними солями приєднання кислоти. 6. Фармацевтична композиція, що містить фармацевтично прийнятний носій і терапевтично активну кількість сполуки за будь-яким з пп. 1-5. 7. Спосіб отримання фармацевтичної композиції за п. 6, де терапевтично активну кількістьсполуки за будь-яким з пп. 1-5 змішують до отримання однорідної маси з фармацевтично прийнятним носієм. 8. Сполука за будь-яким з пп. 1-5 як лікарський препарат. 9. Застосування сполуки за будь-яким з пп. 1-5 для виробництва лікарського препарату для лікування гастроезофагеального рефлюксу, печії, диспепсії, відчуття швидкого насичення, здуття живота/метеоризму і анорексії. 10. Спосіб отримання сполуки Формули (І), де проміжну сполуку формули (II) піддають N-алкілуванню з проміжною сполукою формули (III), в реакційно інертному розчиннику 16 UA 101149 C2 R 5 R R N R 1 N N H + W N N R 10 , 1 де в наведеній вище реакційній схемі радикал R є воднем, фенілметилом, піридинілметилом 2 3 4 5 або бензо[1,3]діоксолілметилом, і R , R , R і R є такими ж, як визначені в пункті 1, і W є відповідною відхідною групою; або, якщо бажано, сполуку формули (І) перетворюють на фармацевтично прийнятну сіль приєднання кислоти, або навпаки, сіль приєднання кислоти сполуки формули (І) перетворюють на форму вільної основи за допомогою обробки лугом; і, якщо бажано, отримують її стереохімічно ізомерні форми. 11. Спосіб отримання сполуки Формули (І), де проміжну сполуку формули (V) піддають N-алкілуванню зі сполукою формули (I-а) в реакційно інертному розчиннику W R1' + HN 4 R 3 N N N (IV) 5 R N 20 (I) (III) R 15 3 2 (II) 5 4 R (I) 2 (I-a) , 1' де в наведеній вище реакційній схемі радикал R є фенілметилом, піридинілметилом або 2 3 4 5 бензо[1,3]діоксолілметилом, і R , R , R і R є такими ж, як визначені в пункті 1, і W є відповідною відхідною групою; або, якщо бажано, сполуку формули (І) перетворюють на фармацевтично прийнятну сіль приєднання кислоти, або навпаки, сіль приєднання кислоти сполуки формули (І) перетворюють на форму вільної основи за допомогою обробки лугом; і, якщо бажано, отримують її стереохімічно ізомерні форми. Комп‟ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 17
ДивитисяДодаткова інформація
Назва патенту англійською2-piperazin-1-yl-3h-imidazo[4,5-b]pyridine derivatives
Автори англійськоюJanssens, Frans, Eduard, Guillemont Jerome Emile Georges, Sommen, Francois, Maria, Bonfanti, Jean-Francois
Назва патенту російськоюПроизводные 2-пиперазин-1-ил-3н-имидазо[4,5-b]пиридина
Автори російськоюЯнссенс Франс Эдуард, Жильмон Жером Эмиль Жорж, Соммен Франсуа Мария, Бонфанти Жан-Франсуа
МПК / Мітки
МПК: C07D 471/04, A61K 31/496, A61P 1/14
Мітки: похідні, 2-піперазин-1-іл-3н-імідазо[4,5-b]піридину
Код посилання
<a href="https://ua.patents.su/19-101149-pokhidni-2-piperazin-1-il-3n-imidazo45-bpiridinu.html" target="_blank" rel="follow" title="База патентів України">Похідні 2-піперазин-1-іл-3н-імідазо[4,5-b]піридину</a>
Наступний патент: Збірно-розбірна будівля
Випадковий патент: Спосіб виготовлення лікарського засобу седативної і спазмолітичної дії












