Циклоалкандіонові похідні з нейропротекторною активністю
Номер патенту: 83116
Опубліковано: 10.06.2008
Автори: Фречілья Мансо Діана, Лопес Родрігес Марія Лус, Дель Ріо Самбрана Хоакін, Бенаму Салама Беллінда, Марко Мартінес Ізабель
Формула / Реферат
1. Сполука формули І:
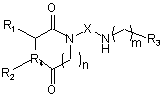 , (I)
, (I)
одна з її стереохімічно ізомерних форм, гідрат, сольват або її фармацевтично прийнятна сіль,
де:
R1 та R2 є Н або є зв'язаними разом метиленовими групами, що утворюють із гетероциклічним кільцем 5- або 6-членне кільце; якщо R4 = S, тоді R1 є Н і R2 відсутній;
R4 вибраний з групи, що складається з N та S;
n є цілим числом від 0 до 1;
Х вибраний з групи, що складається з С2-С10-алкілену, С2-С10-алкенілену та -CH2-Y-CH2-; де Y є фенілом;
m є цілим числом від 1 до 2;
R3 вибраний з групи, що складається з хроман-2-ілу, 2-хінолілу та -O-фенілу, де ароматичне кільце хроманільного залишку, хінолільного або фенільного залишку необов'язково заміщено за допомогою однієї або більшого числа груп, вибраних із С1-С6-алкокси, С1-С6-алкілу, галогену, С2-С6-алкенілу, галоген-(С1-С6)-алкілу, галоген-(С1-С6)-алкокси, фенілу, феніл-(С1-С6)-алкілу, фенокси, С1-С6-алкілкарбонілу, фенілкарбонілу, феніл-(С1-С6)-алкілкарбонілу, C1-C6-алкоксикарбонілу, феніл-(С1-С6)-алкоксикарбонілу, С1-С6-алкілкарбоніламіно, гідрокси, ціано, нітро, аміно, N-(С1-С6)-алкіламіно, N,N-(С1-С6)-діалкіламіно, карбокси, сульфо, сульфамоїлу, сульфоніламіно, (С1-С6)-алкіламіносульфонілу або (С1-С6)-алкілсульфоніламіно; або де фенільне кільце заміщене за допомогою двох сусідніх залишків, які разом з фенільним кільцем, до якого вони приєднані, утворюють тетрагідронафтил; де кожен алкіл необов'язково заміщений за допомогою гідрокси або аміно;
за умови, що сполука не є
2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолом,
3-[4-[(хроман-2-іл)метиламіно]бутил]-2,4-діоксотіазолідином,
3-[5-[(хроман-2-іл)метиламіно]пентил]-2,4-діоксотіазолідином,
3-[6-[(хроман-2-іл)метиламіно]гексил]-2,4-діоксотіазолідином,
2-[4-[2-(феноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолом або
3-[4-[2-(феноксі)етиламіно]бутил]-2,4-діоксотіазолідином та
3-[3-[(хроман-2-іл)метиламіно]пропіл]-2,4-діоксоімідазолідином.
2. Сполука за п. 1, у якій R3 вибраний з групи, що складається з хроман-2-ілу, 2-хінолілу та -O-фенілу, де фенільний залишок необов'язково заміщений за допомогою групи, вибраної з С1-С6-алкокси, С1-С6-алкілу або галогену.
3. Сполука за п. 1 або 2, у якій m має значення 1 і R3 є хроман-2-ілом.
4. Сполука за п. 3, у якій R1 та R2 є зв'язаними разом метиленовими групами, які утворюють із гетероциклічним кільцем 5- або 6-членне кільце; і R4 позначає N.
5. Сполука за будь-яким з пп. 3-4, де Х вибраний з групи, що складається з С2-С10-алкілену, (Е)-2-бутенілену, 3-метилбензилену або 4-метилбензилену.
6. Сполука за п. 3, у якій R1 позначає Н, R2 відсутній і R4 позначає S.
7. Сполука за п. 6, у якій n має значення 0 і Х є С2-С10-алкіленом.
8. Сполука за п. 1 або 2, у якій m = 2 і R3 є -O-фенілом, де фенільний залишок є необов'язково заміщеним за допомогою однієї або більшого числа груп, вибраних з С1-С6-алкокси, С1-С6-алкілу, галогену, С2-С6-алкенілу, галоген-(С1-С6)-алкілу, галоген-(С1-С6)-алкокси, фенілу, феніл-(С1-С6)-алкілу, фенокси, С1-С6-алкілкарбонілу, фенілкарбонілу, феніл-(С1-С6)-алкілкарбонілу, C1-C6-алкоксикарбонілу, феніл-(С1-С6)-алкоксикарбонілу, С1-С6-алкілкарбоніламіно, гідрокси, ціано, нітро, аміно, N-(С1-С6)-алкіламіно, N,N-(С1-С6)-діалкіламіно, карбокси, сульфо, сульфамоїлу, сульфоніламіно, (С1-С6)-алкіламіносульфонілу або (С1-С6)-алкілсульфоніламіно; або де фенільне кільце є заміщеним за допомогою двох сусідніх залишків, які разом з фенільним кільцем, до якого вони приєднані, утворюють тетрагідронафтил.
9. Сполука за п. 8, у якій фенільна група є необов'язково заміщеною за допомогою однієї або більшого числа груп, вибраних з фенілу, С1-С6-алкоксикарбонілу, С1-С6-алкілкарбоніламіно, С1-С6-алкокси, С1-С6-алкілу, галоген-(С1-С6)-алкілу чи галогену, або де фенільна група є заміщеною за допомогою двох сусідніх залишків, які разом з фенільною групою, до якої вони приєднані, утворюють тетрагідронафтил.
10. Сполука за п. 9, у якій фенільний залишок є необов'язково заміщеним за допомогою однієї або більшого числа груп, вибраних з метокси, етокси, пропокси, ізопропокси, етилу, пропілу, ізопропілу, броміду, трифторметилу, метиламіду або етоксикарбонілу.
11. Сполука за будь-яким з пп. 8-10, де фенільна група є заміщеною в орто- та/або мета-положенні.
12. Сполука за будь-яким з пп. 8-11, де R1 та R2 є зв'язаними разом метиленовими групами, які утворюють із гетероциклічним кільцем 5- або 6-членне кільце; і R4 позначає N.
13. Сполука за будь-яким з пп. 8-12, де n має значення 0 і Х є С2-С10-алкіленом.
14. Сполука за будь-яким з пп. 8-11, де R1 є Н і R2 відсутній та R4 позначає S.
15. Сполука за п. 14, яка відрізняється тим, що n має значення 0 і Х є С2-С10-алкіленом.
16. Сполука за пп. 1 або 2, яка відрізняється тим, що m має значення 1 і R3 є 2-хінолілом.
17. Сполука за п. 16, яка відрізняється тим, що R1 та R2 є зв'язаними разом метиленовими групами, які утворюють із гетероциклічним кільцем 5- або 6-членне кільце; і R4 позначає N.
18. Сполука за будь-яким з пп. 16-17, де n має значення 0; і Х є C2-С10-алкіленом.
19. Сполука за п. 1, у якій сполука вибрана з:
(a) 2-[4-[(хроман-2(R)-іл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(b) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3-діоксопергідроімідазо[1,5-а]піридину;
(c) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]піразину;
(d) 2-[5-[(хроман-2-іл)метиламіно]пентил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(e) 2-[6-[(хроман-2-іл)метиламіно]гексил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(f) 2-[3-[(хроман-2-іл)метиламіно]пропіл]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(g) 3-[8-[(хроман-2-іл)метиламіно]октил]-2,4-діоксотіазолідину;
(h) 2-[4-[(хроман-2(S)-іл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(і) 2-[8-[(хроман-2-іл)метиламіно]октил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(j) 2-[3-[[(хроман-2-іл)метиламіно]метил]бензил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(k) 2-[4-[[(хроман-2-іл)метиламіно]метил]бензил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(l) (Е)-2-[4-[(хроман-2-іл)метиламіно]бут-2-еніл]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(m) 2-[4-[2-(о-метоксифеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(n) 2-[4-[2-(м-метоксифеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(о) 2-[4-[2-(о-бромфеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(р) 2-[4-[2-(м-бромфеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]iмідазолу;
(q) 2-[4-[2-(о-етилфеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(r) 2-[4-[2-(м-етилфеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(s) 2-[4-[2-(о-ізопропілфеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(t) 2-[4-[(2-хіноліл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(u) 2-[4-[2-(о-етоксифеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(v) 2-[4-[2-(о-ізопропоксифеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-c]імідазолу;
(w) 2-[4-[2-[м-(трифторметил)феноксі]етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(х) 2-[4-[2-(1,1'-біфеніл-2-ілоксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(у) 2-[4-[2-[о-(ацетиламіно)феноксі]етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(z) 2-[4-[2-[м-(ацетиламіно)феноксі]етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(аа) 2-[4-[2-[о-(етоксикарбоніл)феноксі]етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(bb) 2-[4-[2-(5,6,7,8-тетрагідронафт-1-илоксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(сс) 2-[4-[2-(2,3-диметилфеноксі)етиламіно]бутил]-1,3-діоксопергідропіроло[1,2-с]імідазолу;
(dd) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,4-діоксопергідропіридо[1,2-а]піразину;
(ее) (Z)-2-[4-[(хроман-2-іл)метиламіно]бут-2-еніл]-1,4-діоксопергідропіроло[1,2-с]імідазолу;
(ff) 3-[4-[2-(о-етоксифеноксі)етиламіно]бутил]-2,4-діоксотіазолідину;
(gg) 3-[6-[2-(о-етоксифеноксі)етиламіно]гексил]-2,4-діоксотіазолідину;
(hh) 3-[8-[2-(о-етоксифеноксі)етиламіно]октил]-2,4-діоксотіазолідину;
(іі) 2-[4-[2-(о-етоксифеноксі)етиламіно]бутил]-1,3-діоксопергідроімідазо[1,5-а]піридину;
(jj) 2-[6-[2-(о-етоксифеноксі)етиламіно]гексил]-1,3-діоксопергідроімідазо[1,5-а]піридину;
(kk) 2-[4-[(2-хіноліл)метиламіно]бутил]-1,3-діоксопергідроімідазо[1,5-а]піридину;
(ll)2-[6-[(2-хіноліл)метиламіно]гексил]-1,3-діоксопергідроімідазо[1,5-а]піридину;
фармацевтично прийнятної солі, гідрату, сольвату або однієї з їхніх стереохімічно ізомерних форм.
20. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-19 та фармацевтично прийнятні носії.
21. Застосування сполуки за будь-яким з пп. 1-19, за винятком 3-[3-[(хроман-2-іл)метиламіно]пропіл]-2,4-діоксоімідазолідинону, для одержання лікарського засобу для лікування та/або профілактики хвороби Паркінсона, ураження головного мозку, викликаного тромбофлебічним інсультом або черепно-мозковою травмою, депресії, мігрені, болю, психозу, розладу настрою, агресивних порушень або захворювання сечовидільного тракту.
Текст
1. Сполука формули І: O R1 X N N m R3 H (I) R4 n R2 O , 2 (19) 1 3 83116 4 бутенілену, 3-метилбензилену або 4(d) 2-[5-[(хроман-2-іл)метиламіно]пентил]-1,3метилбензилену. діоксопергідропіроло[1,2-с]імідазолу; 6. Сполука за п. 3, у якій R 1 позначає Н, R2 відсут(e) 2-[6-[(хроман-2-іл)метиламіно]гексил]-1,3ній і R4 позначає S. діоксопергідропіроло[1,2-с]імідазолу; 7. Сполука за п. 6, у якій n має значення 0 і Х є С2(f) 2-[3-[(хроман-2-іл)метиламіно]пропіл]-1,3С10-алкіленом. діоксопергідропіроло[1,2-с]імідазолу; 8. Сполука за п. 1 або 2, у якій m = 2 і R3 є -O(g) 3-[8-[(хроман-2-іл)метиламіно]октил]-2,4фенілом, де фенільний залишок є необов'язково діоксотіазолідину; заміщеним за допомогою однієї або більшого чис(h) 2-[4-[(хроман-2(S)-іл)метиламіно]бутил]-1,3ла груп, вибраних з С1-С6-алкокси, С1-С6-алкілу, діоксопергідропіроло[1,2-с]імідазолу; галогену, С2-С6-алкенілу, галоген-(С1-С6)-алкілу, (і) 2-[8-[(хроман-2-іл)метиламіно]октил]-1,3галоген-(С1-С6)-алкокси, фенілу, феніл-(С1-С6)діоксопергідропіроло[1,2-с]імідазолу; алкілу, фенокси, С1-С6-алкілкарбонілу, фенілкар(j) 2-[3-[[(хроман-2-іл)метиламіно]метил]бензил]бонілу, феніл-(С1-С6)-алкілкарбонілу, C1-C61,3-діоксопергідропіроло[1,2-с]імідазолу; алкоксикарбонілу, феніл-(С1-С6)-алкоксикарбонілу, (k) 2-[4-[[(хроман-2-іл)метиламіно]метил]бензил]С1-С6-алкілкарбоніламіно, гідрокси, ціано, нітро, 1,3-діоксопергідропіроло[1,2-с]імідазолу; аміно, N-(С1-С6)-алкіламіно, N,N-(С1-С6)(l) (Е)-2-[4-[(хроман-2-іл)метиламіно]бут-2-еніл]діалкіламіно, карбокси, сульфо, сульфамоїлу, су1,3-діоксопергідропіроло[1,2-с]імідазолу; льфоніламіно, (С1-С6)-алкіламіносульфонілу або (m) 2-[4-[2-(о-метоксифеноксі)етиламіно]бутил](С1-С6)-алкілсульфоніламіно; або де фенільне кі1,3-діоксопергідропіроло[1,2-с]імідазолу; льце є заміщеним за допомогою двох сусідніх за(n) 2-[4-[2-(м-метоксифеноксі)етиламіно]бутил]-1,3лишків, які разом з фенільним кільцем, до якого діоксопергідропіроло[1,2-с]імідазолу; вони приєднані, утворюють тетрагідронафтил. (о) 2-[4-[2-(о-бромфеноксі)етиламіно]бутил]-1,39. Сполука за п. 8, у якій фенільна група є неободіоксопергідропіроло[1,2-с]імідазолу; в'язково заміщеною за допомогою однієї або біль(р) 2-[4-[2-(м-бромфеноксі)етиламіно]бутил]-1,3шого числа груп, вибраних з фенілу, С1-С6діоксопергідропіроло[1,2-с]iмідазолу; алкоксикарбонілу, С1-С6-алкілкарбоніламіно, С1(q) 2-[4-[2-(о-етилфеноксі)етиламіно]бутил]-1,3С6-алкокси, С1-С6-алкілу, галоген-(С1-С6)-алкілу чи діоксопергідропіроло[1,2-с]імідазолу; галогену, або де фенільна група є заміщеною за (r) 2-[4-[2-(м-етилфеноксі)етиламіно]бутил]-1,3допомогою двох сусідніх залишків, які разом з федіоксопергідропіроло[1,2-с]імідазолу; нільною групою, до якої вони приєднані, утворю(s) 2-[4-[2-(о-ізопропілфеноксі)етиламіно]бутил]ють тетрагідронафтил. 1,3-діоксопергідропіроло[1,2-с]імідазолу; 10. Сполука за п. 9, у якій фенільний залишок є (t) 2-[4-[(2-хіноліл)метиламіно]бутил]-1,3необов'язково заміщеним за допомогою однієї або діоксопергідропіроло[1,2-с]імідазолу; більшого числа груп, вибраних з метокси, етокси, (u) 2-[4-[2-(о-етоксифеноксі)етиламіно]бутил]-1,3пропокси, ізопропокси, етилу, пропілу, ізопропілу, діоксопергідропіроло[1,2-с]імідазолу; броміду, трифторметилу, метиламіду або етокси(v) 2-[4-[2-(о-ізопропоксифеноксі)етиламіно]бутил]карбонілу. 1,3-діоксопергідропіроло[1,2-c]імідазолу; 11. Сполука за будь-яким з пп. 8-10, де фенільна (w) 2-[4-[2-[мгрупа є заміщеною в орто- та/або мета-положенні. (трифторметил)феноксі]етиламіно]бутил]-1,312. Сполука за будь-яким з пп. 8-11, де R1 та R2 є діоксопергідропіроло[1,2-с]імідазолу; зв'язаними разом метиленовими групами, які (х) 2-[4-[2-(1,1'-біфеніл-2-ілоксі)етиламіно]бутил]утворюють із гетероциклічним кільцем 5- або 61,3-діоксопергідропіроло[1,2-с]імідазолу; членне кільце; і R4 позначає N. (у) 2-[4-[2-[о-(ацетиламіно)феноксі]етиламіно]бутил]13. Сполука за будь-яким з пп. 8-12, де n має зна1,3-діоксопергідропіроло[1,2-с]імідазолу; чення 0 і Х є С 2-С10-алкіленом. (z) 2-[4-[2-[м-(ацетиламіно)феноксі]етиламіно]бутил]14. Сполука за будь-яким з пп. 8-11, де R 1 є Н і R2 1,3-діоксопергідропіроло[1,2-с]імідазолу; відсутній та R4 позначає S. (аа) 2-[4-[2-[о15. Сполука за п. 14, яка відрізняється тим, що n (етоксикарбоніл)феноксі]етиламіно]бутил]-1,3має значення 0 і Х є С 2-С10-алкіленом. діоксопергідропіроло[1,2-с]імідазолу; 16. Сполука за пп. 1 або 2, яка відрізняється тим, (bb) 2-[4-[2-(5,6,7,8-тетрагідронафт-1що m має значення 1 і R3 є 2-хінолілом. илоксі)етиламіно]бутил]-1,317. Сполука за п. 16, яка відрізняється тим, що R1 діоксопергідропіроло[1,2-с]імідазолу; та R2 є зв'язаними разом метиленовими групами, (сс) 2-[4-[2-(2,3-диметилфеноксі)етиламіно]бутил]які утворюють із гетероциклічним кільцем 5- або 61,3-діоксопергідропіроло[1,2-с]імідазолу; членне кільце; і R4 позначає N. (dd) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,418. Сполука за будь-яким з пп. 16-17, деn має діоксопергідропіридо[1,2-а]піразину; значення 0; і Х є C2-С10-алкіленом. (ее) (Z)-2-[4-[(хроман-2-іл)метиламіно]бут-2-еніл]19. Сполука за п. 1, у якій сполука вибрана з: 1,4-діоксопергідропіроло[1,2-с]імідазолу; (a) 2-[4-[(хроман-2(R)-іл)метиламіно]бутил]-1,3(ff) 3-[4-[2-(о-етоксифеноксі)етиламіно]бутил]-2,4діоксопергідропіроло[1,2-с]імідазолу; діоксотіазолідину; (b) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3(gg) 3-[6-[2-(о-етоксифеноксі)етиламіно]гексил]-2,4діоксопергідроімідазо[1,5-а]піридину; діоксотіазолідину; (c) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3(hh) 3-[8-[2-(о-етоксифеноксі)етиламіно]октил]-2,4діоксопергідропіроло[1,2-с]піразину; діоксотіазолідину; 5 83116 6 (іі) 2-[4-[2-(о-етоксифеноксі)етиламіно]бутил]-1,321. Застосування сполуки за будь-яким з пп. 1-19, діоксопергідроімідазо[1,5-а]піридину; за винятком 3-[3-[(хроман-2-іл)метиламіно]пропіл](jj) 2-[6-[2-(о-етоксифеноксі)етиламіно]гексил]-1,32,4-діоксоімідазолідинону, для одержання лікарсьдіоксопергідроімідазо[1,5-а]піридину; кого засобу для лікування та/або профілактики (kk) 2-[4-[(2-хіноліл)метиламіно]бутил]-1,3хвороби Паркінсона, ураження головного мозку, діоксопергідроімідазо[1,5-а]піридину; викликаного тромбофлебічним інсультом або че(ll) 2-[6-[(2-хіноліл)метиламіно]гексил]-1,3репно-мозковою травмою, депресії, мігрені, болю, діоксопергідроімідазо[1,5-а]піридину; психозу, розладу настрою, агресивних порушень фармацевтично прийнятної солі, гідрату, сольвату або захворювання сечовидільного тракту. або однієї з їхніх стереохімічно ізомерних форм. 20. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за будьяким з пп. 1-19 та фармацевтично прийнятні носії. Область техніки, до якої належить винахід Даний винахід стосується похідних циклоалкандіонів, без винятку, заміщених за допомогою хроман-2-ільного, 2-хінолільного або -Офенільного залишку, які є модуляторамиагоністами підкласу серотонінових (5гідрокситриптамін, 5-НТ) 5-НТ1а рецепторів, їхніх стереохімічних ізомерів та їхнього застосування в одержанні лікарського засобу для лікування патологічних станів, для яких показаний агоністмодулятор цих рецепторів. Рівень техніки [PCT/ES03/00394] розкриває циклоалкандіонові похідні загальної формули 1а: де: R6 вибраний з групи, що включає Н, С1-С5алкіл, С1-С5-алкокси, ОН, F, СІ, Вr, І; де: R1 вибраний з групи, що включає Н, -(СН2)3-, (СН2)4-, -CH2-S-CH2, -S-СН2СН2-; R2 вибраний з групи, що включає N, S; n має значення 0 або 1; Z вибраний з групи, що включає С2-С10алкілен, С2-С10-алкенілен, С2-С10-алкінілен; R3 вибраний з групи, що включає Н, С1-С10алкіл, арил, аралкіл; m має значення від 0 до 2; R4 вибраний з групи, що включає О, СН2; R5 вибраний з групи, що включає: X вибраний з групи, що включає О, S, NH, NCH3; Y вибраний з групи, що включає О, NH; W вибраний з групи, що включає S, NH. 7 83116 8 [PCT/ES03/00394] описує тести з радіолігандсеротонергічні 5-НТ1A агоністи є більш ефективниного заміщення для визначення in vitro споріднеми. Захисний ефект був також вивчений при цереності та вибірковості по відношенню до церебрабральному інфаркті, викликаному постійною оклюльних рецепторів 5-НТ1а деяких з можливих зією в серединній мозковій артерії у пацюків. сполук, представлених формулою Маркуша (1а), у У відповідності до першого аспекту даного витой час як їхню функціональну особливість (агонаходу, він стосується сполук загальної формули І: ніст/антагоніст) визначають шляхом вивчення їхнього впливу на аденілатциклазу в HeLa клітинах, трансфекованих людським рецептором 5-НТ1а, вимірюючи інгібуючий вплив на стимуляцію ферменту, індукованого форсколіном, для таких сполук: 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (а) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3діоксопергідроімідазо[1,5-b]тіазол, (b) їхні х стереохімічно ізомерних форм, гідратів, 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3сольватів та їхніх стереохімічно прийнятних солей, діоксопергідроімідазо[1,5-с]тіазол, (с) де: 3-[4-[(хроман-2-іл)метиламіно]бутил]-2,4R1 та R2 є Н або зв'язаними разом метиленодіоксотіазолідин, (d) вими групами, що утворюють із гетероциклічним 2-[4-[2-(феноксі)етиламіно]бутил]-1,3кільцем 5- або 6- членне кільце; якщо R 4 = S, тоді діоксопергідропіроло[1,2-с]імідазол, (e). R1 є Н і R2 відсутній; Для цих сполук (a, b, c, d, e) з метою визнаR4 вибраний з групи, що складається з N та S; чення функціональних характеристик in vivo, проn є цілим числом від 0 до 1; водять тести з кількісної оцінки гіпотермії, зв'язаної X вибраний з групи, що складається з С2-С10зі стимуляцією рецептора. Крім того, нейропротекалкілену, С2-С10-алкенілену та -CH2-Y-CH2-; де Y є торний ефект оцінюють на експериментальних фенілом; моделях in vitro, використовуючи первинні культуm є цілим числом від 1 до 2; ри щурячого гіпокампа, піддані депривації сироваR3 вибраний з групи, що складається з хроткою (сполуки a, d, і e), токсичною концентрацією ман-2-ілу, 2-хінолілу та -O-фенілу, де ароматичне глутамату (сполука а) або інкубуванням в умовах кільце хроманільного залишку, хінолільний або гіпоксії та відсутності глюкози (сполука а). З іншого фенільний залишок є необов'язково заміщеними боку, визначення нейропротекторного впливу in за допомогою однієї або більшого числа груп, вибvi vo оцінюють як на швидкоплинній глобальній раних з С1-С6-алкокси, С1-С6-алкілу, галоген у, С2моделі ішемії у гризунів (сполуки а та e), так і на С6-алкенілу, галоген-(С1-С6)-алкілу, галоген-(С1довгостроковій фокальній моделі ішемії на пацюС6)-алкокси, фенілу, феніл-(С1-С6)-алкілу, фенокках (сполука а). си, С1-С6-алкілкарбонілу, фенілкарбонілу, феніл[WO 99/29687] демонструє сполуку 73, яка (С1-С6)-алкілкарбонілу, С1-С6-алкоксикарбонілу, входить до формули І за даним винаходом. феніл-(С1-С6)-алкоксикарбонілу, С1-С6Суть винаходу алкілкарбоніламіно, гідрокси, ціано, нітро, аміно, Даний винахід стосується групи циклоалкандіN-(С1-С6)-алкіламіно, N,N-(С1-С6)-діалкіламіно, онових похідних, які без винятку заміщені за допокарбокси, сульфо, сульфамоїлу, сульфоніламіно, могою хроман-2-ільного залишку, 2-хінолільного (С1-С6)-алкіламіносульфонілу або (С1-С6)залишку або -О-фенільного залишку. алкілсульфоніламіно; або де фенільне кільце заУ великих дослідженнях винахідники несподіміщене за допомогою двох сусідніх залишків, які вано ідентифікували клас сполук, що мають високу разом з фенільним кільцем, до якого вони приєдспорідненість до рецептора 5-НT1А і виявляють нані, утворюють тетрагідронафтил; де кожен алкіл чудові нейропротекторні властивості. необов'язково заміщений за допомогою гідрокси Спорідненість in vitro до рецептора 5-НT1А або аміно; продемонстровано за допомогою тестів з радіоліза умови, що сполука не є 2-[4-[(хроман-2гандного заміщення. Аналогічно, була охарактериіл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,2зована їхня спорідненість по відношенню до серос]імідазолом, 3-[4-[(хроман-2-іл)метиламіно]бутил]тонергічних рецепторів 5-НТ2а, 5-НТ3, 5-НТ4 та 52,4-діоксотіазолідином, 3-[5-[(хроман-2НТ7, 5-НТ-транспортера, адренергічного рецептоіл)метиламіно]пентил]-2,4-діоксотіазолідином,3-[6ра a 1 і допамінергічного рецептора D2. Функціона[(хроман-2-іл)метиламіно]гексил]-2,4льна характеристика (агоніст/антагоніст) нових діоксотіазолідином, 2-[4-[2-(феноксі)лігандів була вивчена шляхом визначення інгібуетиламіно]бутил]-1,3-діоксопергідропіроло[1,2вання стимулюючого ефекту форсколіну на аденіс]імідазолом, 3-[4-[2-(феноксі)-етиламіно]бутил]латциклазу та вивчення, крім того, in vivo характе2,4-діоксотіазолідином або 3-[3-[(хроман-2ру нових сполук, як агоністів 5-НТ1а, за допомогою іл)метиламіно]пропіл]-2,4-діоксоімідазолідином. аналізу на гіпотермію. У такий саме спосіб in vitro, У кращому втіленні, R3 краще вибирають з для сполук за даним винаходом, була показана групи, що складається з хроман-2-ілу, 2-хінолілу та нейропротекторна активність на первинних куль-О-фенілу, де фенільний залишок необов'язково турах щурячого гіпокампа, з огляду на ті моделі заміщений за допомогою групи, вибраної з С1-С6загибелі нейронів (депривація трофічними фактоалкокси, С1-С6-алкілу, або галогену. рами та депривація киснем і глюкозою), у яких Даний винахід включає три основних втілення: 9 83116 10 (1) m має значення 1 і R3 є необов'язково заразом з фенільним кільцем, до якого вони приєдміщеним хроман-2-ілом, нані, утворюють тетрагідронафтил; де кожен алкіл 2) m має значення 2 і R3 є необов'язково замінеобов'язково заміщений за допомогою гідрокси щеним О-фенілом, або аміно. 3) m має значення 1 і R3 є необов'язково заміВідповідно до ще кращого втілення другого щеним 2-хінолілом. основного втілення винаходу, він стосується споВідповідно до першого основного кращого втілук формули (І) де: m = 2 і R3 є -О-фенілом, де лення даного винаходу, m має значення 1 і R3 є фенільне кільце заміщене за допомогою однієї або хроман-2-ілом, фенільне кільце якого є незаміщебільшого числа груп, вибраних з фенілу, С1-С6ним або заміщеним за допомогою однієї або більалкоксикарбонілу, С1-С6-алкілкарбоніламіно, С1шого числа гр уп, вибраних з С1-С6-алкокси, С1-С6С6-алкокси, С1-С6-алкілу, галоген-(С1-С6)-алкілу алкілу, галогену, С2-С6-алкенілу, галоген-(С1-С6)або галогену, або де фенільна група заміщена за алкілу, галоген-(С1-С6)-алкокси, фенілу, феніл-(С1допомогою двох сусідніх залишків, які разом з феС6)-алкілу, фенокси, С1-С6-алкілкарбонілу, фенілнільною групою, до якої вони приєднані, утворюкарбонілу, феніл-(С1-С6)-алкілкарбонілу, С1-С6ють тетрагідронафтил. алкоксикарбонілу, феніл-(С1-С6)-алкоксикарбонілу, В іншому кращому втіленні, m = 2 і R3 є -ОС1-С6-алкілкарбоніламіно, гідрокси, ціано, нітро, фенілом, де фенільне кільце заміщене за допомоаміно, N-(С1-С6)-алкіламіно, N,N-(С1-С6)гою однієї або більшого числа груп, вибраних з С1діалкіламіно, карбокси, сульфо, сульфамоїлу, суС6-алкокси, С1-С6-алкілу або галогену. льфоніламіно, (С1-С6)-алкіламіносульфонілу або Найкращими сполуками є ті, у яких фенільний (С1-С6)-алкілсульфоніламіно; де кожен алкіл незалишок необов'язково заміщений за допомогою обов'язково заміщений за допомогою гідрокси або однієї або більшого числа груп, вибраних з метокаміно. R3 краще є незаміщеним хроман-2-ілом. си, етокси, пропокси, ізопропокси, етилу, пропілу, Якщо конкретно не зазначено інше, термін ізопропілу, броміду, трифторметилу, метиламіду "хроман-2-іл" стосується незаміщеного хроман-2або етоксикарбонілу. ільного залишку. Особливо кращими є ті сполуки, у яких феніВідповідно до першого втілення зазначеного льний залишок заміщений в орто та/або метапершого кращого основного втілення винаходу, R1 положенні. та R2 є зв'язаними разом метиленовими групами, Відповідно до кращого втілення зазначеного що утворюють із гетероциклічним кільцем 5- або 6другого кращого втілення винаходу, R1 та R2 є членне кільце, і R4 позначає N. зв'язаними разом метиленовими групами, що Ті сполуки, у яких m має значення 1 і R 3 є хроутворюють із гетероциклічним кільцем 5- або 6ман-2-ілом, R1 та R2 є зв'язаними разом метилечленне кільце; і R4 позначає N. новими групами, що утворюють із гетероциклічним Особливо кращими є ті сполуки, у яких R1 та кільцем 5- або 6-членне кільце; R4 позначає N; і X R2 є зв'язаними разом метиленовими групами, що вибраний з групи, що складається з С 2-С10утворюють із гетероциклічним кільцем 5-членне алкілену, (Е)-2-бутенілену, 3-метилбензилену або кільце; R4 позначає N; n має значення 0; X є С24-метилбензилену, є кращими. С10-алкілом; m має значення 2; R3 є -О-фенілом, У другому втіленні зазначеного першого кранеобов'язково заміщеним за допомогою однієї або щого основного втілення даного винаходу, R1 побільшого числа груп, вибраних з фенілу, С1-С6значає Н; R2 відсутній; R4 позначає S; m має знаалкоксикарбонілу, С1-С6-алкілкарбоніламіно, С1чення 1; R3 є хроман-2-ілом; і X вибраний з групи, С6-алкокси, С1-С6-алкілу, галоген-(С1-С6)-алкілу що складається з С 2-С10-алкілену, С2-С10або галогену, або де фенільна група є заміщеною алкенілену, або -CH2-Y-CH2-, де Y є фенілом. В за допомогою двох сусідніх залишків, які разом з одному втіленні, n краще дорівнює 0. фенільною групою, до якої вони приєднані, утвоУ ще кращому втіленні даного винаходу, він рюють тетрагідронафтил. забезпечує сполуки формули (І) де: R1 позначає Н; У більш конкретному втіленні R3 є О-фенілом, R2 відсутній; R4 позначає S; m має значення 1; R3 є заміщеним групою, вибраною з С1-С6-алкокси, С1хроман-2-ілом; і X є С2-С10-алкіленом. В одному С6-алкілу або галогену. втіленні n краще дорівнює 0. В іншому кращому втіленні зазначеного другоДруге краще основне втілення винаходу стого кращого основного втілення винаходу, R1 посується сполук, де m має значення 2 і R3 є -Означає Н, R2 відсутній і R4 позначає S. Особливо, фенілом, необов'язково заміщеним за допомогою ті, у яких X є С2-С10-алкілом і n має значення 0. однієї або більшого числа груп, вибраних з С1-С6У відповідності до третього основного втілення алкокси, С1-С6-алкілу, галогену, С2-С6-алкенілу, даного винаходу, вінстосується сполук формули галоген-(С1-С6)-алкілу, галоген-(С1-С6)-алкокси, (І), де m має значення 1 і R 3 є 2-хінолілом, аромафенілу, феніл-(С1-С6)-алкілу, фенокси, С1-С6тичне кільце якого є незаміщеним або заміщеним алкілкарбонілу, фенілкарбонілу, феніл-(С1-С6)за допомогою однієї або більшого числа груп, вибалкілкарбонілу, С1-С6-алкоксикарбонілу, феніл-(С1раних з С1-С6-алкокси, С1-С6-алкілу, галоген у, С1С6)-алкоксикарбонілу, С1-С6-алкілкарбоніламіно, С6-алкенілу, галоген-(С1-С6)-алкілу, галоген-(С1гідрокси, ціано, нітро, аміно, N-(С1-С6)-алкіламіно, С6)-алкокси, фенілу, феніл-(С1-С6)-алкілу, фенокN,N-( С1-С6)-діалкіламіно, карбокси, сульфо, сульси, С1-С6-алкілкарбонілу, фенілкарбонілу, фенілфамоїлу, сульфоніламіно, (С1-С6)(С1-С6)-алкілкарбонілу, С1-С6-алкоксикарбонілу, алкіламіносульфонілу або (С1-С6)феніл-(С1-С6)-алкоксикарбонілу, С1-С6алкілсульфоніламіно; або де фенільне кільце заалкілкарбоніламіно, гідрокси, ціано, нітро, аміно, міщене за допомогою двох сусідніх залишків, які N-(С1-С6)-алкіламіно, N,N-(C1-C6)-діалкіламіно, 11 83116 12 карбокси, сульфо, сульфамоїлу, сульфоніламіно, Оптично чисті ізомери можуть бути одержані з (С1-С6)-алкіламіносульфонілу або (С1-С6)використанням хірального синтезуабо хіральних алкілсульфоніламіно; де кожен алкіл необов'язкореагентів, або розділення з використанням звиво заміщений за допомогою гідрокси або аміно. R3 чайних способів. краще є незаміщеним 2-хінолілом. Визначення стереохімічних ізомерних форм, Якщо конкретно не зазначено інше, термін "2які використовують в даному описі, охоплює всі хіноліл" стосується незаміщеного хінолільного можливі ізомерні форми, в яких можуть існувати залишку. сполуки формули (І). Якщо інше не згадано або не У кращому втіленні зазначеного третього кразазначено, хімічна назва сполук визначає суміш щого основного втілення винаходу, R1 та R2 є зв'явсіх можливих стереохімічно ізомерних форм, заними разом метиленовими групами, що утвопричому зазначені суміші включають всі діастереорюють із гетероциклічним кільцем 5- або 6- членне ізомери та енантіомери основної молекулярної кільце; і R4 позначає N. Ті сполуки, у яких n має структури. значення 0; і X є С2-С10-алкіленом, є особливо Як використовується надалі в даному описі, кращими. визначення сполук формули (І) включає їхні стеВ контексті даного винаходу, термін "алкіл" реохімічно прийнятні кислотно-адитивні солі та всі стосується насиченого, лінійного або розгалуженостереоізомерні форми. го вуглеводневого ланцюга. "Алкільна" група може Фармацевтично прийнятні кислотно-адитивні бути незаміщеною або заміщеною. "Алкіл" є краще солі, раніше згадані в даному описі, включають незаміщеним. Якщо "алкільна" група (також як чакислотно-адитивні солі, які можуть бути легко одестина, наприклад, фенілалкілу, алкілкарбонілу або ржані обробкою основної форми сполук формули алкокси) є заміщеною, заступники, краще, є гідро(І) відповідними неорганічними кислотами, такими ксилом або аміногрупою. Якщо конкретно не заяк соляна або бромистоводнева кислоти, сірчана, значено інше, термін "алкіл" стосується незаміщеазотна, фосфорна кислота та аналогічні кислоти; ного вугле водневого ланцюга. або органічними кислотами, такими як, наприклад В контексті даного винаходу, термін "С2-С10оцтова, гліколева, пропіонова, молочна, піровиноалкіл" стосується насиченого, лінійного або розгаградна, щавлева, малонова, бурштинова, малеїлуженого вуглеводневого ланцюга, що містить від нова, фумарова, оксибурштинова, винна, лимон2 до 10 атомів вуглецю. Термін "С2-С10-алкеніл" на, метансульфонова, етансульфонова, стосується лінійного або розгалуженого вуглеводбензолсульфонова, п-толуолсульфонова, цикланевого ланцюга, що містить від 2 до 10 атомів вугмінова, саліцилова, пара-аміносаліцилова, памова лецю і має, принаймні, один подвійний зв'язок. кислоти та аналоги. З іншого боку, зазначені форТермін "С1-С6-алкіл" стосується насиченого, ми кислотно-адитивних солей можуть перетворюлінійного або розгалуженого вуглеводневого ланватися на вільні основні форми після обробки прицюга, що містить від 1 до 6 атомів вуглецю. датною основою. Термін " галоген", що використовується в даВизначення "кислотно-адитивна сіль" включає ному описі, включає фтор, хлор, бром та йод. як аморфні, так і кристалічні солі, а також включає Термін "галоген-(С1-С6)-алкіл" стосується "С1гідрати та форми в асоціації з розчинником, які С6 алкілу", як визначено вище, який є заміщеним, можуть утворювати сполуки формули (І). Приклапринаймні, одним атомом галогену. Він включає як дами зазначених форм є гідрати, алкоголяти та кращі втілення дифторметил і трифторметил. аналоги. Термін "(С1-С6)-алкокси" стосується групи -ОВ області даного винаходу кращими є фізіоло(С1-С6)-алкілу. гічно прийнятні солі. Термін "галоген-(С1-С6)-алкокси" стосується Загальний спосіб одержання сполук за даним групи "С1-С6-алкокси", як визначено вище, заміщевинаходом: ної, принаймні, одним атомом галогену. Вона Розчин 1,3ммоль відповідного галогенованого включає як кращі втілення групи дифторметокси похідного, розчиненого в 5мл сухого ацетонітрилу, та трифторметокси. додають по краплях до 2,0ммоль відповідного алТермін "модулятор" рецептора 5-НТ1A, як викіламіну, розчиненого в 2мл сухого ацетонітрилу. користовується у даному винаході, включає повні Реакційну суміш нагрівають до температури 60°С та часткові агоністи, так само як антагоністи серопри перемішуванні протягом 4-6 годин (ТШХ). Пістонінового рецептора 5-НТ1А. Кращими є "агонісля охолодження, розчинник видаляють при знижети", тобто, сполуки з, принаймні, частковою агонісному тиску, залишок розчиняють у хлористому тічною активністю по відношенню до рецептора 5метилені (25мл) і промивають водним розчином НТ1A. 20% карбонату калію. Потім органічну фазу суСполуки за даним винаходом можуть включашать над безводним Na2SO4 і розчинник видаляти енантіомери залежно від їхньої асиметрії або ють при зниженому тиску. Одержану маслянисту діастереоізомери. Також є можливою стереоізорідину очищають за допомогою хроматографії на мерія стосовно подвійних зв'язків, таким чином, у колонці із силікагелем у придатній суміші розчиндеяких випадках молекула може існувати як (E)ників, одержуючи кінцевий продукт у вигляді вільізомер або (Z)-ізомер. Кожний з різних можливих ної основи. Сполуку перетворюють на її гідрохлоенантіомерів, діастереоізомерів або ізомерів сторид та очищають за допомогою перекристалізації. совно подвійних зв'язків та їхні суміші, їхні рацемаКінцеві продукти структурно охарактеризовути і оптично чисті форми включені до обсягу даноють за допомогою ІЧ, ЯМР спектрів та кількісного го винаходу. елементного аналізу. Для зручності обробки, якщо кінцевий продукт не є кристалічним, його перетво 13 83116 14 рюють на фармацевтично прийнятну сіль, одер(аа) 2-[4-[2-[ожану з неорганічною або органічною кислотою. (етоксикарбоніл)феноксі]етиламіно]бутил]-1,3Кращими сполуками за даним винаходом є: діоксопергідропіроло[1,2-с]імідазол; (a) 2-[4-[(хроман-2(R)-іл)метиламіно]бутил]-1,3(bb) 2-[4-[2-(5,6,7,8-тетрагідронафт-1діоксопергідропіроло[1,2-с]імідазол; ілоксі)етиламіно]бутил]-1,3(b) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол; діоксопергідроімідазо[1,5-а]піридин; (сс) 2-[4-[2-(2,3(c) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,3диметилфеноксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]піразин; діоксопергідропіроло[1,2-с]імідазол; (d) 2-[5-[(хроман-2-іл)метиламіно]пентил]-1,3(dd) 2-[4-[(хроман-2-іл)метиламіно]бутил]-1,4діоксопергідропіроло[1,2-с]імідазол; діоксопергідропіридо[1,2-а]піразин; (e) 2-[6-[(хроман-2-іл)метиламіно]гексил]-1,3(ее) (Z)-2-[4-[(хроман-2-іл)метиламіно]бут-2діоксопергідропіроло[1,2-с]імідазол; еніл]-1,4-діоксопергідропіроло[1,2-с]імідазол; (f) 2-[3-[(хроман-2-іл)метиламіно]пропіл]-1,3(ff) 3-[4-[2-(о-етоксифеноксі)етиламіно]бутил]діоксопергідропіроло[1,2-с]імідазол; 2,4-діоксотіазолідин; (g) 3-[8-[(хроман-2-іл)метиламіно]октил]-2,4(gg) 3-[6-[2-(одіоксотіазолідин; етоксифеноксі)етиламіно]гексил]-2,4(h) 2-[4-[(хроман-2(S)-іл)метиламіно]бутил]-1,3діоксотіазолідин; діоксопергідропіроло[1,2-с]імідазол; (hh) 3-[8-[2-(о-етоксифеноксі)етиламіно]октил](і) 2-[8-[(хроман-2-іл)метиламіно]октил]-1,32,4-діоксотіазолідин; діоксопергідропіроло[1,2-с]імідазол; (іі) 2-[4-[2-(о-етоксифеноксі)етиламіно]бутил](j) 2-[3-[[(хроман-21,3-діоксопергідроімідазо[1,5-а]піридин; іл)метиламіно]метил]бензил]-1,3(jj) 2-[6-[2-(о-етоксифеноксі)етиламіно]гексил]діоксопергідропіроло[1,2-с]імідазол; 1,3-діоксопергідроімідазо[1,5-а]піридин; (k) 2-[4-[[(хроман-2(kk) 2-[4-[(2-хіноліл)метиламіно]бутил]-1,3іл)метиламіно]метил]бензил]-1,3діоксопергідроімідазо[1,5-а]піридин; діоксопергідропіроло[1,2-с]імідазол; (II) 2-[6-[(2-хіноліл)метиламіно]гексил]-1,3(І) (E)-2-[4-[(хроман-2-іл)метиламіно]бут-2діоксопергідроімідазо[1,5-а]піридин; еніл]-1,3-діоксопергідропіроло[1,2-с]імідазол; їхні стереохімічно ізомерні форми, гідрати, со(m) 2-[4-[2-(ольвати та їхні стереохімічно прийнятні солі. метоксифеноксі)етиламіно]бутил]-1,3Загибель клітин, викликана киснем і депривадіоксопергідропіроло[1,2-с]імідазол; цією глюкози в первинних культурах гіпокампаль(n) 2-[4-[2-(мних нейронів пацюків, є моделлю, що має значно метоксифеноксі)етиламіно]бутил]-1,3більшу подібність до інсульту головного мозку, ніж діоксопергідропіроло[1,2-с]імідазол; загибель клітин, викликана депривацією сироват(о) 2-[4-[2-(о-бромфеноксі)етиламіно]бутил]кою в культуральному середовищі. Якщо в остан1,3-діоксопергідропіроло[1,2-с]імідазол; ній моделі клітинна загибель апоптичної природи (р) 2-[4-[2-(м-бромфеноксі)етиламіно]бутил]відбувається через видалення трофічних факторів 1,3-діоксопергідропіроло[1,2-с]імідазол; із середовища, депривація кисню та глюкози ви(q) 2-[4-[2-(о-етилфеноксі)етиламіно]бутил]кликає загибель з характеристиками, схожими до 1,3-діоксопергідропіроло[1,2-с]імідазол; тих, що мають місце при ішемічному інсульті. Від(r) 2-[4-[2-(м-етилфеноксі)етиламіно]бутил]-1,3повідно до прогнозної цінності цих досліджень in діоксопергідропіроло[1,2-с]імідазол; vitro, сполука (а) за [заявкою PCT/ES03/00394] ви(s) 2-[4-[2-(оявляє тільки лише захисну дію від інфаркту голоізопропілфеноксі)етиламіно]бутил]-1,3вного мозку, викликуваного постійною оклюзією діоксопергідропіроло[1,2-с]імідазол; середньої мозкової артерії, у пацюків при дозі (t) 2-[4-[(2-хіноліл)метиламіно]бутил]-1,32мг/кг. З іншого боку, як відзначено далі в описі діоксопергідропіроло[1,2-с]імідазол; даного винаходу, розкрита тут сполука (e), яка має (u) 2-[4-[2-(о-етоксифеноксі)етиламіно]бутил]нейропротекторну дію від загибелі внаслідок анок1,3-діоксопергідропіроло[1,2-с]імідазол; сії, що дорівнює (-)-BAY´3702, і приблизно в чоти(v) 2-[4-[2-(ори рази перевищує сполуку (а) попереднього доізопропоксифеноксі)етиламіно]бутил]-1,3кумента, значно знижує обсяг інфаркту кори в такій діоксопергідропіроло[1,2-с]імідазол; саме моделі фокальної ішемії на пацюках при зна(w) 2-[4-[2-[мчно нижчій сумарній дозі, 0,04мг/кг, подібно до (трифторметил)феноксі]етиламіно]бутил]-1,3ефективної дози (-)-BAY´3702 на цій моделі. діоксопергідропіроло[1,2-с]імідазол; Беручи до уваги їхню спорідненість до рецеп(х) 2-[4-[2-(1,1'-біфеніл-2торів 5-НТ1А та їхню нейропротекторну дію, сполуілоксі)етиламіно]бутил]-1,3ки формули (І) або 3-[3-[(хроман-2діоксопергідропіроло[1,2-с]імідазол; іл)метиламіно]пропіл]-2,4-діоксоімідазоліни є за(у) 2-[4-[2-[остосовними в лікуванні та/або профілактиці пато(ацетиламіно)феноксі]етиламіно]бутил]-1,3логічних станів, при яких показані модулятори редіоксопергідропіроло[1,2-с]імідазол; цепторів 5-НТ1А і, особливо, агоністи, таких як, (z) 2-[4-[2-[мнаприклад, лікування та/або профілактика ура(ацетиламіно)феноксі]етиламіно]бутил]-1,3ження головного мозку, викликаного тромбоембодіоксопергідропіроло[1,2-с]імідазол; лічним інсультом або травматичним ушкодженням головного мозку, так само як лікування та/або 15 83116 16 профілактика хвороби Паркінсона, депресії, вклюприйому усередину, у яких застосовуються тверді чаючи особливо ендогенну «велику» депресію, фармацевтичні носії. Для парентеральних компомігрень, біль, психоз, такий як, наприклад, шизофзицій носій звичайно включає стерильну воду, ренія; розлади настрою, такі як тривожні розлади принаймні, здебільшого, хоча можуть бути вклю(наприклад, обсесивно-компульсивні розлади, гечені інші компоненти, наприклад, для кращої рознералізована тривожність) і агресивні розлади чинності. Розчини для ін'єкцій, наприклад, можуть (включаючи змішані агресивнобути виго товлені з носієм у вигляді фізіологічного тривожні/депресивні розлади); захворювання серозчину, розчину глюкози або їхньої суміші. Також човидільного тракту, зокрема, нетримання сечі, при необхідності сполуки за даним винаходом монаприклад, стресове нетримання сечі. жуть уводитися черезшкірно. Отже, відповідно до другого аспекту даного Даний винахід проілюстрований такими необвинаходу, він стосується фармацевтичної компомежуючими прикладами. зиції, що складається з терапевтично ефективної Приклади кількості будь-якої сполуки формули (І) та фармаПриклад 1. 2-[4-[(Хроман-2(R)цевтично прийнятного носія. іл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,2Третій аспект даного винаходу стосується зас]імідазол, (діастереоізомери) (а). стосування сполук формули (І) або 3-[3-[(хроман2-іл)метиламіно]пропіл]-2,4-діоксоімідазолінів у виробництві лікарських засобів для лікування та/або профілактики хвороби Паркінсона, ураження головного мозку, викликаного тромбоемболічним інсультом або травматичним ушкодженням Хроматографія: етилацетат. мозку, депресії, мігрені, та/або болю, психозу (наВихід: 35%. 1 приклад, шизофренії); розладів настрою, таких як Н-ЯМР (CDCI3, 5): 1,47-1,86 (м, 5Н, -(СН2)2-, тривожні розлади (наприклад, обсесивноН7), 1,91-2,12 (м, 4Н, 2Н3`, 2Н6), 2,16-2,34 (м, 1Н, компульсивні розлади, генералізована тривожН7), 2,64-2,92 (м, 6Н, 2CH2NH, 2Н4`), 3,16-3,28 (м, ність) і агресивні розлади (включаючи змішані аг1Н, Н5), 3,48 (т, J = 7,1 Гц, 2Н, NCH2), 3,66 (дт, J = ресивно-тривожні/депресивні розлади); захворю11,2, 7,3 Гц, 1Н, Н5), 4,05 (дд, J = 9,1, 7,3 Гц, 1Н, вань сечовидільного тракту (наприклад, Н7а), 4,11-4,18 (м, 1Н, Н2), 6,81 (т, J= 7,6 Гц, 2Н, нетримання сечі). Н6`, Н8), 7,00-7,10 (м,2Н, Н5` Н7`). 13С-ЯМР (CDCI3, Даний третій аспект може альтернативно бути d): 24,6 (С3), 25,6 (С4), 25,8 (СН2), 26,9 (СН2), 27,1 сформульований як спосіб лікування захворювань, (С6), 27,5 (С7), 38,7 (NCH2), 45,4 (С5), 49,3 згаданих вище, у людини, який включає введення (CH2CH2NH), 54,1 (HNCH2CH), 63,2 (С7а), 75,0 (С2), людині, що потребує лікування, ефективної кілько116,7 (С8`), 120,1 (С6`), 121,9 (С4`а), 127,1 (С7`), сті фармацевтичного препарату згідно з наведе129,4 (С5`), 154,5 (С8`а), 160,8 (С3), 173,9 (C 1). ним описом. Обчислено для: C20H27N3O3×HCI: С, 60,98; Н, Для зручності введення сполуки за даним 7,16; N, 10,67, винаходом можуть бути виготовлені в різних фарЗнайдено: С, 60,15; Н, 7,14; N, 10,45. мацевтичних формах. Як придатні композиції, моПриклад 2. 2-[4-[(Хроман-2жна згадати всі композиції, звичайно використовуіл)метиламіно]бутил]-1,3-діоксопергідроімідазо[1,5вані у препаратах, які вводять системно або а]піридин, (b). місцево та зовнішньо. Для виготовлення фармацевтичних композицій за даним винаходом, терапевтично ефективну кількість конкретної сполуки, необов'язково, у формі кислотно-адитивної солі, як активний інгредієнт, комбінують в однорідній суміші з фармацевтично прийнятним носієм, який може набувати різноманітних форм, залежно від бажаної для введення лікарської форми. Ці Хроматографія: етилацетат. фармацевтичні композиції бажано мають форму Вихід: 30%. придатної уніфікованої дози, краще, для перора1 Н-ЯМР (CDCI3 d): 1,06-1,40 (м, 3Н, Н6ах, Н7ах, льного або ректального введення або парентераН8ах), 1,60-1,62 (м, 7Н, Н6ес, -(СН2)2-, 2Н3' , 1,88-2,09 льної ін'єкції. (м, 1Н, Н7ес), 2,11-2,18 (м, 1Н, Н8ес), 2,71-2,74 (м, Наприклад, при виготовленні композицій у фо4Н, 2NHCH2), 2,85-2,87 (м, 3Н, Н5ах, 2Н4`), 3,47 (т, рмі для прийому усередину може бути використа2Н, J = 6,6 Гц, NCH2), 3,67 (дд, 1Н, J= 11,9, 4,3 Гц, ний будь-який традиційний фармацевтично прийнН8а), 4,03-4,14 (м, 2Н, Н5ес, Н2`), 6,76 (т, 2Н, J = 7,6 ятний носій, такий як, наприклад, водно-буферні Гц, Н6`, Н8`), 6,98 (т, 2Н, J = 6,3 Гц, Н5' , Н7`), та/або ізотонічні водні розчини, гліколі, масла, Обчислено для: C21H29N3O3×HCI×H2 O: С, 59,21; спирти та аналоги у випадку рідких препаратів для Н, 7,57; N, 9,87, прийому усередину, таких як суспензії, сиропи, Знайдено: С, 58,76; Н, 7,01; N, 9,89. еліксири та розчини; або тверді носії, такі як крохПриклад 3. 2-[4-[(Хроман-2малі, цукри, каолін, зм'якшувачі, ліганди, дезінтегіл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,2ратори та аналоги у випадку порошків, пігулок, а]піразин, (с). капсул і таблеток. Завдяки простоті їхнього введення таблетки та капсули є найкращими лікарськими формами для 17 83116 18 3,45 (т, J= 7,1 Гц, 2Н, NCH2), 3,58-3,78 (м, 1Н, Н5), 4,06 (дд, J = 9,1, 7,3 Гц, 1Н, Н 7а), 4,29-4,39 (м, 1Н, Н2), 6,80-6,93 (м, 2Н, Н6`, Н8`), 7,00-7,08 (м, 2Н,Н5`, Н7`), 13 С-ЯМР (CDCI3, d): 24,1 (СН2), 24,3 (С3`), 25,5 (С4`), 26,3, 26,5, 27,0 ((СН2)3), 27,5 (С6), 27,8 (С7), Хроматографія: етилацетат. 38,7 (NCH2), 45,5 (С5), 49,2 (CH2CH2NH), 53,1 (HNCH2CH), 63,3 (С7а), 72,7 (C2`), 116,9 (С8`), 120,4 Вихід: 35%. 1 (С6`), 121,7 (С4`а), 127,3 (С5`), 129,5 (С7`), 154,1 Н-ЯМР (CDCI3, d): 1,14-2,09 (м, 9Н, -(СН2)2-, (С8`a), 160,9 (С3), 174,0 (C 1), 2Н7, Н8, 2Н3`), 2,28-2,34 (м, 1Н, Н8), 2,65-2,93 (м, 6Н, 2NHCH2, 2Н4`), 3,29-3,56 (м, 4Н, NCH2, 2Н6), Обчислено для: C22H31N3O3×HCI×H2 O: С, 60,06; 3,71 (д, 1Н, J = 11,9 Гц, Н3), 4,04-4,14 (м, 3Н, Н3, Н, 7,79; N, 9,55, Знайдено: С, 60,46; Н, 7,41; N, 9,54. Н8а, Н2`), 6,67-6,80 (м, 2Н, Н6' , Н8`), 6,95-7,22 (м, 2Н, Приклад 6. 2-[3-[(Хроман-2Н5`, Н7`). 13 іл)метиламіно]пропіл]-1,3С-ЯМР (CDCl3, d): 22,8 (С7), 24,7, 25,0, 25,7, діоксопергідропіроло[1,2-с]імідазол. (f). 26,7, 29,0 (-(СН2)2-, С8, С3`, С4`), 45,4 (NCH2), 46,0 (Се), 49,4 (NHCH2), 51,9 (С3), 54,0 (NHCH2), 59,2 (С8а), 74,7 (С2`), 116,9 (С8`), 120,4 (С6`), 122,1 (С4а`), 127,4 (С7`), 129,7 (С5`), 154,6 (С8а`), 163,4 (С4), 167,4 (С1). Обчислено для: C21H29N3O3×HCI×2H2O: С, 56,81; Н, 7,72; N, 9,46, Хроматографія: етилацетат. Знайдено: С, 56,73; Н, 7,09; N, 9,55. Вихід: 40%. Приклад 4. 2-[5-[(Хроман-21 іл)метиламіно]пентил]-1,3Н-ЯМР (CDCI3 d): 1,64-2,32 (м, 8Н, -(СН2)-, діоксопергідропіроло[1,2-с]імідазол (d) 2Н6, 2Н7, 2Н3`), 2,68-2,88 (м, 6Н, 2CH2NH, 2Н4`), 3,18-3,30 (м, 1Н, Н5), 3,58 (т, 2Н, J = 6,8 Гц, NCH2), 3,65-3,70 (м, 1Н, Н5), 4,03-4,17 (м, 2Н, Н7а, Н2`), 6,79-6,86 (м, 2Н, Н6' , Н8`), 7,02-7,11 (м, 2Н, Н5`, Н7`), 13 С-ЯМР (CDCI3, d): 24,6 (С3`), 25,6 (С4`), 26,9 (СН2), 27,5 (С6), 28,1 (С7), 36,9 (NCH 2), 45,5 (С5), 46,9 (CH2CH2NH), 54,0 (HNCH2CH), 63,3 (С7а), 74,9 Хроматографія: етилацетат. (С2), 116,8 (С8`), 120,2 (С6`), 122,0 (С4`а), 127,2 (С7`), Вихід: 32%. 1 129,5 (С5`), 154,6 (С8`а), 160,9 (С3), 174,0 (С1), Н-ЯМР (CDCI3, d): 1,34-1,39 (м, 2Н, -(СН2)-), Обчислено для: C19H25N3O 3×HCI: С, 60,07; Н, 1,61-1,76 (м, 6Н, -(СН2)2-, 2Н3`), 2,01-2,10 (м, 3Н, 6,90; N, 11,06, 2Н6, Н7), 2,17-2,33 (м, 1Н, Н7), 2,75-2,78 (м, 4Н, Знайдено: С, 59,65; Н, 6,91; N, 10,55. CH2CH2NH, HNCH2CH), 2,81-2,94 (м, 2Н, 2Н4`), Приклад 7. 3-[8-[(Хроман-22,93-2,98 (м, 1Н, Н5), 3,45 (т, J = 7,1 Гц, 2Н, NCH2), іл)метиламіно]октил]-2,4-діоксотіазолідин, (g). 3,58-3,78 (м, 1Н, Н5), 4,06 (дд, J = 9,1, 7,3 Гц, 1Н, Н7а). 4,29-4,39 (м, 1Н, Н2`), 6,82-6,89 (м, 2Н, Н6`, Н8`), 7,02-7,11 (м, 2Н, Н5`, Н7`), 13 С-ЯМР (CDCI3, d): 23,6 (СН2), 24,9 (С3`), 25,1 (С4`), 26,9 ((СН2)2), 27,2 (С6), 27,4 (С7), 38,0 (NCH2), 38,5 (С5), 45,3 (CH2CH2NH), 47,9 (HNCH2CH), 63,3 Хроматографія: етилацетат. (С7а), 70,9 (С2), 117,1 (С8`), 121,0 (С6`), 121,2 (С4`а), Вихід: 35%; температура плавлення 108127,4 (С5`), 129,3 (С7`), 153,0 (С8`а), 160,7 (С3), 173,9 111°С. (C1), Н-ЯМР (CDCI3, d): 1,29-1,31 (м, 8Н, -(СН2)4-), Обчислено для: C21H29N3O3×HCI×H2 O: С, 59,21; 1,55-1,66 (м, 4Н, СН2, 2Н3`), 1,71-1,86 (м, 2Н, СН2), Н, 7,57; N, 9,87, 2,70-2,93 (м, 6Н, 2NHCH2, 2Н4`), 3,60 (т, J = 7,6 Гц, Знайдено: С, 59,19; Н, 7,17; N, 9,64. 2Н, NCH2), 3,94 (с, 2Н, 2Н5), 4,19-4,25 (м, 2Н, Н2`, Приклад 5. 2-[6-[(Хроман-2NH), 6,80-6,86 (м, 2Н, Н6`, Н8`), 7,01-7,11 (м, 2Н, Н5`, іл)метиламіно]гексил]-1,3Н7`), діоксопергідропіроло[1,2-с]імідазол, (e). 13 С-ЯМР (CDCI3, d): 24,3, 25,4, 26,4, 26,9, 27,3, 28,8, 28,9, 29,0 (-(СН2)6`, С3`, С4`), 33,5 (С5), 41,9 (NCH2), 49,3, 53,3 (2CH2NH), 74,0 (С2`), 116,6 (С8), 120,2 (С6`), 121,7 (С4а`), 127,1 (С7`), 129,3 (С5`), 154,2 (С8а`), 171,3, 171,7 (С2, С4), Обчислено для: C21H30N2O3S×HCI-3H2O: С, Хроматографія: хлороформ/метанол, 9,5:0,5. 52,43; Н, 7,75; N, 5,82, Вихід: 35%. Знайдено: С, 52,33; Н, 6,78; N, 5,79. 1 Н-ЯМР (CDCI3, d): 1,28-1,35 (м, 4Н, -(СН2)2-), Приклад 8. 2-[4-[(Хроман-2(S)1,60-1,80 (м, 6Н, -(СН2)2-, 2Н3`), 1,96-2,14 (м, ЗН, іл)метиламіно]бутил]-1,3-діоксопергідропіроло[1,22Н6, Н7), 2,17-2,33 (м, 1Н, Н7), 2,77-3,03 (м, 6Н, с]імідазол, (діастереоізомери) (h). СН2СH2NН, HNCH2CH, 2Н4' ), 3,17-3,30 (м, 1Н, Н5), 19 83116 Хроматографія: етилацетат. Вихід: 38%. [a]25 d = +65 (с = 0,5, СНСІ3), Обчислено: C21H30N2O3SHCI×3H2O: С, 53,62; Н, 7,65; N, 9,38, Знайдено: С, 53,45; Н, 7,34; N, 9,45. Приклад 9. 2-[8-[(Хроман-2іл)метиламіно]октил]-1,3-діоксопергідропіроло[1,2с]імідазол, (і). Хроматографія: етилацетат. Вихід: 35%. 1 Н-ЯМР (CDCI3, d): 1,29-1,31 (м, 8Н, -(СН2)4-), 1,55-1,88 (м, 7Н, -(СН2)2-, 2Н3`, Н7), 1,94-2,34 (м, 3Н, 2Н6, Н7), 2,54 (уширений с, 1Н, NH), 2,66-2,97 (м, 6Н, 2CH2NH, 2Н4`), 3,18-3,29 (м, 1Н, Н5), 3,44 (т, 2Н, J = 7,3 Гц, NCH2), 3,62-3,74 (м, 1Н, Н5), 4,06 (дд, 1Н, J = 7,8, 7,6 Гц, Н7а), 4,14-4,21 (м, 1Н, Н2О, 6,80-6,86 (м, 2Н, Н6' , Н8`), 7,01-7,11 (м, 2Н, Н5`, Н7`), 13 С-ЯМР (CDCI3, d): 24,6, 25,7, 26,6, 27,0, 27,1, 27,6, 27,9, 29,0 (-(СН2)6-, С3`, С4`), 29,3 (С6), 29,6 (С7), 39,0 (NCH2), 45,5 (С5), 49,8 (CH2CH2NH), 54,0 (HNCH2CH), 63,3 (С7а), 74,7 (С2`), 116,8 (С8`), 121,2 (С6`), 121,9 (С4`а), 127,2 (С5`), 129,5 (С7`), 154,5 (С8`a), 160,9 (С3), 174,0 (C 1). Приклад 10. 2-[3-[[(Хроман-2іл)метиламіно]метил]бензил]-1,3діоксопергідропіроло[1,2-с]імідазол, (j). Хроматографія: етилацетат. Вихід: 40%. 1 Н-ЯМР (CDCI3, d): 1,58-2,26 (м, 6Н, 2Н6, 2Н7, 2Н3`), 2,69-2,96 (м, 4Н, CH2NH, 2Н4`), 3,23 (ддд, 1Н, J= 12,5, 7,6, 5,4 Гц, Н5), 3,69 (дт, 1Н, J= 11,2, 7,6 Гц, Н5), 3,85 (с, 2Н, СН2 Аr), 4,04-4,22 (м, 2Н, Н7а, Н2), 4,62 (с, 2Н, NCH2), 6,82 (т, 2Н, J = 6,8 Гц, Н6`, Н8`), 7,02-7,11 (м, 2Н, Н5' , Н7`), 7,26-7,34 (м, 4Н, Аr), 13 С-ЯМР (CDCI3, d): 24,7 (С3`), 25,6 (С4`), 27,0 (С6), 27,5 (С7), 42,5 (NCH2), 45,5 (С5), 53,5, 53,6 (2CH2NH), 63,4 (С7а), 75,2 (С2), 116,8 (С8`), 120,2 (С6`), 122,0 (С4`а), 127,0, 127,2, 127,7, 128,2, 128,8 (С7`, феніл), 129,5 (С5`), 136,1, 140,7 (феніл), 154,7 (С8`а), 160,5 (С3), 173,6 (C 1), Обчислено для: C24H27N3O3×HCI×3H2O: С, 58,12; Н, 6,91; N, 8,47, Знайдено: С, 58,19; Н, 6,51; N, 8,07. Хроматографія: етилацетат Приклад 11. 2-[4-[[(Хроман-2іл)метиламіно]метил]бензил]-1,3діоксопергідропіроло [1,2-с]імідазол, (k) 20 Хроматографія: етилацетат Вихід: 44%. 1 Н-ЯМР (CDCI3, d): 1,57-2,29 (м, 6Н, 2Н6, 2Н7) 2Н3`), 2,75-2,95 (м, 4Н, CH2NH, 2Н4`), 3,24 (ддд, 1Н, J= 12,4, 7,3, 5,4 Гц, Н5), 3,69 (дт, 1Н, J= 11,2, 7,6 Гц, Н5), 3,84 (с, 2Н, СН2 Аr), 4,04-4,22 (м, 2Н, Н7а, Н2`), 4,61 (с, 2Н, NCH2), 6,82 (т, 2Н, J= 8,1 Гц, Н6`, Н8`), 7,01-7,11 (м, 2Н,Н5`,Н7), 7,28-7,38 (м,4Н, Аr), Обчислено для: C24H27N3O3×HCI×2H2O: С, 60,31; Н, 6,75; N, 8,79, Знайдено: С, 60,71; Н, 6,40; N, 8,52. Приклад 12. (Е)-2-[4-[(Хроман-2іл)метиламіно]бут-2-еніл]-1,3діоксопергідропіроло[1,2-с]імідазол, (І). Хроматографія: етилацетат. Вихід: 43%. 1 Н-ЯМР (CDCI3, d): 1,63-2,31 (м, 6Н, 2Н6, 2Н7, 2Н3`), 2,65-2,93 (м, 4Н, CH2NH, 2Н4`), 3,17-3,31 (м, 3Н, CH2NH, Н5), 3,67 (дт, 1Н, J = 11,2, 7,6 Гц, Н5), 4,03-4,14 (м, 4Н, NCH2, Н7а, Н2`), 5,54-5,85 (м, 2Н, СН=СН), 6,77-6,85 (м, 2Н, Н6` Н8`), 7,00-7,10 (м, 2Н, Н5' , Н7`), 13 С-ЯМР (CDCI3, d): 24,7 (С3`), 25,7 (С4`), 27,1 (С6), 27,6 (С7), 40,2 (NCH2), 45,6 (С5), 50,9, 53,6 (2CH2NH), 63,5 (С7а), 75,1 (С2), 116,8 (С8`), 120,3 (С6`), 122,1 (С4а`), 124,8 (СН), 127,3 (С7`), 129,6 (С5`), 132,3 (СН), 154,6 (С8`а), 160,4 (С3), 173,6 (С1), Обчислено для: C20H25N3O3×HCI×4H2O: С, 51,78; Н, 7,39; N, 9,06, Знайдено: С, 52,16; Н, 7,00; N, 9,16. Приклад 13. 2-[4-[2-(оМетоксифеноксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол (m). Хроматографія: етилацетат. Вихід: 38%. 1 Н-ЯМР (CDCI3, d): 1,63-171 (м, 5Н, -(СН2)2-, Н7), 1,99-2,29 (м, 3Н, 2Н6, Н7), 2,78 (т, 2Н, J = 6,8 Гц, CH2NH), 3,01-3,10 (м, 2Н, CH2NH), 3,21 (ддд, 1Н, J= 11,2, 6,1, 5,6 Гц, H5), 3,57-3,80 (м, 3Н, NCH 2, Н5), 3,83 (с, 3Н, ОСН3), 4,00-4,18 (м, 3Н, ОСН2, Н7а), 6,87-6,90 (м, 4Н, Ar), 13 С-ЯМР (CDCI3, d): 25,5, 25,6 (-(СН2)2-), 26,5, 27,4 (С6, С7), 38,4 (NCH2), 45,4 (С5), 48,1, 48,6 (2CH2NH), 63,2 (С7а), 67,7 (ОСН3), 71,0 (ОСН2), 111,8 (С6`), 120,9 (С4`), 125,9, 129,7 (С3`, С5`), 130,5 (С2`), 147,8 (С7`), 160,6 (С3), 173,9 (C 1), Обчислено для: C19H27N3O4×HCI×4H2O: С, 48,56; Н, 7,72; N, 8,94, 21 83116 Знайдено: С, 48,16; Н, 7,32; N, 8,48. Приклад 14. 2-[4-[2-(мМетоксифеноксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (n). Хроматографія: етилацетат. Вихід: 38%. 1 Н-ЯМР (CDCI3, d): 1,42-1,70 (м, 4Н, -(СН2)2-), 1,95-2,06 (м, 3Н, 2Н6, Н7), 2,10-2,19 (м, 1Н, Н7), 2,64 (т, 2Н, J = 6,8 Гц, CH2NH), 2,92 (т, 2Н, J = 5,4 Гц, CH2NH), 3,16 (ддд, 1Н, J = 11,2, 7,3, 5,4 Гц, Н5), 3,39 (т, 2Н, J = 6,3 Гц, NCH2), 3,59 (дт, 1Н, J = 11,3, 7,6 Гц, Н5), 3,71 (с, 3Н, ОСН3), 3,97-4,07 (м, 3Н, ОСН2, Н7а), 6,41-6,47 (м, 3Н, Н2`Н4`, Н6`), 7,10 (т, 1Н, J=7,8 Гц, H5`), 13 С-ЯМР (CDCI3, d): 25,8 (-(СН2)2-), 27,0, 27,5 (С6, С7), 38,7 (NCH2), 45,6 (С5), 48,3, 49,0 (2CH2NH), 63,2 (С7а), 67,2, 68,6 (ОСН3, ОСН2`), 101,0 (С2`), 106,4, 106,6 (С4' , С6`), 129,8 (С5`), 138,9 (С1`), 160,0 (С3`), 160,8 (С3`), 173,9 (С1), Обчислено: C19H27N3 O4×HCI×3H2O: С, 50,49; Н, 7,58; N, 9,30, Знайдено: С, 50,71; Н, 7,18; N, 8,90. Приклад 15. 2-[4-[2-(оБромфеноксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (о). Хроматографія: етилацетат. Вихід: 48%; температура плавлення 98-99°С. 1 Н-ЯМР (CDCI3, d): 1,46-1,69 (м, 4Н, -(СН2)2-), 1,98-2,20 (м, 4Н, 2Н6, 2Н7), 2,70 (т, 2Н, J = 6,8 Гц, CH2NH), 3,00 (т, 2Н, J= 5,1 Гц, CH2NH), 3,19 (ддд, 1Н, J= 11,2, 7,3, 5,4 Гц, Н5), 3,46 (т, 2Н, J= 7,1 Гц, NCH2), 3,64 (дт, 1Н, J= 11,2, 7,6 Гц, Н5), 3,99-4,12 (м, 3Н, ОСН2, Н7а), 6,80 (дт, 2Н, J= 8,1, 8,0 Гц, Н4`, Н6`), 7,21 (д, 1Н, J= 5,9, 1,2 Гц, Н5`), 7,49 (дд, 1Н, J= 7,8, 1,4 Гц, Н3`), 13 С-ЯМР (CDCI3, d): 25,6, 26,8 (-(СН2)2-), 26,9, 27,4 (С6, С7), 38,6 (NCH2), 45,4 (С5), 48,2, 48,9 (2CH2NH), 63,1 (С7а), 68,4 (ОСН2), 112,2 (С2`), 113,4 (С6,), 121,9 (С4`), 128,3 (С5,), 133,1 (С3`, 155,0 (С1`), 160,6 (С3), 173,8 (C 1), Обчислено для: C18H24Br3O3×HCI×2H2O: С, 44,78; Н, 6,05; N, 8,70, Знайдено: С, 44,38; Н, 5,65; N, 9,05. Приклад 16. 2-[4-[2-(мБромфеноксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (р). 22 Хроматографія: етилацетат. Вихід: 42%; температура плавлення 140143°С. 1 Н-ЯМР (CDCI3, d): 1,42-1,74 (м, 4Н, -(СН2)2-), 1,94-2,22 (м, 4Н, 2Н6, 2Н7), 2,68 (т, 2Н, J= 7,1 Гц, CH2NH), 2,96 (т, 2Н, J= 5,1 Гц, CH2NH), 3,19 (ддд, 1Н, J= 11,2, 7,3, 5,1 Гц, Н5), 3,45 (т, 2Н, J= 7,8 Гц, NCH2), 3,64 (дт, 1Н, J= 11,2, 7,6 Гц, Н5), 3,99-4,14 (м, 3Н, ОСН2, Н7а), 6,78-6,83 (м, 1Н, Н4`), 7,02-7,10 (м, 3Н, Н2`, Н5`, Н6`), 13 С-ЯМР (CDCI3, 5): 25,6, 26,9, 27,4 (-(СН2)2-, С6, С7), 38,6 (NCH2), 45,4 (С5), 48,4, 49,0 (2CH2NH), 63,2 (С7а), 67,3 (ОСН2), 113,4 (С6`), 117,7 (С2`), 122,6 (С3`), 123,8 (С4`), 130,4 (С5`), 159,5 (С1`), 160,7 (С3), 173,8 (С1), Обчислено для: C18H24Br3O3×HCI×2H2O: С, 44,78; Н, 6,05; N, 8,70, Знайдено: С, 44,47; Н, 5,65; N, 9,30. Приклад 17. 2-[4-[2-(оЕтилфеноксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (q). Хроматографія: хлороформ/метанол, 9,5:0,5. Вихід: 28%; температура плавлення 115-118°С (гексан). 1 Н-ЯМР (CDCI3, d): 1,19 (т, 3Н, J = 7,4 Гц, СН3), 1,59-1,74 (м, 5Н, -(СН2)2-, Н7), 1,97-2,09 (м, 2Н, 2Н6), 2,17-2,28 (м, 1Н, Н7), 2,63 (кв„ 2Н, J = 7,6 Гц, СН2СН3), 2,80 (т, 2Н, J= 7,1 Гц, CH2NH), 3,08 (т, 2Н, J= 5,1 Гц, CH2NH), 3,17-3,29 (м, 1H, Н5), 3,50 (т, 2Н, J = 6,8 Гц, NCH2), 3,61-3,75 (м, 1Н, Н5), 4,02-4,15 (м, 3Н, ОСН2, Н7а), 6,82-6,94 (м, 2Н, Н4`, Н6,), 7,117,17 (м, 2Н, Н3`, Н5`), 13 С-ЯМР (CDCI3, d): 12,2 (СН3), 23,2, 25,7, 26,6 (СН2СН3, -(СН2)2-), 27,0, 27,5 (С6, С7), 38,6 (CH2NCO), 45,5 (С5), 48,5, 48,9 (2CH2NH), 63,3 (ОСН2, С7а), 111,3 (С6`), 120,8 (С4`), 126,8, 129,0 (С3`, С5`), 132,7 (С2`), 156,3 (С1`), 160,8 (С3), 167,4 (С1), Обчислено для: C20H29N3C3×HCI×2H2O: С, 55,61; Н, 7,93; N, 9,73, Знайдено: С, 55,89; Н, 7,53; N, 9,81. Приклад 18. 2-[4-[2-(мЕтилфеноксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (r). 23 83116 24 Хроматографія: етилацетат. 127,2, 127,4 (С5' , С8`), 128,9, 129,2 (С4`, С7`), 130,7 Вихід: 43%. (С4`а), 155,9 (С2`), 160,5 (С8`а), 160,7 (С3), 173,8 (C 1). 1 Приклад 21. 2-[4-[2-(оН-ЯМР (CDCI3, d): 1,24 (т, 3Н, J = 7,6 Гц, СН3), Етоксифеноксі)етиламіно]бутил]-1,31,59-1,74 (м, 5Н, -(СН2)2-, Н7), 1,97-2,09 (м, 2Н, діоксопергідропіроло[1,2-с]імідазол, (u). 2Н6), 2,17-2,28 (м, 1Н, Н7), 2,63-2,74 (м, 4Н, СН2СН3, CH2NH), 3,12 (т, 2Н, J = 5,1 Гц, CH2NH), 3,17-3,29 (м, 1Н, Н5), 3,50 (т, 2Н, J = 7,1 Гц, NCH2), 3,61-3,75 (м, 1Н, Н5), 4,02-4,15 (м, 3Н, ОСН2, Н7а), 6,72-6,86 (м, 3Н, Н2`, Н4' , Н6`), 7,21 (т, 1H, J = 7,8 Гц, Н5`), 13 С-ЯМР (CDCI3, d): 15,5 (СН3), 25,5, 25,8, 27,0 (СН2СН3, -(СН2)2-), 27,3, 27,6 (С6 , С7), 38,8 (NCH2), 45,6 (С5), 48,7, 49,0 (2CH2NH), 63,4 (С7а), 66,9 (ОСН2), 111,5 (С2`). 114,4 (С6`), 120,6 (С4), 129,3 Хроматографія: етилацетат. (С5`), 146,0 (С3`), 158,9 (С1`), 160,9 (С3), 174,0 (C 1), Вихід: 30%. 1 Обчислено для: С20Н29N3О3×НСІ×Н2 O: С, 58,03; Н-ЯМР (CDCI3, d): 1,43 (т, 3Н, J- 6,8 Гц, СН3), Н, 7,79; N, 10,15, 1,62-1,72 (м, 5Н, -(СН2)2-, Н7), 1,94-2,27 (м, ЗН, 2Н6, Знайдено: С, 57,92; Н, 7,91; N, 10,12. Н7), 2,78 (т, 2Н, J = 6,6 Гц, CH2NH), 3,06 (т, 2Н, J = Приклад 19. 2-[4-[2-(о5,1 Гц, CH2NH), 3,22 (ддд, 1Н, J = 12,4, 7,3, 5,1 Гц, Ізопропілфеноксі)етиламіно]бутил]-1,3Н5), 3,44-3,72 (м, 3Н, NCH2, Н5), 4,01-4,17 (м, 4Н, діоксопергідропіроло[1,2-с]імідазол, (s). ОСН2, Н7а , СH2СН3), 6,87-6,92 (м, 4Н, Аr), 13 С-ЯМР (CDCI3, d): 14,8 (СН3), 25,6, 26,4, 26,8, 27,4 (-(СН2)2-, С6, С7), 38,5 (NCH2), 45,4 (С5), 48,3, 48,7 (2CH2NH), 63,2 (С7а), 64,3 (СН2СН3), 68,3 (ОСН2), 113,6, 115,1, 120,9, 121,8 (С6`, С4`, С3`, С5`), 148,3 (С2`), 149,1 (С1`), 160,7 (С3), 173,8 (С1). Приклад 22. 2-[4-[2-(оІзопропоксифеноксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (v). Хроматографія: етилацетат. Вихід: 23%. 1 Н-ЯМР (CDCI3, d): 1,21 (д, 6Н, J = 7,9 Гц, 2СН3), 1,44-1,76 (м, 5Н, -(СН2)2-, Н7), 1,95-2,32 (м, 3Н, 2Н6, Н7), 2,71 (т, 2Н, J = 6,8 Гц, CH2NH), 3,02 (т, 2Н, J = 5,1 Гц, CH2NH), 3,17-3,37 (м, 2Н, СН, Н5), 3,49 (т, 2Н, J = 7,1 Гц, NCH2), 3,67 (дт, 1Н, J = 7,6, 3,9 Гц, Н5), 4,00-4,09 (м, 3Н, ОСН2, Н7а), 6,82-6,96 (м, 2Н, Н4' , Н6`), 7,09-7,22 (м, 2Н, Н3`, Н5`), 13 С-ЯМР (CDCI3, d): 22,7 (СН3), 25,9, 26,9, 27,0, 27,3, 27,6 (-(СН2)2-, СН, С6, С7), 38,8 (NCH2), 45,6 (С5), 49,0, 49,2 (2CH2NH), 63,4 (С7а), 67,5 (ОСН2), 111,5 (С6`), 120,8 (С4`), 126,1, 126,6 (С3`, С5`, 135,3 (Су), 157,5 (С1`), 160,8 (С3), 173,9 (С1). Приклад 20. 2-[4-[(2Хіноліл)метиламіно]бутил]-1,3діоксопергідропіроло[1,2-сіімідазол, (t). Хроматографія: етилацетат. Вихід: 33%; температура плавлення 125-126°С ІЧ (CDCI3, см -1): 1770, 1708 (CONCON), 1601, 1504, 1442, 1416 (Ar), 1 Н-ЯМР (CDCI3, d): 1,52-1,67 (м, 5Н, -(СН2)2-, Н7), 1,90-2,27 (м, 3Н, 2Н6, Н7), 2,50 (т, 2Н, J = 6,3 Гц, CH2NH), 3,01-3,24 (м, 1Н, Н5), 3,42 (т, 2Н, J = 6,8 Гц, NCH2), 3,53-3,69 (м, 1Н, Н5), 3,91-4,00 (м, 3Н, СН2Аr, Н7а), 7,47 (т, J = 7,1 Гц, 1Н, Н6`), 7,627,77 (м, 3Н, Н3`, Н5' , Н7`), 8,02 (д, J= 8,3 Гц, 1Н, Н4`), 8,11 (д, J= 8,5 Гц, 1Н, Н8`), 13 С-ЯМР (CDCI3, d): 24,4, 25,8, 26,8, 27,4 (2СН2, С6, С7), 38,7 (NCH2), 45,4 (С5), 53,8, 54,1 (CH2Ar, CH2NH), 63,1 (С7а), 120,9 (С3`), 126,0 (С6`), Хроматографія: етилацетат. Вихід: 23%. 1 Н-ЯМР (CDCI3, d): 1,33 (д, 6Н, J = 6,1 Гц, 2СН3), 1,55-1,71 (м, 4Н, -(СН2)2-), 2,04-2,26 (м, 4Н, 2Н6, 2Н7), 2,72 (кв, 2Н, J = 6,2 Гц, CH2NH), 3,02 (кв, 2Н, J = 5,1 Гц, CH2NH), 3,23 (ддд, 1H, J = 12,5, 7,3, 5,1 Гц, Н5), 3,48 (т, 2Н, J = 6,8 Гц, NCH2), 3,67 (дт, 1Н, J= 11,0, 7,8 Гц, Н5), 4,02-4,13 (м, 3Н, ОСН2, Н7а), 4,45 (септ, 1Н, J = 6,1 Гц, СН), 6,89-6,92 (м, 4Н, АR), 13 С-ЯМР (CDCI3, d): 22,1, 22,2 (СН3), 25,8, 27,0, 27,5 (-(СН2)2-, С6, С7), 38,7 (NCH2), 45,5 (С5), 48,7, 49,0 (2CH2NH), 63,3 (С7а), 68,7 (ОСН2), 72,1 (ОСН), 115,5, 116,7, 117,6, 121,8 (С6`, С4' , С3`, С5`), 145,5 (С2`), 151,2 (С1`), 160,3 (С3), 173,9 (С1), Обчислено для: C20H29N3O3×HCI×H2 O: С, 58,03; Н, 7,79; N, 10,15, Знайдено: С, 57,92; Н, 7,91; N, 10,12. Приклад 23. 2-[4-[2-[м(Трифторметил)феноксі]етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (w). 25 83116 26 (дд, 1Н, J = 7,3, 1,7 Гц, Ar), 8,68 (уширений с, 1Н, NH), 13 С-ЯМР (CDCI3, d): 24,6 (СН3), 25,2, 25,3, 26,9, 27,4 (-(СН2)2-, С6, С7), 38,0 (NCH2), 45,3 (С5), 47,7, 48,2 (2CH2NH), 63,2 (С7а), 66,8 (ОСН2), 112,2 (C6`), 121,5, 121,7 (С3`, С4`), 124,0 (С5`), 128,1 (С2`), 147,4 (С1`), 160,6 (С3), 169,0 (CONH), 173,9 (C 1), Обчислено для: C20H28N4O4×HCI×3H2O: С, Хроматографія: суміш етилацетат/етанол, 9:1. 50,15; Н, 7,37; N, 11,70, Вихід: 30%. 1 Знайдено: С, 50,55; Н, 7,75; N, 11,98. Н-ЯМР (CDCI3, d): 1,50-1,72 (м, 5Н, -(СН2)2-, Приклад 26. 2-[4-[2-[мН7), 1,91-2,21 (м, 3Н, 2Н6, Н7), 2,72 (т, 2Н, J = 6,8 (Ацетиламіно)феноксі]етиламіно]бутил]-1,3Гц, CH2NH), 3,01 (т, 2Н, J= 5,2 Гц, CH2NH), 3,11діоксопергідропіроло[1,2-с]імідазол, (z). 3,22 (м, 1H, Н5), 3,42 (т, 2Н, J = 6,8 Гц, NCH 2), 3,583,67 (м, 1Н, Н5), 3,96-4,29 (м, 3Н, ОСН2, Н7а), 7,057,17 (м, 3Н, Н2` Н4`, Н6`), 7,32 (т, 1Н, J= 7,9 Гц, Н5`), Обчислено для: С19Н24F 3N3О 3×НСI×Н2О: С, 50,28; Н, 6,00; N, 9,26, Знайдено: С, 50,62; Н, 6,10; N, 8,75. Приклад 24. 2-[4-[2-(1,1 -Біфеніл-2ілоксі)етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (х). 9:1. Хроматографія: суміш етилацетат/етанол, 9:1. Вихід: 35%. 1 Н-ЯМР (CDCI3, d): 1,22-1,77 (м, 4Н, -(СН2)2-)), 1,93-2,08 (м, 3Н, 2Н6, Н7), 2,16-2,30 (м, 1Н, Н7), 2,57 (т, 2Н, J = 7,0 Гц, CH2NH), 2,95 (т, 2Н, J= 5,1 Гц, CH2NH), 3,12-3,21 (м, 1H, Н5), 3,37 (т, 2Н, J = 7,0 Гц, NCH2), 3,53-3,62 (м, 1Н, Н5), 3,96-4,05 (м, 3Н, ОСН2, Н7а), 6,79-7,00 (м, 2Н, Аr), 7,18-7,47 (м, 7Н, Ar), 13 С-ЯМР (CDCI3 , d): 25,7, 26,9, 27,0, 27,5 ((СН2)2-, С6, С7), 38,7 (NCH2), 45,5 (С5), 48,5, 48,9 (2CH2NH), 63,3 (С7а), 68,1 (ОСН2), 113,3 (С6`), 121,3 (С4`), 126,9, 128,6 (С3`, С5`), 127,9, 129,5, 130,8 (5CH-Ph), 131,4 (С2`), 138,5 (C-Ph), 155,7 (С1`), 160,8 (С3), 173,9 (C 1), Обчислено: С24Н29N3О 3×НСІ×6Н2О: С, 52,21; Н, 7,67; N, 7,61, Знайдено: С, 52,61; Н, 7,27; N, 8,01. Приклад 25. 2-[4-[2-[о(Ацетиламіно)феноксі]етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (y). Хроматографія: суміш етилацетат/етанол, 9:1. Вихід: 24%. 1 Н-ЯМР (CDCI3 d): 1,60-1,71 (м, 5Н, -(СН2)2-, Н7), 1,96-2,17 (м, 3Н, 2Н6, Н7), 2,21 (с, 3Н, СН3), 2,78 (т, 2Н, J = 6,9 Гц, CH2NH), 3,09 (т, 2Н, J = 4,9 Гц, CH2NH), 3,14-3,26 (м, 1Н, Н5), 3,43 (т, 2Н, J= 7,1 Гц, NCH2), 3,62 (дт, 1Н, J= 11,2, 7,8 Гц, Н5), 3,934,19 (м, 3Н, ОСН2, Н7а), 6,82-6,99 (м, 3Н, Аr), 8,14 Хроматографія: суміш етилацетат/метанол, Вихід: 31%. 1 Н-ЯМР (CDCI3, d): 1,60-1,72 (м, 5Н, -(СН2)2-, Н7), 1,96-2,15 (м, 3Н, 2Н6, Н7), 2,21 (с, 3Н, СН3), 2,82 (т, 2Н, J = 6,1 Гц, CH2NH), 3,08 (т, 2Н, J = 5,8 Гц, CH2NH), 3,19 (ддд, 1H, J= 11,2,7,6, 5,1 Гц, Н5), 3,44 (т, 2H,J = 6,9 Гц, NCH2), 3,62 (дт, 1Н, J = 11,2, 7,8 Гц, Н5), 4,00-4,10 (м, 3Н, ОСН2, Н7а), 4,54 (уширений с, 1Н, NH), 6,54-6,57 (м, 1Н, Ar), 6,97-7,19 (м, 3Н, Ar), 13 С-ЯМР (CDCI3, d): 24,7 (СН3), 25,4, 25,9, 27,2, 27,6 (-(СН2)2-, С6, С7), 38,5 (NCH2), 45,6 (С5), 48,6, 48,8 (2CH2NH), 63,5 (С7а), 65,6 (ОСН2), 106,8 (С2`), 110,2 (С6`), 113,1 (С4`), 129,9 (С5`), 138,6 (С3`), 158,7 (С1`), 160,9 (С3), 169,4 (CONH), 174,2 (С1), Обчислено для: C20H28N4O4×HCI×3H2O: С, 50,15; Н, 7,37; N, 11,70, Знайдено: С, 50,65; Н, 7,65; N, 12,03. Приклад 27. 2-[4-[2-[о(Етоксикарбоніл)феноксі]етиламіно]бутил]-1,3діоксопергідропіроло[1,2-с]імідазол, (аа). Хроматографія: суміш етилацетат/етанол, 9:1. Вихід: 25%. 1 Н-ЯМР (CDCI3, d): 1,39 (т, J = 7,2 Гц, СН3СН2), 1,66-1,83 (м, 5Н, -(СН2)2-, Н7), 1,94-2,45 (м, 5Н, 2Н6, Н7, CH2NH), 3,15-3,27 (м, 3Н, CH2NH, Н5), 3,44-3,54 (м, 2Н, NCH2), 3,66 (дт, 1Н, J= 11,2, 7,6 Гц, Н5), 4,07 (дд, 1Н, J= 9,0, 7,3 Гц, Н7а), 4,33 (кв, 2Н, J = 7,1 Гц, СН3СН2), 4,54 (т, 2Н, J = 4,6 Гц, ОСН2), 7,01-7,11 (м, 2Н, Аr), 7,50 (д, 1Н, J = 7,8, 1,7 Гц, Ar), 7,84 (дд, 1Н, J= 7,8, 1,5 Гц, Ar), 27 83116 28 Знайдено: С, 52,99; Н, 8,15; N, 9,74. С-ЯМР (CDCI3, d): 14,0 (СН3СН2), 22,9, 24,8, Приклад 30. 2-[4-[(Хроман-226,9, 27,4 (-(СН2)2-, С6, С7), 37,5 (NCH2), 45,3 (С5), 47,3, 47,4 (2CH2NH), 61,5 (СН3СН2), 63,2 (С7а), 65,7 іл)метиламіно]бутил]-1,4-діоксопергідропіридо[1,2а]піразин, (dd). (ОСН2), 116,2 (С6`), 120,2 (C2`), 122,3 (С4' ), 131,6 Хроматографія: етилацетат. (С3`), 134,4 (С5), 158,0 (С1`), 160,4 (С3), 166,6 Вихід: 35%. (СОО), 173,8 (С1), 1 Н-ЯМР (CDCI3, d): 1,40-1,68 (м, 8Н, -(СН2)2-, Обчислено для: C21H29N3O5×HCI×3H2O: С, 2Н7, Н8ах, Н9ах), 1,96-2,07 (м, 3Н, Н8ес, 2Н3' ), 2,3351,06; Н, 7,35; N, 8,51, 2,58 (м, 2Н, Н9ес, Н6ах), 2,70-2,96 (м, 6Н, 2NHCH2, Знайдено: С, 51,36; Н, 7,42; N, 8,68. 2Н4`), 3,41 (т, 2Н, J = 6,6 Гц, NCH2), 3,82 (д, 2Н, J= Приклад 28. 2-[4-[2-(5,6,7,8-Тетрагідронафт-111,7 Гц, Н9а), 3,96 (с, 2Н, 2Н3), 4,14-4,19 (м, 1Н, илоксі)етиламіно]бутил]-1,3Н2`), 4,67 (д, 1Н, J = 12,9 Гц, Н6ес), 6,83 (т, 2Н, J = діоксопергідропіроло[1,2-с]імідазол, (bb). 7,6 Гц, Н6`, Н8`), 7,02-7,11 (м, 2Н, Н5`, Н7`), 13 С-ЯМР (CDCI3, d): 24,2, 24,4, 24,6, 25,6, 26,9 (-(СН2)2-, С7, С8, С3`, С4`), 31,3 (С9), 42,4 (С6), 45,7 (NCH2), 49,2, 49,3 (NHCH2, С3), 54,0 (NHCH2), 59,2 (С9а), 74,8 (С2`), 116,8 (С8), 120,2 (С6`), 122,0 (С4а`), 127,2 (C7`), 129,5 (С5`), 154,4 (С8а`), 161,3 (С4), 164,9 (С1), Обчислено для: C22H31N3O3×HCI×H2 O: С, 60,06; Хроматографія: суміш етилацетат/етанол, 9:1. Н, 7,79; N, 9,55, Вихід: 32%. Знайдено: С, 60,23; Н, 7,43; N, 9,22. 1 Н-ЯМР (CDCI3, d): 1,52-1,77 (м, 9Н, -(СН2)4-, Приклад 31. (2)-2-[4-[(Хроман-2Н7), 1,98-2,15 (м, 2Н, 2Н6), 2,17-2,29 (м, 1Н, Н7), іл)метиламіно]бут-2-еніл]-1,42,64-2,78 (м, 6Н, СH2NН, 2CH2Ar), 3,01 (т, J= 5,1 діоксопергідропіроло[1,2-с]імідазол, (ее). Гц, CH2NH), 3,17-3,29 (м, 1Н, Н5), 3,49 (т, 2Н, J= 7,1 Гц, NCH2), 3,65 (дт, 1Н, J= 11,2, 7,6 Гц, Н5), 4,024,10 (м, 3Н, ОСН2, Н7а), 6,57 (д, 1Н, J=8,1 Гц, Аr), 6,62 (д, 1Н, J= 7,6 Гц, Аr), 7,03 (т, 1Н, J= 7,8 Гц, Аr), 13 С-ЯМР (CDCI3, d): 22,8, 23,1, 25,8, 27,0, 27,2, 27,6 (-(СН2)2-, -(СН2)4-, С6 , С7), 38,8 (NCH2), 45,5 (С5), 48,8, 49,1 (2CH2NH), 63,3 (С7а), 67,1 (ОСН2), Хроматографія: етилацетат 107,9 (С2`), 121,6 (С4`), 125,6 (С3`), 126,1 (С8`a), Вихід: 38%. 1 138,6 (С4`а), 156,5 (С1`), 160,8 (С3), 173,9 (С1), Н-ЯМР (CDCI3, d): 1,59-2,32 (м, 6Н, 2Н6, 2Н7, Обчислено для: С22Н31N3О3×НСІ×3Н2О: С, 2Н3`), 2,70-2,86 (м, 4Н, CH2NH, 2H4`), 3,24 (ддд, 1Н, 55,51; Н, 8,05; N, 8,83, J= 11,2, 7,6, 5,4 Гц, Н 5), 3,50 (д, 2Н, J= 6 ,6 Гц, Знайдено: С, 55,18; Н, 7,77; N, 8,90. CH2NH), 3,68 (дт, 1Н, J = 11,2, 7,8 Гц, Н5), 4,03-4,19 (м, 4Н, NCH2, Н7а, Н2`), 5,47-5,57 (м, 1Н, СН), 5,70Приклад 29. 2-[4-[2-(2,3Диметилфеноксі)етиламіно]бутил]-1,35,82 (м, 1Н, СН), 6,79-6,86 (м, 2Н, Н6`, Н8`), 7,02діоксопергідропіроло[1,2-с]імідазол, (сс). 7,07 (м, 2Н, Н5`, Н7`), 13 С-ЯМР (CDCI3, d): 24,5, 25,4, 26,8, 27,3 (С3`, С4`, С6, С7), 35,7 (NCH2), 45,3, 45,9 (С5, CH2NH), 53,6 (CH2NH), 63,2 (С7а), 75,0 (С2), 116,6 (С8`), 119,9 (С6`), 121,8 (С4a`) 124,3 (СН), 127,0 (С7`), 129,3 (С5`), 132,7 (СН), 155,8 (С8`а), 156,2 (С3), 172,4 (С1), Обчислено для: С20Н25N3О3×НСІ×4Н2O: С, 51,78; Н, 7,39; N, 9,06, Хроматографія: суміш етилацетат/метанол, Знайдено: С, 51,42; Н, 7,02; N, 8,75. 9:1. Приклад 32. 3-[4-[2-(оВихід: 30% 1 Етоксифеноксі)етиламіно]бутил]-2,4Н-ЯМР (CDCl3, d): 1,53-1,73 (м, 5Н, -(СН2)2-, діоксотіазолідин, (ff) Н7), 1,98-2,23 (м, 3Н, 2Н6, Н7), 2,14 (с, 3Н, СН3), 2,27 (с, 3Н, СН3), 2,72 (т, 2Н, J = 6,8 Гц, CH2NH), 3,02 (т, 2Н, J = 4,9 Гц, CH2NH), 3,17-3,29 (м, 1Н, Н5), 3,49 (т, 2Н, J = 6,8 Гц, NCH2), 3,67 (дт, 1Н, J= 11,2, 7,6 Гц, Н5), 4,02-4,10 (м, 3Н, ОСН2, Н7а), 6,70 (д, 1Н, J = 8,3 Гц, Ar), 6,77 (д, 1Н, J = 7,6 Гц, Ar), 7,03 (т, 1H, J = 7,8 Гц, Ar), 13 С-ЯМР (CDCI3, d): 11,7, 20,1 (2CH3), 25,9, 27,0, 27,2, 27,6 (-(CH2)2-, С6 , С7), 38,8 (NCH2), 45,6 Хроматографія: суміш етилацетат/етанол, 9:1. (С5), 49,0, 49,2 (2CH2NH), 63,4 (С7а), 67,7 (ОСН2), Вихід: 55%; температура плавлення 70-74°С. 109,2 (С6`), 122,4 (С4`), 125,8 (С5`, 137,9, 138,1 (С2`, 1 Н-ЯМР (CDCI3, d): 1,44 (т, 3Н, J = 7,0 Гц, СН3), С3), 155,9 (С1`), 160,5 (С3), 173,9 (С1), 1,57-1,74 (м, 4Н, -(СН2)2-), 2,83 (т, 2Н, J = 7,0 Гц, Обчислено для: C20H29N3O3×HCI×3H2O: С, CH2NH), 3,13 (т, 2Н, J = 5,0 Гц, CH 2NH), 3,29 (т, 2Н, 53,38; Н, 8,06; N, 9,34, J = 7,5 Гц, NCH 2), 3,96 (с, 2Н, 2Н5), 4,08 (кв„ 2Н, J = 13 29 83116 30 7,0 Гц, СН2СН3), 4,19 (т, 2Н, J = 5,0 Гц, ОСН2), 6,86-6,97 (м, 4Н, Аr), 13 С-ЯМР (CDCl3, d): 14,9 (СН3), 24,0, 25,2 ((СН2)2-), 33,8 (C 5), 41,6 (NCH2), 48,2, 48,5 (2CH2NH), 64,4 (СН2СН3), 68,3 (ОСН2), 113,6, 115,1, 121,0, 121,8 (С6' , С4`, С3`, С5`), 148,3, 149,1 Хроматографія: суміш етилацетат/етанол, 7:3. (С1`, С2`), 171,3 (С2, С4), Вихід: 31%. 1 Обчислено для: C17H24N2O4S×HCl×1/2H2O:C, Н-ЯМР (CDCI3, d): 1,28-1,74 (м, 11Н, -(СН2)2-, 51,31; Н, 6,59; N,7,04, СН3, Н6ах, Н7ах, Н8ах, Н6ес), 1,94-2,03 (м, 1Н, Н7ес), Знайдено: С, 51,36; Н, 7,04; N, 6,66. 2,14-2,21 (м, 1Н, Н8ес), 2,73-2,87 (м, 3Н, Н5ах, Приклад 33. 3-[6-[2-(оCH2NH), 3,11 (т, 2Н, J = 5,2 Гц, CH 2NH), 3,51 (т, 2Н, Етоксифеноксі)етиламіно]гексил]-2,4J = 6,5 Гц, NCH2), 3,69-3,79 (м, 1Н, Н8а), 4,00-4,12 діоксотіазолідин, (qg). (м, 3Н, СН2СН3, Н5ес), 4,18 (т, 2Н, J= 5,1 Гц, ОСН2), 6,77-6,87 (м, 4Н, Аr), 13 С-ЯМР (CDCI3, 5): 15,1 (СН3), 22,9, 25,1, 26,0, 27,9, 29,8 (-(СН2)2-, С6, С7, С8), 38,3 (NCH2), 39,4 (С5), 48,3, 48,8 (2CH2NH), 57,5 (С8а), 64,6, 68,1 (СН2СН3, ОСН2), 113,7, 115,4, 121,2, 122,2 (С6, С4`, С3`, С5`), 148,3, 149,3 (С1`, С2`), 154,1 (С3), 173,4 Хроматографія: суміш етилацетат/етанол, 9:1. (C1), Вихід: 48%; температура плавлення 92-94°С. Обчислено для: C21H31N3O4×HCI×H2 O: С, 56,81; 1 Н-ЯМР (CDCI3, d): 1,18-1,66 (м, 11Н, -(СН2)4-, Н, 7,72; N, 9,46, СН3), 2,73 (т, 2Н, J = 7,1 Гц, CH2NH), 3,06 (т, 2Н, J Знайдено: С, 57,38; Н, 8,00; N, 9,02. = 5,3 Гц, CH2NH), 3,46 (уширений с, 1Н, NH), 3,60 Приклад 36. 2-[6-[2-(о(т, 2Н, J = 7,4 Гц, NCH2), 3,92 (с, 2Н, 2Н5), 4,06 (кв, Етоксифеноксі)етиламіно]гексил]-1,32Н, J = 7,0 Гц, СН2СН3), 4,15 (т, 2Н, J = 5,0 Гц, діоксопергідроімідазо[1,5-а]піридин. (jj). ОСН2), 6,81-6,97 (м, 4Н,Аr), 13 С-ЯМР (CDCI3, d): 14,8 (СН3), 26,3, 26,6, 27,3, 29,1 (-(СН2)4-), 33,6 (С5), 41,9 (NCH2), 48,4, 49,2 (2CH2NH), 64,4 (СН2СН3), 68,3 (ОСН2), 113,6, 115,1, 121,0, 121,8 (С6' , С4` С3`, С5`), 148,3, 149,1 (С1`, С2`), 171,3 (С2, С4), Хроматографія: суміш етилацетат/етанол, 8:2. Обчислено для: C19H28N2O4S×HCI×H2 O: С, Вихід: 49%. 52,46; Н, 7,18; N, 6,44, 1 Н-ЯМР (CDCI3, d): 1,23-1,63 (м, 14Н, -(СН2)4-, Знайдено: С, 52,64; Н, 6,99; N, 6,45. СН3, Н6ах, Н7ах, Н8ах), 1,71-1,75 (м, 1Н, Н6ес), 1,96Приклад 34. 3-[8-[2-(о2,01 (м, 1Н, Н7ес), 2,18-2,22 (м, 1Н, Н8ес), 2,70 (т, Етоксифеноксі)етиламіно]октил]-2,42Н, J = 7,3 Гц, CH2NH), 2,77-2,87 (м, 1Н, Н5ах), 3,03 діоксотіазолідин, (hh). (т, 2Н, J= 5,3 Гц, CH2NH), 3,48 (т, 2Н, J= 7,3 Гц, NCH2), 3,73 (дд, 1H, J= 11,9, 4,1 Гц, Н8а), 4,07 (кв„ 2Н, J= 7,0 Гц, СН2СН3), 4,14 (т, 2Н, J = 5,3 Гц, ОСН2), 4,18-4,19 (м, 1Н, Н5ес), 6,86-7,26 (м, 4Н, Ar), 13 С-ЯМР (CDCI3, d): 14,7 (СН3), 22,6, 24,8, 26,3, 26,6, 27,6, 27,0, 29,3 (-(СН2)4-, С6, С7, С8), 38,3 (NCH2), 39,1 (С5), 48,4, 49,3 (2CH2NH), 57,1 (С8а), Хроматографія: суміш етилацетат/етанол, 9:1. 64,3, 68,4 (СН2СН3, ОСН2), 113,5, 114,9, 120,9, Вихід: 48%; температура плавлення 105121,6 (С6' , С4`, С3`, С5`), 148,3, 148,7 (С1`, С2`), 154,4 108°С. (С3), 173,1 (С1), 1 Н-ЯМР (CDCI3, d): 1,07-1,54 (м, 15Н, -(СН2)6-, Обчислено для: C23H35N3O 4×HCI×7/2H2O: С, СН3), 2,73 (т, 2Н, J= 7,4 Гц, CH2NH), 3,04 (т, 2Н, J = 53,43; Н, 8,38; N, 8,13, 5,2 Гц, CH2NH), 3,44 (уширений с, 1Н, NH), 3,54 (т, Знайдено: С, 53,18; Н, 7,82; N, 7,60. 2Н, J = 7,4 Гц, NCH2), 3,87 (с, 2Н, 2Н5), 4,01 (кв„ 2Н, Приклад 37. 2-[4-[(2J = 7,0 Гц, СН2СН3), 4,13 (т, 2Н, J = 5,2 Гц, ОСН2), Хіноліл)метиламіно]бутил]-1,36,76-6,92 (м, 4Н, Ar), 13 діоксопергідроімідазо[1,5-а]піридин, (kk) С-ЯМР (CDCI , d): 14,7 (СН ), 26,4, 26,8, 27,3, 3 3 28,7, 28,8, 29,0 (-(СН2)6-), 33,5 (С5), 41,9 (NCH2), 48,1, 49,1 (2CH2NH), 64,3 (СН2СН3), 68,0 (ОСН2), 113,5, 115,1, 120,9, 121,9 (С6' , С4`, С3`, С5`, 148,3, 149,2 (С1`, С2), 171,3 (С2, С4), Обчислено: C21H32N2O 4S×HCl×1/2H2O: С, 55,55; Н, 7,55; N, 6,17, Знайдено: С, 55,78; Н, 7,34; N, 6,04. Приклад 35. 2-[4-[2-(оЕтоксифеноксі)етиламіно]бутил]-1,3діоксопергідроімідазо[1,5-а]піридин, (іі). Хроматографія: суміш етилацетат/етанол, 7:3. Вихід: 45%; температура плавлення 206208°С. 1 Н-ЯМР (CDCl3, d): 1,21-1,77 (м, 8Н, -(СН2)2-, Н6ах, Н7ах, Н 8ах, Н6ес), 1,95-1,99 (м, 1Н, Н7ес), 2,162,22 (м, 1Н, Н8ес), 2,76-2,86 (м, 3Н, Н5ах, CH2NH), 31 83116 32 3,24 (уширений с, 1Н, NH), 3,53 (т, 2Н, J = 6,9 Гц, * D2 рецептори, [3Н]спіперон, смугасте тіло моNCH2), 3,73 (дд, 1Н, J = 12,1, 4,4 Гц, Н8а), 4,12-4,18 зку пацюків. (м, 3Н, СН2Аr, Н5ес), 7,46 (д, 1Н, J = 8,4 Гц, Н3`), Сполука BAY´3702 була вибрана як стандарт7,44-7,54 (м, 1Н, Н6`), 7,67-7,73 (м, 1Н, Н7`), 7,81 ний ліганд 5-НТ1А, так само як і її лівообертальний (дд, 1Н, J = 8,2, 1,1 Гц, H5`), 8,06 (д, J= 8,5 Гц, 1Н, ізомер (-)-BAY´3702. Н4`), 8,13 (д, 1Н, J= 8,5 Гц, Н8`), Для всіх досліджень зв'язування рецепторів 13 С-ЯМР (CDCI3, d): 22,7, 24,9, 25,9, 26,3, 27,8 використовують самців пацюків лінії Sprague(-(СН2)2-, С6, С7, С8), 38,2 (NCH2), 39,3 (С5), 48,7 Dawley (Rattus norvegicus albinus) масою 180-200г, (CH2NH), 54,6 (СН2Аr), 57,3 (С8а), 120,4 (С3`), 126,3 яких умертвляють шляхом декапітації з наступним (С6`), 127,3, 127,5 (С5' , С8`), 128,9, 129,6 (С4' , C7`), швидким витяганням головного мозку та його пре136,7 (С4`а), 147,5 (С8`а), 154,5 (С2`), 158,0 (С3), паруванням. Тканини зберігають при -80°С для 173,2 (С1), наступного використання та гомогенізують за доОбчислено для: C21H26N4O 2×2HCl×1/2H2O: С, помогою гомогенізатора Polytron PT-10. Мембранні 56,25; Н, 6,52; N, 12,50, суспензії центрифугують у приладі Beckman J2Знайдено: С, 56,66; Н, 6,53; N, 11,94. HS. Зв'язані радіоактивні ліганди відокремлюють Приклад 38. 2-[6-[(2від вільних шляхом вакуумної фільтрації з викориХіноліл)метиламіно]гексил]-1,3станням фільтрів Whatman GF/C, двічі відмитих діоксопергідроімідазо[1,5-а]піридин (II). 4мл відповідного буфера. Додають 4мл сцинтиляційної рідини (EcoLite) і вимірюють радіоактивність, зв'язану з мембранами, за допомогою рідинної сцинтиляційної спектрометрії. Рецептор 5-НТ1A Дослідження зв'язування виконують за модифікованою методикою, раніше описаною Clark et Хроматографія: суміш етилацетат/метанол, al. [J. Med. Chem., 1990, 33, 633], як це наведено 7:3. нижче. Вихід: 30%; температура плавлення 176Кору головного мозку гомогенізують в 10 об'188°С. 1 ємах льодяного Tris буфера (50мМ Tris-HCI, pH 7,7 Н-ЯМР (CDCI3, d): 1,19-1,74 (м, 12Н, -(СН2)4-, при 25°С) і центрифугують при 28000´g протягом Н6ах, Н7ах, Н 8ах, Н6ес), 1,95-2,00 (м, 1Н, Н7ес), 2,1715 хвилин. Осад мембран двічі відмивають шля2,22 (м, 1Н, Н8ес), 2,76 (т, 2Н, J= 7,1 Гц, CH2NH), хом ресуспендування та центрифугування. Після 2,81-2,86 (м, 1Н, Н5ах), 3,06 (уширений с, 1Н, NH), другого відмивання ресуспендований осад інкубу3,48 (т, 2Н, J = 7,3 Гц, NCH 2), 3,72 (дд, 1Н, J = 11,9, ють при 37°С протягом 10 хвилин. Потім мембрани 4,3 Гц, Н8а), 4,14-4,19 (м, 3Н, СН2Аr, Н5ес), 7,46 (д, збирають центрифугуванням і кінцевий осад ре1Н, J= 8,5 Гц, Н3`), 7,49-7,55 (м, 1Н, Н6`), 7,68-7,74 суспендують у буфері (50мМ Tris-HCI, 5мМ MgSO4 (м, 1Н, Н7`), 7,81 (дд, 1Н, J = 8,2, 1,1 Гц, Н 5`), 8,06 і 0,5мМ EDTA; pH 7,4 при 37°С). Порції кінцевої (д, J = 8,5 Гц, 1Н, Н 4`), 8,13(д, 1Н, J=8,4 Гц, Н8`), 13 суспензії мембран по 100мкл (близько 1мг білка) С-ЯМР (CDCI3, d): 22,7, 24,9, 26,3, 26,6, 27,8, інкубують при 37°С протягом 15 хвилин з 0,6нМ 28,0, 29,0 (-(СН2)4-, С6, С7, С8), 38,4 (NCH2), 39,2 [3H]-8-OH-DPAT (133 К/ммоль) у присутності дослі(С5), 49,2 (CH2NH), 54,6 (СН2Аr), 57,2 (С8а), 120,3 джуваного препарату або без нього, в кінцевому (С3`), 126,2 (С6`), 127,3, 127,5 (С5`, С8`), 128,9, 129,6 об'ємі 1,1мл буфера дослідження (50мМ Tris-HCI, (С4`, С7`), 136,7 (С4`а), 147,5 (С8`а), 154,5 (С2`), 158,2 10нМ клонідину, 30нМ празозину, pH 7,4 при (С3), 173,2 (С1), 37°С). Неспецифічне зв'язування визначають за Обчислено для: С23Н30NО2×2НСІ×3/2Н2О: С, допомогою 10мкМ 5-НТ. 55,87; Н, 7,13; N, 11,33, Рецептор 5-НТ2A Знайдено: С, 55,77; Н, 7,09; N, 10,77. Дослідження зв'язування виконують за модиПриклад 39. Дослідження радіолігандного зв'яфікованою методикою, раніше описаною Titeler et зування. al. [Biochem. Pharmacol., 1987, 36, 3265], як це наСпорідненість in vitro сполук за даним винаховедено нижче. Лобову кору гомогенізують в 60 дом до церебральних рецепторів 5-НТ1A, 5-НТ 2A, 5об'ємах льодяного буфера (50мМ Tris-HCI, 0,5мМ НТ3, 5-НТ4, 5-НТ7, a 1 та D2 оцінюють за допомогою Na2EDTA, 10мМ MgSO4 , pH 7,4 при 25°С), і досліджень радіолігандного зв'язування. Викорисцентрифугують при 30000´g протягом 15 хвилин товують такі специфічні ліганди та тканини: при 4°С. Осад мембран відмивають за допомогою * 5-НТ1A рецептори, [3H]-8-OH-DPAT, кора горесуспендування та центрифугування. Після друловного мозку пацюків; гого відмивання ресуспендований осад інкубують * 5-НТ2А рецептори, [3Н]кетансерин, кора голопри 37°С протягом 10 хвилин. Мембрани потім вного мозку пацюків; збирають центрифугуванням і кінцевий осад ре* 5-НТ3 рецептори, [3H]LY 278584, кора голосуспендують в 10 об'ємах буфера дослідження вного мозку пацюків; 3 (50мМ Tris-HCI, 0,5мМ Na2EDTA, 10мМ MgSO4, * 5-НТ4 рецептори, [ H]GR 113808, смугасте ті0,1% аскорбінової кислоти, 10мкМ паргіліну, pH 7,4 ло мозку пацюків; при 25°С). Порції кінцевої суспензії мембран по * 5-НТ7 рецептори, [3Н]-5-СТ, гіпоталамус па100мкл (близько 5мг/мл білка) інкубують при 37°С цюків; протягом 15 хвилин з 0,4нМ [3Н]кетансерину, в * a 1 рецептори, [3Н]празозин, кора головного присутності досліджуваного препарату або без мозку пацюків; нього, у кінцевому об'ємі 2мл буфера дослідження. 33 83116 34 Неспецифічне зв'язування визначають за допомо0,01мМ паргіліну та 3мкМ піндололу). Неспецифічгою 1мкМ цинансерину. не зв'язування визначають за допомогою 10мкМ 5Рецептор 5-НТ3 НТ. Дослідження зв'язування виконують за модиРецептор a 1 фікованою методикою, раніше описаною Wong et Дослідження зв'язування проводять за модиal. [Eur. J. Pharmacol., 1989, 166, 107], як це навефікованою методикою, раніше описаною Ambrosio дено нижче. et al. [Neurosci. Lett, 1984, 49, 193], як це наведено Кору головного мозку гомогенізують в 9 об'нижче. Кору головного мозку гомогенізують в 20 ємах 0,32М льодяної сахарози та центрифугують об'ємах льодяного буфера (50мМ Tris-HCI, 10мМ при 1000´g протягом 10 хвилин при 4°С. СупернаMgCI2, pH 7,4 при 25°С) і центрифугують при тант центрифугують при 17000´g протягом 20 30000´g протягом 15 хвилин. Осад відмивають хвилин при 4°С. Осад мембран відмивають двічі двічі за допомогою ресуспендування та центрифушляхом ресуспендування в 60 об'ємах 50мМ льогування. дяного Tris-HCI буфера (pH 7,4 при 25°С) і Кінцевий осад ресуспендують у такому ж буфері. Порції кінцевої суспензії мембран (близько центрифугування при 48000´g протягом 10 хвилин 250мкг білка) інкубують при 25°С протягом 30 хвипри 4°С. Після другого відмивання ресуспендований осад інкубують при 37°С протягом 10 хвилин і лин з 0,2нМ [3Н]-празозину (23 Кі/ммоль), у присутності шестикратної концентрації конкуруючого центрифугують при 48000´g протягом 10 хвилин препарату або без нього, в кінцевому об'ємі 2мл при 4°С. Мембрани ресуспендують в 2,75 об'ємах буфера. Неспецифічне зв'язування визначають за буфера дослідження (50мМ Tris-HCI, 10мкМ паргідопомогою 10мкМ фентоламіну. ліну, 0,6мМ аскорбінової кислоти та 5мМ СаСІ2, pH Рецептор D2 7,4 при 25°С). Дослідження зв'язування виконують за модиПорції кінцевої суспензії мембран по 100мкл фікованою методикою, раніше описаною Leysen et (близько 2мг/мл білка) інкубують при 25°С протяal. [Biochem. Pharmacol., 1978, 27, 307], як це нагом 30 хвилин з 0,7нМ [3H]L Y 278584, у присутності ведено нижче. Смугасте тіло гомогенізують в досліджуваного препарату або без нього, в кінце50мМ Tris-HCI (p 7,7 при 25°С) і центрифугують вому об'ємі 2мл буфера дослідження. Неспецифіпри 48000´g протягом 10 хвилин. Осад ресуспенчне зв'язування визначають за допомогою 10мкМ дують і центрифугують, як перед цим. Кінцевий 5-НТ. осад ресуспендують в 50мМ Tris-HCI (pH 7,7 при Рецептор 5-НТ4 25°С), що містить 120мМ NaCI, 5мМ КСІ, 2мМ СаДослідження зв'язування виконують за модиСІ2, 1мМ МgСІ2 та 0,1% аскорбінової кислоти. Порфікованою методикою, раніше описаною ції кінцевої суспензії мембран (125-150мг білка) Grossman et al. [Br. J. Pharmacol., 1993, 109, 618], інкубують при 25°С протягом 60 хвилин з 0,8нМ як це наведено нижче. Смугасте тіло гомогенізу[3Н]раклоприду (77Кі/ммоль), у присутності шестиють в 15 об'ємах 50нМ льодяного HEPES буфера кратної концентрації конкуруючої сполуки або без (pH 7,4 при 4°С) і центрифугують при 48000´g неї, в кінцевому об'ємі 1,1мл буфера дослідження протягом 10 хвилин. Осад ресуспендують в 20 (pH 7,4 при 25°С). Неспецифічне зв'язування виоб'ємах буфера дослідження (50мМ HEPES, pH значають за допомогою 1мкМ (+)-бутакламолу. 7,4 при 25°С). Порції кінцевої суспензії мембран по В усіх дослідженнях зв'язування конкуруючого 100мкл (близько 5мг/мл білка) інкубують при 37°С препарату, неспецифічне, загальне та радіоліганпротягом 30 хвилин з 0,1нМ [3H]GR 113808, у придне зв'язування визначають по три рази. Інкубацію сутності досліджуваного препарату або без нього, зупиняють швидкою вакуумною фільтрацією через в кінцевому об'ємі 1мл буфера дослідження. Нефільтри Whatman GF/B, попередньо оброблені в специфічне зв'язування визначають за допомогою 0,05% поліетиленіміні, за допомогою клітинного 30мкМ 5-НТ. харвестера Brandel. Фільтри потім відмивають у Рецептор 5-НТ7 буфері дослідження, висушують і поміщають в Дослідження зв'язування виконують за модиполіетиленові пробірки, до яких додають 4мл сцифікованою методикою, раніше описаною Aguirre et нтиляційного коктейлю (Aquasol). Радіоактивність, al. [Eur. J. Pharmacol., 1998, 346, 181], як це навезв'язану з фільтрами, вимірюють за допомогою дено нижче. Гіпоталамус гомогенізують в 5мл льорідинної сцинтиляційної спектрометрії. Дані аналідяного Tris буфера (50мМ Tris-HCI, pH 7,4 при зують за допомогою ітеративної методики апрок25°С) і центрифугують при 48000´g протягом 10 симації кривої по точках (програма Prism, Graph хвилин. Осад мембран відмивають за допомогою Pad), яка дає значення ІС 50, Кі та г2 для тестованих ресуспендування та центрифугування, потім респолук, причому значення Кі розраховуються за суспендований осад інкубують при 37°С протягом рівнянням Ченга-Прусофа (Cheng-Prusoff). Конце10 хвилин. Потім мембрани збирають центрифугунтрації білка в корі головного мозку пацюків і смуванням і кінцевий осад ресуспендують в 100 об'гастому тілі мозку пацюків визначали за методом ємах 50мМ льодяного буфера (Tris-HCI, 4мМ СаЛоурі, використовуючи як стандарт альбумін бичаСІ2, 1мг/мл аскорбінової кислоти, 0,01мМ паргіліну чої сироватки. та 3мкМ піндололу) в умовах pH 7,4 при 25°С. Результати: Порції кінцевої суспензії мембран по 400мкл інкуВсі тестовані сполуки демонструють високу бують при 23°С протягом 120 хвилин з 0,5нМ [3Н]спорідненість до рецептора 5-НТ1A зі значеннями 5-СТ (88 Кі/ммоль), у присутності декількох концеКі від 0,5 до приблизно 100нМ. Більшість сполук нтрацій досліджуваного препарату або без нього, в зв'язуються з рецептором 5-НТ1А зі спорідненістю кінцевому об'ємі 0,5мл буфера дослідження (Trisменше 30нМ. Також більшість сполук проявляють HCI, 4мМ СаСІ2, 1 мг/мл аскорбінової кислоти, 35 83116 36 високу вибірковість по відношенню до рецепторів їжі та води не обмежують. Всі експерименти про5-НТ1A у порівнянні з 5-НТ2A, 5-НТ3, 5-НТ4 і дофаводять між 9.00 та 14.00. Тест складається із ввеміновими рецепторами. дення зонда на 1,5см в пряму кишку тварини проПриклад 40. Функціональна характеристика. тягом 40 секунд для виміру базальної Клітинна культура та визначення рівня цАМФ температури, яка приймалася за нульову часову після стимуляції ферменту аденілатциклази форсоцінку експерименту. Безпосередньо після цього коліном. тестовані сполуки вводять підшкірно (п/ш) і виміКлітини лінії HeLa, трансфековані людським рюють ректальну температуру через різні проміжрецептором 5-НТ1А (клітини НА 6), вирощують в ки часу: 15, 30, 60, 120 та 240 хвилин. Експери75мл колбах, що містять 20мл модифікованого за мент показує, що тестовані сполуки є агоністами 5Дульбеко середовища Ігла (DMEM) з додаванням НТ1А, про що свідчать значення мінімальної ефек10% фетальної телячої сироватки, 500 одиниць тивної дози та одержувана гипотермічна дія. пеніциліну та 500мкг стрептоміцину/мл (P/S) і Приклад 41. Нейропротекторні дослідження in 0,3мг/мл генетицину. За 48 годин до експерименту vitro. Нейротоксичність, викликана гіпоксією/гіпоглікемією. клітини висівають зі щільністю 75´103 клітин в Визначають здатність запобігати нейротоксич1,5мл середовища DMEM-P/S-фетальна теляча ності, викликаній гіпоксією/гіпоглікемією у первинсироватка-генетицин на 12 багатолункових плашках. В день експерименту клітини обробляють них культурах гіпокампа пацюків (Е18). Для приготування культур препарують мозок плода, 0,5мМ 1-метил-3-ізобутилксантину (ІВМХ), 10мкМ відокремлюючи мозкові оболонки, гіпокамп диспефорсколіну та носієм або різними концентраціями ргують в нейробазальному (neurobasal) середодосліджуваних сполук в інкубаторі з 5% СО2 при вищі з додаванням В-27. Після центрифугування 37°С. Через 10 хвилин обробку зупиняють і клітини лізують в 65% розчині етанолу протягом 2 годин, при 700´g осад механічно редиспергують. Виміпотім етанол збирають і випарюють при 55°С, зарюють щільність клітинної суспензії та відбирають лишаючи осад із цАМФ. Зразки аналізують за доаліквоти в культур у на чашках Петрі, попередньо помогою комерційного набору для радіоімунного оброблених полілізином, використовуючи те ж аналізу (PIA) ([ 3Н]сАМР assay system, cod. TRK саме середовище. Культур у поміщають в інкуба432; Amersham). Білок вимірюють за методикою тор при 37°С в атмосфері 95% повітря/5% СО2. Bradford. Ізотерми конкурентного зв'язування анаЧерез 10 днів чашки переносять в середовищі, що лізують за допомогою ітеративної методики апрокне містить глюкози, до камери, де їх витримують 2 симації кривої по точках (програма Origin 7.0), що години в атмосфері 95% N2/5% СО2. Перед провевидає значення ЕС50 для тестованих сполук. денням гіпоксії додають досліджувані сполуки в Експеримент показує, що тестовані сполуки різний час і з різними концентраціями. значно пригнічують утворення цАМФ у клітинах Нейротоксичність, обумовлена депривацією HeLa, більшість сполук діє як повні, а деякі - як трофічних факторів. часткові агоністи. Було також досліджено запобігання загибелі Визначення ректальної температури у мишей. клітин з характеристиками апоптозу, що відбуваАгоністи рецепторів 5-НТ1A, такі як, наприклад, ється після утримування гіпокампальних культур у 8-OH-DPAT, знижують температуру тіла у гризунів. безсироватковому середовищі протягом 48 годин Цей ефект на мишах, очевидно, обумовлений ак[Koh et al., Science, 1995, 268, 573]. У цьому випадтивацією соматодендритичних рецепторів [De Vry, ку спочатку застосовують середовище Ігла Psychopharmacology 1995, 121, 1] оскільки засто(DMEM) модифіковане 10% телячої сироватки, а сування протягом двох тижнів інгібітора триптофачерез 10 днів культури переносять у середовище нгідроксилази, такого як парахлорфенілаланін, або DMEM, позбавлене телячої сироватки. ушкодження селективним нейротоксином серотоВ обох випадках як індекс токсичності розглянінергічних нейронів, таким як 5,7дали результати вимірів мітохондріальної дегідродигідрокситриптамін (5,7-DHT) повністю блокує генази на 3-(4,5-диметилтіазол-2-іл)-2,5гіпотермічну дію на мишей. дифенілтетразолійбромід (МТТ) з наступним колоУ тесті, проведеному зі сполуками за даним риметричним визначенням утвореного формазану, винаходом, вивчали групу з 8-10 мишей, на яких що дозволяє визначити індекс виживання клітин випробовували щонайменше 4 дози досліджува(Nonaka et al., Proc. Natl. Acad. Sei. USA, 1998, 95, них сполук. Тварин утримують в середовищі з кон2642). трольованою температурою та освітленням Одержані результати наведені в нижче у таб(25±1°С, освітлення з 8.00 до 20.00). Споживання лиці. 37 83116 38 Таблиця 1 Протекторна дія (%) Депривація сироватки Депривація глюкози-кисню 44,0 ±1,4 54,0 ±3,5 31,0 ±2,9 77,5 ± 8,6 25,9 ±2,5 ND 10,7 ±2,4 55,8 ±12,5 19,0 ±3,3 42,0 ±7,8 13,0 ±4,3 65,6 ±4,8 15,5 ±2,2 78,0 ±6,5 29,6 ±2,8 78,0 ±6,8 36,0 ±3,2 35,0 ±7,0 32,0 ±4,0 32,0 ±8,0 Сполука 8-OH-DPAT (-)-BAY´3702 (±)-BAY´3702 А В С D Е F G Приклад 42. Нейропротекторні дослідження in vi vo. Модель фокальної ішемії у пацюків. Внутрішньопросвітну оклюзію серединної мозкової артерії (СМА) у пацюків здійснюють за раніше описаною методикою [Justicia et al., J. Cereb. Blood Flow Metab., 1999, 19, 128], як це наведено нижче. Пацюків анестезують галотаном, підтримуючи їхню температуру на рівні 37,5°С за допомогою електроковдри, з'єднаної з ректальним зондом, і катетеризують ліву сте гнову артерію для відстежування артеріального тиску. Виділяють, праву сонну артерію, перекривають екстракраніальні гілки, і уводять затуплений поліамідний джгут через зовнішню сонну артерію до рівня відгалуження серединної мозкової артерії (СМА). Вибрані сполуки вводять внутрішньовенно. Через 24 години після ішемічного ушкодження пацюкам дають ефірний наркоз, роблять перфузію фізіологічним розчином, а потім декапітують, витягають головний мозок, з якого роблять коронарні зрізи із кроком 1,5мм. Зрізи потім інкубують в 4% трифенілтетразолійхлориді (ТТС), який взаємодіє з інтактними мітохондріальними ферментами з появою червоного забарвлення, що контрастує із блідістю зони інфаркту, дозволяючи побачити останню, а потім поміщають до 10% розчину формаліну. Об'єм інфаркту мозку (у мм 3) підраховують шляхом вимірювання (за допомогою аналізатора зображень) ураженої зони в області кори мозку, що постачається кров'ю з СМА, і в смугастому тілі, та множення середніх одержаних значень в кожному зрізі на його товщину. Внутрішньовенна інфузія 40мкг/кг сполуки (e) протягом 4 годин значно знижує об'єм інфаркту мозку у пацюків після внутрішньопросвітної оклюзії СМА. Протекторний ефект спостерігається в корі, але не в підкіркових стр уктура х, і не викликає зміни артеріального тиску. У Таблиці 2 наведені значення об'єму інфаркту при введенні фізіологічного розчину, стандартної сполуки (-)-BAY´3702 та сполуки (Е). Таблиця 2 Сполука Фізіологічний розчин (-)-BAY´3702 e Доза 40мкг/кг 40мкг/кг Загальний 546,4 ±51,1 376,7 ± 57,8* 386,7 ±47,1* Об'єм інфаркту (мм 3) Кора Підкіркові структури 399,2 ± 37,5 147,2 ±23,4 271,2 ±54,7* 105,5 ±9,3 262,7 ±40,9* 124,0 ±14,3 * р
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of cycloalkanediones with neuroprotective activity
Автори англійськоюLopez Rodriguez Maria Luz, Benhamu Salama Bellinda, Del Rio Zambrana Joaquin, Frechilla Manso Diana, Marco Martinez Isabel
Назва патенту російськоюЦиклоалкандионовые производные с нейропротекторной активностью
Автори російськоюЛопес Родригес Мария Лус, Бенаму Салама Беллинда, Дель Рио Самбрана Хоакин, Фречилья Мансо Диана, Марко Мартинес Изабель
МПК / Мітки
МПК: C07D 277/34, C07D 417/04, A61K 31/4188, C07D 487/04, A61K 31/427, C07D 417/12
Мітки: похідні, активністю, нейропротекторною, циклоалкандіонові
Код посилання
<a href="https://ua.patents.su/19-83116-cikloalkandionovi-pokhidni-z-nejjroprotektornoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Циклоалкандіонові похідні з нейропротекторною активністю</a>
Попередній патент: Ферментатор
Наступний патент: Спосіб викінчувальної обробки
Випадковий патент: Спосіб теплозвукоізоляції рулонних покриттів підлоги












