Похідні 4,5-дигідро-1н-піразолу з антагоністичною активністю щодо св1
Номер патенту: 78523
Опубліковано: 10.04.2007
Автори: Ланге Йозефус Х.М., Тіпкер Якобус, ван Стюйвенберг Герман Г., Герреманс Арнольдус Г.Й., Крузе Корнеліс Г.
Формула / Реферат
1. Сполуки загальної формули (І)
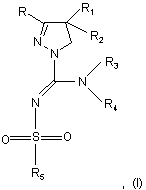
де
R та R1 незалежно один від одного представляють феніл, тієніл або піридил, причому ці групи можуть бути заміщені 1, 2, 3 або 4 замісниками Y, що можуть бути однакові або різні, з групи, що містить С1-3-алкіл або алкокси, гідрокси, галоген, трифторметил, трифторметилтіо, трифторметокси, нітро, аміно, моно- чи діалкіл(С1-2)аміно, моно- чи діалкіл(С1-2)амідо, (С1-3)алкілсульфоніл, диметилсульфамід, С1-3-алкоксікарбоніл, карбоксил, трифторметилсульфоніл, ціан, карбамоїл, сульфамоїл та ацетил, або R та/або R1 представляють нафтил,
- R2 представляє водень, гідрокси, С1-3-алкокси, ацетилокси або пропіонілокси,
- R3 представляє атом водню або розгалужену або нерозгалужену C1-8 алкільну групу, або С3-7 циклоалкільну групу, причому алкільна або циклоалкільна група може бути заміщена гідроксигрупою,
- R4 представляє С2-10 розгалужену або нерозгалужену гетероалкільну групу, С3-8 неароматичну гетероциклоалкільну групу або С4-10 неароматичну гетероциклоалкілалкільну групу, причому ці групи містять один або більше гетероатомів з групи (О,N,S) або групи -SO2-, а С2-10 розгалужена або нерозгалужена гетероалкільна група, С3-8 неароматична гетероциклоалкільна група або С4-10 неароматична гетероциклоалкілалкільна група можуть бути заміщені кетогрупою, трифторметильною групою, С1-3алкільною групою, гідрокси, аміно, моноалкіламіно або діалкіламіногрупою або атомом фтору, або R4 представляє аміно, гідрокси, фенокси або бензилоксигрупу, або R4 представляє C1-8 алкокси, С3-8 алкеніл, С5-8 циклоалкенільну або С6-9 циклоалкенілалкільну групу, і ці групи можуть містити атом сірки, азоту чи кисню, кетогрупу або групу –SO2-, причому алкокси, алкенільна й циклоалкенільна групи можуть бути заміщені гідроксигрупою, трифторметильною групою, аміногрупою, моноалкіламіногрупою чи діалкіламіногрупою або атомом фтору, або R4 представляє C2-5 алкільну групу, яка містить атом фтору, або R4 представляє імідазолалкільну групу, бензильну, піридилметильну, фенетильну чи тієнільну групу, або R4 представляє заміщену фенільну, бензильну, піридильну, тієнільну, піридилметильну або фенетильну групу, де ароматичні кільця заміщені 1, 2 або 3 з замісників Y, де Y має значення, наведені вище,
або, якщо R3 є Н чи метил, R4 може представляти групу NR6R7, де R6 та R7 є однакові або різні й представляють C2-4 алкіл, C2-4 трифторалкіл, або R6 представляє метильну групу за умови, що R7 представляє C2-4 алкільну групу, або R6 та R7 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену гетероциклічну групу з 4-8 кільцевими атомами, причому гетероциклічна група може містити атом кисню чи сірки, або кетогрупу або групу -SO2- та додатковий атом азоту, і насичена або ненасичена гетероциклічна група може бути заміщена С1-4 алкільною групою, або
- R3 та R4 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну гетероциклічну групу з 4-10 кільцевими атомами, яка може містити один або більше атомів з групи (O,N,S), або кетогрупу, або групу –SO2- і яка може бути заміщена С1-4 алкіл, гідроксіалкіл, феніл, тієніл, піриділ, аміно, моноалкіламіноалкіл, діалкіламіноалкіл, моноалкіламіно, діалкіламіно, аміноалкіл, азетидиніл, піролідиніл, піперидиніл або гексагідро-1Н-азепінілгрупою,
- R5 представляє бензил, феніл, тієніл або піридил, які можуть бути заміщені 1, 2, 3 або 4 замісниками Y, де Y має значення, що наведені вище, й вони можуть бути однакові або різні, або R5 представляє C1-8 розгалужений чи нерозгалужений алкіл, С3-8 алкеніл, С3-10 циклоалкіл, С5-10 біциклоалкіл, С6-10 трициклоалкіл чи C5-8 циклоалкеніл, або R5 представляє нафтил, та їхні таутомери, пролікарські форми, стереоізомери й солі.
2. Фармацевтична композиція, яка містить фармацевтично ефективну кількість принаймні одної зі сполук за п.1 як діючу речовину.
3. Спосіб приготування фармацевтичної композиції за п. 2, який відрізняється тим, що сполуці за п. 1 надають форму, придатну для введення до організму.
4. Застосування сполук за п. 1 для приготування фармацевтичної композиції для лікування розладів, пов'язаних з нейротрансмісією канабіноїдів.
5. Застосування за п. 4, яке відрізняється тим, що зазначеними розладами є психічні розлади, як-то психози, збентеженість, депресія, дефіцит уваги, розлади пам'яті, пізнавальні розлади, розлади апетиту, опасистість, згубні звички, гіперсексуальність, наркозалежність, неврологічні розлади, як-то недоумство, дистонія, м'язова еластичність, дрижавка, травматичне пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, епілепсія, хвороба Гантінгтона, синдром Турета, церебральна ішемія, церебральна апоплексія, черепно-мозкова травма, удар, пошкодження хребта, нейрозапалювальні хвороби, бляшковий склероз, вірусний енцефаліт, хвороби, пов'язані з демієлінізацією, а також для лікування болів, включаючи невропатичні больові прояви, та інших хвороб, що пов'язані з нейротрансмісією канабіноїдів, як-то септичний шок, глаукома, рак, діабет, блювання, нудота, астма, респіраторні захворювання, шлунково-кишкові розлади, виразка шлунку, діарея та серцево-судинні розлади.
Текст
Винахід стосується групи нових похідних 4,5-дігідро-1Н-піразолу, способів одержання таких сполук та фармаційних композицій, що містять одну або більше з таких сполук в якості діючої речовини. Зазначені 4,5-дігідро-1Н-піразоли є сильнодіючими антагоністами рецепторів канабіноідів (СВ1) і придатні до лікування захворювань, пов'язаних з розладами канабіноідної системи. Канабіноіди знаходяться у індійських коноплях Cannabis sativa L й використовуються у медицині протягом століть (Mechoulam R., Fegenbaum J.J., Prog Med Chem 1987, 24, 159). Втім, лише в останньому десятиріччі досліди канабіноідів висвітлили ключові дані щодо рецепторів канабіноідів та їхніх (ендогенних) агоністів та антагоністів. Відкриття та наступне клонування двох різних підтипів рецепторів канабіноідів (СВ1 та СВ2) стимулювали пошуки нових антагоністів рецепторів канабіноідів (Munro S. et al., Nature 1993, 365, 61, Matsuda L.A., Bonner Τ.I., Cannabmoid Receptors, Pertwee R.G.Ed., 1995, 117, Academic Press, London). Крім того, фармаційні фірми зацікавилися розробкою ліків для хвороб, пов'язаних з розладами канабіноідної системи. Велике поширення рецепторів СВ1 у мозку поряд з суворо периферійною локалізацією рецепторів СВ2 робить рецептори СВ1 дуже привабливою молекулярною мішенню для розробки спрямованих на ЦНС ліків від психічних та нервових розладів (Consroe Ρ., Neurobiology of Disease 1998, 5, 534, Pop Ε., Curr Opin in CPNS Investigational Drugs 1999, 1, 587, Greenberg D.A., Drug News Perspect 1999, 12, 458, Pertwee R.G., Progress in Neurobiology, 2001, 63, 569). Наразі відомі кілька типів антагоністів рецепторів СВ1 Фірма "Санофі" встановила, що деякі з її діарилпіразолів діють як селективні антагоністи рецепторів СВ 1. Прикладом може бути SR141716A, який зараз проходить другу фазу клінічних випробувань проти психічних розладів (Dutta А.K. et al., Med Chem Res 1994, 5, 54, Lan R. et al., J. Med Chem 1999, 42, 769, Nakamura-Palacios Ε.Μ. et al., CNS Drug Rev. 1999, 5, 43) CP-272871 - це похідне піразолу, подібне до SR-141716А, але менш сильнодіюче й менш селективне до підтипів рецепторів СВ1, ніж SR-141716А (Meschler J.P. et al., Biochem Pharmacol 2000, 60, 1315). Встановлено, що антагоністами рецепторів СВ1 є аміноалкіліндоли. Прикладом є іодоправадолін (АМ630), впроваджений 1995р. АМ-630 є антагоністом рецепторів СВ1, але іноді поводиться як частковий агоніст (Hosohata K. et al., Life Sc 1997, 61, PL115) Пізніше дослідники фірми "Елі Лілі" описали арил-ароілзаміщені бензофурани як селективні антагоністи рецепторів СВ1 (наприклад, LY-320135) (Felder С.С. et al., Pharmacol. Exp. Ther. 1998, 284, 291). Нещодавно з'явилися повідомлення, що 3-алкіл-5,5'-діфенілімідазолщиндюни - це ліганди рецепторів канабіноідів з ознаками антагонізму до канабіноідів (Kаnуоnуо Μ. et al., Bioorg Med Chem Lett 1999, 9, 2233). Фірма "Авентіс-Фарма" заявила аналоги діарилметиленазетидіну як антагоністи рецепторів СВ1 (Vsgnani S. et al., FR 2783246, Chem Abstr 2000, 132,236982). Трициклічні піразоли зявлені фірмою "Санофі-Синтелабо" як антагоністі СВ1 (Barth F. et al., WO 0132663, 2001, Chem Abstr 2001, 134, 340504). Цікаво, що багато з антагоністів рецепторів СВ1 поводяться як зворотні агошсти in vitro (Landsman R.S. et al., Eur. J. Pharmacol 1997, 334, R1). В останніх публікаціях містяться непогані огляди сучасного стану досліджень у галузі канабіноідів (Mechoulam R. et al., Prog Med Chem 1998, 35, 199, Lambert D.Μ., Curr Med Chem 1999, 6, 635, Mechoulam R. et al., Eur J. Pharmacol 1998, 359, 1, Williamson Ε.Μ. and Evans F.J., Drugs 2000, 60, 1303, Pertwee R.G., Addiction Biology 2000, 5, 37, Robson Ρ., Br.J.Psychiatry 2001, 178, 107, Pertwee R.G., Prog.Neurobiol., 2001, 63, 569; Goya P. and Jagerovic N., Exp. Opin.Ther.Patents 2000, 10, 1529; Pertwee R.G., Gut 2001, 48, 859). Нами несподівано виявлено, що сильнодіючий та вибірковий антагонізм до рецепторів канабіноїдів СВ1 виявляють нові похідні 4,5-дігідро-1Н-піразолу формули (І), їхні пролікарські форми, таутомери та солі (І) де - R та R1 незалежно один від одного представляють феніл, тієніл або піриділ, причому ці групи можуть бути заміщені 1, 2, 3 або 4 замісниками Y, що можуть бути однакові або різні, з групи, що містить С1-3-алкіл або алкоксі, гідроксі, галоген, трифторметил, трифторметилтіо, трифторметоксі, нітро, аміно, моно- чи діалкіл(С12)аміно, моно- чи діалкіл(С1-2) амідо, (С1-3)алкілсульфоніл, діметилсульфамід, С1-3-алкоксікарбоніл, карбоксил, трифторметилсульфоніл, ціан, карбамоїл, сульфамоїл та ацетил, або R та/або R1 представляють нафтил, - R2 представляє водень, гідроксі, С1-3-алкоксі, ацетилоксі або пропіонилоксі, - R3 представляє атом водню, або розгалужену або нерозгалужену С 1-8-алкільну групу, або С3-7циклоалкільну групу, причому алкільна або циклоалкільна група може бути заміщена гідроксігрупою, - R4 представляє С2-10-розгалужену або нерозгалужену гетероалкільну групу, С3-8неароматичну гетероциклоалкільну групу або С4-10 неароматичну гетероциклоалкіл-алкільну групу, причому ці групи містять один або більше гетероатомів з групи (O,N,S) або групи -SO2-, а С2-10 розгалужена або нерозгалужена гетероалкільна група, С3-8 неароматична гетероциклоалкільна група або С4-10 неароматична гетероциклоалкілалкільна група можуть бути заміщені кетогрупою, трифторметильною групою, С1-3 алкільною групою, гідроксі, аміно, моноалкіламіно або діалкіламіногрупою або атомом фтору, або R4 представляє аміно, гідроксі, феноксі або бензилоксігрупу, або R4 представляє C1-8 алкоксі, С3-8 алкеніл, С5-8 циклоалкенільну або С6-9 циклоалкенілалкільну групу, і ці групи можуть містити атом сірки, азоту чи кисню, кетогрупу або групу -SO2-, причому алкоксі, алкенільна й циклоалкенільна групи можуть бути заміщені гідроксігрупою, трифторметильною групою, аміногрупою, моноалкіламіногрупою чи діалкіламіногрупою або атомом фтору, або R4 представляє С2-5 алкільну групу, яка містить атом фтору, або R4 представляє імідазолалкільну групу, бензильну, піриділметильну, фенетильну чи тієнільну групу, або R4 представляє заміщену фенільну, бензильну, піридільну, тієнільну, піриділметильну або фенетильну групу, де ароматичні кільця заміщені 1,2 або 3 з замісників Y, де Υ має значення, що наведені вище, або, якщо R3 є Η чи метил, R4 може представляти групу NR6R7, де - R6 та R7 є однакові або різні й представляють С2-4 алкіл, С2-4 трифторалкіл, або R6 представляє метальну групу за умови, що R7 представляє С2-4 алкільну групу, або R6 та R7 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену гетероциклічну групу з 4-8 кільцевими атомами, причому гетероциклічна група може містити атом кисню чи сірки, або кетогрупу або групу -SO2- та додатковий атом азоту, і насичена або ненасичена гетероциклічна група може бути заміщена С1-4 алкільною групою, або - R3 та R4 разом з атомом азоту, до якого вони приєднані, утворюють насичену або ненасичену, моноциклічну або біциклічну гетероциклічну групу з 4-10 кільцевими атомами, яка може містити один або більше атомів з групи (O,N,S), або кетогрупу, або групу -SO2- і яка може бути заміщена С1-4 алкіл, гідроксіалкіл, феніл, тієніл, піриділ, аміно, мгноалкіламіноалкіл, діалкіламіноалкіл, моноалкіламіно, діалкіламіно, аміноалкіл, азетидиніл, піролидиніл, піперидиніл або гексагідро-1Н-азепініл-групою, - R5 представляє бензил, феніл, тієніл або піриділ, які можуть бути заміщені 1,2,3 або 4 замісниками Υ , де Υ має значення, що наведені вище, й вони можуть бути однакові або різні, або R5 представляє С1-8 розгалужений чи нерозгалужений алкіл, С3-8 алкеніл, С3-10 циклоалкіл, C5-10 біциклоалкіл, С6-10 трициклоалкіл чи С5-8 циклоалкеніл, або R5 представляє нафтил. У сполуках формули (І) присутній принаймні один центр хіральності (у позиції С4 4,5-дігідро-1H-піразольної частини). Винахід стосується як рацематів, так і сумішей діастереометрів і окремих стереометрів сполук формули (І). Особливо цікаві серед сполук формули (І) ті, що мають абсолютну стереоконфігурацію у позиції С4 4,5-дігідро-1H-піразольної частини, як зображено формулою (I а). (I a) Винахід також стосується Ε ізомерів, Ζ ізомерів та Ε/Ζ сумішей сполук формули (І) Сполукам за винаходом може бути надана форма, придатна для введення до організму, відомими способами з використанням допоміжних речовин та/або рідких або твердих носіїв. Завдяки сильнодіючій антагоністичній активності до СВ 1 сполуки за винаходом можуть використовуватися для лікування психічних розладів, як от психози, збентеженість, депресія, дефіцит уваги, розлади пам'яті та апетиту, опасистість, алкоголізм, гіперсексуальність, наркозалежність, нервових розладів, як от нейродегенеративні розлади, недоумство, дистонія, м'язова спастичність, дрижавка, епілепсія, розсіяний склероз, травматичне пошкодження мозку, інсульт, хвороба Паркінсона, хвороба Альцгеймера, хвороба Гантінгтона, синдром Турета, церебральна ішемія, церебральна апоплексія, черепно-мозкова травма, пошкодження хребта, нейрозапалювальні хвороби, бляшковий склероз, вірусний енцефаліт, хвороб, пов'язаних з деміелінізацією, а також для лікування болів, включаючи невропатичні больові прояви, та інших хвороб, що пов'язані з нейротрансмісією канабіноїдів, як от септичний шок, глаукома, рак, діабет, блювання, нудота, шлунково-кишкові розлади, виразка шлунку, діарея та серцево-судинні розлади. Спорідненість сполук за винаходом до рецепторів СВ 1 канабіноїдів визначалася за допомогою препаратів з мембран клітин яєчників китайського хом'яка, до яких стійко трансфектували людські рецептори СВ1 канабіноїдів з [3Н]СР-55,940 в якості радіоліганду. Після інкубації свіжо приготованих препаратів клітинних мембран з [3Н]-лігандом з доданням сполук за винаходом або без них зв'язаний та вільний ліганди розділяли фільтрацією на фільтрах із скловолокна. Радіоактивність фільтрів вимірювали лічильником рідинних сцинтиляцій. Антагоністична активність сполук за винаходом щодо СВ1 канабіноїдів визначалася функціональним дослідженням клітин яєчників китайського хом'яка, до яких були стійко впроваджені людські рецептори СВ1. Аденілилциклаза стимулювалася форсколином та вимірювалася шляхом квантифікації кількості циклічно накопиченого АМФ. Супутня активація рецепторів СВ1 агоністами рецепторів СВ1 (СР-55,940, (R)-WIN-55,2122) може пригнічувати викликане форсколином накопичення цАМФ у залежності від концентрації. Ця реакція за посередництвом рецепторів СВі може антагонізуватися антагоністами рецепторів СВ1, такими, як сполуки за винаходом. Проміжні сполуки формули (II) (див. далі) можна одержати відомими способами, наприклад: a) Francotte Ε. and Tong Z., Chem.Abstr., 126, 213598; b) Rempfler H. and Kunz W., Chem.Abstr. 113, 40432; c) Rempfler H. and Kunz W., Chem.Abstr. 107, 217473. Проміжні сполуки формули (III) (див. далі), де представляє водень, можна одержати відомими способами, наприклад: а) ЕР 0021506; b) DE 2529689; с) Grosscurt AC. et al., J.Agric.Food Chem., 1979, 27, (2), 406. Проміжні сполуки формули (III) (див.далі), де R2 представляє гідроксігрупу, можна одержати реакцією сполуки формули (II) (II) з гідразином або гідразингідратом. Цю реакцію переважно провадять в органічному розчиннику, наприклад, етанолі, і одержують сполуку формули (III): (III) Для синтезу сполук за винаходом придатні такі шляхи: Шлях синтезу А1 Етап 1: реакцію сполуки формули (III) з похідним тіоізоціанату формули (IV) (IV) переважно провадять в органічному розчиннику, наприклад, ацетонітрилі. Ця реакція дає похідне тіокарбоксаміду формули (V), де R, R1, R2 та R5 мають значення, що наведені вище для формули (І). (V) Етап 2: реакція сполуки формули (V) зі сполукою формули R3R4NH у присутності солі ртуті (II), наприклад, HgCl2, дає сполуку формули (І). Цю реакцію переважно провадять в органічному розчиннику, наприклад, ацетонітрилі. Шлях синтезу А2 Етап 1: реакція сполуки формули (III) (III) з похідним карбаматефіру формули (VI) (VI) де R8 представляє нижчу алкільну групу, наприклад, метил. Цю реакцію переважно провадять в органічному розчиннику, наприклад, 1,4-діоксані, й одержують похідне 4,5-дігідропіразол-1-карбоксаміду формули (VII), де R, R1, R2 та R5 мають значення, що наведені вище для сполуки (І). (VII) Етап 2: реакція, переважно в інертному органічному розчиннику, наприклад, хлорбензолі, сполуки формули (VII) з галогенуючим агентом, наприклад, РСl5, дає похідне 4,5-дігідропіразол-1карбоксімідоїлгалогениду формули (VIII), де R, R1, R2 та R5 мають значення, що наведені вище для сполуки (І), a R9 представляє атом галогену, наприклад, СІ. (VIII) Етап 3: реакція сполуки формули (VIII) із сполукою R3R4NH, переважно в інертному органічному розчиннику, наприклад, діхлорметані, дає сполуку формули (І). Або ж сполуки R3R4NH, що містять додатковий нуклеофільний атом азоту, реагують зі сполуками формули (VIII) таким чином, що зазначений додатковий нуклеофільний атом азоту захищено захисною групою, наприклад, трет-бутоксікарбонільною (Вос) групою або подібною. Подальше усунення захисної групи відомими способами дає сполуку формули (І). (Див., наприклад: T.W.Greene and P.G.M.Wuts, Protective Groups in Organic Synthesis, third edition, John Wiley and Sons, Inc., New York, 1999) Шлях синтезу A3 Етап 1: реакція сполуки формули (III) (III) з похідним дітіоімідокарбонового ефіру формули (IX) (IX) де R10 представляє C1-3 алкільну групу. Цю реакцію переважно провадять в органічному розчиннику, наприклад, ацетонітрилі або толуолі, й одержують похідне карбоксімідотіо-ефіру формули (X), де R, R1, R2 та R5 мають значення, що наведені вище для сполуки (І), а R10 представляє C1-3 алкільну групу. (X) Або ж сполуку формули (X) можна одержати реакцією сполуки формули (V) зі сполукою формули R10-X, де X представляє відщеплювану групу, наприклад, йодидну групу, a R10 має значення, що наведене вище для формули (І). Етап 2: Реакція, переважно в органічному розчиннику, наприклад, метанолі, сполуки формули (X) зі сполукою формули R3R4NH дає сполуку формули (І). Далі приготування сполук ілюструється наступними прикладами. Приклад 1 3-(4-хлорфеніл)-N’((4-хлорфеніл)сульфоніл)-N-(піперидин-1-іл)-4-феніл-4,5-дігідро-1H-піразол-1карбоксамідин Частина А: До розчину 2,99г (12,0ммолів) метилефіру N-((4-хлорфеніл)сульфоніл) карбамінової кислоти (CAS 34543-04-9) та 4мл піридину в 20мл 1,4-діоксану додають 3,39г (13,2ммолів) 3-(4-хлорфеніл)-4-феніл-4,5дігідро-1Н-піразолу й перемішують суміш 4 години при 100°С. Після концентрування у вакуумі осад розчиняють у діхлорметані, послідовно промивають водою, 1N HCl та водою, сушать над безводним Na2SO4, фільтрують та концентрують розчин у вакуумі до обсягу 20мл. Додають 60мл метил-трет-бутилефіру та концентрують розчин до обсягу 20мл. Одержані кристали відфільтровують та перекристалізують з метил-третбутилефіру, одержуючи 4,75г 3-(4-хлорфеніл)-N-((4-хлорфеніл)сульфоніл)-4-феніл-4,5-дігідро-1Н-піразол-1карбоксаміду (вихід 76%). Точка топлення 211-214°С. Частина В: Суміш 1,42г (3,00ммоля) 3-(4-хлорфеніл)-N-((4-хлорфеніл)сульфоніл)-4-феніл-4,5-дігідро-1Нпіразол-1-карбоксаміду та 0,63г (3,03ммоля) пентахлориду фосфору (РСl5) у 15мл хлорбензолу нагрівають 1 годину при температурі флегми. Після ретельного концентрування у вакуумі одержаний 3-(4-хлорфеніл)-N-((4хлорфеніл) сульфоніл)-4-феніл-4,5-дігідро-1Н-піразол-1-карбоксімідоїлхлорид суспендують у 30мл сухого діхлорметану та реагують з 1,08мл (10,0ммолів) 1-амінопіперидину. Після 16 годин перемішування при кімнатній температурі суміш двічі промивають водою та концентрують у вакуумі. Осад кристалізують з метилтрет-бутилефіру (МТБЕ) і одержують 0,57г чистого 3-(4-хлорфеніл)-N’-((4-хлорфеніл)сульфоніл)-N-(піперидин1-іл)-4-феніл-4,5-дігідро-1Н-піразол-1-карбоксамідину (вихід 34%). Точка топлення (ТТ) 213-214°С. МС ESI+ 556 (МН+). Аналогічно синтезові за прикладом 1 готують загалом 57 сполук формули (XI), що наводяться далі у таблиці 1 та переліку 1. (XI) Таблиця 1 № 2 3 4 5 6 7 8 9 10 R3 Η Η Η Η Η Η Η Η Η R4 Піперидин-1-іл Піролидин-1-іл Піролидин-1-іл Азепан-1-іл Ціс/транс-2,6-діметилпіперидин-1-іл 2,2,2-трифторетиламін Трет-бутоксі 2-пропоксі Метоксі R11 F СІ F СІ СІ СІ СІ СІ СІ Точка топлення, °С 189-190 190-195 197-199 110-146 149-151 194-196 142-145 МС ESI+ (МН+) Форма солі 540 542 526 545 503 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 Η Η Η Η Η Η СН3 Η Η Η Η Η Η Η Η Η СН3 С2Н5 Η Η Η Η Η Η СН3 Η Η Η Η СН3 Η Η Η Метоксі Морфолин-4-іл 2-(морфолин-4-іл)етил 2-(піперидин-1-іл)етил 2-(піролидин-1-іл)етил 2-(діметиламін)етил 2-(діметиламін)етил 2-(діметиламін)етил 2-(метиламін)етил 2-(етиламін)етил 3-(діметиламін)-2-метилпроп-2-іл (N-метилтролидин-2-іл)метил (N-метил піролидин-3-іл)метил 4-(піролідин-1-іл)бутил 3-(морфолин-4-іл)пропил 3-(діметиламін)пропил 3-(діметиламін)пропил 2-амінетил 3-(діметиламін)пропил 3-(1Н-імідазол-1-іл)пропил 2-аміноксіетил 2-(діметиламін)етоксі 2-(діетиламін)етоксі 2-(метоксі)етил 2-(ацетоксі)етил 2-гідроксіетил 2-гідроксіетил 2-гідроксі-2-метиопропил 3-гідроксіпропил Гідроксі Метоксі 2-фторетил 2-фторетил F СІ СІ СІ СІ F СІ СІ СІ СІ СІ СІ СІ СІ СІ СІ F СІ СІ СІ СІ СІ СІ СІ СІ F СІ СІ СІ СІ CF3 СІ CF3 487 213-216 137-139 168-169 155-157 168-170 63-68 HCl 530 544 572 HCl HCl 149-159 128-130 570 598 221-224 93 (розклад) 558 556 HCl HCl 105-109 542 HCl 201 210 99-102 157-158 532 560 588 573 501 517 129-132 208-211 178-180 100-103 132-134 Перелік 1 44. 3-(4-хлорфеніл)-N-метоксі-N’-((3-метилфеніл)сульфоніл)-4-феніл-4,5-дігідро-1Н-піразол-1карбоксамідин. ТТ 151-152°С. 45. 3-(4-хлорфеніл)-N-метоксі-N’-((2-метилфеніл)сульфоніл)-4-феніл-4,5-дігідро-1Н-піразол-1карбоксамідин. ТТ 145-146°С. 46. 3-(4-хлорфеніл)-N-метоксі-N’-((2,4,5-трифторфеніл)сульфоніл)-4-феніл-4,5-дігідро-1H-піразол-1карбоксамідин. ТТ 160-162°С. 47.3 -(4-хлортієн-2-іл)-N’-((4-хлорфеніл)сульфоніл)-N-метоксі-4-феніл-4,5-дігідро-1Н-піразол-1карбоксамідин. ТТ 180-181°С. 48. N’-((4-хлорфеніл)сульфоніл)-3-(4-фторфеніл)-N-метоксі-4-феніл-4,5-дігідро-1Н-піразол-1карбоксамідин. ТТ 201-203°С. 49. 3-(4-хлорфеніл)-N’-((4-хлорфеніл)сульфоніл)-N-метоксі-4-(3-трифторметил)феніл-4,5-дігідро-1Hпіразол-1-карбоксамідин. ТТ 80-83°С. 50.3 -(4-хлорфеніл)-N’-((4-хлорфеніл)сульфоніл)-N-метоксі-4-(2,6-діфторфеніл)-4,5-дігідро-1H-піразол-1карбоксамідин. ТТ 174-177°С. 51. 3-(4-хлорфеніл)-N’-((4-хлорфеніл)сульфоніл)-N-(2-фторетил)-4-(2,6-діфторфеніл)-4,5-дігідро-1Hпіразол-1-карбоксамідин. ТТ 153-155°С. 52. 3-(4-хлорфеніл)-N’-((4-хлорфеніл)сульфоніл)-N-(2-фторетил)-4-(3-фторфеніл)-4,5-дігідро-1H-піразол-1карбоксамідин. ТТ 130°С. 53. 3-(4-хлорфеніл)-N-(2-фторетил)-4-(3-фторфеніл)-N’-((4-(трифторметил)феніл) сульфоніл)-4,5-дігідро1H-піразол-1-карбоксамідин. ТТ 155°С. 54. 3-(4-хлорфеніл)-N’-((4-хлорфеніл)сульфоніл)-4-(3-фторфеніл)-N-(метоксі)-4,5-дігідро-1H-піразол-1карбоксамідин. Аморфний. 55. 3-(4-хлорфеніл)-4-(3-фторфеніл)-N-(метоксі)-N’-((4-(трифторметил)феніл)сульфоніл)-4,5-дігідро-1Hпіразол-1-карбоксамідин. ТТ>60°С. 56. 3-(4-хлорфеніл)-N’-((4-хлорфеніл)сульфоніл)-4-(2-фторфеніл)-N-(метоксі)-4,5-дігідро-1Н-піразол-1карбоксамідин. ТТ 162-164°С. 57. 3-(4-хлорфеніл)-4-(2-фторфеніл)-N-(метоксі)-N’-((4-(трифторметил)феніл)сульфоніл)-4,5-дігідро-1Нпіразол-1-карбоксамідин. ТТ 147-149°С. Аналогічним чином готують ще 29 сполук формули (XII). Вони перелічені далі у таблиці 2 та переліку 2. (XII) Таблиця 2 № 58 59 60 61 61 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 R11 СІ F F СІ F СІ F СІ СІ СІ СІ СІ СІ СІ F F F F СІ F СІ F F СІ СІ СІ СІ СІ R12 1,2,3,4-тетрагідроізохінолин-2-іл 1,2,3,4-тетрагідроізохінолин-2-іл Піролидин-1-іл Морфолин-4-іл Морфолин-4-іл Азетидин-1-іл Азетидин-1-іл 4-гідроксіпіперидин-1-іл 3-гідроксіпіперидин-1-іл 4-(гідроксіметил)піперидин-1-іл 1,1-діоксітіоморфолин-4-іл 4-метил піперазин-1-іл [1,4']-біпіперидин-1’-іл 3,5-ціс-діметил піперазин-1-іл 4-метилпіперазин-1-іл 3,5-ціс-діметшшіперазин-1-іл [1,4']-біпіперидин-1’-іл 4-метил-1,4-діазепан-1-іл 1,4-діазепан-1-іл 1,4-діазепан-1-іл 2,6-ціс-діметилпіперазин-1-іл 4-(діметиламін)піперазин-1-іл Піперазин-1-іл 4-(піридин-1-іл)піперазин-1-іл 4-(2-діметиламінетил)піперазин-1-іл 4-(3-діметиламінпропил)піперазин-1-іл 4-(3-гідроксіпропил)піперазин-1-іл 2,6-ціс-діметил-4-метилпіперазин-1-іл Точка топлення, °С 200-202 112-117 218-222 185-188 120 МС ESI+ (ΜΗ+) 589 573 511 543 527 513 497 Форма солі 591 556 624 260 540 554 608 554 >280 115 84 HCl 100 (розклад) 211-214 88-90 224-226 163-165 >140 (розклад) 75-80 Перелік 2 86. N-[(3-(4-хлорфеніл)-4-(3-трифторметил)феніл)-4,5-дігідро-1Н-піразол-1-іл)(4-метилпіперазин-1іл)метилен]-4-хлорбензолсульфонамід. ТТ 97-100°С. Аналогічним чином одержують сполуки формули (XIII), перелічені у таблиці 3 або детально описані далі. (XIII) Таблиця 3 № 87 88 R3 Η Η R4 3-(діметиламін)пропил N-метилпіперидин-4-іл R13 СН3 і-С3Н7 Точка топлення, °С 136-138 МС ESI+ (ΜΗ+) Приклад 89 N-[(4-фeнiл)-3-(піpидин-3-iл)-4,5-дiгiдpo-1H-пipaзoл-1-iл)(4-мeтилпiпepaзин-1-iл) метилен]-4фторбензолсульфонамід Частина А: 30г (0,153моля) 3-піриділбензилкетону [див. Burger et al., J.Am.Chem.Soc. 1950, 72, 1988-1990] розчиняють у 400мл метанолу та 1,5мл оцтової кислоти й послідовно додають 1,5мл піперидину та 35мл 37% водного розчину формаліну. Суміш нагрівають 210 хвилин при температурі флегми. Одержаній суміші дають охолонути до кімнатної температури та концентрують у вакуумі. Додають воду та 2N розчин NaOH і екстрагують метил-трет-бутилефіром (МТБЕ). Органічну фазу двічі промивають водою, сушать над Na2SO4, фільтрують та концентрують у вакуумі. Після тонкошарового хроматографічного очищення (елюент МТБЕ) одержують 21,4г 2-феніл-1-піридин-3-ілпропенону (вихід 67%). MCESI+(MH+)210. Частина В: 21,4г (0,102моля) 2-феніл-1-піридин-3-ілпропенону розчиняють у 150мл етанолу й додають 10,4мл гідразингідрату. Суміш нагрівають 3 години при температурі флегми. Одержаній суміші дають охолонути до кімнатної температури та концентрують у вакуумі. Додають воду й екстрагують діхлорметаном. Органічну фазу промивають водою, сушать над, фільтрують та концентрують у вакуумі, одержуючи 23г сирого 4-феніл-3-(піридин-3-іл)-4,5-дігідро-1Н-піразолу (вихід ~100%). МС ESI+ (MH+) 224. Частина С: 9,81г (0,044моля) сирого 4-феніл-3-(піридин-3-іл)-4,5-дігідро-1Н-піразолу, 12,99г (0,044моля) діметилефіру [(4-хлорфеніл)сульфоніл]дітіоімілокарбонової кислоти та 47 мл триетиламіну розчиняють у ацетонітрилі. Суміш нагрівають 70 годин при температурі флегми. Одержаній суміші дають охолонути до кімнатної температури та концентрують у вакуумі. Осад розчиняють у діхлорметані. Органічну фазу промивають водою, сушать над Na2SO4, фільтрують та концентрують у вакуумі. Після тонкошарового хроматографічного очищення (елюент метанол/діхлорметан =5/95 обсягів) одержують 7,15г метилефіру N-((4хлорфеніл)сульфоніл)-4-феніл-3-(піридин-3-іл)-4,5-дігідро-1H-піразол-1-карбоксімідотіокислоти (вихід 35%). МС ESI+ (МН+) 471. Частина D: 1,50г (0,0033моля) метилефіру N-(4-хлорфеніл)сульфоніл)-4-феніл-3-(піридин-3-іл)-4,5-дігідро1Н-піразол-1-карбоксімідотіокислоти суспендують у 25мл толуолу й додають 5мл 4-метилпіперазину. Суміш нагрівають при 60°С 70 годин. Одержаному жовтому розчину дають охолонути до кімнатної температури й концентрують у вакуумі. Осад кристалізують з МБТЕ, одержуючи 1,39г N-[(4-фенiл)-3-(тридин-3-іл)-4,5-дігідро1Н-піразол-1-іл)(4-метилпіперазин-1-іл) метилен]-4-фторбензолсульфонаміду (вихід 83%). ТТ 169-170°С. Приклад 90 (-)-()-3-(4-хлорфеніл)-N’-(4-хлорфеніл)сульфоніл)-N-метоксі-4-феніл-4,5-дігідро-1Н-піразол-1карбоксамідин (-)-()-3-(4-хлорфеніл)-К'-(4-хлорфеніл)сульфоніл)-N-метоксі-4-феніл-4,5-дігідро-1Н-піразол-1карбоксамідин (&25D=-165°, с=0,01, МеОН) одержують у вигляді аморфної твердої маси шляхом хірального хроматографічного розділення рацемічного 3-(4-хлорфеніл)-N’-((4-хлорфеніл)сульфоніл)-N-метоксі-4-феніл4,5-дігідро-1Н-піразол-1-карбоксамідину (хіральна нерухома фаза Chiralpak AD). Рухомою фазою слугує етанол.
ДивитисяДодаткова інформація
Назва патенту англійською4,5-dihydro-1h-pyrazoie derivatives as cb1 antagonists
Автори англійськоюKruse Cornelis G., Kruse, Cornelis G., Lange, Josephus, H., M.
Назва патенту російськоюПроизводные 4,5-дигидро-1н-пиразола с антагонистической активностью в отношении св1
Автори російськоюКрузе Корнелис Г., Ланге Йозефус Х.М.
МПК / Мітки
МПК: A61P 11/06, C07D 403/06, C07D 231/06, A61P 25/18, A61K 31/541, A61P 25/24, A61P 25/14, A61K 31/4725, A61P 35/00, C07D 403/12, A61P 25/04, A61P 25/16, A61P 1/12, C07D 409/04, A61P 31/04, A61K 31/496, A61P 9/00, A61P 39/02, A61P 1/08, A61P 25/02, A61P 1/04, A61P 27/06, A61P 25/28, A61K 31/5377, C07D 401/06, A61K 31/4155, A61P 25/08, A61K 31/55, C07D 401/12, A61P 25/22, A61K 31/454, A61P 11/00, A61P 3/04, A61P 31/12, A61P 3/10
Мітки: 4,5-дигідро-1н-піразолу, антагоністичною, активністю, похідні, св1
Код посилання
<a href="https://ua.patents.su/7-78523-pokhidni-45-digidro-1n-pirazolu-z-antagonistichnoyu-aktivnistyu-shhodo-sv1.html" target="_blank" rel="follow" title="База патентів України">Похідні 4,5-дигідро-1н-піразолу з антагоністичною активністю щодо св1</a>
Попередній патент: Бензоксазинові і бензотіазинові похідні, спосіб їх отримання та фармацевтична композиція (варіанти), що їх містить
Наступний патент: Спосіб отримання карбапенемових сполук
Випадковий патент: Спосіб просторово-часової обробки сигналу в системах зв'язку із стрибкоподібною зміною частоти та контрольний приймач для його здійснення











