Похідні діазобіциклоалкану з антагоністичною активністю щодо нк1
Номер патенту: 77515
Опубліковано: 15.12.2006
Автори: Коолен Гейн К.А.К., де Бур Дірк, Геселінк Майке Б., Івема Баккер Воутер І., ван Маарсевен Ян Г., Кьойль Гісберт Д., ван Шаренбург Густав Й.М., МакКрірі Ендрю К.
Формула / Реферат
1. Сполуки загальної формули (1),
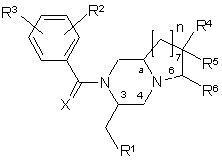 ,
,
де
R1 - феніл, 2-індоліл, 3-індоліл, 3-індазоліл або бенз[b]тіофен-3-іл, причому ці групи
можуть бути заміщені галогеном або алкілом (1-3С),
R2 та R3 незалежно одне від одного представляють галоген, Н, ОСН3, СН3 та СF3,
R4, R5 та R6 незалежно одне від одного представляють Н, ОН, O-алкіл (1-4С), СН2ОН, NH2,
діалкіл (1-3С), піролідин-1-іл, піперидин-1-іл, морфолін-4-іл або морфолін-4-іл, заміщений однією чи двома метильними або метоксиметильними групами, морфолін-4-іламіно, морфолін-4-ілметил, імідазол-1-іл, тіоморфолін-4-іл, 1,1-діоксотіоморфолін-4-іл або 3-окса-8-азабіцикло[3.2.1]окт-8-ил;
R4 та R5 разом можуть представляти кето-, 1,3-діоксан-2-ільну або 1,3-діоксолан-2-ільну групу;
Х представляє О або S;
n має значення 1, 2 або 3,
а - асиметричний атом вуглецю 8а, 9а або 10а, коли n дорівнює 1, 2 або 3 відповідно,
їх фармакологічно прийнятні солі, включаючи усі можливі стереоізомери, у яких замісники на асиметричних атомах вуглецю 3 та "а", а також на потенційно асиметричних атомах вуглецю 6 та 7, знаходяться у R-конфігурації або у S-конфігурації, а також пролікарські форми.
2. Сполуки за п. 1 формули (1), де R1 - 3-індоліл,
R2 та R3 - СF3-групи у позиціях 3 та 5,
Х - кетогрупа,
n має значення 1 або 2,
а "а", R4, R5 та R6 мають значення, наведені вище, включаючи усі можливі стереоізомери, як зазначено у п. 1.
3.Сполуки за п. 2 формули (1), де R4 або R6 представляють або містять морфолінову або гідроксиметильну групу,
R5 - водень, а стереохімічна картина - 3R.
4. Сполуки формули (4):
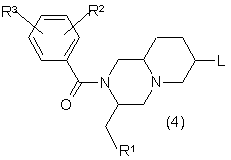 ,
,
де R1, R2 та R3 мають значення, наведені у п. 1,
a L - відщеплювана група, наприклад, хлор, бром або метансульфонат,
придатні для синтезу сполук формули (1).
5. Фармацевтична композиція, що містить як діючу речовину фізіологічно активну кількість принаймні однієї сполуки за пп. 1-3.
6. Застосування сполук за будь-яким з пп. 1-3 для приготування фармацевтичної композиції для лікування розладів, при яких залучені нейрокініни, які взаємодіють з рецепторами NK1, наприклад речовиною Р, або таких, що їх можна лікувати шляхом маніпулювання з зазначеними рецепторами.
7. Застосування за п. 6, яке відрізняється тим, що зазначеними розладами є гострий та хронічний біль, блювання, запалювальні хвороби, менінгіт, артрит, астма, псоріаз та сонячні опіки; шлунково-кишкові розлади, зокрема синдром подразнення кишечнику, запалювальна хвороба кишечнику (хвороба Крона), виразковий коліт; гіперрухливість сечового міхура або шлунково-кишкового тракту, запалення сечового тракту; алергійні реакції, як екзема та риніт; серцево-судинні розлади - гіпертензія, атеросклероз, набряклість, стенокардія, множинний головний біль та мігрень; хвороби шкіри - кропивниця, вовчак, сверблячка; розлади дихання, хронічна обструктивна хвороба легенів, бронхоспазм, бронхопневмонія, бронхіт, синдром розладнаного дихання та цистофіброз; всілякі новоутворення; психічні та/або нервові розлади, в тому числі: шизофренія та інші психічні розлади; розлади настрою, біполярні розлади І, біполярні розлади II, монополярні депресивні розлади, як-от слабка депресія, сезонний афективний розлад, постнатальна депресія, дистимія та важка депресія; бентежні розлади, паніка з агорафобією, паніка без агорафобії, соціальна фобія, нав'язливий примусовий розлад з супутнім хронічним тиком, нав'язливий примусовий розлад без супутнього хронічного тику, шизоподібний розлад, посттравматичні стреси та розлад загальної збентеженості; розлади, пов'язані з речовинами, серед них спричинені вживанням речовин, залежність, зловживання або пов'язані з відмовою від них, ломки; всеохоплюючі розлади розвитку, включаючи аутизм та синдром Ретта; дефіцит уваги та руйнівні розлади поведінки, гіперактивний розлад дефіцит уваги; імпульсивні розлади самоконтролю, як патологічне картярство; розлади харчування, нервова анорексія, нервова булімія, опасистість; тики подібні синдрому Туретта; синдром втомлених ніг; розлади, що характеризуються погіршенням мислення й пам'яті, як хвороба Альцгеймера, хвороба Крейцфельда-Якоба, хвороба Гантінгтона, хвороба Паркінсона та нейрореабілітація, посттравматичні ураження мозку.
Текст
1. Сполуки загальної формули (1), 2 (19) 1 3 77515 4 R2 та R3 - СF3-групи у позиціях 3 та 5, (хвороба Крона), виразковий коліт; гіперрухливість Х - кетогрупа, сечового міхура або шлунково-кишкового тракту, n має значення 1 або 2, запалення сечового тракту; алергійні реакції, як а "а", R4, R5 та R6 мають значення, наведені вище, екзема та риніт; серцево-судинні розлади - гіпервключаючи усі можливі стереоізомери, як зазначетензія, атеросклероз, набряклість, стенокардія, но у п. 1. множинний головний біль та мігрень; хвороби шкі3.Сполуки за п. 2 формули (1), де R4 або R6 предри - кропивниця, вовчак, сверблячка; розлади диставляють або містять морфолінову або гідроксихання, хронічна обструктивна хвороба легенів, метильну групу, бронхоспазм, бронхопневмонія, бронхіт, синдром R5 - водень, а стереохімічна картина - 3R. розладнаного дихання та цистофіброз; всілякі но4. Сполуки формули (4): воутворення; психічні та/або нервові розлади, в R2 R3 тому числі: шизофренія та інші психічні розлади; розлади настрою, біполярні розлади І, біполярні L розлади II, монополярні депресивні розлади, як-от N N слабка депресія, сезонний афективний розлад, O постнатальна депресія, дистимія та важка депре(4) сія; бентежні розлади, паніка з агорафобією, паніR1 , ка без агорафобії, соціальна фобія, нав'язливий 1 2 3 де R , R та R мають значення, наведені у п. 1, примусовий розлад з супутнім хронічним тиком, a L - відщеплювана група, наприклад, хлор, бром нав'язливий примусовий розлад без супутнього або метансульфонат, хронічного тику, шизоподібний розлад, посттравпридатні для синтезу сполук формули (1). матичні стреси та розлад загальної збентеженості; 5. Фармацевтична композиція, що містить як діючу розлади, пов'язані з речовинами, серед них сприречовину фізіологічно активну кількість принаймні чинені вживанням речовин, залежність, зловжиоднієї сполуки за пп. 1-3. вання або пов'язані з відмовою від них, ломки; 6. Застосування сполук за будь-яким з пп. 1-3 для всеохоплюючі розлади розвитку, включаючи ауприготування фармацевтичної композиції для літизм та синдром Ретта; дефіцит уваги та руйнівні кування розладів, при яких залучені нейрокініни, розлади поведінки, гіперактивний розлад дефіцит які взаємодіють з рецепторами NK1, наприклад уваги; імпульсивні розлади самоконтролю, як паречовиною Р, або таких, що їх можна лікувати тологічне картярство; розлади харчування, нервошляхом маніпулювання з зазначеними рецептова анорексія, нервова булімія, опасистість; тики рами. подібні синдрому Туретта; синдром втомлених ніг; 7. Застосування за п. 6, яке відрізняється тим, що розлади, що характеризуються погіршенням мисзазначеними розладами є гострий та хронічний лення й пам'яті, як хвороба Альцгеймера, хвороба біль, блювання, запалювальні хвороби, менінгіт, Крейцфельда-Якоба, хвороба Гантінгтона, хвороартрит, астма, псоріаз та сонячні опіки; шлунковоба Паркінсона та нейрореабілітація, посттравмакишкові розлади, зокрема синдром подразнення тичні ураження мозку. кишечнику, запалювальна хвороба кишечнику Винахід стосується групи унікальних похідних діазобіциклоалкану, що мають важливу антагоністичну активність щодо рецептора нейрокініну NK1. Винахід також стосується способу виготовлення нових сполук і фармаційних композицій, що містять фармакологічно діючу кількість принаймні однієї з цих сполук у якості діючої речовини. З Європейської заявки ЕР 0655442 відомі похідні піперазину з антагоністичною активністю щодо нейрокініну. Нові похідні піперазину, що також мають цю біологічну активність, описані у ЕР 0899270 як низка похідних 2-(3-індолілметил)-1бензоїл-4-[(2бензиламін)етил)амінокарбоніл]піперазину з антагоністичною активністю щодо NK1. Тепер несподівано встановлено, що також є антагоністами NK1 ті похідні, де піперазинове кільце та його N-4 замісник зливаються з утворенням 1,4-діазобіцикло[4.3.0]нонану, 1,4діазобіцикло[4.4.0]декану або 1,4діазобіцикло[4.5.0]ундекану. Винахід стосується сполук загальної формули (1), де R1 - феніл, 2-індоліл, 3-індоліл, 3-індазоліл або бенз[b]тіофен-3-іл, причому ці групи можуть бути заміщені галогеном або алкілом (1-3С), R2 та R3 незалежно одне від одного представляють галоген, Н, ОСН3, СН3 та CF3, R4, R5 та R6 незалежно одне від одного представляють Н, ОН, О-алкіл(1-4С), СН2ОН, NH2, діалкіл(1-3С), піролідин-1-іл, піперидин-1-іл, морфолін-4-іл або морфолін-4-іл, заміщений однією чи двома метильними або метоксіметильними група 5 77515 6 ми, морфолін-4-іламін, морфолін-4-ілметил, імідаприєднати до відповідно захищеної амінокислоти зол-1-іл, тіоморфолін-4-іл, 1,1-діоксотіоморфолінза стандартною процедурою прив'язування пепти4-іл або 3-окса-8-азабіцикло[3.2.1]окт-8-іл; R4 та R5 ду, [описаною в M.Bodanszky, A.Bodanszky, The разом можуть представляти кето-, 1,3-діоксан-2Practice of Peptide Synthesis, Springer-Verlag, 1994; ільну або 1,3-діоксолан-2-ільну групу; ISBN: 0-387-57505-7], з одержанням аміду II. ЗахиX представляє О або S; сну групу в II (у формулі II позначена "PG") можна n має значення 1, 2 або 3З, видалити відомим шляхом [T.W.Greene, а - асиметричний атом вуглецю 8а, 9а або 10а, P.G.M.Wuts, Protective Groups in Organic Synthesis, коли n дорівнює 1, 2 або 3 відповідно, 3rd ed., John Wiley & Sons, 1999]. Наступна цикліта їхні фармакологічно прийнятні солі. зація дає заміщений дікетопіперазин III, застосуУсі сполуки формули (1), у яких замісники на вання хіральної амінокислоти призводить до утвоасиметричних атомах вуглецю 3 та "а", а також на рення діастереометрів, які на цій стадії можна потенційно асиметричних атомах вуглецю 6 та 7, розділити стандартною хроматографією. Відновзнаходяться у R-конфігурації або у S-конфігурації, лення III активним гідридним реагентом, як от входять до обсягу винаходу. алюмогідрид літію, створює аміноспирт, який можТакож пролікарські препарати, тобто сполуки, на ацілювати відповідним кислим хлоридом за які, потрапляючи до людського організму будьумов, відомих фахівцям, і одержати IV. Конверсія яким відомим чином, метаболізуються у сполуки спирту на відповідну відщеплювану групу, наприформули (1), входять до обсягу винаходу. Зокреклад, метансульфонат, та відповідна реакція з ма, це стосується сполук, у яких R4, R5 або R6 яваміном дають V. Подробиці про сполуки, синтезоляють собою гідроксі- або гідроксіметильну групу, вані цим шляхом, наведені у прикладі 1. як, наприклад, 3,5-біс(трифторметил)феніл-[6Ефірні пролікарські форми сполук IV можна гідроксіметил-3-(1Н-індол-3-ілметил)одержати ацілюванням кислими хлоридами у розгексагідропірол[1,2-а]піразин-2-іл]-метанон (сполучиннику типу ацетонітрилу в присутності основи, ка 1 та її енантіомери, див. нижче). Такі сполуки наприклад, діізопропилетиламіну, при температуможна етерифікувати до сполук, які здатні метарах від 20 до 80°С (див. приклад 6). болізуватися у сполуки формули (1). Сполуки за винаходом, де n=l1 a R6=H, можна Зокрема, винахід стосується сполук формули приготувати загальним шляхом, зображеним на (1), де R1 - 3-індоліл, R2 та R3 - CF3 групи у позицісхемі 2. Реакція ефіру амінокислоти з відповідним ях 3 та 5, X - кетогрупа, n має значення 1 або 2, a чином захищеним похідним 4-гідроксіпролину за "a", R4, R5 та R6 мають значення, наведені вище, стандартною процедурою прив'язування пептиду, включаючи усі можливі стереоізомери, як зазначе[описаною в M.Bodanszky, A.Bodanszky, The но вище. Practice of Peptide Synthesis, Springer-Verlag, 1994; Особлива перевага віддається сполукам згідISBN: 0-387-57505-7], дає діпептид VI. Захисну но з винаходом, як зазначено вище, де R4 або R6 групу в VI можна видалити відомим шляхом представляють або містять морфолінову або гід[T.W.Greene, P.G.M.Wuts, Protective Groups in роксіметильну групу, R5 -водень, а стереохімічна Organic Synthesis, 3rd ed., John Wiley & Sons, 1999]. картина - 3R. Наступна циклізація дає заміщений дікетопіпераСполуки формули (1) та їхні солі можна одерзин VII, причому цю реакцію можна провести пежувати принаймні одним з наступних способів, ремішуванням суміші ацетонітрилу та піперидину. відомих для сполук цього типу. Захист гідроксігрупи VII як силілового етеру за Сполуки згідно з винаходом, де n=1, a R4 та R5 стандартною методикою, наприклад, [описаною в - водень, можна одержати загальним шляхом, зоT.W.Greene, P.G.M.Wuts, Protective Groups in браженим на схемі 1. Organic Synthesis, John Wiley & Sons, 1999], з подальшим відновленням активним гідридним реагентом, як от алюмогідрид літію, дає аміноспирт VIII. Сполуки формули VIII можна ацілювати відповідним кислим хлоридом за стандартних умов і одержати IX. Конверсія спирту на відповідну відщеплювану групу, наприклад, метансульфонат, та відповідна реакція з аміном дають X. Подробиці про сполуки, синтезовані цим шляхом , наведені у прикладі 2. Отже, діефір дікарбонової кислоти І [одержаний аналогічно методиці G.Cignarella, G.Nathansohn, J.org.Chem., 1961, 26, 1500] можна 7 Сполуки згідно з винаходом, у яких n=2 і R6=H., можна приготувати загальним шляхом, показаним на схемі 3. Так, реакція ефіру амінокислоти з 1-бензилефіром 5-оксо-піперидин-1,2дікарбонової кислоти [H.C.Beyerman, P.Boekee, Recl.Trav.Chim.Pays-Bas, 1959, 78, 648] за стандартною процедурою прив'язування пептиду, [описаною в M.Bodanszky, A.Bodanszky, The Practice of Peptide Synthesis, Springer-Verlag, 1994; ISBN: 0387-57505-7], дає діпептиди XI. Застосування хіральної амінокислоти призводить до утворення діастереомерів, які можна розідлити на цій (або подальшій) стадії стандартними хроматографічними методами. Захист кетону в XI як циклічного або ациклічного кеталю, [як описано у T.W.Greene, P.G.M.Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1999], дає сполуки формули XII, у яких А і В представляють циклічний або ациклічний кеталь. Цю реакцію можна провадити звичайними прийомами, добре відомими фахівцям. Видаленням бензилоксікарбонільної групи у відновлювальних умовах (Н2, Pd/C) у розчиннику типа метанолу з подальшою каталізованою кислотою циклізацією одержують дікетопіперазини формули XIII. XIII відновлюють активним гідридним реагентом, наприклад, алюмогідридом літію, з одержанням аміну, який можна ацілювати відповідним кислим хлоридом за умов, відомих фахівцям, і одержати XIV. Гідроліз кеталю з утворенням XV можна здійснити, [як описано у T.W.Greene, P.G.M.Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1999]. Відновлювальне амінування XV відповідним аміном у розчиннику типа 1,2-діхлоретану відновлювачем типа триацетоксіборогідриду натрію дає сполуки фopмyли XVI. Або ж можна приготувати XVI з XV відновленням кетону відновлювачем типа триацетоксіборогідриду натрію в розчиннику, наприклад, оцтовій кислоті, до спирту XVII. Спирт можна перетворити на відщеплювану групу (L), скажімо, хлор-, бромабо метансульфонат, за умов, відомих фахівцям, і одержати XVIII. Заміщення відщеплюваної групи у XVIII відповідним аміном у розчиннику типа ацетонітрилу дає сполуки формули XVI. Подробиці про сполуки, синтезовані цим шляхом , наведені у прикладах 3, 4 та 5. Проміжні сполуки VIII (схема 2), XIII (схема 3) та XVIII (схема 3) є новими. Винахід також стосується цих нових сполук. 77515 8 Придатні кислі адуктні солі можна утворювати з неорганічними кислотами, як соляна, сірчана, фосфорна і азотна кислоти, або за органічними кислотами, як от цитринова, фумарова, малеїнова, винна, оцтова, трифтороцтова, бензойна, ртолуолсульфонова, метансульфонова та нафталінова кислоти. Сполуки за винаходом загальної формули (1) та їхні солі посідають антагоністичну активність до НК1 і демонструют високу біозасвоюваність. Вони придатні для лікування розладів, при яких нейрокінини взаємодіють з рецепторами, наприклад, за участі нейрокінину-1 (= речовині Р), або які можна лікувати шляхом маніпуляцій з цими системами. Наприклад, це гострий та хронічний біль, блювання, запалювальні хвороби, як от менінгіт, артрит, астма, псоріаз та (сонячні) опіки; шлунково-кишкові розлади, зокрема, синдром подразнення кишковика, запалювальна хвороба кишковика (хвороба Крона), виразковий коліт; гіперрухомість сечового міхура або шлунково-кишкового тракту, запалення сечового тракту; алергійні реакції, як екзема та риніт; серцево-судинні розлади - гіпертензія, атеросклероз, набряклість, грудна жаба, множинний головний біль та мігрень; хвороби шкіри - кропивниця, вовчанка, сверблячка; розлади дихання, включаючи хронічну обструктивну хворобу легенів, бронхоспазм, бронхопневмонію, бронхіт, синдром розладнаного дихання та цістофіброз; всілякі новоутворення; психічні та/або нервові розлади, в тому числі: шизофренія та інші психічні розлади; розлади настрою, як от біполярні розлади І, біполярні розлади II, монополярні депресивні розлади, як от слабка депресія, сезонний афективний розлад, постнатальна депресія, дистімія та важка депресія; бентежні розлади, тому числі паніка (з агорафобією чи без), соціальна фобія, нав'язливий примусовий розлад (з супутнім хронічним тиком чи без, або шизоподібний розлад), посттравматичні стреси та розлад загальної збентеженості; розлади, пов'язані з речовинами, серед них спричинені вживанням речовин (залежність, зловживання) або з відмовою від них (на кшталт ломки); всеохоплюючі розлади розвитку, включаючи аутизм та синдром Ретта; дефіцит уваги та руйнівні розлади по 9 77515 10 ведінки, як от гіперактивний розлад дефіциту ува5% трихлороцтовою кислотою. Радіомічені АТФ та ги; імпульсивні розлади самоконтролю, як патолоцАМФ виділяли з екстрактів послідовною колонкогічне картярство; розлади харчування (нервова вою хроматографією. Екстракти розділяли іонообанорексія, нервова булімія, опасистість); тики на мінною хроматографією на колонках Dowex кшталт синдрому Туретта; синдром втомлених ніг; 50WX4, що дозволяло виділити АТФ. Колонки посрозлади, що характеризуються погіршенням мислідовно вміщували зверху колонок з оксидом лення й пам'яті, як хвороба Альцгеймера, хвороба алюмінію та елюювали водою. Виділення цАМФ Крейцфельда-Якоба, хвороба Гантінгтона, хвороздійснювали шляхом елюювання з колонок з оксиба Паркінсона та нейрореабілітація (посттравмадом алюмінію 100ммолями імідазолу (рН 7,4). Ратичні враження мозку). діоактивність фракцій як АТФ, так і цАМФ рахуваАнтагоністичні властивості сполук за винахоли рідинними сцинтиляційними лічильниками, а дом щодо НК1 випробували наступним чином. коефіцієнти конверсії розраховували як: Фармакологічні методи ν=[цАМФ]*100%/([АТФ]+[цАМФ]) Зв'язування людських рецепторів НК1 Співвідношення концентрація-реакція визнаСпорідненість сполук до людських рецепторів чали, складаючи графік конверсії цАМФ у залежНК1 оцінювалася методом радіоаналізу зв'язуванності від концентрації сполук, а значення IC50 виня рецепторів. Готували препарати мембран з раховували за чотирьохпараметричною фібробластів клітин яєчників китайського хом'яка логістичною регресією. Значення потенціалів анта(ЯКХ), де людський рецептор НК1 був стабільно гонізму (рА2) розраховували з формули: виражений. Мембрани інкубували з [3Н]pA2=IC50/(1+[SP]/EC50) речовиною Ρ у присутності завданих концентрацій де ІС50 дослідної сполуки одержано зі співвідсполук або без них, розбавляли у відповідному ношень концентрація-реакція, SP - концентрація буфері у присутності інгібітору пептидази 10хв. при речовини Ρ (у молях/л, здебільшого 10нмолів), а 25°С. Зв'язану радіоактивність відокремлювали від ЕС50 - потенціал речовини Ρ на клонованих людсьвільної на фільтрах Whatman GB/F зі скловолокна ких рецепторах НК1. двома промивками по 5с. Зв'язану радіоактивність Спричинене агоністом НК1 тупання лапою у рахували рідинним сцинтиляційним лічильником піщанок Бетаплейт. Виміряну радіоактивність накладали Відома здатність антагоністів НК1 протистояти на концентрацію зсувальної дослідної сполуки й спричиненому введеним до центральної нервової розраховували криві зсуву за допомогою чотирьосистеми агоністом НК1 тупанню лапою [Rupniak хпараметричної логістичної регресії, одержуючи and Willams, 1994, Eur. J. Pharmacol. 265: 179; величини ІС50, тобто концентрації зсувальної споBristowand Young, 1994, Eur. J. Pharmacol. 254: луки, при якій зсувається 50% радіоліганду. Зна245]. Тому ми використали цю модель для оцінки чення спорідненості рK1 розраховували корекцією активності сполук за винаходом. величин для концентрації радіоліганду та його За 60 хвилин до анестезування 0,8л/хв N2O, спорідненості до людського рецептора НК1 за рів3% галотану та 0,8л/хв О2 самцям піщанки Чарльзнянням Ченга-Прусова: Рівер вагою 40-60г робили оральні ін'єкції дослідрKi=-lg[ІС50/(1+S/Kd)] ної сполуки. Після успішного наркозу анестезію де рK1 описана вище, S - концентрація зменшували до 0,6л/хв N2O, 1,5% галотану та [3Н]речовини Р, що використовувалася в аналізі 0,6л/хв О2 і робили надрізи по середній лінії скаль(молів/л), a Kd - постійна дисоціації рівноваги [3Н]па. До церебровентральної порожнини інфузували речовини Ρ щодо людського рецептора НК1 (моGR 73632 (АР -0,5мм, L -1,2мм, по вертикалі лів/л). 4,5мм від брегми). Коли птиці оговтувалися від Вимірювання цАМФ анестезії (за 3-4 хвилини), тупання поновлювалося Вплив дослідних сполук на утворення циклічй тривало протягом 5 хвилин. Завданим критерієм ного АМФ (цАМФ) оцінювався з використанням антагонізму цій реакції було визначено інгібування фібробластів клітин ЯКХ, де стабільно виражалися тупання лапою за 5хв. клоновані людські рецептори НК1. На додаток до Сполуки за винаходом посідають високу споприєднування до фосфоліпази С людські рецепторідненість до рецепторів НК1, маючи значення ри НК1 також здатні стимулювати аденілатциклазу, рK1 7,0 у описаному вище аналізі на зв'язування. яка перетворює АТФ на цАМФ. Для випробувань Сполуки за винаходом активні також у пробі на клітини вирощували на 24-лункових пластинах. цАМФ, значення рА2 в них відповідають значенням Перед початком випробувань наявне середовище рK1. Деякі сполуки за винаходом долають кров'язамінювали безсироватковою культурою в &ний бар'єр мозку, що чітко видно з їх активності in ДМЕМ, що містила [3Н]-аденин, який засвоювався vivo проти спричиненого нейрокініном тупання лаклітинами і послідовно перетворювався на радіопою у піщанок. Ця властивість робить їх корисними мічений аденозин, АМФ, АДП і, нарешті, радіоміпри лікуванні розладів ЦНС. чений АТФ. За 2 години клітини двічі промивали Далі винахід поясняється на прикладах здійсфосфатно-буферним фізрозчином (рН 7,4) у принення. сутності 1ммоля ізобутилметилксантину (ІБМК Приклад 1 (див. схему 1) інгібітора фосфодіестераз, що гідролізують цАМФ Етап 1: До суміші 4,2г діетилефіргідрохлориду до АМФ). Після того клітини стимулювали транс-піролідин-2,5-дікарбонової кислоти та 10,0г 10нмолями речовини Ρ у присутності дослідних Na-карбоксібензилоксі-D-триптофану в 200мл ацесполук або без них при відповідному розбавленні тонітрилу додають 2,6мл 1,3ПБС/ІБМК протягом 20 хвилин. Після стимулювандіізопропилкарбодііміду, а потім 20мг діметиламіння середовище продували та екстрагували клітини піридину. Одержану суміш перемішують усю ніч 11 77515 12 при кімнатній температурі, далі додають 2,5мл 15мл діметилформаміду додають 5мл морфоліну. діізопропилетиламіну і продовжують перемішуОдержану суміш нагрівають 6 годин при 120°С. вання ще добу. Реакцію гасять водним розчином Після охолодження до кімнатної температури до2N NaOH і провадять екстракцію етилацетатом. дають етилацетат та 5% водний розчин бікарбонаОрганічну фазу сушать над Na2SO4, фільтрують та ту натрію та розділяють фази. Органічну фазу суконцентрують у вакуумі. Осад очищують тонкошашать і концентрують у вакуумі. Осад очищують ровою хроматографією (SiO2, МТБЕ) і одержують тонкошаровою хроматографією (SiO2, суміш 8,25г (90%) (2R,5R,2'R) та (2S,5S,2'R) діетиМТБЕ/МеОН/NH4OH 95:4,4:0,5) і одержують 407мг лефірів 1-[2-бензилоксікарбониламін-3-(1Н-індол3,5-біс(трифторметил)феніл-(3R,6R,8аR)-3-(1Н3-іл)пропіонил]-піролідин-2,5-дікарбонової кислоти. індол-3-ілметил)-6-(морфолін-4-ілметил)Rf 0,62 (ЕtOАс) (проміжні сполуки 1 та 2). гексагідропірол[1,2-а]піразин-2-іл]-метанону, Rf Етап 2. Суміш 8,5г (2R,5R,2'R) та (2S,5S,2'R) 0,46 (МТБЕ/МеОН/NH4OH 95:4,4:0,5) (сполука 2). діетилефірів 1-[2-бензилоксікарбониламін-3-(1НАналогічним чином одержують такі сполуки: індол-3-іл)пропіонил]-піролідин-2,5-дікарбонової Сполука 3: МH+ 526; Rf 0,71 кислоти, 250мг 10% паладію на вуглеці та 250мл (СН2СI2/МеОН/NH4OH 90:10:1) етанолу гідрогенують цілу ніч при 1атм Н2. КаталіСполука 4: Rf 0,38 (СН2СI2/МеОН/NH4OH затор видаляють фільтрацією на Целіті, а решту 90:10:1) розчину концентрують у вакуумі. Одержані два Приклад 2 (див. схему 2) стереоізомери розділяють тонкошаровою хромаЕтап 1: До суміші 10,2г флуоренілметоксікартографією (SiO2, CH2CI2/МеОН/NH4OH 95:4,4:0,5) і боніл-транс-4-гідроксіпролину, 8,1г триптофанимеодержують 2,3г етилефіру (3R,6S,8aS)-3(1H-індолтилефіргідрохлориду та 15г бензотриазол-1-ілоксі3-ілметил)-1,4-діоксо-октагідро-пірол[1,2-а]піразинтрис(піролідин)-фосфонійгексафторфосфату в 6-карбонової кислоти та 1,75г етилефіру 200мл ацетонітрилу додають 15мл діізопропиле(3R,6R,8аR)-3(1Н-індол-3-ілметил)-1,4-діоксотиламіну при 0°С. Суміш перемішують усю ніч при октагідро-пірол[1,2-а]піразин-6-карбонової кислоти кімнатній температурі. Розчинник видаляють у (проміжні сполуки 3 та 4). вакуумі, розчиняють в етилацетаті та двічі екстраЕтап 3. До суспензії 1,2г алюмогідриду літію в гують водою і двічі 2Μ соляною кислотою. Органі50мг ТГФ додають розчин 1,75г етилефіру чну фазу сушать над Na2SO4, фільтрують та кон(3R,6R,8аR)-3(1Н-індол-3-ілметил)-1,4-діоксоцентрують у вакуумі. Осад розчиняють у 200мл октагідро-пірол[1,2-а]піразин-6-карбонової кислоти ацетонітрилу, додають 25мл піперидину. За 2 гоу 50мл ТГФ. Одержану суміш нагрівають зі зворотдини при кімнатній температурі відфільтровують нім холодильником 3 години, далі додають по краутворений 1-(9Н-флуорен-9-ілметил)-піперидин, а плинах суміш 3мл води та 30мл ТГФ, після того решту розчину залишають на 72 години. Одержа0,5мл 50% водного розчину гідроксиду натрію і ний кристалічний матеріал відфільтровують і одепродовжують нагрівання зі зворотнім холодильниржують 7,4г (3R,7R,8аS)-7-гідроксі-3-(1Н-індол-3ком ще 2 години. Після охолодження до кімнатної ілметил)-6-(морфолін-4-ілметил)-гексагідротемператури додають 4мл діізопропилетиламіну пірол[1,2-а]піразин-1,4-діону (проміжна сполука 6). та 2,4мл 3,5-біс(трифторметил)бензоїлхлориду і Етап 2: До розчину 2,5г (3R,7R,8аS)-7-гідроксіперемішують усю ніч. Додають етилацетат і екст3-(1Н-індол-3-ілметил)-6-(морфолін-4-ілметил)рагують суміш 5% водним розчином бікарбонату гексагідро-пірол[1,2-а]піразин-1,4-діону в 30мл натрію. Органічну фазу сушать над Na2SO4, фільтдіметилформаміду додають 1,7г імідазолу та рують та концентрують у вакуумі. Осад очищують 4,35мл трет-бутил-хлордіфенілсілану. Одержану тонкошаровою хроматографією (SiO2, суміш перемішують усю ніч при кімнатній темпераСН2СI2/МеОН/NH4OH 95:4,4:0,5) і одержують 1,49г турі, після чого розподіляють між водою та етила3,5-біс(трифторметил)феніл-[(3R,6R,8аR)-6цетатом. Органічну фазу сушать, фільтрують та гідроксіметил-3(1Н-індол-3-ілметил)-1,4концентрують у вакуумі. Осад очищують тонкошагексагідропірол[1,2-а]піразин-2-іл]-метанону. МН+ ровою хроматографією (SiO2, EtOAc) і одержують 526; Rf 0,20 (ЕtOАс) (сполука 1). 4,6г (вихід 99%) (3R,7R,8аS)-7-(третЕтап 4. Суміш 1,30г 3,5бутилдіфенілсіланілоксі)-3-(1Н-індол-3-ілметил)біс(трифторметил)феніл-[(3R,6R,8аR)-6гексагідропірол[1,2-а]піразин-1,4-діону (проміжна гідроксіметил-3(1Н-індол-3-ілметил)-1,4сполука 7). гексагідропірол[1,2-а] піразин-2-іл]-метанону, 1,2г Етап 3. До суспензії 1,8г алюмогідриду літію в трифенілфосфіну, 4мл чотирихлористого вуглецю 120мг ТГФ додають розчин 4,6г (3R,7R,8аS)-7та 40мл ацетонітрилу нагрівають при 70°С 6 годин. (трет-бутилдіфенілсіланілоксі)-3-(1Н-індол-3Після охолодження до кімнатної температури розілметил)-гексагідропірол[1,2-а]піразин-1,4-діону у чинник видаляють у вакуумі. Осад очищують іоно35мл ТГФ. Одержану суміш нагрівають зі зворотобмінною хроматографією у сильній каітіонообміннім холодильником усю ніч, далі додають по крапній (SCX) колонці та одержують 1,06г 3,5линах суміш 1,8мл води та 30мл ТГФ, після того біс(трифторметил)феніл-[(3R,6R,8аR)-6двічі по 1,8мл 50% водного розчину 2М гідроксиду хлорметил-3-(1Н-індол-3-ілметил)натрію. Одержані солі відфільтровують, маточний гексагідропірол[1,2-а]піразин-2-іл]-метанону (пророзчин концентрують у вакуумі. Осад суспендують міжна сполука 5). у 100мл етилацетату і 20мл ТГФ, додають 5мл Етап 5. До розчину 1,06г 3,5діізопропилетиламіну та 2мл 3,5біс(трифторметил)феніл-[(3R,6R,8аR)-6біс(трифторметил)бензоїлхлориду. Суміш екстрахлорметил-3-(1Н-індол-3-ілметил)гують водою, сушать та концентрують у вакуумі. гексагідропірол[1,2-а]піразин-2-іл]-метанону в Осад очищують тонкошаровою хроматографією 13 77515 14 (SiO2, МТБЕ/гексан 2:1) і одержують 4,2г (вихід іл)-1-метоксікарбоніл-етилкарбамоїл]-5-оксо65%) (3R,7R,8аS)-2-3,5-біс(трифторметил)бензоїлпіперидин-1-карбонової кислоти (проміжні сполуки 3(1Н-індол-3-ілметил)-октагідропірол[1,2-а]піразин9 та 10), що їх використовують як такі на наступних 7-іл] ефіру 3,5-біс(трифторметил)бензойної кислоетапах. ти. МН+ 752 (проміжна сполука 8). Етап 2: Суміш 138,9г бензилефіру (2R,2'R) та Етап 4. Суміш 4,2г (3R,7R,8аS)-2-3,5(28,2'R)-2-[2-(1Н-індол-3-іл)-1-метоксікарбонілбіс(трифторметил)бензоїл-3(1Н-індол-3-ілметил)етилкарбамоїл]-5-оксо-піперидин-1-карбонової октагідропірол[1,2-а]піразин-7-іл] ефіру 3,5кислоти, 180г щавлевої кислоти та 87мл 1,3біс(трифторметил)бензойної кислоти, 45мл діокпропандіолу в 1,5л ацетонітрилу нагрівають при сану, 12мл метанолу та 3мл водного розчину 4М 40°С 20 годин. Після цього розчинник видаляють у гідроксиду натрію перемішують 30хв. при кімнатній вакуумі й очищують осад тонкошаровою хроматогтемпературі. Суміш концентрують, осад розподірафією (SiO2, СН2СI2/МеОН 99:1), одержуючи 118г ляють між водою та етилацетатом. Органічну фазу суміші (9R,2'R) та (9S,2'R)-бензилефірів 9-[2-(1Нсушать, фільтрують і концентрують, одержуючи 4г індол-3-іл)-1-метоксікарбоніл-етилкарбамоїл]-1,53,5-біс(трифторметил)феніл-(3R,7R,8аS)-7діокса-8-аза-спіро[5.5]ундекан-8-карбонової кислогідроксі-3-(1Н-індол-3-ілметил)гексагідропірол [1,2ти. ΜΗ+ 536; Rf 0,07 (СН2СІ2/МеОН 99:1) (проміжні а]піразин-2-іл]-метанону (сполука 5). сполуки 11 та 12). Етап 5а: До розчину 0,54г 3,5Етап 3. До розчину 92,8г суміші (9R,2'R) та біс(трифторметил)феніл-(3R,7R,8аS)-7-гідроксі-3(98,2'R)-бензилефірів 9-[2-(1Н-індол-3-іл)-1(1Н-індол-3-ілметил)гексагідропірол [1,2-а]піразинметоксікарбоніл-етилкарбамоїл]-1,5-діокса-8-аза2-іл]-метанону в 20мл етилацетату додають 2мл спіро[5.5]ундекан-8-карбонової кислоти в 1л метадіізопропилетиламіну та 0,2мл метансульфонілхнолу додають 5г 10% паладію на вуглеці. Одержалориду. Одержану суміш перемішують усю ніч при ну суміш усю ніч гідрогенують Н2 при 1атм і кімнакімнатній температурі та концентрують у вакуумі. тній температурі. Каталізатор видаляють До осаду додають 4мл морфоліну й нагрівають фільтрацією на Целіті, а маточний розчин конценсуміш 4 години при 95°С. Надлишок морфоліну трують у вакуумі, одержуючи 69,0г суміші (2R,9'R) видаляють у вакуумі, осад очищують препаративта (2R,9'S)-метилефірів 2-[1,5-діокса-8-азаною рідинною хроматографією, одержуючи 81мг спіро[5.5]ундекан-8-карбоніл)амін]-3-(1Н-індол-33,5-біс(трифторметил)феніл-(3R,7R,8аS)-3-(1Ніл)-пропіонової кислоти. Rf 0,24 індол-3-ілметил)-7-(морфолін-4-іл)-гексагідропірол (СН2СІ2/МеОН/NH4OH 92:7,5:0,5) (проміжні сполуки [1,2-а]піразин-2-іл]-метанону. МН+ 581 (сполука 6). 13 та 14). Етап 5b: До розчину 0,68г 3,5Етап 4. Суміш (2R,9'R) та (2R,9'S)-метилефірів біс(трифторметил)феніл-(3R,7R,8аS)-3-(1Н-індол2-[1,5-діокса-8-аза-спіро[5.5]ундекан-83-ілметил)-7-(морфолін-4-іл)-гексагідропірол [1,2карбоніл)амін]-3-(1Н-індол-3-іл)-пропіонової кислоа]піразин-2-іл]-метанону в 20мл діметилформаміду ти й 9мл оцтової кислоти в 900мл ацетонітрилу додають 2мл діізопропилетиламіну та 0,2мл метанагрівають усю ніч зі зворотнім холодильником. нсульфонілхлориду. Одержану суміш перемішуПісля охолодження до кімнатної температури сують 1 годину при кімнатній температурі, далі доміш концентрують до приблизно однієї третини дають бромід цезію в надлишку й перемішують первісного обсягу. Одержаний осад відфільтровусуміш 5 години при 95°С. Проміжний бромід видіють, одержуючи 23,7г (3R,9aS)-3-(1H-індол-3ляють розподілом між водою та етилацетатом, ілметил)-гексагідро-спіро-[2Н-піридо[1,2-а]піразинорганічну фазу концентрують і очищують хромато1,4-діон-7,2'-[1,3]-діоксану] (Rf 0,34 (Et2O/МеОН графією. До броміду додають4мг морфоліну й 9:1). Концентруючи фільтрат, очищенням осаду нагрівають суміш 4 години при 95°С. Надлишок тонкошаровою хроматографією (SiO2, Et2O/МеОН морфоліну видаляють у вакуумі, осад очищують 9:1) одержують 20,6г (3R,9aR)-3-(1H-індол-3препаративною рідинною хроматографією, одерілметил)-гексагідро-спіро-[2Н-піридо[1,2-а]піразинжуючи 101мг 3,5-біс(трифторметил)феніл1,4-діон-7,2'-[1,3]-діоксану] (Rf 0,18 (Et2O/МеОН [(3R,7R,8аS)-3-(1Н-індол-3-ілметил)-7-(морфолін9:1) (проміжна сполука 15). 4-іл)-гексагідропірол[1,2-а]піразин-2-іл]-метанону. Етап 5. До суспензії 10,6г алюмогідриду літію в МН+ 581 (сполука 7). 500мл ТГФ додають по краплинах розчин 20,6г Аналогічним чином одержують сполуки 8 та 9. (3R,9aR)-3-(1H-iндoл-3-iлмeтил)-гeкcariдpo-спіроПриклад 3 (див. схему 3) [2H-піридо[1,2-а]піразин-1,4-діон-7,2'-[1,3]-діоксану] Етап 1: До розчину 93,5г 1-бензильного ефіру в 100мл ТГФ. Одержану суміш нагрівають зі зво5-оксо-піперидин-1,2-дікарбонової кислоти в 1л ротнім холодильником 2 доби. Після охолодження ацетонітрилу додають розчин 53мл діізопропилкадо 5°С додають по краплинах 9,2мл води, 18,4мл рбодііміду в 50мл ацетонітрилу й охолоджують водного розчину 2М гідроксиду натрію і знов 9,2мл суміш до 5°С. До одержаної суспензії доливають води. Одержану суміш нагрівають зі зворотнім по порціях 85,5г триптофанметилефіргдрохлориду холодильником ще 1 годину, охолоджують до кімта по краплинах розчин 58,6мл діізопропилетиланатної температури, фільтрують на Целіті й конміну в 50мл ацетонітрилу. Одержану суміш перецентрують у вакуумі, одержуючи 19,7г сирого мішують 18 годин при кімнатній температурі, потім (3R,9аR)-3-(1Н-індол-3-ілметил)-октагідро-спірофільтрують і концентрують у вакуумі. Осад розчи[2Н-піридо[1,2-а]піразин-7,2'-[1,3]-діоксану] (Rf 0,16 няють у діхлометані, промивають двічі 1М соля(СН2СI2/МеОН/NH4OH 92:7,5:0,5) (проміжна сполуною кислотою і двічі водою, сушать, фільтрують та ка 16), що її використовують як таку на наступному концентрують у вакуумі, одержуючи 171,2г суміші етапі. (2R,2'R) та (2S,2'R)-бензилефірів 2-[2-(1Н-індол-3Етап 6. До розчину 19,7г сирого (3R,9аR)-3 15 77515 16 (1Н-індол-3-ілметил)-октагідро-спіро-[2Нбіс(трифторметил)феніл-[(3R,7R,9аR)-3-(1Н-індолпіридо[1,2-а]піразин-7,2'-[1,3]-діоксану] в діхлорме3-ілметил)7-морфолін-4-іл-октагідропіридо[1,2-а] тані додають 9,6мл діізопропилетиламіну при кімпіразин-2-іл]-метанону (Rf 0,33 натній температурі та при 5°С і по краплинах 10мл (СН2СІ2/МеОН/NH4OH 92:7,5:0,5) (сполука 13) та 3,5-біс(трифторметил)бензоїлхлориду. Одержану 1,28г 3,5-біс (трифторметил)феніл-[(3R,7R,9аS)-3суміш перемішують усю ніч при кімнатній темпера(1Н-індол-3-ілметил)-7-морфолін-4-ілтурі, концентрують у вакуумі та очищують колоноктагідропіридо[1,2-а]піразин-2-іл]-метанону (Rf ковою хроматографією (SiO2, СН2СI2/МеОН/NH4OH 0,27 (СН2СІ2/МеОН/NH4OH 92:7,5:0,5) (сполука 14). 96:3,75:0,25), одержуючи 30,0г (3R,9aR)-2-3,5Аналогічним чином одержують сполуки 15-23 бic(трифторметил)бензоіл-3-(1Н-індол-3-ілметил)та 33-40. октагідро-спіро-[2Н-піридо[1,2-а]піразин-7,2'-[1,3]Приклад 4 (див. схему 3) діоксану]. Rf 0,35 (СН2Сl2/МеОН/NH4OH Суміш 0,785г (3R,9aR)-2-[3,596:3,75:0,25) (сполука 10). бic(тpифтopмeтил)бeнзoiл]-3-(1H-iндoл-3-iлмeтил)Етап 7. Суміш 30,0г (3R,9aR)-2-[3,5октагідро-2Н-піридо[1,2-а]піразин-7-ону (див. прикбic(тpифтopмeтил)бeнзoiл-3-(1H-iндoл-3-ілметил)лад 3, етапи 1-7), 0,107г піролідину, 0,09г оцтової октагідро-спіро-[2Н-піридо[1,2-а]піразин-7,2'-[1,3]кислоти та 0,47г триацетоксіборогідриду натрію в діоксану] з 150мл оцтової кислоти та 150мл 6М 60мл 1,2-діхлоретану перемішують 3 доби при соляної кислоти нагрівають при 40°С три доби. кімнатній температурі. Одержану суміш виливають Після охолодження до кімнатної температури доу воду, підлужують 5% водним розчином бікарбодають 750мл діхлорметану та 1700мл водного нату натрію та екстрагують діхлорметаном. Оргарозчину 2М гідроксиду натрію. Фази розділяють, нічну фазу концентрують, осад очищують колонководну фазу двічі екстрагують діхлорметаном. вою хроматографією (SiO2, СН2СІ2/МеОН/NH4OH Об'єднані органічні фази промивають водою, кон92:7,5:0,5) і одержують 0,20г 3,5центрують у вакуумі та очищують тонкошаровою бic(тpифтopмeтил)фeнiл-[(3R,7R,9aR)-3-(1Н-індолхроматографією (SiO2, СН2Сl2/МеОН 98:2), одер3-ілметил)-7-піролідин-1-іл-октагідропіридо[1,2жуючи 21,7г (3R,9aR)-2-[3,5а]піразин-2-іл]-метанону (Rf 0,23 біс(трифторметил)бензоіл]-3-(1Н-індол-3-ілметил)(СН2СІ2/МеОН/NH4OH 92:7,5:0,5) (сполука 24) та октагідро-2Н-піридо[1,2-а] піразин-7-ону. Rf 0,12 0,48г 3,5-біс(трифторметил) фeнiл-[(3R,7S,9aR)-3(СН2Сl2/МеОН 98:2) (сполука 11). (1H-iндoл-3-iлмeтил)-7-пipoлiдин-1-iлЕтап 8. До суспензії 5,6г (3R,9aR)-2-[3,5oктaгiдpoпipидo[1,2-а]піразин-2-іл]-метанону (Rf бic(тpифтopмeтил)бeнзoiл]-3-(1H-iндoл-3-ілметил)0,15 (СН2СІ2/МеОН/NH4OH 92:7,5:0,5) (сполука 25). октагідро-2Н-піридо[1,2-а]піразин-7-ону в 75мл Аналогічним чином одержують сполуки 26-28. оцтової кислоти додають 6,78г триацетоксіборогіПриклад 5 (див. схему 3) дриду натрію. Одержану суміш перемішують 1 Етап 1: До суспензії 3,3г (3R,7S,9aR)-(3годину при кімнатній температурі, потім виливають бeнзил-7-гiдpoкci-oктaгiдpompидo[1,2-a]піразин-2у воду й підлужують 2М водним розчином гідрокіл)-3,5-біс(трифторметил)феніл)-метанону, одерсиду натрію. Одержаний осад відфільтровують, жаного аналогічно прикладу 3 (етапи 1-8), у 100мл промивають водою, суспендують у толуолі та кондіхлорметану додають 2,4мл діізоприпилетиламіну центрують у вакуумі, одержуючи 5,7г 3,5та 0,8мл метансульфонілхлориду при 5°С. Одербic(тpифтopмeтил)фeнiл-[(3R,7S,9aR)-7-гідроксі-3жану суміш перемішують при кімнатній температу(1Н-індол-3-ілметил)-октагідропіридо[1,2-а] пірарі 15хв. і концентрують у вакуумі. Осад очищують зин-2-іл]-метанону. Rf 0,35 (СН2Сl2/МеОН 9:1) колонковою хроматографією (SiO2, СН2СІ2/МеОН (сполука 12). 95:5) і одержують 3,8г (3R,7S,9aR)-3-бензил-2-(3,5Етап 9. До суспензії 3,85г 3,5біс(трифторметил)бензоїл)-октагідропіридо[1,2бic(тpифтopмeтил)фeнiл-[(3R,7S,9aR)-7-riдpoкci-3а]піразин-7-іл-ефіру метансульфокислоти. Rf 0,67 (1Н-індол-3-ілметил)-октагідропіридо[1,2-а] піра(СН2СІ2/МеОН 95:5) (проміжна сполука 18). зин-2-іл]-метанону в ацетонітрилі додають 11,6г Етап 2. Суміш 1,97г (3R,7S,9аR)-3-бензил-2чотирибромистого вуглецю та 9,18г трифенілфос(3,5-біс(трифторметил)бензоїл)фіну, одержану суміш перемішують усю ніч при октагідропіридо[1,2-а]піразин-7-іл-ефіру метансукімнатній температурі. Одержаний осад відфільтльфокислоти та 0,44мл морфоліну в 50 мл ацеторовують, фільтрат концентрують у вакуумі. Осад нітрилу нагрівають при 80°С 40 годин. Після охоочищують тонкошаровою хроматографією (SiO2, лодження до кімнатної температури суміш СН2Сl2/МеОН 98:2), одержуючи 3,5г 3,5концентрують у вакуумі, осад очищують колонкобic(тpифтopмeтил)фeнiл-[(3R,9aR)-7-бpoм-3-(1Нвою хроматографією (SiO2, СН2СІ2/МеОН/NH4OH індол-3-ілметил)-октагідропіридо[1,2-а] піразин-2980:18,75:1,25), одержуючи 0,97г (3,5іл]-метанону. ΜΗ+ 588, Rf 0,38 (СН2Сl2/МеОН 97:3) біс(трифторметил)феніл)[(3R,7S,9аR)-3-бензил-7(проміжна сполука 17). морфолін-4-іл-октагідропіридо[1,2-а]піразин-2-іл]Етап 10. Суміш 2,94г 3,5метанону (Rf 0,24 (СН2СІ2/МеОН/NH4OH біс(трифторметил)феніл-[(3R,9аR)-7-бром-3-(1Н96:3,75:0,25) (сполука 29) та 0,75г (3,5індол-3-ілметил)-октагідропіридо[1,2-а]піразин-2біс(трифторметил)феніл)[(3R,7R,9аR)-3-бензил-7іл]-метанону та 0,92мл морфоліну в 100мл ацетоморфолін-4-іл-октагідропіридо[1,2-а]піразин-2-іл]нітрилу нагрівають при 80°С 40 годин. Після охометанону (Rf 0,15 (СН2СІ2/МеОН/NH4OH лодження до кімнатної температури суміш концен96:3,75:0,25) (сполука 30). трують у вакуумі та очищують осад тонкошаровою Аналогічним чином одержують наступні спохроматографією (SiO2, СН2СІ2/МеОН/NH4OH луки: 980:18,75:1,25), одержуючи 1,6г 3,5Сполуки 31 та 32 17 77515 18 Сполука 41; Rf 0,11 (СН2СI2/МеОН/NH4OH ілметилефіру метансульфонової кислоти оцтової 96:3,75:0,25) кислоти. Rf 0,33 (СН2СI2/МеОН 97:3) (сполука 47). Сполука 42; Rf 0,06 (СН2СI2/МеОН/NH4OH Аналогічним чином одержують наступні спо96:3,75:0,25) луки: Сполука 43; Rf 0,08 (СН2СI2/МеОН/NH4OH Сполука 48; Rf 0,50 (СН2СІ2/МеОН 97:3) 96:3,75:0,25) Сполука 49; Rf 0,51 (СН2СІ2/МеОН 97:3) Сполука 44; Rf 0,05 (СН2СI2/МеОН/NH4OH Сполука 50; Rf 0,50 (СН2СІ2/МеОН 97:3) 96:3,75:0,25) Сполука 51; Rf 0,12 (СН2СІ2/МеОН 98:2) Сполуки 45, 46, 55, 56, 58 та 59 Сполука 52; Rf 0,47 (СН2СІ2/МеОН 95:5) Сполука 57; Rf 0,10 (СН2СI2/МеОН/NH4OH Сполука 53; Rf 0,21 (СН2СІ2/МеОН 97:3) 98:1,85:0,15). Сполука 54 Приклад 6 (пролікарські ефіри) Сполуки за винаходом, як от сполуки за прикДо розчину 0,52г (3,5ладами 1-59, мають високу спорідненість до рецебic(тpифтopмeтил)фeнiл)[(3R,6R,8aR)-6пторів НК1 з величинами у аналізі на зв'язування, гiдpoкciмeтил-3-(1Н-індол-3-ілметил)як описано вище. Як витікає з наведених приклагексагідропірол[1,2-а]піразин-2-іл]-метанону в дів, деякі з цих сполук використовувалися як про40мл ацетонітрилу додають 0,17мл діізопропилеміжні при синтезі інших сполук. Сполуки за винатиламіну та розчин 0,8мл ацетилхлориду в 10мл ходом виявляють активність у пробі на цАМФ, а ацетонітрилу при кімнатній температурі. Одержану їхні значення pА2 відповідають значенням рK1. суміш перемішують усю ніч при кімнатній темпераДеякі зі сполук за винаходом долають кров'яний турі й концентрують у вакуумі. Осад очищують бар'єр мозку, що видно з їх активності проти сприколонковою хроматографією (SiO2, СН2СI2/МеОН чиненого агоністом нейрокініну тупання лапою у 97:3), одержуючи 0,32г (3,5-біс (трифторметил) піщанок. Ця властивість робить їх корисними для бензоїл) [(3R,6R, 8aR)-6-гiдpoкciмeтил-3-(1Н-індоллікування розладів ЦНС. 3-ілметил)-гексагідропірол [1,2-а]піразин-6Спол. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 X О О О О О О О О О О О О О О О О О О О O O O O O O O O O О О О О О О О R1 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індoліл 3-індoліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл феніл феніл феніл феніл 3-індоліл 3-індоліл 3-індоліл R2 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 3-CF3 R3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 5-CF3 36 О 3-індоліл 3-CF3 5-CF3 37 О 3-індоліл 3-CF3 5-CF3 38 О 3-індоліл 3-CF3 5-CF3 R4 ОН морфолін-4-іл морфолін-4-іл морфолін-4-іл морфолін-4-іл ОСН2СН2СН2О =О ОН морфолін-4-іл морфолін-4-іл морфолін-4-іл морфолін-4-іл морфолін-4-іл морфолін-4-іл піперидин-1-іл піперидин-1-іл 2,6-діметил-морфолін-4-іл 2,6-діметил-морфолін-4-іл Імідазол-1-іл Піролідин-1-іл Піролідин-1-іл Діетиламін Діетиламін Морфолін-4-іламін Морфолін-4-іл Морфолін-4-іл Морфолін-4-іл Морфолін-4-іл 1,1-діоксо-тіоморфолін-4-іл 1,1-діоксо-тіоморфолін-4-іл 3-метоксіметил-морфолін-4-іл 3,5-біс(метоксіметил)-морфолін4-іл 3,5-біс(метоксіметил)-морфолін4-іл 3-окса-8-азабіцикло[3.2.1]окт-8ил R5 R6 СН2ОН CH2N(CH2CH2)2O CH2N(CH2CH2)2O CH2N(CH2CH2)2O n 1 1 1 1 1 1 1 1 1 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 3 R R R R R R R R R R R R R R R R S S R R R R R R R R R R R R R R R R R 6 R R R S 7 a R R S R R S S S R S R R S R R R R R R R S R R S S S S S R S R R S R R R S R S R R R S R R R S R RS R R R S R R S S S R R S R RS R 2 R S R 2 R R R 2 R RS R 19 77515 20 39 40 41 42 43 44 45 46 47 48 49 50 51 52 О О О О O O O O O O O О O O 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-індоліл 3-CF3 5-CF3 Транс-3,5-діметил-морфолін-4-іл 3-CF3 5-CF3 Ціс-3,5-діметил-морфолін-4-іл 3-СI 5-СI Морфолін-4-іл 3-СI 5-СI Морфолін-4-іл 3-СН3 5-СН3 Морфолін-4-іл 3-СН3 5-СН3 Морфолін-4-іл 3-CF3 5-F Морфолін-4-іл 3-CF3 5-F Морфолін-4-іл 3-CF3 5-CF3 3-CF3 5-CF3 3-CF3 5-CF3 3-CF3 5-CF3 3-CF3 5-CF3 3-CF3 5-CF3 53 O 3-індоліл 3-CF3 5-CF3 54 55 56 57 O O О O 3-CF3 3-CF3 3-CF3 2-CF3 5-CF3 5-CF3 5-CF3 5-CF3 Морфолін-4-іл Морфолін-4-іл Морфолін-4-іл СН2ОСОСН3 СН2ОСОС(СН3)3 СН2ОСО(СН2)5СН3 СН2ОСО(СН2)8СН3 СН2ОСО(СН2)2СН3 СН2ОСОСН2ОСОСН3 СН2ОН ефір нікотино1 вої кислоти CH2OCOCH2N(CH3)2 1 2 2 2 3-CF3 5-CF3 Морфолін-4-іл 2 3-CF3 5-CF3 Морфолін-4-іл 2 58 59 3-індоліл 4-фторфеніл 4-фторфеніл 3-індоліл Бензо[b]тіофенO 3-іл Бензо[b]тіофенO 3-іл Комп’ютерна верстка О. Гапоненко Підписне 2 2 2 2 2 2 2 2 1 1 1 1 1 1 R R R R R R R R R R R R R R RS RS R S R S R S R R R R R R R R R R R R R R R R R R R R R R R R R R R R R S R R R R R R R R S R S Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDiazabicyclo alkane derivatives possessing neuroldnin-nk1 receptor antagonistic activity
Автори англійськоюIwema Bakker, Wouter I., Iwema Bakker Wouter I., Mccreary Andrew C., Banga Ajay K, van Scharrenburg Gustaaf J. M.
Назва патенту російськоюПроизводные диазобициклоалкана с антагонистической активностью в отношении рецептора нк1
Автори російськоюИвема Баккер Воутер И., Маккрири Эндрю К., ван Шаренбург Густав Й.М.
МПК / Мітки
МПК: A61P 11/08, A61P 25/06, A61P 19/00, A61P 25/28, A61P 17/06, A61P 43/00, A61P 25/00, A61P 13/10, A61P 7/10, A61P 9/10, A61P 29/00, C07D 487/04, A61P 17/00, A61P 37/08, A61P 13/02, C07D 491/10, A61P 25/22, A61K 31/5377, A61P 1/00, A61P 11/06, A61P 25/24, A61P 11/16, A61K 31/541, A61P 25/04, A61P 25/18, A61P 27/16, A61P 19/02, A61P 9/00, A61P 1/08, A61P 17/02, C07D 471/04, A61K 31/4985, A61P 9/12, A61K 31/5386, C07D 519/00, A61P 17/04
Мітки: нк1, діазобіциклоалкану, похідні, активністю, антагоністичною
Код посилання
<a href="https://ua.patents.su/10-77515-pokhidni-diazobicikloalkanu-z-antagonistichnoyu-aktivnistyu-shhodo-nk1.html" target="_blank" rel="follow" title="База патентів України">Похідні діазобіциклоалкану з антагоністичною активністю щодо нк1</a>
Попередній патент: Пристрій для вимірювання кутової швидкості
Наступний патент: Сталева заготовка для виготовлення прес-форми для лиття під тиском пластмаси або лиття металів, або для виготовлення деталей металообробкою
Випадковий патент: Пристрій для транспортування текстильних пакувань












