Стабільна кристалічна сіль 1-азабіцикло[2.2.2]окт-3-илового складного ефіру (r)-3-фторфеніл-3,4,5-трифторбензилкарбамінової кислоти
Номер патенту: 102083
Опубліковано: 10.06.2013
Автори: Ідальго Родрігес Хосе, Масіп Масіп Ісабель, Серра Комас Марія дель Кармен, Катена Руіс Хуан Лоренсо
Формула / Реферат
1. D-тартратна сіль сполуки І (1-азабіцикло[2.2.2]окт-3-иловий складний ефір (R)-3-фторфеніл-3,4,5-трифторбензилкарбамінової кислоти) структурної формули:
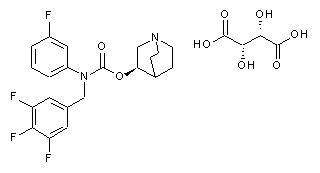 ,
,
яка має стехіометрію з відношенням сполуки І до D-винної кислоти, яке дорівнює 1:1, і в формі кристалічного поліморфа І, який характеризується картиною рентгенівської порошкової дифрактограми з піками при значеннях 2q при 4,6±0,2, 5,6±0,2, 9,2±0,2, 10,0±0,2, 10,8±0,2, 11,9±0,2, 14,0±0,2, 15,9±0,2, 16,4±0,2, 16,8±0,2, 18,9±0,2, 19,2±0,2, 19,6±0,2, 20,9±0,2, 21,8±0,2, 22,3±0,2, 23,0±0,2, 24,0±0,2 і 24,6±0,2.
2. Сіль за п. 1, яка являє собою безводну форму кристалічної D-тартратної солі.
3. Фармацевтична композиція, що містить сіль за будь-яким з пп. 1, 2 зі щонайменше одним фармацевтично прийнятним носієм або ексципієнтом.
4. Сіль за будь-яким з пп. 1, 2 для застосування як лікарського засобу.
5. Застосування солі за будь-яким з пп. 1, 2 при одержанні лікарського засобу для лікування захворювання або патологічного стану, пов'язаного з розладами сечостатевої системи.
6. Застосування солі за п. 5, в якому захворювання, пов'язане з розладами сечостатевої системи, являє собою нетримання сечі.
7. Застосування солі за п. 5, в якому захворювання, пов'язане з розладами сечостатевої системи, являє собою гіперактивний сечовий міхур.
8. Спосіб лікування захворювання або патологічного стану, пов'язаного з розладами сечостатевої системи, за яким суб'єкту, що потребує цього, вводять терапевтично ефективну кількість солі за будь-яким з пп. 1, 2.
9. Спосіб за п. 8, в якому захворювання або патологічний стан, пов'язаний з розладами сечостатевої системи, являє собою нетримання сечі.
10. Спосіб за п. 8, в якому захворювання або патологічний стан, пов'язаний з розладами сечостатевої системи, являє собою гіперактивний сечовий міхур.
Текст
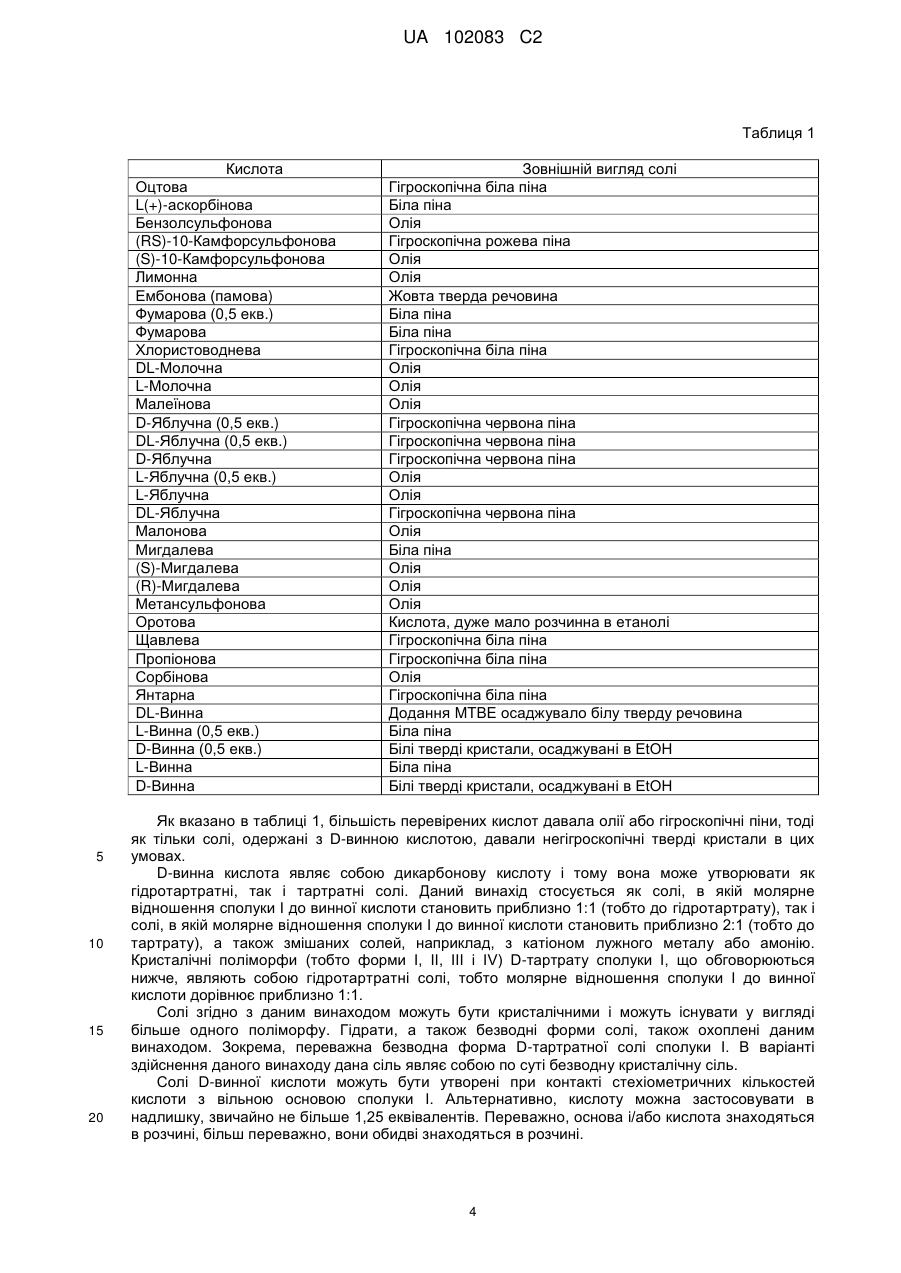
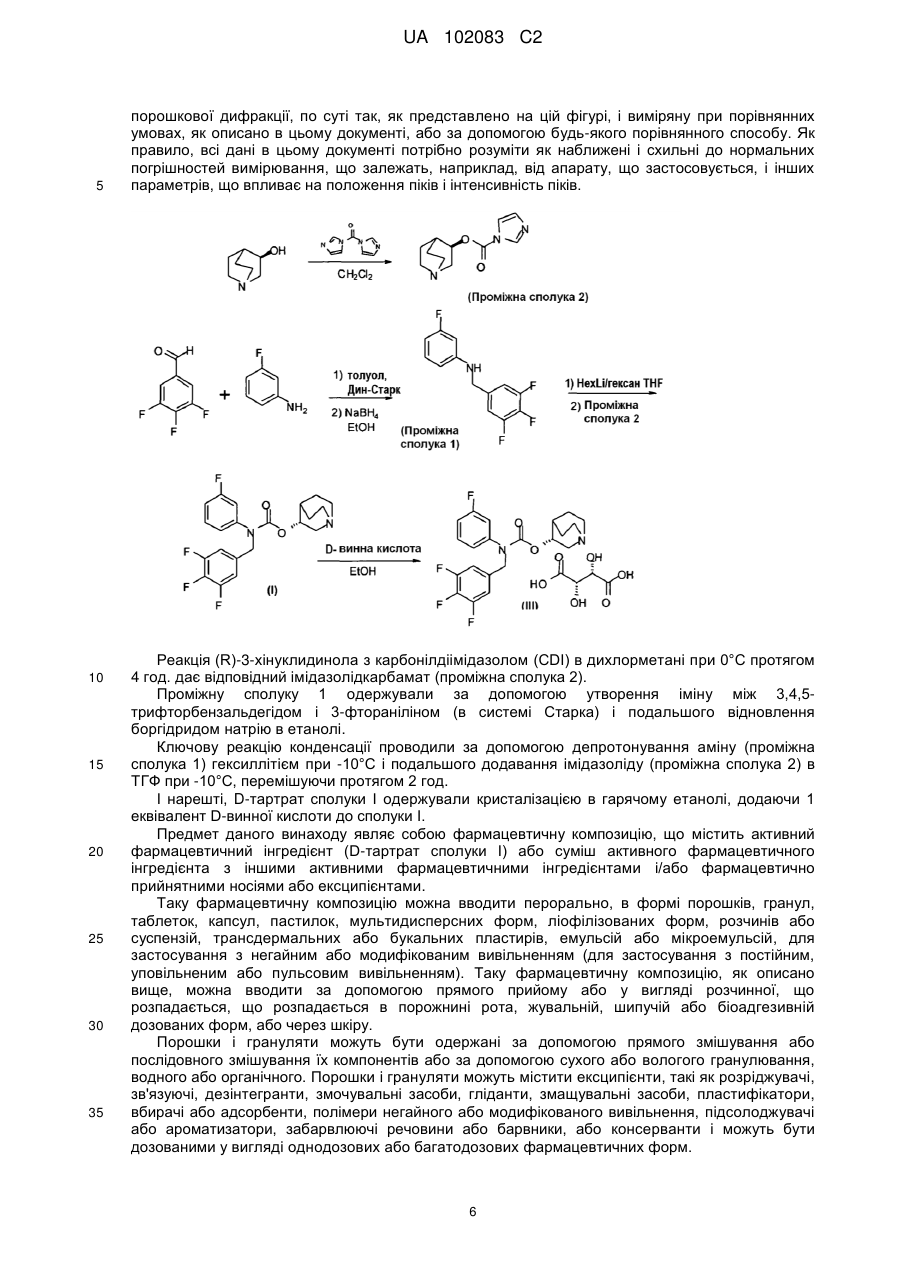
Реферат: OH O F N O OH HO OH N O O F F F . (I) Даний винахід стосується стабільної кристалічної D-тартратної солі 1-азабіцикло[2.2.2]окт-3илового складного ефіру (R)-3-фторфеніл-3,4,5-трифторбензилкарбамінової кислоти формули (І) та її застосування як лікарського засобу, зокрема для лікування нетримання сечі й інших захворювань, пов'язаних з сечостатевими розладами. UA 102083 C2 (12) UA 102083 C2 UA 102083 C2 5 Галузь техніки, до якої належить винахід Даний винахід стосується стабільної кристалічної солі 1-азабіцикло[2.2.2]окт-3-илового складного ефіру (R)-3-фторфеніл-3,4,5-трифторбензилкарбамінової кислоти і фармацевтичних препаратів цієї солі, зокрема, для медичного застосування, включаючи лікування непереборного позиву до сечовипускання або інших захворювань, пов'язаних з сечостатевими розладами. Передумови створення винаходу WO 0200652 розкриває сполуку I (1-азабіцикло[2.2.2]окт-3-иловий складний ефір ((R)-3фторфеніл-3,4,5-трифторбензилкарбамінової кислоти), що має наступну формулу (I) 10 15 20 25 30 35 Сполука I розкрита також в WO 2004000840. Крім того, сполука I представлена в WO 2003053966 у вигляді гідрохлоридної солі як проміжна сполука в синтезі інших сполук. Однак ця кислотно-адитивна сіль, відома з прототипу, має недолік, що полягає в тому, що її фізикохімічна стабільність є незадовільною. При зберіганні препарату вказаної відомої солі спостерігали прогресуюче розкладання, що супроводжувалося збільшенням кількості забруднень і їх числа. Очевидно, цю проблему ще більш посилюють несприятливі умови навколишнього середовища, такі як світло, тепло, вологість або кислотність. Суть винаходу Було особливо важко знайти стабільні, кристалічні форми 1-азабіцикло[2.2.2]окт-3-илового складного ефіру (R)-3-фторфеніл-3,4,5-трифторбензилкарбамінової кислоти. Гідрохлоридна сіль сполуки I має недолік, що полягає в тому, що вона є високо гігроскопічною і внаслідок поглинання вологи її очищена спочатку біла піноподібна форма швидко перетворюється в липку смолоподібну речовину. Таким чином, залишається потреба в солі 1-азабіцикло[2.2.2]окт-3илового складного ефіру (R)-3-фторфеніл-3,4,5-трифторбензилкарбамінової кислоти, яка утворить форми кристалічної твердої речовини, що володіє бажаною морфологією, є стабільною в присутності води і в умовах високої відносної вологості (вище 85%) і може бути легко одержана у великих масштабах. У цей час було знайдено, що вищезгадану задачу можна вирішити з D-тартратною сіллю сполуки I. D-тартратна сіль більш стабільна, ніж гідрохлоридна сіль, при кімнатній і підвищеній температурі і при відносно високій вологості і у водних середовищах. Крім того, було знайдено, що ця D-тартратна сіль в кристалічній формі є стабільною, добре розчинною у воді, з нею зручно поводитися і її легко переробляти в технологічних процесах. Таким чином, перший аспект даного винаходу стосується D-тартратної солі сполуки I (1азабіцикло[2.2.2]окт-3-илового складного ефіру (R)-3-фторфеніл-3,4,5трифторбензилкарбамінової кислоти) структурної формули (II): 1 UA 102083 C2 5 10 15 20 25 30 35 40 45 що володіє стехіометрією з відношенням сполуки I до D-винної кислоти, яке дорівнює 1:1, і що має форму кристалічного поліморфа I, який характеризується картиною рентгенівської порошкової дифрактограми з піками при значеннях 2θ, показаних на фіг. 1. Другий аспект даного винаходу стосується фармацевтичної композиції, що містить Dтартратну сіль сполуки I, як описано вище, з щонайменше одним фармацевтично прийнятним носієм або ексципієнтом. Третій аспект даного винаходу стосується D-тартратної солі сполуки I, як описано вище, для застосування як лікарський засіб. Подальший аспект даного винаходу стосується застосування D-тартратної солі сполуки I, як описано вище, при одержанні лікарського засобу для лікування захворювання або патологічного стану, пов'язаного з сечостатевими розладами, зокрема, для лікування нетримання сечі, і, більш конкретно, для лікування гіперактивного сечового міхура. Подальший аспект даного винаходу стосується способу лікування захворювання або патологічного стану, пов'язаного з сечостатевими розладами, зокрема, лікування нетримання сечі, і, більш конкретно, лікування гіперактивного сечового міхура, що включає в себе введення суб'єкту, потребуючому цього, терапевтично ефективної кількості D-тартратної солі сполуки I, як описано вище. Короткий опис креслень Фіг. 1: Показує рентгенівську порошкову дифрактограму (XRPD) поліморфа I кристалічної Dтартратної солі сполуки I (одержану із застосуванням К-випромінювання міді), приготованого в прикладі 2. Фіг. 2: Показує рентгенівську порошкову дифрактограму (XRPD) поліморфа II кристалічної D-тартратної солі сполуки I (одержану із застосуванням К-випромінювання міді), одержаного в прикладі 3. Фіг. 3: Показує DSC (диференціальну скануючу калориметрію) кристалічної D-тартратної солі сполуки I, одержаної в прикладі 2. Фіг. 4: Показує DSC (диференціальну скануючу калориметрію) кристалічної D-тартратної солі сполуки I, одержаної в прикладі 3. Фіг. 5: Показує DSC (диференціальну скануючу калориметрію) кристалічної D-тартратної солі сполуки I, одержаної в прикладі 4. Фіг. 6: Показує DSC (диференціальну скануючу калориметрію) кристалічної D-тартратної солі сполуки I, одержаної в прикладі 5. Фіг. 7: Показує DVS (динамічну сорбцію парів) кристалічної D-тартратної солі сполуки I, одержаної в прикладі 1. Фіг. 8: Показує ФТ-рамановський спектр кристалічної D-тартратної солі сполуки I, одержаної в прикладі 1. Фіг. 9: Показує ФТ-рамановський спектр кристалічної D-тартратної солі сполуки I, одержаної в прикладі 3. Фіг. 10: Показує ФТ-рамановський спектр кристалічної D-тартратної солі сполуки I, одержаної в прикладі 4. Фіг. 11: Показує відмінності ФТ-рамановських спектрів у різних поліморфів (фіг. 8, 9 і 10). Подальші подробиці фігур показані в прикладах, представлених нижче. Докладний опис винаходу Даний винахід стосується D-тартратної солі сполуки I. D-тартрат надає оптимальні властивості для препарату завдяки його стабільності; він має структурну формулу (II): 2 UA 102083 C2 5 10 15 20 25 30 35 Для того щоб розглядатися як кандидат для подальшої розробки як фармацевтичний засіб, сполука повинна володіти не тільки бажаними біологічними властивостями, але і фізичними властивостями, що дозволяють її застосовувати у виробництві фармацевтичної композиції. Зокрема, ця сполука повинна утворювати стабільна, переважно, кристалічну, тверду речовину, яку можна легко виробляти і з якої зручно одержувати рецептурні форми. Дослідження процесів утворення солей надає засоби зміни фізико-хімічних і кінцевих біологічних характеристик лікарського засобу без модифікування його хімічної структури. Форма солі може впливати істотним чином на властивості лікарського засобу. Відбір відповідної солі частково визначають вихід, швидкість і кількість кристалічної структури. Розчинність сольової форми може впливати на її застосовність як лікарського засобу. У тих випадках, де низька розчинність у воді, тобто менше за 10 мг/мл, швидкість розчинення при введенні in vivo може стати лімітуючим кінетичним фактором в процесі абсорбції, приводячи до незадовільної біодоступності. Важливою характеристикою також є гігроскопічність. Сполуки, що мають низьку гігроскопічність, виявляють тенденцію до кращої стабільності і більш легкої технологічної переробки. Бажаною якістю продукту, що застосовується або продається в умовах широкої різноманітності умов навколишнього середовища, є стабільність при низькій і високої відносної вологості. Автори даного винаходу виявили, що важко одержати сіль сполуки I, придатну для фармацевтичної рецептури. Даний винахід подолав ці проблеми завдяки застосуванню Dтартратної солі, розкритої в цьому документі, яка є кристалічною, відносно негігроскопічною і звичайно має кращі фізичні властивості, ніж інші солі даної сполуки. Крім того, було знайдено, що кінцевий вміст забруднень може бути значно зменшений за допомогою осадження цієї Dтартратної солі сполуки I, як описано в цьому документі. Для того щоб відібрати найбільш відповідну сіль сполуки I і мінімізувати небажані гігроскопічні властивості гідрохлориду, було випробувано декілька кислот. Вільну основу сполуки I розчиняли в гарячому етанолі і потім додавали розчин кислоти в гарячому етанолі. Потім суміш перемішували і нагрівали протягом 30 хв. Після охолоджування до кімнатної температури розчинник видаляли за допомогою випаровування. Перевірені кислоти включали в себе оцтову, L-аскорбінову, бензолсульфонову, (RS)-10-камфорсульфонову, (S)-10камфорсульфонову, лимонну, ембонову (памову), фумарову, DL-молочну, L-молочну, малеїнову, D-яблучну, L-яблучну, DL-яблучну, малонову, мигдалеву, D-мигдалеву, Lмигдалеву, метансульфонову, оротову, щавлеву, пропіонову, сорбінову, янтарну, DL-винну, Lвинну і D-винну. Результати, що стосуються одержаних солей, були такими, як указано в таблиці 1. 3 UA 102083 C2 Таблиця 1 Кислота Оцтова L(+)-аскорбінова Бензолсульфонова (RS)-10-Камфорсульфонова (S)-10-Камфорсульфонова Лимонна Ембонова (памова) Фумарова (0,5 екв.) Фумарова Хлористоводнева DL-Молочна L-Молочна Малеїнова D-Яблучна (0,5 екв.) DL-Яблучна (0,5 екв.) D-Яблучна L-Яблучна (0,5 екв.) L-Яблучна DL-Яблучна Малонова Мигдалева (S)-Мигдалева (R)-Мигдалева Метансульфонова Оротова Щавлева Пропіонова Сорбінова Янтарна DL-Винна L-Винна (0,5 екв.) D-Винна (0,5 екв.) L-Винна D-Винна 5 10 15 20 Зовнішній вигляд солі Гігроскопічна біла піна Біла піна Олія Гігроскопічна рожева піна Олія Олія Жовта тверда речовина Біла піна Біла піна Гігроскопічна біла піна Олія Олія Олія Гігроскопічна червона піна Гігроскопічна червона піна Гігроскопічна червона піна Олія Олія Гігроскопічна червона піна Олія Біла піна Олія Олія Олія Кислота, дуже мало розчинна в етанолі Гігроскопічна біла піна Гігроскопічна біла піна Олія Гігроскопічна біла піна Додання MTBE осаджувало білу тверду речовина Біла піна Білі тверді кристали, осаджувані в EtOH Біла піна Білі тверді кристали, осаджувані в EtOH Як вказано в таблиці 1, більшість перевірених кислот давала олії або гігроскопічні піни, тоді як тільки солі, одержані з D-винною кислотою, давали негігроскопічні тверді кристали в цих умовах. D-винна кислота являє собою дикарбонову кислоту і тому вона може утворювати як гідротартратні, так і тартратні солі. Даний винахід стосується як солі, в якій молярне відношення сполуки I до винної кислоти становить приблизно 1:1 (тобто до гідротартрату), так і солі, в якій молярне відношення сполуки I до винної кислоти становить приблизно 2:1 (тобто до тартрату), а також змішаних солей, наприклад, з катіоном лужного металу або амонію. Кристалічні поліморфи (тобто форми I, II, III і IV) D-тартрату сполуки I, що обговорюються нижче, являють собою гідротартратні солі, тобто молярне відношення сполуки I до винної кислоти дорівнює приблизно 1:1. Солі згідно з даним винаходом можуть бути кристалічними і можуть існувати у вигляді більше одного поліморфу. Гідрати, а також безводні форми солі, також охоплені даним винаходом. Зокрема, переважна безводна форма D-тартратної солі сполуки I. В варіанті здійснення даного винаходу дана сіль являє собою по суті безводну кристалічну сіль. Солі D-винної кислоти можуть бути утворені при контакті стехіометричних кількостей кислоти з вільною основою сполуки I. Альтернативно, кислоту можна застосовувати в надлишку, звичайно не більше 1,25 еквівалентів. Переважно, основа і/або кислота знаходяться в розчині, більш переважно, вони обидві знаходяться в розчині. 4 UA 102083 C2 5 10 15 20 25 30 35 40 45 50 55 60 Взагалі кажучи, кристалічні солі згідно з даним винаходом можуть бути одержані за допомогою змішування розчину кожного реагенту в розчиннику, тобто в одному придатному розчиннику або у придатній суміші розчинників, переважно, при кімнатній температурі або при підвищеній температурі, або за допомогою додавання розчину будь-якого з реагентів до твердої форми іншого реагенту з подальшим осадженням кристалічної солі сполуки I. Термін «розчинник», що використовується в даному описі, включає в себе як один розчинник, так і суміш різних розчинників. Вважають зрозумілим, що розчинник може містити воду, наприклад, в залежності від обставин, приблизно 0-20% води. Термін «придатний розчинник», що використовується в даному описі відносно одержання D-тартратної солі і перекристалізації, визначає будь-який нижчий алканольний, водний або кетоновий розчинник, в якому розчинна сполука I, і включає в себе первинні, вторинні і третинні спирти і відповідні кетони, що містять від 1 до 6 атомів вуглецю. Придатні нижчі алканольні розчинники включають в себе, але не обмежуються ними, метанол, етанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, 2-метил-1пропанол, 1,1-диметилетанол і циклогексанол. Поліпшений вихід може бути одержаний за допомогою випаровування деякого або всіх розчинників або за допомогою кристалізації при підвищених температурах з подальшим контрольованим охолоджуванням, переважно, постадійним. Для поліпшення відновлюваності виробничого процесу, розподілу частинок по розмірах і форми продукту можна застосовувати ретельний контроль температури осадження і введення затравки. Особливо хороші значення виходу можуть бути одержані із застосуванням EtOH як розчинника. Звичайно 1азабіцикло[2.2.2]окт-3-иловий складний ефір (R)-3-фторфеніл-3,4,5трифторбензилкарбамінової кислоти і один еквівалент D-винної кислоти розчиняють в гарячому EtOH. Введення як затравки невеликої кількості раніше одержаних кристалів може допомогти ініціювати кристалізацію. Даний винахід також надає чотири кристалічні поліморфні форми D-тартрату сполуки I (далі в цьому документі вони називаються Формами I, II, III і IV, відповідно). Фармацевтична композиція згідно з даним винаходом може містити приблизно 20, 30, 40, 50, 60, 70,80, 90, 95, 96, 97, 98, 99, 99,1, 99,2, 99,3, 99,4, 99,5, 99,6, 99,7, 99,8, 99,9 або 100% по масі Форми I, II, III або IV D-тартрату сполуки I, з розрахунку на 100% загальної маси D-тартрату сполуки I в фармацевтичній композиції (або на загальну масу кристалічного D-тартрату сполуки I в фармацевтичній композиції). Кристалічна поліморфна Форма I D-тартрату сполуки I стабільна при кімнатній температурі. Форма I фізично стабільна при кімнатній температурі, але вона енантіотропно пов'язана з формою II, і це означає, що при кімнатній температурі форма I (більше низько плавкий поліморф) є більш стабільною формою, а при більш високих температурах більш стабільною формою є більш високо плавкий поліморф (форма II). Згідно з диференціальною скануючою калориметрією (DSC), форма I має подвійну ендотерму приблизно при 139°С і приблизно при 145°С (див. фіг. 3). Форма I може бути одержана з вільної основи сполуки I таким чином. Вільну основу сполуки I і D-винну кислоту розчиняють в гарячому етанолі. Потім розчин повільно охолоджують (наприклад, протягом 3 годин або більш довго) одержуючи форму I D-тартрату сполуки I. Кристали форми I можна збирати будь-яким способом, відомим в даній галузі техніки. Форму I можна також одержувати, готуючи суспензію, що містить форму II, форму III або форму IV, або їх суміш з EtOH при кімнатній температурі. Будь-яка кристалічна речовина, одержана вищезгаданими способами, може бути зібрана за допомогою технічних прийомів, відомих кваліфікованим фахівцям в даній галузі, таких як, наприклад, фільтрація. Кристалічна поліморфна Форма II D-тартрату сполуки I була одержана в умовах контрольованої температури, і згідно DSC вона має ендотерму приблизно при 149°С (див. фіг. 4). Кристалічна поліморфна форма III D-тартрату сполуки I була одержана за допомогою урівноваження у воді, і згідно з DSC вона має широку ендотерму приблизно при 110°С (див. фіг. 5). Кристалічна поліморфна форма IV D-тартрату сполуки I була одержана за допомогою урівноваження в гарячому етанолі (60°С), і згідно з DSC вона має ендотерму приблизно при 162°С (див. фіг. 6). Вирази, подібні виразу «кристалічна форма специфічної солі сполуки I, що характеризується рентгенівською порошковою дифрактограмою, показаною на фіг. (1)», означають кристалічну форму солі сполуки І, що розглядається, яка має рентгенівську порошкову дифрактограму, по суті подібну фіг. (1), тобто демонструючу картину рентгенівської 5 UA 102083 C2 5 10 15 20 25 30 35 порошкової дифракції, по суті так, як представлено на цій фігурі, і виміряну при порівнянних умовах, як описано в цьому документі, або за допомогою будь-якого порівнянного способу. Як правило, всі дані в цьому документі потрібно розуміти як наближені і схильні до нормальних погрішностей вимірювання, що залежать, наприклад, від апарату, що застосовується, і інших параметрів, що впливає на положення піків і інтенсивність піків. Реакція (R)-3-хінуклидинола з карбонілдіімідазолом (CDI) в дихлорметані при 0°С протягом 4 год. дає відповідний імідазолідкарбамат (проміжна сполука 2). Проміжну сполуку 1 одержували за допомогою утворення іміну між 3,4,5трифторбензальдегідом і 3-фтораніліном (в системі Старка) і подальшого відновлення боргідридом натрію в етанолі. Ключову реакцію конденсації проводили за допомогою депротонування аміну (проміжна сполука 1) гексиллітієм при -10°С і подальшого додавання імідазоліду (проміжна сполука 2) в ТГФ при -10°С, перемішуючи протягом 2 год. І нарешті, D-тартрат сполуки I одержували кристалізацією в гарячому етанолі, додаючи 1 еквівалент D-винної кислоти до сполуки I. Предмет даного винаходу являє собою фармацевтичну композицію, що містить активний фармацевтичний інгредієнт (D-тартрат сполуки I) або суміш активного фармацевтичного інгредієнта з іншими активними фармацевтичними інгредієнтами і/або фармацевтично прийнятними носіями або ексципієнтами. Таку фармацевтичну композицію можна вводити перорально, в формі порошків, гранул, таблеток, капсул, пастилок, мультидисперсних форм, ліофілізованих форм, розчинів або суспензій, трансдермальних або букальних пластирів, емульсій або мікроемульсій, для застосування з негайним або модифікованим вивільненням (для застосування з постійним, уповільненим або пульсовим вивільненням). Таку фармацевтичну композицію, як описано вище, можна вводити за допомогою прямого прийому або у вигляді розчинної, що розпадається, що розпадається в порожнині рота, жувальній, шипучій або біоадгезивній дозованих форм, або через шкіру. Порошки і грануляти можуть бути одержані за допомогою прямого змішування або послідовного змішування їх компонентів або за допомогою сухого або вологого гранулювання, водного або органічного. Порошки і грануляти можуть містити ексципієнти, такі як розріджувачі, зв'язуючі, дезінтегранти, змочувальні засоби, гліданти, змащувальні засоби, пластифікатори, вбирачі або адсорбенти, полімери негайного або модифікованого вивільнення, підсолоджувачі або ароматизатори, забарвлюючі речовини або барвники, або консерванти і можуть бути дозованими у вигляді однодозових або багатодозових фармацевтичних форм. 6 UA 102083 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таблетки, вказані вище, можуть бути одержані з порошків, гранулятів, інших таблеток або коржиків або їх комбінацій. Ці таблетки можуть бути традиційними, багатошаровими, шипучими, що розпадаються, розчинними, що розпадаються в порожнині рота, шлунково-стійкими, з модифікованим вивільненням, біоадгезивними, жувальними, букальними або укладеними в матриці дозованими формами. Крім того, ці таблетки можуть бути покриті оболонкою з одного або більше функціональних шарів, щоб захищати активний фармацевтичний інгредієнт або модифікувати його вивільнення. Будь-який шар може містити активний фармацевтичний інгредієнт, окремо або з одним або більше з полімерів модифікованого вивільнення. Таблетки, описані вище, можуть містити ексципієнти, такі як розріджувачі, зв'язуючі, дезінтегранти, змочувальні засоби, гліданти, змащувальні засоби, пластифікатори, вбирачі або адсорбенти, полімери негайного або модифікованого вивільнення, підсолоджувачі або ароматизатори, забарвлюючі речовини або барвники, або консерванти. Капсули, вказані вище, можуть бути одержані з желатину, HPMC, целюлозних або полісахаридних похідних, муки зернових культур або їх комбінації і можуть бути м'якими або твердими капсулами. Капсули можуть містити порошки, грануляти, мультидисперсні фармацевтичні форми, таблетки, пастилки, рідини або напівтверді речовини або їх комбінацію. Крім того, ці капсули можуть бути покриті оболонкою з одного або більше функціональних шарів, щоб захищати активний фармацевтичний інгредієнт або модифікувати його вивільнення. Будь-який шар може містити активний фармацевтичний інгредієнт, окремо або з одним або більше з полімерів модифікованого вивільнення. Капсули, описані вище, можуть містити ексципієнти, такі як розріджувачі, зв'язуючі, дезінтегранти, змочувальні засоби, гліданти, змащувальні засоби, пластифікатори, вбирачі або адсорбенти, полімери негайного або модифікованого вивільнення, підсолоджувачі або ароматизатори, забарвлюючі речовини або барвники, або консерванти. Полідисперсні фармацевтичні форми можна вводити у вигляді однієї дози або багатьох доз. Ці фармацевтичні форми можна застосовувати у вигляді капсул, таблеток, саше або вузьких пластинок (смужок), суспензій, розчинів, флаконів, колб або бутлів або будь-яких інших засобів. Такі мультидисперсні фармацевтичні форми можна застосовувати для безпосереднього використання або використання з модифікованим вивільненням, вони можуть бути одержані з інертного ядра або активного ядра, що містить активний фармацевтичний інгредієнт. Ядра можуть бути покриті оболонкою з одного або більше функціональних шарів, щоб захищати або модифікувати вивільнення активного фармацевтичного інгредієнта. Цей інгредієнт може бути включений в один або більше шарів, окремо або з одним або більше з полімерів модифікованого вивільнення. Додаткові шари, що включають в себе захисні засоби або полімери модифікованого вивільнення, можуть бути включені в інший зовнішній шар, сусідній з шаром, що містить активний фармацевтичний інгредієнт. Такі мультидисперсні фармацевтичні форми можуть містити ексципієнти, такі як розріджувачі, зв'язуючі, дезінтегранти, змочувальні засоби, гліданти, змащувальні засоби, пластифікатори, вбирачі або адсорбенти, полімери негайного або модифікованого вивільнення, підсолоджувачі або ароматизатори, забарвлюючі речовини або барвники, або консерванти. Рідкі або напівтверді фармацевтичні форми, такі як розчини, суспензії, гелі, емульсії, мікроемульсії і інше, включають в себе активний інгредієнт в розчинній формі, дисперсній або мультидисперсній формі і адекватні ексципієнти. Вони можуть бути дозовані в формі однієї дози або багатьох доз, можливо, приготованих для негайного введення (ex tempore). Вони можуть містити ексципієнти, такі як емульгатори, засоби, що підвищують розчинність, дисперсанти, зволожувачі, співемульгатори, пом’якшувальні засоби, засоби, що збільшують в'язкість, наповнювачі, консерванти, регулятори рН, ароматизатори і підсолоджувачі. Ці компоненти можуть бути рідинами водної, ліпідної або органічної природи. Активний фармацевтичний інгредієнт може вивільнятися через шкіру або будь-яку відповідну зовнішню поверхню, включаючи мембрани слизової, такі як ті, що знаходяться у роті. Трансдермальні або букальні пластири можуть інкорпорувати лікарський засіб в сам виріб, в матрицю, в адгезив, або в резервуар. Рецептури можуть включати в себе змочувальні засоби, полімери безпосереднього або модифікованого вивільнення, підсилювачі (енхансери), емульгатори, дисперсанти, співемульгатори, засоби, що підвищують розчинність, адгезиви, зволожувачі, пом’якшувачі, засоби, що збільшують в'язкість, наповнювачі, консерванти або регулятори рН. Ці компоненти можуть бути напівтвердими речовинами або рідинами водної, ліпідної або органічної природи. Матриця може бути твердою або напівтвердою і складатися з одного або більше шарів. На одній з сторін пластири мають проникну мембрану і деяку форму адгезиву для утримання пластиру в потрібному місці на шкірі пацієнта з мембраною, що знаходиться в контакті з шкірою, так що лікарський засіб може дифундувати з резервуара 7 UA 102083 C2 5 10 15 20 25 30 35 40 45 50 55 пластиру в шкіру і крізь неї. Зовнішня сторона пластиру утворена з непроникного шару матеріалу; по периметру пластиру мембранна сторона і зовнішня сторона сполучаються, утворюючи між двома шарами резервуар для лікарського засобу і носія. Приклади Аналітичні методи 1 13 Спектри H-ЯМР і C-ЯМР записували при 400 МГц і 100,61 МГц, відповідно, на приладі Bruker ARX 400. Як розчинник застосовували диметилсульфоксид (99,8% D), як внутрішній референтний стандарт застосовували тетраметилсилан (TMS). Чистоту D-тартрату сполуки I визначали за допомогою ВЕРХ-МС з використанням колонки Gemini 5 мкм C18 110A, 50×4,6 мм при 25°С. Мобільною фазою був 70%-ний розчин А (0,025 M ортофосфорна кислота при рН 3,0-3,1 з триетиламіном) і 30%-ний розчин В (ацетонітрил/метанол (9:1)) при швидкості потоку 1,4 мл/хв. Тривалість хроматограми 20 хв. Детектування здійснювали з використанням УФ-детектора при 200 нм. D-тартрат сполуки I показував час втримання, що дорівнював приблизно 6,5 хв. Енантіомерний надлишок сполуки I визначали з використанням колонки Quirabiotic V-2 column, 25×0,46 см L, при 25°С. Рухома фаза складалася з 0,1% (маса до об'єму) трифтороцтової кислоти в метанолі, яку доводили до рН близько 6,5 доданням гідроксиду амонію, швидкість потоку 0,5 мл/хв., тривалість хроматограми 25 хв. Детектування здійснювали з використанням УФ-детектора при 230 нм. D-тартрат сполуки I мав час втримання, що дорівнював приблизно 16 хв., а його енантіомер мав час втримання, що дорівнював приблизно 17 хв. Точки плавлення вимірювали з використанням диференціальної скануючої калориметрії (DSC). Обладнання складалося з приладу Perkin Elmer DSC 7 або Perkin Elmer Pyris 1 з різними тиглями (золото, глинозем, відкритий, закритий, з мікроотвором), із змінними швидкостями нагрівання і змінними діапазонами. Рентгенівські порошкові дифрактограми вимірювали на приладах Philips X'Pert PW 3040 або Philips PW 1710 з використання Кα-випромінювання Cu. Зразки вимірювали в режимі відображення в діапазоні 2θ від 2° до 50°. ФТ-рамановські спектри реєстрували на обладнанні Bruker RFS100. Nd:YAG, збудження при -1 1064 нм, потужність лазера 100 мВт, Ge-детектор, 64 скани, діапазон 25-3500 см , розрізнення -1 2 см . ТГ-ФТИК (TG-FTIR): Netzsch Thermo-Microbalance TG 209 зі спектрометром Bruker FT-ИК Vector 22. Алюмінієвий тигель (відкритий або з мікроотвором); атмосфера N2, швидкість -1 нагрівання 10°С хв , діапазон 25-250°С. Динамічна сорбція парів (DVS). Обладнання складалося з аналізатора сорбції водяної пари DVS-1 від Surface Measurement Systems, Ltd. Зразок вміщували на кварцовий або платиновий тримач мікровагів, і зразку давали можливість урівноважуватися при 50%-ний відносній вологості до початку попередньо встановленої програми для вологості. Вимірювання питомого обертання проводили з використанням поляриметра моделі Polartronic-E (серійний номер 27586) від Schmidt + Haensch, забезпеченого термостатичною банею моделі TE-8J від Techne. Синтез Приклад 1: Синтез 1-азабіцикло[2.2.2]окт-3-илового складного ефіру (R)-3-фторфеніл-3,4,5трифторбензилкарбамінової кислоти (сполука I). Проміжна сполука 2: 1-Азабіцикло[2.2.2]окт-3-иловий складний ефір (R)-імідазол-1карбонової кислоти До суспензії 1,86 кг (R)-3-хінуклидинола в 30 л дихлорметану додавали 2,92 кг DCI при 0°С. Розчин перемішували протягом 3 год. в інертній атмосфері. Потім додавали 23 л води і екстрагували. Органічний шар сушили над безводним сульфатом натрію. Розчинник відганяли при зниженому тиску. Одержану білу тверду речовину кристалізували в суміші ізопропілацетату (IPAC) з гептаном, з одержанням 24,1 кг сполуки, вказаної в заголовку. ІЧ -1 (KBr, см ): 1746; 8 UA 102083 C2 1 5 10 15 20 25 30 35 40 45 50 H-ЯМР: 1,33-1,43 (м, 1H); 1,47-1,57 (м, 1H); 1,58-1,70 (м, 1H); 1,75-1,87 (м, 1H); 2,07-2,12 (м, 1H); 2,56-2,90 (м, 5H); 3,18 (ддд, J=14,5, J=8, J=2, 1H); 4,95-5,00 (м, 1H); 7,07 (с, 1H); 7,61 (с, 1H); 8,29 (с, 1H). 13 C-ЯМР: 18,9; 23,7; 24,9; 45,7; 46,6; 54,1; 75,7; 117,3; 130,1; 137,1; 147,9. Проміжна сполука 1: (3-Фторфеніл)-(3,4,5-трифторбензил)амін У 300-л реакторі, забезпеченому воронкою Старка і зворотним холодильником, кип'ятили в режимі зворотного холодильника (112°С) толуол (63 л), 3,4,5-трифторбензальдегід (2,1 кг) і 3фторанілін (1,33 кг) протягом 10 год. Після охолоджування розчин, одержаний внаслідок цього, концентрували, одержуючи імін у вигляді масла з кількісним виходом (3,2 кг). Потім додавали етанол (35 л) і боргідрид натрію (0,5 кг). Суспензію, одержану внаслідок цього, перемішували протягом 3 год, потім додавали 42 л води, відганяли етанол і водний шар екстрагували дихлорметаном (2×40 л). Органічний шар сушили над безводним сульфатом натрію. Розчинник відганяли при зниженому тиску, що давало 2,72 кг сполуки, вказаної в заголовку, у вигляді жовтого масла. 1 H-ЯМР: 4,29 (с, 2H); 4,33 (ушир, 1H), 6,28 (дтд, J=11, J=2,5; J=1, 1H), 6,40 (ддд, J=8,5; J=2, J=1, 1H), 6,46 (тдт, J=8,5; J=2,5, J=1); 7,24 (дд, J=8; J=7, 2H); 7,14 (тдд, J=8; J=6,5, J=1). 13 C-ЯМР: 47,1; 99,9 (д, J=25,5); 104,8 (д, J=21); 109,1 (д, J=2); 111,0 (д, J=10,5); 111,0 (д, J=21,5); 149,4 (дд, J=11, J=1); 136,0 (тдд, J=6, J=4, J=2); 139,0 (дт, J=248, J=5); 151,6 (ддд, J=248, J=10, J=4); 164,3 (д, J=241). Сполука I: 1-Азабіцикло[2.2.2]окт-3-иловий складний ефір (R)-3-фторфеніл-3,4,5трифторбензилкарбамінової кислоти До розчину 2,72 кг проміжної сполуки (1) в 17 л ТГФ, охолодженого до -10°С, в інертній атмосфері повільно додавали (2 год.) 3 кг гексиллітію е (33% в суміші гексанів) і суміш, одержану внаслідок цього, перемішували протягом 1 год. при -10°C. Потім при -10°С повільно додавали 2,41 кг проміжної сполуки 2 в 23 л ТГФ (75 хв.). Суміш, одержану внаслідок цього, перемішували протягом 2 год. і цій суміші давали можливість нагріватися до кімнатної температури, після чого додавали воду і розчин екстрагували бутил-трет-метиловим ефіром. Органічну фазу сушили над безводним сульфатом натрію і розчинник видаляли при зниженому тиску, що давало 3,6 кг сполуки, вказаної в заголовку, у вигляді масла оранжевого кольору. Приклад 2 Синтез D-тартратної солі 1-азабіцикло[2.2.2]окт-3-илового складного ефіру (R)-3фторфеніл-3,4,5-трифторбензилкарбамінової кислоти (сполука I) До розчину 3 кг 1-азабіцикло[2.2.2]окт-3-илового складного ефіру (R)-3-фторфеніл-3,4,5трифторбензилкарбамінової кислоти (сполука I) в етанолі (3 л) при 60°С, додавали 1,1 кг Dвинної кислоти в 30 л етанолу, нагрітого до 60°С, і суміш, одержану внаслідок цього, перемішувала протягом 1 год. і потім охолоджували нижче кімнатної температури і витримували при цій температурі протягом 1 години. Відфільтровувати осад і шар на фільтрі промивали етанолом (8 л). З шару на фільтрі відсмоктували велику частину розчинника, і продукт сушили при 45° протягом 16 год. Одержували 3,5 кг сполуки, вказаної в заголовку, у вигляді білої кристалічної твердої речовини. 1 H-ЯМР: 1,45-1,49 (м, 2H) 1,65-1,75 (м, 2H), 2,05 (м, 1H); 2,87-3,01 (м, 3H); 3,07-3,11 (м, 1H); 3,08-3,11 (д, J=14, 1H); 3,39-3,45 (ддд, J=12, J=8, J=2, 1H); 4,00 (с, 2H); 4,83-4,89 (м, 1H); 4,844,89 (д, J=16,5, 1H); 4,93-4,97 (д, J=16,5, 1H); 7,05 (тд, J=8,5; J=2, 1H); 7,21 (дд, J=8; J=1,5, 1H); 7,24 (дд, J=8,5; J=7, 2H); 7,33-7,38 (м, 2H). 13 C-ЯМР: 17,1; 20,4; 24,0; 44,5; 45,1; 51,6; 52,7; 69,5; 72,1; 111,8 (д, J=19,5); 113,4 (д, J=20,5); 114,1 (д, J=22); 122,6; 130,3 (д, J=9); 135,1; 137,8 (дт, J=246, J=16); 142,6 (д, J=9); 150,2 (ддд, J=246, J=9,5, J=3,5); 154,0; 161,9 (д, J=242); 174,7 Елементний аналіз. Розраховано для C25H26F4N2О8: С, 53,77; Н, 4,69; N, 5,02. Знайдено: С, 53,63; Н, 4,73; N, 5,01. Дифрактограма XRPD для одержаних кристалів показана на фіг. 1. 9 UA 102083 C2 Визначали питоме обертання. 1,00 г речовини розбавляли метанолом в 100-мл мірній колбі. α (с=1, MeOH) с=г/100 мл. Виміряне питоме обертання становило -35,2°. Крім того, вимірювали рівноважну розчинність D-тартратної солі в різних розчинниках при 25°С, значення якої (виміряні у вигляді вільної основи) знайшли такими, як указано в таблиці 2. 5 Таблиця 2 Розчинник Метанол Етанол Ізопропіловий спирт Дихлорметан Гексан н-Октанол Вода 0,1н Хлористоводнева кислота 0,1н Гідроксид натрію 10 Розчинність (мг/мл) 258,5 10 1,5 2,2 0,3 0,5 250,8 366,6 0,09 Оцінка гігроскопічності: Ніякого достовірного збільшення маси або зменшення маси не спостерігали в умовах 93%-ої відносної вологості (ВВ) або нижче за це значення. При 97%-ій відносній вологості спостерігали достовірне додання води, але немає ніякої достовірної гігроскопічності, приведеної до стандартних атмосферних умов, як показано в таблиці 3. Таблиця 3 Час (год.) 4 8 14 48 72 96 144 168 192 216 240 15 20 25 Дослідження гігроскопічності (початкова ВВ=0,9692%) 33% 64% 12% ВВ 22% ВВ 43% ВВ 53% ВВ 75% ВВ 85% ВВ 93% ВВ 97% ВВ ВВ ВВ -0,26 -0,16 -0,25 -0,38 -0,19 -0,08 -0,08 0,16 0,16 1,51 -0,20 -0,26 -0,24 -0,32 -0,21 -0,07 0,02 0,13 0,03 1,06 -0,30 -0,25 -0,21 -0,21 -0,16 -0,07 0,01 0,22 0,24 4,36 -0,04 -0,21 -0,19 -0,25 -0,17 0,02 0,06 0,26 0,44 7,86 -0,28 -0,24 -0,23 -0,31 -0,16 -0,07 0,01 0,14 0,41 10,88 -0,30 -0,26 -0,17 -0,30 -0,19 -0,07 -0,06 0,07 0,40 13,77 -0,33 -0,18 -0,30 -0,40 -0,17 0,15 -0,08 0,24 0,43 23,58 -0,32 -0,28 -0,39 -0,34 -0,16 0,15 -0,05 0,18 0,39 23,62 -0,27 -0,21 -0,11 -0,19 -0,20 0,20 0,00 0,15 0,38 23,06 -0,29 -0,19 -0,15 -0,25 -0,14 0,25 0,01 0,23 0,43 22,13 -0,08 -0,11 -0,18 -0,18 0,00 0,59 0,29 0,59 0,81 19,88 Приклад 3 Одержання Форми II D-тартрату сполуки I Форму I (приклад 1) таким чином обробляли при DSC: Закритий тигель (STGF), 0,0295 г, від -1 25 до 143,5°С, 2°С хв , низхідне сканування до 130°С, ізотермічне витримування протягом 15 хвилин, охолоджування до 25°С. Приклад 4 Одержання Форми III D-тартрату сполуки I 0,49 г форми I суспендували в 1 мл води і потім струшували при 20°С протягом 10 хвилин (до розчинення), через 2 год. зразок концентрували. Приклад 5 Одержання форми IV D-тартрату сполуки I 0,522 г форми I суспендували в 1 мл абс. EtOH і потім струшували при 60°С. Через 1 день суспензія зникала і утворювалася нова біла кристалічна кірка, прилипла до стінки контейнера вище шару розчинника. ФОРМУЛА ВИНАХОДУ 30 1. D-тартратна сіль сполуки І (1-азабіцикло[2.2.2]окт-3-иловий складний ефір (R)-3-фторфеніл3,4,5-трифторбензилкарбамінової кислоти) структурної формули: 10 UA 102083 C2 5 10 15 20 , яка має стехіометрію з відношенням сполуки І до D-винної кислоти, яке дорівнює 1:1, і в формі кристалічного поліморфа І, який характеризується картиною рентгенівської порошкової дифрактограми з піками при значеннях 2 при 4,6±0,2, 5,6±0,2, 9,2±0,2, 10,0±0,2, 10,8±0,2, 11,9±0,2, 14,0±0,2, 15,9±0,2, 16,4±0,2, 16,8±0,2, 18,9±0,2, 19,2±0,2, 19,6±0,2, 20,9±0,2, 21,8±0,2, 22,3±0,2, 23,0±0,2, 24,0±0,2 і 24,6±0,2. 2. Сіль за п. 1, яка являє собою безводну форму кристалічної D-тартратної солі. 3. Фармацевтична композиція, що містить сіль за будь-яким з пп. 1, 2 зі щонайменше одним фармацевтично прийнятним носієм або ексципієнтом. 4. Сіль за будь-яким з пп. 1, 2 для застосування як лікарського засобу. 5. Застосування солі за будь-яким з пп. 1, 2 при одержанні лікарського засобу для лікування захворювання або патологічного стану, пов'язаного з розладами сечостатевої системи. 6. Застосування солі за п. 5, в якому захворювання, пов'язане з розладами сечостатевої системи, являє собою нетримання сечі. 7. Застосування солі за п. 5, в якому захворювання, пов'язане з розладами сечостатевої системи, являє собою гіперактивний сечовий міхур. 8. Спосіб лікування захворювання або патологічного стану, пов'язаного з розладами сечостатевої системи, за яким суб'єкту, що потребує цього, вводять терапевтично ефективну кількість солі за будь-яким з пп. 1, 2. 9. Спосіб за п. 8, в якому захворювання або патологічний стан, пов'язаний з розладами сечостатевої системи, являє собою нетримання сечі. 10. Спосіб за п. 8, в якому захворювання або патологічний стан, пов'язаний з розладами сечостатевої системи, являє собою гіперактивний сечовий міхур. 11 UA 102083 C2 12 UA 102083 C2 13 UA 102083 C2 14 UA 102083 C2 15 UA 102083 C2 16 UA 102083 C2 17 UA 102083 C2 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 18
ДивитисяДодаткова інформація
Назва патенту англійськоюStable crystalline salt of (r)-3-fluorophenyl-3,4,5-trifluorobenzylcarbamic acid 1-azabicyclo [2.2.2]oct-3-yl ester
Автори англійськоюCatena Ruiz, Juan Lorenzo, Hidalgo Rodriguez, Jose, Serra Comas, Maria del Carmen, Masip Masip, Isabel
Назва патенту російськоюСтабильная кристаллическая соль 1-азабицикло[2.2.2]окт-3-илового сложного эфира (r)-3-фторфенил-3,4,5-трифторбензилкарбаминовой кислоты
Автори російськоюКатена Руис Хуан Лоренсо, Идальго Родригес Хосе, Серра Комас Мария дель Кармен, Масип Масип Исабель
МПК / Мітки
МПК: A61K 31/439, C07D 453/00
Мітки: складного, стабільна, кислоти, кристалічна, ефіру, r)-3-фторфеніл-3,4,5-трифторбензилкарбамінової, сіль, 1-азабіцикло[2.2.2]окт-3-илового
Код посилання
<a href="https://ua.patents.su/20-102083-stabilna-kristalichna-sil-1-azabiciklo222okt-3-ilovogo-skladnogo-efiru-r-3-ftorfenil-345-triftorbenzilkarbaminovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Стабільна кристалічна сіль 1-азабіцикло[2.2.2]окт-3-илового складного ефіру (r)-3-фторфеніл-3,4,5-трифторбензилкарбамінової кислоти</a>