Похідні хіноліну та їх застосування як інгібіторів тирозинкінази
Номер патенту: 102082
Опубліковано: 10.06.2013
Автори: Мальм Юхан, Вестман Якоб, Нєхотяєва Наталія, Бекман Ульріка, Ванберг Юхан
Формула / Реферат
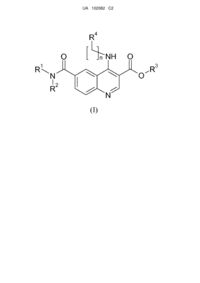
1. Сполука за формулою (І)
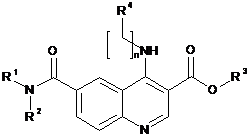 , (I)
, (I)
де
n = 0;
R1 є воднем;
R2 вибирається з насиченого або ненасиченого, розгалуженого або нерозгалуженого С1-10алкілу або С3-12циклоалкілу, заміщеного або незаміщеного фенілу або бензилу;
де
будь-який замісник фенілу або бензилу вибирається з С1-С4алкілу, С2-С4алкенілу, С2-С4алкінілу, С3-С4циклоалкілу, С3-С4циклоалкенілу, С3-С4циклоалкінілу, гідроксилу, аміну, сульфіду, силілу, галогену, нітрилу, карбонової кислоти, сульфокислоти, С1-С4алкокси, С1-С4алкілу вторинного та третинного аміну, С1-С4алкіламіду, С1-С4алкілефірів, С1-С4алкілкетону, С1-С4алкілсульфідів, ефірів С1-С4алкілкарбонових кислот, ефіру С1-С4алкілсульфокислоти, С1-С4алкілсульфону, С1-С4алкілсульфоксиду, С1-С4алкілсульфонаміду, С1-С4аклілового спирту, С1-С4алкілацетилу, С1-С4діалкілдисульфіду,
R3 є воднем;
R4 є заміщеним або незаміщеним С6-С10арилом або С1-С9гетероарилом, де гетероатоми незалежно вибираються з Ν, Ο та S; заміщеним або незаміщеним моно- або біциклічним С3-12циклоалкілом або С1-С9гетероциклілом, де гетероатоми незалежно вибираються з N, O або S;
де
будь-який замісник С6-С10арилу або С1-С9гетероарилу, С3-12циклоалкілу або С1-С9гетероциклілу вибирається з С1-С4алкілу, С2-С4алкенілу, С2-С4алкінілу, С3-С4циклоалкілу, С3-С4циклоалкенілу, С3-С4циклоалкінілу, гідроксилу, аміну, сульфіду, силілу, галогену, нітрилу, карбонової кислоти, сульфокислоти, С1-С4алкокси, С1-С4алкілу вторинного та третинного аміну, С1-С4алкіламіду, С1-С4алкілефірів, С1-С4алкілкетону, С1-С4алкілсульфідів, ефірів С1-С4алкілкарбонових кислот, ефіру С1-С4алкілсульфокислоти, С1-С4алкілсульфону, С1-С4алкілсульфоксиду, С1-С4алкілсульфонаміду, С1-С4аклілового спирту, С1-С4алкілацетилу, С1-С4діалкілдисульфіду;
та її фармацевтично прийнятні солі.
2. Сполука за п. 1, яка відрізняється тим, що R2 вибирається з С1-4алкілу та С3-4циклоалкілу.
3. Сполука за п. 1, яка відрізняється тим, що R2 є С1-4алкілом.
4. Сполука за п. 1, яка відрізняється тим, що R2 є метилом.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що R4 є заміщеним або незаміщеним фенілом.
6. Сполука за п. 1, яка є:
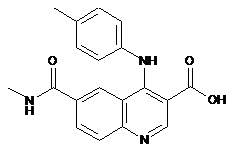
6-(метилкарбамоїл)-4-[(4-метилфеніл)аміно]хінолін-3-карбоновою кислотою або її фармацевтично прийнятною сіллю.
7. Сполука за п. 1, яка є:

4-[(4-метоксифеніл)аміно]-6-(метилкарбамоїл)хінолін-3-карбоновою кислотою або її фармацавтично прийнятною сіллю.
8. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вона придатна для застосування у терапії.
9. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-7 або її фармацевтично прийнятної солі та принаймні одну фармацевтично прийнятну допоміжну речовину.
10. Фармацевтична композиція за п. 9, яка відрізняється тим, що містить принаймні ще одну додаткову фармацевтично активну сполуку.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що додаткова фармацевтично активна сполука має протипухлинну дію.
12. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль для використання у лікування розладів, вибраних з раку, діабетичної ретинопатії, вікової макулярної дегенерації, запалення, інсульту, ішемії міокарда, атеросклерозу, макулярного набряку та псоріазу.
13. Застосування сполуки за будь-яким з пп. 1-7 або її фармацевтично прийнятної солі для виготовлення медикаменту для лікування таких розладів: рак, діабетична ретинопатія, вікова макулярна дегенерація, запалення, інсульт, ішемія міокарда, атеросклероз, макулярний набряк та псоріаз.
14. Спосіб терапевтичного лікування ссавців, які страждають від розладів, вибраних з раку, діабетичної ретинопатії, вікової макулярної дегенерації, запалення, інсульту, ішемії міокарда, атеросклерозу, макулярного набряку та псоріазу, при якому здійснюють введення сполуки за будь-яким з пп. 1-7 або її фармацевтично прийнятної солі зазначеним ссавцям.
Текст
Реферат: Сполука, за формулою (І), а також її фармацевтично прийнятні солі. Фармацевтична композиція, яка містить терапевтично ефективну кількість цієї сполуки. Сполука призначена для використання у лікуванні раку, діабетичної ретинопатії, вікової макулярної деградації, запалення, інсульту, ішемії міокарда, атеросклерозу, макулярного набряку та псоріазу. R O R 4 n NH O 1 O N R R 3 2 N (I) UA 102082 C2 (12) UA 102082 C2 UA 102082 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сфера використання винаходу Даний винахід стосується похідних хіноліну та їх використання у терапії. У більш практичному застосуванні даний винахід стосується похідних хіноліну для лікування раку, діабетичної ретинопатії, вікової макулярної дегенерації, запалень, інсульту, ішемії міокарда, атеросклерозу, макулярного набряку та псоріазу. Передумови винаходу Ангіогенез, зростання нових капілярів з судин, що вже існують, є важливим для розвитку ембріону, формування органів, регенерації тканин та їх перебудови [Folkman, J. & Shing, Y. (1992) J. Biol. Chem. 267, 10931-10934]. Він також сприяє розвитку та прогресуванню різноманітних патологічних станів, включаючи ріст пухлин та метастазів, сердцево-судинні захворювання, діабетичну ретинопатію, ревматоїдний артрит та псоріаз [Folkman, J. (1995) Nat. Med. 1, 27-312]. Ангіогенез та васкулогенез є складними багатоетапними процесами, які включають проліферацію, міграцію та диференціацію ендотеліальних клітин, деградацію позаклітинного матриксу, формування судин та розростання нових систем капілярів [Hanahan, D. & Folkman, J. (1996) Cell 86, 353-364; Risau, W. (1997) Nature (London) 386, 671-674]. Складність ангіогенних процесів передбачає існування багатьох контрольних елементів системи, які можна включати та виключати на деякий час. Вважається, що переключання ангіогенного фенотипу у тканинах залежить від місцевих змін балансу між ангіогенними стимуляторами та інгібіторами [Folkman, J. (1995) N. Engl. J. Med. 333, 1757-1763]. Серед багатьох описаних ангіогенних факторів, фактор росту ендотелію судин (ФРЕС)/фактор проникності судин є найбільш характерним позитивним регулятором із визначеною особливістю для ендотеліальних клітин судин [Senger, D.R., Galli, S.J., Dvorak, A.M., Peruzzi, C.A., Harvey, V.S. & Dvorak H.F. (1983) Science 219, 983-985; Ferrara, N. &Henzal, W.J. (1989) Biochem. Biophys. Res. Commun. 161, 851-858; Gospodarowicz, D., Abraham, J.A. & Schilling, J. (1989) Proc. Natl. Acad. Sci. USA 86, 7311-7315]. Біологічна дія ФРЕС включає в себе стимуляцію проліферації, міграції, диференціації ендотеліальних клітин, формування судин, підвищення проникності судин та підтримання цілісності судин [Mustonen, T. & Alitalo, K. (1995) J. Cell Biol. 129, 895-898; Ferrara, N. & Davis-Smyth, T. (1997) Endocr. Rev. 18, 4-25; Thomas, K. (1996) J. Biol. Chem. 271, 603-606; Risau, W. (1997) Nature (London) 386, 671-674; Breier, G. & Risau, W. (1997) Trends Cell Biol. 6, 454-456]. Посередником ангіогенних реакцій, викликаних ФРЕС, є рецептори тирозинкінази, які експресуються головним чином на клітинах судинного ендотелію [Mustonen, T. & Alitalo, K. (1995) J. Cell Biol. 129, 895-898; De Vries, C., Escobedo, J.A., Ueno, H., Huck, K, Ferrara, N. & Williams, L.T. (1992) Science 255, 989-99; Terman, B.I., DougherVermazen, M., Carrion, M.E., Dimitrov, D., Armellino, D.C., Gospodarowicz, D. & Bohlen, P. (1992) Biochem. Biophys. Res. Commun.187, 1579-1586]. Інгібіція адгезії клітин до мембран ендотеліальних клітин (МЕК) - основний крок до активації, виживання, направлення та міграції активованих ендотеліальних клітин - можливо, є одним з найбільш перспективних цільових механізмів для анти-ангіогенезу. У цих механізмах приймає участь не тільки ФРЕС, також ці взаємодії відбуваються за допомогою інтегринів, родини багатофункціональних рецепторів клітинної адгезії. Членами родини інтегринів є нековалентно з'єднані альфа/бета гетеродимери, які регулюють взаємодію клітинно-клітинного, клітиннопозаклітинного матриксу та клітин і патогенів. На теперешній час відомі 19 різних альфасубодиниць інтегринів та 8 різних бета-субодиниць, що, поєднуючись, утворюють щонайменше 25 різних альфа/бета гетердимерів із різними ліганд-особливостями. Лігандами для позаклітинного домена багатьох інтегринів є білки позаклітинного матриксу, а для внутрішньоклітинного домену інтегринів — ліганди прямо або опосередковано приєднуються до внутрішньоклітинних компонентів, таких як кінази та цитоскелет. Інтегрини діють у якості рецепторів біполярного сигналу, завдяки чому діяльність білків та експресія генів змінюється інтегринами у відповідь на приєднання ліганду до позаклітинного домену інтегрину. Цей процес також розглядається як сигнал ззовні усередину. З іншого боку, зв'язок інтегринів також модулюється у відповідь на зміни всередині клітини, такі як приєднання білків до позаклітинного домену інтегрину, що також розглядається як сигнал зсередини-назовні [Humphries (2000) Biochem Soc Trans. 28, 311; Hynes (2002) Cell, 110, 673]. Деякі дослідження прикладів інтегринів на активованих ендотеліальних клітинах, нокауту генів у мишей та вивчення інгібіції в ангіогенних моделях тварин із антитілами, пептидами та малими молекулами надали відомості про інтегрини та білки МЕК, які залучені до критично важливих етапів ангіогенезу [Brooks (1994) Science, 264, 569; Brooks (1996) Eur J Cancer, 32A, 2423; Mousa (2002), Curr Opin Chem Biol, 6, 534; Hynes (2202) Nature Medicine, 8, 918; Kim (2000) Am J Pathol, 156, 1345]. Згідно із цим дослідженням, альфа-v-бета-3 рецептори фібронектіну, альфа-v-бета-5 та альфа-5-бета-1 рецептор фібронектіну грають важливу роль в процесі 1 UA 102082 C2 5 10 15 20 25 30 35 40 45 50 ангіогенезу. Рівень експресії альфа-5-бета-1 є значно підвищеним у кровоносних судинах пухлин в организмі людини та після стимуляції фактором росту, із експресією альфа-5-бета-1 регулює виживання та міграцію ендотеліальних клітин in vitro та in vivo. Стисле викладення винаходу Згідно із результатами досліджень, проведених цими винахідниками, тільки інгібіція альфа5-бета-1 рецептору фібронектину надала біологічні дані, які повністю відповідають його запропонованій ролі в ангіогенезі. Тому, не маючи на меті дотримуватись якої-небудь теорії, ми можемо припустити, що альфа-5-бета-1 може стати найкращим об'єктом для розробки антиангіогенних препаратів, і відповідно, може мати значний терапевтичний потенціал для лікування неоваскуларизації у пухлинах, очах та під час запалень. Тепер, коли винахідники знайшли новітні похідні хіноліну певного типу з бічними ланцюгами, вони мають змогу блокувати інтегрини, потенційно тирозинкінази, зокрема альфа-5-бета-1 рецептор фібронектину. У порівнянні із аналогами у тій сфері, сполуки за даним винаходом також мають покращені показники розчинності. В одному аспекті, даний винахід стосується сполуки за формулою (І) де n=0, 1 або 2; 1 2 R та R — незалежно обрані з водню, насиченого або ненасиченого, розгалуженого або нерозгалуженого С1-10 алкілу або С3-12 циклоалкілу; є заміщеним або незаміщеним фенілом або бензилом. 3 R є воднем, або насиченим або ненасиченим, розгалуженим або нерозгалуженим С 1-10 алкілом або С3-12 циклоалкілом; 4 R є заміщеним або незаміщеним С6-С10 арилом або С1-С9 гетероарилом, де гетероатоми незалежно обираються з N, O та S; або заміщеним або незаміщеним моно- або біциклічним С312 циклоалкілом або С1-С9 гетероциклілом, де гетероатоми незалежно обираються з N, O або S; а також фармацевтично прийтнятні солі цієї сполуки. В іншому аспекті, цей винахід стосується сполуки за формулою (І), як зазначено вище, або її фармацевтично прийнятної солі, для використання у терапії. В іншому аспекті, даний винахід стосується сполуки за формулою (І) або її фармацевтично прийнятних солей, для використання у терапії таких захворювань, як рак, діабетична ретинопатія, вікова макулярна дегенерація, хронічне запалення, інсульт, ішемія міокарда, атеросклероз, ріст пухлин та макулярний набряк. В іншому аспекті, даний винахід стосується використання сполуки за формулою (І) та її фармацевтично прийнятних солей для виробництва медикаменту для лікування таких захворювань як рак, діабетична ретинопатія, вікова макулярна дегенерація, хронічне запалення, інсульт, ішемія міокарда, атерослероз, ріст пухлин та макулярний набряк. В іншому аспекті, даний винахід пропонує метод лікування таких захворювань як рак, діабетична ретинопатія, вікова макулярна дегенерація, хронічне запалення, інсульт, ішемія міокарда, атеросклероз, ріст пухлин та макулярний набряк застосуванням терапевтично ефективної дози сполуки за формулою (І) або її фармацевтично прийнятних солей до ссавців, у разі необхідності такого лікування. Інші аспекти та втілення винаходу викладені у патентній формулі. Стислий опис креслень Фіг. 1 є графіком сигналу генерації другої гармоніки (ГДГ) як функції часу, отриманого з міченого рецептору альфа-5-бета-1 (верхній рисунок) та альфа-v-бета-3 (нижній рисунок) та пептиду, похідного від фібронектину, який зображує конформаційну зміну рецептора. Фіг. 2 є графіком сигналу ГДГ як функції часу, отриманого з міченого рецептору альфа-5бета-1 (верхній рисунок) та альфа-v-бета-3 (нижній рисунок) із доданням сполуки за цим 2 UA 102082 C2 5 10 15 20 25 30 винаходом та пептиду, похідного від фібронектину, який зображує інгібіцію (зниження конформаційної зміни) рецептора альфа-5-бета-1 сполукою за цим винаходом, але не альфа-vбета-3 (конформаційна зміна). Фіг. 3 є графіком об'єму пухлини (мл) у мишей, яким підшкірно було імплантовано клітини раку легень, як функції днів терапії із пероральним та внутрішньовенним (25 мг/кг/день) застосуванням сполуки за цим винаходом, у порівнянні із застосуванням тільки інертної речовини. Фіг. 4 є діаграмою, що відбиває інгібіцію хоріоїдальної неоваскуларизації (ХНВ), визваної лазером, у мишей пероральним застосуванням сполуки за цим винаходом 50 мг/кг. Фіг. 5 є зображенням епітелію сітківки у мишей із ХНВ: Найбільша кругла ділянка є зруйнованим пігментним епітелієм сітківки (ПЕС) та мембраною Бруха (МБ). Біла ділянка вказує на розростання судин у місці дії лазера. Зліва - контрольний зразок сітківки із значним розростанням нових судин, справа - сітківка із невеликим (тільки на краях) розростанням судин після застосування сполуки за цим винаходом. Детальний опис винаходу Даний винахід має відношення до похідних хінолін-3-карбонової кислоти та її ефірів, які можна застосовувати для лікування таких захворювань та станів як рак, діабетична ретинопатія, вікова макулярна дегенерація, запалення, інсульт, ішемія міокарда, атеросклероз, макулярний набряк, псоріаз та інші у ссавців. Приготування сполук за цим винаходом знаходиться у межах компетенції фахівця у цій галузі. Як приклад, ефір хінолін-3-карбонової кислоти може бути утворений за допомогою 4етапного процесу, де, по-перше, відповідна похідна аніліну реагує із відповідним моно- або діетиловим ефіром, отриманий проміжний продукт циклізують для отримання похідної хіноліну4-олу, яка потім перетворюється на відповідну похідну галогену та, нарешті, реагує із відповідним аміном для утворення ефіру хінолін-3-карбонової кислоти. Ефір хінолін-3карбонової кислоти можна потім гідролізувати для отримання відповідної кислоти. Весь синтез проілюстровано у Схемі реакції 1. Схема реакції 1 Стосовно вищезазначеної реакції фахівець самостійно може обирати відповідні компоненти реакції, а також умови її проведення. Інший синтетичний метод, який може бути використаний для приготування сполук за цим винаходом, показаний у Схемі реакції 2. У цьому випадку синтез починається з п-броманіліну, а амідна група додається на останньому етапі. 3 UA 102082 C2 5 10 15 20 25 30 Схема реакції 2 1 2 3 4 Загалом, існує кілька варіантів порядку введення груп R , R , R та R , добре відомі фахівцю у цій галузі, з метою отримання сумішей за цим винаходом. Термін "алкіл", зазначений в цьому документі самостійно або як частина іншої групи, означає ациклічний прямий або розгалужений ланцюговий радикал, який містить 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 вуглеців у нормальному ланцюгу, наприклад, етил, метил, бутил, пентил, гексил, гептил, октил, ноніл, децил. Алкільна група в основному містить 1, 2, 3 або 4 вуглеці у нормальному ланцюгу, які також можуть бути замінені 1, 2 або 3 групами галогенів, при чому ці групи можуть бути однаковими та різними у будь-якій доступній точці, визначеній стосовно кожної змінної. За наявності такої заміщеної алкільної групи, оптимальним галогеном є фтор, як наприклад, -CF3, -CHF2, -CH2F, -CHFCH2F та інші. Якщо не зазначено інакше, термін "нижчий алкіл", зазначений в цьому документі, як частина іншої групи включає в себе як прямі, так і розгалужені вуглеводні, насичені або ненасичені, що містить 1, 2, 3 або 4 вуглеці, такі як метил, етил, пропіл, ізопропіл, бутил, т-бутил або ізобутил. Як зазначено вище, алкільні групи, що розглядаються, можуть бути ненасиченими (алкеніл або алкиніл) гідрокарбільними радикалами. Термін "алкеніл", зазначений у цьому документі самостійно або як частина іншої групи, означає прямий або розгалужений ланцюг радикалів 2, 3, 4, 5, 6, 7, 8, 9, або 10 вуглеців, що має щонайменше один подвійний зв'язок вуглець-вуглець. Наявність одного подвійного зв'язку вуглець-вуглець є бажаним, як у нормальному ланцюгу вініл, 2-пропеніл, 3-бутеніл, 2-бутеніл, 4пентеніл, 3-пентеніл, 2-гексеніл, 3-гексеніл, 2-гептеніл, 3-гептеніл, 4-гептеніл, 3-октеніл, 3ноненіл, 4-деценіл, 3-ундеценіл, 4-додеценіл, тощо. Алкенільна група бажано містить 2, 3 або 4 вуглеці у нормальному ланцюгу. Пряма або розгалужена частина алкенільної групи додатково може бути заміщена 1, 2 або 3 галогенами, де галогени можуть бути однакові або різні, оптимальним галогеном є фтор. Термін "алкиніл", зазначений у цьому документі самостійно або як частина іншої групи, означає прямий або розгалужений ланцюг радикалів 2, 3, 4, 5, 6, 7, 8, 9 або 10 вуглеців та щонайменше один потрійний зв'язок вуглець-вуглець. Наявність одного потрійного зв'язку вуглець-вуглець є бажаною у ланцюгу, як у 2-пропиніл, 3-бутиніл, 2-бутиніл, 4-пентиніл, 3пентиніл, 2-гексиніл, 3-гексиніл, 2-гептиніл, 3-гептиніл, 4-гептиніл, 3-октиніл, 3-нониніл, 4 4 UA 102082 C2 5 10 15 20 25 30 35 40 45 50 дециніл, тощо. Алкенільна група бажано містить 2, 3 або 4 вуглеці у нормальному ланцюгу. Пряма частина алкинільної групи може бути додатково заміщена 1, 2 або 3 групами галогенів, де галогени можуть бути однаковими або різними, оптимальним галогеном є фтор. Термін "циклоалкіл", зазначений у цьому документі самостійно або як частина іншої групи, включає в себе насичені циклічні гідрокарбільні групи або частково ненасичені (що мають 1 або 2 подвійних зв'язки) циклічні гідрокарбільні групи, що містять одне кільце та у сукупності 3, 4, 5, 6, 7, 8, 9, 10, 11 або 12 вуглеців, бажано 3 або 4 вуглеці, що складають кільце, до якого входять циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, тощо. Циклічний гідрокарбіл може бути моно-, бі- або триціклічним. Циклоалкільна група може бути додатково заміщена 1, 2 або 3 галогенами, де галогени можуть бути однаковими або різними, оптимальним галогеном є фтор. Як зазначено у цьому документі, якщо не вказано інакше, терміни "гетероцикліл" означають неароматичну циклічну групу, яка містить один або більше гетероатомів, оптимально обраних серед N, O, та S, таких як азирідиніл, азетідиніл, дигідропіраніл, дигідропіридил, дигідропіроліл, діоксоланіл, діоксаніл, дитіаніл, дитіоланіл, імідазолідиніл, імідазолініл, морфолініл, оксетаніл, оксираніл, піролідиніл, піролідиноніл, піпериділ, піперазиніл, піперідиніл, піразолідиніл, піразолідиніл, хінуклідиніл, сульфалоніл, 3-сульфоленіл, тетрагідрофураніл, тетрагідропіраніл, тетрагідропіридил, тієтаніл, тііраніл, тіоланіл, тіоморфолініл, тритіаніл, тропаніл, моносахарид, тощо. Термін "галоген" означає фтор, хлор, бром та йод. У межах цього документу, термін "арил" означає ароматичну групу, таку як феніл та нафтил, тощо. У межах цього документу, термін "гетероарил" означає моно-, бі- або трициклічну гетероароматичну групу, яка містить один або більше гетероатомів, оптимально обраних серед N, O та S, такі як піридил, хінолініл, фураніл, тієніл, оксадіазоліл, тіадіазоліл, тіазоліл, оксазоліл, піразоліл, тріазоліл, тетразоліл, ізоксазоліл, ізотіазоліл, ізохінолініл, нафтірідиніл, імідазоліл, феназиніл, фенотіазиніл, фталазиніл, індоліл, піридазиніл, хіназолиніл, хінолізиніл, хіноксалиніл, тетрагідроізохінолініл, піразиніл, індазоліл, індолініл, піримідиніл, тіофенетіл, піраніл, карбазоліл, хроманіл, цинолініл, акрідиніл, бензімідазоліл, бензодіоксаніл, бензодіоксепиніл, бензодіоксоліл, бензофураніл, бензотіазоліл, бензобензоксадіазоліл, бензоксазиніл, бензоксазоліл, бензоморфолініл, бензоселенадіазоліл, бензотієніл, піриніл, птерідиніл, тощо. У межах цього документу, і якщо не зазначено інше, термін "заміщений" означає, що одиницю було заміщено щонайменше одним агентом, обраним з насиченого або ненасиченого, розгалуженого, нерозгалуженого або циклічного нижчого алкілу, гідроксилу, аміну, сульфіду, силілу, галогену, нітрилу, карбонової кислоти, сульфокислоти, нижчого алкілу вторинного та третинного аміну, нижчого алкіламіду, нижчих алкілефірів, нижчого алкілкетону, нижчих алкілсульфідів, ефірів нижчих алкілкарбонових кислот, ефіру нижчої алкілсульфокислоти, нижчий алкілсульфон, нижчий алкіл сульфоксид, нижчий алкілсульфонамід, нижчий акліловий спирт, нижчий алкілацетил, нижчий діалкілдисульфід, тощо. Таким чином, стосовно першого аспекту, винахід має відношення до сполуки за формулою (І). де: n=0, 1 або 2; оптимальне значення n є 0 або 1, найбільш оптимальне – 0; 1 2 R та R незалежно обираються серед водню, насиченого або ненасиченого, розгалуженого або нерозгалуженого С1-10 алкілу або С3-12 циклоалкілу та заміщеного або незаміщеного фенілу або бензилу; 3 R є воднем або насиченим або ненасиченим, розгалуженим або нерозгалуженим С 1-10 алкілом або С3-12 циклоалкілом; 5 UA 102082 C2 4 5 10 15 20 25 30 R є заміщеним або незаміщеним С6-С10 арилом або С1-С9 гетероарилом, де гетероатоми незалежно обираються серед N, O та S; або є заміщеним або незаміщеним моно- або біциклічним С3-12 циклоалкілом або С1-С9 гетероциклілом, де гетероатоми незалежно обираються серед N, O та S; а також їх фармацевтично прийнятні солі. 1 2 В одному з втілень цього винаходу R та R незалежно обираються з водню та насиченого або ненасиченого, розгалуженого або нерозгалуженого С1-10 алкілу або С3-12 циклоалкілу, наприклад, з водню та ненасиченого, розгалуженого або нерозгалуженого С1-6 алкілу або С3-6 циклоалкілу, наприклад, з С1-4 алкілу та С3-4 циклоалкілу, зокрема насиченого С1-4 та С3-4 1 2 циклоалкілу. Наприклад, R та R можуть незалежно бути обраними з водню та насиченого або ненасиченого, розгалуженого або нерозгалуженого С1-6 алкілу, як, наприклад, з водню та насиченого або ненасиченого, розгалуженого або нерозгалуженого С 1-4 алкілу, зокрема з водню та насиченого С1-4 алкілу, наприклад, водню, метилу, етилу та пропілу, зокрема водню та метилу. 1 2 1 В одному із втілень, щонайменше один R та R не є воднем. В одному із втілень, R є 2 воднем, а R не є воднем. 3 У сполуці за формулою (І), R є воднем або насиченим або ненасиченим, розгалуженим або нерозгалуженим С1-10 алкілом, наприклад, С1-6 алкілом або С1-4 алкілом; або С3-12 циклоалкілом, наприклад, С3-6 циклоалкілом або С3-4 циклоалкілом. 3 В одному з втілень, R є воднем або насиченим розгалуженим або нерозгалуженим С1-10 алкілом, наприклад, С1-6 алкілом, або С1-4 алкілом; або С3-12 циклоалкілом, наприклад, С3-6 циклоалкілом, або С3-4 циклоалкілом; 3 Оптимально, R є воднем або насиченим С1-6 алкілом, зокрема воднем або, бажано, насиченим С1-4 алкілом. 3 3 В одному з окремих втілень, R є воднем. В іншому окремому втіленні R не є воднем. 4 У сполуках за формулою (І), R є заміщеним або незаміщеним С6-С10 арилом або С1-С9 гетероарилом, де гетероатоми незалежно обираються з N, O та S; або заміщеним або незаміщеним моно- або біциклічним С3-12 циклоалкілом або С1-С9 гетероциклілом, де 4 гетероатоми незалежно обираються з N, O та S. В одному з втілень, R є заміщеним або незаміщеним С6-С10 арилом або С1-С9 гетероарилом, де гетероатоми незалежно обираються з 4 N, O та S; зокрема R є заміщеним або незаміщеним С6-С10 арилом, наприклад заміщеним або незаміщеним фенілом. Таким чином, в одному з втілень сполука за формулою (І) може бути представлена формулою (І΄) 35 1 40 2 3 де R , R , R та n мають значення, як зазначено вище, m дорівнює 0-5, наприклад, 1-3, або 5 1-2, зокрема, 1; та R є замісником, як зазначено вище, оптимально обраним з бажано насиченого С1-С6 алкілу та С1-С6 алкокси, найбільш оптимально з С1-С4 алкілу та С1-С4 алкокси, наприклад, С1-С3 алкілу та С1-С3 алкокси, таких як метил, етил, метокси та етокси, наприклад, метил та метокси. В одному із втілень, у суміші за формулою (І΄), m дорівнює 0 або 1, наприклад, 1. 5 В одному із окремих втілень, у суміші за формулою (І΄), m дорівнює 1, а R знаходиться у пара-положенні, тобто суміш за цим винаходом може бути представлена формулою (І΄΄) 6 UA 102082 C2 1 5 10 15 20 25 30 35 40 45 2 3 5 де R , R , R , R та n мають значення, як зазначено вище. В одному із втілень, суміш обирається з 6-(метил-карбамоіл)-4-[(4-метилфеніл)аміно]хінолін3-карбонової кислоти; етил 6-(метилкарбамоіл)-4-[(4-метилфеніл)аміно] хінолін-3-карбоксилату; етил 4-[(4-метоксифеніл)аміно]-6-(метилкарбамоіл)хінолін-3-карбоксилату; бутил 4-[(4метоксифеніл)аміно]-6-(метилкарбамоіл)хінолін-3-карбоксилату; метил 4-[(4метоксифеніл)аміно]-6-(метил-карбамоіл)хінолін-3-карбоксилату; та 4-[(4-метоксифеніл)аміно]6-(метил-карбомоіл) хінолін-3-карбонової кислоти, або їх фармацевтично прийнятні солі. Потрібно розуміти, що, якщо протилежна інформація не зазначена або не є явною з контексту, будь-яке посилання в даному документі на сполуку за формулою (І) також стосується сполук за формулами (І΄) або (І΄΄), які також є втіленнями у межах формули (І). Сполуки за цим винаходом можуть бути представлені у вигляді солей, які також знаходяться у межах цього винаходу. Солі повинні бути фармацевтично прийнятними (тобто, нетоксичними, фізіологічно прийнятними). Наприклад, сполуки за цим винаходом можуть утворювати кислотно-адитивні солі, наприклад, у функції аміно. Вони можуть утворюватись за допомогою таких сильних неорганічних кислот як мінеральні кислоти, наприклад, сульфатна кислота, фосфорна кислота або галогенводнева кислота, сильних органічних карбонових кислот, таких як алканкарбонові кислоти з 1-4 атомами вуглецю, заміщені або незаміщені, наприклад, галогеном, наприклад, оцтова кислота, насичені або ненасичені дикарбонові кислоти, наприклад, щавелева, малонова, бурштинова, малеїнова, фумарова, фталева або терефталева кислота, за допомогою гідрокарбонових кислот, наприклад, аскорбінова, гліколева, молочна, яблучна, винна або лимонна кислота; амінокислот (наприклад, аспарагінова або глютамінова кислота, лізин або аргінін), або бензойної кислоти, або за допомогою органічних сульфонових кислот, таких як (С 1С4) алкіл- або арилсульфонові кислоти, заміщені чи незаміщені, наприклад, галогеном, наприклад, метил- або п-толуолсульфокислота. Відповідні кислотно-адитивні солі можуть бути утворені при наявності, за необхідності, додаткового основного центру. Сполуки за формулою І, що містять принаймні одну кислотну групу (наприклад, СООН), можуть також утворювати солі із основами. Підходящими солями із основами можуть бути такі солі металів, як солі лужних та лужноземельних металів, наприклад, солі натрію, калію або магнію, або солі із аміаком або органічним аміном, таким як морфолін, тіоморфолін, піпередин, піролідин, з моно-, ди- або три- (нижчим) алкіламіном, наприклад, етил-, третбутил-, діетил-, диізопропіл, триетил-, трибутил або діметил-пропіламіном, або моно-, ди- або тригідрокси (нижчим) алкіламіном, наприклад, моно-, ди- або триетаноламіном. Крім того, можуть бути утворені відповідні внутрішні солі. Також до складу входять солі, неприйнятні для фармацевтичного використання, але які можуть застосовуватись, наприклад, для ізоляції або очищення вільних компонентів формули І або їх фармацевтично прийнятних солей. Застосування лікарського засобу за цим винаходом означає застосування терапевтично ефективної кількості засобу за цим винаходом. Термін "терапевтично ефективна кількість", що використовується у даному документі, означає кількість лікарського засобу для лікування або профілактики стану, щодо якого застосовується композиція за цим винаходом. Така кількість є кількістю, достатньою для утворення помітного терапевтичного, профілактичного або полегшуючого ефекту. Такий ефект може означати, наприклад, лікування або профілактику зазначених станів. Точна ефективна кількість для суб'єкта залежить від розміру суб'єкта та його загального стану, характеру та ступеню стану, що потребує лікування, рекомендацій терапевта, лікарських засобів або їх поєднання, призначених для лікування. Тому завчасне чітке визначення точної ефективної кількості не є доцільним. При пероральному застосуванні 7 UA 102082 C2 5 10 15 20 25 30 35 40 дозування може варіюватись в день від 0,01 мг до 1000 мг суміші за формулою (І) або відповідної кількості її фармацевтино прийнятної солі. Композиція за цим винаходом може бути виготовлена для будь-якого способу застосування, наприклад, перорального, внутрішньовенного, шкірного або підшкірного, назального, внутрішньом'язового або внутрішньочеревного. Чіткий характер носія засобу або інший матеріал залежить від способу його застосування. Для парентерального застосування використовуються парентерально прийнятні водні розчини, що не містять пірогенні речовини та мають потрібний рівень рН, ізотонічності та стабільності. Фахівці у цій галузі мають досвід у виготовленні потрібних розчинів та знайомі із чисельними методами, описаними в літературі. Фармацевтично прийнятні допоміжні речовини, зазначені у цьому документі, наприклад, зв'язувальні речовини, ад'юванти, інертні речовини або розріджувачі відомі фахівцям у цій галузі та є загальнодоступними. Фармацевтично прийнятні речовини можуть бути хімічно інертними до активних компонентів, не мають шкідливих побічних ефектів та не є токсичними при застосуванні. Приклади фармацевтичних сполук можна знайти у Remington: The Science and Practice of Pharmacy. A. R. Gennaro, Editor. Lippincott, Williams and Wilkins, 20-а редакція (2000). Всі стереоізомери сумішей за цим винаходом представлені у вигляді добавок або у чистій або практично чистій формі. Сполуки за цим винаходом можуть мати асиметричні центри в атомах вуглецю, зокрема у замісників R. Відповідно, сполуки за формулою І можуть існувати у енантіомірних або діастереомірних формах, або їх поєднаннях. Рацемати, енантіоміри або діастереоміри можуть використовуватись у процесі приготування у якості вихідних речовин. При приготуванні діастереомірних та енантіомірних продуктів, вони можуть бути відокремлені за допомогою традиційних методів, таких як хроматографічна або фракційна кристалізація. Сполуки за формулою (І) можуть використовуватись для лікування таких захворювань як рак, діабетична ретинопатія, вікова макулярна дегенерація, запалення, інсульт, ішемія міокарда, атеросклероз, макулярний набряк та псоріаз. Терапія може бути профілактичною, паліативною або лікувальною. Сполуки за цим винаходом можуть використовуватись або призначатись у поєднанні із одним або більше додатковим лікарським засобом, спеціально розробленим для лікування гіперпроліферативних захворювань, наприклад, із цитостатичними засобами. Ці компоненти можуть знаходитись у складі одного засобу або різних для одночасного або послідовного застосування. Сполуки за цим винаходом можуть застосовуватись або призначатись у поєднанні із іншою терапією, наприклад, опроміненням для лікування раку. Серед цитостатичних засобів, призначених для вказаного застосування, можна назвати сполуки для алкілування ДНК, інгібітори топоізомерази І, інгібітори топоізомерази ІІ, сполуки, що впливають на синтез РНК та ДНК, сполуки для полімеризації ниток цитоскелету та сполуки для деполімеризації ниток цитоскелету. Винахід проілюстровано наступними необмежувальними Прикладами. Приклади Приклад 1: Етил 6-(метилкарбамоіл)-4[(4-метилфеніл)аміно] хінолін-3-карбоксилат. (а) Приготування проміжної сполуки 2-[(4-бромфеніламіно) метилен]малонової кислоти діетилефір: 45 До мікрохвильової віали об'ємом 20 мл було завантажено 4-броманілін (6,881 г, 40,0 ммоль), діетил етоксиметил-енмалонат (8,650 г, 40,0 ммоль) та толуол (5 мл). Віалу накрили, суміш нагріли у мікрохвильовій пічці при температурі 150 °C протягом 30 хвил. Після охолодження розчин вилили на 50 мл ізогексану, який енергійно перемішували. Утворився щільний білий 8 UA 102082 C2 5 10 15 20 25 30 35 осад, суспензію перемішували ще протягом 15 хвилин. Суспензію профільтрували, а продукт промили 20 мл ізогексану. Продукт було висушено при вакуумі для отримання 11,678 г (85 %) 2[(4-бромфеніламіно)метилен]малонової кислоти діетилефіру. Мас-спектрометрія (іонізація + + електророзпиленням ) маса/заряд, 342, 344 (MH ). (b) Приготування проміжної сполуки 6-бром-4-хлорхінолін-3-карбонової кислоти етилефір: До мікрохвильової віали об'ємом 20 мл було завантажено 2-[(4-бромфеніламіно)метилен]малонової кислоти діетилефір (1,711 г, 5,0 ммоль) та POCl3 (хлористий фосфоріл, 10,0 мл, 16,8 г, 109 ммоль). Віалу було закрито, а суміш підігрівали у мікрохвильовій пічці поступово до 180 °C (із контролем тиску) більше 5 хвилин, а потім утримували при 180 °C протягом 30 хвилин. Надлишковий РОCl3 було випарено, залишок поділено на СН2Сl2 (40 мл) та 2 N NaOH (вод.) (40 мл). З СН2Сl2 (2 × 40 мл) було екстраговано водянистий шар. Органічні шари було поєднано, висушено з Na2CO3 та випарено. Залишок було очищено на колонці (силікатний гель, СН2Сl2 у якості елюенту). Чисті долі було поєднано, випарено, а залишок висушено під вакуумом для отримання 0,821 г (52 %) 6-бром-4хлорхінолін-3-карбонової кислоти + + етилефіру. Мас-спектрометрія (іонізація електророзпиленням ) маса/заряд 314, 316 (МН ). (c) Приготування проміжної сполуки 6-бром-4-п-толіл-амінохінолін-3-карбонової кислоти етилефір: У мікрохвильову віалу об'ємом 20 мл було завантажено 6-бром-4-хлор-хінолін-3-карбонової кислоти етилефір (0,786 г, 2,50 ммоль), п-толуідин (0,286 г, 2,50 ммоль) та сухий 1,4 діоксан (15 мл). Віалу було накрито, сполуку підігрівали при 150 °C протягом 30 хвил. Після охолодження, утворився жовтий осад. Суспензію вилили на 2 N NaOH (вод.) (100 мл), водний шар було екстраговано з СН2Сl2 (3 × 80 мл). Органічні шари було поєднано та промито Н2О (100 мл), висушено із MgSO4 та випарено. Цей залишок було очищено на колонці (силікатний гель, ізогексан/EtOAc 1:1). Чисті долі було поєднано, випарено, залишок висушили під вакуумом для отримання 0,748 г (78 %) 6-бром-4-п-толіл-амінохінолін-3-карбонової кислоти етилефір. Мас+ + спектрометрія (іонізація електророзпиленням ) маса/заряд 385,387 (МН ). (d) У мікрохвильову віалу об'ємом 2 мл було завантажено 6-бром-4-п-амінохінолін-3карбонову кислоту етилефір (0,100 ммоль), паладацикл Геррмана (транс-ді(μ-ацетат)-біс[о-(діо-толілфосфін)бензил]діпаладій (ІІ), 4,7 мг, 0,0050 ммоль), [(т-Bu)3PH]BF4 (5,9 мг, 0,020 ммоль), Мо(СО)6 (52,8 мг, 0,20 ммоль), 1,5 екв. метиламіну (2М у ТГФ) та сухий ТГФ (1,0 мл). Нарешті, ДБУ (1,8-діазабіцикло[5.4.0]ундек-7-ен, 0,045 μл, 0,30 ммоль) було додано, віалу негайно закрито тефлоновою кришкою та опромінено мікрохвилями протягом 5 хвилин при 130 °C. Летючі речовини були відокремлені при зниженому тиску, залишок очищено хроматографічною колонкою для отримання 6-(метилкарбамоіл)-4[(метилфеніл)аміно]-хінолін-3-карбоксилату. Приклад 2: 6-метилкарбамоіл-4-п-толіламіно-хінолін-3-карбонова кислота. 9 UA 102082 C2 Етил 6-(метилкарбамоіл)-4-[(4-метилфеніл)аміно]хінолін-3-карбоксилат було піддано гідролізу за основних умов з використанням NaOH (вод.). Кінцевий продукт було очищено за допомогою хроматографічної колонки. Приклад 3: Етил 4-[(4-метоксифеніл)аміно]-6-(метилкарбамоіл)хінолін-3-карбоксилат. 5 10 15 20 25 30 35 (а) Приготування проміжної сполуки 2-[(4-бромфеніламіно) метилен]маленової кислоти диетилефіру: 4-Бромананілін (10 г, 0,058 моль) та 12,58 г діетоксіметилен малонат (1 екв.) підігрівали при 150 °C протягом 3 годин у запаяній трубці. Реакційну суміш було охолоджено та розбавлено гексаном, коли твердий продукт випав в осад. Тверду речовину профільтрували, промили кілька разів гексаном та висушили під вакуумом для отримання 17,8 г (89 %) 2-[(41 бромфеніламіно)метилен]малонової кислоти діетилефіру. Н ЯМР (300 МГц, CDCl3) δ 11.03 (d, 1Н, J=13 Гц, -NH-), 8.48 (d, 1H, J=13 Гц, -СН=С), 7.49 (m, 2H, ароматичні), 7.10-7.01 (m, 2H, ароматичні), 4.42-4.22 (m, 4H, -СН2-СН3), 1.45-1.26 (m, 6Н, -СН2-СН3); рідинна хроматографія/мас-спектрометрія (маса/заряд) 343.9 (М+1). (b) Приготування проміжної сполуки 6-бром-4-хлорхінолін-3-карбонової кислоти етилефіру: 2-[4-бромфеніламіно)метилен]малонова кислота діетилефір (5 г) підігрівали POCl3 (хлористий фосфорил, 31,5 мл) при 150 °C у запаяній трубці протягом 6 годин. Надлишковий РОСl3 було видалено роторним випарювачем, сиру суміш промито дихлорметаном. Екстракт дихлорметану було промито 10 % розчином NaOH, висушено на сульфаті натрію та очищено хроматографічною колонкою (силікатний гель, гексан/етил ацетат 80:20) для отримання 2,3 г 1 (50 %) 6-бром-4-хлорхінолін-3-карбонової кислоти етилефіру. Н ЯМР (300 МГц, CDCl3) δ 9.22 (s, 1H, ароматичні), 8.60 (d, 1H, J=2.1 Гц, ароматичні), 8.04 (d, 1H, J=9 Гц, ароматичні), 7.95-7.85 (m, 1H, ароматичні), 4.53 (q, 2H, J=7 Гц, -СН2-), 1.50 (t, 3H, J=7 Гц, -СН3); рідинна хроматографія/мас-спектрометрія (маса/заряд) 315,8 (М+1). (с) Приготування проміжної сполуки етил 6-бром-4-[(4-метоксифеніл)-аміно]хінолін-3карбоксилату: п-Анізидін (0,43 г) та 6-бром-4-хлорхінолін-3-карбонової кислоти етилефір (1 г) змішали у діоксані та опромінювали у мікрохвильовому реакторі при 150 °C протягом 30 хвилин. Реакційну суміш було розбавлено петролейним ефіром. Отриманий твердий продукт було профільтровано та висушено для отримання 1,3 г (100 %) етил 6-бром-4-[(41 метоксифеніл)аміно]хінолін-3-карбоксилату. Н ЯМР (300 МГц, CDCl3) δ 11.41 (s, 1H, -NH-), 9.22 (s, 1H, ароматичні), 8.20 (d, 1H, J=8.2 Гц, ароматичні), 7.77 (d, 1H, J=8.2 Гц, ароматичні), 7.64 (s, 1H, ароматичні), 7.15 (d, 2H, J=8.1 Гц, ароматичні), 6.99 (d, 2H, J=8.1 Гц, ароматичні), 4.47 (q, 10 UA 102082 C2 5 10 15 20 25 30 35 40 2H, J=7 Гц, -СН2-), 3.89 (s, 3H, -OCH3), 1.47 (t, 3H, J=7 Гц, -СН3); рідинна хроматографія/масспектрометрія (маса/заряд) 401.0 (М+1). (d) Етил 6-бром-4-[(4-метоксифеніл)аміно]хінолін-3-карбоксилат (0,25 г, 0,623 ммоль) додали до ТГФ згідно із паладациклом Геррманна (транс-ді(μ-ацетат)-біс[о-(ді-отолілфосфін)бензил]діпаладій (ІІ), 0,031 ммоль), [(т-Bu)3PH]BF4 (три тертіарибутил фосфоній тетрафтороборат, 0,125 ммоль), Мо(СО)6 (гексакарбоніл молібдену, 1,246 ммоль), метиламін (1,5 екв., 2N у ТГФ) та ДБУ (1,8-діазабіцикло[5.4.0]ундек-7-ен, 1,869 ммоль). Реакційну суміш опромінювали при 130 °C протягом 5 хвилин у мікрохвильовому реакторі. Реакційну суміш було сконцентровано та очищено у колонці (силікатний гель, дихлорметан/метиловий спирт 98:2) для отримання 0,25 г (71 %) етил 4-[(4-метоксифеніл)аміно]-6-(метил-карбамоіл)хінолін-31 карбоксилату. Н ЯМР (300 МГц, CDCl3) δ 10.96 (s, 1H, -NH-), 9.24 (s, 1H, ароматичні), 8.14-7.98 (m, 2H, ароматичні), 7.73 (s, 1H, ароматичні), 7.16 (d, 2H, J=9 Гц, ароматичні), 6.98 (d, 2H, J=9 Гц, ароматичні), 4.46 (q, 2H, J=7 Гц, -CH2-), 3.87 (s, 3H, -OCH3-), 1.48 (t, 3H, J= Гц, -СН3); рідинна хроматографія/мас-спектрометрія (маса/заряд) 380.0 (М+1). Приклад 4: 4-[(4-метоксифеніл)аміно]-6-(метилкарбамоіл)хінолін-3-карбонова кислота. Етил 4-[(4-метоксифеніл)аміно]-6-(метилкарбамоіл) хінолін-3-карбоксилат (0,2 г) перемішували із LiOH (85,5 мг) у 6 мл МеОН: ТГФ: Н2О (2:2:2) протягом ночі. Реакційну суміш було сконцентровано, водний шар було промито етилацетатом. Водні шари було зібрано та окислено водною HCl, утворений осад було профільтровано та висушено для отримання 0,142 г 1 (60 %) 4-[(4-метоксифеніл)аміно]-6-(метилкарбамоіл)хінолін-3-карбонової кислоти. Н ЯМР (300 МГц, CD3OD) δ 9.05 (s, 1H, ароматичні), 8.20 (s, 1H, ароматичні), 8.12-7.81 (m, 2H, ароматичні), 7.27 (d, 2H, J=9.9 Гц, ароматичні), 7.06 (d, 2H, J=9.9 Гц, ароматичні), 3.88 (s, 1H, -OCH3), 2.82 (s, 3H, -NCH2-); рідинна хроматографія/мас-спектрометрія (маса/заряд) 352.0 (М+1). Приклад 5: Бутил-4[(4-метоксифеніл)аміно]-6(метилкарбамоіл)хінолін-3-карбоксилат. До суспензії 4[(4-метоксифеніл)аміно]-6-(метилкарбамоіл)-хінолін-3-карбонової кислоти (0,1 г) у дихлорметані ЕДК.HCl (1-Етил-3-(3-діметиламінопропіл)карбодиіміду хлоргідрат, 0,161 г) ГОБт (N-гідроксібензотріазол 0,042 г), ДМАП (4-диметиламінопіридин, 0,17 г), та н-бутанол (25 мл) були додані, реакційну суміш перемішували при кімнатній температурі протягом 3 годин. Після виділення водного шару, було екстраговано реакційну суміш, сконцентровано та висушено на безводному сульфаті натрію для отримання сирого продукту, який потім було очищено хроматографічною колонкою до отримання 0,05 г (55 % на виході) бутил 4-[41 метоксифеніл) аміно]-6(метилкарбамоіл)хінолін-3-карбоксилату. Н ЯМР (300 МГц, CDCl3) δ 10.84 (s, 1H, -NH-), 9.21 (s, 1H, ароматичні), 8.05 (d, 1H, J=8.8 Гц, ароматичні), 7.97 (d, 1H, J=8.8 Гц, ароматичні), 7.80 (s, 1H, ароматичні), 7.16 (d, 2H, J=8.7 Гц, ароматичні), 6.96 (d, 2H, J=8.7, ароматичні), 5.60 (s, 1H, -NHCH3-), 4.41 (t, 2H, J=6.6 Гц, –O-CH2-), 3.87 (s, 3H, -OCH3), 2.88 (s, 3H, -NCH3), 1.92-1.75 (m, 2H, -O-CH2-CH2-CH2-), 1.65-1.46 (m, 2H, -O-CH2-CH2-CH2-), 1.12-0.98 (m, 3H, -CH3); рідинна хроматографія/мас-спектрометрія (маса/заряд) 407.9 (М+1). Приклад 6: Метил 4-[(4-метоксифеніл)аміно]-6-(метилкарбамоіл)хінолін-3-карбоксилат. 11 UA 102082 C2 5 10 15 20 25 30 35 40 45 50 До суспензії 0,1 г 4[4-метоксифеніл)аміно]-6-(метилкарбамоіл)-хінолін-3-карбонової кислоти у дихлорметані ЕДК.HCl (1-Етил-3-(3-диметиламінопропіл)карбодііміду хлоргідрат, 0,161 г) ГОБт (N-гідроксибензотріазол 0,042 г), ДМАП (4-диметиламінопіридин, 0,17 г), та 20 мл метанолу були додані, реакційну суміш перемішували при кімнатній температурі протягом 3 годин. Після виділення водного шару, було екстраговано реакційну суміш, сконцентровано та висушено на безводному сульфаті натрію для отримання сирого продукту, який потім було очищено хроматографічною колонкою до отримання 0,062 г (60 %) метил 4-[(4-метоксифеніл)аміно]-61 (метилкарбамоіл)хінолін-3-карбоксилату. Н ЯМР (300 МГц, CDCl3) δ 11.51 (s, 1H, -NH-), 9.12 (s, 1H, ароматичні), 8.38-8.15 (m, 2H, ароматичні), 8.10 (s, 1H, ароматичні), 7.23 (d, 2H, J=9 Гц, ароматичні), 7.02 (d, 2H, J=9 Гц, ароматичні), 4.02 (s, 3H, -OCH3), 3.90 (s, 3H, -OCH3), 2.92 (s, 3H, NCH3); рідинна хроматографія/мас-спектрометрія (маса/заряд) 365.9 (М+1). Біологічні дослідження Аналіз інтегринів Це дослідження було проведено компанією Biodesy (Берлінгейм, Каліфорнія, США). Очищені інтегрини були отримані з академічних та комерційних джерел. Альфа-5-бета-1 та альфа-v-бета-3 були отримані з академічних джерел як рекомбінантні, розчинні білки (позаклітинний домен). До кожного з трьох білків було застосовано стандартний протокол маркування, розроблений для інтегринів. Всі білки було успішно помічено із середнім відношенням мітка:білок ~4:1. Два розчинних, мічених білка (альфа-5-бета-1 та альфа-v-бета-3) видавали фонові сигнали ГДГ (генерації другої гармоніки). Вони також видавали сигнали конформаційної зміни під впливом GRGDSP (RGD-пептид, фібронектин-похідний пептид гліцин-агринін-гліцин-аспарагінова кислота-серин-пролін). При доданні пептиду у кількості 400 μМ сигнали з'явились відразу (Фіг. 1). Далі, Приклад 4 було преінкубовано при 100 μМ із міченими білками протягом 20 хвилин. Було додано RGD-пептид (400 μМ) для стимуляції білків та тестування сполуки на інгібіцію. Приклад зашкодив появі конформаційної зміни, визваної RGD, у альфа-5-бета-1 і тому є ефективним інгібітором конформаційної зміни, визваної RGD. З іншого боку, Приклад 4 не мав впливу на альфа-v-бета-3, було виявлено конформаційну зміну (Фіг. 2). Ксенографтна модель пухлин Для досліджень пухлин були використані імунодефіцитні 6-тижневі миші SCID жіночої статі. 6 Приблизно 10 клітин раку легенів людини Calu-6 у логарифмічній фазі росту було зібрано та ресуспендовано у середовищі, 100 мл розчину з однією клітиною було імплантовано підшкірно у правий бік кожної тварини. 10 мишей було використано у групі, що піддавалась лікуванню, 10 мишей було використано у контрольній групі. Систематичне лікування пероральним застосуванням або внутрішньовенними ін'єкціями зі 100 μл інертної речовини або активною 3 речовиною (25 мг/кг/день) було розпочато, коли пухлини досягли розміру 300 мм та проводилось один раз на день протягом 17 днів. Помітні пухлини було зафіксовано 5-10 дня після імплантації. Первинні пухлини було виміряно цифровим штанген-циркулем у вказані дні. 2 Розрахунок об'єму пухлин проводився за формулою: довжина х ширина × 0,52, як зазначено у звіті. Мишам вводився приклад 4 (внутрішньовенно або перорально, 25 мг/кг/день). Це дало переконливі результати щодо ефективності сполуки у цій тваринній моделі (Фіг. 3). Суміш за цим винаходом має значний протипухлинний ефект із показниками інгібіції росту пухлини – 52 % при пероральному застосуванні та 71 % при внутрішньовенному введенні. Суміш за цим винаходом також знижує ангіогенез в обох групах. Модель лікування захворювання очей мишей, викликаного лазером У цій моделі Приклад 4, самостійно, значно знизив ріст ХНВ (хоріоідальної неоваскуларизації) в очах, на 42 % у порівнянні із контрольною групою, при пероральному застосуванні 50 мг/кг/день (Фіг. 4 та Фіг. 5). Модель ХНВ, викликана лазером, є високо репродуктивною моделлю, що імітує багато рис ХНВ, яка трапляється у формі набряку вікової макулярної дегенерації (ВМД), головної причини сліпоти у літніх людей. 12 UA 102082 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука за формулою (І) R O R 10 15 20 25 30 35 n NH O 1 O N R 5 4 R 3 2 N , (I) де n = 0; 1 R є воднем; 2 R вибирається з насиченого або ненасиченого, розгалуженого або нерозгалуженого С 1-10алкілу або С3-12циклоалкілу, заміщеного або незаміщеного фенілу або бензилу; де будь-який замісник фенілу або бензилу вибирається з С1-С4алкілу, С2-С4алкенілу, С2-С4алкінілу, С3-С4циклоалкілу, С3-С4циклоалкенілу, С3-С4циклоалкінілу, гідроксилу, аміну, сульфіду, силілу, галогену, нітрилу, карбонової кислоти, сульфокислоти, С 1-С4алкокси, С1-С4алкілу вторинного та третинного аміну, С1-С4алкіламіду, С1-С4алкілефірів, С1-С4алкілкетону, С1-С4алкілсульфідів, ефірів С1-С4алкілкарбонових кислот, ефіру С1-С4алкілсульфокислоти, С1-С4алкілсульфону, С1С4алкілсульфоксиду, С1-С4алкілсульфонаміду, С1-С4аклілового спирту, С1-С4алкілацетилу, С1С4діалкілдисульфіду, 3 R є воднем; 4 R є заміщеним або незаміщеним С6-С10арилом або С1-С9гетероарилом, де гетероатоми незалежно вибираються з Ν, Ο та S; заміщеним або незаміщеним моно- або біциклічним С312циклоалкілом або С1-С9гетероциклілом, де гетероатоми незалежно вибираються з N, O або S; де будь-який замісник С6-С10арилу або С1-С9гетероарилу, С3-12циклоалкілу або С1-С9гетероциклілу вибирається з С1-С4алкілу, С2-С4алкенілу, С2-С4алкінілу, С3-С4циклоалкілу, С3-С4циклоалкенілу, С3-С4циклоалкінілу, гідроксилу, аміну, сульфіду, силілу, галогену, нітрилу, карбонової кислоти, сульфокислоти, С1-С4алкокси, С1-С4алкілу вторинного та третинного аміну, С1-С4алкіламіду, С1С4алкілефірів, С1-С4алкілкетону, С1-С4алкілсульфідів, ефірів С1-С4алкілкарбонових кислот, ефіру С1-С4алкілсульфокислоти, С1-С4алкілсульфону, С1-С4алкілсульфоксиду, С1С4алкілсульфонаміду, С1-С4аклілового спирту, С1-С4алкілацетилу, С1-С4діалкілдисульфіду; та її фармацевтично прийнятні солі. 2 2. Сполука за п. 1, яка відрізняється тим, що R вибирається з С1-4алкілу та С3-4циклоалкілу. 2 3. Сполука за п. 1, яка відрізняється тим, що R є С1-4алкілом. 2 4. Сполука за п. 1, яка відрізняється тим, що R є метилом. 4 5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що R є заміщеним або незаміщеним фенілом. 6. Сполука за п. 1, яка є: O NH O OH N H N 40 6-(метилкарбамоїл)-4-[(4-метилфеніл)аміно]хінолін-3-карбоновою фармацевтично прийнятною сіллю. 7. Сполука за п. 1, яка є: 13 кислотою або її UA 102082 C2 O O NH O OH HN N 5 10 15 20 4-[(4-метоксифеніл)аміно]-6-(метилкарбамоїл)хінолін-3-карбоновою кислотою або її фармацавтично прийнятною сіллю. 8. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль, яка відрізняється тим, що вона придатна для застосування у терапії. 9. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за будьяким з пп. 1-7 або її фармацевтично прийнятної солі та принаймні одну фармацевтично прийнятну допоміжну речовину. 10. Фармацевтична композиція за п. 9, яка відрізняється тим, що містить принаймні ще одну додаткову фармацевтично активну сполуку. 11. Фармацевтична композиція за п. 10, яка відрізняється тим, що додаткова фармацевтично активна сполука має протипухлинну дію. 12. Сполука за будь-яким з пп. 1-7 або її фармацевтично прийнятна сіль для використання у лікування розладів, вибраних з раку, діабетичної ретинопатії, вікової макулярної дегенерації, запалення, інсульту, ішемії міокарда, атеросклерозу, макулярного набряку та псоріазу. 13. Застосування сполуки за будь-яким з пп. 1-7 або її фармацевтично прийнятної солі для виготовлення медикаменту для лікування таких розладів: рак, діабетична ретинопатія, вікова макулярна дегенерація, запалення, інсульт, ішемія міокарда, атеросклероз, макулярний набряк та псоріаз. 14. Спосіб терапевтичного лікування ссавців, які страждають від розладів, вибраних з раку, діабетичної ретинопатії, вікової макулярної дегенерації, запалення, інсульту, ішемії міокарда, атеросклерозу, макулярного набряку та псоріазу, при якому здійснюють введення сполуки за будь-яким з пп. 1-7 або її фармацевтично прийнятної солі зазначеним ссавцям. 14 UA 102082 C2 15 UA 102082 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП ―Український інститут промислової власності‖, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinoline derivatives and their use as tyrosine kinase inhibitors
Автори англійськоюWestman, Jacob, Nekhotiaeva, Natalia, Wannberg, Johan, Backman, Ulrika, Malm, Johan
Назва патенту російськоюПроизводные хинолина и их применение как ингибиторов тирозинкиназы
Автори російськоюВестман Якоб, Нехотяева Наталия, Ванберг Юхан, Бекман Ульрика, Мальм Юхан
МПК / Мітки
МПК: C07D 215/54, A61K 31/4706, A61P 35/00
Мітки: інгібіторів, хіноліну, похідні, тирозинкінази, застосування
Код посилання
<a href="https://ua.patents.su/18-102082-pokhidni-khinolinu-ta-kh-zastosuvannya-yak-ingibitoriv-tirozinkinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні хіноліну та їх застосування як інгібіторів тирозинкінази</a>
Попередній патент: Універсальна вакцина для лікування і профілактики хвороби лайма для застосування у ветеринарії і спосіб її виробництва
Наступний патент: Стабільна кристалічна сіль 1-азабіцикло[2.2.2]окт-3-илового складного ефіру (r)-3-фторфеніл-3,4,5-трифторбензилкарбамінової кислоти
Випадковий патент: Пристрій в. тищенка для виїмки та доставки вугілля на тонких пологих пластах з нестійкими породами покрівлі