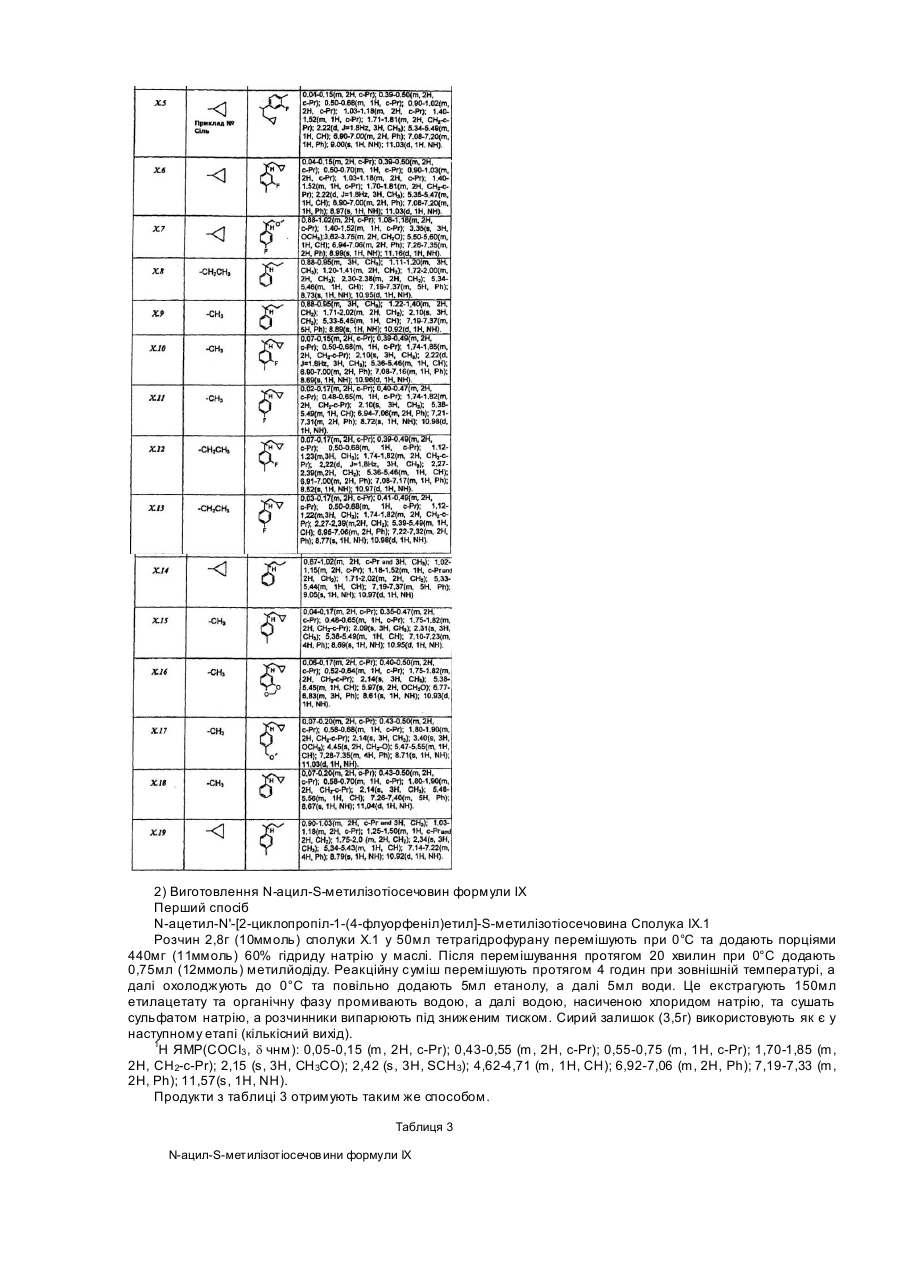
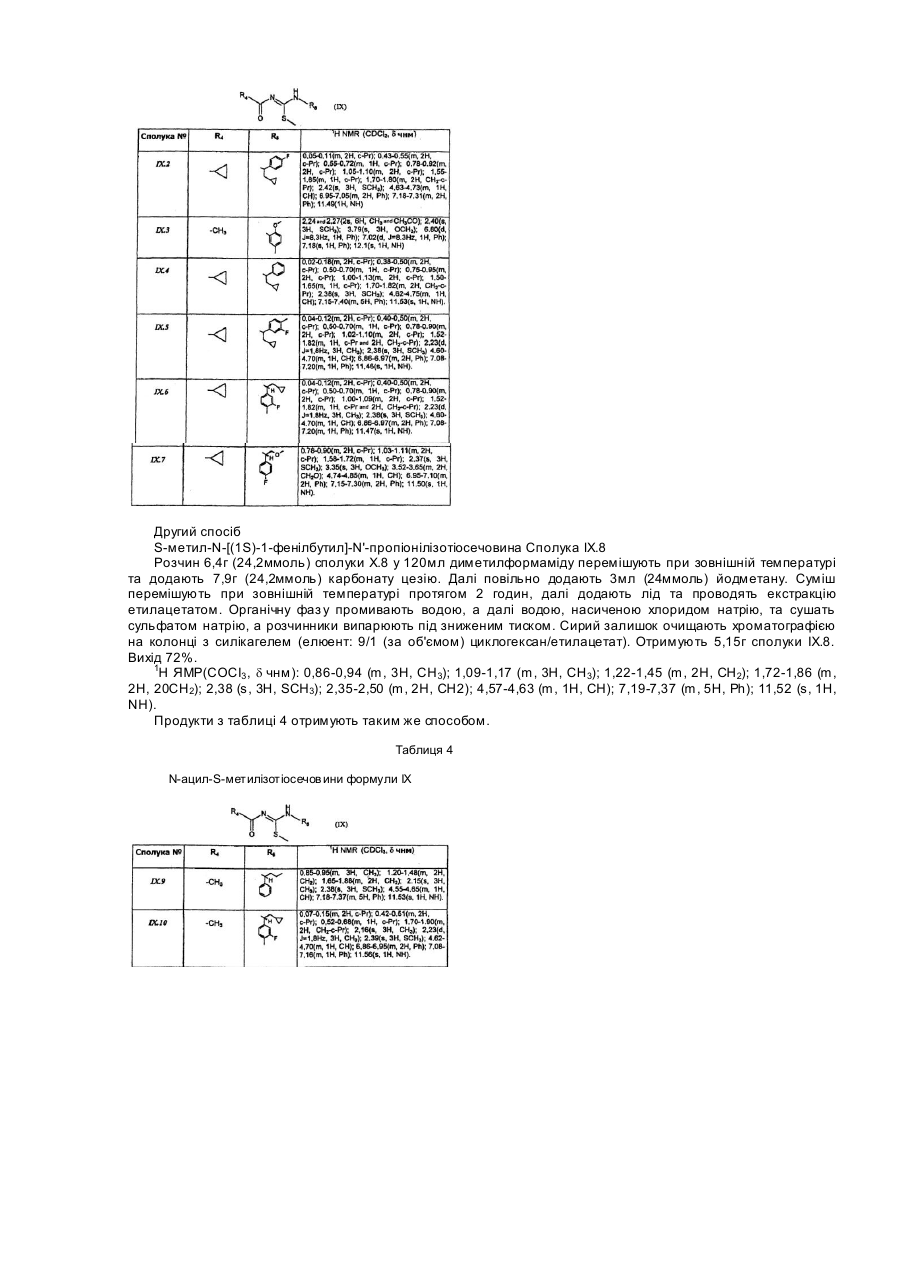
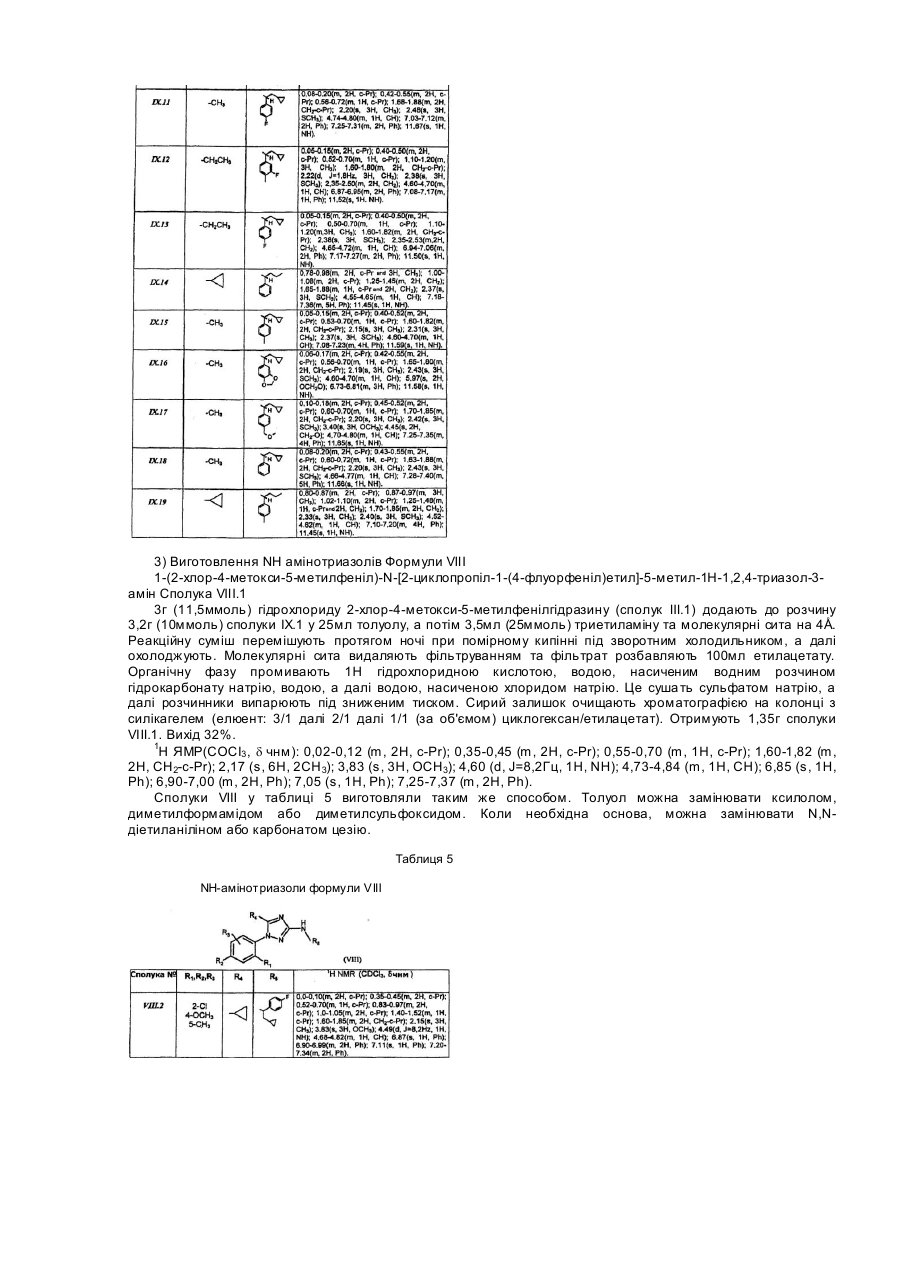
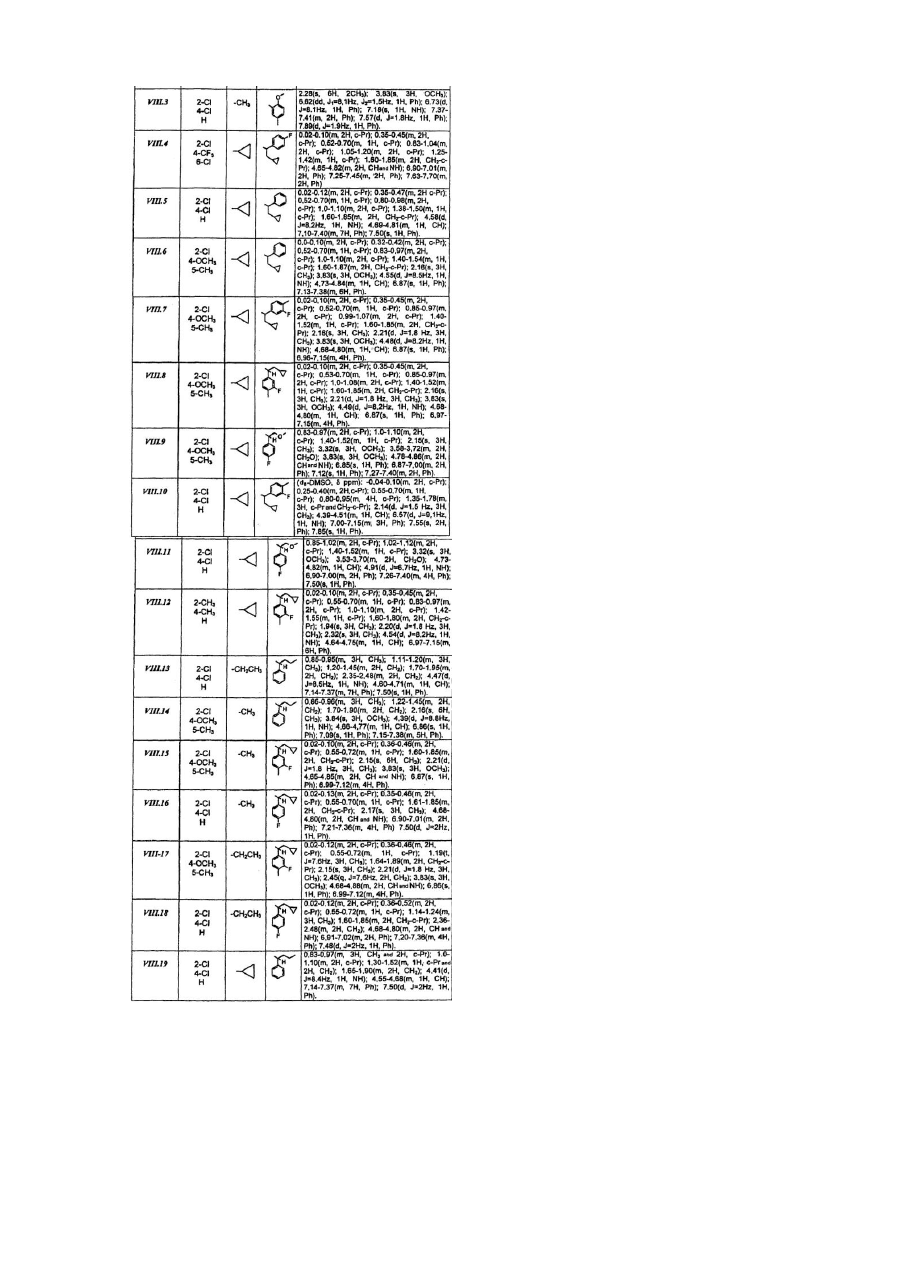
Розгалужені заміщені амінопохідні 3-аміно-1-феніл-1н-[1,2,4]триазолу, спосіб їх одержання (варіанти), фармацевтична композиція та медикамент на їх основі
Номер патенту: 73333
Опубліковано: 15.07.2005
Автори: Маффран Жан-П'єр, Жеслін Мішель, Роже П'єр, Гюллі Даніель
Формула / Реферат
1. Розгалужені заміщені амінопохідні 3-аміно-1-феніл-1Н-[1,2,4]триазолу формули:
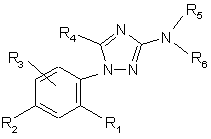 , (I)
, (I)
в яких
R1 та R2, кожний незалежно від іншого, - атом галогену, (С1-С5)алкіл, (С1-С5)алкоксил, нітрогрупа, трифлуорметил або ціаногрупа, аміногрупа NRaRb, в якій Ra та Rb, кожний незалежно від іншого, - атом гідрогену, (С1-С3)алкіл чи СО(С1-С3)алкіл, або інакше, в якій Ra та Rb складають разом з атомом нітрогену, до якого вони приєднані, 5-7-членний гетероцикл; або група S-R, в якій R - атом гідрогену або (С1-С5)алкіл, при цьому можливо, щоб атом сульфуру був моноокисненим або діокисненим;
R3 - атом гідрогену або є таким, як визначено вище для R1;
R4 - атом гідрогену, атом галогену, (С1-С5)алкіл, (С3-С5)циклоалкіл, (С3-С5)циклоалкіл-(С1-С2)алкіл, або група Rc-X-(С1-С2) алкіл, в якій Rc - атом гідрогену або (С1-С3)алкіл, а Х - О, S, SO або SO2;
R5 - (С1-С5)алкіл, алкініл з 3-5 атомами карбону або алкеніл з 3-5 атомами карбону, (С3-С5)циклоалкіл (С1-С3)алкіл; або (С1-С3)алкіл-Х-(С0-С3)алкіл, в якому Х - О, S, SO або SO2;
R6 - феніл, заміщений одним чи більше радикалами Z, щонайменше один з яких знаходиться у позиції 2, а Z - атом галогену, нітрогрупа, трифлуорметил або ціаногрупа, (С1-С5)алкіл, (С1-С5)алкіл-Х- чи (С1-С3)алкіл-Х-(С1-С2)алкіл, в яких Х - О, S, SO або SO2, гідроксі(С1-С3)алкіл або CORd, чи COORd, де Rd - (С1-С3)алкіл або (С3-С5) циклоалкіл;
або інакше, R6 - група –CHR7R8, в якій
R7 - (С3-С5)циклоалкіл, феніл, який може бути заміщеним у позиціях 3, 4 та 5 одним чи більше радикалами Z', де Z' - атом галогену, нітрогрупа, трифлуорметил або ціаногрупа, (С1-С5)алкіл, (С1-С5)алкіл-Х- чи (С1-С3)алкіл-Х-(С1-С2)алкіл, в якому Х - О, S, SO або SO2, гідрокси(С1-С3)алкіл, CORd чи COORd, де Rd визначено вище, метилендіоксил або етилендіоксил, або інакше, піридил, як варіант, заміщений аміногрупою NRaRb, яку визначено вище, або радикалом Z', який визначено вище;
R8 - (С1-С6)алкіл, (С3-С5)циклоалкіл, (С3-С5)циклоалкіл-(С1-С3)алкіл, (С1-С3)алкіл-Х-(С1-С3)алкіл, де Х - О, S, SO або SO2, або (С3-С5) циклоалкіл(С1-С2)алкіл-Х-(С1-С3)алкіл, де Х - О, S, SO або SO2;
та їх фармацевтичнo прийнятні адитивні солі, їх гідрати та/або їх сольвати.
2. Сполуки за п. 1, які відрізняються тим, що:
R1 та R2, кожний незалежно від іншого, - атом галогену, (С1-С5)алкіл, (С1-С5)алкоксил, трифлуорметил або група S-R, в якій R - (С1-С5)алкіл,
R3 - атом гідрогену або (С1-С5)алкіл;
R4 - (С1-С5)алкіл, (С3-С5)циклоалкіл або група Rа-Х-(С1-С2)алкіл, в якій Ra - (С1-С3)алкіл, а Х - O;
R5 - (С1-С5)алкіл або алкініл з 3-5 атомами карбону;
R6 - група –CHR7R8, в якій
R7 - феніл, який може бути заміщеним у позиціях 3, 4 та 5 одним чи більше радикалами Z', де Z' - атом галогену, (С1-С5)алкіл, (С1-С5)алкіл-Х- чи (С1-С3)алкіл-Х-(С1-С2)алкіл, в якому Х - О, або метилендіоксил;
R8 - (С1-С6)алкіл, (С3-С5)циклоалкіл(С1-С3)алкіл або (С1-С3)алкіл-Х-(С1-С3)алкіл, де Х - O,
та їх фармацевтично прийнятні адитивні солі, їх гідрати та/або їх сольвати.
3. Сполуки за пп. 1 або 2, які відрізняються тим, що R5 - пропіл чи пропаргіл.
4. Сполуки за будь-яким з пп. 1-3, які відрізняються тим, що є у формі енантіомерів.
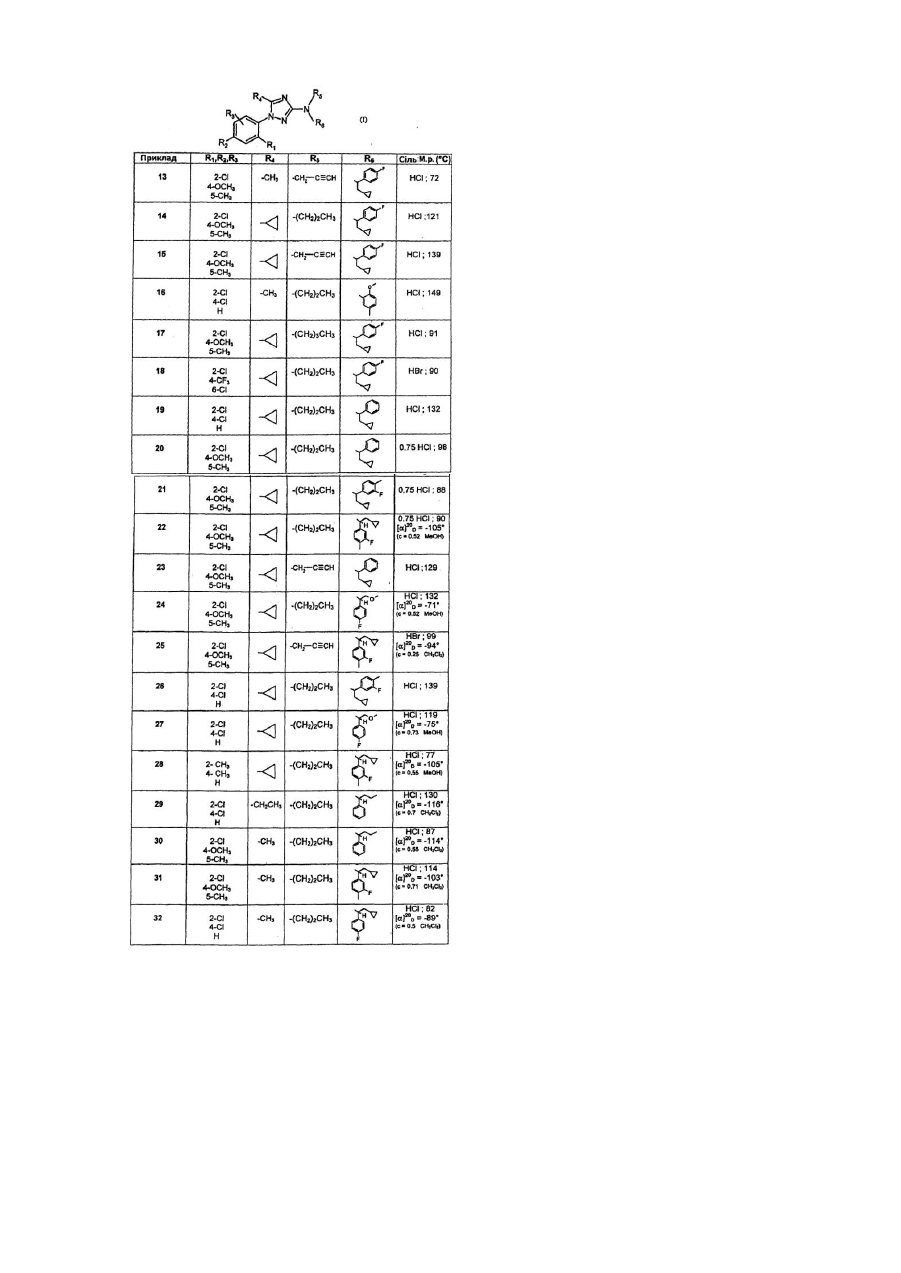
5. Сполуки за будь-яким з пп. 1-4, які відрізняються тим, що їх вибрано з групи, до складу якої входять:
гідрохлорид 5-циклопропіл-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-1-(2,4-дихлорфеніл)-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид N-[2-циклопропіл-1-(4-флуорфеніл)етил]-1-(2,4-дихлорфеніл)-5-(метоксиметил)-N-пропіл-1H-1,2,4-триазол-3-амін;
гідрохлорид N-[2-циклопропіл-1-(4-флуорфеніл)етил]-1-[2,6-дихлор-4-(трифлуорметил)феніл]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-5-метил-N-(2-пропініл)-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-N-(2-пропініл)-1Н-1,2,4-триазол-3-амін;
гідробромід 5-циклопропіл-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-1-[2,6-дихлор-4-(трифлуорметил)феніл]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 5-циклопропіл-N-(2-циклопропіл-1-фенілетил)-1-(2,4-дихлорфеніл)-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-(2-циклопропіл-1-фенілетил)-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)-етил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-(2-циклопропіл-1-фенілетил)-N-(2-пропініл)-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1R)-1-(4-флуорфеніл)-2-метоксіетил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідробромід 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)-етил]-N-(2-пропініл)-1Н-1,2,4-триазол-3-амін;
гідрохлорид 5-циклопропіл-N-[2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-1-(2,4-дихлорфеніл)-N-пропіл-1Н-1,2,4-триазол-3-амін;
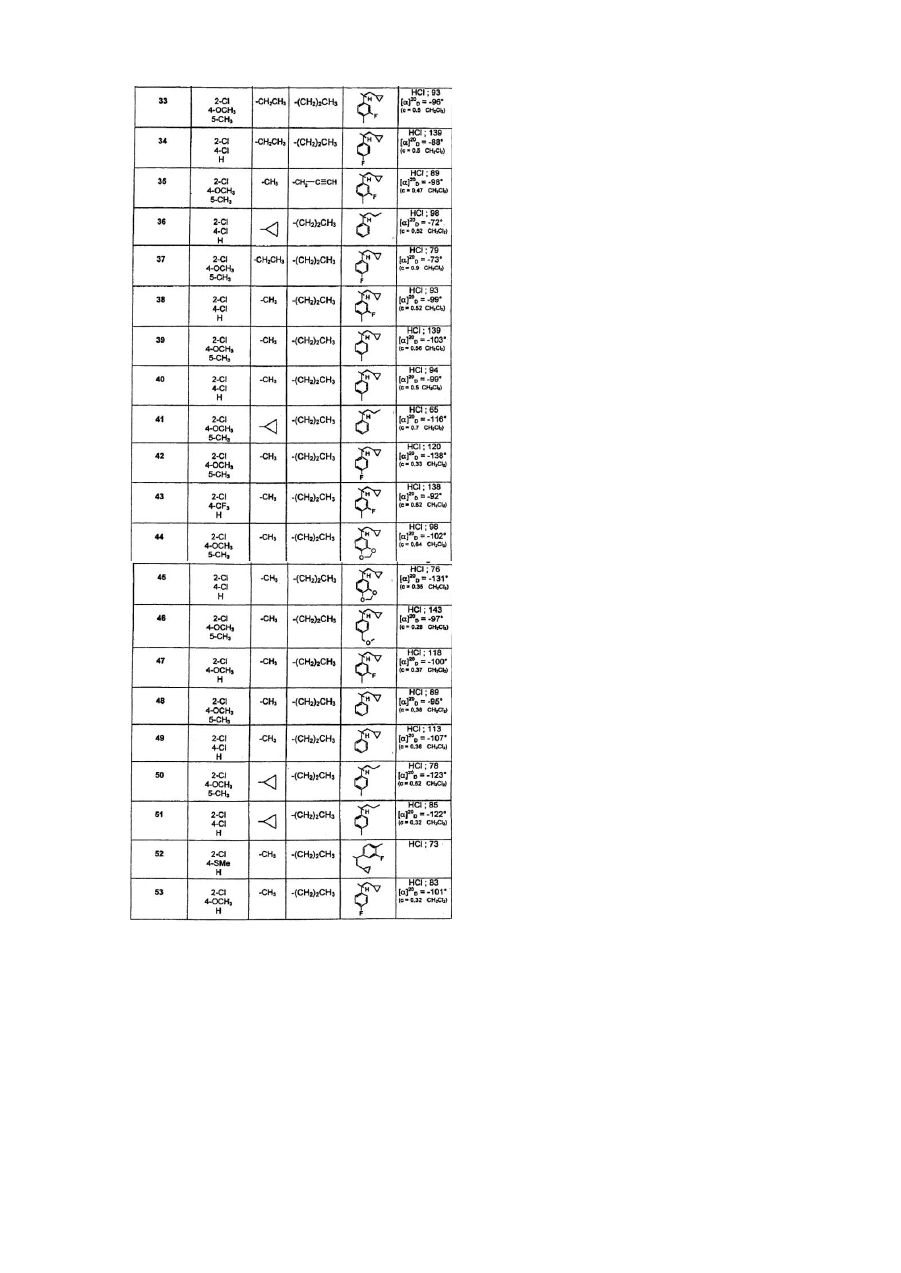
гідрохлорид 5-циклопропіл-1-(2,4-дихлорфеніл)-N-(1R)-1-(4-флуорфеніл)-2-метоксіетил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 5-циклопропіл-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-1-(2,4-диметилфеніл)-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2,4-дихлорфеніл)-5-етил-N-[(1S)-1-фенілбутил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-метил-N-(1S)-1-фенілбутил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5-етил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-1-(2,4-дихлорфеніл)-5-етил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5-метил-N-(2-пропініл)-1Н-1,2,4-триазол-3-амін;
гідрохлорид 5-циклопропіл-1-(2,4-дихлорфеніл)-N-[(1S)-1-фенілбутил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-5-етил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)-етил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(4-метилфеніл)етил]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид N-[(1S)-2-циклопропіл-1-(4-метилфеніл)етил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1S)-1-фенілбутил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-[2-хлор-4-(трифлуорметил)феніл]-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид N-[(1S)-1-(1,3-бензодіоксол-5-іл)-2-циклопропілетил]-1-(2-хлор-4-метокси-5-метилфеніл)-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид N-[(1S)-1-(1,3-бензодіоксол-5-іл)-2-циклопропілетил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-(1S)-2-циклопропіл-1-[(4-метоксиметил)феніл]етил}-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метоксифеніл)-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-феніл)етил]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид N-[(1S)-2-циклопропіл-1-феніл)етил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1S)-1-(4-метилфеніл)бутил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 5-циклопропіл-1-(2,4-дихлорфеніл)-N-[(1S)-1-(4-метилфеніл)бутил]-N-пропіл-1Н-1,2,4-триазол-3-амін;
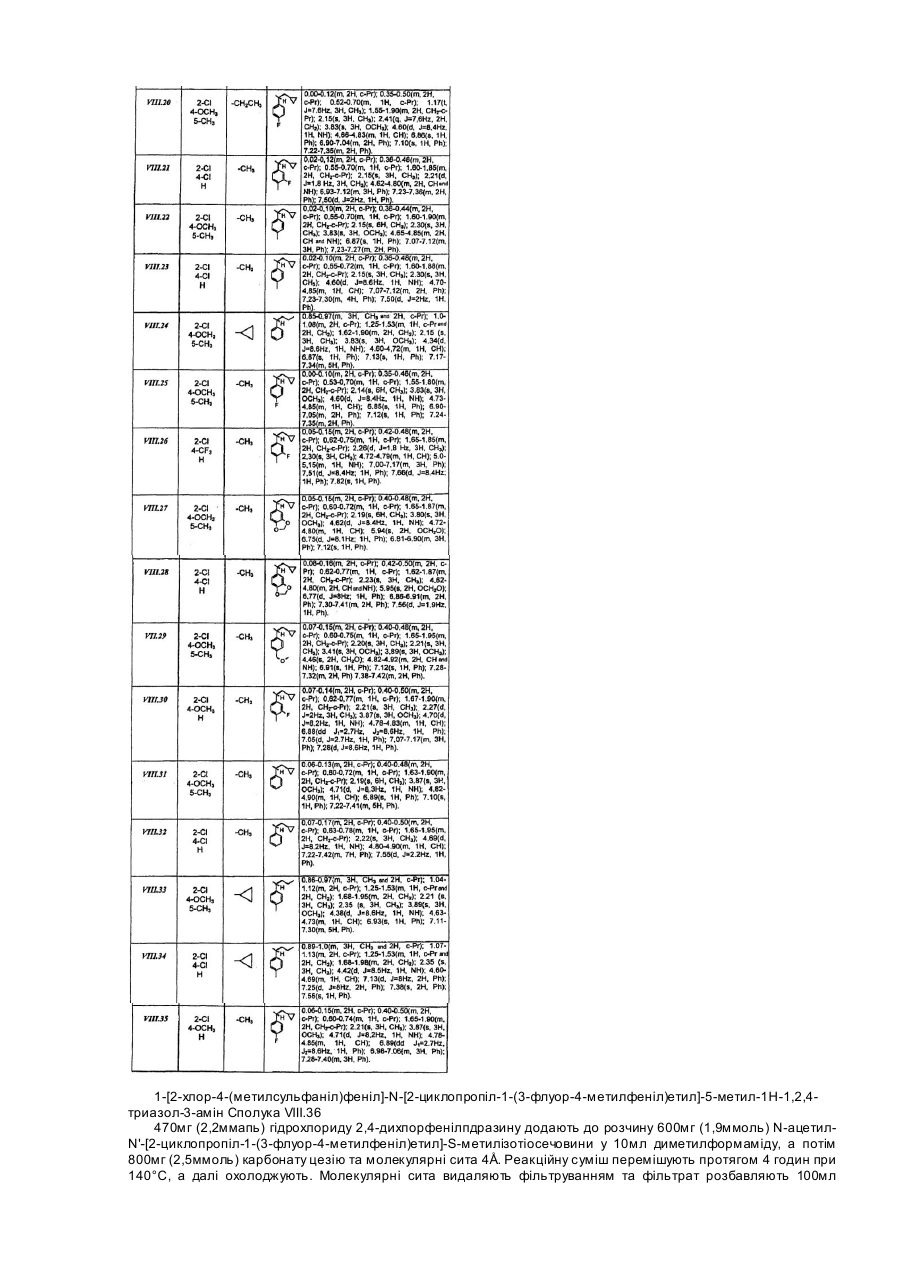
гідрохлорид 1-[2-хлор-4-(метилсульфаніл)феніл]-N-[2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін;
гідрохлорид 1-(2-хлор-4-метоксифеніл)-N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-5-метил-N-пропіл-1Н-1,2,4-триазол-3-амін; та
відповідні основи, інші фармацевтично прийнятні адитивні солі, їх сольвати та/або їх гідрати.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що її використовують для виготовлення медикаментів, призначених для попередження та/або лікування CRF-залежних захворювань.
7. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що здійснюють взаємодію сполуки формули (II)
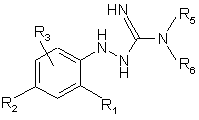 , (II)
, (II)
де R1, R2, R3, R5, та R6 визначені для сполук формули (І), зі сполукою формули R4COX (X - атом галогену) з одержанням сполуки формули (І).
8. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що здійснюють алкілування сполуки формули (VIII):
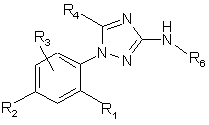 , (VIII)
, (VIII)
в якій R1, R2, R3, R4 та R6 визначені для сполук формули (І), зі сполукою формули R5X (X - атом галогену) з одержанням сполуки формули (І).
9. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що здійснюють взаємодію сполуки формули (VI):
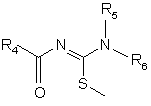 , (VI)
, (VI)
в якій R4, R5 та R6 визначені для сполук формули (І), зі сполукою формули (III):
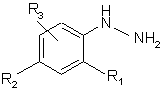 , (III)
, (III)
в якій R1, R2 та R3 визначені для сполук формули (І), з одержанням сполуки формули (І).
10. Спосіб одержання сполук формули (VIII), який відрізняється тим, що здійснюють взаємодію сполуки формули (IX):
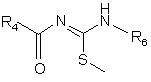 , (IX)
, (IX)
в якій R4, R5 та R6 визначені для сполук формули (І), зі сполукою формули (III):
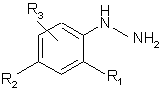 , (III)
, (III)
в якій R1, R2 та R3 визначені для сполук формули (І), з одержанням сполуки формули (VIII).
11. Фармацевтична композиція, яка відрізняється тим, що містить як активну складову сполуку за будь-яким з пп. 1-6 у комбінації з одним чи більше прийнятними ексципієнтами.
12. Медикамент, який відрізняється тим, що містить сполуку за будь-яким з пп. 1-6.
Текст
Згідно з представленим винаходом запропоновано нові розгалужені заміщені амінопохідні 3-аміно-1феніл-1Н-[1,2,4]триазолу, способи їх виготовлення та фармацевтичні композиції, що їх містять. Ці нові похідні триазолу мають антагоністичну активність з огляду на CRF (фактор вивільнення кортикотропіну) та можуть тому складати активні інгредієнти фармацевтичних композицій. Фактор вивільнення кортикотропіну (CRF) є пептидом, послідовність якого з 41 амінокислоти виявлена Vale W. et al., у 1981 році (Science, 1981, 213, 1394-1397). CRF є головним ендогенним фактором, залученим у регуляцію гіпоталамогіпофізосупраренальної осі (вивільнення адренокортикотропного гормону: АСТН) та її патологій, та також при депресивних синдромах, які є результатом її дисфункціонування. CRF також викликає секрецію β-ендорфіну, β-ліпотропіну та кортикостерону. CRF є, таким чином, фізіологічним регулятором секреції адренокортикотропного гормону (АСТН) та кортизолу дією АСТН на супраренальному рівні та більшою частиною пептидів, похідних від прупіомеланокортину (РОМС). На додаток до своєї локалізації у гіпоталамусі CRF широко розповсюджений у центральній нервовій системі, але також у екстранейронних тканинах, як-то супраренальні залози та яєчка. Присутність CRF також продемонстровано при запальних процесах. Ряд експериментів на тваринах показав, що центральне застосування CRF викликає змінну анксіогенну дію, як-то модифікацію поведінки взагалі: наприклад неофобію, зменшення сексуальної сприйнятливості та зменшення споживання їжі і уповільнений сон у щурів. Інтрацереброшлуночкові ін'єкції CRF також збільшують збудження норадренергічних нейронів блакитної плями (locus coeruleus), яка у тварин часто пов'язана зі станом тривожності. У щурів центральне або периферійне застосування CRF або споріднених пептидів (наприклад, урокортину, саувагіну) індук ує, на додаток до центральної дії, як-то збільшення настороженості та емоційної реактивності на оточення, модифікацію розвантаження шлунку, секреції кислоти, часу проходження крізь кишечник та виділення калу, а також напружувальну дію. CRF є також залученим у комплексну регуляцію запальних реакцій, з одного боку прозапальною роллю у деяких тваринних моделях (дегрануляція мастоцитів, утворених при вивільненні запальних молекул, як-то гістамін, простагландин, тощо), а з другого боку, як інгібітор дії, спричиненої повсюдним зростанням проникності судин як результат запалення. Ряд експериментів на тваринах показав, що центральне застосування CRF викликає змінну анксіогенну дію, як-то модифікацію поведінки взагалі: наприклад неофобію, зменшення сексуальної сприйнятливості та зменшення споживання їжі і уповільнений сон у щурів. Інтрацереброшлуночкові ін'єкції CRF також збільшують збудження норадренергічних нейронів блакитної плями (locus coeruleus), яка у тварин часто пов'язана зі станом тривожності. У щурів центральне або периферійне застосування CRF або споріднених пептидів (наприклад, урокортину, саувагіну) індук ує, на додаток до центральної дії, як-то збільшення настороженості та емоційної реактивності на оточення, модифікацію розвантаження шлунку, секреції кислоти, часу проходження крізь кишечник та виділення калу, а також напружувальну дію. CRF є також залученим у комплексну регуляцію запальних реакцій, з одного боку прозапальною роллю у деяких тваринних моделях (дегрануляція мастоцитів, утворених при вивільненні запальних молекул, як-то гістамін, простагландин, тощо), а з другого боку, як інгібітор дії, спричиненої повсюдним зростанням проникності судин як результат запалення. Використання пептидного антагоністу CRF, α-спірального (9-41) (αHCRF), або специфічних антитіл (Rivier J. et аІ., Science, 1984, 224, 889-891) зробило можливим підтвердити рол цього пептиду в усі х цих ефектах. Ці експерименти також підтвердили важливу роль CRF у людини у інтеграції комплексних реакцій, спостережуваних при фізіологічних, психологічних або імунологічних стресах одночасно на нейроендокринному, вісцеральному та поведінковому рівнях [Morley J. Ε. et аІ., Endocrine Review, 1987, 8, 3, 256-287; Smith M, A, et al., Horn Res., 1989, 31, 66-71]. На додаток, клінічні дані свідчать проти на користь ефективного залучення CRF у багатьох розладах, утворених від стану стресу [Gulley L. R et al., J. Clin. Psychiatry, 1993, 54, 1, (suppl.), 16-19], наприклад, наявність CRF-дослідження (внутрішньовенне застосування) у людини зробило можливим показати модифікацію АСТН-реакції у пацієнтів з депресією [Breier A. et al., Am. J. Psychiatry, 1987, 144, 1419-1425], відкриття ендогенної гіперсекреції CRF у деяких патологіях, наприклад, високому рівні CRF у спинномозковій рідині у пацієнтів, що не вживали ліки і відчувають депресією або страждають від деменції типу хвороби Альцгеймера [Nemeroff С. В. et al., Science 1984, 226, 4680, 1342-1343; Regul. Pept, 1989, 25, 123-130], або зменшеної концентрації рецепторів CRF у корі головного мозку жертв самогубства [Nemeroff С.В. et al., Arch Gen. Psychiatry, 1988, 45, 577-579], дисфункціонування CRF-залежних нейронів навіть запропоновано у суворих патологіях, якими є хвороби Альцгеймера та Паркінсона, хорея Хантингтона та аміотрофний латеральний склероз [De Souza E.B., Hospital 1988, 23, 59]. Центральне застосування CRF у багатьох видів тварин продукує поведінкові ефект, подібні отриманим у людини у стресових ситуаціях. Коли вони повторюються протягом часу, ці ефекти можуть призводити до різних патологій, як-то: втома, гіпертензія, серцеві розлади та розлади тиску, модифікації шлункового випорожнення та виділення калу (коліт, подразнений кишечник), модифікація секреції кислоти, гіперглікемія, затримка росту, анорексія, неофобія, мігрень, репродуктивні розлади, імуносупресія (запальні процеси, складні інфекції та рак) і різні нейропсихіатричні розлади (депресія, анорексія або булімія на нервовому фун ті та тривожність). Ін'єкція інтрацереброшлуночковим шляхом згаданого пептидного антагоністу, αΗ-CRF (9-41), попереджує ефекти, отримані застосуванням екзогенного CRF або використанням засобів, що індукують стрес (етер, ув'язнення, сильний шум, електрошок, відлучення від етанолу або хірургічне втручання), здатних самостійно індукувати зростання рівня ендогенного CRF. Ці результати підтверджені дослідженням багатьох антагоністів молекул пептидів, які є структурно спорідненими з CRF та мають подовжену дію з огляду на αH-CRF (9-41) [Rivier J. et al., J.Med. Chem., 1993, 36, 2851-2859; Menzaghi F. et al., J. Pharmacol. Exp. Ther., 1994, 269,2,564572; Hernandez J. F. et al.,J. Med.Chem,1993, 36,2860-2867]. Такі сполуки CRF-антагоністів пептидів розкриті, наприклад, у патентах США 5 109 111, 5 132 111 та 5 245 009, і у патентних заявках WO 92/22 576 та WO 96/19 499. На додаток, попередні дослідження показали, що трициклічні антидепресанти можуть модулювати рівень CRF та ряд рецепторів CRF у мозку [Grigoriadis D. Ε. et al., Neuropsychopharmacology, 1989, 2,53-60). Подібно, бензодіазепінові анксіолітики здатні інгібувати дію CRF [Britton Κ. Τ. et a I., Psychopharmacology, 1988, 94,306], без чіткого освітлення механізму дм цих речовин. Ці результати підтверджують, при необхідності, зростаючу необхідність молекул непептидних антагоністів для рецепторів CRF. Важливо також звернути увагу на три можливі наслідки станів хронічного стресу, якими є імунодепресія, розлади здатності до репродукції потомства та розвиток діабету. CRF викликає такі ефекти взаємодією зі специфічними мембранними рецепторами, які охарактеризовано у гіпофізі та мозку ряду видів (миші, щури та людина), а також у серці, скелетних м'язах (миші, щури) та у м'язовій оболонці матки та плаценти при вагітності. Сполуки 3-міно-1-феніл-1Н-[1,2,4]триазолів великою мірою не представлені. Згадати можна зокрема сполуку, що несе феніл у позиції 5, яку розкрито Ebenreth A. Szilagil G. та Janaky J. [Arch. Pharm, 1989, 322(10), 583-7, патентах №№HU44522, HU195791, 1986], де заявлено антизапальні-антиревматичні властивості. У двох патентах Японії [JP 02091061 та JP 2729810, 1988] Inamori et al., розкрито виготовлення 3аміно-1-феніп-1Н-[1,2,4]триазолів як інсектицидів. У нейрокринній патентній заявці, опублікованій під №WO 96/39 400, сполуки 3-аміно-5-феніл-1H[1,2,4]триазолів розкриті як антагоністи рецепторів CRF. Зараз згідно з представленим винаходом виявлено, що деякі 3-аміно-1-феніл-1Н-[1,2,4]похідні триазолу, як об'єкт представленого винаходу, мають чудову спорідненість з рецепторами CRF. Крім того, внаслідок їх структури, ці молекули мають гарну здатність до диспергування та/або розчинність у розчинниках або розчинах, звичайно використовуваних у терапії, які надають їм фармакологічної активності, а також роблять можливим легке виготовлення пероральних та парентеральних фармацевтичних дозованих форм. Зараз згідно з представленим винаходом виявлено, що деякі 3-аміно-1-феніл-1Н-[1,2,4]похідні триазолу, як об'єкт представленого винаходу, мають чудову спорідненість з рецепторами CRF. Крім того, внаслідок їх структури, ці молекули мають гарну здатність до диспергування та/або розчинність у розчинниках або розчинах, звичайно використовуваних у терапії, які надають їм фармакологічної активності, а також роблять можливим легке виготовлення пероральних та парентеральних фармацевтичних дозованих форм. Об'єктом представленого винаходу є сполуки у рацемічній або енантіомерній формі формули: (l) в яких R1 та R2 представляють, кожний незалежно один від одного, атом галогену; (С1-С5)алкіл; (С1-С5)алкоксил; нітрогрупу, трифлуорметил або ціаногрупу; аміногрупу NRаRb, в якій Rа та Rb представляють, кожний незалежно один від одного, атом гідрогену, (С1-С3)алкіл або СО(С 1-С3)алкіл або інакше, в якій Rа та Rb складають, з атомом нітрогену, до якого вони приєднані, 5-7-членний гетероцикл; або групу S-R, в якій R представляє атом гідрогену або (С1-С5)алкіп, можливо, щоб атом сульфур у був моноокисненим або діокисненим; R3 представляє атом гідрогену або є таким, як визначено вище для R1. R4 представляє атом гідрогену; атом галогену; (С1-С5)алкіл; (С3-С5)циклоалкіл; (С3-С5)циклоалкіл-(С1С2)алкіл; або групу Rс-X-(С1-С2)алкіл, в якій Rс представляє атом гідрогену або (С1-С3)алкіл, а X представляє О, S, SO або SO 2; R5 представляє (С1-С5)алкіл, алкініл з 3-5 атомами карбону або алкеніл з 3-5 атомами карбону; (С3С5)циклоалкіл-(С1-С3)алкіл, або (С3-С5)циклоалкіл-Х-(С0-С3)алкіл, в якому X представляє О, S, SO або SO2 ; R6 представляє феніл, заміщений одним чи більше радикалами Z, щонайменше один з яких знаходиться у позиції 2, a Z представляє атом галогену; нітрогрупу, трифлуорметил або ціаногрупу; (С1-С5)алкіл, (С1С5)алкіл-Х, чи (С1-С3)алкіл-X-(С1-С2)алкіл, в яких Х представляє О, S, SO або SO2; гідрокси(С 1-С3)алкіл; або CORd чи COORd де Rd представляє (С1-С3)алкіл або (С3-С5) циклоалкіл, або інакше R6 представляє групу -CHR7R8, в якій R7 представляє (С3-С5)циклоалкіл; феніл, який може бути заміщеним у позиціях 3, 4 та 5 одним чи більше радикалами Z', де Z' - атом галогену; нітрогрупа, трифлуорметил або цаногрупа; (С1-С5)алкіл, (С1-С5)алкіл-Х-, чи (С1-С3)алкіл-Х-(С1-С2)алкіл, в якому Х представляє О, S, SO або SO2; гідрокси(С 1-С3)алкіл; CORd чи COORd де Rd, визначено вище; метилендіоксил або етилендіоксил; або інакше піридил, як варіант, заміщений аміногрупою NRg Rb, яку визначено вище, або радикалом Z, який визначено вище; R8 представляє (С1-С6)алкіл; (С3-С5)циклоалкіл, (С3-С5)циклоалкіл–(С1-С3)алкіл; (C1-C3)алкіл Х-(С1С3)алкіл, де X представляє О, S, SO або SO2; або (С3-С5) циклоалкіл(С 1-С2)алкіл-Х-(С1-С3)алкіл, де X представляє О, S, SO або SO2; та їх фармацевтично прийнятні адитивні солі, їх гідрати та/або їх сольвати. У представленому описі термін "галоген" означає атом флуору, хлор у, брому або йоду. Алкіли або алкоксили є лінійними або розгалуженими. Згідно з іншими аспектами винаходу запропоновано сполуки формули (І), у рацемічній або енантіомерній формі, в яких: R1 та R2 представляють, кожний незалежно один від одного, атом галогену; (С1-С2)алкіл; (С3-С5)алкоксил; трифлуорметил або групу S-R, в якій R представляє (С1-С5)алкіл. R3 представляє атом гідрогену або (С1-С5)алкіл. R4 представляє (С1-С5)алкіл; (С1-С5)циклоалкіл або групу Ra-Х-(С1-С5)алкіл, в якій Rа представляє (С1С5)алкіл, а X представляє О; R5 представляє (С1-С5)алкіп або алкініл з 3-5 атомами карбону; R6 представляє групу -CHR7R8, в якій R7 представляє феніл, який може бути заміщеним у позиціях 3, 4 та 5 одним чи більше радикалами Z', де Z' - атом галогену; (С 1-С5)алкіл, (С1-С5)алкіл-Х-, чи (С1-С3)алкіл-Х-(С1-С2)алкіл, в якому X представляє О; або метилендіоксил; R8 представляє (С1-С5)алкіл; (С3-С5)циклоалкіл-(С1-С3)алкіл; чи (С1-С3)алкіл-Х-(С1-С3)алкіл, де X представляє О, та їх фармацевтично прийнятні адитивні солі, їх гідрати та/або їх сольвати. Згідно з іншими аспектами винаходу запропоновано сполуки формули (І) у рацемічній або енантіомерній формі, в яких R5 представляє пропіл або пропаргіл та їх фармацевтично прийнятні адитивні солі, їх гідрати та/або їх сольвати. Винахід конкретніше стосується ви щенаведених сполук у енантіомерній формі. Згідно з іншими аспектами винаходу запропоновано наступні сполуки: гідрохлорид 5-циклопропіл-N-[2-циклоалкіл-1-(4-флуорфеніл)етил]-1-{2,4-дихлорфеніл)-N-пропіл-1Н-1,2,4триазол-3-аміну (Приклад 7) гідрохлорид N-[2-циклопропіл-1-(4-флуорфеніл)етил]-1-(2,4-дихлорфеніл)-5-(метоксиметил)-N-пропіл-1Н1,2,4-триазол-3-аміну (Приклад 9) гідрохлорид N-[2-циклопропіл-1-(4-флуорфеніл)етил]-1-[2,6-дихлор-4-(трифлуорметил)феніл]-5-метил-Nпропіл-1Н-1,2,4-триазол-3-аміну (Приклад 10) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл-N-[2-циклопропіл-1-(флуорфеніл)етил]-5-метил-N-(2пропініл)-1Н-1,2,4-триазол-3-аміну (Приклад 13) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-Nпропіл-1Н-1,2,4-триазол-3-аміну (Приклад 14) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-N(2-пропініл)-1Н-1,2,4-триазол-3-аміну (Приклад 15) гідробромід 5-циклопропіл-N-[2-циклопропіл-1-(4-флуорфеніл)-етил]-1-(2,6-дихлор-4(трифлуорметил)феніл]-N-пропіл-1Н-1,2,4-триазол-3-аміну (Приклад 18) гідрохлорид 5-циклопропіл-N-(2-циклопропіл-1-фенілетил)-1-(2,4-дихлорфеніп)-N-пропіл-1Н-1,2,4-триазол3-аміну (Приклад 19) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-(2-циклопропіл-1-фенілетил)-N-пропіл1Н-1,2,4-триазол-3-аміну (Приклад 20) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1S)-2-циклопропіп-1-(3-флуор-4метилфеніл)-етил]-N-пропіл-1Н-1,2,4-триазол-3-аміну (Приклад 22) гідрохлорид 1-(2-хлор-4-метокси-5-метилфен)-5-циклопропіл-N-(2-цикпопропіл-1-фенілетил)-N-(2пропініл)-1Н-1,2,4-триазол-3-аміну (Приклад 23) гідрохлорид 1-(2-xлop-4-мeтoкcи-5-метилфeнiл)-5-циклoпpoпiл-N-(1R)-1-(4-флуорфеніл)-2-метоксіетил]-Nпропіп-1Н-1,2,4-триазол-3-аміну (Приклад 24) гідробромід 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1S)-2-циклопропіл-1-(3-флуор-4метилфеніл)-етил]-N-(2-пропініл)-1Н-1,2,4-триазол-3-аміну (Приклад 25) гідрохлорид 5-циклопропіл-N-[2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-1-(2,4-дихлорфеніл)-Nпропіл-1Н-1,2,4-триазол-3-аміну (Приклад 26) гідрохлорид 5-циклопропіл-1-(2,4-дихлорфеніп)-N-[(1R)-1-(4-флуорфеніл)-2-метоксіетил]N-пропіл-1Н-1,2,4триазол-3-аміну (Приклад 27) гідрохлорид 5-циклопропіл-Ν-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-1-(2,4-диметилфеніл)-Nпропіл-1Н-1,2,4-триазол-3-аміну (Приклад 28) гідрохлорид 1-(2,4-дихлорфеніл)-5-етил-N-[фенілбутил]-N-пропіл-1Н-1,2,4-триазол-3-аміну (Приклад 29) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-метил-N-5[(1S)-1-фенілбутил]-N-пропіл-1Н-1,2,4триазол-3-аміну (Приклад 30) гідрохлорид 1-(2-хпор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5метил-N-пропіл-1Н-1,2,4-триазол-3-амну (Приклад 31) гідрохлорид N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл-1Н-1,2,4триазол-3-аміну (Приклад 32) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5етил-N-пропіл-1Н-1,2,4-триазол-3-аміну (Приклад 33) гідрохлорид Ν-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-1-(2,4-дихлорфеніл)-5-етил-N-пропіл-1Н-1,2,4триазол-3-аміну (Приклад 34) гідрохлорид 1-(2хлор-4-метокси-5-метилфеніл)-N-(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5метил-N-(2-пропініл)-1Н-1,2,4-триазол-3-аміну (Приклад 35) гідрохлорид 5-циклопропіл-1-(2,4-дихлорфеніп)-N-[(1S)-1-фенілбутил]-N-пропіп-1Н-1,2,4-триазол-3-аміну (Приклад 36) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-5-етил-Nпропіл-1Н-1,2,4-триазол-3-аміну (Прикпад37) гідрохлорид N-[(1S)-2-цикпопропіл-1-(3-флуор-4-метилфеніл)-етил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл1Н-1,2,4-триазол-3-аміну (Приклад 38) 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(4-метилфеніл)етил]-5-метил-N-пропіл-1Н1,2,4-триазол-3-аміну гідрохлорид (Прикпад39) N-[(1S)-2-циклопропіл-1-(4-метилфеніл)етил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл-1Н-1,2,4-триазол-3аміну гідрохлорид (Приклад 40) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1S)-1-фенілбутилї-N-пропіл-1Н-1,2,4триазол-3-аміну (Приклад 41) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-5-метил-Nпропіл-1Н-1,2,4-триазол-3-аміну (Прикпад42) гідрохлорид 1-[2-хлор-4-(трифлуорметил)феніл]-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5метил-N-пропіл-1Н-1,2,4-триазол-3-аміну (Приклад 43) гідрохлорид N-[(1S)-1-(1,3-бензодіоксол-5-іл)-2-циклопропілетил]-1-(2-хлор-4-метокси-5-метилфеніл)-5метил-N-пропіл-1Н-1,2,4-триазол-3-аміну (Приклад 44) гідрохлорид N-[(1S)-1-(1,3-бензодіоксол-5-іл)-2-циклопропілетил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл1Н-1,2,4-триазол-3-аміну (Приклад 45) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-{(1S)-2-циклопропіл-1-[(4-метоксиметил)феніл]етил}-5метил-N-пропіл-1Н-1,2,4-триазол-3-аміну (Приклад 46) гідрохлорид 1-(2-хлор-4-метоксифеніл)-N-[(1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5-метил-Nпропіл-1H-1,2,4-триазол-3-аміну (Приклад 47) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-N-[(1S)-2-циклопропіл-1-феніл)етил]-5-метил-N-пропіл-N1,2,4-триазол-3-аміну (Приклад 48) гідрохлорид N-[(1S)-2-циклопропіл-1-феніл)етил]-1-(2,4-дихлорфеніл)-5-метил-N-пропіл-1Н-1,2,4-триазол3-аміну (Приклад 49) гідрохлорид 1-(2-хлор-4-метокси-5-метилфеніл)-5-циклопропіл-N-[(1S)-1-(4-метилфеніл)бутил]-N-пропіл1Н-1,2,4-триазол-3-аміну (Приклад 50) гідрохлорид 5-циклопропіл-1-(2,4-дихлорфеніл)-N-[(1S)-1-(4-метилфеніп)бутил]-N-пропіп-1Н-1,2,4-триазол3-аміну (Приклад 51) гідрохлорид 1-[2-хпор-4-(метилсульфаніл)феніл]-N-[2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5метил-N-пропіл-1Н-1,2,4-триазол-3-аміну (Приклад 52) гідрохлорид 1-(2-хпор-4-метоксифеніл)-N-[(1S)-2-циклопропіл-1-(4-флуорфеніл)етил]-5-метил-N-пропіл-1Н1,2,4-триазол-3-аміну (Приклад 53) відповідні їм основи, інші фармацевтично прийнятні адитивні солі, їх гідрати та/або їх сольвати. Сполуки винаходу у вільній формі звичайно виявляють слабкі основні властивості. Солі сполук формули (І) з фармацевтично прийнятними кислотами є кращими солями, але ті солі, які роблять можливим виділити сполуки формули (І), зокрема очистити їх, або отримати чисті енантіомери або діастереоізомери, також є об'єктом винаходу. Серед фармацевтично прийнятних кислот для виготовлення активних солей сполук формули (І)можна згадати гідрохлоридну, гідробромідну, фосфа тну, фумарову, лимонну, щавлеву, сульфатну аскорбінову, винну, малеїнову, мигдальну, метансульфонову, лактобіонову, глюконову, глюкарову, янтарну, сульфонову або гідроксипропансульфонову кислоти. Сполуки винаходу можна виготовити двома шляхами синтезу А та В. Шлях синтезу А представлено у схемі 1. Схема 1: Шлях синтезу А Шляхом А, сполуку (І) виготовляють конденсацією гідрохлориду аніліногуанідину (II) з галогенангідридом типу R4-CO-X або ангідридом R4-CO-O-CO- R4 у присутності органічної основи (піридин, триетиламін, тощо) у органічному розчиннику, переважно піридині. У випадку, коли R4 представляє атом гідрогену, галогенангідрид замінюють мурашиною кислотою (Chem. Веr., 1965, 98, 1476-1486). Гідрохлорид аніліногуанідину (II) отримують реакцією гідрохлориду фенілгідразину (III) з ціанамідом (IV) у киплячому під зворотним холодильником спирті, переважно ізопропанолі, згідно зі способом, що описано Erczi et aІ., (Eur. J. Med. Chem., 1 993, 28, 185-193). Гідрохлорид фенілгідразину (III) може бути комерційно доступним або його можна виготовити з відповідного аніліну діазотуванням та далі відновленням хлоридом або лужними сульфатами стануму (II). Ціанамід (IV) виготовляють з вторинного аміну (V) реакцією з ціаногенбромідом у органічному розчиннику, як-то діетиловий етер або ацетонітрил. Цей шлях синтезу А особливо ефективний, коли R5 - група типу алкілу. Шлях синтезу В представлено у схемі 2. Схема 2: Шлях синтезу В Коли вихідний амін є вторинним, використовують альтернативну форму В1, а коли він є первинним, використовують альтернативну форму В2. Шляхом В1 амінотриазол (І) виготовляють конденсацією фенілгідразину (III) з N-ацил-Sметилізотіосечовиною (VI) нагріванням у толуолі, ксилолі, диметилформаміді або диметилсульфоксиді, коли фенілгідразин (III) представлено сіллю, наприклад, у формі гідрохлориду, додають основу, як-то триетиламін, Ν,Ν-діетиланілін або карбонат цезію. N-ацил-S-метилізотіосечовину (VI) отримують з N-ацилтіосечовини (VII) S-метилуванням йодметаном у розчиннику, як-то дихлорметан або тетрагідрофурані, після дії основи, переважно гідриду натрію, або інакше у диметилформаміді або тетрагідрофурані у присутності карбонату цезію. N-ацилтіосечовину (VII) отримують додаванням вторинного аміну (V) до ацилізотіоціанату R 4CONCS. Умови обробки, температуру та розчинник можна варіювати згідно з реактивністю амінів. Використовуваними розчинниками можуть бути, наприклад, ацетон, дихлорметан, бензол, толуол або хлороформ. Ацилізотіоціанат R4CONCS звичайно виготовляють завчасно реакцією між ацилгалогенідом R4COCІ та лужним тіоціанатом (тіоціанат амонію, наприклад) у ацетоні. Шляхом В2 амінотриазол (І) виготовляють з NH-амінотриазолу (VIII) реакцією алкілування. Умови обробки підбирають згідно з реактивністю вторинного аміну та галогеніду. Використовуваними системами можуть бути: гідрид натрію/DMF, гідрид калію/бензол/краун-етер, гідрид калію/гетрагідрофуран/краун-етер, лужний третбутоксид/ДМСО. Умови синтезу для виготовлення NH-амінотриазолу (VIII) з первинного аміну (XI) через проміжну Nацилтіосечовину (X), а далі N-ацил-S-метилізотіосечовину (IX) подібні до описаних для шляху В1. Сполуки формули (І) перетворюють у солі, звичайно у формі гідрохлориду. Ці гідрохлориди можуть бути у формі кристалічних або аморфних твердих речовин, отриманих осадженням з розчиннику (або суміші розчинників), як-то пентан, діізопропіловий етер або діетиловий етер. Первинні аміни (XI) та вторинні аміни (V) використовувані, коли вони мають асиметричний атом карбону (R6=CH(R 8)R7), можуть бути у рацемічній або енантіомерній формі фенілкетону (1).В останньому випадку синтез проводять згідно з нижченаведеною схемою 3. Заміщений фенілкетон (1) перетворюють у оксим (2) та далі у бензилоксим (3). Бензилоксим (3) відновлюють, алюмогідридом літію з метою отримання рацемічного аміну, або хіральним комплексом, як-то хіральний оксазаборолідин-борановий комплекс, для отримання аміну у формі енантіомеру. Схема 3 Вищенаведені сполуки формули (І) також включають ті, в яких один чи більше атомів гідрогену або карбону заміщено їх радіоактивним ізотопом, наприклад тритієм або карбоном-14. Такі мічені сполуки використовують у дослідженнях, метаболічних або фармакокінетичних роботах, або альтернативно, у біохімічних дослідженнях як ліганди рецепторів. Сполуки представленого винаходу утворили об'єкт біохімічного та фармакологічного дослідження. Вони мають дуже переважні фармакологічні властивості. Сполуки винаходу при концентраціях менше 10мкМ, витісняють зв'язаний йодинований CRF або споріднені пептиди (уротензин, саувагін), наприклад 125l-Tyr-CRF з рецепторами, присутніх на мембранах мозку, або на культивованих клітинах, згідно зі способом, що описано Е. В. De Souza (J.Neurosci., 1987, 7,1,88-100). Антагоністичну активність сполук згідно з винаходом продемонстровано їх здатністю інгібувати деякі активності, асоційовані з CRF. Зокрема, сполуки формули (І) здатні інгібувати секрецію кортикотропіну (АСТН) індуковану CRF. Дослідження секреції АСТН, індукованої CRF проведено у vivo у conscious rats, згідно з адаптованим способом С. Rivier et аl., Еndосrіnоlоgу, 1982,110(1), 272-278. CRF є нейропептидом, який регулює активність гіпоталамогіпофізосупраренальної осі. Цей фактор відповідає за ендокринні та поведінкові реакції, споріднені зі стресом. Дійсно, показано, що CRF може модулювати поведінку, а також деякі функції автономної нервової системи [G.F.Koob, F.Е.Bloom, Fed. Proc., 1985, 44, 259; Μ.R.Brawn, L.A.Fisher, Fed. Proc, 1985, 44, 243]. Конкретніше, CRF індукує секрецію кортикотропіну (АСТН), (3-ендорфінів та інших пептидів, похідних від прупіомеланокортину [A.Ta zi et al., Regul. Peptides, 1987, 18, 37; M.R.Brown et al., Regul. Peptides, 1986. 16, 321; С.L.Williams et al., Am. J.Ph ysiol., 1987. G582, 253]. Сполуки винаходу можна тому використовува ти при регуляції секреції цих ендогенних речовин. Конкретніше, їх застосовують як активну складову у медикаментах для зменшення реакції на стрес (поведінка, емоційні стани, шлунково-кишкові та серцево-судинні розлади, або розлади імунної системи), а більш звичайно, у патологіях з залученням CRF, як-то наприклад, психіатричні розлади, тривожність, депресія, анорексія та булімія на нервовому ґрунті, епілепсія, розлади сексуальної активності та репродуктивної здатності, хвороба Альцгеймера або інші. Сполуки винаходу дуже стійкі та є тому особливо прийнятними при створенні активної складової медикаментів. Винахід також стосується фармацевтичних композицій, що містять як активну складову сполуку формули (І) або одну з її фармацевтично прийнятних солей, як варіант, у комбінації з одним чи більше прийнятними інертними ексципієнтами. У кожній одиничній дозі активна складова формули (І) присутня у кількості, придатній для завбачуваних добових доз. Кожна одинична доза є придатно підігнаною згідно з дозою та типом передбачуваного вживання, наприклад таблетки, тверді желатинові капсули тощо, скляночки, сиропи тощо, краплі або трансдермальні або трансслизові пластири так, щоб така одинична доза включала 0,5-800мг активної складової, переважно 0,5200мг, що треба застосовувати кожної доби. Сполуки згідно з винаходом можна також використовувати у комбінації з іншою активною складовою, використовуваною у потрібній терапії, як-то, наприклад, анксіолітики, антидепресанти або анорексигеніки. Сполуки формули (І) мають малу токсичність; їх токсичність сумісна з їх використанням як медикаменту при лікуванні вищезазначених розладів та захворювань. Сполуки формули (І) можна сформувати у фармацевтичні композиції для вживання ссавцями, зокрема людиною, для лікування вищезазначених захворювань. Фармацевтичні композиції, так отримані, переважно представлені у різних формах, як-то, наприклад, розчини для ін'єкцій або розчини для перорального вживання, драже, таблетки або тверді желатинові капсули. Фармацевтичні композиції, що містять щонайменше одну сполуку формули (І) або одну з її солей як активну складову зокрема використовують при попередженні чи цілющому лікуванні захворювань, споріднених зі стресом, а частіше, при лікуванні усіх патологій із залученням CRF, як-то, наприклад: хвороба Кашинга, нейропсихіатричні розлади, як-то депресія, тривожність, напади паніки, посттравматичний стрес, примусові нав'язливі розлади, розлади настрою, поведінкові розлади, агресивність, анорексія, булімія, гіперглікемія, передчасні пологи, при ризику вагітності, затримка росту, розлади сну, епілепсія та депресії усіх типів; дегенеративні розлади: хвороба Альцгеймера чи Паркінсона; хорея Хантингтона та аміотрофний латеральний склероз; судинні, серцеві та церебральні розлади; розлади сексуальної активності та здатності до репродукції; передчасні пологи, імунодепресія, імуносупресія, запальні процеси, складні інфекції, інтерстиціальний цистит, ревматоїдний артрит, остеоартрит, увеїтид, псоріаз та діабет; рак; функціональні шлунково-кишкові розлади та запалення, як їх результат (подразнений та запальний товстий кишечник, діарея); розлади відчуття болю, фіброміалгії, споріднені або ні з розладами сну, втомою або мігрень; або симптоми, споріднені із залежністю до алкоголю та відвиканням від ліків. Величину доз можна варіювати широко в залежності від віку, маси та стан здоров'я пацієнта, природи та суворості хвороби та шля ху застосування. Це включає вживання одної чи більше доз приблизно 0,5-800мг активної складової, переважно 0,5-200мг кожної доби. У фармацевтичних композиціях зпдно з винаходом для перорального, під'язичного, підшкірного, внутрішньом'язового, внутрішньовенного, трансдермального, трансслизового, локального або ректального застосування, активну складову можна вживати тваринам та людині у разових формах вживання, змішаною зі звичайними фармацевтичними носіями. Прийнятні разові форми застосування включають форми, призначені для перорального уведення, як-то таблетки, тверді желатинові капсули, порошки, гранули та розчини або суспензії для вживання перорально, форми для під'язичного та защічного застосування, форми для підшкірного, внутрішньом'язового, внутрішньовенного, інтраназального або внутрішньоочноого застосування та форми для ректального вживання. Наступні приклади ілюструють винахід без його обмеження. Способи синтезу різних інтермедіатів, які роблять можливим отримання сполуки винаходу, описані у розділі Виготовлення. Усі ці інтермедіати отримані згідно зі способами, що добре відомі фахівцям. Температури плавлення, визначені способом з використанням приладу Micro-Kofler, виражали у градусах Цельсія. Спектри протонного ядерного магнітного резонансу (1Н ЯМР) реєстрували у дейтерованому хлороформі (CDCI3), якщо не визначено інше, при 200МГц або при 300МГц. Хімічні конфігурації виражено у чнм, а константи сполучення у Герцах. Енантіомерний надлишок (ен) оцінювали за хроматограмами, отриманими хірально-фазовою ВЕРХ хроматографією або хіральною надкритичною рідинною хроматографією (НРХ). Оптичну ротацію оптично активних продуктів охарактеризовано їх [a]t°D (проаналізовані концентрації с розчинів виражено у г на 100мл). Нижченаведені скорочення такі: s=синглет; m=мультиплет; d=дублет; t=триплет; q=квартет; с-Рr=радикал циклопропілу; Ph=радикал фенілу. Сполуки винаходу дають результати аналізу на елементи згідно з теорією. Сполуки винаходу, що описано у таблицях 1 та 6, також мають спектри ЯМР та мас-спектри згідно з їх структурами. Виготовлення вихідних синтонів 1) Виготовлення феніл гідразинів формули III Гідрохлорид 2-хлор-4-метокси-5-метилфенілгідразину Сполука lll.1 Розчин 8,6г (50ммоль) 2-хпор-4-метокси-5-метиланіліну у 75мл 5Η гідрохлоридної кислоти перемішують при -5°С та додають 3,52г (51ммоль) нітриту натрію у розчині в 12,5мл води. Суміш перемішують протягом 1 години при 0°С, а далі додають розчин 22,56г (100ммоль) дигідрату хлориду стануму (ІІ) у 20мл 35% гідрохлоридної кислоти. Суміш перемішують протягом 2 годин з поступовим поверненням до зовнішньої температури. Утворений осад відфільтровують та промивають нормальною гідрохлоридною кислотою, етанолом та діетиловим етером. Після сушки в ексикаторі отримують 7,8г сполуки lll.1. Темп.плавл. =140°С. Вихід 70%. 1 Н ЯМР (d6 ДМСО d чнм): 2,09 (s, 3Н, СН3); 3,73 (s, 3Н, ОСН3); 7,0 (s, 1H, Ph);7,05 (s, 1H, Ph); 7,58 (s, 1H, NH);1 0,13 (s, 3Н, NН6+) 2) Виготовлення вторинних амінів формули V [2-циклопропіл-1-(4-флуорфеніл)етил]пропіламін Сполука V.1 Розчин 8,9г (50ммоль) 2-циклопропіл-1-(4-флуор феніл)етанону у 100мл дихлорметану з 16,4мл (200ммоль) пропіламіну перемішують при 0°С та повільно додають 30мл нормального розчину тетрахлориду титану у дихлорметані. Суміш перемішують протягом 15 години при зовнішній температурі, а далі охолоджують до 0°С, та додають 100мл метанолу. Додають порціями 2,1г (55ммоль) борогідриду натрію та суміш перемішують протягом 2 годин при зовнішній температурі. Суміш концентрують під зниженим тиском до приблизно 100мл, а далі додають 100мл води. Суспензію фільтрують та фільтрат переносять у дихлорметан, промивають водою та далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, а далі розчинники випарюють під зниженим тиском. Отримують 9,43г маслянистого продукту. Ви хід 85% 1 Н ЯМР (CDCІ3 δ чнм): -0,08-0,12 (m, 2Н, c-Pr); 0,28-0,50 (m, 2H, с-Ρr); 0,50-0,62 (m, 1H, cPr); 0,81-0,88 (m, 3H, CH3); 1,35-1,70 (m, 5H, СН2, CH2-c-Pr та NH); 2,30-2,45 (m, 2H, N-CH 2); 3,62-3,68 (m, 1H,CH); 6,90-7,05 (m, 2H, Ph); 7,21-7,31 (m, 2H, Ph).3) Виготовлення первинних амінів формули XI Перший спосіб; виготовлення первинних амінів з амінокислоти a) (1R)-2-аміно-2-(4-флуорфеніп)етанол 240мл (240ммоль) 1М розчину алюмогідриду літію у тетрагідрофуран перемішують при кипінні під зворотним холодильником, а далі додають порціями 20г (118ммоль) (R)-(4-флуорфеніл)гліцину. Після перемішування при кипінні під зворотним холодильником протягом шести годин та 30 хвилин реакційну суміш перемішують при 0°С, а далі повільно додають 9,5мл води, 9,5мл 15% розчину гідроксиду натрію, а далі 28,5мл води. Отриману суспензію фільтрують крізь броунмілерит. Фільтрат концентрують та переносять у 1л дихлорметану. Розчин промивають насиченим розчином хлориду натрію та сушать безводним сульфатом натрію, а далі розчинники випарюють під зниженим тиском. Кристалізація з ізопропілового етеру робить можливим отримання 13,22г (85,2ммоль) кристалічного продукту. Вихід 72%. Темп. плавл. =95°С. 1 Н ЯМР(d6ДМСО):1,82 (s, 2Н, NH2); 3,35-3,45 (m, 2Н, СН2О); 3,84 (m, 1H, CH); 4,73 (s, 1Н, ОН); 7,01-7,13 (m, 2Н, Ph); 7,30-7,41 (m, 2Н, Ph). b) (1R)-1-(4-флуорфеніл)-2-метоксіетиламін Сполука XI.1 3,64г (91ммоль) гідриду калію, отриманого промивкою 8,1г суспензії у маслі пентаном, суспендують у 70мл тетрагідрофурану та перемішують при 10°С. Розчин 13,22г (85ммоль) (1R)-2-аміно-2-4-флуорфеніл)етанолу у 175мл тетрагідрофурану додають повільно. Після перемішування протягом 16 годин при зовнішній температур додають протягом 2 годин розчин 5,2мл (83,5ммоль) йодметану у 105мл тетрагідрофурану. Реакційну суміш перемішують протягом 3 годин при зовнішній температурі та виливають у 1л льодяної води з сіллю. Суміш екстрагують 1л трет-бутилметилового етеру. Органічну фазу промивають водою, а далі насиченим розчином хлориду натрію та сушать безводним сульфатом натрію, а далі розчинники випарюють під зниженим тиском. Отримують 11,87г (70ммоль) маслянистого аміну. Вихід 82%. 1 H ЯМР(CDCІ3):1,66 (s, 2Н, ΝΗ2); 3,29 (d, 1Н, СН2); 3,36 (s, 3Н, ОСН3); 3,45 (dd, 1H, СН2); 4,16 (m, 1H, CH); 6,93-7,05 (m, 2H, Ph); 7,24-7,38 (m, 2H, Ph). Другий спосіб: виготовлення первинних амінів з фенілкетонів а) Синтез заміщених фенілкетонів Сполука 1 Спосіб А 2-циклопропіл-1-(3-флуор-4-метилфеніл)етан-1-он Сполука 1.1 Розчин 61г (323ммоль) 4-бром-3-флуортолуолу у 280мл діетилового етеру повільно додають до 7,8г (323ммоль) стружки магнію так, щоб підтримувати помірне кипіння під зворотним холодильником. Суміш далі нагріють при кипінні під зворотним холодильником протягом 2 годин, а далі охолоджують та фільтрують крізь скляну тканину. Фільтрат перемішують при 0°С та додають 25г (308ммоль) циклопропілацетонітрилу, розбавленого 20мл діетилового етеру. Реакційну суміш перемішують протягом 3 годин при зовнішній температурі, а далі охолоджують до 0°С, та повільно додають 1Η розчин гідрохлоридної кислоти до отримання рН1. Суміш тричі екстрагують етилацетатом та поєднані органічні фази промивають водою, а далі водою, насиченою хлоридом натрію, та сушать сульфа том натрію, розчинники випарюють під зниженим тиском. Отримують 53г сирого продукту, який використовують як є у наступному етапі. Вихід: приблизно 85%. 1 Н ЯМР(СОСІ 3, d чнм):0,15-0,21 (m, 2Н,с-Рr); 0,55-0,65 (m, 2Н, с-Pr); 1,07-1,20 (m, 1Н, с-Рr); 2,31 (d, J=1,9Гц, 3Н, CH3); 2,82 (d, J=6,7Гц, 2H, СН2-c-РR); 7,22-7,30 (m, 1Н, Рh); 7,54-7,64 (m, 2Н, Рh). Наступний кетон синтезували таким же способом: 2-циклопропіл-1-(4-метилфеніл)етан-1-он Сполука 1.2 Спосіб В 2-циклопропіл-1-(4-метоксиметилфеніл)етан-1-он Сполука 1.3 Розчин 32,5г (162ммоль) 1-6ром-4-метоксиметилфенілу у 300мл тетрагідрофурану перемішують при -60°С та повільно додають 112мл (179ммоль) 1,6Μ розчину бутиллітію. Реакційну суміш перемішують протягом 30 хвилин при -60°С, а далі повільно додають розчин 27,6г (192ммоль) 2-циклопропіл-N-метокси-Nметилацетаміду. Реакційну суміш перемішують, даючи температурі повільно повернутися до зовнішньої температури. Після перемішування протягом 4 годин, її охолоджують до 0°С та повільно додають 5мл етанолу. Суміш екстрагують етилацетатом та органічну фазу промивають водою, а далі насиченим розчином хлориду натрію та сушать безводним сульфатом натрію, а далі розчинники випарюють під зниженим тиском. Отриманий залишок очищають хроматографією на колонці з силікагелем (розчинник: циклогексан, далі 20/1 (за об'ємом) циклогексан/етилацетат). Отримують 21,8г кетону. Ви хід 66%. 1 Н ЯМР(СОСІ 3, d чнм):0,13-0,21 (m, 2Н,c-Рr); 0,53-0,62 (m, 2Н, с-Рr); 0,84-0,93 (m, 1Н, с-Рr); 2,85 (d, J=6,6Гц, 2Н, CΗ2-cΡr); 3,40 (s, 3Н, ОСН3); 4,68 (s, 2Н,ОСН 2); 7,57 (d, J=7,5Гц, 2Н, Рh); 7,92 (d, J=7,5Гц, 2Н, Ph). Наступний кетон синтезували таким же способом: 2-циклопропіл-1-(3,4-метилендіоксифеніл)етан-1-он Сполука 1.4 b) Синтез заміщених оксимів Сполука 2 Оксим(Е)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етан-1-ону Сполука 2. 1 Розчин 53г (275ммоль) сполуки 1.1 у 200мл піридину перемішують при 0°С та повільно додають 28,5г (410ммоль) гідрохлориду гідроксиламіну. Суміш перемішують протягом 12 годин при зовнішній температурі, а далі концентрують під зниженим тиском. Залишок переносять у етилацетат та органічну фазу промивають тричі водою, а далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, а далі розчинники випарюють під зниженим тиском. Залишок очищають хроматографією на колонці з силікагелем (елюент: 20/1 (за об'ємом) циклогексан/етилацетат). Отримують 30г оксиму. Ви хід 52%. 1 Н ЯМР(d6ДМСО, d чнм): 0,10-0,20 (m,2Н,с-Рr); 0,28-0,40(m, 2Н, с-Рr); 0,78-0,95 (m, 1H, с-Рr); 2,21 (d, J=1,7Гц, 3Н, СН3); 2,63 (d, J=6,8Гц, 2Н, CH2-с-Pr); 7,20-7,56 (m, 3H, Ph); 11,16 (s, 1H, ОН). Наступні оксими синтезували таким же способом: Оксим 2-циклопропіл-1-фенілетан-1-ону Сполука 2.2 Оксим 2-циклопропіл-1-(4-флуор феніл)етан-1-ону Сполука 2.3 Оксим 2-циклопропіл-1-(4-метилфеніл)етан-1-ону Сполука 2.4 Оксим 2-циклопропіл-1-(4-метоксиметилфеніл)етан-1-ону Сполука 2.5 Оксим 2-циклопропіл-1-(3,4-метилендіоксифеніл)етан-1-ону Сполука 2.6 Оксим 1-фенілбутан-1-ону Сполука 2.7 Оксим 1-(4-метилфеніл)бутан-1-ону Сполука 2.8 c) Синтез заміщених О-бензилоксимів Сполука 3 (E)-O-бензилоксим 2-циклопропіл-1-(3-флуор-4-метилфеніл)етан-1-ону Сполука 3. 1 Розчин 30г (144ммоль) сполуки 2.1 у 140мл диметилформаміду перемішують при 0°С та повільно додають порціями 55% гідрид натрію у маслі. Суміш перемішують протягом 30 хвилин при 0°С, а далі повільно додають 20,5мл (172ммоль) бензиброміду. Реакційну суміш перемішують протягом 3 годин при зовнішній температурі, а далі охолоджують до 0°С, та додають 10мл етанолу, а далі 500мл води. Суміш екстрагують етилацетатом та органічну фазу промивають водою, а далі водою, насиченою хлоридом натрію, і сушать сульфатом натрію, а розчинники випарюють під зниженим тиском. Залишок очищають хроматографією на колонці з силікагелем (елюент: 95/5 (за об'ємом) цикпогексан/дихлорметан). Отримують 30,2г Е-бэнзилоксиму. Вихід 70%. 1 Н ЯМР (1Н Я МР(d6ДМСО, d чнм): 0,10-0,17 (m, 2H, с-Ρr); 0,28-0,40 (m, 2H, c-Pr); 0,78-0,90 (m, 1H, cPr); 2,22 (d, J=1,8Гц, 3Н, СН3); 2,67 (d, J=6,8Гц, 2H, CH 2-cPr); 5,16 (s, 2H, OCH 2-Ph); 7,20-7,43 (m, 8H, Ph). Наступні бензилоксими синтезували таким же способом: (Е)-О-бензилоксим 2-циклопропіл-1-фенілетан-1-он Сполука 3.2 (Е)-О-бензилоксим 2-циклопропіл-1-(4-флуорфеніл)етан-1-он Сполука 3.3 (Е)-О-бензилоксим 2-циклопропіл-1-(4-метилфеніл)етан-1-он Сполука 3.4 (Е)-О-бензилоксим 2-циклопропіл-1-(4-метоксиметилфеніл)етан-1-он Сполука 3.5 (Е)-О-бензилоксим 2-циклопропіл-1-(3,4-метилендіоксифеніл)етан-1-он Сполука 3.6 (Е)-О-бензилоксим 1-фенілбутан-1-он Сполука 3.7 (Е)-О-бензилоксим 1-(4-метилфеніл)бутан-1-он Сполука 3.8 d) Синтез рацемічних первинних амінів Формули XI 2-циклопропіл-1-(4-флуорфеніл)етиламін Сполука XI.2 Суспензію 10,6г (280ммоль) алюмогдриду літію у 500мл тетрагідрофурану перемішують при зовнішній температурі та повільно додають 40г (140ммоль) О-бензилоксиму 2-циклопропіл-1-(4-флуорфеніл}етан-1-ону. Суміш перемішують при кипінні під зворотним холодильником протягом 4 годин, а далі охолоджують до 0°С, та додають краплями 1 0,6мл води, 10,6мл 15% розчину гідроксиду натрію, а далі 32мл води. Отриману суспензію фільтрують крізь броунмілерит та промивають етилацетатом. Поєднані органічні фільтрати промивають водою, а далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, а розчинники випарюють під зниженим тиском. Сирий екстракт очищають хроматографією на колонці з силікагелем (елюент: 95/5 (за об'ємом) дихлорметан/метанол). Отримують 14,2г аміну у формі масла. Вихід 57%. 1 Н ЯМР(СОСІ3, d чнм): -0,05-0,18 (m, 2H, с-Рr); 0,32-0,50 (m, 2H, с-Рr); 0,50-0,70 (m, 1Н, с-Рr); 1,40-1,70 (m, 2Н, CH2-cΡr); 1,76 (s, 2Н, NH2); 3,97-4,05 (m, 1Н, СН); 6,92-7,04 (m, 2H, Ph); 7,24-7,34 (m, 2H, Ph). Наступні рацемічні аміни синтезували таким же способом: 2-циклопропіл-1-фенілетиламін Сполука XI.3 2-циклопропіл-1-(3-флуор-4-метилфеніл)етиламін Сполука XI.4 e) Синтез хіральних первинних амінів формули XI (1S)-2-циклопропіл-1-(3-флуор-4-метилфеніл)етиламін Сполука XI.5 Розчин 37,17г (145ммоль) (S)-2-аміно-3-метил-1,1-дифенілбутан-1-олу у 180мл тетрагідрофурану перемішують при -40°С та повільно додають 285мл 1М розчину боран-тетрагідрофуранового комплексу (285ммоль). Суміш перемішують протягом 3 годин від -40°С до зовнішньої температури, а далі охолоджують до -10°С, та додають розчин 17г (57ммоль) сполуки 3.1. Реакційну суміш перемішують протягом 20 годин при зовнішній температурі, а далі охолоджують до -10°С, та додають 285мл 2Η гідрохлоридної кислоти. Суміш перемішують протягом ще 20 годин, а далі тетрагідрофуран випарюють під зниженим тиском. Утворений осад гідро хлориду(S)-2-аміно-3-метил-1,1-дифенілбутан-1-олу відфільтровують та промивають 1Η гідрохлоридною кислотою. Поєднані кислотні фільтрати промивають трет-бутил-метиловим етером, далі охолоджують до 0°С та повільно підлужують 35% водним розчином гідроксиду натрію. Після екстрагування тричі дихлорметаном, поєднані органічні фази промивають водою, а далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, та розчинники випарюють під зниженим тиском. Залишок очищають хроматографією на колонці з силікагелем (елюент 95/5 (за об'ємом) дихлорметан/метанол). Отримують 7,2г аміну у формі масла. Вихід 47%. tн більше 98%. [a]D22=+5,4 (с=1,16, ди хлорметан) 1 Н ЯМР(СОСІ 3, d чнм):-0,05-0,15 (m, 2Н, cРr); 0,35-0,50 (m, 2Н, с-Рr); 0,55-0,70 (m, 1Н, с-Рr); 1,43-1,70 (m, 2Н, CH2-c-Pr); 2,0 (s, 2Н, NH2); 2,25 (d, J=1,7Гц, 3Н, СН3); 3,99-4,04 (m, 1Н, СН); 6,99-7,17 (m, 3Н, Рh). Наступні хіральні аміни синтезувалитаким же способом: (1S)-2-циклопропіл-1-фенілетиламін eн =96% Сполука XI.6 (1S)-2-циклопропіл-1-(4-флуорфеніл)етиламін eн =98% Сполука XI. 7 (1S)-2-циклопропіл-1-(4-метилфеніл)етиламін eн =97,2% СполукаХІ.8 (1S)-2-циклопропіл-1-(4-метоксиметилфеніл)-етиламін eн =97,8% Сполука XI. 9 (1S)-2-циклопропіл- -(3,4-метилендіоксифеніл)-етиламін eн =96,6% Сполука XI. 10 (1S)-1-фенілбутиламін eн більше 99% Сполука XI. 11 -1-(4-метилфеніл)бутиламін єн = 97,9% Сполука XI. 12 Енантіомерний надлишок (eн) цих сполук оцінювали хіральною надкритичною рідинною хроматографією їх ацетамідних або тіосечовинних похідних. Тільки енантіомерний надлишок сполуки XI.11 оцінювали безпосередньо хірально-фазовою ВЕРХ. Для цих сполук утворення солі, а далі перекристалізація з N-ацетил1-лейцином [Yamamoto Y. et al., Bull. Chem. Sec Jpn., 1976, 49(11), 3247-3249] зробило можливим збільшення енантіомерного надлишку. Виготовлення шляхом А 1) Виготовлення ціанамідів формули IV (1-фенілбутил)пропілціанамід Сполука IV.1 Суспензію 1,4г (16,4ммоль)карбонату магнію у 20мл 9/1 (за об'ємом) суміші діетиловий етер/вода перемішують при 0°С та додають 5г (47ммоль) ціаногенброміду. До цієї суміші повільно додають 9г (47ммоль) (1-фенілбутил)пропіламіну і перемішують при 0°С. Після перемішування протягом 1 години при зовнішній температурі, до реакційної суміші додають 50мл води, а далі 100мл діетилового етеру. Етерну фазу промивають водою, а далі насиченим розчином хлориду натрію. її сушать сульфа том натрію, а далі розчинники випарюють під зниженим тиском. Отриманий маслянистий залишок дистилюють у ламповій термошафі при 150°С при =0,3мм Hg. Отримують 7,6г безбарвного масла. Вихід 74%. 1 Н ЯМР(СОСІ3, d чнм): 0,84-0,95 (m, 6H, 2CH3); 1,28-2,10 (m, 6Н, 3СН2); 2,65-2,90 (m, 2Η, ΝСН2); 3,77 (t, J=7,5Гц, 1H, CH); 7,25-7,39 (m, 5H, Ph). Наступні сполуки синтезували таким же способом: [2-циклопропіл-1-(4-флуорфеніл)етил]пропіл-ціанамід Сполука IV.2 1 Н ЯМР(СОСІ3 , d чнм): 0-0,2 (m, 2Н, с-Рr); 0,37-0,55 (m, 2Н, с-Pr); 0,60-0,75 (m, 1Н, с-Рr); 0,85-0,93 (m, 3Н, СН3); 1,55-1,75 (m, 3Н, СН2 та НСН-c-Рr); 1,95-2,10 (m, 1Н, НСН-c-Рr); 2,72-2,90 (m, 2H, NCH2); 3,87(t, J=7,5Гц, 1Н, СН); 6,98-7,09 (m, 2Н, Рh); 7,25-7,35 (m, 2Н, Ph). 2) Виготовлення аніліногуанідинів формули II Гідрохлорид N-(2,4-дихлорфеніламіно)-N-(1-фенілбутил)-N-пропілгуанідину Сполука ІІ.1 Суміш, що складається з 5,13г (24ммоль) гідрохлориду 2,4-дихлорфенілгідразину, 6,5г (30ммоль) сполуки IV.1 та 10мл безводного н-пропанолу перемішують при 130°С протягом 24 годин. Після охолодження реакційну суміш суспендують у 50мл діетилового етеру. Осад відфільтровують, а далі переносять у 50мл ацетону. Отриману суспензію перемішують протягом 30 хвилин при зовнішній температурі, а далі осад відфільтровують та промивають ацетоном. її далі розчиняють при нагріванні у 10мл метанолу, а далі додають 50мл діетилового етеру. Білий утворений осад відфільтровують, промивають етером та сушать. Отримують 6г (14ммоль) білого порошку. Ви хід 58%. Темп. плавл. =225°С. Наступну сполуку синтезували таким же способом: Гідрохлорид N-[2-циклопропіл-1-(4-флуорфеніл)етил]-N'-(2,4-дихлорфеніламіно)-N-пропілгуанідину Сполука ІІ.2 1 Н ЯМР (d6-ДМСО, δ чнм): 0,1-0,7 (m, 5Н, с-Рr); 0,78 (m, 3Н, СН3); 1,4-1,75 (m, 2Н, СН2); 1,85-2,15 (m, 2Н, СН2); 3,0-3,4 (m, 2H, NCH 2); 5,41 (t, 7,3Гц 1Н, СН); 7,73 (d, 1H, Ph); 7,1-7,6 (m, 6H, Ph); 8,1 (s, 2H, NH 2); 8,23 (s, 1H, NH); 9,98 (s, 1H, NH). 3) Виготовлення амінотриазолів формули І шляхом А ПРИКЛАД 1 [1-(2,4-дихлорфеніл)-5-метил-N-(1-фенілбутил)-N-пропіл-1Н-1,2,4-триазол-3-амін Суспензію 1,29г (3ммоль) сполуки ll.1 у 12мл піридину перемішують при 0°С та повільно додають 1,07мл (15ммоль) ацетилхлориду. Реакційну суміш перемішують протягом 20 годин при зовнішній температурі та виливають у 100мл льодяної води. Після підкислення до рН 11 Η гідрохлоридною кислотою, суміш екстрагують етилацетатом. Органічну фазу далі промивають насиченим розчином гідрокарбонату натрію, водою, а далі водою, насиченою хлоридом натрію. її сушать безводним сульфатом натрію, а далі випарюють. Сирий залишок очищають хроматографією на колонці з силікагелем (елюент: 9/1 (за об'ємом) циклогексан/етилацетат). Отримують 645мг (1,54ммоль) безбарвного каучукоподібного продукту. Ви хід 52%. 1 Н ЯМР(СОСІ3, d чнм): 0,71 (m, 3Н, СН3); 0,94 (m, 3Н, СН3); 1,35-1,55 (m, 4Н, 2СH2); 1,96-2,02 (m, 2Н, СH2); 2,23 (s, 3Н, СН3); 2,97-3,07 (m, 2Н, NCH2); 5,41 (t, J=7,6Гц, 1Н, СН); 7,18-7,40 (m, 7Н, Рh); 7,53 (d, J=1, 9Гц, 1Н, Ph). Цей продукт перетворюють у сіль у формі гідрохлориду; Темп. плавл. =142°C(НCl). ПРИКЛАДИ 2 до 9 у наступній таблиці 1 синтезовано тим же способом: Таблиця 1 Сполуки формули (І), синтезов ані шляхом А Виготовлення шляхом В1 1) Виготовлення N-ацилтіосечовин Формули VII N-ацетил-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-N-пропілтіосечовина Сполука VII.1 Розчин 2г (26,4ммоль) тіоціанату амонію у 27мл ацетону перемішують при зовнішній температурі та повільно додають 1,82мл (24,2ммоль) ацетилхлориду. Після перемішування протягом 10 хвилин повільно додають розчин 4,87г(22ммоль) сполуки V.1 у 44мл дихлорметану. Після перемішування протягом 30 хвилин при зовнішній температурі у реакційну суміш додають 100мл дихлорметану та 100мл води. Органічну фазу промивають водою, а далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, і розчинники випарюють під зниженим тиском. Сирий залишок очищають хроматографією на колонці з силікагелем (елюент: 4/1 (за об'ємом) циклогексан/етилацетат). Отримують 5,5г (17ммоль) сполуки Vll.1. Вихід 77%. 1 Н ЯМР(d6 ДМСО, d чнм): 0,1-0,2 (m, 2Н, с-Рr); 0,35-50,50 (m, 2Н, с-Рr); 0,50-0,70 (m, 3Н, СH3); 0,75-0,95 (m, 1Н, с-Рr); 1,25-1,75 (m, 2Н, СH2); 1,80-2,10 (m, 5Н, СН2-c-Рr та СОСН3); 3,10-3,60 (m, 2H, NCH2); 5,32(m, 1H, CH); 7,15-7,24 (m, 2Н, Ph); 7,55-7,62 (m, 2Н, Рh); 10,33 (s, 1H, NH). 2) Виготовлення N-ацил-S-метилізотіосечовин формули VI N-ацeтил-N'-[2-циклопропіл-1-(4-флуорфеніл)етил]-S-метил-N'-пропілізотіосечовина Сполука VI.1 Розчин 5,5г (17ммоль) сполуки VII.1 у 170мл дихлорметану перемішують при 0°С та додають 740мг (18,5ммоль) 60% гідрид натрію у маслі. Після перемішування протягом 10 хвилин при 0°С до реакційної суміші додають 2,1мл (34ммоль) метилйодіду. Реакційну суміш перемішують протягом 3 годин при зовнішній температурі, а далі охолоджують до 0°С та додають 10мл етанолу, а далі 10мл води. Органічну фазу промивають водою, а далі водою, насиченою хлоридом натрію, сушать сульфатом натрію далі та розчинники випарюють під зниженим тиском. Безбарвний та маслянистий сирий залишок використовують як є у наступному етапі (кількісний вихід). 1 Н ЯМР(СОСІ 3, d чнм): 0,1-0,16 (m, 2Н, c-Рr); 0,45-0,52 (m, 2Н, c-Рr); 0,62-0,70 (m, 3Н, СН3); 0,80-0,95 (m, 1Н, СН, с-Рr); 1,0-1,2 та 1,45-1,65 (2m, 2Н, СH2); 1,8-2,05 (m, 2Н, СН2-c-Рr); 2,18,(s, 3Н, CH2CO); 2,41 (s, 3Н, 5SCH3); 3,04-3,20 (m, 2H, NCH 2); 5,80 (t, 7,6Гц, 1H,CH); 6,96-7,08 (m, 2H, Ph); 7,30-7,38 (m, 2H, Ph). 3) Виготовлення амінотриазолів формули (І) шляхом В1 ПРИКЛАД 10 N-[2-циклопропіл-1-(4-флуорфеніп)етил]-1-[2,6-дихлор-4-(трифлуорметил)феніл]-5-метил-N-пропіл-1Н1,2,4-триазол-3-амін Суміш, що складається з 1г (3ммоль) сполуки VI.1, 1г (4ммоль) 2,6-дихлор-4 трифлуорметилфенілгідразину та 8мл безводного д и метил сульфоксиду, перемішують та повільно нагрівають від 100 до 200°С протягом 30 годин поки не виявляють більше вихідної ізотіосечовини. Реакційну суміш, завчасно охолоджену, виливають у льодяну воду та підкислюють нормальною гідрохлоридною кислотою. Суміш екстрагують етилацетатом та органічний екстракт промивають насиченим водним розчином гідрокарбонату натрію, далі водою та водою, насиченою хлоридом натрію. її далі сушать безводним сульфатом натрію та розчинники випарюють під зниженим тиском. Сирий залишок очищають на колонці з силікагелем (елюент: 9/1 (за об'ємом) циклогексан/метилацетат). Отримують 690мг каучукоподібного продукту. Вихід 44%. 1 Н ЯМР(СОСІ3, d чнм): 0,08-0,18 (m, 2Н, с-Рr); 0,37-0,41 (m, 2Н, с-Рr); 0,67-0,75 (m, 3Н, СН3 та 1Н, с-Рr); 51,30-1,45 та 1,50-1,65 (2m, 2Н, СH2); 1,84-2,03 (m, 2H,CH2-c-Pr); 2,21 (s, 3Н, СН3); 2,94-3,02 та 3,10-3,18 (2m, 2Н, NCH2); 5,43 (t, 7,5Гц, 1Н,СН); 6,93-7,0 (m, 2Н, Рh); 7,36-7,41 (m, 2Н, Ph); 7,71 (s, 2Н, Ph). Сполук перетворюють у сіль у формі гідрохлориду; Темп. плавл. =135°С(НСІ). Виготовлення шляхом В2 1) Виготовлення N-ацилтіосечовин Формули X N-ацетил-N'-[2-циклопропіл-1-(4-флуорфеніл)-етил]тіосечовина Сполука X.1 Розчин 3,38г (44,4ммоль) тіоціанату амонію у 44мл ацетону перемішують при зовнішній температурі та додають 3,07мл (40,7ммоль) ацетилхлориду. Після перемішування протягом 5 хвилин додають 88мл бензолу та реакційну суміш нагрівають до 60°С. Розчин 6,62г (37ммоль) сполуки ХІ.2 у 27мл бензолу додають далі. Температуру тримають при 60°С протягом 5 хвилин, а далі суміш охолоджують до зовнішньої температури та розбавляють 100мл етилацетату. С уміш промивають водою, а далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, а розчинники випарюють під зниженим тиском. Сирий залишок (11г) очищають хроматографією на колонці з силікагелем (елюент: 4/1 (за об'ємом) цикпогекган/етилацетат). Отримують 5,6г Сполуки Х.1. Ви хід 54%. 1 Н ЯМР(СОСІ 3, d чнм): 0,10-0,25 (m, 2Н, c-Рr); 0,45-50,60 (m, 2Н, c-Pr); 0,60-0,75 (m, 1H, с-ΡR), 1,75-1,85 (m, 2Н, СН2-c-Pr); 2,11 (s, 3Н,СН3CO); 5,38-5,49 (m, 1Н, СН); 6,95-7,06 (m, 2Н, Ph); 7,22-7,32 (m, 2H, Ph); 8,73(s, 1H, NH); 11,0 (d, 1H, NH). Наступне синтезують таким же способом: N-циклопропілкарбоніл-N'-[2-циклопропіл-1-(4-флуорфеніл)етил]тіосечовина Сполука X.2 1 Н ЯМР(СОСІ3, d чнм): 0,05-0,15(m, 2Н, с-Рr); 0,41-0,50 (m, 2Н, с-Рr); 0,50-0,70 (m, 1Η, с-Рr); 1,0-1,1 (m, 2H, с-Рr); 1,1-1,2 (m, 2Н, с-Рr); 1,4-1,65 (m, 1Н, 15с-Рr); 1,75-1,85 (m, 2H, CH2-c-Pr); 5,40-5,50 (m, 1Н, СН); 6,95-7,07 (m, 2Н, Рh); 7,23-7,31 (m, 2Н, Ph); 8,89 (s, 1H, NH); 11,05(d, 1H, NH) N-ацетил-N'-(2-метокси-5-метилфеніл)тіосечовина Сполука Х.3 Темп.плавл. =152°С. Сполуки у наступній таблиці 2 також синтезують таким же способом або із заміною бензолу хлороформом: Таблиця 2 N-ацилтіосечов ини формули X 2) Виготовлення N-ацил-S-метилізотіосечовин формули IX Перший спосіб N-ацетил-N'-[2-циклопропіл-1-(4-флуорфеніл)етил]-S-метилізотіосечовина Сполука IX.1 Розчин 2,8г (10ммоль) сполуки Х.1 у 50мл тетрагідрофурану перемішують при 0°С та додають порціями 440мг (11ммоль) 60% гідриду натрію у маслі. Після перемішування протягом 20 хвилин при 0°С додають 0,75мл (12ммоль) метилйодіду. Реакційну суміш перемішують протягом 4 годин при зовнішній температурі, а далі охолоджують до 0°С та повільно додають 5мл етанолу, а далі 5мл води. Це екстрагують 150мл етилацетату та органічну фазу промивають водою, а далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, а розчинники випарюють під зниженим тиском. Сирий залишок (3,5г) використовують як є у наступному етапі (кількісний вихід). 1 Н ЯМР(СОСІ3 , d чнм): 0,05-0,15 (m, 2Н, с-Рr); 0,43-0,55 (m, 2Н, с-Рr); 0,55-0,75 (m, 1Н, с-Рr); 1,70-1,85 (m, 2H, CH2-c-Pr); 2,15 (s, 3Н, CH3CO); 2,42 (s, 3Н, SCH3); 4,62-4,71 (m, 1Н, СН); 6,92-7,06 (m, 2Н, Рh); 7,19-7,33 (m, 2Н, Ph); 11,57(s, 1H, NH). Продукти з таблиці 3 отримують таким же способом. Таблиця 3 N-ацил-S-метилізотіосечов ини формули IX Другий спосіб S-метил-N-[(1S)-1-фенілбутил]-N'-пропіонілізотіосечовина Сполука IX.8 Розчин 6,4г (24,2ммоль) сполуки X.8 у 120мл диметилформаміду перемішують при зовнішній температурі та додають 7,9г (24,2ммоль) карбонату цезію. Далі повільно додають 3мл (24ммоль) йодметану. Суміш перемішують при зовнішній температурі протягом 2 годин, далі додають лід та проводять екстракцію етилацетатом. Органічну фаз у промивають водою, а далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, а розчинники випарюють під зниженим тиском. Сирий залишок очищають хроматографією на колонці з силікагелем (елюент: 9/1 (за об'ємом) циклогексан/етилацетат). Отримують 5,15г сполуки ІХ.8. Вихід 72%. 1 Н ЯМР(СОСІ3 , d чнм): 0,86-0,94 (m, 3Н, СH3); 1,09-1,17 (m, 3Н, СH3); 1,22-1,45 (m, 2Н, СН2); 1,72-1,86 (m, 2Н, 20СН2); 2,38 (s, 3Н, SCH3); 2,35-2,50 (m, 2Н, CH2); 4,57-4,63 (m, 1Н, СН); 7,19-7,37 (m, 5Н, Ph); 11,52 (s, 1H, NH). Продукти з таблиці 4 отримують таким же способом. Таблиця 4 N-ацил-S-метилізотіосечов ини формули IX 3) Виготовлення NH амінотриазолів Формули VIII 1-(2-хлор-4-метокси-5-метилфеніл)-N-[2-циклопропіл-1-(4-флуорфеніл)етил]-5-метил-1Н-1,2,4-триазол-3амін Сполука VIII.1 3г (11,5ммоль) гідрохлориду 2-хлор-4-метокси-5-метилфенілгідразину (сполук III.1) додають до розчину 3,2г (10ммоль) сполуки ІХ.1 у 25мл толуолу, а потім 3,5мл (25ммоль) триетиламіну та молекулярні сита на 4Å. Реакційну суміш перемішують протягом ночі при помірному кипінні під зворотним холодильником, а далі охолоджують. Молекулярні сита видаляють фільтруванням та фільтрат розбавляють 100мл етилацетату. Органічну фазу промивають 1Η гідрохлоридною кислотою, водою, насиченим водним розчином гідрокарбонату натрію, водою, а далі водою, насиченою хлоридом натрію. Це суша ть сульфатом натрію, а далі розчинники випарюють під зниженим тиском. Сирий залишок очищають хроматографією на колонці з силікагелем (елюент: 3/1 далі 2/1 далі 1/1 (за об'ємом) циклогексан/етилацетат). Отримують 1,35г сполуки VIII.1. Вихід 32%. 1 Н ЯМР(СОСІ3 , d чнм): 0,02-0,12 (m, 2Н, с-Рr); 0,35-0,45 (m, 2Н, c-Рr); 0,55-0,70 (m, 1Н, c-Рr); 1,60-1,82 (m, 2H, CH2-c-Pr); 2,17 (s, 6H, 2CH 3); 3,83 (s, 3Н, ОСН3); 4,60 (d, J=8,2Гц, 1Н, NH); 4,73-4,84 (m, 1Н, СН); 6,85 (s, 1Н, Ph); 6,90-7,00 (m, 2Н, Ph); 7,05 (s, 1H, Ph); 7,25-7,37 (m, 2H, Ph). Сполуки VIII у таблиці 5 виготовляли таким же способом. Толуол можна замінювати ксилолом, диметилформамідом або диметилсульфоксидом. Коли необхідна основа, можна замінювати N,Νдіетиланіліном або карбонатом цезію. Таблиця 5 NH-амінотриазоли формули VIII 1-[2-хлор-4-(метилсульфаніл)феніл]-N-[2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-5-метил-1Н-1,2,4триазол-3-амін Сполука VIII.36 470мг (2,2ммапь) гідрохлориду 2,4-дихпорфенілпдразину додають до розчину 600мг (1,9ммоль) N-ацетилN'-[2-циклопропіл-1-(3-флуор-4-метилфеніл)етил]-S-метилізотіосечовини у 10мл диметилформаміду, а потім 800мг (2,5ммоль) карбонату цезію та молекулярні сита 4Å. Реакційну суміш перемішують протягом 4 годин при 140°С, а далі охолоджують. Молекулярні сита видаляють фільтруванням та фільтрат розбавляють 100мл етилацетату. Органічну фазу промивають 1Η гідрохлоридною кислотою, водою, насиченим водним розчином гідрокарбонату натрію, водою, а далі водою, насиченою хлоридом натрію. Це суша ть сульфатом натрію, а далі розчинники випарюють під зниженим тиском. Сирий залишок очищають хроматографією на колонці з силікагелем (елюент 3/1 (за об'ємом) циклогексан/етилацетат). Отримують 385мг N-[2-циклопропіл-1-(3флуор-4-метилфеніл)етил-1-(2,4-дихлорфеніл)-5-метил-1Н-1,2,4-триазол-3-аміну та 115мг сполуки VIІІ.36. Вихід 13%. 1 Н ЯМР(СОСІ3, d чнм): 0,02-0,13 (m, 2Н, с-Рr); 0,40-0,48 (m, 2Н, с-Рr); 0,60-0,72 (m, 1Н, с-Рr); 1,60-1,88 5(m, 2Н, СН2-с-Рr); 2,20 (s, 3Н, СН3); 2,24 (d, J=1,8Гц, 3Н, СН3); 2,52 (s, 3Н, SCH3); 4,75-4,88 (m, 2Н, СН та NH); 7,047,14 (m, 3Н, Ph); 7,18 (dd, J=2Гц, J2=8,3Гц, 1Н, Ph); 7,25 (d, J=8,3Γц, 1H,Ph); 7,33 (d, J=2Гц, 1H, Ph). 4) Виготовлення амінотриазолів формули (І) шляхом В2 ПРИКЛАД 11 [1-(2-хлор-4-метокси-5-метилфеніл)-N-[2-циклопропіл-1(4-флуорфеніл)етил]-5-метил-N-пропіл-1Н-1,2,4триазол-3-амін 240мг (6ммоль) гідриду калію (отримано з масляної суспензії промивкою пентаном, а далі сушкою аргоном) суспендують у 2мл безводного бензолу. Суміш перемішують при 5-10°С та послідовно додають 780мг (1,85ммоль) сполуки VIII.1 у 6мл бензолу і 750мг (2ммоль) 2,3,11,12-цикпогексано-1,4,7,10,13,16гексаоксациклооктадекану. Після перемішування протягом 1 години та 30 хвилин при зовнішній температурі додають 0,6мл (6ммоль) йодпропану та суміш перемішують протягом 3 годин при зовнішній температурі. Реакційну суміш охолоджують на льодяній бані та додають 1мл етанолу, а далі 1мл води, а далі це розбавляють 100мл етилацетату. Органічну фазу промивають водою, а далі водою, насиченою хлоридом натрію, та сушать суль фатом натрію, а далі розчинники випарюють під зниженим тиском. Залишок очищають хроматографією на колонці з силікагелем (елюент: 4/1 (за об'ємом) циклогексан/етилацетат). Отримують 590мг каучукоподібного продукту. Вихід 75%. 1 Н ЯМР(СОСІ3 , d чнм): 0,1-0,17 (m, 2H, с-Рr); 0,39-0,45 (m, 2Н, с-Рr); 0,69-0,76 (m, 4Н, СН3 та СН, с-Рr); 1,30-1,45 та 1,50-1,65 (2m, 2Н, СН3); 1,88-1,98 (m, 2Н, CH2); 2,21 (s, 3Н, СН3); 2,22 (s, 3Н, СН3); 2,94-3,02 та 3,10-3,20 (2m, 2H, NCH2); 3,87 (s, 3Н, СН3); 5,47 (t, 1Н, СН); 6,92 (s, 1Н, Рh); 6,94-7,02 (m, 2Н, Ph); 7,19 (s, 1Н, Ph); 7,38-7,44 (m, 2Н, Ph). Цей продукт перетворюють у гідрохлорид; Темп.плавл. =38°С(НСІ). ПРИКЛАД 12 [1-(2,4-дихлорфеніл)-N-(2-метокси-5-метилфеніл)-5-метил-N-(2-пропініл)-1Н-1,2,4-триазол-3-амін 240мг (6ммоль) гідриду калію (отримано з масляної суспензії промивкою пентаном, а далі сушкою аргоном) суспендують у 2мл безводного бензолу. Суміш перемішують при 10°С та додають 730мг (2ммоль) сполуки VIII.3 у 8мл бензолу. Додають 75мг (0,2ммоль) 2,3,11,12-циклогексано-1,4,7,10,13, 16гексаоксациклооктадекану та суміш перемішують протягом 2 годин при зовнішній температурі. Додають далі 0,66мл (6ммоль) 80% розчину пропаргілброміду у толуолі та суміш перемішують протягом 1 години при зовнішній температурі. Реакційну суміш охолоджують на льодяній бані, далі послідовно додають 1мл етанолу та 1мл води, а далі реакційну суміш розбавляють 100мл етилацетату. Органічну фазу промивають водою, а далі водою, насиченою хлоридом натрію, та сушать сульфатом натрію, а далі розчинники випарюють під зниженим тиском. Сирий екстракт очищають хроматографією на колонці з силікагелем (елюент: 3/1 (за об'ємом) циклогексан/етилацетат). Отримують 600мг продукту. Ви хід 75%. 1 Н ЯМР(СОСІ3 , d чнм): 2,15 (t, J=2,2Гц, 1Н, СН); 2,21 (s, 3Н, CH3); 2,28 (s, 3H,CH 3); 3,78 (s, 3H, OCH 3); 4,52(d, J=2,2Гц, 2Н, СН2); 6,84 (d, J=8,3Гц, 1H, Ph); 7,01 (dd, J=2Гц, J2=8,3Гц, 1H, Ph); 7,23 (d, J=2Гц, 1H, Ph); 7,29-7,39 (m, 2H, Ph); 7,52 (d, J=2Гц, 1H, Ph). Темп.плавл. =116°С. ПРИКЛАДИ 13-53 у наступній таблиці 6 синтезують таким же способом (можливо замінити бензол тетрагідрофураном): Таблиця 6 Сполуки формули І, синтезовані шляхом В2
ДивитисяДодаткова інформація
Назва патенту англійськоюBranched substituted aminoderivatives of 3-amino-1-phenyl-1n-[1,2,4]triazole, a method for the preparation thereof (variants), pharmaceutical composition and medicament based thereon
Автори англійськоюGulli Daniel, Maffrand Jean-Pierre
Назва патенту російськоюРазветвленные замещенные аминопроизводные 3-амино-1-фенил-1н-[1,2,4]триазола, способ их получения (варианты), фармацевтическая композиция и медикамент на их основе
Автори російськоюГюлли Даниэль, Маффран Жан-Пьер
МПК / Мітки
МПК: A61P 29/00, A61P 43/00, A61P 25/08, A61P 25/28, A61P 25/00, C07D 405/12, C07D 249/14, A61P 15/10, A61P 25/24, A61P 25/22, A61P 35/00, A61P 1/14, A61K 31/4196
Мітки: одержання, 3-аміно-1-феніл-1н-[1,2,4]триазолу, розгалужені, амінопохідні, композиція, основі, спосіб, медикамент, варіанти, заміщені, фармацевтична
Код посилання
<a href="https://ua.patents.su/20-73333-rozgaluzheni-zamishheni-aminopokhidni-3-amino-1-fenil-1n-124triazolu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-ta-medikament-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Розгалужені заміщені амінопохідні 3-аміно-1-феніл-1н-[1,2,4]триазолу, спосіб їх одержання (варіанти), фармацевтична композиція та медикамент на їх основі</a>
Попередній патент: Сполука, спосіб лікування від болю (варіанти) та фармацевтична композиція (варіанти)
Наступний патент: Високовольтний трансформатор струму з газовою ізоляцією
Випадковий патент: Спосіб очистки випускних газів від важких металів