Бензоїлсульфонаміди та сульфонілбензамідини для застосування як протипухлинних засобів
Номер патенту: 74889
Опубліковано: 15.02.2006
Автори: Лобб Карен Лінн, Гроссман Кора Сью, Корбетт Томас Х'юз, Ші Чан, Хіпскінд Філіп Артур, Лін Хо-Шен
Формула / Реферат
1. Сполука Формули І:
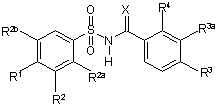 I,
I,
де:
X - О або NH;
R1 - водень, галоген, C1-C6 алкіл, С1-С4 алкокси-, С1-С4 алкілтіогрупа, СF3, ОСF3, SCF3, (С1-С4 алкокси)карбоніл, нітро-, азидогрупа, O(SO2)СН3, N(СН3)2, гідроксил, феніл, заміщений феніл, піридиніл, тієніл, фурил, хінолініл або тіазоліл;
R2 - водень, галоген, ціан, СF3, C1-C6 алкіл, (С1-С4 алкокси)карбоніл, С1-С4 алкоксигрупа, феніл або хінолініл;
R2a - водень або С1-С4 алкоксигрупа;
R2b - водень або C1-C6 алкіл, за умови, що щонайменше один із R2a та R2b є воднем;
R3 - водень, галоген, C1-C6 алкіл, СF3 або нітрогрупа;
R3a - водень, галоген або C1-C6 алкіл, за умови, що у разі, коли R3a - C1-C6 алкіл, R3 - водень та R4 - галоген; та
R4 - галоген, C1-C6 алкіл або СF3, за умови, що лише один із R3 та R4 може бути C1-C6 алкілом та за умови, що у разі, коли R4 - галоген або C1-C6 алкіл, лише один із R3 та R3a є воднем;
або її фармацевтично прийнятна сіль, одержана доданням основи, за умови, що:
a) у разі, коли обидва R3 та R4 - хлор та R2 - водень, R1 - бром, йод, С1-С4 алкокси-, С1-С4 алкілтіогрупа, СF3, ОСF3, нітро-, азидогрупа, O(SO2)СН3, N(СН3)2, гідроксил, феніл, заміщений феніл, піридиніл, тієніл, фурил або триазоліл;
b) у разі, коли обидва R3 та R4 - хлор та R1 - водень, R2 - бром, фтор, СF3, C1-C6 алкіл, С1-С4 алкоксигрупа, феніл або хінолініл.
2. Сполука за п. 1, де R2, R2a та R2b - водень, a R1 вибрані з групи, що включає водень, галоген, C1-C6 алкіл, С1-С4 алкокси-, С1-С4 алкілтіогрупу, СF3, ОСF3, SCF3, (С1-С4 алкокси)карбоніл, нітро-, азидогрупу, O(SO2)СН3, N(CH3)2, гідроксил, феніл, заміщений феніл, піридиніл, тієніл, фурил, хінолініл та тіазоліл.
3. Сполука за п. 1 або п. 2, де згадана сполука є фармацевтично прийнятною сіллю, одержаною доданням основи.
4. Сполука за п. 3, де згаданою фармацевтично прийнятною сіллю, одержаною доданням основи, є сіль натрію.
5. Сполука за п. 1, яка є N-[2-хлор-4-бромбензоїл]-4-хлорфенілсульфонамідом або його сіллю, одержаною доданням основи.
6. Сполука за п. 1, яка є N-[2-метил-4-хлорбензоїл]-4-хлорфенілсульфонамідом або його сіллю, одержаною доданням основи.
7. Сполука за п. 5 або п. 6, де згаданою сіллю, одержаною доданням основи, є сіль натрію.
8. Спосіб лікування сприйнятливих пухлин у ссавця, що включає введення ссавцю, що потребує такого лікування, онколітично ефективної кількості сполуки Формули II:
 II,
II,
де:
Х - О або NH;
R1 - водень, галоген, C1-C6 алкіл, С1-С4 алкокси-, С1-С4 алкілтіогрупа, СF3, ОСF3, SCF3, (С1-С4 алкокси)карбоніл, нітро-, азидогрупа, O(SO2)СН3, N(СН3)2, гідроксил, феніл, заміщений феніл, піридиніл, тієніл, фурил, хінолініл або тіазоліл;
R2 - водень, галоген, ціан, СF3, C1-C6 алкіл, (С1-С4 алкокси)карбоніл, С1-С4 алкоксигрупа, феніл або хінолініл;
R2a - водень або С1-С4 алкоксигрупа;
R2b - водень або C1-C6 алкіл, за умови, що щонайменше один із R2a та R2b є воднем;
R3 - водень, галоген, C1-C6 алкіл, СF3 або нітрогрупа;
R3а - водень, галоген або C1-C6 алкіл, за умови, що у разі, коли R3a - C1-C6 алкіл, R3 - водень та R4 - галоген; та
R4 - галоген, C1-C6 алкіл або СF3, за умови, що лише один із R3 та R4 може бути C1-C6 алкілом та за умови, що у разі, коли R4 - галоген або C1-C6 алкіл, лише один із R3 та R3a є воднем;
або її фармацевтично прийнятної солі, одержаної доданням основи.
9. Спосіб за п. 8, де сприйнятливою пухлиною є пухлина товстої кишки або прямої кишки.
10. Фармацевтична композиція, що містить сполуку Формули II:
 II,
II,
де:
Х - О або NH;
R1 - водень, галоген, C1-C6 алкіл, С1-С4 алкокси-, С1-С4 алкілтіогрупа, СF3, ОСF3, SCF3, (С1-С4 алкокси)карбоніл, нітро-, азидогрупа, O(SO2)СН3, N(СН3)2, гідроксил, феніл, заміщений феніл, піридиніл, тієніл, фурил, хінолініл або тіазоліл;
R2 - водень, галоген, ціан, СF3, C1-C6 алкіл, (С1-С4 алкокси)карбоніл, С1-С4 алкоксигрупа, феніл або хінолініл;
R2а - водень або С1-С4 алкоксигрупа;
R2b - водень або C1-C6 алкіл, за умови, що щонайменше один із R2a та R2b є воднем;
R3 - водень, галоген, C1-C6 алкіл, СF3 або нітрогрупа;
R3a - водень, галоген або C1-C6 алкіл, за умови, що у разі, коли R3a - C1-C6 алкіл, R3 - водень та R4 - галоген; та
R4 - галоген, C1-C6 алкіл або СF3, за умови, що лише один із R3 та R4 може бути C1-C6 алкілом та за умови, що у разі, коли R4 - галоген або C1-C6 алкіл, лише один із R3 та R3a є воднем;
або її фармацевтично прийнятну сіль, одержану доданням основи, та фармацевтично прийнятний носій, розріджувач або наповнювач.
Текст
1. Сполука Формули І: R4 O X C2 2 (19) 1 3 74889 4 5. Сполука за п. 1, яка є N-[2-хлор-4-бромбензоїл]за умови, що у разі, коли R4 - галоген або C1-C6 4-хлорфенілсульфонамідом або його сіллю, одералкіл, лише один із R3 та R3a є воднем; жаною доданням основи. або її фармацевтично прийнятної солі, одержаної 6. Сполука за п. 1, яка є N-[2-метил-4доданням основи. хлорбензоїл]-4-хлорфенілсульфонамідом або його 9. Спосіб за п. 8, де сприйнятливою пухлиною є сіллю, одержаною доданням основи. пухлина товстої кишки або прямої кишки. 7. Сполука за п. 5 або п. 6, де згаданою сіллю, 10. Фармацевтична композиція, що містить сполуодержаною доданням основи, є сіль натрію. ку Формули II: 8. Спосіб лікування сприйнятливих пухлин у ссавR4 O X ця, що включає введення ссавцю, що потребує R3a S R2b такого лікування, онколітично ефективної кількості N сполуки Формули II: O H R4 O X R3 R1 R2a R3a S R2b N R2 II, O H де: 3 R R1 R2a Х - О або NH; R1 - водень, галоген, C1-C6 алкіл, С1-С4 алкокси-, 2 R II, С1-С4 алкілтіогрупа, СF3, ОСF3, SCF3, (С1-С4 алкокде: си)карбоніл, нітро-, азидогрупа, O(SO2)СН3, Х - О або NH; N(СН3)2, гідроксил, феніл, заміщений феніл, піриR1 - водень, галоген, C1-C6 алкіл, С1-С4 алкокси-, диніл, тієніл, фурил, хінолініл або тіазоліл; 2 С1-С4 алкілтіогрупа, СF3, ОСF3, SCF3, (С1-С4 алкокR - водень, галоген, ціан, СF3, C1-C6 алкіл, (С1-С4 си)карбоніл, нітро-, азидогрупа, O(SO2)СН3, алкокси)карбоніл, С1-С4 алкоксигрупа, феніл або N(СН3)2, гідроксил, феніл, заміщений феніл, пірихінолініл; диніл, тієніл, фурил, хінолініл або тіазоліл; R2а - водень або С1-С4 алкоксигрупа; 2 R - водень, галоген, ціан, СF3, C1-C6 алкіл, (С1-С4 R2b - водень або C1-C6 алкіл, за умови, що щонайалкокси)карбоніл, С1-С4 алкоксигрупа, феніл або менше один із R2a та R2b є воднем; хінолініл; R3 - водень, галоген, C1-C6 алкіл, СF3 або нітрогруR2a - водень або С1-С4 алкоксигрупа; па; R2b - водень або C1-C6 алкіл, за умови, що щонайR3a - водень, галоген або C1-C6 алкіл, за умови, що 2a 2b 3a 3 4 менше один із R та R є воднем; у разі, коли R - C1-C6 алкіл, R - водень та R 3 R - водень, галоген, C1-C6 алкіл, СF3 або нітрогругалоген; та па; R4 - галоген, C1-C6 алкіл або СF3, за умови, що R3а - водень, галоген або C1-C6 алкіл, за умови, що лише один із R3 та R4 може бути C1-C6 алкілом та 3a 3 4 у разі, коли R - C1-C6 алкіл, R - водень та R за умови, що у разі, коли R4 - галоген або C1-C6 галоген; та алкіл, лише один із R3 та R3a є воднем; 4 R - галоген, C1-C6 алкіл або СF3, за умови, що або її фармацевтично прийнятну сіль, одержану лише один із R3 та R4 може бути C1-C6 алкілом та доданням основи, та фармацевтично прийнятний носій, розріджувач або наповнювач. Впродовж останніх років було здійснено фундаментальний поступ у розробці хімічних засобів та схем лікування, спрямованих на боротьбу з неопластичними захворюваннями. Незважаючи на цей безперервний поступ, різновиди ракових захворювань продовжують настійно вимагати нестерпних рівнів людського болю та страждань. Потреба у нових та кращих способах лікування злоякісних неоплазм та лейкозів продовжує підкріплювати зусилля, спрямовані на створення нових класів сполук, особливо у галузі іноперабельних та метастатичних солідних пухлин. Нещодавня лавина інформації відносно основних біологічних процесів, залучених до утворення неоплазм, призвела до глибшого розуміння гетерогенності пухлин. Завдяки цій надзвичайній гетерогенності серед популяцій неопластичних клітин, нові хіміотерапевтичні засоби повинні мати широкий спектр дії та прийнятний терапевтичний індекс. Окрім того, такі засоби повинні бути хімічно стійкими та сумісними з інши ми засобами. Важливо також щоб будь-яка схема застосування хіміотерапевтичних засобів була зручною та, наскільки це можливо, безболісною для пацієнта. При лікуванні раку часто вдаються до застосування хіміотерапії та опромінювання, і хоча у цьому разі часто викликається певна реакція з боку злоякісного захворювання, вони рідко коли виявляються цілющими. Зростання маси більшості солідних пухлин відбувається завдяки проліферації злоякісних клітин та клітин строми, у тому числі клітин ендотелію. Для того, щоб пухлина збільшилась у діаметрі більше за 2-3мм, вона повинна утворити судинну сітку, тобто повинен відбутись процес, відомий як ангіогенез. Повідомлялось, що наслідком пригнічення ангіогенезу, індукованого пухлиною, за допомогою ангіостатину та ендостатину є протипухлинна активність [О'Рейлі (O'Reilly) та інші, Cell, 88, 277-285 (1997)]. Оскільки ангіогенез є критичною складовою збільшення маси бі 5 74889 6 льшості солідних пухлин, розробка нових засобів для пригнічення цього процесу є перспективним варіантом підходу до протипухлинної терапії. Цей варіант підходу до протипухлинної терапії може бути позбавленим токсичних побічних ефектів або властивостей стандартних хіміотерапевтичних заходів, що індукують резистентність до лікарських засобів [Джуда Фолькман (Judah Folkman), Endogenous Inhibitors of Angiogenesis, The Harvey де: Lectures, Series 92, стор.65-82, Wiley-Liss Inc., X - О або NH; (1998)]. R1 - водень, галоген, C1-C6 алкіл, C1-C4 алкокN-[бензоїл]-фенілсульфонаміди є добре відоси-, C1-C4 алкілтіогрупа, CF3, OCF3, SCF3, (C1-C4 мими у галузях сільськогосподарської хімії як інсеалкокси)карбоніл, нітро-, азидогрупа, O(SO2)CH3, ктициди та гербіциди [патент Германії №2744137]. N(CH3)2, гідроксил, феніл, заміщений феніл, піриЗастосування N-[бензоїл]-фенілсульфонамідів як диніл, тієніл, фурил, хінолініл або тіазоліл; протипухлинних засобів взагалі або як інгібіторів R2 - водень, галоген, ціан, CF3, C1-C6 алкіл, ангіогенезу зокрема до цього часу не визнавалось. (C1-C4 алкокси)карбоніл, C1-C4 алкоксигрупа, феніл Цей винахід надає сполуку Формули І: або хінолініл; R2а - водень або C1-C4 алкоксигрупа; R2b - водень або C1-C6 алкіл, за умови, що щонайменше один із R2a та R2b є воднем; R3 - водень, галоген, C1-C6 алкіл, CF3 або нітрогрупа; R3a - водень, галоген або C1-C6 алкіл, за умови, що у разі, коли R3a - C1-C6 алкіл, R3 - водень та R4 - галоген; та R4 - галоген, C1-C6 алкіл або CF3, за умови, що де: лише один із R3 та R4 може бути C1-C6 алкілом та X - О або NH; за умови, що у разі, коли R4 - галоген або C1-C6 1 R - водень, галоген, C1-C6 алкіл, C1-C4 алкокалкіл, лише один із R3 та R3a є воднем; або її фарси-, C1-C4 алкілтіогрупа, CF3, OCF3, SCF3, (C1-C4 мацевтично прийнятної солі, одержаної доданням алкокси)карбоніл, нітро-, азидогрупа, O(SO2)CH3, основи. N(CH3)2, гідроксигрупа, феніл, заміщений феніл, Цей винахід також надає спосіб пригнічення піридиніл, тієніл, фурил, хінолініл або тіазоліл; ангіогенезу пухлин у ссавця, що включає введення R2 - водень, галоген, ціан, CF3, C1-C6 алкіл, ссавцю, який потребує такого лікування, кількості (C1-C4 алкокси)карбоніл, C1-C4 алкоксигрупа, феніл сполуки Формули II або її фармацевтично прийняабо хінолініл; тної солі, одержаної доданням основи, що пригніR2a - водень або C1-C4 алкоксигрупа; чує ангіогенез. R2b - водень або C1-C6 алкіл, за умови, що щоЦей винахід надає також фармацевтичну комнайменше один із R2a та R2b є воднем; позицію, що містить сполуку Формули II або її фа3 R - водень, галоген, C1-C6 алкіл, CF3 або нітрмацевтично прийнятну сіль, одержану доданням рогрупа; основи, у комбінації з фармацевтично прийнятним R3a - водень, галоген або C1-C6 алкіл, за умоносієм, розріджувачем або наповнювачем. ви, що у разі, коли R3a є C1-C6 алкіл, R3 - водень та Цей винахід надає також застосування сполуR4 - галоген; та ки Формули II для одержання лікарського засобу R4 - галоген, C1-C6 алкіл або CF3, за умови, що для лікування сприйнятливих неоплазм. На додалише один із R3 та R4 може бути C1-C6 алкілом та ток до цього, цей винахід надає фармацевтичну за умови, що у разі, коли R4 - галоген або C1-C6 композицію, пристосовану для лікування сприйняалкіл, лише один із R3 та R3a є воднем; або її фартливих неоплазм, що містить сполуку Формули II. мацевтично прийнятну сіль, одержану доданням Крім того, цей винахід включає спосіб лікування основи, за умови, що: сприйнятливих неоплазм, що включає введення a) у разі, коли обидва R3 та R4 - хлор та R2 ефективної кількості сполуки Формули II. водень, R1 - бром, йод, C1-C4 алкокси-, C1-C4 алкіЗагальні хімічні терміни, що використовуються лтіогрупа, CF3, OCF3, нітро-, азидогрупа, у вищенаведених формулах, мають своє звичайне O(SO2)CH3, N(CH3)2, гідроксил, феніл, заміщений значення. Наприклад, згаданий термін "C1-C6 алфеніл, піридиніл, тієніл, фурил або триазоліл; кіл" означає метил, етил, пропіл, ізопропіл, бутил, b) у разі, коли обидва R3 та R4 - хлор та R1 ізобутил, втор-бутил, трет-бутил, пентил та гексил. водень, R2 - бром, фтор, CF3, C1-C6 алкіл, C1-C4 Згаданий термін "C1-C4 алкіл" входить до значення алкоксигрупа, феніл або хінолініл. терміну "C1-C6 алкіл" і означає метил, етил, пропіл, Цей винахід додатково надає спосіб обробки ізопропіл, бутил, ізобутил, втор-бутил та третсприйнятливих неоплазм у ссавця, що включає бутил. Згаданий термін "C1-C4 алкоксигрупа" ознавведення ссавцю, який потребує такого лікування, чає C1-C4 алкіл, зв'язаний з вихідною молекулою онколітично ефективної кількості сполуки Формули за допомогою атому кисню, і включає метокси-, II: етокси- та ізопропоксигрупу. Подібним же чином, згаданий термін "C1-C4 алкілтіогрупа" означає C1 7 74889 8 C4 алкіл, зв'язаний з вихідною молекулою за доO(SO2)CH3, N(CH3)2, гідроксил, феніл, заміщений помогою атому сірки, і включає метилтіо-, етилтіофеніл, піридиніл, тієніл, фурил, хінолініл та триата ізобутилтіогрупу. Згаданий термін "галоген" золіл; або означає хлор, фтор, бром та йод. Згаданий термін b) R2a та R2b - водень, R1 вибрані з групи, що "заміщений феніл" означає монозаміщений феніл, включає галоген та C1-C4 алкіл, R2 вибрані з групи, де згадані замісники вибрані з групи, що включає що включає галоген, C1-C4 алкіл та C1-C4 алкоксиC1-C4 алкокси-, C1-C4 алкілтіогрупу, C1-C4 ацил, карбоніл. трифторметил та галоген. Згаданий термін "ацил" Слід розуміти, що вищенаведені класи, яким означає органічну кислотну групу, де ОН карбоквіддається перевага і яким віддається особлива силу заміщується якимось іншим замісником перевага, можуть комбінуватись з одержанням (RCO-). додаткових класів, яким віддається перевага і У разі, коли X=NH, згадана молекула може ісяким віддається особлива перевага. нувати у двох таутомерних формах: Сполуки Формули II є протипухлинними засобами. Таким чином, цей винахід також надає спосіб лікування сприйнятливої пухлини у ссавця, який включає введення ссавцю, який потребує згаданого лікування, онколітично ефективної кількості сполуки Формули II. Гадають, що ці сполуки є придатними для лікування карцином, наприклад, Цей винахід передбачає обидві згадані форми. пухлин центральної нервової системи: мультифоНезважаючи на те, що усі сполуки Формули II рмної гліобластоми, астроцитоми, пухлин олігодеє корисними протипухлинними засобами, перевага ндроглії, пухлин епендими та хоріоїдного сплетенвіддається певним класам сполук. У подальших ня, пухлин шишкоподібного тіла, пухлин нервових параграфах наведено опис таких класів, яким відклітин, медулобластоми, шванноми, менінгіоми, дається перевага. менінгеальної саркоми; пухлин ока: базальноa) R1 - водень та R2 - бром; клітинної карциноми, плоскоклітинного раку, мелаb) R1 - фтор та R2 - хлор; номи, рабдоміосаркоми, ретинобластоми; пухлин c) R1 - фтор; ендокринних залоз: пухлин гіпофізу, пухлин щитоd) R1 - хлор; видної залози, пухлин кори надниркових залоз, е) R1 - метил; пухлин нейроендокринної системи, пухлин гастроf) R1 - метилтіогрупа; ентеропанкреатичної ендокринної системи, пухлин g) R2 - водень; статевих залоз; пухлин голови та шиї: раку голови 3 h) R - хлор, бром або CF3; та шиї, ротової порожнини, глотки, гортані, одонтоі) R3 - хлор; генних пухлин; пухлин грудної клітки: великокліj) R3 - бром; тинного раку легень, дрібноклітинного раку легень, k) R3 - CF3; недрібноклітинного раку легень, злоякісної мезоl) R3a - водень; теліоми, тимом, первинних зародково-клітинних m) R4 - хлор, бром, метил або CF3; пухлин грудної клітки; пухлин травного тракту: пуn) R4 - хлор; хлин стравоходу, пухлин шлунка, пухлин печінки, о) R4 - бром; пухлин жовчного міхура, пухлин екзокринних залоз р) R4 - метил; підшлункової залози, пухлин тонкого відділу кишеq) R4 - CF3; чнику, червоподібного відростка та очеревини, r) обидва R3 та R4 - хлор; аденокарциноми товстої кишки та прямої кишки, s) обидва R3 та R4 - CF3; пухлин анального отвору; пухлин сечо-статевого t) R3 - бром та R4 - хлор; тракту: раку ниркових клітин, пухлин ниркових миu) R3a - водень, R3 та R4 - не водень; сок та сечоводу, пухлин сечового міхура, пухлин ν) Χ - Ο; сечовипускального каналу, пухлин передміхурової w) Згадана сполука Формули II, де згаданою залози, пухлин статевого члена, пухлин яєчок; сполукою є фармацевтично прийнятна сіль, одерпухлин жіночих статевих органів: пухлин вульви та жана доданням основи; вагіни, пухлин шийки матки, аденокарциноми тіла х) Згадана сполука Формули II, де згаданою матки, раку яєчника, гінекологічних сарком; пухлин сполукою є сіль натрію; молочної залози; пухлин шкіри: базально-клітинної у) R1, R2a та R2b - водень, R2 вибрані з групи, карциноми, плоскоклітинного раку, дерматофіброщо включає галоген, C1-C4 алкіл, C1-C4 алкоксигсаркоми, пухлин клітин Меркела; злоякісної меларупу, ціан, трифторметил та хінолініл; номи; пухлин кісток та м'яких тканин: остеогенної z) R2 та R2b - водень, R1 - галоген або C1-C4 саркоми, злоякісної волокнистої гістіоцитоми, хоналкіл та R2a - C1-C4 алкіл або C1-C4 алкоксигрупа; дросаркоми, саркоми Юінга, первинної нейроектоабо дермальної пухлини, ангіосаркоми; пухлин систеаа) R2a - водень, R1 - C1-C4 алкоксигрупа та R2 ми кровотворення: мієлодиспластичних синдромів, 2b та R - C1-C4 алкіл. гострого лейкозу спинного або кісткового мозку, На додаток до цього, особлива перевага відхронічного лейкозу спинного або кісткового мозку, дається таким класам: гострого лімфолейкозу, вірусу людського Тa) R2, R2a та R2b - водень, R1 вибрані з групи, клітинного лейкозу/лімфоми, хронічного лімфощо включає водень, галоген, C1-C6 алкіл, C1-C4 лейкозу, злоякісного ретикулоендотеліозу, хвороалкокси-, C1-C4 алкілтіогрупу, CF3, OCF3, SCF3, би Ходжкіна, неходжкінських лімфом, базофільно(C1-C4 алкокси)карбоніл, нітро-, азидогрупу, го лейкозу; та пухлин дітей: гострого 9 74889 10 лімфолейкозу, гострих мієлоцитарних лейкозів, У разі, коли Ζ - ОН, відповідна бензойна киснейробластоми, пухлин кісток, рабдоміосаркоми, лота сполучається з фенілсульфонамідом за сталімфом, пухлин нирок. Гадають, зокрема, що ці ндартних умов сполучення пептидів, добре відосполуки є придатними для лікування солідних пухмих досвідченому фахівцю. Зокрема, лин, особливо пухлин товстої кишки та прямої кифенілсульфонамід та бензойна кислота сполучашки. Перевага віддається тому, що ссавцем, який ються у присутності реактиву сполучення пептидів, піддається лікуванню шляхом введення згаданих факультативно у присутності каталізатора. До сполук Формули II, є людина. придатних реактивів сполучення пептидів налеЗгадані сполуки за цим винаходом є кислотжить Ν,Ν'-карбонілдіімідазол (CDI), Ν,Ν'ними за своєю природою і, відповідно, можуть дициклогексилкарбодіімід (DCC), гідрохлорид 1-(3вступати до реакції з будь-якою з цілого ряду недиметиламінопропіл)-3-етилкарбодііміду (EDC) та органічних та органічних основ, у тому числі амі1-(3-(1-піролідиніл)пропіл)-3-етилкарбодіімід нами та четвертинними амонієвими основами, з (РЕРС). Були описані форми EDC [Terahedron одержанням фармацевтично прийнятних солей, Letters, 34(48), 7685 (1993)] та РЕРС [патент США одержаних доданням основи. Перевага віддається №5,792,763] на основі полімеру, які є придатними перетворенню сполук Формули II на їхні фармацедля одержання згаданих сполук за цим винаховтично прийнятні солі, одержані доданням основи, дом. До придатних каталізаторів для реакції сподля полегшення введення у разі, коли виникає лучення належить Ν,Ν-диметил-4-амінопіридин потреба у водних розчинах згаданої цільової спо(DMAP). Усі згадані реактиви об'єднують у придатлуки. Згадані сполуки Формули II можуть вступати ному розчиннику, як правило, дихлорметані, хлодо реакції з основними матеріалами, наприклад, роформі, тетрагідрофурані, діоксані або діетилогідроксидами, карбонатами та бікарбонатами лужвому ефірі і перемішують впродовж 1-72год. при них металів або лужноземельних металів, у тому температурі у межах від температури навколишчислі, без обмеження, гідроксидом натрію, карбонього середовища до приблизно температури кинатом натрію, гідроксидом калію, гідроксидом капіння згаданого розчинника. Потрібний продукт льцію, гідроксидом літію тощо, з одержанням фаможе бути виділеним за допомогою стандартних рмацевтично прийнятних солей, наприклад, методів екстрагування та кристалізації, і очищеним відповідної солі натрію, калію, літію або кальцію. шляхом хроматографування або кристалізації, за Особлива перевага віддається солям натрію та потребою або бажанням. У разі застосування реакалію. ктивів на основі полімеру, вони можуть легко виПрикладами амінів, придатних для одержання далятись зі згаданої реакційної суміші шляхом солей є: первинні, вторинні та третинні аліфатичні фільтрації. та ароматичні аміни, наприклад, метиламін, етиЗа альтернативним варіантом сульфонамід ламін, пропіламін, i-пропіламін, чотири ізомерні може вступати до реакції з похідною бензойної бутиламіни, диметиламін, діетиламін, діетанолакислоти, наприклад, такими сполуками, де Ζ мін, дипропіламін, діізопропіламін, ді-n-бутиламін, хлор, бром, метансульфонілокси- або трифтормепіролідин, піперидин, морфолін, триметиламін, тансульфонілоксигрупа, у присутності акцептора триетиламін, трипропіламін, хінуклідин, піридин, кислоти, наприклад, піридину, триетиламіну або хінолін та ізохінолін, зокрема, етил-, пропіл-, діеосновної смоли, факультативно у присутності катил- або триетиламін, але особливо ізопропіламін талізатора. Згадані реактиви об'єднують, і продукта діетаноламін. ти виділяють, по суті як було описано вище. Прикладами четвертинних амонієвих основ є, Фахівцю, досвідченому у цій галузі техніки, бувзагалі, катіони галогенамонієвих солей, наприде зрозуміло, що сполуки Формули II, де X - ΝΗ, клад, катіон тетраметиламонію, катіон триметилможна одержати, як показано на Схемі II, де R1, бензиламонію, катіон триетилбензиламонію, катіон R2, R2a, R2b, R3, R3a та R4 відповідають визначентетраетил амонію або катіон триметилетиламонію, ню, яке було наведено перед тим. але також катіон амонію. Згадані сполуки за цим винаходом можна одержати за способами, добре відомими пересічному фахівцю у цій галузі техніки. Взагалі, N-[бензоїл]фенілсульфонаміди Формули II одержують шляхом сполучення відповідно заміщеного фенілсульфонаміду з відповідно заміщеною бензойною кислотою або похідною бензойної кислоти, як поВідповідно заміщений бензамідин вступає до казано на подальшій схемі. Змінні R1, R2, R2a, R2b, реакції з похідними сульфонілу, наприклад, сполу3a 4 R3 R тa R відповідають попередньо наведеному ками, де Z' - хлор, бром, метансульфонілокси- або визначенню, Ζ - ОН, СІ, Вr, метансульфонілокситрифторметансульфонілоксигрупа, у присутності або трифторметансульфонілоксигрупа. акцептора кислоти, наприклад, піридину, триетиламіну або основної смоли, факультативно у присутності каталізатора. Згадані реактиви об'єднують, і продукти виділяють, по суті як було описано вище. Необхідні бензойні кислоти, похідні бензойної кислоти, бензамідини, похідні сульфонілу та сульфонаміди є доступними або комерційними шляхами, або їх можна одержати способами, добре ві 11 74889 12 домими досвідченому фахівцю. краплею) розчином броміду міді (II) (7,81г) у воді Підготовчий синтез 1 (20мл). Після завершення додання одержану реа2,4-дибромбензонітрил кційну суміш витримують з нагріванням до темпеРозчин ціаніду міді (І) (2,32г, 25,9ммоль) у безратури навколишнього середовища, і перемішують водному диметилсульфоксиді (50мл) перемішують впродовж ночі. Після цього одержану реакційну при температурі 60°С, і до цього розчину однією суміш екстрагують сумішшю (3:1) етилацетапорцією додають трет-бутилнітрит (7,1мл, ту:гексану (2 400мл). Об'єднані органічні шари 59,7ммоль). До одержаної суміші крапля за краппромивають насиченим водним розчином хлориду лею за допомогою канюлі додають розчин 2,4натрію (200мл), сушать, концентрують під знижедиброманіліну (5,0г, 19,9ммоль) у безводному диним тиском, і одержаний залишок піддають хромаметилсульфоксиді (30мл). Після завершення дотографуванню на силікагелі з елююванням хлородання одержану реакційну суміш перемішують формом, що містить 1% метанолу та 0,5% оцтової впродовж 1год., охолоджують до температури кислоти. Фракції, що містять продукт, об'єднують, і 45°С, після чого повільно обробляють 5N розчиконцентрують під зниженим тиском з одержанням ном НСl (50мл). Через 5хв. згадану реакційну суцільової сполуки (4,04г, 59% вихід). міш охолоджують до температури навколишнього т.пл.=154-155°С. середовища і екстрагують сумішшю (1:1) етилацеESIMS: m/e=233, 235 (M+-1). татутексану (2 300мл). Об'єднані органічні шари Підготовчий синтез 4 промивають водою (100мл) та насиченим водним Метиловий складний ефір 4розчином хлориду натрію (100мл), сушать, концесульфамоїлбензойної кислоти нтрують під зниженим тиском, і одержаний зали4-карбоксифенілсульфонамід (2,00г, шок піддають хроматографуванню на силікагелі з 9,9ммоль) суспендують у суміші (3:1) хлорофорелююванням гексаном, що містить 0-5% етилацему:метанолу (200мл). При температурі навколиштату. Фракції, що містять продукт, об'єднують, і нього середовища додають 2,0Μ розчин (триметиконцентрують під зниженим тиском з одержанням лсиліл)-діазометану у гексані (7,4мл, 14,8ммоль), і цільової сполуки (1,61г, 31% вихід). перемішують впродовж 5хв. Одержаний розчин Т.пл. (температура плавлення)=76-78°С. концентрують in vacio, неочищену речовину хроFDMS (мас-спектрометрія з полевою десорбматографують на силікагелі, 0,5% МеОН/0,1% цією): m/e=261 (М+). АсОН у СН2СІ2. Одержаний продукт являє собою Підготовчий синтез 2 2,4-дибромбензойна китверду речовину білого кольору, 2,11г, 98% вихід. слота т.пл.=180°С. Перемішувану суспензію 2,4ESIMS m/e 214 (М+-1). дибромбензонітрилу (1,57г, 6,0ммоль) у сірчаній Підготовчий синтез 5 3,4кислоті (6М, 150мл) нагрівають зі зворотним холодибромфенілсульфонамід дильником впродовж 3 днів. Одержану реакційну 3,4-дибромфенілсульфонілхлорид (20ммоль, суміш охолоджують до температури навколишньоAldrich) суспендують у 40мл 30% водного розчину го середовища, після чого екстрагують етилацетаNH4OH, і одержану суміш перемішують. Порціями повільно додають ацетон з одержанням гомогентом (2 75мл). Об'єднані органічні шари промиваної реакційної суміші (5-10мл). Під час згаданого ють водою (100мл) та насиченим водним додання відбувається екзотермічна реакція з інтерозчином хлориду натрію (50мл), сушать, конценнсивним газоутворенням. Одержану реакційну трують, після чого піддають хроматографуванню суміш перемішують при кімнатній температурі, і на силікагелі з елююванням хлороформом, що контролюють засобами ESI-MS. Одержану суміш містить 0,5% метанолу та 0,1% оцтової кислоти. концентрують на роторному випарнику з видаленФракції, що містять продукт, об'єднують, і конценням ацетону і одержанням твердої речовини. Одетрують під зниженим тиском з одержанням цільоржану тверду речовину збирають шляхом фільтвої сполуки (0,81г, 48% вихід). рування з відсмоктуванням, промивають водою і т.пл.=171-172°С. витримують з висушуванням на повітрі. ОдержаESIMS (мас-спектрометрія з електронний матеріал використовують у тому вигляді, у стимульованою іонізацією): m/e=279 (M+-1). якому його було одержано без додаткового очиПідготовчий синтез 3 щенням. ESIMS: 312, 314, 316 (М+ -1); т.пл.=1692-бром-4-хлорбензойна кислота 171°С; за літературними даними т.пл.=175-176°С, Розчин нітриту натрію (2,21г) у воді (15мл) [Хантресс Е.Г. (Huntress E.H.), Картен Ф.Г. (Carten крапля за краплею додають до перемішуваної суF.H.), J. Am. Сhem. Sос. 1940, 62, 511-514]. міші 2-аміно-4-хлорбензойної кислоти (5,00г, Сполуки Підготовчих синтезів 6-15 одержують 29,1ммоль) та 48% бромистоводневої кислоти по суті як описано у процедурі Підготовчого синте(150мл) у воді (150мл), охолодженої до темперазу 5. тури танення льоду. Одержану реакційну суміш перемішують впродовж 2год. при температурі 0°С, після чого обробляють (шляхом додання крапля за 13 74889 Підг. синтез № Продукт 6 3-хлор-4-фторфенілсульфонамід 7 4-йодофенілсульфонамід 8 3,4-дихлорфенілсульфонамід 9 10 11 12 13 14 15 4-ізопропілфенілсульфонамід 4-етилфенілсульфонамід 3-трифторметилфенілсульфонамід 3-фторфенілсульфонамід Толуол-3-сульфонамід 3-бромфенілсульфонамід 4-бромфенілсульфонамід Підготовчий синтез 16 2-хлор-4-метилбензойна кислота До розчину 4-бром-3-хлортолуолу (4,97г, 24,2ммоль) у диметилформаміді (DMF) (25мл) додають Pd(OAc)2 (0,54г, 2,42ммоль), 1,3біс(дифенілфосфіно)пропан (0,998г, 2,42ммоль), триетиламін (12,5мл) та метанол (12,5мл). Повітря з реакційної посудини видаляють, і тричі продувають газоподібним моноксидом вуглецю. Для підтримування атмосфери моноксиду вуглецю застосовують еластичну камеру, наповнену газоподібним моноксидом вуглецю. Одержану реакційну суміш нагрівають при температурі 80°С впродовж 8год. Після охолодження додають Н2О (50мл). Одержану суміш екстрагують гексаном (2 50мл). Об'єднані органічні шари сушать над Na2SO4, фільтрують, концентрують, і хроматографують з 0-3% EtOAc у гексані. 1,24г (28%) метил2-хлор-4-метилбензоату виділяють у вигляді безбарвного масла. EIMS m/e 184 (М+; 33(21) та 186 (М+; 37CI). До метил-2-хлор-4-метилбензоату (1,00г, 5,42ммоль) у THF (10мл), МеОН (5мл) та Н2О (2,5мл) додають 2N LiОН (8,12мл, 16,2ммоль). Одержану реакційну суміш нагрівають при температурі 50°С впродовж 2,5год., охолоджують до кімнатної температури, після чого реакцію швидко припиняють шляхом додання холодного 5N розчину НСl (3,24мл). Одержану суміш концентрують з видаленням THF та МеОН. Одержаний осад білого кольору відфільтровують. Після висушування виділяють 0,922г (100%) 2-хлор-4-метилбензойної кислоти. ESIMS m/e 169 (М -1; 35CI) та 171 (М -1; 37 CI). Підготовчий синтез 17 4-(трет –бутилдиметилсилілокси)фенілсульфонамід 4-гідроксифенілсульфонамід (3,46г, 20ммоль) розчиняють у диметилформаміді (40мл), і обробляють трет-бутилдиметилсилілхлоридом (3,31г, 22,0ммоль) та імідазолом (1,50г, 22,0ммоль) при кімнатній температурі. Через 20год. одержану реа Mac-спектрометричні дані (т/е) ESIMS: 210 (М+ -1) ESIMS: 284 (М+ -1) ESIMS m/e 224 (М -1; 35CI, 35CI) та 226 (М -1; 37 CI) та 228 (М--1; 37CI, 37CI) ESIMS m/e 198(М --1) ESIMS m/e 184(М -1) ESIMS: 224 (М+ -1) ESIMS: 174 (М+ -1) ESIMS: 170 (М+ -1) ESIMS: 237 (М+ -1) ESIMS: 237 (М+ -1) 35 СI, кційну суміш розбавляють EtOAc (100мл), і промивають 1,0N розчином НСI (2 50мл). Одержану органічну фазу сушать (MgSO4), фільтрують, і концентрують з одержанням масла. Неочищене масло очищають шляхом хроматографування на колонці Biotage (колонка з 40М SiO2, елюювання 75мл/хв. сумішшю (1:1) гексану:EtOAc). Одержують тверду речовину білого кольору (4,24г, 15,4ммоль, 77%). ESI-MS m/e 288,1 (М+ + Н); т.пл.=117-118°С; 1Н ЯМР (CDCl3) 7,78 (d, 2Н), 6,89 (d, 2Н), 4,86 (br s, 2H), 0,97 (s, 9H), 0,20 (s, 6H). Підготовчий синтез 18 N-(2,4-дихлорбензоїл)-4-(третбутилдиметилсилілокси)фенілсульфонамід До перемішуваного розчину 2,4дихлорбензойної кислоти (1,25екв.) у сухому дихлорметані (10мл/ммоль) однією порцією додавали 4-(трет-бутилдиметилсилілокси)фенілсульфонамід (1,0екв.), потім EDC (1,25-1,5екв.) і, нарешті, М,№диметил-4-амінопіридин (1,2екв.). Одержану суміш енергійно перемішують у атмосфері азоту впродовж 16год., концентрують під зниженим тиском, і одержаний залишок розподіляють між етилацетатом та водою. Одержаний органічнй шар промивають 1N розчином хлористоводневої кислоти (4 рази, 20мл/ммоль), після чого об'єднані водні фази екстрагують етилацетатом (двічі, 20мл/ммоль). Об'єднані органічні шари врешті промивають водою та насиченим водним розчином хлориду натрію, сушать над сульфатом натрію, та концентрують під зниженим тиском. Одержаний залишок очищають шляхом хроматографування на силікагелі або концентруванням, у разі потреби або бажання. ESI-MS m/e 458,0 (М+ -Н; 460,0 (М+ +Н). Сполуки Підготовчих синтезів 19-21 одержують по суті як описано у процедурі Підготовчого синтезу 18. Підг. синтез № Продукт 19 3-бром-N-(2,4-дихлорбензоїл)фенілсульфонамід 20 4-йод-N-(2,4-дихлорбензоїл)фенілсульфонамід 21 4-бром-N-(2,4-дихлорбензоїл)фенілсульфонамід Загальна методика сполучення До перемішуваного розчину бензойної кислоти 14 Мас-спектрометричні дані (m/e) + ESI-MS m/e 409,0 (М -Н) ESI-MS m/e 455,08 (М+-Н) ESI-MS m/e 409,0 (М+-Н) (1,25екв.) у сухому дихлорметані (10мл/ммоль) однією порцією додавали фенілсульфонамід 15 74889 16 (1,0екв.), потім EDC (1,25-1,5екв.) і, нарешті, Ν,Ν20мл/ммоль). Об'єднані органічні шари врешті [диметил]-4-амінопіридин (1,2екв.). Одержану супромивають водою та насиченим водним розчиміш енергійно перемішують у атмосфері азоту ном хлориду натрію, сушать над сульфатом навпродовж 16год., концентрують під зниженим тистрію, та концентрують під зниженим тиском. Одеком, і одержаний залишок розподіляють між етиржаний залишок може піддаватись лацетатом та водою. Одержаний органічний шар хроматографуванню на силікагелі або кристалізапромивають 1N розчином хлористоводневої кисції, у разі потреби або бажання. лоти (4 рази, 20мл/ммоль), після чого об'єднані Сполуки Прикладів 1-84 одержують по суті як водні фази екстрагують етилацетатом (двічі, описано у цій загальній процедурі. Приклад № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Продукт Mac-спектрометричні дані (m/е) МS(ЕS)(мас-спектрометрія (з електроN-[2,4-дихлорбензоїл]-3-бромфенілсульфонамід розпилюванням)): 408 [М-Н] N-[2,4-дихлорбензоїл]-3-хлорфенілсульфонамід MS(ES): 362 [М-Н] N-[2,4-дихлорбензоїл]-4-метоксифенілсульфонамід MS(ES): 360 [М-Н] N-[2,4-дибромбензоїл]-4-метилфенілсульфонамід ESIMS: 434 (М++1) N-[2,4-дибромбензоїл]-4-третESIMS: 476 (М++1) бутилфенілсульфонамід N-[2,4-дибромбензоїл]-4-хлорфенілсульфонамід ESIMS: 454, 456 (М++1) N-[2-бром-4-хлорбензоїл]-4ESIMS: 388, 390 (М++1) метилфенілсульфонамід N-[2-бром-4-хлорбензоїл]-4-хлорфенілсульфонамід ESIMS: 408, 410 (М++1) N-[2,4-дихлорбензоїл]-3-хлор-4ESIMS: 380 (М+-2),382 (М+), 384 (М++2) фторфенілсульфонамід N-[2-хлор-4-нітробензоїл]-4-хлорфенілсульфонамід ESIMS: 373 (М+-2),375 (М+), 377 (М++2) N-[2-хлор-4-бромбензоїл]фенілсульфонамід ESIMS: 372 (М+-2), 374 (М+) N-[2-метил-4-бромбензоїл]фенілсульфонамід ESIMS: 352 (М+-2),354 (М+) N-[2-хлор-4-нітробензоїл]фенілсульфонамід ESIMS: 339 (М+-1),341 (М++1) N-[2-хлор-4-бромбензоїл]-4ESIMS: 450 (М+-3), 452 (М+-1), 454 бромфенілсульфонамід (М++1) N-[2-хлор-4-нітробензоїл]-4+ + ESIMS: 417 (М -2), 419 (М ) бромфенілсульфонамід N-[2-хлор-4-бромбензоїл]-4ESIMS: 390 (М+-2), 392 (М+) фторфенілсульфонамід ESIMS: 406 (М+-3),408 (М+-1), 410 N-[2-хлор-4-бромбензоїл]-3-хлорфенілсульфонамід (М++1) N-[2-хлор-4-бромбензоїл]-4ESIMS: 402 (M+-2),404 (M+), 406 (M++2) метоксифенілсульфонамід N-[2-метил-4-бромбензоїл]-4ESIMS: 382 (M+-2), 384 (M+) метоксифенілсульфонамід N-[2-хлор-4-нітробензоїл]-4ESIMS: 369 (M+-1),371 (M+) метоксифенілсульфонамід N-[2-хлор-4-нітробензоїл]-3,4ESIMS: 407 (M+-2), 409 (M+), 411 (M++2) дихлорфенілсульфонамід N-[2-метил-4-хлорбензоїл]-3ESIMS: 342 (M -1),344 (M -1), 346 (M -1) хлорфенілсульфонамід Іони, що спостерігаються при масспектрометрії з електророзпилюванням N-[2-метил-4-хлорбензоїл]-4негативних іонів (ES NІ MS) [М-Н] : m/z метилфенілсульфонамід 342 (35Сl, 35Сl), m/z 344 (35СІ, 37CI) та m/z 346 (37СI, 37СI) Іони, що спостерігаються при ES NI MS N-[2,4-дихлорбензоїл]-3,4дибромфенілсульфонамід [М-Н] : m/z 322 (35Сl) та m/z 324 (37СI) N-[2,4-дихлорбензоіл]-3ESIMS: 395,9476/395,9469 трифторметилфенілсульфонамід N-[2,4-дихлорбензоїл]-3-фторфенілсульфонамід ESIMS: 345,9508/345,9515 N-[2,4-дихлорбензоїл]-3-метилфенілсульфонамід ESIMS: 365,9734/365,9747 N-[2-метил-4-бромбензоїл]-4ESIMS m/е 386,0, 387,9, та 389,9 (М+-1; 79 хлорфенілсульфонамід Вr, 35Сl; 79Вr, 37Сl; 81Br, 37Cl) N-[2-метил-4-бромбензоїл]-4ESIMS m/e 366,0 та 368,0 (М+-1; 79Br; 81 метилфенілсульфонамід Br) N-[2-бром-4-хлорбензоїл]-4ESIMS m/е 430,0, 431,9 та 433,9 (М+-1; 35 метоксикарбонілфенілсульфонамід Сl, 79Br; 37Сl, 79Br; 37Сl, 81Br) 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 17 74889 N-[2,4-дибромбензоїл]-4метоксикарбонілфенілсульфонамід N-[2-бром-4-хлорбензоїл]-3-метоксикарбоніл-4метоксифенілсульфонамід N-[2-бром-4-хлорбензоїл]-4-третбутилфенілсульфонамід N-[2,4-дибромбензоїл]-3-метоксикарбоніл-4метоксифенілсульфонамід N-[2-метил-4-бромбензоїл]-3-хлор-4фторфенілсульфонамід N-[2-метил-4-бромбензоїл]-4йодофенілсульфонамід N-[2-метил-4-бромбензоїл]-3метилфенілсульфонамід 18 ESIMS m/е 473,8, 475,9, та 477,9 (М+-1; 79 Br, 79Вr; 79Вr, 81Вr; 81Вr, 81Вr) ESIMS m/е 459,9, 461,9, 463,9 (М+-1; 79 Вr, 35Сl; 81Br, 35Сl; 81Br, 37Сl) ESIMS m/е 428,2, 430,2, та 432,2; (М+-1; 79 Вr, 35Сl; 81Вr, 35Сl; 81Вr, 37Cl ESIMS m/е 503,9, 506,0 та 508,0; (М+-1; 79 Вr, 79Вr; 81Вr, 79Вr; 81Вr, 81Вr) ESIMS m/е 404,0, 406,0, 408,0 (М+-1; 79 Вr, 35Сl; 81Вr, 35Сl; 81Вr, 37Сl) ESIMS m/е 478,0 та 480,0 (М+-1; 79Вr; 81 Вr) ESIMS m/е 366,1 та 368,1 (М+-1; 79Вr; 81 Вr) ESIMS m/е 541,9, 543,9 та 545,9 (М+-1; N-[2,4-дибромбензоїл]-4-йодофенілсульфонамід 79 Вr, 79Вr; 81Вr, 79Вr; 81Вr, 81Вr) ESIMS m/е 454 (M -1; 35Сl, 35Сl) та 456 N-[2,4-дихлорбензоїл]-4-йодофенілсульфонамід (M -1; 35Сl, 37Сl) та 458 (M -1; 37CI, 37CI) Іони, що спостерігаються при ES NI MS N-[2-хлор-4-бромбензоїл]-4-йодофенілсульфонамід [М-Н] : m/z 498 (79Вr, 35Сl), m/z 500 (81Вr, 35 Сl) та m/z 502 (81Вr, 37Сl) Іони, що спостерігаються при ES NI MS N-[2-метил-4-хлорбензоїл]-435 37 метоксифенілсульфонамід [М-Н] : m/z 338 ( Сl) та m/z 340 ( Сl) Іони, що спостерігаються при ES NI MS N-[2-метил-4-хлорбензоїл]-4фторфенілсульфонамід [М-Н] : m/z 326 (35Сl) та m/z 328 (37СI) Іони, що спостерігаються при ES NI MS N-[2-метил-4-хлорбензоїл]-4[М-Н] : m/z 386 (79Вr, 35Сl), m/z 388 (81Вr, бромфенілсульфонамід 35 Сl) та m/z 390 (81Вr, 37Сl) Іони, що спостерігаються при ES NI MS N-[2-метил-4-хлорбензоїл]-2-метокси-4метилфенілсульфонамід [М-Н] : m/z 352 (35Сl) та m/z 354(37СI) Іони, що спостерігаються при ES NI MS N-[2-метил-4-хлорбензоїл]-3-хлор-4[М-Н] : m/z 356 (35Сl, 35Сl), m/z 358 (35Сl, метилфенілсульфонамід 37 CI) та m/z 360 (37СI, 37СI) Іони, що спостерігаються при ES NI MS N-[2,4-біс-трифторметилбензоїл]-4фторфенілсульфонамід [М-Н] : m/z 414 Іони, що спостерігаються при ES NI MS N-[2,4-біс-трифторметилбензоїл]-4метоксифенілсульфонамід [М-Н] : m/z 426 Іони, що спостерігаються при ES NI MS N-[2,4-біс-трифторметилбензоїл]-4метилфенілсульфонамід [М-Н] : m/z 410 Іони, що спостерігаються при ES NI MS N-[2,4-біс-трифторметилбензоїл]-4бромфенілсульфонамід [М-Н] : m/z 474 (79Вr) та m/z 476 (81Вr) Іони, що спостерігаються при ES NI MS N-[2,4-біс-трифторметилбензоїл]-3метилфенілсульфонамід [М-Н] : m/z 410 Іони, що спостерігаються при ES NI MS N-[2-метил-4-хлорбензоїл]-4трифторметоксифенілсульфонамід [М-Н] : m/z 392 (35Сl) та m/z 394 (37СI) Іони, що спостерігаються при ES NІ MS N-[2,4-біс-трифторметилбензоїл]-3,4[М-Н] : m/z 464 (35Сl, 35Сl), m/z 466 (35Сl, дихлорфенілсульфонамід 37 Сl) та m/z 468 (37СІ, 37Сl) Іони, що спостерігаються при ES NІ MS N-[2,4-біс-трифторметилбензоїл]-3,4дифторфенілсульфонамід [М-Н] : m/z 432 Іони, що спостерігаються при ES NІ MS N-[2-метил-4-хлорбензоїл]-3-хлор-4[М-Н] : m/z 360 (35Сl, 35Сl), m/z 362 (35Сl, фторфенілсульфонамід 37 Сl) та m/z 364 (37Сl, 37Сl) Іони, що спостерігаються при ES NІ MS N-[2-метил-4-хлорбензоїл]-3метилфенілсульфонамід [М-Н] : m/z 322 (35Сl) та m/z 324 (37Сl) Іони, що спостерігаються при ES NІ MS N-[2-метил-4-хлорбензоїл]-435 37 йодофенілсульфонамід [М-Н] : m/z 434 ( Сl) та m/z 436 ( Сl) Іони, що спостерігаються при ES NІ MS N-[2-метил-4-хлорбензоїл]-3,4дифторфенілсульфонамід [М-Н] : m/z 344 (35Сl) та m/z 346 (37Сl) Іони, що спостерігаються при ES NІ MS N-[2,4-біс-трифторметилбензоїл]-3-хлор-4фторфенілсульфонамід [М-Н] : m/z 448 (35Сl) та m/z 450 (37Сl) N-[2-хлор-4-метилбензоїл]-3-хлор-4Іони, що спостерігаються при мас 19 фторфенілсульфонамід 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 74889 20 спектрометрії з електророзпилюванням позитивних іонів (ES PI MS) [M+H]+: m/z 362 (35Сl) та m/z 364 (37Сl) Іони, що спостерігаються при ES PI MS N-[2-метил-4-хлорбензоїл]фенілсульфонамід [M+H]+: m/z 310 (35Сl) та m/z 312 (37Сl) Іони, що спостерігаються при ES NІ MS N-[2-метил-4-бромбензоїл]-4етилтіофенілсульфонамід [М-Н] : m/z 412 (79Вr) та m/z 414 (81Вr) Іони, що спостерігаються при ES NІ MS N-[2,4-дихлорбензоїл]-4-етилтіофенілсульфонамід [М-Н] : m/z 388 (35Сl, 35Сl), m/z 390 (35Сl, 37 Сl) та m/z 392 (37Сl, 37Сl) Іони, що спостерігаються при ES NІ MS N-[2,4-біс-трифторметилбензоїл]-4ізопропілфенілсульфонамід [М-Н] : m/z 438 Іони, що спостерігаються при ES NІ MS N-[2-хлор-4-бромбензоїл]-4[М-Н] : m/z 414 (79Вr, 35Сl), m/z 416 (81Вr, ізопропілфенілсульфонамід 35 Сl) та m/z 418 (81Вr, 37Сl) Іони, що спостерігаються при ES NІ MS N-[2,4-дибромбензоїл]-4-етилфенілсульфонамід [М-Н] : , m/z 444(79Вr, 79Вr), m/z 446 (79Вr, 81Вr) та m/z 448 (81Вr, 81Вr) Іони, що спостерігаються при ES NІ MS N-[2-метил-4-бромбензоїл]-4етилфенілсульфонамід [М-Н] : m/z 380 (79Вr) та m/z 382 (81Вr) Іони, що спостерігаються при ES PI MS N-[2,4-дибромбензоїл]-4[M+H]+: m/z 460 (79Вr, 79Вr), m/z 462 ізопропілфенілсульфонамід (79Вr, 81Вr) та m/z 464 (81Вr, 81Вr) Іони, що спостерігаються при ES NІ MS N-[2,4-дихлорбензоїл]-4[М-Н] : m/z 370 (35Сl, 35Сl), m/z 372 (35Сl, ізопропілфенілсульфонамід 37 Сl) та m/z 374 (37Сl, 37Сl) Іони, що спостерігаються при ES NІ MS N-[2,4-дихлорбензоїл]-4-етилфенілсульфонамід [М-Н] : m/z 356 (35Сl, 35Сl), m/z 358 (35Сl, 37 Сl) та m/z 360 (37Сl, 37Сl) Іони, що спостерігаються при ES NІ MS N-[2-метил-4-хлорбензоїл]-4етилфенілсульфонамід [М-Н] : m/z 336 (35Сl) та m/z 338 (37Сl) Іони, що спостерігаються при ES NІ MS N-[2-хлор-4-бромбензоїл]-4-етилфенілсульфонамід [М-Н] : m/z 400 (79Вr, 35Сl), m/z 402 (81Вr, 35 Сl) та m/z 404 (81Вr, 37Сl) Іони, що спостерігаються при ES NІ MS N-[2-бром-4-хлорбензоїл]-4-етилфенілсульфонамід [М-Н] : m/z 400 (79Вr, 35Сl), m/z 402 (81Вr, 35 Сl) та m/z 404 (81Вr, 37Сl) Іони, що спостерігаються при ES NІ MS N-[2-бром-4-хлорбензоїл]-4[М-Н] : m/z 414 (79Вr, 35Сl), m/z 416 (81Вr, ізопропілфенілсульфонамід 35 Сl) та m/z 418 (81Вr, 37Сl) N-[2-хлор-4-йодобензоїл]-4ESIMS m/е 460,9 (М-1) азидофенілсульфонамід Іони, що спостерігаються при ES NІ MS N-[2-метил-4-хлорбензоїл]-4метилтіофенілсульфонамід [М-Н] : m/z 356 (35Сl) та m/z 358 (37Сl) Іони, що спостерігаються при ES NІ MS N-[2-метил-4-хлорбензоїл]-4[М-Н] : m/z 408 (79Вr, 35Сl), m/z 410 (81Вr, трифторметилтіофенілсульфонамід 35 Сl) та m/z 412 (81Вr, 37Сl) N-[2-метил-4-хлорбензоїл]-3Іони, що спостерігаються при ES PI MS трифторметилфенілсульфонамід [M+H]+: m/z 378 (35Сl) та m/z 380 (37Сl) N-[2-метил-4-бромбензоїл]-3Іони, що спостерігаються при ES PI MS трифторметилфенілсульфонамід [М+Н]+: m/z 422 (79Вr) та m/z 424 (81Вr) N-[2-трифторметил-4-метилбензоїл]-4Іони, що спостерігаються при ES PI MS метилфенілсульфонамід [М+Н]+: m/z 358 1 Н ЯМР (CDCI3) 7,68-7,15 (m, 7Н); 3,80 N-[2,4-дихлорбензоїл]-3-метоксифенілсульфонамід (s, 3Η) N-[2,4-дихлорбензоїл]-4ESI-MS m/e 395,9 (M+-Η) трифторметилфенілсульфонамід Т.пл.=155-157°С; ESI-MS m/e 344,0 (M+N-[2,4-дихлорбензоїл]-4-гідроксифенілсульфонамід Η) N-[4-бром-2-метилбензоїл]-3,4MS (ES): [М-Н] 379,9943 диметилфенілсульфонамід N-[2,4-біс-трифторметилбензоїл]-3MS (ES): [М-Н] 414,0049 фторфенілсульфонамід 21 Приклад 85 N-[2-хлор-4-бромбензоїл]-4хлорфенілсульфонамід До 8мл реакційної посудини вносять 2-хлор4-бромбензойну кислоту (0,39ммоль, 1,5екв.) та 2,0мл дихлорметану. Додають концентрований розчин (4,0мл), що містить 4хлорфенілсульфонамід (0,26ммоль, 1екв.) та N,N-[диметил]-4-амінопіридин (48мг, 0,39ммоль, 1,5екв.) у дихлорметані, потім 0,261г карбодіімідполістиролу (2,0ммоль/г, 0,52ммоль, 2,0екв., Novabiochem), пробірку закривають пробкою і центрифугують. Через 72год. додають 0,77г сульфованого полістиролу (MP-TsOH) (1,53ммоль/г, 1,17ммоль, Argonaut). Через приб 74889 22 лизно 18год. одержану реакційну суміш фільтрують, і концентрують у потоці азоту. Одержаний залишок піддають високоефективній рідинній хроматографії з оберненою фазою; колонка CombiPrep, колонка YMC ODS-A 20X50мм (5мкм), С18, розмір пор 120Å, градієнтне елюювання: 5%-95% CH3CN/0,01 водний розчин НСІ. Фракції, що містять продукт, об'єднують, і концентрують під зниженим тиском з одержанням цільової сполуки. ESIMS: m/e=408(M++1), 406(М+-1), 410(М++3). Сполуки Прикладів 86-107 одержують по суті як описано у Прикладі 85. Приклад № Продукт 86 N-[2,4-дихлорбензоїл]-4-метилфенілсульфонамід 87 N-[2,4-дихлорбензоїл]-4-метилтіофенілсульфонамід N-[2,4-дихлорбензоїл]-4-трет88 бутилфенілсульфонамід N-[2,4-дихлорбензоїл]-3-хлор-489 метилфенілсульфонамід N-[2-метил-4-хлорбензоїл]-390 бромфенілсульфонамід 91 N-[2,4-дихлорбензоїл]-4-фторфенілсульфонамід 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 Мас-спектрометричні дані (т/е) ESIMS: 342 (М+-1),344 (М++1) ESIMS: 374 (М+-1),376 (М++1) ESIMS: 384 (М+-1), 386 (М++1) ESIMS: 378 (М++1), 376 (М+-1), 380 (М++3) ESIMS: 388 (М++1), 386 (М+-1), 390 (М++3) ESIMS: 346 (M+-1), 348 (M++1) ESIMS: 398 (M++1), 396 (M+-1), 400 N-[2,4-дихлорбензоїл]-3,4-дихлорфенілсульфонамід (M++3) N-[2-метил-4-хлорбензоїл]-4-хлорфенілсульфонамід ESIMS: 342 (M+-1), 344 (M++1) N-[2,4-дихлорбензоїл]-4-бромфенілсульфонамід ESIMS: 408 (M+1), 406 (M-1), 410 (M+3) N-[2,4-дихлорбензоїл]-4ESIMS: 422 (M-2), 424 (M), 426 (M+2) метилсульфонілоксифенілсульфонамід N-[2,4-дихлорбензоїл]-4ESIMS: 412 (M-2), 414 (M), 416 (M+2) трифторметоксифенілсульфонамід N-[2,4-дихлорбензоїл]-4-метокси-3,5ESIMS: 368 (M-2), 370 (M), 372 (M+2) диметилфенілсульфонамід N-[2,4-дихлорбензоїл]-4ESIMS: 371 (M-2), 373 (M) диметиламінофенілсульфонамід N-[2,4-біс-трифторметилбензоїл]-4ESIMS: 430 (M-1), 432 (M+1) хлорфенілсульфонамід N-[2-метил-4-бромбензоїл]-4ESIMS: 430 (M-3), 432 (M-1), 434 (M+1) бромфенілсульфонамід N-[2-хлор-4-нітробензоїл]-4-фторфенілсульфонамід ESIMS: 357 (M-1) N-[2-хлор-3-метилбензоїл]-4-хлорфенілсульфонамід ESIMS: 342 (M-1) 344 (M+1) N-[2,4-дихлорбензоїл]-4-нітрофенілсульфонамід ESIMS: 373 (M-1) 375 (M+1) N-[2-метил-4-хлорбензоїл]-3,4ESIMS: 378 (M+1) 376 (M-1) 380 (M+3) дихлорфенілсульфонамід N-[2-метил-4-хлорбензоїл]-4-третESIMS: 364 (M-1) 366 (M+1) бутилфенілсульфонамід N-[2-метил-4-хлорбензоїл]-3ESIMS: 333 (M-1) ціанофенілсульфонамід N-[2,4-дихлорбензоїл]-4-[1,2,4]триазол-4-іл395 (M) фенілсульфонамід Приклад 108 N-[2,4-дихлорбензоїл]-4-(1метилсульфанілфен-4-іл)фенілсульфонамід Стадія А: Методика активації смоли Поліамід (фірмова назва Rink) (фірма СА Novabiochem, 0,53ммоль/г) суспендували у 30% розчині піридину у диметилформаміді, і перемішували при кімнатній температурі впродовж 3год. Одержану суміш фільтрували, і згадану смолу двічі промивали диметилформамідом, потім по чергово СН2СІ2 та МеОН. Активовану смолу з вільною аміногрупою сушили, і застосовували без додаткового очищення. Поліамід (фірмова назва Rink) (0,53ммоль/г) суспендували у суміші (1:1) СН2СІ2/THF та Et3N (4екв.), 4-йодофенілсульфонаміду (3екв.) та DMAP (каталітична кількість). Одержаний розчин перемішували при кімнатній температурі впродовж ночі. Одержану суміш фільтрували, і смолу почергово промивали СН2СІ2 та МеОН. Одержа 23 74889 24 ний 4-йодофенілсульфонамід сушили під вакуудукт, об'єднують та концентрують під зниженим мом. тиском з одержанням цільової сполуки. Відповідний 4-йодофенілсульфонамід MS(ES): m/e=329,9 (М++1), 327,9 (М+-1). (0,26ммоль, 0,53ммоль/г), метилсульфанілфенілПриклад 111 борну кислоту (2екв.), карбонат калію (6екв.) та N-[2,4-дихлорбензоїл] -4ацетат паладію (0,5екв.) змішували, і суспендухлорфенілсульфонамід вали у 7мл суміші (6:1) діоксану/води. Цю суміш Згадану цільову сполуку одержали практично згідно з описом Прикладу 110 із суміші 4нагрівали у Argovant QUEST 210 при темперахлорфенілсульфонаміду (0,1моль; 19,0г) та 2,4турі 100°С впродовж 24год. Після цього згадану дихлорбензоїлхлориду (0,12моль; 16,8мл). смолу двічі промивали 5мл суміші (6:1) діоксаMS(ES): m/e=363,9 (M+). ну/води, потім шість разів СН2СІ2 (7мл) із промиЕА (елементний аналіз): Обчислено для ванням після кожного разу МеОН (7мл). C13H8Cl3NO3S: Теоретично: С, 42,82; Н, 2,21; N, 3мл 95% водного розчину трифтороцтової 3,84. Встановлено: С, 42,56; Н, 2,14; N, 3,76. кислоти додавали до згаданої смоли, попередньо Приклад 112 розчиненої у 3 мл СН2СІ2. Одержану суміш переN-[2-хлор-4-бромбензоїл]-4мішували впродовж 30хв. при кімнатній темперахлорфенілсульфонамід турі, і фільтрували, як описано вище. 4'До реакційної суміші 4метилсульфанілдифеніл-4-сульфонамід застосохлорфенілсульфонаміду (15,6г, 81,4ммоль), CDI вували без додаткового очищення. (15,82г, 97,7ммоль) та етилацетату (300мл) при До перемішуваного розчину 2,4кімнатній температурі впродовж 15,0хв. додають дихлорбензойної кислоти (1,25екв.) у сухому суспензію 2-хлор-4-бромбензойної кислоти (23,0г, СН2СІ2 (10мл/ммоль) однією порцією додавали 97,7ммоль) у етилацетаті (100,0мл) (примітка: 4'-метилсульфанілдифеніл-4-сульфонамід спостерігається виділення газу, яке може контро(1,0екв.), потім EDC (1,25екв. або 1,5екв.) і, налюватись швидкістю додання суспензії; реакційна решті, DMAP (1,2екв.). Одержану суміш енергійно суміш переходить до розчину на кінець додання перемішували у атмосфері азоту впродовж згаданої суспензії; проходження реакції можна 16год., потім випарювали in vacio, і одержаний контролювати засобами високоефективної рідинзалишок розподіляли поміж EtOAc та водою. ної хроматографії або тонкошарової хроматогОдержаний органічний шар промивали IN HCl (4 рафії із застосуванням суміші (1:1) етилацетарази, 20мл/ммоль), потім водну фазу екстрагувату/гептану як елюенту). Після цього реакційну ли EtOAc (двічі, 20мл/ммоль). Одержані органічні суміш перемішують при кімнатній температурі шари кінець-кінців промивали водою та розсовпродовж 30хв, після чого нагрівають при темпелом, сушили над Na2SO4, і концентрували in ратурі 60°С впродовж 90хв. або доти, доки не vacio. Неочищений продукт очищали шляхом припиниться виділення газу. Одержану реакційну хроматографування на силікагелі із застосувансуміш охолоджують до температури 40°С, і доням відповідного елюенту з одержанням цільової дають 1,8-діазабіцикло[5.4.0]ундец-7-єн (14,63мл) сполуки. (весь одразу). Температура реакційної суміші ESI-MS (M+-H) 450,9870/450,0. підвищується з 40°С до 45°С. Одержану реакційПриклад 109 ну суміш перемішують доти, доки її температура N-[2,4-дихлорбензоїл]-4-3'не досягне рівня кімнатної температури, після ацетилдифенілсульфонамід чого реакцію швидко припиняють доданням хоСуспензію 4-йодофенілсульфонаміду лодної деіонізованої води (400мл). Верхній орга(0,26ммоль, 0,53ммоль/г), 3-ацетилфенілборної нічний шар відокремлюють, промивають IN HCІ кислоти (2екв.) та 2,4-дихлорбензойної кислоти (300,0мл), висушують за допомогою безводного (1,25екв.) застосовували по суті як описано у MgSO4, фільтрують, і осад промивають етилацеПрикладі 108 з одержанням цільової сполуки. татом (20,0мл). Одержаний фільтрат концентруESI-MS (M+-H) 447,0099/446,0. ють з одержанням сиропоподібного розчину Приклад 110 (50,0г), після чого з енергійним перемішуванням N-[2,4-дихлорбензоїл]фенілсульфонамід додають гептан (250,0мл). Під час нагрівання До суміші фенілсульфонаміду (0,16моль, одержують суспензію білого кольору, яку нагрі25,12г) та карбонату калію (0,2моль, 27,6г) у вають зі зворотним холодильником, після чого 500мл діоксану крапля за краплею додавали 2,4витримують з охолодженням до кімнатної темпедихлорбензоілхлорид (0,13моль, 18,0мл). Одерратури. Осад білого кольору відфільтровують і жану суміш нагрівали зі зворотним холодильнипромивають гептаном (20,0мл). Одержаний осад ком у атмосфері азоту впродовж 16год. Після висушують у вакуум-сушільній печі при темперацього одержану реакційну суміш розбавляли вотурі 55°С впродовж 18год. (маса=29,12г, вихід дою (500мл), нейтрализували до pH 5 концентро87,4% (мас.)). ваною хлористоводневою кислотою, і тричі екстСуміш 19,17г згаданого продукту та етилацерагували етилацетатом. Об'єднані етилацетатні тату/гептану (1:2, 150,0мл) нагрівають зі зворотшари промивали насиченим водним розчином ним холодильником впродовж 30хв., після чого хлориду натрію, сушили над сульфатом натрію, і охолоджують до кімнатної температури. Осад не концентрували під зниженим тиском з одержанзовсім білого кольору відфільтровують і потім ням твердої речовини білого кольору. Одержаний промивають гептаном (50,0мл). Одержаний осад твердий залишок піддавали хроматографуванню висушують у вакуум-сушільній печі при темперана силікагелі з елююванням дихлорметаном, що турі 50°С впродовж 18год. (маса=14,93г, вихід містив 0-5% метанолу. Фракції, що містять про 25 74889 26 78%). фторбензамідину (0,025г, 0,133ммоль) та 3-хлорESIMS: m/e=408(M++1), 406(М+-1), 410(М++3). 4-фторфенілсульфонілхлориду (0,0304г, Приклад 113 0,133ммоль); згадану цільову сполуку одержують Натрієва сіль N-[2-хлор-4-бромбензоїл]-4по суті як описано у Прикладі 115. Іони, що спохлорфенілсульфонаміду стерігаються при ES PI MS [М+Н]+: m/z 365 (35Сl, 35 35 37 37 37 До розчину N-[2-хлор-4-бромбензоїл]-4Сl), m/z 367 ( Сl, Сl) та m/z 369( Сl, Сl). хлорфенмсульфонаміду (5,2г, 12,72ммоль) та Приклад 117 трет-бутилметилового ефіру (88,0мл) при кімнатN-[2,4-дихлорбензоїл]-4ній температурі додають метоксид натрію (0,69г, гідроксифенілсульфонамід 12,72ммоль) (весь одразу). Після цього одержану 4-метоксифеніл-4-сульфонамід (0,0608г, реакційну суміш перемішують впродовж 5год., і 0,132ммоль) розчиняють у тетрагідрофурані додають гептан (88,0мл) з подальшим енергійним (1,25мл), і обробляють тетрабутиламонію фториперемішуванням впродовж 60хв. Осад білого дом (1,0N/THF; 200мкл, 2,0ммоль) при кімнатній кольору відфільтровують під надлишковим тистемпературі з перемішуванням впродовж 18год. ком азоту, після чого промивають гептаном Одержану реакційну суміш розбавляють EtOAc (10мл), і промивають насиченим водним розчи(2 44,0мл). Осад підсушують до напівсухого станом NH4CI (1мл), Н2О (2 1мл) та розсолом (1мл). ну, після чого висушують у вакуум-сушільній печі при температурі 130°С впродовж 18год. (маОдержану органічну фазу висушують за допомоса=4,4г, вихід 80% (мас.)). 1Н ЯМР (DMSO d6) 7,8гою MgSO4, фільтрують та концентрують на ро7,85 (m, 1Н), 7,81-7,82 (m, 1Н), 7,58-7,59 (d, 1H, торному випарнику. (Ліофілізують із Н2О/МеОН з J=1,76Гц), 7,51-7,52 (m, 1Н), 7,48-7,49 (m, 1Н), одержанням склоподібної твердої речовини, 20мг 7,44-7,45 (d, 1Н, J=1,76Гц) 7,37-7,4 (d, 1Н). (0,058ммоль, 58%). Очищають засобами препаПриклад 114 ративної високоефективної рідинної хроматограN-[3-хлор-4-фторфенілсульфоніл]-3-фтор-4фії. т.пл.=155-157°С; ESI-MS m/е 344,0 (М+ - Н); 1 метилбензамідин Н ЯМР (d6-DMSO) 7,90 (d, 2 Η); 7,68 (s, 1 Η); 7,44 До 3-хлор-4-фторфенілсульфонілхлориду (s, 2 Η); 6,90 (d, 2H); 3,43 (br s, 3H). (0,0304г, 0,133ммоль) додають спочатку розчин Приклад 118 гідрохлориду 3-фтор-4-метилбензамідину (0,025г, N-[2,4-дихлорбензоїл]-4-(тієн-30,133ммоль) у тетрагідрофурані (0,5мл), потім іл)фенілсульфонамід №метилморфолін (0,2мл). Одержану реакційну До розчину N-(2,4-дихлорбензоїл)-4суміш концентрують і піддають високоефективній йодофенілсульфонаміду (0,10ммоль) у толуорідинній хроматографії з оберненою фазою (гралі/етанолі (20/1, 3мл) додають 3-тіофенборонову дієнт 5-95% (0,1% розчин трифтороцтової кислокислоту (0,18ммоль, 0,18мл, 1,0Μ розчин у димети у CH3CN) у (0,1% розчин трифтороцтової кистилформаміді) та тетракіслоти у Н2О). Було виділено тверду речовину (трифенілфосфін)паладій (0) (10% (моль)). Після білого кольору (16,4мг, 36%). Іони, що спостеріцього додають 2Μ водний розчин Na2CO3 (0,3мл), гаються при ES PI MS [М+Н]+: m/z 345 (35Сl) та і перемішувану суміш нагрівають при температурі m/z 347 (37Сl). 100°С впродовж ночі (17год.) (система Buchi Приклад 115 Syncore). Одержану реакційну суміш концентруN-[3-хлор-4-фторфенілсульфоніл]-4ють (апарат Genevac), після чого додають воду хлорбензамідин (2,5мл) та етилацетат (5мл). Одержані фази відоГідрохлорид 4-хлорбензамідину (0,025г, кремлюють, і водний шар екстрагують етилаце0,133ммоль) та 3-хлор-4татом (3 5мл). Цей процес здійснюється автомафторфенілсульфонілхлорид (0,0304г, тично за допомогою системи Тесаn. Розчинники 0,133ммоль) застосовували по суті як описано у випарюють, відповідний неочищений продукт Прикладі 114 з одержанням згаданої цільової очищають засобами високоефективного рідинносполуки. Іони, що спостерігаються при ES PI MS го хроматографування з одержанням згаданої [М+Н]+: m/z 347 (35Сl, 35Сl), m/z 349 (35Сl, 37Сl) та цільової сполуки. m/z 351 (37Сl, 37Сl). ESI-MS m/е 410,96/410,0 [М+-Н]. Приклад 116 Сполуки Прикладів 119-130 одержують по суN-[3-хлор-4-фторфенілсульфоніл]-3-хлор-4ті як описано у процедурі Прикладу 118. фторбензамідин Суміш гідрохлориду 3-хлор-4 27 Приклад № 119 120 121 122 123 124 125 126 127 128 129 130 74889 28 Продукт N-[2,4-дихлорбензоїл]-4-(1-трифторметилфен-4іл)фенілсульфонамід N-[2,4-дихлорбензоїл]-4-(1-фторфен-3іл)фенілсульфонамід N-[2,4-дихлорбензоіл]-4-фуран-2-іл-фенілсульфонамід N-[2,4-дихлорбензоїл]-4-(1-метоксифен-2іл)фенілсульфонамід N-[2,4-дихлорбензоіл]-4-(1-метоксикарбонілфен-4іл)фенілсульфонамід N-[2,4-дихлорбензоїл]-4-хінолін-8-іл-фенілсульфонамід N-[2,4-дихлорбензоїл]-3-хінолін-8-іл-фенілсульфонамід N-[2,4-дихлорбензоіл]-4-фур-3-іл-фенілсульфонамід N-[2,4-дихлорбензоїл]-4-піридин-3-іл-фенілсульфонамід N-[2,4-дихлорбензоїл]-3-дифенілсульфонамід N-[2,4-дихлорбензоїл]-4'-метокси-4-дифенілсульфонамід N-[2,4-дихлорбензоїл]-4-тіофен-2-іл-фенілсульфонамід Усі сполуки, що мають відношення до цього винаходу, є придатні для перорального застосування і, як правило, вводяться пероральним шляхом, тому перевага віддається пероральному введенню. Однак пероральне введення не є єдиним шляхом або не є навіть єдиним шляхом, якому віддається перевага. Наприклад, для пацієнтів, які є забудькуватими або невдоволені пероральним застосуванням лікарського засобу, дуже бажаним може бути трансдермальне введення; інтравенозному шляху може віддаватись перевага з точки зору зручності або для запобігання можливих ускладнень, пов'язаних із пероральним застосуванням. За особливих обставин, сполуки Формули II можуть також вводитись підшкірним, внутрішньом'язовим, інтраназальним або інтраректальним шляхом. Шлях введення може змінюватись будь-яким чином, з огляду на обмеження, що накладаються фізичними властивостями лікарських засобів, зручністю для пацієнта та особи, яка доглядає за хворим, та інші відповідні обставини [Remington's Pharmaceutical Sciences. 18-те видання, Mack Publishing Co. (1990)]. Згадані фармацевтичні композиції одержують способом, добре відомим у фармацевтичній галузі. Носій або наповнювач може бути твердим, напівтвердим або рідким матеріалом, який може прислужуватись як розчинник або середовище для активного інгредієнта. Придатні носії або наповнювачі є добре відомими у цій галузі техніки. Фармацевтична композиція може бути пристосованою для перорального, інгаляційного, парентерального або місцевого застосування і може вводитись пацієнту у формі таблеток, капсул, аерозолей, лікарських форм для інгаляції, супозиторіїв, розчинів, суспензій тощо. Згадані сполуки за цим винаходом можуть вводитись пероральним шляхом, наприклад, з інертним розріджувачем для капсул, або пресуватись з одержанням таблеток. З метою перорального терапевтичного введення згадані сполуки можуть змішуватись із наповнювачами і застосовуватись у формі таблеток, пастилок, капсул, еліксирів, суспензій, сиропів, облаток, жувальних гумок тощо. Ці препарати повинні містити що Мас-спектрометричні дані (m/е) ESI-MS m/е 472,99/472,2 [М+-Н] + ESI-MS m/е 422,99/422,0 [М -Н] ESI-MS m/е 394,98/394,2 [М+-Н] ESI-MS m/е 435,01/434,0 [М+-Н] ESI-MS m/е 447,07/446,0 [М+-Н] ESI-MS m/е 456,01/455,1 [М+-Н] ESI-MS m/е 456,01/457,2 [М++Н] ESI-MS m/е 394,98/394,0 [М+-Н] ESI-MS m/е 406,0 [М -Н] ESI-MS m/е 405,1 [М -Н] ESI-MS m/е 435,2 [М -Н] ESI-MS m/е 411,1 [М -Н] найменше 4% сполуки за цим винаходом як активного інгредієнта, однак вміст може коливатись у залежності від конкретної форми, і може, звичайно, складати від 4% до приблизно 70% (мас.) лікарської форми. Кількість згаданої сполуки, присутня у композиціях, є такою, що буде одержуватись відповідна доза. Композиції та препарати за цим винаходом, яким віддається перевага, можуть визначатись способами, добре відомими досвідченому фахівцю. Таблетки, драже, капсули, пастилки тощо можуть також містити один або декілька таких ад'ювантів: в'яжучі речовини, наприклад, повідон, гідроксипропілцелюлозу, мікрокристалічну целюлозу або желатин; наповнювачі або розріджувачі, наприклад, крохмаль, лактозу, мікрокристалічну целюлозу або дикальційфосфат; дезінтеграційні агенти, наприклад, кроскармелозу, кросповідон, натрійглікозилований крохмаль, кукурудзяний крохмаль тощо; змащувальні речовини, а саме: стеарат магнію, стеаринову кислоту, тальк або гідрогенізовану рослинну олію; ковзні речовини, наприклад, колоїдний діоксид силікону; змочувальні компоненти, наприклад, лаурилсульфат натрію та полісорбат 80 (CAS №9005-65-6); можуть додаватись підсолоджуючі речовини, наприклад, цукроза, аспартам або сахарин або коригенти, наприклад, м'ята перцева, метилсаліцилат або апельсиновий ароматизатор. У разі, коли лікарською формою є капсула, вона може містити, на додаток до матеріалів вищезгаданого типу, рідкий носій, наприклад, поліетиленгліколь або жирну олію. Інші лікарські форми можуть містити різні інші матеріали, які модифікують фізичну форму лікарської форми, наприклад, покриття. Так, таблетки або драже можуть бути покриті цукром, гідроксипропілметилцелюлозою, поліметакрилатами або іншими покривними матеріалами. Сиропи можуть містити, на додаток до цих сполук, цукрозу як підсолоджуючу речовину та певні консерванти, барвники, забарвлювальні речовини та коригенти. Матеріали, що застосовуються для одержання різних згаданих композицій, повинні бути фармацевтично чистими і нетоксичними у застосованих кількостях. Ін'єкції для парентерального введення вклю 29 74889 30 чають стерильні водні або неводні розчини, сурогатої худоби. HUVEC інкубували при темпераспензії та емульсії. Водні розчини та суспензії турі 37°С впродовж 72год. у зволоженій 5% атмоможуть містити дистильовану воду для ін'єкцій сфері діоксиду вуглецю/повітря. До лунок вносиабо фізіологічний розчин. Неводні розчини та ли реактив для проліферації клітин WSТ-1 суспензії можуть містити пропіленгліколь, поліе(20мкл; Boehnnger Mannheim, Indianapolis, Індіатиленгліколь, рослинну олію, наприклад, оливкона), і планшети знову інкубували впродовж 1год. ву олію, спирт, наприклад, етанол або полісорбат Визначали оптичну густину кожної лунки при 80. Ін'єкції можуть включати додаткові інгредієн440нм. Долю росту визначали за оптичною густити, окрім інертних розріджувачів, наприклад, конною оброблених лунок з/без VEGF, поділеною на серванти, змочувальні компоненти, емульгатори, оптичну густину, визначену для контрольних лудиспергувальні речовини, стабілізатори (напринок, виставлених на нуль та 1,0. У цьому аналізі клад, лактозу), допоміжні речовини, наприклад, випробуванню піддавались зразкові сполуки, усі з речовини, що сприяють розчиненню (наприклад, яких продемонстрували ІС50 1,0мкМ. глутамінова кислота або аспарагінова кислота). Аналіз на мікропорожнинах пацючої рогівки Вони можуть стерилізуватись, наприклад, фільтПацюків-самиць лінії Fisher 344 (145-155г; руванням через бактеріальний фільтр, включенTaconic, Inc., Germantown, Нью-Йорк) анестезуням стерилізаційних речовин до композицій або вали ацепромазином (2,5мг/кг, внутрішньоочереопромінюванням. Вони можуть також виготовлявинно) за 20хв. до започаткування вдихання 2-3% тись у формі стерильних твердих композицій, які суміші ізофурану/кисню. Температуру тіла підтможуть розчинятись у стерильній воді або якоримували за допомогою грілки-матрацу з циркумусь іншому стерильному розчиннику(ах) для люючою гарячою водою. Хірургічне втручання ін'єкції безпосередньо перед застосуванням. здійснювали із застосуванням офтальмологічного Сполуки Формули II є, взагалі, ефективними у операційного мікроскопу (OMS.75 Operating широкому діапазоні доз. Наприклад, добова доза, Microscope, TopCon Corporation, Японія). Лезом як правило, становить від приблизно 10мг/кг до скальпелю (№15) робили прямолінійний вертикаприблизно 300мг/кг маси тіла. У деяких випадках льний розріз рогівки на половину її товщини у дози нижче нижньої межі згаданого діапазону латеральному, відносно центру ока, напрямку. можуть виявитись більше ніж адекватними, у той Кінцем леза скальпеля обережно піддівали верхчас як у інших випадках можуть застосовуватись ній шар рогівки якнайближче до краю. Порожнину ще більші дози без спричинення жодного шкідлиу рогівці утворювали шляхом відшарування за вого побічного ефекту, тому згаданий діапазон допомогою ножиць для рогівки (Roboz, Rockville, дозування не є призначеним для будь-якого обМериленд). Нітроцелюлозні фільтри (0,45мкм, меження обсягу цього винаходу. Слід розуміти, МіІІіроге, Bedford, Массачусетс) різали на невещо фактична введена кількість сполуки буде виликі диски за допомогою голки-перфоратора 20 значатись лікарем у світлі відповідних обставин, калібру (0,811мм). Одержані диски просочували у тому числі, стану, призначеного для лікування, 2мкл розчину людського VEGF (0,82мкг/мкл; R&D обраного шляху введення, фактичної введеної Systems) або основним людським фактором россполуки або сполук, віку, маси та реакції індивіту фібробластів (0,20мкг/мкл; R&D Systems) дуального пацієнта та тяжкості симптомів згадавпродовж 10хв. на льоду. Згадані диски, просоного пацієнта. чені ангіогенним фактором (VEGF або bFGF), за Пригнічення проліферації HUVEC допомогою пінцета вставляли до рогівкової поКлітини ендотелію людської пупкової вени рожнини таким чином, що диск надійно накривав(HUVEC; BioWhittaker/Clonetics, Walkersville, Меся епітелієм рогівки. Тварин обробляли сполукою риленд) підтримували на середовищі для вироПрикладу 110 (160мг/кг) (яку вводили перорально щування ендотеліальних клітин (EGM), що містиза допомогою шлункового зонда) у забуференоло основне живильне середовище (ЕВМ) з му фосфатом фізіологічному розчині один раз на екстрактом головного мозку великої рогатої худобу впродовж 1-10 днів після імплантації згададоби, людським епідермальним фактором росту, них дисків. Очі фотографували на 7 день та 14 гідрокортизоном, гентаміцином, амфотерицином день після імплантації дисків. Для фотографуВ та 2% сироватки зародка великої рогатої худовання тваринам місцево вводили атропіну сульби. Для проведення аналізів HUVEC (5 103) у фат (AmTech Group, Inc., Phoenix Scientific, Inc., ЕВМ (200мкл) з 0,5% сироватки зародка великої St. Joseph, Міссурі) для розширення зіниць і анерогатої худоби вносили до лунок 96-лункового стезували 2-3% сумішшю ізофурану/кисню. Очі культурального планшета та інкубували при темфотографували за допомогою офтальмологічнопературі 37°С впродовж 24год. у зволоженій 5% го мікроскопа, і зображення зберігали за допомоатмосфері діоксиду вуглецю/повітря. Експеримегою програми Image Pro-Plus. Зображення аналінтальні сполуки послідовно розбавляли диметизували шляхом перетворення ділянок, які лсульфоксидом (DMSO) у концентраціях від викликали інтерес, на висококонтрастні чорно-білі 0,0013мкМ до 40мкМ, і вносили до лунок 20мкл негативні зображення, і підраховували світлі міпорціями. Після цього до лунок вносили людсьнімальні елементи зображення, як визначення кий фактор росту ендотелію кровоносних судин васкуляризованої ділянки. Наведені дані були (VEGF) (20нг/мл на лунку; R&D Systems, одержані із зображень щонайменше 6 очей. СпоMinneapolis, Міннесота), який одержували з конлука Прикладу 110 виявилась дуже ефективним центрованого розчину (100мкг/мл) у забуфереінгібітором неоангіогенезу, індукованого VEGF, ному фосфатом фізіологічному розчині, що місале вона не була ефективним інгібітором неоантив 0,1% сироваткового альбуміну великої гіогенезу, індукованого bFGF. 31 74889 32 Пригнічення росту клітин карциноми товстої 56 16,8 121 24,5 кишки НСТ116. 57 5,0 122 25,8 Клітини карциноми товстої кишки людини 59 15,0 123 37,7 НСТ116 вирощували як моношарову культуру на 60 6,6 124 5,6 живильному середовищі RPMI 1640, доповнено61 14,2 126 18,5 му 10% сироватки зародка великої рогатої худоби та 1% суміші пеніциліну-стрептоміцину Аналізи звичайних пухлин мишей та людсь(GibcoBRL, Grand Island, Нью-Йорк). Клітини ких пухлинних ксенотрансплантатів НСТ116 у експоненційній фазі росту обробляли Пригнічення пухлин, трансплантованих миекспериментальними сполуками різної концентшам, є загальноприйнятою методикою вивчення рації при температурі 37°С впродовж 72год. у 5% ефективності протипухлинних засобів [Корбетт суміші діоксиду вуглецю/повітря. Після обробки (Corbett) та інші, In vivo Methods ibr Screening and згаданим засобом, клітини промивали 0,9% заPreclinical Testing: Use of rodent solid tumors for буференим фосфатом фізіологічним розчином. drug discovery., У: Anticancer Drug Development Пригнічення росту визначали за допомогою реакGuide: Preclinical Screening, Clinical Trials, and тиву для проліферації клітин WST-1, як описано Approval, під редагуванням Б. Тейчер (В. Teicher), вище. Результати виражені як доля росту обробHumana Press Inc., Totowa, Нью-Йорк, розділ 5, лених клітин, порівняно з контрольними культустор.75-99 (1997); (Корбетт (Corbett) та інші, Int. J. рами. Репрезентативні сполуки за цим винахоPharmacos.. 33, Supplement, 102-122 (1995)]. Пудом перевіряли на ефективність проти людських хлини мишей або людські ксенотрансплантати клітин пухлини товстої кишки НСТ116. Дані цих імплантували по суті як описано [Корбетт експериментів узагальнені у Таблиці І. (Corbett) у In vivo Methods for Screening and Preclinical Testing: Use of rodent solid tumors for Таблиця І drug discovery]. Стисло, мишачу пухлину або людський ксенотрансплантат імплантували підшПриклад IC50 (мкМ) Приклад IC50 (мкМ) кірно з використанням або троакарових (12 калібр 1 4,2 62 19,3 (2,052мм)) імплантатів або підрахованої кількості 3 2,5 63 24,7 клітин. Троакар вводили посередині між пахво5 3,8 64 18,2 вою та паховою ділянками на боці миші. Троакар 6 4,0 70 16,9 вводили приблизно на 3/4 дюйма (19,049мм) пі9 1,7 73 8,3 дшкірно у напрямку пахвової ділянки перед введенням фрагмента пухлини; шкіру при видаленні 10 12,1 79 5,2 троакару прищемляли. За альтернативним варіа11 5,5 80 12,3 нтом людські пухлинні клітини, одержані з гомо14 40,0 81 11,3 генату донорських пухлин (5 106 клітин), імплан15 10,4 82 12,4 тували підшкірно у задню лапку "голої" миші16 3,8 86 1,6 самиці або самця (фірма Charles River). Експери17 15,8 87 5,5 ментальну сполуку у носії або сам носій вводили 18 9,3 88 4,8 шляхом інтравенозної ін'єкції (iv) ударної дози, 20 2,4 89 4,8 внутрішньоочеревинної ін'єкції (ір) або за допо21 30,4 90 4,5 могою шлункового зонда (ро). Кожна експеримен23 15,9 92 17,4 тальна група у кожному експерименті, а також 24 37,1 93 18,1 група контрольних тварин, які обробці не підда25 9,6 94 3,6 вались, складалась із п'яти тварин на групу. Під26 6,1 95 4,3 шкірну пухлинну реакцію контролювали шляхом 30 10,1 96 34,7 визначення об'єму пухлин, яке здійснювали двічі 32 7,8 97 7,0 на тиждень на протязі експерименту (60-120 днів). Маса тіла приймалась як загальний крите33 7,8 98 13,0 рій токсичності. Підшкірні пухлинні дані аналізу34 16,5 99 33,5 вали шляхом визначення середньої маси пухлин 35 17,0 100 9,2 для кожної експериментальної групи на протязі 36 28,4 101 12,4 експерименту або шляхом визначення затримки 37 15,5 102 6,3 росту пухлин як різницю у днях до досягнення 38 13,9 103 11,9 пухлинами (пухлини експериментальні порівняно 41 14,5 104 22,2 з контрольними) об'єму 500мм3 або 1000мм3. 42 3,3 105 14,8 Сполуку прикладу 110 перевіряли проти ціло44 18,7 106 4,6 го ряду мишачих та людських пухлин по суті, як 45 20,7 108 16,0 описувалось вище. Дані цих експериментів уза46 4,8 109 25,1 гальнені у Таблицях ll-Хlll. Параметри, визначені 47 8,7 110 3,5 у кожному експерименті, узагальнені у подаль49 14,7 111 15,0 ших параграфах. 50 10,5 112 2,8 Маса пухлини (мг)=(a b2)/2, де а=довжина пухлини (мм) та b=ширини пухлини (мм). 51 26,7 115 33,6 Затримка росту пухлини=Т-С. де Τ - середній 53 11,2 116 5,9 період часу (дні), необхідний для того, щоб пух55 9,5 117 12,4 33 74889 34 лини експериментальної групи досягли визначеЕ/К4,5 5/5 ++++ a Лікарський засіб вводили інтравенозним шляхом у дозі 80мг/кг на день 3; 160мг/кг на день 4; 240мг/кг на день 5; та ін'єкцією двічі на добу у дозі 120мг/кг на дні 7-9. b Лікарський засіб вводили інтравенозним шляхом у дозі 40мг/кг на день 3; 80мг/кг на день 4; та ін'єкцією чотири рази на добу у дозі 160мг/кг на дні 5-9. c Лікарський засіб вводили інтравенозним шляхом у дозі 20мг/кг на день 3; 40мг/кг на день 4; та ін'єкцією чотири рази на добу у дозі 106мг/кг на дні 5-6. Таблиця III Рання стадія аденокарциноми-16/С молочної залози мишей (миші-самиці лінії С3Н, CRL-Kingston) Найнижчий рівень Загибель, спричиЗагальна дозменшення маси нена лікарським за (мг/кг) тіла (%) засобом 0 +0,0% 0/5 (вливання +10,8 0/4 розріджувача) a 560 загибель 5/5 560b +10,9% 0/4 680c +7,6% 0/5 a Відсутність % Е/К Затримка LOG ураОцінка акпухлин на 14 маси росту (дні) ження тивностІ день 0/5 60% 0,7 0,22 0/4 37% 39% загибель 2,0 2,5 0,6 0,75 0/5 0/4 0/5 загибель + + Лікарський засіб у дозі 560мг/кг вводили шляхом інтравенозного вливання впродовж 3год. на день 3. Лікарський засіб у дозі 280мг/кг вводили шляхом інтравенозного вливання на дні 3 та 7. c Лікарський засіб вводили інтравенозним шляхом у дозі 80мг/кг на ін'єкцію на дні 3-6; 120мг/кг на ін'єкцію на дні 7-9. b 35 74889 36 Таблиця IV Рання стадія аденокарциноми - СТ116 товстої кишки людини (миші-самиці лінії Balb/C SCID, NCI) Загальна доза (мг/кг) 0 560а 280b a b Найнижчий рівень Загибель, спричиВідсутність % Е/К Затримка LOG Оцінка актизменшення маси нена лікарським пухлин на маси росту (дні) ураження вності тіла (%) засобом 115 день -4,2% 0/5 -4,0% 0/5 0% 56 6,7 2/5 ++++ 0% 0/5 0% 28 3,4 2/5 ++++ Лікарський засіб вводили інтравенозною ін'єкцією у дозі 140мг/кг на дні 3, 4, 5 та 9. Лікарський засіб вводили інтравенозною ін'єкцією у дозі 70мг/кг на дні 3, 4, 5 та 9. Таблиця V Рання стадія чутливої до таксолу аденокарциноми №15/0 товстої кишки людини (миші-самиці лінії Balb/C SCID, NCI) Загальна доза(мг/кг) 0 420а a Найнижчий рівень Загибель, спричиВідсутність %Е/К Затримка LOG ураОцінка актизменшення маси нена лікарським пухлин на маси росту (дні) ження вності тіла (%) засобом 151 день +4,3% 0/5 0/5 0% 0/5 0% 33,5 5,0 1/5 ++++ Лікарський засіб вводили інтравенозною ін'єкцією у дозі 140мг/кг на дні 3, 5 та 7. Таблиця VI Рання стадія пласкоклітинного раку легень мишей LC-12 (миші-самиці лінії Balb/C, NCI-Kingston) Найнижчий рівень Загибель, спричиВідсутність Загальна %Е/К Затримка LOG ураОцінка актизменшення маси нена лікарським пухлин на доза (мг/кг) маси росту (дні) ження вності тіла (%) засобом 174 день 0 +6,5% 0/5 0/5 640а 0% 0/4 14% 12,5 1,7 0/4 ++ 139b +1,6% 0/5 20% 15,5 2,1 0/5 +++ a Лікарський засіб вводили інтравенозною ін'єкцією у дозі 160мг/кг на дні 4, 6, 8 та 10. Лікарський засіб вводили інтравенозною ін'єкцією у дозі 107мг/кг на дні 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26 та 28. b Таблиця VII Рання стадія раку передміхурової залози людини LNCaP (миші-самиці лінії Balb/C SCID, NCI) Найнижчий рівень Загибель, спричиВідсутність Загальна %Е/К Затримка LOG ураОцінка актизменшення маси нена лікарським пухлин на доза (мг/кг) маси росту (дні) ження вності тіла (%) засобом 185 день 0 +3,9% 0/5 840а +5,6% 0/5 0 60b 7,2b 4/5 ++++ a b Лікарський засіб вводили інтравенозною ін'єкцією у дозі 140мг/кг на дні 3, 5, 7, 9, 10 та 11. Одна миша. 37 74889 38 Таблиця VIII Занедбаний рак молочної залози людини WSU-Br-1 (миші-самиці лінії Balb/C SCID, NCI) Найнижчий рівень Загибель, спричиВідсутність Загальна % Е/К Затримка LOG ураОцінка актизменшення маси нена лікарським пухлин на доза (мг/кг) маси росту (дні) ження вності тіла (%) засобом 179 день 0 +3,9% 0/5 725a +3,9% 0/5 0% 57 2,9 2/5 ++++ 500b +14% 0/5 0% 39 2,0 2/5 ++++ a b Лікарський засіб вводили інтравенозною ін'єкцією у дозі 145мг/кг на дні 11-13 та 19-20. Лікарський засіб вводили інтравенозною ін'єкцією у дозі 100мг/кг на дні 11-13 та 19-20. Таблиця IX Рання стадія раку яєчника людини BG-1 (миші-самиці лінії Balb/C SCID, NCI) Найнижчий рівень Загибель, спричиВідсутність Загальна %Е/К Затримка LOG ураОцінка актизменшення маси нена лікарським пухлин на доза (мг/кг) маси росту (дні) ження вності тіла (%) засобом 176 день 0 0% 0/5 870а -2,0% 0/5 0% 30,5 3,7 1/5 ++++ 600b -3,0% 0/5 0% 30 3,6 0/5 ++++ a b Лікарський засіб вводили інтравенозною ін'єкцією у дозі 145мг/кг на дні 3-5 та 9-11. Лікарський засіб вводили інтравенозною ін'єкцією у дозі 100мг/кг на дні 3-5 та 9-11. Таблиця Х Рання стадія мишачої карциноми-26 товстої кишки (миші-самиці лінії Balb/C, NCI-Kingston-CRL) Найнижчий рівень Загибель, спричиВідсутність Загальна %Е/К Затримка LOG ураОцінка актизменшення маси нена лікарським пухлин на 31 доза (мг/кг) маси росту (дні) ження вності тіла (%) засобом день 0 +1,8% 0/5 0/5 1600а +15% 0/5 34% 15 2.2 0/5 +++ 1305b +15% 0/5 28% 6 0,9 0/5 + 1740c +17% 0/5 34% 14 2,1 0/5 +++ a Лікарський засіб вводили інтравенозною ін'єкцією у дозі 100мг/кг двічі на добу на дні 1, 3, 5, 7, 13, 15, 17 та 21. b Лікарський засіб вводили інтравенозною ін'єкцією у дозі 145мг/кг на дні 1, 3, 5, 7, 9, 13, 15, 17 та 19. c Лікарський засіб вводили інтравенозною ін'єкцією у дозі 145мг/кг на дні 1, 2, 3, 7, 8, 13, 14, 16, 18 та 2022. Таблиця XI Рання стадія пласкоклітинного раку легень людини MRI-H165 (миші-самиці лінії Balb/C SCID, NCI) Найнижчий рівень Загибель, спричиВідсутність Загальна % Е/К Затримка LOG ураОцінка актизменшення маси нена лікарським пухлин на 55 доза (мг/кг) маси росту (дні) ження вності тіла (%) засобом день 0 0% 0/5 600а -2,1% 0/5 0% 31 3,7 0/5 ++++ a Лікарський засіб вводили інтравенозною ін'єкцією у дозі 100мг/кг на дні 3-5 та 10-12. 39 74889 40 Таблиця XII Рання стадія резистентної до таксолу аденокарциноми № 15/MDR товстої кишки людини (миші-самиці лінії Balb/C SCID, NCI) Найнижчий рівень Загибель, спричиВідсутність Загальна % Е/К Затримка LOG ураОцінка актизменшення маси нена лікарським пухлин на 38 доза (мг/кг) маси росту (дні) ження вності тіла (%) засобом день 0 0% 0/5 0/5 500a +2,1% 0/5 10% 11 1,4 0/5 ++ a Лікарський засіб вводили інтравенозною ін'єкцією у дозі 100 мг/кг на дні 3-5 та 13-14. Таблиця XIII Не дуже занедбана аденокарцинома-38 товстої кишки мишей (лікарський засіб вводили інтравенозним, підшкірним, пероральним та внутрішньоочеревинним шляхами) (миші-самиці лінії BDF1, CRL-Raleigh-NCI) Найнижчий рівень Загибель, спричиЗагальна зменшеннямаси нена лікарським доза (мг/кг) тіла (%) засобом 0 +6,5% 450 ІVа +8,9% 0/5 780 РОb +9,7% 0/3 450 РОс +6,8% 0/3 450 SCd +13,2% 0/2 450 ІРе +8,3% 0/2 %Е/К маси Затримка росту (дні) 0% 18 0% Усі виліковані 0% 22,5 5,7% 10,5 3,7% 17 LOG ураження 2,4f >4,5 3,0f 1,4f 2,2f Відсутність Оцінка пухлин на активності 161 день 0/5 2/5 ++++ З/З ++++ 2/3 ++++ 1/2 ++/++++g 1/2 +++/++++g a Лікарський засіб вводили інтравенозною ін'єкцією у дозі 150мг/кг на дні 5, 7 та 9. Лікарський засіб вводили перорально у дозі 260мг/кг на дні 5, 7 та 9. c Лікарський засіб вводили перорально у дозі 150мг/кг на дні 5, 7 та 9. d Лікарський засіб вводили підшкірною ін'єкцією у дозі 150мг/кг на дні 5, 7 та 9. e Лікарський засіб вводили внутрішньоочеревинною ін'єкцією у дозі 150мг/кг на дні 5, 7 та 9. f Log ураження лише пухлинами, що відновили ріст (середні значення). g Оцінка активності для кожної миші у експерименті. У кожному експерименті було виліковано одну мишу, що відображено оцінкою "++++". Основу іншої оцінки активності становить log ураження, обчислений для кожної миші у експерименті. b Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzoylsulfonamides and sulfonylbenzamidines for the application as antitumour agents
Автори англійськоюShih Chuan, Hipskind, Philip, Arthur
Назва патенту російськоюБензоилсульфонамиды и сульфонилбензамидины для применения как противоопухевых средств
Автори російськоюШи Чан, Хипскинд Филип Артур
МПК / Мітки
МПК: C07C 311/51, A61K 31/381, A61P 35/00, C07D 213/34, A61K 31/4196, C07D 249/08, C07C 323/67, A61K 31/235, C07C 311/50, A61K 31/18, C07D 333/18, C07D 215/12, C07D 521/00, A61K 31/47, A61K 31/341, C07D 307/38, A61K 31/4418
Мітки: засобів, застосування, протипухлинних, бензоїлсульфонаміди, сульфонілбензамідини
Код посилання
<a href="https://ua.patents.su/20-74889-benzolsulfonamidi-ta-sulfonilbenzamidini-dlya-zastosuvannya-yak-protipukhlinnikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Бензоїлсульфонаміди та сульфонілбензамідини для застосування як протипухлинних засобів</a>
Попередній патент: Пляшка для зберігання алкогольного напою
Наступний патент: Спосіб випробування безпілотного літального апарата
Випадковий патент: Кернорвач












