Похідні хіназолін-4(3н)-ону, що використовуються як інгібітори pi3-кінази
Номер патенту: 109667
Опубліковано: 25.09.2015
Автори: Мюррей Пітер Джон, Іто Казухіро, Харді Джордж, Кінг-Андервуд Джон, Браун Крістофер Джон, Брукфілд Фредерік Артур
Формула / Реферат
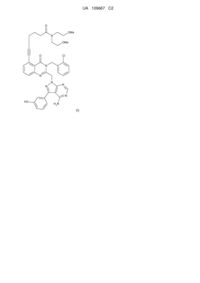
1. Сполука формули (І):
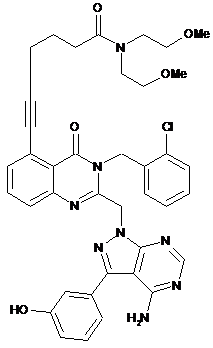 , (I)
, (I)
яка являє собою 6-(2-((4-аміно-3-(3-гідроксифеніл)-1H-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід або його фармацевтично прийнятну сіль, у тому числі всі відповідні стереоізомери, таутомери і ізотопні похідні.
2. Фармацевтична композиція, що містить сполуку за п. 1 в поєднанні з одним або декількома фармацевтично прийнятними розчинниками або носіями.
3. Застосування сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2 як лікарського засобу.
4. Застосування сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2 для лікування або запобігання стану, вибраному з наступних:
COPD (включаючи хронічний бронхіт і емфізему), астма, дитяча астма, муковісцидоз, саркоїдоз, ідіопатичний легеневий фіброз, алергічний риніт, риніт, синусит, алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне до ревматоїдного артриту або остеоартриту, ревматоїдний артрит, панкреатит, кахексія, інгібування росту і метастазування пухлин, включаючи недрібноклітинні карциноми легень, карциноми молочної залози, карциноми шлунка, карциноми товстої і прямої кишки і злоякісні меланоми.
5. Застосування сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2 для отримання лікарського засобу для лікування або запобігання стану, вибраному з наступних:
COPD (включаючи хронічний бронхіт і емфізему), астма, дитяча астма, муковісцидоз, саркоїдоз, ідіопатичний легеневий фіброз, алергічний риніт, риніт, синусит, алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне до ревматоїдного артриту або остеоартриту, ревматоїдний артрит, панкреатит, кахексія, інгібування росту і метастазування пухлин, включаючи недрібноклітинні карциноми легень, карциноми молочної залози, карциноми шлунка, карциноми товстої і прямої кишки і злоякісні меланоми.
6. Спосіб лікування стану, вибраного з наступних:
COPD (включаючи хронічний бронхіт і емфізему), астма, дитяча астма, муковісцидоз, саркоїдоз, ідіопатичний легеневий фіброз, алергічний риніт, риніт, синусит, алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне до ревматоїдного артриту або остеоартриту, ревматоїдний артрит, панкреатит, кахексія, інгібування росту і метастазування пухлин, включаючи недрібноклітинні карциноми легень, карциноми молочної залози, карциноми шлунка, карциноми товстої і прямої кишки і злоякісні меланоми, що включає введення пацієнту ефективної кількості сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2.
Текст
Реферат: Даний винахід стосується сполуки формули (І) і композицій, що її містять, а також використання даної сполуки і композицій даної сполуки для лікування, наприклад для лікування запальних захворювань, зокрема респіраторного запального захворювання. UA 109667 C2 (12) UA 109667 C2 O OMe N OMe O Cl N N N N N N HO H2 N (І) UA 109667 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується сполуки, яка інгібує фосфоінозитид-3-кінази (PI3-кінази). Зокрема даний винахід стосується сполуки, яка інгібує дельта-підтип PI3-кінази і додатково її гамма- і альфа-підтипи, і її застосування, в тому числі в фармацевтичних комбінаціях, в терапії, зокрема, в лікуванні запальних захворювань, включаючи запальні захворювання легенів, такі як COPD і астма. Даний винахід також поширюється на способи отримання вказаної сполуки і фармацевтичних композицій, що її містять. Рівень техніки, до якого належить винахід Ліпідні кінази каталізують фосфорилування ліпідів з утворенням речовин, що беруть участь в регулюванні широкого кола фізіологічних процесів, включаючи клітинну міграцію і адгезію. PI3кінази являють собою зв'язані з мембраною білки і належать до класу ферментів, які каталізують фосфорилування ліпідів, які самі зв'язані з клітинними мембранами. Дельта (δ)ізозим PI3-кінази (PI3-кіназа-дельта) являє собою одну з чотирьох ізоформ типу I PI3-кіназ, відповідальну за синтез різноманітних 3'-фосфорилованих фосфоінозитидів, які проводять клітинні сигнали і беруть участь в ряді клітинних процесів, такі як запалення, сигнали факторів росту, злоякісне перетворення і імунітет [див. огляд L. E. Rameh і L. C. Cantley, J. Biol. Chem., 1999, 274:8347-8350]. Участь PI3-кіназ в боротьбі із запаленням підтверджена в декількох модельних дослідженнях з використанням інгібіторів пан-PI3-кінази, таких як LY-294002 і вортманін [K. Ito et al., J. Pharmacol. Exp. Ther., 2007, 321:1-8]. Нещодавно проведені дослідження з використанням селективних інгібіторів PI3-кінази або з нокаутованими мишами, у яких була відсутня специфічна ізоформа ферменту. Ці дослідження продемонстрували роль шляхів, що обмежуються ферментами PI3-кінази при запаленні. Виявлено, що селективний інгібітор IC87114 PI3-кінази-дельта інгібує гіперчутливість дихальних шляхів, вивільнення імуноглобуліну IgE, експресію протизапальних цитокінів, накопичення запалених клітин легенів і проникність судин сенсибілізованих овальбуміном і стимульованих овальбуміном мишей [K. S. Lee et al., J. Allergy Clin. Immunol., 2006, 118:403-409; K. S. Lee, et al., FASEB J., 2006, 20:455-65]. Крім того, IC-87114 знижував накопичення нейтрофілів в легенях мишей і функцію нейтрофілів, стимульовану TNFα [С. Sadhu et al., Biochem. Biophys. Res. Commun., 2003, 308:764-9]. Ізоформа PI3-кінази-дельта активується інсуліном і іншими факторами росту, а також зв'язаними з G-білком сигнальними і запальними цитокінами. Згідно з нещодавнім повідомленням, подвійний інгібітор PI3-кінази-дельта/гамма TG100-115 інгібує легеневу еозинофілію і інтерлейкін-13, а також накопичення муцину і гіперчутливість дихальних шляхів в мишачій моделі при введенні шляхом аерозолізації. Ті ж автори також повідомили, що дана сполука виявилася здатною інгібувати нейтрофілію, викликану LPS або сигаретним димом [J. Doukas et al., J. Pharmacol. Exp. Ther., 2009, 328:758-765] Оскільки вона також активується окислювальним стресом, ізоформа PI3-кінази-дельта, імовірно, має значення як мішень для терапевтичного втручання у разі захворювань, де спостерігається високий рівень окислювального стресу. У число подальших медіаторів шляху передачі сигналу PI3-кінази входять Akt (серинтреонінпротеїнкіназа) і мішень рапаміцину в клітинах ссавців, фермент mTOR. Автори недавнього дослідження передбачили, що активація PI3-кінази-дельта, яка приводить до фосфорилування Akt, здатна індукувати стан стійкості до кортикостероїдів в клітинах, чутливих до кортикостероїдів в інших умовах [Y. To et al., Am. J. Respir. Crit. Care Med., 2010, 182:897-904]. Ці спостереження привели до гіпотези, що цей каскад сигналів міг би являти собою механізм, відповідальний за нечутливість до кортикостероїдів запалення, виникаючого в легенях пацієнтів, що страждають від COPD, а також астматиківкурців, внаслідок чого їх легені зазнають посиленого окислювального стресу. Дійсно, запропонований теофілін, сполука, що використовується в лікуванні COPD, для усунення нечутливості до стероїдів за допомогою механізмів, що містять взаємодію з шляхами, обмеженими PI3-кіназою-дельта [Y. To et al., Am. J. Respir. Crit. Care Med., 2010, 182:897-904]. У цей час основу лікування астми і COPD являє собою інгаляційна терапія з використанням поєднання кортикостероїдів, мускаринових антагоністів і β2-агоністів, що вважається відповідним в клінічному відношенні. Один із шляхів вирішення незадоволених медичних потреб у випадку COPD і астми полягає в знаходженні нових лікарських засобів, наприклад, придатних для використання як інгаляційних лікарських засобів, які мають можливість забезпечувати значний корисний ефект при використанні в монотерапії або в поєднанні з одним або декількома лікарськими засобами з цих трьох фармакологічних класів. Таким чином, залишається необхідність у визначенні і розробці селективних до ізоформи інгібіторів PI3-кінази, які мають можливість забезпечувати підвищену ефективність в лікуванні астми, COPD і інших запальних захворювань. 1 UA 109667 C2 Суть винаходу Згідно з даним винаходом, запропонована сполука формули (I): 5 10 15 20 25 30 35 40 , яка являє собою 6-(2-((4-аміно-3-(3-гідроксифеніл)-1H-піразоло[3,4-d]піримідин-1-іл)метил)3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід або його фармацевтично прийнятну сіль, включаючи всі відповідні стереоізомери, таутомери і ізотопні похідні. Сполука, згідно з даним винаходом, являє собою подвійний інгібітор PI3-кіназидельта/гамма. Термін "інгібітор" при використанні в цьому документі означає сполуку, яка зменшує (наприклад щонайменше на 50%) або усуває біологічну активність білка-мішені, наприклад, ізозиму PI3-кінази-дельта, при дослідженні ферменту in vitro. Термін "інгібітор дельта/гамма" при використанні в цьому документі означає той факт, що сполука інгібує в деякому ступені обидві ізоформи ферменту, хоч і не обов'язково в однаковому ступені. Сполука, згідно з даним винаходом, виявляє активність у відбірних системах на клітинній основі, і тим самим вона демонструє, що має придатні властивості для проникнення в клітини і внаслідок цього виробляє внутрішньоклітинні фармакологічні ефекти. Сполуку, згідно з даним винаходом, характеризують терапевтично відповідні і бажані фармацевтичні властивості, наприклад, достатню стійкість, розчинність і високу активність. У одному варіанті здійснення запропонована фармацевтично прийнятна кислотно-адитивна сіль сполуки, згідно з даним винаходом. Фармацевтично прийнятні кислотно-адитивні солі, згадані вище в цьому документі, містять терапевтично активні нетоксичні кислотно-адитивні солі, які здатні утворювати сполуку формули (I). Дані фармацевтично прийнятні кислотно-адитивні солі можна зручно отримувати, обробляючи вільну основну форму сполуки формули (I) відповідною кислотою. Відповідні кислоти містять, наприклад, неорганічні кислоти, такі як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота і подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропіонова, гліколева, молочна, малонова, янтарна, малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, пара-толуолсульфонова, цикламова, саліцилова, пара-аміносаліцилова, памова і подібні кислоти. Приклади солей сполуки (I) містять всі фармацевтично прийнятні солі, наприклад, без обмеження, кислотно-адитивні солі мінеральних кислот, такі як солі HCl і HBr і адитивні солі органічних кислот, такі як сіль метансульфонової кислоти. Наступні приклади містять солі сірчаної кислоти і солі фосфорної кислоти. У одному варіанті здійснення запропонований гідрохлорид 6-(2-((4-аміно-3-(3гідроксифеніл)-1H-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-хлорбензил)-4-оксо-3,4дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инаміду. У одному варіанті здійснення запропонований гідробромід 6-(2-((4-аміно-3-(3-гідроксифеніл)1H-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,Nбіс(2-метоксіетил)гекс-5-инаміду. У одному варіанті здійснення запропонований тозилат 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Hпіразоло[3,4-d]піримідин-1-іл)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,Nбіс(2-метоксіетил)гекс-5-инаміду. 2 UA 109667 C2 10 Даний винахід також поширюється на сольвати сполук, вказаних в цьому документі. Приклади сольватів містять гідрати. Сполуки, згідно з даним винаходом, містять ті, в яких вказаний атом являє собою той, що зустрічається в природі або штучно отриманий ізотоп. У одному варіанті здійснення ізотоп являє собою стабільний ізотоп. Таким чином, сполуки, згідно з даним винаходом, містять, наприклад, ті, які містять один або декілька атомів дейтерію замість атомів водню, і подібні сполуки. Згідно з одним із варіантів здійснення даного винаходу, в якому сполука формули (I) являє собою мічену дейтерієм сполуку, ізотопічно мічена сполука являє собою гексадейтеропохідне формули (IA) 15 . Даний винахід також поширюється на всі поліморфні форми сполук, які визначені в цьому документі. Сполуку формули (I) можна зручно синтезувати способом, що включає реакцію сполуки формули (II): 5 або її захищеного похідного, в якій LG1 являє собою відхідну групу, таку як атом галогену, зокрема атом брому, із сполукою формули (III): 20 25 , в присутності придатного каталізатора і органічної основи, в полярному апротонному розчиннику в атмосфері інертного газу. Придатні каталізатори містять паладієві каталізатори, такі як дихлорид біс(трифенілфосфін)паладію(II), в присутності йодиду міді, і придатний полярний апротонний розчинник являє собою DMF. Придатний інертний газ являє собою азот. Як альтернатива, сполуку формули (I) можна синтезувати способом, що включає реакцію сполуки формули (II) або її захищеного похідного із сполукою формули (IV): 3 UA 109667 C2 5 10 15 20 25 , де R переважно являє собою Н, з утворенням сполуки формули (V) або її захищеного похідного. Сполуку формули (I) потім отримують із сполуки формули (V) за допомогою одного або декількох стандартних перетворень функціональних груп. Наприклад, якщо R являє собою Н, сполуку формули (I) можна отримати із сполуки формули (V) реакцією амідного з’єднання з аміном, найбільш переважно використовуючи біс(2-метоксіетил)амін. Для способів синтезу, в яких сполука формули (II) являє собою захищене похідне, сполуку формули (I) отримують відповідною стадією видалення захисної групи, що добре відомо і практично використовується в галузі техніки. Наприклад, коли фенол, присутній в сполуці формули (I), захищає силільна група, наприклад, трет-бутилдиметилсилільна група, стадію видалення захисної групи можна здійснювати шляхом обробки реагентом, таким як фторид тетрабутиламонію, в присутності полярного апротонного розчинника, такого як DMF. Цю реакцію можна здійснювати при зниженій температурі, такій як приблизно 0 °C. Сполуку формули (II) можна синтезувати реакцією сполуки формули (VI) або її захищеного похідного, де LG1 являє собою відхідну групу, як визначено вище в цьому документі для сполук формули (II), і LG2 також являє собою відхідну групу, таку як галогенна, наприклад атом галогену і переважно атом хлору, із сполукою формули (VII) або її захищеним похідним, в присутності основи і в полярному апротонному розчиннику. Придатні основи для даного перетворення містять карбонат калію, і придатний полярний апротонний розчинник являє собою DMF. Способи синтезу включають ті, в яких вважається переважним захист фенольної гідроксильної групи сполуки формули (VII) під час стадії з’єднання, і придатні захищені похідні містять простий трет-бутилдиметилсиліловий ефір і простий трет-бутиловий ефір. Як альтернатива, сполуку формули (II) можна синтезувати реакцією сполуки формули (VIII): 4 UA 109667 C2 або її захищеного похідного, де LG1 являє собою відхідну групу, яка визначена вище для сполуки формули (II), і LG3 являє собою відхідну групу, таку як атом галогену, зокрема атом йоду, із сполукою формули (IX): 5 10 15 20 25 30 35 40 45 або її захищеним похідним в присутності придатного каталізатора, що містить благородний метал, неорганічної основи і полярного протонного розчинника в інертній атмосфері; після чого здійснюють видалення захисної групи, якщо це доцільно. Придатний каталізатор являє собою тетракис(трифенілфосфін)паладій(0). Придатна неорганічна основа являє собою карбонат натрію, і придатний полярний протонний розчинник являє собою етанол. Реакцію можна здійснювати при підвищеній температурі, наприклад при 85 °C, протягом тривалого періоду, що складає, наприклад, 3 доби, перед охолодженням до кімнатної температури. Захисні групи можуть переважно маскувати хімічно чутливі групи під час однієї або декількох послідовностей реакцій, описаних вище, щоб забезпечувати ефективність одного або декількох способів. Таким чином, якщо це бажано або необхідно, проміжні сполуки можна захищати, використовуючи традиційні захисні групи. Захисні групи і способи їх видалення описали Theodora W. Greene і Peter G. M. Wuts в "Protective Groups in Organic Synthesis", опублікованої John Wiley & Sons Inc; 4th Rev Ed., 2006, ISBN-10: 0471697540. Нові проміжні сполуки заявлені як аспект даного винаходу. Переважно в сполуках, згідно з даним винаходом, не виявляється атропоізомеризм. У одному аспекті дана сполука є корисною для лікування, наприклад, COPD і/або астми. Отримані до цього часу сполуки PI3-кінази звичайно призначені для перорального введення. Звичайно ця стратегія включає оптимізацію фармакокінетичного профілю сполуки для досягнення достатнього тривалого часу її дії. Таким чином, досить висока концентрація лікарського засобу встановлюється і зберігається між дозами, забезпечуючи безперервний клінічний корисний ефект. Неминучий і часто небажаний наслідок такого підходу полягає в тому, що на нецільові тканини організму, особливо печінку і кишечник, ймовірно, впливають фармакологічно активні концентрації лікарського засобу. Альтернативна стратегія полягає в тому, щоб розробити режими лікування, в яких лікарський засіб дозується безпосередньо до запаленого органа (наприклад, місцева терапія). Хоч даний підхід не є придатним для лікування всіх хронічних запальних станів, його широко використовують для лікування легеневих захворювань (астма, COPD), шкірних уражень (атопічний дерматит і псоріаз), хвороб носа (алергічний риніт) і шлунково-кишкових розладів (неспецифічний виразковий коліт). У місцевій терапії бажана ефективність може іноді бути досягнута шляхом забезпечення того, що лікарський засіб має стійкий тривалий період впливу і утримується переважно в цільовому органі, внаслідок чого зводяться до мінімуму ризики загальної токсичності. Як альтернатива, можна використовувати відповідну композицію, яка утворює "резервуар" активного лікарського засобу, який потім стає доступним для підтримки бажаних ефектів. Приклад першого підходу являє собою використовуваний як антихолінергічний лікарський засіб бромід тіотропію (Spiriva HandiHaler®), який вводять місцево в легеню з метою лікування COPD. Дана сполука має виключно високу спорідненість до свого цільового рецептора, що приводить до дуже повільної швидкості його розпаду (швидкості дисоціації) і подальшого тривалого періоду дії. 5 UA 109667 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно з одним аспектом даного винаходу, запропоноване застосування сполуки формули (I) або отриманої з неї відповідної композиції як інгібітору PI3-кінази, наприклад, для місцевого введення в легеню. Згідно з одним аспектом даного винаходу, описана в цьому документі сполука є особливо придатною для місцевої доставки, такої як місцева доставка в легені, зокрема, для лікування COPD. Таким чином, в одному аспекті запропоноване застосування сполуки, згідно з даним винаходом, для лікування COPD і/або астми, зокрема COPD або важкої астми, шляхом інгаляції, тобто шляхом місцевого введення в легені. Переважно введення в легені забезпечує для пацієнтів здійснення корисних ефектів сполук, скорочуючи при цьому до мінімуму побічні ефекти. У одному варіанті здійснення сполука є придатною для сенсибілізації пацієнтів до лікування кортикостероїдами. Сполука, описана в цьому документі, може також бути корисною для лікування ревматоїдного артриту. Крім того, в цьому винаході пропонується фармацевтична композиція, що містить сполуку згідно з даним винаходом необов'язково в поєднанні з одним або декількома фармацевтично прийнятними розріджувачами або носіями. Розріджувачі і носії можуть включати речовини, придатні для парентерального, перорального, місцевого, мукозального і ректального введення, причому вони можуть бути різними в залежності від шляху введення. У одному варіанті здійснення можуть бути отримані композиції, наприклад, для парентерального, підшкірного, внутрішньом'язового, внутрішньовенного, внутрішньосуглобового або навколосуглобового введення, зокрема, в формі рідких розчинів або суспензій; для перорального введення, зокрема в формі таблеток або капсул; для місцевого, наприклад легеневого або внутрішньоназального, введення, зокрема, в формі порошків, крапель для носа або аерозолів і трансдермального введення; для мукозального введення, наприклад в щічні, під’язикові або вагінальні слизові оболонки; а також для ректального введення, наприклад в формі супозиторія. Композиції можна зручно вводити в стандартній лікарській формі, і їх можна отримувати, використовуючи будь-який із способів, добре відомих в галузі фармацевтики, наприклад, як описано в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA. (1985). Композиції для парентерального введення можуть містити як ексципієнти стерильну воду або фізіологічний розчин, алкіленгліколі, такі як пропіленгліколь, поліалкіленгліколі, такі як поліетиленгліколь, олії рослинного походження, гідровані нафталіни і т. п. Композиції для внутрішньоназального введення можуть бути твердими і в них можуть міститися ексципієнти, наприклад лактоза або декстран, або вони можуть являти собою водні або масляні розчини для використання в формі крапель для носа або дозованих аерозолів. Для букального введення типові ексципієнти містять цукор, стеарат кальцію, стеарат магнію,прежелатинізований крохмаль і т. п. Композиції, придатні для перорального введення, можуть містити один або декілька фізіологічно сумісних носіїв і/або ексципієнтів і можуть знаходитися в твердій або рідкій формі. Таблетки і капсули можна отримувати, використовуючи зв'язуючі речовини, наприклад сироп, гуміарабік, желатин, сорбіт, трагакант або полівінілпіролідон; наповнювачі, такі як лактоза, сахароза, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцин; лубриканти, такі як стеарат магнію, тальк, поліетиленгліколь або діоксид кремнію; і поверхнево-активні речовини, такі як лаурилсульфат натрію. Рідкі композиції можуть містити традиційні добавки, такі як суспендуючі речовини, наприклад сироп сорбіту, метилцелюлозу, цукровий сироп, желатин, карбоксиметилцелюлозу або їстівні жири; емульгатори, такі як лецитин або гуміарабік; рослинні олії, такі як мигдалева олія, кокосова олія, масло печінки тріски або арахісова олія; консерванти, такі як бутилований гідроксіанізол (BHA) і бутилований гідрокситолуол (BHT). Рідкі композиції можна інкапсулювати, наприклад, в желатин, з отриманням стандартних лікарських форм. Тверді пероральні лікарські форми містять таблетки, капсули в твердій оболонці з двох частин і м'які пружні желатинові (SEG) капсули. Композиція сухої оболонки містить, як правило, желатин в концентрації, що складає від приблизно 40% до 60%, пластифікатор (такий як гліцерин, сорбіт або пропіленгліколь) в концентрації, що складає від приблизно 20% до 30%, і воду в концентрації, що складає від приблизно 30% до 40%. Крім того, також можуть бути присутніми і інші речовини, такі як консерванти, барвники, замутнювачі і ароматизатори. Рідка речовина наповнювача містить 6 UA 109667 C2 5 10 15 20 25 30 35 40 45 50 55 60 твердий лікарський засіб, який розчинений, солюбілізований або диспергований (за допомогою суспендуючих речовин, таких як бджолиний віск, гідрована рицинова олія або поліетиленгліколь 4000), або рідкий лікарський засіб в носії або сполученнях носіїв, таких як мінеральне масло, рослинні олії, тригліцериди, гліколі, поліоли і поверхнево-активні речовини. Переважно сполуку формули (I) вводять місцево в легені. Таким чином, в одному варіанті здійснення запропонована фармацевтична композиція, що містить сполуку, згідно з даним винаходом, необов'язково в поєднанні з одним або декількома місцево прийнятними розріджувачами або носіями. Місцеве введення в легені можна здійснювати шляхом використання аерозольної композиції. Аерозольні композиції, як правило, містять активний інгредієнт, суспендований або розчинений у відповідному газоподібному витиснювачі аерозолю, такому як хлорфторвуглець (CFC) або фторований вуглеводень (HFC). Придатні CFC як газоподібні витиснювачі містять трихлормонофторметан (газоподібний витиснювач 11), дихлортетрафторметан (газоподібний витиснювач 114) і дихлордифторметан (газоподібний витиснювач 12). Придатні HFC як газоподібні витиснювачі містять тетрафторетан (HFC-134a) і гептафторпропан (HFC-227). Газоподібний витиснювач, як правило, складає від 40% до 99,5%, наприклад від 40% до 90%, сумарної маси інгаляційної композиції. Композиція може містити ексципієнти, в тому числі співрозчинники (наприклад, етанол) і поверхнево-активні речовини (наприклад, лецитин, триолеат сорбіту і т. п.). Аерозольні композиції упаковані в балони, і придатна доза визначається за допомогою дозуючого клапана (наприклад, як постачають фірми Bespak, Valois або 3M). Місцеве введення в легені можна також забезпечувати шляхом використання композиції, що не знаходиться під тиском, такої як водний розчин або суспензія. Її можна вводити, використовуючи розпилювач. Місцеве введення в легені можна також здійснювати шляхом використання сухої порошкоподібної композиції. Суха порошкоподібна композиція містить сполуку, згідно з даним винаходом, в тонкодисперсній формі, в якій середньомасовий діаметр (MMAD) частинок складає, як правило, від 1 до 10 мкм. Композиція, як правило, містить місцево прийнятний розріджувач, такий як лактоза, що звичайно має частинки великого розміру, у яких середньомасовий діаметр (MMAD) складає, наприклад, 100 мкм або більше. Приклади системи доставки сухого порошку містять SPINHALER, DISKHALER, TURBOHALER, DISKUS, SKYEHALER, ACCUHALER і CLICKHALER. У одному варіанті здійснення сполука, згідно з даним винаходом, запропонована в формі мікронізованої сухої порошкоподібної композиції, наприклад, що містить лактозу придатної категорії і упакована в пристрій, такий як DISKUS. Сполука, згідно з даним винаходом, призначена для вияву терапевтичної активності. У наступному аспектіданий винахід пропонує сполуку, згідно з даним винаходом, для застосування як лікарського засобу. Сполука, згідно з даним винаходом, може також виявлятися корисною в лікуванні респіраторних захворювань, в число яких входять COPD (включаючи хронічний бронхіт і емфізему), астма, дитяча астма, муковісцидоз, саркоїдоз, ідіопатичний легеневий фіброз, алергічний риніт, риніт, синусит; зокрема астма, хронічний бронхіт і COPD. Сполука, згідно з даним винаходом, здатна також відновлювати у пацієнта стан чутливості до лікування кортикостероїдами, коли попередній стан пацієнта перешкоджав такому лікуванню. Згідно з одним варіантом здійснення даного винаходу, дану сполуку використовують в дозі, яка дорівнює дозі, придатній для використання як монотерапії, але її вводять в поєднанні з кортикостероїдом. У одному варіанті здійснення сполуку формули (I) використовують в дозі, яка була б нижче терапевтичної у разі її використання як єдиного лікарського засобу, в поєднанні з кортикостероїдом, внаслідок чого у пацієнта відновлюється чутливість до кортикостероїду в тих випадках, де пацієнт раніше ставав нечутливим до нього. Крім того, сполука, згідно з даним винаходом, може виявляти противірусну активність і виявляється корисною в лікуванні викликаних вірусами загострень запальних станів, таких як астма і/або COPD. Сполука, згідно з даним винаходом, може також виявлятися корисною в профілактиці, лікуванні або зменшенні інтенсивності вірусу грипу, риновірусу і/або респіраторного синцитіального вірусу. Крім того, передбачається, що сполука формули (I), згідно з даним винаходом, виявиться корисною в лікуванні певних станів, які можна лікувати, використовуючи топічну або місцеву терапію, включаючи алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне до ревматоїдного артриту або остеоартриту. 7 UA 109667 C2 5 10 15 20 25 30 35 40 45 У одному варіанті здійснення сполука формули (I) вважається корисною в лікуванні гепатиту С і/або вірусу імунодефіциту людини (ВІЛ) при її введенні відповідним шляхом. Відповідні шляхи введення можуть включати пероральне введення, внутрішньовенні ін'єкції або інфузії. У одному варіанті здійснення сполуку формули (I) для лікування гепатиту С вводять в кров перед її надходженням в печінку. Крім того, передбачається, що сполука, згідно з даним винаходом, виявиться корисною в лікуванні інших певних станів, в число яких входять ревматоїдний артрит, панкреатит, кахексія, інгібування росту і метастазування пухлин, включаючи недрібноклітинні карциноми легенів, карциноми молочної залози, карциноми шлунка, карциноми товстої і прямої кишки і злоякісні меланоми. У одному варіанті здійснення описана в цьому документі сполука і фармацевтичні композиції, що містять її, виявляються корисними в лікуванні або запобіганні раку, зокрема раку легенів, особливо шляхом місцевого введення в легені. Таким чином, в наступному аспекті, даний винахід пропонує сполуку, яка описана в цьому документі, для застосування в лікуванні одного або декількох вищезазначених станів. У наступному аспекті даний винахід пропонує застосування сполуки, яка описана в цьому документі, в отриманні лікарського засобу для лікування одного або декількох вищезазначених станів. У наступному аспекті даний винахід пропонує спосіб лікування вищезазначених станів, який включає введення пацієнту ефективної кількості сполуки, згідно з даним винаходом, або фармацевтичною композицією, що її містить. Сполуки, описані в цьому документі, можна також використовувати в отриманні лікарського засобу для лікування одного або декількох вищезгадуваних захворювань. Слово "лікування" використовується для позначення профілактики, а також терапевтичного лікування. Сполуку, згідно з даним винаходом, можна також вводити в поєднанні з одним або декількома іншими активними інгредієнтами, наприклад активними інгредієнтами, придатними для лікування вищезазначених станів. Наприклад, можливі поєднання для лікування респіраторних розладів містять поєднання, в які входять стероїди (наприклад, будесонід, беклометазону дипропіонат, флутиказону пропіонат, мометазону фуроат, флутиказону фуроат), бета-агоністи (наприклад, тербуталін, сальбутамол, салметерол, формотерол, індакатерол) і/або ксантини (наприклад, теофілін), мускаринові антагоністи (наприклад, іпратропій) і/або інгібітор кінази p38 мітогенактивованого білка (MAP). У одному варіанті здійснення в поєднанні із сполукою, згідно з даним винаходом, вводять противірусний лікарський засіб, такий як, наприклад, ацикловір, таміфлю, реленза або інтерферон. У одному варіанті здійснення активні інгредієнти складають в композиції. У одному варіанті здійснення сполуку, згідно з даним винаходом, і кортикостероїд складають в композиції для інгаляції, наприклад, для використання в підтримуючій терапії COPD або раку легенів, включаючи запобігання останньому. У одному варіанті здійснення поєднання активних інгредієнтів просто використовують для спільного введення. У одному варіанті здійснення сполуку, згідно з даним винаходом, вводять шляхом інгаляції, а кортикостероїд вводять перорально або шляхом інгаляції в поєднанні або окремо. Експериментальна частина Скорочення, що використовуються в даному описі, визначені нижче (таблиця 1). Будь-яке скорочення, для якого не наведено визначення, вважається таким, що має своє загальноприйняте значення. 8 UA 109667 C2 водн. Ac ATP BALF шир. BSA COPD д DCM DMAP ДМСО ECD·HCl + (ES ) Et EtOAc EtOH FACS FCS FP г ВЕРХ-МС год. HRP HRV в. н. в. т. IL-8 мкл LPS мкМ М + (M+Н) MCP-1 Me MeOH мг МГц хв. мл мМ ммоль МТТ m/z нг нМ нм ЯМР OVA PBS Ph PIP2 PIP3 PMA п. о. PPh3 Таблиця 1 Скорочення водний ацетил аденозин-5'-трифосфат бронхоальвеолярна промивна рідина широкий бичачий сироватковий альбумін хронічне обструктивне легеневе захворювання дублет дихлорметан 4-диметиламінопіридин диметилсульфоксид 1-етил-3-(3-диметиламінопропіл)карбодііміду гідрохлорид електророзпилювальна іонізація, позитивний режим етил етилацетат етанол сортування флуоресцентно-активованих клітин ембріональна теляча сироватка флутиказону пропіонат грам(и) високоефективна рідинна хроматографія і мас-спектрометрія година(и) пероксидаза хрону риновірус людини внутрішньоназальний внутрішньотрахеальний інтерлейкін 8 мікролітр(и) ліпополісахарид мікромолярний молярний протонований молекулярний іон моноцитарний хемоатрактантний білок метил метанол міліграм(и) мегагерц хвилина мілілітр(и) мілімолярний мілімоль 3-(4,5-диметилтіазол-2-іл)-2,5-дифенілтетразолію бромід співвідношення маси і заряду нанограм наномолярний нанометр ядерний магнітний резонанс (спектроскопія) овальбумін фосфатно-сольовий буферний розчин феніл фосфатидилінозит-4,5-біфосфат фосфатидилінозит-3,4,5-трифосфат форболміристацетат пероральне введення трифенілфосфін 9 UA 109667 C2 кв квінт. t R КТ ОФ-ВЕРХ RSV с SDS SEM т TMB TNFα TR-FRET об. 5 10 15 20 25 30 квартет квінтет час утримання кімнатна температура оберненофазова високоефективна рідинна хроматографія респіраторний синцитіальний вірус синглет додецилсульфат натрію стандартна погрішність середнього значення триплет 3,3',5,5'-тетраметилбензидин фактор некрозу пухлини альфа дозволене у часі резонансне перенесення енергії флуоресценції об'єм Загальні процедури Всі вихідні речовини і розчинники отримували з торгових джерел або синтезували згідно з цитованою літературою. Якщо не визначені інші умови, всі реакції проводили при перемішуванні. Органічні розчини сушили в стандартних умовах над безводним сульфатом магнію. ВЕРХ-МС здійснювали на системах Agilent HP1200, використовуючи колонки Agilent Extend C18 (1,8 мкм, 4,6×30 мм), при 40 °C і швидкості потоку від 2,5 до 4,5 мл/хв., елююючи градієнтом H2O-MeCN, що містить 0,1 об.% мурашиної кислоти, протягом 4 хв. Параметри градієнта: 0-3,00 хв., зміна від 95% H2O - 5% MeCN до 5% H2O - 95% MeCN; 3,00-3,01 хв., витримування при 5% H2O - 95% MeCN, збільшення швидкості потоку до 4,5 мл/хв.; 3,01-3,50 хв., витримування при 5% H2O - 95% MeCN; 3,50-3,60 хв., повернення до 95% H2O - 5% MeCN; зменшення швидкості потоку до 3,50 мл/хв.; 3,60-3,90 хв., витримування при 95% H2O - 5% MeCN; 3,90-4,00 хв., витримування при 95% H2O - 5% MeCN, зменшення швидкості потоку до 2,5 мл/хв. Аналіз ультрафіолетового (УФ) спектра здійснювали при 254 нм, використовуючи детектор Agilent G1314B із змінною довжиною хвилі. Мас-спектри отримували, використовуючи електророзпилювальну (ES) іонізацію в діапазоні m/z від 60 до 2000 при частоті відбору проб 1,6 цикл./сек., використовуючи систему Agilent G1956B, в діапазоні m/z від 150 до 850 при частоті відбору проб 2 Гц, використовуючи систему Waters ZMD, або в діапазоні m/z від 100 до 1000 при частоті відбору проб 2 Гц, використовуючи 1 систему Shimadzu 2010 LC-MS. Спектри H-ЯМР реєстрували з допомогою спектрометра Bruker Avance III при 400 МГц, використовуючи залишковий недейтерований розчинник як стандарт. 5-Бром-3-(2-хлорбензил)-2-(хлорметил)хіназолін-4(3H)-он До переміщуваного розчину 2-аміно-6-бром-бензойної кислоти (3,06 г, 14,2 ммоль) в толуолі (75 мл), охолодженому до 0 °C на льодяній бані, піридин (0,60 мл, 7,10 ммоль) і потім розчин хлорацетилхлориду (2,26 мл, 28,4 ммоль) в толуолі (75 мл) додавали по краплях протягом 1 год. Реакційну суміш залишали нагріватися до КТ, нагрівали при 115 °C протягом 3 год. і потім залишали охолоджуватися до КТ. Об'єм розчинника зменшували в два рази шляхом випаровування у вакуумі. Після витримування протягом ночі продукт осаджувався, і його збирали шляхом фільтрування, отримуючи 2-бром-6-(2-хлорацетамідо)бензойну кислоту (1a, + + X=Cl) (1,44 г) у вигляді білої твердої речовини: m/z 290/292 (M+Н) (ES ). Фільтрат концентрували у вакуумі, і залишок розтирали з сумішшю етанолу і гептану, отримуючи 2-бром6-(2-гідроксіацетамідо)бензойну кислоту (1b, X=OH) (об'єднаний вихід 1,02 г, 59%): m/z 274/276 10 UA 109667 C2 + 5 10 15 20 25 30 35 40 + (M+Н) (ES ). Обидві сполуки 1a і 1b можна використати без додаткового очищення на наступній стадії. До переміщуваної суміші сполуки (1a) (7,50 г, 27,4 ммоль) 2-хлорбензиламіну (5,00 мл, 41,05 ммоль) і триетиламіну (5,70 мл, 41,1 ммоль) в толуолі (250 мл) додавали розчин трихлориду фосфору (2,60 мл, 30,1 ммоль) в толуолі (250 мл) по краплях протягом 1 год. Реакційну суміш нагрівали до 110 °C протягом 24 год., після чого гарячий розчин декантували і концентрували у вакуумі. Залишок розтирали, використовуючи пропан-2-ол (50 мл), щоб отримати вказану в t заголовку сполуку (2) (6,41 г, 59%) у вигляді жовтої твердої речовини: R 2,67 хв.; m/z 397/399 + + (M+Н) (ES ). 2-((4-Аміно-3-йод-1H-піразоло[3,4-d]піримідин-1-іл)метил)-5-бром-3-(2-хлорбензил)хіназолін4(3H)-он . До переміщуваної суміші 5-бром-3-(2-хлорбензил)-2-(хлорметил)-хіназолін-4(3H)-ону, (2), (13,6 г, 30,7 ммоль) і 3-йод-1H-піразоло[3,4-d]піримідин-4-аміну (3) (8,09 г, 30,7 ммоль) в DMF (300 мл) додавали карбонат калію (6,36 г, 46,0 ммоль), і реакцію проводили при КТ в темряві протягом 24 год. Суміш виливали у воду (4,0 л), і отриману суспензію перемішували при КТ протягом 1 год. Осад відділяли фільтруванням і сушили у вакуумі, отримуючи вказану в t заголовку сполуку (4) у вигляді безбарвної твердої речовини (18,0 г, 94%); R 2,17 хв.; m/z + + 622/624 [M+Н] (ES ). 3-(3-(Трет-бутилдиметилсилілокси)феніл)-1H-піразоло[3,4-d]піримідин-4-амін . До переміщуваної суспензії 3-йод-1H-піразоло[3,4-d]піримідин-4-аміну (3) (8,22 г, 31,5 ммоль), 3-фенолборонової кислоти (13,0 г, 94,5 ммоль) і фосфату калію (10,0 г, 47,3 ммоль) в дегазованій суміші DMF і води (3:2, 140 мл) додавали дихлорид [dppf]паладію(II) (13,0 г, 15,7 ммоль). Реакційну суміш продували азотом, нагрівали при 120 °C протягом 2 год. і потім залишали охолоджуватися до КТ. Реакційну суміш розбавляли EtOAc (500 мл) і хлористоводневою кислотою (2М, 500 мл), і отриману суспензію фільтрували. Фільтрат екстрагували хлористоводневою кислотою (2М, 2×500 мл). Об'єднані водні екстракти підлуговували насиченим водним розчином карбонату натрію до pH 10. Осад, що утворився, відфільтровувати, і фільтрат екстрагували EtOAc (3×1 л). Об'єднані органічні екстракти сушили і фільтрували, і розчинник видаляли у вакуумі, отримуючи сіру тверду речовину. Всі тверді речовини, отримані під час технологічної процедури, об'єднували і розтирали з DCM, отримуючи 3-(4-аміно-1H-піразоло[3,4-d]піримідин-3-іл)фенол (5) (6,04 г, 84%) у вигляді сірої + + твердої речовини: m/z 228 (M+Н) (ES ). До переміщуваного розчину фенолу (5) (4,69 г, 20,66 ммоль) і імідазолу (2,10 г, 30,99 ммоль) в сухому DMF (100 мл) додавали TBDMSCl (4,70 г, 30,99 ммоль). Через 16 год. додатково додавали порції імідазолу (2,10 г, 30,99 ммоль) і TBDMSCl (4,70 г, 30,99 ммоль), і суміш перемішували протягом 48 год. Реакційну суміш розбавляли водою (120 мл) і екстрагували DCM (2×200 мл). Об'єднані органічні екстракти промивали водою (2×200 мл), сушили, фільтрували, і 11 UA 109667 C2 5 10 15 20 25 об'єм зменшували приблизно до 100 мл шляхом випаровування у вакуумі. Отриману суспензію фільтрували, і твердий осад промивали гептаном (50 мл), отримуючи вказану в заголовку + + сполуку (6) (6,05 г, 85%) у вигляді кремової твердої речовини: m/z 343 (M+Н) (ES ). Проміжна сполука А: 2-((4-аміно-3-(3-гідроксифеніл)-1H-піразоло[3,4-d]піримідин-1-іл)метил)5-бром-3-(2-хлорбензил)хіназолін-4(3H)-он . До перемішуваної суміші 5-бром-3-(2-хлорбензил)-2-(хлорметил)хіназолін-4(3H)-ону (2) (100 мг, 0,25 ммоль) і карбонату калію (42 мг, 0,30 ммоль) в DMF (2,5 мл) додавали розчин 3-йод-1Hпіразоло[3,4-d]піримідин-4-аміну (6) (94 мг, 0,28 ммоль) в DMF (2,5 мл), і реакційну суміш перемішували при КТ протягом 18 год. Карбонат калію (3(35 мг, 0,75 ммоль) додавали трьома порціями протягом 30 год., після чого розчинник видаляли у вакуумі, і неочищену речовину очищали колонковою флеш-хроматографією при елююванні розчином 4,5% метанолу в DCM, отримуючи вказану в заголовку сполуку, тобто проміжну сполуку А (94 мг, 64%) у вигляді не t + + зовсім білої твердої речовини: R 2,01 хв.; m/z 588/590 (M+Н) (ES ). Проміжна сполука В: N,N-біс(2-метоксіетил)гекс-5-инамід . До розчину гекс-5-иноєвої кислоти (7,11 г, 63,4 ммоль), ECD·HCl (14,0 г, 72,9 ммоль) і DMAP (387 мг, 3,17 ммоль) в DCM (600 мл) при 0 °C додавали біс(2-метоксіетил)амін (9,3 мл, 63 ммоль). Отриману суміш нагрівали до КТ протягом 20 год. і потім промивали хлористоводневою кислотою (1М, 2×500 мл) і водою (500 мл). Органічний шар сушили і випаровували у вакуумі, отримуючи вказану в заголовку сполуку, тобто проміжну сполуку В, у вигляді жовтого масла (16 1 г, 97%): H-ЯМР (400 МГц, CDCl3) δ: 1,88 (3H, м), 2,26 (2H, м), 2,49 (2H, м), 3,32 (6H, с), 3,51 (4H, м), 3,55 (4H, м). 6-(2-((4-Аміно-3-(3-гідроксифеніл)-1H-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-хлорбензил)4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід: сполука формули (I) 12 UA 109667 C2 5 10 15 20 25 30 35 40 . Суміш проміжної сполуки В (9,11 г, 34,9 ммоль), дихлориду біс-трифенілфосфінпаладію(II) (0,98 г, 1,4 ммоль), проміжної сполуки А (8,3 г, 14 ммоль) і йодиду міді(I) (0,27 г, 1,4 ммоль) в діетиламіні (400 мл, 3,8 моль) дегазували азотом, перемішували при 60 °C протягом 4 год. і потім охолоджували до КТ протягом наступних 72 год. Суміш випаровували у вакуумі, і залишок розподіляли між водним розчином ацетату амонію (500 мл) і EtOAc (500 мл). Органічний шар відділяли, промивали концентрованим розчином солі (2×500 мл), а потім сушили і випаровували у вакуумі. Залишок очищали колонковою флеш-хроматографією (SiO2, градієнтне елюювання 120 г 0-5% MeOH в DCM), отримуючи вказану в заголовку сполуку формули (I) у вигляді не t + + 1 зовсім білої твердої речовини (6,9 г, 66%): R 1,92 хв.; m/z 735/737 (M+Н) (ES ) (спосіб D); HЯМР (400 МГц, ДМСО-d6) δ: 1,70 (2H, квінт.), 2,46 (2H, т), 2,55 (2H, т), 3,12 (3H, с), 3,19 (3H, с), 3,26 (2H, мультиплет, що перекривається), 3,31 (4H, м, частково прихований піком HOD), 3,35 (2H, кв), 5,30 (2H, с), 5,76 (2H, с), 6,18 (1H, дд), 6,80 (1H, дт), 6,85 (1H ддд), 6,92-6,94 (2H, мультиплет, що перекривається), 7,05 (1H, тд), 7,13 (1H, дд), 7,31 (1H, т), 7,61 (1H, дд), 7,68 (1H, дд), 7,81 (1H, дд), 8,18 (1H, шир. с), 9,65 (1H, шир. с). Додаткові складності і наслідки для розробки лікарських засобів, виникаючі в результаті атропоізомеризму, аналогічні тим, які виникають з інших джерел молекулярного ізомеризму, таких як присутність стереогенного центра. Ця властивість робить такі молекули хіральними, і, якщо вони нерозділені, утворюється рацемічна суміш, компоненти якої можуть мати різні фармакологічні і токсикологічні профілі. Ця властивість, ймовірно, приводить до значного збільшення вартості подальшої розробки для таких молекул, і, таким чином, відсутність атропоізомеризму в сполуці формули (I), описаної в цьому документі, являє собою у високому ступені бажану і переважну властивість. Біологічне дослідження: експериментальні методи Дослідження інгібування ферментів PI3-кінази каталізують фосфорилування фосфатидилінозит-4,5-біфосфату (PIP2) в 2+ фосфатидилінозит-3,4,5-трифосфат (PIP3) в присутності ATP і іонів Mg . Отриманий PIP3 можна визначати по витісненню біотин-PIP3 з комплексів з перенесенням енергії, які складають мічене європієм анти-GST моноклональне антитіло, мічений GST плекстрин-гомологічний (PH) домен, біотинільований PIP3 і стрептавідин-алофікоціанін (APC), використовуючи дозволене у часі резонансне перенесення енергії флуоресценції (TR-FRET) (ферментативний аналіз PI3кінази HTRF®, Millipore). Збудження (330 нм) європію в комплексі викликає перенесення енергії на APC і флуоресцентне випромінювання при 665 нм, хоч сам європій виробляє своє характеристичне випромінювання при 620 нм. PIP3 продукт, що утворюється, за рахунок активності PI3-кінази витісняє біотин-PIP3 з комплексу і приводить до втрати перенесення енергії (зменшення сигналу). Сполуку, що досліджується, додавали в бажаних кінцевих концентраціях в суміш субстрату PIP2 і рекомбінантних ферментів PI3-кінази-альфа, -дельта або -гамма (Millipore), і суміш інкубували протягом 2 год. при КТ. Після цього інкубаційного періоду ATP (20 мкмоль) додавали в суміш, що містить фермент, сполуку і субстрат PIP2, і отриману в результаті суміш інкубували протягом 30 хв. при КТ. Потім додавали зупиняючий розчин, що містить біотинільований PIP 3 і суміш для аналізу, в якій містилися GST мічений GRP1 плекстрин-гомологічний (PH) домен і флуорофори, і суміш інкубували при КТ протягом 15-18 год., після чого аналізували, 13 UA 109667 C2 5 10 15 20 25 30 35 40 45 50 55 використовуючи флуоресцентний зчитуваний пристрій для мікропланшетів Varioskan® Flash (ThermoFisher Scientific). Результати обчислювали згідно з формулою: сигнал APC (випромінювання при 665 4 нм)/сигнал європію (випромінювання при 620 нм)×10 . Процент інгібування в кожній реакції обчислювали відносно обробленого ДМСО контрольного зразка, і медіанну інгібуючу концентрацію (значення IC50) потім обчислювали по кривій концентраційній залежності відгуку. Клітинний аналіз PI3-кінази-дельта Як спосіб аналізу активації PI3-кінази-дельта у відповідь на стимуляцію, визначали сигнал в стані фосфорилування білка Akt, продукту PI3-кінази-дельта. Моноцити людини (клітини U937) диференціювали в клітини типу макрофагів шляхом інкубації з PMA (100 нг/мл) протягом від 48 до 72 год. Клітини потім заздалегідь інкубували із досліджуваною сполукою або носієм протягом 2 год. і потім стимулювали протягом короткого часу шляхом впливу H2O2 (10 мМ; від 5 до 7 хв.), і реакцію припиняли, замінюючи середовище на 4% розчин формальдегіду. Ендогенну пероксидну активність і формальдегід інактивували шляхом інкубації з гасним буферним розчином (0,1% азиду натрію, 1% H 2O2 в PBS з 0,1% Triton X-100) протягом 20 хв. Клітини промивали буферним розчином (PBS, що містить 0,1% Triton X100) і інкубували з блокуючим розчином (1% BSA в PBS) протягом 1 год. і повторно промивали буферним розчином і інкубували протягом ночі, додаючи або антитіло анти-pAkt, або антитіло анти-pan-Akt (обидва від компанії Cell Signaling Technology). Після промивання буферним розчином (PBS, що містить 0,1% Triton X-100) Клітини інкубували, додаючи кон’юговане з HRP вторинне антитіло (Dako), і отриманий сигнал визначали колориметрично (ОП при 450 нм з опорною довжиною хвилі 655 нм), використовуючи субстрат TMB (комплекс субстратного регента постачає компанія R&D Systems, Inc.). Цю реакцію зупиняли, додаючи 100 мкл розчину 1 н. H 2SO4. Клітини потім промивали буферним розчином (PBS, що містить 0,1% Triton X-100), і 100 мкл 5% розчину кристалічного фіолетового додавали на 30 хв. Після промивання буферним розчином (PBS, що містить 0,1% Triton X-100) в кожну ямку додавали по 100 мкл 1% SDS, і планшети злегка струшували протягом 1 год. перед вимірюванням поглинання при 595 нм (прилад Varioskan® Flash від компанії Thermo-Fisher Scientific). Виміряні показання ОП50-655 коректували на число клітин діленням показань ОП450-655 на ОП595. Співвідношення сигналу pAkt і сумарного сигналу Akt використовували для кількісної оцінки ступеня активації PI3-кінази-дельта. Процент інгібування для кожної ямки обчислювали по відношенню до контрольного розчину, що містить 10 г/мл стандартного контролю (LY294002), інгібування якого приймали рівним 100%, в той час як інгібування контрольного розчину, що містить тільки H2O2, приймали рівним 0%. Значення IC50 обчислювали по кривих концентраційної залежності відгуку, отриманих шляхом послідовного розбавлення досліджуваних сполук. Клітинний аналіз PI3-кінази-гамма Як спосіб аналізу активації PI3-кінази-гамма у відповідь на стимуляцію, визначали сигнал у стані фосфорилування білка Akt, продукту PI3-кінази-гамма, після стимуляції MCP-1. Моноцити людини (клітини THP1) заздалегідь інкубували в середовищі 1% FCS RPMI-1640 протягом 1 год. Клітини потім обробляли досліджуваною сполукою або носієм протягом 1 год. і стимулювали протягом короткого часу при впливі MCP-1 (50 нМ; 5-7 хв.; R&D Systems, штат Минесота, США). Реакцію зупиняли, замінюючи середовище на 4% розчин формальдегіду, після чого здійснювали пермеабілізацію (зміна проникності мембран клітин), використовуючи IntraPrep™ (Beckman Coulter, Франція) згідно з інструкціями виробника. Клітини промивали буферним розчином для промивання (PBS, що містить 0,1% BSA) і потім інкубували з антифосфо-Akt (#9271, Cell Signaling, Данверс, штат Масачусетс, США) протягом 15 хв. при КТ. Після промивання буферним розчином для промивання клітини інкубували, додаючи кон’юговане з Pacific Blue™ козяче антикроляче антитіло (Life Technologies Corp., Карлсбад, штат Каліфорнія, США), і рівень флуоресценції визначали, використовуючи проточний цитометр ATTUNE (Life Technologies Corp.). На основі гістограми мінімальну процентну частку позитивних клітин в кожному зразку обчислювали в порівнянні з контрольним базисом і використовували для кількісного визначення ступеня активації PI3-кінази-гамма. Процент інгібування для кожної ямки обчислювали по відношенню до контрольного розчину, що містить 10 г/мл LY294002, інгібування якого приймали рівним 100%, в той час як інгібування контрольного розчину, що містить тільки MCP-1, приймали рівним 0%. Значення IC50 обчислювали по кривих концентраційної залежності відгуку, отриманих шляхом послідовного розбавлення досліджуваних сполук. Індуковане риновірусом виділення IL-8 14 UA 109667 C2 5 10 15 20 25 30 35 40 45 50 55 Риновірус людини RV16 отримували з Американської колекції типових культур (Манассас, штат Віргінія). Вірусний матеріал отримували інфікуванням клітин Hela, використовуючи HRV, доти, поки 80% клітин не стали цитопатичними. Клітини BEAS2B інфікували HRV при MOI 5 і інкубували протягом 2 год. при 33 °C з м'яким струшуванням, щоб сприяти абсорбції. Клітини потім промивали PBS, додавали свіже середовище, і клітини інкубували протягом наступних 72 год. Надосадову рідину збирали для визначення концентрації IL-8, використовуючи проявляючий набір ELISA Duoset (R&D Systems, Міннеаполіс, штат Міннесота). Навантаження вірусу RSV в первинних бронхіальних епітеліальних клітинах in vitro Клітини NHBEC (нормального бронхіального епітелію людини), вирощені в 96-ямкових планшетах, інфікували RSV A2 (штам A2, HPA, Солсбері, Великобританія, при MOI 0,001) в середовищі LHC8 RPMI-1640 (50:50), що містить 15 мМ хлориду магнію, і інкубували протягом 1 год. при 37 °C для абсорбції. Клітини потім промивали PBS, додавали свіже середовище, і клітини інкубували протягом 4 діб. У разі необхідності клітини заздалегідь інкубували із досліджуваною сполукою або ДМСО протягом 2 год., і потім знову додавали після відмивання вірусу. Клітини фіксували розчином 4% формальдегіду в PBS протягом 20 хв., промивали буферним розчином для промивання (PBS, що містить 0,5% BSA і 0,05% Tween-20) і інкубували з блокуючим розчином (5% згущеного молока в PBS) протягом 1 год. Клітини потім промивали буферним розчином для промивання і інкубували протягом 1 год. при КТ з антитілом F-злитого білка анти-RSV (2F7) (мишаче моноклональне антитіло, партія 798760, номер по каталогу ab43812, Abсam). Після промивання клітини інкубували, додаючи кон’юговане з HRP вторинне антитіло (партія 00053170, номер по каталогу P0447 від компанії Dako) і потім додавали субстрат TMB (комплект субстратного реагенту, партія 269472, номер по каталогу DY999, R&D Systems, Inc.). Цю реакцію зупиняли додаванням 2н H 2SO4 (50 мкл), і отриманий в результаті сигнал визначали колориметрично (ОП при 450 нм з опорною довжиною хвилі 655 нм), використовуючи флуоресцентний зчитуваний пристрій для мікропланшетів Varioskan® Flash (ThermoFisher Scientific). Клітини потім промивали, і 2,5% розчин кристалічного фіолетового (партія 8656, номер по каталогу PL7000 від компанії Pro-Lab Diagnostics) додавали на 30 хв. Після промивання буферним розчином для промивання в кожну ямку додавали по 100 мкл 1% SDS, і планшети злегка струшували на струшуючому пристрої протягом 1 год. перед зняттям показань поглинання при 595 нм. Виміряні показання ОП50-655 коректували на число клітин діленням показань ОП450-655 на ОП595. Визначали процентне інгібування для кожної ямки, і значення IC50 обчислювали по кривих концентраційної залежності відгуку, отриманих шляхом послідовного розбавлення досліджуваної сполуки. Аналіз МТТ Диференційовані з допомогою PMA клітини U937 заздалегідь інкубували із досліджуваною сполукою протягом 4 год. в 5% FCS або 10% FCS протягом 24 год. Надосадову рідину замінювали 200 мкл нового середовища, і в кожну ямку додавали по 10 мкл стокового розчину МТТ (5 мг/мл). Після інкубації протягом 1 год. середовище видаляли, в кожну ямку додавали по 200 мкл ДМСО, і планшети злегка струшували протягом 1 год. перед зчитуванням показань поглинання при 550 нм. Процентну втрату життєздатності клітин обчислювали для кожної ямки по відношенню до випадку використання носія (0,5% ДМСО). Дослідження in vivo: фармакодинаміка і протизапальна активність Індуковане назальним овальбуміном накопичення еозинофілів і нейтрофілів у мишей Мишей BALB/с (у віці від 6 до 8 тижнів) інтраперитонеально імунізували OVA (40 мкг/кг) в дні 1 і 5. Щоб збудити місцеві запальні реакції в носі, мишей повторно стимулювали внутрішньоназальним введенням (по 10 мкл в кожну ніздрю) в дні 12-19 OVA (3% OVA в фізіологічному розчині). У день 19 не голодуючі миші отримували внутрішньоназальні дози (по 10 мкл в кожну ніздрю) носія або досліджуваної сполуки за 2 год. до початку кінцевої імунізації OVA. У нульовий момент часу кожна тварина отримувала кінцеву внутрішньоназальну дозу OVA (3%). Через 8 год. кожну тварину піддавали анестезії і промиванню носових порожнин введенням 1 мл PBS в хоани (отвори, що з'єднують порожнини носа і назальну частину глотки) через імплантовану спереду трахеальну канюлю, що проходить до положення, яке знаходилося приблизно на 1 мм перед хоанами. Цю процедуру повторювали, щоб отримати приблизно 2 мл рідини для промивання. Сумарне число клітин в зразках рідини для внутрішньоназального промивання вимірювали, використовуючи гемоцитометр. Зразки цитоспінових мазків рідини для внутрішньоназального промивання отримували центрифугуванням із швидкістю 1200 об./хв. протягом 2 хв. при КТ і забарвлювали, використовуючи фарбувальну систему DiffQuik (Dade Behring) для диференційованого підрахунку клітин. Клітини рахували, використовуючи 15 UA 109667 C2 5 10 15 20 25 30 мікроскопію при зануренні в масло. Дані представлені як диференціальне число клітин на 1 мл рідині для внутрішньоназального промивання в формі "середнє значення ± SEM". Індуковане полі(I:C) накопичення клітин у мишей Специфічним мишам А/J, що не містять патогенів (самці у віці 5 тижнів), вводили внутрішньоназально низькомолекулярний полі(I:C) (полі-IC; 1 мг/мл, 40 мкл; InvivoGen, СанДієго, штат Каліфорнія, США) два рази на добу протягом 3 діб під анестезією, використовуючи 3% ізофлуран. Досліджувану сполуку вводили внутрішньоназально (35 мкл розчину в 50% ДМСО/PBS) за 2 год. перед кожним введенням полі(I:C). Через 24 год. після останнього введення полі(I:C) твариною під анестезією вводили канюлю в трахею і збирали BALF. Концентрації альвеолярних макрофагів і нейтрофілів в BALF визначали шляхом аналізу FACS (EPICS® ALTRA II, Beckman Coulter, Inc., Фуллертон, штат Каліфорнія, США), використовуючи антимишаче моноклональне антитіло MOMA2 (макрофаг) або антимишаче антитіло 7/4 (нейтрофіл). Модель сигаретного диму Мишам А/J (самці у віці 5 тижнів) давали вдихати сигаретний дим (4% сигаретний дим, розбавлений стиснутим повітрям) протягом 11 діб по 30 хв. на добу, використовуючи експериментальну систему для інгаляції тютюнового диму дрібним тваринам (модель SIS-CS; Sibata Scientific Technology, Токіо, Японія). Досліджувану сполуку вводили внутрішньоназально (35 мкл розчини в 50% ДМСО/PBS) і терапевтично протягом 3 діб двічі на добу після заключного вдихання сигаретного диму. Через 12 год. після останнього введення під анестезією вводили канюлю в трахею і збирали бронхоальвеолярну промивну рідину (BALF). Кількості альвеолярних макрофагів і нейтрофілів визначали шляхом аналізу FACS (EPICS® ALTRA II, Beckman Coulter, Inc., Фуллертон, штат Каліфорнія, США), використовуючи антимишаче моноклональне антитіло MOMA2 (макрофаг) або антимишаче антитіло 7/4 (нейтрофіл). Короткий огляд результатів досліджень in vitro і in vivo Характеристики in vitro описаної в цьому документі сполуки формули (I), визначені описаними вище способами, представлені нижче (таблиці 2 і 3). Сполука, згідно з даним винаходом, демонструє потужне інгібування обох ізоформ PI3-кінази-дельта і -гамма і виявляє лише невелику активність інгібування PI3-кінази-альфа в ферментних аналізах. Ці ефекти перетворюються в потужне інгібування фосфорилування Akt, індукованого стимуляцією клітин пероксидом водню або MCP-1, а також активність інгібування індукованого HRV виділення IL-8 і індукованої RSV експресії білка F в клітинах епітелію. Не виявлено ніякого впливу на життєздатність клітин, отриманих внаслідок інкубації із сполукою формули (I). Таблиця 2 Вплив сполуки формули (I) на ізоформи PI3-кінази, на клітинне індуковане пероксидом водню або MCP-1 фосфорилування Akt і на життєздатність клітин Інгібування PI3-кінази Клітинна активність Життєздатність клітин Значення IC50 для вказаного Значення IC50 для інгібування Аналіз МТТ клітин da ізозиму (нМ) індукованого фосфорилування Akt U937 Стимуляція H2O2 Стимуляція MCPчерез 24 δ γ α через 4 год. клітин d-U937 1 клітин THP1 год. b 12 25 193 1,1 46 -ve -ve a) -ve являє собою значення інгібування менше 30%; b) значення IC50, обчислене методом лінійної регресії. 35 Таблиця 3 Вплив сполуки формули (I) на індуковане HRV виділення IL-8 і індуковану RSV експресію білка F Індуковане HRV16 виділення IL-8 в клітинах Експресія білка RSV F в клітинах бронхіального BEAS2B (% інгібування) епітелію: значення IC50 (нМ) 78% (при 0,1 мкг/мл) 389 Виявилося, що внутрішньоназальне введення мишам сполуки, описаної в цьому документі, проводило залежне від дози інгібування накопичення як еозинофілів, так і нейтрофілів у внутрішньоназальній промивній рідині після стимуляції алергенами (таблиця 4). 40 16 UA 109667 C2 Таблиця 4 Вплив введення сполуки формули (I) на індуковану OVA еозинофілію і нейтрофілію у мишей 5 Кількість клітин у внутрішньоназальній промивній рідині (10 /мл) і Сполука (I) (мг/мл) (% інгібування) Еозинофіли Нейтрофіли Носій 1,51±0,22 0,34±0,06 0,05 1,13±0,16 (25) 0,27±0,04 (21) 0,2 0,57±0,14 (62) 0,15±0,04 (56) N=8 на групу 5 Крім того, досліджували вплив введення сполуки, згідно з даним винаходом, на накопичення макрофагів і нейтрофілів в BALF після введення мишам полі(I:C). Виявилося, що введення сполуки формули (I) проводило залежне від дози інгібування індукованого полі(I:C) накопичення макрофагів і нейтрофілів в BALF (таблиця 5) Таблиця 5 Вплив введення сполуки формули (I) на індуковане полі(I:C) накопичення клітин в дихальних шляхах мишей Введення і доза сполуки формули (I) Кількість клітин в BALF (104/мл) (процент інгібування) (мг/мл) Макрофаги Нейтрофіли Наповнювач 5,0±0,90 3,0±0,55 Наповнювач+полі(I:C) 16,7±1,6 11,8±0,3 Полі(I:C)+(I) (0,002) 13,8±0,48 (25) 10,8±0,59 (11) Полі(I:C)+(I) (0,02) 12,2±0,29 (38) 9,4±0,26 (27) Полі(I:C)+(I) (0,2) 9,4±0,75 (61) 7,9±0,74 (44) Полі(I:C)+(I) (2) 6,4±1,2 (88) 5,6±0,66 (70) Дані для числа клітин представлені в формі "середнє значення ± SEM", N=5. 10 Вплив введення сполуки формули (I) на накопичення макрофагів і нейтрофілів в BALF визначали після вдихання сигаретного диму (таблиця 6). Таблиця 6 Вплив введення сполуки формули (I) пропіонату флутиказону на індуковане сигаретним димом накопичення клітин в BALF мишей a Введення і доза сполуки формули (I) Кількість клітин в BALF (104/мл)b (процент інгібування) (мкг/мл) Макрофаги Нейтрофіли Повітря+Наповнювач (0) 3,9±0,75 2,3±0,33 T+Наповнювач (0) 20,1±1,3 18,3±2,2 T+(I) (20) 14,9±0,65 (32) 13,0±0,55 (33) T+(I) (200) 10,6±0,02 (59) 10,2±0,83 (51) T+(I) (2000) 7,2±0,40 (80) 6,5±0,55 (91) T+(I) (2)+FP 13,7±0,63 (40) 12,4±1,0 (37) T+(I) (20)+FP 10,1±0,70 (62) 8,3±0,72 (63) T+(I) (200)+FP 5,8±0,48 (90) 4,5±0,49 (86) a) T=табачний дим, FP=флутиказону пропіонат в дозі 50 мкг/мл; b) дані для числа клітин представлені в формі "середнє значення±SEM", N=5. 15 20 Згідно з повідомленнями, модель сигаретного диму, що використовується для даного дослідження, являє собою систему, несприйнятливу до кортикостероїдів [Y. To et al., Am. J. Respir. Crit. Care Med., 2010 р., т. 182, с. 897-904; S. Medicherla et al., J. Pharmacol. Exp. Ther., 2008, 324:921-9], і дані показують, що пероральний дексаметазон (0,3-10 мг/кг) виявився неактивним, як і передбачалося. Вплив введення сполуки формули (I) на кількості нейтрофілів і активованих альвеолярних макрофагів в BALF демонструє, що вона має протизапальну активність при використанні як монотерапії. Крім того, коли сполуку згідно з даним винаходом вводили спільно з пропіонатом флутиказону в дозуванні, при якому відсутній який-небудь значний ефект у випадку монотерапії, було виявлено помітне підвищення протизапальної активності. 17 UA 109667 C2 5 10 15 Таким чином, сполука, згідно з даним винаходом, є потужним інгібітором обох ізоформ PI3кінази-дельта і -гамма. Її поведінка in vitro перетворюється в широкий протизапальний фенотип in vivo. У зв'язку з цим, значним є інгібуючий вплив сполуки, описаної в цьому документі, на індуковане полі(I:C) накопичення клітин в дихальних шляхах. Крім того, особливо несподіваним є те, що, на відміну від селективних інгібіторів PI3-кінази-дельта, введення сполуки, описаної в цьому документі, в чистому вигляді приводить до помітного інгібування індукованого сигаретним димом запалення дихальних шляхів, і що цей вплив спостерігається і при зменшенні дози, коли його вводять спільно з кортикостероїдом (флутиказону пропіонат) в станах, в яких введення чистого кортикостероїду не проводить ніякого впливу. У даному описі і наступній формулі винаходу, якщо інші умови не потрібні в контексті, слово "містити" і його форми, такі як "містить" і "що містить", потрібно розуміти як такі, що означають включення вказаного цілого процесу, стадії, групи цілих процесів або груп стадій, але не включення якого-небудь іншого процесу, стадії, групи цілих процесів або груп стадій. Всі патенти і патентні заявки, вказані в цьому документі, у всій своїй повноті включені в нього за допомогою посилання. ФОРМУЛА ВИНАХОДУ 1. Сполука формули (І): 20 O OMe N OMe O Cl N N N N N N HO H2 N , (I) 25 30 35 яка являє собою 6-(2-((4-аміно-3-(3-гідроксифеніл)-1H-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід або його фармацевтично прийнятну сіль, у тому числі всі відповідні стереоізомери, таутомери і ізотопні похідні. 2. Фармацевтична композиція, що містить сполуку за п. 1 в поєднанні з одним або декількома фармацевтично прийнятними розчинниками або носіями. 3. Застосування сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2 як лікарського засобу. 4. Застосування сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2 для лікування або запобігання стану, вибраному з наступних: COPD (включаючи хронічний бронхіт і емфізему), астма, дитяча астма, муковісцидоз, саркоїдоз, ідіопатичний легеневий фіброз, алергічний риніт, риніт, синусит, алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне до ревматоїдного артриту або остеоартриту, ревматоїдний артрит, панкреатит, кахексія, інгібування росту і метастазування пухлин, включаючи недрібноклітинні карциноми легень, карциноми молочної залози, карциноми шлунка, карциноми товстої і прямої кишки і злоякісні меланоми. 18 UA 109667 C2 5 10 15 5. Застосування сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2 для отримання лікарського засобу для лікування або запобігання стану, вибраному з наступних: COPD (включаючи хронічний бронхіт і емфізему), астма, дитяча астма, муковісцидоз, саркоїдоз, ідіопатичний легеневий фіброз, алергічний риніт, риніт, синусит, алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне до ревматоїдного артриту або остеоартриту, ревматоїдний артрит, панкреатит, кахексія, інгібування росту і метастазування пухлин, включаючи недрібноклітинні карциноми легень, карциноми молочної залози, карциноми шлунка, карциноми товстої і прямої кишки і злоякісні меланоми. 6. Спосіб лікування стану, вибраного з наступних: COPD (включаючи хронічний бронхіт і емфізему), астма, дитяча астма, муковісцидоз, саркоїдоз, ідіопатичний легеневий фіброз, алергічний риніт, риніт, синусит, алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, неспецифічний виразковий коліт, запалення суглобів, вторинне до ревматоїдного артриту або остеоартриту, ревматоїдний артрит, панкреатит, кахексія, інгібування росту і метастазування пухлин, включаючи недрібноклітинні карциноми легень, карциноми молочної залози, карциноми шлунка, карциноми товстої і прямої кишки і злоякісні меланоми, що включає введення пацієнту ефективної кількості сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 19
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinazolin-4(3h)-one derivatives used as pi3 kinase inhibitors
Автори англійськоюKing-Underwood, Johm, Ito, Kazuhiro, Murray, Peter John, Hardy, George, Brookfield, Frederick Arthur, Brown, Christopher John
Автори російськоюКинг-Андервуд Джон, Ито Казухиро, Мюррей Питер Джон, Харди Джордж, Брукфильд Фредерик Артур, Браун Кристофер Джон
МПК / Мітки
МПК: C07D 487/04, A61P 17/00, A61P 35/00, A61P 19/02, A61P 11/00, A61P 11/06, A61K 31/519
Мітки: використовуються, похідні, pі3-кінази, хіназолін-4(3н)-ону, інгібітори
Код посилання
<a href="https://ua.patents.su/21-109667-pokhidni-khinazolin-43n-onu-shho-vikoristovuyutsya-yak-ingibitori-pi3-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні хіназолін-4(3н)-ону, що використовуються як інгібітори pi3-кінази</a>
Попередній патент: Спосіб одержання нікель-карбонового нанокомпозита
Наступний патент: Герметизатор
Випадковий патент: Сатуратор-нагрівач