Похідні бенз(иліден)лактаму, фармацевтична композиція на їх основі та спосіб лікування
Формула / Реферат
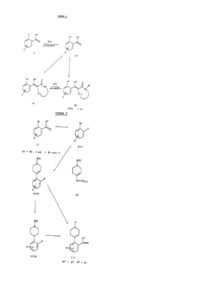
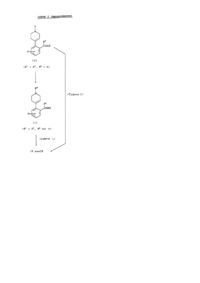
1. Соединение формулы (I):
,
в которой R1 представляет группу формулы G1:
,
где
R6 выбирают из группы, включающей водород, (С1-С6)алкил и [(С2-С4)алкил]арил, в котором арильная часть является фенилом или нафтилом, и где указанная арильная часть может, необязательно, быть замещенной одним или более заместителями, независимо выбранными из хлора, фтора, брома, йода, (C1-C6)алкила, (C1-C6)алкокси, трифторметила, циано и SOg(C1-C6)алкила, где g равен нулю, единице или двум;
х имеет значение от нуля до восьми;
каждый R13 представляет собой, независимо, (C1-C4)алкил;
R2 представляет водород, (C1-C4)алкил, фенил или нафтил, где указанные фенил или нафтил могут, необязательно, быть замещенными одним или несколькими заместителями, независимо выбранными из хлора, фтора, брома, йода, (C1-C6)алкила, (C1-C6)алкокси, трифторметила, циано и SOg(C1-C6)алкила, где g равен нулю, единице или двум;
R3 представляет собой (СН2)mB, где m имеет значение ноль, один, два или три, и В является водородом, фенилом или нафтилом, и где каждая из упомянутых выше арильных групп может быть, необязательно, замещена одним или несколькими заместителями, независимо выбранными из хлора, фтора, брома, йода, (C1-C6)алкила, (C1-C6)алкокси, трифторметила, циано, гидрокси, СООН и SOg(C1-C6)алкила, где g равен нулю, единице или двум;
Z представляет собой CR4R5, где R4 и R5 независимо выбирают из водорода, (C1-C6) алкила и трифторметила, и n равно 2;
или Z представляет собой фенилен, необязательно замещенный одним или несколькими заместителями, независимо выбранными из хлора, фтора, брома, йода, (C1-C6)алкила, (C1-C6)алкокси, трифторметила, циано, гидрокси, СООН и SOg(C1-C6)алкила, где g равен нулю, единице или двум, и где два смежных кольцевых члена Z являются также членами кольца А, и n равно 1;
X представляет собой водород, хлор, фтор, бром, йод, циано, (C1-C6)алкил, гидрокси, трифторметил, (C1-C6)алкокси, SOg(C1-C6)алкил, в котором g равен нулю, единице или двум, CO2R10 или CONR11R12;
каждый из R10, R11 и R12 выбирают, независимо, из группы радикалов, указанных при определении R2; и
пунктирная линия указывает на необязательную двойную связь;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, в котором Z представляет собой СН2.
3. Соединение по п. 1, в котором n равно двум.
4. Соединение по п. 1, в котором R3 является замещенным фенилом.
5. Соединение по п. 1, в котором указанное соединение выбирают из группы, включающей следующие соединения:
3-[2-(4-метилпиперазин-1-ил)бензилиден]-1,3-дигидроиндол-2-он;
6-хлор-3-[2-(4-метилпиперазин-1-ил)бензилиден]-1,3-дигидроиндол-2-он;
5-хлор-3-[2-(4-метилпиперазин-1-ил)бензилиден]-1,3-дигидроиндол-2-он;
1-метил-3-[2-(4-метилпиперазин-1-ил)бензилиден]-1,3-дигидроиндол-2-он;
3-[2-(4-метилпиперазин-1-ил)бензилиден]-1-фенил-1,3-дигидроиндол-2-он;
1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
1-(3,4-дихлорбензил)-3-[2-(4-метилпиперазин-1-ил)бензилиден]-1,3-дигидроиндол-2-он;
1-(4-хлорбензил)-3-[2-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
1-(4-хлорбензил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
1-(3,4-дифторфенил)-3-[2-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
1-(2,4-дихлорбензил)-3-[2-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
1-(3,4-дихлорфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
3-[2-(4-метилпиперазин-1-ил)бензилиден]-1-фенилпирролидин-2-он;
3-[2-(4-метилпиперазин-1-ил)бензилиден]-1-(4-трифторметилфенил)пирролидин-2-он;
1-(3,4-дифторфенил)-3-[2-(4-метилпиперазин-1-ил)-бензил]пирролидин-2-он;
3-[2-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
3-[5-фтор-2-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
3-[2-(4-метилпиперазин-1-ил)бензил]-1-фенилпирролидин-2-он;
3-[2-(4-метилпиперазин-1-ил)бензилиден]-1-(п-толил)пирролидин-2-он;
3-[4-фтор-2-(4-метилпиперазин-1-ил)бензилиден]-1-фенилпирролидин-2-он;
1-(3,4-дихлорфенил)-3-[2-фтор-6-(4-метилпиперазин-1-ил)бензилиден]пирролидин-2-он;
3-[2-(4-метилпиперазин-1-ил)бензил]-1-(4-трифторметилфенил)пирролидин-2-он
и фармацевтически приемлемые соли этих соединений.
6. Фармацевтическая композиция, содержащая соединение по п. 1 в фармацевтически эффективном количестве и фармацевтически приемлемый носитель.
7. Способ лечения или профилактики заболевания или coстояния, выбранного из депрессии, генерализированного беспокойства, фобий, посттравматического стресс-синдрома, обсессивно-компульсивного расстройства и расстройства панического типа у млекопитающих, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, соединения по п. 1 в количестве, которое эффективно при лечении или профилактике таких заболеваний или состояний.
Текст
Настоящее изобретение относится к производным лактама, способам и промежуточным соединениям их получения, к содержащим их фармацевтическим композициям и к их использованию в медицине. Соединения по настоящему изобретению включают селективные агонисты и антагонисты рецепторов серотонина 1 (5-НТ), особенно одного или обоих 5-НТ1А и 5-НТ1D рецепторов. Они полезны для лечения или профилактики мигрени, депрессии и други х заболеваний, при которых необходимы агонисты или антагонисты 5-НТ. Публикация Европейского патента 434,561, опубликованного 26 июня 1991 года, относится к 7-алкил-, алкокси- и гидрокси-замещенным 1-(4-замещенным-1-пиперазинил)нафталинам. Соединения относятся к агонистам и антагонистам 5-НТ, являющимся полезными для лечения мигрени, депрессии, чувства тревоги, шизофрении, стресса и боли. Публикация Европейского патента 343,050, опубликованного 23 ноября 1989 года, относится к 7незамещенным, галогенированным и метокси-замещенным 1-(4-замещенным-1-пиперазинил)нафталинам, полезным для 5-НТ1A лигандной терапии. Glennon и др., ссылается на 7-метокси-1-(1-пиперазинил) нафталин как полезный 5-НТ лиганд в своей статье "5-НТ1D рецепторы серотонина" ("5-НТ1D Serotonin Receptors"), Clinical Drug Res. Dev., 22, 25-36 (1991). Статья Glennon "Рецепторы серотонина: клинические выводы" ("Serotonin Receptors: Clinical implications"), Neuroscience and Behavoral Reviews, 14, 35-47 (1990) ссылается на фармакологическое воздействие, связанное с рецепторами серотонина, на подавление аппетита, терморегуляцию, кардиоваскулярное/гипотензивное действие, сон, психозы, чувство тревоги, депрессию, тошноту, р воту, болезнь Альцгеймера, болезнь Паркинсона и болезнь Гантингтона. Лиганды с высоким сродством к рецепторам 5-НТ хорошо известны, как имеющие терапевтическое значение для лечения у человека симптомов, вызванных серотониновым дисбалансом. Заявка на Международный патент WO 95I31988, опубликованная 30 ноября 1995 года, ссылается на использование 5-НТ1D антагониста в сочетании с 5-НТ1A антагонистом для лечения заболеваний ЦНС (центральной нервной системы), таких как депрессия, повышенная возбудимость, чувство паники, агорафобия, социальная фобия, навязчивые расстройства, посттравматический стресс, нарушения памяти, невротическая анорексия и невротическая булимия, болезнь Паркинсона, замедленная дискинезия, эндокринные нарушения, такие как гиперпролактинаемия, вазоспазм (особенно сосудов мозга) и гипертензия, заболевания желудочно-кишечного тракта, в которых наблюдаются изменения подвижности и секреции, так же как и половые расстройства. G. Maura и др., J. Neurochem, 66 (1), pp. 203-209 (1966), установили, что введение агонистов, селективных к 5-НТ1A рецепторам или к обоим 5-НТ1A и 5-НТ1D рецепторам, может дать значительное улучшение при лечении церебральных расстройств, мультифасеточного синдрома, для лечения которых не имеется установленных терапевтических средств. Настоящее изобретение относится к соединениям формулы I, изображенной ниже, в которой R1 представляет группу формулы G 1, G2 , G 3, G4 или G5, изображенных ниже где Е является кислородом, серой, SO или SO2 ; R6 и R7 независимо выбирают из группы, включающей водород, (С1-С6) алкил, [(С2-С4)алкил]арил, в котором арильная часть является фенилом или нафтилом, и гетероарил-(СH2)q , в котором гетероарильную часть выбирают из пиридила, пиримидила, бензоксазолила, бензотиазолила, бензизоксазолила и бензизотиазолила, и q равен нулю, единице, двум, трем или четырем, и где указанные арильная и гетероарильная части могут, необязательно, быть замещенными одним или более заместителями, предпочтительно от нуля до трех заместителей, независимо выбранных из хлора, фтора, брома, йода, (С1 С6)алкила, (С1-С6)алкокси, трифторметила, циано и SOg (С1-С6)алкила, в котором g равен нулю, единице или двум; или R6 и R7 вместе образуют углеродную цепь из 2-4 атомов; x составляет от н уля до восьми; каждый R13 представляет собой, независимо, (С1-С4)алкил или (С1-С4)метилeновый мостик от одного из углеродов кольца в пиперазиновом или пиперидиновом кольце в заместителях G1 или G2, соответственно, к тому же самому или к другому кольцевому углероду или азоту кольца в пиперазиновом или пиперидиновом кольце в заместителях G1 или G2, соответственно, имеющих доступные места связывания, или к углероду кольца заместителя R6, имеющего доступное место связывания; R8 выбирают из водорода и (С1-С3)алкила; R9 выбирают из водорода и (С1-С6)алкила; или R8 и R9 вместе с атомом азота, с которым они связаны, образуют 5 - 7-членное кольцо; и p равен единице, двум или трем; R2 представляет водород, (С1-С4)алкил, фенил или нафтил, причем указанные фенил или нафтил могут, необязательно, бытьзамещенными одним или более заместителями, предпочтительно от нуля до трех заместителей, независимо выбранных из хлора, фтора, брома, йода, (С1-С6)алкила, (С1-С6)алкокси, трифторметила, циано и SOg (С1-С6)алкила, в котором g равен нулю, единице или двум; R3 представляет собой (СН2)mВ, где m составляет ноль, один, два или три, и В является водородом, фенилом, нафтилом или 5- или 6-членной гетероарильной группой, содержащей от одного до четырех гетероатомов в кольце (например, фурил, тиенил, пиридил, пиримидил, тиазолил, пиразолил, изотиазолил, оксазолил, изоксазолил, пирролил, триазолил, тетразолил, имидазолил и т.д.) и в котором каждая из упомянутых вы ше арильных и гетероарильных групп может, быть, необязательно, замещена одним или более заместителями, предпочтительно от нуля до трех заместителей, независимо выбранных из хлора, фтора, брома, йода, (С1-С6)алкила, (С1-С6)алкокси, трифторметила, циано, гидрокси, СООН и SOg (С1С6)алкила, в котором g равен нулю, единице или двум; Ζ представляет CR4R5, в котором R4 и R5 независимо выбирают из водорода, (С1-С6)алкила и трифторметила; или Ζ может быть одной из арильных или гетероарильных групп, на которые ссылались при определении В выше, и в которой два смежных кольцевых члена Ζ являются также членами кольца А; X представляет собой водород, хлор, фтор, бром, иод, циано, (С1-С6)алкил, гидрокси, трифторметил, (С1-С6)алкокси, SOg (С1-С6)алкил, в котором g равен нулю, единице или двум, CO2R 10 или CONR 11R12; каждый из R10, R11 и R12 выбирают, независимо, из группы радикалов, указанных при определении R2; или R11 и R12 , вместе с атомом азота, с которым они связаны, образуют от 5- до 7-членного кольца, которое может содержать от нуля до четырех гетероатомов, выбранных из азота, серы или кислорода, например, где NR11R12 представляет пирролидинил, пирролил, имидазолил, триазолил, тетразолил, пиперидил, пиперазинил, морфолинил, тиоморфолинил, гексаметилениминил, диазепинил, оксазепинил, тиазепинил, оксадиазепинил, тиадиазепинил или триазепинил; n составляет один, два, три или четыре, и прерывистая линия указывает на необязательную двойную связь; при условии, что n должен быть единицей, когда Ζ представляет арильную или гетероарильную группу; и их фармацевтически приемлемые соли. Далее приведены более конкретные воплощения групп G1 и G2 . Настоящее изобретение также относится к фармацевтически приемлемым кислотно-аддитивным солям соединений формулы I. Кислоты, которые используются для получения фармацевтически приемлемых солей присоединения кислот к вышеотмеченным основным соединениям по настоящему изобретению, это те, которые образуют нетоксичные кислотно-аддитивные соли, т. е. соли, содержащие фармакологически приемлемые анионы, такие соли, как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Изобретение также относится к основным аддитивным солям формулы I. Химические основания, которые могут использоваться в качестве реагентов для получения фармацевтически приемлемых солей соединений формулы I, которые являются кислыми по своей природе, с основаниями, это те, которые образуют нетоксичные основные соли с такими соединениями. Такие нетоксичные основные соли включают, но не ограничиваются ими, производные таких фармакологически приемлемых катионов, как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, кальция и магния), аммония или соли присоединения с водорастворимыми аминами, такими как N-метилглюкамин-(меглюмин), и низшие алканоламмониевые и другие основные соли фармацевтически приемлемых органических аминов. Соединения по настоящему изобретению включают все стереоизомеры и все оптические изомеры соединений формулы I (например, R и S энантиомеры), так же как и рацемические, диастереомерные и другие смеси таких изомеров. Если не указано другого, алкильные и алкенильные группы, на которые ссылаются здесь, так же как и алкильные части других гр упп, на которые ссылаются здесь (например, алкокси), могут быть линейными или разветвленными, и они могут также быть циклическими (например, циклопропил, циклобутил, циклопентил или циклогексил) или быть линейными или разветвленными и включать циклические группы. Если не указано другого, галоген включает фтор, хлор, бром и йод. Предпочтительные соединения формулы I включают те, в которых R1 представляет пиперазинил. Предпочтительные соединения формулы I также включают те, в которых Ζ является СН2. Предпочтительные соединения формулы I также включают те, в которых n равен двум или трем. Предпочтительные соединения формулы I также включают те, в которых R 3 представляет замещенный фенил. Примерами конкретных предпочтительных соединений формулы I являются следующие: 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1,3-дигидро-индол-2-он; 6-хлор-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1,3-дигидро-индол-2-он; 5-хлор-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1,3-дигидро-индол-2-он; 1-метил-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1,3-дигидро-индол-2-он; 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1-фенил-1,3-дигидро-индол-2-он; 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 1-(3,4-дихлорбензил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1,3-дигидро-индол-2-он; 1-(4-хлорбензил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 1-(4-хлорбензил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 1-(3,4-дифторфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 1-(2,4-дихлорбензил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 1-(3,4-дихлорфенил-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 1-(4-хлорбензил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он; 1-(3,4-дихлорбензил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он; 1-(4-хлорфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он; 1-(3,4-дихлорфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он; 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1-фенил-пирролидин-2-он; 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1-(4-трифторметилфенил)-пирролидин-2-он; 1-(3,4-дифторфенил)-3-[2-(4-метилпиперазин-1-ил)-бензил]-пирролидин-2-он; 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он; 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензил]-пиперидин-2-он; 1-(4-метоксифенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-3,4-дигидро-1Н-хинолин-2-он; 1-(3,4-дихлорфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензил]-пиперидин-2-он; 3-[2-(4-метилпиперазин-1-ил)-бензил]-1-фенил-пирролидин-2-он; 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1-(п-толил)-пирролидин-2-он; 3-[4-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-1-фенил-пирролидин-2-он; 1-(3,4-дихлорфенил)-3-[2-фтор-6-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он; 1-(3,4-дифторфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пиперин-2-он; 1-[2-(4-хлорфенил)этил]-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он; 1-(3,4-дихлорфенил)-3-[2-(2-диметиламиноэтокси)-бензилиден]-пирролидин-2-он; и 3-[2-(4-метилпиперазин-1-ил)-бензил]-1-(4-трифторметилфенил)-пирролидин-2-он. Другие соединения формулы I включают следующие: 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-азетидин-2-он; 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-азепин-2-он; 1-(3,4-дихлорфенил)-3-{1-[2-(4-метилпиперазин-1-ил)фенил]этил}-пирролидин-2-он; 1-(3,4-дихлорфенил)-3-{1-[2-(4-метилпиперазин-1-ил)фенил]этил}-пиперидин-2-он; 1-(3,4-дихлорфенил)-3-{1-[2-(4-метидпиперазин-1-ил)фенил]этилиден}-пирролидин-2-он; 1-(3,4-дихлорфенил)-3-{1-[2-(4-метилпиперазин-1-ил)фенил]этилиден}-пиперидин-2-он; 1-(3,4-дихлорфенил)-3-{[2-(4-метилпиперазин-1-ил)фенил]фенилметилен}-пирролидин-2-он; 1-(3,4-дихлорфенил)-3-{2-[(2-диметиламиноэтил)-метиламино]-бензилиден}-пирролидин-2-он; 1-(3,4-дихлорфенил)-3-[2-(пирролидин-1-илэтокси)-бензилиден]-пирролидин-2-он; 1-(3,4-дихлорфенил)-3-[2-(2-диметиламиноэтиламино)-бензилиден]-пирролидин-2-он; 2-(3,4-дихлорфенил)-3-[2-(2-диметиламиноэтиламино)-бензилиден]-пирролидин-2-он; 2-(3,4-дихлорфенил)-4-[2-(4-метилпиперазин-1-ил)-бензилиден]-октагидро-изохинолин-3-он; 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-октагидро-хинолин-2-он; 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-октагидро-индол-2-он; и 1-(3,4-дихлорфенил)-5,5-диметил-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики заболеваний или симптомов, выбранных из гипертензии, депрессии, состояния общего возбуждения, фобий (например, агорафобии, социальной фобии и простых фобий), синдрома посттравматического стресса, нарушения общения, преждевременного семяизвержения, расстройств питания (например, невротической анорексии и невротической булимии), ожирения, химических зависимостей (например, от алкоголя, кокаина, героина, фенобарбитуратов, никотина и бензодиазепинов), кластерной головной боли, мигрени, болей, болезни Альцгеймера, навязчивых состояний, чувства тревоги, расстройств памяти (например, слабоумия, амнетических нарушений и возрастной потери памяти), болезней Паркинсона (например, слабоумия при болезни Паркинсона, нейролептически индуцированного паркинсонизма и запаздывающей дискинезии), эндокринных заболеваний (например, гиперпролактинаемия), вазоспазма (особенно в церебральных сосудах), церебральных расстройств координации движений, заболеваний желудочно-кишечного тракта, приводящих к изменениям в моторике и секреции, и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми нарушениями, у млекопитающих, предпочтительно у человека, включающей количество соединения формулы I или его фармацевтически приемлемой соли, эффективное для лечения или профилактики таких заболеваний или симптомов, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики заболеваний или симптомов, которые могут излечиваться или предотвращаться посредством усиления серотонергической нейротрансмиссии у млекопитающих, предпочтительно у человека, включающей такое количество соединения формулы I или его фармацевтически приемлемой соли, которое эффективно для лечения или профилактики таких заболеваний или симптомов, и фармацевтически приемлемый носитель. Примерами таких заболеваний и симптомов являются перечисленные в предыдущем абзаце. Настоящее изобретение также относится к способу лечения или профилактики заболеваний или симптомов, выбранных из гипертензии, депрессии, состояния общего возбуждения, фобий (например, агорафобия, социальная фобия и простые фобии), синдрома посттравматического стресса, нарушения общения, преждевременного семяизвержения, расстройств питания (например, невротическая анорексия и невротическая булимия), ожирения, химических зависимостей (например, от алкоголя, кокаина, героина, фенобарбитуратов, никотина и бензодиазепинов), кластерной головной боли, мигрени, болей, болезни Альцгеймера, навязчивых состояний, чувства тревоги, расстройств памяти (например, слабоумие, амнетические нарушения и возрастная потеря памяти), болезней Паркинсона (например, слабоумие при болезни Паркинсона, нейролептически индуцированный паркинсонизм и запаздывающая дискинезия), эндокринных заболеваний (например, гиперпролактинаемия), вазоспазма (особенно в церебральных сосудах), церебральных расстройств координации движений, заболеваний желудочно-кишечного тракта, приводящих к изменениям в моторике и секреции, и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми нарушениями, у млекопитающих, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике, такого количества соединения формулы I или его фармацевтически приемлемой соли, которое эффективно при лечении или профилактике таких заболеваний или симптомов. Настоящее изобретение также относится к способу лечения или профилактики заболевания или симптомов, которые могут излечиваться или предотвращаться посредством усиления серотонергической нейротрансмиссии у млекопитающих, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике, такого количества соединения формулы I или его фармацевтически приемлемой соли, которое эффективно при лечении или профилактике таких заболеваний или симптомов. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики заболеваний или симптомов, выбранных из гипертензии, депрессии, состояния общего возбуждения, фобий (например, агорафобия, социальная фобия и простые фобии), синдрома посттравматического стресса, нарушения общения, преждевременного семяизвержения, расстройств питания (например, невротическая анорексия и невротическая булимия), ожирения, химической зависимости (например, от алкоголя, кокаина, героина, фенобарбитуратов, никотина и бензодиазепинов), кластерной головной боли, мигрени, болей, болезни Альцгеймера, навязчивых состояний, чувства тревоги, расстройств памяти (например, слабоумие, амнетические нарушения и возрастная потеря памяти), болезней Паркинсона (например, слабоумие при болезни Паркинсона, нейролептически индуцированный паркинсонизм и запаздывающая дискинезия), эндокринных нарушений (например, гиперпролактинаемия), вазоспазма (особенно в церебральных сосудах), церебральных расстройств координации движений, заболеваний желудочно-кишечного тракта, приводящих к изменениям в моторике и секреции, и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми нарушениями, у млекопитающих, предпочтительно у человека, включающей эффективное для антагонизма или агонизма серотонинового рецептора количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к фармацевтической композиции для лечения или профилактики заболеваний или симптомов, которые могут излечиваться или предотвращаться посредством усиления серотонергической нейротрансмиссии у млекопитающих, предпочтительно у человека, включающей эффективное для антагонизма или агонизма серотонинового рецептора количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения или профилактики заболеваний или симптомов, выбранных из гипертензии, депрессии, состояния общего возбуждения, фобий (например, агорафобия, социальная фобия и простые фобии), синдрома посттравматического стресса, нарушения общения, половых расстройств (например, преждевременное семяизвержение), расстройств питания (например, невротическая анорексия и невротическая булимия), ожирения, химической зависимости (например, зависимости от алкоголя, кокаина, героина, фенобарбитуратов, никотина и бензодиазепинов), кластерной головной боли, мигрени, болей, болезни Альцгеймера, навязчивых состояний, чувства тревоги, расстройств памяти (например, слабоумие, амнетические нарушения и возрастная потеря памяти), болезней Паркинсона (например, слабоумие при болезни Паркинсона, нейролептически индуцированный паркинсонизм и запаздывающая дискинезия), эндокринных заболеваний (например, гиперпролактинаемия), вазоспазма (особенно в церебральных сосудах), церебральных расстройств координации движений, заболеваний желудочно-кишечного тракта, приводящих к изменениям в моторике и секреции, и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми нарушениями, у млекопитающих, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике, эффективного для антагонизма или агонизма серотонинового рецептора количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу лечения или профилактики заболевания или симптомов, которые могут излечиваться или предотвращаться посредством усиления серотонергической нейротрансмиссии у млекопитающих, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике, эффективного для антагонизма или агонизма серотонинового рецептора количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение относится к фармацевтической композиции для лечения или профилактики симптомов или заболеваний, которые могут излечиваться или предотвращаться посредством усиления серотонергической нейротрансмиссии у млекопитающих,·предпочтительно у человека, включающей: a) фармацевтически приемлемый носитель; b) соединение формулы I или его фармацевтически приемлемую соль; и c) 5-НТ ингибитор обратного захвата, предпочтительно сертралин, или его фармацевтически приемлемую соль; в которой количество активных соединений (т.е. соединения формулы I и 5-НТ вновь поглощающего ингибитора) являются такими, что их комбинация является эффективной для лечения или профилактики таких заболеваний или симптомов. Настоящее изобретение также относится к способу лечения или профилактики симптомов или заболеваний, которые могут излечиваться или предотвращаться посредством усиления серотонергической нейротрансмиссии у млекопитающих, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике: a) соединения формулы I, определенного выше, или его фармацевтически приемлемой соли; и b) 5-НТ ингибитора обратного захвата, предпочтительно сертралина, или его фармацевтически приемлемой соли; в котором количество активных соединений (т.е. соединения формулы I и 5-НТ вновь поглощающего ингибитора) являются такими, что их комбинация является эффективной для лечения или профилактики таких заболеваний или симптомов. Настоящее изобретение также относится к способу лечения или профилактики симптомов или заболеваний, которые могут излечиваться или предотвращаться посредством усиления серотонергической нейротрансмиссии у млекопитающих, предпочтительно у человека, включающему введение млекопитающему, нуждающемуся в таком лечении или профилактике: a) антагониста 5-НТ1A или его фармацевтически приемлемой соли; b) антагониста 5-НТ1D или его фармацевтически приемлемой соли; в котором количество каждого активного соединения (т.е. антагониста 5-НТ1A и антагониста 5-НТ1D) являются такими, что их комбинация является эффективной для лечения или профилактики таких заболеваний или симптомов. "Усиление серотонергической нейротрансмиссии", как это используется здесь, относится к увеличению или улучшению нейронных процессов, при которых серотонин высвобождается из пресинаптической клетки при возбуждении и переходит синапс для стимулирования или ингибирования пост-синаптической клетки. "Химическая зависимость", как это использовано здесь, означает патологическую потребность в лекарствах или желание, или склонность к лекарствам. Такие лекарства обычно применяются для возбудимых индивидуумов посредством введения любым из множества способов, включая оральный, парентеральный, назальный или посредством ингаляции. Примерами химических зависимостей, излечиваемых способами по настоящему изобретению являются алкогольная зависимость, зависимость от никотина, кокаина, героина, фенобарбитуратов и бензодиазепинов (например, Валиума (торговая марка)). "Излечивание химической зависимости", как это использовано здесь, означает уменьшение или облегчение такой зависимости. Сертралин, (1S-цис)-4-(3,4-дихлорфенил)-1,2,3,4-тетра-гидро-N-метил-1-нафталинамин, как использовано здесь, имеет химическую формулу C17H17NCI 2 и следующую стр уктурную формулу: Его синтез описан в патенте Соединенных Штатов Америки 4,536,518, поданном Pfizer Inc. Гидрохлорид сертралина является полезным в качестве антидепрессанта и снижающего аппетит агента, он также полезен при лечении депрессии, химических зависимостей, тревожно-навязчивых заболеваний, фобий, паники, посттравматического стресса и преждевременного семяизвержения. Соединения формулы I могут быть получены согласно следующим реакционным схемам и их обсуждению. Если не указано другого, группы с R 1 по R12, с G1 по G5, Χ, Α, Β, Ε, Ζ, n, m, p, q и g и структурная формула I на следующи х далее реакционных схемах и при обсуждении являются такими, как определено выше. Схема 1 иллюстрирует способ синтеза соединений формулы I, где пунктирная линия представляет двойную углерод-углеродную связь, a R1 является группой формулы G1, G3, G 4 или G5. Ссылаясь на Схему 1, соединение формулы II, в котором Q является подходящей уходящей гр уппой (например, хлор, фтор, бром, мезилат, тозилат и т.д.) реагирует с соединением формулы R1Н, в которой R1 представляет группу формулы G1, G3 , G4 или G5, в присутствии основания с образованием соответствующего соединения формулы III. Эту реакцию обычно осуществляют при температуре от примерно 0°С до примерно 140°С, предпочтительно примерно при температуре кипения в полярном растворителе, таком как диметилсульфоксид (ДМСО), N,N-диметилформамид (ДМФА), Ν,Ν-диметилацетамид (ДМА) или N-метил-2пирролидинон (ΝΜΡ), предпочтительно в ДМФА. Подходящие основания включают безводный карбонат натрия (Na2CO3), карбонат калия (К2СO3), гидроксид натрия (NaOH) и гидроксид калия (КОН), так же как и третичные амины, такие как пирролидин, триэтиламин и пиридин. Предпочтительным является безводный карбонат калия. Соединения формулы III могут быть переведены в соединения формулы І, в которых R3 отличается от водорода (т.е. соединения формулы IB, как показано на Схеме 1), посредством введения их в альдольную конденсацию или реакцию Виттига. Например, в случае альдольной конденсации, соединение формулы III может взаимодействовать с соединением формулы в присутствии основания с образованием альдольного интермедиата формулы V, который может быть выделен или переведен непосредственно на той же реакционной стадии в соединение формулы IB за счет потери воды. Степень окончания превращения соединений формулы III в альдольные продукты формулы IB может оцениваться с использованием одного или более аналитических методов, таких как тонкослойная хроматография (ТСХ) или масс-спектрометрия. В некоторых случая х может оказаться возможным или желательным выделить промежуточное соединение формулы V. В таком случае соединение формулы V может быть превращено в соединение формулы IB за счет элиминирования воды с использованием методов, знакомых специалистам в данной области, например, посредством нагревания при температуре кипения раствора соединения формулы V в растворителе, таком как бензол, толуол или ксилол, в присутствии каталитического количества бензол- или п-толуолсульфоновой кислоты с условием удаления образующейся воды. Такие способы удаления воды могут включать использование молекулярных сит или насадки Дина-Старка для отделения воды в виде азеотропа с растворителем. Альдольную реакцию обычно осуществляют в полярном растворителе, таком как ДМСО, ДМФА, тетрагидрофуран (ТГФ), метаноле или этаноле, при температуре от примерно -25°С до примерно 80°С. Предпочтительно, эту реакцию осуществляют в ТГФ при примерно 25°С. Подходящие основания для использования на стадии образования альдоля включают К2СO3 , Na2CO3 , гидрид натрия (NaH), пирролидин и пиперидин. Предпочтительным является гидрид натрия. Альдольные конденсации описаны в "Modern Synthetic Reactions" ("Современные синтетические реакции" Herbert О. House, 2d Edition, W.A. Benjamin, Menlo Park, California, 1972, pp. 629-682). Соединения формулы І, в которых R3 является водородом (соединения формулы IA, как изображено на Схеме 1), могут быть получены посредством альдольной конденсации способом, аналогичным описанному выше для образования соединений формулы IB, но исходя в качестве исходного материала из соединений формулы IV, в которой R3 является водородом или -C(=O)R 13, где R13 является (С1-С6)алкилом или трифторметилом. Соединения формулы ІА могут быть переведены в соединения формулы IB посредством введения их в реакцию с соединением формулы R 3Y, в которой Υ является уходящей группой и определен как Q, определенный выше. Эти реакции могут быть осуществлены в растворителе, таком как диалкиловый эфир, ТГФ, ДМФА, ДМА или ДМСО, предпочтительно в ДМФА, в присутствии основания, такого как карбонат калия, карбонат натрия, гидрид натрия, гидрид калия, гидроксид натрия или гидроксид калия, предпочтительно, гидрид натрия. Температуры реакции могут колебаться от примерно 0°С до примерно 150°С, предпочтительно от примерно 25°С до примерно температуры кипения растворителя. Альтернативно, соединение формулы IV может быть превращено в соединение формулы IB посредством олефинирования по Виттигу, как описано в Helvetica Chimica Acta, 1963, 46, 1580 и изображено ниже. Таким образом, соединение формулы IV может быть превращено в соответствующий бромид формулы ХI с использованием стандартных условий бромирования, с последующей обработкой трифенилфосфином в безводном ТГФ с образованием промежуточного соединения формулы XII. Соединение формулы XII затем может быть обработано сильным основанием (например, водным Na 2CO3) с образованием соответствующего фосфониевого илида, который затем может быть введен во взаимодействие с подходящим промежуточным соединением формулы III, давая соединения общей формулы I. Такое превращение описано A. Maercker, Organic Reactions, 1965, 14, 270. Соединения формулы I, в которых пунктирная линия представляет ординарную углерод-углеродную связь, могут быть получены гидрированием соответствующи х соединений, в которых пунктирная линия обозначает двойную углерод-углеродную связь, с использованием стандартных способов, хорошо известных специалистам в данной области. Например, восстановление двойной связи может быть осуществлено газообразным водородом (Н2) с использованием таких катализаторов, как палладий на углероде (Pd/C), палладий на сульфате бария (Pd/BaSO4), платина на углероде (Pt/C) или хлорид трис(трифенилфосфин)родия (катализатор Вилкинсона), в подходящем растворителе, таком как метанол, этанол, ТГФ, диоксан или этилацетат, при давлении от примерно 1 до примерно 5 атмосфер и при температуре от примерно 10°С до примерно 60°С, как описано в Catalytic Hydrogenation in Organic Synthesis (Каталитическое гидрирование в органическом синтезе), Paul Rylander, Academic Press Inc., San Diego, 1979, pp. 31-63. Следующие условия являются предпочтительными: Pd на углероде, метанол при 25°С и давлении водорода 50 фунтов на квадратный дюйм (344,74КПа) . Этот метод также обеспечивает введение изотопов водорода (т.е. дейтерия, трития) посредством замены 1Н2 на 2Н2 или 3Н2 в' вышеуказанном способе. Альтернативный способ, в котором применяют такие реагенты, как формиат аммония и Pd/C в метаноле при температуре образования флегмы в инертной атмосфере (например, газы азот или аргон), также является эффективным при восстановлении углерод-углеродной двойной связи соединений формулы I. Другой альтернативный способ включает селективное восстановление углерод-углеродной двойной связи посредством использования самария и йода или йодида самария (Sml2) в метаноле или этаноле при комнатной температуре, как описано R. Yanada и др., Synlett, 1995, pp.443-4. Исходные вещества формул II и IV или являются коммерчески доступными, или известными в данной области техники. Например, соединения формулы II, в которых R 2 представляет водород, коммерчески легко доступны или могут быть получены с использованием способов, описываемых в химической литературе. Они также могут быть получены из соответствующи х карбоновых кислот или сложных эфиров (т.е. формулы II, в которой R2 = ОН или О-алкил), которые коммерчески доступны. Эти кислоты или сложные эфиры могут быть восстановлены до соответствующи х спиртов формулы XIII, приведенной ниже, в которой Q определен так же, как в формуле II, посредством использования одного или более из множества восстанавливающих агентов и условий, зависящи х от природы заместителей Q и X. Такие восстанавливающие агенты включают боргидрид натрия (NaBH4), цианоборгидрид натрия (NaCNBH3), литийалюминийгидрид (LiAlH 4), боран в ТГФ (ВН3·ΤГΦ) в таких растворителях, как метанол, этанол, ТГФ, диэтиловый эфир и диоксан. Окисление спирта формулы XIII до соответствующего альдегида формулы II может быть осуществлено с использованием селективных окисляющих агентов, таких как реагент Джонса (хромат водорода (Н2СrO4)), хлорхромат пиридиния (РСС) или диоксид марганца (МnО2). Ссылки на такие превращения легко доступны (например, К.В. Wiberg, Oxidation in Organic Chemistry (Окисление в органической химии), Часть A, Academic Press Inc., N.Υ., 1965, pp. 69-72). Исходные вещества формулы IV могут быть получены несколькими способами, включая методы, описанные в литературе. Например, соединения формулы IV, в которых Ζ является ароматическим кольцом и n=1 (т.е. 1,3-дигидро-индол-2-он и его замещенные аналоги), являются коммерчески доступными или могут быть получены с использованием методов, описываемых, например, H.R. Howard и R. Sarges, Патент США 4,476,307 от 9 октября 1984 года. Один из способов получения исходных соединений формулы IV, в которых Ζ представляет CR4R5 и n является единицей, двумя или тремя, включает конденсацию циклического лактона формулы VIII с амином формулы H2NR3, как показано ниже, в присутствии сильной минеральной кислоты, такой как соляная кислота (НСl) (см., M.J. Kornet, J. Pharm. Sci., 1979, 68 (3), 350; и J. Het. Chem., 1966, 3, 311). Альтернативно, соединения формулы IV, в которых R3 является водородом (соединения формулы IVA), могут быть проалкилированы с образованием соответствующи х соединений, в которых R3 не является водородом (соединения формулы IB), с использованием стандартных приемов, доступных специалистам, например, посредством (а) генерации аниона требуемого соединения IVA с использованием системы сильное основание/полярный растворитель, такой как NaH/ΤΓΦ, NaH/ДМФА или н-бутиллитий/ТГФ (n-buLi/ΤΓΦ), при температуре от примерно -30°С до примерно температуры кипения растворителя, в течение периода времени от примерно 5 минут до примерно 24 часов, и (b) обработки аниона алкилирующим агентом формулы R3Y, где Υ - уходящая группа, такая как хлор, бром, йод или мезилат. Этот способ изображен ниже. Вышеуказанные превращения соединений формулы IVA в соединения формулы IVB могут также достигаться с использованием условий межфазного катализа, как описано Takahata и др., Heterocycles, 1979, 12 (11), pp. 1449-1451. Соединения формулы R1H, используемые для получения промежуточных соединений формулы III, легко доступны или могут быть получены с использованием стандартных способов органического синтеза, известных специалистам и приспособленных, исходя из методов, описываемых в химической литературе. Например, получение соединений формулы R1H, где R1 представляет собой G1, может быть осуществлено с использованием следующей последовательности реакций, начиная с коммерчески доступного N-третбутоксикарбонил пиперазина (VI): Алкилирование соединения формулы VI соединением формулы R6Y, в которой Υ такой, как определено выше, и R6 представляет (С1-С6)алкил, арил-(С2-С4)алкил, в котором арильная часть является фенилом или нафтилом, или гетероарил-(СН2)q , в котором q представляет ноль, один, два, три или четыре, и гетероарильная часть выбрана из пиридила, пиримидила, бензоксазолила, бензотиазолила, бензизоксазолила и бензизотиазолила, в присутствии кислотной "ловушки" (акцептора) (например, бикарбоната натрия (NаНСО3), бикарбоната калия (КНСО3), карбоната натрия (Na2CO3) или карбоната калия (К2СO3)) в полярном растворителе, таком как ацетон, при температуре от примерно 10°С до температуры кипения растворителя, будет приводить к промежуточному соединению формулы VII. Удаление трет-бутоксикарбонильной группы может быть осуществлено с использованием кислых условий, например, HBr в уксусной кислоте или трифторуксусная кислота, до тех пор пока реакция не завершится. Соединения формулы III, в которых R1 представляет тетра-гидропиридин или пиперидин, a R2 является водородом, могут быть получены из являющегося коммерчески доступным 2-бромбензальдегида, как изображено на Схеме 2. Ссылаясь на Схему 2, соединение формулы II сначала превращают в защищенный альдегид или кетон формулы XIV, в которой Ρ представляет полностью защищенную альдегидную или кетонную часть, с использованием способов, хорошо известных в те хнике. Например, 1,3диоксолановое производное альдегида или кетона может быть получено способом, описанным J.E. Cole и др., J. Chem. Soc, 1962, pp. 244, посредством кипячения с обратным холодильником раствора альдегида формулы II и 1,3-пропандиола в безводном бензоле в присутствии каталитического количества п-толуолсульфоновой кислоты. Когда R2 в формуле II не является водородом, кетон может быть защищен с использованием подходящей защитной группы. Подходящие защитные группы могут быть выбраны из многих подобных групп, в зависимости от наличия и природы заместителя X. Примеры подходящих защитных групп могут быть найдены в книге T.W. Greene, Protecting Groups in Organic Synthesis (Защитные группы в органическом синтезе), John Wiley & Sons, New York, 1981. Наиболее предпочтительными группами являются те, которые устойчивы при каталитическом гидрировании (например, 1,3-диоксолан), что позволяет, если необходимо, провести последующее восстановление углерод-углеродной двойной связи тетрагидропиридинов формулы XVI. Соединения формулы XIV могут затем быть обработаны винилстаннанами формулы XV, например, 1ВOС-4-триметилстаннил-1,2,5,6-тетрагидропиридином (ВОС = трет-бутоксикарбонил) в присутствии катализатора с образованием соответствующего соединения формулы XVIA. Палладий является предпочтительным катализатором (например, (PH3P)4Pd или Pd2(dba)3), где dba = дибензилиденацетон. Эта реакция может быть осуществлена так, как описано в "Palladium-catalyzed Vinylation of Organic Halides" (Катализируемое палладием винилирование органических галогенидов) в Organic Reactions, Vol. 27, pp. 345-390, W.G. Dauben, Ed. John Wiley & Sons, Inc., New York, New York, 1982. Соединения формулы III, в которых R1 представляет пиперидин (G2), могут быть получены каталитическим гидрированием тетрагидропиридина формулы XVIA из предыдущего абзаца, с использованием стандартных способов, известных в технике, обычно с использованием в качестве катализатора палладия на углероде, с образованием соответствующих соединений формулы XVIB. Эту реакцию обычно осуществляют в инертном растворителе, таком как этанол или этилацетат, в присутствии или в отсутствие протонсодержащей кислоты, такой как уксусная кислота или НСI. Уксусная кислота является предпочтительной. Защитные группы на G2 (т.е. ВОС) могут быть удалены с использованием одного или более способов, описанных в книге Greene, на которую ссылались выше, например, при перемешивании соединения формулы XVI в этилацетате и 3М соляной кислоте при примерно комнатной температуре в течение приблизительно 30 минут. Защи тная группа альдегида или кетона, Р, может быть превращена в незащищенный кетон или альдегид формулы -C(=O)R2 с использованием одного или более способов, описанных в книге Greene, например, посредством перемешивания раствора соединения формулы XVI в ТГФ и 5% соляной кислоте при комнатной температуре в течение 20 часов. Соединения формулы XIV из предыдущей реакционной схемы могут быть также обработаны реагентами алкиллития, например, бутиллитием, втор-бутиллитием и трет-бутиллитием, предпочтительно бутиллитием, в инертном растворителе, как показано на Схеме 3, с образованием промежуточного литиевого аниона формулы XVII. Подходящие растворители для этой реакции включают, например, диэтиловый эфир или тетрагидрофуран, предпочтительно тетрагидрофуран. Температуры реакции могут колебаться в пределах от примерно -110°С до примерно 0°С. Промежуточные литиевые анионы формулы XVII могут в дальнейшем быть введены во взаимодействие с подходящим электрофилом, выбор которого зависит от наличия и природы заместителя. Подходящие электрофилы для использования при получении соединений формулы III, в которой R1 представляет группу формулы G 2, включают, например, карбонильные производные или алкилирующие агенты (например, 1-ВОС-4-пиперидон). В том случае когда в качестве электрофила используют альдегид или кетон, гидроксильная группа должна быть удалена из промежуточного соединения формулы XVIII, как изображено ниже, для того, чтобы образовалось соответствующее соединение формулы III. Эта стадия может быть осуществлена одним из стандартных способов, известных в те хнике. Например, тиокарбонильное производное, такое как ксантат, может быть получено и удалено посредством свободно-радикальных способов, оба из которых известны специалистам в данной области. Альтернативно, гидроксильная группа может быть удалена посредством восстановления в присутствии источника водорода, такого как триэтилсилан в кислых условиях, с использованием, например, трифтор уксусной кислоты или трифторида бора. Реакция восстановления может быть осуществлена в отсутствие или в растворителе, таком как хлористый метилен. Дополнительной альтернативой было бы сначала превращение гидроксильной группы в подходящую уходящую гр уппу, такую как тозилат или хлорид, с использованием стандартных способов, известных в те хнике, и затем удаление уходящей группы с использованием нуклеофильного гидрида, такого как, например, литийалюминийгидрид. Последнюю реакцию обычно проводят в инертном растворителе, таком как диэтиловый эфир или тетрагидрофуран. Также восстанавливающий агент может использоваться для восстановительного удаления бензильного заместителя. Подходящие восстановители включают, например, никель Ренея в этаноле и натрий или литий в жидком аммиаке. Другой альтернативный способ для удаления гидроксильной группы заключается в том, чтобы сначала дегидратировать спирт формулы XVIII до олефина с использованием такого реагента, как соль Бургесса (J. Org. Chem., 1973, 38, 26), а затем каталитически гидрировать двойную связь в стандартных условиях с использованием катализатора, такого как палладий на углероде. Спирт может также быть дегидратирован до олефина посредством обработки кислотой, такой как п-толуолсульфоновая кислота. Соединения формулы III, в которых R1 представляет G2 и R6 представляет водород, могут быть превращены в соответствующие соединения формулы III, в которых R1 представляет G2 и R 6 отличается от водорода, посредством введения их во взаимодействие с соединением формулы R6Y, как описано выше при получении соединений формулы VII. Если не указано другого, давление в каждой из указанных реакций не является решающим фактором. Обычно, реакции проводят при давлении от примерно одной до примерно трех атмосфер, предпочтительно при давлении окружающей среды (примерно одна атмосфера). Соединения формулы I, которые по природе являются основаниями, способны к образованию большого множества разнообразных солей с различными неорганическими и органическими кислотами. Хотя такие соли могут быть фармацевтически приемлемыми для введения животным, на практике часто желательно первоначально выделить соединение формулы I из реакционной смеси в качестве фармацевтически неприемлемой соли и затем просто превратить последнюю обратно в свободное основание посредством обработки щелочным реагентом и впоследствии превратить свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотно-аддитивные соли основных соединений по настоящему изобретению легко получают при обработке основного соединения по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном упаривании растворителя получают требуемую соль. Кислоты, полезные для получения фармацевтически приемлемых кислотно-аддитивных солей основных соединений по настоящему изобретению, это те, которые образуют нетоксичные соли присоединения, т.е. соли, содержащие фармакологически приемлемые анионы, такие соли, как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат или бисульфа т, фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метан-сульфонат и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Те соединения формулы I, которые по своей природе также являются кислотами, например, когда R3 включает СООН или тетразольную часть, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных или щелочноземельных металлов и, особенно, соли натрия и калия. Все эти соли получают общепринятыми способами. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых солей оснований по настоящему изобретению, это те, которые образуют нетоксичные соли оснований с описанными здесь кислыми соединениями формулы I. Эти нетоксичные соли оснований включают производные таких фармакологически приемлемых катионов, как катионы натрия, калия, кальция и магния и т.д. Эти соли могут легко быть получены обработкой соответствующи х кислых соединений водными растворами, содержащими требуемые фармакологически приемлемые катионы, а затем упариванием образующихся растворов до сухого остатка, предпочтительно при пониженном давлении. Альтернативно они могут быть получены смешиванием слабо щелочных растворов кислых соединений и алкоксида требуемого щелочного металла, а затем упариванием образующегося раствора до сухого остатка тем же способом, что и ранее. В любом случае предпочтительно используют стехиометрические количества реагентов для того, чтобы быть уверенными в том, что реакция прошла полностью и для максимизации выходов продуктов. Соединения формулы I и их фармацевтически приемлемые соли (на которые далее ссылаются вместе как на "активные соединения") являются полезными психотерапевтическими средствами и потенциальными агонистами и/или антагонистами рецепторов серотонина IA (5-НТ1A) и/или серотонина ID (5-НТ1D). Активные соединения являются полезными при лечении гипертензии, депрессии, состояния общего возбуждения, фобий (например, агорафобии, социальной фобии и простых фобий), синдрома посттравматического стресса, нарушения общения, половых расстройств (например, преждевременного семяизвержения), расстройств питания (например, невротической анорексии и невротической булимии), ожирения, химических зависимостей (например, от алкоголя, кокаина, героина, фенобарбитуратов, никотина и бензодиазепинов), кластерной головной боли, мигрени, болей, болезни Альцгеймера, навязчивых состояний, чувства тревоги, расстройств памяти (например, слабоумия, амнетических нарушений и возрастной потери памяти), болезней Паркинсона (например, слабоумия при болезни Паркинсона, нейролептически индуцированного паркинсонизма и запаздывающей дискинезии), эндокринных заболеваний (например, гиперпролактинаемии), вазоспазма (особенно в церебральных сосудах), церебральных расстройств координации движений, заболеваний желудочно-кишечного тракта, приводящих к изменениям в моторике и секреции, и хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми нарушениями. Эти соединения также полезны в качестве сосудорасширяющих лекарственных средств. Сродство соединений по настоящему изобретению к различным серотонин-1-рецепторам может определяться с использованием стандартных анализов радиолигандного связывания, как это описано в литературе. Сродство к 5-НТ1Aд может измеряться посредством использования способа Ноуеr и др. (Brain Res., 198 6, 376, 85). Сродство к 5-НТ1D может измеряться посредством использования способа Heuring и Peroutka (J. Neurosci., 1987, 7, 894). Активность соединений по настоящему изобретению in vitro κ 5-НТ1D сайту связывания может быть определена следующим способом. Ткани бычьих хвостовых придатков гомогенизируют и суспендируют в 20 объемах буфера, содержащего 50мМ TRIS гидрохлорида (трис[гидроксиметил]аминометан гидрохлорид) при рН 7,7. Гомогенат центрифугируют при 45000G в течение 10 минут. С упернатант отбрасывают и конечный осадок после центрифугирования ресуспендируют в примерно 20 объемах 50мМ TRIS гидро-хлоридного (НСl) буфера при рН 7,7. Суспензию затем предварительно инкубируют в течение 15 минут при 37°С, после чего суспензию еще раз центрифугируют при 45000G в течение 10 минут и супернатант отбрасывают. Конечный осадок после центрифугирования (примерно 1 грамм) ресуспендируют в 150мл буфера 15мМ TRIS гидрохлорида (НСl), содержащего 0,01 процент аскорбиновой кислоты с конечным рН 7,7 и также содержащего 10мкМ паргилина и 4мМ хлорида кальция (СаСl2). Суспензию выдерживают во льду по крайней мере в течение 30 минут перед использованием. Ингибитор, контроль и разбавитель затем инкубируют согласно следующему способу. К 50мкл раствора 20 процентов диметилсульфоксида (ДМСО)/80 процентов дистиллированной воды добавляют 200мкл порошкообразного 5-гидрокситриптамина (2нМ) в буфере 50мМ TRIS гидрохлорида, содержащем 0,01 процент аскорбиновой кислоты, с рН 7,7 и также содержащем 10мкМ паргилина и 4мкМ хлорида кальция, плюс 100нМ 8-гидрокси-DРАТ (дипропиламинотетралина) и 100нМ месулергина. К этой смеси добавляют 750мкл ткани бычьих хвостовых придатков и конечную суспензию встряхивают до гомогенизации. Суспензию затем инкубируют на качалке с водяным термостатом в течение 30 минут при 25°С. После завершения инкубации суспензию фильтруют с использованием фильтров со стекловолокном (например, фильтры Whatman GF/B). Осадок промывают три раза 4мл буфера 50мМ TRIS гидрохлорида с рН 7,7, осадок затем помещают в сцинтилляционную ампулу с 5мл сцинтилляционной жидкости (aquasol 2 Ô ) и оставляют на ночь. Процент ингибирования может быть рассчитан для каждой дозы соединения. Затем могут быть рассчитаны значения IС50 из величин процента ингибирования. Активность соединений по настоящему изобретению в отношении связывающей 5-НТ1A способности может быть определена согласно следующему способу. Ткани коры головного мозга крыс гомогенизируют и разделяют на пробы в 1 грамм и разбавляют 10 объемами 0,32Μ раствора сахарозы. Суспензию затем центрифугир уют при 900G в течение 10 минут, супернатант отделяют и центрифугируют еще раз при 70000G в течение 15 минут. Надосадочную жидкость отбрасывают, а осадок ресуспендируют в 10 объемах 15мМ TRIS гидрохлорида с рН 7,5. Суспензию оставляют инкубироваться в течение 15 минут при 37°С. После завершения предварительной инкубации суспензию центрифугир уют при 70000G в течение 15 минут и супернатант отбрасывают. Конечный осадок ресуспендируют в буфере 50мМ TRIS гидрохлорида с рН 7,7, содержащем 4мМ хлорида кальция и 0,01 процент аскорбиновой кислоты. Ткань хранят при -70°С до полной готовности к эксперименту. Ткань можно оттаивать непосредственно перед использованием, разбавлять 10мкм паргилина и хранить на льду. Затем ткань инкубируют согласно следующему способу. Пятьдесят микролитров контроля, ингибитора или разбавителя (конечная концентрация ДМСО 1 процент) готовят в различных дозировках. К этому раствору добавляют 200мкл порошка DPAT в концентрации 1,5нМ в буфере 50мМ TRIS гидрохлорида с рН 7,7, содержащем 4мМ хлорида кальция, 0,01 процент аскорбиновой кислоты и паргилин. К этому раствору затем добавляют 750мкл ткани и конечную суспензию встряхивают до полной гомогенности. Суспензию затем инкубируют на качалке с водяным термостатом в течение 30 минут при 37°С. Затем раствор фильтруют, промывают дважды 4мл 10мМ TRIS гидрохлорида с рН 7,5, содержащем 154мМ хлорида натрия. Процент ингибирования рассчитывается для каждой дозы соединения, контроля или разбавителя. Затем рассчитывают значения IC50 из величин процента ингибирования. Соединения формулы I согласно настоящему изобретению, описанные в следующи х Примерах, анализировали на сродство к рецепторам 5-НТ1A и 5-НТ1D с использованием вышеупомянутых способов. Все такие соединения показали значения IС50 менее 0,60мкМ для сродства к 5-НТ1D и IС50 менее 1,0мкМ для сродства к 5-НТ1A. Агонистическую и антагонистическую активности соединений по изобретению в отношении 5-НТ1A и 5НТ1D рецепторов можно определять с использованием единой насыщенной концентрации согласно следующему способу. Самцов морских свинок Hartley обезглавливали и 5-НТ1A рецепторы иссекали из гиппокампуса, тогда как 5-НТ1D рецепторы получали, нарезая 350мМ на измельчителе тканей Mcllwain и иссекая субстанции нигра из подходящих кусочков. Индивидуальные ткани гомогенизировали в 50мМ буфере HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота), содержащем 1мМ EGTA (этиленгликольтетрауксусная кислота) (рН 7,5) с использованием ручного стеклянно-тефлонового гомогенизатора (glass-TeflonÒ) и центрифугировали при 35000 x g в течение 10 минут при 4°С. Осадки ресуспендировали в 100мМ буфера HEPES, содержащего 1мМ EGTA (рН 7,5), до конечной концентрации протеина 20мг (гиппокампус) или 5мг (субстанция нигра) протеина на пробирку. Следующие агенты добавляли таким образом, чтобы реакционная смесь в каждой пробирке содержала 2,0мМ МgСl2, 0,5мМ АТФ, 1,0мМ сАМФ, 0,5мМ IBMX, 10мМ фосфокреатина, 0,31мг/мл креатин фосфокиназы, 100мкМ ГТФ и 0,5-1микрокюри [32Р]-АТФ (30кюри/ммоль: NEG-003 - New England Nuclear). Инкубирование начинали с добавления ткани в силиконовую микроцентрифужную пробирку (в тройной последовательности) при 30°С в течение 15 минут. В каждую пробирку добавляли 20мкЛ ткани, 10мкЛ лекарства или буфера (при конечной концентрации 10Х) , 10мкЛ 32нМ агониста или буфера (при конечной концентрации 10Х), 20мкЛ форсколина (3мМ конечная концентрация) и 40мкЛ предшествующей реакционной смеси. Инкубацию заканчивали посредством добавления 10мкЛ 2% SDS (додецилсульфат натрия), 1,3мМ сАМФ, 45мМ АТФ раствора, содержащего 40000 dpm (число распадов в минуту) [ 3Н]-сАМФ (30кюри/ммоль: NET-275 - New England Nuclear) для контроля восстановления сАМФ с колонок. Разделение [32Р]-АТФ и [32Р]-сАМФ осуществляют с использованием способа, описанного Salomon и др., Analytical Biochemistry, 1974, 58, 541548. Радиоактивность подсчитывают жидким сцинтилляционным счетчиком. Максимальное ингибирование определяют посредством 10мкМ (R)-8-ОН-DPAT для 5-НТ1A рецепторов и 320нМ 5-НТ для 5-НТ1D рецепторов. Проценты ингибирования для испытуемых соединений затем рассчитывают по отношению к ингибирующему эффекту (R)-8-OH-DPAT к 5-НТ1A рецепторам или 5-НТ для 5-НТ1D рецепторов. Обращение агониста, индуцированное ингибированием форсколин-стимулированной активностью аденилат циклазы, рассчитывают по отношению к эффекту 32нМ агониста. Соединения по изобретению могут быть исследованы на активность in vivo антагонизма 5-НТ1D агонист-индуцированной гипотермии на морских свинках согласно следующему способу. Самцы морской свинки Hartley от Charles River, весом 250-275 грамм по получении и 300-600 грамм при тестировании, служили объектом эксперимента. Морские свинки содержались в стандартных лабораторных условиях в режиме освещения с 7 утра до 7 вечера по крайней мере в течение семи дней перед экспериментом. Еда и вода были постоянно доступны до времени начала эксперимента. Соединения по изобретению могут вводиться в виде растворов в объеме 1мл/кг. Используемый разбавитель варьируется в зависимости от растворимости соединений. Тестируемые соединения обычно вводят или за шестьдесят минут орально (р.о.), или за 0 минут подкожно (s.c.) до 5-НТ1D агониста, который вводят в дозе 5,6мг/кг s.c. Перед регистрированием первой температуры каждую морскую свинку помещают в чистый пластиковый лоток, содержащий деревянную стр ужку и металлический сетчатый пол, и позволяют акклиматизироваться к окружающей обстановке в течение 30 минут. Животных затем возвращают в тот же самый лоток после записывания каждой температуры. Перед каждым измерением температуры каждое животное твердо держат одной рукой в течение 30 секунд. Для измерений температуры используют цифровой термометр с маленьким зондом для животных. Зонд сделан из полугибкого нейлона с эпоксидным наконечником. Температурный зонд вводят на 6см в прямую кишку и удерживают в течение 30 секунд или до тех пор, пока не будет получено стабильное значение. Затем регистрируют температуры. В р.о. сплошных экспериментах снимается "пред-лекарственная" основная температурная линия при 90 минут, тестир уемое соединение дают при -60 минутах и дополнительно при -30 минутах регистрируют температуру. Затем вводят 5-НТ1D агонист при 0 минут и регистрируют температур у 30, 60, 120 и 240 минутами позже. В подкожных сплошных экспериментах пред-лекарственную основную температурную линию регистрируют при -30 минутах. Тестир уемое соединение и 5-НТ1D агонисты вводят одновременно и регистрируют температуру 30, 60, 120 и 240 минутами позже. Данные анализируют двусторонним анализом вариантов при повторяющихся измерениях по пост-хок анализу Newman-Keuls. Активные соединения по настоящему изобретению могут оцениваться как анти-мигреневые агенты посредством тестирования степени, в которой они имитируют суматриптан при сужении изолированной подкожной вены собаки [P.P.A. Humphrey и др., Вг. J. Pharmacol., 94, 1128 (1988)]. Этот эффект может быть блокирован метиозепином, известным антагонистом серотонина. Известно, что суматриптан полезен при лечении мигрени и дает селективное увеличение каротидной васкулярной устойчивости у анестезируемой собаки. Фармакологическая основа эффективности суматриптана обсуждается W. Fenwick и др., Br. J. Pharmacol., 96, 83 (1989). Сродство к серотонин 5-НТ рецепторам может быть определено посредством рецептор-связывающего анализа in vitro, как описано для 5-НТ1A рецептора с использованием коры головного мозга крысы в качестве источника рецептора и [3Н]-8-OH-DPAT в качестве радиолиганда [D. Ноуег и др., Eur. J. Pharm., 118, 13 (1985)] и как описано для 5-НТ1D рецептора с использованием бычьих хвостовы х придатков в качестве источника рецептора и [3Н]серотонина в качестве радиолиганда [R.E. Heuring и S.J. Peroutka, J. Neuroscience, 7, 894 (1987)]. Из испытанных активных соединений все показали значения ІС 50 в каждом анализе 1мкМ или менее. Соединения формулы I могут выгодным образом использоваться в сочетании с одним или более терапевтических агентов, например, различных антидепрессантов, таких как трициклические антидепрессанты (например, амитриптилин, дотиепин, доксепин, тримипрамин, бутрипилин, кломипрамин, дезипрамин, имипрамин, иприндол, лофепрамин, нортриптилин или протриптилин), ингибиторами моноаминной оксидазы (например, изокарбоксазид, фенельзин или транилциклопрамин) или ингибиторами обратного захвата 5-НТ (например, флувоксамин, сертралин, флуоксетин или пароксетин) и/или с антипаркинсонными агентами, такими как допаминергические антипаркинсонные агенты (например, леводопа, предпочтительно в сочетании с ингибитором периферийной декарбоксилазы, например, бензеразидом или карбидопом, или с агонистом допамина, например, бромокриптином, лизуридом или перголидом). Следует понимать, что настоящее изобретение охватывает использование соединения общей формулы I или его физиологически приемлемой соли или его сольвата в сочетании с одним или более других терапевтических агентов. Соединения формулы I и их фармацевтически приемлемые соли в сочетании с ингибитором обратного захвата 5-НТ (например, флувоксамин, сертралин, флуоксетин или пароксетин), предпочтительно сертралином, или его фармацевтически приемлемой солью или полиморфной модификацией (комбинация соединения формулы I с ингибитором обратного захвата 5-НТ здесь называется "активной комбинацией") являются полезными психотерапевтическими средствами и могут использоваться для лечения или профилактики заболеваний, лечение или профилактика которых облегчаются посредством усиления серотонергической нейротрансмиссии (например, гипертензия, депрессия, состояние общего возбуждения, фобии, синдром посттравматического стресса, нарушение общения, половые расстройства, расстройств питания, ожирение, химические зависимости, кластерная головная боль, мигрень, боль, болезнь Альцгеймера, навязчивые состояния, чувство тревоги, расстройства, памяти (например, слабоумие, амнетические нарушения и возрастная потеря памяти), болезни Паркинсона (например, слабоумие при болезни Паркинсона, нейролептически индуцируемый паркинсонизм и запаздывающая дискинезия), эндокринные заболевания (например, гиперпролактинаемия), вазоспазм (особенно церебральных сосудов), церебральная атаксия, заболевания желудочно-кишечного тракта, при которых происходят изменения в моторике и секреции, и хроническая пароксизмальная гемикрания и головная боль, связанная с сосудистыми нарушениями. Ингибиторы обратного захвата серотонина (5-НТ), предпочтительно сертралин, проявляют положительную активность против депрессии; химических зависимостей; чувства беспокойства, включая чувство паники, состояния общего возбуждения, агорафобии, простых фобий, социальной фобии и синдрома посттравматического стресса; навязчивых состояний; нарушения возможности общения и преждевременного семяизвержения у млекопитающих, включая человека, частично благодаря их способности блокировать синаптосомальный захват серотонина. Патент Соединенных Штатов Америки 4,536,518 описывает синтез, фармацевтическую композицию и использование сертралина в случае депрессии, и этот патент включен в качестве ссылки в настоящее описание в полном объеме. Активность активной комбинации в качестве антидепрессантов и родственные фармакологические свойства могут быть определены способами (1)-(4) ниже, которые описаны Кое В. и др., Journal of Pharmacology and Experimental Therapeutics, 226 (3), 686-700 (1983). Конкретно, активность соединений может обнаруживаться посредством изучения (1) их способности воздействовать на попытки мышей покинуть бассейн (тест Porsolt "поведения отчаяния" на мышах), (2) их способности потенциировать 5гидрокситриптофан-зависимые поведенческие симптомы на мышах in vivo, (3) и х способности антагонизировать серотонин-уменьшаемую активность п-хлорамфетамин гидрохлорида на мозге крыс in vi vo и (4) их способности блокировать поглощение серотонина, норепинефрина и допамина синапсоидными клетками мозга крыс in vitro. Способность активной комбинации противодействовать резерпиновой гипотермии на мышах in vivo может быть обнаружена способами, описанными в Патенте США №4,029,731. Композиции по настоящему изобретению могут быть составлены общепринятым способом с использованием одного или более фармацевтически приемлемых носителей. Таким образом, активные соединения по настоящему изобретению могут быть составлены в рецептуры для орального, буккального (щечного), вн утриназального, парентерального (например, внутривенного, вн утримышечного или подкожного) или ректального введения, или находиться в форме, подходящей для введения посредством ингаляций или для введения в легкие. Для орального введения, фармацевтические композиции могут быть в форме, например, таблеток или капсул, полученных традиционными способами с фармацевтически приемлемыми эксципиентами, такими как связующие агенты (например, желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропил метилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); лубриканты (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или натриевый гликолят крахмала); или смачивающие агенты (например, лаурил сульфат натрия). Таблетки могут быть покрыты оболочкой способами, известными в технике. Жидкие препараты для орального введения могут быть в форме, например, растворов, сиропов или суспензий, или могут быть в виде сухого продукта, предназначенного для разведения водой или другими подходящими средствами перед использованием. Такие жидкие препараты могут быть получены традиционными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбитоловый сироп, метилцеллюлоза или гидрированные пищевые жиры); эмульгирующие агенты (например, лецитин или гуммиарабик); неводные растворители (например, миндальное масло, сложные эфиры масел или этиловый спирт); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Для буккального введения, композиция может иметь форму таблеток или пастилок, полученных общепринятым образом. Активные соединения по изобретению могут входить в состав композиций для парентерального введения путем инъекций, включая использование обычных способов катетеризации или инфузии. Композиции для инъекций могут быть в форме единичной дозы, например, в ампулах или в мультидозировочных контейнерах, снабженных дополнительной защитой. Композиции могут быть в форме суспензий, растворов или эмульсий в масляной или водной среде и могут содержать составляющие композицию агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в виде порошка для составления перед использованием композиции с применением подходящего связующего ве щества, например, стерильной, свободной от примесей воды. Активные соединения по изобретению могут также быть составлены в ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие общепринятые суппозиторные основы, такие как масло какао или другие глицериды. Для внутриназального введения или введения с помощью ингаляций, активные соединения по настоящему изобретению могут общепринято быть представлены в форме раствора или суспензии в баллончике с распылителем, из которого композиция выдавливается или накачивается пациентом, или в форме для аэрозольного распыления из баллончика под давлением или распылителя с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением, единичная доза может определяться посредством клапана, выпускающего отмеренное количество. Баллончик под давлением или распылитель могут содержать раствор или суспензию активного соединения. Могут быть сделаны капсулы или картриджи (изготовленные, например, из желатина) для использования в ингаляторе или инсуффляторе, содержащие порошкообразную смесь соединения по изобретению и подходящей порошкообразной основы, такой как лактоза или крахмал. Предлагаемая доза активных соединений по настоящему изобретению для орального, парентерального или буккального введения среднестатистическому взрослому человеку при лечении симптомов, на которые ссылались выше (например, при мигрени), составляет от 0,1 до 200мг активного ингредиента в единичной дозе, которая может вводиться, например, от 1 до 4 раз в сутки. Аэрозольные композиции для лечения симптомов, на которые ссылались выше (например, мигрень), для среднего взрослого человека преимущественно составляются так, чтобы каждая отмеряемая доза или "струя" аэрозоля содержала от 20мкг до 1000мкг соединения согласно изобретению. Общая суточная доза аэрозоля будет находиться внутри интервала от 100мкг до 10мг. Введение может осуществляться несколько раз в день, например, 2, 3, 4 или 8 раз, вводя, например, каждый раз 1, 2 или 3 дозы. В связи с использованием активного соединения по настоящему изобретению вместе с 5-НТ ингибитором обратного захвата, предпочтительно сертралином, для лечения субъектов, подверженных любым из вышеперечисленных симптомов, следует отметить, что эти соединения могут вводиться или по отдельности, или в комбинации с фармацевтически приемлемыми носителями ранее указанными способами, и что такое введение может осуществляться как в единичной, так и в многократных дозах. Более конкретно, активная комбинация может вводиться в виде широкого диапазона различных дозировочных форм, т.е. они могут комбинироваться с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, таблеток, леденцов, порошков, спреев, водных суспензий, инъекционных растворов, эликсиров, сиропов и тому подобного. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные не токсичные органические растворители и т.д. Более того, такие оральные фармацевтические композиции могут быть подходящим образом подслащены и/или им может быть придан определенный вкус посредством различных агентов, обычно используемых в таких целях типов. В общем, соединения формулы I присутствуют в таких дозировочных формах в концентрационных уровнях, колеблющихся от примерно 0,5% до примерно 90% по весу от общей композиции, т.е. в количествах, которые достаточны для обеспечения необходимой единичной дозы, и 5-НТ ингибитор обратного захвата, предпочтительно сертралин, присутствует в таких дозировочных формах в концентрационных уровнях, колеблющихся от примерно 0,5% до примерно 90% по весу от общей композиции, т.е. в количествах, которые являются достаточными для обеспечения необходимой единичной дозировки. Предлагаемая суточная доза активного соединения согласно настоящему изобретению в объединенной композиции (композиция, содержащая активное соединение по настоящему изобретению и 5-НТ ингибитор обратного захвата) для орального, парентерального, ректального или буккального введения для среднестатистического взрослого человека при лечении симптомов, на которые ссылались выше, составляет от примерно 0,01мг до примерно 2000мг, предпочтительно от примерно 0,1мг до примерно 200мг активного ингредиента формулы I на единичную дозу, которая может вводиться, например, от 1 до 4 раз в день. Предлагаемая суточная доза 5-НТ вновь поглощающего ингибитора, предпочтительно сертралина, в объединенной композиции для орального, парентерального, ректального или буккального введения для среднестатистического взрослого человека при лечении симптомов, на которые ссылались выше, составляет от примерно 0,1мг до примерно 2000мг, предпочтительно от примерно 1мг до примерно 200мг 5-НТ вновь поглощающего ингибитора на единичную дозу, которая может вводиться, например, от 1 до 4 раз в день. Предпочтительное дозировочное соотношение сертралина к активному соединению по настоящему изобретению в объединенной композиции для орального, парентерального или буккального введения для среднестатистического взрослого человека при лечении симптомов, на которые ссылались выше, составляет от примерно 0,00005 до примерно 20,000, предпочтительно от примерно 0,25 до примерно 2000. Аэрозольные объединенные композиции для лечения симптомов, на которые ссылались выше, для среднего взрослого человека предпочтительно составляются так, чтобы каждая отмеряемая доза или "струя" аэрозоля содержала от примерно 0,01мкг до примерно 1000мкг активного соединения согласно изобретению, предпочтительно от примерно 1мкг до примерно 10мг такого соединения. Введение может осуществляться несколько раз в день, например, 2, 3, 4 или 8 раз, вводя, например, каждый раз 1, 2 или 3 дозы. Аэрозольные композиции для лечения симптомов, на которые ссылались выше, для среднего взрослого человека предпочтительно составляются так, чтобы каждая отмеряемая доза или "струя" аэрозоля содержала от примерно 0,01мг до примерно 2000мг 5-НТ вновь поглощающего ингибитора, предпочтительно сертралина, предпочтительно от примерно 1мг до примерно 200мг сертралина. Введение может осуществляться несколько раз в день, например, 2, 3, 4 или 8 раз, вводя, например, каждый раз 1, 2 или 3 дозы. Как указано ранее, 5-НТ ингибитор обратного захвата, предпочтительно сертралин, в сочетании с соединениями формулы I легко приспосабливается для терапевтического использования в качестве антидепрессантов. В общих чертах, такие антидепрессантные композиции, содержащие 5-НТ ингибитор обратного захвата, предпочтительно сертралин, и соединение формулы I, нормально вводятся в дозах, колеблющихся от примерно 0,01мг до примерно 100мг на кг веса тела в сутки 5-НТ вновь поглощающего ингибитора, предпочтительно сертралина, предпочтительно от примерно 0,1мг до примерно 10мг на кг веса тела в сутки сертралина; и от примерно 0,001мг до примерно 100мг на кг веса тела в сутки соединения формулы I, предпочтительно от примерно 0,01мг до примерно 10мг на кг веса тела в сутки соединения формулы I, хотя необходимы вариации в зависимости от состояния субъекта, подвергаемого лечению, и конкретного избираемого пути введения. Следующие Примеры иллюстрируют получение соединений по настоящему изобретению. Поправка для температур плавления не вводилась. Данные ЯМР представлены в миллионных долях (d) и относились к фиксированному сигналу дейтерия в растворителе образца (дейтерохлороформ, если не указано другого). Углы вращения измеряли при комнатной температуре с использованием D-линии натрия (589нм). Продажные реагенты использовали без дополнительной очистки. ТГФ относится к тетрагидрофурану. ДМФА относится к Ν,N-диметилформамиду. Хроматография относится к колоночной хроматографии, осуществляемой с использованием силикагеля 32-63мкм и проводимой под давлением током азота (флэш-хроматография). Комнатная или температура окружающей среды относится к 20-25°С. Все неводные реакции осуществляли в атмосфере азота из соображений удобства и для оптимизации выходов. Концентрирование при пониженном давлении означает, что использовали роторный испаритель. Пример 1 3-[2-(4-Метилпиперазин-1-ил)-бензилиден]-1,3-дигидро-индол-2-он В сухую круглодонную колбу, снабженную обратным холодильником и магнитной мешалкой, в атмосфере азота загружают 2-(4-метил-1-пиперазинил)-бензальдегид (0,152г, 0,75г, 0,75ммоль), оксиндол (0,104г, 0,78ммоль), пирролидин (62мкл) и этанол (7,0мл). Смесь нагревают с обратным холодильником в течение 16 часов, охлаждают и упаривают при пониженном давлении. Остаток перераспределяют между этилацетатом и водой и органический слой промывают насыщенным водным раствором хлорида натрия (NaCl), сушат над сульфатом магния (MgSO4), фильтр уют и абсорбируют 437мг силикагеля. Элюирование этилацетатом (EtOAc) (125мл), 1% метанолом (СН3ОН) в EtOAc (100мл), 2% СН3ОН в EtOAc (100мл) и 4% СН30Н + 1% триэтиламина (Et3N) в EtOAc (50 мл) дает 280 мг твердого желтого соединения. Перекристаллизация из горячего СН3ОН приводит к указанному в заголовке соединению, т. пл. 226-228°С. 1 Н-ЯМР (CDCI3, 250Мгц) d 7,93 (1Н, с), 7,84 (1Н, уш. с), 7,79 (1Н, дд), 7,66 (1Н, д, J=7,94Гц), 7,42 (1Н, дт), 7,12-7,03 (2Н, м), 6,91-6,84 (2Н, м), 3,06 (4Н, т), 2,66-2,53 (4Н, м), 2,35 (3Н, с). Элементный анализ для C20H21N3О·0,5Н2О: вычислено: С 73,15; Η 6,75; N 12,79 найдено : С 73,00; Η 6,51; N 13,01. Таким же способом получены следующие аналоги в Примерах 2-6: Пример 2 Гидрохлорид дигидрата 6-хлор-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1,3-дигидро-индол-2-она Т. пл. 265-267°С (СН2СI2). MCBP: 354 (Μ+1). Элементный анализ для C20H20CIN3O·НСI·2Н2O: вычислено: С 56,34; Η 5,91; N 9,86 найдено: С 56,83; Η 5,90; N 10,07. Пример 3 Гидрохлорид гидрата 1-метил-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1,3-дигидро-индол-2-она Т. пл. 120°С с разложением (Et2O:CH2Cl2). MCBP: 334 (Μ+1). Элементный анализ для C21H23N3O·НСI·2,5Н2O: вычислено: С 60,79; Η 7,04; N 10,13 найдено: С 61,04; Η 6,69; N 10,18 Пример 4 Полугидрат 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1-фенил-1,3-дигидро-индол-2-она Т. пл. 171-172°С (EtOAc). MCBP: 396 (M+1). Элементный анализ для C26H25N3O·0,5Н2О: вычислено: С 77,20; Η 6,48; N 10,39 найдено: С 77,31; Η 6,43; N 10,39. Пример 5 1-(3,4-Дихлорбензил)-3-[2-(4-метилпилеразин-1-ил)-бензилиден]-1,3-дигидро-индол-2-он Т. пл. 120-124°С (EtOAc: гексаны). МСВР: 478 (М+1). Элементный анализ для C27H25CI2N3O: вычислено: С 67,78; Η 5,27; N 8,78 найдено: С 67,85; Η 5,41; N 8,53. Пример 6 5-Хлор-3-[2-(4-метилпипераэин-1-ил)-бензилиден]-1,3-дигидро-индол-2-он Т. пл. 235-237°С (МеОН). МСВР: 354 (М+1). Элементный анализ для C20H20ClN3O: вычислено: С 67,89; Η 5,70; N 11,88 найдено: С 67,39; Η 5,67; N 11,81. Пример 7 Полугидрат 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-она В атмосфере азота в трехгорлую колбу, снабженную мешалкой, термометром и обратным холодильником, загружают 12,8г (0,321моль) NaH (60%-ная дисперсия в масле) и 2165мл безводного ТГФ. После охлаждения до 0°С добавляют раствор 48,8г (0,212моль) 1-(3,4-дихлорфенил)-пирролидин-2-она и 42,7г (0,209моль) 2-(4-метил-1-пиперазинил)-бензальдегида в 1300мл ТГФ при охлаждении на ледяной бане. После добавления смесь нагревают с обратным холодильником в течение 7 часов, затем концентрируют в вакууме до темно-коричневого остатка, который обрабатывают горячим 10%-ным EtOAC: гексаном. Оставшийся остаток отфильтровывают и суша т на воздухе, получая 95,6г коричневатого твердого вещества, которое перекристаллизовывают из 16л МеОН, получая 24,2г не белого твердого вещества . Дополнительная перекристаллизация из СНСl3: МеOН дает указанный в заголовке продукт в виде не белого твердого соединения, 14,4г, т. пл. 224-225°С. МСВР: 416 (М+1), 418, 420. 1 Н-ЯМР (CDCI3, 250МГц) d 7,98 (1Н, д, J=2,6Гц), 7,82 (1Н, т, J=2,7Гц), 7,70 (1Н, дд) , 7,48-7,41 (2Н, м), 7,34 (1Н, дт), 7,09 (2Н, д, J=7,8Гц), 3,91 (2Н, т, J=6,8Гц), 3,23-3,14 (2Н, м), 3,00 (4Н, симметричный м), 2,63 (4Н, уш. с), 2,35 (3Н, с). Элементный анализ для C22H23N3OCI2·0,5Н2 О: вычислено: С 62,12; Η 5,69; N 9,88 найдено: С 62,06; Η 5,39; N 9,69. Дополнительные порции указанного в заголовке продукта были также выделены из маточных растворов, оставши хся после перекристаллизации. Свободное основание было переведено в гидрохлоридную соль посредством растворения основания в метаноле и добавления 1N НСl в Et2O до осаждения соли, которая была перекристаллизована из смеси метанол:Et2O с образованием белого кристаллического твердого вещества, т. пл. 177-179°С. Элементный анализ для C22H23N3OCI2·НСl·1,5Н2O: вычислено: С 55,07; Η 5,67; Ν 8,76 найдено: С 55,22; Η 5,61; Ν 8,73. Таким же способом были также получены следующие соединения Примеров 8-28: Пример 8 1-(2,4-Дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он Т. пл. 228-229°С. МСВР: 416 (М+1). Элементный анализ для C22H23N3OCI2: вычислено: С 63,47; Η 5,57; N 10,09 найдено: С 63,30; Η 5,53; N 10,12. Пример 9 1-(3,4-Дифторфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он Т. пл. 228-229°С. МСВР: 384 (М+1). Элементный анализ для C22H23FN3O·1/3Н2O: вычислено: С 67,85; Η 6,13; N 10,79 найдено: С 67,99; Η 6,02; N 10,86. Пример 10 Полугидрат 1-(3,4-дихлорфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-она Т. пл. 228-229°С. МСВР: 434 (М+1) . Элементный анализ для C22H22CI2FN3O·0,5Н2O: вычислено: С 59,60; Η 5,23; N 9,48 найдено: С 59,67; Η 5,02; N 9,44. Пример 11 1-(4-Хлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он Т. пл. 177-178°С (EtOAc). МСВР: 396 (М+1). Пример 12 1-(3,4-Дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он Т. пл. 138-139,5°С (EtOAc). МСВР: 430 (М+1). Пример 13 1-(4-Хлорфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он Т. пл. 158-159°С (Et2O). МСВР: 414 (М+1). Пример 14 1-(3,4-Дихлорфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он Т. пл. 161-162°С (EtOAc). МСВР: 448 (М+1). Пример 15 3-[2-(4-Метилпиперазин-1-ил)-бензилиден]-1-фенилпирролидин-2-он Т. пл. 178-179,5°С. МСВР: 348 (М+1). Элементный анализ для C22H25N3O: вычислено: С 76,05; Η 7,25; N 12,09 найдено: С 76,36; Η 6,90; N 12,18. Пример 16 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1-(4-трифторметилфенил)-пирролидин-2-он Т. пл. 185-186,5°С. МСВР: 416 (М+1). Элементный анализ для C23H24F3N3O: вычислено: С 66,49; Η 5,82; N 10,11 найдено: С 66,42; Η 5,85; N 10,18. Пример 17 3-[2-(4-Метилпиперазин-1-ил)-бензилиден]-1-п-толил-пирролидин-2-он Т. пл. 165-167°С. МСВР: 362 (М+1). Элементный анализ для C23H27N3O·0,25Н2О: вычислено: С 75,48; Η 7,57; N 11,48 найдено: С 75,68; Η 7,56; N 11,39 Пример 18 1-(4-Хлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он Т. пл. 188-190°С. МСВР: 382 (М+1). Элементный анализ для C22H24ClN3O·0,25С4Н8O2: вычислено: С 68,39; Η 6,49; N 10,40 найдено: С 68,24; Η 6,62; N 10,18. (соединение содержит 1/4 моля этилацетата) Пример 19 3-[4-Фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-1-фенилпирролидин-2-он Т. пл. 199-200/5°С. МСВР: 366 (М+1). Пример 20 1-(3,4-Дихлорфенил)-3-[2-фтор-6-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он Т. пл. 170-171°С. МСВР: 434 (М+1). Элементный анализ для C22H22CI2FN3O: вычислено: С 60,84; Η 5,11; Ν 9,67 найдено: С 60,77; Η 5,07; Ν 9,62. Пример 21 1-(3,4-Дифторфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он Т. пл. 168-170°С (МеОН: Et2 O). МСВР: 416 (М+1). Пример 22 1-[2-(4-Хлорфенил)этил]-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он Т. пл. 88-90°С (Et2O). МСВР: 442 (М+1). Пример 23 1-(4-Хлорбензил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он Т. пл. 129-130°С. МСВР: 396 (М+1). Пример 24 1-(4-Хлорбензил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он Т. пл. 131-132°. МСВР: 414 (М+1). Пример 25 1-(3,4-Дихлорбензил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он Т. пл. 118-119°С. МСВР: 430 (М+1). Элементный анализ для C23H25CI2N3O·0,25Н2О: вычислено: С 63,52; Η 5,91; N 9,66 найдено: С 63,38; Η 5,85; N 9,67. Пример 26 1-(3,4-Дихлорбензил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидиы-2-он МСВР: 444 (М+1). Пример 27 1-(3,4-Дихлорфенил)-3-[2-(2-диметиламиноэтокси)-бензилиден]-пирролидин-2-он Т. пл. 111-112°С (свободное основание), 241-242°С (НСI соль). МСВР: 405 (М+1). Элементный анализ для C21H22CI2N2O 2: вычислено: С 62,23; Η 5,47; N 6,91 найдено: С 62,42; Η 5,46; N 6,86. Пример 28 1-(3,4-Дихлорфенил)-3-[5-метил-2-(4-метилпиперазин-1-ил)-бензилиден]-пирролидин-2-он Т. пл. 149-150°С. МСВР: 430 (М+1). Пример 29 1-(3,4-Дифторфенил)-3-[2-(4-метилпиперазин-1-ил)-бензил]-пирролидин-2-он Смесь 1-(3,4-дифторфенил)-3-[2-(4-меттлпиперазин-1-ил)-бензилиден]-пирролидин-2-она (125мг, 0,326ммоль), формиата аммония (411мг, 6,53ммоль) и 10% палладия на углероде (40мг) в 30мл безводного метанола кипятили с обратным холодильником в атмосфере азота в течение 18 часов. После охлаждения катализатор удаляли в вакууме и остаток обрабатывали насыщенным водным раствором бикарбоната натрия и хлористым метиленом. Органический слой отделяли, объединяли со вторичным экстрактом водного слоя дополнительным количеством хлористого метилена, промывали насыщенным водным раствором хлорида натрия (NaCl) и высушивали. Растворитель опять удаляли в вакууме с образованием сырого продукта в виде белого твердого вещества (111мг). Это твердое вещество растворяли в горячем этилацетате и кристаллизовали посредством добавления нескольких капель гексана. Указанный в заголовке продукт, 29мг, имел т. пл. 130-131°С. Из фильтрата также получена, как указано выше, вторая порция продукта, 50мг, т. пл. 130-131°С. Масс-спектр: 386 (М+1). 1 Н-ЯМР (CDCI3, 250МГц) d 7,75 (1Н, м) , 7,33-7,00 (6Н, м) , 3,71-3,60 (2Н, м), 3,39 (1Н, дд, J=13,5, 4,2Гц), 3,08 (1Н, м) , 2,93 (4Н, дд, J=8,8, 4,2Гц), 2,78 (1Н, дд, J=13,5, 10,2Гц), 2,59 (4Н, уш. с), 2,36 (3Н, с), 2,17-2,01 (1Н, м), 1,94-1,76 (1Н, м). Элементный анализ для C22H25F2N3O: вычислено: С 68,55; Η 6,54; N 10,90 найдено: С 68,55; Η 6,53; N 10,90. Пример 30 3-[2-(4-Метилпиперазин-1-ил)-бензил]-1-фенил-пирролидин-2-он Способом, аналогичным синтезу по Примеру 29, 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1-фенилпирролидин-2-он был превращен в 3-[2-(4-метилпиперазин-1-ил)-бензил]-1-фенил-пирролидин-2-он, т. пл. 104-105,5°С. Масс-спектр: 350 (М+1). 1 Н-ЯМР (CDCI3, 250МГц) d 7,68 (2Н, дд, J=8,7, 1,1Гц), 7,39 (2Н, т), 7,26-7,03 (5Н, м), 3,76-3,69 (2Н, м), 3,40 (1Н, дд, J=13,5, 3,9Гц), 3,06 (1Н, м) , 2,96 (4Н, дд, J=5,2, 3,5Гц), 2,81 (1Н, дд, J=13,5, 3,9Гц), 2,59 (4Н, уш. с), 2,36 (3Н, с), 2,16-2,00 (1Н, м), 1,94-1,76 (1Н, м). Пример 31 Полугидрат гидрохлорида 3-[2-(4-метилпиперазин-1-ил)-бензил]-1-(4-трифторметилфенил)пирролидин-2-она 3-[2-(4-метилпиперазин-1-ил)-бензилиден]-1-(4-трифторметилфенил)-пирролидин-2-он был превращен в полугидрат гидрохлорида 3-[2-(4-метилпиперазин-1-ил)-бензил]-1-(4-трифторметилфенил)-пирролидин-2она, т. пл. 181-183°С. Масс-спектр: 418 (М+1). 1 Н-ЯМР (D МСО-d6, 250МГц) d 10,61 (1Н, уш. с), 7,91 (2Н, д, J=8,5Гц), 7,72 (2Н, д, J=8,9Гц), 7,30-7,18 (2Н, м), 7,18-7,03 (2Н, м), 3,73 (2Н, т, J=6,7Гц), 3,50-3,33 (2Н, м), 3,22-2,94 (8Н, м), 2,78 (3Н, с), 2,70 (1Н, дд, J=13,7, 10,2Гц), 2,03 (1Н, м), 1,74 (1Н, м). Элементный анализ для C23H26N3OF3 ·НСl·1/2Н2О: вычислено: С 59,67; Η 6,10; N 9,08 найдено: С 59,84; Η 6,06; N 8,96. Пример 32 Гидрохлорид 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензил]-пиперидин-2-она Раствор 1-(3,4-дихлорфенил)-3-[2-(4-метилпиперазин-1-ил)-бензилиден]-пиперидин-2-она (260мг, 0,6ммоль) в 20мл метанола объединяли, со 100мг 10% палладия на углероде и гидрировали в качающемся аппарате Парра при давлении 50 фунтов на квадратный дюйм (344,738КПа) в течение 4 часов. Катализатор затем удаляли фильтрацией через диатомовую землю и растворитель удаляли в вакууме, получая желтый резинообразный остаток. Хроматография (силикагель) с элюированием смесью 5% метанол (СН3ОН)/95% хлористый метилен (СН2Сl2) дает чистый продукт, 70мг, в виде прозрачного резиноподобного вещества, которое было растворено в сухом этиловом эфире (Et2O) и обработано насыщенным НСl этиловым эфиром с образованием гидрохлоридной соли, 61мг, т. пл. 106-108°С. Масс-спектр: 432 (Μ+1), 434. Пример 33 Гидрохлорид 1-(3,4-дихлорфенил)-3-[5-фтор-2-(4-метилпиперазин-1-ил)-бензил]-пиперидин-2-она Используя способ, подобный способу Примера 32, 1-(3,4-дихлорфенил)-3-[5-фтор-2-(4метилпиперазин-1-ил)-бензилиден]-пиперидин-2-он (270мг, 0,6ммоль) был восстановлен в течение 18 часов, давая, после превращения в гидрохлоридную соль, гидрохлорид 1-(3,4-дихлорфенил)-3-[5-фтор-2(4-метилпиперазин-1-ил)-бензил]-пиперидин-2-она, т. пл. 83-85°С, белое твердое вещество. Масс-спектр: 450 (Μ+1), 452.
ДивитисяДодаткова інформація
Назва патенту англійськоюBenz(ylidene) lactam derivatives, a pharmaceutical composition based thereon and a method for treatment
Назва патенту російськоюПроизводные бенз(илиден)лактама, фармацевтическая композиция на их основе и способ лечения
МПК / Мітки
МПК: C07D 209/34, C07D 211/86, C07D 217/24, A61P 9/00, A61K 31/403, C07D 205/00, C07D 211/76, A61K 31/40, A61K 31/397, A61K 31/472, A61P 25/00, C07D 207/38, A61K 31/4015, A61K 31/55, A61P 3/04, A61K 31/47, C07D 215/22, A61P 9/12, C07D 207/26, A61P 1/00, A61K 31/495, C07D 223/00, A61K 31/404, A61K 31/395, A61P 43/00
Мітки: фармацевтична, спосіб, композиція, основі, лікування, бенз(иліден)лактаму, похідні
Код посилання
<a href="https://ua.patents.su/21-70284-pokhidni-benzilidenlaktamu-farmacevtichna-kompoziciya-na-kh-osnovi-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні бенз(иліден)лактаму, фармацевтична композиція на їх основі та спосіб лікування</a>