Нове застосування агоністів печінкового рецептора х
Формула / Реферат
1. Застосування агоніста LXR для виготовлення лікарського засобу, корисного для лікування діабету типу І.
2. Застосування за п. 1, де зазначений лікарський засіб застосовують для регенерації бета-клітин.
3. Застосування за п. 1, де зазначений лікарський засіб застосовують для підвищення життєздатності бета-клітин.
4. Застосування за п. 1, де зазначений лікарський засіб застосовують для підвищення життєздатності трансплантованих донорських острівцевих клітин підшлункової залози у реципієнта трансплантата.
5. Застосування за п. 1, де агоніст LXR являє собою агоніст LXR альфа.
6. Застосування за п. 1, де агоніст LXR вибрано з групи, що складається з GW3965 і Т0901317.
7. Застосування за п. 1, де зазначений лікарський засіб знаходиться у формі, придатній для перорального введення.
8. Застосування за будь-яким з пп. 1-7, де зазначений лікарський засіб застосовують щодобово протягом щонайменше 30 діб.
9. Застосування за будь-яким з пп. 1-7, де зазначений лікарський засіб застосовують у сполученні з відомим протидіабетичним лікарським засобом.
10. Застосування за п. 9, де зазначений відомий протидіабетичний лікарський засіб вибрано з групи, що складається з метформіну, піоглітазону, розиглітазону, глімепіриду, гліпізиду, глібуриду/метформіну, глібуриду, міглітолу, гліпізиду+метформіну, репаглініду, акарбози, троглітазону, натеглініду та агоніста GLP-1.
Текст
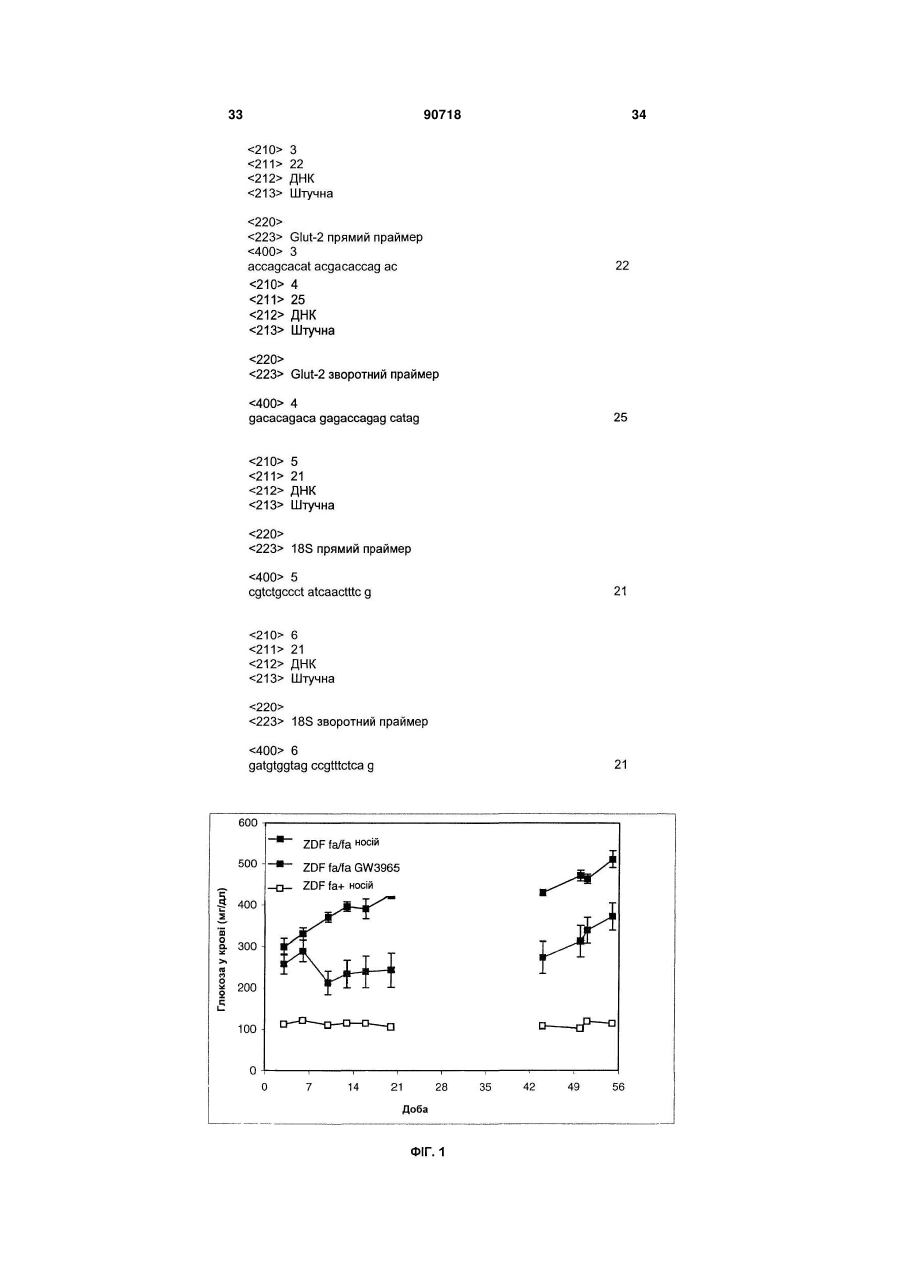
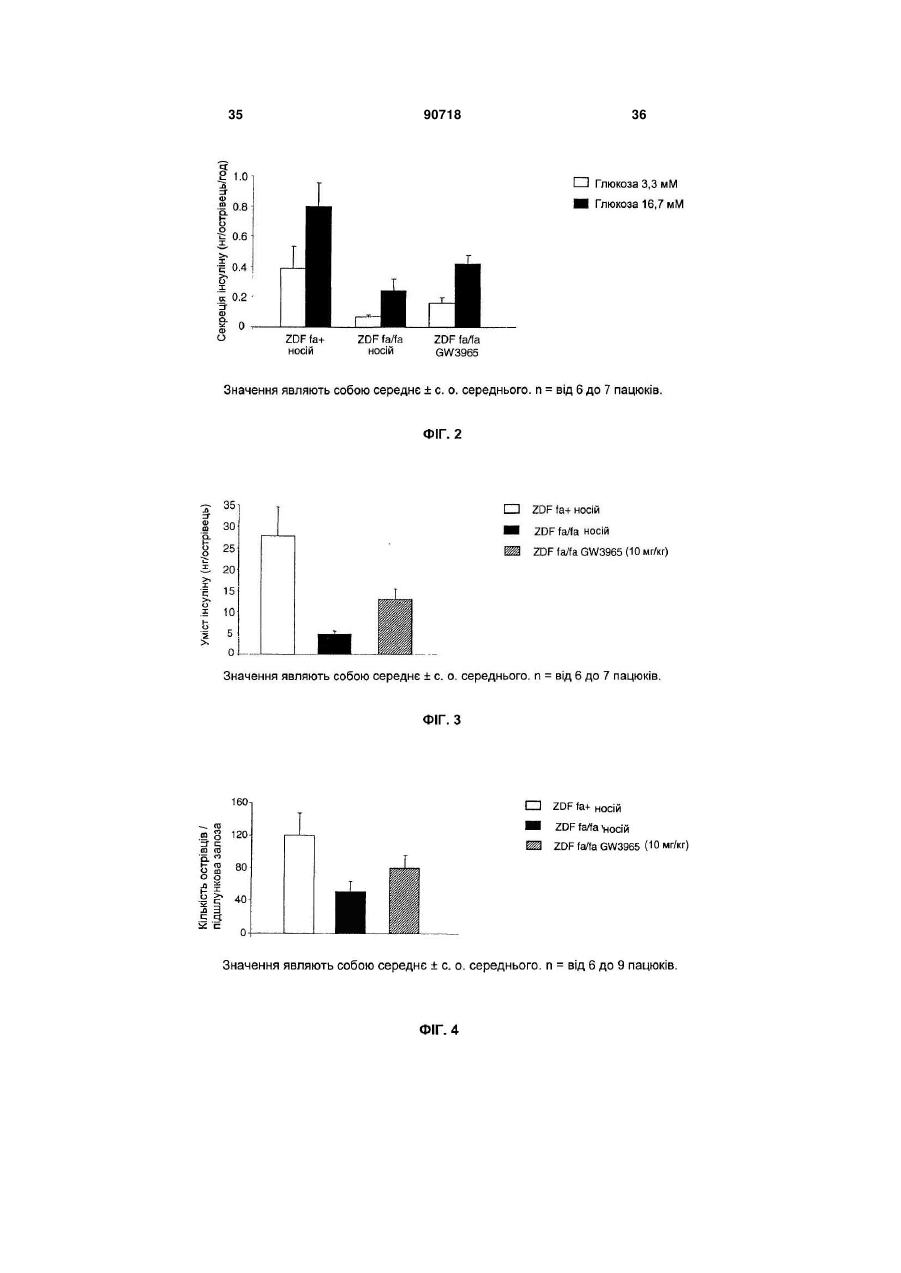
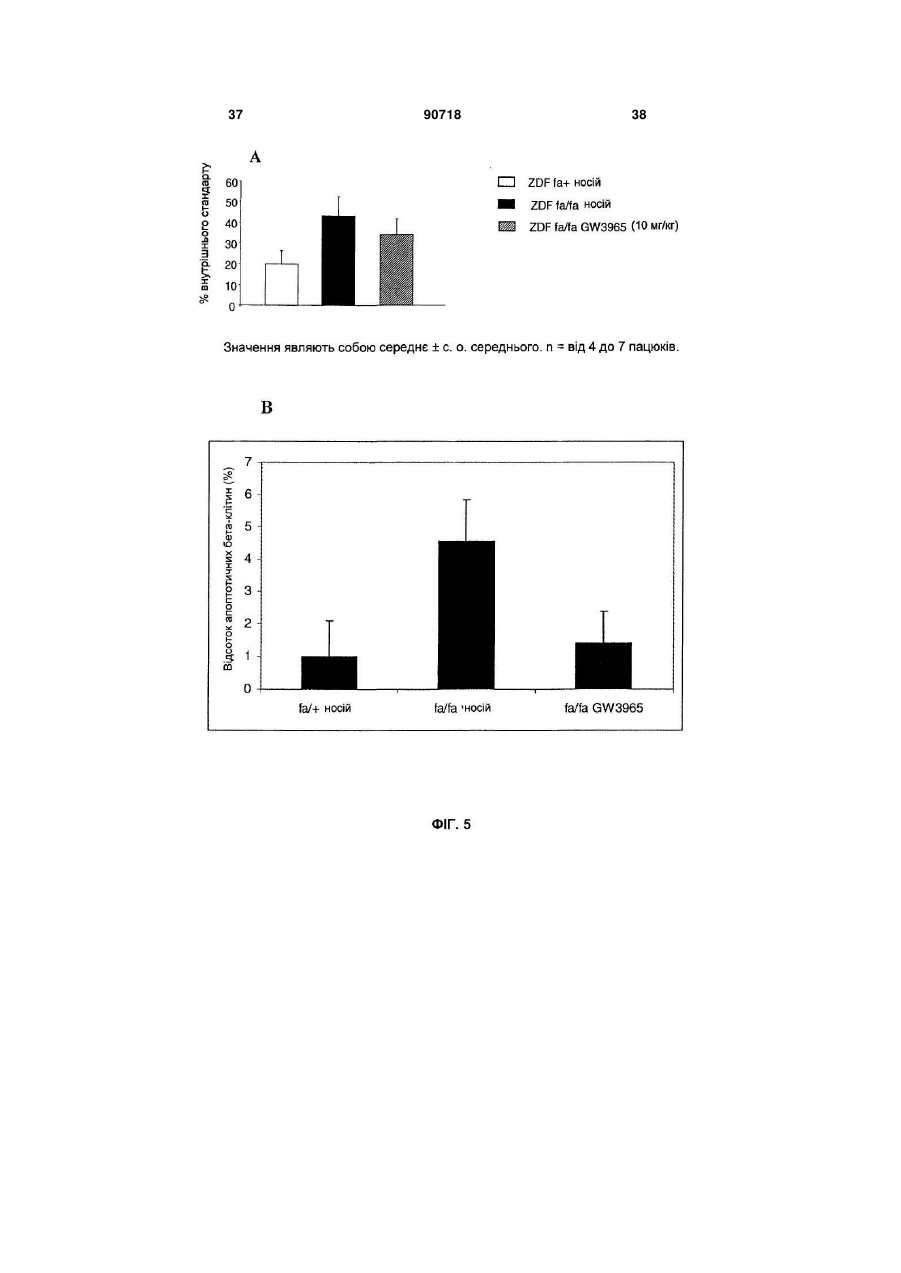
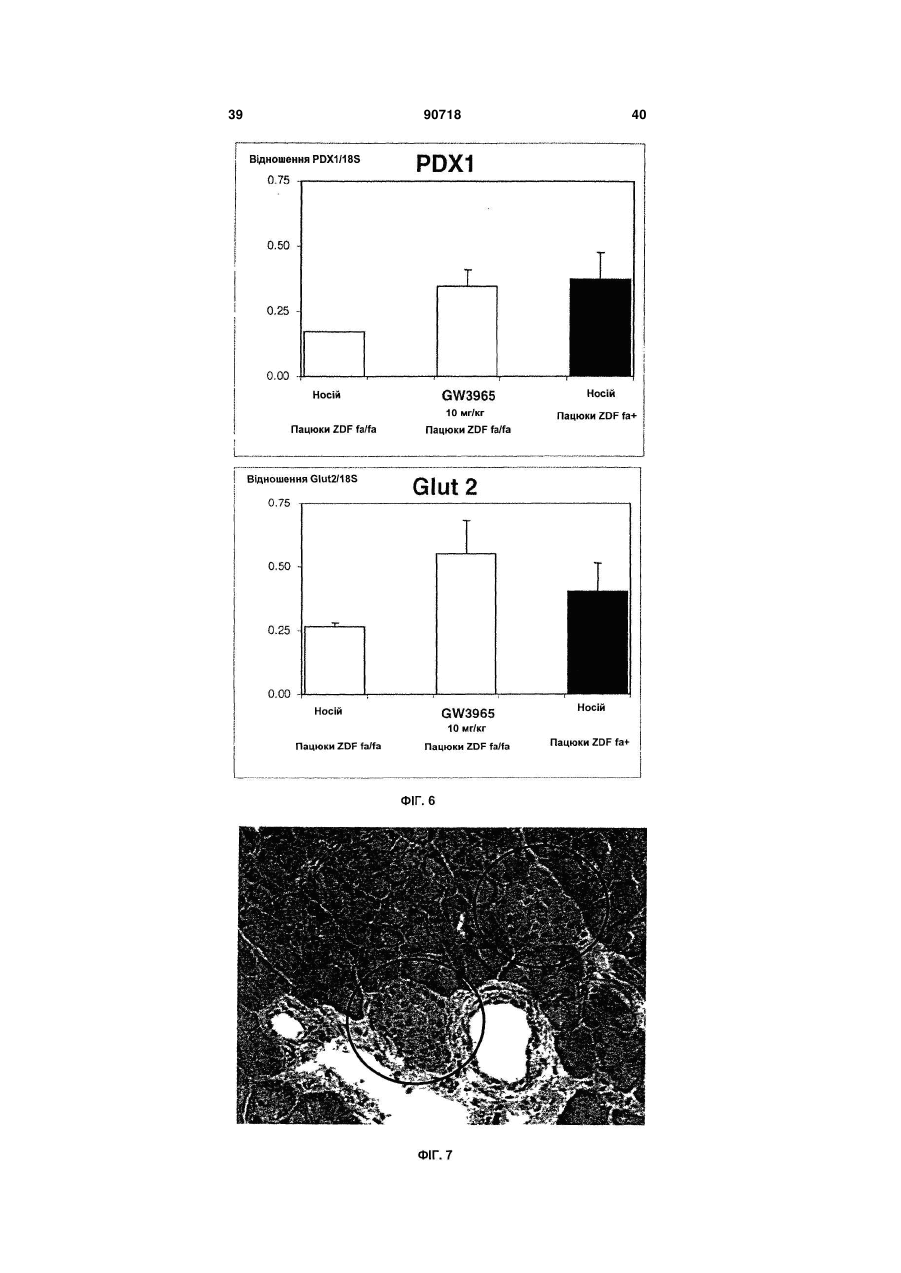
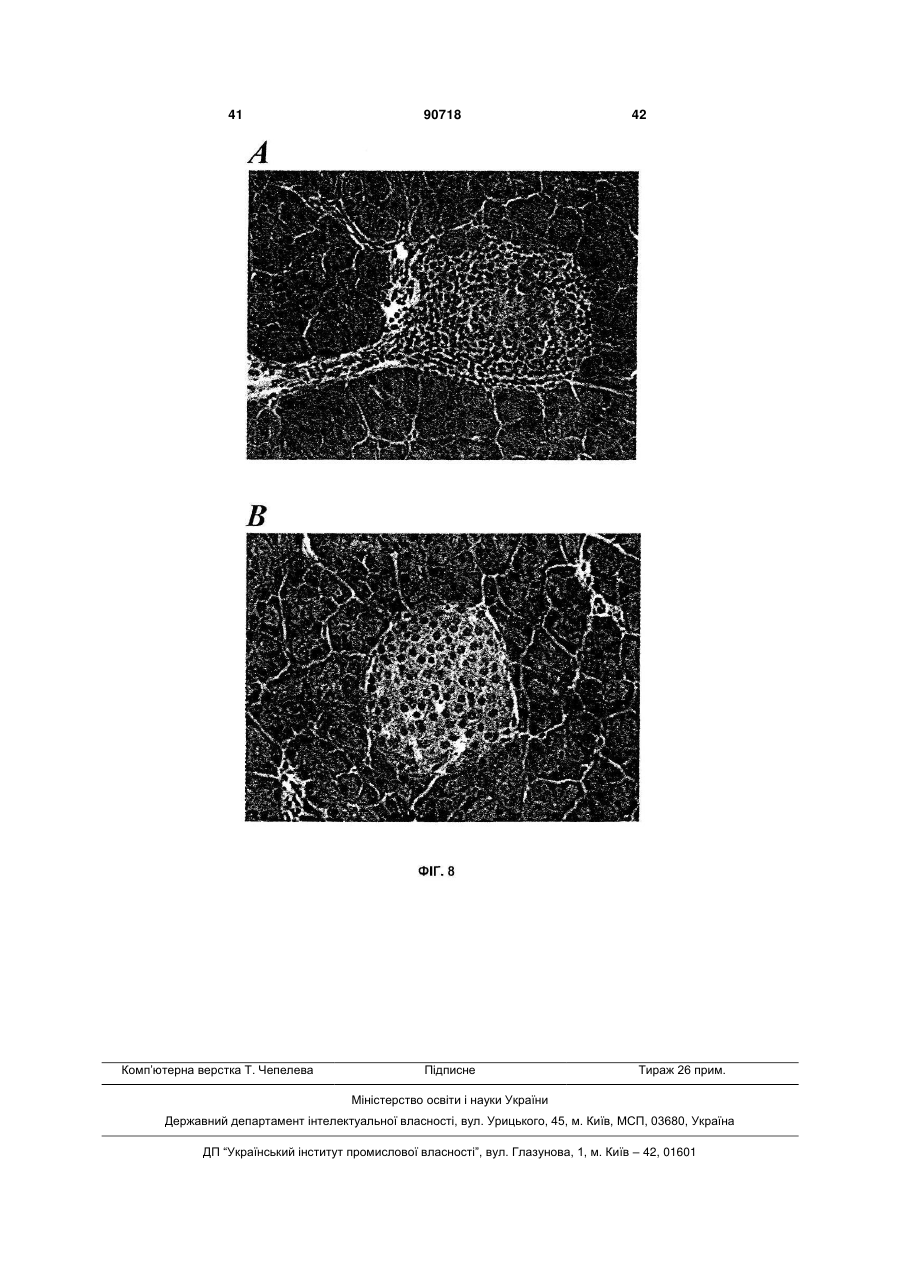
1. Застосування агоніста LXR для виготовлення лікарського засобу, корисного для лікування діабету типу І. 2. Застосування за п. 1, де зазначений лікарський засіб застосовують для регенерації бета-клітин. 3. Застосування за п. 1, де зазначений лікарський засіб застосовують для підвищення життєздатності бета-клітин. 4. Застосування за п. 1, де зазначений лікарський засіб застосовують для підвищення життєздатнос C2 2 (19) 1 3 примітно, що непереносимість глюкози розвивається з віком, коли швидкість реплікації бетаклітини є зниженою, і що у пацієнтів з інсуліннезалежним цукровим діабетом втрата маси бетаклітин складає 40-60% у порівнянні із суб'єктами, які не є діабетиками. Загальноприйнято, що в суб'єктів, стійких до інсуліну, нормоглікемія підтримується за рахунок компенсаторної гіперінсулінемії доти, поки бета-клітини не стають нездатними задовольняти підвищену потребу в інсуліні, і в цей момент виникає діабет типу II. Цукровий діабет типу II, чи інсуліннезалежний цукровий діабет (ІНСД), є полігенним захворюванням і складає >90% випадків діабету. Це захворювання характеризується стійкістю до дії інсуліну на всмоктування глюкози та порушеною дією інсуліну на інгібування продукування глюкози печінкою. Регуляція метаболізму глюкози інсуліном є ключовим механізмом, за допомогою якого підтримується гомеостаз у тварини. Інсулін стимулює всмоктування глюкози з крові до тканин, зокрема, до м'язової і жирової. Це відбувається за рахунок підвищеного переміщення Glut4, чуттєвого до інсуліну транспортера глюкози, від внутрішньоклітинного везикулярного компартмента до плазматичної мембрани. Glut4 є найважливішим чуттєвим до інсуліну транспортером глюкози в цих тканинах. Інсулін зв'язується з його рецептором у плазматичній мембрані, генеруючи серію сигналів, що приводять до переміщення або руху везикул транспортера Glut4 до плазматичної мембрани. Печінкові рецептори X (LXR) є членами надсімейства ядерних рецепторів, що індукують залежну від ліганду транскрипційну активацію генівмішеней. Вони відіграють важливу роль у метаболізмі та гомеостазі холестерину. Відомо, що у ссавців існує два білки LXR (альфа і бета). Експресія LXR альфа є високої в органах, залучених до гомеостазу ліпідів, таких як тонкий кишечник, бура і біла жирова тканина, тоді як LXR бета є більш розповсюдженим та рясним у тканинах нервового й ендокринного походження. Нещодавно виявлено, що LXR альфа і бета експресуються в острівцях підшлункової залози, а також в альфа-клітинах і бета-клітинах (Efanov et al, Diabetes, 53 (3), S7578, 2004). LXR альфа і LXR бета є близькоспорідненими та володіють 77% амінокислотною ідентичністю як у їхній ДНК-, так і в єднальних ліганд доменах. LXR також є консервативними в людей та інших тварин (наприклад, у гризунів). Подібно іншим ядерним рецепторам, LXR утворять гетеродимер з рецептором ретиноїда X (RXR) для функціонування. Відомо, що LXR активуються деякими окисленими похідними холестерину, що зустрічаються в природі, включаючи 22(R)-гідроксихолестерин, 24(S)гідроксихолестерин і 24,25(S)-епоксихолестерин. LXR альфа і бета є регуляторами печінкових генів, залучених до метаболізму холестерину і жирних кислот (HMGCo синтази/редуктази, фарнезилдіфосфатсинтази, скваленсинтази, SREBP1c, стеароіл-соа-десатурази (SCD1 і 2), FAS), інгібують експресію ферментів глюконеогенеза (РЕРСK, фруктозодіфосфатази-1, глюкозо-6-фосфатази), індукують експресію трансмембранних транспор 90718 4 терів (АВСА1, Glut1 і Glut4), інгібують експресію ферментів, залучених до гліколізу (6фосфофрукто-2-кінази) та індукують кіназу піруватдегідрогенази-4 (негативний регулятор гліколізу), знижують 11-бетагідроксистероїддегідрогеназу типу 1 (фермент, що повторно активує неактивний кортизон в активний кортизол у людей). Лептин та UCP-1 ідентифіковані як гени-мішені LXR (понижуюча регуляція агоністами LXR). Крім того, LXR мають функції, що перекриваються, з PPAR (рецепторами активаторів проліферації пероксисом) при негативній регуляції запальної відповіді. LXR інгібують продукування TNFa і IL-1β та експресію запальних медіаторів, таких як СОХ2, iNOS, IL-6. LXR можуть відігравати ключову роль у відповідях на запалення, і, оскільки показано, що вони важливі в метаболізмі ліпідів, LXR можуть бути також залучені до індукованих ожирінням запальних відповідей (розглянуто в Steffensen et al, Diabetes, 2004, 53 (1), S36-42). Показано, що у мишей db/db агоніст LXR T0901317, описаний тут нижче, знижує рівень глюкози в плазмі (не у нормальних мишей). Дана сполука інгібує експресію РЕРСК (фосфоенолпіруваткарбоксикінази) з обмеженням утворення глюкози печінкою (Cao et al, J Biol Chem, 2003, 278, 11311136). Культивування острівців підшлункової залози або секретуючих інсулін клітин MIN6 з Т0901317 викликало підвищення залежної від глюкози секреції інсуліну та вміст інсуліну в острівцях. Стимулюючий ефект даної сполуки на секрецію інсуліну спостерігали тільки після >72ч культивування острівців з Т0901317. У клітинах MIN6 Tularik підвищував білкову експресію ліпогенних ферментів, сінтази жирних кислот і ацетил-СоА карбоксілази. Активація LXR також давала підвищення рівня активності білків глюкокінази і піруваткарбоксилази (PC). LXR можуть регулювати секрецію і біосинтез інсуліну шляхом регуляції метаболізму глюкози і ліпідів у бета-клітинах підшлункової залози (Efanov et al, Diabetes, 53 (3), S75-78, 2004). Панкреатичний дуоденальний гомеобоксний ген-1 (Pdx-1) є головним регулятором як розвитку підшлункової залози, так і диференціації клітинпопередників у фенотип бета-клітин. Крім того, у диференційованій бета-клітині Pdx1 є регулятором, що відповідає на глюкозу, експресії гена інсуліну, і функція Pdx1 у відповідь на глюкозу регулюється як його фосфориліруванням, так і ядерною транслокацією. Під час більш пізніх стадій розвитку острівців експресія Pdx-1 стає найбільш обмеженою зрілими бета-клітинами ендокринної підшлункової залози. У підшлунковій залозі дорослих субпопуляції клітин, продукуючих соматостатин, і клітин, продукуючих панкреатичний поліпептид, також експресують Pdx-1, і тільки деякі клітини, продукуючі глюкагон, експресують його. Дефект чутливості до глюкози бета-клітин підшлункової залози спостерігали у декількох тваринних моделях діабету типу II, і він корелював зі зниженою експресією гена транспортера глюкози типу 2 (Glut2). У моделі трансгенної миші показано, що експресія Glut2 антисмисловий РНК у бетаклітинах підшлункової залози зв'язана з поруше 5 ною глюкозою, що індукується, секрецією інсуліну та розвитком діабету. Експресія генатранспортера глюкози типу 2 (GLUT2) вибірково знижена в бета-клітинах підшлункової залози експериментальних моделей діабету, і мишачий промотор GLUT2 регулюється PDX-1. Даний винахід частково заснований на несподіваному відкритті, що активація LXR у пацюків ZDF приводить до поліпшення діабетичного стану при значному зниженні глікемії після обробки агоністом LXR. При оцінці потенційних механізмів, що полягають в основі протидіабетичної дії агоністу LXR, несподівано виявлено значне зниження апоптозу в ізольованих острівцях [Лангерганса] з пацюків ZDF, оброблених відомим агоністом LXR, названим "GW3965", зв'язано із збільшенням числа острівців; крім того, ці острівці мали значно більш високий вміст інсуліну та кращу чутливість до глюкози, ніж острівці з пацюків ZDF, оброблених носієм. Ці відкриття і додаткова експериментальна робота показали, що введення агоністу LXR in vivo здатне стимулювати секрецію інсуліну, у той же час, захищаючи острівці підшлункової залози від руйнування. Крім того, показано, що значне підвищення рівня мРНК PDX1 і Glut2, двох основних генів, залучених до регенерації острівців, було отримано в острівцях пацюків ZDF, оброблених GW3965. Регенерація острівців підшлункової залози також підтверджена гістологічним аналізом підшлункової залози мишей NOD, оброблених GW3965. Даний винахід також заснований на новому відкритті, що агоніст LXR не тільки захищає підшлункову залозу діабетиків від подальшого руйнування, зокрема, шляхом зниження апоптозу та інсуліту в підшлунковій залозі, але також підсилює регенеративні процеси підшлункової залози і, таким чином, дає можливість відновлення функції підшлункової залози, коли вона піддається ризику. Ці ефекти є додатковими до зниження утворення глюкози печінкою, описаному в печінці (Cao et al, 2003, JBC, 278 (2), 1131-1136), і потенціюють протидіабетичні властивості агоністів LXR. Корисна властивість агоністів LXR збільшувати число острівців та знижувати апоптоз в острівцях дає можливість нового режиму лікування: він полягає в лікуванні пацієнтів протягом обмеженого періоду часу до тих пір, поки глікемія та/або НbА1с (гемоглобін А1с) не знизиться до рівня стабільного стану (НbА1с 7% та/або глікемія 1,2-1,4г/л); тоді лікування припиняють до тих пір, поки глікемія та/або НbА1с залишається у прийнятному інтервалі (наприклад, на один місяць). Якщо рівень глікемії та/або НbА1с підвищується вище прийнятних значень, тоді лікування агоністом LXR буде призначено знову. У першому аспекті даний винахід, таким чином, спрямовано на застосування агоністу LXR для виготовлення лікарського засобу, корисного для лікування та/або попередження захворювання, зумовленого дегенерацією бета-клітин. Даний винахід також спрямований на застосування агоністу LXR для виготовлення лікарського засобу, корисного для регенерації бета-клітин і для підвищення життєздатності бета-клітин. 90718 6 Застосування відповідно до винаходу передбачає лікарський засіб, який можна застосовувати в сполученні з відомим протидіабетичним лікарським засобом. У другому аспекті даний винахід спрямований на спосіб підвищення ex vivo життєздатності первинних острівкових клітин підшлункової залози, при якому приводять у контакт зазначені острівкові клітини з агоністом LXR. У третьому аспекті в даному винаході запропоновані способи лікування дегенерації бетаклітин, при яких суб'єкту вводять агоніст LXR. У першому втіленні у винаході запропоновані способи попередження діабету типу І у суб'єкта, при яких суб'єкту вводять ефективну кількість агоністу LXR. В іншому втіленні в даному винаході запропоновані способи лікування або полегшення діабету, при яких вимірюють рівень циркулюючої глюкози та/або НbА1с у суб'єкта і вводять такому суб'єктові щодоби ефективну кількість агоністу LXR до стабілізації глікемії та/або НbА1с (НbА1С 7% та/або глікемії 1,2-1,4г/л, що підтримуються протягом одного місяця щонайменше двома дозами), потім призупиняють лікування, як тільки глікемія та/або НbА1с стабілізується, при цьому щодобове лікування, можливо, відновляють, якщо необхідно. В іншому втіленні у винаході запропоновані способи підвищення життєздатності трансплантованих донорських острівкових клітин підшлункової залози в реципієнта трансплантата, при яких зазначеному реципієнту трансплантата вводять агоніст LXR. Подальше розуміння природи і переваг даного винаходу може бути реалізоване з посиланням на решту розділів опису та формули винаходу. В одному аспекті даний винахід спрямований на застосування агоністу LXR для виготовлення лікарського засобу, корисного для лікування та/або попередження захворювання, обумовленого дегенерацією бета-клітин. Застосування згідно з даним винаходом є додатковим при лікуванні захворювань, обумовлених, зокрема, втратою функції бета-клітин чи клітин дисфункції бета-клітин та/або загибелі бетаклітин, таких як, але не обмежених ними, діабет, гіперглікемія й ожиріння. Даний винахід також корисний для попередження або модулювання розвитку таких захворювань чи розладів у суб'єкта, який підозрюється на схильність до таких захворювань чи розладів, або якщо така схильність відома. Даний винахід, таким чином, належить до застосування агоністу LXR для виготовлення лікарського засобу, корисного для лікування та/або попередження діабету типу І та типу II, і переважно діабету типу І. Як пояснено вище, у пацієнтів з діабетом типу II можуть проявлятися в більшій або меншій мірі ознаки діабету типу І, в основному, пов'язані з дефіцитом продукування інсуліну. Відповідно, в одному втіленні даний винахід спрямований на застосування агоністу LXR для виготовлення лікарського засобу, корисного для попередження, зупинення або уповільнення прогресування діабе 7 ту типу II у напрямку наступного діабетичного стану, що характеризується дефіцитом продукування інсуліну. Оскільки введення in vivo агоністу LXR збільшує число острівців та знижує апоптоз в острівцях, застосування агоністу LXR для виготовлення лікарського засобу, корисного для регенерації бетаклітин і для підвищення життєздатності бета-клітин являє собою два додаткових втілення даного винаходу. Щодо застосування для підвищення життєздатності клітин підшлункової залози має бути зрозуміло, що життєздатні клітини визначають як здатні до проліферації, диференціації, росту і розвитку. Життєздатність можна вимірити будь-якими способами, відомими в даній області техніки, та, наприклад, шляхом використання фарбування трипановим синім. В іншому втіленні даний винахід спрямований на застосування агоністу LXR для виготовлення лікарського засобу, корисного для підвищення життєздатності трансплантованих донорських острівкових клітин підшлункової залози у реципієнта трансплантата. Острівкові клітини підшлункової залози являють собою первинні острівкові клітини. Для даного конкретного застосування лікарський засіб можна вводити місцево до трансплантованої області або переважно вводити системно. В одному втіленні лікарський засіб вводять реципієнту трансплантата до та/або після трансплантації донорських острівкових клітин підшлункової залози. В іншому втіленні лікарський засіб вводять реципієнту трансплантата одночасно з трансплантацією донорських клітин підшлункової залози. Будь-які агоністи LXR, відомі й описані в даній області техніки, можна застосовувати для всіх застосувань і способів, як описано тут відповідно до даного винаходу. Переважно агоніст LXR являє собою агоніст LXR альфа, і, зокрема, агоніст LXR обрано з групи, що складається з GW3965 і Т0901317. Крім того, відповідно до переважного втілення, лікарський засіб, який слід застосовувати для всіх застосувань і способів даного винаходу, знаходиться у формі, придатної для перорального введення. При всіх застосуваннях і способах, описаних тут, лікарський засіб переважно вводять щодоби протягом щонайменше 30 діб. Його можна також вводити протягом щонайменше 60 діб, 90 діб або довше. Крім того, лікарський засіб згідно з даним винаходом можна застосовувати у сполученні з відомим протидіабетичним лікарським засобом, зокрема, обраним з групи, що складається з метформіну, піоглітазону, розиглітазону, глімепіриду, гліпізиду, глібуриду/метформіну, глібуриду, міглітолу, гліпізиду+метформіну, репагліниду, акарбози, троглітазону, натегліниду й агоністу GLP-1 (глюкагоноподібного пептиду-1). В другому аспекті даний винахід спрямовано на спосіб підвищення життєздатності первинних острівкових клітин підшлункової залози ex vivo, 90718 8 при якому приводять у контакт зазначені острівкові клітини підшлункової залози з агоністом LXR. Переважно агоніст LXR являє собою агоніст LXR альфа, і, зокрема, агоніст LXR, якій слід застосовувати, обрано з групи, що складається з GW3965 і Т0901317. У третьому аспекті в даному винаході запропоновано способи лікування дегенерації бетаклітин. Ці способи включають введення суб'єктові агоністу LXR. При таких способах застосовуваний агоніст LXR може являти собою агоніст LXR альфа, і, зокрема, агоніст LXR, який слід застосовувати, обрано з групи, що складається з GW3965 і Т0901317. У способах відповідно до винаходу суб'єкт переважно страждає діабетом типу І або типу II. Можливо, агоніст LXR вводять суб'єктові одночасно з відомим що знижує глікемію та/або НbА1с. Зокрема, відомий протидіабетичний лікарський засіб обрано з групи, що складається з метформіну, піоглітазону, розиглітазону, глімепіриду, гліпізиду, глібуриду/метформіну, глібуриду, міглітолу, гліпізиду+метформіну, репагліниду, акарбози, троглітазону, натегліниду й агоністу GLP-1. В одному втіленні у винаході запропоновані способи попередження діабету типу І у суб'єкта. Ці способи включають введення суб'єкту ефективної кількості агоністу LXR. Подібним чином, агоніст LXR, застосовуваний у зазначених способах попередження діабету типу І, може являти собою агоніст LXR альфа, і, зокрема, агоніст LXR, який слід застосовувати, обраний з групи, що складається з GW3965 і Т0901317. Можливо, агоніст LXR вводять суб'єктові одночасно з відомим протидіабетичним лікарським засобом або з будь-яким іншим лікарським засобом, що знижує глікемію та/або НbА1с. Зокрема, відомий протидіабетичний лікарський засіб обрано з групи, що складається з метформіну, піоглітазону, розіглітазону, глімепіриду, гліпізиду, глібуриду/метформіну, глібуриду, міглітолу, гліпізиду+метформіну, репагліниду, акарбози, троглітазону, натегліниду та агоністу GLP-1. В іншому аспекті в даному винаході запропоновані способи лікування або полегшення діабету, при яких вимірюють рівень циркулюючої глюкози та/або НbА1с у суб'єкта і вводять цьому суб'єктові щодобово ефективну кількість агоністу LXR до стабілізації глікемії та/або НbА1с (НbА1С 7% та/або глікемія 1,2-1,4г/л, що підтримується протягом одного місяця щонайменше двома дозами), потім припиняють лікування, як тільки глікемія та/або НbА1с стабілізується, при цьому щодобове лікування можливе відновлюють за необхідності. Щодобове лікування може бути відновлено, якщо глікемія та/або НbА1с більш не стабілізована або втрачена чутливість до інсуліну. Способи виміру рівнів циркулюючої глюкози та/або НbА1с являють собою способи, добре відомі на попередньому рівні техніки, і можна використовувати будь-який вид способів. Подібним чином агоніст LXR, застосовуваний у зазначених способах лікування або полегшення діабету, може являти собою агоніст LXR альфа, і, зокрема, агоніст LXR, який слід застосовувати, 9 обрано з групи, що складається з GW3965 і Т0901317. Можливо, агоніст LXR вводять суб'єкту одночасно з відомим протидіабетичним лікарським засобом або з будь-яким іншим лікарським засобом, що знижує глікемію та/або НbА1с. Зокрема, відомий протидіабетичний лікарський засіб обраний з групи, що складається з метформіну, піоглітазону, розіглітазону, глімепіриду, гліпізиду, глібуриду/метформіну, глібуриду, міглітолу, гліпізиду+метформіну, репагліниду, акарбози, троглітазону, натегліниду та агоністу GLP-1. У зазначених способах агоніст LXR переважно вводять суб'єкту щонайменше щодобово протягом щонайменше 30 діб. В іншому втіленні даний винахід направлено на спосіб підвищення життєздатності трансплантованих донорських острівкових клітин підшлункової залози реципієнту трансплантата, при якому вказаному реципієнту трансплантата вводять агоніст LXR. У наступних розділах приведений посібник з одержання і застосування лікарського засобу відповідно до винаходу та із здійснення способів за винаходом. Визначення Якщо не вказано інше, всі технічні та наукові терміни, що використовуються тут, мають таке саме значення, як звичайно їх розуміє звичайний фахівець в області техніки, до якої належить дане визначення. Наведені нижче посилання дають фахівцю в даній області техніки загальне визначення багатьох термінів, що використовуються в даному винаході: Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY (2d ed. 1994); THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY (Walker ed., 1988); і Hale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY (1991). Крім того, наведені нижче визначення наведено, щоб допомогти читачеві у здійсненні винаходу. Термін "LXR" (печінковий рецептор X) чи "рецептор LXR" включає всі підтипи даного рецептору. Конкретно LXR включає LXR альфа і LXR бета. Ряд назв, таких як LXRU, LXRa, LXR, RLD-1, NR1H3, використовували для позначення LXR альфа. Він охоплює будь-який поліпептид, що кодується геном з істотною ідентичністю послідовності з номером за каталогом GenBank U22662. Подібним чином, LXR бета включає будь-який поліпептид, що кодується геном, який називають як LXRb, LXRP, LXR бета, NER, NER1, UR, OR-1, RIP 15, NR1H2, чи геном з істотною ідентичністю послідовності з номером за каталогом GenBank U07132. Термін "ліганд" належить до агоністу або часткового агоністу LXR. Ліганд може бути виборчим до LXR альфа чи LXR бета, або він може володіти змішаною єднальною спорідненістю до обох рецепторів LXR альфа і LXR бета. Хоча ліганд може або агонізувати, або антагонізувати функцію рецептору, якщо не вказано інше, ліганд LXR, що використовується тут, насамперед, відноситься до агоністу LXR, що активує рецептор LXR. Термін "модулювати" щодо рецептору LXR належить до активації рецептору LXR та його біо 90718 10 логічних активностей, пов'язаних з біохімічним шляхом LXR (наприклад, регуляції транскрипції гена-мішені). Модулювання рецептору LXR може являти собою підвищувальну регуляцію (тобто агонізм, активацію або стимуляцію) чи понижуючу регуляцію (тобто антагонізм, інгібування чи пригнічення). Механізм дії модулятора LXR може бути прямим, наприклад, шляхом зв'язування з рецептором LXR в якості ліганду. Модулювання також може бути опосередкованим, наприклад, шляхом зв'язування з іншою молекулою та/або модифікацією цієї іншої молекули, яка в протилежному випадку зв'язується з рецептором LXR та активує його. Таким чином, модулювання LXR включає зміну в біологічних активностях ліганду агоністу LXR (тобто його активності при зв'язуванні та/або активації рецептору LXR) або зміна в клітинному рівні ліганду. Як використовують тут, вираз "скринінг на агоністи LXR" відноситься до використання відповідної системи аналізу для ідентифікації нових агоністів LXR з агентів, що тестуються. Аналіз може являти собою аналіз in vitro або in vivo, придатний для ідентифікації, чи може агент, що підлягає тестуванню, стимулювати чи активувати одну або більше ніж одну з біологічних функцій рецептору LXR. Приклади придатних біологічних аналізів включають, але не обмежені ними, аналізи на дослідження зв'язування агентів, що тестуються, з поліпептидом LXR (наприклад, фрагментом LXR, що містить його домен зв'язування з лігандом), аналізи на основі транскрипції, аналізи креатинкінази, аналізи, засновані на диференціації преадипоцитів, аналізи, засновані на регуляції захоплення глюкози в адипоцитах, та імунологічні аналізи. "Суб'єкт" переважно являє собою ссавця, більш переважно людину. Термін "дегенерація бета-клітин" призначений для позначення втрати функції бета-клітин, дисфункції бета-клітин та загибелі бета-клітин, такий як чи некроз апоптоз бета-клітин. Термін "лікування захворювання" визначають як допомога та догляд за пацієнтом з метою боротьби з захворюванням, станом або розладом і включають до нього введення агоністу LXR для попередження появи симптомів чи ускладнень, або для полегшення чи симптомів ускладнень, або для усунення захворювання, стани, чи розладу. Лікування включає модулювання, інгібування, зниження, зменшення або зупинення дегенерації бета-клітин, такої як некроз або апоптоз бета-клітин, зокрема, загибелі бета-клітин, що програмується, відомої як апоптоз бета-клітин, а також попередження дегенерації бета-клітин, такої як некроз або апоптоз бета-клітин, зокрема, попередження апоптозу бета-клітин. Лікування включає також дегенерацію бета-клітин. Термін "для лікування", як використовують тут, слід розуміти як охоплюючий пряме застосування сполуки для лікування або опосередковане застосування зазначеної сполуки при лікуванні вказаного захворювання. Термін "дефіцит продукування інсуліну" призначений для позначення прояву значимої гіперглікемії та нормо- чи гіпоінсулінемії. Способи виміру 11 рівнів глікемії або інсуліну та оцінки гіперглікемії і нормо- або гіпоінсулінемії добре відомі в даній області техніки. Термін "у сполученні з" слід відносити або до лікарського засобу, в якому дві активних речовини (агоніст LXR та протидіабетичний лікарський засіб) є істотними складовими частинами однієї і тієї ж композиції, або до двох окремих лікарських засобів, які можна вводити одночасно чи послідовно. Терміни "стабілізація глікемії та/або НbА1с" чи "як тільки глікемія та/або НbА1с стабілізується", як використовують тут, призначені для позначення значення НbА1с < 7% та/або значення глікемії 1,2-1,4г/л, що підтримуються протягом одного місяця щонайменше двома дозами. Агоністи LXR Існує багато агоністів LXR, які придатні для здійснення способів за даним винаходом. Вони можуть являти собою будь-які відомі агенти, які активують рецептор LXR, наприклад, GW3965 (див. Приклади нижче) або інші наявні у продажу сполуки, такі як РЗметилАА (від Merck; див. Menke et al., Endocrinology 143: 2548-58, 2002) і Т0901317 (Tularik, Calif.). Вони можуть також являти собою нові агоністи LXR, що підлягають скринінгу відповідно до даного винаходу. Як детально описано нижче, агоністи LXR, придатні для даного винаходу, можуть являти собою поліпептиди, пептиди, малі молекули або інші агенти. Агоністи LXR можуть являти собою агоністи для LXR людини, а також інших тварин. Велика кількість агоністів LXR описана в даній області техніки. Приклади низькомолекулярних агоністів LXR включають добре відомі оксистерини та родинні сполуки (Janowski et al., Nature 383: 728-31, 1996); T0901317 і Т0314407 (Schultz et al., Genes Dev 14: 2831-8, 2000); 24(5)гідроксихолестерин і 22(R)-гідроксихолестерин (Janowski et al., Nature 383: 728-731, 1996); а також 24,25-епоксихолестерин (патент США №6316503). Зразкові поліпептидні агоністи LXR також описані в даній області техніки, наприклад, у WO 02/077229. Додаткові агоністи LXR описані в даній області техніки, наприклад, у патенті США №6316503; Collins et al., J Med Chem. 45: 1963-6, 2002; Joseph et al., Proc Natl Acad Sci USA 99: 7604-9, 2002; Menke et al., Endocrinology 143: 2548-58, 2002; Schultz et al., Genes Dev. 14: 2831-8, 2000 і Schmidt et al., Моl Cell Endocrinol. 155: 51-60,1999. Багато агоністів LXR ефективні при активації як LXR альфа, так і LXR бета (наприклад, GW3965, як описано в Collins et al., J Med Chem. 45: 1963-6, 2002). Деякі агоністи LXR активують LXR альфа і LXR бета в різних умовах. Наприклад, 6-альфа-гідроксилірованні жовчні кислоти є агоністами LXR альфа, але також активують LXR бета при більш високих концентраціях (Song et al., Steroids 65: 423-7, 2000). Деякі агоністи LXR діють виключно на LXR альфа, тоді як деякі інші активують тільки LXR бета. Наприклад, у результаті введення атома кисню на стерольне В-кільце оксистерину утворюється ліганд з вибірковістю до LXR альфа-підтипу (Janowski et al., Proc Natl Acad Sci USA 96: 266-71, 1999). З використанням залежних від ліганду транскрипційних аналізів було виявле 90718 12 но, що 5-тетрадецилокси-2-фуранкарбонова кислота (TOFA) і гідроксихолестерин трансактивують хімерні рецептори, що складаються з ДНКєднального домену рецептору глюкокортикоїдів та єднальних ліганд областей рецепторів LXR бета, PPAR альфа і PPAR бета (Schmidt et al., Мої Cell Endocrinol. 155: 51-60, 1999). Агоністи LXR можуть бути також отримані з похідних відомих поліпептидних агоністів рецептору LXR. Вони можуть бути отримані за допомогою низки методик, відомих у даній області техніки. Наприклад, можна синтезувати специфічні олігопептиди (наприклад, 10-25 амінокислотних залишків), що охоплюють відомий поліпептидний агоніст LXR (наприклад, хімічним або рекомбінантним шляхом) і тестувати на їх здатність до активації рецептору LXR. Фрагменти агоністу LXR можна синтезувати, використовуючи стандартні методики, такі як описані в Bodansky, Μ. Principles of Peptide Synthesis, Springer Verlag, Berlin (1993) і Grant, G. A. (ed.). Synthetic Peptides: A User's Guide, W. H. Freeman and Company, New York (1992). Автоматичні синтезатори пептидів наявні у продажу, наприклад, від Advanced ChemTech Model 396; Milligen/Biosearch 9600. Альтернативно такі агоністи LXR можуть бути отримані шляхом ферментативного розщеплення нативних або продукованих рекомбінантним шляхом поліпептидних агоністів LXR, використовуючи протеазу, наприклад, трипсин, термолізин, хімотрипсин або пепсин. Комп'ютерний аналіз (з використанням наявного у продажу програмного забезпечення, наприклад, MacVector, Omega, PCGene, Molecular Simulation, Inc.) можна використовувати для ідентифікації сайтів протеолітичного розщеплення. Поліпептидні або пептидні агоністи для застосування у способах за даним винаходом є переважно ізольованими та по суті вільними від клітинного матеріалу або інших забруднюючих білків з клітини або тканинного оточення, з яких виділяють агоністи LXR, або по суті вільними від хімічних попередників або інших хімічних речовин при хімічному синтезі. Протеолітичні або синтетичні поліпептидні агоністи або їх фрагменти можуть містити стільки амінокислотних залишків, скільки необхідно для активації рецепторної активності LXR, і можуть містити щонайменше 5, 10, 15, 20, 25, 30, 35, 40, 45, 50 або більше амінокислотних залишків у довжину. Крім відомих сполук і поліпептидів, що активують рецептор LXR, агоністи LXR можуть бути також отримані шляхом скринінгу агентів, що тестуються, (наприклад, бібліотек сполук) для ідентифікації нових агоністів LXR, які зв'язуються з рецепторними активностями LXR та/або активують їх. Для скринінгу на такі нові агоністи LXR можна використовувати людський LXR чи LXR інших тварин у системі точного аналізу. Полінуклеотидні та амінокислотні послідовності рецепторів LXR відомі й описані в даній області техніки. їх структури та функціональні організації, включаючи їх домени, що зв'язують ліганд, також охарактеризовані. Див., наприклад, Apfel et al., МоІ Cell Biol 14: 7025-7035, 1994; Willy et al., Genes Dev 9: 1033-1045, 1995; Song et al., Proc Natl Acad Sci USA 91: 10809 13 10813, 1994; Shinar et al., Gene 147: 273-276, 1994; Teboul et al., Proc Natl Acad Sci USA 92: 2096-2100, 1995; і Seol et al., МоІ Endocrinol 9: 72-85, 1995. Агоністи можуть активувати або LXR, або LXR альфа. Крім того, замість повнорозмірної молекули LXR у деяких із скринінгових аналізів можна використовувати поліпептид LXR, що містить фрагмент молекули LXR. Наприклад, два функціональних домени рецептору LXR, N-кінцевий ДНКз'єднувальний домен (DBD) і С-кінцевий домен, що зв'язує ліганд (LBD), опосередковують функцію транскрипційної активації ядерних рецепторів. Поліпептид LXR, який містить будь-який з цих доменів, можна використовувати в скринінгу на нові агоністи LXR. Ряд аналітичних систем можна використовувати для скринінгу агентів, що тестуються, на агоністи рецептору LXR. Як детально описано нижче, агенти, що тестуються, можна піддавати скринінгу на пряме зв'язування з поліпептидом LXR чи його фрагментом (наприклад, його доменом, що зв'язує ліганд). Альтернативно або додатково потенційні агоністи LXR можна досліджувати на здатність до активації біохімічного шляху рецептору LXR чи до стимуляції інших біологічних активностей рецептору LXR. У скринінгу можна використовувати або систему аналізу in vitro, або систему аналізу на клітинній основі. Вибірковість потенційних агоністів LXR до різних рецепторів (наприклад, LXR альфа, LXR бета, RXR чи PPAR) можна тестувати, використовуючи способи, добре відомі в даній області техніки, наприклад, конкурентні аналізи наближеності сцинтиляції радіоактивного ліганду LXR описано, наприклад, у WO 01/41704, і конкурентні аналізи зв'язування PPAR описано, наприклад, у Berger et al., J Biol Chem 274: 6718-6725, 1999). Агенти, що тестуються і які можна піддавати скринінгу на нові агоністи LXR, включають поліпептиди, бета-обертаючі міметики, полісахариди, фосфоліпіди, гормони, простагландиіни, стероїди, ароматичні сполуки, гетероциклічні сполуки, бензодіазепини, олігомерні N-заміщені гліцини, олігокарбамати, поліпептиди, сахариди, жирні кислоти, стероїди, пурини, піримидини, похідні, структурні аналоги чи їх комбінації. Деякі агенти, що тестуються, являють собою синтетичні молекули, а також й інші природні молекули. Агенти, що тестуються, одержують із широкого ряду джерел, включаючи бібліотеки синтетичних чи природних сполук. Комбінаторні бібліотеки можна одержувати для багатьох типів сполуки, які можна синтезувати східчасто. Великі комбінаторні бібліотеки сполук можна конструювати способом синтетичних бібліотек (ESL), що кодуються, описаним у WO 95/12608, WO 93/06121, WO 94/08051, WO 95/35503 і WO 95/30642. Пептидні бібліотеки можна також створювати способами фагового дисплею (див., наприклад, Devlin, WO 91/18980). Бібліотеки природних сполук у формі бактеріальних, грибних, рослинних і тварин екстрактів можуть бути отримані з комерційних джерел або зібрані в полі. Відомі фармакологічні агенти можуть бути предметом спрямованих чи випадкових хімічних модифікацій, таких як ацилірування, алкілірування, 90718 14 естерифікація, амідування, з одержанням структурних аналогів. Комбінаторні бібліотеки пептидів чи інших сполук можуть бути цілком рандомізованими безпереваг послідовностей або констант у будь-якому положенні. Альтернативно бібліотека може бути зміщеною, тобто деякі положення в межах послідовності або зберігають постійними, або обирають з обмеженого числа можливостей. Наприклад, у деяких випадках нуклеотиди чи амінокислотні залишки рандомізовані в межах визначеного класу, наприклад, гідрофобних амінокислот, гідрофільних залишків, стерично зміщених (або малих, або великих) залишків, у напрямку утворення цистеїнів, для поперечної зшивки, пролинів для SH-3 доменів, серинів, треонинів, тирозинів або гистидинів для сайтів фосфорилірування, або пуринів. Агенти, що тестуються, можуть являти собою білки, які зустрічаються в природі, або їх фрагменти. Такі агенти, що тестуються можуть бути отримані з природного джерела, наприклад, клітинного або тканинного лізату. Бібліотеки поліпептидних агентів можуть бути також отримані, наприклад, з бібліотеки кДНК, що наявна у продажу або створена рутинними способами. Агенти, що тестуються, можуть також являти собою пептиди, наприклад, пептиди з амінокислот у кількості від приблизно 5 до приблизно 30, де переважно від приблизно 5 до приблизно 20 амінокислот, і особливо переважно від приблизно 7 до приблизно 15. Пептиди можуть являти собою продукти ферментативного розщеплення білків, що зустрічаються в природі, випадкових пептидів або "зміщених" випадкових пептидів. При деяких способах агенти, що тестуються, являють собою поліпептиди чи білки. Агенти, що тестуються, можуть також являти собою нуклеїнові кислоти. Нуклеїново-кислотні агенти, що підлягають тестуванню, можуть являти собою нуклеїнові кислоти, які зустрічаються у природі, випадкові нуклеїнові кислоти або "зміщені" випадкові нуклеїнові кислоти. Наприклад, продукти ферментативного гідролізу прокаріотичних або еукаріотичних геномів можна використовувати подібним чином, як описано вище для білків. При деяких переважних способах агенти, що тестуються, являють собою малі органічні молекули (наприклад, молекули з молекулярною масою не більш ніж приблизно 1000). Переважно аналізи з високим виходом адаптовані та використовуються для скринінгу на такі малі молекули. При деяких способах комбінаторні бібліотеки низькомолекулярних агентів, що тестуються, як описано вище, можна легко використовувати для скринінгу на низькомолекулярні модулятори рецептору LXR. Ряд аналізів доступний для такого скринінгу, наприклад, як описано в Schultz (1998) Bioorg Med Chem Lett 8: 2409-2414; Weller (1997) МоІ Divers. 3: 61-70; Femandes (1998) Curr Opin Chem Biol 2: 597603; і Sittampalam (1997) Curr Opin Chem Biol 1: 384-91. Потенційні агоністи LXR можна також ідентифікувати на підставі раціонального дизайну. Наприклад, Janowski et al. (Proc Natl Acad Sci USA 96: 266-71, 1999) розкрито структурні вимоги до ліганд для LXR альфа і LXR бета. Було показано, що 15 специфічне для положення моноокислення бокового ланцюга стерину оксистерина є необхідним для зв'язування LXR з високою спорідненістю та його активації. Посилене зв'язування і активація можуть бути також досягнуті за допомогою використання 24-оксо-лігандів, що діють як акцептори водневого зв'язку в боковому ланцюзі. Крім того, результатом введення атома кисню на стеринове В-кільце є ліганд і вибірковістю до LXR альфапідтипу. Бібліотеки агентів, що тестуються, які підлягають скринінгу заявленими способами, можна також створити на підставі структурних досліджень рецепторів LXR, їх фрагментів або аналогів. Такі структурні дослідження дають можливість ідентифікації агентів, що тестуються та більш ймовірно зв'язуються з рецептором LXR. Тривимірну структуру рецептору LXR можна досліджувати низкою шляхів, наприклад, кристалічної структури і молекулярного моделювання. Способи дослідження білкових структур з використанням рентгенокристалографії добре відомі в літературі. Див. Physical Bio-chemistry, Van Holde, Κ. Ε. (Prentice-Hall, N. J. 1971), pp.221-239, і Physical Chemistry with Applications to the Life Sciences, D. Eisenberg & D. C. Crothers (Benjamin Cummings, Menlo Park 1979). Способи молекулярного моделювання описані в літературі, наприклад, у патенті США №5612894, озаглавленому "System and method for molecular modeling utilizing a sensitivity factor", та в патенті США №5583973, озаглавленому "Molecular modeling method and system". Крім того, білкові структури можна також визначати за допомогою дифракції нейтронів і ядерного магнітного резонансу (ЯМР). Див., наприклад, Physical Chemistry, 4th Ed. Moore, W. J. (Prentice-Hall, N.J. 1972), і NMR of Proteins and Nucleic Acids, K. Wuthrich (Wileylnterscience, New York 1986). У деяких скринінгових аналізах визначають зв'язування агента, що тестується, з LXR чи поліпептидом LXR, який містить його домен, що зв'язує ліганд. Зв'язування агентів, що тестуються, (наприклад, поліпептидів) з поліпептидом LXR можна аналізувати за допомогою ряду способів, включаючи, наприклад, позначені аналізи зв'язування білок-білок in vitro, аналізи зрушення електрофоретичної рухливості, імунологічні аналізи на зв'язування білка, функціональні аналізи (аналізи фосфорилірування і т.д.) тощо. Див., наприклад, патенти США №№4366241; 4376110; 4517288; і 4837168; а також Bevan et al., Trends in Biotechnology 13: 115-122, 1995; Ecker et al., Віо/Technology 13: 351-360, 1995; і Hodgson, Bio/Technology 10: 973-980, 1992. Агент, що тестується, можна ідентифікувати шляхом виявлення прямого зв'язування з поліпептидом LXR, наприклад, спільної імунопреципітації з поліпептидом LXR антитілом, спрямованим на поліпептид LXR. Агент, що тестується, можна також ідентифікувати шляхом виявлення сигналу, який вказує на те, що цей агент зв'язується з поліпептидом LXR, наприклад, гасіння флуоресценції. Конкурентні аналізи забезпечують придатний формат для ідентифікації агентів, що тестуються (наприклад, пептидів або низькомолекулярних 90718 16 сполук), які специфічно зв'язуються з поліпептидом LXR. У таких форматах агенти, що тестуються, піддають скринінгу в конкуренції зі сполукою, вже відомою як з'єднуюча поліпептид LXR. Відома з'єднуюча сполука може являти собою синтетичну сполуку. Вона також може являти собою антитіло, що специфічно розпізнає поліпептид LXR, наприклад, моноклональне антитіло, спрямоване проти поліпептиду LXR. Якщо агент, що тестується, інгібує зв'язування сполуки, відомої як зв'язуюча поліпептид LXR, тоді агент, що тестується, також зв'язує поліпептид LXR. Відомі різні типи аналізів конкурентного зв'язування, наприклад: твердофазний прямий або опосередкований радіоімунологічний аналіз (РІА), твердофазний прямий або опосередкований ферментативний імунологічний аналіз (ЕІА), конкурентний сендвіч-аналіз (див. Stahli et al., Methods in Enzymology 9: 242-253 (1983)); твердофазний прямий ЕІА біотин-авідин (див. Kirkland et al., J. Immunol. 137: 3614-3619 (1986)); твердофазний прямий позначений аналіз, твердофазний прямий позначений сендвіч-аналіз (див. Harlow and Lane, "Antibodies, A Laboratory Manual," Cold Spring Harbor Press (1988)); твердофазний прямий позначений РІА з використанням позначення 125І (див. Morel et al., Моl. Immunol. 25(1): 7-15 (1988)); твердофазний прямий ЕІА біотин-авідин (Cheung et al., Virology 176: 546-552 (1990)); та прямий позначений РІА (Moldenhauer et al., Scand. J. Immunol. 32: 77-82 (1990)). Типово до такого аналізу залучено використання очищеного поліпептиду, зв'язаного з твердою поверхнею або клітинами, що несуть будь-який з них, непозначеного агента, що тестується, і позначеної порівняльної сполуки. Конкурентне інгібування вимірюють шляхом визначення кількості позначення, зв'язаного з твердою поверхнею чи клітинами в присутності агента, що тестується. Звичайно агент, що тестується, присутній у надлишку. Агенти, що модулюють, ідентифіковані конкурентним аналізом, включають агенти, що зв'язуються з тим же епітопом, що й порівняльна сполука, і агенти, що зв'язуються з прилягаючим епітопом, істотно близьким до епітопу, що зв'язується порівняльною сполукою, щоб відбулося стеричне утруднення. Звичайно, коли конкуруючий агент присутній у надлишку, він буде інгібувати специфічне зв'язування порівняльної сполуки з загальним поліпептидом-мішенню щонайменше на 50 чи 75%. Скринінгові аналізи можна проводити або в нерозчинному, або в розчинному форматі. Одним із прикладів нерозчинних аналізів є іммобілізація поліпептиду LXR або його фрагментів на твердофазному матриксі. Потім цей твердофазний матрикс приводять у контакт з агентами, що тестуються, на період, достатній для можливості зв'язування агентів, що тестуються. Після відмивання будь-якого матеріалу, що не зв'язався, від твердофазного, матриксу присутність агента, зв'язаного з твердою фазою, дає можливість ідентифікації цього агента. Ці способи можуть додатково включати стадію елюції зв'язаного агента з твердофазного матрикса, виділяючи за допомогою цього агент. Альтернативно, крім іммобілізації по 17 ліпептиду LXR, агенти, що тестуються, зв'язують з твердим матриксом, а потім додають молекулу поліпептиду LXR. Аналізи у розчині включають деякі із способів скринінгу комбінаторних бібліотек, описаних вище. У форматах аналізу в розчині ані агенти, що тестуються, ані поліпептид LXR не зв'язано з твердим носієм. Зв'язування поліпептиду LXR чи його фрагмента з агентом, що тестується, можна визначити, наприклад, по змінам флуоресценції або поліпептиду LXR, або агентів, що тестуються, або того й іншого. Флуоресценція може бути власною або набутою шляхом позначення будь-якого компонента флуорофором. У деяких аналізах зв'язування або поліпептид LXR, або агент, що тестується, або третя молекула (наприклад, антитіло проти поліпептиду LXR) можуть бути представлені у вигляді позначених угруповань, тобто ковалентно пов'язаних чи зшитих з позначенням, що детектується, чи групою, або групою, що поперечно зшивається, щоб сприяти ідентифікації, виявленню та кількісному визначенню поліпептиду в даній ситуації. Такі групи, що детектуються, можуть містити поліпептидну групу, яка виявляється, наприклад, аналізований фермент чи епітоп антитіла. Альтернативно група, що детектується, може бути обрана з ряду інших груп, що детектуються, або позначень, таких як радіоактивні позначення (наприклад, 125І, 32Р, 35S), або хемілюмінесцентна чи флуоресцентна група. Подібним чином, група, що детектується, може являти собою субстрат, кофактор, інгібітор або афінний ліганд. Зв'язування агента, що тестується, з LXR можна також тестувати опосередковано при аналізі на клітинній основі. Наприклад, ДНК-зв'язуючий домен не рецепторного фактора транскрипції GAL4 можна злити з доменом, що зв'язує ліганд, LXR (наприклад, LXR альфа). Отриману в результаті конструкцію вводять до клітини-хазяїна (наприклад, клітини 293) разом з конструкцієюрепортером (наприклад, конструкція люциферазного репортера, що містить UAS). Потім трансфецировані клітини обробляють бібліотеками агентів, що тестуються, і вимірюють активність поліпептиду-репортера (наприклад, активність люциферази). Ефекти індивідуальних агентів, що тестуються, на активність поліпептиду-репортера оцінюють щодо контролю (тобто, коли сполука, що тестується, не присутня). Безклітиний аналіз чутливості до ліганду (LiSA, cell-free ligand sensing assay) можна також використовувати для ідентифікації нових агоністів LXR. Його можна проводити, як описано в даній області техніки, наприклад, Collins et al., J. Med. Chem. 45: 1963-6, 2002; і Spencer et al., J. Med. Chem. 44: 886-97, 2001. У цьому аналізі вимірюють залежний від ліганду рекрутмент пептиду від соактиватора 1 стероїдного рецептору (SRC1) до ядерного рецептору. При даному аналізі (LiSA) можна досліджувати структурні вимоги до активації рецептору LXR агентами, що тестуються. Крім того, або на додаток до виявлення прямого зв'язування агента, що тестується, з поліпептидом LXR, потенційні агоністи LXR для застосу 90718 18 вання у способах відповідно до даного винаходу можна також досліджувати на здатність до активації інших біологічних активностей чи клітинних активностей рецептору LXR. Агенти, що тестуються та активують рецептор LXR, можна ідентифікувати шляхом моніторингу їх ефектів на ряд клітинних активностей LXR. Клітинні активності LXR включають будь-як активність, опосередковану активованим рецептором LXR (наприклад, транскрипційну регуляцію гена-мішені). Наприклад, LXR трансактивує експресію ряду генів-мішеней (наприклад, АВСА1), інгібує диференціацію фібробластів в адипоцити, модулює продукування ферментів, специфічних для м'язів, наприклад, креатинкінази, модулює захоплення глюкози клітинами і стимулює проліферацію клетинміобластів. Ступінь, з яким агент, що тестується, активує рецептор LXR, можна ідентифікувати шляхом тестування на здатність агента до посилення таких активностей LXR. Таким чином, новий агоніст LXR можна ідентифікувати шляхом ідентифікації агента, що тестується та підсилює експресію гена-мішені LXR (наприклад, АВСА1, ABCG1, SREBP1 або гена холестерин-7-гідроксилази). Способи ідентифікації агентів, що тестуються та які індукують експресію гена-мішені LXR (наприклад, підвищення рівнів мРНК АВСА1), розкрито в даній області техніки, наприклад, Menke et al., Endocrinology 143: 254858, 2002; Sparrow et al., J. Biol. Chem. 277: 10021-7, 2002; і Murthy et al., J. Lipid Res. 43: 1054-64, 2002. Крім моніторингу експресії гена-мішені LXR, агоністи LXR можна також ідентифікувати шляхом дослідження інших клітинних активностей, що стимулюються біохімічним шляхом LXR. Наприклад, агоністи LXR модулюють рівень білку і, отже, активність специфічного для м'язів ферменту, креатинкінази. Отже, агоністи LXR можна піддавати скринінгу шляхом дослідження агентів, що тестуються, на здатність до модулювання активності креатинкінази, наприклад, як описано в Somjen et al., J Steroid Biochem Моl Biol 62: 401-8, 1997. Цей аналіз можна проводити в клітинній лінії, наприклад, лінії клітин-міобластів скелетних м'язів миші або клітинної лінії первинних клітин-міобластів курчати. Ефекти сполук, що тестуються, на активність креатинкінази в клітинах, що культивуються, можна вимірити в клітинних лізатах, використовуючи наявний у продажу набір (що поставляється Sigma, St Louis, Mo.). Модулювання інших клітинних біологічних активностей рецептору LXR можна також виявити, використовуючи способи, які добре відомі та звичайно практикуються в даній області техніки. Наприклад, агент, що тестується, можна аналізувати на його активності при підвищенні відтоку холестерину з клітин, таких як макрофаги (Menke et al., Endocrinology 143: 2548-58, 2002; і Sparrow et al., J. Biol. Chem. 277: 10021-7, 2002). Інші аналізи включають залежні від ліганду транскрипційні аналізи (Schmidt et al., Моl Cell Endocrinol 155: 51-60, 1999), способи виміру здатності агоністів LXR до втручання в процес диференціації преадипоцитів (фібробластів) в адипоцити (Plaas et al., Biosci Rep 1: 207-16, 1981; Hiragun et al., J Cell Physiol 134: 19 124-30, 1988; і Liao et al., J. Biol Chem 270: 1212332, 1995) або здатності до стимуляції проліферації клітин-міобластів (Konishi et al., Biochemistry 28: 8872-7, 1989; і Austin et al., J Neurol Sci 101: 193-7, 1991). В якості контролю усі ці аналізи можуть включати вимірювання до і після додавання агента, що тестується, до системи аналізу. Терапевтичні застосування У даному винаході запропоновано способи лікування дегенерації бета-клітин у суб'єкта, при яких зазначеному суб'єктові вводять агоніст LXR. Ці способи також знаходять застосування при лікуванні захворювання, що характеризується недостатністю бета-клітин і, отже, дисфункцією інсуліну (наприклад, стійкістю, відсутністю активності чи дефіцитом) та/або недостатнім транспортом глюкози до клітин. Такі захворювання включають, але не обмежені ними, діабет, гіперглікемію та ожиріння. Лікування дегенерації бета-клітин також корисно для попередження або модулювання розвитку таких захворювань чи розладів у суб'єкта, що підозрюється на схильність до таких захворювань чи розладів, або якщо така схильність відома. Більш конкретно, оскільки тепер несподівано виявлено, що можливо уникнути дегенерації бетаклітин, винахід також спрямований на спосіб попередження діабету типу І у суб'єкта, при якому суб'єктові вводять ефективну кількість агоністу LXR. Агоністи LXR, які слід використовувати в даних застосуваннях, можуть являти собою будь-який з відомих агоністів LXR, що описані в даній області техніки. Альтернативно способи терапії включають скринінг агентів, що тестуються, для ідентифікації нових агоністів LXR, як описано вище, і введення таких нових агоністів для лікування дегенерації бета-клітин або для лікування зазначених вище захворювань у суб'єкта. Автори даного винаходу спостерігали, що зупинка дегенерації бета-клітин може бути досягнута після застосування агоністу LXR протягом дуже короткого періоду часу, наприклад, 21 доба. Однак, коли метою є посилення чутливості до інсуліну або полегшення симптомів діабету в суб'єкта, необхідний більш тривалий період лікування. Для таких застосувань агоніст LXR типово вводять суб'єктові протягом тривалого періоду часу, наприклад, щонайменше 30 діб, 60 діб, 90 діб або довше. Винахід також відноситься до нового способу з поліпшеним дотриманням пацієнтом режиму і схеми лікування. Добре відомо, що суб'єкт із діабетом повинен приймати велику кількість ліків. Даний винахід дає можливість зменшити кількість ліків, що приймаються, і навіть надає можливість призупинити лікування, як тільки значення глікемії та/або НbА1 с стабілізується, або відновити чутливість до інсуліну. Таким чином, даний винахід також спрямований на спосіб лікування чи полегшення діабету, при якому вимірюють рівень циркулюючої глюкози та/або НbА1с у суб'єкта і вводять цьому суб'єктові щодобово ефективну кількість агоністу LXR до стабілізації глікемії та/або НbА1с, потім припиняють лікування, як тільки глікемія та/або НbА1с стабілізується. 90718 20 Агоніст LXR переважно вводять суб'єкту щодобово протягом щонайменше 30 доби. Його можна також вводити протягом щонайменше 60 діб, 90 діб чи довше. Щодобове лікування може бути відновлено, якщо глікемія та/або НbА1с більше не стабілізовано або втрачено чутливість до інсуліну. Способи вимірювання рівнів циркулюючої глюкози та/або НbА1с являють собою способи, які є добре відомими на попередньому рівні техніки, і можна використовувати будь-який вид способів. Фармацевтичні композиції (або лікарський засіб) Агоністи LXR за даним винаходом можна безпосередньо вводити в стерильних умовах суб'єктові, що підлягає лікуванню. Модулятори можна вводити окремо або у вигляді активного інгредієнта фармацевтичної композиції. Терапевтичну композицію згідно з даним винаходом можна комбінувати або застосовувати в сполученні з іншими терапевтичними агентами. Наприклад, суб'єкта можна лікувати агоністом LXR паралельно з іншими загальноприйнятими протидіабетичними лікарськими засобами. Приклади таких відомих протидіабетичних лікарських засобів включають Actos (піоглітазон, Takeda, Eli Lilly), Avandia (розиглітазон, Smithkline Beacham), Amaryl (глімепірид, Aventis), гліпізид сульфоналсечовину (Generic) чиGlucotrol (Pfizer), Glucophage (метформін, Bristol Meyers Squibb), Glucovance (глібурид/метформін, Bristol Meyers Squibb), Glucotrol XL (гліпізид пролонгованого вивільнення, Pfizer), глібурид (Micronase; Upjohn, Glynase; Upjohn, Diabeta; Aventis), Glyset (міглітол, Pharmacia & Upjohn), Metaglip (гліпізид+метформін; таблетка фіксованої комбінації), Prandin (репаглінид, NOVO), Precose (акарбоза, Bayer), Rezulin (троглітазон, Parke Davis) і Starlix (натеглінид, Novartis). Суб'єкта можна також лікувати агоністом LXR паралельно з аналогами і похідними GLP-1. Такі аналоги і похідні GLP-1, які можна застосовувати відповідно до даного винаходу, включають ті, на які посилаються у WO 99/43705 (Novo Nordisk A/S), WO 99/43706 (Novo Nordisk A/S), WO 99/43707 (Novo Nordisk A/S), WO 98/08871 (Novo Nordisk A/S), WO 99/43708 (Novo Nordisk A/S), WO 99/43341 (Novo Nordisk A/S), WO 87/06941 (The General Hospital Corporation), WO 90/11296 (The General Hospital Corporation), WO 91/11457 (Buckley et al.), WO 98/43658 (Eli Lilly & Co.). Фармацевтичні композиції за даним винаходом типово містять щонайменше один активний інгредієнт разом з одним чи більш ніж одним його прийнятним носієм. Фармацевтично прийнятні носії підсилюють або стабілізують композицію, або полегшують виготовлення препарату композиції. Фармацевтично прийнятні носії частково визначаються конкретною композицією, що підлягає введенню (наприклад, нуклеїнова кислота, білок або модуляторні сполуки), а також конкретним способом, застосовуваним для введення композиції. Вони також повинні бути як фармацевтично, так і фізіологічно прийнятними у сенсі сумісності з іншими інгредієнтами та безпеки для пацієнта. Цей носій може мати широке розмаїття форм у залеж 21 ності від форми препарату, бажаної для введення, наприклад, пероральної, під'язикової, ректальної, назальної чи парентеральної. Існує широке розмаїття придатних фармацевтично прийнятних носіїв для практики даного винаходу (див., наприклад, Remington: The Science and Practice of Pharmacy, Mack Publishing Co., 20th ed., 2000). Без обмеження вони включають поміж іншого сироп, воду, ізотонічний сольовий розчин, 5% декстрозу у воді або буферному розчині ацетату натрію або амонію, олії, гліцерин, спирти, агентів, що коригують, консерванти, агенти, що фарбують, крохмалі, цукри, розріджувачі, агенти, що гранулюють, агенти, що змазують і агенти, які зв'язують. Можна також утворювати комплекс агоністу LXR з білками-носіями, такими як овальбумін або сироватковий альбумін, перед його введенням з метою посилення стабільності. Фармацевтичні композиції можна готувати в різних формах, таких як гранули, таблетки, пігулки, супозиторії, капсули, суспензії, мазі, лосьйони тощо. Концентрація терапевтично активної сполуки в препараті може варіювати від приблизно 0,1-100% мас/мас. Терапевтичні препарати готують будьякими способами, добре відомими в області фармацевтики. Див., наприклад, Gilman et al., eds., Goodman and Gilman's: The Pharmacological Bases of Therapeutics, 8th ed., Pergamon Press, 1990; Remington: The Science і Practice of Pharmacy, Mack Publishing Co., 20th ed., 2000; Avis et al., eds., Pharmaceutical Dosage Forms: Parenteral Medications, published by Marcel Dekker, Inc., N.Y., 1993; і Lieberman et al., eds., Pharmaceutical Dosage Forms: Disperse Systems, published by Marcel Dekker, Inc., N.Y., 1990. Препарат фармацевтичної композиції за винаходом готують таким чином, щоб він був сумісний з призначеним шляхом введення. Приклади придатних шляхів введення включають парентеральне, наприклад, внутрішньовенне, внутрішньошкірне, підшкірне, пероральне (наприклад, інгаляцію), крізьшкірне (місцеве), введення до слизуватої оболонки і ректальне введення. Для парентерального введення препарати агоністів LXR за даним винаходом можна готувати різноманітними шляхами. Водяні розчини модуляторів можна інкапсулювати у полімерних гранулах, наночастках або інших ін'єкційних препаратах депо, відомих фахівцям у даній області техніки. Крім того, сполуки за даним винаходом можна також вводити інкапсульованими в ліпосомах. Композиції, і залежності від їх розчинності, можуть знаходитися як у водяному шарі, так і в ліпідному шарі, або в тому, що звичайно називають ліпосомною суспензією. Гідрофобний шар, звичайно, але не винятково, містить фосфоліпіди, такі як лецитин і сфингомієлін, стероїди, такі як холестерин, більше або менше іонних сурфактанів, таких як диацетілфосфат, стеариламін чи фосфатидна кислота, та/або інші речовини гідрофобної природи. До композиції можуть бути додані інші активні фармацевтичні інгредієнти, де бажано. Можливі антибактеріальні, антисептичні агенти й антиоксиданти можуть також бути присутніми у композиціях, де вони будуть виконувати свої звичайні функ 90718 22 ції. При деяких застосуваннях агоністи LXR готують з носіями, які будуть захищати сполуку від швидкого видалення з організму, такі як препарат регульованого вивільнення, включаючи імплантати і мікроінкапсульовані системи доставки. Матеріал уповільненого вивільнення, такий як гліцерилмоностеарат чи гліцерилдистеарат, окремо або з воском, можна включати до композицій. Можна також використовувати біоруйновані, біосумісні полімери, такі як етиленвінілацетат, поліангідриди, полігліколева кислота, колаген, поліортоефіри та полімолочна кислота. Способи виготовлення таких препаратів будуть очевидні фахівцям у даній області техніки. Ці матеріали можуть бути також отримані з комерційних джерел, таких як Alza Corporation і Nova Pharmaceuticals, Inc. Фармацевтичні композиції можуть бути включені до контейнеру, упаковку або диспенсер разом з інструкціями застосування. Дозування Суб'єктів, що страждають діабетом або спорідненими розладами, типово лікують фармацевтичними композиціями за даним винаходом протягом тривалого періоду часу (наприклад, щонайменше 30 діб, 60 діб, 90 діб або довше). Фармацевтичні композиції містять фармацевтино ефективну кількість або профілактично ефективну кількість агоністу LXR. Під терміном "терапевтично ефективна кількість" слід розуміти таку кількість лікарського засобу чи фармацевтичного агента, яка буде викликати біологічну або медичну відповідь тканини, системи, тварини чи людини, що спостерігається дослідником, ветеринаром, лікарем чи іншим клініцистом. Під терміном "профілактично ефективна кількість" слід розуміти таку кількість фармацевтичного лікарського засобу, що буде попереджати або зменшувати ризик виникнення біологічного чи медичного процесу, який прагнуть запобігти в тканині, системі, у тварини чи людини. Придатну терапевтичну дозу можна визначити будь-яким з добре відомих способів, таким як клінічні дослідження на видах ссавців для визначення максимальної переносимо!' дози і на нормальних суб'єктах-людях для визначення безпечної дози. Зокрема, доза ліганду LXR, що одержує суб'єкт, може бути обрана таким чином, щоб досягти регенерації бета-клітин; дозу, що одержує суб'єкт, можна також титрувати за часом з метою стабілізації глікемії та/або НbА1с або одержання чутливості до інсуліну. Токсичність і терапевтичну ефективність агоністів LXR можна визначити за допомогою стандартних фармацевтичних методик на клітинних культурах або піддослідних тваринах, наприклад, для визначення LD50 (дози, летальної для 50% популяції) і ED50 (дози, терапевтично ефективної у 50% популяції). Відношення дози між токсичним і терапевтичним ефектами являє собою терапевтичний індекс, і його можна виразити у вигляді відношення LD50/ED50. Агоністи LXR, що проявляють високі терапевтичні індекси, є переважними. Хоча агоністи LXR, що проявляють токсичні побічні ефекти, можна застосовувати, слід подбати про розробку системи доставки, що направляє такі агоністи LXR до місця ураженої тка 23 нини з метою мінімізації потенційної шкоди неураженим клітинам, за допомогою чого зменшуються побічні ефекти. Дані, отримані на підставі аналізів на клітинних культурах і дослідженнях на тваринах, можна використовувати при підборі діапазону дозувань для застосування людьми. Дозування таких сполук переважно знаходиться в інтервалі концентрацій у кровообігу, що включає ED50 при невеликій токсичності або її відсутності. Дозування може варіюватися в межах цього інтервалу в залежності від застосовуваної лікарської форми і використовуваного шляху введення. Для будьякого агоністу LXR, застосовуваного в способі за винаходом, терапевтично ефективну дозу можна оцінити спочатку на підставі аналізів на клітинних культурах. Дозу можна підібрати на тваринних моделях для досягнення інтервалу концентрації в плазмі крові, що включає ІС5о (тобто концентрацію агоністів LXR, що тестуються, при якій досягається половина максимального інгібування симптомів), визначену на клітинній культурі. Таку інформацію можна використовувати для більш точного визначення корисних доз у людей. Рівні в плазмі можна вимірювати, наприклад, за допомогою високоефективної рідинної хроматографії. У цілому, за винятком деяких обставин, коли можуть вимагатися більш високі дозування, переважне дозування агоністу LXR звичайно знаходиться в інтервалі від приблизно 0,001 до приблизно 1000мг, більш звичайно від приблизно 0,01 до приблизно 500мг на добу. Переважне дозування та режим введення агоністу LXR можуть варіювати для різних суб'єктів у залежності від факторів, які можуть індивідуально спостерігатися лікуючим лікарем, таких як стан або стани, що підлягають лікуванню, вибір композиції для введення, яка включає конкретний агоніст LXR, вік, маса та відповідь індивідуального суб'єкта, важкість симптомів у суб'єкта й обраний шлях введення. В якості загального правила кількість агоністу LXR, що вводиться, складає найменше дозування, що ефективно і надійно попереджує чи мінімізує стани суб'єктів. Таким чином, приведені вище інтервали дозування призначені для забезпечення загального керівництва та підтвердження викладених тут положень, але не призначені для обмеження обсягу винаходу. При деяких застосуваннях перший агоніст LXR застосовують у комбінації з другим агоністом LXR або відомим протидіабетичним лікарським засобом з метою досягнення терапевтичних ефектів, які не можуть бути досягнуті при застосуванні одного агоністу LXR індивідуально. Обробка ex vivo Наступною ознакою винаходу є спосіб інгібування втрати бета-клітин в острівковій тканині підшлункової залози шляхом приведення в контакт острівкової тканини підшлункової залози з агоністом LXR. Під зменшенням втрати розуміють, що в тканині підшлункової залози знаходиться на 10%, 20%, 30%, 40% або більше бета-клітин у присутності агоністу LXR у порівнянні з відсутністю агоністу LXR. 90718 24 Ознакою винаходу також є спосіб підвищення життєздатності або проліферації острівкових клітин підшлункової залози шляхом приведення у контакт клітини з агоністом LXR. Крім того, життєздатність острівкових клітин підшлункової залози підвищують шляхом введення реципієнту трансплантата агоністу LXR. Острівкові клітини підшлункової залози являють собою первинні клітини острівців. Альтернативно клітини являють собою трансплантовані донорські клітини підшлункової залози. Під життєздатністю розуміють, що клітина виключає вітальний барвник, такий як трипан. Життєздатні клітини також здатні до проліферації, диференціації, росту і розвитку. Життєздатність вимірюють способами, відомими в даній області техніки, такими як фарбування трипановим синім. Клітини приводять у контакт in vivo, in vitro або ex vivo. Агоніст LXR вводять локально в область трансплантації. Альтернативно агоніст LXR вводять системно. Агоніст LXR вводять реципієнту трансплантата до або після трансплантації донорських острівкових клітин підшлункової залози. Можливо, агоніст LXR вводять реципієнту трансплантата одночасно з трансплантацією донорських острівкових клітин підшлункової залози. До винаходу також включені способи інгібування клітинної загибелі шляхом приведення в контакт клітини з агоністом LXR. Клітини приводять у контакт in vivo, in vitro або ex vivo. Клітина являє собою клітину підшлункової залози, таку як острівкова клітина підшлункової залози. Клітинна загибель являє собою клітинну загибель, індуковану оксидантним стресом, або апоптотичну клітинну загибель. Стислий опис графічних матеріалів На Фіг.1 показано ефект GW3965 (10мг/кг), що вводиться перорально пацюкам ZDF протягом 3 тижнів, на глюкозу плазми та після закінчення обробки. На Фіг.2 зображено ефект GW3965 (10мг/кг), що вводиться перорально пацюкам ZDF протягом 3 тижнів, на секрецію інсуліну, що стимулюється глюкозою, в ізольованих острівцях підшлункової залози. На Фіг.3 показано ефект GW3965 (10мг/кг), що вводиться перорально пацюкам ZDF протягом 3 тижнів, на вміст інсуліну в ізольованих острівцях підшлункової залози. На Фіг.4 показано ефект GW3965 (10мг/кг), що вводиться перорально пацюкам ZDF протягом 3 тижнів, на кількість зібраних острівців підшлункової залози. На Фіг.5 зображено ефект GW3965 (10мг/кг), що вводиться перорально пацюкам ZDF протягом 4 тижнів, на апоптоз в ізольованих острівцях підшлункової залози та зрізах підшлункової залози. На Фіг.6 показано ефект GW3965 на експресію мРНК PDX1 і GLUT2. На Фіг.7 показаний ефект GW3965 (50мг/кг) на регенерацію бета-клітин у мишей NOD. На Фіг.8 зображено ефект GW3965 (50мг/кг) на розвиток інсуліту в мишей NOD, де на пластині А представлено зрізи підшлункової залози контрольних мишей NOD, оброблених одним носієм, а на 25 пластині В проілюстровано зрізи підшлункової залози оброблених GW3965 мишей NOD. Приклади Приведені нижче приклади запропоновані для ілюстрації, але не для обмеження даного винаходу. Тварини Самці пацюків Zucker Diabetic Fatty fa/fa (ZDF) являють собою модель діабету типу II. Ці пацюки стійкі до інсуліну, але мають нормоглікемію від народження, і у них розвивається діабет у віці приблизно від тижня 7 до тижня 10. Під час перехідного періоду тварини проходять через стан порушеної толерантності до глюкози. Хоча ці тварини мають гіперінсулінемію перед виникненням діабету і під час ранніх стадій діабету, згодом вони втрачають стимульовану глюкозою секрецію інсуліну і, нарешті, здобувають майже повну інсулінопенію. Самців пацюків ZDF fa/fa і ZDF fa+ одержували від Genetic Models (Indianapolis,IN) у віці 6 тижнів і використовували в експериментах у віці 12 тижнів після 3 тижнів пероральної обробки носієм і GW3965 (10мг/кг). Сполуки давали один раз на добу (в 17 ч) через пероральний зонд. У момент використання пацюки ZDF fa/fa важили 310-350г, тоді як пацюки ZDF fa+ такого ж віку важили 245285г. Тварини ZDF fa+ і ZDF fa/fa мали вільний доступ до діабетогенного корму (Purina 5008). Тварин тримали по 5 на клітину в кімнаті з регульованою, температурою та вологістю при світловому циклі 12/12ч. Зразки крові брали через 16ч після введення сполуки з хвостової вени і вимірювали на клінічному хімічному аналізаторі Konelab 300 (Labsystem). Миші NOD (non-obese diabetes, діабет без ожиріння) являють собою експериментальну модель спонтанного діабету, що нагадує діабет типу І (інсулінозалежний) людини, що є результатом прогресуючої інвазії острівців і руйнування бетаклітин аутоімунними Т-клітинами. Ця модель спонтанного діабету дає унікальну можливість дослідження аутоімунних Т-клітин, залучених до процесу руйнування бета-клітин, і установки превентивних стратегій до клінічного прояву захворювання. Одержання препаратів острівців підшлункової залози пацюків Препарати острівців підшлункової залози пацюків одержували шляхом ферментативного гідролізу колагеназою і очищення в градієнті щільності. Фермент колагенази типу XI (Sigma Chemical, St. Louis, MO) використовували для ферментативного гідролізу підшлункової залози. Після голодування протягом ночі тварин піддавали глибокій анестезії й умертвляли. Потім протоку підшлункової залози канюлірували й повільно ін'єцирували 20мл розчину, що переварює, при 37°С (колагеназа 30мг/мл, розчинена в 20мл збалансованого сольового розчину Хенкса [HBSS]) (Sigma Chemical, St. Louis, MO) для розправлення тканини. Після розправлення підшлункову залозу поміщували в 20мл скляну склянку, що містить 5мл розчину, що переварює, при 37°С, який встановлювали у водяну баню з качалкою при 37°С на 8 хвилин. Після 90718 26 центрифугірування при 633 д протягом 1 хв при 4°С надосадову рідину видаляли, і острівці промивали три рази HBSS шляхом центрифугірування при 633g протягом 1хв. при 4°С. Для процедури очищення острівці ресуспендирували в 4мл 80% Histopaque 1,077 (Sigma) і 4мл HBSS. Після центрифугірування при 1943g протягом 20хв. при 4°С острівці виділяли на межі розділу між шарами Histopaque і HBSS. Острівці ресуспендирували в середовищі RPMI 1640, що містить 11мМ глюкозу, 10% ФСТ (фетальну сироватку теляти), пеніцилін (100ед/мл), стрептоміцин (100мкг/мл) і L-глутамін (2мМ), та культивували протягом ночі при 37°С у СО2 інкубаторі. Оцінка апоптозу шляхом вимірювання фрагментів ДНК Апоптоз острівкових клітин оцінювали за допомогою твердофазного імуноферментного аналізу виявлення клітинної загибелі (ELiSA) з набором від Roche відповідно до методик, рекомендованих виготовлювачем і застосовуваним до експерименту з острівцями Лангерганса пацюків. Після інкубації протягом ночі в середовищі RPMI 1640, що містить 11мМ глюкозу, 10% ФСТ, пеніцилін (100ед/мл), стрептоміцин (100мкг/мл) і L-глутамін (2мМ), групи з 10 острівців інкубірували протягом 30хв. з лізуючим буфером при кімнатній температурі, а потім центрифугірували при 200g протягом 10хв. при 4°С для апоптозу. Аліквоти надосадової рідини (20мкл) поміщували в лунки мікротитраційного планшета, покриті стрептавідином. Потім додавали сумарно 80мкл суміші, що містить антитіло анти-гістон-біотин і антитіло анти-ДНКпероксидазу, і давали можливість інкубації протягом 120хв. при 37°С. Потім препарати відмивали і додавали 100 мкл розчину, що містить ABTS (2,2'азино-ди[3-етилбензтіазалінсульфонат]) (субстрат для пероксидази). Після закінчення 5-хвилинної інкубації поглинання зразків зчитували спектрофотометричним шляхом при 405нм. Результати виражали у вигляді відсотку від внутрішнього стандарту (нуклеосомних часток). Оцінка апоптозу за допомогою фарбування TUNEL Апоптоз острівкових клітин визначали шляхом фарбування опосередкованим трансферазою кінцевим позначенням dUTP (TUNEL, transferasemediated dUTP nick-end labeling). Клітинну загибель ідентифікували по 3'-кінцевому позначенню in situ фрагментованої ДНК біотинілірованим дезоксиурідинтрифосфатом. Кожний шматочок підшлункової залози різали в довжину на зрізи товщиною 5мкм, які збирали на скло, вкрите желатином. Чотири зрізи через регулярні інтервали збирали як з шматочків голівки, так і хвоста. Після ферментативного гідролізу протеіназою K (2мкг/мл; Sigma) зрізи послідовно промивали в буфері TdT (0,5моль/л какодилату [рН6,8], 1ммоль/л хлориду кобальту, 0,15моль/л NaCI), а потім інкубірували при 37°С з TdT (25U; Boehringer-Mannheim, Mannheim, Germany) і біотинілірованим dUTP (1нмоль/мкл). Після відмивання в буфері ТВ (300ммоль/л NaCI, 30ммоль/л цитрату натрію) для зупинення реакції включення біотинілірованого dUTP виявляли модифікованим способом компле 27 ксу авідин-біотин. Наносили комплекс стрептавідин-біотин, кон'югований з пероксидазою хрону (Vector Laboratories). Потім зрізи виявляли, використовуючи DAB як хромоген, і злегка офарблювали контрастно гематоксиліном і зміцнювали на dePex(BDH Laboratory, Poole, England). Секреція інсуліну, що стимулюється глюкозою, і вміст інсуліну в острівцях Після 30хв. періоду попередньої інкубації при 37°С протягом 30хв. у бікарбонаті Кребса-Рингера (ККВ)-розчині HEPES (129мМ NaCI, 4,8мМ KСІ, 1,2мМ MgSO4, 1,2мМ KН2РО4, 2,5мМ СаСІ2, 5мМ NaHCO3 і 10мМ HEPES при p7,4), що містить 0,5% БСА (бичачого сироваткового альбуміну) і без глюкози партії з 3 острівців порівняного розміру помішували в лунки мікротитраційного планшета, що містять 200мкл розчину KRB-HEPES, який містить 0,5% БСА і 3,3мМ глюкози, при 37°С протягом 1 години при хитанні й атмосфері 5% СО2 і 95% О2. Наприкінці цієї провокації середовище повністю видаляли та заміняли KRB-HEPES, що містить 16,7ммоль/л глюкози. Після додаткової 1-годинної інкубації середовище видаляли і заморожували. Вміст інсуліну вимірювали в тих же острівцях після екстракції кислотою-спиртом протягом ночі (етанол 75%+НСІ 0,15н.). Концентрації інсуліну в різних середовищах визначали за допомогою тесту ЕЛАЙЗА на інсулін пацюка (Insulin Rat Elite plus, MERCODIA). Кількісна зворотна транскрипція-ПЦР у реальному часі Експресію генів панкреатичного дуоденального гена 1 гомеобокса, Pdx1 (Genbank: NM_022852) і посиленого транспортера глюкози, члена 2, Glut2 (Genbank: NM_012879) вимірювали за допомогою кількісної зворотної транскрипції (ОТ)-ПЦР у реальному часі. Препарати сумарної РНК з свіжовиділених острівців підшлункової залози пацюків одержували, використовуючи набір Rneasy 96 Kit відповідно до протоколу виготовлювача (Qiagen, France), обробляли ДНКазою І для видалення забруднюючої ДНК (Stratagene, France) і визначали кількісно, використовуючи набори iScript cDNA Synthesis і і SYBR Green Supermix (Biorad, France). Кількісну ОТ-ПЦР у реальному часі проводили, використовуючи прилад і програмне забезпечення iCycler Detection System (Bio-Rad). Оскільки передбачений розмір ампліфікованих кДНК і значення Тm для праймерів були подібними, використовували єдині умови ампліфікації (тобто відпал при 60°С). Моніторинг специфічності ампліфікованих продуктів проводили шляхом побудови кривих відпалу наприкінці кожної ампліфікації. Рівні експресії кількісно визначали (одиниці сумарної РНК) шляхом побудови стандартної кривої з серій по шість крапок. Зразки РНК нормалізували в порівнянні з визначеними рівнями 18S рРНК. Послідовності праймерів PDX1 (прямий): CCACAGCCCTCCAGCATCG PDX1 (зворотний): CAGACCCGCTCACCCTCAG Glut2 (прямий): ACCAGCACATACGACACCAGAC 90718 28 Glut2 (зворотний): GACACAGACAGAGACCAGAGCATAG 18S (прямий): CGTCTGCCCTATCAACTTTCG 18S (зворотний): GATGTGGTAGCCGTTTCTCAG Аналіз даних Дані виражають у виді середнього ±СОС (стандартна помилка середнього). Порівняння між різними групами були отримані за допомогою tкритерію Стьюдента. Розходження при p
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel use of liver x receptor agonists
Автори англійськоюHusson Bernadette, Broqua Pierre, Junien Jean-Louis
Назва патенту російськоюНовое применение агонистов печеночного рецептора х
Автори російськоюЮссон Бернадетт, Брока Пьерр, Жуньен Жан-Луи
МПК / Мітки
МПК: A61P 3/10, A61K 31/502
Мітки: агоністів, печінкового, нове, рецептора, застосування
Код посилання
<a href="https://ua.patents.su/21-90718-nove-zastosuvannya-agonistiv-pechinkovogo-receptora-kh.html" target="_blank" rel="follow" title="База патентів України">Нове застосування агоністів печінкового рецептора х</a>
Попередній патент: Спосіб виробництва багатошарової скляної панелі (варіанти)
Наступний патент: Спосіб виготовлення молока або молочних продуктів з високим вмістом мелатоніну
Випадковий патент: Спосіб очищення труб теплообмінника за допомогою засобу для струминної обробки, а також пристрій для його здійснення