Похідні діарилметиліден-піперидину, їх застосування як агоністів опіоїдних дельта-рецепторів, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі
Формула / Реферат
1. Сполука формули І, її фармацевтично прийнятна сіль, її діастереомери, її енантіомери та їх суміші:
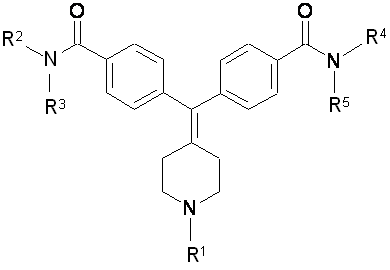 I,
I,
де
R1 вибраний з групи: гідроген, С1-6-алкіл, С6-10-арил-С1-3-алкіл, С2-9-гетероцикліл-С1-3-алкіл, де вказані С1-6-алкіл, С6-10-арил-С1-3-алкіл, С2-9-гетероцикліл-С1-3-алкіл необов'язково заміщені одним або декількома замісниками, вибраними з С1-6-алкілу, -ОН, С1-6-алкокси, хлору, флуору, брому та йоду;
R2 та R3 незалежно вибрані з С1-6-алкілу; та
R4 тa R5 є -H.
2. Сполука за п. 1, в якій R1 вибраний з групи: гідроген, С1-6-алкіл, феніл-С1-3-алкіл та С3-5-гетероцикліл-С1-3-алкіл, де вказані С1-6-алкіл, феніл-С1-3-алкіл та С3-5-гетероцикліл-С1-3- алкіл необов'язково заміщені одним або більше замісниками, вибраними з групи: С1-6-алкіл, -ОН, С1-6 - алкоксил та хлор; і
R2 та R3 є етилом.
3. Сполука за п. 1, в якій R1 вибраний з групи: гідроген, С1-4-алкіл, феніл-С1-3-алкіл та С3-5-гетероарил-С1-3-алкіл, де вказані С1-4-алкіл, феніл-С1-3-алкіл та С3-5-гетероарил-С1-3-алкіл необов'язково заміщені одним або більше замісниками, вибраними з групи: С1-3-алкіл, -ОН, С1-3 - алкоксил та хлор; і
R2 та R3 є етилом.
4. Сполука за п. 1, в якій
R1 вибраний з групи: С2-4-алкіл, бензил, тіазолілметил, фурилметил, піридилметил та тієнілметил, де вказані С2-4-алкіл, бензил, тіазолілметил, фурилметил, піридилметил та тієнілметил необов'язково заміщені одним або більше замісниками, вибраними з групи: С1-3-алкіл, -ОН, С1-3 - алкоксил та хлор; і
R2 та R3 є етилом.
5. Сполука за п. 1, в якій
R1 є R6-CH2-, де R6 вибраний з групи: 2-піридил, 2-тієніл, 2-фурил, 5-хлор-2-фурил, 5-метил-2-фурил, 3-метил-2-тієніл, 3-хлор-2-тієніл, 5-хлор-2-тієніл, 5-метил-2-тієніл, 6-хлор-3-піридил, 2-гідроксіетил, 2-метоксіетил, метоксиметил, 3-піридил, 4-піридил, 4-тіазоліл, 5-тіазоліл, н-пропіл та 6-метил-2-піридил; і
R2 та R3 є етилом.
6. Сполука, вибрана з групи:
4-[[4-[(діетиламіно)карбоніл]феніл][1-[(2-піридинілметил)-4-піперидиніліден]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-[(2-тієнілметил)-4-піперидиніліден]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-[(2-фуранілметил)-4-піперидиніліден]метил]бензамід;
4-[[1-[(5-хлор-2-фураніл)метил]-4-піперидиніліден][4-[(діетиламіно)карбоніл]феніл]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-[(5-метил-2-фураніл)метил]-4-піперидиніліден]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-[(3-метил-2-тієніл)метил]-4-піперидиніліден]метил]бензамід;
4-[[1-[(3-хлор-2-тієніл)метил]-4-піперидиніліден][4-[(діетиламіно)карбоніл]феніл]метил]бензамід;
4-[[1-[(5-хлор-2-тієніл)метил]-4-піперидиніліден][4-[(діетиламіно)карбоніл]феніл]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-[(5-метил-2-тієніл)метил]-4-піперидиніліден]метил]бензамід;
4-[[1-[(6-хлор-3-піридиніл)метил]-4-піперидиніліден][4-[(діетиламіно)карбоніл]феніл]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-(3-гідроксипропіл)-4-піперидиніліден]метил]бензамід:
4-[[4-[(діетиламіно)карбоніл]феніл][1-(2-метоксіетил)-4-піперидиніліден]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-(3-піридинілметил)-4-піперидиніліден]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-(4-піридинілметил)-4-піперидиніліден]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-[(6-метил-2-піридиніл)метил]-4-піперидиніліден]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-(3-метоксипропіл)-4-піперидиніліден]метил]бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-(фенілметил)-4-піперидиніліден]метил]-бензамід;
4-[[4-[(діетиламіно)карбоніл]феніл][1-(4-тіазолілметил)-4-піперидиніліден]метил]бензамід;
3-[[4-[(діетиламіно)карбоніл]феніл][1-(5-тіазолілметил)-4-піперидиніліден]метил]бензамід;
4-[[4-(амінокарбоніл)феніл](1-бутилпіперидин-4-іліден)метил]-N,N-діетилбензамід; та їх фармацевтично прийнятні солі.
7. Сполука за будь-яким з пп. 1 - 6 для застосування як медикаменту.
8. Застосування сполуки за будь-яким з пп. 1 - 6 у виробництві медикаменту для терапії болю, тривожності або функціональних шлунково-кишкових розладів.
9. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1 - 6 та фармацевтично прийнятний носій.
10. Спосіб лікування болю у теплокровної тварини, згідно з яким вводять вказаній тварині, що потребує такої терапії, терапевтично ефективну кількість сполуки за будь-яким з пп. 1 - 6.
11. Спосіб лікування тривожності у теплокровної тварини, згідно з яким вводять вказаній тварині, що потребує такої терапії, терапевтично ефективну кількість сполуки за будь-яким з пп. 1 - 6.
12. Спосіб отримання сполуки формули II
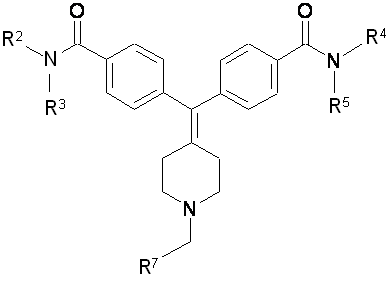 II,
II,
згідно з яким піддають взаємодії сполуку формули III з R7-CH2X або R7-CHO:
 , III
, III
де
R2 та R3 є етилом;
X вибраний з групи: Сl, І, Br, -OTs та -OMs;
R4 тa R5 є -H;
R7 вибраний з групи: С1-6-алкіл, феніл та С3-5-гетероарил, де вказані С1-6-алкіл, феніл та С3-5-гетероарил необов'язково заміщені одним або більше замісниками, вибраними з групи: С1-6-алкіл, С1-6-алкоксил, хлор, флуор, бром та йод.
13. Спосіб отримання сполуки формули І
 I,
I,
згідно з яким піддають взаємодії сполуку формули IV зі сполукою формули V:
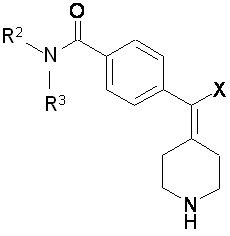 , IV
, IV 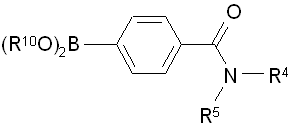 , V
, V
де R1 вибрано з групи: С1-6-алкіл, феніл-С1-3-алкіл та С3-5-гетероцикліл-С1-3-алкіл, де вказані С1-6-алкіл, феніл-С1-3-алкіл та С3-5-гетероцикліл-С1-3-алкіл необов'язково заміщені одним або більше замісниками, вибраними з групи: С1-6-алкіл, -ОН, С1-6 -алкоксил, хлор, флуор, бром та йод;
X вибраний з групи: І, Вr та Сl;
R10 вибраний з групи: Н та С1-6-алкіл, або (R10O)2B- представляє  ;
;
R2 та R3 є етилом; і
R4 тa R є -H.
Текст
1. Сполука формули І, її фармацевтично прийнятна сіль, її діастереомери, її енантіомери та їх суміші: C2 2 (19) 1 3 4-[[1-[(5-хлор-2-фураніл)метил]-4піперидиніліден][4[(діетиламіно)карбоніл]феніл]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-[(5-метил-2фураніл)метил]-4-піперидиніліден]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-[(3-метил-2тієніл)метил]-4-піперидиніліден]метил]бензамід; 4-[[1-[(3-хлор-2-тієніл)метил]-4-піперидиніліден][4[(діетиламіно)карбоніл]феніл]метил]бензамід; 4-[[1-[(5-хлор-2-тієніл)метил]-4-піперидиніліден][4[(діетиламіно)карбоніл]феніл]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-[(5-метил-2тієніл)метил]-4-піперидиніліден]метил]бензамід; 4-[[1-[(6-хлор-3-піридиніл)метил]-4піперидиніліден][4[(діетиламіно)карбоніл]феніл]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-(3гідроксипропіл)-4-піперидиніліден]метил]бензамід: 4-[[4-[(діетиламіно)карбоніл]феніл][1-(2метоксіетил)-4-піперидиніліден]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-(3піридинілметил)-4піперидиніліден]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-(4піридинілметил)-4піперидиніліден]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-[(6-метил-2піридиніл)метил]-4піперидиніліден]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-(3метоксипропіл)-4-піперидиніліден]метил]бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-(фенілметил)4-піперидиніліден]метил]-бензамід; 4-[[4-[(діетиламіно)карбоніл]феніл][1-(4тіазолілметил)-4-піперидиніліден]метил]бензамід; 3-[[4-[(діетиламіно)карбоніл]феніл][1-(5тіазолілметил)-4-піперидиніліден]метил]бензамід; 4-[[4-(амінокарбоніл)феніл](1-бутилпіперидин-4іліден)метил]-N,N-діетилбензамід; та їх фармацевтично прийнятні солі. 7. Сполука за будь-яким з пп. 1 - 6 для застосування як медикаменту. 8. Застосування сполуки за будь-яким з пп. 1 - 6 у виробництві медикаменту для терапії болю, тривожності або функціональних шлунковокишкових розладів. 9. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1 - 6 та фармацевтично прийнятний носій. 10. Спосіб лікування болю у теплокровної тварини, згідно з яким вводять вказаній тварині, що потребує такої терапії, терапевтично ефективну кількість сполуки за будь-яким з пп. 1 - 6. 11. Спосіб лікування тривожності у теплокровної тварини, згідно з яким вводять вказаній тварині, що потребує такої терапії, терапевтично ефективну кількість сполуки за будь-яким з пп. 1 6. 12. Спосіб отримання сполуки формули II 81309 4 O R2 O R4 N N R3 R5 N R7 II, згідно з яким піддають взаємодії сполуку формули III з R7-CH2X або R7-CHO: O R2 O R4 N N R3 R5 N H , III де R2 та R3 є етилом; X вибраний з групи: Сl, І, Br, -OTs та -OMs; R4 тa R5 є -H; R7 вибраний з групи: С1-6-алкіл, феніл та С3-5гетероарил, де вказані С1-6-алкіл, феніл та С3-5гетероарил необов'язково заміщені одним або більше замісниками, вибраними з групи: С1-6-алкіл, С1-6-алкоксил, хлор, флуор, бром та йод. 13. Спосіб отримання сполуки формули І O R2 O R4 N N R3 R5 N R1 I, згідно з яким піддають взаємодії сполуку формули IV зі сполукою формули V: 5 81309 O R2 алкіл необов'язково заміщені одним або більше замісниками, вибраними з групи: С1-6-алкіл, -ОН, С1-6 -алкоксил, хлор, флуор, бром та йод; X вибраний з групи: І, Вr та Сl; R10 вибраний з групи: Н та С1-6-алкіл, або (R10O)2B N X R3 6 O B O представляє R2 та R3 є етилом; і R4 тa N H , ; R є -H. IV O (R10O)2B N R4 R5 ,V де R1 вибрано з групи: С1-6-алкіл, феніл-С1-3-алкіл та С3-5-гетероцикліл-С1-3-алкіл, де вказані С1-6алкіл, феніл-С1-3-алкіл та С3-5-гетероцикліл-С1-3 Представлений винахід стосується нових сполук, способу їх отримання, їх застосування та фармацевтичних композицій, що містять нові сполуки. Нові сполуки є корисними у терапії, а зокрема для лікування болю, тривожності та функціональних шлунково-кишкових розладів. Ідентифіковано, що б-рецептор грає роль у багатьох тілесних функціях, як-то циркуляторна та больова системи. Ліганди для δ-рецептору можуть тому знайти потенційне застосування як аналгетичні та/або як антигіпертензивні агенти. Ліганди для δ-рецептору, як також показано, виявляють імуномодулятивну активність. Ідентифікація принаймні трьох відмінних родин опіоідних рецепторів (μ, δ та к) є зараз добре встановленою та усі три наявні у центральній та периферійній нервових системах багатьох видів, охоплюючи людину. Аналгезію спостерігали у різних тваринних моделях, коли один або більше цих рецепторів є активованими. За небагатьма винятками зараз доступні селективні опіоїдні δ-ліганди є пептидними за природою та є непридатними для застосування системними шляхами. Одним приклад непептидного δ-агоністу є SNC80 [Bilsky EJ. et al., Journal of Pharmacology та Experimental Therapeutics, 273(1), pp. 359-366 (1995)]. Багато сполук δ-агоністів, що ідентифіковано упопередньому рівні техніки, мають багато недоліків у тому, що вони мають погану фармакокінетику та не є аналгетиками при застосуванні системними шляхами. Також задокументовано, що багато з цих сполук багоністів виявляють значну конвульсивну дію при систематичному застосуванні. Патент США № 6187792 Dekxrne et al. описує деякі δ-агоністи. Однак, є потреба у поліпшених δагоністах. Отже проблема полягає у пошуку нових аналгетиків поліпшеної дії, але також з поліпшеним профілем побічної дії у порівнянні із сучасними μ-агоністами, тобто поліпшену δагоністичну потужність, фармакоюнетичну потужність in vivo, біозасвоюваність, стабільність in vitro та нижчу токсичність. Відповідно, об'єктом деяких втілень цього винаходу є полишені ліганди δ-рецепторів. Якщо не визначено інше у цьому описі, номенклатура, застосовувана у цьому описі загалом дотримується прикладів та правил, встановлених у [Nomenclature of Organic Chemistry, Sections A, B, C, D, E, F, ma H, Pergamon Press, Oxford, 1979], що наведено як посилання стосовно назв хімічних структур та правил стосовно найменування хімічних структур. Термін "Cm-n" або "група Cm-n ", поодинці, чи як префікс, стосується будь-якої групи, що має m - n атомів карбону. Термін "вуглеводень", поодинці, чи як суфікс або префікс, стосується будь-якої структури, що містить тільки атоми карбону та гідрогену до 14 атомів карбону. Термін "вуглеводневий радикал" або "пдрокарбіл", поодинці, чи як суфікс або префікс, стосується будь-якої структури, що є результатом видалення одного або більше гідрогенів від вуглеводню. Термін "алкіл", поодинці, чи як суфікс або префікс, стосується моновалентного вуглеводневого радикалу з лінійним та 7 розгалуженим ланцюгом, що містить приблизно 1 12 атомів карбону. Термін "алкілен", поодинці, чи як суфікс або префікс, стосується двовалентного вуглеводневого радикалу з лінійним та розгалуженим ланцюгом, що містить приблизно 112 атомів карбону, котрі зв'язують дві структури разом. Термін "алкеніл", поодинці, чи як суфікс або префікс, стосується моновалентного вуглеводневого радикалу з лінійним та розгалуженим ланцюгом, що має принаймні один подвійний зв'язок карбон-карбон та містить принаймні приблизно 2-12 атомів карбону. Термін "алкініл", поодинці, чи як суфікс або префікс, стосується моновалентного вуглеводневого радикалу з лінійним та розгалуженим ланцюгом, що має принаймні один потрійний зв'язок карбон-карбон та містить принаймні приблизно 2-12 атомів карбону. Термін "циклоалкіл,", поодинці, чи як суфікс або префікс, стосується моновалентного вуглеводневого радикалу, що має кільце, що містить принаймні приблизно 3-12 атомів карбону. Термін "циклоалкеніл", поодинці, чи як суфікс або префікс, стосується моновалентно-го вуглеводневого радикалу, що має кільце, що має принаймні один подвійний зв'язок карбон-карбон та містить принаймні приблизно 3-12 атомів карбону. Термін "циклоалкініл", поодинці, чи як суфікс або префікс, стосується моновалентного вуглеводневого радикалу,, що має кільце, що має принаймні один потрійний зв'язок карбон-карбон та містить приблизно 7-12 атомів карбону. Термін "арил", поодинці, чи як суфікс або префікс, стосується моновалентного вуглеводневого радикалу, що має одне або більше поліненасичених карбонових кілець, що мають ароматичний характер, (наприклад, 4n+2 делокалізованих електронів) та містять приблизно 5-14 атомів карбону. Термін "арилен", поодинці, чи як суфікс або префікс, стосується двовалентного вуглеводневого радикалу, що має одне або більше поліненасичених карбонових кілець, що мають ароматичний характер, (наприклад, 4n+2 делокалізованих електронів) та містять приблизно 5-14 атомів карбону, котрі зв'язують дві структури разом. Термін "гетероцикл", поодинці, чи як суфікс або префікс, стосується кільцевмісної структури або молекули, що мають один або більше багатовалентних гетероатомів, незалежно вибраних з Ν, Ο, Ρ та S, як частину кільцевої структури, що містить принаймні приблизно 3-20 атомів у кільцях. Гетероцикл може бути насиченим або ненасиченим, містити один або більше подвійних зв'язків, та гетероцикл може містити більше одного кільця, коли гетероцикл містить більше одного кільця, кільця можуть бути конденсованими або не-конденоованими. Конденсовані кільця звичайно мають принаймні два кільця, що мають два спільні атоми. 81309 8 Гетероцикл може мати ароматичний характер або не мати ароматичний характер. Термін "гетероалкіл", поодинці, чи як суфікс або префікс, стосується радикалу, в якому в алкілі один або більше атомів С заміщено один або більше гетероатомами, незалежно вибранимиа з Ν, Ο та S. Термін "гетероароматичний", поодинці, чи як суфікс або префікс, стосується кільцевмісної структури або молекули, що мають один або більше багатовалентних гетероатомів, незалежно вибраних з Ν, Ο, Ρ та S, як частину кільцевої структури, що містить принаймні приблизно 3-20 атомів у кільцях, де кільце-вмісна структура або молекула має ароматичний характер (наприклад, 4n+2 делокалізованих електронів). Термін "гетероциклічна група" "гетероциклічна частина," "гетероциклічний" або "гете-роцикпо", поодинці, чи як суфікс або префікс, стосується радикалу, похідного від гетероцик-лу видаленням з нього одного або більше гідрогенів. Термін "гетероцикліл", поодинці, чи як суфікс або префікс, стосується моновалентного радикалу, похідного від гетероциклу видаленням з нього одного гідрогену. Термін "гетероциклілен", поодинці, чи як суфікс або префікс, стосується двовалентного радикалу, похідного від гетероциклу видаленням з нього двох гідрогенів. котрі зв'язують дві структури разом. Термін "гетероарил", поодинці, чи як суфікс або префікс, стосується гетероциклілів, що мають ароматичний характер. Термін "гетероциклоалкіл", поодинці, чи як суфікс або префікс, стосується гетероциклі-лів, що не мають ароматичного характеру. Термін "гетероарилен", поодинці, чи як суфікс або префікс, стосується гетероцикпіле-нів, що мають ароматичний характер. Термін "гетероциклоалкілен", поодинці, чи як суфікс або префікс, стосується гетероцикліленів, що не мають ароматичного характеру. Термін "шести-членний», застосовуваний як префікс, стосується фуп, що мають кільце, що містить шість кільцевих атомів. Термін "п'яти-членний», застосовуваний як префікс, стосується груп, що мають кільце, що містить п'ять кільцевих атомів. П'яти-членний гетероарил є гетероарилом з кільцем, що має п'ять кільцевих атомів, де 1,2 або 3 кільцеві атоми незалежно вибрані з Ν, Ο та S. Прикладами п'яти-членних кільцевих гетероарилів є тієніл, фурил, піроліл, імідазоліл, тіазоліл, оксазоліл, піразоліл, ізотіазоліл, ізоксазоліл, 1,2,3-триазоліл, тетразоліл, 1,2,3тіадіазоліл, 1,2,3-оксадіазоліл, 1,2,4-триазоліл, 1,2,4-тіадіазоліл, 1,2,4-оксадіазоліл, 1,3,4триазоліл, 1,3,4-тіадіазоліл, та 1,3,4- оксадіазоліл. Щести-членним кільцевим гетероарилом є гетероарил з кільцем, що має шість кільцевих атомів, де 1,2 або 3 кільцеві атоми незалежно вибрані з Ν, Ο та S. Прикладами шести-членних кільцевих гетероарилів є піридил, піразиніл, піримідиніл. 9 Термін "заміщений», застосовуваний як префікс, стосується структури, молекули або групи, де одного або більше гідрогенів заміщено одною або більше С1-6-вуглеводневих груп, або одною або більше хімічних груп, що містять один або більше гетероатомів, вибраних з N, О, S, F, СІ, Вг, І, та Р. Приклади хімічних груп, що містять один або більше гетероатомів охоплюють –NO2 -OR. СІ, -Br, -I, -F, -CF3, -C(=O)R, -C(=O)OH, -NH2, -SH, NHR, -NR2, -SR, -SO3H, -SO2R, -S(=O)R, -CN, -OH, -C(=O)OR, C(=O)NR2, -NRC(=O)R, оксо (=O), іміно (=NR), тіо (=S), та оксиміно (=N-OR), де кожний "R" - С1-6гідрокарбіл, наприклад, заміщений феніл може стосуватися нггрофенілу, метоксифенілу, хлорфенілу, амінофенілу, тощо, де нітро, метокси, хлор, та аміногрупи можуть заміщувати будь-який придатний гідроген на фенільному кільці. Термін "заміщений», застосовуваний як суфікс стосовно першої структури, молекули або групи, супроводжуваний одною або більше назв хімічних груп, стосується другої структури, молекули або групи, котрі є результатом заміщення одного або більше гідрогенів першої структури, молекули або групи одною або більше названих хімічних груп, наприклад, "феніл заміщений нітро" стосується нітрофенілу. Термін "як варіант, заміщений» стосується структур, молекул або груп, котрі є заміщеними, а також незаміщених. Гетероцикл охоплює, наприклад, моноциклічні гетероцикли, як-то: азиридин, оксиран, тііран, азетидин, оксетан, тіетан, піролідин, піролін, імідазолідин, піразолідин, піразолін, діо-ксолан, сульфолан 2,3-дигідрофуран, 2,5-дигідрофуран тетрагідрофуран, тіофан, піпери-дин, 1,2,3,6тетрагідро-піридин, піперазин, морфолін, тіоморфолін, піран, тіопіран, 2,3-дигідропіран, тетрагідропіран, 1,4-дигідропіридин. 1,4-діоксан, 1,3-діоксан, діоксан, гомопі-перидин, 2,3,4,7тетрагідро-1Н-азепін, гомопіперазин, 1,3діоксепан, 4,7-дигідро-1,3-діоксепін та гексаметилен-оксид. На додаток, гетероцикли охоплюють ароматичні гетероцикли, наприклад, піридин, піразин, піримідин, піридазин, тіофен, фуран, фуразан, пірол, імідазол, тіазол, оксазол, піразол, ізотіазол, ізоксазол, 1,2,3-триазол, тетразол, 1,2,3-тіадіазол, 1,2,3-оксадіазол, 1,2,4-триазол, 1,2,4-тіадіазол, 1,2,4-оксадіазол, 1,3,4-триазол, 1,3,4-тіадіазол, та 1,3,4-оксадіазол. На додаток, гетероцикли охоплюють поліциклічні гетероцикли, наприклад, індол, індолін, ізоіндолін, хінолін, тетрагідрохінолін, ізохінолін, тетрагідроізохінолін, 1,4-бензодіоксап. кумарин, дигідрокумарин, бензофуран, 2,3дигідробензофуран, ізобензофуран, хромен, хроман, ізохроман, ксантен, феноксатіін, тіантрен, індолізин, ізоіндол, індазол, пурин, фталазин, нафтиридин, хіноксалін, хіназолін, цинолін, птеридин, фенантридин, перимідин, фенатролін, феназин, фенотіазин, феноксазин, 1,2бензізоксазол, бензотіофен, бензоксазол, бензтіазол, бензімідазол, бензтриазол, тіоксантин, 81309 10 карбазол, карболін, акридин, піролізидин, та хінолізидин. На додаток до вищеописаних поліциклічних гетероциклів, поліциклічні гетероцикли, де конденсація кілець між двома або більше кільцями охоплює більше одного зв'язку, спільного для обох кілець та більше двох атомів, спільних для обох кілець. Приклади таких шунтованих гетероциклів охоплюють хінуклідин, діазабіцикло[2,2,1]гептан та 7-оксабіцикло[2,2,1 ]гептан. Гетероцикліл охоплює, наприклад, моноциклічні гетероцикпіли, як-то: азиридиніл, оксираніл, тііраніл, азетидиніл, оксетаніл, тіетаніл, піролідиніл, піролініл, імідазолідиніл, піразолідиніл, піразолініл, дюксоланіл, сульфоланіл, 2,3дипдрофураніл, 2,5-дигідрофураніл, тетрагідрофураніл, тіофаніл, піперидиніл, 1,2,3,6тетрагідро-піридиніл, піперазиніл, морфолі-ніл, тіоморфолініл, піраніл, тіопіраніл, 2,3дигідропіраніл, тетрагідроліраніл, 1,4дигідропіридиніл. 1,4-діоксаніл, 1,3-діоксаніл, діоксаніл, гомопіперидиніл, 2,3,4,7-тетрагідро-1Назериніл, гомопіперазиніл, 1,3-діоксераніл, 4,7дигідро-1,3-діоксериніл, та гексаметилен оксидил. На додаток, гетероцикпіл охоплює ароматичні гетероцикліли або гетероарили, наприклад, піридиніл, піразиніл, піримідиніл, піридазиніл, тієніл, фурил, фуразаніл, піроліл, іміда-золіл, тіазоліл, оксазоліл, піразоліл, ізотіазоліл, ізоксазоліл, 1,2,3-триазоліл, тетразоліл, 1,2,3тіадіазоліл, 1,2,3-оксадіазоліл, 1,2,4-триазоліл, 1,2,4-тіадіазоліл, 1,2,4-оксадіазоліл, 1,3,4триазоліл, 1,3,4-тіадіазоліл та 1,3,4 оксадіазоліл. На додаток, гетероцикпіл охоплює поліциклічні гетероцикліли (охоплюючи ароматичні або неароматичні), наприклад, індоліл, індолініл, ізоіндолініл, хінолініл, тетрагідрохінолініл, ізохінолініл. тетрагідроізохінолініл 1,4бензодіоксаніл, кумариніл, дигідрокумариніл, бензо-фураніл, 2,3-дигідробензофураніл, ізобензофураніл, хроменіл, хроманіл, ізохроманіл, ксан-теніл, феноксатіініл, тіантреніл, індолізиніл, ізоіндоліл, індазоліл, пуриніл, фталазиніл, нафтиридиніл, хіноксалініл, хіназолініл, цинолініл, птериддиніл, фенантридиніл, перимідиніл, фенантролініл, феназиніл, фенотіазиніл, феноксазиніл, 1,2-бензізоксазоліл, бензотіофеніл, бензоксазоліл, бензтіазоліл, бензімідазоліл, бензтриазоліл, тіоксантиніл, карбазоліл, карболініл, акридиніл, піролізидиніл, та хінолізидиніл. На додаток до вищеописаних поліциклічних гетероциклілів гетероцикліл охоплює поліциклічні гетероцикліли, де конденсація кілець між двома або більше кільцями охоплює більше одного зв'язку, спільного для обох кілець та більше двох атомів, спільних для обох кілець. Приклади таких шунтованих гетероциклів охоплюють хінуклідиніл, діазабіцик-ло[2,2,1]гептил; та 7оксабіцикло[2,2,1]гептил. Термін "алкокси", поодинці, чи як суфікс або префікс, стосується радикалів загальної формули -OR, де R вибрано з групи: вуглеводневого радикалу. Приклади алкокси охоплюють метокси, етокси, пропокси, ізопропокси, бутокси, трет 11 бутокси, ізобутокси, циклопропіл-метокси, алілокси. та пропаргілокси. Термін "амін" або "аміно", поодинці, чи як суфікс або префікс, стосується радикалів загальної формули -NRR', де R та R' незалежно вибрані з гідрогену або вуглеводневого радикалу. Галоген охоплює флуор, хлор, бром та йод. Талогенований", застосовуваний як префікс групи, означає, що один або більше пдро-генів на групі заміщено одним або більше галогенами. Вираз - перша кільцева група, "конденсована" з другою кільцевою групою, означає, що перша та друга кільцеві групи мають щонайменше два спільних атоми. "Зв'язаний" означає ковалентно зв'язаний. В одному аспекті винахід стосується сполуки формули І, Π фармацевтично прийнятної солі, її діастереомерів, її енантіомерів та їх сумішей: де R1 вибрано з групи: гідроген, С1-6-алкіл-ОС(=О)-, як варіант, заміщений С1-6-алкіл., як варіант, заміщений С3-6-циклоалкіл, як варіант, заміщений С6-10-арил, як варіант, заміщений С2-9гетероцикліл, як варіант, заміщений С6-10-арил- С13-алюл, як варіант, заміщений С2-9-гетероциклілС1-3-алкіл, та де D - двовалентна фупа, вибрана, як варіант, з групи: заміщений С1-6-валкілен, як варіант, заміщений фенілен, як варіант, заміщений фенілен- С1-3-алкіл, як варіант, заміщений С3-5гетероарилен та як варіант, заміщений С3-5гетероарилен- С1-3-алкіл; R2 та R3 незалежно вибрані з групи: гідроген, як варіант, заміщений С1-6-алкіл та, як варіант, заміщений С3-6-циклоалкіл; а R4 та R5 незалежно вибрані з групи: -Н, як варіант, заміщений С1-6-алкіл, як варіант, заміщений С3-8-циклоалкіл, як варіант, заміщений С6-10-арил, як варіант, заміщений С2-9гетероцикліл, як варіант, заміщений С6-10-арил- С13-алкіл, як варіант, заміщений С2-9-гетероциклілС1-6-алкіл, -С(=Ο)-NR8R9 та -C(=O)-R8, де R8 та R9 незалежно вибрані з групи: -Н, як варіант, 81309 12 заміщений С1-6-алкіл, як варіант, заміщений С3-8циклоалкіл, як варіант, заміщений С6-10-арил, як варіант, заміщений С2-9-гетероцикліл, як варіант, заміщений С6-10-арил- С1-6-алкіл та як варіант, заміщений С2-9-гетероцикліл- С1-6-алкіл. Зокрема, винахід стосується сполуки формули І, де R1 вибрано з групи: гідроген, С1-6-алкіл-ОС(=О)-, С1-6-алкіп, С3-6-циклоалкіл, феніл, фенілС1-3-алкіл, С3-5-гетероцикліл та С3-5-гетероциклілС1-6-алкіл, де вказані С1-6-алкіл, С3-6-циклоалюл, феніл, феніл- С1-6-алкіл, С3-5-гетероцикліл та С3-5гетероцикліл- С1-3-алкіл, як варіант, заміщені одним або більше замісниками, вибраними з групи: С1-6-алкіл, галогенований С1-6-алкіл, -ОН, NO2, -CF3, С1-6алкоксил, хлор, флуор, бром та йод; R2 та R3 представляють етил; а R4 та R5 незалежно вибрані з групи: -Н, як варіант, заміщений феніл, як варіант, заміщений С3-5-гетероцикліл, як варіант, заміщений феніл- С13-алкіл, як варіант, заміщений С3-5-гетероциклілС1-3-алкіл, як варіант, заміщений С1-6-алкіл, як варіант, заміщений С3-6-циклоалкіл, як варіант, заміщений С3-6-циклоалкіл- С1-3-алкіл, -C(=O)-NR8R9 та -C(=O)-R8, де R8 та R9 незалежно вибрані з групи: -Н, як варіант, заміщений феніл, як варіант, заміщений С3-5-гетероцикліл, як варіант, заміщений феніл- С1-3-алкіл, як варіант, заміщений С3-5-гетероцикліл- С1-3-алкіл, як варіант, заміщений С1-6-алкіл, як варіант, заміщений С3-6-циклоалкіл, як варіант, заміщений С3-6-циклоалкіл- С1-3-алкіл. Конкретніше, винахід стосується сполуки формули І, де R1 вибрано з групи: гідроген, С1-6-алкіл-ОС(=О)-, С1-6-алкІл, С3-6-циклоалкіл, феніл- С1-3алкіл та С3-5-гетероарил- С1-3-алкіл, де вказані С16алкіл, С3-6-циклоалкіл, феніл- С1-3-алкіл та С3-5гетероарил- С1-3-алкіл, як варіант, заміщені одним або більше замісниками, вибраними з групи: С1-6алкіл, галогенований С1-6-алкіл, -ОН, -NO2, -CF3, С1-6алкоксил, хлор, флуор, бром та йод; R2 тa R3 представляють етил; а R4 та R5 представляють гідроген. Більш конкретно, винахід стосується сполуки формули І, де R1 вибрано з групи: С2-4-алкіл, бензил, тіадіазолілметил, фурилметил, піридилметил та тієнілметил, де вказані: С2-4-алкіл, бензил, тіадіазолілметил, фурилметил, піридилметил та тієнілметил, як варіант, заміщені одним або більше замісниками, вибраними з групи: С1-3-алкіл, галогенований С1-3-алкіл, -ОН, -NO2, -CF3, С16алкоксил, хлор, флуор, бром та йод; R2 та R3 представляють етил; а R4 та R5 представляють гідроген. Ще конкретніше, винахід стосується сполуки формули І, де R1 – R6-CH2-, де R6 вибрано з групи: 2-піридил, 2-тієніл, 2-фурил, 5-хлор-2-фурил, 5-метил-2фурил, З-метил-2-тіеніл, З-хлор-2-тієніл, 5-хлор-2тієніл, 5-метил-2-тієніл, 6-хлор-3-піридил, 2гідрокаетил, 2-метоксіетил, метоксиметил, 3піридил, 4-піридил, 4-тізоліл, 5-тіазоліл, н-пропіл та (іИиетил-З-піридил. R2 та R3 представляють етил; а 13 R4 та R5 представляють гідроген. Слід розуміти, що коли сполуки представленого винаходу містять один або більше хіральних центрів, сполуки винаходу можуть існувати в енантіомерних або діастереомерних формах та бути виділеними як енантіомери або діастереомери або як рацемічна суміш. Представлений винахід охоплює будь-як можливі енантіомери, діастереомери, рацемати або їх суміші сполук формули І. Оптично активні форми сполуки винаходу можна отримувати, наприклад, хіральним хроматографічним розділенням рацемату, синтезом з оптично активних вихідних матеріалів або асиметричним синтезом описаними далі способами. Слід також розуміти, що деяк сполуки представленого винаходу можуть існувати як геометричні ізомери, наприклад, Ε та Ζ ізомери алкенів. Представлений винахід охоплює будьякий геометричний ізомер сполук формули І. Слід також розуміти, що представлений винахід охоплює таутомери сполук формули І. Слід також розуміти, що деякі сполуки представленого винаходу можуть існувати у сольватованій, наприклад, пдратованій, а також несольватованій формах. Слід також розуміти, що представлений винахід охоплює усі такі сольватовані форми сполук формули І. Рамками винаходу охоплено також солі сполук представленого винаходу, що можна отримувати стандартними способами, добре відомими у рівні техніки, наприклад, реакцією достатньо основної сполуки, наприклад, алкіламіну з придатною кислотою, наприклад, НСІ або оцтовою кислотою, що дає фізіологічно прийнятний аніон. Також можливо утворювати відповідну сіль лужного металу (як-то натрій, калій, або літій) або лужноземельного металу (як-то кальцій) обробкою сполуки представленого винаходу, що має належно кислотний протон, як-то карбонова кислота або фенол з одним еквівалентом гідроксиду або алкоксиду лужного металу або лужно-земельного металу (як-то етоксид або метоксид), або належно основний органічний амін (як-то холін або мегаумін) у водному середовищі, а потім звичайними способами очистки. В одному втіленні, сполуку формули І вище можна перетворити у фармацевтично прийнятну сіль або сольват, зокрема, кислотно-адитивну сіль, як-то гідрохлорид, гідробромід, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат чи п-толуолсульфонат. Нові сполуки представленого винаходу є корисними у терапії, особливо для лікування різних больових станів, як-то хронічний біль, невропатичний біль, гострий біль, біль при раку, біль при ревматоїдному артриті, мігрень, вісцеральний біль тощо. Цей перелік, однак не є повним. Сполуки винаходу є корисними для лікування діареї, депресії, тривожності та асоційованих зі стресом розладів, як-то посттравматичні стресрозлади, панічний розлад, розлад з генералізованою тривожністю, соціальні фобії, та обсесивно-компульсивний розлад, невтримання 81309 14 сечі, передчасна еякуляція, різні психічні захворювання, кашель, набряк легенів, різні шлунково-кишкові розлади, наприклад, запор, функціональні шлунково-кишкові розлади, як-то синдром подразненого кишечнику та функціональна диспепсія, хвороба Паркінсона та інші моторні розлади, травма мозку, інсульт, кардіозахист після інфаркту міокарду, травма спини та залежність від ліків, охоплюючи лікування від зловживання алкоголем, нікотином, опіоїдними та іншими ліками, та для розладів симпатичної нервової системи, наприклад, гіпертензії. Сполуки винаходу є корисними як імуномодулятори, особливо для автоімунних хвороб, як-то артрит, для пересадки шкіри, трансплантації органів та подібних хірургічних потреб, для колагенових хвороб, різних алергій, для застосування як антипухлинних агентів та анти-вірусних агентів. Сполуки винаходу є корисними у станах хвороб, де наявні чи залучені у цю парадигму дегенерація або дисфункція опіоїдних рецепторів. Це може прилучати застосування мічених ізотопами сполук винаходу у діагностиці та інтраскопії, як-то позитронна емісійна томографія (PET). Сполуки винаходу є корисними як аналгетики для застосування при загальній анестезії та контрольованій анестезії. Комбінації агентів з відмінними властивостями часто застосовують для досягнення збалансованої дії для підтримки стану анестезії (наприклад, амнезії, аналгезії, релаксації м'язів та заспокоєння). Залученими у цю комбінацію є інгаляційні анестетики, снодійні, анксіолітики, нейром'язові блокатори та опіоїди. Рамки винаходу охоплюють застосування будь-якої сполуки формули І вище, для виробництва медикаменту. Також рамки винаходу охоплюють застосування будь-якої сполуки формули І вище, для виробництва медикаменту для лікування болю, як-то, без обмеження, гострий біль, хронічний біль, невропатичний біль, біль при раку, біль у спині, мігрень та вісцеральний біль. Також рамки винаходу охоплюють застосування будь-якої сполуки формули І вище, для виробництва медикаменту для лікування тривожності. Також рамки винаходу охоплюють застосування будь-якої сполуки формули І вище, для виробництва медикаменту для лікування будьяких вищезазначених станів. Наступним аспектом винаходу є спосіб лікування суб'єкту, який потерпає від будь-яких вищезазначених станів, згідно з яким до пацієнта, що потребує такого лікування, застосовують ефективну кількість сполуки формули І вище. Відтак, винахід стосується сполуки формули І, або її фармацевтично прийнятної солі або сольвату, що визначено вище, для застосування у терапії. У наступному аспекті представлений винахід стосується застосування сполуки формули і, або її фармацевтично прийнятної солі або сольвату, що 15 визначено вище, у виробництві медикаменту для застосування у терапії. У контексті представленого опису, термін "терапія" також охоплює "профілактику" якщо не визначено інше. Термін "терапевтичний" та "терапевтично" слід розуміти відповідно. Термін "терапія" у контексті представленого винаходу також охоплює застосування ефективної кількості сполуки представленого винаходу для пом'якшення вже існуючого стану хвороби, гострого або хронічного чи рекурентного стану. Це визначення також охоплює профілактичні терапії для попередження рекурентних станів та безперервну терапію для хронічних розладів. У терапії теплокровної тварини, як-то людини, сполуку винаходу можна застосовувати у формі звичайної фармацевтичної композиції будь-яким шляхом, охоплюючи пероральний, внутрішньом'язовий, підшкірний, місцевий, інтраназальний, інтраперитональний, інтраторакальний, внутрішньовенний, епідуральний, інтратекальний, інтрацеребровентрикулярний та ін'єкцією у суглоби. В одному втіленні винаходу, шлях застосування може бути пероральним, внутрішньовенним або внутрішньом'язовим. Дозування залежить від шляху застосування, суворості хвороби, віку та маси пацієнта та інших факторів звичайно враховуваних лікарем при визначенні індивідуального режиму та рівню дозування, найприйнятнішого для конкретного пацієнта. На додаток, запропоновано фармацевтичну композицію, що містить сполуку формули І, або її фармацевтично прийнятну сіль в асоціації з фармацевтично прийнятним носієм. Зокрема, запропоновано фармацевтичну композицію, що містить сполуку формули І, або її фармацевтично прийнятну сіль в асоціації з фармацевтично прийнятним носієм для терапії, більш конкретно для терапії болю. Крім того запропоновано фармацевтичну композицію, що містить сполуку формули І або її фармацевтично прийнятну сіль в асоціації з фармацевтично прийнятним носієм застосування у будь-яких з вищезазначених станів. Для отримання фармацевтичної композиції зі сполуки цього винаходу інертні, фармацевтично прийнятні носії можуть бути твердими та рідкими· Тверді форми препаратів охоплюють порошки, таблетки, дисперсивні гранули, капсули, саше та супозиторії. Твердий носій може бути одною або більше речовинами, котрі можуть також діяти як розріджувачі, ароматизатори, солюбілізатори, лубриканти, суспендувальні агенти, зв'язуючі, або дезинтегратори таблеток; а також як капсулювальний матеріал. У порошках носій є мілко подрібненим твердим матеріалом у суміші з мілко подрібненою сполукою винаходу або активним компонентом. У таблетках активний компонент змішують з носієм, що має необхідні зв'язувальні властивості, у придатній пропорції та пресують до потрібної форми та розміру. 81309 16 Для отримання композиції супозиторію низькоплавкий віск, як-то суміш гліцеридів жирних кислот та масло какао спершу плавлять та диспергують активний інгредієнт, наприклад, перемішуванням. Розплавлену гомогенну суміш у тоді виливають у форму підхожого розміру та дають охолонути та затвердіти. Придатними носіями є магній карбонат, матій стеарат, тальк, лактоза, цукор, пектин, декстрин, крохмаль, трагакант, метилцелюлоза, натрій карбоксиметилцелюлоза, низькоплавкий віск, масло какао, тощо. Термін композиція також охоплює композицію активного компоненту з капсулювальним матеріалом як носієм, що забезпечує капсулу, у котрій активний компонент (з іншими носіями чи без них) оточено носієм, котрий відтак є в асоціації з ним. Подібно, є залученими саше. Таблетки, порошки, саше та капсули можна застосовувати як тверді форми дозування, придатні для перорального застосування. Рщкі форми композиції охоплюють розчини, суспензії та емульсії, наприклад, стерильні водні або водно-пропіленгліколеві розчини активних сполук можуть бути рідкими препаратами, придатними для парентерального застосування. Рідкі композиції можна також формувати у розчині у водно-поліетиленгліколевому розчині. Водні розчини для перорального застосування можна отримувати розчиненням активного компоненту у воді та додаванням придатних барвників, ароматизаторів, стабілізаторів та загусників, за потребою. Водні суспензії для перорального застосування можна отримувати диспергуванням мілко подрібненого активного компоненту у воду разом з в'язким матеріалом, якто природні синтетичні камеді, смоли, метилцелюлоза, натрій карбоксиметилцелюлоза та інші суспендувальні агенти, відомі у рівні фармацевтичної техніки. Залежно від режиму застосування, фармацевтичні композиції переважно містять від 0,05% до 99 мас.%, більш переважно від 0,10 до SOмас.%, сполуки винаходу. Терапевтично ефективну кількість для здійснення представленого винаходу може визначати застосуванням відомих критеріїв, охоплюючи вік, масу та чутливість конкретного пацієнта, та інтерпретувати у контексті хвороби, котру лікують або попереджають, фахівець. У наступному аспекті представлений винахід стосується способу отримання сполуки представленого винаходу. В одному втіленні, винахід стосується способу отримання сполуки формули II, що полягає у: 17 81309 18 Зокрема, винахід стосується способу отримання сполуки формули II, що вищеописано, де R2 та R3 представляють етил; Х-Вг; R4 та R5 представляють гідроген; 7 7 реакції сполуки формули III з R -CH2X або R CHO: де R2 та R3 представляють етил; X вибрано з групи: СІ, І, Вг, -OTs (тозил) та OMs (мезилат); R4 та R5 незалежно вибрані з групи: -Н, як варіант, заміщений феніл, як варіант, заміщений С3-5-гетероцикліл, як варіант, заміщений феніл- С13алкіл, як варіант, заміщений С3-5-гетероцикліл- С1як варіант, заміщений С3-6-алкіл, як 3-алкіл, варіант, заміщений С3-6-циклоалкіл, як варіант, заміщений С3-6-циклоалкіл- С1-3-алкіл, -C(=O)-NR8R9 та -C(=O)-R8, де R8 та R9 незалежно вибрані з групи: -Н, як варіант, заміщений феніл, як варіант, заміщений С3-5-гетероцикліл, як варіант, заміщений феніл- С13-алкіл, як варіант, заміщений С3-5-гетерсщиклілС1-3-алкіл, як варіант, заміщений С1-6-алкіл, як варіант, заміщений С3-6циклоалкіл, як варіант, заміщений С3-6-циклоалкіл- С1-3-алкіл; , R7 вибрано з групи: С1-6-алкіл, феніл, тіазоліл, фурил, піридил та тієніл, де вказані С1-6-алкіл, феніл, фурил, піридил, тієніл, як варіант, заміщені одним або більше замісниками, вибраними з групи: С1-6-алкіл, галогенований. С1-6-алкіл, -ОН, -NO2, -CF3, С1-6алкокси, хлор, флуор, бром та йод; а де D - С1-6-алкілен. У другому втіленні представлений винахід стосується способу отримання сполуки формули І, що полягає у: реакції сполуки формули IV зі сполукою формули V: де де R1 вибрано з групи: С1-6-алкіл-О-С(=О)R7 вибрано з групи: , С1-6-алкіл, С3-6-циклоалкіл, феніл, феніл- С1-3алкіл, С3-5-гэтероарил та С3-5-гетероарил- С1-3алкіл, де вказані С1-6-алкіл, С3-6-циклоалкіл, феніл, феніл- С1-3-алкіл, С3-5-гетероарил та С3-5петероарил- С1-3алкіл, як варіант, заміщені одним або більше замісниками, вибраними з групи: С1-6алкіл, галогенований С1-6-алкіл, -ОН, -NO2, -CF3 С16алкокси, хлор, флуор, бром та йод; а D - двовалентна група, вибрана з груп: як варіант, заміщений С1-6-алкілен, як варіант, заміщений фенілен, як варіант, заміщений фенілен- С1-3-алкіл, як варіант, заміщений С3-5гетероарилен та як варіант, заміщений С3-5гетероарилен-С1-3-алкіл. , , С1-6-алкіл, С3-6циклоалкіл, феніл, феніл- С1-3-алкіл, С3-5гетероцикліл та С3-5-гетероцикліл-Сі_з-алкіл, де вказані С1-6-алкіл, С3-6-циклоалкіл, феніл, фенілС1-3алкіл, С3-5-гетероцикліл та С3-5-гетероциклілС1-3-алкіл, як варіант, заміщені одним або більше замісниками, вибраними з групи: С1-6-алкіл, галогенований С1-6-алкіл, -ОН, -NO2, -CF3, С16алкокси, хлор, флуор, бром та йод; D - двовалентна фупа, вибрана з груп: як варіант, заміщений С1-6-алкілен, як варіант, заміщений фенілен, як варіант, заміщений 19 фенілен- С1-3-алкіл, як варіант, заміщений С3-5гетероарилен та як варіант, заміщений С3-5гетероарилен- С1-3-алкіл; 1 X вибрано з групи: І, Вг та СІ; R10 вибрано з групи: Η та С1-6алкіл, або (R10О)2В- представляє R2 та R3 представляють етил; а R4 та R9 незалежно вибрані з групи: -Н, як варіант, заміщений феніл, як варіант, заміщений С3-5-гетероцикліл, як варіант, заміщений феніл- С16-алкіл, як варіант, заміщений С3-5-гетероциклілС1-6-алкіл, як варіант, заміщений С1-6-алкіл, як варіант, заміщений С3-6-циклоалкіл, як варіант, заміщений С3-6-циклоалкіл- С1-3-алкіл, -C(=OH)-R8 R97 та -C(=O)-R8, де R8 та R9 незалежно вибрані з групи: -Н, як варіант, заміщений феніл, як варіант, заміщений С3-5-гетероцикліл, як варіант, заміщений феніл- С1-3алкіл, як варіант, заміщений С3-5-гетероцикліл- С1-3-алкіл, як варіант, заміщений С1-6-алкіл, як варіант, заміщений С3-6-циклоалкіл, як варіант, заміщений С3-6-циклоалкіл- С1-3-алкіл. Зокрема, винахід стосується способу отримання сполуки формули І, що вищеописано, де R1 вибрано з групи: гідроген, С1-6-алкіл-ОС(=О) , С1-6-алкіл, С3-6-циклоалкіл, феніл- С1-3-алкіл та С3-5-гетероцикліл- С1-3-алкіл, де вказані С1-3-алкіл, С3-6-циклоалкіл, феніл- С13алкіл та С3-5-гетероцикліл- С1-3-алкіл, як варіант, заміщені одним або більше замісниками, вибраними з групи: С1-3-алкіл, галогенований С1-6алкіл, -ОН, -NO2, -CF3, С1-3- алкокси, хлор, флуор, бром та йод; D - С1-6-алкілен; Х-Вr; R10-H; R2 та R3 представляють етил; а R4 та R5 представляють гідроген. Більш конкретно, сполуки представленого винаходу та інтермедіати, застосовувані для їх отримання можна отримувати шляхами синтезу, представленими у схемах 1-4. 81309 20 21 Біологічна оцінка Сполуки винаходу виявлені як активні по відношенню до δ-рецепторів теплокровної тварини, наприклад, людини. Зокрема сполуки винаходу виявлені як ефективні ліганди δрецептору. In vitro дослідження, нижче, демонструють ці несподівані активності, особливо з точки зору на потужність та ефективність агонютів, як продемонстровано у функціональному дослідженні мозку щурів та/або функціональному дослідженні δ-рецептору людини. Ця особливість може стосуватися активності in vivo та може не корелювати лінійно зі спорідненістю до зв'язування. У цих in vitro дослідженнях сполуки тестують на їх активність по відношенню до δрецепторів та отримують IKso для визначення селективної активності конкретної сполуки по відношенню до δ-рецепторів. У сучасному контексті IKso звичайно стосується концентрації' сполуки, при котрій спостерігають 50% заміщення стандартного радіоактивного ліганду δ-рецептору. Активності сполук по відношенню до рецепторів k та μ також вимірюють у подібному дослідженні. Модель in vitro Культура клітин Клітини 293 S людини, що експресують клоновані рецептори к, δ та μ людини та є резистентними до неоміцину, вирощують у суспензії при 37°С та 5% СО2 у струшуваних колбах, що містять позбавлений кальцію ОМЕМ10% FBS, 5% BCS, 0,1% Plutonic F-68 та 600 мкг/мл генетицину. Мозки щурів зважують та промивають у льодяному PBS (що містить 2,5 мМ ЕДТА, рН 7,4). Мозки гомогенізують політроном протягом ЗО с (щури) у льодяному лізисному буфері (50 мМ Трис, рН 7,0,2,5 мМ ЕДТА, з фенілметилсульфонілфлуориді, доданому безпосередньо перед застосуванням до 0,5 МмМ від 0,5 Μ вихідного розчину у суміші ДМСО: етанол). Отримання мембран Клітини гранулюють та ресуспендують у лізисному буфері (50 мМ Трис, рН 7,0, 2,5 мМ ЕДТА, з PMSF, доданому безпосередньо перед застосуванням до 0,1 мМ від 0,1 Μ вихідного розчину у етанол), інкубують на льоді протягом 15 хвил, тоді гомогенізують політроном протягом 30 с Суспензію центрифугують при 1000 g (макс) протягом 10 хвил при 4°С. Надо-садковий шар зберігають на льоді та гранули ресуспендують та центрифугують як перед тим. Надосадкові шари від обох центрифугувань поєднують та 81309 22 центрифугують при 46000 г(макс) протягом 30 хвил. Гранули ресуспендують у холодному буфері Трис (50 мМ Трис/СІ, рН 7,0) та центрифугують знов. Кінцеві гранули ресуспендують у мембранному буфері (50 мМ Трис, 0,32 Μ сахароза, рН 7,0). Аліквоти (1 мл) у поліпропіленових тубах заморожують у сухому льоді/етанолі та зберігають при -70°С до застосування. Концентрації' білку визначають модифікованим дослідженням Лаурі з натрій додецилсульфатом. Дослідження зв'язування Мембрани розморожують при 37°С, охолоджують на льоді, пропускають 3 рази через голку 25 розміру та розбавляють зв'язувальним буфером (50 мМ Трис, 3 мМ МдСІ2,1 мг/мл BSA (Sigma А-7888), рН 7,4, і зберігають при 4°С після фільтрування через 0,22 м фільтр і додають 5 мкг/мл апротиніну, 10 мкМ бестатину, 10 мкМ ліпротину А, без DTT). Аліквоти по 100 мкл додають до охолоджених льодом 12x75 мм поліпропіленових туб, що містять 100 мкл прийнятного радіоліганду та 100 мкл тест-сполуки при різних концентраціях. Загальне (ТВ) та неспецифічне (NS) зв'язування визначають у відсутності та присутності 10 мкМ на-локсону відповідно. Туби перемішують та інкубують при 25 °С протягом 60-75 хвил, після чого вміст швидко вакуум-фільтрують та промивають приблизно 12 мл/туб охолодженого льодом промивального буферу (50 мМ Трис, рН 7,0, 3 мМ МдСІ2) через фільтри GF/B (Whatman), попередньо просочені протягом принаймні 2 годин у 0,1% поліетиленіміні. Радіоактивність на фільтрах вимірюють бета-лічильником після просочення фільтрів протягом принаймні 12 годин у мініколбах, що містять 6-7 мл сцинтиляційної рідини. Якщо дослідження проводять у 96місцевих планшетах з глибокими комірками, фільтрування проводять через 96-місцеві просочені поліетиленіміном уніфільтри, котрі промивають 3 χ 1 мл промивального буферу та сушать у шафі при 55°С протягом 2 годин. Фільтр планшети підраховують у TopCount (Packard) після додавання 50 мкл сцинтиляційної рідини MS-20 на комірку. Функціональне дослідження Агоністичну активність сполук вимірюють визначенням ступеню до котрого комплекс сполука-рецептор активує зв'язування GTP до Gбілків, до котрих рецептори приєднуються. У дослідженні зв'язування GTP GTPfypS поєднували з тест-сполуками та мембранами від клітин HEK293S, що експресують клоновані людини опіоїдні рецептори або від гомогенізованого мозку щура та миші. Агоністи стимулюють зв'язування GTP[g]35 у цих мембранах Значення Емакс та Емакс сполук визначають за кривими доза-відгук. Праві зсуви кривої доза-відгук дельта-антагоністом налтриндолом проводять для перевірки, чи опосередкована аго-ністична активність дельтарецепторами. Значення Емакс визначали відносно стандартного δ-агоністу SNC80, тобто, вище 100% означає сполуку, що має кращу ефективність, ніж SNC80. 23 Процедура для мозку щурів GTP Мембрани мозку щурів розморожують при 37°С, пропускають 3 рази через голку 25 розміру із затупленим кінцем та розбавляють GTPyS зв'язуючим (50 мМ Hepes, 20 мМ NaOH, 100 мМ NaCI, 1 мМ ЕДТА, 5 мМ МдСІ2, рН 7,4, Додають свіжі: 1 мМ DTT, 0,1% BSA). Кінцево додають 120 мкМ GDP розбавлень мембран. Значення ЕК50 та Емакс сполук оцінюють за 10-точковими кривими доза-відгук у 300 мкл з прийнятною кількістю білку мембран (20 мкг на комірку) та 100000-130000 імп/хвил GTPg35 на комірку (0,11 -0,14 нМ). Базове та максимальне стимульоване зв'язування визначають у відсутності та присутності 3 мкМ SNC-80 Дані аналізу Специфічне зв'язування (SB) розраховували як TB-NS та SB у присутності різних тест-сполук і виражали як процент контролю SB. Значення ІК50 та коефіцієнту Хілла (nн) для лігандів у заміщенні специфічно зв'язаного радіоліганду розраховували логіт-трансформацією або програмами підгонки кривих, як-то Ligand, GraphPad Prism, SigmaPlot, або ReceptorFit. Значення Кi розраховували за рівнянням Ченга-Пруссофа. Значення IK50± ДІ., Кi та nH представлено для лігандів, тестованих у принаймні трьох кривих заміщення. На основі вищенаведеного тестування ми знайшли, що сполуки представленого винаходу є активними по відношенню до б-рецептору людини. Звичайно, IK50 по відношенню до δ-рецептору людини для більшості сполук представленого винаходу є у межах 0,48 нМ -17,9 нМ. ΕΚ50 та % Емакс по відношенню до δ-рецептору людини для цих сполук є звичайно у межах 18,6 нМ -1724 нМ та 65 -108, відповідно. ІК50 по відношенню до рецептори людини k та μ для сполуки винаходу є звичайно у межах 1317 нМ - 9739 нМ та 261 нМ 9774 нМ, . відповідно. Експерименти з насичення рецепторів Значення Кd радіоліганду визначають проведенням дослідження зв'язування на мембранах клітин з прийнятними радіолігандами при концентрації у межах від 0,2 до 5 разів оціненого Ко (до 10 разів, якщо кількості потрібного радіоліганду є реальними). Специфічне зв'язування радіоліганду виражають як пмоль/мг білку мембран. Значення Кdта Вмакс від індивідуальних експериментів отримували нелінійною підгонкою специфічно зв'язаного (В) проти нМ вільного (F) радіоліганду від індивідуалу згідно з одно-сайтовою моделлю. Визначення механоалодиніТ тестуванням вон Фрея Тестування проводять між 08: 00 та 16:00 годинами способом, описаним Chaplan et al. (1994). Щурів розміщають у клітках з плексигласу, дротяне дно котрих дозволяє доступ до лап, та дають звикнути протягом 10-15 хвил. Тестованою зоною є середина підошви лівої задньої лапи, уникаючи менш чутливих подушечок лапи. Лапи торкаються серією з 8 волосинок вон Фрея з логарифмічно зростаючою жорсткістю (0,41, 0,69, 1,20, 2,04, 3,63, 5,50, 8,51 та 15,14 π Stoelting, 111, USA). Волосинку вон Фрея просувають знизу 81309 24 підлоги перпендикулярно поверхні підошви з достатньою силою для виклику слабкого вигину лап та тримають протягом приблизно 6-8 с Позитивний відгук відмічають, якщо лапа різко відсмикується. Здригування негайно після видалення волосинки також вважають позитивним відгуком. Уставання вважають сумнівним відгуком і у таких випадках стимул повторюють. Протокол тестування Тварин тестують на добу 1 після операції для обробленої FCA групи. 50% поріг відсмикування визначають, застосовуючи спосіб уверх-униз Діксона (1980). Тестування починають з волосинки 2,04г у середині серії. Стимули завжди застосовують послідовно, підвищуючи або понижуючи. При відсутності відсмикування лапи як відгуку на спочатку вибрану волосинку застосовують сильніший стимул; у випадку відсмикування лапи, наступний слабший стимул. Розрахунок оптимального порогу цим способом потребує 6 відгуків у безпосередній близькості до 50% порогу та підрахунок цих 6 відгуки починають, коли відбувається перша зміна відгуку, наприклад, поріг є вперше перейденим. У випадках, де пороги знаходяться за межами стимулів, відповідно позначають значення 15,14 (нормальна чутливість) або 0,41 (максимально алодинічно). Результативні позитивні та негативні відгуки групують, застосовуючи умовні позначення, X = нема відсмикування: О = відсмикування та 50% поріг відсмикування інтерполюють за формулою: 50% г поріг=10(Xf+кd)/10000 де Xf = значення останньої застосовуваної волосинки вон Фрея (логарифмічні одиниці); k = табличне значення (від Chaplan et al. (1994)) для позитивних / негативних відгуків; а б = значення різниці мвк стимулами (логарифмічні одиниці). Тут d = 0,224. Пороги вон Фрея виражають як процент максимально можливої дії (% МРЕ), згідно з Chaplan et al. 1994. Наступне рівняння застосовували для розрахунку %МРЕ: порігприлікуванні - порігаладинії(г ) Х100 %МРЕ = порігконтролю(г ) - порігаладинії(г ) Застосування тест-речовини Щурів ін'єктують (підшкірно, інтраперитонально, внутрішньовенно або перорально) тест-речовиною перед тестуванням вон Фрея, час між застосуванням тест-сполуки та тестом вон Фрея варіює залежно від природи тестсполуки. Тест на корчення Оцтова кислота призводить до абдомінальних скорочень при інтраперитональному застосуванні у мишей, що витягують їх тіло у типовій картині, коли застосовують аналгетичні ліки, цей описаний рух спостерігають рідше та ліки вибирають як потенційно гарні. Повний та типовий рефлекс корчення вважають наявним тільки коли представлено такі елементи: тварина не рухається; нижча частина спини слабко пригнічена; підошви обох лап доступні для спостереження. У цьому дослідженні 25 сполуки представленого винаходу демонструють значне інгібування відгуків корчення після перорального застосування 1-100мкмоль/кг. (і) Отримання розчинів Оцтова кислота (АсОН): 120мкл оцтової кислоти додають до 19,83мл дистильованої води до кінцевого об'єму 20мл з кінцевою концентрацією 0,6% АсОН. Розчин тоді змішують та застосовують для ін'єкцій. Сполуки (ліки): Кожну сполуку отримують та розчиняють у найпридатнішому носії стандартними способами. (іі) Застосування розчинів Сполуку (ліки) застосовують перорально, інтраперитонально, підшкірно або внутрішньовенно при 10мл/кг (приймаючи до уваги середню масу тіла мишей) за 20, 30 або 40 хвилин (згідно з класом сполуки та її характеристиками) перед тестуванням, коли сполуку доставляють центрально: інтравентрикулярно або інтратекально, застосовують об'єм 5мкл. АсОН застосовують інтраперитонально у двох ділянках при 10мл/кг (приймаючи до уваги середню масу тіла мишей) негайно перед тестуванням, (ііі) Тестування: Тварину (мишу) спостерігають протягом 20 хвилин та число випадків (рефлекс корчен-ня) занотовують та компілюють в кінці експерименту. Мишей тримають в індивідуальних клітках "коробка для взуття" з контактною укладкою. Загалом одночасно звичайно спостерігають 4 мишей: один контроль та три дози ліків. Для симптомів тривожності та подібних тривожності, ефективність встановлено у конфліктному тесті у щурів Для симптомів функціональних шлунковокишкових розладів, ефективність може бути встановленою у дослідженні, описаним Coutinho SV et at, у American Journal of Physiology Gastrointestinal & Liver Physiology. 282(2): G3 0716,2002 Feb. у щуре. Додаткові протоколи тестування in vivo Суб'єкти та розміщення Необроблених самців щурів Sprague Dawtey (175-200 г) розбивають у групи по 5 у кімнаті з регульованою температурою (22°С, 40-70% вологості, 12 годин світло/темрява). Експерименти проводять протягом світлової фази циклу. Тварини мають їжу та воду досхочу та їх вбивають негайно після отримання даних. Зразок Тестування сполуки (ліків) охоплює групи щурів, що не отримують будь-якого лікування та інших, яких обробляють ліпополісахаридом Е. coli (LPS). Для LPS-експерименту, 4 групи ін'єктують LPS, 1 з 4 груп тоді обробляють носієм, а інші три групи ін'єктують ліками та їх носієм. Другий ряд експериментів проводять, застосовуючи п'ять груп щурів; усі з котрих не отримують обробки LPS. Необроблена група не отримує сполук (ліків) або носія; інші 4 групи обробляють носієм з ліками або без них. Це проводять для визначення анксіолітичної або седативної дії ліків, котра може сприяти зменшенню USV. 81309 26 Застосування LPS Щурам давали звикнути в експериментальній лабораторії протягом 15-20 хвил перед лікуванням. Запалення індукують застосуванням LPS (ендотоксин грам-негативного серо-типу бактерій Е. coli 0111: В4, Sigma). LPS (2,4мкг) ін'єктують інтрацеребровентрикулярно), у об'ємі 10мкл, застосовуючи стандартну стереотаксичну хірургію під анестезією ізофлу-раном. Шкіру між вухами рострально зсувають та роблять поздовжній розріз приблизно 1см для відкриття поверхні черепа. Ділянку проколювання визначають координатами: 0,8мм позаду тім'я, 1,5мм ліворуч стосовно ламбди (сагітальний шов) та 5мм нижче поверхні черепа (вертикально) у бічному шлуночку. LPS ін'єктують через стерильну голку з нержавіючої сталі (26-G 3/8) 5мм довжиною, приєднаною до шприца Гамільтона на 100мкл поліетиленовою трубкою (РЕ20; 10-15см). Стопор 4мм, зроблений з розрізаної голки (20-5 G), розміщають зверху та ізолюють від голки 26-G силіконовим клеєм для утворення потрібної глибини 5мм. Після ін'єкції LPS голку залишають протягом додаткових 10 с для дифузії сполуки, тоді видаляють. Розріз закривають та щура повертають у його клітку та дають спочити протягом мінімум 3,5 годин перед тестуванням. Експериментальна установка для стимуляції ударом повітря Щурів залишають в експериментальній лабораторії після ін'єкції LPS та застосування сполуки (ліків). У час тестування усіх щурів видаляють та розміщають поза лабораторією. Одного щура передають у тест-лабораторію та розміщають у прозорому боксі (9x9x18 см) котрий є тоді розміщають у шумопоглинальному вентильованому боксі для вимірювання 62(ш) х35(г) х46(в) см (BRS/LVE, Div. Tech-Serv Inc). Удари повітря через вихідне сопло повітря 0,32 см, регулюють системою (AirStim, San Diego Intruments), здатною спрямовувати удари повітря фіксованої тривалості (0,2 с) та фіксованої інтенсивності з частотою 1 удар за 10 с Максимум застосовують 10 ударів, або доки не подається голос, котрий іде першим. Перший удар повітря означає початок реєстрації. Експериментальна установка для ультразвукової реєстрації Голосіння реєструють протягом 10 хвилин, застосовуючи мікрофони (G.R.A.S, Vedbaek, Denmark) розміщають збоку кожного боксу та регулюють програмою LMS (LMS CADA-X 3,5В, Data Acquisition Monitor, Troy, Michigan). Частоти між 0 та 32000 Гц реєструють, зберігають та аналізують тою ж програмою (LMS CADA-X 3,5В, Time Data Processing Monitor та UPA (User Programming and Analysis)). Сполуки (ліки) Усі сполуки (ліки) доводять до рН між 6,5 та 7,5 та застосовують у об'ємі 4мл/кг. Після застосування сполуки (ліків), тварин повертають в їх клітки до часу тестування. Аналіз 27 Реєстрацію пропускають через серію статистичних та Фур'є аналізів до фільтру (між 2024к Гц) та для розрахунку потрібних параметрів. Дані виражають як значення ± ДІ. Статистичну значимість оцінюють, застосовуючи для порівняння між необробленими та LPSобробленими щурами Т-тест та одношляхову ANOVA, а потім тест багатократного порівняння Дуннета (після цього), стосовно ефективності ліків. Різницю між групами вважають значущою з мінімальним р-значенням менше 0,05. Експерименти повторюють мінімум два рази. Визначення термічної гіперплазії, застосовуючи підошовний тест Харгосавеса Застосування FCA або карагінану Повний ад'ювант Фрейнда (FCA): SIGMA cat# F 588-1, Mycabacteriwn tuberculosis (H37Ra, ATCC 25177), 1 мг/мл, вбито теплом, висушено, 0. 85 мл парафін, 0. 15 мл маніт моноолеат. Або карагінан типу Ламбда IV(Cg): SIGMA cat# C-3889, (Gelatin, vegetable; Irish moss), (1.0% розчин) у NaCI. Ін'єкції роблять через стерильну голку з нержавіючої сталі (26-G 3/8) 5 мм довжиною, приєднаною до шприца Гамільтона розмір 26G5/8". Щурів витримують та поміщають у камері для анестезії ізофлураном. Коли досягнуто потрібного ефекту, щура видаляють та поміщають у вентральне лежаче положення (стернальна позиція). Ліву задню лапу тримають та голку уводять під шкіру, у вентральному аспекті між подушечками пальців # 2 та # 3 для доступу до середини лапи (метатарзальн зона). Кінцево, об'єм 100 мкл FCA, або 100 мкл розчину карагінану, повільно ін'єктують у лапу, та трохи притискають протягом 3-4 с після видалення голок. Якщо тварини просипаються протягом процедури, їх тоді повертають у камеру для інгаляцій для досягнення потрібного ефекту. Після внутрішньопідошовної ін'єкції тваринам дають проснутися під наглядом у їх клітці. Для обробки FCA, щурам дають 48 годин для розвитку запального процесу. Для обробки карагінаном щурам дають 3 годин для розвитку запального процесу. На ранок тесту щурів поміщають у лабораторію (у їх клітки). їм дають звикнути до помешкання протягом щонайменше 30 хвилин. Тест-ділянка Теплові стимули подають до центру поверхні підошов між подушечками. Тест-ділянка повинна бути у контакті зі склом без сечі або калу для підтримки коректних властивостей переносу теплоти зі скла до шкіри. Підошовний апарат складається з боксу зі скляними верхівкою/платформою, скляну поверхню тримають при 30°С механізмом зі зворотним зв'язком. Знизу цієї скляної платформи є лампа, змонтована на рухомому важелі, дзеркало поміщають знизу для позиціювання світла під лапою щура. При активуванні світлом воно світить через отвір приблизно 2мм діаметром. Експериментатор включає світло, а автоматичні сенсори виключають світло, коли лапу видаляють; відсічення 20, 48 с гарантує не пошкоджування 81309 28 тканин, якщо щур не в змозі убрати свою лапу. Експериментатор також може спрямовувати світло у будь-яку точку. Таймер реєструватиме тривалість часу активації світлом. Флюксметр вимірює потік/чм2 при активуванні світлом. Це слід тримати при -97-98; потік можна модифікувати підгонкою підошовного пристрою, але у середині експерименту не можна вносити зміни. Хід часу Експеримент можна проводити після різних інтервалів часу після індукування запалення. Гіперплазію вимірюють через 48 годин після ін'єкції' FCA або через 3 години після ін'єкції карагінану. Тест-проиедура Необроблені шури: Для встановлення кривої доза-відгук, одну групу з 7 щурів застосовують як контрольну фупу; їх анестезують з іншими 28 щурами, але не роблять будь-якої ін'єкції. Тестування необробленої групи можна робити до початку або безпосередньо після експерименту з мінімальним можливим стресом, щурів поміщають у окремі плексигласові бокси (14 х 21 х 9см) на верхівці підошовного пристрою; їм дають звикнути протягом 30 хвилин. Коли тварини готові до тесту, світло спрямовують безпосередньо під тестділянку та включають та реєструють затримку відсмикування. Через 5-8 хвилин, після повернення температури шкір до нормальної роблять друге зчитування та щурів тоді видаляють та знов поміщають у їх клітку. Базові значення: інших 28 щурів (поділених на 4 групи), що ін'єктовано FCA (або карагінаном) поміщають у окремі бокси та дають звикнути протягом 30 хвилин. Експериментатор повинен перевірити ступінь запалення лапи та контролювати зміну кольору. Теплові стимули поміщають під тест-ділянкою, та реєструють затримку відсмикування; роблять два зчитування, як вище. Порівнюють ці базові значення зі значеннями від необроблених тварини, чим встановлюють, чи є гіперплазія. Тестування після ліків: Якщо встановлюють гіперплазію, щурів ін'єктують потрібною сполукою Кожну сполуку отримують та розчиняють у найпридатнішому носії стандартними способами. Шлях застосування, дози, об'єм, та час тестування після ін'єкції є певним для тої сполуки (або класу сполук). При тестуванні сполуки протягом 20-30 хвилин після ін'єкції', як-то для внутрішньовенної або підшкірної ін'єкції, щурів поміщають та дають звикнути на підошовному апараті доки не подіють ліки. При тестуванні сполуки протягом 60 хвилин або більше після ін'єкції, щурів поміщають назад у їх клітку з їх клітковою підстилкою. Щурів завжди знов поміщають у їх клітку з їх клітковою підстилкою для мінімізації стресу від поновлення соціальної структур групи щурів. Через 30 хвилин щурів поміщають по одному та дають 30 хвилин звикнути до підошовного пристрою. Тестування проводять як описано вище. Роблять два зчитування Критерії Тестування: 29 Тварини повинні бути спокійними та тихими, ще сторожкими та у правильній позиції, без сечі або калу між шкірою лап та скляною поверхнею пристрою. Тварину не тестують, якщо: - Тварина знаходиться у локомоції, охоплюючи фиркання, чистку та дослідження. - Тварина спить. - Тварина виявляє чіткі ознаки стресу (тонічна нерухомість, голосіння, прижаті вуха), якщо вони не є результатом побічної дії сполуки та не можуть бути усуненими. - Тварина розташована так, що лапа не є у безпосередньому контакті зі склом (лапа відпочиває на верху хвоста); - Лапа тварини виявляє блакитний колір як результат поганої ін'єкції У цьому випадку, тварин усувають з експерименту повністю (на початку). Коли наявні сеча або кал, тварину видаляють, скляну поверхню чистять, та тоді тварину поміщають знов. Коли тварина спить, або виявляє тонічну нерухомість, експериментатор може обережно рухати бокс або свою руку до боксу для виклику короткотермінової уваги. Уважне спостереження поведінки тварин слід проводити протягом тесту Повторні тести: У будь-який час протягом експерименту, якщо експериментатор не упевнений, що відсмикування лап не було відгуком на теплові стимули, тварину можна знов тестувати після 5-8 хвилин. Це може бути обумовлене неочікуваним рухом тварини, або сечовипусканням чи дефекацією при дії стимулу. Прийнятні відгуки: будь-що з наступного вважають відгуками на теплові стимули - Відсмикування лапи від скла (часто після облизування лапи) - Латеральний рух тіла (контралатеральний для стимульованої лап) - Пальці рухаються від скла - центропланарний (середина лапи) аспект запаленої лапи видалення від скла. Аналіз Результати виражають як значення±ДІ. Статистичну значимість оцінюють, застосовуючи для порівняння між необробленими та запаленими щурами Т-тест та одношляхову ANOVA, а потім тест багатократного порівняння Дуннета (після цього) стосовно ефективності ліків. Різницю між групами вважають значущою з мінімальним рзначенням менше 0,05. Приклади Винахід детальніше описано наступними прикладами, котрі описують способи, де сполуки представленого винаходу можна отримувати, очищати, аналізувати та біологічно тестувати, і котрі не обмежують винахід. Інтермедіат 1: метил 4{(диметоксифосфорил)метил]бензоат Суміш 4-(бромметил)бензойної кислоти метилового естеру (11,2 г, 49 ммоль) та триметилфосфіту (25 мл) гріли при кипінні під зворотним холодильником під азотом протягом 5 годин. Надлишок триметилфосфіту видаляли 81309 30 співдистиляцією з толуолом, отримуючи інтермедіат 1 з кількісним виходом. 1 Ή-ЯМР (CDCI3) δ 3,20 (d, 2Н, J=22 Гц, СН2), 3,68 (d, ЗН 10,8 Гц, ОСН3), 3,78 (d, 3H, 11,2 Гц, ОСНз), 3,91 (s, ЗН, ОСНз), 7,38 (m, 2H, Аr-Н), 8,00 (d, 2H, J=8 Гц, Аг-Н).Інтермедіат 2: 4-(4-Метоксикарбонілбензиліден)-піперидин-1-карбонової кислоти третбутиловий естер До розчину інтермедіату 1 у сухому тетрагідрофурані (200 мл) додавали краплями літій діізопропіламід (32,7 мл 1,5 Μ у гексанах, 49 ммоль) при -78 °С. Реакційній суміші тоді давали нагрітися до кімнатної температури перед додаванням М-трет-бутоксикарбоніл-4-піперидону (9,76 г, 49 ммоль у 100 мл сухого тетрагідрофурану). Через 12 годин, реакційну суміш гасили водою (300 мл) та екстрагували етилацетатом (3 χ 300 мл). Поєднані органічні фази сушили безводним магній сульфатом та випарювали, отримуючи сирий продукт, котрий очищали флеш-хроматографією, отримуючи інтермедіат 2 як білий твердий продукт (5,64 г, 35%). ІЧС (NaCi) 3424, 2974, 2855.. 1718:1 688,1606.1427:1362,1276 см-1; 1 Н-ЯМР( СDCІ3) δ 1,44 (s, 9Н), 2,31 (t, J*5,5 Гц, 2Н), 2,42 (t, J=5,5 Гц, 2Н), 3,37 (t, J=5,5 Гц, 2Н), 3,48 (t, J=5,5 Гц, 2Н), 3,37 (s, ЗН, OСН3), 6,33 (s, 1Н, СН), 7,20 (d J=6,7 Гц, 2Н, Аг-Н), 7,94(d, 7=6,7Гц, 2М, Аг-Н); 13 С ЯМР (CDCI3) δ 28,3, 29,2 36,19, 51,9, 123,7, 127,8, 128,7,129,4,140,5,142,1,154,6,166,8. Інтермедіат 3: 4-Бром-4-[бром-(4метоксикарбоніл-феніл)-метил]-піперидин-1карбонової кислоти трет-бутиловий естер У суміш інтермедіату 2 (5,2 г, 16 ммоль) та калій карбонат (1,0 г) у сухому дихлорметані (200 мл) додавали розчин брому (2,9 г, 18 ммоль) у 30 мл дихлорметану при 0°С. Через 1,5 годин при кімнатній температурі розчин після фільтрування калій карбонату загуснув. Залишок тоді розчиняли в етилацетаті (200 мл), промивали водою (200 мл), 0,5 Μ НСІ (200 мл) та розсолом (200 мл) та сушили безводним магній сульфатом. Видалення розчинників дало сирий продукт, котрий перекристалізовували з метанолу, отримуючи інтермедіат 3 як білий твердий продукт (6,07 г, 78%). ІЧС (NaCI) 3425, 2969,1725,1669,1426,1365,1279,1243 см-1; 1 Н-ЯМР (CDCI3) δ 1,28 (s, 9H), 1,75 (m, 1H), 1,90 (m, 1H), 2,1 (m, 2H), 3,08 (br, 2H), 3,90 (s, ЗН, ОСН3), 4,08 (br, ЗН), 7,57 (d, J=8,4 Гц, 2Н, Ar-H) 7,98 (d, J=8,4 Гц, 2Н, Ar-H); 13 С-ЯМР(CDCI3) δ 28,3, 36,6, 38,3, 40,3, 52,1, 63,2, 72,9, 129,0, 130,3, 130,4, 141,9, 154,4,166,3. Інтермедіат 4: 4-[бром-(4-карбоксифеніл)метилен]-піперидин-1-карбонової кислоти третбутиловий естер Розчин інтермедіату 3 (5,4 г 11 ммоль) у метанолі (300 мл) та 2,0 Μ NaOH (100 мл) гріли при 40 °С протягом 3 годин. Твердий продукт збирали фільтруванням та сушили протягом ночі під вакуумом. Суху сіль розчиняли у суміші 40% 31 ацетонітрил/вода та доводили до рН 2, застосовуючи концентровану НСІ. Інтермедіат 4 (3,8 г, 87%) виділяли як білий порошок фільтруванням. 1 Н ЯМР (CDCI3) δ 1,45 (s, 9Н, Ви), 2,22 (dd, J=5,5 Гц, 6,1 Гц, 2Н), 2,64 (dd, J=5,5 Гц, 6,1 Гц, 2Н), 3,34 (dd, J=5,5 Гц, 6,1 Гц, 2Н), 3,54 (dd, J=5,5 Гц, 6,1 Гц, 2Н), 7,35 (d, J=6,7 Гц, 2Н, Аr-Н), 8,08(d,J=6,7r4,2H,Ar-H); 13 С ЯМР (CDCI3) δ 28,3, 31,5, 34,2, 44,0, 115,3,128,7, 129,4, 130,2, 137,7, 145,2, 154,6, 170,3. Інтермедіат 5: 4-[бром-(4-діетилкарбамоїлфеніл)-метилен]-піперидин-1-карбонової кислоти трет-бутиловий естер До розчину інтермедіату 4 (1,0 г, 2,5 ммоль) у сухому дихлорметані (10 мл) при - 20 °С додавали ізобутилхлорформіат (450 мг, 3,3 ммоль). Через 20 хвил при -20 °С додавали діетиламін (4 мл) та реакційній суміші давали нагрітися до кімнатної температури. Через 1,5 годин розчинники випарювали та залишок розподіляли між етилацетатом та водою. Органічну фазу промивали розсолом та сушили безводним магній сульфатом. Видалення розчинников дало сирти продукт, котрий очищали флеш-хроматографією, отримуючи інтермедіат 5 як білі голки (800 мг, 73%). NC(NaCI) 3051, 2975,1694,1633, 1416, 1281, 1168,1115 см"1; 1 Ή-ЯМР (CDCI3) δ 1,13 (br, ЗН, СН3), 1,22 (br, 3H, СН3), 1,44 (s, 9H, feu), 2,22 (t, J=5,5 Гц, 2Н), 2,62 (t J=5,5 Гц, 2Н), 3,33 (m, 4Н), 3,55 (m, 4Н), 7,31 (d, J=8,0 Гц, 2Н, Аг-Н), 7,36 (d, J=8,0 Гц,2Н,Аг-Н); 13 C ЯМР (CDCI3) δ 12,71, 14,13, 28,3, 31,5, 34,2, 39,1,43,2, 79,7,115,9,126,3,129,3,136,8,137,1,140,6,154,6,170, 5. Інтермедіат 6 трет-бутил 4-((4-ціанофеніл){4[(діетиламіно)карбоніл]феніл метил-ен)піперидин1 -карбоксилат До колби, що містить інтермедіат 5 (23,3д, 51,6 ммоль) додавали толуол (240 мл), етанол (24 мл), 4-ціанофенілборонову кислоту (9,87 г, 69,5 ммоль) та водний 2 Η калій карбонат (24 мл, 48 ммоль). Суміш дегазували протягом ЗО хвилин азотом. Тоді додавали паладій тетракістрифенілфосфін (5,97 г, 5,1 ммоль). Реакційну суміш гріли до 80°С протягом ночі. Реакційну суміш охолоджували, розбавляли розчином насиченого водного натрій пдрогенкарбонату та органічний шар відділяли. Водну фазу тоді екстрагували 3 рази етилацетатом. Поєднані органічні екстракти сушили безводним натрій сульфатом, фільтрували та концентрували. Залишок очищали флешхроматографією, елюючи сумішшю 40/60 - 60/40 етилацетат/гептан, отримуючи інтермедіат 6 як білий твердий продукт (111,8 г, 48 %) Інтермедіат 7: трет-бутил 4-([4(амінокарбоніл)фенілК4{(діетиламіно)карбоніл]феніл} метилен)піперидин1-карбоксилат До колби, що містить суміш інтермедіату 6 (9,81 г, 20,7 ммоль) у 90 мл трет-бутанолу додавали розмелений калій гідроксид (2,9 г, 51,8 ммоль). Реакційну суміш гріли при 80°С протягом 3 81309 32 годин, потім концентрували. Суміш розподіляли між водою та дихлорметаном. Органічний шар відділяли та воднусразу екстрагували 4 рази дихлорметаном. Поєднані органічні шари промивали розсолом, сушили безводним натрій сульфатом, фільтрували та концентрували. Залишок очищали флеш-хроматографією, елюючи сумішшю 90/10 етилацетат/гептан, отримуючи інтермедіат 7 як білий твердий продукт (9,0 г, 88,4 %). 1 Ή ЯМР (400 МГц, CDCfe) 1,09-1,16 (brs, ЗН), 1,20-1,26 (br s, ЗН), 1,46 (s, 9H), 2,29-2,37 (m, 4H), 3,24-3,32 (br s, 2H), 3,43-3,49 (m, 4H), 3,50-3,57 (br 8, 2H), 5,49-5,66 (br s, 1H), 5,97-6,12 (br з, 1Н), 7,11 (d, J = 8,4 Гц, 2Н), 7,19 (d, J * 8,4 Гц, 2Н), 7,32 (d, J = 8,4 Гц, 2Н), 7,75 (d, J = 8,4 Γц,2Η), Інтермедіат 8:4-Ц4[(діетиламіно)карбоніл]фенілНпіперидиніліденіиетил]бензамід До розчину інтермедіату 7 (4 г, 8,4 ммоль) у дихлорметані (40 мл) додавали трифлуо-роцтову кислоту (10 мл). Реакційну суміш філи при 40 °С протягом 4 годин тоді концентрували до сухого стану. Утворене масло переносили у дихлорметан та нейтралізували 1 N розчин of натрій гідроксид. Органічний шар відділяли та водний шар екстрагували 5 разів дихлорметаном. Поєднані органічні шари промивали розсолом, сушили безводним натрій сульфатом, фільтрували та концентрували, отримуючи (2,9 г, 87,7 %) інтермедіату 8. 1 Н ЯМР (400 МГц, СГХІз) 1,07-1,17 (brs, 3H), L19-1,28(brs, 3H), 2,29-2,38 (m, 4H), 2,89-2,96 (т, 4Н), 3,22-3,32 (br s, 2Н), 3,48-3,59 (br s, 2H)S 5,535,67 (br s, 1H), 6,01-6,14 (br s: 1H), 7,12 (d, J = 8,4 Гц, 2Н), 7,20 (d, J = 8,4 Гц, 2Н}; 7,3! (d, J* 8,4 Гц, 2H),7,74(d, J=8,4 Гц, 2H), Сполука 1:4-[[4[(діетиламіно)карбоніл]феніл][1-(2піридинілметил)-4-піперидиніліден]метил]бензамід У суспензію інтермедіату 8 (400 мг, 1,02 ммоль) у 1,2-дихлоретані (6 мл) додавали 2піридинкарбоксальдегід (136 мкл; 1,43 ммоль, 1,4 екв) та натрій триацетоксиборогідрид (303 мг, 1,54 ммоль, 1,4 екв). Реакційну суміш перемішували протягом ночі при кімнатній температурі під азотом. Реакційну суміш розбавляли дихлорметаном та промивали насиченим водним натрій гідрогенкарбонатом. Водну фазу екстрагували 4 рази дихлорметаном та поєднані органічні фази сушили безводним натрій сульфатом, фільтрували та концентрували. Утворене масло очищали зворотно-фазовою 33 хроматографією, елюючи сумішшю 10% - 45% ацетонітрилу у воді з вмістом 0,1% трифлуороцтової кислоти. Продукт отримували як трифлуорацетат та ліофілізували, отримуючи сполуку 1 (475 мг, 65 % виходу) як білий твердий продукт. МС (розрах): 483,3 (МН+), МС (виявлено): 483,2 (МІТ). ВЕРХ: k': 2,37; Чистота: >99% (215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0: 05% ТФОК у воді, В: 0,05% ТФОК у CH3CN. 1 Н ЯМР (400 МГц, CD3OD): δ 1,12 (m, ЗН), 1,23 (m, ЗН), 2,70 (m, 4H), 3,29 (m, 2H), 3,42 (br s, 4H), 3,54 (m, 2H), 4,51 (s, 2H), 7,28 (m, 4H), 7,37 (d, J = 8,0 Гц, 2Н), 7,44 (dd, J= 5,3 Гц, 7,2 Гц, 1Н), 7,49 (d, J = 7,8 Гц, 1Н), 7,86 (d, J = S.4 Гц, 2Н), 7,89 (m, 1H), 8,68 (d, J = 4,5 Гц, 1H). Виявлено: С, 58,37; Η, 5,26: Ν, 8,19. C30H34N4O2 χ 1,30 COHFaOz x 0,2 НгО має С, 58,36; Η, 5,28; Ν, 8,10%. Сполука 2:4-{[4{(дівтиламіно)карбоніл]фвніл][1-(2-тієнілметил)-4піперидиніліден]метил]бензамід. Способом, описаним для сполуки 1 з інтермедіату 8 (400 мг, 1,02 ммоль) та 2тіофенкарбоксальдегіду (134 мкл, 1,43 ммоль) отримували трифлуорацетат сполуки 2 як білий твердий продукт. (424 мг, 69 %). МС (розрах): 488,2 (МН+), МС (виявлено): 488,2 (МН+). ВЕРХ: к':2,73; Чистота: >99% (215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у CH3CN. 1 Ή ЯМР (400 МГц, CD3OD): δ 1,09 (m, ЗН), 1,20 (m, ЗН), 2,51 (br s, 2H), 2,73 (br s, 2H), 3,09 (br s, 2H), 3,26 (m, 2H), 3,53 (m, 4H), 4,58 (s, 2H), 7,12 dd, J= 3,5 Гц, 5,1 Гц, 1Н), 7,24 (m, 4H), 7,31 (dd, J = 1,0 Гц, 3,5 Гц, 1Н), 7,34 (d, J = 8,4 Гц, 2Н), 7,61 (dd, J = 1,0 Гц, 5,1 Гц, 1H)7,83(d,J = 8,4ri4,2H). Виявлено: С, 56,55; Η, 5,24; Ν, 6,17. СаН^С-гв χ 1,70 C2HF3O2 χ 0,4 Η2Ο: С, мае 56,51; Η, 5,20; Ν, 6,10%. Сполука 3:4-[[4[(діетиламіно)карбоніл]феніл][1-(2чрураніл метил )-4-піперидиніліден]метил]бензамід 81309 34 Способом, описаним для сполуки 1 з інтермедіату 8 (400 мг, 1,02 ммоль) та 2фуральдегіду (134 мкп, 1,43 ммоль) отримували трифлуорацетат сполуки 3 як білий твердий продукт (441 мг, 63 %). МС (розрах): 472,3 (МН+), МС (виявлено): 472,2 (МН+). Верх: к':2,55; Чистота: >99% (215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10- 95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у CH3CN. 1 Н-ЯМР(400 МГц, CD3OD): δ 1,12 (m, ЗН), 1,23 (m, ЗН), 2,53 (br s, 2H), 2,75 (br s, 2H), 3,13 (brs, 2H), 3,29 (m, 2H), 3,54 (m, 4H), 4,43 (s, 2H), 6,53 dd, J= 1,8 Гц, 3,1 Гц, 1Н), 6,72 (d, 3,3 Гц, 1Н), 7,27 (m, 4H), 7,37 (d, J = 8,2 Гц, 2Н), 7,68 (dd, J = 0,6 Гц, 1,8 Гц, 1Н), 7,86 (d, J = 8.4ГЦ.2Н). Виявлено: С, 59,42; Η, 5,38; Ν, 6,59. C29H33N3O3 x 1,50 C2HF3O2 x 0,2 Н2О має C5 59,48; Η, 5,44; Ν, 6,50%. Сполука 4:4-Ц1-{(5-хлор-2-фураніл)метил]-4піперидиніліден][4[(діетиламіно)карбоніл]феніл]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (340 мг, 0,87 ммоль) та 5-хлор-2фуральдегіду (158 мг, 1,21 ммоль) отримували трифлуорацетат сполуки 4 як білий твердий продукт (341 мг, 63 %). МС (розрах): 506,2 (МН+), МС. (виявлено): 506,2 (МН+). Верх: к': 2,93; Чистота: >99%(215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОКуСНзСІЧ. 1 Н ЯМР (400 МГц, CD3OD): δ 1,12 (m, ЗН), 1,23 (m, ЗН), 2,66 (br s, 4H), 3,17 (br s, 2H), 3,30 (m, 2H), 3,54 (m, 2H), 4,41 (s, 2H), 6,41 (d, J = 3,3 Гц, 1Н), 6,77 (d, J = 3,3 Гц, 1Н), 7,27 (m, 4H), 7,37 (d, J = 3,4 Гц, 2Н), 7,86 (d, J = 8,4 Гц, 2Н). 35 Виявлено: С, 55,48; Η, 4,86; Ν, 6,03. C29H32N3O3Сl x 1,70 C2HF3O2 x 0,1 Н2О мае С5 55,46; Η, 4,87; Ν, 5,99%. Сполука 5: 4[[Ф[(діетиламіно)карбоніл]феніл][Н(5-мвтил-2фураніл)метил]-4-піперидиніліден]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (340 мг, 0,87 ммоль) та 5метилфуральдегіду (121 мкл, 1,21 ммоль) отримували трифлуорацетат сполуки 5 як білий твердий продукт (344 мг, 66 %). МС (розрах): 486,3 (MB*), MC (виявлено): 486,2 (МН*). Верх: к': 2,86; Чистота: >99% (215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОКу CH3CN. 1Н ЯМР (400 МГц, CD3OD): δ 1,12 (m, ЗН), 1,23 (m, ЗН), 2,31 (s, ЗН), 2,52 (br s, 2H), 2,76 (br s, 2H), 3,09 (br s, 2H), 3,29 (m, 2H), 3,54 (m, 4H), 4,46 (s, 2H), 6,11 (dd, J = 1,0 Гц, 3,1 Гц, 1Н), 6,58 (dd, J = 1,0 Гц, 3,1 Гц, 1Н), 7,27 (m, 4H), 7,37 (d, J = 8,4 Гц, 2H)I7,85(d,J = 8,4Гц,2H). Виявлено: С, 60,71; Η, 5,69; Ν, 6,55. C30H35N3O3 х 1,40 С2ΗF3Ο2 має С, 60,72; Η, 5,72; Ν, 6,48%. Сполука 6: 4-[[4[(діетиламіно)карбоніл]феніл][1-[(3-метил-2тієніл)метил]-4-піперидиніліден]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (340 мг, 0,87 ммоль) та З-метил-2тіофвнкарбоксальдегіду (131 мкл, 1,21 ммоль) отримували трифлуорацетат сполуки 6 як білий твердий продукт (307 мг, 57 %). МС (розрах): 502,3 (МН+), МС. (виявлено): 502,2 (М МН*) Верх: к': 2,55; Чистота: >91%(215 нм), >91% (254 нм), >92% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у Н2О, В: 0,05% ТФОК у СН3СN. 81309 36 1 Н ЯМР (400 МГц, CD3OD): δ 1,11 (m, ЗН), 1,23 (m, ЗН), 2,33 (s, ЗН), (br s, 2H), 2,78 (br s, 2H), 3,16 (br s, 2H), 3,29 (m, 2H), 3,53 (m, 2H), 3,60 (br s, 2H), 4,54 (s, 2H), 6,99 (d, J = 5,2 Гц, 1H), 7,27 (m, 4H), 7,37 (d, J = 8,4 Гц, 2H), (d, J = 5,2 Гц, 1H), 7,86 (d, J = 8,6 Гц, 2Н). Виявлено: С, 57,13; Η, 5,15; Ν, 5,88. C30H35N2O2S x 1,80 C2HF3O2 має С, 57,09; Η, 5,25; Ν, 5,94%. Сполука 7:4-[[1-[(3-хлор-2-тієніл)метил]-4піперидиніліден][4[(діетиламіно)карбоніл]феніл]метил]бензамід. Способом, описаним для сполуки 1 з інтермедіату 8 (340 мг, 0,87 ммоль) та 3хлортіофен-2-карбоксальдегіду (177 мг, 1,21 ммоль) отримували трифлуорацетат сполуки 7 як білий твердий продукт (305 мг, 55 %). МС (розрах): 522,2 (МН+) МС (виявлено): 522,2 (МН*)· Верх: к':2,94; Чистота: >97%(215 нм), >97% (254 нм), >99% (2S0 нм). Умови: Zorbax С-13, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. 1 Н ЯМР вільний амін (400 МГц, CDCI3): δ 1,12 (br s, ЗН), 1,23 (br з, ЗН), 2,40 (m, 4H), 2,59 (m, 4H), 3,27 (br s, 2H), 3,53 (br з, 2Н), 3,76 (з, 2Н), 5,61 (br s, 1Н), 6,07 (br з, 1Н), 6,87 (d, J = 5,4 Гц, 1Н), 7,11 (d, J = 8,4 Гц, 2Н), 7,19 (d, J = 8,4 Гц, 2Н), 7,23 (d, J = 5,4 Гц, 1Н), 7,30 (d, J = 8,4 Гц, 2H), 7,73 (d, J = 8,4 Гц, 2Н). Виявлено: С, 54,79: Η, 4,82; Ν, 6,03. C29H32N3O3SСl x 1,60 C2HF3O2 x 0,1 Н2О має С, 54,75; Η, 4,82; Ν, 5,95%. Сполука 8:4[[1-[(5-хлор-2-[тієніл)метил]-4піперидиніліден][4[(діетиламіно)карбоніл]фeніл]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (400 мг, 1,02 ммоль) та 5-хлор-2тіофенкарбоксальдегіду (140 мкл, 1,32 ммоль) 37 отримували трифлуорацетат сполуки 8 як білий твердий продукт (486 мг, 75 %). МС (розрах): 522,2 (МН+), МС (виявлено): 522,2 (МН+). Верх: к': 3,17; Чистота: >99%(215 нм), >99% (254 нм), >99% (280 нм). Умови: Zor-bax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. 1 Ή ЯМР вільний амін (400 МГц, CDCI3): δ 1,11 (br s, 3H), 1,22 (br s, 3H), 2,40 (m, 4H), 2,54 (m, 4H), 3,27 (br s, 2H), 3,53 (br s, 2H), 3,66 (s, 2H), 5,70 (br з, 1H), 6,12 (br s, 1H), 6,66 (d, J = 3,7 Гц, 1Н), 6,73 (d, J = 3,7 Гц, 1Н), 7,10 (d, J = 8,4 Гц, 2Н), 7,18 (d, J = 8,4 Гц, 2Н), 7,29 (d, J = 8,4 Гц, 2Н), 7,73 (d, J = 8,4 Гц, 2Н). Виявлено: С, 53,87; Η, 4,79; Ν, 5,87. C29H32N3O2SCI х 1,70 C2HF3O2 x 0,4H2O має С, 53,31; Η, 4,81; Ν, 5,81%. Сполука 9:4-[[4[(діетиламіно)карбоніл]феніл][Н(5метил-2тієніл)метил]-4-піперидиніліден]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (400 мг, 1,02 ммоль) та 5-метил-2тіофенкарбоксальдегіду (142 мкл, 1,32 ммоль) отримували трифлуорацетат сполуки 9 як білий твердий продукт (530 мг, 84 %). МС (розрах): 502,3 (МН+). МС (виявлено): 502,2 (ΜΗ*). Верх; к':3,05; Чистота: >99%(215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax C-l 8, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. 1 Ή ЯМР вільний амін (400 МГц, CDCI3): δ 1,11 (br s, 3H), 1-22 (br s, 3H), 2,39 (m, 4H), 2,45 (s, 3H), 2,53 (m, 4H), 3,27 (br s, 2H), 3,53 (br s, 2H), 3,68 (s, 2H), 5,67 (br s, 1H), 6,10 (br s, 1H), 6,57 (m, 1H), 6,66 (d, J = 3,3 Гц, 1Н), 7,10 (d, J = 8,4 Гц, 2Н), 7,18 (d, J = 8,4 Гц, 2Н), 7,29 (d, J = 8,4 Гц, 2Н), 7,72 (d, J = 8,4 Гц, 2Н). Виявлено: С, 57,88; Η, 5,41; Ν, 6,16. C30H35N3O2S х 1,60 C2HF3O2 х 0,3 Η2Ο: C, 57,83; Η, 5,44; Ν, 6,09%. Сполука 10:4-[[1-[(6-хлор-3-піридиніл)метил]-4піпіеридиніліден][4[(діетиламіно)карбоніл]феніл]метил]бензамід 81309 38 До розчину інтермедіату 8 (400 мг, 1,02 ммоль) та 2-хлор-5-(хлорметил)піридину (197 мг, 1,22 ммоль) у диметилформамщі (6 мл) додавали калій карбонат (169 мг, 1,22 ммоль). Реакційну суміш гріли протягом ночі при 50 °С. Реакційну суміш концентрували та переносили у дихлорметан та воду. Органічний шар відділяли. Водну фазу тоді екстрагували З рази дихлорметаном. Поєднані органічні екстракти сушили безводним натрій сульфатом, фільтрували та концентрували. Утворене масло очищали зворотно-фазовою хроматографією, елюючи сумішшю 10% - 45% ацвтонітрилу у воді з вмістом 0,1% трифлуороцтової кислоти. Продукт отримували як трифлуорацетат та ліофілізували, отримуючи сполуку 10 (513 мг, 67 % виходу) як білий твердий продукт. МС (розрах): 517,2 (МН+), МС (виявлено): 517,2 (МН+). Верх: к': 2,63; Чистота: >997о (215 нм), >99% (254 нм), >99% (280 нм), Умови: Zorbax С-18, Градієнт 10- 95% 3 у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, B:O,O5% ТФОК у СН3СN. 1 Н ЯМР вільний амін (400 МГц, CDCI3): δ 1,11 (br з, ЗН), 1,22 (br s, ЗК), 2,37 (m, 4H), 2,47 (m, 4Н), 3,26 (br s, 2H), 3,50 (s, 2H), 3,52 (br s, 2H), 5,73 (br s, 1H), 6,13 (br s, 1H), 7,10 (d, J = 8,1 Гц, 2H), 7,18 (d, J= 8,2 Гц, 2H), 7,29 (m, ЗН), 7,66 (dd, J = 2,4, 8,2 Гц, 1Н), 7,73 (d, J = 8,4 Гц, 2Н), 8,3 (d, J = 2,2 Гц, 1 Η). Виявлено: С, 56,07; Η, 4,94; Ν, 7,88. C30H33N4O2CI х 1,70 C2HF3O2 х 0,2 Η2Ο мае С, 56,15; Η, 4,95; Ν, 7,84%. Сполука 11:4-[[4[(дівтиламіно)карбоніл]феніл][1-(3-гідроксипропіл)4-піперидиніліден]метил]бензамід До розчину інтермедіату 8 (400 мг, 1-02 ммоль) та 2-(3-бромпропокси)тетрагідро-2Н-пірану (207 мкл, 1,22 ммоль) у диметилформа^іді (6 мл) додавали калій карбонат (169 мг, 1,22 ммоль). Реакційну суміш гріли протягом ночі при 50 °С. 39 Реакційну суміш концентрували та переносили у дихлорметан та воду. Органічний шар відділяли. Водну фазу тоді екстрагували 3 рази дихлорметаном. Поєднані органічні екстракти сушили безводним натрій сульфатом, фільтрували та концентрували. Утворене масло переносили у метиловий спирт (5 мл) та 1 Η НСІ (2 мл) та гріли при 50 °С протягом ночі. Реакційну суміш концентрували та очищали зворотно-фазовою хроматографією, елюючи сумішшю 10% - 45% ацетонітрил у воді з вмістом 0,1% трифлуороцтової кислоти. Продукт отримували як трифлуорацетат та ліофілізували, отримуючи сполуку 16 (168 мг, 29 % виходу) МС (розрах): 450,3 (МН+), МС (виявлено): 450,2 (МН+). Верх: к': 4,02; Чистота: >97% (215 нм), >98% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. Ή ЯМР (400 МГц, CDaOD): δ 1,12 (m, ЗН), 1,23 (m, ЗН), 1,97-2,06 (m, 2H), 2,47-2,58 (m, 2Н), 2,712,82 (m, 2H), 3,03-3,12 (m, 2H), 3,22-3,32 (m, 2H), 3,34 (s, 3H% 3,48-3,57 (m, 4H), 3,61-3,68 (m, 2Н) 7,28 (m, 4Н), 7,37 (d, J = 8,4 Гц, 2H), 7,86 (d, J = 8,4 Гц, 2Н). Виявлено: С, 58,32; Η, 6,13; Ν, 6,97. C27H35N3O3 x 1,30 С2НF3О2 х 0,6 Η2Ο має С, 58,41; Η, 6,21; Ν, 6,90%. Сполука 12:4-[[4[(діетиламіно)карбоніл]феніл][1-(2-метоксіетил)-4піперидиніліден]метил]бензамід Способом, описаним для сполуки 10 з інтермедіату 8 (220 мг, 0,55 ммоль) та 2-брометилметилетеру (63,4 мкп, 0,67 ммоль) отримували трифлуорацетат сполуки 12 як білий твердий продукт (124 мг, 39 %). МС (розрах): 450,3 (МН+). МС (виявлено): 450,2 (МН+). Верх; к': 3,05; Чистота: >99%(215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN 1 Ή ЯМР вільний амін (400 МГц, CD3OD): δ 1,12 (m, ЗН), 1,23 (m, ЗН), 2,56 (m, 2H), 2,75 (m, 2H), 3,12 (m, 2H),), 3,29 (m, 2H),), 3,37 (m, 2H), 3,41 (s, ЗН), 3,53 (m, 2H), 3,64 (m, 2H), 3,72 (m, 2H), 7,29 (m, 4H), 7,37 (d, J = 8,4 Гц, 2H), 7,86 (d, J = 8,4 Гц, 2Н). Виявлено: С, 55,70; Η, 5,90; Ν, 6,48. C27H35N3O3S х 1,70 C2HF3O2 x 0,7 Н2О: С, 55,66; Η, 5,85; Ν, 6,41%. 81309 40 Сполука 13:4-[[4[(діетиламіно)карбоніл]феніл][1-(2піридинілметил)-4-піперидиніліден]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (200 мг, 0,50 ммоль) та 3піридинкарбоксальдегід (63 мкп, 0,64 ммоль) отримували трифлуорацетат сполуки 13 як білий твердий продукт (255 мг, 72 %), МС (розрах): 483,3 (МН+), МС (виявлено): 483,2 (МН+). Верх: к': 1,86; Чистота: >98%(215 нм), >98% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. 1 Н ЯМР вільний амін (400 МГц, CDCI3): δ 1,11 (br 5, ЗН), 1,22 (br s, ЗН), 2,38 (m, 4H), 2,49 (m, 4H), 3,27 (br s, 2H), 3,53 (s, 2H), 3,53 (br s, 2H), 5,62 (br s, 1H), 6,09 (br s, 1H), 7,11 (d, J = 8,2 Гц, 2H), 7,18 (d, J = 8,4 Гц, 2H), 7,25 (m, 1H), 7,30 (d, J = 8,2 Гц, 2H), 7,67 (m, 1H), 7,73 (d, J = 8,4 Гц, 2H), 8,51 (br s, 1H), 8,55 (brs, 1H). Виявлено: С 56,34; Η, 5,02; Ν, 7,80. C30H34N4O2 х 2,1 C2HF3O2 х 0,4 Η2Ο має С, 56,33; Η, 5,10; Ν, 7,68%. Сполука 14:4-[[4[(діетиламіно)карбоніл]фенілН1-(4піридинілметил)-4-піперидиніліден]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (200 мг, 0,50 ммоль) та 4піридинкарбоксальдегіду (63 мкп, 0,64ммоль) отримували трифлуорацетат сполуки 14 як білий твердий продукт (244 мг, 68 %). МС (розрах): 433,3 (МН+), МС (виявлено): 483,2 (МН+). Верх: к': 1,80; Чистота: >99%(215 нм), >98% (254 нм), >99% (280 нм). Умови: Zorbax С-І 8, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. 41 1 Ή-ЯМР вільний амін (400 МГц, CDCI3): δ 1,11 (br s, ЗН), 1,23 (br s, 3H), 2,40 (m, 4H), 2,49 (m, 4H), 3,27 (br s, 2H), 3,52 (s, 2H), 3,53 (br s, 2H), 5,61 (br з, 1H), 6,09 (br s, 1H), 7,11 (d, J = 8,4 Гц, 2H), 7,19 (d, J = 8,6 Гц, 2H), 7,29 (m, 4H), 7,73 (d, J = 3,6 Гц, 1H), 8-54 (br s, 2H). Виявлено: С, 55,00; Η, 5,00; Ν, 7,43. C30H34N4O2 х 2,3 C2HF3O2 x 0,6 Н2О має С, 54,99; Η, 5,00; Ν, 7,41% Сполука 15: 4-[[4[(діетіламіно)карбоніл]феніл][1-[(6-метил2піридиніл)метил1-4піперидиніліден]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (300 мг, 0,77 ммоль) та 6-метил-2піридинкарбоксальдегіду (116 мг, 0,97 ммоль) отримували трифлуорацетат сполуки 15 як білий твердий продукт (291 мг, 52 %). МС (розрах): 497,3 (МН+), МС (виявлено): 497,2 (МН+). Верх: к': 2,49; Чистота: >99% (215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. Ή ЯМР вільний амін (400 МГц, CDCI3): δ 1,11 (br s, ЗН), 1,23 (br s, 3H), 2,41 (m, 4H), 2,53 (s, 3H), 2,56 (m, 4H), 3,26 (br s, 2H), 3,53 (br s, 2H), 3,65 (s, 2H), 5,60 (br s, 1 H), 6,08 (br s, 1H), 7,02 (d, J = 7,4 Гц, 1Н), 7,12 (d, J = 8,2 Гц, 2Н), 7,19 (d, J = 8,4 Гц, 2Н), 7,25 (d, J = 7,8 Гц, IK), 7,29 (d, J = 8,4 Гц, 2Н), 7,54 (t, J = 7,6 Гц, 1Н), 7,73 (d, J = 8,4 Гц, 2Н). Виявлено: С, 59,19; Η, 5,51; Ν, 8,12. С31Н36N4О2 x 1,70 C2HF3O2 x 0,4 Н2О має С, 59,22; Η, 5,56; Ν, 8,03%. Інтермедіат9 До розчину інтермедіату 5 (1,09 г, 2,41 ммоль) у дихлорметані (5 мл) додавали триф-луороцтову кислоту (1,37 мл, 12,08 ммоль). Реакційну суміш перемішували протягом ночі при 40 °С тоді концентрували до сухого стану. Утворене масло переносили у дихлорме-тан та нейтралізували 1 Η NaOH. Органічний шар відділяли та водний шар екстрагували п'ять разів дихлорметаном. Поєднані органічні шари промивали розсолом, сушили безводним натрій сульфатом, фільтрували та концентрували. Це масло переносили у диметилформамід (25 мл). До цього розчину додавали 2-(3-бромпропокси)тетрагідро-2Н-піран (490 мкл, 2,89 ммоль) та калій карбонат (400 мг, 2,89 ммоль). Реакційну суміш гріли протягом ночі при 50 °С. Реакційну суміш концентрували та переносили у дихлорметан та воду. Органічний 81309 42 шар відділяли. Водну фазу тоді екстрагували 3 рази дихлорметаном. Поєднані органічні екстракти сушили безводним натрій сульфатом, фільтрували та концентрували. Утворене масло очищали флеш-хроматографією на силікагелі, елюючи сумішшю 1% - 5% метанол у дихлорметані, отримуючи інтермедіат 9 (0,85 г, 71 %) Інтермедіат 10 Розчин інтермедіату 9 (852 мг, 1,72 ммоль) у метиловому спирті 1,11 (5 мл) та 1 Η НСІ (2 мл) гріли при 50°С протягом ночі Реакційну суміш концентрували та переносили у дих-лорметан та насичений розчин натрій гідрогенкарбонату. Органічний шар відділяли та водну фазу тоді екстрагували 3 рази дихлорметаном. Поєднані органічні екстракти сушили безводним натрій сульфатом, фільтрували та концентрували, що дало спирт (658 мг, 93 %), котрий алкшували без наступної очистки. До розчину спирту (658 мг, 1,6 ммоль) у диметилформальдегіді (10 мл), охолодженому у льоді, додавали натрій гідрид (60 % у маслі) (46 мг, 1,9 ммоль). Суспензію перемішували протягом ЗО хвилин, а потім додавали йодметан (118 мкл, 1,9 ммоль). Реакційну суміш перемішували протягом ночі. Насичений розчин амоній хлориду додавали та реакційну суміш концентрували. Суміш розподіляли між етилацетатом та водою. Водну фазу екстрагували 4 рази етилацетатом. Органічні шари поєднували, сушили безводним натрій сульфатом, фільтрували та концентрували. Утворене масло очищали зворотно-фазовою хроматографією, елюючи сумішшю 10% - 45% ацетонітрилу у воді з вмістом 0,1% трифлуороцтової кислоти. Продукт отримували як трифлуорацетат та виділяли екстракцією дихлорметаном та 1 Η розчином натрій гідроксиду, що забезпечує інтермедіат 10 (95 мг, 14% виходу) як безбарвне масло Сполука 16:4-[[4[(діетиламіно)карбоніл]феніл][1-(3-метоксипропіл)4-піперидиніліден]метил]бензамід До колби, що містить інтермедіат 10 (43 мг, 0,1 ммоль) додавали толуол (3 мл), етанол (0,5 мл), 4амінокарбонілфенілборонову кислоту (33 мг, 0,2 ммоль) та водний 2 Η калій карбонат (0,5 мл, 1 ммоль). Суміш дегазували протягом ЗО хвилин азотом. Тоді додавали паладій тетракістрифенілфосфін (11,6 мг, 0,01 ммоль). Реакційну суміш гріли до 85°С протягом 3 годин. Реакційну суміш охолоджували та розбавляли етилацетатом та водою. Органічний шар відділяли та водну фазу тоді екстрагували 4 рази етилацетатом. Поєднані органічні екстракти сушили безводним натрій сульфатом, фільтрували та концентрували. Утворений залишок очищали 43 зворотно-фазовою хроматографією, елюючи сумішшю 10% - 45% ацетонітрилу у воді з вмістом 0,1% трифлуороцтової кислоти. Продукт отримували як трифлуорацетат та ліофілізували, отримуючи сполуку 16 (31 мг, 54 % виходу) як білий твердий продукт. МС (розрах): 464,3 (МН+), МС (виявлено): 464,2 (ΜΗ*). Верх: к': 4,02; Чистота: >97% (215 нм), >98% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-95% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. 1 Ή ЯМР (400 МГц, CDaOD): δ 1,12 (t, J = 6,2 Гц, ЗН), 1,24 (t, J = 6,1 Гц, ЗН), 1,97-2,06 (m, 2H), 2,47-2,58 (m, 2H), 2,71-2,82 (m, 2H), 3,03-3,12 (m, 2H), 3,22-3,32 (m, 2H), 3,34 (s, ЗН% 3,48-3,57 (m, 4H), 3,61-3,68 (m, 2H) 7,25-7,30 (m, 4H), 7,37 (d, J = 8,0 Гц, 2Н), 7,86 (t, J = 8,4Гц,2Н). Інтермедіат 11:4-[бром[1-(фeнілметил)-4піпeридинілiдeн]метил]-N,N-діетил-бензамід До розчину інтермедіату 5 (1,0 г, 2,2 ммоль) у дихлорметані (15 мл) додавали триф-луороцтову кислоту (2,2 мл, 22,6 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом ночі, тоді промивали водним натрій гідроксидом (1 Н). Органічний шар тоді сушили магній сульфатом, фільтрували та концентрували, отримуючи жовтий твердий продукт (684 мг, 88% виходу). Жовтий твердий продукт розчиняли у 1,2-дихлоретані (15 мл) та бензальдегіді (0,32 мл, 3,1 ммоль) та додавали натрій триацеток-сиборогідрид (661 мг, 3,1 ммоль). Після перемішуванняпротягом трьох діб при кімнатній температурі реакційну суміш розбавляли дихлорметаном та промивали насиченим водним натрій гідрогенкарбонатом. Водний шар промивали три рази дихлорметаном та поєднані органічні екстракти сушили магній сульфатом, фільтрували та концентрували. Кількісну кількість інтермедіату 11 отримували як жовту піну. Інтермедіат 12: 4-[(4-ціанофеніл)[1(фенілметил)-4-піперидиніліден]метил]-М,Мдіетил-бензамід До розчину інтермедіату 11 у сухому толуолі (15 мл) додавали 4-ціанофенілборонову кислоту (430 мг, 2,9 ммоль), етанол (3 мл) та водний натрій карбонат (2 Н, 2,4 мл, 4,8 ммоль). Реакційну суміш дегазували протягом 20 хвилин, тоді додавали паладій тетрагастрифенілфосфін (225 мг, 0,2 ммоль) та реакційну суміш гріли до 90 °С протягом 20 годин. Реакційну суміш охолоджували та додавали етилацетат. Реакційну суміш промивали насиченим амоній хлоридом та органічний шар сушили магній сульфатом, фільтрували та концентрували. Залишок очищали флешхроматографією, елюючи етилацетатом, отримуючи інтермедіат 12 (616 мг, 68%) як жовту піну. Сполука 17:4-[[4[(діетиламіно)карбоніл]феніл][1-(феніл метил )-4піперидиніліден]метил]бензамід 81309 44 До розчину інтермедіату 12 (616 мг, 1,3 ммоль) у ВиОН (15 мл) додавали розтовчений КОН (186 мг, 3,3 ммоль) та реакційну суміш гріли до кипіння під зворотним холодильником. Через 1 годину реакційну суміш охолоджували та концентрували. Залишок очищали флеш-хроматографією, елюючи сумішшю 6% - 10% метанолу у дихлорметані, отримуючи сполуку 17 (389,2 мг, 61 % виходу) як жовту піну. Цей матеріал розчиняли у дихлорметані та додавали НСІ у діетиловому етері (1 Н, 1,2 мл, 1,2 ммоль). Суспензію концентрували, отримуючи сполуку 17 як сіль НСІ МС (розрах): 482,3 (МН+), МС (виявлено): 482,2 (МН+). Верх: к':3,78; Чистота: >99% (215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 20-50% В у 25 хвил, потік: 1 мл/хвил, 30°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у СН3СN. 1 Н ЯМР (400 МГц, CDaOD): δ 1,07-1,21 (m, 6H), 2,47-2,54 (m, 2H), 2,66-2,80 (m, 2H), 3,00-3,18 (m, 2H), 3,25-3,35 (m, 2H), 3,45-3,56 (m, 4H), 4,32 (з, 2Н), 7,20-7,27 (m, 4H), 7,23 (d, J = 7,2 Гц, 2Н), 7,407,55 (m, 5Н), 7,82 (d, J = 7,4 Гц, 2Н). Виявлено: С, 68,64; Η, 7,17; Ν, 7,62. С31Н35N3О2 x 1,4 Н2О x 1,0 НСІ має С, 68,53; Η, 7,20 Ν, 7,73%. Сполука 18:4-[[4[(діетиламіно)карбоніл]феніл][1-(4-тіазолілметил)4-піперидиніліден]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (170 мг, 0,45 ммоль) та 4(хлормвтил)тіазол гідрохлориду (84 мг, 0,49 ммоль) отримували трифлуорацетат сполуки 18 як білий твердий продукт (98 мг, 30%). МС (розрах): 489,2 (МН+), МС (виявлено): 489,2 (МН+). Верх: к': 3,31; Чистота: >99% (215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax. С-18, 45 Градієнт 10-50% В у 25 хвил, потік: 1 мл/хвил, 40°С, А: 0,1% мурашиної кислоти у воді, В: 0,1% мурашиної кислоти у CH3CN. 1 Н ЯМР (400 МГц, CD3OD): δ 1,12 (t, J = 7,1 Гц, 3H),1,23 (t, J = 6,8 Гц, ЗН), 2,50-2,60 (m, 2H), 2,692,84 (m, 2H), 3,11-3,23 (m, 2H), 3,24-3,34 (m, 2H), 3,49-3,57 (m, 2H), 3,56-3,65 (m, 2H), 4,54 (s, 2H) 7,27 (m, 4H), 7,37 (d, J = 8,4 Гц, 2Н), 7,86 (m, ЗН), 9,12 (d, J = 1,8 Гц, 1H). Виявлено: С, 52,12; Η, 4,91; Ν, 7,55. С28Н32N4О2S x 2,1 C2HF3O2 x 0,8 H2O має С, 52,09; Η, 4,85; Ν, 7,50%. Сполука 19:3-[[4[(діетиламіно)карбоніл]феніл][1-(5-тіазол-метил}-4піперидиніліден]метил]бензамід Способом, описаним для сполуки 1 з інтермедіату 8 (170 мг, 0,45 ммоль) та тіазол-5карбоксальдегіду (61 мг, 0,54 ммоль) отримували трифлуорацетат сполуки 19 як білий твердий продукт (124 мг, 38 %). МС (розрах): 489,2 (МН+), МС (виявлено): 489,2 (МH*). Верх: к': 3,06; Чистота: >99%(215 нм), >99% (254 нм), >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-50% В у 25 хвил, потік: 1 мл/хвил, 40°С, А: 0,1% мурашиної кислоти у воді, В: 0,1% мурашиної кислоти у CH3CN. 1 Н ЯМР (400 МГц, CDaOD): δ 1,11 (t, J = 6,8 Гц, ЗН), 1,24 (t, J = 6,8 Гц, ЗН), 2,51-2,78 (br s, 4H), 3,25-3,33 (m, 2H), 3,10-3,62 (m, 4H), 3,49-3,58 (m, 2H), 4,73 (s, 2H) 7,28 (m, 4H), 7,38 (d, J - 8,4 Гц, 2H), 7,86 (d, J = 8,6 Гц, 2H), 8,09 (s, 1H), 9,20 (з, 1Н). Виявлено: С, 52,48; Н, 4,85; N, 7,67. С28Н32N4О2S x 2,1 C2HF3O2 х 0,5 H2O має С, 52,47; Η, 4,80; Ν, 7,60 Сполука 20:4-[[4-амінокарбоніл)феніл](1бутилпіперидин-4-іліден)метил]-М,Мдіетилбензамід. Способом, описаним для сполуки 1 з інтермедіату 8 (242 мг, 0,618 ммоль) та бутира 81309 46 льдегіду (84 мкп, 0,93 ммоль) отримували трифлуорацетат сполуки 20 як білий твердий продукт (154 мг, 44 %). МС (розрах): 448,3 (МН+), МС (виявлено): 448,2 (МР+) Верх: к': 5,08; Чистота: >99% (215 нм), >99% (254 нм)> >99% (280 нм). Умови: Zorbax С-18, Градієнт 10-50% В у 25 хвил, потік: 1 мл/хвил, 40°С, А: 0,05% ТФОК у воді, В: 0,05% ТФОК у CH3CN. 1 Ή ЯМР (400 МГц, CD3OD): δ 1,00 (t, J = 7,4 Гц, ЗН), 1,12 (br t, J = 6,6 Гц, ЗН), 1,24 (br t, J = 6,3 Гц, ЗН), 1,37-1,48 (m, 2H), 1,67-1,78 (m, 2H), 2,46-2,60 (br m, 2H), 2,70-2,83 (m, 2H), 3,01-3,11 (m, 2H), 3,11-3,18 (m, 2H), 3,25-3,33 (m, 2H), 3,49-3,58 (m, 2H), 3,63 (br d, J= 11,7 Гц, 2H), 7,24-7,31 (m, 4H), 7,37 (d, J = 8,2 Гц, 2H),,7,86 (d, J = 8,2 Гц, 2Н). Виявлено: С, 59,97; Η, 6,46; Ν, 6,72. С28Н37N3О2 x 1,40 С2HFО2 х 0,5 Η2Ο мае С, 60,03; Η, 6,44; Ν, 6,82%.
ДивитисяДодаткова інформація
Назва патенту англійськоюDiarylmethylidene piperidine derivatives and their use as delta opioid receptor agonists, metod for their preparation (variants), phameutical composition based thereon
Автори англійськоюGriffin Andrew
Назва патенту російськоюПроизводные диарилметилиден-пиперидина, их применение в качестве агонистов опиоидных дельта-рецепторов, способ их получения (варианты), фармацевтическая композиция на их основе
Автори російськоюГриффин Эндрю
МПК / Мітки
МПК: C07D 409/06, C07D 211/70, C07D 417/06, C07D 401/06, C07D 405/06
Мітки: основі, агоністів, дельта-рецепторів, варіанти, композиція, застосування, спосіб, діарилметиліден-піперидину, фармацевтична, похідні, одержання, опіоїдних
Код посилання
<a href="https://ua.patents.su/23-81309-pokhidni-diarilmetiliden-piperidinu-kh-zastosuvannya-yak-agonistiv-opiodnikh-delta-receptoriv-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні діарилметиліден-піперидину, їх застосування як агоністів опіоїдних дельта-рецепторів, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі</a>
Попередній патент: Чутливий елемент датчика коливань та спосіб реєстрації коливань поверхні
Наступний патент: Спосіб очищення рідких середовищ
Випадковий патент: Моторна паливна композиція для дизельних, газотурбінних та турбореактивних двигунів












